Рак поджелудочной железы
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Злокачественное новообразование головки поджелудочной железы (C25.0), Злокачественное новообразование поджелудочной железы (C25), Злокачественное новообразование тела поджелудочной железы (C25.1), Злокачественное новообразование хвоста поджелудочной железы (C25.2)
Онкология
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «14» декабря 2023 года
Протокол №198
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
РАК ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ
Рак поджелудочной железы – злокачественное новообразование исходящее из эпителия железистой ткани или протоков поджелудочной железы [1].
Код МКБ-10:
Рак поджелудочной железы – злокачественное новообразование исходящее из эпителия железистой ткани или протоков поджелудочной железы [1].
ВВОДНАЯ ЧАСТЬ
Код МКБ-10:
|
C 25.0
|
Рак поджелудочной железы |
| C 25.1 | Рак тела поджелудочной железы |
| C 25.2 | Рак хвоста поджелудочной железы |
Дата разработки протокола: 2015 год (пересмотр 2022 г.).
Категория пациентов: взрослые.
Шкала уровня доказательности:
Пользователи протокола: онкологи, хирурги, терапевты, химиотерапевты, врачи общей практики, врачи лучевой диагностики.
Категория пациентов: взрослые.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В |
Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть
распространены на соответствующую популяцию.
|
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++или+), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
Классификация
Классификация [2]
Злокачественные опухоли поджелудочной железы разделяются на (ВОЗ, 2017):
1. Эпителиальные:
а) Аденокарцинома
б) Плоскоклеточный рак.
в) Цистаденокарцинома
г) Ацинарный рак
д) Недифференцируемый рак.
1. Опухоли панкреатических островков
2. Неэпителиальные опухоли
3. Смешанные опухоли
4. Неклассифицируемые опухоли
5. Гемопоэтические и лимфоидные опухоли
6. Метастатические опухоли
Классификация применима только для рака поджелудочной железы. Должно быть гистологическое, цитологическое подтверждение диагноза, заключение МДГ.
Анатомические области:
1. Головка поджелудочной железы.
2. Тело поджелудочной железы.
3. Хвост поджелудочной железы
4. Панкреатический проток.
5. Регионарные лимфатические узлы.
Регионарными лимфатическими узлами для поджелудочной железы являются:
- Верхние: кверху от головки и тела.
- Нижние: книзу от головки и тела.
- Передние: передние панкреатодуоденальные, пилорические и проксимальные мезентериальные.
- Задние: задние панкреатодуоденальные, вокруг общего желчного протока и проксимальные мезентериальные.
Селезеночные: в воротах селезенки и области хвоста поджелудочной железы. Отдаленные метастазы наиболее часто локализуются в печени, параортальных и надключичных лимфоузлах слева (Вирхова).
Клиническая классификация TNM (ICD-O C25).
T- Первичная опухоль.
ТХ Первичная опухоль не может быть оценена.
Т0 Отсутствие данных о первичной опухоли.
Tis Карцинома in situ*.
Т1 Опухоль не более 2 см в наибольшем измерении в пределах поджелудочной железы.
Т2 Опухоль более 2 см в наибольшем измерении в пределах поджелудочной железы.
ТЗ Опухоль распространяется за пределы поджелудочной железы, но не поражает чревный ствол или верхнюю брыжеечную артерию.
Т4 Опухоль прорастает в чревный ствол или верхнюю брыжеечную артерию.
*Tis также включает панкреатическую интраэпителиальную неоплазию
N - Региональные лимфатические узлы.
NX Региональные лимфатические узлы не могут быть оценены .
N0 Нет метастазов в региональных лимфатических узлах.
N1 Есть метастазы в региональных лимфатических узлах .
М — Отдаленные метастазы.
МО Нет отдаленных метастазов.
М1 Есть отдаленные метастазы.
Группировка по стадиям:
pTNM патогистологическая классификация.
Требования к определению категорий pT, pN, pM соответствуют требованиям к определению категорий T, N, M.
G – гистопатологическая дифференцировка.
GX – степень дифференцировки не может быть установлена.
G1 – высокая степень дифференцировки.
G2 – средняя степень дифференцировки.
G3 – низкая степень дифференцировки.
G4 – не дифференцируемый рак.
Группировка по стадиям:
| СТАДИЯ 0 | Тis | N0 | М0 |
| СТАДИЯ IА | Т1 | N0 | М0 |
| СТАДИЯ IВ | Т2 | N0 | М0 |
| СТАДИЯ ІІА | Т3 | N0 | М0 |
| СТАДИЯ ІІВ | Т1-Т3 | N1 | М0 |
| СТАДИЯ ІІІ | Т4 | Nлюбая | М0 |
| СТАДИЯ ІV | Тлюбая | Nлюбая | М1 |
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии
Диагностические критерии
Жалобы и анамнез:
Характерными симптомами в клинической картине рака поджелудочной железы являются: боль, желтуха, кожный зуд, потеря массы тела, снижение аппетита, лихорадка.
Боль — самый частый симптом, наблюдается у 70–85% больных. Боль чаще всего возникает в результате прорастания или сдавления опухолью нервных стволов, реже она бывает вызвана закупоркой желчного или вирсунгова протока или перитонеальными явлениями из-за обострения сопутствующего панкреатита. При раке головки боль ощущается в правом подреберье или надчревной области, рак тела и хвоста характеризуется болью в левом подреберье и надчревной области, но может проявляться боевыми ощущениями и в правой подреберной области. Диффузному поражению свойственна разлитая боль в верхней половине живота. У некоторых больных боль остается локализованной в одном месте. У других — иррадиирует в позвоночник или в межлопаточную область, реже — в правую лопатку. При опухолях, закупоривающих вирсунгов проток и сопровождающихся панкреатитом, возникает приступообразная опоясывающаяся боль.
Отмечено, что боль чаще появляется или усиливается в вечернее или ночное время, в положении больного на спине. После обильной и особенно жирной пищи, а также после приема алкоголя. Боль сильнее при раке тела железы, особенно при прорастании или сдавлении опухолью солнечного сплетения. При этом она становится чрезвычайно сильной, нестерпимой, может приобретать опоясывающий характер. Больные принимают вынужденное положение, наклоняют вперед позвоночник. Опираясь на спинку стула или перегибаясь через прижатую к животу подушку. Эта поза в виде «крючка» довольно характерна для больных запущенным раком поджелудочной железы.
Желтуха – наиболее яркий симптом рака головки поджелудочной железы. Встречается у 70–80% больных. Обусловлена прорастанием опухолью желчного протока и застоем желчи в желчевыводящей системе. Изредка возникает при раке тела и хвоста, в таких случаях вызвана сдавлением общего желчного протока метастазами в лимфатические узлы. Первым симптомом заболевания желтуха бывает редко, чаще ей предшествуют болевые ощущения или потеря массы тела. Желтуха носит механический характер. Развивается постепенно. Интенсивность ее неуклонно нарастает. Желтуха сопровождается изменением цвета мочи и кала. Каловые массы обесцвечиваются. Моча приобретает коричневую окраску, по цвету напоминающую пиво. Иногда изменения мочи и кала возникают до появления желтухи.
Кожный зуд обусловлен раздражением кожных рецепторов желчными кислотами. При желтухе на почве рака поджелудочной железы зуд встречается у большинства заболевших. Обычно он возникает после появления желтухи, чаще при высоком содержании билирубина в крови, но иногда больные отмечают зуд кожных покровов еще в дожелтушном периоде. Кожный зуд значительно ухудшает самочувствие больных, не дает им покоя, вызывает бессонницу и повышенную раздражительность, часто приводит к многочисленным расчесам, следы которых видны на коже. Потеря массы тела является одним из наиболее важных симптомов. Она обусловлена интоксикацией за счет развивающейся опухоли и нарушением кишечного пищеварения в результате закупорки желчных и панкреатических протоков. Похудание наблюдается у большинства больных, иногда бывает первым симптомом заболевания, предшествуя появлению боли и желтухи. Снижение аппетита встречается более чем у половины больных. Нередко возникает отвращение к жирной или мясной пище. Похудание и снижение аппетита сочетается с нарастающей слабостью, утомляемостью, иногда — тошнотой и рвотой. Иногда наблюдается чувство тяжести после еды, изжога, часто нарушается функция кишечника, появляется метеоризм, запоры, изредка — поносы. Стул обильный, серо-глинистого цвета с неприятным зловонным запахом, содержит большого количества жира.
Кожный зуд обусловлен раздражением кожных рецепторов желчными кислотами. При желтухе на почве рака поджелудочной железы зуд встречается у большинства заболевших. Обычно он возникает после появления желтухи, чаще при высоком содержании билирубина в крови, но иногда больные отмечают зуд кожных покровов еще в дожелтушном периоде. Кожный зуд значительно ухудшает самочувствие больных, не дает им покоя, вызывает бессонницу и повышенную раздражительность, часто приводит к многочисленным расчесам, следы которых видны на коже. Потеря массы тела является одним из наиболее важных симптомов. Она обусловлена интоксикацией за счет развивающейся опухоли и нарушением кишечного пищеварения в результате закупорки желчных и панкреатических протоков. Похудание наблюдается у большинства больных, иногда бывает первым симптомом заболевания, предшествуя появлению боли и желтухи. Снижение аппетита встречается более чем у половины больных. Нередко возникает отвращение к жирной или мясной пище. Похудание и снижение аппетита сочетается с нарастающей слабостью, утомляемостью, иногда — тошнотой и рвотой. Иногда наблюдается чувство тяжести после еды, изжога, часто нарушается функция кишечника, появляется метеоризм, запоры, изредка — поносы. Стул обильный, серо-глинистого цвета с неприятным зловонным запахом, содержит большого количества жира.
Физикальное обследование:
Симптомы рака поджелудочной железы являются следствием трех клинических феноменов, обусловленных растущей опухолью: обтурации, компрессии и интоксикации.
Феномен компрессии проявляется болевыми ощущениями в результате прорастания или сдавления опухолью поджелудочной железы нервных стволов.
Феномен обтурации возникает, если растущая опухоль обтурирует общий желчный проток, двенадцатиперстную кишку, панкреатический проток, сдавливает селезеночную вену. Обтурация общего желчного протока ведет к появлению желчной гипертензии, с которой связано возникновение механической желтухи, кожного зуда, увеличение печени и желчного пузыря, появления обесцвеченного кала и темной окраски мочи. Желчная гипертензия является тяжелым патологическим состоянием, определяющим дальнейшую судьбу больного. Она приводит к нарушениям функции печени, сердечно-сосудистой и нервной систем, обмена веществ, вызывает брадикардию, головную боль, апатию, повышенную раздражительность. Исходом длительной и интенсивной желтухи является печеночная и печеночно-почечная недостаточность, холемические кровотечения. Прорастание опухолью двенадцатиперстной кишки приводит к непроходимости. напоминающей по клинике стеноз привратника.
Феномен интоксикации проявляется похуданием, снижением аппетита и общей слабостью. Эти симптомы часто наблюдаются при раке поджелудочной железы, поскольку обусловлены не только влиянием самой опухоли, но и нарушением кишечного пищеварения.
Дополнительные:
Лабораторные исследования
Основные:
Цитологическое исследование биоптата опухоли поджелудочной железы или метастаза печени (увеличение размеров клетки вплоть до гигантских, изменение формы и количества внутриклеточных элементов, увеличение размеров ядра, его контуров, разная степень зрелости ядра и других элементов клетки, изменение количества и формы ядрышек);
Гистологическое исследование биоптата опухоли поджелудочной железы или метастаза печени (выраженный клеточный полиморфизм, увеличение размеров клеток, выраженная гипохромия, ядра крупные содержат одно или несколько ядрышек, имеются железистые структуры из раковых клеток в виде розеток, много клеток в состоянии митоза).
Дополнительные:
Иммуногистохимическое исследование биоптата и операционного материала для детального определения подтипа опухоли;
Молекулярно-генетическое исследование: в связи с частотой выявления мутаций в генах BRCA1, BRCA2 более 5 %, а также существенным влиянием данных мутаций на выбор схемы ХТ, их определение целесообразно у всех пациентов.
Биохимический анализ крови для опухоли, локализующейся в области головки поджелудочной железы, характерно развитие механической («подпеченочной») желтухи - лабораторные исследования обнаруживают гипербиллирубинемию.
Неспецифические лабораторные исследования или в случаях решения вопроса о назначении химиотерапии рекомендуется:
Общий (клинический) анализ крови развернутый, СОЭ;
Биохимический исследования крови: общий белок, глюкоза, билирубин, креатинин, мочевина, железо, аланинаминотрасфераза (АЛТ), аспартатаминотрансфераза (АСТ), билирубин общий, щелочная фосфатаза (ЩФ), электролиты плазмы (калий, натрий, хлор), СРБ;
Общий (клинический) анализ мочи;
Коагулология: фибриноген, протромбин, МНО, протромбиновое время, протромбиновый индекс, активированное частичное тромбопластиновое время (АЧТВ), тромбиновое время (ТВ);
Анализ крови на раковый эмбриональный антиген (РЭА), определения уровня антигена аденогенных раков СА 19-9) с целью оценки текущей клинической ситуации и при их повышении для дальнейшего мониторинга заболевания. Определение базового уровня должно проводится на фоне билиарной декомпрессии, нормальном уровне билирубина купирования воспаления;
Анализ крови на хромогранин А для дифдиагноза с нейроэндокринными опухолями.
Неспецифические лабораторные исследования или в случаях решения вопроса о назначении химиотерапии рекомендуется:
Общий (клинический) анализ крови развернутый, СОЭ;
Биохимический исследования крови: общий белок, глюкоза, билирубин, креатинин, мочевина, железо, аланинаминотрасфераза (АЛТ), аспартатаминотрансфераза (АСТ), билирубин общий, щелочная фосфатаза (ЩФ), электролиты плазмы (калий, натрий, хлор), СРБ;
Общий (клинический) анализ мочи;
Коагулология: фибриноген, протромбин, МНО, протромбиновое время, протромбиновый индекс, активированное частичное тромбопластиновое время (АЧТВ), тромбиновое время (ТВ);
Анализ крови на раковый эмбриональный антиген (РЭА), определения уровня антигена аденогенных раков СА 19-9) с целью оценки текущей клинической ситуации и при их повышении для дальнейшего мониторинга заболевания. Определение базового уровня должно проводится на фоне билиарной декомпрессии, нормальном уровне билирубина купирования воспаления;
Анализ крови на хромогранин А для дифдиагноза с нейроэндокринными опухолями.
Инструментальные исследования
Основные:
УЗИ органов брюшной полости – первичная диагностика образований поджелудочной железы.
Мультисрезная компьютерная томография органов брюшной полости с болюсным контрастированием позволяет диагностировать рак поджелудочной железы и оценить инвазию сосудов и определить метастазы (лимфатические узлы, печень, брюшная полость).
Фиброгастродуоденоскопия (с целью оценки распространенности опухолевого процесса)
Показания для консультации специалистов:
Дополнительные:
Эндоскопическая ретроградная холангиопанкреатография – имеет значение в диагностике обструкции панкреатического и желчных протоков.
Магнитно-резонансная томография с магнитно-резонансной холангиопанкреатографией позволяет получить информацию о состоянии панкреатического протока и желчных протоков.
ПЭТ-КТ– один из наиболее чувствительных и информативных методов для оценки степени распространенности опухолевого процесса малого таза, брюшной полости, забрюшинного пространства, грудной клетки, головного мозга, мягких тканей, костей, выявления «маленьких» опухолей, рецидивов, метастазов.
NB! При любой последовательности применения инструментальных методов исследований необходимо установить опухолевую природу изменений в поджелудочной железе и распространённость опухоли.
Показания для консультации специалистов:
Консультация узких специалистов по показаниям.
Алгоритм диагностики рака ПЖ:
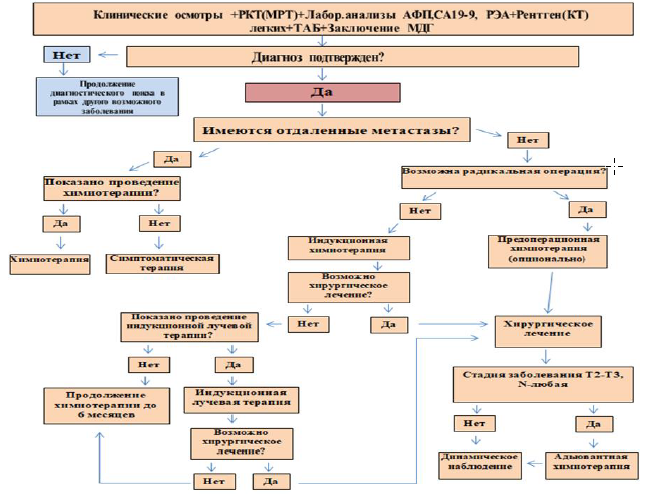
Диагностический алгоритм [36].
Алгоритм диагностики рака ПЖ:

Дифференциальный диагноз
Дифференциальный диагноз
[36]:
|
Диагноз
|
Обоснование для дифференциальной диагностики | Признаки | Обследование и критерии диагноза |
| Рак ПЖ | Абдоминальный болевой синдром | Изменение интенсивности болевого синдрома (в т.ч. усиление боли, связанное с приемом пищи), потеря веса или желтуха |
• КТ или ЭРХПГ: образование ПЖ или стриктура протока.
• Биопсия.
• Онкомаркеры крови (CA19-9, CEA).
|
| Острый панкреатит | Абдоминальный болевой синдром | Отличительные признаки острого тяжелого панкреатита: стойкая органная недостаточность (респираторная, почечная; гипотония или нарушения психики) |
• Трехкратное повышение амилазы и/или липазы сыворотки.
• Абдоминальная КТ: интерстициальный или некротизирующий ХП.
|
| Язвенная болезнь (ЯБ) | Абдоминальный болевой синдром | Абдоминальный дискомфорт, тошнота, отрыжка, вздутие, ЖДА, возможны мелена и гематомезис | • ЭГДС: обнаружение язвенного дефекта. |
| Мезентериальная ишемия | Абдоминальный болевой синдром | Периумбиликальная, постпрандиальная абдоминальная боль, потеря веса без напряжения брюшной стенки. Острая ишемия – начало с интенсивного болевого синдрома |
• КТ ангиография /МРТ ангиография, допплерография (ангиографическая картина сужения мезентериальных артерий и их ветвей).
• Возможно реактивное повышение амилаза/ липазы, что затрудняет диагностику.
|
| Инфаркт миокарда | Абдоминальный болевой синдром | Инфаркт миокарда нижней стенки левого желудочка может проявляться эпигастральной болью, диспепсическими явлениями, холодным потом, одышкой | • ЭКГ, кардиальные ферменты (тропонин). |
| Кишечная непроходимость | Абдоминальный болевой синдром | Интенсивный болевой синдром сопровождается тошнотой и рвотой, сменяется периодами мнимого благополучия | • Лучевые методы исследования (например, обнаружение чаш Клойбера при обзорной рентгенографии органов брюшной полости). |
| Радикулопатия | Абдоминальный болевой синдром | Позиционные боли (по локализации иннервируемого дерматома) | • Электромиография и МРТ позвоночника |
| Постгерпетическая невралгия | Абдоминальный болевой синдром | Жгучая боль с нарушением чувствительности Визуально: кожная эритема и везикулы в пределах дерматома | • Клиническая диагностика (наличие везикулезных элементов по ходу нервов). |
| Нефролитиаз | Абдоминальный болевой синдром | Односторонняя боль, иррадиирующая в спину или живот Диспепсические явления сочетаются с нарушением мочеиспускания и гематурией |
• УЗИ, КТ (обнаружение конкрементов в лоханках почек и мочеточниках).
• Патологический мочевой осадок.
|
| ЖКБ | Кишечная диспепсия, возможная абдоминальная боль, желтуха | Боль, тошнота, рвота, анорексия, связанные с приемом жирной пищи. Длительность болей короче, чем при ХП (1-2 часа) |
• УЗИ, ЭндоУЗИ, КТ, МРТ: холелитиаз (холецистолитиаз, холедохолитиаз, дилатация общего желчного протока).
• Повышение активности печеночных ферментов.
|
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ: нет.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ
Карта наблюдения пациента, маршрутизация пациента: нет.
Немедикаментозное лечение:
Режим: при проведении консервативного лечения – общий. В ранний послеоперационный период – постельный или полупостельный (в зависимости от объема операции и сопутствующей патологии). В послеоперационном периоде – палатный.
Диета: после хирургического лечения – стол №1, затем переход на стол № 15.
Виды лучевой терапии:
Лучевая терапия
Целевая функция лучевой терапии при раке поджелудочной железы:
радикальная лучевая терапия;
паллиативная лучевая терапия;
симптоматическая лучевая терапия.
В самостоятельном, пред-или послеоперационном режиме.
Виды лучевой терапии:
фотонная терапия (тормозное излучение высоких энергий, гамма терапия).
корпускулярная терапия (быстрые электроны высоких энергий, протонная, ионная, нейтронная).
Методы лучевой терапии (Режимы фракционирования дозы во времени):
а) Классический (стандартный) режим фракционирования: РОД 1,8-2,4 Гр до 5 фракций в неделю, расщепленный или непрерывный курс, до СОД 20,0-70,0 Гр.
б) Режим гипофракционирования РОД >2,5 Гр до 5 фракций в неделю, расщепленный или непрерывный курс, до СОД > 15,0 Гр.
в) Режим гиперфракционирования (мультифракционирования): РОД 1,0-1,25 Гр 2 раза в день через 4-6 и 20-18 часов, расщепленный или непрерывный курс, до СОД 20-70 Гр.
г) Стереотаксическая радиохирургия – одномоментное подведение высокой дозы (РОД 12 Гр и более) с использованием стереотаксической техники; применяется при небольших опухолях (до 3 см в максимальном измерении) с четкими границами;
Способы лучевой терапии.
д) Стереотаксическая радиотерапия (SRT) - крупнофракционное облучение от 2-х до 5 фракций РОД > 7,0 Гр ежедневно до СОД >14 Гр.
Способы лучевой терапии.
– Дистанционная ЛТ:
2-х мерная конвенциальная (стандартная) лучевая терапия (2D RT);
3-х мерная конформная лучевая терапия (3D CRT);
интенсивно-модулированная лучевая терапия (IMRT);
лучевая терапия, управляемая по изображениям (IGRT);
лучевая терапия, синхронизированная с дыханием (4D RT);
томотерапия на томоаппаратах;
стереотаксическая радиохирургия (SRS);
стереотаксическая радиотерапия (SRT).
– Интраоперационная лучевая терапия (IORT);
– Брахитерапия.
Лучевая терапия при метастазах в головной мозг.
1. Тотальное облучение головного мозга до С1 шейного позвонка:
РОД 2,0 Гр 5 фракций в неделю СОД 30-40 Гр;
РОД 2,5 Гр 5 фракций в неделю СОД 30-35 Гр;
РОД 3,0 Гр 5 фракций в неделю СОД 30-33 Гр;
РОД 4,0 Гр 5 фракций СОД 20 Гр.
2. Локальное облучение головного мозга
стереотаксическая радиохирургия (SRS) - РОД 10,0 – 30,0 Гр 1 фракция при размерах метастаза не более 3 см в диаметре;
стереотаксическая радиотерапия (SRT) – РОД 6,0-10,0 Гр 3-5 фракций при размерах метастаза от 3,0 до 6,0 см;
локальное облучение метастазов РОД 2,0-3,0 до СОД 20-60 Гр.
Лучевая терапия при метастазах в кости скелета:
РОД 2,0 Гр 5 фракций в неделю СОД 40-50 Гр;
РОД 2,5 Гр 5 фракций в неделю СОД 40-50 Гр;
РОД 3,0 Гр 5 фракций в неделю СОД 39-45 Гр;
РОД 4,0 Гр 3-5 фракций в неделю СОД 20-40 Гр;
РОД 8,0 Гр 1-2 фракции.
Лучевая терапия проводится в конвенциальном (стандартном) или конформном режиме облучения в статическом многопольном режиме РОД 1,8-2,0-2,5Гр 5 фракций в неделю СОД 40-60Гр непрерывном или расщепленным курсом.
Лучевая терапия назначается в послеоперационном режиме, в плане предоперационного или самостоятельного воздействия в сочетании с химиотерапией.
Облучение проводят на гамма-терапевтических аппаратах или линейных ускорителях.
Томотерапия на томоаппаратах. Используются как стандартные методики фракционирования при подведении разовых и суммарных очаговых доз. Однако упор при томотерапии делается на гипофракционирование при РОД<2,5 Гр.
Адъювантная терапия:
Неоадъювантная терапия - применяется при потенциально операбельном процессе с целью увеличения доли резектабельности и улучшения общей выживаемости.
Монохимиотерапия:
Комбинированная химиотерапия:
Медикаментозное лечение:
Общепризнанным стандартом химиотерапевтического лечения больных раком поджелудочной железы в настоящее время является монотерапия гемцитабином. Попытки усиления данной схемы другими препаратами (фторурацил, производными платины, таксаны) к настоящему времени успехом не увенчались.
Наиболее распространенные схемы химиотерапии.
Адъювантная терапия:
1. Фторурацил 425 мг/м2, в/в, в 1-5-й день Курсы повторяют каждые 3-4 недели. 6 циклов.
2. Гемцитабин 1000 мг/м2, в/в (10мг/м2/мин) в 1, 8, 15 дни. Курсы повторяют каждые 28 дней. 6 циклов.
Неоадъювантная терапия - применяется при потенциально операбельном процессе с целью увеличения доли резектабельности и улучшения общей выживаемости.
Распространенный рак поджелудочной железы
Монохимиотерапия:
1. Гемцитабин 1000 мг/м2, в/в, в течение 100 мин; 10мг/м2/мин; 1, 8, 15 дни каждые 28 дней.
Или гемцитабин 1000мг/м2, в/в, еженедельно, в течение 7 недель, с последующим недельным перерывом, следующий курс гемцитабин - 1000мг/м2, в/в, еженедельно, в течение 3 недель с последующим недельным перерывом.
Повторять 3-х недельный курс каждые 28 дней.
2. Капецитабин 1250мг/м2, внутрь, дважды в день, с 1-го по 14-й дни.
Доза может быть снижена до 850-1000мг/м2, внутрь, дважды в день, с 1-го по 14-й дни для уменьшения риска токсичности без уменьшения клинической эффективности.
Повторять каждый 21-й день.
3. Фторурацил 500 мг/м2, в/в, с 1-го по 5-й день, каждые 28 дней.
4. Эрлотиниб 100мг, внутрь, ежедневно до прогрессирования.
Комбинированная химиотерапия:
1.Фторурацил 425 мг/м2, в/в, с 1-го по 5-й день и далее; Кальция фолинат 20мг/м2, в/в, с 1-го по 5-й день.
Повторять каждые 4 недели.
2. Гемцитабин 1000мг/м2; 1, 8, 15, 22 дни;
Кальция фолинат 200мг/м2, в/в; 1, 8, 15, 22 дни.
Фторурацил 750мг/м2, в/в; 1, 8, 15, 22 дни. Повторять каждые 6 нед.
3. GEM-CAP:
Гемцитабин 1000мг/м2, в/в; 1, 8, 15 дни;
Капецитабин 880мг/м2, внутрь, 2 раза в день, с 1-го по 21-й дни. Повторять каждые 28 дней.
4. GTX:
Гемцитабин 750мг/м2, в/в, в течение 75 мин, на 4-й и 11-й дни; Доцетаксел 30мг/м2, в/в, на 4-й и 11-й дни;
Капецитабин 1000-1500мг/м2, внутрь, 2 раза в день, с 1-го по 14-й день. Повторять каждые 3 недели.
5. GEMOX:
Гемцитабин 1500мг/м2, в/в, 1-й и 8-й дни; Оксалиплатин 85мг/м2, в/в, 1-й и 8-й дни. Каждые 4 недели.
или
Гемцитабин 1000мг/м2, в/в, в течение 100мин, 10мг/м2/мин, 1-й день; Оксалиплатин 100мг/м2, в течение 2 часов, 2-й день.
Повторять цикл каждые 2 недели.
6. GP:
Гемцитабин 1000мг/м2, в/в, 1-й и 8-й дни;
Цисплатин 25мг/м2, в/в, 1-й и 8-й дни
Каждые 21 день.
7. GF:
Гемцитабин 1000мг/м2, в/в; 1, 8, 15 дни;
Фторурацил 400мг/м2, в/в, струйно, затем - 600мг/м2, 22-часовая инфузия, 1-й и 2-й дни.
Каждые 28 дней.
8. DG:
Доцетаксел 35мг/м2, в/в; 1, 8, 15 дни;
гемцитабин 1000мг/м2; 1, 8, 15 дни.
Каждые 28 дней.
9. FOLFOXIRI:
иринотекан 165мг/м2, в/в, в 1-й день; оксалиплатин 85мг/м2, в 1-й день;
кальция/натрия фолинат 200-400 мг/м2, в/в 2-часовая инфузия в 1-й день; фторурацил 3200мг/м2, в/в 48-часовая инфузия.
Повторение курса каждые 2 недели.
10. Гемцитабин + Эрлотиниб:
Гемцитабин 1000мг/м2, в/в, еженедельно, в течение 7 недель, с последующим недельным перерывом, следующие курсы 1000мг/м2, еженедельно, в течение 3 недель, с последующим недельным перерывом
Эрлотиниб 100мг, внутрь, ежедневно до прогрессирования. Повторять 3-х недельный курс каждые 28 дней.
11. mFOLFIRINOX: иринотекан 165-180мг/м2, в/в, в 1-й день; оксалиплатин 60-85мг/м2, в 1-й день;
кальция/натрия фолинат 400 мг/м2 в/в 120мин; фторурацил 320-400мг/м2 в/в болюсно; фторурацил 2000-2400мг/м2, в/в 46-часовая инфузия. Повторение курса каждые 2 недели.
12. Олапариб 300 мг (2 таблетки по 150 мг) два раза в сутки качестве монотерапии для поддерживающего лечения метастатической аденокарциномы поджелудочной железы с наличием герминальных мутаций BRCA1/2 без прогрессирования заболевания в течении минимум 16 недель лечения платиносодержащей химиотерапии первой линии, продолжительностью до прогрессирования заболевания или развития недопустимой токсичности.
Химиолучевая терапия:
фторурацил + лучевая терапия (GITSG режим):
фторурацил 500мг/м2/день, в/в, с 1-го по 3-й дни и с 29-го по 31-й дни, далее – еженедельно, начиная с 71 дня.
Лучевая терапия общая доза 40Гр.
Химиотерапии и лучевая терапия проводится конкурентно.
Химиотерапия «НЭ» назначается при невозможности хирургического лечения, после циторедуктивных операций.
Функционирующие НЭО G1-G3:
Ланреотид - рекомендуемая начальная доза составляет 90 мг каждые 28 дней в течение 2 месяцев. В дальнейшем дозу следует подбирать в зависимости от достигнутого уменьшения симптоматики. В случае недостаточного ответа, оцениваемого по клиническим симптомам («приливы» и мягкий стул), доза может быть увеличена до 120 мг каждые 28 дней (4 недели). В случае достаточного ответа, оцениваемого по клиническим симптомам («приливы» и мягкий стул), доза может быть снижена до 60 мг каждые 28 дней (4 недели).
Октреотид 0,1 мг п/к 3 раза в сутки в течение короткого периода времени (примерно 2 недели) с целью оценки его эффективности и общей переносимости затем Октреотид 20 мг внутримышечно 1раз/28 дней.
Если в течение 3 месяцев обеспечивается адекватный контроль клинических проявлений и биологических маркеров заболевания – Октреотид 10 мг внутримышечно 1раз/28 дней.
Если в течение 3 месяцев обеспечивается только частичный контроль клинических проявлений и биологических маркеров заболевания – Октреотид 30 мг внутримышечно каждые 4 недели.
Прогрессирование:
эверолимус 10мг внутрь ежедневно до прогрессирования.
эверолимус 10мг внутрь ежедневно в комбинации с Октреотид 1раз/28 дней до прогрессирования.
Нефункционирующие НЭО
Ki67>10%, G2/G3: темозоломид;
Ланреотид показан при гастроэнтеропанкреатических, нейроэндокринных опухолях (-НЭО) грэйд 1 и 2 (индекс пролиферации Ki67 до 10%), имеющие происхождение из средней кишки, поджелудочной железы или неуточненного первичного очага (за исключением опухолей, имеющих происхождение из задней кишки) у взрослых пациентов с нерезектабельными местнораспространенными или метастатическими опухолями:
рекомендуемая доза Лантреотида составляет 120 мг каждые 28 дней. Лечение должно продолжаться столь долго, сколько необходимо для контроля опухоли
Ki67 5-20%, G2:
доксорубицин+фторурацил;
Ki67 2-20%, G1/G2:
1) эверолимус;
2) сунитиниб
Ki67>20%, G3:
1) карбоплатин/цисплаин+этопозид*
Схемы лекарственной терапии:
1) Цисплатин - 80 мг/м² в/в капельно в 1-й день. Этопозид* - 120мг/м² в/в капельно в 1-3-й день. Повторение цикла каждые 4 недели;
2) Карбоплатин – AUC 4-5. Этопозид*100мг/м² в/в 1-3-й день. Повторение цикла каждые 4 недели;
3) Темозоломид - 150 мг/ м² /сут внутрь 7 дней, перерыв 7 дней; бевацизумаб – 5 мг/кг в/в 1 раз в 2 недели
Продолжительность курса 22 недели;
4) Темозоломид - 150 мг/ м² /сут внутрь в 1 - 5-й день; капецитабин – 2 г/ м² /сут внутрь в 1 – 14-й день Бевацизумаб – 5 мг/кг в/в 1 раз в 2 недели Повторение цикла каждые 28 дней;
5) XELOX: оксалиплатин 130 мг/м2 в 1й день, капецитабин 2000 мг/м2 в сутки (разделить в 2 приема, утором и вечером) в 1-14й дни;
6) α -ИФН 3-5 млн. ЕД п/к 3 раза в неделю. Доза подбирается индивидуально по переносимости;
7) Эверолимус 10мг внутрь ежедневно до прогрессирования.
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
Перечень дополнительных лекарственных средств (менее 100% вероятности применения):
Хирургическое лечение. Основными видами хирургических операций являются:
Консенсусная группа экспертов разработала критерии для определения резектабельности опухоли, чтобы улучшить отбор пациентов для хирургического вмешательства и увеличить вероятность резекции R0. [24,25] Также было описано более строгое определение пограничных резектабельных опухолей поджелудочной железы [26], в котором используются степени контакта опухоли с магистральными сосудами и деформация или сужение для определения вероятности сосудистой инвазии.
Определение резектабельности.

Стандартным доступом при всех операциях на поджелудочной железе является срединная лапаротомия. При опухолях головки поджелудочной железы следует выполнять гастропанкреатодуоденальную резекцию.
Стандартный объем лимфодиссекции при раке головки поджелудочной железы предполагает удаление следующих лимфатических узлов: надпилорических и подпилорических лимфоузлов по ходу печеночной артерии и чревного ствола, лимфоузлов вдоль общего желчного протока, пузырного протока и воротной вены, ретропанкреатических лимфоузлов, лимфоузлов по нижнему краю головки поджелудочной железы, лимфоузлов по правой полуокружности верхней брыжеечной артерии, лимфоузлов по верхнему краю головки поджелудочной железы. При раке головки поджелудочной железы рекомендуется иссечение клетчатки и нервных сплетений вдоль правой полуокружности верхней брыжеечной артерии.
При карциномах тела и хвоста поджелудочной железы рекомендовано удаление следующих групп лимфоузлов: лимфоузлов ворот селезенки, лимфоузлов вдоль селезеночной артерии, лимфоузлов по нижнему краю поджелудочной железы, вдоль общей печеночной артерии и чревного ствола, расположенных вдоль левой полуокружности верхней брыжеечной артерии, средних ободочных лимфоузлов вдоль одноименной артерии. Стандартная лимфаденэктомия должна включать удаление не менее 12 лимфатических узлов. Расширенная лимфаденэктомия не показала преимуществ в ходе сравнительных исследований, ее применение не рекомендовано на сегодняшний день. Многочисленные исследования, посвященные возможностям выполнения операций по поводу РПЖ лапароскопическим способом, продемонстрировали сопоставимые с эффективностью традиционных вмешательств хирургические и онкологические результаты. В связи с этим они могут рассматриваться в качестве альтернативы стандартным операциям с лапаротомным доступом в центрах, имеющих существенный опыт подобных вмешательств.
Операция Appleby (дистальная резекция поджелудочной железы с резекцией чревного ствола) может применяться только в специализированных клиниках с участием специалистов, имеющих опыт подобных вмешательств, на фоне стабилизации или частичного ответа на предоперационную ХТ или ХЛТ.
СА19-9 не может ограничивать применение операции при резектабельном раке поджелудочной железы [31]. Безопасная панкреатдуоденэктомия может быть рекомендована при уровне билирубина 128 мкмоль/л[32]. Анатомическое положение РПЖ относительно к плоскостям хирургического рассечения означает, что, несмотря на использование оптимальных методов резекции, большинство удаленных участков будут иметь раковые клетки, лежащие в 1 мм от края резекции на одном или нескольких поверхности образцов [33-35].
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
|
Лекарственная группа
|
Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Алкилирующие агенты – комплексные соединения платины | цисплатин | 75 мг/м2 1-й день, в/в | А |
| карбоплатин | АUC 5-6 1-й день, в/в | А | |
| Антагонисты пиримидина – фторпиримидины | капецитабин | 2000 мг/м2, 1-14дни, таблетки, внутрь | А |
| Антиметоболиты – аналоги цитидина | гемцитабин | 1000 мг/м2 1-й, 8-й и 15-й день, в/в | А |
| Специфический ингибитор топоизомеразы I | иринотекан | 165 мг/м2 в 1-й день, в/в | А |
| Ингибиторы топоизомеразы 11 | этопозид* | 100 мг/м2 1-5 дни, в/в | А |
| Комплексные соединения платины | оксалиплатин | 130 мг/м2 в 1-й день, в/в | А |
| Алкилирующее соединение | дакарбазин | 200 мг/м² в/в в 1-3-й день | А |
| Антиметаболит | фторурацил | 400 мг/м2, в/в струйно, затем - 600мг/м2 22-часовая инфузия | А |
| Ингибитор протеинкиназы | эрлотиниб | 100 мг внутрь | А |
| Синтетический аналог соматостатина | ланреотид | 120 мг каждые 28 дней | В |
| Аналог соматостатина | октреотид | 0,1 мг п/к | А |
| Ингибитор серин-треониновой киназы mTOR | эверолимус | 10 мг внутрь | А |
| Противоопухолевое средство, ингибитор протеинтирозинкиназ | сунитиниб |
37,5 мг не прерывно до прогрессирования;
40 мг 4 недели с перерывом 2 недели непрерывно до прогрессирования .
При неудовлетворительной переносимости 40 мг 2 недели с перерывом 2 недели непрерывно до прогрессирования внутрь.
|
А |
| Антидот антагонистов фолиевой кислоты | кальция фолинат | 200 мг/м2 в/в | А |
| натрия фолинат | 400 мг/м2 в/в | С | |
| Алкилирующий агент | темозоломид | 150 мг/ м² /сут внутрь | В |
*В соответствии с правилами применения незарегистрированных ЛС.
Перечень дополнительных лекарственных средств (менее 100% вероятности применения):
| Лекарственная группа | Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Моноклональные антитела к факторам роста и их рецепторам | бевацизумаб | 7,5-15 мг/кг в/в 1 раз в 3 недели | А |
|
Ингибитор человеческого фермента поли (АДФ-рибоза) полимераз (PARP)
|
олапариб | 300 мг, 2 раза в сутки, длительно | А |
NB! Дополнительное медикаментозное лечение проводится соответственно протоколам лечения развившихся осложнений.
Хирургическое вмешательство
Радикальным методом лечения опухолей поджелудочной железы является операция, объем которой зависит от локализации и распространенности процесса.
Показанием к хирургическому лечению рака поджелудочной железы является установление диагноза операбельного рака поджелудочной железы при отсутствии противопоказаний к операции.
Хирургическое лечение. Основными видами хирургических операций являются:
1. Стандартная гастропанкреатодуоденальная резекция (субтотальная панкреатикодуоденэктомия, операция Whipple);
2. Расширенная гастропанкреатодуоденальная резекция (расширенная субтотальная или тотальная панкреатикодуоденэктомия, региональная субтотальная или тотальная панкреатикодуоденэктомия);
3. Дистальная (левосторонняя) резекция поджелудочной железы;
4. Панкреатэктомия (тотальная дуоденопанкреатэктомия);
5. Криодеструкция опухоли тела и хвоста поджелудочной железы.
Консенсусная группа экспертов разработала критерии для определения резектабельности опухоли, чтобы улучшить отбор пациентов для хирургического вмешательства и увеличить вероятность резекции R0. [24,25] Также было описано более строгое определение пограничных резектабельных опухолей поджелудочной железы [26], в котором используются степени контакта опухоли с магистральными сосудами и деформация или сужение для определения вероятности сосудистой инвазии.
Определение резектабельности.

После проведения курсов предоперационного лечения решение о хирургическом лечении должно приниматься мультидисциплинарной группой. Хирургическое лечение целесообразно только при отсутствии отдаленных метастазов. При изолированном местном прогрессировании опухоли решение об операции принимается индивидуально в условиях специализированного центра. Пациентам с погранично резектабельными карциномами, которым проводилось неоадъювантное лечение, операция целесообразна только при отсутствии инструментальных признаков прогрессирования. При погранично резектабельных опухолях головки поджелудочной железы сохранение инфильтрации вокруг артериальных сосудов менее 180 градусов не является абсолютным противопоказанием к лапаротомии.
Стандартным доступом при всех операциях на поджелудочной железе является срединная лапаротомия. При опухолях головки поджелудочной железы следует выполнять гастропанкреатодуоденальную резекцию.
При опухолях тела или хвоста поджелудочной железы следует выполнять дистальную субтотальную резекцию поджелудочной железы, включающую удаление тела, хвоста железы, а также селезенки. При поражении карциномой всех отделов поджелудочной железы рекомендуется выполнить тотальную панкреатэктомию.
Стандартный объем лимфодиссекции при раке головки поджелудочной железы предполагает удаление следующих лимфатических узлов: надпилорических и подпилорических лимфоузлов по ходу печеночной артерии и чревного ствола, лимфоузлов вдоль общего желчного протока, пузырного протока и воротной вены, ретропанкреатических лимфоузлов, лимфоузлов по нижнему краю головки поджелудочной железы, лимфоузлов по правой полуокружности верхней брыжеечной артерии, лимфоузлов по верхнему краю головки поджелудочной железы. При раке головки поджелудочной железы рекомендуется иссечение клетчатки и нервных сплетений вдоль правой полуокружности верхней брыжеечной артерии.
При карциномах тела и хвоста поджелудочной железы рекомендовано удаление следующих групп лимфоузлов: лимфоузлов ворот селезенки, лимфоузлов вдоль селезеночной артерии, лимфоузлов по нижнему краю поджелудочной железы, вдоль общей печеночной артерии и чревного ствола, расположенных вдоль левой полуокружности верхней брыжеечной артерии, средних ободочных лимфоузлов вдоль одноименной артерии. Стандартная лимфаденэктомия должна включать удаление не менее 12 лимфатических узлов. Расширенная лимфаденэктомия не показала преимуществ в ходе сравнительных исследований, ее применение не рекомендовано на сегодняшний день. Многочисленные исследования, посвященные возможностям выполнения операций по поводу РПЖ лапароскопическим способом, продемонстрировали сопоставимые с эффективностью традиционных вмешательств хирургические и онкологические результаты. В связи с этим они могут рассматриваться в качестве альтернативы стандартным операциям с лапаротомным доступом в центрах, имеющих существенный опыт подобных вмешательств.
Операция Appleby (дистальная резекция поджелудочной железы с резекцией чревного ствола) может применяться только в специализированных клиниках с участием специалистов, имеющих опыт подобных вмешательств, на фоне стабилизации или частичного ответа на предоперационную ХТ или ХЛТ.
При резектабельных опухолях первоначальная операция остается стандартом лечения[27]. Стандартная лимфаденэктомия должна включать удаление ≥16 узлов и (таблица S5 доступно на сайте Annals of Oncology онлайн[28]). ISGPS не рекомендует расширенную лимфаденэктомию[29]. Доказательств влияния на выживаемость при удалении обширного числа лимфоузлов в рандоминизированных исследования нет [30].
СА19-9 не может ограничивать применение операции при резектабельном раке поджелудочной железы [31]. Безопасная панкреатдуоденэктомия может быть рекомендована при уровне билирубина 128 мкмоль/л[32]. Анатомическое положение РПЖ относительно к плоскостям хирургического рассечения означает, что, несмотря на использование оптимальных методов резекции, большинство удаленных участков будут иметь раковые клетки, лежащие в 1 мм от края резекции на одном или нескольких поверхности образцов [33-35].
NB! В послеоперационном материале необходимо исследовать не только линию среза поджелудочной железы, но и области которые соприкасаются с забрюшинным пространством[33-35].
Наблюдение:
Дальнейшее ведение
Наблюдение, сроки и объем обследования
Наблюдение:
первый год – 1 раз в 3мес.;
Объем наблюдения:
второй год – 1 раз в 6мес.;
в последующем, пожизненно – 1 раз в год.
Объем наблюдения:
фиброгастроскопия;
УЗИ органов брюшной полости, забрюшинного пространства, КТ/МРТ;
рентгенологическое исследование легких;
УЗИ периферических лимфатических узлов, пальцевое исследование прямой кишки, осмотр гинеколога (у женщин);
общий анализ крови;
онкомаркер СА 19-9;
ПЭТ-КТ.
По показаниям: фиброколоноскопия, ирригоскопия, ангиография, сцинтиграфия костей скелета.
Критерии эффективности лечения:
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе:
удовлетворительное состояние при условии отсутствия осложнений и заживления п/о раны;
данные, свидетельствующие об отсутствии признаков прогрессирования процесса, полученные клиническими и/или визуализирующими методами исследования, а также повышение качества жизни больного.
Критерии эффективности лечения:
полный эффект – исчезновение всех очагов поражения на срок не менее 4х недель;
частичный эффект – большее или равное 50% уменьшение всех или отдельных опухолей при отсутствии прогрессирования других очагов;
стабилизация – (без изменений) уменьшение менее чем на 50% или увеличение менее чем на 25% при отсутствии новых очагов поражения;
прогрессирование – увеличение размеров одной или более опухолей более 25% либо появление новых очагов поражения.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации:
подозрение или верифицированный рак поджелудочной железы, II клиническая группа.
Показания для экстренной госпитализации:
механическая желтуха;
кровотечение;
распад опухоли.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- 1) Ducreux M., Cuhna A. Sa., Caramella C., et al. Cancer of the pancreas: ESMO clinical practice guidelines // Published in 2015 – Ann Oncol (2015) 26 (suppl 5): v56-v68. eUpdate – 15 March 2019. 2) Патютко Ю.И., Котельников А.Г. «Хирургия рака органов билиопанкреатодуоденальной зоны» (Москва, 20017 г). 3) Руководство по химиотерапии опухолевых заболеваний под ред. Н.И.Переводчиковой (Москва, 2018 г.). 4) Bethesda Handbook of Clinical Oncolology (James Abraham, James L.Gulley, Carmen J.Allegra, 2018). 5) Pocket Guide to Chemotherapy Protocols (Edward Chu, 2016). 6) Principles and Practice of Gastrointestinal Oncology (D.Kelsen et al., 2016). 7) Zu-Yoo Yag et al. Gemcitabine plus erlotinib for advanced pancreatic cancer: A systematic review with meta-analyses/ open access available on-line. march 2013. v8 e57528. 8) NCCN guidelines. Pancreatic Adenocarcinom. Version 2.2021 – February, 2021 https://www.nccn.org/professionals/physician_gls/pdf/pancreatic.pdf. 9) Yao JC, et al. Gastrointestinal Cancers Symposium; January 20‐22, 2017; San Francisco, CA. Abstract 159. 10) Golan T, Hammel P, Reni M, et al. Maintenance olaparib for germline BRCA-mutated metastatic pancreatic cancer. [article and supplementary appendix published online ahead of print]. June 2, 2019]. New Engl J Med. 2019. https://www.nejm.org/doi/full/10.1056/NEJMoa1903387. Accessed June 2, 2019. 11) Kindler HL, Hammel P, Reni M, et al. Olaparib as maintenance treatment following first-line platinum-based chemotherapy in patients with a germline BRCA mutation and metastatic pancreatic cancer: phase III POLO trial [presentation]. Presented at: American Society of Clinical Oncology (ASCO) Annual Meeting; May 31–June 4, 2019; Chicago, IL. 12) Huang Y, Cai X, Qiu M et al. Prediabetes and the risk of cancer: a meta-analysis. // Diabetologia. – 2014. – V. 57, N 11. – P. 2261-9. 13) Tempero M., Malafa M., Al-Hawary M. et al. NCCN Clinical practice guidelines in oncology. Pancreatic adenocarcinoma. V. 2.2016. / Published online https://www.nccn.org/professionals/physician_gls/f_guidelines.asp 14) Li JH, He R, Li YM et al. Endoscopic ultrasonography for tumor node staging and vascular invasion in pancreatic cancer: a meta-analysis. Dig Surg. – 2014. – V. 31, N 4-5. – P. 297-305 15) Daly M., Pilarski R., Berry M. et al. NCCN Clinical practice guidelines in oncology. Genetic/familial high-risk assessment: breast and ovarian. V. 2.2017 / Published online https://www.nccn.org/professionals/physician_gls/f_guidelines.asp 16) Патютко Ю.И., Кудашкин Н.Е., Котельников А.Г., Чистякова О.В. Тотальная панкреатэктомия при опухолевом поражении поджелудочной железы. // Хирургия. Журнал им. Н.И. Пирогова. – 2016. - №9 - С. 13-20 17) Базин И.С., Покатаев И.А., Попова А.С. и соавт. Место химиотерапии в лечении локализованного рака поджелудочной железы // Злокачественные опухоли. – 2016. – Т. 21, №4 (спецвыпуск 1). – С. 20-25. 18) Liao WC1, Chien KL, Lin YL et al. Adjuvant treatments for resected pancreatic adenocarcinoma: a systematic review and network meta-analysis. // Lancet Oncol. –2013. – V. 14, N 11. – P. 1095-103. 19) Valle JW, Palmer D, Jackson R, et al. Optimal duration and timing of adjuvant chemotherapy after definitive surgery for ductal adenocarcinoma of the pancreas: ongoing lessons from the ESPAC-3 study. J Clin Oncol. 2014 Feb 20;32(6):504-12 20) Neoptolemos J., Palmer D., Ghaneh P. et al. ESPAC-4: A multicenter, international, openlabel randomized controlled phase III trial of adjuvant combination chemotherapy of gemcitabine (GEM) and capecitabine (CAP) versus monotherapy gemcitabine in patients with resected pancreatic ductal adenocarcinoma. J Clin Oncol 34, 2016 (suppl; abstr LBA4006) 21) Покатаев И.А., Тюляндин С.А. Системная лекарственная терапия метастатического рака поджелудочной железы. – Современная онкология. – 2016. – №1. – С. 20-24. 22) Von Hoff D., Ervin T., Arena F. et al. Increased Survival in Pancreatic Cancer with nabPaclitaxel plus Gemcitabine. // N Engl J Med – 2013. V. 369. – P. 1691-703. 23) Fogelman D., Sugar E.A., Oliver G. et al. Family history as a marker of platinum sensitivity in pancreatic adenocarcinoma. // Cancer Chemother Pharmacol. – 2015. – V. 76, N 3. – P. 489- 98. 30 24) Callery MP, Chang KJ, Fishman EK, et al. Pretreatment assessment of resectable and borderline resectable pancreatic cancer: expert consensus statement. Ann Surg Oncol 2009;16:1727–1733. 25) Abrams RA, Lowy AM, O’Reilly EM, et al. Combined modality treatment of resectable and borderline resectable pancreas cancer: expert consensus statement. Ann Surg Oncol 2009;16:1751–1756. 26) Katz MH, Marsh R, Herman JM, et al. Borderline resectable pancreatic cancer: need for standardization and methods for optimal clinical trial design. Ann Surg Oncol 2013;20:2787–2795. 27) National Comprehensive Cancer Network. Pancreatic Adenocarcinoma, Version 2.2023. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). 28) https://www.annalsofoncology.org 29) Tol J.A. Gouma D.J. Bassi C. et al. Definition of a standard lymphadenectomy in surgery for pancreatic ductal adenocarcinoma: a consensus statement by the International Study Group on Pancreatic Surgery (ISGPS). Surgery. 2014; 156: 591-600. 30) Dasari, B. V. et al. Extended versus standard lymphadenectomy for pancreatic head cancer: meta- analysis of randomized controlled trials. J. Gastrointestinal Surg. 19, 1725–1732 (2015). 31) Benke M, Farkas N, Hegyi P, Tinusz B, Sarlós P, Erőss B, Szemes K, Vörhendi N, Szakács Z, Szücs Á. Preoperative Serum Carbohydrate Antigen 19-9 Levels Cannot Predict the Surgical Resectability of Pancreatic Cancer: A Meta-Analysis. Pathol Oncol Res. 2022 May 10;28:1610266. doi: 10.3389/pore.2022.1610266. PMID: 35645620; PMCID: PMC9136945. 32) De Pastena M, Marchegiani G, Paiella S, et al. Impact of preoperative biliary drainage on postoperative outcome after pancreaticoduodenectomy: an analysis of 1500 consecutive cases. Dig Endosc. 2018 Nov;30(6):777–784. 33) Verbeke, C. S. et al. Redefining the R1 resection in pancreatic cancer. Br. J. Surg. 93, 1232–1237 (2006). 34) Esposito, I. et al. Most pancreatic cancer resections are R1 resections. Ann. Surg. Oncol. 15, 1651–1660 (2008). 35) Campbell, F. et al. Classification of R1 resections for pancreatic cancer: the prognostic relevance of tumour involvement within 1 mm of a resection margin. Histopathology 55, 277–283 (2009).
Информация
Сокращения, используемые в протоколе:
|
CA 19
|
– карбогидратный антиген 19
|
| АФП |
– альфафетопротеин
|
| ВБА |
– верхнеебрыжеечная артерия
|
| ГПДР |
– гастропанкреатодуоденальная резекция
|
|
Гр
|
– Грей
|
| ГЭП |
– гастроэнтеропанкреатические опухоли
|
| ИГХ |
– иммуногистохимия
|
| МДГ |
– мультидисциплинарная группа
|
| МРТ |
– магнитно резонансная томография
|
|
НЭО
|
– нейроэндокринные опухоли
|
| ПБ |
– пункционная биопсия
|
| ПЖ |
– поджелудочная железа
|
| ПЦР |
– полимеразная цепная реакция
|
| ПЭТ |
– позитронно эмиссионная томография
|
|
РКТ
|
– рентгеновская компьютерная томография
|
| РОД |
– разовая очаговая доза
|
| РЭА |
– раковоэмбриональный антиген
|
| СОД |
– суммарно очаговая доза
|
| УЗИ |
– ультразвуковое исследование
|
|
ХЛТ
|
– химиолучевая терапия |
| ХТ | – химиотерапия |
| ЭРХПГ |
– эндоскопическая ретроградная холецисто панкреатография
|
|
BRCA 1/2
|
– ген рака молочной железы 1/2
|
| TNM |
– Tumor Nodulus Metastasis - международная классификация стадий злокачественных новообразований.
|
| ICD |
– международная классификация болезней
|
| IMRT |
– интенсивно-модулированная лучевая терапия
|
| IGRT |
– лучевая терапия, управляемая по изображениям
|
|
SRS
|
– стереотаксическая радиохирургия
|
| SRT |
– стереотаксическая радиотерапия
|
| 3D CRT |
– 3-х мерная конформная лучевая терапия
|
| GEM-CAP |
– схема химиотерапии
|
| GEMOX |
– схема химиотерапии
|
| GP |
– схема химиотерапии
|
| GTX |
– схема химиотерапии
|
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ВНЕДРЕНИЯ ПРОТОКОЛА
Список разработчиков протокола с указанием квалификационных данных:
1) Джуманов Абай Игликович – доктор PhD, Руководитель Центра абдоминальной онкологии АО «Казахский научно-исследовательский институт онкологии и радиологии». Онколог-хирург.
2) Абдрахманов Рамиль Зуфарович – заведующий круглосуточного химиотерапевтического отделения, Председатель химиотерапевтического совета АО «Казахский научно – исследовательский институт онкологии и радиологии». Онколог-химиотерапевт.
3) Ким Виктор Борисович – доктор медицинских наук, Руководитель Центра общей радиологии АО «КазНИИОиР», Председатель радиологического Совета. Онколог-радиолог.
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
Указание условий пересмотра протоколов: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
4) Дюсембаев Акжол Кабдоллаевич – врач онколог-хирург Центра абдоминальной онкологии АО «Казахский научно – исследовательский институт онкологии и радиологии».
5) Туркпенова Иннара Талгатовна – врач-химиотерапевт Центра абдоминальной онкологии АО «Казахский научно-исследовательский институт онкологии и радиологии». Онколог-химиотерапевт.
6) Макаров Валерий Анатольевич – заведующий хирургическим отделением «Алматинской Региональной Многопрофильной Клиники». Онколог-хирург. 7) Тулегенов Марат Асанбаевич заместитель руководителя по онкологии Областной больницы УЗ Туркестанской области. Онколог-хирург.
8) Рахманбердиева Эльвира Жайдаровна – врач, клинический фармаколог АО «Казахский научно – исследовательский институт онкологии и радиологии».
9) Спатаев Жанат Сейтбатталович – заведующий отделением гепатопанкреатобилиарной хирургии и трансплантации печени «Национальный научный онкологический центр». Транплантолог, гепатопанкреатобилиарный хирург, онколог, хирург общей практики, высшей квалификационной категории.
10) Баймаханов Болатбек Бимендеевич – доктор мед. наук, профессор, Академик НАН РК, председатель правления АО «Национальный Научный Центр Хирургии им. А.Н. Сызганова». Онколог-хирург.
11) Досханов Максат Оналбаевич – Phd, заведующий отделением гепатопанкреатобилиарной хирургии и трансплантации печени, АО «Национальный Научный Центр Хирургии им. А.Н. Сызганова». Онколог-хирург.
12) Тилеуов Серик Туребаевич – научный сотрудник отделения гепатопанкреатобилиарной хирургии и трансплантации печени, АО «Национальный Научный Центр Хирургии им. А.Н. Сызганова». Онколог-хирург.
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
1) Кузикеев Марат Анатольевич – д.м.н, заместитель директора по науке и инновационным технологиям «Многопрофильный медицинский центр» акимата города Астаны. Онколог-хирург.
2) Ижанов Ерген Бахчанович – доктор медицинских наук, онколог-хирург, ассистент кафедры онкологии КазНМУ им. Асфендиярова.
Указание условий пересмотра протоколов: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.