Предоперационное обследование и хирургическое лечение пациентов с фармакорезистентными формами эпилепсии
 Версия: Клинические протоколы 2020-2023 (Узбекистан)
Версия: Клинические протоколы 2020-2023 (Узбекистан)
Эпилепсия (G40), Эпилептический статус (G41)
Неврология, Неврология детская, Нейрохирургия
Общая информация
Краткое описание
Название документа
Национальный клинический протокол по предоперационному обследованию и хирургическому лечению пациентов с фармакорезистентными формами эпилепсии
Клиническая проблема: Нейрохирургия
Этапы оказания помощи
Данный протокол предназначен для учреждений первичного, вторичного и третичного уровней системы здравоохранения Узбекистана
Дата создания: 4.12.2020 год
Планируемая дата обновления: 2024 г.
ВВЕДЕНИЕ
В настоящее время в мире насчитывают более 65 миллионов больных эпилепсией. Заболеваемость эпилепсией в индустриально развитых странах составляет от 40 до 70 на 100000 населения в год, в развивающихся странах – от 35 до 190 на 100000.
Частота фармакорезистентной эпилепсии в развитых странах, придерживающихся современных стандартов лечения, достигает 30 - 40% от общего количества пациентов с эпилепсией. Потребность в хирургическом лечении пациентов с фармакорезистентной эпилепсией равна 0,3 – 1,26 на 100 000 населения в год. В Узбекистане хирургическое лечение по поводу фармакорезистентной эпилепсии необходимо проводить 200 пациентам в год.
У пациентов с фармакорезистентной эпилепсией имеются значительные ограничения в повседневной активности, получении образования, ежедневной работе и социализации, в связи с постоянными приступами и побочными эффектами противосудорожной терапии. У данных пациентов риск развития психологических проблем, таких как депрессия, тревога и психоз значительно выше, чем в популяции. У пациентов с постоянными приступами в несколько раз повышается риск летального исхода. Основными причинами неблагоприятных исходов у больных с эпилепсией являются случайные травмы, снижение когнитивных функций и риск «неожиданной, внезапной смерти у больного эпилепсией» (SUDEP).
Цель
Задачи:
Цель
Целью данного протокола является повышение качества медицинской помощи пациентам с фармакорезистентными формами эпилепсии путем применения методов пред хирургическую диагностику и хирургического лечения.
Задачи:
1. Обеспечение нормативной и методологической базы для своевременной качественной диагностики фармакорезистентных форм эпилепсии; 2. Разработать дифференцированный подход к выбору способов хирургического лечения больных с фармакорезистентными формами эпилепсии; 3. Улучшить результаты лечения больных с фармакорезистентными формами эпилепсии путем совершенствования диагностики и тактики лечения.
Целевая группа протокола: невропатологи (детские, взрослые), врачи общей практики, анестезиологи-реаниматологи, врачи скорой и неотложной помощи, психиатры (детские, взрослые), нейрохирурги (детские, взрослые), врачи-эксперты.
Фармакорезистентность - невозможность достичь контроля над приступами при использовании двух «адекватных» схем применения противосудорожных препаратов (в качестве монотерапии или в комбинации).
При неэффективности противосудорожных препаратов в качестве возможной ее причины всегда следует рассматривать «псевдорезистентность» - наличие постоянных приступов, возникших вследствие неподходящего или «неадекватного» лечения.
Основными причинами «псевдорезистентности» являются: неправильно установленный диагноз, использование неподходящего противосудорожного препарата или нарушение дозировки препарата. Согласно исследованиям, примерно у 25% пациентов с эпилепсией устанавливается неверный диагноз, одна треть из которых принимает противосудорожные препараты.
Категория пациентов: дети и взрослые страдающие с фармакорезистентными формами эпилепсии.
Целевая группа протокола: невропатологи (детские, взрослые), врачи общей практики, анестезиологи-реаниматологи, врачи скорой и неотложной помощи, психиатры (детские, взрослые), нейрохирурги (детские, взрослые), врачи-эксперты.
Определение:
Под термином Эпилепсия (ILAE, 2014) следует понимать заболевание головного мозга, соответствующее любому из следующих состояний:
1. Не менее двух неспровоцированных (или рефлекторных) эпилептических приступов с интервалом более 24 ч.
2. Один неспровоцированный (или рефлекторный) приступ и вероятность повторения приступов, близкая к общему риску рецидива (> 60 %) после двух спонтанных приступов, в последующие 10 лет
3. Диагноз эпилептического синдрома (наличие комплекса признаков и симптомов, определяющих особое эпилептическое состояние, которое, в свою очередь, включает в себя больше, чем просто типа приступа).
Под термином «эпилептический приступ» следует понимать преходящие клинические проявления патологической избыточной или синхронной нейронной активности головного мозга.
Фармакорезистентность - невозможность достичь контроля над приступами при использовании двух «адекватных» схем применения противосудорожных препаратов (в качестве монотерапии или в комбинации).
Критерии фармакорезистентности:
а). Сохранение приступов при использовании двух противосудорожных препаратов;
б). Один приступ в месяц в течение 18 месяцев наблюдения;
в). Отсутствие приступов не более чем три месяца в течение 18 месяцев наблюдения.
При неэффективности противосудорожных препаратов в качестве возможной ее причины всегда следует рассматривать «псевдорезистентность» - наличие постоянных приступов, возникших вследствие неподходящего или «неадекватного» лечения.
Основными причинами «псевдорезистентности» являются: неправильно установленный диагноз, использование неподходящего противосудорожного препарата или нарушение дозировки препарата. Согласно исследованиям, примерно у 25% пациентов с эпилепсией устанавливается неверный диагноз, одна треть из которых принимает противосудорожные препараты.
Первой причиной столь высокой распространенности установки неверного диагноза является отсутствие «золотого стандарта» или лабораторного теста для подтверждения эпилепсии. Диагноз эпилепсии полностью зависит от умелой интерпретации истории болезни пациента. В одном из исследований было выявлено, что 55% пациентов, получающих антиэпилептическую терапию, никогда не были на приеме у специалиста, занимающегося проблемами лечения эпилепсии (невропатолога, эпилептолога).
Согласно современным международным руководствам, пациенты всех возрастов после первого приступа должны быть осмотрены специалистом (неврологом или эпилептологом).
Другим фактором, влияющим на постановку неправильного диагноза, является чрезмерная зависимость клиницистов от данных ЭЭГ. Анализ данных ЭЭГ неспециалистами в эпилептологии может приводить к неправильной интерпретацией нормальных вариантам биоэлектрической активности головного мозга. В одном из исследований, до 54% пациентам c «мю-ритмом» (ритм частотой 7-11 Гц, состоящий из аркообразных волн, регистрируемых в центральных или центрально-теменных отделах головы в состоянии бодрствования - нормальный вариант биоэлектрической активности головного мозга) по данным ЭЭГ бы выставлен ошибочный диагноз «эпилепсия».
G40 Эпилепсия
G41 Эпилептический статус
КЛАССИФИКАЦИЯ ЭПИЛЕПСИИ ПО МКБ-10
G40 Эпилепсия
G40.0 Локализованная (фокальная) (парциальная) идиопатическая эпилепсия и эпилептические синдромы с судорожными припадками с фокальным началом.
G40.1 Локализованная (фокальная) (парциальная) симптоматическая эпилепсия и эпилептические синдромы с простыми парциальными припадками.
G40.2 Локализованная (фокальная) (парциальная) симптоматическая эпилепсия и эпилептические синдромы с комплексными парциальными судорожными припадками.
G40.3 Генерализованная идиопатическая эпилепсия и эпилептические синдромы.
G40.4 Другие виды генерализованной эпилепсии и эпилептических синдромов.
G40.5 Особые эпилептические синдромы.
G40.6 Припадки grand mal неуточненные (с малыми припадками [petitmal] или без них).
G40.7 Малые припадки [petitmal] неуточненные без припадков grand mal.
G40.8 Другие уточненные формы эпилепсии.
G40.9 Эпилепсия не уточненная.
G41 Эпилептический статус
G41.0 Эпилептический статус grand mal(судорожных припадков).
G41.1 Эпилептический статус petit mal (малых припадков).
G41.2 Сложный парциальный эпилептический статус.
G41.8 Другой уточненный эпилептический статус.
G41.9 Эпилептический статус неуточненный.
Классификация
Классификация эпилепсии
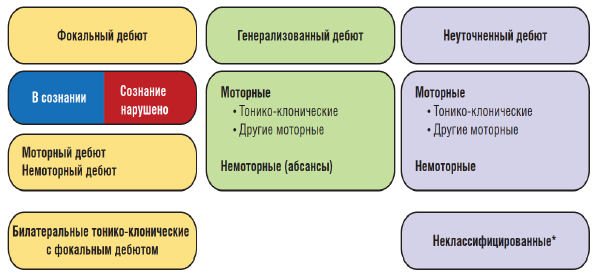
Рисунок 1. Базовая рабочая классификация типов приступов Международной Противоэпилептической Лиги 2017 г.
Примечание. * Вследствие недостатка информации или невозможности отнести к другим категориям.
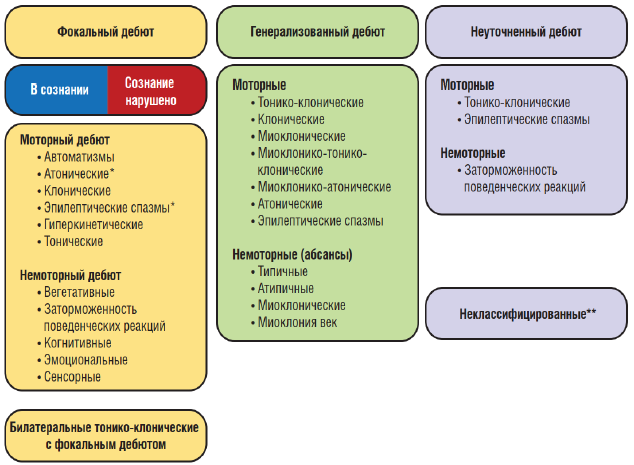
Рисунок 2. Расширенная рабочая классификация типов приступов Международной Противоэпилептической Лиги 2017 г.
Примечания. * Состояние сознания обычно не определяется; ** вследствие недостатка информации или невозможности отнести к другим категориям.
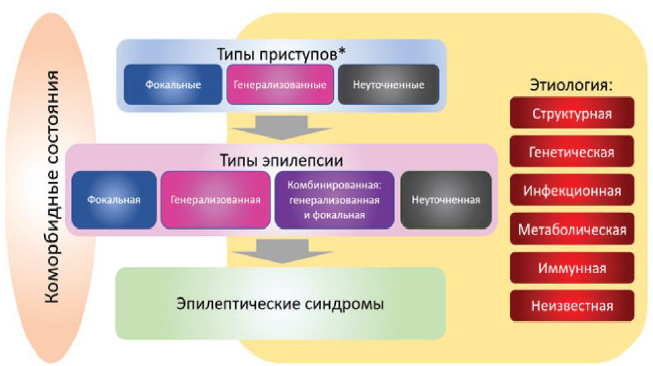
Рисунок 3.
Структура Классификации эпилепсии ILAE 2017 г.
Этиология и патогенез
Этиология эпилепсии.
В последние годы наблюдается значительное расширение в нашем понимании основных этиологии эпилепсии, опирающихся на достижения современной нейровизуализации и генетического тестирования. Такие термины, как «идиопатический», «криптогенный» и «симптоматический», больше не используются. Эпилепсии теперь описываются более точно по их специфической основной этиологии.
Наиболее важные генетические причины эпилепсии, которые могут быть идентифицированы при клиническом тестировании:
Существует много способов, которыми генетические факторы могут способствовать развитию эпилепсии. Определенные генетические факторы, возможно, не были унаследованы и не могут быть переданы потомству. Вот некоторые важные генетические концепции, используемые на этом веб-сайте, и их определения:
Генетическая этиология
Понятие генетической эпилепсии заключается в том, что эпилепсия, насколько мы понимаем, является прямым результатом известного или предполагаемого генетического дефекта (ов), в котором судороги являются основным симптомом расстройства. Генетический дефект может возникать на хромосомном или молекулярном уровне. Важно подчеркнуть, что «генетический» не означает то же, что «унаследовано», поскольку мутации de novo не являются редкостью. Наличие генетической этиологии не исключает экзогенного влияния на возникновение эпилепсии.
Наиболее важные генетические причины эпилепсии, которые могут быть идентифицированы при клиническом тестировании:
хромосомные аномалии;
аномалии гена.
Существует много способов, которыми генетические факторы могут способствовать развитию эпилепсии. Определенные генетические факторы, возможно, не были унаследованы и не могут быть переданы потомству. Вот некоторые важные генетические концепции, используемые на этом веб-сайте, и их определения:
унаследованные аномалии генов, аутосомно-доминантное, аутосомно-рецессивное и менделевское наследование;
приобретенные аномалии генов — de novo, спорадические, мозаицистические, зародышевые и соматические;
полигенная / комплексная генетическая этиология.
Общие структурные аномалии мозга, связанные с эпилепсией:
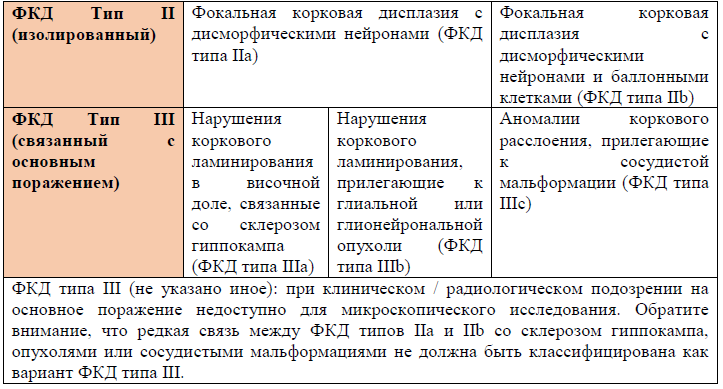
Таблица 1. Трехуровневая система классификации очаговой корковой дисплазии (ФКД) по ILAE (2011г.) различает изолированные формы (ФКД типы I и II) от форм, связанных с другим основным поражением (ФКД типа III).

2) сосудистые пороки развития:
3) гиппокампальный склероз;
4) гипоксически-ишемические:
5) травматическая повреждение мозга:
Согласно концепции H.O. Luders с соавт. (1993) в эпилептогенную зону входят область (области) коры, анатомически связанные друг с другом, которые совместно участвуют в генерации приступов одного типа [13]. Соответственно, у больного может быть не одна, а несколько эпилептогенных зон, может также существовать «потенциальная зона начала приступа» – зона, которая может участвовать в генерации приступа (рис.6).
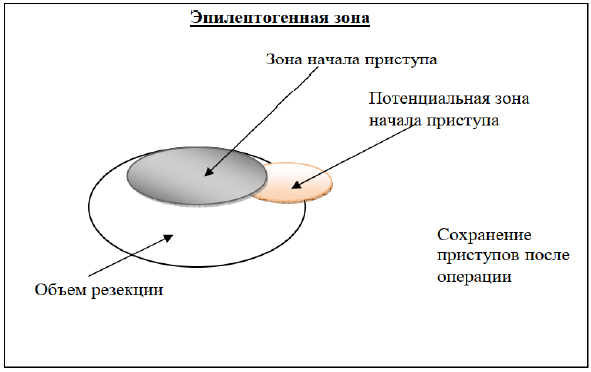 Рисунок 5. Диаграмма иллюстрирует объем хирургической резекции, который приведет к сохранению приступов после операции, в связи с неполной резекцией потенциальной зоны начала приступа.
Рисунок 5. Диаграмма иллюстрирует объем хирургической резекции, который приведет к сохранению приступов после операции, в связи с неполной резекцией потенциальной зоны начала приступа.
Данная концепция основана на патогенетической связи эпилептогенного поражения с генерацией приступов и основной целью хирургического вмешательства является удаление эпилептогенной зоны. Единственным методом оценки правильности выявленной эпилептогенной зоны является отсутствие приступов после проведенного хирургического вмешательства.
Структурная этиология
Структурные эпилепсии определяются как имеющие выраженную структурную аномалию мозга, которая связана с существенно повышенным риском эпилепсии. Структурная аномалия мозга может быть приобретена (например, вследствие инсульта, травмы или инфекции) или может быть генетического происхождения; однако, как мы это понимаем в настоящее время, структурная аномалия мозга представляет собой отдельное нарушение, расположенное между приобретенным или генетическим дефектом и эпилепсией.
Общие структурные аномалии мозга, связанные с эпилепсией:
1) пороки развития коры головного мозга:
-фокальная кортикальная дисплазия (ФКД)
Таблица 1. Трехуровневая система классификации очаговой корковой дисплазии (ФКД) по ILAE (2011г.) различает изолированные формы (ФКД типы I и II) от форм, связанных с другим основным поражением (ФКД типа III).


- туберозный склероз,
- лиссэнцефалия,
- подкорковая перевязочная гетеротопия,
- гетеротопия серого вещества,
- полимикрогирия,
- гемимегалэнцефалия,
- шизэнцефалия
- гамартома гипоталамуса
2) сосудистые пороки развития:
- ангиомы
- артериовенозные мальформации
- синдром Штурге-Вебера;
3) гиппокампальный склероз;
4) гипоксически-ишемические:
- инсульт (нарушение мозгового кровообращения)
- гипоксическо-ишемические повреждении;
5) травматическая повреждение мозга:
6) опухоли;
7) порэнцефалическая киста.
Метаболическая этиология
Метаболические эпилепсии определяются как имеющие определенное метаболическое нарушение, связанное с выраженным риском развития эпилепсии. Метаболические расстройства имеют генетическое происхождение; однако, как мы это понимаем в настоящее время, метаболические аномалии представляют собой отдельное нарушение, стоящее между генетическим дефектом и эпилепсией.
Важные метаболические эпилепсии:
дефицит биотинидазы и голокарбоксилазы-синтазы;
дефицит церебрального фолата;
нарушения креатина;
приступы при нарушении фолатного цикла;
недостаточность транспортера глюкозы 1 (GLUT1);
митохондриальные расстройства;
пероксисомальные расстройства;
Иммунная этиология
пиридоксинзависимая эпилепсия.
Иммунная этиология
Иммунные эпилепсии определены как имеющие выраженную иммунную опосредованную этиологию с подтверждением воспаления центральной нервной системы, что, как было показано, связано с существенно повышенным риском развития эпилепсии.
Важные иммуноопосредованные эпилепсии:
Синдром Расмуссена;
Антителоопосредованная эпилепсия.
Инфекционная этиология
Наиболее распространенная этиология эпилепсии во всем мире является инфекционной, особенно в развивающихся странах. Инфекции в центральной нервной системе могут вызывать как острые симптоматические припадки (которые тесно связаны со сроками первичной инфекции), так и эпилепсией. Инфекционная этиология включает туберкулез, ВИЧ, церебральную малярию, нейроцистицеркоз, подострый склерозирующий панэнцефалит, церебральный токсоплазмоз. Эти инфекции иногда имеют структурный коррелят, однако основная причина эпилепсии определяется как инфекционный процесс. Инфекционная этиология может иметь специфические последствия лечения. Существуют также последствия для общественного здравоохранения, поскольку профилактика таких инфекций может снизить нагрузку на эпилепсию, особенно в развивающихся странах. Наиболее распространенные из таких инфекций следующие:
бактериальный менингит или менингоэнцефалит;
церебральная малярия;
церебральный токсоплазмоз;
цитомегаловирусная инфекция;
ВИЧ;
нейроцистицеркоз;
туберкулез;
вирусный энцефалит;
подострый склерозирующий панэнцефалит;
прочие инфекции (токсокариоз, шистосомоз, болезнь Лайма (нейроборрелиоз).
Неизвестная этиология
«Неизвестная» этиология должна рассматриваться нейтрально и обозначать, что природа основной причины возникновения эпилепсии пока неизвестна; это может быть фундаментальный генетический дефект или отдельное, пока еще установленное, нарушение.
Понятие об эпилептогенной зоне.
Эпилептогенная зона является теоретическим понятием и представления о ее локализации и границах формируются на основе анализа клинической картины приступа (симптоматогенная зона), нейрофизиологического (зона начала приступа и ирритативная зона) и нейровизуализационного исследований (эпилептогенное поражение), неврологического, нейропсихологического и радиологического исследований (зона функционального дефицита).
Эпилептогенная зона включает в себя не только область, генерирующую приступы, но и потенциально возможные эпилептогенные области, без резекции которых могут сохраняться приступы.
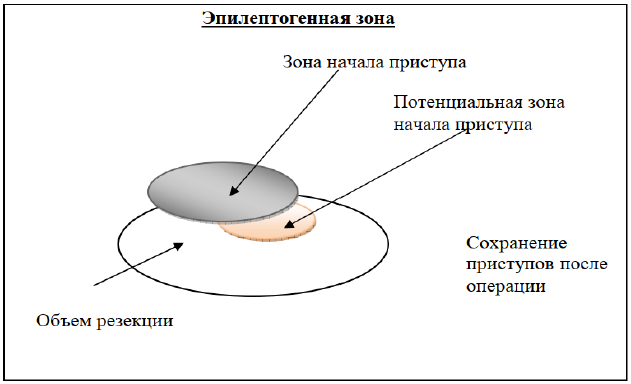

Рисунок 4. Диаграмма иллюстрирует объем хирургической резекции, который приведет к сохранению приступов после операции, в связи с неполной резекцией зоны начала приступа.
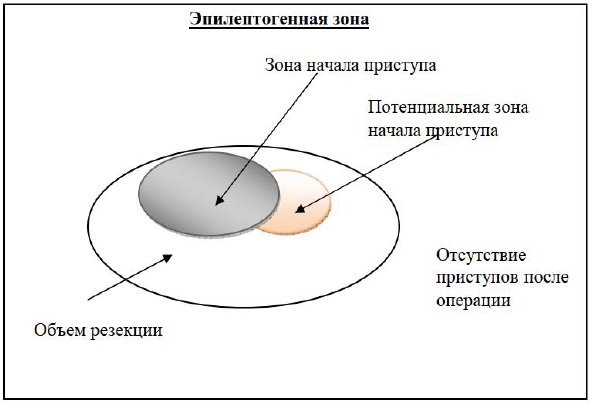
Согласно концепции H.O. Luders с соавт. (1993) в эпилептогенную зону входят область (области) коры, анатомически связанные друг с другом, которые совместно участвуют в генерации приступов одного типа [13]. Соответственно, у больного может быть не одна, а несколько эпилептогенных зон, может также существовать «потенциальная зона начала приступа» – зона, которая может участвовать в генерации приступа (рис.6).


Рисунок 6. Диаграмма показывает фактическую зону начала приступа, потенциальную зону начала приступа и требуемый объем хирургической резекции, включающей в себя обе зоны. Тотальная резекция обеих зон должна привести к отсутствию приступов после операции.
Данная концепция основана на патогенетической связи эпилептогенного поражения с генерацией приступов и основной целью хирургического вмешательства является удаление эпилептогенной зоны. Единственным методом оценки правильности выявленной эпилептогенной зоны является отсутствие приступов после проведенного хирургического вмешательства.
Симптоматогенная зона.
Симтоматогенная зона – область мозга, при раздражении или активации которой пароксизмальным разрядом происходит развитие клинических симптомов.
Часто клиническую картину приступа определяет именно распространение разряда на определенные области, поэтому симптоматогенная зона не всегда располагается в пределах эпилептогенной зоны, но часто близко от нее.
Попытаться локализовать эпилептогенную зону возможно на основе тщательного анализа клинической симптоматики, с изучения истории развития приступов и видео-ЭЭГ мониторинга. Однако лучшим способом определения симтоматогенной зоны является электростимуляция, которая позволяет активировать кору головного мозга по типу эпилептиформного разряда.
Зона начала приступа.
Зона начала приступа - область коры, инициирующая приступ. Для выявления этой области применяют ЭЭГ мониторинг (неинвазивный и инвазивный), магнитоэнцефалографию (МЭГ), функциональную МРТ (фМРТ), иктальную однофотонную эмиссионную компьютерную томографию (ОФЭКТ), которая наиболее информативна в варианте иктальной-межиктальной субтракционной ОФЭКТ в сопоставлении с МРТ.
Зона функционального дефицита.
Ирритативная зона.
Ирритативная зона - область генерации интериктальной (межприступной) эпилептической активности. Ведущим методом диагностики является нейрофизиологический. Регистрация скальповой ЭЭГ не отражает реального распространения ирритативной зоны, ее границы более точно могут быть определены при помощи инвазивных исследований с использованием корковых и внутримозговых электродов, интраоперационной электрокортикографии (ЭкоГ), а также МЭГ.
Зона функционального дефицита.
Зона функционального дефицита - область коры головного мозга, проявляющаяся нарушениями в интериктальном периоде. Эта дисфункция может быть прямым или функционально опосредованным следствием воздействия эпилептогенного поражения головного мозга.
Для выявления зоны функционального дефицита применяют следующие методы обследования: подробный неврологический осмотр, нейропсихологическое исследование, позитронно-эмиссионная томография (ПЭТ), интериктальная ОФЭКТ, тест Wada (интракаротидное введение пропофола), позволяющий определить речевую доминантность полушария. Выявление после приступа транзиторной пирамидной симптоматики или вербального дефицита имеет большое значение для латерализации зоны начала приступа.
Клиническая картина
Cимптомы, течение
Клинические проявления эпилепсии.
Таблица 3. Термины, использующиеся в обновленной Рабочей классификации типов приступов ILAE 2017 г.
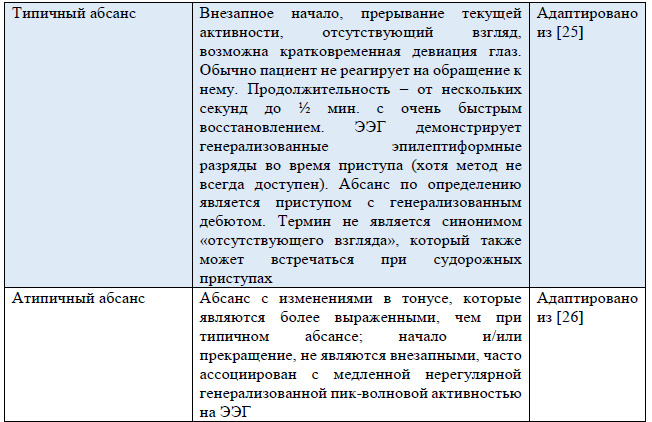
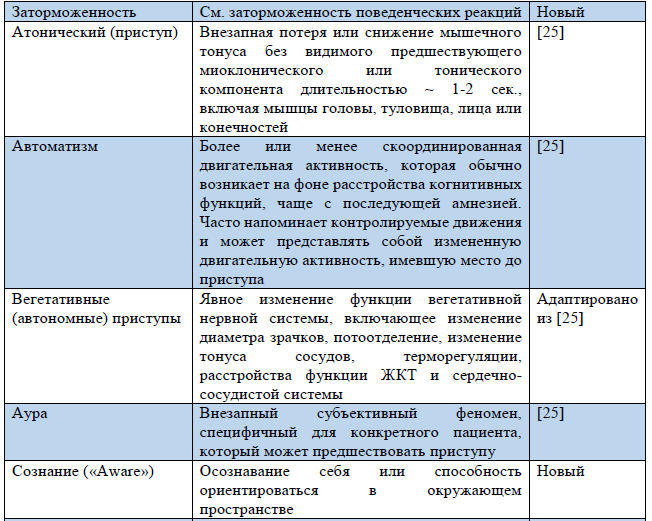
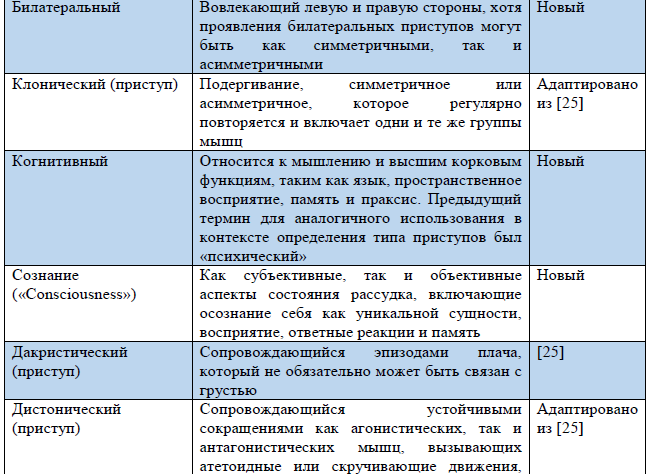
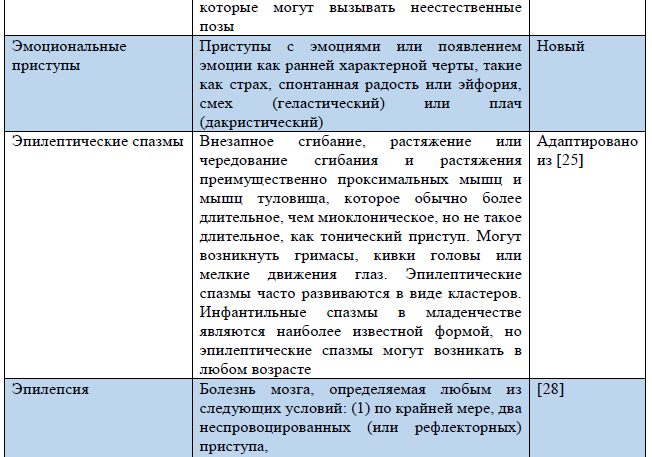
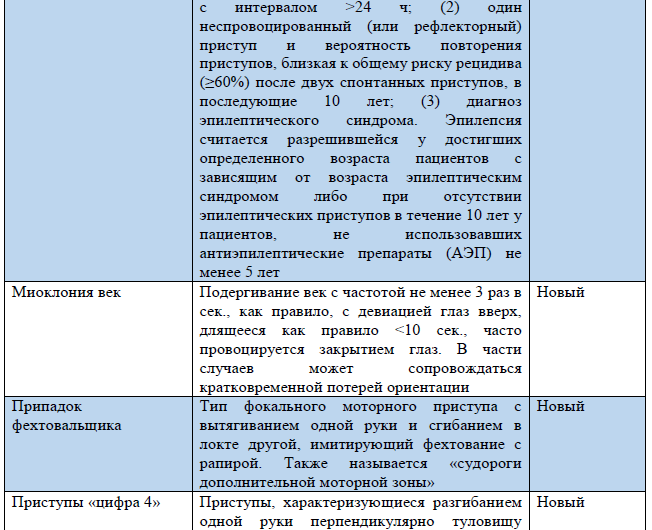
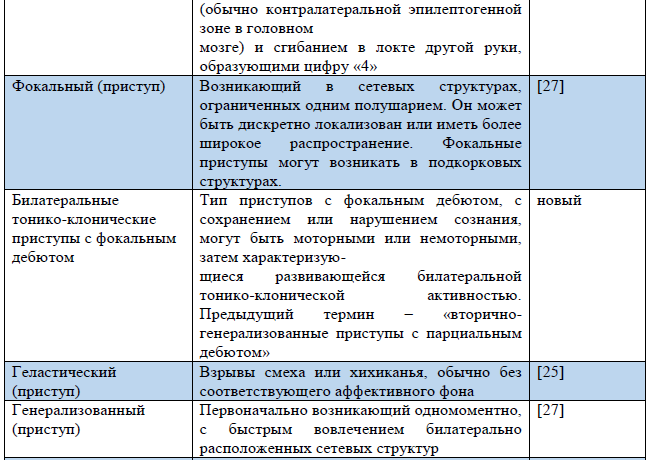
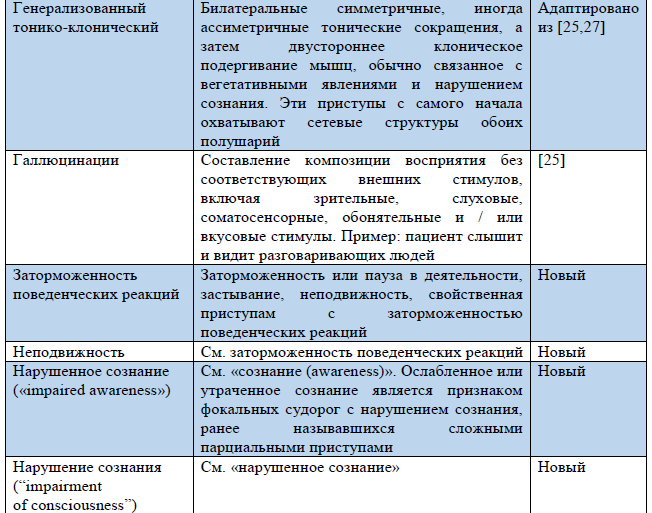
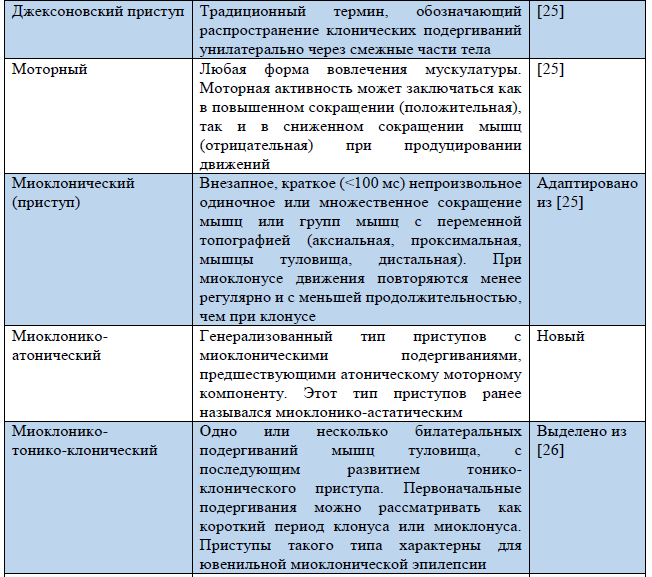
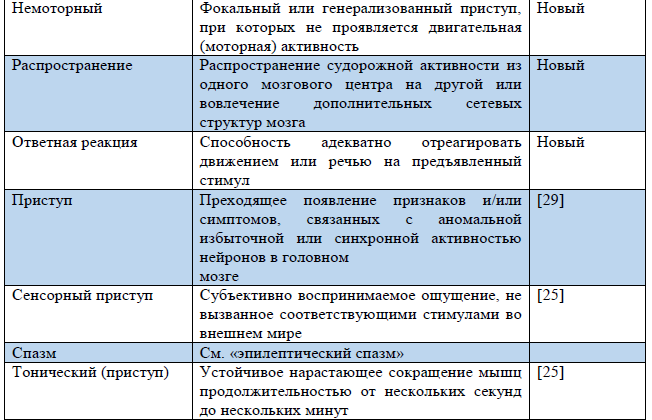
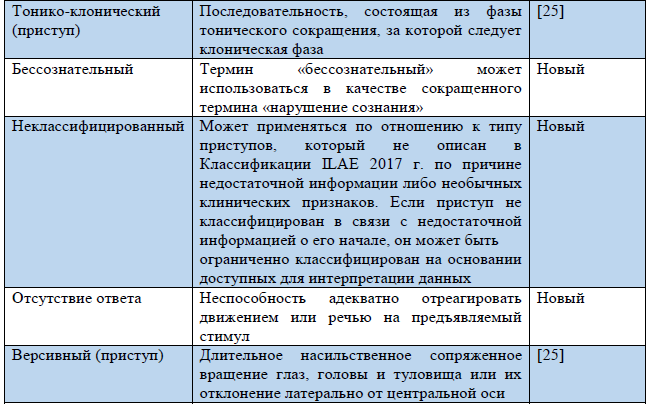
Примечание. «Новый» – новый термин, разработанный в ходе создания Рабочей классификации типов приступов ILAE 2017 г.
Диагностика
ОСНОВНЫЕ И ДОПОЛНИТЕЛЬНЫЕ МЕТОДЫ ДИАГНОСТИКИ ФАРМАКОРЕЗИСТЕНТНОЙ ФОРМЫ ЭПИЛЕПСИИ
Объем медицинской помощи на амбулаторном этапе: проводится врачами неврологами любых доступных для пациента стационаров, это РМО, ГМО, ОММЦ, РСНПМЦН, а также, при недоступности вышеперечисленных, возможно врачами неврологами и врачами общей практики СВП и семейных поликлиник.
Предоперационное обследование.
Диагностика эпилепсии
Предоперационное обследование.
Основной целью обследования пациентов с фармакорезистентной эпилепсией для решения вопроса о необходимости хирургического лечения и его объема является определение эпилептогенной зоны – области головного мозга, которая служит источником эпилептической активности и представляет активную или потенциальную зону генерации приступов.
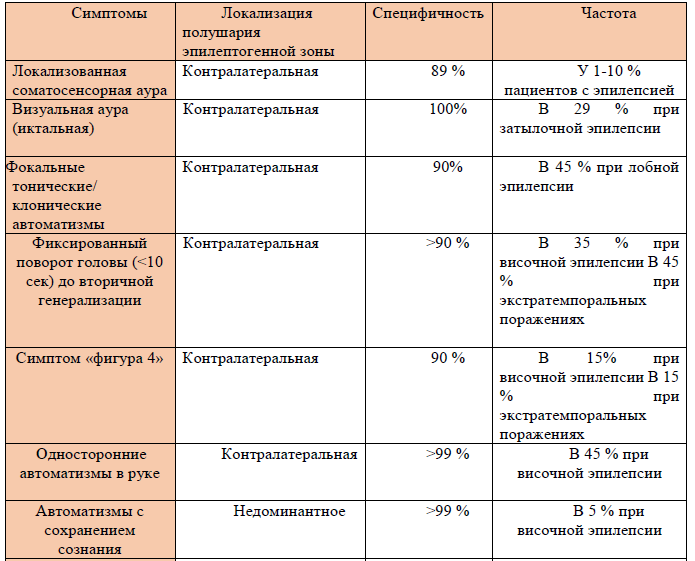
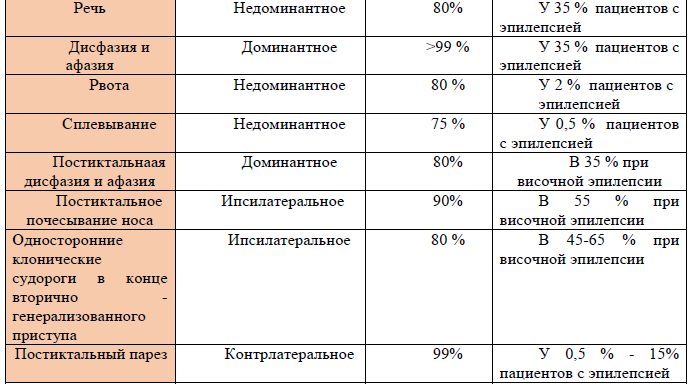
Таблица 2. Латерализация иктальных и постиктальных симптомов.
2. Нейрофизиологические методы обследований
2.1 Скальповый видео-ЭЭГ мониторинг (стандарт)
Данный метод позволяет дифференцировать эпилептические приступы от неэпилептических судорог, классифицировать приступы, и локализовать зону начала приступа. Неэпилептические судороги - непроизвольные движения, ощущения или поведение, напоминающее судорожные эпилептические приступы, причиной которых является не нарушение нейронной активности головного мозга. Они могут имитировать любой вид эпилептического приступа, данные приступы ошибочно принимаются за генерализованные тонико-клонические, абсансные, простые или сложно-парциальные приступы.
К недостаткам скальпового видео-ЭЭГ мониторинга относят:
1. Клиническое исследование семиологии приступов (стандарт)
Основными целями клинической оценки семиологии приступов являются: получение достоверной информации о симптоматике приступов, выявление вероятной этиологии приступов, оценка «адекватности» противосудорожной терапии и воздействия приступов на качество жизни. Подробный опрос о наличие различных факторов риска эпилепсии, таких как перинатальная травма, фебрильные судороги, менингоэнцефалит и черепно-мозговая травма, может дать ценную информацию о возможной этиологии эпилепсии.
Подробное изучение клиники и семиологии приступа позволяет заподозрить локализацию симптоматогенной зоны.
Таблица 2. Латерализация иктальных и постиктальных симптомов.


2. Нейрофизиологические методы обследований
2.1 Скальповый видео-ЭЭГ мониторинг (стандарт)
Круглосуточный скальповый видео-ЭЭГ мониторинг иктального и интериктального периодов - является одним из более важных методов обследования пациентов с фармакорезистентной эпилепсией.
Всем пациентам необходимо проводить длительный видео ЭЭГ мониторинг с использованием 21 электрода, установленных по международной схеме отведений 10-20% с использованием провоцирующих проб: ритмическая фотостимуляция, гипервентиляция, запись после депривации сна.
Данный метод позволяет дифференцировать эпилептические приступы от неэпилептических судорог, классифицировать приступы, и локализовать зону начала приступа. Неэпилептические судороги - непроизвольные движения, ощущения или поведение, напоминающее судорожные эпилептические приступы, причиной которых является не нарушение нейронной активности головного мозга. Они могут имитировать любой вид эпилептического приступа, данные приступы ошибочно принимаются за генерализованные тонико-клонические, абсансные, простые или сложно-парциальные приступы.
К недостаткам скальпового видео-ЭЭГ мониторинга относят:
1. Для регистрации пароксизмальной активности объем коры головного мозга, участвующий в активности должен составлять не менее 10-20 см2, поэтому у 15-25% пациентов с фармакорезистентной эпилепсией по данным скальпового видео ЭЭГ мониторинга невозможно точно локализовать зону начала приступа и ирритативную зону;
2. У 20-30% пациентов с височной эпилепсией, а также у пациентов с лобной и затылочными формами эпилепсии могут регистрироваться двухсторонние или контралатеральные интериктальные и иктальные пароксизмальные разряды, что может затруднять локализацию и латерализацию зоны начала приступа.
2.2 Инвазивный видео ЭЭГ мониторинг (стандарт)
Если в ходе неинвазивных исследований получены недостаточные или противоречивые данные о латерализации и локализации эпилептогенной зоны, пациентам показано применение инвазивного видео ЭЭГ мониторинга. Для проведения инвазивного видео ЭЭГ мониторинга используют внутримозговые и субдуральные электроды.
Для регистрации биоэлектрической активности с коры головного мозга используют 4-х, 6-и и 8-и контактные «стрипы» (полоски), для записи с большей поверхности коры, а также при экстратемпоральных поражениях и МР-негативных формах используют 4х4, 4х6, 4х8 контактные «гриды» электроды. Субдуральные «стрипы» электроды устанавливают через трефинационные («bur hole») отверстия, для установки «гридов» выполняют костно-пластическую трепанацию. Для записи с глубинных отделов головного мозга (в проекции предполагаемого эпилептогенного очага) и гиппокампов использую внутримозговые (глубинные) 4-х, 6-и и 8-и контактные электроды. Глубинные электроды (для записи с глубинных отделов головного мозга и гиппокампов) устанавливают с использованием стереотаксической рамной или безрамной навигационных установок мининвазивно через трефинационные («bur hole») отверстия.
Инвазивный видео ЭЭГ мониторинг с использованием внутричерепных электродов (внутримозговых и субдуральных) позволяет выявить зону начала приступа и ирритативную зону.
3.1 МРТ головного мозга (стандарт)
Признаками, типичными для фокальной кортикальной дисплазии (ФКД) являются:
3. Нейровизуализационные методы обследований
3.1 МРТ головного мозга (стандарт)
МРТ головного мозга с базовыми импульсными последовательностями позволяет выявить эпилептогенные поражения не более чем в 50% случаев, прежде всего, из-за стандартной толщины среза при выполнении МРТ головного мозга 3-4мм, не позволяющей визуализировать мелкие очаговые изменения белого вещества и четко оценить границу серого и белого вещества. Оптимальная толщина среза при МРТ головного мозга для пациента с эпилепсией должна составлять 2мм и менее. Помимо базового набора импульсных последовательностей FSE T2, SE T1, FLAIR, DWI или их аналогов, толщиной среза 2мм, при исследовании пациента с эпилепсией используются дополнительные программы, например, 3D FSPGR толщиной среза 0.6 мм с возможностью постпроцессорной реконструкции MIP в любой плоскости, что позволяет максимально адекватно визуализировать гиппокамп и медиобазальные отделы височных долей, независимо от нарушения укладки пациента и провести необходимые измерения.
Для диагностики фокальной кортикальной дисплазии, склероза гиппокампа, геторотопий необходимо оценивать дифференциацию серого и белого вещества, форму и строение извилин. Для этого применяются импульсные последовательности с высоким разрешением и минимальной толщиной среза (3D FSPGR IR толщиной среза 0.6-1мм).
Признаками, типичными для фокальной кортикальной дисплазии (ФКД) являются:
• усиление сигнала от серого вещества в режимах Т2 и Т2 FLAIR (устранение сигнала от свободной жидкости);
• усиление сигнала от белого вещества в субкортикальной зоне в режимах Т2 и Т2 FLAIR;
• отсутствие четкой границы между серым и белым веществом в режимах Т2 и Т2 FLAIR;
• уменьшение интенсивности сигнала от белого вещества в режимах Т1 и Т1 «инверсия-восстановление»;
• утолщение коры клиновидной формы с вершиной, направленной в сторону перивентрикулярной зоны;
• изменения толщины коры;
• аномальное строение извилин;
• гипоплазия извилин и части височной доли.
С целью оценки проводящих путей и строения трактов (верхне-продольного пучка, нижне-продольного пучка, пирамидного тракта, верхне – и нижне-затылочно-лобных пучков, крючковидного пучка) головного мозга и их взаимоотношения предполагаемыми эпилептогенными очагами применяется диффузионно-тензорная МРТ (DTI), т.н. МР-трактография (опция). В последующем, данные МР трактографии используются для создания виртуальной модели проводящих путей головного мозга при планировании хирургического вмешательства с применением безрамной навигационной системы. Применение во время операции данных МР трактографии для визуализации зрительного тракта при помощи навигационной установки позволяет снизить объем выпадения полей зрения и ее частоту в 2 раза, после проведения антеромедиальных височных лобэктомий . Воксель-базированная морфометрия (оценка фракционной анизотропии, коэффициента диффузии, концентрации серого вещества) позволяет выявлять изменения серого и белого вещества головного мозга при эпилепсии (особенно при МР-негативных формах).
Склероз гиппокампа характеризуется наличием следующих признаков:
• Усиление сигнала от структуры в режимах Т2 и Т2 FLAIR;
• Уменьшение размеров структуры в режиме Т1 и Т1 «инверсия-восстановление» более чем на 30%;
• При протонной магниторезонансной спектроскопии – уменьшение отношения N ацетил аспартата (нейрональный маркер) к холину (маркер целостности клеточных мембран) и креатину (маркер энергетического обмена).
С целью оценки проводящих путей и строения трактов (верхне-продольного пучка, нижне-продольного пучка, пирамидного тракта, верхне – и нижне-затылочно-лобных пучков, крючковидного пучка) головного мозга и их взаимоотношения предполагаемыми эпилептогенными очагами применяется диффузионно-тензорная МРТ (DTI), т.н. МР-трактография (опция). В последующем, данные МР трактографии используются для создания виртуальной модели проводящих путей головного мозга при планировании хирургического вмешательства с применением безрамной навигационной системы. Применение во время операции данных МР трактографии для визуализации зрительного тракта при помощи навигационной установки позволяет снизить объем выпадения полей зрения и ее частоту в 2 раза, после проведения антеромедиальных височных лобэктомий . Воксель-базированная морфометрия (оценка фракционной анизотропии, коэффициента диффузии, концентрации серого вещества) позволяет выявлять изменения серого и белого вещества головного мозга при эпилепсии (особенно при МР-негативных формах).
Широкое применение при эпилепсии нашла функциональная МРТ, прежде всего, МР-трактография и МР-спектроскопия дополнительный метод исследования.
С помощью МР-спектроскопии не инвазивно оценивают параметры метаболизма предполагаемых эпилептогенных очагах (рекомендация) Особенно широко МР спектроскопию применяют для подтверждения склероза гиппокампа, для которого характерно уменьшение отношения N-ацетил аспартата (Naa) (нейрональный маркер) к холину (Cho) (маркер целостности клеточных мембран) и креатину (Cr) (маркер энергетического обмена), оценивают соотношении Naa/Cr, Cho/Cr, Naa/Cho. У здоровых лиц соотношение Naa/Cr составляет 1,45±0,17, Cho/Cr - 0.60 ± 0.27, Naa/Cho - 1.00 ± 0.23.
В клинической практике применяют функциональное картирование коры головного мозга – EPI BOLD, с помощью которой, на основании изменения оксигенации крови, можно четко локализовать функционально активные центры коры головного мозга в ответ на внешнюю стимуляцию.
Полный набор перечисленных программ чаще всего используется на МР томографах напряженностью поля 3 Тесла.
3.2 Интериктальная и иктальная позитронная эмиссионная томография (опция)
(ПЭТ) с 18-фтордезоксиглюкозой и ОФЭКТ (SPECT, SISCOM) (Дополнительные методы обследования).
Иктальная и интериктальная ОФЭКТ и ПЭТ с 18-фтордезоксиглюкозой могут применяться как дополнительный метод диагностики для локализации эпилептогенного очага при: недостаточности данных неинвазивных методов обследования, МР негативных формах эпилепсии, мультифокальных или диффузных поражениях головного мозга по данным МРТ (опция).
При ПЭТ в межприступном периоде предполагаемая эпилептогенная зона характеризуется гипометаболизмом глюкозы, в иктальном периоде – гиперметаболизмом глюкозы. Чувствительность ПЭТ у пациентов с височной эпилепсией составляет – 70-85%, у пациентов при экстратемпоральных поражениях- 30-60%.
Иктальное ОФЭКТ позволяет оценить иктальный церебральный кровоток, характеризующийся зоной гиперперфузии в области предполагаемого эпилептогенного очага. SPECT – субтракционное вычитание интериктального ОФЭКТ из иктального ОФЭКТ позволяет точно выявлять зону гиперперфузии головного мозга. Для сопоставления с анатомическими структурами картину SPECT комбинируют с данными МРТ – SISCOM. Чувствительность метода у пациентов с височной эпилепсией составляет - 70–90%, у пациентов при экстратемпоральных поражениях - около 60%.
Полученные результаты неинвазивных методов диагностики должны быть оценены и проанализированы специалистами (неврологом, эпилептологом, нейрохирургом, нейрофизиологом, нейропсихологом, патоморфологом, нейрорадиологом). Для решения вопроса о выполнении хирургического лечения или проведении инвазивного видео-ЭЭГ мониторинга для уточнения локализации эпилептогенной зоны и зоны начала приступа.
4. Нейропсихологическое исследование (стандарт)
Нейропсихологическое исследование является неотъемлемой частью предоперационного обследования пациентов с эпилепсией (стандарт). Предоперационная нейропсихологическая оценка позволяет получить дополнительную информацию о латерализации и локализации эпилептогенного очага, оценить когнитивный и эмоциональный статус пациента. Оценка когнитивного статуса включает в себя исследование различных видов праксиса, зрительного и слухового гнозиса, мнестической деятельности, речи и зрительно-пространственных функций. Исследование эмоционального статуса необходимо для оценки общих личностных особенностей, а также актуального состояния – в частности, наличия и, при необходимости, глубины тревожных и депрессивных переживаний. С помощью данных комплексного обследования становится возможным понимание стойкости и выраженности различных нарушений, механизмов их компенсации, а также рисков и перспектив хирургического вмешательства относительно влияния на данные нарушения.
Полученные результаты неинвазивных методов диагностики должны быть оценены и проанализированы специалистами (неврологом, эпилептологом, нейрохирургом, нейрофизиологом, нейропсихологом, патоморфологом, нейрорадиологом). Для решения вопроса о выполнении хирургического лечения или проведении инвазивного видео-ЭЭГ мониторинга для уточнения локализации эпилептогенной зоны и зоны начала приступа.
Для установления характера припадка, помимо клинико-неврологического, нейрофизиологического и инструментального исследования, больные нуждаются в следующих исследованиях.
1. Детальный сбор анамнеза (лучше по данным медицинской документации) – наличие родовой травмы или другой тяжелой патологии ЦНС в раннем детстве, эпилептических стигм в детском возрасте, потери сознания и состояния суженного сознания в анамнезе, семейный анамнез.
2. Серологическое обследование крови и ликвора на сифилис и вирусы, в том числе ВИЧ, позволит подтвердить или исключить инфекционную патологию ЦНС, провести адекватное лечение.
3. Лабораторное обследование, которое должно обязательно включать следующие показатели:
-анализ крови (гемоглобин, гематокрит, лейкоцитарная формула, количество тромбоцитов, -свертываемость крови);
-анализ мочи (белок, глюкоза, микроскопия, кетоны, примеси крови);
-биохимию (электролиты, белок, мочевина, иммуноглобулины, кальций, трансаминазы, щелочная фосфатаза, билирубин, мочевина, глюкоза, креатинин, амилаза, церулоплазмин, молочная кислота);
-генетическое исследование (кариотипирование, анализ ДНК и др.).
4. Ультразвуковое транскраниальное доплерографическое исследование (УЗДГ). Оно позволяет дифференцировать некоторые пароксизмальные состояния, а также служит скрининговой методикой для диагностики патологии сосудистого русла – стенозов, мальформации и т. п. УЗДГ должно проводиться в каротидном и базилярном бассейнах с адекватными функциональными нагрузками.
5. Длительный мониторинг АД, возможна замена мониторинга регулярным измерением АД через равные интервалы с обязательным замером в момент клинического ухудшения, однако информированность такого измерения существенно ниже, чем мониторинга.
6. ЭКГ-мониторинг при подозрении на кардиогенные пароксизмы. Необходимо помнить, что рутинное ЭКГ не способно заменить ЭКГ-мониторинг.
7. Проведение отоневрологического обследования помогает при диагностике целого ряда неэпилептических приступов.
8. Углубленное эндокринологическое обследование при наличии показаний. Патологии инсулярного аппарата, щитовидной железы, надпочечников, гипофиза приводят к развитию пароксизмальных состояний, которые следует дифференцировать с эпилептическими.
При установлении эпилептического характера припадка необходимо, по возможности:
Проведение выше рекомендованного стандартного алгоритма исследований, безусловно, только в сочетании с клинической картиной позволит дифференцировать эпилептический припадок от неэпилептического.
При установлении эпилептического характера припадка необходимо, по возможности:
-установить причину припадка;
-установить тип эпилептического припадка;
-решить вопрос о лечении, в том числе о назначении АЭП;
-выбрать АЭП.
Если у больного известна этиология эпилепсии, она должна быть устранена (если это возможно) хирургическим или терапевтическим путем, такое лечение проводится даже при эффективности АЭП. Поиск этиологии эпилепсии не должен прекращаться после начала лечения АЭП даже в случае его успешности. Иными словами, важно лечение основного заболевания.
Развитие лишь одного эпилептического припадка требует осуществления описанного диагностического стандарта и дифференцированного подхода к началу лечения АЭП.
Начало лечения лиц с эпилепсией возможно лишь, когда есть уверенность в том, что припадки эпилептические. Наличие у больных двух и более эпилептических припадков требует лечения АЭП.
Если у больного известна этиология эпилепсии, она должна быть устранена (если это возможно) хирургическим или терапевтическим путем, такое лечение проводится даже при эффективности АЭП. Поиск этиологии эпилепсии не должен прекращаться после начала лечения АЭП даже в случае его успешности. Иными словами, важно лечение основного заболевания.
Развитие лишь одного эпилептического припадка требует осуществления описанного диагностического стандарта и дифференцированного подхода к началу лечения АЭП.
5. Показания для консультации узких специалистов:
консультация офтальмолога – для исключения поражения органа зрения;
консультация офтальмолога – для исключения поражения органа зрения;
консультация невропатолога
консультация эндокринолога – при нарушении функции щитовидной железы или наличия других эндокринологических заболеваний;
консультация гастроэнтеролога – для мониторинга побочного действия АЭП;
консультация психиатра – при сопутствующих психических нарушениях;
консультация кардиолога – для исключения сердечно – сосудистых заболеваний;
консультация дефектолога – при наличии ментального дефицита.
консультация эндокринолога – при нарушении функции щитовидной железы или наличия других эндокринологических заболеваний;
консультация гастроэнтеролога – для мониторинга побочного действия АЭП;
консультация психиатра – при сопутствующих психических нарушениях;
консультация кардиолога – для исключения сердечно – сосудистых заболеваний;
консультация дефектолога – при наличии ментального дефицита.
Лечение
ЛЕЧЕБНЫЕ МЕРОПРИЯТИЯ И ОРГАНИЗАЦИИ МЕДИЦИНСКОЙ ПОМОЩИ ПРИ ФАРМАКОРЕЗИСТЕНТНОЙ ФОРМЫ ЭПИЛЕПСИИ
Лечение эпилепсии можно подразделять на медикаментозное с применением АЭП, немедикаментозное (кетогенная диета).
1. Медикаментозное лечение
Ситуации, не требующие назначения антиконвульсантов после первого эпилептического припадка:
- детский возраст;
- неосложненная беременность;
- отсутствие факторов риска развития эпилепсии;
- острый симптоматический припадок;
- припадок, спровоцированный длительной депривацией сна.
Ситуации, требующие обязательного назначения антиконвульсантов после первого эпилептического припадка:
- дебют с эпилептического статуса;
- уверенность в дебюте идиопатической генерализованной эпилепсии;
- доказанное наличие эпилептических приступов в анамнезе;
- наличие актуальной неврологической патологии, вызывающей припадок.
Если принято решение начинать лечение АЭП, то выбор должен осуществляться с учетом следующих клинико-социальных особенностей:
Назначение антиконвульсантов целесообразно после развития первого припадка при сочетании двух и более признаков:
- однозначные эпилептические изменения на ЭЭГ;
- родовая травма;
- данные о тяжелой органической патологии ЦНС в раннем детстве;
- эпилептические стигмы в детском и подростковом возрасте, отягощающие семейный анамнез по эпилепсии;
- тяжелый характер припадков, развитие которых угрожает жизни или здоровью больного;
- эпилептические изменения личности;
- наличие в анамнезе периодов или состояний, которые можно рассматривать как их психические эквиваленты;
- недопустимость развития повторного припадка.
Если принято решение начинать лечение АЭП, то выбор должен осуществляться с учетом следующих клинико-социальных особенностей:
- Тип припадка.
- Синдром эпилепсии.
- Пол больного.
- Сопутствующие заболевания.
- Возраст больного.
- Социальная и экономическая ситуации пациента.
При выборе АЭП первой линии необходимо помнить о наиболее часто встречающихся побочных эффектах, которые могут ухудшить качество жизни больных в большей степени, чем наличие эпилептических припадков в зависимости от пола, возраста и социального функционирования пациента. При эффективности первого назначения АЭП его применяют длительно в терапевтических дозах в течение 2-3 лет.

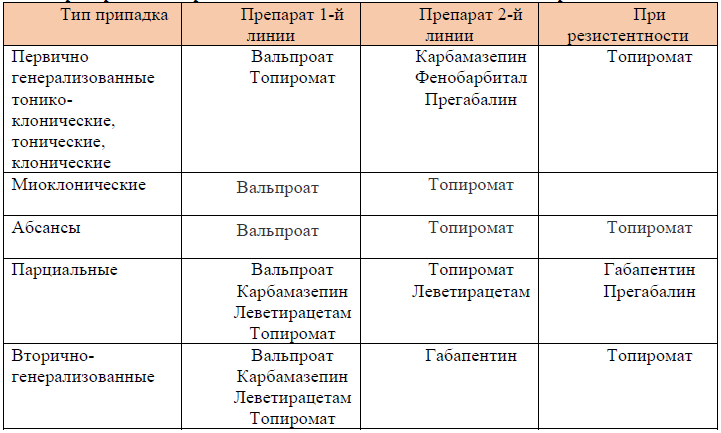
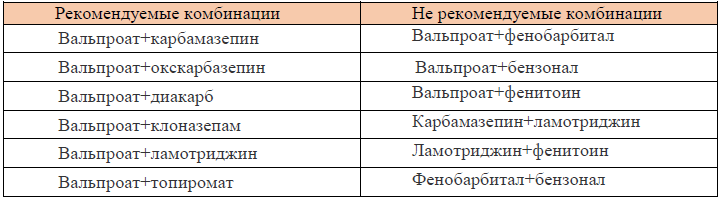
Таблица 5. Рекомендуемые и нерекомендуемые комбинации антиэпилептических средств:
3. Контроль эффективности лечения:
5. Хирургическое лечение
5.1. Показания к хирургическому лечению
Лечение припадков начинают с монотерапии препаратом первой линии выбора, эффективность которого оценивают на протяжении не менее трех месяцев после достижения терапевтической дозы препарата. Оценка эффективности в течение меньшего периода времени не позволяет изменить эффективность АЭП, что приводит к частой их смене и развитию вторичной фармакорезистентности.
При выборе АЭП первой линии необходимо помнить о наиболее часто встречающихся побочных эффектах, которые могут ухудшить качество жизни больных в большей степени, чем наличие эпилептических припадков в зависимости от пола, возраста и социального функционирования пациента. При эффективности первого назначения АЭП его применяют длительно в терапевтических дозах в течение 2-3 лет.

Таблица 4. Препараты выбора в зависимости от типа эпилептических припадков:

Таблица 5. Рекомендуемые и нерекомендуемые комбинации антиэпилептических средств:

2. Не медикаментозное лечение (кетогенная диета) – принцип питания, в основу которого положено определенное соотношение потребляемых в пищу белков, жиров и углеводов. Преобладание жирной пищи в рационе позволяет почти в 90% случаев снизить частоту приступов у детей, больных эпилепсией.
3. Контроль эффективности лечения:
1. Клинический – ведение дневника приступов!
2. Контроль родителями за приступами и приемом препаратов у детей.
3. Нейрофизиологический (ЭЭГ, видео-ЭЭГ-мониторинг)
4. Терапевтический лекарственный мониторинг.
5. Лабораторно-биохимический мониторинг.
6. Ревизия.
4. Медикаментозная терапия
Противосудорожные препараты:
- Внутривенно р-р Диазепама 10 мг в 20 мл физ. раствора. При отсутствии эффекта – повторить через 30 мин.
- Параллельная дегидратационная терапия (р-р Фуросемида 20 мг в/в, р-р Магния сульфата 25% 5-10 мл в/в струйно).
Необходимо отметить, что у детей грудного возраста и при эпилептическом статусе седативные препараты могут вызвать остановку дыхания. При угрозе остановки дыхания в условиях некупируемых судорог необходимы вызов специализированной выездной бригады скорой медицинской помощи, перевод ребенка на ИВЛ с последующей экстренной медицинской эвакуацией в реанимационное отделение стационара.
5. Хирургическое лечение
Решение принимается группой специалистов-экспертов – мультидисциплинарной бригадой – имеющих подготовку по прехирургической диагностике и хирургическому лечению эпилепсии в соответствии со стандартами ILAE. Результаты хирургического лечения зависят от правильности выбора пациентов, поэтому необходимо использовать строгий протокол для отбора больных (рекомендации ILAE).
5.1. Показания к хирургическому лечению
Показанием к хирургическому лечению является наличие эпилептических
приступов вследствие эпилептогенных поражений (пороки развития головного мозга, внутримозговые опухоли, гетеротопии, фокальные кортикальные дисплазии, последствия ЧМТ), при лечении которых не возникнет неврологической симптоматики.
Хирургическое лечение показано пациентам с фокальным началом приступов, принимающих два или более противосудорожных препаратов в течении минимум 2-х лет, или пациентам с выраженными побочными эффектами от приема противосудорожных препаратов и приступы влияют или ограничивают повседневную жизнь и ее качество.
Раннее хирургическое вмешательство позволяет избежать разрушительных психосоциальных и нейропсихологических последствий хронической эпилепсии и улучшить качество жизни после операции. Около 90% пациентов, с длительностью заболевания менее 10 лет, после операции избавились от приступов, в то время как, только 30% пациентов, с длительность заболевания более 30 лет, после операции стали «seizure free».
5.2. Противопоказания к хирургическому лечению:
• идиопатическая генерализованная эпилепсия или доброкачественные эпилептические синдромы;
• приступы, не ухудшающие качество жизни;
• прогрессирующие соматических заболевания или тяжелая сопутствующая патология (острая почечная недостаточность, неконтролируемый сахарный диабет, дыхательная недостаточность и т.п.);
• тяжелые психические заболевания
2) Паллиативная хирургия:
3) Альтернативные методы (должны применяться при невозможности при неэффективности резекционного вмешательства):
5.3. Виды хирургических вмешательств:
1) Резекционные вмешательства:
a) Удаление патологического очага (АВМ, каверномы, опухоли головного мозга и т.п.);
b) Селективная амигдалогиппокампэктомия;
c) Резекции коры;
d) Частичная лобэктомия;
e) Лобэктомия;
f) Гемисферэктомия;
2) Паллиативная хирургия:
a) Каллозотомия;
b) Множественные субпиальные насечки;
3) Альтернативные методы (должны применяться при невозможности при неэффективности резекционного вмешательства):
a) Стимуляция блуждающего нерва (VNS);
b) DBS;
Передняя медиальная височная лобэктомия (стандарт).
c) Радиохирургия;
d) Стреотаксическая термодеструкция, лазерная абляция.
Передняя медиальная височная лобэктомия (стандарт).
Наиболее эффективным способом лечения фармакорезистентной эпилепсии является резекция эпилептогенной зоны. Более 70-80% от всех хирургических процедур лечения фармакорезистентной эпилепсии приходится на переднюю медиальную височную лобэктомию, после которой у 48-84% пациентов достигается контроль над приступами.
Существует несколько методик выполнения передней медиальной височной лобэктомии - удаление антеромедиальной части височной доли «единым блоком», раздельное удаления неокортикальных и медиальных отделов височной доли.
Границами неокортикальной резекции являются 4 – 4,5 см от верхушки полюса по верхней височной извилине на доминантной стороне и 6 см на субдоминантной.
Селективная амигдалогиппокампэктомия (стандарт).
Термин «селективная амигдалогиппокампэктомия» относится к группе хирургических вмешательств направленных на резекцию медиальных структур височной доли без резекции неокортикальных.
Существует несколько доступов к гиппокампу: транскортикальный, трансвентрикулярный, транссильвиевый, трансильвиевый-трансцистернальный, субтемпоральный и транстенториальный-супрацеребеллярный доступ.
В настоящее время наиболее распространены транссильвиевый и траскортикальный доступы.
Показаниями к селективной амигдалогиппокампэктомии являются изолированные поражения медиальных отделов височной доли без вовлечения неокортикальных отделов височной доли (так называемый «мезиальный височный склероз»). Данные методики могут применяться только при локальных эпилептогенных поражениях гиппокампа.
C.B.Josephson (2013) анализируя результаты лечения пациентов после переднемедиальной височной лобэктомии и селективной амигдалогиппокампэктомии (АМГЭ) показал, что исход Engel I класса статистически более вероятен у пациентов после лобэктомии нежели после АМГЭ.
Множественные субпиальные насечки (опция).
Данная методика паллиативной хирургии применяется в тех случаях, когда эпилептогенная зона находится в функционально значимой зоне и не может быть резецирована. Данная концепция основана на том, что нарушение горизонтальной кортикальной взаимосвязи предотвращает распространение пароксизмального разряда, а
сохранение вертикально ориентированных волокон - предотвращает развитие функционального дефицита.
После проведения данной процедуры снижение частоты приступов более чем на 50% удается добиться у 55-65% пациентов, при сочетании множественных субпиальных насечек с дополнительной резекцией очага - у 56% пациентов достигается контроль над приступами, а у 75 – 85% пациентов снижается частота приступов более чем на 95%.
Гемисферэктомия (рекомендация).
Функциональная гемисферэктомия заключается в резекции височной доли и центральной коры с последующим разделением теменной и затылочной коры головного мозга от подкорковых структур и мозолистого тела. Данный тип хирургических вмешательств выполняется в основном в педиатрической практике пациентам с тяжелым неврологическим дефицитом в виде гемипареза и обширным поражением полушария головного мозга кортикальной мальформацией, энцефалитом Расмуссена, синдромом Штурге-Вебера или последствиями нарушения мозгового кровообращения.
Каллозотомия (рекомендация).
Каллозотомия редко применяется у взрослых. Каллозотомию выполняют пациентам с генерализованной симптоматической фармакорезистентной эпилепсией и с многочисленными типами приступов: тоническими, атоническими, генерализованными тонико-клоническими, абсансами и, менее часто, фокальными приступами. Наиболее часто каллозотомию проводят пациентам с синдромом Леннокса Гасто. Целью хирургического вмешательства является предотвращение распространения приступа из одного полушария в другое. Тонические и атонические приступы, приводящие к травмам, лучше всего поддаются коррекции, чем другие типы приступов. Каллозотомию проводят в два этапа для предотвращения развития «disconnection syndrome»: передние две три разъединяются первым этапом, если контроля над приступами достичь не удается, то выполняется второй этап – рассечение задней трети.
VNS (Вагус стимуляция) (опция).
Показаниями для проведения вагус стимуляции является фармакорезистентная эпилепсия у пациентов, которым резекционное вмешательство не может быть проведено. Согласно большинству исследований, снизить частоту приступов ≥50% после установки вагус стимулятора удается в среднем у 50,9% (18,4-67%) пациентов, а добиться полного контроля над приступами удается добиться у 14% (9-27%).
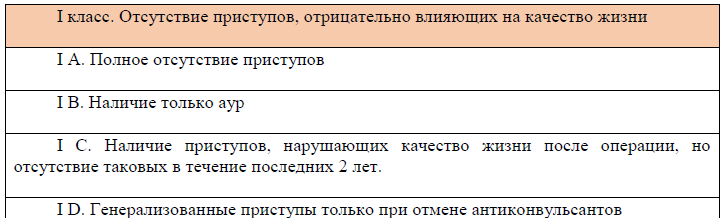
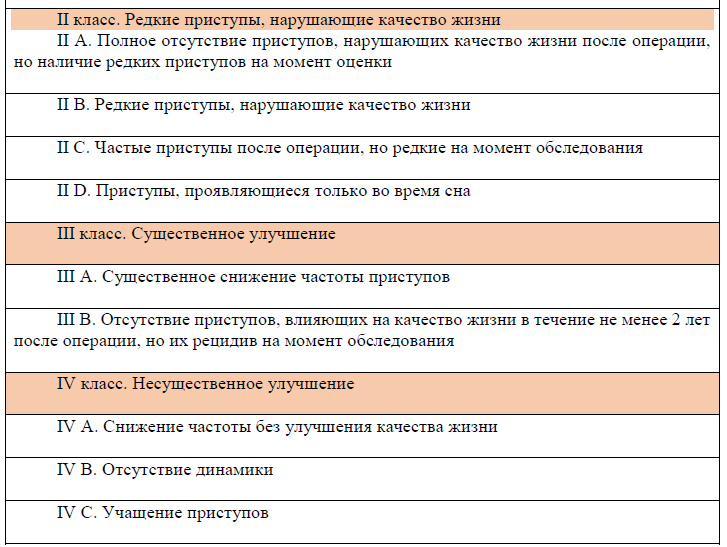
Шкала исходов хирургического лечения эпилепсии по J. Engel (1993)
В зависимости от объема эпилептогенного очага и эпилептогенной зоны, их локализации,форм и размеров выбирают тот или иной тип хирургического вмешательства.
При хирургическом лечении височных форм эпилепсии контроль над приступами достигают у 53–84% пациентов, при экстратемпоральных формах – у 31-38%. При продолжении противосудорожной терапии у пациентов с фармакорезистентными формами контроля над приступами удается добиться не более чем в 8% случаях.
Фармакорезистентная эпилепсия связана с заметными нарушениями качества жизни пациента с эпилепсией, несмотря на проводимую консервативную терапию, частота приступов является наиболее важным фактором, влияющим на качество жизни пациентов с эпилепсией.
Через 6 месяцев после хирургического лечения качество жизни пациентов заметно улучшается, и через 2-3 года после операции у пациентов без приступов, качество жизни достигается уровня сходного со здоровым населением. После проведенного хирургического лечения противоэпилептические препараты при отсутствии клинических и нейрофизиологических приступов могут быть постепенно отменены.
В долгосрочной перспективе, согласно проспективному исследованию A. Edelvik (2013), 86% детей и 43% взрослых через 10 лет после операции не принимали противосудорожных препаратов и у них не наблюдалось приступов (т.н «seizure-free»), но у пациентов, которым хирургическое вмешательство не проводилось приступы сохранялись.
Шкала исходов хирургического лечения эпилепсии по J. Engel (1993)


Медицинская реабилитация
МЕДИЦИНСКАЯ РЕАБИЛИТАЦИЯ
Реабилитация при эпилепсии направлена на восстановление нормальной жизнедеятельности организма и компенсацию его функциональных возможностей, нарушенных в результате заболевания. Мероприятия медицинской реабилитации при симптоматической эпилепсии включают: психологическую, физическую (ЛФК, эрготерапию, ФТЛ, бальнеолечение и другие методы) и медикаментозную реабилитацию, а также диетотерапию и организацию школ пациентов. Вместе с тем, при эпилепсии приоритет уделяется медикаментозной реабилитации, важнейшей целью которой является прекращение приступов с минимальными побочными эффектами, поскольку часто повторяющиеся приступы несут в себе потенциальную опасность для здоровья, получения вторичной травмы при внезапном падении, приводят к снижению интеллекта. Принципы реабилитации с использованием притивоэпилептических препаратов включают: индивидуальность (подбор препарата индивидуально каждому пациенту), непрерывность, длительность приема препаратов (не менее 2–5 лет после последнего припадка), тщательный самоконтроль за состоянием во время лечения с целью выявления побочных действий препарата, корректировка дозы и кратности при изменении возраста и соматического состояния, постепенная отмена препарата (с обязательным учетом формы эпилепсии и ее прогноза, возможности возобновления припадков, индивидуальных и возрастных особенностей пациента, под контролем данных ЭЭГ-исследования в течение года).
Госпитализация
Показания для госпитализации
Показания для плановой госпитализации:
- впервые возникшие эпилептические приступы у взрослых или детей (для выявления этиологических факторов, уточнения характера, частоты приступов, подбора препаратов, отработки адекватной схемы лечения);
- при неэффективности амбулаторного лечения;
- появление у больного других неврологических симптомов;
- увеличение частоты приступов или изменение их стереотипа;
Показания для экстренной госпитализации:
- приступы, сумеречное расстройство сознания.
- необходимость хирургического лечения (в нейрохирургический стационар).
Организация скорой медицинской помощи
Общие мероприятия
обеспечение проходимости дыхательных путей;
ингаляция увлажненным кислородом;
профилактика травм головы, конечностей, предотвращение прикусывания и запрокидывания языка, аспирации рвотными массами (необходимо положить пациента головой на мягкую поверхность, повернуть голову на бок для предотвращения западения языка или аспирации рвотными массами);
мониторинг гликемии, ЭКГ;
при необходимости — обеспечение венозного доступа.
Организация медицинской помощи в специализированном стационаре
Диагностика эпилепсии см. Диагностика
Клинические проявления эпилепсии см. Клиническая картина
Медикаментозное лечение см. Лечение
Профилактика
ПРОФИЛАКТИКА И НАБЛЮДЕНИЕ
-борьба с гипертермией свыше 38°С у детей фебрильно спровоцированных приступах;
-соблюдать режим дня;
-необходим полноценный ночной сон (не менее 8 ч),
-противопоказана работа, при которой развитие приступа у больного может угрожать жизни или безопасности самого больного или окружающих (на высоте, около открытого огня, водоема, вождение автотранспорта (при сохранении приступов), около движущихся механизмов;
-алкоголь может провоцировать эпилептические приступы, может вызвать симптомы передозировки противосудорожных средств из-за взаимодействия с противоэпилептическими препаратами. Его необходимо исключить;
-ограничить пользование компьютера, просмотра телевизора, мелькание света при фотосенситивных формах эпилепсии.
-дневник введения приступов.
-видеорегистрация приступа (на телефон).
-контроль общеклинических анализов и ЭЭГ.
Информация
Источники и литература
-
Клинические протоколы, руководства, рекомендации Министерства здравоохранения Республики Узбекистан 2020
- 1. Клиническое руководство по диагностике и лечению эпилепсии у взрослых МЗРУз16.04.2013 2. ICD coding for epilepsy: Past, present, and future. A report by the International League Against Epilepsy Task Force on ICD codes in epilepsy. Nathalie Jette, Ettore Beghietall. Epilepsia, 56(3):348–355, 2015; 3. Robert S. Fisher et al Epileptic seizure and Epilepsy: Definitions Proposed by ILAE and IBE. Epilepsia 46(4); 470-472, 2005; 4. Definition of drug resistant epilepsy: Consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies. Patrick Kwan, Alexis Arzimanoglou et all. Epilepsia, 51(6):1069–1077, 2010; 5. A practical clinical definition of epilepsy. Robert S. Fisher et al. Epilepsia, 55(4):475–482, 2014; 6. Commission classification and terminilogy of the International League Against Epilepsy. Proposal for revised clinical and electroencephalographic classification of epileptic seizures. Epilepsia, 1981;22:489-501; 7. Revised terminology and concepts for organization of seizures and epilepsies: Report of the ILAE Commission on Classification and Terminology, 2005–2009. Anne T. Berg, Samuel F. Berkovic, Martin J. Brodie, J. Helen Cross et all. Epilepsia, 51(4):676–685, 2010; 8. The Epilepsies. The diagnosis and management of the epilepsies in adults and children in primary and secondary care. National Clinical Guidelines Center and National Institute clinical Excellence. 2012; 9. Clinical Aspects of the Ketogenic Diet. Adam L. Hartman and Eileen P. G. Vining. Epilepsia, 48(1):31–42, 2007; 10. Updated ILAE evidence review of antiepileptic drug efficacy and effectiveness as initial monotherapy for epileptic seizures and syndromes. Tracy Glauser et all for the ILAE subcommission of AED Guidelines. Epilepsia, 1–13, 2013; 11. Diagnosis and management of epilepsy in adults. SIGN (Scottish Intercollegiate Guidelines Network) 2015; 12. The Epilepsies. The diagnosis and management of the epilepsies in adults and children in primary and secondary care. National Clinical Guidelines Center and National Institute clinical Excellence. 2012; 13. Antiepileptic drugs as a cause of worsening seizures. Perucca E1, Avanzini G, Dulac O. Epilepsia. 1998 Jan;39(1): 5-17; 14. Мухин К.Ю., Петрухин А.С. Идиопатические формы эпилепсии. М., 2000, с. 3-12; 15. Presurgical evaluation and outcome of epilepsy surgery in childhood. J. HELEN CROSS.UCL Institute of Child Health, Great Ormond Street Hospital for Children NHS Trust, 2012; 16. Engel J. Approaches to localization of the epileptogenic lesion. In : Engel J Jr ed. Surgical treatment of the epilepsies. New York: Raven Press 1987; 75-95. 17. Epilepsy 2017. From bench to Bedside. Sixtenth Epilepsy Teaching Weakend University of Oxford Mathematical Institute. 18. Хирургия эпилепсии. Под редакцией В.В.Крылова – 2019г. 19. Зенков Л.Р. Осложнения противоэпилептической фармакотерапии // Российский медицинский журнал. — 2004. — № 6. — С. 9–12. 4. Зенков Л.Р. Непароксизмальные эпилептические расстройства: Руководство для врачей. — М.: МЕДпресс-информ, 2007. 5. 20. Зенков Л.Р. Утяжеление эпилепсии вследствие противосудорожной фармакотерапии // Неврологический журнал. — 2007. — Т. 12. — № 3. — C. 8–13. 6. 21. Зенков Л.Р. Выбор препарата в лечении фокальных эпилепсий: место вальпроатов // Русский медицинский журнал. — 2009. — Т. 17. — № 20. — С. 1334–1340. 22. Зенков Л.Р. Клиническая эпилептология: Руководство для врачей. — 2-е изд., испр. и доп. — М.: Медицинское информац ионное агентство, 2010. 23. Зенков Л.Р., ПритыкоА.Г. Фармакорезистентные эпилепсии: Pуководство для врачей. — М.: Медпресс-информ, 2003. 12. 24. Карлов В.А. Эпилепсия у детей и взрослых, женщин и мужчин. — М.: Медицина, 2010. 13. 25. Blume W. T., Luders H. O., Mizrahi E., et al. Glossary of descriptive terminology for ictal semiology: report of the ILAE task force on classification and terminology. Epilepsia. 2001; 42: 1212-1218. 26. Proposal for revised clinical and electroencephalographic classification of epileptic seizures. From the Commission on Classification and Terminology of the International League Against Epilepsy. Epilepsia. 1981; 22: 489-50. 27. Berg A. T., Millichap J. J. The 2010 revised classification of seizures and epilepsy. Continuum (Minneap Minn). 2013; 19: 571-597. 28. Fisher R. S., Acevedo C., Arzimanoglou A., Bogacz A., Cross J. H., Elger C. E., Engel J. Jr., Forsgren L., French J. A., Glynn M., Hesdorffer D. C., Lee B. I., Mathern G. W., Moshé S. L., Perucca E., Scheffer I. E., Tomson T., Watanabe M., Wiebe S. ILAE official report: a practical clinical definition of epilepsy. Epilepsia. 2014; 55 (4): 475-482. 29. Fisher R. S., van Emde Boas W., Blume W., et al. Epileptic seizures and epilepsy: definitions proposed by the International League Against Epilepsy (ILAE) and the International Bureau for Epilepsy (IBE). Epilepsia. 2005; 46: 470-472. 30. Engel Jr JVNP. Outcome with respect to epileptic seizures. Surgical treatment of the epilepsies. 1993;609-621
Информация
Адрес для связи с рабочей группой:
E-mail: dockxaus@gmail.com Узбекистан, г. Ташкент, массив Хумоюн 40.100176 Республиканский специализированный научно-практический медицинский центр
нейрохирургии.
Тел: (+71) 264-96-10
Моб: (+97) 343 -44-12
Факс: (+71) 264-96-30
Ответственные исполнители:
Руководитель рабочей группы:
СПИСОК ИСПОЛЬЗУЕМЫХ СОКРАЩЕНИЙ
ОПРЕДЕЛЕНИЕ ПОНЯТИЙ
Состав рабочей группы:
Миразимов Д.Б. Главный врач РСНПМЦН,к.м.н. Бурнашев М.И. Заведующий отделением 1-й нейрохирургии. Хасилбеков Н.Х. Нейрохирург, РСНПМЦН
Ответственные исполнители:
Бурнашев М.И. Заведующий отделением 4-й нейрохирургии,к.м.н. Хасилбеков Н.Х. Нейрохирург, РСНПМЦН
Руководитель рабочей группы:
Кариев Гайрат Маратович д.м.н.,профессор Директор РСНПМЦН,.
СПИСОК ИСПОЛЬЗУЕМЫХ СОКРАЩЕНИЙ
ILAE – International League Against Epilepsy
IBE – International Bureau Epilepsy
АД – артериальное давление
АЭП – антиэпилептический препарат
КТ – компьютерная томография
МРТ – магнитно – резонансная томография
УЗДГ – Ультразвуковая транскраниальная доплерография
ЦНС – центральная нервная система
ЭКГ – электрокрадиография
ЭЭГ – электроэнцефалография
ОПРЕДЕЛЕНИЕ ПОНЯТИЙ
Стандарт.
Общепризнанные принципы диагностики и лечения, которые могут рассматриваться в качестве обязательной лечебной тактики (эффективность подтверждена несколькими рандомизированными исследованиями, мета-анализами или когортными клиническими исследованиями).
Рекомендация.
Лечебные и диагностические мероприятия, рекомендованные к использованию большинством экспертов по данным вопросам. Могут рассматриваться как варианты выбора лечения в конкретных клинических ситуациях (эффективность подтверждена отдельными рандомизированными исследованиями или когортными клиническими исследованиями).
Опция.
Лечебные или диагностические мероприятия, которые могут быть полезны (эффективность подтверждена мнением отдельных экспертов, в отдельных клинических случаях).
Не рекомендуется.
Лечебные и диагностические мероприятия, не имеющие положительного эффекта, или могущие принести вред (любой уровень подтверждения).
Критерии качества медицинской помощи эпилепсии

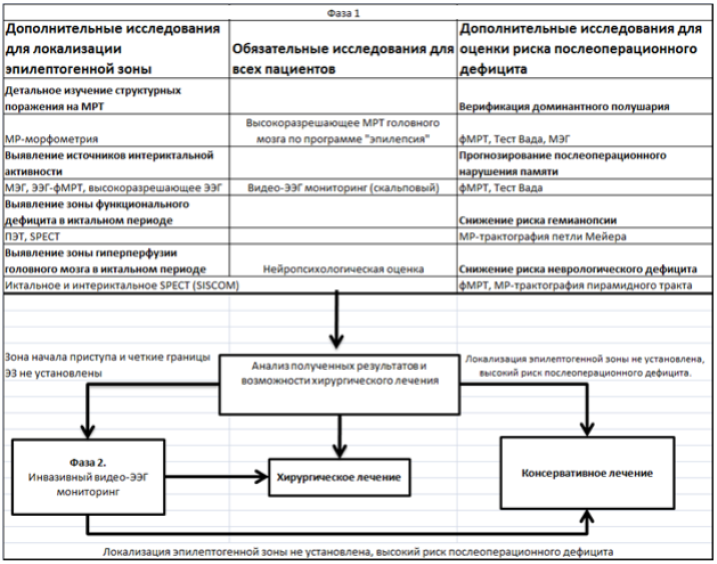
Приложение 1. Схема предоперационного обследования пациентов с фармакорезистентной симптоматической эпилепсией (P. Ryvlin et.al, 2014).:
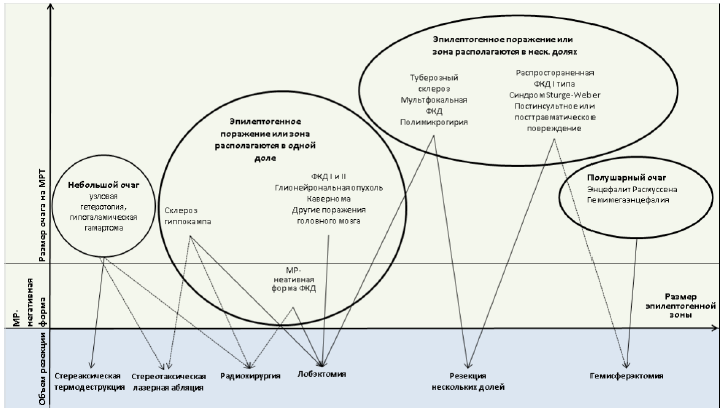
Приложение 2. В зависимости от объема эпилептогенного очага и эпилептогенной зоны, их локализации, форм и размеров выбирают тот или иной тип хирургического вмешательства (P. Ryvlin et.al, 2014).:
Медицинское вмешательство – выполняемые медицинским работником по отношению к пациенту, затрагивающие физическое или психическое состояние человека и имеющие профилактическую, исследовательскую, диагностическую, лечебную, реабилитационную направленность виды медицинских обследований и (или) медицинских манипуляций.
1. Я,_________________________________________________________________________ ,
2. В доступной для меня форме мне разъяснены возможные методы и варианты предстоящих медицинских вмешательств, их последствия, необходимость, цель и ожидаемые результаты предстоящего обследования, диагностики и/или лечения, в том числе вероятность развития осложнений, а также последствия отказа от медицинского вмешательства.
3. Я проинформирован, что точно предсказать результат и исход медицинского вмешательства невозможно. Я понимаю, что любое лечение или операция сопряжены с риском для жизни и могут привести к временной или постоянной, частичной или полной нетрудоспособности. Никакие гарантии относительно результатов медицинского вмешательства не предоставляются.
4. Я понимаю, что в процессе диагностических, лечебных и иных вариантов медицинских вмешательств могут возникнуть непредвиденные экстренные обстоятельства и осложнения, при которых я буду не в состоянии дать согласие на проведение необходимых экстренных действий (повторных операций или процедур). В таких ситуациях ход медицинского вмешательства может быть изменен врачами по их усмотрению.
5. Я знаю, что в целях максимальной эффективности предстоящего медицинского вмешательства я обязан поставить врача в известность о всех проблемах, связанных с моим здоровьем, наследственностью, в том числе об аллергических проявлениях, индивидуальной непереносимости лекарственных препаратов и продуктов питания, а также о курении табака, употреблении алкоголя, наркотических или токсических препаратов.
6. Я понимаю, что при проведении хирургического вмешательства возможна потеря крови и может возникнуть необходимость в переливании донорской крови или ее компонентов, на что я даю добровольное согласие. Я получил разъяснения от лечащего врача о цели переливания крови или ее компонентов, необходимости переливания, характере и особенностях процедуры, возможных последствиях, в случае развития которых я согласен на проведение всех нужных лечебных мероприятий. Я извещен о вероятном течении заболевания при отказе от переливания крови и ее компонентов.
8. Мне разъяснено, что я имею право отказаться от одного или нескольких методов профилактики, диагностики, лечения и реабилитации при оказании медицинской помощи или потребовать его (их) прекращения, мне также разъяснены возможные последствия такого отказа.
9. В доступной для меня форме мне разъяснена возможность получения бесплатной медицинской помощи соответствующих видов в рамках ежегодной программы, в том числе территориальной, государственных гарантий бесплатного оказания гражданам медицинской помощи.
10. Я разрешаю предоставлять информацию о моей (моего ребенка) болезни, прогнозе и лечении только:
11. Я ознакомлен со всеми пунктами настоящего документа, они мне понятны, о чем свидетельствует моя подпись ниже.
КРИТЕРИИ ОЦЕНКИ КАЧЕСТВА МЕДИЦИНСКОЙ ПОМОЩИ
1. Электроклиническая ремиссия: полный контроль – отсутствие приступов в течение более 3х лети и патологической активности на ЭЭГ;
2. Неполный контроль приступов – редукция частоты приступов более чем на 50%;
3. Неконтролируемые приступы – отсутствие эффекта лечения;
4. Аггравация приступов – аггравации под влиянием АЭП, предложенная E. Perucca и соавт. в 1998 г., подразделяет этот феномен на два типа:
• тип А – парадоксальная интоксикация – увеличение частоты приступов как проявление чрезмерной для данного пациента лекарственной нагрузки;
• тип В – специфическая (фармакодинамическая) аггравация – специфичный для пациента или типа заболевания феномен, при котором определенные типы приступов появляются, возобновляются или учащаются под влиянием определенных АЭП в связи с их механизмом действия.
Критерии качества медицинской помощи эпилепсии

Приложение 1. Схема предоперационного обследования пациентов с фармакорезистентной симптоматической эпилепсией (P. Ryvlin et.al, 2014).:

Приложение 2. В зависимости от объема эпилептогенного очага и эпилептогенной зоны, их локализации, форм и размеров выбирают тот или иной тип хирургического вмешательства (P. Ryvlin et.al, 2014).:

Приложение 2
Информированное добровольное согласие пациента на медицинское вмешательство
Медицинское вмешательство – выполняемые медицинским работником по отношению к пациенту, затрагивающие физическое или психическое состояние человека и имеющие профилактическую, исследовательскую, диагностическую, лечебную, реабилитационную направленность виды медицинских обследований и (или) медицинских манипуляций.
1. Я,_________________________________________________________________________ ,
(Ф.И.О. пациента или родителей)
«____»_______________ _____г. рождения, зарегистрированный(ая) по адресу _____________________________________________________________________________
_____________________________________________________________________________
(адрес места жительства (пребывания) пациента либо его законного представителя)
____________________________________________________________, даю информированное добровольное согласие на предстоящее медицинское вмешательство в _____________________________________________________________________________
_____________________________________________________________________________
(наименование медицинского учреждения)
2. В доступной для меня форме мне разъяснены возможные методы и варианты предстоящих медицинских вмешательств, их последствия, необходимость, цель и ожидаемые результаты предстоящего обследования, диагностики и/или лечения, в том числе вероятность развития осложнений, а также последствия отказа от медицинского вмешательства.
3. Я проинформирован, что точно предсказать результат и исход медицинского вмешательства невозможно. Я понимаю, что любое лечение или операция сопряжены с риском для жизни и могут привести к временной или постоянной, частичной или полной нетрудоспособности. Никакие гарантии относительно результатов медицинского вмешательства не предоставляются.
4. Я понимаю, что в процессе диагностических, лечебных и иных вариантов медицинских вмешательств могут возникнуть непредвиденные экстренные обстоятельства и осложнения, при которых я буду не в состоянии дать согласие на проведение необходимых экстренных действий (повторных операций или процедур). В таких ситуациях ход медицинского вмешательства может быть изменен врачами по их усмотрению.
5. Я знаю, что в целях максимальной эффективности предстоящего медицинского вмешательства я обязан поставить врача в известность о всех проблемах, связанных с моим здоровьем, наследственностью, в том числе об аллергических проявлениях, индивидуальной непереносимости лекарственных препаратов и продуктов питания, а также о курении табака, употреблении алкоголя, наркотических или токсических препаратов.
6. Я понимаю, что при проведении хирургического вмешательства возможна потеря крови и может возникнуть необходимость в переливании донорской крови или ее компонентов, на что я даю добровольное согласие. Я получил разъяснения от лечащего врача о цели переливания крови или ее компонентов, необходимости переливания, характере и особенностях процедуры, возможных последствиях, в случае развития которых я согласен на проведение всех нужных лечебных мероприятий. Я извещен о вероятном течении заболевания при отказе от переливания крови и ее компонентов.
7. Я согласен на запись лечебно-диагностического процесса на любые информационные носители, с использованием любых технических средств, а также на взятие у меня в диагностических и лечебных целях образцов биологических материалов, в том числе клеток, тканей, биологических жидкостей.
8. Мне разъяснено, что я имею право отказаться от одного или нескольких методов профилактики, диагностики, лечения и реабилитации при оказании медицинской помощи или потребовать его (их) прекращения, мне также разъяснены возможные последствия такого отказа.
9. В доступной для меня форме мне разъяснена возможность получения бесплатной медицинской помощи соответствующих видов в рамках ежегодной программы, в том числе территориальной, государственных гарантий бесплатного оказания гражданам медицинской помощи.
10. Я разрешаю предоставлять информацию о моей (моего ребенка) болезни, прогнозе и лечении только:
_____________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
_____________________________________________________________________________
(доверенные лица)
11. Я ознакомлен со всеми пунктами настоящего документа, они мне понятны, о чем свидетельствует моя подпись ниже.
Подпись
Дата «___»______________ ______г.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.