Почечно-клеточный рак
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Злокачественное новообразование почки, кроме почечной лоханки (C64)
Онкология
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «08» сентября 2023 года
Протокол №189
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
ПОЧЕЧНО – КЛЕТОЧНЫЙ РАК
Почечно–клеточный рак - злокачественная опухоль почки, которая чаще всего представляет собой карциному и развивается либо из эпителия проксимальных канальцев и собирательных трубочек (почечноклеточный рак, ПКР), либо из эпителия чашечно-лоханочной системы (переходноклеточный рак) [1].
Код(ы)МКБ–10:
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2018 г./2022 г.)
Категория пациентов: взрослые.
Уровни градации рекомендаций.
Почечно–клеточный рак - злокачественная опухоль почки, которая чаще всего представляет собой карциному и развивается либо из эпителия проксимальных канальцев и собирательных трубочек (почечноклеточный рак, ПКР), либо из эпителия чашечно-лоханочной системы (переходноклеточный рак) [1].
ВВОДНАЯ ЧАСТЬ
Код(ы)МКБ–10:
|
Код
|
Название |
|
С.64
|
Злокачественные новообразования почки, кроме почечной лоханки |
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2018 г./2022 г.)
Пользователи протокола: онкологи, урологи, лучевые терапевты, хирурги, терапевты, врачи общей практики.
Категория пациентов: взрослые.
Шкала уровня доказательности:
Уровни градации рекомендаций.
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С |
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+).
Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++или+), результаты которых не могут быть непосредственно распространены на соответствующую популяцию.
|
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
|
Категория
|
Доказательства |
| 1A | Мета-анализ рандомизированных контролируемых исследований |
| 1B | По крайней мере, 1 рандомизированное контролируемое исследование |
| 2А | По меньшей мере, 1 контролируемое исследование без рандомизации |
| 2В | По крайней мере, 1 квази-экспериментальное исследование |
| 3 | Описательные исследования, такие как сравнительные исследования, корреляционные исследования или «случай-контроль» исследования |
| 4 | Отчет экспертного комитета или мнение и/или клинический опыт уважаемых авторитетов |
Классификация
Классификация [3,10,51,52,55]:
Гистологическая классификация почечно-клеточного рака:
- Светлоклеточный вариант;
- Папиллярный вариант (тип 1 и тип 2);
- Хромофобный вариант;
- Зернисто-клеточный вариант;
- Саркоматозный вариант;
- Рак эпителия собирательных канальцев (или протоков Беллини).
Гистологическая классификация Всемирной Организации здравоохранения (ВОЗ), 2016 год [15].
Существует три основных типа ПКР:
светлоклеточный (ccRCC);
папиллярный (pRCC типа I и II);
хромофобный (chRCC).
Гистологическая дифференцировка:
Традиционно почечно-клеточный рак классифицировали в соответствии с ядерной или клеточной морфологией. Современные морфологические, цитогенетические и молекулярные исследования позволяют выделить 5 типов рака [10]:
Гистологический диагноз включает, помимо типа ПКР; оценку ядерной градации, саркоматоидные особенности, сосудистую инвазию, некроз опухоли и инвазию собирательной системы и околопочечного жира, pT или даже категории pN. Четырехуровневая система оценок ВОЗ / ISUP (Международное общество урологической патологии) заменило систему оценок Фурмана [2].
Гистологическая дифференцировка:
GX – степень дифференцировки не может быть установлена. G1 – высокая степень дифференцировки.
G2 – средняя степень дифференцировки. G3 – низкая степень дифференцировки. G4 – недифференцированный рак.
Традиционно почечно-клеточный рак классифицировали в соответствии с ядерной или клеточной морфологией. Современные морфологические, цитогенетические и молекулярные исследования позволяют выделить 5 типов рака [10]:
• светлоклеточный — 80–90%;
• папиллярный — 10–15%;
• хромофобный — 4–5%;
• онкоцитарный — 2–5%;
• протоковый — 1–2%.
Таблица 1. TNM класификация (Международный противораковый союз, 2017)
Таблица 2. Соответствие клинических стадий категориям TNM
Таблица 3 – Классификация Босняка кистозных образований почки.
Таблица 1. TNM класификация (Международный противораковый союз, 2017)
| Т – первичная опухоль: |
|
ТX – недостаточно данных для оценки первичной опухоли.
Т0 – первичная опухоль не определяется.
Т1 – опухоль до 7 см в наибольшем измерении, ограниченная почкой.
Т1а – опухоль до 4 см в наибольшем измерении, ограниченная почкой.
T1b – опухоль 4-7 см в наибольшем измерении.
Т2 – опухоль более 7 см в наибольшем измерении, ограниченная почкой.
Т2а – опухоль 7-10 см в наибольшем измерении.
Т2б – опухоль более 10 см, ограниченная почкой.
Т3 – опухоль распространяется в крупные вены или инвазирует надпочечник или паранефральную клетчатку (кроме ипсилатерального надпочечника) без распространения за пределы фасции Герота.
Т3а – опухоль макроскопически распространяется на почечную вену или ее сегментарные (содержащие гладкомышечную ткань) ветви, или инвазирует паранефральную клетчатку или клетчатку почечного синуса, но в пределах фасции Героты.
Т3b – опухоль макроскопически распространяется на нижнюю полую вену (НПВ), до уровня диафрагмы.
Т3с – опухоль макроскопически распространяется на НПВ выше уровня диафрагмы или инвазирует стенку НПВ.
Т4 – инвазия опухоли за пределы фасции Героты (в том числе смежное распространение на ипсилатеральный надпочечник).
|
|
N – регионарные лимфатические узлы:
NX – недостаточно данных для оценки состояния регионарных лимфатических узлов.
N0 – нет признаков метастатического поражения регионарных лимфатических узлов.
N1 – метастаз в регионарном лимфатическом узле (узлах).
|
|
М – отдаленные метастазы:
М0 – нет признаков отдаленных метастазов.
М1 – имеются отдаленные метастазы.
|
|
pTNM патогистологическая классификация:
Категории pT, pN и pM соответствуют категориям T, N и М.
|
Регионарные лимфатические узлы:
Регионарными лимфатическими узлами для правой почки являются лимфоузлы ворот почки, а также лимфатические узлы, расположенные вокруг нижней полой вены от диафрагмы до слияния НПВ. Для левой почки регионарными лимфоузлами считаются лимфоузлы ворот почки и лимфатические узлы, расположенные вокруг аорты от диафрагмы до бифуркации аорты.
Таблица 2. Соответствие клинических стадий категориям TNM
|
Стадия
|
Категория T | Категория N | Категория M |
| I | T1 | N0 | M0 |
| II | T2 | N0 | M0 |
| III | T3 | N0 | M0 |
| T1,Т2,Т3 | N1 | M0 | |
| IV | T4 | N любое | M0 |
| T любое | N2 | M0 | |
| T любое | N любое | M1 |
Классификация Босняка кистозных образований почки [16]:
В классификации Босняка кистозные образования почки делят на пять категорий в зависимости от данных КТ и МРТ, что позволяет оценить риск злокачественного перерождения [17, 18]. В этой классификации указывается также способ лечения в зависимости от категории кисты (таблица 2).
Таблица 3 – Классификация Босняка кистозных образований почки.
|
Категория по Босняку
|
Особенности | Результат исследования |
| I | Простая доброкачественная с тонкой стенкой, не содержит септ, очагов обызвествлений и солидных компонентов. По плотности соответствует воде и неконтрастируется | Доброкачественная киста |
| II |
Доброкачественная киста, в которой могут быть немного численные тонкие септы. В стенке или септах возможны мелкие очаги обызвествления. Гомогенное гипоинтенсивное по сравнению с
паренхимой образование диаметром <3 см, с четкими границами, накапливающее контраст
|
Доброкачественная киста |
| IIF |
В кистах, относящихся к этой категории, может быть больше тонких септ. Возможно незначительное усиление септ и стенки кисты, а также минимальное утолщение их. В кисте могут быть относительно крупные очаги обызвествления, имеющие нодуллярную структуру, но не накапливающие контрастное вещество. Мягкотканные элементы, усиливающие сигналы, могут отсутствовать. К этой категории относятся, расположенные полностью интраренально кистозные образования диаметром ≥3 см, не накапливающие контраст, имеющие чётко
очерченные границы и повышенную плотность
|
Необходимо наблюдение больного. Иногда возможно злокачественное перерождение |
| III | Кистозные образования с неровными, утолщёнными стенками и септами, в которых может накапливаться контраст (т.е. контрастное усиление образования) |
Показано хирургическое иссечение или наблюдение в динамике. Более 50% случаев кист III категории бывают
злокачественными
|
| IV | Явно злокачественные кисты, содержащие мягкотканный компонент, для которого характерно контрастное усиление | Рекомендуется хирургическое удаление. В основном злокачественные новообразования |
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии
Жалобы и анамнез:
боль в боку, видимая гематурия и пальпируемое образование в проекции почки.
Экстраренальные симптомы:
синдром сдавления НПВ: отеки ног, варикоцеле, расширение подкожных вен живота, тромбоз глубоких вен нижних конечностей, протеинурия - развивается примерно у 50% больных при массивном опухолевом тромбозе НПВ или при компрессии НПВ опухолью и увеличенными лимфатическими узлами.
паранеопластический синдром – кахексия, снижение массы тела, лихорадка, нейромиопатия, амилоидоз, повышение СОЭ, анемия.
Физикальные обследования:
при небольших образованиях объективный осмотр не выявляет какой-либо патологии, характерной для ПКР. По мере роста образования почки могут определяться:
пальпируемое образование в проекции почек;
пальпируемые увеличенные шейные и надключичные лимфатические узлы;
неисчезающее варикоцеле или двусторонний отек нижних конечностей, что свидетельствует об опухолевой инвазии НПВ.
Лабораторные исследования:
общий анализ крови – наиболее характерно наличие анемии, разной степени выраженности; повышение СОЭ;
общий анализ мочи – макро- или микро-гематурия, или изменения в анализе могут отсутствовать;
биохимический анализ крови (общий белок, мочевина, креатинин, билирубин, глюкоза, АЛТ, АСТ, альбумин, амилаза) – возможно повышение креатинина мочевины при признаках почечной недостаточности;
коагулограмма – могут быть признаки нарушения свертываемости крови;
скорость клубочковой фильтрации – для оценки функции почек, особенно в случае опухоли единственной почки.
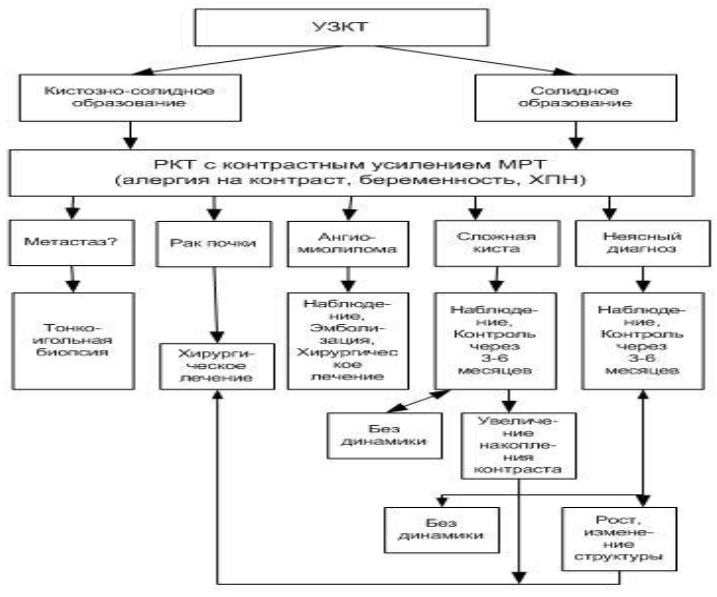
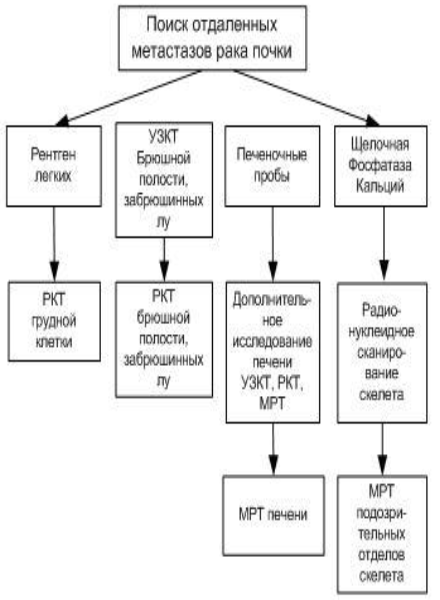
Схема 2 - Диагностика метастазов рака почки.
Инструментальные исследования [16]:
экскреторная внутривенная урография - рентгенологические признаки образования – афункция или снижение функции почки на стороне поражения, деформация ЧЛС – сдвигание, оттеснение чашечек, лоханки, ампутация чашечек, увеличенные контуры почки и т.д. В случае проведения КТ с болюсным усилением экскреторная урография может не проводиться;
Рекомендации [17]:
Диагностический алгоритм:
Схема 1 - Первичная диагностика рака почки.
ангиография сосудов почек и НПВ - имеют ограничесенные показания, используются в качестве дополнительных средств диагностики у отдельных пациентов;
изотопная ренография почек – показано для пациентов с снижением функции почек для полной оценки почечной функции с целью оптимизации планируемого лечения, например, при необходимости сохранения почечной функции.
NB! При местно-распространенном процессе, или сопутствующей патологии органов желудочно-кишечного тракта возникает необходимость в проведении обследования данных органов, где применяются ЭФГДС, ирригоскопия, фиброколоноскопия.
NB! Остеосцинтиграфия и КТ головного мозга показаны пациентам с III- IV стадией рака почки, а также больным с симптомами, которые могут быть проявлениями метастатического процесса.
ангиография почечных сосудов - при планировании эмболизации почечных артерий (УД – В).
МРТ органов забрюшинного пространства или органов брюшной полости (УД–В) - при выявлении жидкостных образований в почке для дифференциальной диагностики почечно-клеточного рака кистозной формы и рака в кисте от доброкачественных жидкостных образований [16].
чрескожная биопсия почки (УД–В) - с целью установления гистологического диагноза, для отбора больных с небольшой опухолью для наблюдения в динамике; для уточнения гистологической природы опухоли перед её удалением или применением аблативных методов лечения; для отбора больных с метастазами, наиболее подходящих для таргетной фармакологической терапии.
NB! Биопсия почек не показана пациентам с сопутствующей патологией и ослабленным состоянием, которые могут рассматриваться только для консервативного лечения (бдительного ожидания) независимо от результатов биопсии.
УЗИ почек и забрюшинного пространства, УЗИ органов брюшной полости – выявление образования на начальной стадии, на основании которого решается дальнейшее углубленноео бследование;
ЭхоКГ – назначается паиентам с сопутствующей кардиальной патологией или подозрении на наличии тромба в предсердии;
УЗДГ сосудов почек и нижней полой вены (при подозрении на наличие тромба) и/или МРТ; для оценки распространения опухолевого тромба и состояние кровотока в исследуемой зоне;
УЗДГ сосудов нижних конечностей – при планировании оперативного вмешательства на опухоль почки для исключения тромбоза вен нижних конечностей;
УЗИ органов малого таза – оценка состояния органов малого таза;
Рентгенография органов грудной клетки в двух проекциях – для исключения легочных изменений при подготовке пациента к оперативному вмешательству;
МСКТ органов брюшной полости и забрюшинного пространства с болюсным усилением – назначается в качестве дообследования при выявлении на УЗИ образований неясной этиологии;
МРТ органов брюшной полости (с контрастированием) – для определения характера новообразования, изучения распространенности опухолевого тромба в нижнюю полую вену, если не удалось получить четкой информации при КТ исследовании; также показано пациентам с аллергией на внутривенный контраст, и беременным без нарушения функции почек;
КТ грудной клетки – необходимо для уточнения распространенности процесса в легкие, плевру, кости грудной клетки;
КТ органов малого таза – в случае невозможности поведения МРТ исследования (по причине металлических имплантов у пациента, установленный кардиостимулятор и т.д.);
КТ головного мозга – при подозрении на мтс в головной мозг, при наличии любой мозговой симптоматики, так как одной из частых локализаций мтс при ПКР является головной мозг.
Рекомендации [17]:
|
Рекомендация
|
Градация рекомендации |
| Для диагностики и определения стадии опухолей почек используйте многофазную компьютерную томографию с контрастным усилением брюшной полости и грудной клетки. | Сильная (Высокая) |
| Исключите КТ грудной клетки у пациентов со случайно выявленным заболеванием cT1a из-за низкого риска метастазов в легкие в этой когорте. | Слабая (Низкая) |
| Используйте магнитно-резонансную томографию, чтобы лучше оценить поражение вен, уменьшить облучение или отказаться от внутривенного введения контрастного вещества для КТ. | Слабая |
| Используйте неионизирующие методы, включая МРТ и ультразвук с контрастным усилением, для дальнейшей характеристики небольших почечных образований, тромбов опухоли и дифференциации неясных почечных образований, если результаты КТ с контрастным усилением неопределенны. | Сильная |
| Не следует регулярно использовать сканирование костей и/ или позитронно-эмиссионную томографию для определения стадии почечно-клеточного рака. | Слабая |
| Выполните биопсию опухоли почки перед абляционной терапией и системной терапией без предшествующей патологии. | Сильная |
| Выполните подкожную биопсию у избранных пациентов, которым рассматриваете возможность активного наблюдения. | Слабая |
| При проведении биопсии опухоли почки используйте коаксиальную технику. | Сильная |
| Не выполняйте биопсию опухоли почки при кистозных образованиях почек. | Сильная |
| Для гистологической характеристики солидных опухолей почек используйте метод базовой биопсии, а не тонкоигольную аспирацию. | Сильная |
Показания для консультации специалистов:
консультация кардиолога – всем пациентам старше 50 лет и при сопутствующей патологии со стороны ССС;
консультация гастроэнтеролога – при сопутствующих гастритах, язвенной болезни желудка;
консультация сосудистого хирурга – пациентам с варикозной болезнью нижних конечностей, а также с опухолевыми тромбами венозной системы почек;
консультация кардиохирурга – при наличии опухолевого тромба, уходящего в предсердие, или если в анамнезе у пациента имелись операции на сосудах сердца, кардиостимуляторы;
консультация невропатолога – при наличии мтс в головной мозг, спинной мозг, а также в случае, если пациент в анамнезе состоял на учете у невропатолога по поводу перенесенного инсульта, других неврологическихзаболеваний;
консультация пульмонолога/торакального хирурга – в случае если у больного сопутствующая патология со стороны легких, или мтс в легкие;
консультация эндокринолога – при наличии сахарного диабета или других эндокринных заболеваний.
Диагностический алгоритм:
Схема 1 - Первичная диагностика рака почки.

Схема 2 - Диагностика метастазов рака почки.

Дифференциальный диагноз
Дифференциальный диагноз [18]
Дифференциальная диагностика рака почки:
|
Диагноз
|
Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Солитарная киста почки | При наличии кист почек по классификации Босняк 3-4 категории показано хирургическое лечение как при раке почки |
МСКТ с болюсным усилением;
УЗИ;
Артериография
|
В дифференциальной диагностике опухоли и кисты почки может оказать помощь МСКТ с болюсным усилением, при которой опухоль почки контрастируется.
Более точное дифференцирование опухоли и кисты почки может быть проведено с помощью почечной артериографии.
На сканограммах (УЗИ) киста имеет капсулу с ровным контуром, внутри которого находится зона, свободная от эхосигналов.
Киста отличается пониженной контрастностью.
|
| Гидронефроз почек | При гидронефрозе прощупывают опухолевидное образование в подреберье, однако консистенция его тугоэластическая, поверхность гладкая, а гематурия отмечается редко. | Артериография | Пиелографическая картина гидронефротической трансформации резко отличается от деформации чашечно-лоханочной системы опухолью. На почечных артериограммах выявляют сужение просвета почечной артерии и ее ветвей. |
| Поликистоз почек | Поликистоз почек симулирует опухоль в случае его асимметрического развития, когда прощупывают только одну увеличенную плотную бугристую почку. Подозрение на наличие опухоли усиливается при гематурии. | Артериография |
Для поликистоза характерна хроническая почечная недостаточность той или иной стадии, а главное- патогномоничная пиелографическая картина двусторонних изменений, повышенная ветвистость чашечек, сдавление и удлинение лоханок. На артериограммах для поликистоза характерно наличие множества округлых бессосудистых участков и удлиненных истонченных
артерий.
|
| Гнойное воспаление почек | При карбункуле (реже абсцессе) почки подозрение на наличие опухоли обычно возникает в связи со сходной рентгенологической картиной при проведении экскреторной урографии (деформация, оттеснение чашечно- лоханочной системы, ампутация чашечек). | Артериография | Клинические и лабораторные признаки острого воспалительного процесса (лихорадка с ознобом, лейкоцитоз) не только не исключают опухоль почки, но и являются достаточно характерными ее симптомами. Ясность в дифференциальную диагностику в этих случаях вносит почечная артериография. |
| Туберкулез почки | При туберкулезе почки довольно рано появляются симптомы общего характера: потеря аппетита, слабость, субфебрильная температура и нерезкие боли в пояснице. В моче может определяться умеренная альбуминурия и микрогематурия (профузная макрогематурия встречается крайне редко). В дальнейшем при образовании и вскрытии каверны в лоханку исследование мочи дает картину пиурии и нефрита. В моче, помимо большого количества лейкоцитов, обнаруживаются эритроциты, цилиндры, белок. У больного могут появиться коликообразные боли вследствие отхождения комочков гноя и кровяных сгустков. Нередко присоединяются дизурические расстройства. | Большое значение имеет бактериологическое исследование мочи и биологическая проба | На обзорных снимках иногда можно в почке обнаружить очаги петрификации. При исследовании с контрастным веществом определяется снижение функции больной почки, умеренное расширение лоханки и верхнего отдела мочеточника, изъеденность, размытость очертаний почечных сосочков и чашечек, которые могут быть расширены: со стороны мочеточника можно обнаружить изменения в виде стриктур. Характерным признаком туберкулеза почки являются каверны в виде полости (неправильной округлой формы), которая может сообщаться с лоханкой. |
| Опухоль почки | Наличие объёмного образования в почке | КТ | Почечный рак на КТ визуализируется как объемное образование с гомогенной или неоднородной внутренней структурой, по плотности несколько выше или ниже нормальной паренхимы (±5-10 HU). При контрастном усилении рак почки в большинстве случаев характеризуется меньшим усилением плотности, чем нормальная паренхима. При этом почечно-клеточная карцинома, которая в 80 % гиперваскулярна, легко дифференцируется от почечной паренхимы |
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ: таргетная терапия распространенного/метастатического ПКР на амбулаторном уровне осуществляется через кабинет амбулаторной химиотеорапии.
Немедикаментозное лечение:
режим 3 (общий) свободный (минимизация воздействия повреждающих печень факторов - алкоголь, курение, воздействие гепатотоксичных лекарств и других веществ и т.д.);
диета – стол №7.
Медикаментозное лечение [24,25]: на амбулаторном уровне лечение распространенного/метастатического ПКР осуществляется через кабинет амбулаторной химиотеорапии, путем назначения таргетных препаратов.
Таргетная терапия
В настоящее время была доказана эффективность следующих таргетных препаратов для лечения мПКР: сунитиниб, сорафениб, пазопаниб, акситиниб, акситиниб в комбинации с пембролизумабом, акситиниб в комбинации с авелумабом, эверолимус, кабозатиниб, и ленватиниб (плюс эверолимус или пембролизумаб).
Иммунотерапия/ Комбинированная терапия.
|
Рекомендации
|
Градация рекомендаций |
| Системное лечение: 1 линия терапии светлоклеточного мПКР | |
| Пациенты с благоприятным прогнозом | |
| Комбинация Акситиниба и Пембролизумаба рекомендована в качестве 1-й линии терапии светлоклеточного мПКР пациентов группы благоприятного прогноза (УД-А) (Категория 1) | Высокая |
| Комбинация Акситиниба и Авелумаба рекомендована в качестве 1-й линии терапии светлоклеточного мПКР пациентов группы благоприятного прогноза (УД-B) (Категория 2A) | Высокая |
| Комбинация Кабозантиниба и Ниволумаба рекомендована в качестве 1-й линии терапии светлоклеточного мПКР пациентов группы благоприятного прогноза (УД-А) (Категория 1) | Высокая |
| Комбинация Ленватиниба и Пембролизумаба рекомендована в качестве 1-й линии терапии светлоклеточного мПКР пациентов группы благоприятного прогноза (УД-А) (Категория 1) | Высокая |
| Комбинация Ипилимумаба и Ниволумаба рекомендована в качестве 1-й линии терапии светлоклеточного мПКР пациентов группы благоприятного прогноза (УД-B) (Категория 2A) | Высокая |
|
Пазопаниб рекомендован в качестве 1-й линии терапии светлоклеточного мПКР у пациентов группы
благоприятного прогноза (УД-B) (Категория 2a)
|
Высокая |
| Сунитиниб рекомендован в качестве 1-й линии терапии светлоклеточного мПКР у пациентов группы благоприятного прогноза (УД-B) (Категория 2a) | Высокая |
|
Активное наблюдение за отдельными пациентами, бессимптомными пациентами со светло-клеточным ПКР в качестве опции у пациентов группы благоприятного прогноза (Категория 2a)
|
Высокая |
| Акситиниб рекомендован в качестве 1-й линии терапии светлоклеточного мПКР для использования у отдельных пациентов любой группы риска (благоприятного, промежуточного и плохого прогноза) (УД-С) (Категория 2B) | Низкая |
| Высокая доза IL2 в качестве 1-й линии терапии светлоклеточного мПКР для хорошо отобранных у пациентов группы благоприятного прогноза (УД-С) (Категория 2B) | Низкая |
| Пациенты с плохим/ промежуточным прогнозом | |
| Комбинация Акситиниба и Пембролизумаба рекомендована в качестве 1-й линии терапии светлоклеточного мПКР пациентов группы промежуточного и плохого прогноза (УД-А) (Категория 1) | Высокая |
| Комбинация Акситиниба и Авелумаба рекомендована в качестве 1-й линии терапии светлоклеточного мПКР пациентов группы промежуточного и плохого прогноза (УД-B) (Категория 2A) | Высокая |
| Комбинация Кабозантиниба и Ниволумаба рекомендована в качестве 1-й линии терапии светлоклеточного мПКР пациентов группы промежуточного и плохого прогноза (УД-А) (Категория 1) | Высокая |
| Комбинация Ипилимумаба* и Ниволумаба рекомендована в качестве 1-й линии терапии светлоклеточного мПКР пациентов группы промежуточного и плохого прогноза (УД-А) (Категория 1) | Высокая |
| Комбинация Ленватиниба и Пембролизумаба рекомендована в качестве 1-й линии терапии светлоклеточного мПКР пациентов группы промежуточного и плохого прогноза (УД-А) (Категория 1) Высокая | Высокая |
| Кабозантиниб в качестве 1-й линии терапии светлоклеточного мПКР пациентов группы промежуточного и плохого прогноза (УД-B) (Категория 2А) | Высокая |
| Пазопаниб рекомендован в качестве 1-й линии терапии светлоклеточного мПКР пациентов группы промежуточного и плохого прогноза (УД-B) (Категория 2А) | Высокая |
| Сунитиниб рекомендован в качестве 1-й линии терапии светлоклеточного мПКР пациентов группы промежуточного и плохого прогноза (УД-B) (Категория 2А) | Высокая |
| Акситиниб рекомендован в качестве 1-й линии терапии светлоклеточного мПКР для использования у отдельных пациентов промежуточного и плохого прогноза) (УД-C) (Категория 2B) | Низкая |
| Высокая доза IL2 в качестве 1-й линии терапии светлоклеточного мПКР для хорошо отобранных пациентов с рецидивом заболевания (релапс) или неоперабельной опухолью IV стадии мПКР (УД-Д) (Категория 3) | Низкая |
| Темсиролимус рекомендован в 1-й линии терапии светлоклеточного мПКР пациентов группы плохого прогноза с рецидивом заболевания (релапс) или неоперабельной опухолью IV стадии мПКР (УД-А) (Категория 1) | Высокая |
| Системное лечение: последующие линии терапии светлоклеточного мПКР | |
| Кабозантиниб рекомендован пациентам светлоклеточным мПКР в качестве последующей терапии после 1-й линии VEGF-таргетной терапии (УД-А) (Категория 1) | Высокая |
| Комбинация Ленватиниба с Эверолимусом рекомендована пациентам со светлоклеточным мПКР в качестве последующей терапии (УД-А) (Категория 1) | Высокая |
| Ниволумаб рекомендован пациентам со светлоклеточным мПКР в качестве последующей терапии (УД-А) (Категория 1) | Высокая |
| Акситиниб рекомендован пациентам со светлоклеточным мПКР в качестве последующей терапии (УД-А) (Категория 1) | Высокая |
| Комбинация Акситиниба и Пембролизумаба рекомендована пациентам со светлоклеточным мПКР в качестве последующей терапии (УД-B) (Категория 2A) | Высокая |
| Комбинация Кабозатиниба и Ниволумаба рекомендована пациентам со светлоклеточным мПКР в качестве последующей терапии (УД-B) (Категория 2A) | Высокая |
| Комбинация Ипилимумаба и Ниволумаба рекомендована пациентам со светлоклеточным мПКР в качестве последующей терапии(УД-B) (Категория 2A) | Высокая |
| Комбинация Ленватиниба и Пембролизумаба рекомендована пациентам со светлоклеточным мПКР в качестве последующей терапии (УД-B) (Категория 2A) | Высокая |
| Пазопаниб рекомендован пациентам со светлоклеточным мПКР в качестве последующей терапии (УД-B) (Категория 2A) | Высокая |
| Сунитиниб рекомендован пациентам со светлоклеточным мПКР в качестве последующей терапии (УД-B) (Категория 2A) | Высокая |
| Тивозаниб рекомендован пациентам со светлоклеточным мПКР в качестве последующей терапии (УД-B) (Категория 2A) | Высокая |
| Комбинация Акситиниба и Авелумаба рекомендована пациентам со светлоклеточным мПКР в качестве последующей терапии (УД-С) (Категория 3) | Низкая |
| Эверолимус рекомендован пациентам со светлоклеточным мПКР в качестве последующей терапии (УД-B) (Категория 2A) | Высокая |
| Бевацизумаб рекомендован пациентам со светлоклеточным мПКР в качестве последующей терапии (УД-C) (Категория 2B) | Высокая |
| Высокая доза IL2 рекомендована пациентам со светлоклеточным мПКР в качестве последующей терапииу хорошо отобранных у пациентов (УД-С) (Категория2B) | Низкая |
|
Сорафениб НЕ рекомендуется пациентам с светлоклеточным мПКР в качестве первой линии, но остается доступной опцией у пациентов в качестве последующей терапии (УД-D) (Категория 3)
|
Низкая |
| Темсиролимус рекомендован пациентам со светлоклеточным мПКР в качестве последующей терапии (УД-С) (Категория2B) | Низкая |
| Системная терапия несветлоклеточного мПКР | |
| Сунитиниб рекомендован у пациентов, ранее не получавших лечение, со стадией IV несветло-клеточного мПКР в качестве предпочитаемого режима (УД-B) (Категория 2А) | Высокая |
| Кабозатиниб рекомендован у пациентов с несветлоклеточным ПКР (УД-B) (Категория 2А) | Высокая |
| Комбинация Ленватиниба и Эверолимуса может быть рекомендована при определенных условиях пациентам с несветлоклеточным ПКР (УД-B) (Категория 2А) | Высокая |
| Ниволумаб рекомендован у пациентов с несветлоклеточным ПКР (УД-B) (Категория 2А) | Высокая |
| Пембролизумаб рекомендован у пациентов с несветлоклеточным ПКР (УД-B) (Категория 2А) | Высокая |
| Акситиниб рекомендован у пациентов с несветлоклеточным ПКР (УД-B) (Категория 2А) | Высокая |
| Химиотерапия может быть рекомендована в качестве опции терапии для пациентов с светлоклеточным и несветлоклеточным мПКР с преимущественно саркоматоидным типом в режиме; гемцитабином в комбинации с доксорубицином или сунитинибом | |
| Сорафениб НЕ рекомендуется у пациентов IV стадией плоскоклеточного мПКР (УД-B) (Категория 2B) | Низкая |
*В соответствии с правилами применения незарегистрированных ЛС.
Иммунотерапия/ Комбинированная терапия.
Монотерапия интерфероном-α и в комбинации с бевацизумабом, была заменена на стандартное лечение таргетными препаратами распространенного светло-клеточного мПКР. В некоторых случаях рекомендуется назначение иммунотерапия (интерферон-альфа, интерлейкин-2), но показания к ним ограничены (см. ниже). Ингибирование рецептора (PD-1) и лиганда (PD-L1) было исследовано при мПКР. Рандомизированные исследования подтверждают использование ниволумаба (PD-1 ингибитора) при резистентном к VEGF заболевании. Комбинация двух ингибиторов иммунных контрольных точек: ипилимумаба и ниволумаба показали улучшение выживаемости в группах среднего и низкого риска, в то время как комбинация пембролизумаба и акситиниба показала преимущество в выживаемости пациентов во всех группах риска.
Таблица 4 –Прогностические критерии выживаемости, при поздних стадиях почечно-клеточного рака по Мотцеру.
Таблица 5 –Прогностические критерии для таргетной терапии
Первая линия терапии светлоклеточного мПКР (Категория 2А)
Факторы прогноза для таргетной терапии.
Пациенты с распространённым светлоклеточным ПКР представляют собой разнородную в прогностическом отношении группу (табл.4)
Таблица 4 –Прогностические критерии выживаемости, при поздних стадиях почечно-клеточного рака по Мотцеру.
|
Факторы риска
|
Группы согласно риску |
|
Время от момента установления диагноза до начала терапии <12 мес;
Общее состояние по шкале Карновского < 80;
Лактатдегидрогеназа- в 1,5 раза больше верхней границы нормального диапазона
Откорректированное значение уровня кальция в сыворотке крови- >10,0 мг/дл (2,4 ммоль/л) 10,0 мг/дл (2,4 ммоль/л) Гемоглобин меньше нижней границы референтного диапазона значений
|
Низкий уровень риска - отсутствие факторов риска; умеренный риск—1 или 2 прогностических фактора;
высокий риск—3 фактора риска и более
|
Таблица 5 –Прогностические критерии для таргетной терапии
|
Факторы риска
|
Группы согласно риску |
|
Время от момента установления диагноза до начала терапии <12 мес;
Общее состояние по шкале Карновского < 80;
Уровень гемоглобина < нижней границы нормы (ВГН) (Норма: 120 г/л);
Концентрация скорректированного Са2+ в сыворотке крови >верхней границы нормы (Норма:8.5-10 мг/дл);
Уровень нейтрофилов > верхней границы нормы (ВГН)(Норма: 2,0-7,0*106/л;
Число тромбоцитов > верхней границы нормы ВГН. (Норма: «150000-400000).
|
Благоприятный-отсутствие факторов риска;
Промежуточный- умеренный риск—1 или 2 прогностических фактора;
Высокий риск—3 фактора риска и более.
|
Первая линия терапии светлоклеточного мПКР (Категория 2А)
|
Группа прогноза IMDC
|
Предпочтительные режимы | Альтернативные режимы | У отдельных пациентов |
| Благоприятный прогноз |
Акситиниб + Пембролизумаб (Категория 1);
Акситиниб+Авелумаб
Кабозатиниб +ниволумаб (Категория 1)
Ленватиниб +Пембролизумаб (Категория 1)
|
Кабозантиниб (Категория 2B)
Ипилимумаб+ Ниволумаб
Пазопаниб
Сунитиниб
|
Активное наблюдение
Акситиниб (Категория 2B)
Высокая доза IL-2 (Категория 2B)
|
| Промежуточный и неблагоприятный прогноз |
Акситиниб+ Пембролизумаб (Категория 1)
Акситиниб+Авелумаб
Кабозантиниб+ниволумаб (Категория 1)
Ипилимумаб+ниволумаб (Категория 1)
Ленватиниб + пембролизумаб (Категория 1)
Кабозатиниб
|
Пазопаниб
Сунитиниб
|
Акситиниб (Категория 2В)
Высокая доха IL-2 (Категория 3)
Темзиролимус (Категория 3) |
Последующая терапия светлоклеточного мПКР
|
Предпочтительные режимы
|
Альтернативные режимы | У отдельных пациентов |
|
Кабозатиниб (Категория 1)
Ленватиниб+эверолимус (Категория 1)
Ниволумаб (Категория 1)
|
Акситиниб (Категория 1)
Акситиниб+ Пембролизумаб Акситиниб+Авелумаб
(Категория 3)
Кабозантиниб+ниволумаб
Ипилимумаб+ниволумаб
Ленватиниб + пембролизумаб
Пазопаниб
Сунитиниб
Тивозаниб
Кабозатиниб
|
Эверолимус
Бевацизумаб (Категория 2B)
Высокая доза IL-2 (Категория 2B)
Сорафениб (Катешория 3)
Темзиролимус (Категория 2B)
|
Алгоритм выбора режима лекарственной терапии у больных ПКР.
В первой линии терапии светлоклеточного ПКР (сПКР) группы хорошего прогноза предпочтительно проведение комбинации пембролизумаб плюс акситиниб, Акситиниб+Авелумаб; Кабозатиниб+ниволумаб; Ленватиниб+Пембролизумаб (Категория 1). Терапия кабозатинибом, комбинация ипилимумаба и ниволумаба, пазотиниб и сунитиниб используются в качестве альтернативного варианта, у отдельных пациентов акситиниб. В первой линии терапии сПКР групп промежуточного и неблагоприятного прогноза предпочтительно назначение ниволумаба в комбинации с ипилимумабом, пембролизумаба в комбинации с акситинибом, комбинацции авелумаба с акситинибом, комбинации кабозатиниба с ниволумабом, кабозантиниба. В качестве возможной опции с меньшим уровнем доказательности может рассматриваться назначение пазотиниба и сунитиниба. При использовании комбинации «пембролизумаб + акситиниб» частота нежелательных явлений (3–4 ст.) может достигать 63 %. При использовании комбинации «ниволумаб + ипилилумаб» частота имму ноопосредованных нежелательных явлений (3–4 ст.) увеличивается до 46 %. У отдельных пациентов с меньшим уровнем доказательности для пациентов группы неблагоприятного прогноза может рассматриваться назначение темсиролимуса, имеющих противопоказания или непереносимость при использовании режимов предпочтения или альтернативного режима, допускается назначение сунитиниба или пазопаниба. Больным сПКР, у которых развилась резистентность к антиангиогенной терапии тирозинкиназными ингибиторами или терапии к анти-VEGF антителам, предпочтительно назначение ниволумаба или кабозантиниба. В качестве альтернативы возможно проведение терапии комбинацией ленватиниба с эверолимусом или назначение акситиниба. Частота нежелательных явлений 3–4 ст. при использовании кабозантиниба или комбинации ленватиниба с эверолимусом может достигать 70 % и требует тщательного мониторинга переносимости терапии. У отдельных пациентов, имеющих противопоказания к использованию режимов предпочтения или альтернативного режима во второй линии, допускается назначение эверолимуса. Больным сПКР с резистентностью к цитокиновой терапии предпочтительно назначение акситиниба или пазопаниба*. В качестве альтернативы возможно назначение сунитиниба. У отдельных пациентов, имеющих противопоказания или непереносимость при использовании режимов предпочтения или альтернативного режима, допускается назначение сорафениба. При резистентности к комбинации «ниволумаб + ипилилумаб» возможно назначение тирозинкиназных ингибиторов.
Системная терапия несветлоклеточного мПКР (категория 2А)
Системная терапия метастатического ПКР
Несветлоклеточный рак почки.
Лекарственная терапия несветлоклеточного ПКР (нПКР) не изучалась в рандомизированных исследованиях III фазы. В программах расширенного доступа было показано, что прогноз больных нПКР хуже, чем у пациентов со светлоклеточными опухолями. Имеются данные об эффективности темсиролимуса, эверолимуса, сунитиниба и сорафениба при нПКР. На основании результатов систематического анализа, включившего данные небольших исследований 2 фазы (ESPN, RECORD-3 и ASPEN), сунитиниб и, в меньшей степени, эверолимус остаются предпочтительными опциями для лечения этой группы пациентов. При раке из собирательных трубочек возможно назначение ХТ с включением цисплатина (карбоплатина) и гемцитабина. При ПКР с преобладанием саркоматоидного компонента комбинация пембролизумаба c акситинибом по результатам подгруппового анализа демонстрирует максимальную эффективность.
Системная терапия несветлоклеточного мПКР (категория 2А)
|
Предпочтительные режимы
|
Альтернативные режимы | У отдельных пациентов |
|
Сунитиниб
Кабозатиниб
Клинические исследования
|
Ленватиниб+ эверолимус Ниволумаб
Пембролизумаб
|
Акситиниб
Бевацизумаб
Бевацизумаб+эрлотиниб для хорошо отобранных пациентов с распространенным папиллярным ПКР, включая наследственную лейоматозом и HLRCC-associated RCC
Бевацизумаб+эверолимус
Эрлотиниб
Эверолимус
Пазопаниб
Темзиролимус (Категория 1 для пациентов с плохим прогнозом; категория 2А для других групп риска)
|
Рекомендации EAU-2021
Системная терапия метастатического ПКР
Иммунотерапия
Монотерапия интерфероном-α в комбинации с бевацизумабом была вытеснена терапией таргетными препаратами и стала стандартом лечения светлоклеточного распространенного мПКР. Ингибирование рецептора запрограммированной смерти через иммунную контрольную точку (PD-1) и лиганда (PD-L1) было исследовано при мПКР. Рандомизированные данные подтверждают использование ниволумаба (PD-1 ингибитор) при резистентном к VEGF заболевании. Сочетание двух ингибиторов иммунных контрольных точек: ипилимумаб и ниволумаб показали превосходящую выживаемость в группах промежуточного и плохого прогноза, в то время как комбинация пембролизумаба и акситиниба показала преимущество в выживаемости пациентов во всех группах риска.
Таргетная терапия
Таблица: Обновленные рекомендации EAU для лечения мПКР первой линии
|
Доказательство
|
Уровень доказательности |
| Монотерапия интерфероном-α уступает таргетной терапии ингибиторами VEGF или (mTOR) ингибиторами при мПКР. | 1b |
| Ниволумаб обеспечивает лучшую ОВ по сравнению с эверолимусом у пациентов, не получивших одну или две линии анти-VEGF-ингибиторами. | 1b |
| Комбинация ниволумаба и ипилимумаба у пациентов со светлоклеточным мПКР, не получавших лечения, промежуточного и плохого прогноза по IMDC продемонстрировала преимущества по ОВ и ЧОО по сравнению с терапией сунитинибом. | 1b |
| Комбинация пембролизумаб плюс акситиниб, авелумаб* плюс акситиниб, ленватиниб плюс пембролизумаб и ниволумаб плюс кабозантиниб у пациентов со светлоклеточным мПКР, не получавших лечения, во всех группах риска по IMDC продемонстрировала преимущества ВБП, ОВ и ЧОО по сравнению с сунитинибом. | 1b |
| В настоящее время статус экспрессии PD-L1 не используется для выбора пациентов. | 2b |
| Акситиниб, кабозантиниб или ленватиниб можно продолжить, если побочные эффекты, связанные с иммунной системой, приводят к прекращению лечения комбинацией акситиниб плюс пембролизумаб, авелумаб* плюс акситиниб, кабозантиниб плюс ниволумаб или ленватиниб плюс пембролизумаб. Для повторного лечения иммуноонкологическими препаратами требуется экспертной поддержки. | 4 |
| Пациентам, которые не получили полные 4 дозы ипилимумаба из-за токсичности, следует продолжать монотерапию ниволумабом там, где это безопасно и возможно. Для повторного проведения комбинированной терапии требуется экспертная поддержка. | 4 |
| Лечение после прогрессирования может быть оправдано, но требует внимательного изучения и экспертной поддержки многопрофильной команды. | 1b |
| Ниволумаб плюс ипилимумаб, пембролизумаб плюс акситиниб, авелумаб плюс акситиниб, ниволумаб плюс кабозантиниб и ленватиниб плюс пембролизумаб следует назначать в центрах с опытом лечения комбинациями иммунными препаратами и соответствующей поддерживающей терапии в составе многопрофильной команды. | 4 |
| Комбинация ниволумаба и ипилимумаба у пациентов со светлоклеточным мПКР промежуточного и плохого прогноза по IMDC, не получавших лечения, продемонстрировала лучшую выживаемость по сравнению с сунитинибом, при этом у пациентов с благоприятным прогнозом, ОВ была выше на терапии сунитинибом | 2b |
| Комбинация Ниволумаб плюс ипилимумаб ассоциировалась с токсичностью 3-5 степени у 15%и смертей, связанных с лечением, у 1,5% пациентов. | 1 |
| Рекомендуется комбинация пембролизумаб плюс акситиниб, авелумаб плюс акситиниб, ленватиниб плюс пембролизумаб или ниволумаб плюс кабозантиниб для лечения пациентов с метастатической светлоклеточной ПКР любого риска, ранее не проходивших лечение | Сильная |
| Рекомендуется комбинация ипилимумаб плюс ниволумаб для лечения пациентов с метастатической светлоклеточной ПКР промежуточного и плохого прогноза, ранее не проходивших лечение | Сильная |
| Комбинации ниволумаб плюс ипилимумаб, пембролизумаб плюс акситиниб, авелумаб плюс акситиниб, ленватиниб плюс пембролизумаб и ниволумаб плюс кабозантиниб следует назначать в центрах с опытом лечения комбинациями иммунными препаратами и соответствующей поддерживающей терапии в составе многопрофильной команды. | Слабая |
| Пациентам, не получившие полные 4 дозы ипилимумаба из-за токсичности, следует продолжить прием монотерапии ниволумабом, где это безопасно и возможно | Слабая |
| Рекомендуется терапия акситинибом, кабозантинибом или пациентам, которые испытывают побочные эффекты связанные с иммунитетом, ограничивающие лечение, после лечения с комбинацией акситиниб плюс пембролизумаб, авелумаб плюс акситиниб, кабозантиниб плюс ниволумаб или ленватиниб плюс пембролизумаб. | Слабая |
| Лечение после прогрессирования может быть оправдано, но требует внимательного изучения и экспертной поддержки многопрофильной команды. | Слабая |
| Не рекомендовано повторное лечение иммунноонкологическими препаратами, которое было прекращено в связи с токсичностью, без экспертной поддержки и поддержки многопрофильной команды. | Сильная |
| Рекомендуются сунитиниб или пазопаниб* пациентам со светлоклеточным мПКР промежуточного и плохого прогноза по IMDC, не получавших лечения, которые не могут получить или не переносят лечение иммунноонкологическими препаратами | Сильная |
| Рекомендуется кабозантиниб пациентам со светлоклеточным мПКР промежуточного и плохого прогноза по IMDC, не получавших лечения, которые не могут получить или не переносят лечение иммунноонкологическими препаратами | Сильная |
Хотя это основано на рандомизированном исследовании фазы II, кабозантиниб (слабый) продемонстрировал результаты не хуже сунитиниба IMDC = Международный консорциум баз данных метастатического рака почки.
Таргетная терапия
|
Доказательство
|
Уровень доказательности |
| Монотерапия, направленная на ингибирование VEGF, была заменена комбинированной терапией с иммуноонколгическими препаратами. | 1b |
| Пазопаниб* не уступает сунитинибу в терапии первой линии мПКР. | 1b |
| Кабозантиниб у пациентов со светлоклеточным мПКР промежуточного и плохого прогноза по IMDC, не получавших лечения, демонстрирует лучшие результаты по ВБП но не ОС по сравнению с сунитинибом. | 2b |
| Тивозаниб был одобрен EMA, но доказательства по-прежнему считаются более низкого уровня по сравнению с существующими вариантами терапии | 3 |
| Тивозаниб был одобрен EMA, но доказательства по-прежнему считаются более низкого уровня по сравнению с существующими вариантами терапии | 3 |
| Монотерапия Кабозантинибом или ниволумабом превосходит терапию эверолимусом после одной или нескольких линий терапии анти-VEGF-препаратами. | 1b |
| Эверолимус продлевает ВБП после терапии, анти-VEGF-препаратами по сравнению с плацебо. Данное лечение больше широко не рекомендуется перед терапией третьей линии. | 1b |
| Терапия ингибиторами mTOR, и анти- VEGF препаратами имеет ограниченную активность при несветлоклеточом мПКР. Не наблюдается значительного улучшения онкологических исходов для сунитиниба в сравнении с эверолимусом. | 2а |
| Ленватиниб в комбинации с эверолимусом улучшил ВБП по сравнению с монотерапией эверолимусом при резистентном к VEGF заболевании. Его роль после ингибиторов иммунных ответа неясна. Нет надежных данных по данной комбинации, вследствие чего рекомендовать ее – сложная задача. | 2а |
| Рекомендуются ниволумаб или кабозантиниб пациентам, не принимавшим ингибиторы контрольных точкек, для лечения пациентов с метастатической светлоклеточной ПКР, рефрактерном к анти VEGFR -препаратам после первой или двух линий терапии. | Сильная |
| Рекомендовано секвенирование, не проводившееся при терапии второй линии (ниволумаб или кабозантиниб), при терапии третьей линии. | Слабая |
| Рекомендуются ингибиторы VEGF-тирозинкиназы как терапия второй линии для пациентов, рефрактерных к ниволумабу плюс ипилимумаб или акситиниб плюс пембролизумаб или кабозантиниб плюс ниволумаб или ленватиниб плюс пембролизумаб. | Слабая |
| Рекомендуется кабозантиниб после таргетной терапии анти- VEGF агентами при светлоклеточном мПКР | Сильная |
| Рекомендуется последовательность системной терапии в лечении мПКР. | Сильная |
IMDC = Международный консорциум баз данных метастатического рака почки.
Таблица: Обновленные рекомендации EAU для лечения мПКР первой линии
|
Группа прогноза IMDC
|
Стандарт лечения | Альтернативное лечение у пациентов, которые не могут получать или не переносят терапию ингибиторами контрольных точек иммунного ответа |
| Благоприятный прогноз по IMDC |
Кабозантиниб+ниволумаб (1b)
Акситиниб+ Пембролизумаб(1b)
Ленватиниб+ пембролизумаб(1b)
Акситиниб+Авелумаб(1b)
|
Пазопаниб(1b)
Сунитиниб(1b)
У отдельных пациентов
Акситиниб
|
| Промежуточный и неблагоприятный прогноз по IMDC |
Кабозантиниб+ниволумаб (1b)
Акситиниб+ Пембролизумаб(1b)
Ленватиниб+ пембролизумаб(1b)
Акситиниб+Авелумаб(1b)
Ипилимумаб+ниволумаб (1b)
|
Сунитиниб (1b)
Пазопаниб(1b)
Кабозатиниб(2a)
|
IMDC = Международный консорциум баз данных метастатического рака почки.
пазопаниб только для лечения заболеваний среднего риска.
[1b] = на основе одного рандомизированного контролируемого исследования III фазы.
[2a] = на основе одного рандомизированного контролируемого исследования фазы II
Ведение ПКР с помощью неоадъювантной и адъювантной терапии
|
Группа прогноза IMDC
|
Стандарт лечения | Альтернативное лечение |
| Предыдущая терапия иммуноонкологическими препараитами |
Кабозантиниб+ниволумаб (1b)
Акситиниб+ Пембролизумаб(1b)
Ленватиниб+ пембролизумаб(1b)
Акситиниб+Авелумаб(1b)
|
Пазопаниб(1b)
Сунитиниб(1b)
У отдельных пациентов
Акситиниб
|
| Предыдущая терапия ИТК |
Ниволумаб (1b)
Кабозантиниб (1b)
|
Акситиниб (2b) |
IO = иммунотерапия;
TKI = ингибиторы тирозинкиназы;
VEGF = фактор роста эндотелия сосудов.
[1b] = на основе одного рандомизированного контролируемого исследования III фазы.
[2b] = анализ подгрупп рандомизированной контролируемой фазы III.
[4] = мнение эксперта.
Ведение ПКР с помощью неоадъювантной и адъювантной терапии
|
Доказательство: резюме
|
Уровень доказательности |
| Адъювантная терапия не улучшает выживаемость после нефрэктомия | 1b |
| В одном рандомизированном контролируемом исследовании с участием отобранных пациентов из группы высокого риска: сунитиниб в режиме адъювантной терапии улучшил выживаемость без прогреессирования (ВБП), но не общую выживаемость (ОВ) | 1b |
| Сорафениб, пазопаниб, эверолимус, гирентуксимаб или акситиниб в режиме адъювантной терапии не улучшает ВБП или ОВ после нефрэктомии. | 1b |
| Адъювантные РКИ продолжаются для оценки преимуществ адъювантной иммунотерапия после нефрэктомии у пациентов с высоким риском. | 1b |
| Не предлагайте адъювантную терапию сорафенибом, пазопанибом, эверолимусом, гирентуксимабом или акситинибом. | Сильная |
| Не предлагайте сунитиниб в режиме адъювантной терапии после хирургически удаления светлоклеточного ПКР высокого риска. | Слабая |
Режимы таргетной и иммуно-таргетной терапии:
1. Комбинация Пембролизумаб + Акситиниб - Пембролизумаб 200 мг в / в капельно каждые 3 нед. в комбинации с акситинибом 5 мг × 2 раза в день.
2. Комбинация Авелумаб + акситиниб – 28 дневный курс, Авелумаб 800 мг в / в капельно на 1 и 15 день в комбинации с акситинибом 5 мг × 2 раза в день.
3. Авелумаб 800 мг внутривенно в течение 60 минут каждые 2 недели, длительно до прогрессирования или возникновения неприемлемых токсических эффектов. Перед первыми 4 инфузиями препарата авелумаб пациенту следует провести премедикацию антигистаминными средствами и парацетамолом. Если четвертая инфузия завершается без развития инфузионных реакций, премедикация перед введением последующих доз назначается по усмотрению врача.
4. Сунитиниб - 50мг перорально ежедневно в течение 4 недель, затем перерыв 2 нед. При тяжелой переносимости сократить режим приема до 2 недель и затем 1 неделя перерыв.
5. Сорафениб по 400мг перорально 2 раза в сутки (утром и вечером) – суточная доза 800мг, ежедневно. Возможна редукция дозы до 400 и 200 мг в сутки (при тяжелых побочныхэффектах).
6. Эверолимус 10мг ежедневно однократно перорально. При появлении признаков плохой переносимости возможно снижение дозы на 2 уровня – 5мг ежедневно перорально однократно, 5мг 1 раз в 2 дня.
7. Пазопаниб 800 мг перорально 1 раз в сутки. В зависимости от индивидуальной переносимости суточная доза препарата может быть уменьшена с шагом 200 мг, при этом максимальная суточная доза не должна превышать 800 мг и минимальная суточная доза не должна быть меньше 400мг.
8. Акситиниб–по 5 мг 2 раза в сутки, перорально. Начальная доза акситиниба – 5 мг × 2 раза в день, при отсутствии токсических осложнений III–IV степени в течение первых двух недель приема производится эскалация дозы препарата до 7 мг × 2 раза в день (в течение последующих двух недель) и далее – до 10 мг × 2 раза в день.
9. Ленватиниб – пероральный ингибитор тирозинкиназ, избирательно подавляющийкиназную активность VEGFR1, VEGFR2 и VEGFR3, FGFR1, FGFR2, FGFR3 и FGFR4,PDGFR-α, а также рецепторы тирозинкиназKITиRET. Рекомендованная суточная дозапрепарата составляет 18 мг 1 раз в сутки (в сочетании с Эверолимусом 5 мг 1 разв сутки, препараты принимаются внутрь ондовременно).
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
Дальнейшее ведение:
В зависимости от наличия новых эффективных методов лечения, могут потребоваться более интенсивные графики последующего наблюдения, особенно потому, что частота местных рецидивов выше после криотерапии и РЧА.
Пример алгоритма наблюдения за пациентами после лечения ПКР, включающий не только профиль риска пациента, но и эффективность лечения представлена в таблице 7. Для пациентов с метастатическим заболеванием, показано индивидуальное наблюдение (схема 2 - Диагностика метастазов рака почки).
Таблица 7. Предлагаемый график наблюдения после лечения ПКР с учетом профиля риска пациента и эффективности лечения
10. Темсиролимус - В/в, капельно 25 мг в течение 30–60 мин 1 раз в неделю.Лечение следует продолжать до тех пор, пока подтверждается клиническая эффективность или пока не регистрируется недопустимая токсичность.
11. Кабозатиниб - 140 мг один раз в сутки перорально. На голодный желудок, можно есть за 2 часа до или через 1 час после приема Кабозатиниба.
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
| Фармакотерапевтическая группа | Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Ингибитор протеинтирозинкиназы | Сунитиниб | 50мг перорально ежедневно в течение 4 недель, затем перерыв 2 нед. При тяжелой переносимости сократить режим приема до 2 недель и затем 1 неделя перерыв. | Высокая |
| Ингибитор протеинтирозинкиназы | Сорафениб | 400мг перорально 2 раза в сутки (утром и вечером) – суточная доза 800мг, ежедневно. Возможна редукция дозы до 400 и 200 мг в сутки (при тяжелых побочныхэффектах). | Высокая |
| Ингибитор протеинкиназы | Эверолимус | 10мг ежедневно однократно перорально. При появлении признаков плохой переносимости возможно снижение дозы на 2 уровня – 5мг ежедневно перорально однократно, 5мг 1 раз в 2 дня. | Высокая |
| Ингибитор тирозинкиназ | Пазопаниб | 800 мг перорально 1 раз в сутки. В зависимости от индивидуальной переносимости суточная доза препарата может быть уменьшена с шагом 200 мг, при этом максимальная суточная доза не должна превышать 800 мг и минимальная суточная доза не должна быть меньше 400мг. | Высокая |
| Ингибитор ирозинкиназ | Акситиниб | 5 мг 2 раза в сутки, перорально. Начальная доза акситиниба – 5 мг × 2 раза в день, при отсутствии токсических осложнений III–IV степени в течение первых двух недель приема производится эскалация дозы препарата до 7 мг × 2 раза в день (в течение последующих двух недель) и далее – до 10 мг × 2 раза в день. | Высокая |
| Ингибитор тирозинкиназ | Ленватиниб | 18 мг 1 раз в сутки (в сочетании с Эверолимусом 5 мг 1 разв сутки, препараты принимаются внутрь ондовременно). | Высокая |
| Ингибитор тирозинкиназ | Кабозатиниб | 140 мг один раз в сутки | Высокая |
Хирургическое вмешательство: нет.
Дальнейшее ведение:
Наблюдение после лечения ПКР позволяет урологу оценивать:
• послеоперационные осложнения;
• почечную функцию;
• местный рецидив;
• рецидив в контралатеральной почке;
• развитие метастазов.
В зависимости от наличия новых эффективных методов лечения, могут потребоваться более интенсивные графики последующего наблюдения, особенно потому, что частота местных рецидивов выше после криотерапии и РЧА.
Пример алгоритма наблюдения за пациентами после лечения ПКР, включающий не только профиль риска пациента, но и эффективность лечения представлена в таблице 7. Для пациентов с метастатическим заболеванием, показано индивидуальное наблюдение (схема 2 - Диагностика метастазов рака почки).
Таблица 7. Предлагаемый график наблюдения после лечения ПКР с учетом профиля риска пациента и эффективности лечения
|
Профиль риска
|
Онкологическое наблюдение после даты операции | ||||||||
| 3 мес | 6 мес | 12 мес | 18 мес | 24 мес | 30 мес | 36 мес | > 3 года | > 5 лет (по желанию) | |
| Низкий риск рецидива | - | КТ | - | КТ | - | КТ | - | КТ каждые два года | - |
| Средний риск рецидива | - | КТ | КТ | - | КТ | - | КТ | КТ каждый год | КТ каждые два года |
| Высокий риск повторение | КТ | КТ | КТ | КТ | КТ | - | КТ | КТ каждый год | КТ каждые два года |
КТ = компьютерная томография грудной клетки и брюшной полости, в качестве альтернативы используйте магнитно-резонансную томографию для брюшной полости;
УЗИ = УЗИ брюшной полости, почек и почечного ложа.
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе:
«ответ опухоли» - регрессия опухоли после проведенного лечения;
Полный эффект – исчезновение всех очагов поражения на срок не менее 4х недель.
Частичный эффект – большее или равное 50% уменьшение всех или отдельных опухолей при отсутствии прогрессирования других очагов.
Стабилизация – (без изменений) уменьшение менее чем на 50% или увеличение менее чем на 25% при отсутствии новых очагов поражения.
Прогрессирование – увеличение размеров одной или более опухолей более 25% либо появление новых очагов поражения[7] (УД – А):
безрецидивная выживаемость (трех и пятилетняя);
«качество жизни» включает кроме психологического, эмоционального и социального функционирования человека, физическое состояние организма больного.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ
Карта наблюдения пациента, маршрутизация пациента.
Рисунок 2.
Немедикаментозное лечение
режим 1 (постельный) первые сутки после операции;
режим 2 (полупостельный) 2-3 сутки после операции;
режим 3 (общий) свободный режим;
диета – стол №7.
Медикаментозное лечение: на стационарном уровне проводится в условиях круглосуточного стационара или стационара дневного пребывания. Используются препараты, предназначенные для иньекционного введения (таргетная терапия или лечение иммуноонкологическими препаратами).
Перечень дополнительных лекарственных средств (имеющих 100% вероятность применения).
|
Лекарственная группа
|
Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Ингибитор протеинкиназы | Темсиролимус* | В/в, капельно 25 мг в течение 30–60 мин 1 раз в неделю. | Высокая |
| Ингибитор PD-1, моноклональное антитело | Пембролизумаб | 200 мг в / в капельно каждые 3 нед. в комбинации с акситинибом 5 мг × 2 раза в день. | Высокая |
| Ингибитор PD-L-1, моноклональное антитело | Авелумаб | 800 мг в / в капельно на 1 и 15 день в комбинации с акситинибом 5 мг × 2 раза в день. | Высокая |
* В соответствии с правилами применения незарегистрированных ЛС.
Хирургическое вмешательство
Цели лечения:
радикальное удаление опухоли;
удаление первичного очага;
стабилизация частичная или полная регрессии опухоли;
улучшение общегосостояния;
увеличение общей выживаемости.
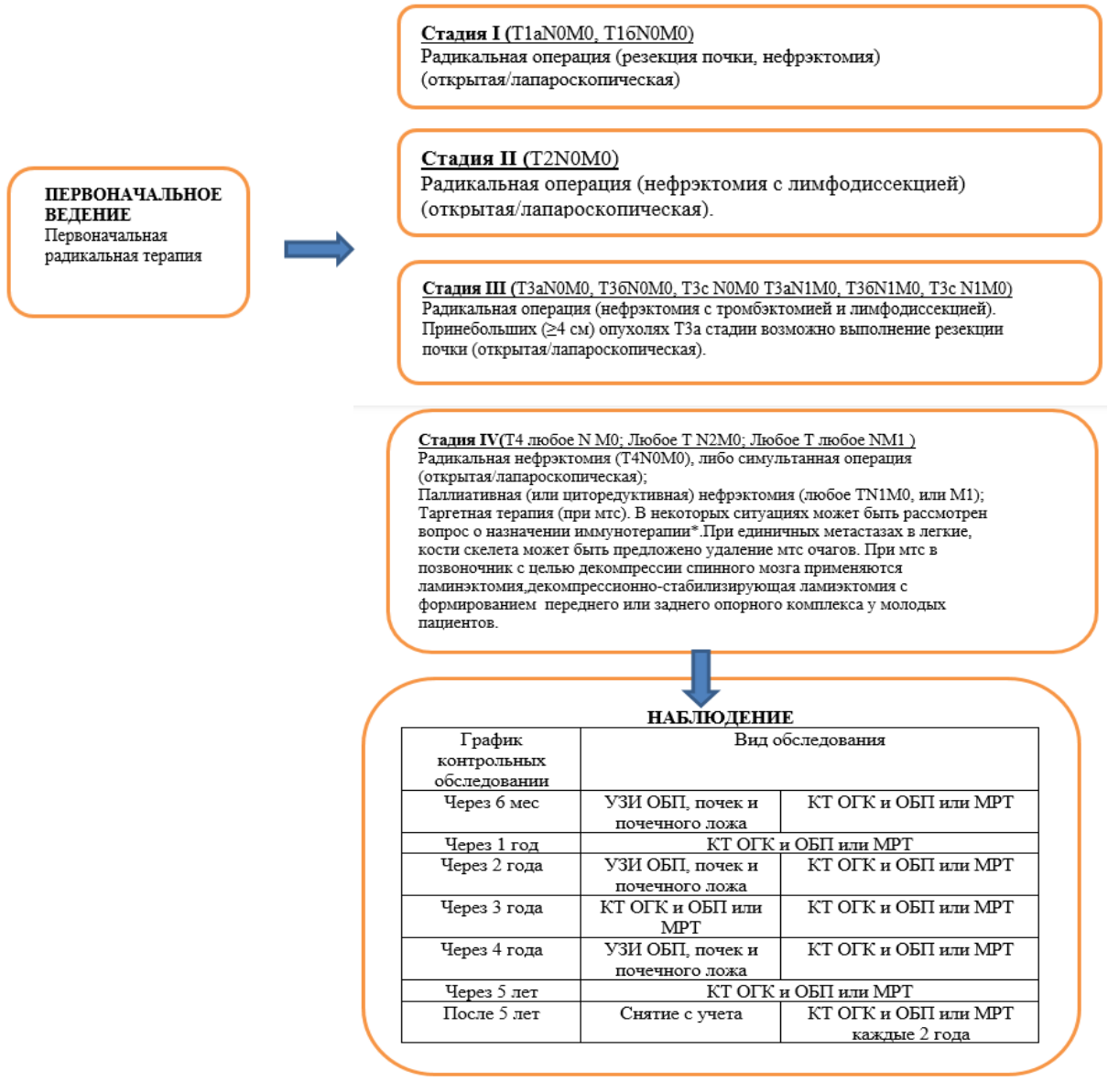
Таблица 8. Лечение рака почки в зависимости от стадии опухолевого процесса.
|
Стадия заболевания
|
Методы лечения |
|
Стадия I (T1аN0M0,
T1бN0M0)
|
Радикальная операция (резекция почки, нефрэктомия) (открытая/лапароскопическая). |
| Стадия II (T2N0M0) | Радикальная операция (нефрэктомия с лимфодиссекцией)(открытая/лапароскопическая) |
| Стадия III (T3аN0M0, T3бN0M0, Т3с N0M0 T3аN1M0, T3бN1M0, Т3с N1M0) | Радикальная операция (нефрэктомия с тромбэктомией и лимфодиссекцией). При небольших (≥4 см) опухолях Т3а стадии возможно выполнение резекции почки (открытая/лапароскопическая). |
|
Стадия IV
(T4 любое N M0; Любое Т N2М0; ЛюбоеТ, любое NМ1)
|
Радикальная нефрэктомия (Т4N0M0), либо симультанная операция (открытая/лапароскопическая);
Паллиативная (или циторедуктивная) нефрэктомия (любое ТN2М0, или М1);
Таргетная терапия (при мтс). В некоторых ситуациях может быть рассмотрен вопрос о назначении иммунотерапии.
При единичных метастазах в легкие, кости скелета может быть предложено удаление мтс очагов. При мтс в позвоночник с целью декомпрессии спинного мозга применяются ламинэктомия, декомпрессионно стабилизирующая ламиэктомия с формированием переднего или заднего опорного комплекса у молодых пациентов.
|
Примечание: проведение адъювантной терапии после осуществеления радикального хирургического лечения ПКР не показано [5] (УД – А).
Хирургическое вмешательство: стандартом в лечении рака почки является радикальная или расширенная нефрэктомия (лапаротомия, в том числе лапароскопическая, роботассистированная).
Радикальная нефрэктомия подразумевает удаление единым блоком почки с окружающей жировой клетчаткой, фасцией Герота, надпочечником и регионарными лимфоузлами.
При расширенной нефрэктомии дополнительно выполняется резекция окружающих органов в случае распространения на них опухоли.
При выполнении радикальной или расширенной нефрэктомии должны соблюдаться следующие принципы:
использование оперативного доступа, позволяющего выполнить перевязку почечных сосудов до проведения манипуляции на почке (оптимальными считаются торако- абдоминальный и абдоминальныйдоступы);
удаление почки единым блоком с опухолью, окружающей жировой клетчаткой и фасциями;
адреналэктомия на стороне поражения при подозрении на поражение или метастазирование в надпочечник по данным МРТ и/или КТ, при поражении опухолью верхнего полюса почки сТ3–Т4.
лимфодиссекция в полном объеме (классический вариант) выполняется при опухолях сТ3–Т4. При раке правой почки она включает удаление латерокавальных, прекавальных, ретрокавальных и интер-аортокавальных лимфоузлов от диафрагмы до места слияния общих подвздошных вен. При раке левой почки лимфодиссекция включает удаление латероаортальных, преаортальных, ретроаортальных и интераортокавальных лимфоузлов от диафрагмы до бифуркации аорты. При опухолях сТ1–Т2 расширенная лимфодиссекция не обязательна, возможна ограниченная лимфодиссекция. При раке правой почки ограниченная лимфодиссекция включает удаление латерокавальных, прекавальных и ретрокавальных лимфоузлов от диафрагмы до слияния НПВ. При раке левой почки удаляются латероаортальные и преаортальные лимфоузлы от диафрагмы до бифуркации аорты;
при распространении опухолевого тромба в просвет почечной или нижней полой вены выполняется удаление тромба. В случае распространения опухолевого тромба в просвет НПВ вена пережимается выше и ниже тромба, а также противоположная почечная с последующим его извлечением после рассечения вены над тромбом. При прорастании сосудистой стенки опухолью производится резекция данного участка НПВ на всю толщину сосудистойстенки. В случае распространения опухоли на окружающие органы и ткани производятся комбинированнные операции с резекцией пораженных органов и тканей с интраоперационным исследованием краев отсечения.
Таблица 9. Рекомендации по лечению локализованного и местно- распространенного ПКР
Наблюдение
Криоабляция и радиочастотная абляция
Резекция почки:
Показания:
- Абсолютные:
рак единственной или обеих почек (открытая, лапароскопическая, роботассистированная);
рак одной почки и функционально несостоятельная другая почка с ХПН.
- Относительные:
заболевания контрлатеральной почки с латентной стадией хпн;
при здоровой другой почке, если возможна резекция в пределах здоровых тканей опухоли до 4см (Т1а);
резекция почки может быть выполнена и в стадии процесса рТ1б, только у тщательно отобранных пациентов.
Таблица 9. Рекомендации по лечению локализованного и местно- распространенного ПКР
|
Рекомендация
|
УД |
| Хирургическое вмешательство – единственный радикальный метод лечения ПКР. | С |
| Для опухолей стадии Т1 по возможности следует выполнять резекцию почки. | В |
|
При наличии соответствующих технических возможностей
Резекция почки вляется стандартной процедурой при солитарных опухолях почек диаметром <7см
|
С |
| При осуществлении резекции почки необходим минимальный отступ в пределах здоровых тканей для предотвращения возникновения местногорецидива | В |
|
Проведение расширенной лимфаденэктомии не рекомендовано всем больным, в связи отсутствием данных об улучшении выживаемости. Расширеннуюлимфаденэктомию следует выполнять для осуществления стадирования больным с пальпируемыми и/илиувеличенными лимфатическими узлами.
|
А |
|
Выполнение адреналэктомии не рекомендовано больным, у которых по данным предоперационного КТ исследования надпочечники в норме и пациентам, у которых интраоперационное обследование не выявляет метастазов в надпочечник или прямого врастания опухоли в надпочечник
|
С |
|
У больных с опухолями больших размеров (>7 см) или при наличии положительного края резекции после выполнения органосохраняющей операции имеется высокий риск развития внутрипочечных рецидивов.
|
С |
|
Лапароскопическая радикальная нефрэктомия показана и является стандартом в лечении больных ПКР стадии Т2 и больных, которым невозможно выполнить резекцию почки
|
С |
|
Выполнение лапароскопической радикальной нефрэктомии не показано пациентам с опухолями стадии Т1 – им рекомендуется проведение резекции почки
|
С |
| Открытая резекция почки на сегодняшний день остается стандартом лечения. Лапароскопическая и робот- ассистированная резекция почки являются альтернативными вариантами открытой резекции почки | С |
Альтернативы хирургическому вмешательству
Наблюдение
Пожилые пациенты и пациенты с сопутствующей патологией со случайно обнаруженным небольшим образованием в почке имеют низкую смертность от рака почки и значительную смертность от конкурирующих причин. У отдельных пациентов пожилого возраста и/ или сопутствующие заболевания, активное наблюдение (АН) целесообразно, чтобы сначала контролировать небольшие образования в почках, а затем, если требуется, лечить при прогрессировании. Концепция АН отличается от концепции ожидания. Ожидание предназначено для пациентов, сопутствующие заболевания которых противопоказаны любым последующим активным лечениям и не требуют последующей визуализации, если нет клинических показаний.
Криоабляция и радиочастотная абляция
В настоящее время нет данных, свидетельствующих о онкологической пользе методов криоабляции или радиочастотной абляции по сравнению с ЧН.
Ведение ПКР с венозным тромбозом опухоли
|
Рекомендация
|
Градация рекомендации |
| Предлагайте активное наблюдение (АН) или тепловизионное абляция (ТА) до слабости и / или сопутствующей патологии пациенты с небольшими образованиями почек. | Слабая |
| Выполните подкожную биопсию почек до, а не одновременно с ТА. | Сильная |
| Когда предлагается TA обсудите с пациентом вред/ пользу в отношении онкологических исходов и осложнений. | Сильная |
| Не предлагайте рутинно ТА при опухолях> 3 см и криоабляцию для опухолей> 4 см. | Слабая |
Лечение местно-распространенного ПКР
Лечение при наличии метастазов лимфатических узлов (cN +)
При наличии клинически положительных LN (cN +) диссекция ЛУ всегда оправдана, но масштабы диссекции ЛУ все еще остаются спорными.
Данные низкого качества предполагают, что тромб опухоли в следует удалить при отсутствии метастатического заболевания. Адьювантные процедуры, такие как эмболизация опухоли или фильтр нижней полой вены, по-видимому, не дает никаких преимуществ при лечении опухолевого тромба.
У пациентов, непригодных для операции или с неоперабельным заболеванием, эмболизация может контролировать симптомы, в том числе видимую гематурию или боль в боку. В настоящее время нет доказательств того, что использование адъювантной терапии после операции.
Ведение ПКР с венозным тромбозом опухоли
|
Рекомендация
|
Градация рекомендации |
| У пациентов с клинически увеличенными лимфо узлами (LN), выполните диссекцию ЛУ для определения стадии, прогноза и тактики последующего наблюдения. | Слабая |
| Удалите опухоль почек и тромб в случае поражения вен при не метастатическом заболевании. | Сильная |
| В случае метастатического заболевания обсудите хирургию в составе мультидисциплинарной команды. | Слабая |
Циторедуктивная нефрэктомия
Нефрэктомия опухоли является излечивающей только в том случае, если все опухолевые конгломераты удаляются. Сюда входят пациенты с первичной опухолью и с одно- или олигометастатическим резектабельным заболеванием. Для большинства пациентов с метастатическим заболеванием, циторедуктивным нефрэктомия (ЦН) является паллиативной и требуется системная терапия.
|
Доказательство
|
Уровень доказательности |
| Отложенный ЦН с предоперационным сунитинибом у пациентов промежуточного риска с CC-метастатическим ПКР (мПКР) показывает улучшение выживаемости при вторичном анализе конечных точек и отбирает пациентов с присущей им устойчивостью к системная терапия. | 2b |
| Сам по себе сунитиниб ничем не уступает препарату немедленного действия ЦН с последующим приемом сунитиниба у пациентов с MSKCC среднего и низкого риска, которые требуют системной терапии с фактором роста эндотелия сосудов рецептор (VEGFR) ингибитором тирозинкиназы (TKI). | 1а |
| Циторедуктивная нефрэктомия у пациентов с одновременной полнаой резекцией одного метастаза или олигометастазы могут улучшить выживаемость и отсрочить системную терапию. | 3 |
| Пациенты с низким риском MSKCC или IMDC (≥ 4 факторы) не получают пользы от местной терапии. | 1а |
| Пациенты с первичной опухолью на месте проходят лечение с комбинированной терапией на основе ICI имеют лучшую ВБП и ОС в исследовательских анализах подгрупп по сравнению с лечение сунитинибом. | 2b |
| Не выполняйте циторедуктивную нефрэктомию. (CN) у пациентов с низким риском MSKCC. | Сильная |
| Не выполняйте немедленное выполнение CN в MSKCC пациенты среднего риска, у которых есть бессимптомный синхронный первичный опухоль и требуют системной терапии. | Слабая |
| Начать системную терапию без ХН в Пациенты среднего риска MSKCC, у которых есть бессимптомная синхронная первичная опухоль и требуют системной терапии. | Слабая |
| Обсудите задержку ХН с пациентами, которые получить клиническую пользу от системной терапии. | Слабая |
| Немедленное выполнение CN у пациентов с хороший статус производительности, кто не требуется системная терапия. | Слабая |
| Немедленное выполнение CN у пациентов с олигометастазы при полном местном лечение метастазов может быть достигнуто. | Слабая |
Рецидивирующий ПКР
Может возникнуть местно рецидивирующее заболевание почки, подвергшейся лечению, либо после частичной нефрэктомии, либо после абляционной терапии. После радикальной нефрэктомии или нефронсохраняющей терапии рецидив может произойти в почечном ложе или регионарной, например, венозный тромбоз опухоли или метастазы в забрюшинные ЛУ. Изолированный местный рецидив в почечное ложе после РН встречается редко.
Пациентам может быть полезна полная хирургическая резекция местного рецидивирующего заболевания. В случаях, когда полное хирургическое удаление невозможно из-за прогрессирующего роста опухоли и боли, рекомендовано паллиативное лечение, включая лучевую терапию и системную терапию.
В соответствии с моделью MSKCC все пациенты диссеминированным ПКР подразделяются на 3 группы:
Лечение больных раком почки с отдаленными метастазами
У 10–15% больных раком почки при первичном обращении определяются отдаленные метастазы.
Больные диссеминированным ПКР представляют собой разнородную в прогностическом отношении группу.
Неблагоприятными прогностическим факторами (прогностическая модель Memorial Sloan Kettering Cancer Center; MSKCC), негативно влияющими на общую выживаемость больных, являются:
соматический статус (<70% по шкале Карновского); повышение уровня ЛДГ>1.5 от верхней границы нормы; уровень гемоглобина < нижней границы нормы;
уровень скорректированного Ca2+ в сыворотке крови > 10 мг/дл или > 2.5 ммоль/л; интервал от первичного установления диагноза ПКР до начала терапии < 1 года;
В соответствии с моделью MSKCC все пациенты диссеминированным ПКР подразделяются на 3 группы:
• группа благоприятного прогноза (нет факторов риска, медиана выживаемости ~ 30 мес.);
• группа промежуточного прогноза (1-2 фактора риска, медиана выживаемости ~ 14 мес.;
• группа плохого прогноза (≥3 факторов риска, медиана выживаемости ~ 6 мес.).
В настоящее время не существует стандартов в лечении больных с множественными отдаленными метастазами рака почки. Для лечения метастатического почечно - клеточного рака могут применяться следующие методы:
У первичных больных раком почки с отдаленными метастазами на первом этапе лечения (в случае, если общее состояние больного позволяет – группа благоприятного прогноза) выполняется паллиативная или расширенная операция (нефрэктомия). Хирургическое лечение приводит к излечению лишь при условии удаления всех определяемых опухолевых очагов. У большинства больных метастатическим ПКР нефрэктомия носит паллиативный характер, в связи с этим им необходимо проведение дальнейшего системного лечения.
При выявлении отдаленных метастазов у больных раком почки после радикальной нефрэктомии необходимо стремиться к их хирургическому удалению при наличии технических возможностей (одиночные метастазы).
В случае определения множественных метастазов у больных раком почки после радикальной операции у больных благоприятного прогноза, ограниченной распространенностью процесса, минимальным объемом поражения и при отсутствии симптомов болезни допустимо использование ИНФ-α в монотерапии при условии тщательного мониторинга эффективности лечения и возможности использования таргетных препаратов при прогрессировании. При частичной регрессии метастазов, в случае появления технических возможностей производится их хирургическое удаление. В других случаях проводится таргетная терапия.
Для уменьшения болевого синдрома, при мтс в кости скелета, возможно проведение паллиативного курса лучевойтерапии.
Противопоказания к метастазэктомии:
Показаниями к метастазэктомии являются:
Возможность радикального удаления солитарных или единичных метастазов у больных с ранее выполненной радикальной или паллиативной нефрэктомией
Противопоказания к метастазэктомии:
Невозможность радикального удаления всех определяемых опухолей (опухоль почки и метастазы);
Промежуточный или неблагоприятный прогноз по шкале MSKCC [7];
Бурное прогрессирование опухолевого процесса или появление новых метастазов в короткие сроки во время предшествующего лечения или динамическогонаблюдения;
Высокий операционный риск.
Дополнительные способы лечения метастатического рака почки
В случаях невозможности выполнить нефрэктомию у первичных больных с отдаленными метастазами при развитии гематурии применяется эмболизация почечной артерии с гемостатической целью.
При метастазах в костях скелета с целью снятия болевого синдрома применяется лучевая терапия крупными фракциями по 5Гр до СОД 35Гр, назначение бифосфонатов.
При метастазах в головной мозг также может проводиться лучевая терапия.
Таблица 6. Рекомендации по хирургическому лечению и лучевой терапии больных метастатическим ПКР [6]
Показаниями к лучевой терапии при метастатическом ПКР:
Больные ПКР с 1-3 метастазами в головной мозг,
Отсутствие экстракраниальных проявлений болезни или возможность контроля за этими проявлениями с помощью лекарственных методов,
Больные с метастазами в кости при наличии болевого синдрома.
Таблица 6. Рекомендации по хирургическому лечению и лучевой терапии больных метастатическим ПКР [6]
|
Рекомендация
|
Уровень доказательности |
| Выполнение паллиативной нефрэктомии рекомендовано больным метастатическим ПКР и хорошим общим соматическим состоянием. | А |
| У больных метастатическим ПКР удаление метастазов необходимо выполнять у отдельных больных при резектабельном поражении, низком операционном риске, удовлетворительном общем состоянии, благоприятном прогнозе больного и индолентном течении заболевания. | С |
| Радикальное удаление резидуальных метастазов возможно у больных, ответивших на иммунотерапию и/или другое системное лечение. | С |
| В отдельных случаях применение стереотаксической лучевой терапии у больных с метастатическим поражением головного мозга и наличием костных метастазов может существенно снизить выраженность симптоматики. | С |
Паллиативная помощь:
При выраженном болевом синдроме лечение осуществляется в соответствии с рекомендациями протокола «Паллиативная помощь больным с хроническими прогрессирующими заболеваниями в инкурабельной стадии, сопровождающимися хроническим болевым синдромом».
При наличии кровотечения лечение осуществляется в соответствии с рекомендациями протокола «Паллиативная помощь больным с хроническими прогрессирующими заболеваниями в инкурабельной стадии, сопровождающимися кровотечением».
Показания к лучевой терапии:
Лучевая терапия:
рак почки резистентен к лучевой терапии, поэтому лучевые методы лечения при почечно-клеточном раке на первичный очаг не показаны. Лучевая терапия может применяться для облучения метастатических очагов в кости с обезболивающей целью или облучения метастатических очагов головной мозг. В этих случаях применение лучевой терапии у больных может существенно снизить выраженность симптоматики.
Показания к лучевой терапии:
морфологически установленный диагноз злокачественного новообразования; при рецидивах, продолженном росте опухоли или прогрессирование заболевания после ранее проведенного комбинированного или комплексного лечения.
Противопоказания к лучевой терапии:
• декомпенсированное общее состояние по сопутствующей соматической патологии (сердечно сосудистая, дыхательная, мочеполовая, пищеварительная и т.п.);
• общесоматическое инкурабельное состояние больного вызванное онкологическим процессом;
Симптоматическая лучевая терапия:
Виды лучевой терапии:
Методики лучевой терапии:
Целевая функция лучевой терапии:
• радикальная лучевая терапия; паллиативная лучевая терапия;
Симптоматическая лучевая терапия:
• профилактическая лучевая терапия.
Виды лучевой терапии:
Фотонная терапия (рентгенотерапия, тормозное излучение высоких энергий, гамма терапия).
Корпускулярная терапия (β-терапия; быстрые электроны высоких энергий, протонная, ионная, нейтронная).
Методики лучевой терапии:
самостоятельная лучевая терапия; предоперационная лучевая терапия; послеоперационная лучевая терапия; химиолучевая терапия.
Способы лучевой терапии:
1- мерная лучевая терапия (1DRT);
2- х мерная конвенциальная (стандартная) лучевая терапия (2D RT);
3- х мерная конформная лучевая терапия (3D CRT); интенсивно-модулированная лучевая терапия (IMRT); лучевая терапия, управляемая по изображениям (IGRT); лучевая терапия, синхронизированная с дыханием (4DRT); стереотаксическая радиохирургия (SRS); стереотаксическая радиотерапия (SRT); интраоперационная лучевая терапия (IORT); брахитерапия;
• Протонная лучевая терапия;
• Томотерапия на томоаппаратах. Используются стандартные методики фракционирования при подведении разовых и суммарных очаговых доз. Однако упор при томотерапии делается на гипофракционирование при РОД<2,5 Гр.
Методы лучевой терапии:
Непрерывная лучевая терапия.
Однофракционная лучевая терапия при SRS.
Фракционированная лучевая терапия при РОД от 1,6 Гр до 12,0 Гр 2-5 фракций в неделю:
- стандартное фракционирование;
- гипофракционирование;
- гиперфракционирование;
- ускоренное фракционирование;
- мультифракционирование.
Лучевая терапия при метастазах в головной мозг.
1. Тотальное облучение головного мозга до С1 шейного позвонка: РОД 2,0 Гр 5 фракций в неделю СОД 30-40 Гр;
РОД 2,5 Гр 5 фракций в неделю СОД 30-35 Гр; РОД 3,0 Гр 5 фракций в неделю СОД 30-33 Гр; РОД 4,0 Гр 5 фракций СОД 20 Гр.
2. Локальное облучение головного мозга
стереотаксическая радиохирургия (SRS) - РОД 10,0 – 30,0 Гр 1 фракция при размерах метастаза не более 3 см в диаметре;
стереотаксическая радиотерапия (SRT) – РОД 6,0-10,0 Гр 3-5 фракций при размерах метастаза от 3,0 до 6,0 см;
локальное облучение метастазов РОД 2,0-3,0 до СОД 20-60 Гр.
Лучевая терапия при метастазах в кости скелета.
РОД 2,0 Гр 5 фракций в неделю СОД 40-50 Гр;
РОД 2,5 Гр 5 фракций в неделю СОД 40-50 Гр;
РОД 3,0 Гр 5 фракций в неделю СОД 30-45 Гр;
РОД 4,0 Гр 3-5 фракций в неделю СОД 20-40 Гр;
РОД 8,0 Гр 1-3 фракции
РОД 2,5 Гр 5 фракций в неделю СОД 40-50 Гр;
РОД 3,0 Гр 5 фракций в неделю СОД 30-45 Гр;
РОД 4,0 Гр 3-5 фракций в неделю СОД 20-40 Гр;
РОД 8,0 Гр 1-3 фракции
Подготовка к лучевой терапии:
1. Выбор позиции пациента и фиксирующих приспособлений.
2. Разметка (центрация) на рентгеновском симуляторе.
3. КТ топометрия на КТ аппаратах.
4. Совмещение данных КТ и МР (ко-регистрация).
5. Контурометрия (очерчивание).
6. Компьютерное дозиметрическое планирование лучевой терапии медицинскими физиками, т.е. расчёт плана лучевой терапии.
7. Совместное обсуждение и утверждение плана лучевой терапии с медицинскими физиками (утвердить план может только лучевой терапевт- радиолог!).
8. Симуляция – проверка дозиметрического плана при рентгеноскопическом контроле рентгеновского симулятора.
Первая укладка пациента в присутствии врача и медицинского физика.
Альтернативные варианты лечения ПКР:
Активное наблюдение;
Пожилые больные и пациенты с тяжелой сопутствующей патологией с небольшими случайно-выявленными опухолями почки имеют относительно низкий риск смерти от ПКР и значительно больший риск смерти от сопутствующих заболеваний. Тактика активного наблюдения подразумевает постоянный контроль размера опухоли на основании современных методик визуализации органов брюшной полости (УЗИ, КТ или МРТ) с возможностью отложенного вмешательства в случае клинической прогрессии в течение периода наблюдения. В самых больших сериях наблюдении у большинства больных вероятность роста опухолей почек низка и прогрессирование с развитием метастазов наблюдается у ограниченного количества больных (1-2%). Как кратко так и среднесрочные онкологические результаты показывают, что стратегия активного наблюдения является подходящей для осуществления начального мониторинга малых новообразований в почках, которые при необходимости могут затем быть подвергнуты лечению при прогрессировании.
Преимущества:
Недостатки:
Целесообразность:
Высокая вероятность выявления клинически незначимого ПКР при опухоли почки маленьких размеров;
10-15% больных с маленькой опухолью почки имеют доброкачественные опухоли почки.
Преимущества:
Предотвращение побочных эффектов терапии;
Сохранение качества жизни и физической активности пациента;
Предотвращение «ненужной» терапии клинически незначимых опухолей;
Сокращение стоимости лечения;
Возможность отложенного вмешательства в случае клинической прогрессии.
Недостатки:
Вероятность прогрессиизаболевания;
Сложности при проведении терапии более распространенного заболевания в случае выявления его прогрессии;
Психологический дискомфорт у пациента;
Необходимость постоянного мониторинга (УЗИ, КТ или МРТ органов брюшной полости и грудной клетки).
Аблативные методики.
Существующие альтернативы хирургическому лечению ПКР включают чрескожные малоинвазивные процедуры, выполняемые под контролем современных средств визуализации, такие как чрескожная радиочастотная абляция, криоабляция, микроволновая и лазерная абляция, а также абляция высокоинтенсивным сфокусированным ультразвуком (HIFU).
Показания для применения малоинвазивных аблативных методик:
Преимущества:
Меньшая травматичность;
Возможность проведения лечения в амбулаторном режиме;
Возможность лечения пациентов группы высокого хирургического риска;
Возможность повторного вмешательства в случае неэффективности первого сеанса абляции;
Сокращение стоимости лечения.
Показания для применения малоинвазивных аблативных методик:
Наличие небольших случайно выявленных новообразований в корковом веществе почек у пожилых пациентов;
Генетическая предрасположенность больных к развитию множественных опухолей;
выявление у пациента двусторонних опухолей, которые не могут быть излечены хирургическим методом;
наличие у больного единственной почки и высокий риск развития ренопривного состояния после хирургического вмешательства (УД – В)[5,6,7].
В целом, аблативные чрескожные вмешательства не рекомендуется проводить при опухолях диаметром >3 см или расположенных в области ворот почки, центральной собирательной системы или проксимального отдела мочеточника.
Противопоказания для применения аблативных методик:
ожидаемый срок жизни <1года;
наличие множественных метастазов;
малые шансы на успех лечения вследствие размера или расположения опухоли.
В целом, аблативные чрескожные вмешательства не рекомендуется проводить при опухолях диаметром >3 см или расположенных в области ворот почки, центральной собирательной системы или проксимального отдела мочеточника.
Абсолютные противопоказания для применения аблативных методик:
наличие необратимых коагулопатий;
крайне высокий операционный риск.
Среди имеющихся аблативных методик РЧТА и криоаблация наиболее полно изучены в отношении практичности их использования, частоты возникновения осложнений и онкологических результатов.
Перед применением аблативных методик необходимо выполнить предварительную биопсию для выяснения гистологического варианта новообразования почки.
Таблица 11. Рекомендации по альтернативным вариантам лечения ПКР [5,6,7]
Режим наблюдения:
Объем наблюдения:
Эмболизация.
Преимуществ выполнения эмболизации перед проведением нефрэктомии не выявлено. Неоперабельным больным и пациентам, которые не перенесут оперативного вмешательства, выполнение эмболизации позволяет уменьшить выраженность симптомов, например таких, как гематурия или боль. Осуществление эмболизации до проведения резекции гиперваскулярных метастазов в кости или позвоночник способствует уменьшению интраоперационной кровопотери. Некоторым больным с костными или паравертебральными метастазами с наличием болевой симптоматики выполнение эмболизации помогает устранить симптомы.
Таблица 11. Рекомендации по альтернативным вариантам лечения ПКР [5,6,7]
|
Рекомендация
|
Уровень доказательности |
|
Активное наблюдение является оправданным выбором для пожилых больных и/или пациентов с тяжелой
сопутствующей патологией с небольшими опухолями почек и ограниченной ожидаемой продолжительностью жизни.
|
С |
|
Пациенты с небольшими опухолями почки и/или тяжелой сопутствующей патологией, с противопоказаниями к
выполнению хирургического вмешательства, могут рассматриваться как кандидаты на проведение аблативных методик, например криоаблации или РЧТА
|
С |
|
Выполнение биопсии перед проведением аблативных методик и активного наблюдения является стандартной процедурой и показано для стратификации на основании гистологического варианта опухоли в различные группы
последующего наблюдения
|
С |
|
Другие выполняемые под контролем современных методов визуализации минимально-инвазивные методы, такие как микроволновая и лазерная аблация, а также HIFU, в настоящее время носят экспериментальный характер и рекомендованы для использования только в исследованиях.
|
С |
|
Эмболизация показана в качестве паллиативного вмешательства больным, которым не возможно выполнить оперативное вмешательство, и больным с выраженной гематурией или болями в поясничной области
|
С |
Дальнейшее ведение
Режим наблюдения:
первый год – 1 раз в 3мес;
второй год – 1 раз в 6 мес;
в последующие до 5 лет – 1 раз в год.
Объем наблюдения:
общий анализ крови раз в 3 месяца в течении первого года, далее 1 раз в 6 месяцев;
общий анализ мочи раз в 3 месяца в течении первого года, далее 1 раз в 6 месяцев;
биохимический анализ крови (с определением шлаков, белка, сахара) раз в 3 месяца в течении первого года, далее 1 раз в 6 месяцев
УЗИ органов брюшной полости и забрюшинного пространства, раз в 3 месяца в течении первого года, далее 1 раз в 6 месяцев;
Рентгенография легких каждые 6 месяцев;
КТ органов брюшной полости и забрюшинного пространства каждые 12 месяцев.
Динамическое наблюдение проводится после выполнения хирургического лечения и аблативных методик сцелью:
оценки функции почек;
выявления наличия послеоперационных осложнений;
выявления местных рецидивов, возникших после выполнения резекции почки или проведения аблативного лечения;
Методам и срокам проведения контрольных обследований посвящено множество публикаций. В настоящее время нет единого мнения о необходимой периодичности динамического наблюдения за пациентами после получения ими лечения по поводу ПКР, также отсутствуют данные о том, что раннее выявление рецидива способствует улучшению выживаемости по сравнению с поздним его обнаружением. Стандартными методами обследования при динамическом наблюдении являются: КТ органов грудной и брюшной полости, рентгенография легких, УЗИ органов брюшной полости (не чаще 1 раза в 6 месяцев после радикального хирургического лечения)
Индикаторы эффективности лечения:
выявление рецидивов в контралатеральной почке и ипсилатеральной почке (после резекции);
выявить отдаленные метастазы.
Методам и срокам проведения контрольных обследований посвящено множество публикаций. В настоящее время нет единого мнения о необходимой периодичности динамического наблюдения за пациентами после получения ими лечения по поводу ПКР, также отсутствуют данные о том, что раннее выявление рецидива способствует улучшению выживаемости по сравнению с поздним его обнаружением. Стандартными методами обследования при динамическом наблюдении являются: КТ органов грудной и брюшной полости, рентгенография легких, УЗИ органов брюшной полости (не чаще 1 раза в 6 месяцев после радикального хирургического лечения)
Профилактические мероприятия: Наиболее важными мерами первичной профилактики ПКР являются отказ от курения и борьба с ожирением.
В послеоперационном периоде необходимо уделять внимание профилактике тромбоэмболических осложнений, особенно у больных с тромбами в почечной и НПВ, у больных с ожирением, а также лицам преклонного возраста и с сопутствующей сердечной патологией. Учитывая, что радикальным является органоуносящая операция, обязательно до операции установление функции контралатеральной почки с целью предотвращения возможной почечной недостаточности. В случае выполнения резекции почки необходимо следить за возможным развитием мочевого свища или мочевого затека.
Индикаторы эффективности лечения:
«ответ опухоли» - регрессия опухоли после проведенного лечения;
без рецидивная выживаемость (трех и пятилетняя);
«качество жизни» включает кроме психологического, эмоционального и социального функционирования человека, физическое состояние организма больного.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для экстренной госпитализации: нет.
Показания для плановой госпитализации:
наличие верифецированного опухолевого процесса в почке;
операбельный рак почки (I-IV стадии).
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- 1) Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016. CA Cancer J Clin 2016; 66(1): 7–30. 2) Moch, H., et al. The 2016 WHO Classification of Tumours of the Urinary System and Male Genital Organs-Part A: Renal, Penile, and Testicular Tumours. Eur Urol, 2016. 70: 93. https://pubmed.ncbi.nlm.nih.gov/26935559. 3) Capitanio, U., et al. Epidemiology of Renal Cell Carcinoma. Eur Urol, 2019. 75: 74. https://pubmed.ncbi.nlm.nih.gov/30243799. 4) Al-Bayati, O., et al. Systematic review of modifiable risk factors for kidney cancer. Urol Oncol, 2019. 37: 359. https://pubmed.ncbi.nlm.nih.gov/30685335. 5) Moch H, et al. WHO Classification of Tumours of the Urinary System and Male Genital Organs, ed. WHO. 2016, IARC, Lyon. https://publications.iarc.fr/Book-And-Report-Series/Who-Classification-Of-Tumours/WHO Classification-Of-Tumours-Of-The-Urinary-System-And-Male-Genital-Organs-2016. 6) Europian Association of urology (EAU) Guedelines 2021 Edition. 7) Клинические рекомендации по диагностике и лечению рака почки. Ассоциация онкологов России, Москва2020г. 8) NCCN guidelines 2021 http:// www.nccn.org/professionals/ physician_gls /pdf/ kidney.pdf. 9) Ljungberg, B. EAU guidelines on renal cell carcinoma: 2014 update / B. Ljungberg, K. Bensalah, S. Canfield et al. // Eur Urol. – 2015. – Vol. 67(5). – Р. 913-924. 62. 10) Luciani, L.G. Robotic-assisted partial nephrectomy provides better operative outcomes as compared to the laparoscopic and open approaches: results from a prospective cohort study / L.G. Luciani, S. Chiodini, D. Mattevi et al. // J Robot Surg. – 2016. – Vol. 20. – Р. 1007-1013. 11) Schmidt, L.S. Genetic predisposition to kidney cancer / L.S. Schmidt, W.M. Linehan // Semin Oncol. – 2016. – Vol. 43(5). – Р. 566-574. 80. 12) Secin, F.P. et al. American Confederation of Urology (CAU) experience in minimally invasive partial nephrectomy / F.P., Secin, O. A. Castillo, J. J. Rozanec et al. // World J Urol. – 2017. – Vol. 35(1). – P. 57-65. 81. 13) Seo, A.N. Clinicopathologic and Molecular Pathology of Collecting Duct Carcinoma and Related Renal Cell Carcinomas / A.N. Seo, G. Yoon, J.Y. Ro // Adv Anat Pathol. – 2017. – Vol. 24(2). – Р. 65-77. 14) Wu, W.S. Protein Kinase RNA-Like Endoplasmic Reticulum Kinase-Mediated Bcl-2 Protein Phosphorylation Contributes to Evodiamine-Induced Apoptosis of Human Renal Cell Carcinoma Cells / W.S. Wu, C.C. Chien, Y.C. Chen, W.T. Chiu // PLoS One. – 2016. – Vol. 2 (8). – Р. 484. 126 97. 15) Yoo, S. et al. Preserving Renal Function through Partial Nephrectomy Depends on Tumor Complexity in T1b Renal Tumors / S. Yoo, D. You, I.G. Jeong et al. // J Korean Med Sci. – 2017. – Vol. 32(3). – P. 495-501.
Информация
Сокращения, используемые впротоколе:
|
CN
|
Клинически положительных лимфоузлов |
|
DRT
|
2-х мерная конвенциальная (стандартная) лучевая терапия |
|
EAU
|
Европейская Ассоциация урологов |
|
HIFU
|
Высокоинтенсивный сфокусированный ультразвук |
|
IMDC
|
Группа прогноза |
|
IMRT
|
Интенсивно-модулированная лучевая терапия |
|
IO
|
Иммунотерапия |
|
IORT
|
Интраоперационная лучевая терапия |
|
ISUP
|
International Society of Urological Pathology
Четырехуровневая система оценок ВОЗ/ISUP (Международное общество урологической патологии)
|
|
MSKCC
|
Пациенты среднего риска |
|
PD-L1
|
Лиганд рецептора программируемой клеточной гибели 1 |
|
per os
|
Перорально |
|
SRS
|
Стереотаксическая радиотерапия |
|
TKI
|
Ингибиторы тирозинкиназы |
|
TNM
|
Tumor Nodulus Metastasis (международная классификация стадий злокачественных новообразований) |
|
VEGF
|
Сосудистый эндотелиальный фактор роста |
|
VEGFR
|
Фактор роста эндотелия сосудов рецептор |
|
в/в
|
Внутривенно |
|
в/к
|
Внутрикожно |
|
в/м
|
Внутримышечно |
|
ВБП
|
Выживаемость без прогрессирвоания |
|
ВГН
|
Верхняя граница нормы |
|
ВОЗ
|
Всемирная организация здравоохранения |
|
ГР
|
Грей |
|
ЕД
|
Единицы |
| ИЛ -2 | Интерлейкин -2 |
|
ИНФ
|
Интерферон |
| КТ | Компьютерная томография |
|
ЛДГ
|
Лактат-дегидрогеназа |
|
мг
|
Миллиграмм |
| мл | Миллилитр |
|
МРТ
|
Магнитно-резонансная томография |
| МСКТ | Мультиспиральная компьютерная томография |
|
мтс
|
Метастазы |
|
НПВ
|
Нижняя полая вена |
| ОАК | Общий анализ крови |
|
ОАМ
|
Общий анализ мочи |
| п/к | Подкожно |
|
ПКР
|
Почечно-клеточный рак |
| РКИ | Рандомизированные клинические исследования |
|
РОД
|
Разовая очаговая доза |
| РЧТА | Чрескожная радиочастотная абляция |
|
СОД
|
Суммарно-очаговая доза |
| СОЭ | Скорость оседания эритроцитов |
|
ТА
|
Тепловизионное абляция |
| УД | Уровень доказанности |
|
УЗДГ
|
Ультразвуковая доплерография |
| УЗИ | Ультразвуковое исследование |
|
ХПН
|
Хроническая почечная недостаточность |
| ХТ | Химиотерапия |
|
ЦН
|
Циторедуктивная нефрэктомия |
| ЧЛС | Чащечно-лоханочная система |
|
ЭКГ
|
Электрокардиограмма |
| ЭФГДС | Эзофагофиброгастродуоденоскопия |
| ЭхоКГ | Эхокардиография |
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков протокола с указанием квалификационных данных:
1) Умурзаков Хусан Талипбаевич - PhD докторант, магистр медицины, руководитель центра онкоурологии АО «Казахский научно – исследовательский институт онкологии и радиологии».
2) Гасанов Зиё Бахшиевич - PhD докторант, врач онкоуролог, старший ординатор АО «Казахский научно – исследовательский институт онкологии и радиологии».
3) Онгарбаев Бахытжан Тулигенович – врач высшей категории, заместитель председателя по клинической работе АО «Казахский научно – исследовательский институт онкологии и радиологии».
4) Абдрахманов Рамиль Зуфарович – кандидат медицинских наук, руководитель Центра химиотерапии опухолей, Председатель химиотерапевтического совета АО «Казахский научно – исследовательский институт онкологии и радиологии».
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
5) Арыбжанов Давранкул Турсункулович – доктор медицинских наук, профессор, заместитель главного врача по лечебной работе ГКП на ПХВ «Областная мноопрофильная клиника » УЗ области Жетыcу. Доцент кафедры хирургических дисциплин №1АО «Южно Казахстанская медицинская академия».
6) Новиков Игорь Игоревич - PhD докторант , Магистр медицины. Заместитель директора по контролю качества оказания медицинских услуг ГКП на ПХВ «Алматинская региональная многопрофильная клиника».
7) Кабыкенов Асхат Амангелдынович - врач онкоуролог высшей категории, магистр медицины. ГКП на ПХВ « Центр ядерной медицины и онкологии гСемей
8) Рахманбердиева Эльвира Жайдаровна – врач, клинический фармаколог АО «Казахский научно – исследовательский институт онкологии и радиологии».
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
1) Шалекенов Булат Уахитович – доктор медицинских наук, профессор, заведующий кафедрой урологии и андрологии НАО «Казахский Национальный университет им. Аль-Фараби», уролог;
2) Кайдаров Бакыт Касенович – доктор медицинских наук, профессор кафедры онкологии НАО «Казахский Национальный медицинский университет им. С.Д.Асфендиярова», онколог.
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.