Парентеральное питание новорожденных
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Проблемы вскармливания новорожденного (P92), Расстройства системы пищеварения у плода и новорожденного (P75-P78)
Неонатология, Педиатрия
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «28» июля 2023 года
Протокол №185
КЛИНИЧЕСКИЙ ПРОТОКОЛ МЕДИЦИНСКОГО ВМЕШАТЕЛЬСТВА
ПАРЕНТЕРАЛЬНОЕ ПИТАНИЕ НОВОРОЖДЕННЫХ
Парентеральное питание – это вид нутритивной поддержки, при которой все питательные вещества или их определенная часть вводятся в организм внутривенно, минуя желудочно-кишечный тракт [1,2,4, 5-7].
ВВОДНАЯ ЧАСТЬ
Код(ы) МКБ-10: нет.
Дата разработки протокола: 2015 год (пересмотр 2023 год).
Пользователи протокола: неонатологи, детские анестезиологи-реаниматологи, педиатры.
Категория пациентов: новорожденные дети.
Классификация
Классификация парентерального питания [1]:
- полное ПП ― полностью компенсирует потребность в питательных веществах и энергии, без участия желудочно-кишечного тракта;
- частичное ПП ― часть потребности в питательных веществах и энергии компенсируется за счет их поступления через желудочно-кишечный тракт, то есть энтерально.
Лечение
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
2.1 Цель проведения процедуры/вмешательства: Обеспечение сбалансированного питания критически больным новорожденным детям для формирования адекватного метаболизма и удовлетворения особых потребностей, возникающих при некоторых заболеваниях перинатального периода, защиты от возможных будущих осложнений и обеспечения оптимального роста и развития.
Показания и противопоказания к процедуре/ вмешательству.
Показания к процедуре/ вмешательству: Парентеральное питание (полное/частичное) показано критически больным новорожденным детям, если проведение энтерального питания невозможно или его объем недостаточен для покрытия метаболических потребностей пациента [7]
Парентеральное питание у детей проводится в следующих ситуациях:
- при нефункционирующем ЖКТ;
- в случае необходимости временного исключения ЖКТ из пищеварения (например, опасность расхождения швов в раннем послеоперационном периоде);
- при невозможности полного обеспечения организма необходимыми нутриентами и энергией через рот или энтеральный зонд.
Показания к началу парентерального питания у новорожденных [9]:
- Недоношенным новорожденным детям с гестационным возрастом менее 31 недели, если характер их заболевания не позволяет проводить энтеральное питание;
- Недоношенным детям, рожденным с гестационным возрастом более 31 недели парентеральное питание проводится, если при энтеральном питании в первые 72 часа после рождения не было достигнуто достаточного прогресса в стабилизации их состояния;
- Доношенным и недоношенным детям, у которых вероятность получения достаточного энтерального питания мала в связи с наличием тяжелого заболевания, например, с врожденными заболеваниями кишечника, с неонатальным сепсисом и др.
Показания к парентеральному питанию у новорожденных, если энтеральное питание было приостановлено [9]:
- Недоношенным детям, получающим энтеральное питание, начинают парентеральное питание, если:
- по состоянию ребенка энтеральное питание необходимо прекратить и маловероятно, что оно будет возобновлено в течение следующих 48 часов;
- по состоянию ребенка энтеральное питание было прекращено более чем на 24 часа и маловероятно достижение достаточного прогресса при энтеральном питании в течение следующих 48 часов.
- Доношенным детям, получающим энтеральное питание, начинают парентеральное питание, если:
- по состоянию ребенка энтеральное питание необходимо прекратить и маловероятно, что оно будет возобновлено в течение следующих 72 часов;
- по состоянию ребенка энтеральное питание было прекращено более чем на 48 часов и маловероятно достижение достаточного прогресса при энтеральном питании в течение следующих 48 часов.
Сроки начала парентерального питания новорожденных:
- При наличии показаний к началу парентерального питания у доношенных и недоношенных новорожденных, его следует осуществить как можно скорее, но не позже, чем через 8 часов [9].
Прекращение парентерального питания новорожденных [9]:
- При принятии решения о том, когда прекратить парентеральное питание необходимо учитывать:
- переносимость ребенком энтерального питания;
- объем и состав нутриентов, доставляемых энтеральным питанием;
- относительный вклад парентерального и энтерального питания в общую потребность ребенка в пищевых ингредиентах;
- польза энтерального питания по сравнению с парентеральным в плане предупреждения риска развития катетер-ассоциированной инфекции кровотока.
- Для недоношенных детей, рожденных при сроке гестации ˂28 недель возможность прекращения парентерального питания, рассматривается в течение 24 часов после того, как объем энтерального питания достиг 140 – 150 мл/кг/сут.
- Для недоношенных детей, рожденных при сроке гестации ˃28 недель и для доношенных новорожденных следует рассмотреть возможность прекращения парентерального питания в течение 24 часов, если допустимый объем энтерального питания составляет 120 – 140 мл/кг/день.
Особые обстоятельства у конкретного ребенка (например, ребенок с синдромом короткой кишки, повышенной потерей из стомы, замедленным ростом) могут быть показанием к проведению длительного парентерального питания в связи со сложными потребностями
Противопоказания к процедуре/вмешательству: Парентеральное питание не проводится на фоне реанимационных мероприятий. Хирургические операции, ИВЛ и потребность в инотропной поддержке не являются противопоказанием к проведению парентерального питания
Перечень основных и дополнительных диагностических мероприятий:
Перед началом парентерального питания необходимо определить следующие показатели [7]:
- уровень глюкозы в крови;
- уровень электролитов (калий, натрий, кальций, магний и фосфат) в крови;
- содержание общего и прямого билирубина, трансаминаз в крови;
- содержание триглицеридов в плазме.
Во время проведения парентерального питания необходимо ежедневно определять следующие показатели [7]:
- динамику массы тела;
- диурез;
- уровень глюкозы в моче;
- уровень электролитов в крови;
- уровень глюкозы в крови (при увеличении скорости поступления глюкозы 2 раза в сутки);
- содержание триглицеридов в плазме (при увеличении дозы жиров ежедневно, в остальных случаях один-два раза в неделю).
При длительном (более 1 недели) парентеральном питании еженедельно необходимо определять следующие показатели [7]:
- Уровень глюкозы в крови;
- Уровень электролитов;
- Содержание общего и прямого билирубина, трансаминаз в сыворотке крови;
- Содержание триглицеридов в плазме (при увеличении дозы жиров ежедневно, в остальных случаях один-два раза в неделю);
- Уровень креатинина и мочевины в плазме. Для более точной оценки функции почек целесообразно определение цистатина С, поскольку этот показатель не зависит от мышечной массы ребенка;
- Уровень электролитов, как минимум уровень натрия в моче (при спонтанном мочеиспускании, а лучше в суточной моче).
Требования к проведению процедуры/вмешательства.
Обеспечение потребности в энергии [7]:
- При проведении парентерального и энтерального питания следует стремиться к полному покрытию всех компонентов потребляемой энергии для обеспечения адекватного роста и развития новорожденного. При наличии показаний к полному парентеральному питанию все потребности необходимо обеспечивать парентеральным путем. В остальных случаях (частичное ПП) парентерально должно вводиться лишь то количество энергии, которое недополучено энтеральным путем.
- В первый день жизни недоношенным новорожденным следует обеспечить по крайней мере 45–55 ккал/кг/день для удовлетворения минимальных потребностей в энергии (LOE 2+, RG 0, сильная рекомендация).
- У младенцев с очень низкой массой тела при рождении после начальной постнатальной потери веса рекомендуется стремиться к увеличению массы тела на 17-20 г/кг в день, чтобы предотвратить ее снижение по центильным кривым Фентона [2] (LOE 2+, RG 0, настоятельная рекомендация).
- У новорожденных с очень низкой массой тела при рождении необходимо обеспечить потребление энергии 90–120 ккал/кг/день, чтобы приблизиться к внутриутробному приросту и росту мышечной массы тела (LOE 2++, RG B, сильная рекомендация).
Таблица 1. Потребность новорожденных в энергии (ккал/кг) во время парентерального питания при различных фазах заболевания [7].
| - |
Острая фаза
|
Фаза стабилизации | Фаза восстановления |
| Недоношенный ребенок | 45-55* | 90-120 | |
|
Доношенный
Возраст от 0 до 1 года
|
45-50 | 60-65 | 75-85 |
| *рекомендуемый уровень потребляемой энергии в первый день жизни | |||
- Для расчета калорий можно исходить из следующего:
- 1 г углеводов = 4 ккал.
- 1 г белка = 4 ккал.
- 1 г жира = 10 ккал.
Обеспечение потребности в аминокислотах [3]
Около 30% поступающих аминокислот может использоваться для целей синтеза энергии. Приоритетной задачей является обеспечение синтеза новых белков, используемых на пластические процессы в организме ребенка.
- У недоношенных детей, не получающих достаточного количества питания энтеральным путем, обеспечение аминокислотами должно начинаться в первый день жизни, по крайней мере, из расчета 1,5 г/кг/сут для обеспечения анаболических процессов. (LOE 1++, RG A, сильная рекомендация).
- У недоношенных детей потребление аминокислот со 2-го дня жизни должно составлять от 2,5 г/кг/сут до 3,5 г/кг/сут и сопровождаться небелковым калориями (углеводами, жирами) для увеличения энергии на пластические процессы >65 ккал/кг/сут и адекватным потреблением микроэлементов. (LOE 1+, RG A, сильная рекомендация).
- У недоношенных детей парентеральное введение аминокислот выше 3,5 г/кг/сут следует назначать только в рамках клинических испытаний. (LOE 2+, RG 0, условная рекомендация).
- Минимальное потребление аминокислот 1,5 г/кг/день следует обеспечить стабильным доношенным детям, чтобы избежать отрицательного баланса азота, в то время как максимальное потребление аминокислот не должно превышать 3,0 г/кг/день. (LOE 1 (+), RG B, настоятельная рекомендация, устойчивый консенсус).
- Для обеспечения потребности в аминокислотах:
- недоношенным новорожденным следует вводить биодоступный цистеин (50–75 мг/кг/сут). (LOE 1 (+), RG B, условная рекомендация, устойчивый консенсус);
- нижний предел потребления тирозина для недоношенных детей должен составлять не менее 18 мг/кг/сутки. (LOE 2 (++), RG B, условная рекомендация, устойчивый консенсус);
- рекомендуемое потребление тирозина доношенным детям составляет 94 мг/кг в день. (LOE 1 (+), RG B, условная рекомендация, устойчивый консенсус);
- добавки аргинина могут использоваться для профилактики НЭК у недоношенных детей. (LOE: 1 (-), RG B, условная рекомендация, твердый консенсус).
- нижний предел потребления тирозина для недоношенных детей должен составлять не менее 18 мг/кг/сутки. (LOE 2 (++), RG B, условная рекомендация, устойчивый консенсус);
- рекомендуемое потребление тирозина доношенным детям составляет 94 мг/кг в день. (LOE 1 (+), RG B, условная рекомендация, устойчивый консенсус);
- добавки аргинина могут использоваться для профилактики НЭК у недоношенных детей. (LOE: 1 (-), RG B, условная рекомендация, твердый консенсус).
Обеспечение потребности в липидах [4]
- Парентеральное введение липидов решает возможность обеспечения энергией при малом объеме вводимой жидкости и дотации основных жирных кислот.
- В качестве источника энергии используются внутривенные липидные эмульсии, которые должны быть неотъемлемой частью ПП, исключающего или дополняющего энтеральное питание. (LoE 1-, RG A, настоятельная рекомендация, сильный консенсус).
- У недоношенных детей при наличии показаний к ПП, введение липидных эмульсий можно начинать сразу после рождения и не позже, чем на второй день жизни, а тем, у которых энтеральное питание было прекращено, липидные эмульсии можно включать, как только началось парентеральное питание (LoE 1, RG A, сильная рекомендация, сильный консенсус).
- У недоношенных и доношенных детей парентеральное потребление липидов не должно превышать 4 г/кг/день. (LoE 4, GPP, условная рекомендация, сильный консенсус).
- Для предотвращения дефицита незаменимых жирных кислот (НЖК) недоношенным детям можно назначать липидную эмульсию в дозе, обеспечивающей минимальное потребление линолевой кислоты 0,25 г/кг/день. Эта доза липидной эмульсии обеспечивает адекватное потребление линоленовой кислоты со всеми 20% ВЛЭ, зарегистрированными в настоящее время для педиатрического применения. (LoE 2-, RG 0, настоятельная рекомендация, сильный консенсус)
- Для предотвращения дефицита НЖК у доношенных новорожденных можно назначать липидную эмульсию в дозе, обеспечивающей минимальное потребление линолевой кислоты 0,1 г/кг/день, что также обеспечивает адекватное потребление линоленовой кислоты со всеми 20% ВЛЭ, зарегистрированными в настоящее время для использования у новорожденных детей (LoE 3-4, RG 0, условная рекомендация, твердый консенсус).
- У доношенных и недоношенных новорожденных и детей старшего возраста, получающих краткосрочное ПП, ВЛЭ на чистом соевом жире (СЖ) могут обеспечить менее сбалансированное питание, чем комбинированные ВЛЭ. При продолжительности ПП более нескольких дней ВЛЭ на чистом СЖ не должны использоваться, а комбинированные ВЛЭ с рыбьим жиром (РЖ) или без него должны быть терапией первого выбора (LoE 1 -, RG A, условная рекомендация, сильный консенсус).
- Новорожденным, в том числе недоношенным, ВЛЭ следует вводить в виде непрерывных инфузий с постоянной скоростью в течение 24 часов (LoE 2++, RG B, условная рекомендация за, сильный консенсус).
- У недоношенных детей ВЛЭ должны быть защищены валидированными светозащитными трубками. (LoE 1-, RG B, сильная рекомендация, сильный консенсус).
- У пациентов с тяжелой необъяснимой тромбоцитопенией следует контролировать концентрацию триглицеридов в сыворотке крови и можно рассмотреть вопрос о снижении дозы парентеральных липидов. (LoE 3-4, GPP, условная рекомендация, твердый консенсус).
- Маркеры функции печени, а также концентрацию триглицеридов в сыворотке крови следует регулярно контролировать у пациентов, получающих ВЛЭ, и чаще в случаях с выраженным риском гиперлипидемии (например, у пациентов с высокими дозами липидов или глюкозы, сепсисом, катаболизмом, у младенцев с крайне низкой массой тела при рождении) (LoE 2-, RG B, настоятельная рекомендация, сильный консенсус).
- Можно рассмотреть возможность снижения дозы ВЛЭ, если концентрация триглицеридов в сыворотке крови во время инфузии превышает 3 ммоль/л (265 мг/дл) у младенцев или 4,5 ммоль/л (400 мг/дл) у детей старшего возраста (LoE 4, GPP, условная рекомендация, сильный консенсус).
- Не следует добавлять раствор гепарина в жировую эмульсию.
Обеспечение потребности в углеводах [5]
- Углеводы – основной источник энергии и обязательный компонент парентерального питания независимо от срока гестации и массы тела при рождении.
- Количество глюкозы, которое должно быть обеспечено ПП, определяется [1] балансом между удовлетворением энергетических потребностей и рисками избыточной нагрузкой глюкозой [2], фазой заболевания (острая, стабильная, выздоровление/рост) [3], поступлением макронутриентов при энтеральном и парентеральном питании [4] и введением глюкозы вне энтерального и парентерального питания, т.е. с лекарствами (GPP, условная рекомендация).
- Следует избегать избыточного потребления глюкозы, поскольку это может быть причиной гипергликемии (LoE 1-, RG A, настоятельная рекомендация), вызывающей усиление липогенеза и отложение жировой ткани с последующим стеатозом печени и усиленной выработкой триглицеридов печенью (LOE 2+, RG B, настоятельная рекомендация), может вызывать повышенную выработку CO2 и минутную вентиляцию легких (LoE 2+, RG B, настоятельная рекомендация).
- Измерения уровня глюкозы в крови желательно проводить на оборудовании, валидированном для использования, таком как анализаторы газов крови (LoE 2+, RG B, настоятельная рекомендация).
- Рекомендуемое парентеральное введение глюкозы у недоношенных и доношенных новорожденных в мг/кг/мин (г/кг в день) (LoE 2+, RG B, условное), представлено в таблице 2.
Таблица 2. Рекомендуемые дозы глюкозы в мг/кг/мин (г/кг в день) для новорожденных [5]
| - |
День 1
Начинаете с
|
День 2 и далее
Постепенно увеличивайте в течение 2-3 дней до
|
| Недоношенный | 4-8 (5.8 – 11.5) |
Целевой
8 – 10 (11.5 – 14.4)
Мин 4 (5.8); макс. 12 (17.3)
|
| Доношенный | 2,5 – 5 (3.6 – 7.2) |
Целевой
5 – 10 (7.2 – 14.4)
Мин 2.5 (3.6); макс. 12 (17.3)
|
- Новорожденные в возрасте до 28 дней, у которых имеется эпизод острого заболевания, такого как инфекция или сепсис, должны временно получать углеводы, уровень которых указан в табл.2 для 1-го дня (GPP, условная рекомендация).
- Гипергликемию >8 ммоль/л (145 мг/дл) следует избегать у новорожденных пациентов, поскольку она связана с повышенной заболеваемостью и смертностью (Уровень доказательности 2-, RG B, настоятельная рекомендация).
- У новорожденных повторяющиеся уровни глюкозы в крови >10 ммоль/л (180 мг/дл) следует лечить с помощью инсулинотерапии, при условии обеспечения адаптации разумной скорости инфузии глюкозы, если она оказалась недостаточной (LoE 2++, RG 0, условная рекомендация)
- Повторяющуюся и/или длительную гипогликемию 2,5 ммоль/л (45 мг/дл) и менее следует избегать у всех детей, получающих интенсивную терапию (экстраполированный LoE 2+, RG 0, настоятельная рекомендация).
Обеспечение потребности в жидкости и электролитах [1].
- Введение жидкости для нутритивных целей определяется необходимостью:
- обеспечения экскреции мочи для элиминации продуктов обмена;
- компенсации неощутимых потерь воды (с испарением с кожи и при дыхании); дополнительного количества для обеспечения формирования новых тканей (для прироста массы на 15-20 г/кг/ сут требуется от 10 до 12 мл/кг/сут воды);
- восполнения ОЦК при артериальной гипотензии или шоке.
- Объем жидкости в составе парентерального питания рассчитывается с учетом:
- баланса жидкости;
- объема энтерального питания (энтеральное питание в объеме до 25 мл/кг не учитывается при расчете необходимой жидкости и нутриентов);
- диуреза;
- динамики массы тела;
- уровня натрия.
В постнатальном периоде в зависимости от изменений водно-электролитного обмена выделяются: период транзиторной убыли массы, период стабилизации массы и период стабильного нарастания массы тела.
В период транзиторной убыли массы тела (фаза I)
- У доношенных новорожденных постнатальная потеря веса происходит в течение первых 2-5 дней жизни и не должна превышать 10% массы тела при рождении (LoE 2+, RG 0, условная рекомендация)
- У детей с ОНМТ и ЭНМТ снижение массы тела на 7-10% является адекватным, учитывая более высокое содержание воды в их организме и неблагоприятные осложнения, связанные с перегрузкой жидкостью (LoE 2+, RG B, сильная рекомендация)
- Недоношенным и доношенным новорожденным после рождения рекомендуется постепенное увеличение потребления жидкости (LoE 3, RG B, настоятельная рекомендация) (см.табл.3).
- Электролиты (Na, Cl и K) следует назначать, начиная с I фазы первоначальной потери массы тела (LoE 3, RG 0, сильная рекомендация).
- Потребление хлора должно быть немного ниже, чем сумма потребления натрия и калия [(Na + K) – Cl = 1-2 ммоль/кг/сутки], чтобы избежать чрезмерного поступления хлора и риска ятрогенного метаболического ацидоза (LoE 3, RG 0, настоятельная рекомендация).
- Детям с ЭНМТ и ОНМТ с первого дня жизни можно рекомендовать введение Na и K при обеспечении должного высокого уровня аминокислот и энергии, при условии, что установлен диурез, и принимая во внимание возможность развития неолигурической гиперкалиемии (LoE 2+, RG 0, условная рекомендация).
- Следует признать, что потребности отдельных пациентов могут заметно отклоняться от диапазонов обычно рекомендуемых доз в зависимости от клинического состояния, таких как задержка жидкости, обезвоживание или чрезмерная потеря жидкости и другие (GPP, настоятельная рекомендация).
В промежуточной фазе (фаза II)
- После первоначальной постнатальной потери масса тела обычно должна восстанавливаться к 7-10 дням жизни (GPP, условная рекомендация) (см. табл.4).
В фазе стабильного роста (фаза III)
- Следует поддерживать водно-электролитный гомеостаз, пока младенец набирает соответствующий вес в фазе стабильного роста (LoE 3, RG B, сильная рекомендация) (см. табл. 5)
Таблица 3. Рекомендуемый объем водно-электролитного гомеостаза у новорожденных детей в фазе I [1]
| - | Сутки после рождения | ||||
| 1 | 2 | 3 | 4 | 5 | |
|
Потребление жидкостиа, (мл/кг/сут)
Доношенные
Недоношенные >1500 г
Недоношенные 1000-1500 г
Недоношенные <1000 г |
40-60
60-80
70-90
80-100
|
50-70
80-100
90-110
100-120
|
60-80
100-120
110-130
120-140
|
60-100
120-140
130-150 140-160 |
100-140 140-160 160-180 160-180 |
|
Na b, d (ммоль/кг/сут)
Доношенные
Недоношенные >1500 г
Недоношенные <1500 г
|
0-2
0-2(3)
0-2(3)
|
0-2
0-2 (3)
0-2 (3)
|
0-2
0-3
0-5 (7)
|
1-3
2-5
2-5 (7)
|
1-3
2-5
2-5 (7)
|
| K c, d (ммоль/кг/сутки) | 0-3 | 0-3 | 0-3 | 2-3 | 2-3 |
| Cl (ммоль/кг/сутки) | 0-3 | 0-3 | 0-3 | 2-5 | 2-5 |
|
а Послеродовые потребности в жидкости сильно зависят от условий лечения и факторов окружающей среды. Определенные клинические состояния могут позволить модифицировать ежедневное потребление жидкости, например, при фототерапии объем жидкости увеличивается примерно на 10–20%, а у младенцев с асфиксией, респираторным дистресс-синдромом на механической вентиляция легких увлажненными дыхательными газами, наоборот объем жидкости уменьшается примерно на 10–20%.
b Тщательная коррекция введения жидкости и электролитов необходима у детей с ЭНМТ с началом установления диуреза и у пациентов с полиурией. В случаях высоких потерь Na с мочой потребность в поступлении Na может превышать 5 ммоль/кг/сутки, особенно у новорожденных <1500 г в конце фазы I.
c При назначении K следует учитывать начальную фазу олигурии и риск неолигурической гиперкалиемии у детей с ОНМТ. Во избежание гиперкалиемии может потребоваться отсрочка введения парентерального калия.
d Парентеральное введение Na и K следует начинать до падения их концентрации в сыворотке крови ниже рекомендованных значений в табл.3.
e Рекомендации в таблице 3 основаны на клиническом опыте, мнении экспертов и экстраполированных данных различных исследований на животных и людях.
|
|||||
Таблица 4. Рекомендуемый объем водно-электролитного гомеостаза у новорожденных детей во время транзиторной фазе II [1]
|
Объем жидкости (мл/кг/сут)
|
Na (ммоль/кг/сут) | K (ммоль/кг/сут) | Cl (ммоль/кг/ сут | |
| Доношенные | 140-170 | 2-3 | 1-3 | 2-3 |
| Недоношенные >1500 г | 140-160 | 2-5 | 1-3 | 2-5 |
| Недоношенные <1500 г | 140-160 | 2-5 (7) | 1-3 | 2-5 |
Таблица 5. Рекомендуемый объем водно-электролитного гомеостаза у новорожденных детей во время фазы стабильного роста III [1]
|
Объем жидкости (мл/кг/сут)
|
Na (ммоль/кг/сут) | K (ммоль/кг/сут) | Cl (ммоль/кг/сут) | |
| Доношенные | 140-160 | 2-3 | 1,5-3 | 2-3 |
| Недоношенные >1500 г | 140-160 | 3-5 | 1-3 | 3-5 |
| Недоношенные <1500 г | 140-160 | 3-5 (7) | 2-5 | 3-5 |
Обеспечение потребности в препаратах железа и в микроэлементах [10,11].
Железо. У пациентов, получающих ПП, при наличии показаний препараты железа предпочтительно вводить энтерально, а не парентерально, если они хорошо переносятся. (Уровень доказательности 4, ОР 0, настоятельная рекомендация, сильный консенсус).
Железо. У пациентов, получающих ПП, при наличии показаний препараты железа предпочтительно вводить энтерально, а не парентерально, если они хорошо переносятся. (Уровень доказательности 4, ОР 0, настоятельная рекомендация, сильный консенсус).
- Рутинное введение железа не следует назначать при краткосрочном ПП (<3 недель) (Уровень доказательности 4, ОР 0, условная рекомендация, сильный консенсус).
- Пациенты, получающие длительное ПП и не способные поддерживать адекватный статус железа с помощью его энтеральных добавок, должны получать парентеральные добавки железа. (LoE 4, RG 0, настоятельная рекомендация, сильный консенсус).
- Железо при проведении ПП можно вводить ежедневно, добавляя к раствору для ПП, или в виде прерывистых отдельных инфузий. (GPP, условная рекомендация, сильный консенсус).
- При ежедневном введении препаратов железа их рутинное парентеральное введение, при условии отсутствия их энтерального введения, рекомендуется в дозе 200–250 мкг/кг/сут недоношенным детям и 50–100 мкг/кг/сут. до максимальной дозы 5 мг в сутки младенцам и детям (LoE 4, RG 0, условная рекомендация, сильный консенсус).
- Статус железа (по крайней мере, ферритин и гемоглобин) следует регулярно контролировать у пациентов, длительно принимающих ПП, чтобы предотвратить дефицит железа и перегрузку железом. (LoE 4, RG 0, сильная рекомендация, сильный консенсус)
- Цинк следует назначать при ПП в дозе 400-500 мкг/кг/сут у недоношенных детей, 250 мкг/кг/сут у детей в возрасте до 3 месяцев, 100 мкг/кг/сут у детей от 3 до 12 месяцев (Уровень доказательности 4, СР 0, сильная рекомендация, сильный консенсус).
- Статус цинка (сывороточный цинк, щелочная фосфатаза) следует периодически контролировать у пациентов, при длительном ПП, и чаще у пациентов с высоким очищением желудочно-кишечного содержимого (обычно потери через илеостому), у которых могут иметь значительно более высокие потребности в цинке. (LoE 3, RG 0, сильная рекомендация, сильный консенсус).
- Медь следует назначать при ПП в дозе 40 мкг/кг/сутки у недоношенных и 20 мкг/кг/сут. у доношенных новорожденных и детей (LoE 4, RG 0, настоятельная рекомендация, сильный консенсус).
- Йод следует назначать при ПП в суточной дозе 1–10 мкг/кг недоношенным и не менее 1 мкг/кг в сутки младенцам и детям. (Уровень доказательности 4, степень вероятности 0, настоятельная рекомендация, сильный консенсус).
- При длительном ПП следует регулярно контролировать йодный статус путем измерения концентрации гормонов щитовидной железы (уровень доказательности 4, степень вероятности 0, условная рекомендация, сильный консенсус).
- Селен следует назначать при ПП в дозе 7 мг/кг/сутки у недоношенных и 2–3 мкг/кг/сутки у младенцев и детей, при максимальной дозе 100 мкг/сутки для рутинной добавки (LoE 4, RG 0, сильная рекомендация, сильный консенсус).
- Статус селена в плазме следует регулярно контролировать при длительном ПП и у пациентов с почечной недостаточностью. (LoE 4, RG 0, условная рекомендация, твердый консенсус).
- Марганец следует вводить при длительном ПП в дозе не более 1 мкг/кг/день (максимум 50 мкг/день для рутинного приема) (LoE 4, RG 0, условная рекомендация, сильный консенсус).
- Концентрацию марганца в крови необходимо постоянно мониторировать у пациентов, получающих ПП в течение длительного времени (уровень доказательности 4, степень вероятности 0, условная рекомендация, сильный консенсус).
- Молибден следует вводить при длительном ПП в дозе не более 1 мкг/кг в день у маловесных детей и 0,25 мкг/кг в день (максимум до 5,0 мкг/день) у младенцев и детей. (LoE 4, RG 0, условная рекомендация, твердый консенсус).
- Хром содержится в растворах для ПП в концентрации, удовлетворяющей требованиям, поэтому добавление хрома считается ненужным, потребление Cr при ПП не должно превышать 5 мкг/день. (GPP, условная рекомендация, твердый консенсус).
- Кальций, магний, фосфор. Младенцам, получающим ПП, следует давать соответствующие количества Ca, P и магния для обеспечения оптимального роста, и минерализации костей (GPP, настоятельная рекомендация).
- Прирост минералов у плода, здорового младенца, ребенка и подростка можно использовать в качестве эталона для обеспечения Ca, P и Mg (см. табл.6) (GPP, условная рекомендация).
- У каждого ребенка адекватное ПП должно обеспечивать одновременный небольшой избыток кальция, фосфора и магния для обеспечения оптимального прироста минералов в тканях и костях (GPP, условная рекомендация)
- Инфузия кальция может использоваться для профилактики и лечения ранней неонатальной гипокальциемии, которая часто встречается и, как правило, не связана с очевидными клиническими проблемами, такими как судороги (GPP, условная рекомендация).
- У недоношенных детей на ПП, матери которых подвергались терапии магнием, потребление магния необходимо адаптировать к постнатальным концентрациям в крови (LoE 2, RG B, условная рекомендация).
- Кислые растворы, упакованные в стеклянные флаконы, такие как глюконат кальция, загрязнены алюминием и не должны использоваться при ПП (LoE 3, RG 0, настоятельная рекомендация).
- Рекомендуется использовать органические соли Ca и P для приготовления растворов ПП для предотвращения преципитации (GPP, настоятельная рекомендация)
- Адекватность потребления Ca и P у недоношенных детей можно корректировать до тех пор, пока оба препарата не начнут выделяться одновременно с низкой концентрацией мочи (> 1 ммоль/л), указывающей на небольшой избыток (экстраполированные данные, полученные в исследованиях энтерального питания LoE 2+, RG B, условная рекомендация)
- Рекомендуемые дозы парентерального приема для потребления кальция, фосфора и магния у новорожденных и детей, находящихся на парентеральном питании, в ммоль (мг)/кг/сутки отражены в таблице 6 (LoE 2, 3 и 4, RG 0, условная рекомендация)
Таблица 6. Потребность в электролитах при парентеральном питании у новорожденных детей [11].
|
Возраст
|
Ca
ммоль(мг)/кг/сутки
|
P
ммоль(мг)/кг/сутки
|
Mg
ммоль(мг)/кг/сутки
|
| Недоношенные дети в первые дни жизни | 0.8-2.0 (32-80) | 1.0-2.0 (31-62) | 0.1-0.2 (2.5-5.0) |
| Растущие недоношенные | 1.6-3.5 (64-140) | 1.6-3.5 (50-108) | 0.2-0.3 (5.0-7.5) |
| 0–6 мес* | 0.8-1.5 (30-60) |
0.7-1.3 (20-40)
|
(2.4-5) |
| *в том числе доношенные новорожденные | |||
- У недоношенных детей с задержкой внутриутробного развития на фоне ПП необходим тщательный мониторинг концентрации фосфатов в плазме в первые дни жизни для предотвращения тяжелой гипофосфатемии, которая может привести к мышечной слабости, дыхательной недостаточности, сердечной дисфункции и смерти (LoE 3, RG 0, сильная рекомендация)
- Недоношенным новорожденным, получающим раннее ПП в первые дни жизни, рекомендуется более низкое потребление кальция, фосфора и магния, чем у растущих стабильных недоношенных детей (таблица 6) (Уровень доказательности 2, RG B, условная рекомендация)
- При раннем ПП, когда кальций и потребление фосфора низкое (таблица 6), а белок и энергия оптимизированы, рекомендуется использовать молярное соотношение Ca:P ниже 1 (0,8–1,0) для снижения частоты ранней постнатальной гиперкальциемии и гипофосфатемии (LoE 2, RG B, настоятельная рекомендация)
- У младенцев и детей, получающих ПП, требуется регулярный мониторинг индивидуальной щелочной фосфатазы, концентраций Ca, P и Mg в сыворотке крови и концентраций Ca и P в моче (Экстраполированные данные из LoE 2 и 3 исследования, СР 0, сильная рекомендация)
- У младенцев и детей, длительно получающих ПП, риск метаболического заболевания костей требует периодического мониторинга содержания кальция, фосфора, витамина D и минерального статуса костей (Уровень доказательности 2+ и 3, СР 0, сильная рекомендация).
Обеспечение потребности в витаминах [12]:
- Младенцы и дети на ПП должны получать витамины парентерально (LoE 4, RG 0, настоятельная рекомендация).
- По возможности, водо- и жирорастворимые витамины следует добавлять в липидную эмульсию или смесь, содержащую липиды, для повышения стабильности витаминов. (LoE 4, RG 0, настоятельная рекомендация).
- Витамины следует принимать ежедневно, если это возможно. Жирорастворимые витамины следует давать одновременно с липидными эмульсиями; исключение составляет витамин К, который можно давать еженедельно. Прерывистое замещение два или три раза в неделю имеет гипотетический риск побочных эффектов от кратковременных высоких уровней. (LoE 4, RG 0, настоятельная рекомендация).
- Оптимальные дозы и условия инфузии витаминов у младенцев и детей не установлены. Витамины следует давать в дозах, указанных в таблице 7. Однако в основном они основаны на мнении экспертов. (GPP, условная рекомендация).
- Рутинный мониторинг концентрации витаминов (за исключением витамина D) не рекомендуется из-за отсутствия доказательств адекватной пользы. У пациентов, находящихся на длительном ПП (недели), может потребоваться мониторинг витаминов на основании клинических показаний. (LoE 4, RG 0, условная рекомендация).
- Недоношенные дети на ПП должны получать 700–1500 МЕ/кг/день (или 227–455 мкг/кг/день) витамина А, доношенные дети — 150–300 мкг/кг/день (или 2300 МЕ (697 мкг/день), а детям старшего возраста 150 мкг/день. (LoE 3, RG 0, настоятельная рекомендация).
- При введении водорастворимого раствора происходит значительная потеря витамина А; поэтому жирорастворимые витамины парентерально следует вводить вместе с липидной эмульсией, когда это возможно. (LoE 3, RG 0, сильная рекомендация).
- Недоношенные дети на ПП должны получать 200–1000 МЕ/день (или 80–400 МЕ/кг/день) витамина D, доношенные дети до 12 месяцев — 400 МЕ/день (или 40–150 МЕ/кг/сут), а детям старшего возраста 400–600 МЕ/сут. (LoE 3, RG 0, настоятельная рекомендация).
- Пероральное добавление витамина D следует рассматривать у пациентов на частичном ПП, а также во время отлучения от парентерального питания. (LoE 3, RG 0, настоятельная рекомендация).
- Для недоношенных детей общая доза витамина Е должна составлять от 2,8 до 3,5 мг/кг/день, но не должна превышать 11 мг/день. (LoE 2+, RG B, настоятельная рекомендация).
- Для правильной оценки статуса витамина Е следует использовать соотношение между витамином Е в сыворотке крови и общим содержанием липидов в сыворотке крови (GPP, условная рекомендация).
- Недоношенные и доношенные дети до 12 месяцев на ПП, должны получать 10 мкг/кг/день, а дети старшего возраста — 200 мкг/день витамина К. (Уровень доказательности 3, СР 0, настоятельная рекомендация).
- Классические тесты, характеризующие процессы свертывания крови, могут использоваться у младенцев из группы низкого риска для косвенной оценки статуса витамина К, но они не специфичны для дефицита витамина К (LoE 3, RG 0, условная рекомендация).
- Недостаточно карбоксилированные сывороточные витамин К-зависимые факторам свертывания крови (PIVKA-II), по-видимому, являются полезным биомаркером субклинического дефицита витамина К для пациентов из группы риска и их следует использовать, когда они доступны в МО. (LoE 3, RG 0, условная рекомендация).
- Новорожденные, которые не могут принимать перорально витамин К или чьи матери принимали лекарства, нарушающие метаболизм витамина К, должны следовать специальному протоколу приема добавок в соответствии с местными правилами. (LoE 4, RG 0, сильная рекомендация).
- Недоношенные и доношенные дети до 12 месяцев на ПП, должны получать 15–25 мг/кг/день, а дети старшего возраста — 80 мг/день витамина С. (LoE 3, RG 0, сильная рекомендация).
- Недоношенные и доношенные дети до 12 месяцев на ПП, должны получать 0,35–0,50 мг/кг/день, а дети старшего возраста — 1,2 мг/день тиамина. (GPP, условная рекомендация).
- Недоношенные и доношенные дети до 12 месяцев на ПП, должны получать 0,15–0,2 мг/кг/день, а дети старшего возраста — 1,4 мг/день рибофлавина. (GPP, условная рекомендация).
- Недоношенные и доношенные дети до 12 месяцев на ПП, должны получать 0,15–0,2 мг/кг/день, а дети старшего возраста — 1,0 мг/день пиридоксина. (GPP, условная рекомендация).
- Недоношенные и доношенные дети до 12 месяцев на ПП, должны получать 0,3 мкг/кг/день, а дети старшего возраста — 1 мкг/день кобаламина. (GPP, условная рекомендация).
- Недоношенные и доношенные дети до 12 месяцев на ПП, должны получать 4–6,8 мг/кг/день, а дети старшего возраста — 17 мг/день никотиновой кислоты. (GPP, условная рекомендация).
- Недоношенные и доношенные дети до 12 месяцев на ПП, должны получать 2,5 мг/кг/день, а дети старшего возраста — 5 мг/день пантотеновой кислоты. (GPP, условная рекомендация).
- Недоношенные и доношенные дети до 12 месяцев на ПП, должны получать 5–8 мкг/кг/день, а дети старшего возраста — 20 мкг/день биотина. (GPP, условная рекомендация).
- Недоношенные и доношенные дети в возрасте до 12 месяцев на ПП, должны получать 56 мкг/кг/день, а дети старшего возраста — 140 мкг/день фолиевой кислоты. Необходимо подтвердить адекватность существующих рекомендаций. (LoE 3, RG 0, настоятельная рекомендация).
Методы введения препаратов для парентерального питания [13].
Венозный доступ:
- У новорожденных и детей PICC и туннельный ЦВК следует использовать для пролонгированного ПП во время госпитализации (GPP, настоятельная рекомендация).
- ЦВК следует использовать только для введения препаратов ПП (LOE 2À, RG B, настоятельная рекомендация).
- Следует использовать катетер с минимальным количеством портов или просветов (LOE 2À, RG 0, настоятельная рекомендация).
- Если многопросветный ЦВК установлен, выделить один просвет для ПП; следует избегать забора, переливания крови и мониторинга центрального венозного давления через ЦВК (Экстраполированные данные исследований взрослых с оценкой LOE 1А, RG B, настоятельная рекомендация).
- Для улучшения качества жизни пациентов, находящихся на длительном ПП, рекомендуется забор крови через ЦВК для рутинного мониторинга при условии соблюдения протокола по асептике и антисептике (GPP, настоятельная рекомендация).
- Катетеры, используемые для длительного ПП, могут быть изготовлены из силикона или полиуретана (LOE 2А, RG 0, настоятельная рекомендация).
- ЦВК с антимикробным покрытием не следует использовать у детей на длительном ПП (Экстраполированные данные исследований взрослых с рейтингом LOE 1+, RG B, условная рекомендация против).
- У новорожденных пупочные сосуды могут использоваться для краткосрочного ПП (GPP, условная рекомендация).
- Кончик ЦВК должен находиться вне перикардиального мешка, чтобы избежать риска перикардиального выпота/тампонады (GPP, настоятельная рекомендация).
- У детей, как и у взрослых, рекомендуется располагать кончик ЦВК над Кариной, что означает, его нахождение в верхней полой вене и, следовательно, вне перикардиального мешка (LOE 3, RG 0, настоятельная рекомендация за).
- Кончик бедренного катетера должен располагаться над почечными венами (первый поясничный позвонок) (GPP, настоятельная рекомендация).
- Чрескожное, рентгенологическое или ультразвуковое исследование можно использовать для постановки катетера под контролем, так как они столь же эффективны, как и хирургическое вмешательство, и несут меньший риск осложнений (УД 2–, КО 0, настоятельная рекомендация).
- Ультразвуковой контроль может использоваться для уменьшения осложнений во время венозной катетеризации (УД 1). 2А, СР 0, настоятельная рекомендация).
- ЦВК не следует менять рутинно, чтобы снизить риск сепсиса (Экстраполированные данные исследований взрослых, оценены как LoE 1+, СР А, настоятельная рекомендация против).
- Удаление, переустановка ЦВК, а не замена по проводнику снижает риск инфицирования. Замена ЦВК может быть предусмотрена только для пациентов с затрудненным венозным доступом (Экстраполированные данные исследований взрослых с оценкой УО 3, СР 0, условная рекомендация).
- Профилактическое назначение антибиотиков не снижает риск инфекции кровотока, связанной с установкой катетера, поэтому их не следует назначать (Уровень доказательности 2+, RG B, условная рекомендация против).
- Антибактериальные «замки» катетеров не следует использовать отдельно для лечения инфекций кровотока, связанных с установкой катетеров, поскольку их эффективность не доказана (LoE 1-, RG B, условная рекомендация против)
- Антибактериальные «замки» катетеров могут быть использованы в сочетании с системными антибиотиками для лечения инфекции кровотока, связанных с установкой катетеров у некоторых пациентов (LoE 3, RG 0, условная рекомендация).
- «Замки» катетеров этанолом могут быть рассмотрены для предотвращения инфекции кровотока, связанных с установкой катетеров (LoE 3, RG 0, условная рекомендация).
- Тауролидин* эффективен для предотвращения инфекции кровотока, связанных с катетером, и должен использоваться при длительном нахождении катетера в сосуде (Экстраполированные данные исследований взрослых, оцененные как LoE 1+, RG B, настоятельная рекомендация).
- Промывание гепарином для профилактики тромботической окклюзии ЦВК, используемое ежедневно, не может быть рекомендовано по сравнению с промыванием физиологическим раствором из-за отсутствия доказанной пользы у детей (Уровень доказательности 2А, СР 0, условная рекомендация против).
- Промывание периодически используемого катетера гепаринизированным физиологическим раствором (5–10 ЕД/мл) 1–2 раза в неделю помогает поддерживать его проходимость и, следовательно, может быть рекомендовано для применения (экстраполированные данные исследований взрослых, оцененные как LoE 2–, RG 0, условная рекомендация).
- Было показано, что рутинное использование гепарина эффективно для предотвращения окклюзии PICC у новорожденных, но, поскольку потенциальные риски не определены, его рутинное использование не может быть рекомендовано (LoE 3, RG 0, рекомендация для исследования).
- У младенцев и детей для разблокирования катетера следует использовать рекомбинантный активатор тканевого плазминогена или урокиназу (LoE 1+, RG A, настоятельная рекомендация).
- Перед доступом к внутрисосудистому устройству или месту его введения необходимо соблюдать соответствующие процедуры гигиены рук (Экстраполированные данные исследований взрослых, оцененные как степень защиты 1+, степень вероятности B, настоятельная рекомендация).
- Перед постановкой внутрисосудистого устройства и после постановки катетера для ухода за местом введения, кожу следует дезинфицировать 2% раствором хлоргексидина в 70% изопропиловом спирте (Экстраполированные данные исследований взрослых, оценены как LoE 1, RG B, настоятельная рекомендация).
- Антисептический раствор должен оставаться на месте введения и необходимо дать время высохнуть на воздухе перед введением катетера или наложением повязки (GPP, настоятельная рекомендация).
- Из-за потенциальных побочных эффектов не рекомендуется проводить антисептическую обработку кожи хлоргексидином у детей младше двух месяцев (LOE 2À, RG 0, условная рекомендация против).
- Коннекторы катетеров, порты следует дезинфицировать перед доступом, предпочтительно 2% раствор хлоргексидина в 70% изопропиловом спирте (LoE 2+, RG B, настоятельная рекомендация).
- Для покрытия места введения катетера можно использовать как стерильную марлю с лентой, так и прозрачную полупроницаемую полиуретановую повязку (LoE 3, RG 0, условная рекомендация).
- Стерильная марлевая повязка предпочтительнее, если место установки катетера кровоточит или просачивается (GPP, условная рекомендация для). (LoE 2А, RG 0, условная рекомендация).
- При краткосрочном ЦВК местные повязки можно менять каждые 2 дня на марлевую повязку и каждые семь дней на прозрачную повязку. (LoE 2А, RG 0, условная рекомендация)
- Повязку следует менять раньше, если она становится влажной, ослабленной или загрязненной (GPP, настоятельная рекомендация).
- Туннельный ЦВК с хорошо зажившим местом выхода не требует повязки для предотвращения смещения, тем не менее, у детей целесообразно носить их с петлей и накрывать (GPP, условная рекомендация).
- Местная антимикробная обработка в месте введения не может использоваться рутинно, поскольку она может способствовать грибковой инфекции, резистентности к противомикробным препаратам и повреждению поверхности катетера (LoE 3, RG 0, настоятельная рекомендация против).
- Мультимодальные протоколы для поставщиков медицинских услуг, направленные на стандартизацию клинической практики по установке и обслуживанию внутрисосудистых устройств, должны быть разработаны и регулярно проверяться (LoE 2+, RG B, настоятельная рекомендация).
Препараты для проведения процедуры и/или вмешательства.
Стандартизированные препараты для парентерального питания [9.15]
- Согласно последним международным рекомендациям для новорожденных, в том числе и для недоношенных детей предпочтительным является использование готовых стандартизированных препаратов для парентерального питания, которые в заводских условиях укомплектованы таким образом, что пакет состоит из трех отсеков, содержащих основные макронутриенты (аминокислоты, жировые эмульсии, глюкозу) и электролиты с учетом их потребностей у конкретного контингента детей. Все три компонента перед использованием смешиваются с помощью надавливания, что исключает вскрытие отсеков и контакт их содержимого с внешней средой и, таким образом, исключается риск внутрибольничной инфекции и медицинских ошибок [7,9].
- Рабочая группа Американского общества специалистов по парентеральному и энтеральному питанию (A.S.P.E.N.) сообщает, что фактические данные свидетельствуют о преимуществах в эффективности, экономии и клинической целесообразности в случае использования стандартизированных смесей для ПП по сравнению с индивидуализированными смесями. Стандартизированные препараты для ПП готовы к немедленному использованию, обеспечивают лучший прирост веса и развитие, способствуют снижению риска возникновения внутригоспитальных инфекций, приводят к снижению риска врачебных ошибок и ошибок при смешивании препаратов.
- Стандартизированные растворы (заводского приготовления, трехкамерные) для ПП, как правило, следует использовать вместо индивидуальных растворов для ПП у большинства детей и новорожденных, включая недоношенных детей с ОНМТ (УД 2 для недоношенных детей и УД 3 для детей, СР 0, условная рекомендация за).
- Индивидуально подобранный раствор для ПП, как правило, следует использовать, когда пищевые потребности не могут быть удовлетворены с помощью имеющегося ассортимента стандартных препаратов для ПП (например, у очень больных и метаболически нестабильных пациентов, таких как пациенты с аномальной потерей жидкости и электролитов; длительные периоды, например, при синдроме короткой кишки (LoE 2, RG B, настоятельная рекомендация за).
- Компьютеризированные рецепты, будь то стандартные или индивидуальные, должны использоваться в процессе заказа ПП, когда это возможно (LoE 2+, RG B, настоятельная рекомендация).
Требования к проведению процедуры и/или вмешательства [14]:
Парентеральное питание может осуществляться через периферические, центральные и глубокие линии [7].
- Периферический доступ используется в том случае, когда не планируется проводить парентеральное питание длительно, и не будут использоваться гиперосмолярные растворы.
- Центральный венозный доступ применяется в том случае, когда планируется длительное парентеральное питание с использованием гиперосмолярных растворов.
- В качестве косвенного показателя осмолярности используется концентрация глюкозы в растворе. В периферическую вену не рекомендуется вводить растворы с концентрацией глюкозы более 12,5%.
- Для точного расчета осмолярности раствора используется формула:
- Растворы, расчётная осмолярность которых превышает 850-1000 мосм/л, в периферическую вену вводить не рекомендуется.
- В клинической практике при расчете осмолярности следует считать концентрацию сухого вещества.
Расчет программы парентерального питания.
Порядок расчета парентерального питания у недоношенных детей:
1.Расчет суточного объема жидкости:
- В суточный объем жидкости входят все жидкости, вводимые ребенку: парентеральное питание, энтеральное питание, жидкость в составе парентерально вводимых антибиотиков. Минимальное трофическое питание (менее 25 мл/кг в сутки), обязательно проводимое в первые сутки жизни, не учитывается в общем объеме жидкости:
- m (кг) × доза жидкости (мл/кг/сутки) = суточная доза жидкости (мл/сутки)
- При объеме энтерального питания, превышающем трофический:
- суточная доза жидкости (мл/сутки) – объем энтерального питания (мл/сутки) = суточный объем парентерального питания.
1. Расчет суточного объема белка:
- Вес ребенка в килограммах умножается на расчетную дозу парентерального белка на 1 кг массы тела (см. табл. 6) с учетом вводимого энтерального белка (при объеме энтерального питания, превышающем трофический):
- m (кг) × доза белка (г/кг/сутки) = суточная доза белка (г/сутки).
- При использовании 10% раствора аминокислот суточная доза белка умножается на 10:
- суточная доза белка (г/сутки) × 10 = количество 10% раствора аминокислот в мл на сутки.
- При расчете частичного парентерального питания:
- из суточного объема энтерального питания высчитывается доза белка в граммах и результат вычитается из суточной дозы белка.
2. Расчет суточного объема эмульсии жиров:
- Вес ребенка (кг) умножается на расчетную дозу жира на 1 кг массы тела с учетом вводимого энтерального белка (при объеме энтерального питания, превышающем трофический).
- При использовании 20% эмульсии жиров: суточная доза жиров умножается на 5, при использовании 10% умножается на 10, получается объем в мл/сутки:
- При расчете частичного парентерального питания в суточном объеме энтерального питания высчитывается доза жира в граммах, и результат вычитается из суточной дозы жира.
3. Расчет суточного объема электролитов.
- Расчет дозы натрия при использовании физиологического раствора:
- Расчет дозы натрия при использовании 10% раствора хлорида натрия в составе комбинированного раствора:
- Расчет дозы калия:
- Расчет дозы кальция:
- Расчет дозы магния:
4. Расчет суточного объема углеводов:
- Вычисляем количество граммов глюкозы за сутки: умножаем вес ребенка в килограммах на расчетную дозу скорости утилизации глюкозы (см. табл.), умножаем на коэффициент 1,44.
- Скорость введения углеводов (мг/кг 1 мин) × m (кг) × 1,44 = доза глюкозы (г/сутки).
- При расчете частичного парентерального питания ― в суточном объеме энтерального питания высчитывается доза углеводов в граммах и вычитается из суточной дозы углеводов.
5.Расчет объема вводимой жидкости, приходящейся на глюкозу
- Из суточной дозы жидкости (мл/сут) вычесть объем энтерального питания, суточный объем белков, жиров, электролитов, жидкость в составе парентерально вводимых антибиотиков.
Суточный объем парентерального питания (мл) – суточный объем белка (мл) – суточный объем жировой эмульсии (мл) – суточный объем электролитов (мл) – объем жидкости в составе парентерально вводимых антибиотиков, инотропных препаратов и т.д. – объем растворов витаминов (мл) = объем раствора глюкозы (мл).
- Для адекватного восполнения жидкости после вычета ниже приведенных объемов жидкости, оставшийся объем восполняется глюкозосодержащим раствором или же водой для инъекций.
- Применение глюкозосодержащих растворов показано в том случае, если при помощи комбинированного раствора глюкозы различной концентрации можно восполнить оставшуюся потребность в жидкости. Если в распоряжении имеются только растворы с высоким содержанием глюкозы (напр., 50% глюкозы), то это вызовет слишком высокую дотацию углеводов. В этом случае количество раствора глюкозы следует рассчитать с учетом необходимых калорий углеводов, а недостающее количество жидкости восполнить водой для инъекций.
- Подбор объемов растворов глюкозы.
При изготовлении раствора вне аптеки из стандартных – 5%, 10% и 40% глюкозы используется следующий метод расчета.
Вычисляем, в каком объеме 40% глюкозы содержится заданное количество сухой глюкозы (г/сутки): доза глюкозы (г/сутки): 0,4 = глюкоза 40% (мл). В знаменателе дроби пишется процентное содержание глюкозы в растворе в виде десятичного числа. Для 10% глюкозы в знаменателе будет 0,1, для 50% глюкозы – 0,5.
- Вычисляем количество воды, которое необходимо добавить:
[объем жидкости, приходящейся на глюкозу] - [объем 40% глюкозы] = объем воды (мл).
- При использовании двух растворов глюкозы различной концентрации объемы суммируются.
Контроль полученной концентрации глюкозы в комбинированном растворе:
- Суточная доза глюкозы (г)х 100: суммарный объем раствора (мл) = концентрация глюкозы в растворе (%).
- Допустимый процент сравнивается с рекомендациями по введению в центральную или периферическую вену.
6.Контроль калорийности ПП питания:
- доза липидов г/сутки 9 + доза глюкозы г/сутки 4 = калорийность ПП ккал/сут, аминокислоты не учитываются как источник калорий, хотя и могут использоваться в энергетическом обмене.
- Значение общей калорийности питания:
- калорийность энтерального питания (ккал/сут)+калорийность ПП (ккал/сутки) : массу тела (кг).
-
Раствор эмульсии жиров вводится параллельно с основным раствором в разных шприцах, через тройник.
7.Расчет скорости введения растворов
- Оптимальным для начала терапии считается поступление компонентов парентерального питания с одинаковой скоростью в течение суток. При проведении длительного парентерального питания постепенно переходят на циклическую инфузию.
- Расчет скорости введения основного раствора:
- Расчет скорости введения эмульсии жиров:
Объем эмульсии жиров 24 ч = скорость введения жировой эмульсии (мл/ч).
Осложнения парентерального питания [16]
- Любой ребенок с кишечной недостаточностью и постоянным ЦВК подвержен значительному риску инфекции кровотока, связанной с катетером и, соответственно, любая лихорадка (температура >38,50 или ее повышение на >10C) или изменение клинических или лабораторных параметров должны вызывать подозрение на инфекцию кровотока, связанную с катетером до тех пор, пока не будет доказано обратное (LOE 2+, RG B, сильная рекомендация).
- Парные количественные культуральные исследования крови, взятые одновременно из ЦВК и периферической вены, в идеале должны быть получены при подозрении на инфекцию кровотока, связанную с катетером и до начала антибактериальной терапии (экстраполировано из исследований взрослых, оцененных как LOE 2++, RG B, сильная рекомендация).
- Наиболее доступным методом подтверждения инфекции кровотока, связанной с катетером без удаления катетера, является расчет ДВД (дифференциальное время до постановки диагноза) между культурами крови, взятыми из катетера и из периферической вены или отдельного просвета (экстраполировано из исследований взрослых, оцененных как LOE 2++, RG B, сильная рекомендация).
- Эмпирическая антибактериальная терапия инфекции кровотока, связанная с катетером, обычно должна включать лечение грамм положительных коагулазонегативных и/или положительных стафилококков и грамм отрицательных бацилл (экстраполировано из исследований взрослых, оцененных как LOE 2+, RG B, сильная рекомендация).
- Продолжительность антимикробной терапии инфекции кровотока, связанной с катетером без его удаления, обычно составляет 10–14 дней, при условии клинического и микробиологического ответа в течение 48–72 ч при отсутствии признаков осложнений (экстраполировано из исследований взрослых, оцененных как LOE 2+, RG B, сильная рекомендация).
- Удаление ЦВК рекомендуется при клиническом ухудшении или персистирующей или рецидивирующей бактериемии, наличии гнойных осложнений или определенных инфекционных агентов (экстраполировано из исследований взрослых, оцененных как LOE 2+, RG B, сильная рекомендация)
- Тромботическая окклюзия катетера и тромбоз, связанный с ЦВК, требуют тщательного обследования и лечения, поскольку они могут быть связаны со значительной заболеваемостью (LOE 2-, RG B, сильная рекомендация).
- Фибринолитики являются препаратами выбора для лечения тромбоза катетеров. Тканевый активатор плазминогена в настоящее время является рекомендуемым средством, (LOE 2+, RG B сильная рекомендация).
- При подозрении на поломку катетера или экстравазацию жидкости следует провести правильное позиционирование кончика катетера и немедленное обследование, чтобы предотвратить серьезные осложнения (LOE 4, RG 0, сильная рекомендация).
- Соответствующие меры для обеспечения безопасного расположения катетера на месте постановки и обучение пользователей правильному обслуживанию и безопасности катетера настоятельно рекомендуются (GPP, сильная рекомендация).
- Фосфат следует добавлять в органически связанной форме, чтобы предотвратить риск осаждения фосфата кальция (GPP, сильная рекомендация).
- Если используется неорганический фосфат, необходимо строго соблюдать матрицы стабильности и порядок смешивания (GPP, сильная рекомендация).
- Когда используются смеси «2 в 1» через Y-коннектор, добавление липидов должно быть полностью утверждено производителем или аккредитованной лабораторией, в противном случае введение липидов через альтернативную линию (GPP, сильная рекомендация).
- Следует избегать смешивания лекарственных средств с парентеральным питанием в линиях введения, если это не одобрено производителем или аккредитованной лабораторией (GPP, сильная рекомендация).
- Многослойные мешки, непроницаемые для кислорода, рекомендуются для проведения парентерального питания (GPP, сильная рекомендация).
- Рекомендуется использовать защиту от света как для пакетов, так и для магистралей (LOE 3, RG 0, сильная рекомендация).
- Рекомендуемое место введения для ПП является центральный катетер, однако периферическое введение ПП также можно использовать в течение короткого периода времени (LOE 3, RG 0, сильная рекомендация).
- Осмолярность раствора для периферического ПП должна поддерживаться на уровне менее 900 мосмоль/л (LOE 3, RG 0, условная рекомендация).
- Ингредиенты с наименьшим содержанием алюминия рекомендуются для приготовления растворов для парентерального питания, предоставляемых пациентам, получающим ПП (LOE 2+, RG B, сильная рекомендация).
- Следует проводить регулярную оценку минерализации кости (LOE 2 -, RG В, сильная рекомендация)
- Риск заболевания печени можно снизить за счет снижения факторов риска, связанных с пациентом и ПП (LOE 2+, RG B, сильная рекомендация).
- У пациентов при заболеваниях печени, связанных с кишечной недостаточностью, максимальный энтеральный прием при переносимости может улучшить исход заболевания печени (GPP, настоятельная рекомендация).
- Чистые липидные эмульсии на основе сои следует избегать при наличии холестаза (LOE 3, RG 0, сильная рекомендация)
- Использование смешанных липидных эмульсии может быть рекомендовано пациентам с кишечной недостаточностью находящихся на длительном ПП (LOE 3, СР 0, условная рекомендация).
- Рекомендуется раннее направление детей с перенесенной кишечной недостаточностью в педиатрический центр реабилитации/трансплантации с заболеваниями печени, связанными с кишечной недостаточностью (GPP, сильная рекомендация).
- Всем пациентам на длительном ПП требуется регулярный мониторинг роста и состава тела (LOE 2 -, RG B, сильная рекомендация).
Индикаторы эффективности процедуры:
- Индикатором эффективности парентерального питания является сбалансированное и правильно организованное питание новорожденного. Назначение каждого компонента питания должно основываться на потребностях ребенка в данном ингредиенте. Соотношение ингредиентов питания должно способствовать формированию правильного метаболизма, а также удовлетворению особых потребностей при некоторых заболеваниях перинатального периода. Технология назначения питания должна быть оптимальной для его полноценного усвоения. Эффективность ПП оценивается по гармоничному развитию ребенка согласно шкалам Фентона [2].
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023 - 1) E. Jochum et al., ESGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Fluid an electrolyts, Clinical Nutrition 37 (2018), pp 2344-2353. 2) Fenton TR, Nasser R, Eliasziw M, Kim JH, Bilan D, Sauve R. Validating the weight gain of preterm infants between the reference growth curve of the fetus and the term infant. BMC Pediatr. 2013;13(1):92. 3) J.B. van Goudover et al., ESGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Amino acids, Clinical Nutrition 37 (2018), pp 2315-2323. 4) Lapillonne et al., ESGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Lipids, Clinical Nutrition 37 (2018), pp 2324-2336. 5) D. Mesotten et al., ESGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Carbohydrates, Clinical Nutrition 37 (2018), pp 2337-2343. 6) W. Mihatsch et. Al., ESGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Calcium, phosphorus and magnesium, Clinical Nutrition 37 (2018), pp 2360-2365. 7) K. Joosten et al., ESGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Energy, Clinical Nutrition 37 (2018), pp 2309-2314. 8) Mostovoy A, Prutkin M, Gorelik K et al. Protokoll der Infusionstherapie und der parenteralen Ernährung der Neugeborenen, Sankt-Petersburg, 2011, 23 Seiten (auf Russisch). 9) Neonatal parenteral nutrition. NICE guideline Published: 26 February 2020 www.nice.org.uk/guidance/ng154. 10) M. Domellof et al., ESGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Iron and trace minerals. Clinical Nutrition 37 (2018) рр 2354-2359. 11) W. Mihatsch et al., ESGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Calcium, phosphorus and magnesium. Clinical Nutrition 37 (2018) 2360-2365. 12) J. Bronsky, et al., ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Vitamins. Clinical Nutrition 37 (2018) 2366-2378. 13) S. Kolacek et al., ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Venous access. Clinical Nutrition 37 (2018) 2379-2391. 14) JWL. Puntis et al., ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Organisational aspects. Clinical Nutrition 37 (2018) 2392-2400. 15) Arieh Riskin et al., ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Standard versus individualized parenteral nutrition. Clinical Nutrition 37 (2018) 2409-2417. 16) Corina Hartman et al., ESPGHAN/ESPEN/ESPR/CSPEN guidelines on pediatric parenteral nutrition: Complications. Clinical Nutrition 37 (2018) 2418-2429. 17) Sweet D.G et al., European Consensus Guidelines on the Management of Respiratory Distress Syndrome – 2019 Update.
Информация
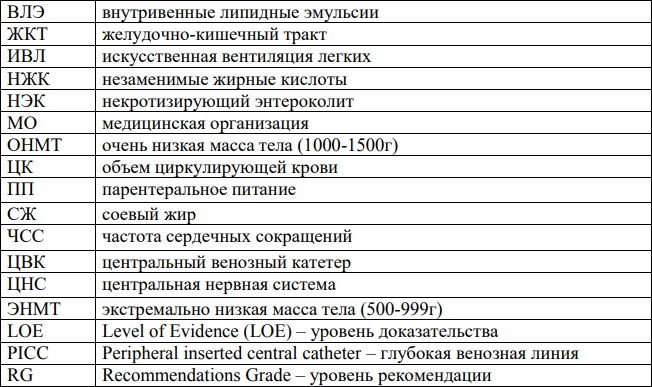
Сокращения, используемые в протоколе:
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков протокола:
1) Чувакова Тамара Курмангалиевна - доктор медицинских наук, врач-неонатолог, профессор кафедры неонатологии НАО «Медицинского университета Астана».
2) Джаксалыкова Куляш Каликановна – доктор медицинских наук, врач-неонатолог, профессор, заведующая кафедрой неонатологии НАО «Медицинского университета Астана».
3) Карин Бектурган Тынымбайулы – МSc, врач-неонатолог, ассистент кафедры неонатологии НАО «Медицинского университета Астана».
4) Ералиева Бибихан Абдилиевна – кандидат медицинских наук, доцент кафедры клинической фармакологии НАО «Казахский Национальный медицинский университет имени С. Асфендиярова», главный внештатный клинический фармаколог МЗ РК.
Указание на отсутствие конфликта интересов: нет.
Рецензент: Божбанбаева Нишангуль Сейтбековна – доктор медицинских наук, профессор, заведующая кафедрой неонатологии НАО «Казахский национальный медицинский университет им. С.Д. Асфендиярова».
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.