Острый промиелоцитарный лейкоз у детей
 Версия: Клинические рекомендации РФ 2025 (Россия)
Версия: Клинические рекомендации РФ 2025 (Россия)
Острый промиелоцитарный лейкоз (C92.4)
Онкогематология детская, Онкология детская, Педиатрия
Общая информация
Краткое описание
Разработчик клинической рекомендации
Российское общество детских онкологов и гематологов
Одобрено Научно-практическим Советом Минздрава России
Клинические рекомендации
Острый промиелоцитарный лейкоз
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 915_1
Возрастная категория: Дети
Определение заболевания или состояния (группы заболеваний или состояний)
ОПЛ относят к острым миелоидным лейкозам (ОПЛ), которые представляют собой гетерогенную группу опухолевых заболеваний системы крови, возникающих в результате мутации в стволовой клетке-предшественнице гемопоэза, в результате чего происходит блок дифференцировки и начинается неконтролируемая пролиферация недифференцируемых опухолевых кроветворных клеток, вытесняющих нормальные.
ОПЛ представляет собой четко очерченную нозологическую форму в рамках ОПЛ с настолько характерными клинико-лабораторными признаками (типичная морфология опухолевых клеток, тяжелый геморрагический синдром, гематомный тип кровоточивости, избыточно активированный фибринолиз, ДВС-синдром, обычно – лейкопения), что диагноз порой можно установить, основываясь лишь на клинических проявлениях. Тем не менее именно этот вариант ОПЛ требует жесткой верификации диагноза молекулярно-генетическими методами [7,8].
Это обусловлено тем, что именно с ОПЛ связано одно из самых принципиальных открытий в области биологии лейкозов: обнаружен феномен дифференцировки бластных клеток ОПЛ под воздействием дериватов ретиноевой кислоты ‒ 13-цис-ретиноевой, полностью транс-ретиноевой (третиноин**, ATRA**), 9-цис-ретиноевой кислоты. Именно ATRA** стала первым так называемым таргетным препаратом. Применение ATRA** революционным образом изменило исходы терапии ОПЛ.
После появления ATRA** арсенал патогенетических эффективных методов терапии был расширен за счет триоксида мышьяка** (АТО**), являющегося, вероятнее всего, одним из наиболее активных биологических средств в лечении ОПЛ и уже не вызывает сомнения тот факт, что ОПЛ может быть излечен даже без применения цитостатических препаратов.
ОПЛ является ярким примером современной точной медицины. Введение в медицинскую практику комбинации ATRA**/ATO** привела к тому, что ОПЛ превратился из смертельного заболевания в практически излечимое состояние, даже без применения химиотерапии. Продолжающееся педиатрические исследования, основанные на комбинации ATRA**/ATO** представляют собой прорыв в лечении ОПЛ у детей, символизирующий метод лечения злокачественных новообразований без химиотерапевтических средств, характеризующиеся как острыми, так и долговременными побочными эффектами [9].
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
C92.4 Острый промиелоцитарный лейкоз
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Перечень вариантов ОПЛ и других опухолей с миелоидной дифференцировкой (ВОЗ, 2016) [20,21]
Классификация ВОЗ (2016) подразделяет все ОПЛ, основываясь на их цитогенетических и молекулярно-генетических особенностях, и именно эти особенности формируют клинико-патологические группы. ОПЛ входит в группу
ОПЛ с устойчиво выявляемыми генетическими аномалиями
ОПЛ с t(8;21)(q22;q22); RUNX1-RUNX1T1
ОПЛ с inv(16)(p13.1q22) or t(16;16)(p13.1;q22); CBFB-MYH11
ОПЛ с t(15;17)(q22;q12); PML-RARA
ОПЛ с t(9;11)(p22;q23); MLLT3-MLL
ОПЛ с t(6;9)(p23;q34); DEK-NUP214
ОПЛ с inv(3)(q21q26.2) or t(3;3)(q21;q26.2); RPN1-EVI1
ОПЛ (мегакариобластный) с t(1;22)(p13;q13); RBM15-MKL1
ОПЛ с BCR/ABL1*
ОПЛ с генными мутациями*:
ОПЛ с мутированным геном NPM1*
ОПЛ с биаллельной мутацией гена CEBPA*
«ОПЛ с t(15;17)(q22;q12); PML-RARA»; транслокации RARA с другими партнерами выделяются в отдельные формы ОПЛ, например, ОПЛ с t(11;17)(q23;q12); ZBTB16-RARA; ОПЛ с t(11;17)(q13;q12); NUMA1-RARA; ОПЛ с t(5;17)(q35;q12); NPM1-RARA; ОПЛ с STAT5B-RARA.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Этиология ОПЛ в большинстве случаев неизвестна. В последние годы описывается все больше случаев возникновения ОПЛ как вторичного лейкоза, связанного с предшествующей химиотерапией (ХТ) и облучением. Крупные многоцентровые исследования свидетельствуют о том, что вторичный ОПЛ в большинстве случаев возникает не позднее трех лет после завершения ХТ по поводу первичного онкологического заболевания ингибиторами топоизомеразы II (антрациклины (АТХ: L01DB антрациклины и родственные соединения), или митоксантрон**, реже этопозид**). У 57% пациентов первичной опухолью было злокачественное новообразование молочной железы, далее следуют неходжкинские лимфомы, значительно реже – лимфома Ходжкина. Среднее время от завершения терапии по поводу первичной опухоли до момента диагностики вторичного ОПЛ составляет 24 мес (от 15 мес до 8 лет). По мере увеличения агрессивности химиотерапевтического воздействия увеличивается вероятность развития вторичного ОПЛ, как, впрочем, может уменьшаться и временной интервал от момента завершения ХТ до возникновения ОЛ.
В 95% случаев ОПЛ выявляется реципрокная транслокация t(15;17)(q22;ql2), которая приводит к слиянию части PML гена, расположенного на 15-й хромосоме, с RARa геном (17 хромосома) с образованием химерного гена PML-RARa. В редких случаях ген RARа может быть слит с другими генами-партнерами, отличными от PML. Выявлено не менее 14 вариантов генов-партнеров, в том числе наиболее часто встречающийся ZBTB16-RARA, за которым следуют NPM-RARA, NuMA-RARA, STAT5B-RARA, PRKAR1A-RARA, BCOR-RARA, FIP1L1-RARA, OBFC2A-RARA, GTF2I-RARA, и более поздние IRF2BP2-RARA, FNDC3B-RARA, TBLR1-RARA, STAT3-RARA и NUP98-RARA [10].
Случаи с этими нетипичными партнерами по слиянию с геном RARA часто отличаются от традиционных APL по отсутствию палочек Ауэра в атипичных промиелоцитах при морфологической оценке, пациенты имеют более ранний возраст и могут быть менее чувствительны к дифференцировочной терапии [11,12]. Так, пациенты с химерными онкогенами ZBTB16-RARA и STAT5B-RARA демонстрируют in vitro и/или in vivo устойчивость к ATRA** и триоксиду мышьяка (АТО).
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Эпидемиология ОПЛ среди детского населения в Российской Федерации изучена недостаточно. Острый миелоидный лейкоз встречается в 20% от всех острых лейкозов у детей, составляет 6% от всех опухолей у детей. Новые случаи ОПЛ составляют 0,7-1,2/100.000 в год [13,14].
Острый промиелоцитарный лейкоз cоставляет 5-10% всех случаев AML у детей [14]. Более высокая заболеваемость описана в Италии, Испании, Китае и Латинской Америке, с самой высокой долей ОПЛ (до 50% всех случаев ОПЛ), зарегистрированных в Никарагуа и Аргентине [15-16]. Заболеваемость становится выше с возрастом с пиком в четвертом десятилетии, в то время как ОПЛ особенно редко встречается у младенцев (средний возраст педиатрических случаев составляет 9-12 лет) [17,18].
По данным популяционного исследования SEER в период с 1975 по 2008 год в Соединенных Штатах было зарегистрировано 1397 пациентов в возрасте до 20 лет и показатель заболеваемости составил 0,06 на 100 000 человек [19].
В рамках исследования ОПЛ-MRD-2018, проводимом НМИЦ ДГОИ имения Дмитрия Рогачева с 2019 по 2023 гг. было зарегистрировано 777 пациентов с ОПЛ в возрасте до 18 лет, ОПЛ составил 26% (199 пациентов).
Факторы и группы риска
Прогностические факторы
Пациенты с ОПЛ подразделяются на группы риска в зависимости от лабораторных показателей общего анализа крови при манифестации заболевания:
- группа низкого риска: лейкоциты <10×109/л
- группа высокого риска: лейкоциты >10×109/л
Окончательное определение группы риска проводится по результатам исследования транскрипта (состояние минимальной резидуальной болезни, MRD) после проведения 2-х 1 курсов консолидации или перед началом поддерживающей терапии [22,24].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Острый промиелоцитарный лейкоз представляет собой четко очерченную нозологическую форму с настолько характерными клинико-лабораторными признаками (типичная морфология опухолевых клеток, тяжелый геморрагический синдром, гематомный тип кровоточивости, избыточно активированный фибринолиз, ДВС-синдром, обычно – лейкопения), что диагноз порой можно установить, основываясь лишь на клинических проявлениях. При этом существуют ОПЛ, которые протекают не столь драматично: отсутствуют проявления геморрагического синдрома, больные в течение нескольких месяцев наблюдаются по поводу лейкопении, умеренной тромбоцитопении. Проявления геморрагического синдрома (кровоточивость десен, повышенная травмируемость кожных покровов, синяки, петехии, нередко кровотечения из носа, желудочно-кишечного тракта) на момент диагностики имеются у 90% пациентов. Гепатоспленомегалия или лимфаденопатия определяются менее чем у 20% пациентов [24].
Пациенты с ОПЛ, особенно с гипергранулярным вариантом, могут иметь низкое количество лейкоцитов и только редкие лейкозные клетки в периферической крови. Хотя ОПЛ обычно не является быстро пролиферативным острым лейкозом, к тому времени, когда у пациентов появляются симптомы, ситуация часто становилась опасной для жизни из-за риска катастрофического кровотечения. Как долго ОПЛ обычно присутствует в доклинической фазе, неизвестно, но при диагностике костный мозг часто почти на 100% заменяется злокачественными промиелоцитами, что приводит к тяжелой анемии, тромбоцитопении и нейтропении. Что еще более важно, эта масса злокачественных клеток в мозге провоцирует тяжелую коагулопатию как с диссеминированным внутрисосудистым тромбозом, так и с первичным фибринолизом. Вариант ОПЛ, характеризующийся микрогранулярными ОПЛ-клетками, не имеет какой-либо дополнительной независимой прогностической ценности, но имеет тенденцию к более высокому количеству периферических бластов и, возможно, более быстрой пролиферации. Количество лейкоцитов >10000/мкл (>10x109/L) при постановке диагноза идентифицирует подгруппу ОПЛ высокого риска, отчасти из-за более высокого уровня ранней смертности [25].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу в соответствии с шкалами оценки уровня достоверности доказательств (УДД) и уровня убедительности рекомендаций (УУР) по причине отсутствия посвященных им клинических исследований. Невзирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Критерии установления диагноза/состояния: ОПЛ устанавливают независимо от процентного содержания бластных клеток в пунктате костного мозга или в периферической крови (ПК) при наличии патогномоничной для ОПЛ хромосомной аномалии t(15;17)(q12;q11‒12) PML/RARα.
Сводная таблица исследований, необходимых для диагностики и верификации диагноза ОПЛ, представлена в Приложении А3.1. На основании клинической картины, а также анализа результатов перечисленных исследований, пациентов стратифицируют на молекулярно-генетические, а также клинические группы прогноза (приложение Г2).
1. Жалобы и анамнез
Манифестация клинических проявлений ОПЛ сопровождается жалобами на слабость, утОПЛяемость вследствие анемии; развитием геморрагического синдрома различной интенсивности вследствие тромбоцитопении и ДВС и инфекционных осложнений на фоне нейтропении. Данные проявления могут развиться остро или постепенно нарастать.
У 40% пациентов геморрагический синдром может протекать в виде цереброваскулярного или легочного кровоизлияния, которые обусловлены коагулопатией, связанной с ОПЛ, включающей как диссеминированное внутрисосудистое свертывание (ДВС), так и первичный гиперфибринолиз и либо присутствует при постановке диагноза, либо возникает вскоре после начала специфической терапии [26]. Это осложнение в 10-20% является причиной ранней геморрагической смерти и требует немедленной неотложной медицинской помощи [27,28]. Тромботические осложнения встречаются реже.
- Рекомендуется всем пациентам при подозрении и при установленном ОПЛ: тщательный сбор анамнеза заболевания с уточнением терапии, которая проводилась в связи с этим заболеванием или по поводу других заболеваний ранее, семейного анамнеза, подробное описание жалоб пациента для верификации диагноза а также на наличие сиблингов (родных братьев и/или сестер) [7,29,30].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
2. Физикальное обследование
- Рекомендуется всем пациентам при подозрении и при установленном ОПЛ проводить физикальное обследование, включающее измерение роста и массы тела, температуры тела; оценку состояния кожных покровов, костно-суставной системы; выявление признаков геморрагического синдрома; наличие гепатоспленомегалии, лимфаденопатии; наличие признаков дисфункции сердца, легких, печени, органов эндокринной, нервной системы для верификации диагноза [31].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: при физикальном обследовании пациентов с ОПЛ особое внимание следует обратить на степень тяжести геморрагического синдрома для принятия неотложных мер по профилактике цереброваскулярного и/или легочного кровотечения.
3. Лабораторные диагностические исследования
- Рекомендуется всем пациентам при подозрении, диагностике ОПЛ, а также в ходе терапии с частотой от ежедневного (в дебюте заболевания) до ежемесячного, выполнение общего (клинического) анализа крови с дифференцированным подсчетом лейкоцитов (лейкоцитарной формулы) и исследованием уровня тромбоцитов в крови для определения дальнейшей тактики ведения пациента и верификации диагноза [32].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: У 80% пациентов манифестация заболевания характеризуется лейкопенией (медиана числа лейкоцитов составляет 1,8×109/л). Если у пациента в момент диагностики ОЛ определяется лейкопения <1×109/л, особенно в сочетании с гипофибриногенемией, то с большой долей вероятности можно предполагать промиелоцитарный вариант ОПЛ. У 15-20% пациентов в дебюте болезни выявляется лейкоцитоз (медиана 83×109/л) с увеличением числа лейкоцитов до ≥150×109/л. У подавляющего числа пациентов (80-90%) определяется анемия, причем у половины из них концентрация гемоглобина составляет <100 г/л. У 75% пациентов содержание тромбоцитов снижается до ≤50×109/л.
Общий (клинический) анализ крови (особенно число лейкоцитов и тромбоцитов) выполняется ежедневно в первые дни терапии ATRA** для оценки риска возникновения синдрома дифференцировки (СД) (при быстром увеличении числа лейкоцитов целесообразно начать профилактику СД, даже если не было исходного лейкоцитоза; уровень тромбоцитов не должен быть <30×109/л, целевой уровень ≥50×109/л), затем ‒ через день-два до констатации ремиссии. Развернутая формула ‒ 2 раза в неделю.
Дифференцированный подсчет лейкоцитов (лейкоцитарная формула) необходимо выполнять не на автоматическом анализаторе. Рекомендовано исследовать как минимум 200 лейкоцитов в мазке периферической крови.
- Рекомендуется всем пациентам при подозрении и при установленном ОПЛ, а также в ходе терапии в зависимости от клинической ситуации с частотой не реже одного раза в месяц и не чаще трех раз в неделю, выполнить анализ крови биохимический общетерапевтический крови (В03.016.003) (исследование уровня общего белка в крови, исследование уровня альбумина в крови, определение альбумин/глобулинового соотношения в крови, исследование уровня мочевины в крови, исследование уровня креатинина в крови, исследование уровня общего билирубина в крови, определение активности аланинаминотрансферазы (АЛТ) в крови, определение активности аспартатаминотрансферазы (АСТ) в крови, определение активности лактатдегидрогеназы (ЛДГ) в крови, исследование уровня общего магния в сыворотке крови, исследование уровня натрия в крови, исследование уровня калия в крови, исследование уровня общего кальция в крови, глюкозы) для диагностики сопутствующей патологии (заболеваний) и определения тактики сопроводительной терапии [32].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется всем пациентам при подозрении и при установленном ОПЛ, а также в ходе терапии с частотой не реже одного раза в месяц и не чаще одного раза в неделю (в дебюте заболевания) выполнить коагулограмму (Исследование коагуляционного гемостаза) (В03.005.004) для диагностики сопутствующей патологии и осложнений, а также определения тактики гемостатической терапии [32,33,34,39,182,185].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: Количество тромбоцитов и рутинные параметры коагуляции, протромбиновое время, АЧТВ и тромбиновое время, а также уровни фибриногена и продуктов распада фибриногена следует контролировать не реже одного раза в день и, при необходимости, чаще, до исчезновения всех клинических и лабораторных признаков коагулопатии.
- Рекомендуется всем пациентам при подозрении и при установленном ОПЛ, а также в ходе терапии выполнить общий (клинический) анализ мочи с частотой с частотой не реже одного раза в месяц и не чаще одного раза в неделю для диагностики сопутствующей патологии и определения тактики сопроводительной терапии [33,35,39].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется всем пациентам при подозрении и при установленном ОПЛ, а также в ходе терапии с частотой не реже одного раза в 3 месяца определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови, и при необходимости молекулярно-биологическое исследование крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1) для уточнения необходимости одновременного проведения противоопухолевой и антиретровирусной терапии [32,33,36,39].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется всем пациентам при подозрении и при установленном ОПЛ, а также в ходе терапии с частотой не реже одного раза в 3 месяца определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови, и, при необходимости, молекулярно-биологического исследования крови на вирус гепатита B (Hepatitis B virus) и на вирус гепатита C (Hepatitis C virus) с целью уточнения риска реактивации вирусного гепатита и, в случае необходимости, ее профилактики [32,33,37,38,39]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется всем пациентам при подозрении на развитие герпетической инфекции и установленном ОПЛ молекулярно-биологическое исследование крови на цитомегаловирус (Cytomegalovirus), на вирус Эпштейна-Барр (Epstein-Barr virus) с целью уточнения необходимости ее лечения или профилактики [32,33,39,40,183,184].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуются всем пациентам при подозрении и при установленном ОПЛ микробиологическое (культуральное) исследование отделяемого из полости рта; исследование микробиоценоза кишечника культуральными методами; микробиологическое (культуральное) исследование крови на стерильность; микробиологическое (культуральное) исследование мочи на бактериальные патогены с целью проведения прецизионной антибиотической терапии в ходе лечения при наличии фебрильной лихорадки и инфекционных осложнений [39,41,42,171,172].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- Рекомендуется всем пациентам при подозрении и при установленном ОПЛ, а также в случае развития рецидива и после выполнения алло-ТГСК, определение основных групп крови по системе АВ0 и определение антигена D системы Резус (резус-фактор) для возможности выполнения заместительной гемокомпонентной терапии при наличии показаний до, во время или после терапии [32,39,43].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется до начала лечения ОПЛ для верификации диагноза всем пациентам выполнить цитологическое и цитохимическое исследования опухолевых клеток в пунктате КМ, и всем больным после окончания программы индукции ремиссии, в ходе консолидации и поддерживающей терапии выполнять контрольное цитологическое исследование аспирата КМ (Цитологическое исследование клеток спинномозговой жидкости) (А08.23.007), оценку ответа на лечение, оценку состояния костномозгового кроветворения, а также при выявлении изменений в общем клиническом анализе крови вне связи с проводимым лечением и/или подозрении на рецидив ОПЛ. При констатации рецидива (независимо от процентного содержания бластных клеток в периферической крови) выполнить цитологическое исследование мазка костного мозга (миелограмма) (А08.05.001) и дополнительно цитохимическое исследование микропрепарата костного мозга (А08.05.012) с морфологическим и цитохимическим исследованиями бластных клеток для подтверждения рецидива и идентификации клеточной дифференцировки [32,33,39,44].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: получение цитологического препарата костного мозга путем пункции (А11.05.002) является обязательной рутинной диагностической процедурой. Процедура должна проводиться под комбинированным ингаляционным наркозом (В01.003.004.012)!!!!
Мазки костного мозга исследуют с помощью окраски по Маю-Грюнвальду, Паппенгейму или Райту-Гимзе. Рекомендовано исследовать как минимум 500 ядросодержащих клеток в мазке костного мозга.
Для установления диагноза ОПЛ в мазке периферической крови или костного мозга необходимо наличие 20% или более бластных клеток. При ОПЛ с t(15;17), t(8;21), inv(16) or t(16;16) и при некоторых случаях острого эритромиелоза доля бластных клеток может быть менее 20%. В соответствии с классификацией ВОЗ 2016 года процент бластных клеток подсчитывают вне зависимости от доли красного ростка.
В большинстве случаев диагноз может быть заподозрен при морфологической оценке лейкемических клеток. Бластные клетки при ОПЛ у большинства пациентов прежде всего характеризуются значительным ядерным полиморфизмом и наличием крупной фиолетово-бурой зернистости, густо заполняющей цитоплазму, большим количеством палочек Ауэра (классический гипергранулярный вариант ОПЛ) [45]. У 15-20% пациентов в цитоплазме опухолевых клеток обнаруживается лишь несколько мелких гранул или они не выявляются вовсе, при этом все остальные признаки (клинические, цитохимические, цитогенетические) ОПЛ присутствуют.
Классическим признаком опухолевых клеток ОПЛ является очень выраженная цитохимическая реакция на миелопероксидазу (MPO), липиды, которая выявляется с помощью суданового черного (SBB), и на хлорацетатэстеразу.
Выполнение цитохимического исследования микропрепарата костного мозга (А08.05.012) необходимо, даже если определяется высокое содержание бластных клеток в периферической крови. Это связано с тем, что в ряде случаев цитохимические реакции могут давать различные результаты в клетках периферической крови и костного мозга, что может повлечь за собой установление ошибочного диагноза. Диагноз основывают на результатах исследования, полученного на клетках костного мозга. Используют реакции на миелопероксидазу (myeloperoxidase – МРО) или судановый черный, неспецифическую эстеразу (альфа-нафтилацетатэстеразу, подавляемую или нет фторидом натрия) и PAS (Periodic Acid Schiff). Классическим признаком опухолевых клеток ОПЛ является очень выраженная цитохимическая реакция на миелопероксидазу (MPO), липиды, которая выявляется с помощью суданового черного (SBB), и на хлорацетатэстеразу.
На основании цитохимического исследования бластных клеток костного мозга (Цитохимическое исследование микропрепарата костного мозга, А08.05.012) может быть диагностировано около 90% случаев ОПЛ, при отсутствии активности MPO и неспецифической эстеразы необходимо проведение иммунофенотипического исследования методом проточной цитофлюориметрии.
- Рекомендуется всем пациентам при первичной диагностике ОЛ, а также при обследовании по поводу диагностированного рецидива ОПЛ, выполнить иммунофенотипирование гемопоэтических клеток-предшественниц в костном мозге для определения принадлежности бластных клеток к той или иной линии клеточной дифференцировки [32,39,45,46].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Иммунофенотипирование (ИФТ) выполняется всегда на клетках костного мозга, даже если определяется высокое содержание бластных клеток в периферической крови. Определение процента бластных клеток методом проточной цитофлуориметрии при первичной диагностике не является заменой морфологического подсчета, так как результаты этих двух исследований могут не совпадать [46].
Для подтверждения миелоидной направленности опухолевых клеток необходимо оценить экспрессию миелоидных антигенов. MPO – линейно-специфический маркер миелоидной линии, лизосомальный фермент гранулоцитов. К менее специфичным миелоид-ассоциированным антигенам относятся CD11b, CD11c, CD13, CD15, CD16, CD33, CD64, CD65, CD66b, лизоцим и другие
Бластные клетки считаются позитивными по экспрессии мембранного антигена, если он определяется на 20% бластных клеток и более (пороговое значение). Для цитоплазматических маркеров (таких, как цитоплазматический CD3, MPO, лизоцим, ядерная TdT и другие) используют более низкий порог – 10%.
ИФТ с использованием многоцветной проточной цитометрии может повысить точность морфологических исследований ОПЛ, но не является ключевым методом диагностики. Как правило, PML/RARA-положительные бластные клетки имеют иммунофенотип, аналогичный нормальным промиелоцитам (CD34‒/+ гетерогенный, CD117‒/+ dim, HLADR‒/+ dim, CD13+/++, CD11b‒). Тем не менее в отличие от нормальных промиелоцитов PML/RARA-положительные промиелоциты имеют крайне низкий уровень CD15 (CD15‒/+ dim вместо CD15+++). Бластные клетки при гипогранулярной (вариантной) форме ОПЛ (M3V) часто коэкспрессируют Т-линейные маркеры, такие как CD2, совместно с миелоидными маркерами, такими как CD13 и CD33.
- Рекомендуется всем пациентам до начала лечения ОПЛ выполнить цитогенетическое исследование (кариотип) аспирата КМ, а также для получения быстрого ответа о наличии химерного гена PML-RARA ‒ определение экспрессии PML-RARA (количественное), молекулярно-генетическое исследование мутаций в гене PML-RARA методом ПЦР для верификации диагноза и выполнения в дальнейшем мониторинга минимальной остаточной болезни (МОБ) [22,23,47].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: все случаи ОПЛ, установленного морфологическими и цитохимическими методами исследования, должны быть подтверждены методом ПЦР или FISH в момент установления диагноза, так как в 5-10% случаев при отсутствии классической t(15;17) обнаруживается транскрипт PML-RARA.
Для диагностики ОПЛ крайне необходимым является быстрое генетическое подтверждение диагноза. Поскольку эффективность таргетного лечения на основе ретиноидов и/или производных мышьяка строго зависит от наличия химерного гена PML/RARA, генетические подтверждение диагноза является обязательным во всех случаях. В 1977 г. J.D. Rowley и соавт. было доказано, что практически во всех случаях ОПЛ обнаруживается t(15;17)(q22;q12‒21) [8]. В результате этой транслокации ген промиелоцитарного лейкоза (PML-ген), расположенный на хромосоме 15, переносится на длинное плечо хромосомы 17 в область, где находится ген альфа-рецептора ретиноевой кислоты (эту транслокацию относят к группе реципрокных, сбалансированных, что означает, что генетический материал не утрачивается и передается с одной хромосомы на другую. В результате t(15;17) появляется 2 сливных аномальных гена: PML/RARα на деривате хромосомы 15 и RARα/PML на деривате хромосомы 17.
Генетическое подтверждение диагноза должно выполняться на бластных клетках, полученных из КМ. Идентификация ОПЛ-специфических генетических поломок в бластных клетках осуществляется на уровне анализа хромосом, ДНК, РНК и химерного белка с использованием стандартного кариотипирования, флуоресцентной in situ гибридизации (FISH), полимеразно-цепной реакции с обратной транскриптазой (ОТ-ПЦР) или анти-PML моноклональных антител. Соответственно, каждый из методов имеет свои преимущества и недостатки.
Кариотипирование на G-окрашенных метафазах(стандартная цитогенетика), полученных из образцов КМ, выполняется обычными методами на прямой 24- и 48-часовой культуре. Несмотря на высокую специфичность, цитогенетический анализ дóрог, отнимает много времени, нуждается в метафазах хорошего качества (потери до 20%) и по определению не в состоянии обнаружить случаи, когда PML/RARA является результатом так называемой криптогенной перестройки (ложно отрицательный результат). Этот метод позволяет обнаруживать дополнительные хромосомные перестройки, но они не имеют существенного прогностического значения при ОПЛ. Цитогенетический анализ может быть полезен в тех случаях ОПЛ, когда синтез химерного белка PML/RARA не осуществляется. Стандартная цитогенетика также может способствовать выявлению редких вариантов ОПЛ в том числе с t(11;17)(q23;q21), t(11;17)(q13;q21) и t(5;17)(q35;q21), приводящих к синтезу химерных продуктов ZBTB16-RARA, NuMA RARA и NPM1-RARA соответственно, а также другим, описанным совсем недавно.
FISH-анализ на PML/RARα выполняется с использованием флуоресцентных зондов. Хотя в некоторых случаях образцы ПК пригодны для исследования (в частности, когда на момент установления диагноза имеется гиперлейкоцитоз), FISH-анализ лучше выполнять на образцах КМ. Этот метод высокоспецифичен, обладает достаточной чувствительностью, намного дешевле и менее трудоемок, чем кариотипирование. Однако FISH не дает никакой информации об изоформе химерного транскрипта PML/RARA, который необходим для осуществления молекулярного мониторинга МОБ.
Тем не менее FISH может быть полезен в диагностике предполагаемых случаев ОПЛ, при которых не выявляется химерный транскрипт PML-RARA. Так, FISH-исследование может выявить реаранжировку гена RARA, который может быть партнером другого – не PML-гена.
ОТ-ПЦР-анализ PML-RARA проводят на РНК, выделенной из клеток КМ, хотя химерный транскрипт, как правило, легко определяется и в ПК даже в случаях с лейкопенией. ОТ-ПЦР-анализ для выявления химерного продукта PML-RARA был создан и стандартизован в рамках международной кооперации. ОТ-ПЦР является «золотым стандартом» для подтверждения диагноза ОПЛ. Важно, что помимо высокой специфичности и чувствительности он определяет расположение точки разрыва PML, устанавливая тем самым маркер для следующего мониторинга МОБ. Однако малое количество РНК (и, как следствие, ложноотрицательный результат), контаминация/артефакты (ложноположительный результат), а также относительно длительный период подготовки проб (около 2 дней) являются основными недостатками этого метода. Кроме того, очень желательно, чтобы детекцию химерных транскриптов и мониторинг образцов проводили в референс-лабораториях с хорошо обученным персоналом и большим опытом. В клиниках, в которых нет возможности выполнить цитогенетическое исследование, диагноз должен быть подтвержден в референс-лаборатории. Образцы КМ или ПК должны быть доставлены в лабораторию до начала терапии.
Определение молекулярного варианта ОПЛ (PML-RARA, ZBTB16-RARA, NuMА-RARA, NPM-RARA, STAT5B-RARA.и др.) может подсказать, чувствительны ли опухолевые клетки к воздействию ATRA** и мышьяка. Варианты ОПЛ с ZBTB16-RARA-онкогеном и STAT5B-RARA плохо отвечают на терапию ретиноидами и мышьяком.
- Рекомендуется всем пациентам, получающим терапию по поводу верифицированного ОПЛ, проводить цитологическое исследование мазков КМ (миелограмма) и определение минимальной остаточной болезни (МОБ) с помощью молекулярно-генетического исследования при помощи пациент – специфичных праймеров (А27.05.001) после курса консолидации ремиссии и завершения всей программы терапии. Молекулярная ремиссия в КМ должна быть оценена по завершении консолидация с помощью анализа RT-ПЦР (ПЦР с обратной транскрипцией) или количественной RQ-ПЦР (в реальном времени), обеспечивающих чувствительность не менее 1 из 104 [48 – 52].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: Поскольку в настоящее полная ремиссия время достигается практически у всех пациентов с генетически доказанными PML/RARA ОПЛ как на терапии ATRA плюс химиотерапия или АТРА плюс АТО. Этот факт следует учитывать при проведении 1-ой контрольной пункции КМ, которую следует выполнять не ранее 30-го дня после завершения курса ХТ. Более ранний анализ пунктата КМ может привести к ложному подсчету процента бластных клеток – продолжающих дифференцироваться опухолевых клеток, которые через 7-10 дней полностью исчезнут из КМ. Таким образом, первая контрольная пункция КМ осуществляется в среднем на 30-й день (иногда на 40-50 дни) индукции ремиссии или при окончательном восстановлении показателей ПК. Эта отсроченная дифференцировка бластных клеток может привести к ложно-позитивной МОБ, определяемой любыми генетическими методами. Таким образом оценка МОБ после индукции сомнительна, за исключением исследовательских целей.
В отличие от отсутствия клинической ценности МОБ, выполненной в конце индукции, молекулярный анализ КМ, произведенный после завершения консолидации имеет решающее значение для определения риска рецидива [48,49], причем при детекции позитивной МОБ (предпочтительно методом ПЦР) необходимо провести подтверждающий (повторный) тест МОБ в КМ через 2 недели, так как раннее изменение терапии МОБ-позитивных пациентов имеет лучший результат, чем лечение полномасштабного рецидива. Мониторинг МОБ должен проводится в рутинной клинической практике для всех пациентов.
- Не рекомендуется рутинное молекулярно-генетическое исследование мутации гена FLT3 (fms-подобная тирозин-киназа-3) в крови или КМ всем пациентам с впервые диагностированным ОПЛ [23,39,53].
Уровень убедительности рекомендации С (уровень достоверности доказательств –5)
Комментарии: мутации в гене, кодирующем FMS-подобную тирозинкиназу-3 (FLT3), при ОПЛ наблюдаются чаще, чем при других ОПЛ – у 30-40% пациентов. Однако, хотя FLT3-мутации ассоциированы с более высоким числом лейкоцитов в момент диагностики ОЛ, они не являются каким-либо прогностическим фактором и не оказывают влияние на выбор терапевтической тактики в лечении впервые диагностированного ОПЛ ингибиторы тирозинкиназ не используются
- Рекомендуется всем пациентам высокой группы риска выполнить диагностическую спинномозговую пункцию с общим (клиническим) анализом спинномозговой жидкости с целью диагностики нейролейкемии [32,39,25].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: при ОПЛ в целом инициальное вовлечение ЦНС встречается достаточно редко, однако в случае возникновения рецидива ОПЛ около 10% гематологических рецидивов протекают с вовлечением ЦНС [4]. Вследствие того, что большинство ЦНС-рецидивов возникает у больных с изначальным гиперлейкоцитозом, профилактика нейрорецидивов в виде интратекального введения химиопрепаратов проводится только пациентам высокой группы риска и тем, у кого в дебюте заболевания было кровоизлияние в ЦНС, для которых риск ЦНС-рецидивов существенно увеличивается. Первую люмбальную пункцию следует отложить до нормализации показателей гемостаза
Желательно поддерживать число тромбоцитов в крови перед выполнением спинномозговой пункции 50х109/л и выше. Если уровень тромбоцитов не удается повысить до 30х109/л и выше, при отсутствии клинических признаков поражения ЦНС, от пункции можно воздержаться до повышения тромбоцитов в гемограмме выше 30х109/л.
- Рекомендуется всем пациентам выделять первичную ДНК или РНК из клеток костного мозга и сохранять ее в биобанке либо направлять материал на хранение в лаборатории федеральных медицинских организаций для возможности последующего выполнения молекулярных исследований [32,39,44].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: сохранение первичного биологического материала осуществляется в виде ДНК и/или РНК, выделенных из костномозговых клеток или замороженных клеток. Материал может в последующем понадобиться для проведения молекулярных исследований, позволяющих определить группы риска, а также в рамках клинических исследований (КИ).
4. Инструментальные диагностические исследования
- Рекомендуется всем пациентам с ОПЛ до начала специфической терапии, а также в ходе лечения с частотой не реже одного раза в месяц, опираясь на наличие сопутствующей патологии и текущую клиническую ситуацию, а также при необходимости в любой момент в течение всего периода лечения, регистрация, расшифровка, описание и интерпретация электрокардиографических данных для выявления и/или мониторинга нарушений проводимости импульсов в сердечной мышце [29,32,54].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется всем пациентам с ОПЛ до начала специфической терапии, а также в ходе лечения с частотой не реже одного раза в месяц, опираясь на наличие сопутствующей патологии и текущую клиническую ситуацию, а также при необходимости в любой момент в течение всего периода лечения, выполнение эхокардиографии для оценки функционального состояния сердечной мышцы, учитывая кардиотоксичность препаратов [29,32,54].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется всем пациентам с ОПЛ до начала специфической терапии, а также в ходе лечения, опираясь на наличие сопутствующей патологии и текущую клиническую ситуацию, но не реже, чем с одного раза каждые три месяца, а также при необходимости в любой момент в течение всего периода лечения выполнение компьютерной томографии (КТ) головного мозга без контраста для выявления и/или мониторинга изменений в структурах головного мозга. При наличии нейролейкемии выполнение МРТ головного и спинного мозга с контрастированием (внутривенным), для оценки вещества головного мозга и оболочек головного и спинного мозга [7,23,24,39,55-57].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: КТ головного мозга при ОПЛ надо выполнять всем пациентам в первые дни диагностики, так как могут быть бессимптомные интракраниальные кровоизлияния. При появлении головных болей, менингизма, сонливости, загруженности на фоне терапии ретиноидами КТ головного мозга выполняется обязательно, а спинномозговая пункция выполняется после КТ (если позволяет количество тромбоцитов).
- Рекомендуется всем пациентам с ОПЛ до начала специфической терапии, а также в ходе лечения, опираясь на наличие сопутствующей патологии и текущую клиническую ситуацию, но не реже, чем с одного раза каждые три месяца, а также при необходимости в любой момент в течение всего периода лечения выполнение прицельной рентгенографии органов грудной кетки и/или КТ органов грудной полости для выявления изменений легочной ткани и органов средостения [32,39,55-57].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется всем пациентам с ОПЛ на любом этапе ведения с подозрением на наличие экстрамедуллярных очагов выполнение КТ (Компьютерная томография мягких тканей, А06.01.001) и/или магнитно-резонансной томографии (МРТ) (Магнитно-резонансная томография мягких тканей, А05.01.002) с контрастом соответствующего региона для уточнения распространенности заболевания или диагностики экстрамедуллярного рецидива [39,55-57].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется всем пациентам с ОПЛ до начала специфической терапии, а также в ходе лечения, опираясь на наличие сопутствующей патологии и текущую клиническую ситуацию, но не реже, чем с одного раза каждые три месяца, а также при необходимости в любой момент в течение всего периода лечения, для определения объема опухолевой массы и диагностики и мониторинга сопутствующей патологии выполнение ультразвукового исследования (УЗИ) органов брюшной полости (комплексного) с определением размеров печени, селезенки и внутрибрюшных лимфатических узлов, а также оценка состояния органов брюшной полости и выполнение трансабдоминального УЗИ органов малого таза у девочек и УЗИ органов мошонки (яичек) (А04.28.003) у мальчиков [39,55].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
5. Иные диагностические исследования
- Рекомендуется пациентам с подозрением на экстрамедуллярные очаги ОПЛ выполнение биопсии вовлеченного органа/ткани в объеме, необходимом для выполнения патолого-анатомического исследований биопсийного материала с применением иммуногистохимических методов и молекулярно-биологических исследований [58].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется всем пациентам с ОПЛ, которые потенциально могут рассматриваться как кандидаты на выполнение трансплантации алло-ТГСК (отсутствие молекулярной ремиссии после проведения индукции ремиссии и циклов консолидации, варианты ОПЛ с ZBTB16-RARA и STAT5B-RARA, рецидив ОПЛ), а также их сиблингам молекулярно-генетическое исследование гистосовместимости (HLA высокого разрешения при помощи секвенирования) для подбора неродственного донора костного мозга с целью поиска потенциального донора с консультацией в трансплантационном центре с целью определения целесообразности и возможности выполнения алло-ТГСК [33,39,44].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется при наличии показаний и определения сопутствующей патологии приемы (осмотры, консультации) врача-невролога, врача-офтальмолога, врача-оториноларинголога и других врачей-специалистов, всем девочкам старше 14 лет – прием (осмотр, консультация) врача-акушера-гинеколога [39].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Назначение и применение лекарственных препаратов, указанных в клинической рекомендации, направлено на обеспечение пациента клинически эффективной и безопасной медицинской помощью, в связи с чем их назначение и применение в конкретной клинической ситуации определяется в соответствии с инструкциями по применению конкретных лекарственных препаратов с реализацией представленных в инструкции мер предосторожности при их применении, также возможна коррекция доз с учетом состояния пациента.
1. Основные принципы лечения ОПЛ
Острый промиелоцитарный лейкоз у детей является редким и потенциально излечимым заболеванием на современном этапе, благодаря терапии, основанной на применении таргетных препаратов и минимизации воздействия химиотерапии. Основной причиной неудач при ОПЛ являются фатальные геморрагические осложнения в дебюте заболевания и возможные инфекционные осложнения, развивающиеся на фоне индуцированной аплазии. С учетом редкости данной патологии терапия пациентов с ОПЛ должна проводится в специализированных клиниках с методическим руководством федеральных центров.
- Рекомендуется для улучшения выживаемости и снижения частоты и тяжести осложнений всем пациентам с впервые выявленным ОПЛ при наличии возможности – участие в клинических исследованиях [59,173].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: в настоящее время существуют 2 подхода к терапии ОПЛ у детей: первый – на основе ATRA** + химиотерапия и второй – на основе ATRA** + триоксид мышьяка [9,60].
- Рекомендуется пациентам при возникновении подозрений на ОПЛ клиническую ситуацию и любые действия в отношении пациента расценивать как неотложные и незамедлительные, в том числе до генетического подтверждения диагноза начинать сопроводительную терапию, направленную на коррекцию гемостаза, и специфическую терапию ATRA** (см. раздел 3.2. «Первичные действия по проведению сопроводительной терапии при подозрении на диагноз ОПЛ» и раздел 3.3.3. «Лечение коагулопатии») [22,23,33,39,47,185].
Уровень убедительности рекомендации В (уровень достоверности доказательств – 3)
Комментарии: хотя существует общий консенсус в отношении необходимости молекулярно-генетического подтверждения диагноза ОПЛ, дифференцирующая (таргетная) и сопроводительная терапия должны быть начаты до получения результатов генетических тестов. Необходимо учитывать любые подозрения на ОПЛ: наличие у пациента тяжелой коагулопатии, геморрагического синдрома, лейкопении, характерной морфологической картины бластных клеток. Во всех таких случаях следует начинать терапию ATRA** немедленно и продолжать ее до момента подтверждения диагноза или его опровержения на основе генетического исследования.
- Рекомендуется пациентам с верифицированным ОПЛ индукционная терапия, включающая сочетанное применение ATRA** и антрациклинов (АТХ: L01DB антрациклины и родственные соединения) с цитарабином** или без него (стандартный подход) либо ATRA** и АТО** (альтернативный подход) [22,23,39].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
Комментарии: всем пациентам независимо от инициального лейкоцитоза курс ХТ должен быть начат не позднее 3-го дня от начала лечения ATRA**. Пациентам с числом лейкоцитов >10×109/л курс противоопухолевыми препаратами начинают одномоментно с ATRA**. Оптимальным днем начала курса ХТ для пациентов с числом лейкоцитов <10×109/л может считаться 2-й день от начала приема ATRA**, поскольку к этому времени уже должен быть подтвержден диагноз ОПЛ и вероятность развития раннего ретиноидного синдрома крайне мала.
2. Первичные действия по проведению сопроводительной терапии при подозрении на диагноз ОПЛ
Сопроводительная терапия, направленная на коррекцию гемостаза
Внутримозговые кровоизлияния, легочные и другие кровотечения являются частыми жизнеугрожающими осложнениями ОПЛ вследствие грубых коагуляционных нарушений. Эти осложнения не только становятся наиболее частой причиной смерти на ранних этапах индукционной терапии, но нередко развиваются до установления диагноза ОПЛ и начала терапии [61-64].
- Рекомендуется всем пациентам начало сопроводительной терапии, направленной на коррекцию коагулопатии, начинать немедленно при минимальном подозрении на ОПЛ [33,63,65,66,185].
Уровень убедительности рекомендации B (уровень достоверности доказательств – 3)
Комментарии: терапия должна включать свежезамороженную плазму (СЗП), криопреципитат и/или концентрат фибриноген, трансфузию тромбоконцентратов для поддержания уровня концентрации фибриногена >1,0-1,5 г/л и количества тромбоцитов >50×109/л. Поддерживать количество тромбоцитов выше 100,000/μL для пациентов с кровоизлиянием в ЦНС (до стабилизации состояния, нормализации коагулопатии и минимум 7 дней от диагноза кровотечения).
Мониторинг этих показателей (Лабораторный контроль за лечением синдрома диссеминированного внутрисосудистого свертывания крови, В03.005.002) должен выполняться по крайней мере 1 раз в день (при необходимости – чаще). Такая терапия должна продолжаться в течение всего периода индукционной терапии до исчезновения всех клинических и лабораторных признаков коагулопатии. Следует обращать внимание на факторы, повышающие риск развития фатальных кровоизлияний и кровотечений. Эти факторы следующие: уже состоявшееся или активное кровотечение, гипофибриногенемия (<1,0 г/л), повышение уровня продуктов деградации фибрина или D-димеров в сочетании с увеличением протромбинового времени или активированного частичного тромбопластинового времени, а также гиперлейкоцитоз, наличие бластных клеток в ПК, высокий уровень креатинина, плохой сом атический статус. Следует избегать катетеризации центральных вен, спинномозговых пункций и других инвазивных процедур (например, бронхоскопии) перед началом терапии и в период индукции ремиссии в связи с высоким риском геморрагических осложнений.
Катетеризация подключичной и других центральных вен (А11.12.001) должна выполняться опытными врачами только после коррекции коагуляционных нарушений. Кроме того, прокоагуляционный статус при ОПЛ может не только приводить к увеличению риска геморрагических осложнений, но и увеличивать риск тромбозов. Преимущество от использования гепарина натрия**, транексамовой кислоты**, аминокапроновой кислоты**, других антикоагулянтов или ингибиторов фибринолиза спорно и не доказано, и эти препараты не должны использоваться вне клинических испытаний. Есть также сообщения о случаях использования эптакога альфа (активированного)** (фактор свертывания крови VIIa) (АТХ – B02BD08) в случае тяжелого, жизнеугрожающего кровотечения [67,68].
3. Лечение пациентов с впервые установленным диагнозом ОПЛ
В настоящее время существует 2 подхода к лечению ОПЛ: «стандартный» – включающий однвременное применение дифференцирущего лечения (ATRA**) и цитостатического воздействия, включающего антрациклины (АТХ: L01DB антрациклины и родственные соединения) и цитарабина** и «альтернативный» подход, включающий только комбинацию ATRA** и триоксида мышьяка (ATO) для лечения пациентов группы низкого риска и добавлением к этой комбинации антрациклинов в индукции ремиссии для пациентов группы высокого риска.
1. Специфическая терапия ОПЛ у детей с одновременным применением
ATRA**+ ХТ («Стандартный» подход)
- Рекомендуется всем пациентам с впервые выявленным ОПЛ проведение курса индукции с последующей консолидацией; для пациентов с рефрактерной формой – аллогенная трансплантация гемопоэтических стволовых клеток (аллоТГСК) (A16.05.001 Трансплантация костного мозга) [7,8,9,33,69-72].
Уровень убедительности рекомендации A (уровень достоверности доказательств – 2)
Комментарии: самые первые рандомизированные исследования по сочетанному применению ATRA** и ХТ показали безусловные преимущества данного подхода перед стандартной ХТ [73].
Ряд клинических исследований (КИ), проведенных в течение последних 2-х десятков лет, позволил оптимизировать схему введения ATRA** и антрациклинов (АТХ: L01DB антрациклины и родственные соединения). Так, в рандомизированном исследовании Европейской группы по ОПЛ было показано, что наиболее эффективным является одновременное, а не последовательное, применение ATRA** и ХТ [74].
Именно итоги этих исследований привели к тому, что программа сочетанного применения ATRA** и ХТ антрациклинами (АТХ: L01DB антрациклины и родственные соединения) стала стандартом лечения первичных ОПЛ [72]. Однозначных жестких рекомендаций по выбору программы ХТ нет. Большинство исследователей склоняются к применению риск-адаптированного испанского протокола AIDA, поскольку при одинаковой эффективности у него существенно меньшие показатели токсичности [75].
По опыту Российской научно-исследовательской группы по лечению ОПЛ у взрослых применение протокола AIDA у пациентов с впервые выявленным ОПЛ столь же эффективно: трехлетняя ОВ и БРВ составили 86,7 и 75,8%. Этап индукционного лечения сложный и требует массивной сопроводительной терапии, этапы консолидации значительно менее токсичны и могут выполняться в амбулаторном режиме.
Отказ от использования стандартного подхода должен рассматриваться только в исключительных случаях, в которых ХТ противопоказана (например, тяжелая органная недостаточность, терапия антикоагулянтами (АТХ – В01А Антитромботические средства), пациент старше 80 лет), а также в тех случаях, когда альтернативные варианты индукционной терапии диктуются социально-экономи ческими факторами или проведением клинических испытаний.
Проведенное исследование российско-белорусской группой по лечению ОПЛ у детей по протоколам ОПЛ 1993/98 и ОПЛ 2003 показало хорошую эффективность терапии в целом (БСВ и ОВ составили 79±6 и 93±3% соответственно), не смотря на снижение суммарной дозы даунорубицина** до 405 мг/м2 и разовой дозы АТRА** до 25 мг/м2 [77].
- Рекомендуется пациентам с ОПЛ, получавшим на индукционном этапе ATRA** и ХТ, проводить 2-3 курса консолидации, включающей антрациклины (АТХ: L01DB антрациклины и родственные соединения) (идарубицин**, даунорубицин** и митоксантрон**) и поддерживающую терапию с включением коротких курсов ATRA**. [69,70,77,78, 175]
Уровень убедительности рекомендации В (уровень достоверности доказательств ‒ 3)
Комментарии: Индукция ремиссии и последующие консолидаций проводится согласно одной из следующих схем*:[175]
1. ATRA**, Цитарабин**, Даунорубицин**
Индукция для группы низкого и высокого риска
ATRA** 25 мг/м2/сутки в капсулах по 10 мг в два приёма, во время еды. Доза округляется в сторону увеличения. Препарат дается незамедлительно при подозрении на ОПЛ до достижения полной ремиссии, но не более 45 дней
Цитарабин** 100 мг/м2 в виде часовой инфузии каждые 12 часов с 4-го дня после начала ATRA** по 10-й день, всего 14 доз
Даунорубицин** 60 мг/м2/сутки в/в в виде 30-минутной инфузии с 4-го по 6-й день, всего 3 дозы.
Консолидация 1 для групп низкого и высокого риска
Цитарабин** 100 мг/м2 в/в в виде часовой инфузии каждые 12 часов 1-7-дни, всего 14 доз
Даунорубицин** 45 мг/м2в/в в виде 30-минутной инфузии 1 раз в сутки с 1 по 3 дни, всего 3 дозы
Консолидация 2 (интенсификация) для групп низкого и высокого риска
АТRА** 25 мг/м2/сутки per os в капсулах по 10 мг в 2 приема – 14 дней.
Цитарабин** 1000 мг/м2 в/в в виде 2-х часовой инфузии каждые 12 часов 1-4 дни, всего 8 доз
Даунорубицин** 30 мг/м2 в/в в виде 30-минутной инфузии 1 раз в сутки с 1 по 3 дни, всего 3 дозы
После завершения интенсивной фазы протокола, восстановления показателей крови и проведения пункции костного мозга начинается поддерживающая терапия (ПТ). В случае выявления минимальной остаточной болезни в костном мозге пациент переводится в группу очень высокого риска. Общая продолжительность протокола составляет 24 месяца от начала индукции. Поддерживающая терапия основана на комбинированном применении химиотерапии и ATRA**
Поддерживающая терапия [14,79]
АTRA** – 25 мг/м2 в день по 15 дней (начиная с третьего месяца поддерживающей терапии) каждые 3 месяца в течение первого года. Всего на этапе поддерживающей терапии проводится 3 двухнедельных курса ATRA.
Меркаптопурин** (Код МНН: 004120) (МП) в стартовой дозе 50 мг/м2 внутрь в таблетках ежедневно натощак в вечернее время
Метотрексат** (МТХ) – 20 мг/м2 в таблетках 1 раз в неделю.
Доза препаратов модифицируется на 25-50% в зависимости от лейкоцитов крови, уровень лейкоцитов должен поддерживаться на уровне 2500-3000/мкл
2. ATRA**, Идарубицин**/Митоксантрон**, Цитарабин** [14,79]
Индукция для группы низкого риска
ATRA** 25 мг/м2/сутки, с 1 по 30-й день
Идарубицин** 12 мг/м2, короткая инфузия, 3-й, 5-й и 7-й дни
Индукция для группы высокого риска
ATRA** 25 мг/м2/сутки, с 1 по 30-й день
Идарубицин** 12 мг/м2, 1-й, 3-й и 5-й дни
Консолидация 1 для групп низкого и высокого риска
ATRA** 25 мг/м2/сутки, с 1 по 14-й день
Митоксантрон** 10 мг/м2, короткая инфузия, 4-й и 5-й дни
Цитарабин** 1000 мг/м2 в/в в виде 2-х часовой инфузии каждые 12 часов 2-4 дни, всего 6 доз
Консолидация 2 для групп низкого и высокого риска
ATRA** 25 мг/м2/сутки, с 1 по 14-й день
Идарубицин** 5 мг/м2, 1-й, 3-й и 5-й дни
Цитарабин** 1000 мг/м2 в/в в виде 2-х часовой инфузии каждые 12 часов 2-4 дни, всего 6 доз
Консолидация 3 для группы высокого риска
ATRA** 25 мг/м2/сутки, с 1 по 14-й день
Идарубицин** 10 мг/м2, 4-й день
Цитарабин** 1000 мг/м2 в/в в виде 2-х часовой инфузии каждые 12 часов 1-3 дни, всего 6 доз
После 2-й консолидации у пациентов низкой группы риска и 3-ей консолидации у пациентов высокой группы риска производится костно-мозговая пункция с определением МОБ методом ПЦР.
В случае негативной МОБ пациенты группы низкого риска получают поддерживающую терапию, а при позитивной МОБ – получают Консолидацию 3 для группы высокого риска, после которой проводится повторное исследование МОБ. Если МОБ остается позитивной – пациент получает лечение для рефрактерных ОПЛ; при негтивной МОБ пациенты группы низкого риска получают поддерживающую терапию.
Для пациентов высокой группы риска негативная МОБ после Консолидации 3 является основанием для назначения поддерживающей терапии. В случае позитивной МОБ после Консолидации 3 пациент получает лечение для рефрактерных ОПЛ.
- Рекомендуется с целью профилактики нейролейкемии всем пациентам, получающим терапию ОПЛ, выполнение спинномозговой пункции и интратекальная терапия (введение лекарственных препаратов в спинномозговой канал). Первая (диагностическая) спинномозговая пункция (А11.23.001) проводится только при купировании геморрагического синдрома не ранее 2-х недель от начала терапии индукции ремиссии (см. диагностические исследования) [7,8,22].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
ЦНС-терапия
Комментарии: все больные без инициального ЦНС – поражения всего получают 3 эндолюмбальных (э/л) введения Цитарабина** в возрастной дозировке (профилактика): 1-ое введение – перед консолидацией, второе введение – перед интенсификацией и 3-е введение по выходе из аплазии после интенсификации. Краниальное облучение не проводится.
Таб.2.
Дозы цитарабина** для интратекального введения в зависимости от возраста [174].
| Возраст | Доза, мг |
| Меньше 1 года | 20 |
| 1-2 года | 26 |
| 2-3 года | 34 |
| Старше 3 лет | 40 |
При инициальном поражении ЦНС (цитоз >5/мкл при наличии бластов или эпидуральная хлорома) показаны э/л введения Цитарабина** и Метотрексата** в возрастных дозировках, при плохой переносимости – в э/л введение добавить Дексаметазон** – 2 мг. Пункции проводятся 1 раз в неделю до санации ликвора (не менее 3 пункций), далее – перед курсами ХТ, всего не менее 5 э/л введений. Дозы химиопрепаратов для эндолюмбального введения [174]:
| Возраст, лет | <1 | 1-2 | 2-3 | >3 |
| Цитарабин** мг | 20 | 26 | 34 | 40 |
| Метотрексат** мг | 6 | 8 | 10 | 12 |
При инициальном нейролейкозе – доза Цитарабина** для системной терапии в курсе интенсификации должна быть увеличена до 3 гр/м2 в/в за 3 часа – всего 8 введений.
2. Специфическая терапия ОПЛ у детей с без применения ХТ на основе ATRA**+ АТО** («Альтернативный» подход)
- Рекомендуется пациентам с ОПЛ группы низкого риска в терапии индукции и коносолидации применение комбинации ATRA** и АТО** без химиотерапии. Пациенты высокой группы риска дополнительно получают антрациклины (АТХ: L01DB антрациклины и родственные соединения) в индукции, консолидация проводится аналогично группе низкого риска [80-86]. Поддерживающая терапия не проводится в обеих группах риска [84,85].
Уровень убедительности рекомендации A (уровень достоверности доказательств – 2)
Комментарии: В последние несколько лет в лечении ОПЛ произошла революция, связанная с введением триоксида мышьяка в терапию первой линии ОПЛ у взрослых пациентов. Это привело к созданию протоколов лечения ОПЛ без использования химиотерапевтических препаратов. Впервые Lo-Coco et al. (2013) в рандомизированном исследовании сравнили комбинацию ATRA** + триоксид мышьяка (ATO**) против ATRA** + антрациклины и родственные соединения (Код АТХ: L01DB) в индукции и консолидации у пациентов группы низкого риска ОПЛ. Хотя результаты в обеих группах рандомизации были отличными, статистически значимая лучшая выживаемость без событий (EFS) и общая выживаемость (ОS) наблюдалась у пациентов, которые получили ATRA** + ATO** [80]. После этих результатов детские гематологи также начали создавать протоколы лечения впервые выявленых ОПЛ, состоящих только из ATRA и АТО для пациентов группы низкого риска с добавлением небольших доз антрациклинов (АТХ: L01DB антрациклины и родственные соединения) в схемы индукции ремиссии у пациентов высокой группы риска. В 2-х законченных мультицентровых исследованиях у детей с ОПЛ в Китае [84] и США [85] результаты безсобытийной выживаемости для детей группы низкого риска составили 97% и 98% соответственно, а для детей высокой группы риска – 95% и 96,4% соответственно. В обоих исследованиях антрациклины (АТХ: L01DB антрациклины и родственные соединения) применялись только для высокой группы риска в индукции ремиссии в редуцированной суммарно дозе (240 мг/м2 по даунорубицину**). Стоит отметить, что в исследовании AAML1331(COG, США) [85] поддерживающая терапия не предусматривалась. Это нерандомизированное исследование показало, что педиатрических пациенты с ОПЛ низкого риска могут быть успешно и безопасно излечены с помощью ATRA**/АТО** аналогично взрослым пациентам с ОПЛ низкого риска. Добавление к ATRA**/АТО** только идарубицина** в индукцию ремиссии в сниженной кумуллятивной дозе способствуют достижению отличных результатов выживаемости, а отсутствие поддерживающей терапии позволяет закончить все лечение за 9-10 месяцев.
ATRA**, АТО**, Идарубицин** [85]
Индукция для группы низкого риска
ATRA** 25 мг/м2/сутки в капсулах по 10 мг в два приёма, во время еды. Доза округляется в сторону увеличения. Препарат дается незамедлительно при подозрении на ОПЛ с 1 по 28 день до достижения полной ремиссии, но не более 45 дней
АТО** (триоксид мышьяка) 0,15 мг/кг/сутки в/в в виде 2-х часовой инфузии (можно удлинить инфузию до 4 часов при появлении активных вазомоторных симптомов) с 1 по 28 день до достижения полной ремиссии, но не более 45 дней
Дексаметазон** 5мг/м2/сутки внутрь или в/в в 2 приема
Индукция для группы высокого риска
ATRA** 25 мг/м2/сутки в капсулах по 10 мг в два приёма, во время еды. Доза округляется в сторону увеличения. Препарат дается незамедлительно при подозрении на ОПЛ с 1 по 28 день до достижения полной ремиссии, но не более 45 дней
АТО** (триоксид мышьяка) 0,15 мг/кг/сутки в/в в виде 2-х часовой инфузии (можно удлинить инфузию до 4 часов при появлении активных вазомоторных симптомов) с 1 по 28 день до достижения полной ремиссии, но не более 45 дней
Идарубицин** 12мг/м2 (0,4 мг/кг для детей весом менее 10 кг) в/венно в виде часовой инфузии 1-й, 3-й и 5-й день (возможна замена препарата на Митоксантрон** в дозе 15 мг/м2 или Даунорубицин** в дозе 60 мг/м2)
Дексаметазон** 5мг/м2/сутки внутрь или в/в в 2 приема
Консолидация 1, 2, 3 для групп низкого и высокого риска
Каждая консолидация проводится в течении 42 дней, между которыми 14-дневный перерыв
ATRA** 25 мг/м2/сутки в капсулах по 10 мг в два приёма, во время еды. Доза округляется в сторону увеличения. Препарат дается в 1-14 и 29-42 дни каждой консолидации
АТО** (триоксид мышьяка) 0,15 мг/кг/сутки в/в в виде 2-х часовой инфузии (можно удлинить инфузию до 4 часов при появлении активных вазомоторных симптомов). Препарат дается в 1-5, 8-12, 15-19 и 22-26 дни каждой консолидации.
На 43-й день цикла Консолидации 2 проводится КМП для определения МОБ методом RQ-PCR:
Если МОБ негативна, то пациент продолжает лечение по циклу Консолидации 3
При позитивности МОБ через 1-2 недели проводится контрольная КМП с повторным определением МОБ. Если МОБ при контрольной КМП негативна, то пациент продолжает лечение по циклу Консолидации 3 При сохраняющемся позитивном значении МОБ в контрольной КМП, пациент переводится на Консолидацию для МОБ-позитивных пациентов.
Консолидация для МОБ-позитивных пациентов
ATRA** 25 мг/м2/сутки в капсулах по 10 мг в два приёма, во время еды. Доза округляется в сторону увеличения. Препарат дается в 1-14 и 29-42 дни каждой консолидации.
Цитарабин** 1000 мг/м2/доза (для детей с площадью поверхности тела <0,6 м2, то доза Цитарабина** – 33 мг/кг/доза) за 1-3 часа в/венно капельно каждые 12 часов на 1-4-й дни (всего 8 введений) консолидации.
Митоксантрон** 15 мг/м2 (для детей с площадью поверхности тела <0,6 м2, то доза Митоксантрона** – 0,4 мг/кг/доза) в/венно в виде часовой инфузии 1 раз в день на 3-6-й дни (всего 4 введения) консолидации.
КМП для определения МОБ методом RQ-PCR проводится на 29-й день цикла Консолидации для МОБ-позитивных пациентов
- Если МОБ негативна, то пациент продолжает лечение по циклу Консолидации 3 на день 57 и при восстановлении показателей крови (гранулоциты ≥1 000/мкл и тромбоциты ≥100 000/мкл).
- При позитивности МОБ через 1-2 недели проводится контрольная КМП с повторным определением МОБ. Если МОБ при контрольной КМП негативна, то пациент продолжает лечение по циклу Консолидации 3 на день 30 и при восстановлении показателей крови (гранулоциты ≥1 000/мкл и тромбоциты ≥100 000/мкл). При сохраняющемся позитивном значении МОБ пациент позитивном значении МОБ в контрольной КМП, пациент переводится на Алло-ТГСК.
Консолидация 4
4-й цикл консолидации на 57-й день после 3-го цикла консолидации и при восстановлении показателей крови (гранулоциты ≥1 000/мкл и тромбоциты ≥100 000/мкл). Консолидация 4 длится 28 дней
ATRA** 25 мг/м2/сутки в капсулах по 10 мг в два приёма, во время еды. Доза округляется в сторону увеличения. Препарат дается в 1-14 консолидации.
АТО** (триоксид мышьяка) 0,15 мг/кг/сутки в/в в виде 2-х часовой инфузии (можно удлинить инфузию до 4 часов при появлении активных вазомоторных симптомов). Препарат дается в 1-5, 8-12, 15-19 и 22-26 дни консолидации.
ЦНС терапия
Диагностическая спинномозговая пункция (А11.23.001) должна быть отложена до купирования симтомов коагулопатии.
- Поскольку АТО** (триоксид мышьяка) проникает через гематоэнцефалический барьер, пациенты с ОПЛ, получающие лечение на основе АТО**и не имеющих признаков нейролейкемии, а также признаков кровоизлияния в ЦНС, профилактика нейролейкемии не рекомендуется [87-90].
Уровень убедительности рекомендации С (уровень достоверности доказательств ‒ 5)
- Рекомендуется пациентам с ОПЛ проведение лечения и профилактики нейролейкемии, имеющим клинические и лабораторные признаки поражения ЦНС и клинические и инструментальные признаки кровоизлияния в ЦНС [85,176,177].
Уровень убедительности рекомендации С(уровень достоверности доказательств ‒ 5)
Коментарии:
ЦНС-лейкемия определяется как:
- Любое количество бластов в препарате цитоспина при атравматической (<100 Er) пункции
- Наличие бластов в ликворе при травматической пункции, если соотношение L/Er ликвора в 2 раза превышает соотношение L/Er в периферической крови
- Клинические признаки ЦНС лейкемии (такие как паралич лицевого нерва или гипоталамический синдром). Изолированное кровоизлияние в сетчатку не является признаком ЦНС лейкемии.
- Пациенты с документированным кровотечением ЦНС и с неврологическими симптомами, которые полностью связаны с кровоизлиянием в ЦНС не имеют ЦНС лейкемии, если они не соответствуют одному из других критериев (ликвор или объемное образование), но эти пациенты соответствуют критериям для «ЦНС кровотечения»
- Радиологические признаки объемного образования ЦНС
ЦНС кровотечение определяется как:
- Любые радиологические признаки кровоизлияния в паренхиму мозга, спинной мозг или субарахноидальное, субдуральное или эпидуральное пространство.
- Изолированное кровоизлияние в сетчатку не является кровоизлиянием в ЦНС.
Показания к интратекальной терапии в индукции
- Кровотечение в ЦНС
- Пациенты с документированным кровотечением в ЦНС будут получать профилактику ЦНС-лейкемии, включающую тройную интратекальную химиотерапию на 29-й день индукции. (См. таблицу ниже для дозировка в зависимости от возраста).
- ЦНС-лейкемия
- Пациенты с ЦНС-лейкемией будут получать 2 раза в неделю тройную интратекальную химиотерапию (с минимальным интервалом 48 часов между процедурами) до санации ликвора плюс два дополнительных введения (минимум 4 и максимум 6 процедур). Во время индукции пациенты с ЦНС-лейкемией также получат дозу Лейковорина** 10 мг/м2 через 24 часа после интратекального введения МТХ.
Показания к интратекальной терапии в консолидациях 1, 2, 3
Интратекальная (тройная) терапия проводится только для пациентов с ЦНС-лейкемией в 15 и 43 дни консолидаций
Таблица дозировки интратекальной ХТ в зависимости от возраста [192,186, 192,193]
| Возраст | Метотрексат** | Преднизолон** | Цитарабин** |
| 1-2 года | 8 мг | 6 мг | 24 мг |
| 2-3 года | 10 мг | 8 мг | 30 мг |
| >3 лет | 12 мг | 10 мг | 36 мг |
Поддерживающая терапия
- Не рекомендуется проведение поддерживающей терапии пациентам с ОПЛ, завершивших программу индукции и консолидации ремиссии на основе применения ATRA** и АТО** [85,178,179].
Уровень убедительности рекомендации С (уровень достоверности доказательств ‒ 5)
Комментарии: как показало исследование AAML 1331 панамериканской группы COG отсутствие поддерживающей терапии существенно сократило общую продолжительность терапии ОПЛ, от более чем 2 лет до примерно 9 месяцев при достижении высоких показателей выживаемости (2-летний EFS 96,4%) среди пациентов с APL высокой группы риска [85].
3. Лечение побочных эффектов ATRA** и ATO**
Профилактика и лечение синдрома дифференцировки опухолевых клеток
При терапии ОПЛ c использованием АТРА** и АТО** возможно развитие тяжелого жизнеугрожающего осложнения – синдрома дифференцировки (СД).
- Рекомендуется всем пациентам с ОПЛ назначать дексаметазон** в дозе 2,5 мг/м2 2 раза в сутки внутрь или внутривенно (в/в) в течение 15 дней с целью профилактики развития СД [85,91].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
- Рекомендуется всем пациентам с ОПЛ с минимальными подозрениями на начало развития ДС незамедлительное назначение дексаметазона** в дозе 10 мг/м2 2 раза в сутки внутривенно до купирования ДС [22,33,85,91-93].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
Комментарии: введение дексаметазона** даже при малейшем подозрении на ДС является стандартным подходом к лечению ДС, несмотря на то что прямые доказательства тому, что профилактическое введение глюкокортикоидов снижает летальность, связанную с этим синдромом, отсутствуют. Тем не менее в неконтролируемых исследованиях было показано, что процент фатальных исходов при развитии ДС на фоне профилактического введения глюкокортикоидов снижается.
Вероятность развития ДС опухолевых клеток выше у пациентов с инициальным лейкоцитозом (>5×109/л) и нарушением функции почек (креатинин >123 мкмоль/л).
Поэтому раннее начало ХТ в сочетании с ATRA** и профилактическое введение глюкокортикоидов являются стандартным подходом к лечению в этой угрожающей жизни ситуации. У пациентов с числом лейкоцитов >10×109/л ХТ обычно начинается в течение нескольких часов после приема первой дозы ATRA**. Именно это позволяет контролировать коагулопатию при одновременном снижении риска развития ДС, частота которого особенно высока у этих пациентов.
Лечение гиперлейкоцитоза
- Рекомендуется увеличение уровня лейкоцитов более 10х109/л на фоне начала лечения ATRA**/ATO** интерпретировать как признак индуцированной дифференцировки на фоне приема дифференцировочных агентов и не приводить к рестратификации группы риска [33]
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
- Рекомендуется пациентам со значительным гиперлейкоцитозом (лейкоциты >10.000-100.000/мкл), который может протекать без симптомов СД после инициации ATRA** или ATRA**/ATO** антипролиферативное лечение #гидроксикарбамидом** (30 мг/кг/доза (максимум, 1000 мг/доза) внутрь 4 раза в день). В настоящее время гидроксимочевина уже рекомендуется при уровнях лейкоцитов >5,000/мкл в дополнение к кортикостероидам [33, 85].
Уровень убедительности рекомендации ‒ С (уровень достоверности доказательств – 5)
Комментарии: Не рекомендуется пациентам с ОПЛ проведение цитафереза лейкоцитов (Цитаферез гемопоэтических клеток, А18.05.017) в качестве рутинной процедуры из-за риска развития фатальных геморрагических осложнений и ДВС-синдрома. Однако, в случае неэффективности проведения циторедуктивной терапии у больных с гиперлейкоцитозом в жизнеугрожающих ситуациях возможно использование цитафереза лейкоцитов (Цитаферез гемопоэтических клеток, А18.05.017) при условии максимально возможного контроля геморрагического синдрома.
Контроль побочных эффектов терапии триоксидом мышьяка** (ATO**)
Применение мышьяка триоксида может приводить к удлинению интервала QT и развитию полной предсердно-желудочковой блокады. Удлинение интервала QT может стать причиной желудочковой тахикардии типа "пируэт" (torsades de pointes) с возможным летальным исходом. Механизм ATO-индуцированная кардиотоксичности в основном включает накопление активных форм кислорода (АФК) и внутриклеточного кальция 5,6 АТО может явиться тригером для повреждения кардиомиоцитов путем апоптоза, аутофагии и некроза.
Кардиотоксичность проявляется в удлинении интервала QT на ЭКГ, развитии аритмий сердца и снижение электролитов (калия и магния) в биохимическом анализе крови. При появлении изменений на ЭКГ – прервать введения триоксида мышьяка до восстановления всех показателей.
Наиболее важными дополнительными побочными эффектами триоксида являются лейкоцитоз (начало гидроксимочевины с WBC >5.000/мкл), удлинение интервала QT на ЭКГ и снижение электролитов (калия и магния) в биохимическом анализе крови.
- Рекомендуется всем пациентам с ОПЛ, получающим лечение с использованием АТО** контролировать ЭКГ (регистрация электрокардиограммы) перед каждым курсом АТО** и один раз в неделю во время инфузии АТО. При интервале QTc более 500 мс терапия прерывается из-за риска сердечной аритмии. Значения калия должны быть выше 4 ммоль/л, а значения магния – выше 1,8 мг/дл. [22,33,180]
Уровень убедительности рекомендации ‒ С (уровень достоверности доказательств – 5)
Комментарии: Некоторые лекарственные препараты удлиняют интервал QT и потенциально могут усугубить влияние ATO на интервал QT. Следует соблюдать осторожность при одновременном применении любых лекарственных средств. Список таких лекарственных средств приведен в приложении 2
4. Лечение рецидивов и рефрактерных форм ОПЛ
По данным разных исследований, применение монотерапии ATO в лечении рецидива ОПЛ позволяет достичь 2-й молекулярной ремиссии в 70-90% случаев [47,48]. В то же время использование трансплантационных подходов у пациентов, которым достигнута 2-я ремиссия ОПЛ, показывает их преимущество перед использованием только ATO-содержащих программ. Так, например, исследование европейской группы LeukemiaNet показало 3-летнюю ОВ у 80% больных после применения ауто ТГСК во второй молекулярной ремиссии по сравнению с 59% у пациентов без ТГСК [49]. Хотя алло-ТГСК характеризуется, по данным некоторых исследований, меньшей вероятностью развития повторных рецидивов после ТГСК по сравнению с ауто-ТГСК, летальность, связанная с лечением, делает этот подход у пациентов во второй ремиссии ОПЛ менее предпочтительным по сравнению с ауто-ТГСК [50]. Ожидать высокую эффективность ауто-ТГСК в то же время следует только у пациентов с достигнутой 2-й молекулярной ремиссией.
- Рекомендуется у пациентов с подтвержденным молекулярным рецидивом ОПЛ (определенным как 2 последовательных ПЦР-положительных анализа со стабильным нарастанием уровня PML-RARA-транскрипта) незамедлительно начать терапию, включающую ATRA** и ATO, с целью предотвращения развернутого рецидива [96,97].
Уровень убедительности рекомендации С (уровень достоверности доказательств ‒ 4)
Комментарии: хотя ATRA** в сочетании с ХТ может быть использована в качестве терапии спасения, схемы на основе ATO в настоящее время считаются 1-й линией лечения рецидива ОПЛ.
- Рекомендуется пациентам, у которых получена 2-я молекулярная ПР, рассмотреть возможность выполнения аутологичной ТКМ [98].
Уровень убедительности рекомендации С (уровень достоверности доказательств ‒ 4)
Комментарии: аутологичная ТКМ может выполняться только в случае, если в заготовленном аутотрансплантате отсутствует молекулярный маркер.
- Рекомендуется пациентам, у которых не достигнута 2-я молекулярная ремиссия, рассмотреть возможность выполнения аллогенной ТКМ [99].
Уровень убедительности рекомендации С (уровень достоверности доказательств ‒ 4)
- Рекомендуется для пациентов с рецидивом ОПЛ, протекающим только с поражением ЦНС, индукционная терапия из минимум еженедельного (оптимально 2 раза в неделю) интратекального введения 3-х препаратов (метотрексата** 15 мг, цитарабина** 30 мг и дексаметазона** 4 мг) до полной элиминации опухолевых клеток из спинномозговой жидкости, затем выполняется от 6 до 10 интратекальных введений в качестве консолидации. Параллельно должно проводиться системное лечение как при костномозговом рецидиве [100,174,186].
Уровень убедительности рекомендации C (уровень достоверности доказательств ‒ 5)
- Рекомендуется для лечения рецидивов ОПЛ после лечения АТО использование Бортезомиба** в сочетании с АТО. Доза Бортезомиба** 1,3 мг/м2 внутривенно или подкожно (с целью снижения возможной нейротоксичности) 1, 4, 8 и 11 дни. В случае проявлений нейротоксичности на терапии Бортезомибом** возможно исключение 8 и 11 дней введений, а также уменьшение дозы Бортезомиба** до 1 мг/м2 или до 0,7 мг/м2 на введение [101,102].
Уровень убедительности рекомендации C (уровень достоверности доказательств ‒ 3)
Комментарии: Несмотря на высокую эффективность АТО у больных с ОПЛ, существует проблема рецидивов после терапии АТО и резистентности к лечению АТО. Одном из подходов к лечению рецидивов и резистентных ОПЛ в таких случаях является использование Бортезомиба** в сочетании с АТО [101,102].
- Рекомендуется для лечения рецидивов ОПЛ, в том числе – экстрамедуллярных, включая рецидивы в ЦНС, рефрактерных к терапии АТО, использование Венетоклакса** в дозах в зависимости от веса непрерывно как в монотерапии, так и в сочетании с химиотерапией [94,95,181].
Уровень убедительности рекомендации C (уровень достоверности доказательств ‒ 5)
Коментарии: Таблица дозировки Венетоклакса** у детей старше 2-х лет в зависимости от веса
| Вес (кг) | 10-<20 кг | 20-<30 кг | 30-<45 кг | >45 кг |
| Доза (мг) | 250 | 300 | 400 | 600 |
5. Сопутствующая и сопроводительная терапия
- Всем пациентам, получающим терапию по поводу ОПЛ рекомендуется проведение сопутствующей и сопроводительной терапии в соответствии с профильными рекомендациями [7,104,107].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Показана изоляция детей в боксированные палаты, проведение инфузионной терапии, применение колониестимулирующих факторов по показаниям.
- Не рекомендуется всем пациентам с ОПЛ, учитывая высокую вероятность формирования резистентной микрофлоры, а также высокую частоту инфекций, вызванных энтеробактериями с продукцией бета-лактамаз расширенного спектра (БЛРС), проведение первичной профилактики бактериальных инфекций при ОПЛ антибиотиками, в том числе «селективной деконтаминации» кишечника неабсорбируемыми антимикробными препаратами [108,109].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- Рекомендуется пациентам с ОПЛ в период нейтропении проведение профилактики инвазивных микозов: позаконазолом** (детям старше 13 лет), вориконазолом** (старше 2-х лет), итраконазолом (старше 2-х лет) или, при невозможности назначения азолов, другими противогрибковыми препаратами системного действия (по показаниям) [108-110,156,157].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: прием противогрибковых препаратов системного действия продолжается до повышения гранулоцитов выше 0,5х109/л.
- Рекомендуется пациентам с ОПЛ и ранее установленным инвазивным микозом (ИМ) проведение вторичной противогрибковой профилактики препаратом, при назначении которого было достигнуто излечение от ИМ [108,111–113].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- Рекомендуется всем пациентам с ОПЛ при развитиии ФН в течение не более 60 минут инициировать эмпирическую терапию бета-лактамным антибактериальным препаратом, пенициллиными (комбинации пенициллинов, включая комбинации с ингибиторами бета-лактамаз; цефалоспорины третьего либо четвертого поколения), с активностью против грамположительных и грамотрицательных бактерий, включая синегнойную палочку. [120,122,123 ,153,154,158].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии: Выбор стартовой терапии зависит от соматического состояния, результатов скрининга и предшествующего инфекционного анамнеза пациента, а также локальных эпидемиологических данных и рекомендаций. Введение противомикробных препаратов системного действия пациентам с ОПЛ осуществляется только внутривенно.
- Рекомендуется всем пациентам с ОПЛ и фебрильной нейтропенией при стабильном клиническом состоянием (адекватный уровень сознания, нормальные показатели гемодинамики, отсутствие клиники локальной инфекции) назначение бета-лактамных антибактериальных препаратов, пенициллинов: цефалоспоринов (ЦФ) третьего, четвертого поколения либо #пиперациллин/тазобактама в комбинации с аминогликозидами. [117-119,120,122,127,129-131,154,158].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Дополнительно может быть выполнено назначение антибиотиков гликопептидной структуры, в зависимости от клинической картины, локальных рекомендаций и колонизации пациента. Назначение карбапенемов в качестве антибактериальных препаратов системного действия первой линии обосновано у пациентов с тяжелыми инфекциями, при поражении брюшной, параректальной областей, при развитии сепсиса. Модификацию антимикробной терапии проводят на основании клинических симптомов, результатов инструментальных и микробиологических исследований. При стабильном клиническом состоянии и отсутствии очагов инфекции допустимо продолжение стартовой антибактериальной терапии в течение 48-72-х часов, поскольку лихорадка не является единственным показателем тяжести инфекционного процесса.
- Рекомендуется пациентам с ОПЛ и персистирующей ФН при эмпирической эскалации антибактериальной терапии учитывать результаты микробиологических (культуральных) исследований кала на аэробные и факультативно-анаэробные микроорганизмы для назначения прецизионной антибактериальной терапии [143].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Пациентам с колонизацией резистенстными бактериями необходимо назначение препаратов группы резерва (в соответствии с данными антибиотикограммы).
- Рекомендуется пациентам с ОПЛ при развитии персистирующей ФН, тяжелой инфекции, признаков сепсиса и септического шока назначение бета-лактамных антибактериальных препаратов наиболее широкого спектра действия (карбапенемов) в сочетании с аминогликозидом и ванкомицином**, а пациентам с известной колонизацией – препараты группы резерва. [126,143,152-154,166].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: При развитии тяжелых инфекционных осложнений и/или сепсиса антибактериальные препараты назначаются в максимальных дозах, предпочтительно пролонгированными инфузиями в связи с нарушением клиренса и перераспределением жидкости в организме. Препаратами резервной группы являются колистиметат натрия, полимиксин В**, тигециклин**, #цефтолозан+[тазобактам]**, цефтазидим+[авибактам]** (в некоторых ситуациях в комбинации с азтреонамом**) [126-128,130,143].
- Рекомендуется всем пациентам с ОПЛ проведение эмпирической противогрибковой терапии [131, 133, 134, 156, 157].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3).
- Упреждающая противогрибковая терапия рекомендована всем пациентам с ОПЛ в случае выявления признаков инвазивного микоза при проведении полного комплекса диагностических обследований: КТ органов грудной полости, бронхоскопии с последующим микробиологическим исследованием бронхоальвеолярной лаважной жидкости (в соответствии с приложением А3.4) [131, 156, 157].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Рекомендуется всем пациентам с ОПЛ при развитии кандидемии/инвазивного кандидоза назначение терапии противогрибковыми препаратами системного действия [152, 153, 156-159]
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- Всем пациентам с ОПЛ и нейтропенией и/или гемодинамической нестабильностью для лечения кандидемии флуконазол** не рекомендован [157].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- При развитии инвазивного аспергиллеза всем пациентам с ОПЛ рекомендуется незамедлительное начало терапии противогрибковыми препаратами системного действия [157-163].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
- При развитии инвазивного мукормикоза всем пациентам с ОПЛ рекомендуется незамедлительное проведение комбинированной терапии, включающей противогрибковые препараты системного действия и хирургическое вмешательство [157, 164-166].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
- Рекомендуется всем пациентам младше 18 лет с ОПЛ при снижении уровня тромбоцитов ниже 20×109/л либо при более высоких показателях тромбоцитов при наличии коагулопатии (гипофириногенемия, повышение АЧТВ и МНО) геморрагического синдрома или инфекции трансфузия концентрата тромбоцитов [104,189].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Любое проявление геморрагического синдрома (петехиальные высыпания, особенно на слизистой полости рта, на лице и передней поверхности грудной клетки, любые кровотечения) и/или повышение температуры тела выше 37,5оС даже в отсутствие явного очага инфекции, требует выполнения трансфузии тромбоконцентрата даже при количестве тромбоцитов в периферической крови более 20х109/л. Аналогичные показания для трансфузии тромбоконцентрата при подготовке пациента перед выполнением инвазивных процедур.
Для проведения первой фазы индукции и для выполнения инвазивных манипуляций (люмбальной пункции, катетеризации центральной вены) уровень тромбоцитов должен быть не менее 30х109/л. В период аплазии кроветворения после любого курса полихимиотерапии, если нет кровотечений и/или инфекций с фебрильной лихорадкой – тромбоциты должны поддерживаться на уровне не менее 15х109/л. При присоединении инфекций с фебрильной лихорадкой и при применении Амфотерицина В** тромбоциты должны поддерживаться на уровне не менее 20х109/л.
Выраженная кровоточивость со слизистых, кровотечение в ЖКТ, легочное кровотечение, кровоизлияние в мозг – показания к трансфузии тромбоконцентрата при любых показателях тромбоцитов
- Рекомендуется всем пациентам с ОПЛ при снижении гемоглобина ниже 70 г/л и гематокрите менее 0,3 или развитии клинических симптомов анемического синдрома (сонливость, тахикардия, одышка) трансфузия эритроцитной массы [104,189].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Рекомендуется при наличии нарушений плазменного гемостаза (гипо- и гиперкоагуляция) выполнение трансфузии компонентов крови [190].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: Показания и объем трансфузионной поддержки определяется показателями коагулограммы и клинической ситуацией.
Трансфузии свежезамороженной плазмы проводятся только при серьезных изменениях в коагулограмме: фибриноген менее 1 г/л, протромбиновый индекс менее 50%, АЧТВ более 55 секунд.
- Рекомендуется при возникновении острого или хронического болевого синдрома уточнение этиологии боли; при выявлении очага воспаления – проведение необходимых мероприятий по лечению очага воспаления согласно соответствующим клиническим рекомендациям (включая, при необходимости, хирургическое лечение); при исключении инфекционно-воспалительной природы болевого синдрома рекомендуется проведение обезболивающей терапии согласно существующим протоколам обезболивания (см. соответствующие клинические рекомендации по хронической боли, клинические рекомендации по анестезиологии), в том числе, по показаниям – с применением наркотических и психотропных лекарственных препаратов, с учетом возможных противопоказаний, связанных с цитопенией, иными клиническими ситуациями [191].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Подход к реабилитации и диспансерное наблюдение пациентов с ОПЛ. Диспансерное наблюдение включает систематические осмотры и целенаправленное лабораторное и инструментальное обследование, направленное на оценку статуса ремиссии основного заболевания и возможных осложнений, связанных с перенесенной полихимиотерапией.
Специальных методов реабилитации при ОПЛ не существует.
- Рекомендуется проведение реабилитации при возникновении осложнений после завершения программы терапии ОПЛ в рамках соответствующих нозологий [170].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: после окончания лечения рекомендуется вести здоровый образ жизни, исключить инсоляцию.
При проведении полихимиотерапии возможна кардио-, гепато-, нейро-, нефро- и другая токсичность, последствия которой могут проявляться и после ее окончания.
Госпитализация
Организация оказания медицинской помощи
Показания для плановой госпитализации:
1) Подозрение/установление диагноза ОЛ
2) Диагностика рецидива ОПЛ
3) Проведение очередного курса ХТ в условиях круглосуточного стационара
4) Проведение запланированной ТГСК
5) Выполнение плановых хирургических вмешательств,
6) Выполнение плановых экстракорпоральных методов очищения крови и заместительной почечной терапии
7) Проведение заместительной гемокомпонентной терапии
Показания для экстренной госпитализации:
Неотложные состояния у пациентов с ОПЛ и при подозрении на ОЛ:
- лейкоцитоз более 100х109/л
- фебрильная лихорадка и инфекционные осложнения на фоне нейтропении после курса ХТ
- геморрагический синдром
- тромботические осложнения
- необходимость проведения экстренной заместительной гемокомпонентной терапии
- другие системные нарушения, обусловленные течением основного заболевания или резвившиеся вследствие проведенного лечения
Показания к выписке пациента из стационара:
1) Восстановление показателей периферической крови (лейкоциты более 1х109/л, гранулоциты более 0,5х109/л, тромбоциты более 50х109/л, гемоглобин – более 80 г/л) после очередного курса ХТ
2) Нормотермия в течение 3-5 суток и отсутствие неконтролируемых инфекционных осложнений в послекурсовом периоде
3) Купирование геморрагических осложнений
4) Купирование тромботических осложнений
5) Купирование системных нарушения, обусловленных течением основного заболевания или развившихся вследствие проведенного лечения.
Заключение о целесообразности перевода больного в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра больного врачами специалистами медицинской организации, в которую планируется перевод.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Первичная профилактика ОПЛ невозможна в связи с низкой базовой заболеваемостью и неустановленными причинами болезни.
Профилактика рецидива заболевания основана на полном выполнении протокола терапии первой линии и проведении регулярного динамического наблюдения
- Рекомендуется с целью мониторинга ремиссии в течение поддерживающей терапии выполнение общего (клинического) анализа крови 1 раз в месяц. [7,8,186]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
- Рекомендуется с целью мониторинга ремиссии после окончания терапии наблюдение врачом-гематологом и/или врачом-педиатром по месту жительства с выполнением необходимого объема обследований со следующей периодичностью: [7,186]
1) общий (клинический) анализ крови с подсчетом лейкоцитарной формулы 1 раз в месяц первые 3 мес., затем 1 раз в 6 мес в течение 5 лет;
2) молекулярно-биологическое исследование крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1), определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови через 6 месяцев после окончания химиотерапии;
3) анализ крови биохимический общетерапевтический с оценкой альбумина, АЛТ, АСТ, ЛДГ, билирубина (общего и прямого), мочевины и креатинина, ферритина 1 раз в год в течение 5 лет;
4) ЭКГ и эхокардиография 1 раз в год в течение 5 лет;
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Информация
Источники и литература
-
Клинические рекомендации Ассоциации онкологов России
- Клинические рекомендации Ассоциации онкологов России - 1. Sanz MA, Montesinos P: How we prevent and treat differentiation syndrome in patients with acute promyelocytic leukemia. Blood 123 (18): 2777-82, 2014 2. Montesinos P, Bergua JM, Vellenga E, et al.: Differentiation syndrome in patients with acute promyelocytic leukemia treated with all-trans retinoic acid and anthracycline chemotherapy: characteristics, outcome, and prognostic factors. Blood 113 (4): 775-83, 2009. 3. Coombs CC, DeAngelis LM, Feusner JH, et al.: Pseudotumor Cerebri in Acute Promyelocytic Leukemia Patients on Intergroup Protocol 0129: Clinical Description and Recommendations for New Diagnostic Criteria. Clin Lymphoma Myeloma Leuk 16 (3): 146-51, 2016 4. de Botton S, Coiteux V, Chevret S, et al.: Outcome of childhood acute promyelocytic leukemia with all-trans-retinoic acid and chemotherapy. J Clin Oncol 22 (8): 1404-12, 2004. 5. Unnikrishnan D, Dutcher JP, Varshneya N, et al.: Torsades de pointes in 3 patients with leukemia treated with arsenic trioxide. Blood 97 (5): 1514-6, 2001. 6. Barbey JT: Cardiac toxicity of arsenic trioxide. Blood 98 (5): 1632-1634, 2001. 7. Детская гематология Под ред: А.Г. Румянцева, А.А. Масчана, Е.В. Жуковской. 2015. 656 p. 8. Pui C.-H. Childhood leukemias. 2012. 880 p. 9. C.Gurnari, М.T.Voso, K.Girardi, A.Mastronuzzi and L. Strocchio. Acute Promyelocytic Leukemia in Children: A Model of Precision Medicine and Chemotherapy-Free Therapy. Int. J. Mol. Sci. 2021, 22, 642 10. Grimwade D, Biondi A, Mozziconacci MJ, Hagemeijer A, Berger R, Neat M, et al. Characterization of acute promyelocytic leukemia cases lacking the classic t (15;17): results of the European Working Party. Groupe Francais de Cytogenetique Hematologique, Group Francais d’Hematologie Cellulaire, UK Cancer Cytogenetics. Blood, 2000; 96:1297–308. 11. Melnick, A.; Licht, J.D. Deconstructing a disease: RARalpha, its fusion partners, and their roles in the pathogenesis of acute promyelocytic leukemia. Blood 1999, 93, 3167–3215 12. Zhao, J.; Liang, J.W.; Xue, H.L.; Shen, S.H.; Chen, J.; Tang, Y.J.; Yu, L.S.; Liang, H.H.; Gu, L.J.; Tang, J.Y.; et al.; et al. The genetics and clinical characteristics of children morphologically diagnosed as acute promyelocytic leukemia. Leukemia 2019, 33, 1387–1399 13. Shallis R.M. et al. Epidemiology of acute myeloid leukemia: Recent progress and enduring challenges. // Blood Rev. 2019. Vol. 36. P. 70–87. 14. Testi, A.M.; Pession, A.; Diverio, D.; Grimwade, D.; Gibson, B.; de Azevedo, A.C.; Moran, L.; Leverger, G.; Elitzur, S.; Hasle, H.;et al. Risk-adapted treatment of acute promyelocytic leukemia: Results from the International Consortium for Childhood APL.Blood 2018, 132, 405–412. 15. Maule, M.; Dama, E.; Mosso, M.L.; Magnani, C.; Pastore, G.; Merletti, F. High incidence of acute promyelocytic leukemia in children in northwest Italy, 1980–2003: A report from the Childhood Cancer Registry of Piedmont. Leukemia 2008, 22, 439–441. 16. Corea, A.M.; Espinoza, C.P.; Rajnoldi, A.C.; Conter, V.; Lietti, G.; Masera, G.; Sessa, C.; Cavalli, F.; Biondi, A.; Rovelli, A. Childhood acute promyelocytic leukemia in Nicaragua. Ann. Oncol. 1993, 4, 892–894. 17. Gómez, S.M.; Schuttenberg, V.; Armendariz, H.; Alba, L.; Martinez, M.; Fynn, A.; Ferrère, E.; Delgado-Caffé, A. Childhood acute leukemia: A single institution experience in La Plata, Argentina. Med. Pediatr. Oncol. 2001, 36, 383–385. 18. Creutzig, U.; Zimmermann, M.; Reinhardt, D.; Rasche, M.; von Neuhoff, C.; Alpermann, T.; Dworzak, M.; Perglerová, K.Zemanova, Z.; Tchinda, J.; et al. Changes in cytogenetics and molecular genetics in acute myeloid leukemia from childhood to adult age groups. Cancer 2016, 122, 3821–3830. 19. Testi, A.M.; Coco, F.L.; D’Angiò, M.; Locatelli, F.; Pession, A. Acute promyelocytic leukemia (APL): Comparison between children and adults. Mediterr. J. Hematol. Infect. Dis. 2014, 6, e2014032. 20. Swerdlow S.H. et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms // Blood. 2016. 21. Arber D.A. et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia // Blood. 2016. 22. Sanz M.A. et al. Management of acute promyelocytic leukemia: recommendations from an expert panel on behalf of the European LeukemiaNet. // Blood. 2009. Vol. 113, № 9. P. 1875–1891. 23. Савченко В.Г., Паровичникова Е.Н. Острый промиелоцитарный лейкоз. М.: Литерра, 2010. 200 p. 24. Паровичникова Е.Н., Соколов А.Н., Савченко В.Г. Протокол лечения острого промиелоцитарного лейкоза AIDA // Программное лечение заболеваний крови, под ред. Савченко В.Г. 2012. P. 265–287. 25. Jae H. Park et al. Early death rate in acute promyelocytic leukemia remains high despite all-trans retinoic acid. Blood, august 4, 2011,volume 118, number 5, pp.1248-1254 26. Jill S. Menell et al. Annexin II and Bleeding in Fcute Promyelocytic Leukemia. NEJM, 1999, Vol 340, N 13, pp.994-1004 27. Tiziano Barbui, Guido Finazzi, Anna Falanga The Impact of All-trans-Retinoic Acid on the Coagulopathy of Acute Promyelocytic Leukemia, Blood, Volume 91, Issue 9, 1 May 1998, Pages 3093-3102 28. P Fenaux Management of acute promyelocytic leukemia , Eur J Haematol.,1993 Feb; 50(2):6 29. Савченко В.Г., Паровичникова Е.Н. Острые лейкозы // Клиническая онкогематология: руководство для врачей. Под ред. Волковой М.А. 2-е изд., перераб. и доп. 2007. P. 409–502. 30. Godley L.A. Inherited predisposition to acute myeloid leukemia. // Semin. Hematol. 2014. Vol. 51, № 4. P. 306–321. 31. Rubnitz J.E., Gibson B., Smith F.O. Acute Myeloid Leukemia // Hematology/Oncology Clinics of North America. 2010. Vol. 24, № 1. P. 35–63. 32. Creutzig U. et al. Diagnosis and management of acute myeloid leukemia in children and adolescents: Recommendations from an international expert panel // Blood. American Society of Hematology, 2012. Vol. 120, № 16. P. 3167–3205. 33. Miguel A. Sanz et al. Management of acute promyelocytic leukemia: updated recommendations from an expert panel of the European LeukemiaNet Blood® 11 APRIL 2019 | VOLUME 133, NUMBER 15, pp.1630 – 1643 34. Ku G.H. et al. Venous thromboembolism in patients with acute leukemia: Incidence, risk factors, and effect on survival // Blood. 2009. Vol. 113, № 17. P. 3911–3917. 35. Муфтахова Г.М., Аксенова М.Е. Поздние эффекты противоопухолевой терапии со стороны мочеполовой системы (отсроченное влияние противоопухолевой терапии на органы мочеполовой системы) // Российский журнал детской гематологии и онкологии. 2019. Vol. 5, № 4. P. 114–119. 36. Fang R.C., Aboulafia D.M. HIV infection and myelodysplastic syndrome/acute myeloid leukemia // HIV-Associated Hematological Malignancies. 2016. P. 133–144. 37. Freeman A.J. et al. Estimating progression to cirrhosis in chronic hepatitis C virus infection. // Hepatology. 2001. Vol. 34, № 4 Pt 1. P. 809–816. 38. Ribas A. et al. How important is hepatitis C virus (HCV)-infection in persons with acute leukemia? // Leuk. Res. 1997. Vol. 21, № 8. P. 785–788. 39. Acute Myeloid Leukemia. National Comprehensive Cancer Network (NCCN) Guidelines. 2-2020. [Electronic resource]. 40. Lam M.T. et al. Herpes simplex infection in acute myelogenous leukemia and other hematologic malignancies: a prospective study. // Cancer. 1981. Vol. 48, № 10. P. 2168–2171. 41. Averbuch D. et al. Targeted therapy against multi-resistant bacteria in leukemic and hematopoietic stem cell transplant recipients: Guidelines of the 4th European conference on Infections in Leukemia (ECIL-4, 2011) // Haematologica. 2013. Vol. 98, № 12. P. 1836–1847. 42. Averbuch D. et al. European guidelines for empirical antibacterial therapy for febrile neutropenic patients in the era of growing resistance: Summary of the 2011 4th European Conference on Infections in Leukemia // Haematologica. 2013. Vol. 98, № 12. P. 1826–1835. 43. Leahy M.F., Mukhtar S.A. From blood transfusion to patient blood management: a new paradigm for patient care and cost assessment of blood transfusion practice. // Intern. Med. J. 2012. Vol. 42, № 3. P. 332–338. 44. Döhner H. et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel // Blood. 2017. Vol. 129, № 4. P. 424–447. 45. Brain B.J. Acute promyelocytic leukemia // Leukemia Diagnosis / ed. Brain B.J.Blackwell Science, 1999. P. 14–19 46. Bene M.C. et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL). // Leukemia. 1995. Vol. 9, № 10. P. 1783–1786. 47. Tallman M.S., Altman J.K. How I treat acute promyelocytic leukemia // Blood. 2009. Vol. 114, № 25. P. 5126–5135 48. Lo Coco F, Diverio D, Falini B, Biondi A, Nervi C, Pelicci PG. Genetic diagnosis and molecular monitoring in the management of acute promyelocytic leukemia. Blood. 1999;94(1):12-22. 49. Grimwade D, Lo Coco F. Acute promyelocytic leukemia: a model for the role of molecular diagnosis and residual disease monitoring in directing treatment approach in acute myeloid leukemia. Leukemia. 2002;16(10):1959-1973. 50. Schuurhuis GJ, Heuser M, Freeman S, et al.Minimal/measurable residual disease in AML: a consensus document from the European LeukemiaNet MRD Working Party. Blood. 2018;131(12):1275-1291. 51. Grimwade D, Jovanovic JV, Hills RK, et al. Prospective minimal residual disease monitoring to predict relapse of acute promyelocytic leukemia and to direct pre-emptive arsenic trioxide therapy. J Clin Oncol. 2009;27(22):3650-3658. 52. Freeman SD, Jovanovic JV, Grimwade D. Development of minimal residual diseasedirected therapy in acute myeloid leukemia. Semin Oncol. 2008;35(4):388-400. 53. Cicconi L, Divona M, Ciardi C, et al. PML-RARa kinetics and impact of FLT3-ITD mutations in newly diagnosed acute promyelocytic leukaemia treated with ATRA and ATO or ATRA and chemotherapy. Leukemia. 2016;30(10): 1987-1992 54. Herrmann J. et al. Evaluation and management of patients with heart disease and cancer: Cardio-oncology // Mayo Clin. Proc. 2014. Vol. 89, № 9. P. 1287–1306. 55. Roberts A.S. et al. Extramedullary haematopoiesis: radiological imaging features // Clinical Radiology. 2016. Vol. 71, № 9. P. 807–814. 56. Fritz J. et al. Radiologic spectrum of extramedullary relapse of myelogenous leukemia in adults. // AJR. Am. J. Roentgenol. 2007. Vol. 189, № 1. P. 209–218. 57. Arrigan M. et al. Imaging findings in recurrent extramedullary leukaemias // Cancer Imaging. 2013. Vol. 13, № 1. P. 26–35. 58. Almond L.M. et al. Myeloid Sarcoma: Presentation, Diagnosis, and Treatment // Clinical Lymphoma, Myeloma and Leukemia. Elsevier Inc., 2017. Vol. 17, № 5. P. 263–267. 59. Winestone L.E. et al. Disparities in pediatric acute myeloid leukemia (AML) clinical trial enrollment // Leuk. Lymphoma. Taylor and Francis Ltd, 2019. Vol. 60, № 9. P. 2190–2198. 60. O.Abla1, R.C. Ribeiro. How I Treat Children and Adolescents with Acute PromyelocyticLeukaemia. Br J Haematol. 2014 January; 164(1): 24–38 61. Park J.H. et al. Early death rate in acute promyelocytic leukemia remains high despite all-trans retinoic acid. // Blood. 2011. Vol. 118, № 5. P. 1248–1254. 62. Lehmann S. et al. Continuing high early death rate in acute promyelocytic leukemia: a Population-based report from the Swedish Adult Acute Leukemia Registry. // Leukemia. 2011. Vol. 25, № 7. P. 1128–1134. 63. C.Gurnari et al. Early intracranial haemorrhages in acute promyelocytic leukaemia: analysis of neuroradiological and clinico-biological parameters. British Journal of Haematology, 2021, 193, 129–132 64. R.Abrahão, R.C. Ribeiro et al. Early mortality and survival improvements of adolescents and young adults with acute promyelocytic leukemia in California: an updated analysis. Harmatologica, 2022; 107(3), 733 - 736 65. Mantha S., Tallman M.S., Soff G.A. What’s new in the pathogenesis of the coagulopathy in acute promyelocytic leukemia? // Curr. Opin. Hematol. 2016. Vol. 23, № 2. P. 121–126. 66. Mantha S. et al. Determinants of fatal bleeding during induction therapy for acute promyelocytic leukemia in the ATRA era. // Blood. 2017. Vol. 129, № 13. P. 1763–1767. 67. Meijer K. et al. Successful treatment of massive hemoptysis in acute leukemia with recombinant factor VIIa. // Arch. Intern. Med. 2000. Vol. 160, № 14. P. 2216–2217. 68. Pemmaraju N. et al. Successful Treatment of Intracranial Hemorrhage with Recombinant Activated Factor VII in a Patient with Newly Diagnosed Acute Myeloid Leukemia: A Case Report and Review of the Literature. // Front. Oncol. 2015. Vol. 5. P. 29. 69. Самочатова Е.В., Масчан А.А., Алейникова О.В., Тарасевич И.С.и др. Опыт лечения промиелоцитарного лейкоза у детей по протоколу с использованием трансретиноевой кислоты: результаты клиник России и Беларуси. Гематология и трансфузиология. 2000; 45, №1: 6-10 70. Самочатова Е.В., Масчан А.А, Алейникова О.В. с соавт. Долгосрочные результаты комбинированного лечения острого промиелоцитарного лейкоза у детей и подростков с использованием геннонаправленной терапии: Терапевтический архив, 2007, т. №7, c. 26 - 30 71. Zhen-Yi Wang and Zhu Chen1 Acute promyelocytic leukemia: from highly fatal to highly curable. BLOOD, 1 MARCH 2008 _ VOLUME 111, NUMBER 5 72. Li X. et al. Combined chemotherapy for acute promyelocytic leukemia: a meta-analysis //Hematology. Taylor and Francis Ltd., 2017. Vol. 22, № 8. P. 450–459 73. Fenaux P. et al. Long-term follow-up confirms the benefit of all-trans retinoic acid inacute promyelocytic leukemia. European APL group. // Leukemia. 2000. Vol. 14, № 8. P. 1371–1377. 74. Fenaux P. et al. A randomized comparison of all transretinoic acid (ATRA) followed by chemotherapy and ATRA plus chemotherapy and the role of maintenance therapy in newly diagnosed acute promyelocytic leukemia. The European APL Group. // Blood. 1999. Vol. 94, № 4. P. 1192–1200. 75. Lo-Coco F. et al. Front-line treatment of acute promyelocytic leukemia with AIDA induction followed by risk-adapted consolidation for adults younger than 61 years: Results of the AIDA-2000 trial of the GIMEMA Group // Blood. 2010. Vol. 116, № 17. P. 3171–3179.
Информация
Список сокращений
алло-ТКМ – аллогенная трансплантация костного мозга (А16.05.001)
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
ATRA – третиноин
АТО – триоксид мышьяка
ауто-ТКМ – аутологичная трансплантация костного мозга (А16.05.001)
БЛРС – бета-лактамазы расширенного спектра
БСВ – бессобытейная выживаемость
БРВ – безрецидивная выживаемость
ВДЦ – высокие дозы цитарабина**
ВИЧ – вирус иммунодефицита человека
ВОЗ – Всемирная организация здравоохранения
ДВС – диссеминированное внутрисосудистое свертывание
ДНК – дезоксирибонуклеиновая кислота
ЖКТ – желудочно-кишечный тракт
ИА – инвазивный аспергиллез
ИФТ – иммунофенотипическое исследование
КМ – костный мозг
КИ – клинические исследования
КТ – компьютерная томография
ЛДГ – лактатдегидрогеназа
МДС – миелодиспластический синдром
МДЦ – малые дозы цитарабина**
МОБ – минимальная остаточная болезнь
МП – меркаптопурин
МПЗ – миелопролиферативное заболевание
МС – миелоидная саркома
ОВ – общая выживаемость
ОЛ – острый лейкоз
ОЛЛ – острый лимфобластный лейкоз
ОМЛ – острый миелоидный лейкоз
ОПЛ – острый промиелоцитарный лейкоз
ПР – полная ремиссия
ПЦР – полимеразная цепная реакция
РТПХ – реакция «трансплантат против хозяина»
СД – синдром дифференцировки
УДД – уровень достоверности доказательств
УЗИ – ультразвуковое исследование
УУР – уровень убедительности рекомендаций
ХТ – химиотерапия
ЦМВ – цитомегаловирус
ЦНС – центральная нервная система
ЭКГ – электрокардиография
Эхо-КГ – эхокардиография (А04.10.002)
FAB классификация – французско-американско-британская классификация
FISH – флюоресцентная in situ гибридизация
NCCN – Национальная общественная онкологическая сеть
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся вне показаний к применению, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
Острый промиелоцитарный лейкоз (ОПЛ) ‒ уникальный подтип острого миелобластного лейкоза (ОПЛ) с преобладанием аномальных промиелоцитов, которые характеризуется сбалансированной транслокацией между хромосомами 15 и 17, генерирующей PML-RARa химерный ген [1,2].
Оценка эффективности терапии:
Полная ремиссия (ПР) – полной ремиссией (ПР) острого промиелоцитарного лейкоза принято называть то состояние кроветворной ткани, при котором в пунктате костного мозга обнаруживается ≤5% бластных клеток при нормальном соотношении всех ростков кроветворения, при количестве нейтрофилов в периферической крови >1,0×109/л, при количестве тромбоцитов ≥100×109/л, при отсутствии экстрамедуллярных очагов лейкемического роста. Указанные показатели должны сохраняться в течение ≥1 мес. ПР констатируется без учета данных определения «минимальной остаточной болезни» (МОБ) с помощью молекулярно-биологических методов (количественная ПЦР, флуоресцентная in situ гибридизация (FISH)). Молекулярно-генетическое исследование костного мозга на этапе достижения цитологической ремиссии не проводится, транскрипт PML/RAR на этом сроке лечения может оставаться позитивным у больных, что не имеет значения для прогноза ОПЛ и не требует коррекции лечения.
ПР с неполным восстановлением – полная ремиссия при сохраняющейся нейтропении (<1х109/л) или тромбоцитопении (<100х109/л).
Минимальная остаточная болезнь (МОБ) – это популяция опухолевых клеток, которая не может быть выявлена с помощью световой микроскопии, но обнаруживается более точными методами исследования, способными детектировать 1 лейкемическую клетку на 104-106 исследуемых.
Молекулярная ремиссия – это полная клинико-гематологическая ремиссия, при которой не обнаруживают исходно определявшийся методом полимеразно-цепной реакции химерный транскрипт PML-RARA при чувствительности метода 10-4.
Неудачи в лечении:
Ранняя смерть – смерть пациентов в период индукционной терапии.
Резистентная форма острого промиелоцитарного лейкоза может быть констатирована при отсутствии полной ремиссии после завершения 1 курса индукционной терапии и 2-х курсов консолидации. По мнению большинства международных и российских экспертов, у пациентов c острым промиелоцитарным лейкозом с транскриптом PML-RARA, доказанным молекулярно-цитогенетическими исследованиями, при использовании транс-ретиноевой кислоты в сочетании с химиотерапией или триоксидом мышьяка** рефрактерных форм острого промиелоцитарного лейкоза не существует. Рефрактерная форма ОПЛ наблюдается при редких вариантах ОПЛ затрагивающих слияние гена ретиноевой кислоты (RARA) на хромосоме 17q21 с другими генами-партнерами (не геном PML) такими как ZBTB16 на хромосоме 11q23 и STAT5B на хромосоме 17q21, приводящих к синтезу химерных продуктов ZBTB16-RARA, STAT5B/RARA соответственно.
Рецидив – более 5% лейкемических бластов в костном мозге или любое экстрамедуллярное поражение не менее чем через 1 месяц после установления первой полной клинико-гематологической ремиссии.
Молекулярный рецидив – выявление МОБ методом ПЦР в последовательном двухкратном исследовании с интервалом не менее 2-х недель, на фоне сохраняющейся клинико-гематологической ремиссии.
Нейролейкоз – любое количество бластных клеток в цитопрепарате, не объяснимое контаминацией ликвора примесью периферической крови в результате травматической пункции; и/или симптомы поражения черепно-мозговых нервов или иная неврологическая симптоматика, связанная с хлоромным ростом.
Индукция ремиссии – первый этап лечения ОПЛ, целью которого является максимально быстрое и существенное уменьшение опухолевой массы, устранение клинических симптомов, нормализация гематологических показателей и достижение полной ремиссии, (обычно 1 курс)
Консолидация ремиссии – второй этап терапии острого промиелоцитарного лейкоза, является периодом закрепления достигнутого противоопухолевого эффекта. Цель консолидирующей терапии – преобразование полного гематологического ответа в молекулярный ответ (или ремиссию). Обычно проводится 3-4 цикла. Если молекулярный ответ не достигнут, могут быть назначены дополнительные циклы консолидирующей терапии.
Поддерживающая терапия направлена на то, чтобы молекулярный ответ сохранялся в течение длительного времени. Эта фаза обычно длится от 1 до 2 лет. Поддерживающая терапия требуется не во всех случаях ОПЛ: так, пациентам, получающим терапиюна на основе третионина и триоксида мышьяка поддерживающая терапия не проводится.
Профилактика или ‒ при необходимости ‒ лечение нейролейкемии является принципиальным этапом при лечении пациентов с острым промиелоцитарным лейкозом из группы высокого риска. Этот этап распределяется на все периоды программного лечения ‒ индукцию ремиссии, консолидацию и поддерживающее лечение.
Трансплантация костного мозга/гемопоэтических клеток (ТГСК) – под этим термином объединены трансплантация гемопоэтических стволовых клеток костного мозга, периферической крови и пуповинной (плацентарной) крови.
Осложнения, уникальные для терапии ОПЛ:
Синдром дифференцировки (СД), также известный как синдром ретиноевой кислоты – жизнеугрожающее осложнение, развивающееся при лечении ОПЛ полностью транс-ретиноевой кислотой (третиноин**) и триоксидом мышьяка. Cчитается, СД является синдромом, опосредованным воспалительным ответом, проявляющимся лихорадкой без выявленной причины, нарастанием числа лейкоцитов, респираторным дистресс-синдром, инфильтрацией легочной ткани на рентгенограммах, гипоксемией, отеками (гидроторакс и гидроперикард), прибавкой массы тела, почечной недостаточностью, артериальная гипотензией [1,2].
Pseudotumor cerebri (Идиопатическая внутричерепеная гипертензия) обычно проявляется головной болью, отеком диска зрительного нерва, параличом 6-й пары черепно-мозгового (отводящего) нерва, уменьшением полей зрения, повышением внутри-черепного давления при отсутствии объемного поражения головного мозга и гидроцефалии. Псевдотумор головного мозга, при ОПЛ связан с приемом третиноина, предположительно тем же механизмом токсичности витамина А, который приводит к увеличению выработки спинномозговой жидкости [3,4].
Удлинение интервала QT. Триоксид мышьяка связан с удлинением интервала QT, что может привести к опасным для жизни аритмиям (например, torsades de pointes) [5]. Важно внимательно следить за электролитами у пациентов, получающих триоксид мышьяка, и поддерживать значения калия и магния в средних контрольных диапазонах, а также знать о других агентах, которые, как известно, продлевают интервал QT [6].
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
«Молекулярно-направленная» терапия
Прогресс в изучении молекулярного патогенеза ОПЛ привел к разработке новых «молекулярных» препаратов, т.е. молекул, механизм действия которых связан с влиянием на белки, функция которых изменяется в результате мутации или транслокации (таргетное воздействие). Например, генетические изменения приводят к мутациям в генах, активирующих каскады трансдукции сигнала (например, FLT3, KIT, RAS), к слиянию генов или мутациям, приводящим к повышению или угнетению транскрипционной активности (например, PML-RARA, RUNX1-RUNX1T1, CBFB-MYH11, CEBPA), к нарушению функции генов, вовлеченных в передачу сигнала (например, NPM1, NUP98, NUP) или гиперэкспрессии онкопротеинов на поверхности клеток ОПЛ. Хотя для некоторых препаратов, действующих на молекулярном уровне, и была продемонстрирована эффективность при ОПЛ, уже на стадии КИ было понятно, что большинство из них необходимо использовать в сочетании со стандартными препаратами. В настоящее время проводится большое число КИ по изучению эффективности при ОПЛ и безопасности препаратов из различных фармацевтических групп.
Критерии оценки качества медицинской помощи
|
№
|
Критерии качества
|
Уровень достоверности доказательств
|
Уровень убедительности рекомендаций
|
|
1.
|
У пациента с подозрением на ОПЛ или при первичном приеме пациента с ОПЛ выполнен сбор жалоб, анамнеза и оценка объективного статуса
|
5
|
С
|
|
2.
|
У пациента с подозрением на ОПЛ или при первичном приеме пациента с ОПЛ выполнен общий (клинический) анализ крови с дифференцированным подсчетом лейкоцитов (лейкоцитарной формулы) и исследованием уровня тромбоцитов в крови
|
5
|
C
|
|
3.
|
У пациента с подозрением на ОПЛ выполнено цитологическое и цитохимическое исследования опухолевых клеток в пунктате КМ.
|
5
|
C
|
|
4.
|
У пациента с подозрением на ОПЛ выполнено цитогенетическое исследование (кариотип) аспирата костного мозга
|
5
|
C
|
|
5.
|
У пациента с подозрением на ОПЛ или при первичном приеме пациента с ОПЛ выполнен анализ крови биохимический общетерапевтический (креатинин, общий белок, общий билирубин, ЛДГ)
|
5
|
С
|
|
6.
|
У пациента с подозрением на ОПЛ выполнен общий (клинический) анализ спинномозговой жидкости
|
5
|
С
|
|
7.
|
У пациента с подозрением на ОПЛ выполнена рентгенография органов грудной клетки и/или КТ органов грудной полости и/или головного мозга
|
5
|
C
|
|
8.
|
У пациента с впервые диагностированным ОПЛ, который не может быть включен в клиническое исследование, после завершения всех диагностических мероприятий проведена индукционная терапия
|
3
|
В
|
|
9.
|
У пациента с верифицированным ОПЛ, получающего терапию и достигшего ПР после индукционного этапа терапии, выполнена программа консолидации ремиссии
|
1
|
А
|
|
10.
|
У пациента с верифицированным ОПЛ, получающего терапию и достигшего ПР после индукционного этапа терапии, проведена консультация в трансплантационном центре для решения вопроса о возможности и целесообразности выполнения алло-ТКМ/алло-ТГСК
|
1
|
А
|
|
11.
|
У пациента, получающего терапию по поводу верифицированного ОПЛ, после окончания 1 и 2 курсов индукции ремиссии проведено цитологического исследования мазка костного мозга (миелограммы)
|
5
|
C
|
|
13.
|
У пациента, получающего терапию по поводу верифицированного ОПЛ, после окончания консолидации ремиссии проведено цитологическое исследование мазка костного мозга (миелограммы) и определение МОБ с помощью молекулярно-генетического исследования (А27.05.001).
|
5
|
C
|
|
14.
|
У пациента, получающего терапию по поводу верифицированного ОПЛ, после завершения всей программы терапии проведено цитологического исследования мазка костного мозга (миелограммы)
|
5
|
C
|
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Масчан А.А. – д.м.н., директор Института гематологии, иммунологии и клеточных технологий ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России, профессор кафедры гематологии, онкологии и лучевой терапии педиатрического факультета РНИМУ им. Н.И. Пирогова МЗ РФ
Алейникова О.В. – д.м.н., профессор, член корр. НАН Беларуси, заведующий отделом по реализации национальных и международных проектов по детской гематологии и онкологии ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
Масчан М.А. – д.м.н., зам. генерального директора ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России, профессор кафедры гематологии, онкологии и лучевой терапии профессор кафедры гематологии, онкологии и лучевой терапии РНИМУ им. Н.И.Пирогова РНИМУ им. Н.И. Пирогова МЗ РФ, член Российского общества детских онкологов и гематологов
Новичкова Г.А. – д.м.н., научный руководитель ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России, профессор кафедры гематологии, онкологии и лучевой терапии профессор кафедры гематологии, онкологии и лучевой терапии РНИМУ им. Н.И.Пирогова РНИМУ им. Н.И. Пирогова МЗ РФ
Попа А.В. – д.м.н., заведующий отделом эпидемиологии и исследования поздних эффектов у детей, перенесших онкологическое заболевание ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России, профессор кафедры пропедевтики детских болезней РНИМУ им. Н.И. Пирогова МЗ РФ
Солопова Г.Г. – к.м.н., заместитель главного врача по инфекционному контролю ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
Румянцев А.Г. – д.м.н., академик РАН, президент ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России, профессор кафедры гематологии, онкологии и лучевой терапии педиатрического факультета РНИМУ им. Н.И. Пирогова
Валиев Т.Т. – д.м.н., заведующий отделением гематологии НИИ Детской онкологии и гематологии им. Л.А. Дурнова, ФГБУ НМИЦ РОНЦ им. Н.Н. Блохина МЗ РФ.
Садовская М.Н., – врач-гематолог отделения детской гематологии/онкологии ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
Абросимов А.Б. – к.м.н., заведующий отделением-врач-гематолог отделения лечения и реабилитации пациентов иммуногематологического профиля и реципиентов стволовых клеток, старший научный сотрудник лаборатории фармакологии и оценки технологий здравоохранения ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России
Конфликт интересов отсутствует
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория клинических рекомендаций:
-
Врачи-гематологи;
-
Врачи-онкологи;
-
Врачи-педиатры;
-
Врачи-анестезиологи-реаниматологи;
-
Врачи-клинические фармакологи.
Методология сбора доказательств
Методы, использованные для сбора/селекции доказательств:
Поиск публикаций в специализированных периодических печатных изданиях;
Поиск в электронных базах данных.
Базы данных, использованных для сбора/селекции доказательств:
Доказательной базой для рекомендаций являются публикации, вошедшие в Кохрайновскую библиотеку, базы данных PUBMED и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
-
Обзоры опубликованных мета-анализов;
-
Систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
-
Консенсус экспертов;
-
Оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. А2.1-А2.3).
Таблица А2.1.
Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД
|
Расшифровка
|
|
1
|
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
|
|
2
|
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
|
|
3
|
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Таблица А2.2.
Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД
|
Расшифровка
|
|
1
|
Систематический обзор РКИ с применением мета-анализа
|
|
2
|
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
|
|
3
|
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль»
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Таблица А2.3.
Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР
|
Расшифровка
|
|
A
|
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
B
|
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C
|
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
Порядок обновления клинических рекомендаций.
Актуализация проводится не реже чем один раз в три года с учетом появившейся новой информации о диагностике и тактике ведения пациентов, страдающих ОПЛ. Решение об обновлении принимает Минздрав России на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Приложение А3.1. Диагностические тесты и исследования, применяемые у пациентов впервые выявленным ОПЛ
|
Показатель
|
Исследования
|
Необходимость проведения исследования
|
|
Исследования, необходимые для установления диагноза
|
Общий (клинический) анализ крови развернутый (В03.016.002)
|
Да
|
|
Цитологическое исследование мазка костного мозга (миелограмма) (А08.05.001)
|
Да
|
|
|
Цитологическое исследование отпечатков трепанобиоптата костного мозга (А08.05.017)
|
По показаниям
|
|
|
Иммунофенотипирование гемопоэтических клеток-предшественниц в костном мозге (А08.05.018)
|
Да
|
|
|
Цитогенетическое исследование (кариотип) (А12.05.013)
|
Да
|
|
|
Молекулярно-генетическое исследование транслокации t(15;17) в биопсийном (операционном) материале методом флюоресцентной гибридизации in situ (FISH) (A27.30.097)
|
По показаниям
|
|
|
Определение экспрессии pML-RAR-a (количественное) (А27.30.103)
|
Да
|
|
|
Спинномозговая пункция (А11.23.001)
|
После нормализации гемостаза
|
|
|
Необходимые исследования до начала лечения
|
Сбор анамнеза и жалоб при заболеваниях органов кроветворения и крови (А01.05.001)
|
Да
|
|
Анализ крови биохимический общетерапевтический (В03.016.004), Исследование коагуляционного гемостаза) (В03.005.004)
|
Да
|
|
|
Исследование мочи на хорионический гонадотропин (А09.28.029)
|
Да
|
|
|
Молекулярно-генетическое исследование гистосовместимости (HLA ого разрешения при помощи секвенирования) для подбора неродственного донора костного мозга (А27.05.041)
|
Нет
|
|
|
Молекулярно-биологическое исследование крови на вирус гепатита B (Hepatitis B virus) (А26.05.020), Молекулярно-биологическое исследование крови на вирус гепатита C (Hepatitis C virus) (А26.05.019), Молекулярно-биологическое исследование крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1) (А26.05.021)
|
Да
|
|
|
Рентгенография легких (А06.09.007)
|
Да
|
|
|
Компьютерная томография органов грудной полости (А06.09.005), Компьютерная томография головного мозга (А06.23.004),
|
Да
|
|
|
Регистрация электрокардиограммы (А05.10.006),эхокардиография (А04.10.002)
|
Да
|
|
|
Получение генетического материала (суммарной клеточной ДНК) из биологических объектов и следов, изъятых с мест несчастных случаев или нераскрытых преступлений, и хранение препаратов ДНК (B03.045.039)
|
Рекомендательно
|
|
|
Молекулярно-генетическое исследование мутации гена FLT3 (fms-
подобная тирозин-киназа третьего типа) в костнм мозге(А27.05.014)
|
Рекомендательно
|
Приложение А3.2. Молекулярно-генетические прогностические факторы риска при ОПЛ
Таблица А3.3.
Молекулярно-генетические и клинические признаки ОПЛ, разделяющие пациентов на благоприятную и неблагоприятную прогностические группы [44]
Молекулярно-генетические и клинические признаки ОПЛ, разделяющие пациентов на благоприятную и неблагоприятную прогностические группы [44]
|
Цитогенетические маркеры
|
Молекулярные маркеры
|
Клинические факторы
|
|
Благоприятные прогностические факторы:
|
||
|
t(15;17)(q24.1;q21.2)
|
PML-RARa
|
Негативные маркеры МОБ
|
|
Неблагоприятные прогностические факторы:
|
|
|
|
t(11;17)(q23;q21)
t(17;17)(q21;q21)
|
ZBTB16-RARa
STAT5B-RARa.
|
Вторичный ОПЛ
Лейкоцитоз >10 х 109/л
Персистенция маркеров МОБ после 2-х курсов консолидации или перед поддерживающей терапией
|
Приложение А3.3 Диагностика инфекционных осложнений
Таблица А 3.4
|
Название исследования
|
Код НМУ
|
|
Исследования жидкости БАЛ, трахео-бронхиального аспирата
|
|
|
Микроскопическое исследование лаважной жидкости
|
А12.09.011
|
|
Микроскопическое исследование бронхоальвеолярной лаважной жидкости на грибы (дрожжевые и мицелиальные)
|
А26.09.027
|
|
Микроскопическое исследование бронхоальвеолярной лаважной жидкости на микобактерий туберкулеза (Mycobacterium tuberculosis)
|
А12.09.091
|
|
Микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на цисты пневмоцист (Pneumocystis carinii)
|
А26.09.035
|
|
Микробиологическое (культуральное) исследование лаважной жидкости на аэробные и факультативно-анаэробные микроорганизмы
|
А26.09.011
|
|
Микробиологическое (культуральное) исследование бронхоальвеолярной лаважной жидкости на грибы (дрожжевые и мицелильные)
|
А26.09.030
|
|
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на респираторно-синтициальный вирус (Respiratory Syncytial virus)
|
A26.09.017
|
|
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на аденовирус (Adenovirus)
|
A26.09.018
|
|
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на вирус гриппа (Influenza virus)
|
A26.09.019
|
|
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на метапневмовирус (Human Metapneumovirus)
|
A26.09.055
|
|
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на вирусы парагриппа (Human Parainfluenza virus)
|
A26.09.056
|
|
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на риновирусы (Human Rhinovirus)
|
A26.09.057
|
|
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на бокавирус (Human Bocavirus)
|
A26.09.058
|
|
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на коронавирус ТОРС (SARS-cov)
|
A26.09.060
|
|
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на Mycoplasma pneumoniae
|
A26.09.062
|
|
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости на Chlamydophila pneumoniae
|
A26.09.063
|
|
Молекулярно-биологическое исследование мокроты, бронхоальвеолярной лаважной жидкости на цитомегаловирус (Cytomegalovirus)
|
A26.09.071
|
|
Молекулярно-биологическое исследование бронхоальвеолярной лаважной жидкости, мокроты, эндотрахеального аспирата на Pneumocystis jirovecii
|
A26.09.072
|
|
Молекулярно-биологическое исследование мокроты, бронхоальвеолярной лаважнои жидкости или промывных вод бронхов на Mycobacterium tuberculosis complex (микобактерии туберкулеза)
|
A26.09.080
|
|
Молекулярно-биологическое исследование мокроты, бронхоальвеолярной лаважной жидкости или промывных вод бронхов для дифференциации видов Mycobacterium tuberculosis complex (M.tuberculosis, M.bovis, M.bovis BCG)
|
A26.09.081
|
|
Микробиологическое (культуральное) исследование биоптата легкого на легионеллу пневмонии (Legionella pneumophilia)
|
А26.09.008
|
|
Определение антигена возбудителя легионеллеза (Legionella/pneumophila) в моче
|
А26.08.010
|
|
Определение метаболитов грибов (галактоманнана) в жидкости БАЛ, крови
|
А26.30.007
|
|
Исследования мазков со слизистой оболочки ротоглотки
|
|
|
Молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки на вирус гриппа (Influenza virus)
|
А26.08.038
|
|
Молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки на респираторно-синцитиальный вирус (Human Respiratory Syncytial virus)
|
А26.08.039
|
|
Молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки на аденовирус (Human Adenovirus)
|
А26.08.040
|
|
Молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки на метапневмовирус (Human Metapneumo virus)
|
А26.08.041
|
|
Молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки вирусов парагриппа (Human Parainfluenza virus)
|
А26.08.042
|
|
Молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки на риновирусы (Human Rhino virus)
|
А26.08.043
|
|
Молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки на бокавирус (Human Bocavirus)
|
А26.08.044
|
|
Молекулярно-биологическое исследование мазков со слизистой оболочки ротоглотки на коронавирус ТОРС (SARS-cov)
|
А26.08.046
|
Приложение Б. Алгоритмы действий врача
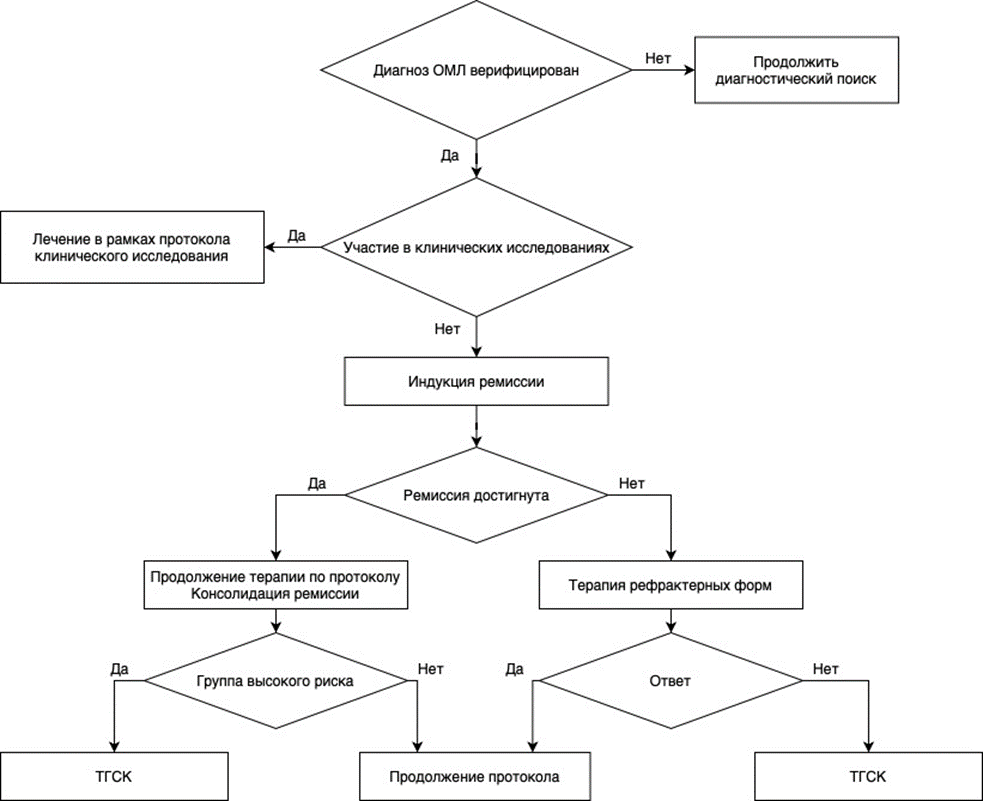
Приложение В. Информация для пациента
Острый миелоидный лейкоз – редкое злокачественное заболевание кроветворной ткани, характеризующаяся неконтролируемой пролиферацией, нарушением дифференцировки и накоплением в костном мозге и периферической крови незрелых гемопоэтических клеток
При развитии ОПЛ поражаются все органы и системы, т.к. заболевание носит генерализованный (распространенный) характер. В клинической картине заболевания преобладают синдромы, связанные с прогрессирующим нарастанием количества злокачественных клеток в костном мозге, а также в печени, селезенке, так же возможно поражение ЦНС и других органов и систем. Наиболее частое проявление заболевания:
1) Лихорадка.
Повышение температуры тела выше 38,0С может быть первым и единственным проявлением заболевания, в связи с наличием бластных (опухолевых) клеток, выделением их продуктов жизнедеятельности, а так же в связи с развитием инфекционного процесса
2) Инфекционный процесс (ангина, стоматит, пневмония и др.) развивается в связи с вытеснением бластными клетками клеток нормального кроветворения – лейкоцитов/нейтрофилов, защищающих в здоровом состоянии организм ребенка от бактериальной и грибковой инфекции
3) Геморрагический синдром (кровотечения, появления синяков) в следствии вытеснения бластными клетками из нормального кроветворения тромбоцитов (клеток ответственных за остановку кровотечения)
4) Анемический синдром (бледность, вялость, быстрая утОПЛяемость, слабость), так же развивается из-за отсутствия эритроцитов (снижение гемоглобина) в костном мозге пациента с ОПЛ.
5) Боль в костях и других пораженных органах
6) Увеличение размеров печени и селезенки, появление желтухи
7) Поражение ЦНС может проявляться головной болью, рвотой, судорогами
Для установления диагноза необходимо выполнение большого количества исследований крови, пункции костного мозга и люмбальной пункции, рентгеновских и томографических исследований. Для проведения химиотерапии необходима постановка центрального венозного катетера (ЦВК), во избежание многочисленных уколов в периферические вены.
Все инвазивные процедуры (пункции, постановка ЦВК) выполняются под общей анестезией.
Лечение острого миелоидного лейкоза состоит в основном из двух этапов: интенсивная фаза терапии и проведение трансплантации гемопоэтических стволовых клеток. Во время интенсивной фазы химиотерапия проводится с небольшими интервалами, часто необходимо пребывание пациента в стационаре. Химиотерапия первой линии состоит из трех основных препаратов: цитозар, вепезид, даунорубицин** (идарубицин** или митроксантрон). Затем проводится несколько курсов высокодозной химиотерапии.
Побочные эффекты химиотерапии:
-
Выпадение волос
-
Тошнота и рвота
-
Снижение/изменение аппетита
-
Лихорадка
-
Развитие инфекционных очагов
-
Целью терапии является излечение болезни, предотвращение рецидивов и осложнений связанных как с проявлениями болезни так и с развитием индуцированной (вызванной химиотерапией) аплазии кроветворения. Суммарная длительность терапии составляет около 6 месяцев, без проведения ТГСК. Сокращение длительности терапии может привести к увеличению риска рецидива болезни. При терапии в соответствии с современными программами лечения вероятность выздоровления составляет около 70%.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.