Острый панкреатит
 Версия: Клинические протоколы КР 2010-2016 (Кыргызстан)
Версия: Клинические протоколы КР 2010-2016 (Кыргызстан)
Общая информация
Краткое описание
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ КЫРГЫЗСКОЙ РЕСПУБЛИКИ
ОСТРЫЙ ПАНКРЕАТИТ
Клиническое руководство по диагностике и лечению острого панкреатита у взрослых на первичном, вторичном и третичном уровнях здравоохранения КР принято Экспертным советом по оценке качества клинических руководств/протоколов и утверждено Приказом МЗ КР № 691 от 09.09.2016.
Цель руководства: Улучшение качества диагностики и лечения при остром панкреатите на основе внедрения в клиническую практику современных методов диагностики и лечения, основанных на принципах доказательной медицины.
Этапы помощи:
Дата создания:
Острый панкреатит - это первоначально асептическое воспаление поджелудочной железы, при котором возможно поражение окружающих тканей и отдаленных органов, а также систем.
Классификация
1. Острый панкреатит лёгкой степени. Панкреонекроз при данной форме острого панкреатита не образуется (отёчный панкреатит) и органная недостаточность не развивается.
2. Острый панкреатит средней степени. Характеризуется наличием либо одного из местных проявлений заболевания: перипанкреатический инфильтрат, псевдокиста, отграниченный инфицированный панкреонекроз (абсцесс), или/и развитием общих проявлений в виде транзиторной органной недостаточности (не более 48 часов).
3. Острый панкреатит тяжёлой степени. Характеризуется наличием либо неотграниченного инфицированного панкреонекроза (гнойно-некротического парапанкреатита), или/и развитием персистирующей органной недостаточности (более 48 часов).
Этиология и патогенез
ЭТИОЛОГИЯ ОСТРОГО ПАНКРЕАТИТА
ХОЛЕЛИТИАЗ И АЛКОГОЛЬ
Этиология острого панкреатита может быть уверенно установлена у большинства пациентов. Наиболее частой причиной острого панкреатита являются желчные камни (40–70%) и алкоголь (25–35%) [6-8]. Из-за высокой частоты и важности с точки зрения предотвращения повторного заболевания, УЗИ брюшной полости для выявления камней желчных протоках и пузыре должно быть проведено всем пациентам с острым панкреатитом [9-11]. Выявление желчных камней в качестве причины должно сопровождаться холецистэктомией для предотвращения повторных приступов панкреатита и возможного развития билиарного сепсиса [12, 13]. Желчнокаменный панкреатит обычно является острым состоянием и проходит, когда камень удаляется или выходит самостоятельно. Алкогольный панкреатит может проявляться по-разному, начиная с чётко определённых эпизодов острого панкреатита и заканчивая медленно прогрессирующим, хроническим, необратимым, клинически не проявляющимся повреждением. Диагноз не должен устанавливаться, кроме как в тех случаях, когда у пациента имеется в анамнезе более пяти лет злоупотребления алкоголем [14]. Злоупотреблением алкоголем обычно считается употребление более 50 г в день, однако чаще оно бывает еще более выраженным [15]. Клинический очевидный острый панкреатит встречаются менее чем у 5% злоупотребляющих алкоголем [16]. Таким образом, вероятно, имеются другие факторы, которые делают индивида более чувствительным к алкоголю, такие, как генетические предосторожности и использование табака [8, 16, 17].
ДРУГИЕ ПРИЧИНЫ ОСТРОГО ПАНКРЕАТИТА
При отсутствии употребления алкоголя и желчных камней необходима осторожность в оценке вероятной причины острого панкреатита. Лекарственные препараты, инфекционные агенты, а также метаболические причины, такие, как гиперкальциемия и гиперпаратиреоз, часто неправильно рассматриваются в качестве причин острого панкреатита, будучи на самом деле причинами редкими [18-20]. Хотя некоторые препараты, такие, как 6-меркаптопурин, азатиоприн, диданозин явно могут вызывать острый панкреатит, имеются очень ограниченные свидетельства в отношении большинства других лекарственных препаратов в качестве факторов, вызывающих панкреатит [18]. Первичная и вторичная гипертриглицеридемия могут вызывать острый панкреатит; однако они ответственны только за 1–4% случаев [19]. Для того, чтобы считаться причиной острого панкреатита, триглицериды должны иметь уровень в крови выше 1000 мг/дл [21, 22]. Сыворотка с повышенным содержанием липидов наблюдается у 20% пациентов с острым панкреатитом, и, таким образом, когда подозревается гипертриглицеридемия, уровень триглицеридов в крови натощак должен быть оценен повторно через один месяц после выписки [23]. Хотя и не всегда, но любая доброкачественная или злокачественная опухоль, которая приводит к сужению основного панкреатического протока, может привести к развитию острого панкреатита. По разным оценкам, 5-14% пациентов c доброкачественными или злокачественными опухолями панкреатобилиарной системы, будут иметь явный идиопатический острый панкреатит [24-26]. Исторически аденокарцинома поджелудочной железы считалась заболеванием пожилого возраста. Однако все чаще рак поджелудочной железы обнаруживается у пациентов на четвёртом десятке жизни, а иногда и у более молодых. Это заболевание должно подозревается у любого пациента в возрасте более 40 лет с идиопатическим панкреатитом, особенно при его длительном или рецидивирующем течении [8, 27, 28]. Таким образом, у этих пациентов необходимо выполнение компьютерной томографии с контрастом или МРТ.
Таблица 1. ЭТИОЛОГИЧЕСКИЕ ФАКТОРЫ ОСТРОГО ПАНКРЕАТИТА [34]:
| Механические | ЖКБ, холедохолитиаз, билиарный сладж, стриктура, спазм, воспаление или дивертикул большого сосочка двенадцатиперстной кишки, при сдавлении жёлчных протоков опухолью головки поджелудочной железы, склерозирующем холангите и дискинезии жёлчных путей различной природы., аскаридоз, язвенная болезнь двенадцатиперстной кишки (пенетрация язвы в головку поджелудочной железы), дуоденостаз, дуоденальные дивертикулы, дуоденит с папиллитом. |
| Токсические | Этанол, метанол, яд скорпиона, отравление флсфорорганическими веществами |
| Метаболические | Гиперлипидемия (I, IV и V типов, связанных с гипертриглицеридемией), гиперкальциемия |
| Лекарственные вещества | Диданозин, пентамидин, метронидазол, stibogluconate, тетрациклин, фуросемид, тиазиды, сульфасалазин, 5-аминосалициловая кислота, L-аспарагиназа, азатиоприн, вальпроевая кислота, сулиндак, салицилаты, кальций, эстроген |
| Инфекции |
Вирусы - паротита, Коксаки, гепатита В, ЦМВ, ветряной оспы, HSV, ВИЧ
Бактерии-микоплазмы, легионеллы, лептоспир, сальмонеллез
Грибы-аспергиллез
Паразиты-Toxoplasma, Cryptosporidium, аскариды
|
| Травмы | Тупые или проникающие травмы брюшной полости, ятрогенные травмы во время операции или ЭРХПГ (сфинктеротомия) |
| Врожденные | Разнообразные формы аномалий развития: кольцевидная поджелудочная железа, врожденные кисты, кистозный фиброз, разделенная поджелудочная железа |
| Сосудистые | Ишемия, атеросклеротические поражения сосудов, тромбоэмболия, васкулиты, системная красная волчанка, узелковый полиартрит |
| Разное | Пост-ЭРХПГ панкреатиты, беременность, трансплантация почки, дефицит альфа-1-антитрипсина |
| Наследственные | Трансмембранный регулятор муковисцидоза и другие генетические мутации |
Третичные факторы: макрофаги, мононуклеарные клетки, нейтрофилы на фоне нарушений микроциркуляции, СВР, гипоксии продуцируют цитокины ( интерлейкин 1,6 и 8, фактор некроза опухоли, фактор активации тромбоцитов, простагландинов, тромбоксана, лейкотриенов, оксида азота, угне тению иммунного статуса.
Эпидемиология
Эпидемиология
Острый панкреатит более распространён среди мужчин, чем среди женщин. У мужчин основной этиологической причиной служит злоупотребление алкоголем, а у женщин заболевания билиарного тракта.
Средний возраст пациентов с данным заболеванием зависит от этиологии (при алкоголь-индуцированном остром панкреатите средний возраст составляет 39 лет, а при билиарном - 69 лет).
У 20-25% больных развитие острого панкреатита носит деструктивный характер. Именно эта группа пациентов является наиболее тяжелой в диагностическом, лечебном и социально-экономическом плане. Об этом свидетельствуют высокие показатели летальности, осложнений и материальных затрат, а так же разнообразие взглядов на тактику лечения.
Общая летальность при ОП колеблется от 1% до 10%.
Примерно у 2/3 пациентов перенесших ОП развивается сахарный диабет или синдромы нарушения пищеварения и всасывания [4].
Диагностика
ДИАГНОСТИКА ОСТРОГО ПАНКРЕАТИТА
Рекомендации
[35]:
1. Точный диагноз ОП (этиология, форма ОП, осложнения и т.д.) должен быть установлен в течение 48 ч от момента госпитализации больного. Невзирая на то, что диагностика в полном объеме вызывает напряжение диагностических служб, риск невыявленной альтернативной абдоминальной катастрофы требует исследования в исчерпывающем объеме (рекомендация зависит от условий, умеренный уровень доказательности).
2. Этиология острого панкреатита должна быть определена, по крайней мере в 80% случаев, и не больше, чем 20 % должна быть классифицирована как идиопатическая (сильный уровень рекомендации, низкое качество доказательности).
3. Хотя оценка амилазы широко доступна и обеспечивает приемлемую точность диагноза, где это возможно, оценка липазы предпочтительна для диагноза острого панкреатита (сильный уровень рекомендации, умеренное качество доказательности)..
4. Для диагностики ОП требуются 2 критерия из следующих: (1) характерная (сильная) боль в животе; (2) повышение уровня амилазы и/или липазы более чем в 3 раза верней границы нормы; и/или (3) типичные изменения при визуализации брюшной полости [37].
5. Все пациенты с ОП должны проходить трансабдоминальное ультразвуковое исследование (сильный уровень рекомендации, низкое качество доказательности)
6. У пациентов без камней в желчном пузыре и со злоупотреблением алкоголя в анамнезе следует определить сывороточные уровни триглицеридов и рассматривать эту причину (злоупотребление алкоголем) в качестве причины, если такие уровни выше чем 1000 мг/дл (рекомендация зависит от условий, умеренный уровень доказательности).
7. У пациентов старше 40 лет необходимо рассмотреть в качестве причины острого панкреатита опухоль поджелудочной железы (рекомендация зависит от условий, низкий уровень доказательности).
8. У пациентов моложе 30 лет необходимо рассмотреть уместность генетического тестирования, если причина заболевания неочевидна и имеется семейный анамнез заболеваний поджелудочной железы (рекомендации зависит от условий, низкий уровень доказательности).
9. Пациенты с острым панкреатитом и сопутствующим острым холангитом должны пройти эндоскопическую ретроградную холангиопанкреатографию (ЭРХПП) в течение 24 часов после госпитализации. Эта процедура сочетается с верхней эндоскопией и рентгенографией (радиографией) для выявления и разрешения проблемы, затрагивающей желчные протоки и протоки поджелудочной железы (сильный уровень рекомендации, низкое качество доказательности).
10. У большинства пациентов с панкреатитом при желчнокаменной болезни без лабораторных и клинических признаков обструкции желчных путей нет нужды в ЭРХПГ (сильный уровень рекомендации, низкое качество доказательности).
11. КТ поджелудочной железы с контрастным усилением и/или МРТ должны применяться у пациентов, у которых диагноз остается не ясным или у тех, которые не улучшаются клинически в течение первых 48 - 72 часов поступления в стационар, или для оценки осложнений (сильный уровень рекомендации, низкое качество доказательности).
12. Параллельно с диагностикой острого панкреатита необходимо определение тяжести заболевания (тяжёлый или нетяжёлый). Наиболее важно раннее выявление тяжёлого панкреатита, результаты лечения которого во многом обусловлены сроком его начала.
КЛИНИЧЕСКАЯ ДИАГНОСТИКА
острым аппендицитом;
пищевой токсикоинфекцией.
ЛАБОРАТОРНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Согласно данным Американской коллегии гастроэнтерологов (2013), предпочтительным является определение уровня сывороточный липазы по сравнению с сывороточной амилазой. Сывороточная амилаза у пациентов с острым панкреатитом обычно повышается в первые часы после появления симптомов и возвращается к нормальным значениям в течение трёх - пяти дней; однако она может оставаться в пределах нормальных величин при поступлении у каждого пятого пациента [36, 37]. В сравнению с липазой, уровень сывороточный амилазы более быстро возвращается к значениям ниже верхнего уровня нормы. Концентрация сывороточный амилазы может быть в норме при алкогольном остром панкреатите и гипертриглицеридемии. Концентрация сывороточной амилазы может быть повышена при отсутствии острого панкреатита при макроамилаземии (синдроме, характеризующимся образованием крупных молекулярных комплексов между амилазой и патологическими иммуноглобулинами), У пациентов со снижением уровня клубочковой фильтрации, при заболеваниях слюнных желёз, при внепанкреатических заболеваниях органов брюшной полости, сопровождающихся воспалением, включая острый аппендицит, холецистит, кишечную непроходимость или ишемию, пептическую язву, гинекологические заболевания.
Сывороточная липаза является более специфичным признаком и уровень её после начала заболевания остается повышенным дольше. Несмотря на рекомендации предыдущих исследователей [38] руководства по лечению острого панкреатита [39], которая подчёркивает важность сывороточный липазы, у определённых популяций пациентов имеются похожие проблемы, касающиеся предсказательной ценности, включая существование макролипаземии. Как выяснилось, липаза тоже может увеличиваться при целом ряде заболеваний, не связанных с поджелудочной железой, таких, как заболевания почек, аппендицит, холецистит и некоторых других. Кроме того, для правильной диагностики острого панкреатита у диабетиков может понадобиться наличие уровня липазы в крови в три - пять раз выше в сравнении с нормой, так как по неясным причинам средний уровень липазы у них выше, чем у пациентов без диабета [40, 41]. В течение последних 15 лет исследовались наборы для диагностики многих других ферментов поджелудочной железы, однако ни один из них не позволяет достичь более высокой диагностической ценности, чем уровень амилазы и липазы [42]. Несмотря на то, что большинство исследователей демонстрируют диагностическую эффективность уровней этих ферментов в три - пять раз выше верхней границы нормы, клиницисты должны учитывать клинические ситуации и состояние пациента, когда проводят оценку уровня амилазы/липазы в каждой конкретной ситуации. Когда имеются сомнения в наличии диагноза острого панкреатита, рекомендуется использование абдоминальной визуализации, например, КТ с контрастированием.
В дополнение к уровню амилазы и липазы, следующие значения должны быть установлены при поступлении: клинический анализ крови, концентрации электролитов и кислотоосновного состава крови, креатинин, сахар крови, общий альбумин, показатели коагуляции, билирубин, трансаминазы, щелочная фосфатаза, азот мочевины крови, триглицериды [43].
ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
ЭКГ и рентгенография грудной полости
В 50 или менее процентов случаев отмечается подъем и инверсия сегмента ST, в основном на задней стенке, без инфаркта миокарда. На рентгенографии грудной клетки в двух проекциях может обнаруживаться плевральный выпот и легочный инфильтрат, что является признаком тяжелого течения болезни. Обзорная рентгенография органов брюшной полости (вертикально или на левом боку) также может быть использована для диагностики. Могут обнаруживаться признаки кишечной непроходимости, такие как раздутые петли кишечника (изолированная петля в верхне-левой или средней части брюшной полости) или признаки “обрыва” толстой кишки (отсутствие воздуха в левом изгибе толстого кишечника или его нисходящей части). Кальцификация поджелудочной железы предстает доказательством хронического панкреатита – то есть пациент переносит скорее приступ обострившегося хронического панкреатита, чем первый эпизод острого панкреатита [43].
Компьютерная томография
Компьютерная томография с контрастом имеет показатели чувствительности и специфичности в диагностике острого панкреатита более 90% [44]. Компьютерная томография или МРТ при оценке раннего панкреатита имеют сравнимую эффективность. Проведение компьютерной томографии при поступлении только для определения степени тяжести не рекомендуется. Ранняя КТ, т.е. проведенная в течении первых 4 дней с момента появления симптомов не покажет другой диагноз, не поможет определиться между интерстициальной и некротизирующей формой и не покажет наличие возможных осложнений. Ранняя КТ должна быть проведена только тогда, когда есть сомнения в диагнозе острого панкреатита и другие жизнеугрожающие заболевания должны быть исключены [43].
Определение начала острого панкреатита
Определение тяжелого панкреатита.
Рекомендации [35]:
1. Состояние гемодинамики должно быть оценено немедленно после поступления и при необходимости должны быть предприняты неотложные меры (сильный уровень рекомендации, умеренный уровень доказательности).
2. Необходимо проведение оценки риска у пациентов для отнесения их к категориям высокого и низкого рисков, что помогает определить тактику лечения, например, госпитализацию в отделении интенсивной терапии (рекомендации зависит от условий, от низкого до умеренного уровень доказательности).
3. Пациенты с органной недостаточностью должны были госпитализированы в отделения неотложной терапии при наличии возможности (сильный уровень рекомендации, низкий уровень доказательности).
Большинство эпизодов острого панкреатита являются лёгкими и проходят самостоятельно, требуя лишь краткой госпитализации. Лёгкий острый панкреатит определяется отсутствие органной недостаточности и/или панкреатического некроза [45, 46]. Через 48 часов после поступления такие пациенты обычно значительно улучшается и начинают самостоятельно питаться. У пациентов с более тяжелым течением выделяют две фазы: раннюю (в пределах первой недели) и позднюю. Местные осложнения включают перипанкреатические жидкостные скопления (вокруг поджелудочной железы) и панкреатический и перипанкреатический некроз (стерильный или инфицированный). Большинство пациентов с тяжелым заболеванием поступают в неотложное отделение без органной недостаточности или панкреатического некроза; к сожалению, это ведёт к многим ошибкам в клиническом ведении данного заболевания [57]. Такие ошибки включают неадекватную и/или несвоевременную гидратацию, несвоевременное распознавание и лечение холангита, неспособность начать лечение ранних стадий органной недостаточности. По этой причине для врача является критически важным понять опасность неправильной диагностики у пациентов легкой формы заболевания в течение первых 48 часов после их поступления с острым панкреатитом.

Однако эти местные осложнения (включая панкреатический некроз с наличием или отсутствием преходящей органной недостаточности) определяют умеренно тяжелый острый панкреатит (см. табл. 2). Умеренно тяжелый острый панкреатит характеризуется наличием преходящей органной недостаточности или местных или системных осложнений при отсутствии стойкой органной недостаточности [46]. Примером пациента с умеренно тяжелым острым панкреатитом может служить тот, у которого имеются перипанкреатические жидкостные скопления, лейкоцитоз и лихорадка, долго сохраняющаяся боль в животе, которые удлиняет нахождения пациентов в стационаре на 7-10 дней. При отсутствии стойкой органной недостаточности смертность у таких пациентов меньше, чем при тяжелом панкреатите. Если у пациента с некротизирующим панкреатитом развивается стойкая органная недостаточность, это считается тяжелым заболеванием.
|
Классификация Атланта (1993)
|
Современный консенсус (2012) |
|
Легкий острый панкреатит
Отсутствие органной недостаточности.
Отсутствие местных осложнений.
|
Легкий острый панкреатит
Отсутствие органной недостаточности.
Отсутствие местных осложнений.
|
|
Тяжелый острый панкреатит
1. Местные осложнения.
2. Органная недостаточность:
ЖКТ – кровотечения;
Шок (АДс ≤ 90 мм. рт. ст.);
РаО2 ≤ 60 мм рт. ст.;
Креатинин ≥ 194,5 мкмоль/л
|
Умеренно тяжелый панкреатит
1. Местные осложнения.
2. Временная органная недостаточность < 48 часов.
Тяжелый острый панкреатит
Постоянная органная недостаточность > 48 часов
(не менее 6-8 баллов по шкале Маршалла)
|
Органная недостаточность ранее определилась, как шок (систолическое кровяное давление менее 90 мм ртутного столба), легочная недостаточность (парциальное давление кислорода менее 60 мм ртутного столба), почечная недостаточность (уровень креатинина менее 2 мг/дл после регидратации), и/или желудочно-кишечное кровотечение (потеря крови более 500 мл за 24 часа) [47]. Пересмотренные Атлантские критерии теперь определяют органную недостаточность, как состояние, при котором имеется два или более баллов при оценке одной из этих систем органов с использованием шкалы Маршалла [47, 48] . Авторы считают, что вместо подсчета баллов по шкале Маршалла (что может быть сложным для занятого врача) можно полагаться на более старые, Атлантские критерии, что может оказаться не менее полезным. Необходимы дополнительные исследования, чтобы подтвердить необходимость использования шкалы Маршалла (табл. 3).
Таблица 3. МОДИФИЦИРОВАННАЯ ШКАЛА MARSHALL ДЛЯ ОСТРОГО ПАНКРЕАТИТА
| Системы органов | Баллы | ||||
| 0 | 1 | 2 | 3 | 4 | |
| Дыхательная система (PaO2/FiO2) | >400 | 301–400 | 201–300 | 101–200 | ≤101 |
|
Почки: (креатинин плазмы, μmol/l) (креатинин плазмы mg/dl) |
≤134 | 134–169 | 170–310 | 311–439 | >439 |
| <1,4 | 1,4–1,8 | 1,9–3,6 | 3,6–4,9 | >4,9 | |
| Сердечно-сосудистая система (АД мм/ Hg) без инотропной поддержки | >90 | <90 возрастает на фоне инфузии | <90 не возрастает на фоне инфузии | <90 при pH<7,3 | <90 при pH<7,2 |
Панкреатический некроз определяется, как диффузное или локальное наличие нежизнеспособной паренхимы поджелудочной железы, размерами более 3 см или занимающий более 30% всей железы [47]. Панкреатический некроз может быть стерильным или инфицированным. При отсутствии панкреатического некроза и лёгком течении заболевания отёк поджелудочной железы называется интерстициальным панкреатитом. Несмотря на то, что существует некоторая корреляция между инфекцией, наличием некроза, длительностью госпитализации и наличием органной недостаточности, последняя может развиваться как при стерильном, так и при инфицированном некрозе [49, 50]. Наличие инфекции в некрозе, возможно, и не увеличивает вероятность текущей или будущей органной недостаточности. Пациенты со стерильными некрозом могут страдать от органной недостаточности и иметь такую тяжесть заболевания клинически, как и пациенты с инфицированным некрозом. Стойкая органная недостаточность теперь определяется модифицированной шкалой Маршалла [46, 48].
Хотя большинство рентгенологов могут легко идентифицировать панкреатический некроз, при отсутствии хирургического вмешательства, неинвазивно, экстрапанкреатический некроз выявляется гораздо реже [51].
|
При поступлении
|
Через 48 часов |
|
1. Возраст > 55 лет
2. Лейкоцитоз > 16 000/мл
3. Уровень глюкозы > 11,1 ммоль/л;
4. Лактатдегидрогеназа (ЛДГ) > 350 межд. ед/л
5. Аспартатаминотрансфераза (АСТ) > 250 межд. ед/л
|
1. Снижение Ht > 10%
2. Мочевина > 1,8 ммоль/л
3. Кальций плазмы < 2 ммоль/л
4. РаО2 < 60 мм рт. ст.
5. Дефицит оснований (ВЕ) >4 ммоль/л
6. Ориентировочная секвестрация жидкости > 6 л
|
Таблица 5. ПРОГНОСТИЧЕСКАЯ ШКАЛА BISAP
|
Одним баллом оцениваются следующие показатели:
уровень мочевины более 8,9 ммоль/л;
снижение ментального статуса по шкале Глазго менее 15;
возраст > 60 лет;
наличие пневмонии (плеврита);
наличие 2-х и более признаков SIRS.
|
|
Оценка в 3 балла соответствует летальности в 5-8%,
в 5 баллов и выше летальности в 25%.
|
Несмотря на то, что лабораторные исследования такие, как гематокрит и оценка уровня мочевины в крови могут помочь клиницистам, нет ни одного лабораторного теста, который бы, с практической точки зрения, позволил надёжно и точно предсказывать тяжесть заболевания у пациентов с острым панкреатитом [57-59]. Даже такой, быстро реагирующий на воспаление параметр, как С-реактивный белок, наиболее часто используемый для оценки воспаления при остром панкреатите, не может применяться практически, так как необходимо, чтобы прошло 72 часа, чтобы его исследование сопровождалось нужной точностью [60]. КТ и/или МРТ также не могут надёжно определять тяжесть в раннем периоде течения острого панкреатита, так как некроз обычно при поступлении ещё отсутствует, и может развиться лишь через 24–48 часов [61, 62] (табл. 6). Таким образом, при отсутствии надёжного маркера, определяющего тяжесть, крайне важно иметь возможность ранней оценки потери жидкости, гиповолемического шока и симптомов, предполагающих развитие дисфункции органов.
| Класс А | Нормальная поджелудочная железа |
| Класс В | Локальное или диффузное увеличение поджелудочной железы |
| Класс С | Изменения в поджелудочной железе + воспалительные изменения в перипанкреатической клетчатке |
| Класс D | Предыдущие изменения + единичное жидкостное образование |
| Класс Е | Два и более жидкостных образования или газ в поджелудочной железе/перипанкреатической области |
В 1990 году Бальтазар модифицировал свою шкалу, назвав ее «Компьютерно- томографический индекс тяжести» (табл. 7).
Таблица 7. КОМПЬЮТЕРНО-ТОМОГРАФИЧЕСКИЙ ИНДЕКС ТЯЖЕСТИ (CTSI)
|
Степень некроза
|
Баллы |
| Отсутствие некроза | 0 |
| < 30% некроза | 2 |
| 30-50% некроза | 4 |
| > 50% некроза | 6 |
| Шкала Бальтазара | |
| А | 0 |
| В | 1 |
| С | 2 |
| D | 3 |
| Е | 4 |
Примечание: максимальное количество баллов – 10.
Таблица 8.
| КЛИНИЧЕСКИЕ ПЕРЕМЕННЫЕ, СВЯЗАННЫЕ С ТЯЖЕЛЫМ ТЕЧЕНИЕМ ПРИ ПЕРВИЧНОЙ ОЦЕНКЕ РИСКА [63]* |
| Характеристики пациента |
| Возраст более 55 лет |
| Ожирение (индекс массы тела более 30 кг/кв.м) |
| Нарушенное психическое состояние |
| Сопутствующая патология |
|
Синдром системного воспалительного ответа (SIRS) Наличие более двух из следующих критериев: |
| - пульс более 90 ударов в минуту |
| - дыхание более 20/мин, или PaCO2 более 32 мм Hg |
| - температура более 380C или менее 36 |
| - лейкоцитоз >12000 или <4000/мм3 или более >10% незрелых форм |
| Лабораторные данные: |
|
- Уровень мочевины более 20 мг/дл
|
| - Увеличение уровня мочевины |
|
- Гематокрит более 44%
|
| - Увеличение гематокрита |
| - Увеличенный креатинин |
| Рентгенологические признаки: |
|
- Плевральный выпот
|
| - Легочные инфильтраты |
| - Множественные или распространённые экстрапанкреатические жидкостные скопления |
| * наличие органной недостаточности и/или панкреатического некроза определяет тяжелый острый панкреатит |
Развитие органной недостаточности, как выясняется, связано с развитием и сохранением синдрома системного воспалительного ответа. Обратное развитие недостаточности любого органа, как показано, является важным для предотвращения заболеваемости и смертности пациентов с острым панкреатитом [64, 65]. Хотя наличие синдрома системного воспалительного ответа в первые 24 часа имеет высокую чувствительность в предсказании органной недостаточности и смертности, наличие этого синдрома не имеет достаточной специфичности в оценке тяжести заболевания (41%). Отсутствие специфичности объясняется тем фактом, что не столь важно наличие этого синдрома, как его продолжительность. По этой причине пациенты со стойким синдромом системного воспалительного ответа, особенно те, у которых имеются тахипноэ и/или тахикардия, должны быть госпитализированы в отделение интенсивной терапии или ему подобное, для агрессивной внутривенной дегидратация и тщательного мониторинга.
Несмотря на разнообразие существующих оценочных шкал, большинство из которых крайне трудоемки и имеют очень ограниченное применение в клинической практике, ищутся новые подходы к прогнозированию тяжести течения острого панкреатита.
Один из таких новых способов это шкала безвредности острого панкреатита (harmless acute pancreatitis score – HAPS), которая помогает идентифицировать легкие случаи острого панкреатита (которые являются большинством случаев) в течение 30 минут с момента пребывания пациента в стационаре даже неспециалистами (табл. 9). В исследовании Gardner T.B. [66] показано, что мягкое течение панкреатита может быть прогнозировано с точностью 98% для пациентов с отрицательным симптомом Щеткина-Блюмберга, без защитного напряжения мышц передней брюшной стенки, нормальным гематокритом и концентрацией креатинина в плазме крови. Исследования из Индии подтверждают точность HAPS [67]. Эта шкала выявляет большинство пациентов, у которых никогда не развивалась и не разовьется деструктивный (некротизирующий) панкреатит или органная недостаточность и которым не нужна будет интенсивная терапия. HAPS может быть использована в обычных больницах лечащим врачом для определения пациентов, которым необходим перевод в более специализированные центры для более агрессивного лечения и тщательного мониторирования состояния. Эта шкала также способна определить, когда пациент может адекватно лечиться амбулаторно, что является экономически выгодным.
|
Оценка следующих признаков:
- Отсутствие признаков перитонита/ мышечного напряжения. - Нормальный показатель креатинин сыворотки крови. - Нормальный показатель гематокрита. Если присутствуют все три признака, это означает, что в 98% случаев выявляется нетяжелое течения заболевания |
Лечение
В приложении 1 дана сводная таблица международных, в том числе российских рекомендаций по лечению острого панкреатита. Это объясняется наличием терминологических расхождений в классификации острого панкреатита (Атланта 1992 и ее модификации), наличием терминов, стадий и фаз острого панкреатита. Возникает интерес сравнить, как отражены основные, стратегические и тактические моменты в лечении острого панкреатита с местными осложнениями в различных международных рекомендациях.
Ключевыми позициями в ведении больных ОП являются ранняя инфузионная терапия, адекватное обезболивание, поддерживающее лечение и управление местными и системными осложнениями. Все больные с панкреатитом средней тяжести и тяжелым госпитализируются в отделения интенсивной терапии в больницы, где круглосуточно имеется возможность проведения УЗИ, КТ, МРТ, интервенционной эндоскопии и РХПГ.
Рекомендации
1. Агрессивная гидратация, определяемая как введение 250–500 мл изотонического кристаллоидного раствора в час, должна быть проведена всем пациентам, если нет сердечно-сосудистых или почечных заболеваний, которые являются противопоказаниями для этого (сильный уровень рекомендации, умеренный уровень доказательности).
2. У пациентов со значительным уменьшением объема циркулирующей крови, проявляющимся гипотензией и тахикардией, может потребоваться более быстрое его восполнение (болюс) (рекомендация зависит от условий, умеренный уровень доказательности).
3. Раствор Рингера, содержащий лактат, может быть предпочтительным изотоническим кристаллоидным раствором, замещающим потерю жидкости (рекомендация зависит от условий, умеренный уровень доказательности).
4. Потребность в жидкости должна оцениваться повторно с частыми интервалами в пределах 6 часов от момента поступления и в течение следующих 24–48 часов. Целью агрессивной гидратации должно быть уменьшение азота мочевины в крови (сильный уровень рекомендации, умеренный уровень доказательности).
АГРЕССИВНАЯ ВНУТРИВЕННАЯ ГИДРАТАЦИЯ
В то же время в рекомендациях оговаривается, что для пациентов с сердечной, почечной недостаточностью или острым респираторным дисстресс-синдромом необходимо придерживаться менее активной инфузионной терапии, чтобы не допустить у них развития осложнений, таких, как перегрузка объемом, отек легких, абдоминальный компартмент-синдром [69]. Чаще всего в этой ситуации с целью оценки объема циркулирующей крови применяются измерения центрального венозного давления через центральный венозный катетер, необходимо контролировать SpO2 и внутрибрюшное давление. У пациентов, у которых нет быстрого ответа на внутривенную гидратацию (в течение 6-12 часов), продолжение агрессивной гидратации может оказаться бесполезным.
Обоснование ранней агрессивной гидратации при остром панкреатите проистекает из наблюдения, что при остром панкреатите множество факторов приводит к частому развитию гиповолемии, включая рвоту, уменьшения поступления жидкости с пищей, распределения жидкостей в третьих пространствах, увеличение респираторных потерь и диафореза (повышенного потоотделения). Кроме того, исследователи выдвинули гипотезу, что комбинация микроангиопатии, отека воспалённой ткани железы вызывает уменьшение кровотока, который ведёт к увеличению гибели клеток, некрозу и непрерывному освобождению панкреатических ферментов, активирующих множественные каскады реакций. Воспаление также увеличивает сосудистую проницаемость, что приводит к потере жидкости, связанной с накоплением её в третьих пространствах, ухудшению кровоснабжения поджелудочной железы, которое ведёт к увеличению её некроза и смерти клеток [70]. Ранее агрессивное внутривенное восстановление количества жидкости предоставляет микро- и макроциркуляторную поддержку, которая предотвращает развитие серьезных осложнений, таких как панкреатический некроз [71].
Рекомендации
1. Пациентам с острым панкреатитом и одновременным острым холангитом необходимо выполнение ЭРХПГ в течение первых 24 часов от момента поступления (сильный уровень рекомендации, умеренный уровень доказательности).
2. ЭРХПГ не требуется у большинства пациентов с панкреатитом, вызванным желчный камнями, у которых отсутствуют лабораторные или клинические признаки билиарный обструкции, имеющиеся на данный момент. (Сильный уровень рекомендации, низкий уровень доказательности).
3. При отсутствии холангита и/или желтухи, для выявления желчных камней, при наличии обоснованного предположения, необходимо использовать МРХГ или эндоскопическую сонографию, а не диагностическую ЭРХПГ (рекомендация зависит от условий, низкий уровень доказательности).
4. У пациентов с высоким риском, для уменьшения риска возникновения тяжелого панкреатита после ЭРХПГ, необходимо использовать стенты панкреатического протока и/или послеоперационное применение нестероидных противовоспалительных препаратов в виде ректальных суппозиториев (рекомендация зависит от условий, низкий уровень доказательности).
Патофизиологические изменения в поджелудочной железе начинаются и прогрессируют в первые 12-24 ч заболевания, когда потенциальная эффективность некоторых фармакологических агентов еще возможна, но не реализуется из-за позднего обращения больных за медицинской помощью и потерь времени, необходимого для уточнения диагноза.
Результаты экспериментальных исследований утверждают, что применение лексипафанта (lexipafant) в первые 24 ч после развития заболевания сопровождается снижением локального повреждения железы, а также снижением частоты органных нарушений. К сожалению, в клинических исследованиях многие авторы не подтверждают положительного влияния на выживаемость больных после применения лексипафанта, особенно при наличии полиорганных нарушений, поэтому рутинное использование данного препарата не рекомендуется.
Из других модуляторов заболевания ингибитор протеаз апротинин (контрикал) широко применяется для лечения панкреатита в течение последних лет, однако, клинические исследования показали, что его применение никак не влияет на исход заболевания. Возможно, это объясняется неспособностью препарата проникать в ткань поджелудочной железы.
Габексата месилат (gabexate mesilate) является ингибитором протеаз, а также ингибитором фосфолипазы. Контролируемые исследования не показали каких-либо поло-жительных эффектов от применения препарата. В отдельных исследованиях показано, что препарат может предотвращать развитие ОП после ЭРХПГ, а также способствовать сокращению системных осложнений и потребности в хирургических вмешательствах, не влияя на исходы при ОП [73].
Октреотид - синтетический аналог соматостатина, который ингибирует продукцию энзимов поджелудочной железы, а также обладает иммуномодулирующей активностью.
Антисекреторный эффект соматостатина и октреотида обусловлен снижением захвата ацинарными клетками поджелудочной железы аминокислот из плазмы. Этот механизм обусловливает уменьшение синтеза панкреатических ферментов, подавление активности ацинарных клеток и снижение аккумуляции в них ферментов, что сопровождается угнетением базальной и стимулированной панкреатической секреции, ингибированием выделения секретина и холецистокинина.
Результаты клинических исследований достаточно противоречивы - наряду с положительными результатами имеются сообщения о полном отсутствии какого-либо эф-фекта, кроме того, введение препарата сопровождается вазоконстрикцией сосудов брюшной полости.
Не вызывает сомнений эффективность профилактического и лечебного действия октреотида у больных с панкреатическими свищами и пострезекционным панкреатитом, однако при деструктивном панкреатите его клиническая значимость исследована недостаточно.
С позиций индифферентности влияния соматостатина и октреотида на заболеваемость и летальность при ОП эти препараты не рекомендованы для широкого клинического применения.
Антагонисты Н2-гистаминовых рецепторов и блокаторы протонной помпы способствуют поддержанию режима покоя поджелудочной железы, снижая высвобождение секретина 12-перстной кишкой. Большинство специалистов в интенсивной терапии склоняются к ограничению применения препаратов этой группы в связи с увеличением частоты нозокомиальных осложнений со стороны легких, которые обусловлены колонизацией верхних отделов ЖКТ при снижении кислотности желудочного содержимого. Кроме того, в настоящее время не имеется серьезных доказательств, что эти препараты положительно влияют на течение ОП.
Однако данные больших рандомизированных исследований подтверждают пользу от профилактики стресс-язв в общей популяции больных ОИТ и рекомендуют назначение антагонистов Н2-гистаминовых рецепторов для профилактики гастроинтестинальных кровотечений (уровень доказательности А).
В настоящее время нет аргументированных данных в пользу положительного специфического влияния на течение ОП препаратов с антиоксидантной активностью, пентоксифиллина, иммуномодулирующих средств, препаратов метаболического действия, глюкагона, антитромбина III и других очищенных дериватов плазмы крови.
Рекомендации
1. Для быстрого купирования выраженного болевого синдрома препаратами выбора являются опиоидные анальгетики для внутривенного введения фентанил и морфин (сильный уровень рекомендации, умеренный уровень доказательности).
2. Назначение опиоидов в режиме продленной титрованной внутривенной инфузии предпочтительнее, чем их болюсное введение «по требованию» (слабый уровень рекомендации, низкий уровень доказательности).
3. Если болевой синдром сопровождается гемодинамической нестабильностью или нарушением функции почек, препаратом выбора является фентанил (сильный уровень рекомендации, умеренный уровень доказательности).
4. Продленная эпидуральная анальгезия с применением современных местных анестетиков и шприцевых дозаторов позволяет проводить эффективное обезболивание и обеспечивает комфорт у больных с ОП. Дополнительное введение морфина в дозе 2 мг/сутки или фентанила в дозе 100 мкг каждые 6 ч в эпидуральное пространство потенцирует действие местных анестетиков (слабый уровень рекомендации, низкий уровень доказательности).
5. Нестероидные противовоспалительные средства или ацетаминофен (парацетамол) в отдельных случаях могут быть назначены в комбинации с опиоидами (сильный уровень рекомендации, умеренный уровень доказательности).
6. Кеторолак может применятся не более 5 дней с обязательным контролем функции почек и тщательным наблюдением для исключения гастроинтестинальных кровотечений (сильный уровень рекомендации, умеренный уровень доказательности).
РОЛЬ АНТИБИОТИКОВ ПРИ ОСТРОМ ПАНКРЕАТИТЕ
Рекомендации
1. Антибиотики должны применяться при наличии внепанкреатической инфекции, такой, как холангит, инфекции связанные с применением катетеров, бактериемия, инфекции мочевыводящих путей, пневмония (сильный уровень рекомендаций, высокий уровень доказательности).
2. Рутинное использование антибиотиков для профилактики у пациентов с тяжелым острым панкреатитом не рекомендуется (сильный уровень рекомендации, умеренный уровень доказательности).
3. Использование антибиотиков у пациентов со стерильным некрозом для предотвращения развития инфицированного некроза не рекомендуется (сильный уровень рекомендации, умеренный уровень доказательности).
4. Необходимо предположить наличие инфицированного некроза у тех пациентов с панкреатическим или перипанкреатическим некрозом, которые имеют ухудшение состояния или не улучшаются через 7–10 дней после госпитализации. У этих пациентов необходимо либо (1) тонкоигольная аспирация под контролем КТ с последующей окраской по Граму и посевом для оценки чувствительности к антибиотикам или (2) эмпирическое применение антибиотиков без тонкоигольной аспирации под контролем КТ (сильный уровень рекомендации, низкий уровень доказательности).
5. У пациентов с инфицированным некрозом антибиотики, для которых известно, что они проникают в панкреатический некроз, такие, как карбапенемы, хинолоны и метронидазол, могут применяться для отсрочки или иногда полного отказа от интервенции, таким образом уменьшая заболеваемость и смертность (рекомендация зависит от условий, низкий уровень доказательности).
6. Рутинное применение противогрибковых препаратов вместе с профилактическими или терапевтическим антибиотиками не рекомендуется. (рекомендация зависит от условий, низкий уровень доказательности).
7. Рутинное применение противогрибковых препаратов вместе с профилактическими или терапевтическим антибиотиками не рекомендуется (рекомендация зависит от условий, низкий уровень доказательности).
Инфекционные осложнения
Предотвращение инфицирования стерильного некроза
Сдвиг парадигмы и противоречия, касающиеся использования антибиотиков при остром панкреатите, в основном касаются панкреотического некроза. По сравнению с пациентами у которых имеется стерильный некроз, пациенты с инфицированным панкреатическим некрозом имеют большую смертность (в среднем 30%, от 14 до 69%) [47].
Поэтому важным является предотвращение инфицирования панкреатического некроза. Несмотря на то, что раньше считалось, что инфекционные осложнения начинаются в позднем периоде течения заболевания [75, 76], недавний обзор обнаружил, что 27% всех случаев инфицированного некроза встречаются в первые 14 дней [77]. В другом исследовании почти половина всех инфекционных осложнений возникла в течение первых семи дней после поступления [78].
Хотя в ранних нерандомизированных исследованиях предполагалось, что применение антибиотиков может предотвратить инфекционные осложнения у пациентов со стерильным некрозом [79, 80], в последующих исследованиях более высокого качества с высоким постоянством не могли подтвердить преимущества антибиотикопрофилактики [81-85]. Из-за консистенции некроза очень мало антибиотиков проникают в него при внутривенном введении. Проникающие в некроз антибиотики, которые использовались в клинических исследованиях, включают в себя карбапенем, хинолоны, метронидазол и высокие дозы цефалоспоринов [52, 76, 83]. С 1993 года было проведено 11 проспективных, рандомизированных исследований адекватного качества, с достаточной популяцией пациентов и адекватными оценками исходов, которые оценивали использование профилактических антибиотиков при тяжелом остром панкреатите [86]. По данным анализа этих исследований число пациентов, которых необходимо было пролечить, для того, чтобы получить эффект у одного пациента, составило 1429. На основании имеющейся литературы использование антибиотиков для профилактики инфекций у пациентов со стерильными некрозом (даже с его тяжелым течением) не рекомендуется.
Предупреждение грибковых инфекций у этих пациентов тоже не рекомендуется. Несмотря на то, что предполагалось, что грибковые инфекции могут оказаться более частой причиной смертности при остром панкреатите, дальнейшие исследования не подтвердили это предположение [87]. Существует одно успешное клиническое исследование, в котором применялась селективная деконтаминация кишечника, направленная как на грибки, так и на бактерии, для того, чтобы предотвратить инфицирование некроза [88]. Так как в данном исследовании обнаружилось уменьшение заболеваемости и смертности пациентов с тяжелым острым панкреатитом, необходимы дальнейшие исследования в этой области. Ну и наконец, нет необходимости в назначении пробиотиков у пациентов с тяжелым острым панкреатитом. Несмотря на то, что в ранних исследованиях предполагалось наличие эффекта, очень тщательно проведённые рандомизированные, контролируемые клинические исследования продемонстрировали увеличение смертности [89]. Отсутствие эффекта также было продемонстрировано в недавнем метаанализе [90].
Инфицированный некроз
Вместо предупреждения инфекции современная роль антибиотиков у пациентов с некротизирующим острым панкреатитом заключается в лечении инфицированного некроза. Концепция, что инфицированный некроз требует быстрого хирургического лечения, также ставится под сомнение множественными сообщениями и наблюдениями случаев, которые демонстрируют, что антибиотики сами по себе могут приводить к прекращению инфекции, у отдельных пациентов даже позволяют избежать операции [91-94]. Garg с соав. [94] опубликовал наблюдение 47 из 80 пациентов на протяжении 10 лет, которые были успешно пролечены консервативно лишь с применением антибиотиков. Смертность в группе консервативного лечения составила 23% в сравнении с 54% в группе хирургического лечения. Таким образом, определённая группа относительно стабильных пациентов с инфицированным некроза может лечиться только антибиотиками без необходимости перкутанного дренирования. Однако необходимо предупредить, что эти пациенты требуют тщательного наблюдения и необходимость проведения хирургического или эндоскопического лечения у них должна быть немедленно рассмотрена при отсутствии улучшения, либо клиническом ухудшении.
Роль КТ-контролируемой тонкоигольной аспирации
Методика тонкоигольной аспирации под контролем КТ (КТ ТИА) является доказано эффективной, безопасной, точной при дифференциальной диагностике инфицированного и стерильного некроза [47, 96]. Так как пациенты со стерильным инфицированным некрозом могут одинаково иметь лейкоцитоз, лихорадку и органную недостаточность [97], надёжно отличить эти два состояния без пункции невозможно. Известно, что использование антибиотиков наиболее эффективно при доказанном клинически инфицировании, и, таким образом, при подозрении на инфекцию необходимо проведение аспирации под контролем КТ. Немедленная микроскопия после окраски по грамму часто может позволить поставить диагноз. Однако может оказаться уместным начать антибиотики во время ожидания микробиологического подтверждения. Если посев окажется отрицательным антибиотики, могут быть отменены.
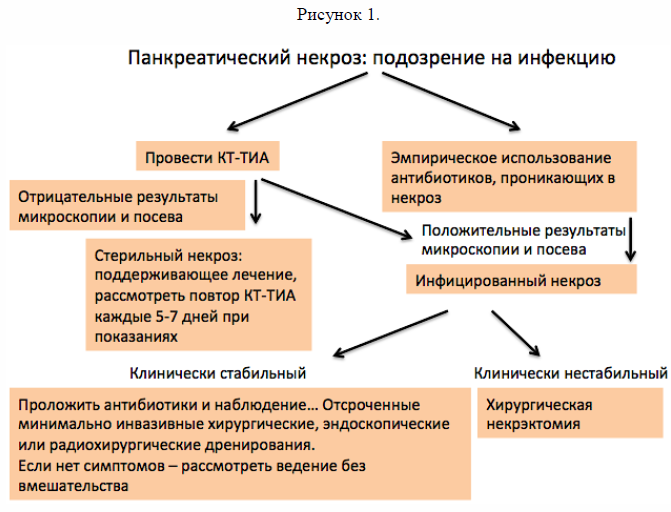
Имеются определённые сомнения - всем ли пациентам нужна аспирация (Рисунок 1). У многих пациентов использование аспирации не повлияет на лечение [98]. Увеличение частоты использования консервативного лечения и минимально инвазивных дренирований уменьшило роль аспирации в диагностике инфицированного некроза [60]. Многие пациенты, как со стерильным, так и инфицированным некрозом либо быстро улучшаются, либо становятся нестабильными, поэтому на решение использовать у них вмешательство через минимально инвазивный доступ результаты аспирации никак не влияют. Конференция для выработки общего мнения сделала вывод, что аспирация должна использоваться лишь в некоторых ситуациях, когда нет клинического ответа на антибиотики, например, когда подозреваются грибковые инфекции [60].
ПИТАНИЕ ПРИ ОСТРОМ ПАНКРЕАТИТЕ
Рекомендации
1. При лёгком остром панкреатите питание через рот может быть начато немедленно, если нет тошноты и рвоты, а боли в животе прекратились (рекомендация зависит от условий, умеренный уровень доказательности).
2. Питание на основе твёрдой, с низким содержанием жиров пищи является столь же безопасным, как и жидкое питание (рекомендация зависит от условий, умеренный уровень доказательности).
3. При тяжелом остром панкреатите для предотвращения инфекционных осложнений рекомендуется энтеральное питание. Парентеральное питание не должно использоваться, кроме тех случаев, когда оно невозможно, не переносится, или не соответствует необходимым энергетическим потребностям (сильный уровень рекомендации, высокий уровень доказательности).
4. Способы питания через назогастральный или назоеюнальный зонды сравнимы по эффективности и безопасности (сильный уровень рекомендации, умеренный уровень доказательности).
РЕЗЮМЕ ДОКАЗАТЕЛЬСТВ
Питание при легком остром панкреатите
Традиционно, несмотря на отсутствие клинических данных, пациентам с острым панкреатитом назначался голод для обеспечения покоя поджелудочной железы [99]. Большинство рекомендаций в прошлом советовали сохранять голод до прекращения болей, а некоторые предлагали дождаться нормализации уровня ферментов поджелудочной железы или даже видимых (рентгенологических) свидетельств прекращения воспаления до возобновления питания через рот [60]. Требование обеспечить покой поджелудочной железе до полного разрешения острого панкреатита на данный момент является необязательным. Долгое время существовавшие предположения, что воспалённая поджелудочная железа требует длительного покоя, обеспечиваемого голоданием, как оказалось, не поддерживается лабораторными и клиническими наблюдениями [100]. Клинические и экспериментальные исследования показали, что покой кишечника связан с возникновением атрофии слизистой оболочки и увеличением числа инфекционных осложнений, которые возникают из-за попадания бактерий из кишечника. Во многих исследованиях было показано, что у пациентов, которые начинают питаться через рот в раннем сроке течения острого панкреатита, сокращается длительность госпитализации, уменьшается число инфекционных осложнений, уменьшаются смертность и заболеваемость [101-105].
При лёгком остром панкреатите питание через рот обычно восстанавливается быстро и нутритивной поддержки не требуется. Несмотря на то, что сроки восстановления обычного питания продолжает обсуждаться, в недавних исследованиях продемонстрировано, что немедленное возобновление питания через рот у пациентов с легким острым панкреатитом является безопасным [100]. Кроме того оказалось, что твёрдая пища с низким содержанием жира является более безопасной в сравнении с пищей жидкой, и позволяет получить больше калорий [106]. Сходным образом, в других рандомизированных клинических исследованиях было продемонстрировано, что питание мягкой пищей через рот является более безопасным по сравнению с жидкой пищей и сокращает длительность госпитализации [107-108]. Возобновление питания, как, оказалось, тоже приводит к сокращению сроков госпитализации. На основании данных этих исследований питание через рот, осуществляемое при легком остром панкреатите, не нужно начинать с использования жидких смесей, постепенно увеличивая в объеме, а можно сразу использовать содержащую мало жира и мало клетчатки мягкую пищу при улучшении состояния пациента.
Необходимо избегать полного перевода пациентов с лёгким и тяжёлым острым панкреатитом на парентеральное питание. Многочисленные клинические исследования продемонстрировали, что тотальное парентеральное питание связано с инфекционными и другими осложнениями, относящимися к введению пищи [60]. Так как питание через рот способствует сохранению естественного барьера слизистой оболочки кишечника, предотвращает её повреждения, препятствуют проникновению бактерий в участки некроза, то оно может предотвращать инфицирование некритических скоплений [104, 105]. Недавний метаанализ, содержащий описания восьми контролируемых клинических исследований с участием 381 пациента, обнаружил уменьшение числа инфекционных осложнений и случаев органной недостаточности и смертности у пациентов с тяжелым острым панкреатитом, которые питались через рот в сравнении с теми, у которых проводилось только парентеральное питание [105].
Несмотря на то, что назоеюнальный зонд традиционно предпочитался во избежание стимуляции фазы желудочной секреции, назогастральное энтеральное питание считается теперь столь же безопасным. Систематический обзор, в котором проанализированы 92 пациента из четырёх исследований, изучавших питание с помощью назогастрального зонда позволил сделать выводы, что этот вид питания был безопасным и хорошо переносился пациентами с тяжелым острым панкреатитом [101]. Некоторые публикации упоминают о повышении риска аспирации при питании через назогастральный зонд. По этой причине пациенты с острым панкреатитом, которым проводится энтеральное питание, для предупреждения аспирации должны быть помещены в более приподнятое положение. В сравнении с кишечным зондом, установка желудочного зонда проходит гораздо быстрее, что у пациентов с острым панкреатитом является важным, особенно в условиях интенсивного лечения. Установка кишечного зонда требует интервенционного радиолога или эндоскописта и, таким образом, является более затратной. По всем этим причинам необходимо предпочитать питание при помощи желудочного зонда [110].
Рекомендации
1. Пациентам с лёгким острым панкреатитом, у которых выявляются камни в желчном пузыре, необходимо выполнение удаления желчного пузыря перед выпиской для предотвращения повторных эпизодов острого панкреатита (сильный уровень рекомендации, умеренный уровень доказательности).
2. У пациентов с некротизирующим билиарным острым панкреатитом для предотвращения инфекции холецистэктомия должна быть отложена до прекращения активного воспаления и исчезновения жидкостных скоплений или стабилизации (сильный уровень рекомендации, умеренный уровень доказательности).
3. Наличие бессимптомных псевдокист и пакнреатического/экстрапанкреатического некроза не предполагает необходимости вмешательства, вне зависимости от размера, локализации и/или распространённости. (сильный уровень рекомендации, умеренный уровень доказательности).
4. У пациентов в стабильном состоянии и наличием инфицированного некроза хирургическое, рентгенологическое или эндоскопическое дренирование должно быть отложено, предпочтительно, на срок более, чем четыре недели, для окончания разжижения содержимого и формирования соединительнотканной стенки вокруг некроза (отграниченного некроза).
5. У больных с симптомным инфицированным некрозом предпочтительными, по сравнению с открытой хирургией, являются минимально инвазивные методики некрэктомии (сильный уровень рекомендации, низкий уровень доказательности).
РЕЗЮМЕ ДОКАЗАТЕЛЬСТВ
Холецистэктомия
У пациентов с лёгким желчнокаменным панкреатитом холецистэктомия должна проводиться в течение основной госпитализации. По данным современной литературы, которые включают восемь когортных исследований и одно клиническое рандомизированное исследование, описывающих 998 пациентов, которым холецистэктомия по поводу желчного панкреатита была выполнена или не выполнена, 95 из них (18%) были госпитализированы повторно из за рецидивирующих желчных симптомов в течение 90 дней с момента выписки (0% против 18%, P < 0.0001), которые включали и рецидивы билиарного панкреатита (n=43, 8%) [109]. При этом некоторые случаи оказывались тяжелыми. На основе данного опыта можно сделать вывод, что, если приступ является лёгким, необходимо ранее выполнение холецистэктомии в течение той же самой госпитализации. Пациенты, у которых имеется тяжелый острый панкреатит, особенно те, у которых имеется некроз, требую индивидуального подхода с выработкой комплексного решения с участием хирурга и гастроэнтеролога . У этих пациентов холецистэктомия чаще всего откладывается (1) на более позднее время текущей, обычно длительной, госпитализации, (2) является частью лечения панкреатического некроза, если он имеется, (3) или производится после выписки [111, 112]. Предыдущие рекомендации советовали выполнять холецистэктомию после двух приступов интерстициального отечного панкреатита на основе предположения, что многие такие случаи могут вызываться мелкими камнями. Однако популяционное исследование обнаружило, что если холецистэктомия проводится по поводу повторных приступов острого панкреатита и при этом нет камней или сгустков желчи на УЗИ, нет значимого подъема уровня печеночных ферментов при первом приступе острого панкреатита, имеется более, чем 50% вероятность повторения острого панкреатита [113].
У большинства пациентов с желчнокаменным панкреатитом камни общего желчного протока проходят в двенадцатиперстную кишку самостоятельно. Рутинное использование ЭРХПГ не является уместным, кроме тех случаев, когда имеется обоснованное предположение на наличие камня в общем желчном протоке, который проявляется увеличением уровня билирубин [114]. Пациентам с лёгким острым панкреатитом, и нормальным уровнем билирубина может выполняться лапароскопическая холецистэктомия с использованием интраоперационной холангиографии, и при наличии камней в желчном протоке они могут удаляться при помощи послеоперационной или интраоперационной ЭРХПГ. У пациентов С низким или умеренным риском до операции возможно выполнение МРХПГ или ЭндоУЗИ, однако рутинное применение МРХПГ не требуется. Если пациенту с лёгким острым панкреатитом оперативное вмешательство не может быть выполнено, например, престарелые пациенты и/или те, у которых есть тяжелые сопутствующие патологии, эффективным методом лечения и предупреждения будущих приступов острого панкреатита может оказаться билиарная сфинктеротомия, хотя она не предотвращает приступов холецистита [60].
Хирургическое лечение некроза
Традиционно методом выбора лечения инфицированного некроза и стерильного симптомного некроза являлась открытая некрэктомия с дренированием. Десятилетия назад пациенты со стерильным некрозом подвергались ранним хирургическим вмешательствам, что приводило к высокой смертности. По этой причине ранние открытые вмешательства по поводу стерильного некроза были прекращены [99]. Однако вмешательство при стерильном не грусти всё ещё рекомендуется если он сопровождается стенозом выхода из желудка или/и механической желтухой. Раньше неправильно считалось, что если некрэктомия не проведена в неотложном порядке то смертность от инфицированного некроза достигает 100% [115, 116]. В ретроспективном исследовании 53 пациентов с инфицированным некрозом, пролеченных оперативно (среднее время, прошедшее до момента вмешательства, составило 28 дней), смертность снизилась до 22%, когда операция была отсрочена [78]. Проведя обзор 11 исследований, в которых было включено в 1136 пациентов, авторы обнаружили, что перенос операции у стабильных пациентов, отличившиеся только антибиотиками, на 30 дней с момента поступления сопровождалось уменьшением смертности [91].
Эта концепция, что пациенты с инфицированным панкреатическим некрозом требуют быстрого хирургического вмешательства, подверглась критике во многих публикациях и клинических наблюдениях, показавших, что терапия антибиотиками сама по себе может привести к разрешению инфекции и, у некоторых пациентов, сделать хирургическое вмешательство вообще ненужным [46, 60]. В одной публикации [93] из 28 пациентов, которым были назначены антибиотики по поводу инфицированного некроза, 16 оперативное вмешательство не понадобилась. Наблюдалось два смертельных случая среди пациентов, которые лечились хирургически, И два смертельных случая среди пациентов, которые лечились только антибиотикотерапией. Таким образом, в данном исследовании более, чем половина пациентов, были успешно проведены антибиотиками и смертность в группах с хирургическим и консервативным лечением оказалась одинаковой. Таким образом, концепция, в соответствии с которой необходима неотложная хирургия у пациентов с инфицированным некрозом, больше не считается верной. Бессимптомные панкреатический и/или экстрапанкреатические некритические скопления не требуют вмешательство вне зависимости от размеров, локализации и распространенности. С высокой вероятностью они сами рассосутся стечением времени, в некоторых случаях даже при наличии инфицированности [60].
И хотя нестабильным пациентом с инфицированным некрозом проводить неотложное вмешательство необходимо, современный консенсус таков, что в начале лечения инфицированного некроза у пациентов, который стабильны клинически, необходимо назначение курса антибиотиков до начала вмешательства, чтобы воспалительная реакция могла лучше ограничиться [60]. Если состояние не улучшается и инфицированный некроз не разрешается, необходимы минимально инвазивное вмешательство: эндоскопическое, интервенционное, видео-ассистированный забрюшинный, лапараскопический доступ или их комбинация, либо открытая хирургия по мере возникновения ограничения некроза [60, 116-119].
Минимально инвазивное лечение панкреатического некроза
Минимально извазивные подходы к панкреатической некрэктомии через передний, либо задний доступы, перекутанное, интервенционное катерное дренирование или некрэктомию, видео-ассистированную или ретроперитонеальную некрэктомию из мини -доступа и эндоскопия все чаще становятся стандартными методиками лечения. Перкутанное дренирование без некрэктомии может оказаться наиболее часто применяющимся минимально инвазивный методом лечения жидкостных скоплений, осложняющих течение некротизирующего панкреатита [60, 109, 115-121]. Если избегать открытого вмешательства, то общий процент успеха в лечении составляет примерно 50%. Кроме того, эндоскопическое дренирование некротических скоплений и/или прямая эндоскопическая некрэктомия, как сообщается в некоторых крупных нескольких исследованиях, является одинаково эффективными (47, 60, 118]. Иногда эти методы могут сочетаться, применяться одновременно, или по очереди, например, могут комбинироваться чрескожные и эндоскопические методики. Недавно, в хорошо организованном исследований из Нидерландов, в котором применялся пошаговый подход (чрескожные катерное дренирование с последующей видео-ассистированной ретроперитонеальной некрэктомией) (79, 121] было продемонстрировано, что пошаговый подход имеет преимущество, которое проявляется меньшей заболеваемостью (меньше частота полиорганной недостаточности и хирургических осложнений), а также более низкой стоимостью по сравнению с открытым хирургическим вмешательством.
Несмотря на то, что данные рекомендации не могут обсуждать в деталях различные методики удаление некротических масс, или провести сравнительный анализ эффективности каждой из методик, как из-за ограниченного количества доступных данных, так и другого акцента данного обзора, некоторые обобщения являются важными. Вне зависимости от используемого метода, применение минимально инвазивных подходов требует организации панкреатического некроза [60, 117-121]. В то время как в ранней стадии течения заболевания (первые 7-10 дней) панкреатический некроз представляет собой диффузную плотную и/или полужидкую массу, через четыре недели вокруг некроза формируется фиброзная стенка, которая способствует более легкому его удалению при помощи открытой или лапараскопической хирургии, перекутанного интервенционного катерного дренирования, и/или эндоскопического дренирования.
На данный момент лечении панкреатического некроза мультидисциплинарный консенсус складывается в пользу применения минимально инвазивных методик вместо открытой хирургии [60]. Недавнее контролируемое клиническое исследование ясно продемонстрировало преимущество эндоскопического подхода над хирургией [117]. Несмотря на достижения хирургических, рентгенологических, эндоскопических методик, которые существуют, а также находится на стадии развития, необходимо подчеркнуть, что многие пациенты со стерильным некрозом и некоторые пациенты с инфицированным некрозом клинически улучшается до такого состояния, при котором никакого вмешательства не нужно [60, 94]. Ведение пациентов с некротизирующим панкреатитом должно быть индивидуализировано, требуя принятия во внимание всех доступных данных(клинических, рентгенологических, лабораторных) и использования всего имеющегося опыта. Раннее направление пациента в экспертный центр является крайне важным, так как максимальная отсрочка вмешательства, использование всего спектра поддерживающих мер и применение минимально инвазивного подхода продемонстрировали значительное уменьшение заболеваемости и смертности.
Рекомендация
Выбор хирургической техники для некросектомии (некрсеквестрэктомии) и последующего послеоперационного ведения зависит от индивидуального опыта и местной практики (слабый уровень рекомендации, умеренный уровень доказательности) [5].
В силу имеющегося опыта и ресурсов здравоохранения местная практика заключается в выполнении открытых оперативных вмешательств при инфицированном панкреатическом некрозе.
Технические аспекты оперативного вмешательства заключаются в следующем:
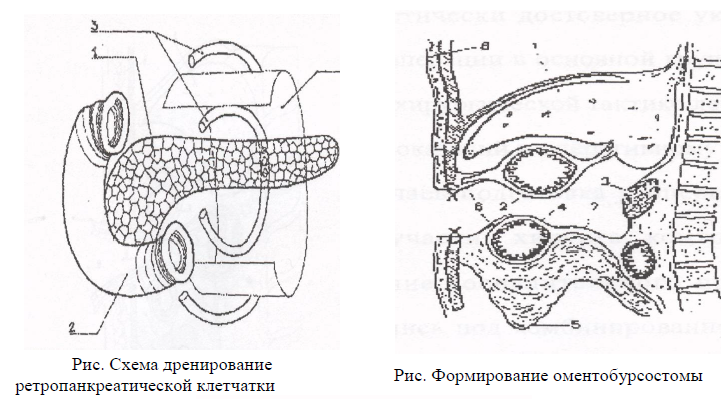
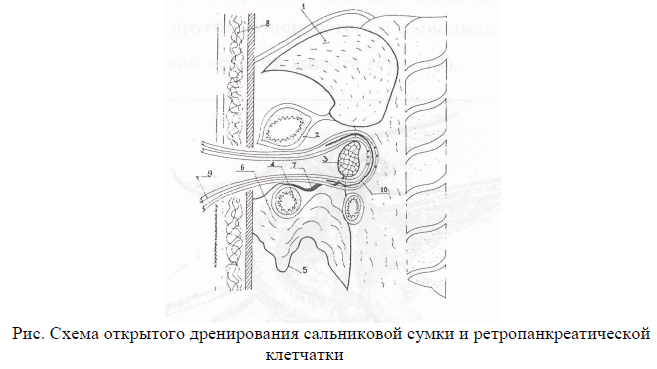
деперитонизации ПЖ.
мобилизации тела и хвоста ПЖ из забрюшиного пространства и последующее дренирование ретропанкреатической забрюшиной клетчатки широкой резиновой полоской и микроирригаторами по разроботанной методике.
мобилизации 12-перстной кишки по Кохеру с последующим дренированием забрюшиного пространства позади головки ПЖ.
наружного дренирование желчных путей.
тотальной пролангированной нейровегатативной забрюшинной блокады.
катетеризации пупочной вены и внутрипортольное ведение антибиотиков и поляризующей смеси.
автономного ирригаторно-полосочного дренирования брюшной полости и дренирование сальниковой сумки.
формирование широкой оментобурсостомы.
проведение в послеоперационном периоде регулярных секвестректомий и санаций сальниковой сумки через оментобурсостому до полного ее закрытия.
Информация
Источники и литература
-
Клинические протоколы Министерства здравоохранения Кыргызской Республики
- 1. Руководство по неотложной хирургии органов брюшной полости / Под ред. В. С. Савельева. М., 2004. 2. Fagenholz PJ, Castillo CF, Harris NS et al. Increasing United States hospital admissions for acute pancreatitis, 1988-2003. Ann Epidemiol 2007;17:491–7. 3. Yadav D, Lowenfels AB. Trends in the epidemiology of the first attack of acute pancreatitis: a systemic review. Pancreas 2006;33:323–30. 4. Sekimoto M, Takada T, Kawarada Y, Hirata K, Mayumi T, Yoshida M, Hirota M, Kimura Y, Takeda K, Isaji S, Koizumi M, Otsuki M, Matsuno S: JPN Guidelines for the management of acute pancreatitis: epidemiology, etiology, natural history, and outcome predictors in acute pancreatitis. J Hepatobiliary Pancreat Surg 2006;13:10–24. 5. Диагностика и лечение острого панкреатита (российские клинические рекомендации) – рекомендации, принятые на круглом столе в Санкт-Петербурге, 30 октября 2014 г. 6. Lankisch PG, Assmus C, Lehnick D et al. Acute pancreatitis: does gender matter? Dig Dis Sci 2001;46:2470–4. 7. Gullo I, Migliori M, Olah A et al. Acute pancreatitis in five European countries: etiology and mortality. Pancreas 2002;24:223–7. 8. Lowenfels AB, Maisonneuve P, Sullivan T. The changing character of acute pancreatitis: epidemiology, etiology, and prognosis. Curr Gastroenterol Rep 2009;11:97–103. 9. Johnson C, Lévy P. Detection of gallstones in acute pancreatitis: when and how? Pancreatology 2010;10:27–32. 10. Moreau JA, Zinsmeister AR, Melton LJ et al. Gallstone pancreatitis and the effect of cholecystectomy. Mayo Clin Proc 63;466:1988. 11. Yadav D, O’Connell M, Papachristou GI. Natural history following the first attack of acute pancreatitis. Am J Gastroenterol 2012;107:1096–103. 12. Moreau JA, Zinsmeister AR, Melton LJ et al. Gallstone pancreatitis and the effect of cholecystectomy. Mayo Clin Proc 63;466:1988. 13. Yadav D, O’Connell M, Papachristou GI. Natural history following the first attack of acute pancreatitis. Am J Gastroenterol 2012;107:1096–103. 14. Ammann RW. The natural history of alcoholic chronic pancreatitis. Intern Med 2001;40:368–75. 15. Steinberg W, Tenner S. Medical progress: acute pancreatitis. New Engl J Med 1994;330:1198–210. 16. Rebours V, Vullierme MP, Hentic O et al. Smoking and the course of recurrent acute and chronic alcoholic pancreatitis: a dose-dependent relationship. Pancreas 2012;41:1219–24. 17. Whitcomb DC. Genetic polymorphisms in alcoholic pancreatitis. Dig Dis Sci 2005;23:247–54. 18. Badalov N, Baradarian R, Iswara K et al. Drug induced acute pancreatitis: an evidence based approach. Clin Gastroenterol Hepatol 2007;101:454–76. 19. Fortson MR, Freeman SN, Webster PD. Clinical assessment of hyperlipid- meic pancreatitis. Am J Gastroenterol 1995;90:2134–9. 20. Parenti DM, Steinberg W, Kang P. Infectious causes of acute pancreatitis. Pancreas 1996;13:356–71. 21. Farmer RG, Winkelman EI, Brown HB et al. Hyperlipoproteinemia and pancreatitis. Am J Med 1973;54:161–5. 22. Toskes PP. Hyperlipidmic pancreatitis. Gastroenterol Clin North Am 1990;19:783–91. 23. Yadav D, Pitchumoni CS. Issues in hyperlipidemic pancreatitis. J Clin Gastroenterol 2003;36:54–62. 24. Simpson WF, Adams DB, Metcalf JS et al. Nonfunctioning pancreatic neuroendocrine tumors presenting as pancreatitis: report of four cases. Pancreas 1988;3:223–31. 25. Kohler H, Lankisch PG. Acute pancreatitis and hyperamylasaemia in pancreatic carcinoma. Pancreas 1987;2:117–9. 26. Robertson JF, Imrie CW. Acute pancreatitis associated with carcinoma of the ampulla of Vater. Br J Surg 1987;74:395–7. 27. Bank S, Indaram A. Causes of acute and recurrent pancreatitis. Clinical considerations and clues to diagnosis. Gastroenterol Clin North Am 1999;28:571–89, viii. 28. Banks PA. Epidemiology, natural history, and predictors of disease outcome in acute and chronic pancreatitis. Gastrointest Endosc 2002;56:S226–30. 29. Al-Haddad M, Wallace MB. Diagnostic approach to patients with acute idiopathic pancreatitis, what should be done? World J Gastroenterol 2008;14:1007–10. 30. DiMagno MJ, Dimagno EP. Pancreas divisum does not cause pancreatitis, but associates with CFTR mutations. Am J Gastroenterol 2012;107:318–20. 31. Steinberg WM, Chari ST, Forsmark CE et al. Controversies in clinical pancreatology: management of acute idiopathic recurrent pancreatitis. Pancreas 2003;27:103–17. 32. Badalov N, Tenner S, Baillie J. Prevention and treatment of post-ERCP pancreatitis. JOP 2009;10:88–97. 33. Cote GA, Imperiale TF, Schmidt SE et al. Similar efficacies of biliary, with or without pancreatic, sphincterotomy in treatment of idiopathic recurrent acute pancreatitis. Gastroenterology 2012;6):1502–9. 34. Vege S.S., Whitcomb D.C., Grover S. Etiology of acute pancreatitis. Uptodate. 2015май 7. 35. Tenner S., Baillie J., DeWitt J. AMERICAN COLLEGE OF GASTROENTEROLOGY GUIDELINE: MANAGEMENT OF ACUTE PANCREATITIS. Am J Gastroenterol. advance online publication, 30 July 2013; doi:10.1038/ajg.2013.218. 36. Winslet M, Hall C, London NJM. Relation of diagnostic serum amylase levels to aetiology and severity of acute pancreatitis. Gut 1992;33:982–6. 37. Clavien PA, Robert J, Meyer P et al. Acute pancreatitis and normoamylasemia. Not an uncommon combination. Ann Surg 1989;210:614–20. 38. Malka D, Rosa-Hezode I. Positive and etiological diagnosis of acute pancreatitis. Gastroenterol Clin Biol 2001;25:1S153–1S68. 39. UK guidelines for the management of acute pancreatitis. Gut 2005;54: 1–9. 40. Steinberg WM, DeVries JH, Wadden T et al. Longitudinal monitoring of lipase and amylase in adults with type 2 diabetes and obesity: Evidence from two phase 3 randomized clinical trials with the once-daily GLP-1 analog liraglutide. Gastroenterology 2012;121: A246. 41. Shah AM, Eddi R, Kothari ST et al. Acute pancreatitis with normal serum lipase: a case series. JOP 2010;11:369–72. 42. Lippil G, Valentino M, Cervellin G. Laboratory diagnosis of acute pancrea- titis: in search of the Holy Grail. Crit Rev Clin Lab Sci 2012;49:18–31. 43. Lankisch P.G., Apte M., Banks P.A. Acute pancreatitis. The Lancet. - Volume 386, No. 9988, p85–96, 4 July 2015 44. Balthazar EJ. Acute pancreatitis: assessment of severity with clinical and CT evaluation. Radiology 2002;223:603–13. 45. Bradley EL. A clinically based classification system of acute pancreatitis. Arch Surg 1993;128:586–90. 46. Banks PA, Bollen TL, Dervenis C et al. Classification of acute pancreatitis—2012: revision of Atlanta classification and definitions by international consensus. Gut 2013;62:102–11. 47. Banks PA, Freeman ML. Practice guidelines in acute pancreatitis. Am J Gastroenterol 2006;101:2379–400. 48. Marshall JC, Cook DJ, Christou NV et al. Multiple organ dysfunction score: a reliable descriptor of complex clinical outcome. Crit Care Med 1995;23:1638–52. 49. Perez A, Whang EE, Brooks DC et al. Is severity of necrotizing pancreatitis increased in extending necrosis and infected necrosis? Pancreas 2002;25:229–33. 50. Bakker OJ, van Santvoort H, Besselink MG et al. Extrapancreatic necrosis without pancreatic parenchymal necrosis: a separate entity in necrotising pancreatitis? Gut 2012;18:143–9.
Информация
Адрес для переписки с рабочей группой:
Разработчики руководства
| Ф.И.О. | Должность |
| Сыргаев Д.Т. | Зав. отделением хирургии желчевыводящих путей и поджелудочной железы НХЦ, доцент кафедры госпитальной хирургии с курсом оперативной хирургии КГМА им. И.К. Ахунбаева, к.м.н. |
| Иманов Б.М. | Зав. сектором гепатопанкреатобилиарной хирурги НХЦ, к.м.н., доцент |
| Сопуев А.А. | Зав.кафедры госпитальной хирургии с курсом оперативной хирургии КГМА им. И.К. Ахунбаева, д.м.н., профессор |
| Тилеков Э.А. | Зам. директора НХЦ по лечебной работе, д.м.н., профессор |
| Эгенбаев Р.Т. | Зав.ПЛКиЭХ НХЦ, к.м.н., с.н.с. |
Ответственные исполнители
| Ф.И.О. | Должность |
| Абдылдаев Ж.У. | Врач хирург отделения хирургии желчевыводящих путей и поджелудочной железы НХЦ |
| Урманбетов Ч.У. | Врач хирург отделения хирургии желчевыводящих путей и поджелудочной железы НХЦ |
| Джайнаков А. | Врач хирург отделения хирургии желчевыводящих путей и поджелудочной железы НХЦ |
| Исраилов Б.Ш. | Врач хирург отделения хирургии желчевыводящих путей и поджелудочной железы НХЦ |
| Самаков А.А. | Доцент кафедры госпитальной хирургии с курсом оперативной хирургии КГМА им. И.К. Ахунбаева, к.м.н. |
| Калжикеев А.М. | Профессор кафедры госпитальной хирургии с курсом оперативной хирургии КГМА им. И.К. Ахунбаева, д.м.н. |
| Кудайбергенов Т.И. | Ассистент кафедры госпитальной хирургии с курсом оперативной хирургии КГМА им. И.К. Ахунбаева |
| Сыдыгалиев К.С. | Профессор кафедры госпитальной хирургии с курсом оперативной хирургии КГМА им. И.К. Ахунбаева, д.м.н. |
Медицинские рецензенты
| Ф.И.О. | Должность |
| Тойматов С.Ш. | Начальник управления оказания медицинской помощи и лекарственной политики МЗ КР |
| Оморов Р.А. | Зав.кафедры факультетской хирургии КГМА им. И.К. Ахунбаева, член-корр. НАН КР, д.м.н., профессор |
| Кочоров | Зам.главного врача НГ МЗ КР по лечебной работе, д.м.н. |
| Камбаралиева Б.А. | Клинический фармаколог, координатор программ ПМСП МЗ КР |
Ответственный эксперт-методолог разработки и оценки качества клинических руководств и протоколов - Барыктабасова Б.К., консультант доказательной медицины Министерства здравоохранения, к.м.н.
ТЕРМИНОЛОГИЯ ПРИ ОСТРОМ ПАНКРЕАТИТЕ [5]:
Отёчный панкреатит («interstitial oedematous pancreatitis») - характеризуется диффузным (или иногда локальным) увеличением поджелудочной железы из-за воспалительного отека.
Некротический панкреатит (панкреонекроз, «pancreatic necrosis») - диффузные или очаговые зоны нежизнеспособной паренхимы поджелудочной железы, которые, как правило, сочетаются с некрозом забрюшинной жировой клетчатки.
Стерильный панкреонекроз («sterile pancreatic necrosis») - панкреонекроз, который не содержит патогенной микрофлоры и не сопровождается развитием гнойных осложнений.
Инфицированный панкреонекроз («infected pancreatic necrosis») - бактериально обсемененный некроз ткани поджелудочной железы и забрюшинной клетчатки с гнойным их расплавлением и секвестрацией. Инфицированный панкреонекроз, не имеющий отграничения от здоровых тканей называется гнойно-некротический парапанкреатит. Инфицированный панкреонекроз, имеющий отграничение от здоровых тканей, следует расценивать, как панкреатический абсцесс.
Перипанкреатический инфильтрат («acute fluid сollection», «аcute necrotic collection») - это экссудативно-пролиферативный воспалительный процесс в поджелудочной железе и окружающих тканях, который сопровождается острым скоплением жидкости (с панкреонекрозом или без панкреонекроза), располагающейся внутри или около поджелудочной железы и не имеющей стенок из грануляционной или фиброзной ткани. Имеет следующие исходы: полное разрешение и рассасывание (чаще к 4-ой неделе заболевания), образование псевдокисты поджелудочной железы, развитие гнойных осложнений.
Гнойные осложнения (панкреатический абсцесс или гнойно-некротический парапанкреатит) определяются при наличии минимум одного из следующих признаков:
пузырьки воздуха в зоне панкреонекроза, выявленные при компьютерной томографии;
положительный бакпосев аспирата, полученного при тонкоигольной пункции;
положительный бакпосев отделяемого, полученного при санирующей операции.
Органная недостаточность («organ failure») определяется по наихудшему показателю одной из 3 систем органов (сердечно-сосудистой, почечной и дыхательной) за 24-часовой период без предшествующей органной дисфункции. Определение производится по соответствующим показателям шкалы SOFA (Sepsis-related Organ Failure Assessment): превышение порога в 2 балла является основанием для диагностирования органной недостаточности:
сердечно-сосудистая недостаточность: необходимость инотропных препаратов;
почечная недостаточность: креатинин >171 μmol/L (>2.0 mg/dL);
дыхательная недостаточность: Pa02/Fi02 <300 mmHg (<40 kPa).
Персистирующая органная недостаточность («persistent organ failure») - недостаточность одной органной системы в течение 48 часов или более.
Транзиторная органная недостаточность («transient organ failure») - недостаточность одной органной системы в течение менее 48 часов.
Полиорганная недостаточность («multiple organ failure») - недостаточность двух и более органных систем.
ШКАЛА УРОВНЕЙ ДОКАЗАТЕЛЬНОСТИ
| Уровни доказательности | |
| Высокая | Дальнейшие исследования крайне мало вероятно могут изменить уверенность в оценках эффективности. |
| Умеренно | Дальнейшие исследования могут иметь важное значение в оценке эффекта и могут изменить эту оценку. |
| Низкая | Дальнейшие исследования скорее всего окажут влияние на оценку эффекта и, скорее всего, изменят эту оценку |
| Очень низкая | Оценка эффекта является крайне неопределённой. |
| Уровни рекомендации | |
| Сильная рекомендация | |
| Слабая рекомендация | |
СВОДНАЯ ТАБЛИЦА МЕЖДУНАРОДНЫХ РЕКОМЕНДАЦИЙ ПО ЛЕЧЕНИЮ ОСТРОГО ПАНКРЕАТИТА
|
Наименование
документа
Наименование метода |
Приказ №320 ДЗ г.Москвы от 13.04.2011 «О единой тактике и лечении острых хирургических заболеваний органов брюшной полости в лечебно -профилактических учреждениях ДЗ г.Москвы» | «Диагностика и лечение острого панкреатита» Российские клинические рекомендации, 2014 | International Association of Pancreatology/American Pancreatic Association- научнообоснованные рекомендации по лечению острого панкреатита, 2013 |
| Применение ингибиторов панкреатической секреции при легком ОП | Отсутствует информация | Базисную терапию целесообразно усиливать ингибиторами панкреатической секреции. | Отсутствует информация |
| Применение ингибиторов панкреатической секреции при среднем/тяжелом ОП | В состав лечебного комплекса должны быть включены препараты подавляющие секрецию поджелудочной железы сандостатин (или его аналога) 300 мкг x 3 раза в сутки подкожно или 900 мг в сутки при внутривенно непрерывной инфузии. Данная терапия должна использоваться в течение первых 3-5 суток от начала заболевания. | Ингибирование секреции поджелудочной железы (оптимальный срок-первые трое суток заболевания). | Отсутствует информация |
| Профилактическое применение антибиотиков при легком ОП | Отсутствует информация | Не применяется | Внутривенная антибиотико- профилактика не рекомендуется для профилактики инфекционных осложнений при остром панкреатите. |
| Профилактическое применение антибиотиков при перипанкреатическом инфильтрате | Отсутствует информация | Системная антибиотико профилактика (цефалоспорины III-IVпоколений или фторхинолоныII-III поколений в сочетании с метронидазолом, препараты резерва - карбапенемы).– ПРОТИВОРЕЧИТ РЕКОМЕНДАЦИИ ПРИ СРЕДНЕЙ СТЕНЕНИ. ИНФИЛЬТРАТ ОТНОСИТСЯ К СРЕДНЕЙ СТЕПЕНИ ТЯЖЕСТИ. | Внутривенная антибиотико- профилактика не рекомендуется для профилактики инфекционных осложнений при остром панкреатите. |
| Профилактическое применение антибиотиков при среднетяжелом ОП | В интенсивном консервативном лечении (период асептических деструктивных осложнений) основную роль ..., антибиотикотерапия и.. | Не является обязательным | Внутривенная антибиотико- профилактика не рекомендуется для профилактики инфекционных осложнений при остром панкреатите. |
| Профилактическое применение антибиотиков при тяжелом ОП | Всем больным тяжелым панкреатитом должна проводиться профилактическая антибиотикотерапия. Препараты выбора - меропенем, имипенем/циластатин. Препараты резерва - цефалоспорины III-IV поколений или фторхинологы II-III поколений в сочетании с метронидазолом | В первые трое суток заболевания не является обязательным. | Внутривенная антибиотико профилактика не рекомендуется для профилактики инфекционных осложнений при остром панкреатите. Внутривенно антибиотики следует назначать в случае подозрения на инфицирование некротического панкреатита и если планируется хирургическое вмешательство. |
| Свободная жидкость в брюшной полости | Видеолапароскопия, чрескожная пункция или дренирование острых жидкостных скоплений брюшной полости. | Лапароскопия или дренирование под УЗИ, или лапароцентез. | Перкутанное дренирование асцита катетерами |
| Билиарная этиология ОП; холедохолитиаз; вклиненный камень терминального отдела холедоха, БДС | При вклиненном камне БДС на фоне острого панкреатита ЭПСТ производится в срочном порядке без ЭРХПГ | При вклиненном камнев срочном (12-24 часов) необходимо восстановить пассаж желчи и панкреатического сока, методом ЭПСТ с литоэкстракцией, после которой, при наличии возможностей, желательно выполнять дренирование главного панкреатического протока. При вклиненном камне БДС и при остром панкреатите ЭПСТ нежелательно и опасно производить контрастирование протоков. | ЭРХПГ+ЭПСТ показано при билиарном панкреатите с обструкцией общего желчного протока. |
| Тонкоигольная аспирационная пункция/биопсия для диагностики инфицирования | Положительные результаты бактериоскопии, полученные при тонкоигольной пункции. Диагностическими задачами тонкоигольной пункции под контролем УЗИ в фазу токсемии является своевременная диагностика раннего инфицирования очагов панкреонекроза с помощью аспирации материала для бактериологического и бактериоскопического исследования. При отрицательном результате необходимы повторные пункции и аспирации каждые 2-3 дня. Противопоказаний к пункции нет. | Бактериоскопия и бакпосев аспирата, полученного при тонкоигольной пункции. | Регулярная чрескожная пункционная биопсия из перипанкреатических жидкостных скоплений для обнаружения бактерии не показана, так как клинические признаки (т.е. постоянные лихорадка, увеличение маркеры воспаления) и визуализационные признаки (т.е. газ в перипанкреатических скоплениях) являются точными предикторами инфицированным некрозом в большинства пациентов. Хотя диагноз инфекции может быть подтверждено пункцией тонкой иглой (FNA), существует риск ложно-отрицательных результатов. Ложно-отрицательные результаты FNA у пациентов с инфицированным некротическим панкреатитом были зарегистрированы в 12-25 % пациентов. FNA показана пациентам без клинического улучшения в течение нескольких недель после начала некротизирующего панкреатита в отсутствии четких клинических и визуализации признаков инфицирования некротического панкреатита. Нет никаких доказательств, что FNA дает преимущества, сокращая период для диагностики инфицированного некроза и лечение антибиотиками, улучшит результат. |
| Чрескожное дренирование острых жидкостных скоплений в фазу токсемии/ инфильтрата/ IВ фаза | Показанием к тонкоигольной пункции под УЗ-наведением является наличие острых скоплений жидкости в очагах панкреатогенной деструкции, когда жидкостные образования не имеют капсулы, жидкостной компонент преобладает над тканевым и размеры очагов не превышают 100 мл в объеме. Систематические пункции могут послужить окончательным методом хирургической помощи или сместить выполнение "открытой" операции на более благоприятные сроки. Хирургические вмешательства в эту фазу ограничиваются малоинвазивными манипуляциями: видеолапароскопией, чрескожной пункцией или дренированием острых жидкостных скоплений брюшной полости и забрюшинного пространства, декомпрессией билиарного тракта под контролем УЗИ. Чрескожная пункция и дренирование острых жидкостных скоплений под контролем УЗИ в фазу токсемии показана; в случаях, когда имеются очаги острых жидкостных скоплений, располагающиеся в сальниковой сумке, забрюшинной клетчатке, и в случаях, когда лапароскопическое дренирование острых жидкостных скоплений в брюшной полости невозможно, в связи с тяжестью состояния больного (панкреатогенный шок), или больной перенес раннее несколько операций на брюшной полости, или имеется гигантская вентральная грыжа. Лечебной задачей тонкоигольной пункции или дренирования под контролем УЗИ является эвакуация содержимого жидкостных скоплений, что позволяет снизить уровень эндогенной интоксикации. При малых объемах жидкости (<100 мл) и полноценной аспирации, предпочтительным являются повторные чрескожные пункции с последующим УЗ - контролем. При объеме жидкости >100 мл, или скопление не удалось эвакуировать полностью, или оно рецидивировало, или при фистулографии установлено сообщение с протоком поджелудочной железы, или получен рост микрофлоры в аспирате - показано чрескожное дренирование этого жидкостного скопления. | Отсутствует информация | Отсутствует информация |
| Чрескожное дренирование острой псевдокисты. Асептическая секвестрация - стерильный панкреонекроз с формированием псевдокист поджелудочной железы | При показаниях к хирургическому лечению преимущество отдается чрескожным вмешательствам. Показанием к чрескожному дренированию острых жидкостных скоплений под УЗИ наведением является доказанный при бактериоскопии факт инфицирования жидкости. В другом случае чрескожное дренирование может быть произведено при острой псевдокисте (сальниковой сумки, парапанкреатической клетчатки) объемом более 100 мл. Дренирование кисты предусматривает аспирационно-промывную санацию полости кисты и оценку адекватности дренирования с помощью динамической фистулографии. Абсолютным показанием к чрескожному дренированию под контролем УЗИ являются ограниченные гнойные жидкостные образования (жидкостные скопления, панкреатический абсцесс, инфицированная псевдокиста). Противопоказаниями к чрескожным вмешательствам являются: преобладание в жидкостном скоплении или острой псевдокисте, тканевого компонента (секвестров). | Псевдокисты более 5 см подлежат оперативному лечению в плановом порядке при отсутствии осложнений. Операцией выбора незрелой (несформировавшейся) псевдокисты (менее 6 мес) является наружное дренирование. Зрелая (сформировавшаяся) псевдокиста (более 6 мес) подлежит оперативному лечению в плановом порядке | Отсутствует информация |
| Чрескожное дренирование абсцесса. Септическая секвестрация - отграниченный инфицированный панкреонекроз (инфицирование некроза поджелудочной железы и парапанкреальной клетчатки). | Абсолютным показанием к чрескожному дренированию под контролем УЗИ являются ограниченные гнойные жидкостные образования (жидкостные скопления, парапанкреатический абсцесс, инфицированная псевдокиста). Открытые вмешательства, в том числе повторные, являются операцией выбора при отграниченном процессе, когда применение чрескожных дренирующих вмешательств не дает возможности достичь адекватной санации парапанкреатической и забрюшинной клетчатки (наличие в полости гнойника крупных некротических масс). | При решении вопроса о первичном дренировании абсцесса поджелудочной железы следует отдавать предпочтение минимально инвазивным вмешательствам (дренирование под УЗ-наведением, ретроперитонеоскопия, минилапаротомия с помощью набора «Мини-ассистент» и др.). | Чрескожное или эндоскопическое чреспросветное дренирование должно быть первым шагом в лечении больных с подозрением или подтверждением отграниченным инфицированным некротическим панкреатитом. Чрескожное дренирование позволит предотвратить 23-50 % некрэктомии у пациентов с инфицированным некротизирующим панкреатитом. Чрескожное дренирование технически возможно в >95% пациентов с инфицированным некрозом. Уменьшение размера жидкостных скоплений на не менее 75% после первых 10-14 дней чрескожным дренированием правильно предсказывает успешное чрескожное лечение. После дренирования, крайне важно, чтобы пациент наблюдался опытным врачом, который в отсутствие клинических улучшение может направить на хирургическую или эндоскопическую некрэктомию. Хотя утверждают, что использование крупнокалиберных дренажей, дает лучшие результаты, убедительные данные отсутствуют. В целом, в настоящее время опыт работы с эндоскопическимя чреспросветным дренированием меньше, чем с чрескожным дренированием. |
| Чрескожное дренирование инфицированного (гнойно- некротического) парапанкреатита. Септическая секвестрация - неотграниченный инфицированный панкреонекроз– инфицирование некроза поджелудочной железы и парапанкреальной клетчатки). | В этот период основную роль играют открытые "традиционные" - дренирующие и санирующие вмешательства. Основным методом санации гнойно-некротических очагов является некрсеквестрэктомия, которая может быть как одномоментной, так и многоэтапной. Малоинвазивные вмешательства должны использоваться по ограниченным показаниям. Открытые вмешательства, в том числе повторные, являются операцией выбора в случаях значительной распространенности процесса, когда применение чрескожных дренирующих вмешательств не дает возможности достичь адекватной санации парапанкреатической и забрюшинной клетчатки (наличие в полости гнойника крупных некротических масс). При наличии большого массива некротических тканей, а также признаках распространенного ретроперитонеонекроза (флегмоны) чрескожные дренирующие вмешательства под УЗИ наведением могут быть использованы только, как временное этапное лечение гнойника с целью стабилизации состояния больного и достижения оптимальных сроков проведения радикального хирургического вмешательства. | Основным методом санации гнойно- некротических очагов является некрсеквестрэктомия, которая может быть как одномоментной, так и многоэтапной, и достигается как минимально инвазивными, так и традиционными методами. При решении вопроса о первичном гнойно- некротического парапанкреатита следует отдавать предпочтение минимально инвазивным вмешательствам (дренирование под УЗ-наведением, ретроперитонеоскопия, минилапаротомия с помощью набора «Мини-ассистент» и др.). Дренирование предпочтительно осуществлять внебрюшинными доступами. | Оптимальная интервенционная стратегия для пациентов с подозреваемым или подтвержденным инфицированием некротического панкреатита является чрескожное (забрюшинное) дренирование или эндоскопическое чреспросветное дренирование, а затем, при необходимости, эндоскопической или хирургической некрсеквестрэктомии. Чрескожное дренирование или эндоскопическое чреспросветное дренирование должны быть первым шагом в лечении больных с подозреваемым или подтвержденным отграниченным инфицированным некротическим панкреатитом. Для пациентов с доказанным или подозреваемым инфицированым некротизирующим панкреатитом, инвазивные вмешательства (т.е. чрескожное дренирование, эндоскопическое чреспросветное дренирование/некрэктомия, минимально инвазивная или открытая некрэктомия) должно быть отложено, где это возможно, по крайней мере до 4 недель после начала заболевания, для отграничения некроза. |
| Секвестрэктомия | Радикальное хирургическое вмешательство - открытая санирующая и дренирующая операция (предпочтительно из внебрюшинного доступа). | При неэффективности минимально инвазивного дренирования операцией выбора является санационная лапаротомия с некрсеквестрэктомией. Оптимальными сроками выполнения первой санационной лапаротомии с некрсеквестрэктомией являются 4-5 недели заболевания. | Даже если начальное чрескожное дренирование проводится рано, некрэктомия не должны поводиться и в идеале должна быть отложена до отграничения скоплений. Сроки для повторных вмешательств (например, повторить чрескожное дренирование, повторить эндоскопическую некрэктомию, или кроссовер в хирургии) должна быть основана на клинических критериях и данных визуализации, и никакие строгие руководящие принципы не могут быть рекомендованы. У пациентов с инфицированным некротическим панкреатитом показали, что повышающий подход чрескожного (забрюшинного) дренирования, а затем, в случае необходимости, малоинвазивная некрэктомия снизилась основные краткосрочные осложнения, такие как впервые выявленной полиорганной недостаточности и долгосрочных осложнений такие как эндокринной недостаточности, и снижение расходов, по сравнению с первичной открытой некрсеквестрэктомией. Дренирование забрюшинно слева может облегчить малоинвазивная забрюшинного некрэктомия. Если катетер дренаж не удается, оптимальный метод некрсеквестрэктомии (т.е. минимально инвазивной или открытая операция или эндоскопическая чреспросветная) остается неясным Минимально инвазивная некрэктомия могут быть связаны со снижением риска осложнений и смерти по сравнению с открытой некрэктомией |
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ ОСТРОГО ПАНКРЕАТИТА
Агрессивная внутривенная гидратация
Анальгетическая и противорвотная терапия
ПЛЮС
Заместительная терапия кальция. В тяжелых случаях панкреатита развивается гипокальциемия, которая должна быть лабораторно установлена. Уровень кальция следует восстановить до нормальных значений ионов кальция в сыворотке крови. По сравнению с хлоридом кальция предпочтение следует отдавать глюконату кальция.
Заместительная терапия магнием. Магний следует восполнять, если идентифицируются низкие его уровни в сыворотке крови, что обычно наблюдается у больных алкоголизмом. При этом следует определять функцию почек (креатинин) перед введением магния.
Основная группа препаратов:
Резервная группа:
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.