Острый миелобластный лейкоз у взрослых
 Версия: Клинические протоколы МЗ РК - 2022 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2022 (Казахстан)
Острый миелоидный лейкоз (C92.0), Хронический миелоидный лейкоз (C92.1)
Онкогематология
Общая информация
Краткое описание
Одобрено
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «09» февраля 2023 года
Протокол №179
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
ОСТРЫЙ МИЕЛОБЛАСТНЫЙ ЛЕЙКОЗ У ВЗРОСЛЫХ
Острый миелобластный лейкоз (миелоидный) – гетерогенное опухолевое заболевание системы крови, характеризующееся клональной экспансией миелобластов в костном мозге, периферической крови и в других тканях и органах.
Код(ы) МКБ-10:
Дата разработки/пересмотра протокола: 2015 г. (пересмотрен в 2018 г.; 2022 г.)
Категория пациентов: взрослые, в том числе беременные.
Шкала уровня доказательности [1]:
Острый миелобластный лейкоз (миелоидный) – гетерогенное опухолевое заболевание системы крови, характеризующееся клональной экспансией миелобластов в костном мозге, периферической крови и в других тканях и органах.
ВВОДНАЯ ЧАСТЬ
Код(ы) МКБ-10:
| МКБ-10 | |
|
Код
|
Название |
| С 92.0 | Острый миелобластный лейкоз |
| С 92.1 | Хронический миелолейкоз (фаза бластного криза) |
|
МКБ-11
|
|
|
XH1B20
|
Острый лейкоз, не уточненный иначе |
| XH37U0 | Острый бифенотипический лейкоз |
| XH2H98 | Острый билинейный лейкоз |
|
XH3VV7
|
Острый лейкоз неопределенного линейного происхождения |
|
XH97B7
|
Острый лейкоз со смешанным фенотипом с t(9;22)(q34;q11.2); BCR-ABL1 |
|
XH2S51
|
Острый лейкоз со смешанным фенотипом с t(v;11q23); MLL реаранжировкой |
|
XH1928
|
Острый лейкоз со смешанным фенотипом, В/миелоидный, не уточненный иначе |
|
XH4YB5
|
Острый лейкоз со смешанным фенотипом, Т/миелоидный, не уточненный иначе |
|
XH43N4
|
Острый эритроидный лейкоз |
| XH4M02 | Острый миелоидный лейкоз с биаллельной мутацией CEBPA |
| XH74W8 | Острый миелидный лейкоз с мутацией NPM1 |
|
XH9Y46
|
Острый миелоидный лейкоз с t(6;9)(p23;q34); DEK-NUP214 |
| XH78Y4 | Острый миеломоноцитарный лейкоз |
|
XH2KE3
|
Острый миелоидный лейкоз с inv(3)(q21;q26.2) или t(3.3)(q21;q26.2); RPN1-EVI1 |
|
XH7MR1
|
Острый базофильный лейкоз |
| XH3PA4 | Острый миелоидный лейкоз с эозинофилией |
| XH90G0 | Острый миелидный лейкоз с минимальной дифференцировкой |
| XH5AH8 | Острый миелоидный лейкоз без созревания |
|
XH1XJ9
|
Острый миелоидный лейкоз с созреванием |
| XH9NE2 | Острый моноцитарный лейкоз |
| XH1K97 | Острый монобластный и моноцитарный лейкоз |
|
XH64R4
|
Острый миелоидный лейкоз с чертами миелоидсплазии |
| XH3CX5 | Острый миелоидный лейкоз, t(8;21)(q22;q22) |
| XH1E41 | Острый миелоидный лейкоз, 11q23 аномалии |
|
XH4750
|
Острый мегакариобластный лейкоз |
|
XH16K4
|
Острый миелоидный лейкоз (мегакариобластный) с t(1;22)(p13;q13); RBM15-MKL1 |
|
XH6Z50
|
Ассоциированный с лечением острый миелоидный лейкоз, связанный с алкилирующими препаратами |
|
XH4EJ0
|
Ассоциированный с лечением острый миелоидный лейкоз, связанный с эпиподофиллотоксином |
|
XH3L40
|
Миелоидная саркома |
| XH1075 | Острый панмиелоз с миелофиброзом |
| XH6FZ7 | Острый миелидный лейкоз с BCR-ABL1 |
| XH1EK4 | Острый миелоидный лейкоз с мутированным RUNX1 |
|
2A60
|
Острые миелоидные лейкозы и родственные опухоли из клеток-предшественников
|
| 2A60.5 | Опухоль из бластных плазмоцитоидных дендритных клеток |
Дата разработки/пересмотра протокола: 2015 г. (пересмотрен в 2018 г.; 2022 г.)
Пользователи протокола: врачи общей практики, терапевты, онкологи, гематологи, акушер – гинекологи.
Категория пациентов: взрослые, в том числе беременные.
Шкала уровня доказательности [1]:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
Классификация
Классификация [3-8]:
1) Острые миелоидные лейкозы (ОМЛ) и родственные новообразования ОМЛ с повторяющимися генетическими аномалиями (≥10% бластов в КМ или ПК) (ВОЗ 2022г)
ОМЛ (промиелоцитарный) с PML-RARA;
ОМЛ с t(8;21)(q22;q22.1); RUNX1-RUNX1T1;
ОМЛ с inv(16)(p13.1q22) или t(16;16)(p13.1;q22); CBFB-MYH11;
ОМЛ с t(9;11)(p21.3;q23.3); MLLT3-KMT2A;
ОМЛ с t(6;9)(p23;q34.1); DEK-NUP214;
ОМЛ с inv(3)(q21.3q26.2) или t(3;3)(q21.3;q26.2); GATA2, MECOM;
ОМЛ (мегакариобластный) с t(1;22)(p13.3;q13.3); RBM15-MKL1;
ОМЛ с t(9;22)(q34.1;q11.2)/ BCR-ABL1;
ОМЛ с мутированным NPM1;
ОМЛ с другими редкими повторяющимися транслокациями;
ОМЛ с мутацией внутри bZIP CEBPA.
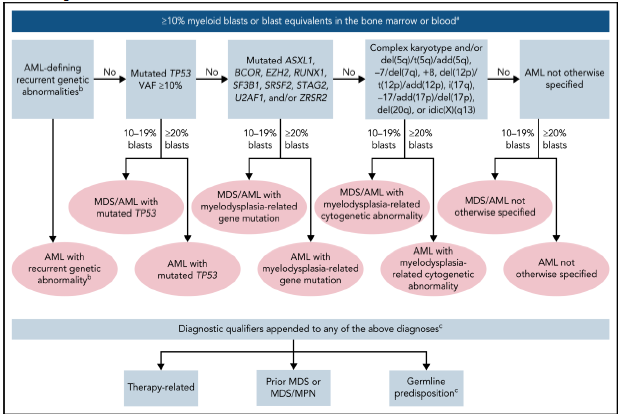
2) ОМЛ (≥20% бластов в КМ или ПК) или МДС/ОМЛ (10-19% бластов в КМ или ПК):
ОМЛ с мутацией TP53;
ОМЛ с генными мутациями, связанными с миелодисплазией Определяетсямутациями в ASXL1 , BCOR , EZH2 , RUNX1 , SF3B1 , SRSF2 , STAG2 , U2AF1 и/или ZRSR2
ОМЛ с цитогенетическими аномалиями, связанными с миелодисплазией
ОМЛ не классифицированный
3) Миелоидная саркома;
4) Миелоидные пролиферации, связанные с синдромом Дауна:
Преходящий аномальный миелопоэз, ассоциированный с синдромом Дауна;
Миелоидный лейкоз, ассоциированный с синдромом Дауна.
5) Новообразование из бластных плазмоцитоидных дендритных клеток
6) Острые лейкозы (ОЛ) неопределенного линейного происхождения
Острый недифференцированный лейкоз
Острый лейкоз с t(9;22)(q34.1;q11.2) BCR-ABL1+
Острый лейкоз с t(v;11q23.3); с перестройкой KMT2A
Острый лейкоз со смешанным фенотипом В/миелоидный неуточненный
Острый лейкоз со смешанным фенотипом Т/миелоидный неуточненный
Молекулярно-генетическая стратификация пациентов по группам риска ELN 2022 [9 – 12]
|
Генетическая группа
|
Подгруппы |
| Благоприятная |
t(8;21)(q22;q22.1); RUNX1-RUNX1T1
inv(16)(p13.1q22) или t(16;16)(p13.1;q22); CBFB-MYH11
Мутация NPM1 без FLT3-ITD
bZIP с мутацией внутри CEBPA
|
| Промежуточная |
Мутация NPM1 с FLT3-ITD
Дикий тип NPM1 с FLT3-ITD (без генетических повреждений, относящихся к неблагоприятным)
t(9;11)(p21.3;q23.3); MLLT3-KMT2A
Цитогенетические аномалии и/или, не классифицируемые как благоприятные или неблагоприятные
|
| Неблагоприятная |
t(6;9)(p23;q34.1); DEK-NUP214
t(v;11q23.3); KMT2A реаранжировка
t(9;22)(q34.1;q11.2); BCR-ABL1
t(8;16)(p11.2;p13.3)/KAT6A::CREBBP
inv(3)(q21.3q26.2) или t(3;3)(q21.3;q26.2); GATA2, MECOM (EVI1)
t(3q26.2;v)/MECOM(EVI1) реанжировка
-5 или del(5q); -7; -17/abn(17p)
Комплексный кариотип; моносомный кариотип
Мутация ASXL1, BCOR, EZH2, RUNX1, SF3B1, SRSF2, STAG2, U2AF1, and/or ZRSR2
Мутация TP53
|
Иерархическая классификация Международной согласованной классификации ОМЛ ELN 2022
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ [2,6,7,13-18,20]
Диагностические критерии
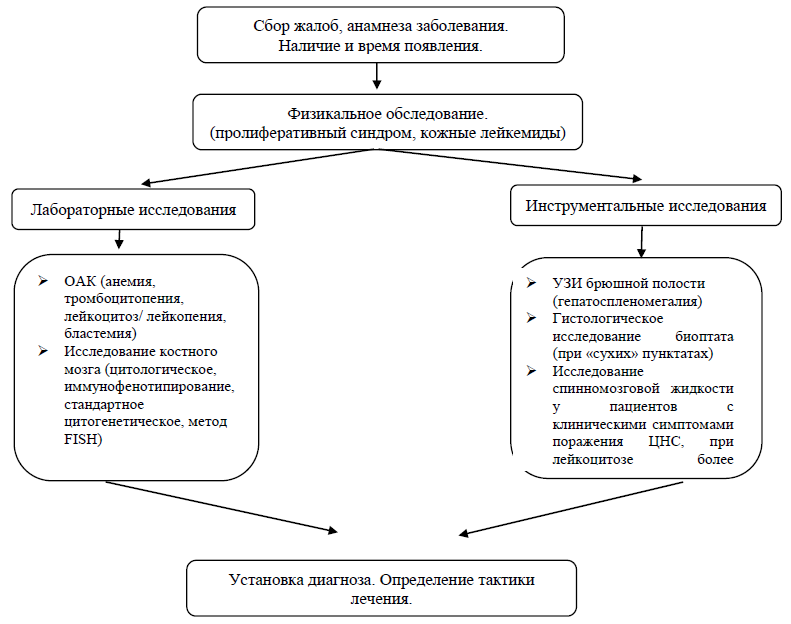
Жалобы и анамнез:
В ряде случаев у пациентов в течение нескольких месяцев до обращения может наблюдаться немотивированная слабость. Геморрагический синдром в виде петехий, кровоточивости десен, рецидивирующих носовых кровотечений, гиперполименорреи. При остром миеломонобластном лейкозе и остром миелобластном лейкозе характерна гиперплазия десен и пациенты могут первоначально обращаться к стоматологу [2].
Пациенты с ОМЛ обычно имеют симптомы, связанные с осложнениями панцитопении (например, анемия, нейтропения и тромбоцитопения), включая слабость и быструю утомляемость, инфекции различной степени тяжести и/или геморрагические признаки, такие как кровоточивость десен, экхимозы, носовое кровотечение. или меноррагии. Часто встречаются сочетания этих симптомов. Как правило, трудно точно датировать начало ОМЛ.
Физикальное обследование [13]: признаки пролиферативного синдрома (спленомегалия, увеличение лимфатических узлов), кожные лейкемиды. Лейкемиды выявляются в 13% случаев и имеют вид узлов c измененным цветом кожи над ними. В остальном проявления малоспецифичены и включают симптомы, связанные с анемией и тромбоцитопенией. [13]
ОАМ: при выраженном геморрагическом синдроме может наблюдаться гематурия.
Исследование костного мозга: миелоидная направленность бластов подтверждается на основании следующих признаков:
Экспрессия клеточно-поверхностных и цитоплазматических маркеров для диагностики ОМЛ и лейкоза со смешанным фенотипом (ELN 2022)
Пересмотренная шкала EGIL для бифенотипических острых лейкозов.
молекулярно-генетическое исследование выявляет генетические аномалии, такие как FLT3, NMP1, KIT, CEBPA, MLL имеющие прогностическое значение и позволяющие проводить мониторинг минимальной остаточной болезни. [17]
Лабораторные исследования [6,7,14-18]:
ОАК: как правило, выявляется нормохромная, нормоцитарная анемия различной степени тяжести. Количество ретикулоцитов в пределах нормы или снижено. Примерно у 75% пациентов имеется тромбоцитопения. Средний уровень лейкоцитов на этапе установления диагноза около 15х109/л. 20% пациентов имеют лейкоцитоз более 100х109/л. У 25-40% пациентов уровень лейкоцитов не превышает 5х109/л. В 95% случаев при цитологическом исследовании периферической крови выявляют циркулирующие бласты [14].
ОАМ: при выраженном геморрагическом синдроме может наблюдаться гематурия.
Исследование костного мозга: миелоидная направленность бластов подтверждается на основании следующих признаков:
- палочки Ауэра по данным световой микроскопии;
- по данным цитохимического исследования позитивная реакция на Судан черный В, миелопероксидазу, хлорацетатэстеразу или неспецифическую эстеразу; [6,7]
- по данным проточной цитометрии идентифицируется экспрессия миелоидных антигенов на бластных клетках. В 20% случаев ОМЛ имеется коэкспрессия лимфоидных маркеров (например, CD7, CD19, CD2). «Истинный» лейкоз со смешанным фенотипом (бифенотипический, билинейный) встречается редко (в 2-5% случаев) и диагностируется на основе оценки балов по шкале Европейской группы по иммунологической характеристике лейкемий (EGIL). [15].
Иммунофенотипирование с помощью многопараметрической проточной цитометрии (MFC) необходимо для точной диагностики ОМЛ путем идентификации маркеров на поверхности и внутри клеток. Из-за гетерогенности ОМЛ ни один маркер не экспрессируется во всех случаях. Также важно идентифицировать ассоциированные с лейкемией иммунофенотипы (LAIP) для последующего мониторинга минимальной остаточной болезни (МОБ) с помощью MFC. Роль оценки МОБ при ОМЛ и использованием MFC в настоящее время продолжает изучаться в рамках клинических исследований. В случаях, когда невозможно получить аспират и отсутствуют циркулирующие бласты, миелоидный фенотип может быть подтвержден при гистологическом исследовании костного мозга и иммуногистохимии.
Экспрессия клеточно-поверхностных и цитоплазматических маркеров для диагностики ОМЛ и лейкоза со смешанным фенотипом (ELN 2022)
| Диагностика ОМЛ | |
| Маркеры клеток -предшественников | CD34, CD117, HLA-DR |
| Миелоидные маркеры | Цитоплазматическая МПО, CD33, CD13 |
| Маркеры миелоидного созревания | CD11b, CD15, CD64, CD65 |
| Моноцитарные маркеры | CD14, CD36, CD64, CD4, CD38, CD11c |
| Мегакариоцитарные маркеры | CD41 (гликопротеин IIb/IIIa), CD61 (гликопротеин IIIa), CD36 |
| Эритроидные маркеры | CD235a (гликофорин А), CD71, CD36 |
| Диагностика лейкоза со смешанным фенотипом | |
| Миелоидная линия | МПО (проточная цитометрия, иммуногистохимия или цитохимия) или моноцитарная дифференцировка (как минимум 2 из следующих: неспецифическая эстераза по данным цитохимии, CD11c, CD14, CD64, лизоцим) или как минимум два миелоидных маркера, т. е. CD177, CD33, CD13 |
| Т-линия | яркий цитоплазматический CD3 (с антителами к ε-цепи CD3) или поверхностный CD3 |
| B-линия g | яркий CD19 с по крайней мере одним из следующих ярко выраженных: цитоплазматический CD79a, cCD22 или CD10, или слабый CD19 с по крайней мере двумя из следующих ярко выраженных: CD79a, cCD22 или CD10 |
| Основные маркеры МОБ | |
| CD34, CD117, CD45, CD33, CD13, CD56, CD7, HLA-DR Если моноцитарные: CD64, CD11b, CD4 (дополнительно) | |
Пересмотренная шкала EGIL для бифенотипических острых лейкозов.
|
Баллы
|
В-линейные | Т-линейные | Миелоидная линия |
| 2 |
СD79a
|
CD3 (cyt/m) | Anti-MPO |
|
cytIgM
|
Anti-TCR α/β | Anti-Lysocyme | |
| cytCD22 | Anti-TCR γ/δ | ||
| 1 |
CD19
|
CD2 | CD13 |
|
CD10
|
CD5 | CD33 | |
|
CD20
|
CD8 | CDw65 | |
|
CD10
|
CD117 | ||
| 0,5 |
TdT
|
TdT | CD14 |
|
CD24
|
CD7 | CD15 | |
|
CD1a
|
CD64 | ||
| Для установления диагноза бифенотипического лейкоза необходимо не менее 2 баллов по двум линиям | |||
- стандартное цитогенетическое исследование и исследование методом FISH позволяет выявить маркеры благоприятного прогноза (t(8;21)/RUNX1/AML1; inv(16)/CBFB/MYH11) и прогностически неблагоприятные маркеры (моносомальный кариотип, t(9;11)/MLL, комплексные хромосомные абберации и др.) в связи с чем, должно проводиться всем пациентам до начала химиотерапии. Около 50% пациентов имеют те или иные цитогенетические аномалии. [16]
молекулярно-генетическое исследование выявляет генетические аномалии, такие как FLT3, NMP1, KIT, CEBPA, MLL имеющие прогностическое значение и позволяющие проводить мониторинг минимальной остаточной болезни. [17]
Цитогенетические маркеры необходимо определять в течение первых 5 – 7 дней от момента установления диагноза. Генетические мутации NPM1 и FLT3 необходимо определять в течение 48 – 72 часов (как минимум, у пациентов, являющихся кандидатами для проведения интенсивной химиотерапии и ТКМ), и другие генетические маркеры – в течение первого индукционного цикла. [18]
Рекомендуется всем пациентам при первичной диагностике ОЛ, а также при обследовании по поводу диагностированного рецидива ОМЛ, в случае выявления при стандартном цитогенетическом исследовании костного мозга или FISH- исследовании транслокации t(8;21) или инверсии 16, выполнить молекулярно-генетические исследования мутаций в гене RUNX1-RUNX1T1 или в гене CBFB-MYH11 методом ПЦР. Всем пациентам при первичной диагностике, а также в момент рецидива ОМЛ или констатации рефрактерного течения заболевания необходимо определение мутаций в гене FLT3 методом ПЦР или секвенирования. Перечисленные исследования выполняются на аспирате костного мозга для стратификации пациентов по группам риска и определения тактики лечения, а также в целях выявления маркера для мониторинга динамики опухолевого клона на фоне терапии. В случае невозможности забора образца костного мозга допускается определение мутаций в гене FLT3 на материале периферической крови пациента
- Скрининг генных мутаций для определения тактики терапии
- FLT3, IDH1, IDH2 NPM1 CEBPA, DDX41, TP53; ASXL1, BCOR, EZH2, RUNX1, SF3B1, SRSF2, STAG2, U2AF1, ZRSR2
Комментарий: качественное определение наличия мутаций в гене FLT3 необходимо проводить как при постановке диагноза ОМЛ, так и при констатации рефрактерности к предыдущему лечению или при развитии рецидива, т.к. в ходе течения заболевания статус мутации может меняться.
Рекомендуется всем пациентам при первичной диагностике ОЛ, а также при обследовании по поводу диагностированного рецидива ОМЛ, в случае выявления при стандартном цитогенетическом исследовании костного мозга или FISH- исследовании транслокации t(8;21) или инверсии 16, выполнить молекулярно-генетические исследования мутаций в гене RUNX1-RUNX1T1 или в гене CBFB-MYH11 методом ПЦР. Всем пациентам при первичной диагностике, а также в момент рецидива ОМЛ или констатации рефрактерного течения заболевания необходимо определение мутаций в гене FLT3 методом ПЦР или секвенирования. Перечисленные исследования выполняются на аспирате костного мозга для стратификации пациентов по группам риска и определения тактики лечения, а также в целях выявления маркера для мониторинга динамики опухолевого клона на фоне терапии. В случае невозможности забора образца костного мозга допускается определение мутаций в гене FLT3 на материале периферической крови пациента
- Скрининг генных мутаций для определения тактики терапии
- FLT3, IDH1, IDH2 NPM1 CEBPA, DDX41, TP53; ASXL1, BCOR, EZH2, RUNX1, SF3B1, SRSF2, STAG2, U2AF1, ZRSR2
Комментарий: качественное определение наличия мутаций в гене FLT3 необходимо проводить как при постановке диагноза ОМЛ, так и при констатации рефрактерности к предыдущему лечению или при развитии рецидива, т.к. в ходе течения заболевания статус мутации может меняться.
- Скрининг генных перестроек
PML::RARA, CBFB::MYH11, RUNX1::RUNX1T1, KMT2A реанжировки, BCR::ABL1, и др. (если доступны)
- Дополнительные гены, рекомендуемые для тестирования
ANKRD26, BCORL1, BRAF, CBL, CSF3R, DNMT3A, ETV6, GATA2, JAK2, KIT, KRAS, NRAS, NF1, PHF6, PPM1D, PTPN11, RAD21, SETBP1, TET2, WT1
PML::RARA, CBFB::MYH11, RUNX1::RUNX1T1, KMT2A реанжировки, BCR::ABL1, и др. (если доступны)
- Дополнительные гены, рекомендуемые для тестирования
ANKRD26, BCORL1, BRAF, CBL, CSF3R, DNMT3A, ETV6, GATA2, JAK2, KIT, KRAS, NRAS, NF1, PHF6, PPM1D, PTPN11, RAD21, SETBP1, TET2, WT1
- Если в лечебном учреждении определение данных молекулярных аномалий невозможно, необходимо сохранить материал исходного диагностического образца для возможного его молекулярного анализа в другой лаборатории после получения полных цитогенетических данных.
Инструментальные исследования:
УЗИ органов брюшной полости – выявление увеличения размеров печени, селезенки;
КТ грудного сегмента – выявление инфильтративных изменений легочной ткани;
ЭКГ – выявление нарушения проводимости импульсов в сердечной мышце;
ЭхоКГ – оценка функционального состояния сердечной мышцы;
ФГДС – оценка состояния слизистой оболочки пищевода, желудка, двенадцатиперстной кишки, обнаружение источника кровотечения
Бронхоскопия – оценка состояния слизистой оболочки трахеи, бронхов, обнаружение источника кровотечения
Показания для консультации специалистов: по показаниям.
Диагностический алгоритм:
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований [14, 19]:
|
Диагноз
|
Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Миелодиспластический синдром с избытком бластов |
Цитопения в ОАК
Количество бластов в ОАК до 19%
|
Цитологическое исследование костного мозга
ИФТ костного мозга на проточном цитофлюориметре (панель острых лейкозов)
Гистологическое исследование костного мозга
|
Количество бластов в костном мозге 5-19%, то есть не превышает 20%
Дисмиелопоэз
|
| Хронический миелолейкоз в фазе акселерации/бластного криза |
Уровень лейкоцитов > 10×109/л
Бластные клетки в периферической крови или костном мозге
|
Цитологическое
Цитогенетическое исследование костного мозга
Исследование костного мозга методом FISH (t (9;22) BCR/ABL)
|
Наличие всех переходных форм гранулоцитарного ряда
Отсутствует «лейкемический» провал
Нейтрофильный лейкоцитоз со сдвигом влево до бластов
Костный мозг гиперклеточный, гиперплазия эритроидного ростка
Увеличение количества лейкоцитов, размеров селезенки несмотря на проводимую терапию
Выявляется t(9;22) и/или химерный ген BCR/ABL
|
| Хронические миелопролиферативные заболевания |
Лейкоцитоз (количество лейкоцитов ≥11 × 109 /л) Пальпируемая спленомегалия Повышение уровня ЛДГ |
Цитологическое исследование костного мозга
Гистологическое исследование костного мозга
Молекулярно-генетическое исследование периферической крови
Стандартное цитогенетическое исследование костного мозга
|
Пролиферация и атипия мегакариоцитов, сочетающаяся с ретикулиновым /или коллагеновым фиброзом костного мозга; при отсутствии выраженного ретикулинового фиброза – повышенная клеточность костного мозга с пролиферацией клеток гранулоцитарного ряда и угнетением эритропоза
Дисплазия в 1 или более миелоидных ростках
Наличие мутаций JAK2, CALR или MPL
|
| Бифенотипический острый лейкоз |
Смешанный иммунофенотип популяции бластных клеток
Коэкспрессия лимфоидных маркеров
|
Цитологическое исследование костного мозга
ИФТ костного мозга на проточном цитофлюориметре (панель острых лейкозов)
|
Оценка баллов по шкале ВОЗ, Европейской группы иммунологической характеристики лейкемий (EGIL). |
Критерии диагностики острых лейкозов со смешанным фенотипом в соответствии с классификацией ВОЗ [20]
|
Миелоидная линия
MPO (проточная цитометрия, иммуногистохимия*, цитохимия) или моноцитоидная дифференцировка (по крайней мере 2 из перечисленных: α-нафтилацетатэстераза, ингибируемая натрия фторидом, CD11c, CD14, CD64, лизоцим)
|
|
Т-лимфоидная линия
Цитоплазматический CD3 (цитофлуориметрически с помощью антитела к ε-цепи CD3; иммуногистохимически (для исследования материала трепанобиопсии костного мозга) с помощью неспецифического поликлонального анти-CD3) или поверхностный CD3 (редко используется для диагностики острого лейкоза смешанного фенотипа)
|
|
В-лимфоидная линия
Яркая экспрессия CD19 + один из следующих маркеров: CD79a, cytCD22, CD10; или слабая экспрессия CD19 + яркая экспрессия по крайней мере двух из перечисленных маркеров: CD79a, cytCD22, CD10
|
Дополнительные исследования
Исследование спинномозговой жидкости у пациентов с клиническими симптомами поражения ЦНС, при лейкоцитозе более 30*109/л
Гистологическое исследование биоптата (гребень подвздошной кости) – при получении «сухих» пунктатов
КТ и/или ЯМРТ грудного сегмента, брюшного сегмента, головы, малого таза (по показаниям) - оценка размеров, структуры инфильтрированных органов, наличие образований и свободной жидкости
Биохимический анализ крови (глюкоза, натрий, калий, кальций, креатинин, аспартат аминотрансфераза, аланин аминотрансфераза, щелочная фосфатаза, лактатдегидрогеназа, билирубина, мочевины, общий белок, мочевая кислота, креатинин).
Коагуляционные тесты: протромбиновое время, международное нормализованное отношение, активированное частичное тромбопластиновое время.)
Исследование спинномозговой жидкости у пациентов с клиническими симптомами поражения ЦНС, при лейкоцитозе более 30*109/л
Гистологическое исследование биоптата (гребень подвздошной кости) – при получении «сухих» пунктатов
КТ и/или ЯМРТ грудного сегмента, брюшного сегмента, головы, малого таза (по показаниям) - оценка размеров, структуры инфильтрированных органов, наличие образований и свободной жидкости
Биохимический анализ крови (глюкоза, натрий, калий, кальций, креатинин, аспартат аминотрансфераза, аланин аминотрансфераза, щелочная фосфатаза, лактатдегидрогеназа, билирубина, мочевины, общий белок, мочевая кислота, креатинин).
Коагуляционные тесты: протромбиновое время, международное нормализованное отношение, активированное частичное тромбопластиновое время.)
ПЦР на вирусные инфекции (вирусные гепатиты, цитомегаловирус, вирус простого герпеса, вирус Эпштейна-Барр, вирус Varicella/Zoster) ВИЧ.
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ [9,21-26]:
I этап: для первичных пациентов – выявление заболевания, госпитализация в профильное отделение.
Немедикаментозное лечение
II этап: для пациентов с установленным диагнозом поддерживающая химиотерапия может проводиться в амбулаторных условиях, контроль показателей общего анализа крови (лейкоформула + тромбоциты) каждые 1 – 3 месяца в течение 2-х лет, затем каждые 3 – 6 месяцев до 5 лет.
Немедикаментозное лечение
Режим: общеохранительный
Диета: стол №15 (общая).
Медикаментозное лечение:
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
|
Фармакотерапевтическая группа
|
Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Антинеопластические и иммуносупрессивные лекарственные средства | Цитарабин |
Курсы: 5+ЦФ
5+6-МП
100 мг/м2 2 раза в день каждые 12 часов 1-5 дни
Внутривенное, подкожное введение
|
В |
| Циклофосфамид |
Курс: 5+ЦФ
650 мг/м2 в 1-й день курса
Внутривенное введение
|
В | |
| Меркаптопурин |
60 мг/м2 в день в 1-5 дни
Внутрь
|
В | |
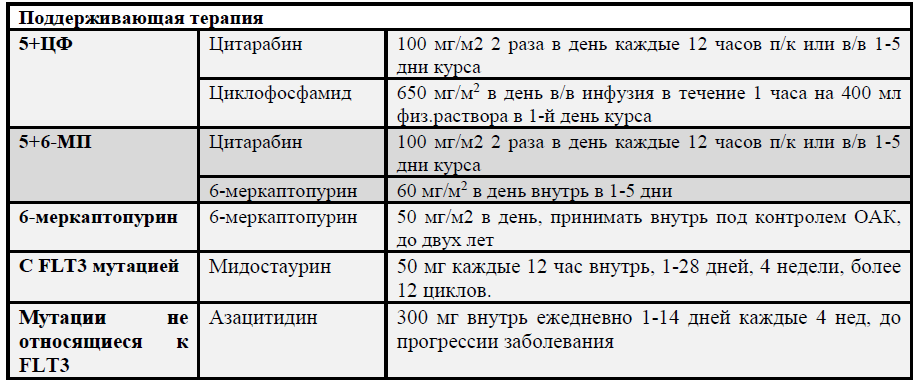
| *Мидостаурин | 50 мг каждые 12 часов Внутрь. 1-28 дней, 4 недели, более 12 циклов. | В | |
| Ингибиторы гипометилирования | Децитабин | 20 мг/м2 1—5-й дни каждые 4 недели Подкожное, внутривенное введение | В |
| Азацитидин |
300 мг ежедневно 1-14 дней каждые 4 недели
Внутрь
|
В | |
| Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов | Ондансетрон |
8–12 мг внутривенное введение
16–24 мг внутрь
|
С |
| Трамадол |
50-100мг внутривенное введение
50-100мг внутрь
|
А | |
| Аллопуринол | 10 мг/кг/сут внутрь | С |
*В соответствии с правилами применения незарегистрированных ЛС.
NB! Дополнительное медикаментозное лечение проводится соответственно протоколам лечения развившихся осложнений.
Хирургическое вмешательство: нет.
Дальнейшее ведение:
после завершения лечения согласно протоколу, пациенты в течение 2х лет получают поддерживающую терапию. При условии сохранения ремиссии заболевания, после окончания поддерживающей терапии, пациенты находятся на динамическом наблюдении и наблюдаются у гематолога по месту жительства в течение 5 лет.
Индикаторы эффективности лечения [9,21-26]:
Критерии ремиссии [21-23]:
Полная ремиссия (СR).
Бласты костного мозга < 5%; отсутствие циркулирующих бластов; отсутствие экстрамедуллярного заболевания; абсолютное количество нейтрофилов ≥ 1,0 × 109/л (1000/мкл); количество тромбоцитов ≥ 100 × 109/л (100 000/мкл)
Полная ремиссия с неполным восстановлением периферической крови (CRi)
Все критерии полного ответа, кроме остаточной нейтропении <1,0 × 109/л (1000/мкл) или тромбоцитопении <100 × 109/л (100 000/мкл)
Нет ответа
Пациенты, поддающиеся оценке ответа, но не соответствующие критериям ответа, классифицируются как не имеющие ответа. Пациенты, не достигшие ответа, определяются как имеющие рефрактерное заболевание.
Рецидив заболевания
Рефрактерность заболевания [9]
Отсутствие CR или CRi, т. е. после 2 курсов интенсивной индукционной терапии (7+3 или интенсивнее).
Рецидив заболевания
Бласты костного мозга ≥ 5%; или повторное появление бластов в крови как минимум в 2 образцах периферической крови с интервалом не менее одной недели; или развитие экстрамедуллярного заболевания.
Минимальная остаточная болезнь [24-26]
Оценка МОБ при ОМЛ используется для установления статуса ремиссии; оценки риска рецидива после ремиссии; определения развития рецидива. В настоящее время двумя наиболее используемыми методами являются МОБ на основе многопараметрической проточной цитометрии (MFC-МОБ) и молекулярная MRD (Mol-МОБ), оцениваемые с помощью qПЦР. [25]
Новые методы исследования — это секвенирование следующего поколения (NGS) и dПЦР. [26]
|
Метод определения
|
Мишень | Чувствительность |
| Многопараметрическая проточная цитометрия (MFC) | Иммунофенотип, ассоциированный с лейкозом (LAIP), или отличный от нормального (DfN) | 10−3 до 10−4 |
| Количественная ПЦР в реальном времени (RT-qPCR) | NPM1, CBFB::MYH11, RUNX1::RUNX1T1 KMT2A::MLLT3, DEK::NUP214, BCR::ABL1, WT1 | 10−4 до 10−5 |
| Секвенирование следующего поколения (NGS) | Потенциально любая соматическая мутация. Пороговое значение NGS-МОБ для отдельных мутаций не определено; Позитивность NGS-МОБ условно определяется как частота вариантных аллелей ≥ 0,1% | 10−2 до 10−4 |
| Цифровая ПЦР (dПЦР) | Специфические таргетные мутации | 10−3 до 10−4 |
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ [27-32]
Карта наблюдения пациента, маршрутизация пациента: см. Приложение 1.
Индукция ремиссии [27, 28]
Общепринятым режимом индукции ремиссии у пациентов всех возрастов является схема 7+3 (антрациклины и цитарабин). Альтернативным вариантом является FLAG-IDA (флударабин, цитарабин, гранулоцитарный колониестимулирующий фактор и идарубицином). Стандартом также является включение ингибитор киназы мидостаурин в терапии первой линии для пациентов с FLT3-мутантным ОМЛ. Мидостаурин улучшил 4-летнюю ОВ на 7,1%, с 44,3 до 51,4% при использовании в индукции даунорубицин-цитарабин и высокие дозы цитарабина в консолидации у пациентов в возрасте от 18 до 59 лет.
После трёх дней введения антрациклинов и 7 дней введения цитарабина полная ремиссия достигается у 60-80% более молодых пациентов и у 40-60% более пожилых пациентов (60 лет и старше) (УД –А) [29]
Применение даунорубицина в дозе 45 мг/м2 в течение 3-х дней ассоциируется с низкой частотой достижения полных ремиссий и более высокой частотой рецидивов вводимого в режиме одного цикла индукции. [30, 31] У пациентов в возрасте 60-65 лет повышение дозы даунорубицина до 90 мг/м2 сопровождается повышением вероятности достижения ремиссии после первого курса, но не влияет на общую выживаемость. [30, 32]
Имеющиеся в настоящее время доказательства позволяют рекомендовать даунорубицин для проведения индукции в режиме «7+3» в дозе не ниже 60 мг/м2 (УД – А).
Показатели достижения полной ремиссии при применении идарубицина в дозе 12мг/м2 в течение 3 дней, находятся в диапазоне 60-70% у пациентов в возрасте моложе 50 лет. Как высокая доза даунорубицина, так и идарубицина приводит к 5-летней выживаемости от 40% до 50%. [33]
Для более пожилых пациентов (старше 60 лет) с плохим соматическим статусом, которым не может быть выполнена интенсивная терапия, выбор средств альтернативной терапии достаточно ограничен и включает паллиативную помощь, терапию низкой интенсивности, или клинические исследования с применением новых препаратов. К терапии низкой интенсивности относятся малые дозы Ara-C или гипометилирующие препараты. Малые дозы цитарабина обычно хорошо переносится и приводит к полной ремиссии в 15–25% случаев, хотя общая непродолжительная выживаемость (медиана 5–6 месяцев) считается неудовлетворительным результатом. Лечение гипометилирующими препаратами увеличивает общую выживаемость при применении децитабина по сравнению с низкодозным цитарабином (7.7 против 5.0 месяцев). [34] Азацитидин при сравнении с тремя общепринятыми режимами химиотерапии у пациентов старше 65 лет с количеством бластов более 30% и показал продление выживаемости (медиана выживаемости, 10.4 против 6.5 месяцев). Применение азацитидина может иметь особые преимущества в группе с генетикой неблагоприятного риска. Превосходство азацитидина над общепринятой терапией ранее было показано при остром миелобластном лейкозе с количеством бластных клеток 20–30%. (УД – А) [34]
Рефрактерные формы заболевания. Первично рефрактерные или резистентные формы ОМЛ, когда не удается достичь полной ремиссии (после 1 – 2 курсов интенсивной индукционной терапии) встречаются в 10% - 40% от общего числа пациентов. В настоящее время не определены высокоэффективные и стандартизованные режимы химиотерапии данных форм ОМЛ. В данных случаях необходимо оценить возможность проведения ТГСК, своевременное проведение HLA-типирования пациента, потенциальных доноров, оценить все характеристические показатели пациента, его возраст, общее состояние, наличие сопутствующих заболеваний, результаты цитогенетического, молекулярно-генетического исследования и предпочтения самого пациента. В качестве режима терапии применяется курс FLA-IDA, HAM. При условии наличия аллогенного донора, определяется стратегия терапии пациента в качестве «моста к трансплантации» с целью достижения ремиссии основного заболевания, так как наиболее значимым фактором перед проведением аллогенной ТГСК является статус заболевания. Достижение полной ремиссии после режима FLAG-IDA в 30 – 50% случаев с возможностью дальнейшего проведения ТГКСК по сравнению со стандартными режима индукции. [35]
Для терапии рефрактерных форм и рецидивов у пациентов с мутациями гена FLT3 рекомендуется использовать ингибитор протеинкиназ *гилтеритиниб (120 мг в сутки в 1 прием) либо в монотерапии, либо в комбинации с цитостатическим воздействием до развития непереносимой токсичности или прогрессирования заболевания. Гилтеритиниб улучшает частоту ответа до 21,1% и медиану общей выживаемости до 9,3 месяцев. 109,150
Комментарий: ответ на лечение может иметь отсроченный характер, то есть при использовании препарата в назначенной дозе до получения клинического ответа может пройти до 6 месяцев. При отсутствии ответа на лечение через 4 недели терапии доза может быть увеличена до 200 мг в сутки в один прием. При достижении второй ремиссии и невозможности проведения ТКМ терапия должна быть продолжена на протяжении 2 х лет. У пациентов, перенесших трансплантацию гемопоэтических стволовых клеток, лечение гилтеритинибом может быть возобновлено после восстановления донорского кроветворения. Прием гилтеритиниба рекомендуется продолжать в течение 2х лет. В случае развития осложнений суточная доза гилтеритиниба может быть снижена с 120 мг до 80 мг или с 200 мг до 120 мг. Прервать лечение гилтеритинибом при появлении связанных с его использованием симптомов токсичности 3 или более степени. При разрешении токсических явлений или улучшении их до степени тяжести 1 возобновить использование препарата в меньшей дозе.
Консолидация ремиссии
Стратегия постремиссионной терапии включает в себя интенсивную и высокодозную терапию, за которой следуют преимущественно аллогенная или аутологичная трансплантация костного мозга [36].
Режимы консолидации включают в себя монотерапию цитарабином или многокомпонентную химиотерапию, которые приводят к одинаковым результатам. После достижения полной ремиссии пациентам проводится консолидация с режимами, которые включают цитарабин в средней дозе. Введение до 3-х курсов высокодозного цитарабина (HiDAC; 2000-3000 мг/м2) широко применяется в рутинной клинической практике. В настоящее время отсутствуют убедительные доказательства более высокой эффективности высокодозного цитарабина 3000 мг/м2 по сравнению с цитарабином в промежуточной дозе 1000 – 1500 мг/м2 в монотерапии или в комбинации с антрациклинами. [37, 39] Также отсутствуют четкие данные о преимуществах усиленной консолидации у пациентов из группы высокого риска, особенно у пожилых пациентов. [38]
Более ранняя алло-ТКМ от совместимого донора, родственного или неродственного, в настоящее время является терапией выбора для пациентов из группы неблагоприятного риска в первой ремиссии. Проведение ТКМ позволяет статистически значимо улучшить долгосрочные результаты (общую и безрецидивную выживаемость).
Именно для пациентов группы высокого риска крайне важно соблюдать рекомендации по HLA-типированию пациента до начала первого индукционного курса, а после достижения первой полной ремиссии - начало поиска потенциальных доноров.
Оптимальными курсами консолидации у пациентов ОМЛ в возрасте моложе 60 лет после 1-2 курсов индукции являются 2 - 4 курса консолидации цитарабином (IDAC). [30, 31] Если по организационным причинам нет возможности выполнить консолидацию проведением курсов IDAC, как дополнительный вариант может рассматриваться выполнение еще двух курсов 7+3 с идарубицином или митоксантроном в индукционных дозах (УД – С).
Для пациентов с неблагоприятным риском в первой ремиссии необходима оценка МОБ для выбора тактики лечения консолидации. Пациенты с предполагаемым риском рецидива, превышающим 35-40%, консолидация с аллогенной ТКМ остается предпочтительным вариантом после ремиссии, сюда относятся также пациенты с ОМЛ неблагоприятного риска или с персистирующей МОБ. [40]
Таким образом, у пациентов из группы высокого и промежуточного риска при отсутствии возможности аллогенной трансплантации ГСК выполняется консолидация не менее, чем двумя курсами. В большинстве случаев, за исключением пациентов молодого возраста с нормальным кариотипом и без дополнительных молекулярных маркеров плохого прогноза могут использоваться режимы со стандартными дозами. [36]
Проведение постремиссионной терапии у пожилых пациентов определяется индивидуально в зависимости от общего состояния и коморбидного статуса и варьируется от аллогенной транспланатации ГСК с кондиционированием пониженной интенсивности до проведения паллиативной терапии или адекватного ухода без специфического лечения.
Поддерживающая терапия
Поддерживающая терапия имеет значение у пациентов в возрасте старше 55-60 лет, которые не являются кандидатами на аллоТКМ и получают терапию низкой интенсивности и у пациентов с FLT3 позитивным ОМЛ, получающих терапию мидастаурином в случае, если аллоТКМ по каким-либо причинам не может быть выполнена.
Основной целью поддерживающей терапии является проведение минимально токсичной терапии, способной снизить риск развития рецидива. [42] Пероральный азацитидин рекомендуется в течение 14 дней в 28-дневных циклах после достижения ремиссии для снижения риска рецидива среди пациентов старше 55 лет не кандидатов на аллогенную ТКМ. [43] Пероральный азацитидин продлевает ОВ независимо от статуса МОБ. [44] Пероральный азацитидин одобрен для продолжения лечения пациентов с ОМЛ в первой полной ремиссии после интенсивной индукционной химиотерапии, которым невозможно проведение интенсивной терапии, в том числе аллогенной ТКМ.
Пациенты, получавшие мидостаурин во время индукции и консолидации, могут продолжать прием этих препаратов в соответствии с фазой 3. [45]

Пациенты, не подходящие для интенсивной терапии.
Существенный прогресс достигнут в лечении пациентов, признанных непригодными для интенсивной химиотерапии (пожилые или неподходящие для интенсивной терапии пациенты с ОМЛ). [46] По сравнению с одним азацитидином добавление ингибитора BCL2 венетоклакс улучшает клинический ответ. [47, 48] Для пациентов, которые не могут получать гипометилирующие агенты (HMA), низкие дозы цитарабина (LDC) в сочетании с венетоклаксом представляют собой альтернативный вариант лечения. У пациентов, получающих комбинированную терапию на основе гипометилирующих агентов с венетоклакс, ответ следует оценить в начале первого цикла (на 14-21 день) и необходимости перенести или изменить дозировку при стойкой цитопении в костном мозге. Вторая оценка обычно проводится после 3 циклов, а затем повторять каждые 3 цикла для пациентов в стадии ремиссии. [49]
Рецидив или рефрактерность
Повторное молекулярное исследование очень важно при рецидиве для определения таргетных вариантов терапии. Пациенты, не достигшие ремиссии после 2 циклов индукции (включая не менее 1 цикла средние дозы цитарабина) определяются как первичный рефрактерный ОМЛ. Пациенты должны быть рассмотрены для аллогенной ТКМ. Факторы, связанные со снижением выживаемости при рецидиве ОМЛ, включают: более короткий период безрецидивной выживаемости (менее 6-12 месяцев), неблагоприятный кариотип риска при постановке диагноза, пожилой возраст (> 45-55 лет) или предшествующую ТКМ. Если проведение ТКМ не рассматривается (например, у пожилых пациентов), целесообразным контролем заболевания является использование неинтенсивного варианта, такого как гипометилирующие агенты в комбинации с венетоклаксом или без него. [53]
Аллогенная трансплантация гемопоэтических стволовых клеток
ОМЛ является наиболее частым показанием для проведения аллогенной ТГСК, частота которой ежегодно в мире увеличивается на 10% [54, 55]. Немиелоаблативные режимы кондиционирования ил режимы кондиционирования со сниженной токсичностью (RIC) позволяют проводить аллогенную ТГСК пациентам в старшей возрастной группе. Тем не менее, только небольшому количеству пациентов с ОМЛ проводится ТГСК по причине более пожилого возраста пациентов, наличия сопутствующих заболеваний, токсичности предшествующей терапии, невозможности достижения полной ремиссии, раннего развития рецидива или рефрактерной формы лейкоза [56, 57]. Принятие решения по поводу проведения трансплантации зависит от оценки соотношения риска и пользы (например, соотношение риска смерти или осложнений, не связанных с рецидивом, к снижению риска рецидива), основанной на цитогенетических и молекулярно-генетических критериях заболевания, а также на соматическом статусе пациента, донора и других факторах предстоящей трансплантации. При остром миелобластном лейкозе с генетикой благоприятного риска проведение ТГСК в первой ремиссии не показано [58]. Как правило, ТГСК рекомендуется проводить, когда риск рецидива в случае не проведения ТГСК превышает 35 – 40%. В группе пациентов с генетикой неблагоприятного риска считается общепринятым, что трансплантацию необходимо проводить сразу после достижения полной ремиссии. [59]
Для пациентов с перстистирующей МОБ или с ранним появлением МОБ необходимо проведение терапии спасения с последующей ТГСК до развития гематологического рецидива. [60].
Прогноз у пациентов с морфологическим рецидивом в течение первых 12 месяцев после ТКМ плохой, хотя быстрое снижение иммуносупрессии или инфузия донорских лимфоцитов может помочь пациентам с ранним молекулярным или цитогенетическим рецидивом. Азацитидин с инфузией донорскими лимфоцитами или без них и режимы спасения на основе венетоклакса могут достичь ремиссии у небольшой части пациентов с меньшей токсичностью в сравнении с интенсивной химиотерапией. При достижении второй ПР рекомендуется рассмотреть инфузию донорских лимфоцитов или вторую аллогенную ТКМ. [61]
Терапевтическая тактика в ходе проведения индукционного лечения
Первым курсом индукции должно быть 7-дневное введение цитарабина в дозе 100-200 мг/м2 либо 2 раза в сутки как короткая инфузия либо в виде непрерывной в/в инфузии в сочетании с 3-дневным введением антрациклинов (даунорубицина в дозе как минимум 60 мг/м2 или идарубицина или митоксантрона в дозе 12 мг/м2). Схема “7 + 3” в настоящее время является стандартом индукционной терапии. До начала терапии необходимо определить, может ли быть выполнена пациентам интенсивная индукционная химиотерапия. Несмотря на то, что оценка риска смертности, обусловленной интенсивной химиотерапией (TRM), наиболее актуальна для более пожилых пациентов (обычно старше 65 лет), однако возраст не должен быть решающим определителем при выборе интенсивности терапии [62]. Если после первой индукции на 14 или 21 день курса констатирована ремиссия, существует несколько подходов к постремиссионной терапии ОМЛ: выполнение ТКМ, традиционная консолидационная ХТ. Трансплантация аллогенного костного мозга или аллогенных гемопоэтических стволовых клеток (алло-ТКМ/алло-ТГСК) в постремиссионной терапии ассоциирована с самым низким риском развития рецидива. Если ремиссия не достигнута, то пациент ведется по программе «двойной индукции».
Снижение доз препаратов производят:
при почечной недостаточности;
при печеночной недостаточности.
Нарушения со стороны почек и печени необходимо принимать во внимание не изолированно, а в контексте с другими сопутствующими заболеваниями, при необходимости для снижения доз препаратов, но данные нарушения в чистом виде не должны считаться причиной отнесения пациентов к группе, которой не может быть выполнена интенсивная индукционная терапия. После завершения первого курса химиотерапии необходимо выполнение программы сопроводительной терапии.
| Коррекция дозы препаратов при почечной недостаточности | |
| Даунорубицин (Daunomycin) | Если креатинин >262,2 мкмоль/л, доза снижается на 50% |
|
Идарубицин (Idarubicin)
|
Если креатинин 106—177мкмоль/л, доза снижается на 50%
Если креатинин >177мкмоль/л, не использовать
|
| Коррекция дозы препаратов при печеночной недостаточности | |
| Цитарабин (Ara-C) |
Если билирубин 26,65 мкмоль/л-51,3 мкмоль/л, доза снижается на 25%;
Если билирубин >51,3 мкмоль/л, доза снижается на 50%
|
|
Даунорубицин (Daunomycin) |
Если билирубин 26,65 мкмоль/л-51,3 мкмоль/л, доза снижается на 25%;
Если билирубин 51,01 мкмоль/л-85,5 мкмоль/л, доза снижается на 50%;
Если билирубин >85,5 мкмоль/л, продолжать не рекомендуется
|
|
Идарубицин
(Idarubicin)
|
Если билирубин 26,65 мкмоль/л-51,3 мкмоль/л, доза снижается на 25%; Если билирубин 51,01 мкмоль/л-85,5 мкмоль/л, доза снижается на 50%; Если билирубин >85,5 мкмоль/л, продолжать не рекомендуется |
Нарушения со стороны почек и печени необходимо принимать во внимание не изолированно, а в контексте с другими сопутствующими заболеваниями, при необходимости для снижения доз препаратов, но данные нарушения в чистом виде не должны считаться причиной отнесения пациентов к группе, которой не может быть выполнена интенсивная индукционная терапия. После завершения первого курса химиотерапии необходимо выполнение программы сопроводительной терапии.
У пациентов с ОМЛ с экспрессией FLT-3 добавление к программе лечения препаратов FLT3-ингибиторов (ингибиторов протеинкиназы) *мидостаурина или сорафениба**.
Режим дозирования мидостаурина: 50 мг 2 раза в день внутрь 8-21-й дни курса одновременно с индукционной терапией «7 + 3» и 4 консолидирующими курсами цитарабином** в высоких дозах с последующей поддерживающей терапией мидостаурином 50 мг 2 раза в день в течение 1 года.
Режим дозирования сорафениба** у молодых пациентов: 400 мг 2 раза в день внутрь 1019-й дни каждого индукционного курса; далее 400 мг 2 раза в день, начиная с 8-го дня каждого курса консолидации, далее поддерживающая терапия сорафенибом** 400 мг 2 раза в день в течение 1 года.
Режим дозирования сорафениба** у пожилых пациентов: 400 мг 2 раза в день внутрь 17-й дни каждого индукционного курса; далее 400 мг 2 раза в день внутрь 128-й дни два 28-дневных курса одновременно с 2 курсами консолидации средними дозами цитарабина** (2 г/м2/сутки, 1-й и 5-й дни 28-дневного курса), далее поддерживающая терапия сорафенибом 400 мг 2 раза в день внутрь в течение года.
Первая контрольная пункция костного мозга выполняется на 14 – 21 день от начала терапии первого индукционного курса (но не позже 21 дня) независимо от показателей периферической крови.
Ремиссия констатируется при наличии в пунктате костного мозга 5% и менее бластных клеток (при подсчете не менее чем на 200 клеток) при количестве нейтрофилов в периферической крови более 1,5 х109/л, при количестве тромбоцитов более или равном 100х109/л, при отсутствии экстрамедуллярных очагов лейкемического роста.
Если при исследовании костного мозга на 14 – 21 день после начала терапии, констатируется выраженная остаточная болезнь без гипоплазии костного мозга (гипоплазия определяется, когда количество клеток <10% -20% и остаточных бластов <5% -10%) или значительная циторедукция с низким % остаточных бластов, то можно повторить второй цикл такого же индукционного режима. При сомнительном результате, необходимо повторить пункцию костного мозга за 5-7 дней до начала следующей терапии. В случае констатирования гипоплазии - дождаться восстановления костного мозга – повторить пункцию костного мозга через 7-14 дней.
Исключение: начало курса откладывается при некупирующихся инфекционных осложнениях (пневмонии, инвазивного аспергиллеза, диссеминированного кандидоза, сепсиса и т.д.), вопрос о пролонгировании перерыва после первой индукции решается индивидуально.
Максимальный срок удлинения межкурсового интервала после 7+3 в отсутствии бластоза составляет 35 дней. Обязательно выполняется вторая контрольная пункция уже после восстановления показателей.
Если цитопения после первого индукционного курса очень глубокая – число лейкоцитов 1,0х109/ л и менее сохраняется к 35 дню после курса, то рекомендуется выполнить повторную пункцию костного мозга с подсчетом миелограммы, оценить вероятность инфицирования вирусами (периферическая кровь и костный мозг на маркеры вирусов гепатитов, группы герпеса), выполнить трепанобиопсию (при возможности, следует выполнить и иммуногистохимическое исследование антигенов вирусов семейства герпеса и вирусов гепатитов в трепанобиоптате).
До начала второго курса индукции производят перерасчет доз цитостатических препаратов, поскольку высока вероятность того, что после первого курса вес пациента уменьшился, и общая поверхность тела изменилась.
Если у пациента после второго курса индукции на 14 или 21 день в контрольном пунктате костного мозга определяется более 5% бластных клеток то констатируется резистентная форма острого лейкоза, и пациент переводиться на протоколы лечения рефрактерных ОМЛ.
Если в трепанобиоптате на фоне глубокой цитопении продолжительностью более 35 дней выявляется нормоклеточный или гиперклеточный костный мозг независимо от процента бластных клеток в пунктате, то пациентам может быть начат второй курс индукции. Если в трепанобиоптате определяется значительная аплазия при отсутствии увеличенного процента бластных клеток в пунктате, то рекомендуется еще на неделю (+42 день после курса) отложить начало курса консолидации.
До начала второго курса индукции производят перерасчет доз цитостатических препаратов, поскольку высока вероятность того, что после первого курса вес пациента уменьшился, и общая поверхность тела изменилась.
Этот курс требует такого же выполнения алгоритмов сопроводительной терапии, что и первый индукционный (антиэметическая терапия, заместительная терапия компонентами крови, антибиотическая терапия при развитии инфекционных осложнений).
Если у пациента после второго курса индукции на 14 или 21 день в контрольном пунктате костного мозга определяется более 5% бластных клеток то констатируется резистентная форма острого лейкоза, и пациент переводиться на протоколы лечения рефрактерных ОМЛ.
При установлении диагноза ОМЛ всем пациентов и сибсам обязательно проведение HLA-типирования (среднее разрешение).
Терапевтическая тактика в ходе проведения консолидирующего лечения.
Обычный срок начала первого курса консолидации - 28-35 день второго курса индукции, максимальный - 42 дня. Максимальный срок определяется лишь наличием тяжелых инфекционных осложнений, не купированных в течение послекурсового периода.
Всем пациентам независимо от возраста целесообразно исследовать функциональное состояние сердечной мышцы (перед курсами консолидации и ТКМ обязательно). При обнаружении значительного снижения сократительной способности миокарда (фракция выброса менее 40%) или повышения концентрации предсердного натрий уретического пептида более 100 нг/мл целесообразна консультация кардиолога и выбор курсов без антрациклинов.
Современные антрациклины, применяемые в терапии ОМЛ, характеризуются различным диапазоном кумулятивных доз, приводящих к развитию кардиотоксичности:
|
Антрациклины
|
Кумулятивная доза | Однократная доза |
|
Даунорубицин
|
450 мг/м2 | 60 -90 мг/м2 |
| Идарубицин | 150 мг/м2 | 12 мг/м2 |
| Митоксантрон | 140 мг/м2 | 12 мг/м2 |
Для проведения консолидации рекомендуются режимы, не содержащие антрациклины. Это связано с развитием токсических реакций, обусловленных миелотоксичностью, при применении антрациклинов в режимах консолидации [43].
Дозы цитостатических препаратов в курсах консолидации, включающих промежуточные дозы цитарабина, назначают соответственно площади поверхности тела пациента, определенной перед каждым курсом. [63]
Инфузия цитарабина при проведении курсов IDAC должна осуществляться в течение 3 часов. При избыточно коротком введении (до 1 часа) и очень длительном (круглосуточно) возможно развитие легочного дистресс-синдрома, связанного цитарабиновой эндотелиопатией. Премедикация перед введением цитарабина в высоких дозах проводиться дексаметазоном 4-8 мг в/в или метилпреднизолоном в перерасчете на дексаметазон. За 12 часов до начала курса IDAC пациенту назначаются глазные капли с кортикостеридами и проводится все 5 дней курса + первый день перерыва. Сопроводительная терапия осуществляется по тем же принципам, как и в период индукционного лечения.
Контрольную пункцию костного мозга после каждого курса консолидации производят:
1. После курса «IDAC» – на 28 день;
2. После других программ ПХТ – на 21 день.
Если после программ консолидации показатели периферической крови не восстанавливаются к 35 дню, то необходимо выполнить тот же алгоритм обследования пациента с цитопенией, который описан для индукционного курса.
Если пациент был отнесен к группе низкого риска, но после первого курса индукции, проведенного в полных дозах ремиссии не достигнуто, то пациента относят к группе высокого риска.
В дополнение к исходным факторам риска, оценка МОБ при ПР рекомендуется для пациентов с неблагоприятным риском в первой ремиссии для обоснования выбора консолидирующей терапии. Для пациентов с оценочным риском рецидива, превышающим 35-40%, консолидация с аллогенной HCT остается предпочтительным вариантом после ремиссии. [64] К ним относятся пациенты с ОМЛ с неблагоприятным риском или болезнью без неблагоприятного риска с персистенцией МОБ. [36]
Дальнейшее ведение.
Перерывы в терапии допустимы только в случаях инфекционных осложнений, в том числе фебрильной нейтропении, в случае отсутствия эффекта от стартовой антибактериальной терапии. Лейкопения (агранулоцитоз) и/или тромбоцитопения сами по себе не являются достаточным основанием для прерывания химиотерапии в периоде индукции. Если число лейкоцитов менее 1,0х109/л, но отсутствуют инфекционные осложнения – терапия не прекращается.
Вакцинация против вирусных инфекций гриппа [65] и COVID-19 рекомендуется всем пациентам для снижения риска тяжелых инфекций. Использование факторов роста обычно не рекомендуется, исключение только у отдельных пациентов (например, в случае тяжелых инфекций) или в определенных условиях лечения (например, для уменьшения времени гематологического восстановления в циклах консолидации). [66]
Новые агенты: тактика при нежелательных явлениях [47]
|
Агент
|
НЯ, требующее особого внимания | Дальнейшая тактика |
| Мидостаурин | Удлинение QT (10%) | Прерывание/снижение дозы, коррекция сопутствующего лечения, дополнительный контроль ЭКГ |
| Гилтеритиниб |
Повышение уровня трансаминаз (81%)
Удлинение QT (9%)
Синдром обратимой энцефалопатии (1%)
|
Прерывание/снижение дозы (при степени ≥ 3) снижение дозы с 120 мг до 80 мг или с 200 мг до 120 мг в случае развития осложнений
При разрешении токсических явлений или улучшении их до степени тяжести 1 возобновить использование препарата в меньшей дозе.
|
| Ивосидениб |
Дифференциальный синдром (25% моно, 17% в сочетании с азацитидин)
Удлинение QT (21% моно,
26% комбинация с азацитидином)
|
дексаметазон, гидроксимочевина при сопутствующем лейкоцитозе,
Прерывание/снижение дозы
коррекция сопутствующего лечения
|
| Эназидениб |
Дифференциальный синдром (14% моно, 10% в сочетании с азацитидин)
Повышение билирубина (81%)
|
Дексаметазон, гидроксимочевина при сопутствующем лейкоцитозе,
Прерывание/снижение дозы
|
| Венетоклакс | Нейтропения Тромбоцитопения |
Ранняя оценка ответа, например, на 14-21 день цикла 1, если количество бластов в костном мозге < 5%, отмена венетоклакса на срок до 14 дней для восстановления. Если нейтропения не проходит через 7 дней после прекращения приема венетоклакса, добавление Г-КСФ может ускорить восстановление. Последующие циклы: азацитидин 75 мг/м 2 п /к/в/в 1-7 дней (или 1-5 + 8-9 дней) или децитабин 20 мг/м 2 в/ в 1-5 дней плюс венетоклакс 400 мг 1 р/сут, или низкие дозы цитарабина 20 мг/м2 п /к d1–10 плюс венетоклакс 600 мг один раз в день каждые 4 недели до прогрессирования. Отсроченное восстановление или рецидивирующая нейтропения/тромбоцитопения 4-й степени, возникающая при лечении и продолжающаяся ≥ 7 дней, требуют сокращения продолжительности введения венетоклакса (с 28 до 21 или 14 дней или даже меньше) и/или снижения дозы азацитидина, децитабина, или низкие дозы цитарабина, если тяжелая гипоплазия костного мозга |
| Синдром лизиса опухоли | Увеличение дозы в цикле 1; рекомендуется гидратация, профилактическое использование препаратов, снижающих уровень мочевой кислоты, тщательный мониторинг электролитов и снижение лейкоцитов до < 25 × 109 /л (< 25 000 / мкл). | |
| Взаимодействие с ингибиторами CYP3A |
• Умеренные ингибиторы CYP3A (например, ципрофлоксацин): уменьшите дозу венетоклакса не менее чем на 50%; фаза нарастания: 50 мг на 1-й день, 100 мг на 2-й день, 200 мг внутрь QD начиная с 3-го дня • Сильные ингибиторы CYP3A (например, позаконазол): фаза нарастания: 10 мг на 1-й день, 20 мг на 2-й день, 50 мг на 3-й день. , 100 мг (или менее ‡ ) 207 QD PO начиная с 4 дня. |
|
| CC-486/пероральный азацитидин | Нейтропения (44%) Тромбоцитопения (33%) Тошнота (65%), рвота (60%), диарея (50%) |
Прерывание/снижение дозы, миелоидные факторы роста Профилактические противорвотные средства |
Особенности лечения у беременных
При диагностике острого лейкоза в первый триместр беременности до начала химиотерапии рекомендуется обсудить вопрос о прерывании беременности.
Химиотерапия в первом триместре беременности имеет 10-20% риск развития тяжелых аномалий развития [67]. Необходимо обсудить с пациентом все аргументы за и против искусственного прерывания беременности (УД - IIС).
Химиотерапию у беременных рекомендуется начинать не раньше второго триместра (после 14-15 недель гестации), когда завершается формирование гемоплацентарного барьера [68]. Диагностика ОМЛ, начиная со II триместра и до 34 недель беременности, является показанием к проведению индукционной ХТ в полных дозах. Данная тактика направлена на наиболее быстрое достижение полной ремиссии ОЛ, так как родоразрешение, при возможности, должно выполняться на фоне ремиссии ОМЛ вне цитопении, что позволит сделать необходимый для восстановления после родов интервал между курсами цитоститической терапии как минимум 2-3 недели.
При применении любых лекарственных препаратов во время беременности необходимо всегда оценивать соотношение риска и пользы (УД - IC). Препараты в высоких дозах, идарубицин, даунорубицин и липосомальный доксорубицин могут проникать через гемоплацентарный барьер и оказывать токсическое влияние на плод, в том числе влиять на функцию миокарда. При выборе антрациклиновых антибиотиков предпочтение скорее должно отдаваться даунорубицину, нежели идарубицину, учитывая его бóльшую липофильность, облегчающую его трансплацентарный транспорт. Кроме того, идарубицин обладает и бóльшей аффинностью к ДНК. В качестве индукционной химиотерапии предпочтительна стандартная комбинация даунорубицина и цитарабина (УД - IB).
Расчет доз препаратов должен проводиться на основании фактической массы тела с учетом изменений массы тела во время беременности (УД - IC).
При проведении сопроводительной терапии у беременных необходимо исключить использование фторхинолонов (риск развитии артропатии, нарушение остеогенеза), тетрациклинов, сульфаниламидов (дефекты нервной трубки, мальформация сердца) (УД - IB).
Необходимости аборта в поздние сроки беременности (16—28 нед) нет, риск выполнения этой процедуры (малое кесарево сечение, искусственные роды) превышает риск проведения химиотерапии: вероятность массивного кровотечения, наличие очага инфекции, затягивание начала индукционного курса, возможность гибели плода.
При выявлении ОМЛ на сроке беременности более 34 недель целесообразно выполнить родоразрешение с последующим проведением индукционной ПХТ (УД - IIC). Терапевтическая тактика при ОМЛ определяется необходимостью в срочном начале лечения после оценки гематологического статуса, прогнозом заболевания, риском химиотерапии для плода, риском прерывания беременности или её сохранения.
Современные методы лечения позволяют женщинам во время беременности проходить химиотерапию и рожать абсолютно здоровых детей. Шансы на успешное лечение и выживаемость, абсолютно такие же, как и у всех остальных пациентов. Беременность не влияет на исход болезни, если лечение проводится в полной мере и вовремя [69].
Немедикаментозное лечение:
Медикаментозное лечение:

Программы индукционной, консолидирующей терапии (ECOG 0-2; CCI 0-2; <60 лет).
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
Хирургическое вмешательство при развитии инфекционных осложнений пациентам могут также проводиться вмешательства, направленные на дренирование/устранение инфекционного очага.
Иссечение анальной трещины (острой/хронической) - по показаниям в рамках профилактики / лечения септических состояний у пациентов с гемобластозами.
Удаление геморроидальных узлов (геморроидэктомия) - по показаниям в рамках профилактики / лечения септических состояний у пациентов с гемобластозами.
Вскрытие парапроктита/инфильтрата - по показаниям в рамках профилактики/лечения септических состояний у пациентов с гемобластозами.
Выведение стомы кишечника - по показаниям (при острой и хронической анальной трещины) в рамках профилактики/лечения септических состояний у пациентов с гемобластозами.
Плевральная пункция - по показаниям при гидротораксе плеврите.
Лапароцентез - по показаниям при асците.
Основным противопоказанием к хирургическим вмешательствам является не купируемый геморрагический синдром
Дальнейшее ведение см. Амбулаторный уровень.
Индикаторы эффективности лечения: см. Амбулаторный уровень.
Химиотерапия в первом триместре беременности имеет 10-20% риск развития тяжелых аномалий развития [67]. Необходимо обсудить с пациентом все аргументы за и против искусственного прерывания беременности (УД - IIС).
Химиотерапию у беременных рекомендуется начинать не раньше второго триместра (после 14-15 недель гестации), когда завершается формирование гемоплацентарного барьера [68]. Диагностика ОМЛ, начиная со II триместра и до 34 недель беременности, является показанием к проведению индукционной ХТ в полных дозах. Данная тактика направлена на наиболее быстрое достижение полной ремиссии ОЛ, так как родоразрешение, при возможности, должно выполняться на фоне ремиссии ОМЛ вне цитопении, что позволит сделать необходимый для восстановления после родов интервал между курсами цитоститической терапии как минимум 2-3 недели.
При применении любых лекарственных препаратов во время беременности необходимо всегда оценивать соотношение риска и пользы (УД - IC). Препараты в высоких дозах, идарубицин, даунорубицин и липосомальный доксорубицин могут проникать через гемоплацентарный барьер и оказывать токсическое влияние на плод, в том числе влиять на функцию миокарда. При выборе антрациклиновых антибиотиков предпочтение скорее должно отдаваться даунорубицину, нежели идарубицину, учитывая его бóльшую липофильность, облегчающую его трансплацентарный транспорт. Кроме того, идарубицин обладает и бóльшей аффинностью к ДНК. В качестве индукционной химиотерапии предпочтительна стандартная комбинация даунорубицина и цитарабина (УД - IB).
Расчет доз препаратов должен проводиться на основании фактической массы тела с учетом изменений массы тела во время беременности (УД - IC).
При проведении сопроводительной терапии у беременных необходимо исключить использование фторхинолонов (риск развитии артропатии, нарушение остеогенеза), тетрациклинов, сульфаниламидов (дефекты нервной трубки, мальформация сердца) (УД - IB).
Необходимости аборта в поздние сроки беременности (16—28 нед) нет, риск выполнения этой процедуры (малое кесарево сечение, искусственные роды) превышает риск проведения химиотерапии: вероятность массивного кровотечения, наличие очага инфекции, затягивание начала индукционного курса, возможность гибели плода.
При выявлении ОМЛ на сроке беременности более 34 недель целесообразно выполнить родоразрешение с последующим проведением индукционной ПХТ (УД - IIC). Терапевтическая тактика при ОМЛ определяется необходимостью в срочном начале лечения после оценки гематологического статуса, прогнозом заболевания, риском химиотерапии для плода, риском прерывания беременности или её сохранения.
Современные методы лечения позволяют женщинам во время беременности проходить химиотерапию и рожать абсолютно здоровых детей. Шансы на успешное лечение и выживаемость, абсолютно такие же, как и у всех остальных пациентов. Беременность не влияет на исход болезни, если лечение проводится в полной мере и вовремя [69].
Трансфузионная поддержка
Показания к проведению трансфузионной терапии определяются в первую очередь клиническими проявлениями индивидуально для каждого пациента с учетом возраста, сопутствующих заболеваний, переносимости химиотерапии и развития осложнений на предыдущих этапах лечения.
Лабораторные показатели для определения показаний имеют вспомогательное значение, в основном для оценки необходимости профилактичесиких трансфузий концентрата тромбоцитов.
Показания к трансфузиям также зависят от времени, после проведения курса химиотерапии – принимаются во внимание, прогнозируемое снижение показателей в ближайшие несколько дней.
Эритроцитарная масса/взвесь:
• Уровень гемоглобина не нужно повышать, пока обычные резервы и компенсационные механизмы достаточны для удовлетворения потребностей тканей в кислороде;
• Существует только одно показание для трансфузий эритроцитсодержащих сред при хронических анемиях – симптомная анемия (проявляющаяся тахикардией, одышкой, стенокардией, синкопе, de novo депрессией или элевацией ST);
• Уровень гемоглобина менее 30 г/л является абсолютным показанием для трансфузии эритроцитов;
• При отсутствии декомпенсированных заболеваний сердечно-сосудистой системы и легких показаниями для профилактической трансфузии эритроцитов при хронических анемиях могут быть уровни гемоглобина:
|
Возраст (лет)
|
Триггерный уровень Hb (г/л) |
|
<25
|
35-45 |
|
25-50
|
40-50 |
|
50-70
|
55 |
|
>70
|
60 |
Концентрат тромбоцитов:
• При снижении уровня тромбоцитов менее 10 х109/л или появлении геморрагических высыпаний на коже (петехии, синячки) проводится профилактическая трансфузия аферезных тромбоцитов;
• Профилактическая трансфузия аферезных тромбоцитов у пациентов с лихорадкой, пациентам, которым планируется инвазивное вмешательство может проводится при более высоком уровне – 20 х109/л;
• При наличии геморрагического синдрома петехиально-пятнистого типа (носовые, десневые кровотечения, мено-, метроррагии, кровотечения других локализаций) трансфузия концентрата тромбоцитов проводится с лечебной целью.
Свежезамороженная плазма:
• Трансфузии СЗП проводятся у пациентов с кровотечением или перед проведением инвазивных вмешательств;
• Пациенты с МНО ≥2.0 (при нейрохирургических вмешательствах ≥1.5) рассматриваются как кандидаты для трансфузии СЗП при планировании инвазивных процедур. При плановых вмешательствах возможно назначение не менее, чем за 3 дня до вмешательства фитоменадиона не менее 30 мг/сут внутривенно или внутрь.
Немедикаментозное лечение:
Режим: общеохранительный
Диета: стол №15 (общая).
Лучевая терапия. Если вследствие осложнений или технических трудностей не представляется возможным провести полную программу профилактики нейролейкемии интратекальными введениями цитостатических препаратов, то пациентам рекомендуется выполнить краниальное облучение в дозе 24 Гр.
Медикаментозное лечение:

Программы индукционной, консолидирующей терапии (ECOG 0-2; CCI 0-2; <60 лет).
|
Критерий для интенсивной терапии
|
Индукция | Консолидация | Поддерживающая ХТ |
| ОМЛ с FLT3 мутацией |
DNR 60 мг/м2 в/в 1-3 дня; или Ida 12 мг/м2 в/в 1-3 дня; и цитарабин 100-200 мг/м2/сут в/в 1-7 дней; плюс мидостаурин 50 мг каждые 12 ч внутрь 8-21 дней
Реиндукция: 2-ой цикл «7+3» или режим высокие дозы цитарабина, плюс мидостаурин, предпочтительнее для пациентов без ответа на 1-ый цикл
|
3 цикла IDAC 1000-1500 мг/м2 в/в (500-1000 мг/м2 ≥60 лет) в течении 3 ч каждые 12 часов, 1-3 дня; плюс мидостаурин 50 мг каждые 12 час. во внутрь 8-21 дней (во всех циклах) |
Для группы высокого риска, старше 55-60 лет:
Мидостаурин 50 мг каждые 12 час внутрь, 1-28 дней, 4 недели, более 12 циклов.
5+ЦФ
5+6-МП
6-МП
|
| Мутации не относящиеся к FLT3 |
DNR 60 мг/м2 в/в 1-3 дня,
Ida 12 мг/м2 в/в 1-3 дня, или Mito 12 мг/м2 в/в 1-3 дня;
и цитарабин 100-200 мг/м2/сут в/в 1-7 дней
Реиндукция: 2-ой цикл «7+3» или режим высокие дозы цитарабина, предпочтительнее последнее для пациентов без ответа
|
3 цикла IDAC 1000-1500 мг/м2 в/в (500-1000 мг/м2 ≥60 лет) в течении 3ч каждые 12 ч, 1-3 дня |
Для группы высокого риска, старше 55-60 лет:
Азацитидин 300 мг внутрь ежедневно 1-14 дней каждые 4 нед, до прогрессии заболевания
5+ЦФ
5+6-МП
6-МП
|
| Режимы терапии «спасения» пациентов, не ответивших на первоначальную индукцию или с рецидивом заболевания, которые являются кандидатами на интенсивную терапию. | |||
| Средние дозы Ara-C (с или без антрациклинов) | Цитарабин 1000–1500 мг/м2 в/в в течение 3 ч каждые 12 ч дd1–3 (500–1000 мг/м2 у пациентов старше 60 лет); с или без даунорубицин 60 мг/м2 в/в 1-3 дня; или идарубицин 8-10 мг/м2 в/в 3-5 дней; или митоксантрон 8-10 мг/м2 в/в 1-3 | ||
| FLAG-Ida |
Флударабин 30 мг/м2 в/в в течение 30 мин 1-5 дни курса
Цитарабин 1500-2000 мг/м2 в/в в течение 3х часов в 1-5 дни курса через 3,5 часа после флударабина
G-CSF Филграстим 300 мкг п/к 1 раз в сутки за 12 часов до первого введения цитостатиков
Идарубицин 10 мг/м2 в/в в течение 10 минут 1,3,5 дни курса
|
||
| MEC | Митоксантрон 8 мг/м2 в/в 1-5 дней; этопозид 100 мг/м2 в/в 1-5 дней; цитарабин 1000 мг/м2 в/в д1-5 | ||
| CLAG-M |
Кладрибин 5 мг/м2 в/в 1–5 дней; цитарабин 2000 мг/м2 в/в 1-5 дней (начиная через 2 часа после инфузии кладрибина);
митоксантрон 10 мг/м2 в/в 1-3 дня; Г-КСФ 300 мг подкожно 0–5 дней
|
||
| Гилтеритиниб (с FLT3 мутацией) | Гилтеритиниб 120 мг перорально 1 раз в день 1–28 дней, каждые 4 недели, до прогрессии заболевания | ||
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
|
Фармакотерапевтическая группа
|
Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Антинеопластические и иммуносупрессивные лекарственные средства | Цитарабин | Внутривенное, подкожное введение | А |
| Даунорубицин | Внутривенное введение | А | |
| Идарубицин | Внутривенное введение | А | |
| Митоксантрон | Внутривенное введение | В | |
| Венетоклакс | Внутрь | В | |
| Мидостаурин | Внутрь | В | |
| Кладрибин | Внутривенное введение | В | |
| Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов | Ондансетрон |
Противорвотная терапия с риском развития от умеренного до высокого Внутривенное введение 8–12 мг
Внутрь 16–24 мг
|
С |
| Трамадол |
Внутривенное введение
Внутрь
|
В |
NB! Дополнительное медикаментозное лечение проводится соответственно протоколам лечения развившихся осложнений.
Хирургическое вмешательство при развитии инфекционных осложнений пациентам могут также проводиться вмешательства, направленные на дренирование/устранение инфекционного очага.
Иссечение анальной трещины (острой/хронической) - по показаниям в рамках профилактики / лечения септических состояний у пациентов с гемобластозами.
Удаление геморроидальных узлов (геморроидэктомия) - по показаниям в рамках профилактики / лечения септических состояний у пациентов с гемобластозами.
Вскрытие парапроктита/инфильтрата - по показаниям в рамках профилактики/лечения септических состояний у пациентов с гемобластозами.
Выведение стомы кишечника - по показаниям (при острой и хронической анальной трещины) в рамках профилактики/лечения септических состояний у пациентов с гемобластозами.
Плевральная пункция - по показаниям при гидротораксе плеврите.
Лапароцентез - по показаниям при асците.
Основным противопоказанием к хирургическим вмешательствам является не купируемый геморрагический синдром
Дальнейшее ведение см. Амбулаторный уровень.
Индикаторы эффективности лечения: см. Амбулаторный уровень.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации:
Проведение курсов химиотерапии, таргетной терапии и иных видов лечения.
Проведение гаплоидентичной/аллогенной трансплантации гемопоэтических стволовых клеток.
Контрольное обследование перед/после гапло/аллоТКМ.
Показания для экстренной госпитализации:
Впервые выявленный острый лейкоз;
Соматически тяжелый пациент (ECOG≥3 баллов);
опухолевая интоксикация, синдром сдавление;
тяжелой анемический/геморрагический синдром, требующий заместительной терапии;
полиорганная недостаточность вследствие основного заболевания.
Фебрильная нейтропения.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2022
- 1. Scottish Intercollegiate Guidelines Network (SIGN). SIGN 50: a guideline developer’s handbook. Edinburgh: SIGN; 2014. (SIGN publication no. 50). [October 2014]. Available from URL: http://www.sign.ac.uk. Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016; 127 (20): 2391–405. 2. Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016; 127 (20): 2391–405. 3. Kayser S, Hills RK, Langova R, et al. Characteristics and outcome of patients with acute myeloid leukaemia and t(8;16)(p11;p13): results from an International Collaborative Study. Br J Haematol. 2021; 192 (5):832-842. 4. Fang H, Yabe M, Zhang X, et al. Myelodysplastic syndrome with t(6;9)(p22;q34.1)/DEK-NUP214 better classified as acute myeloid leukemia? A multicenter study of 107 cases. Mod Pathol. 2021;34(6):1143-1152. 5. Montalban-Bravo G, Kanagal-Shamanna R, Sasaki K, et al. NPM1 mutations define a specific subgroup of MDS and MDS/MPN patients with favorable outcomes with intensive chemotherapy. Blood Adv. 2019;3(6):922-933. 6. Patel SS, Ho C, Ptashkin RN, et al. Clinicopathologic and genetic characterization of nonacute NPM1-mutated myeloid neoplasms. Blood Adv. 2019;3(9):1540-1545. 7. Forghieri F, Nasillo V, Paolini A, et al. NPM1-mutated myeloid neoplasms with <20>30% bone marrow blasts treated with azacitidine by cytogenetic risk status: Results of the AZA-AML-001 study [abstract]. Blood. 2014;124(21). Abstract 621. 35. Estey EH. Epigenetics in clinical practice: the examples of azacitidine and decitabine in myelodysplasia and acute myeloid leukemia. Leukemia. 2013;27(9):1803-1812 36. Ferrara F, Picardi A. Is there still a role for autologous stem cell transplantation for the treatment of acute myeloid leukemia? Cancers (Basel). 2019;12(1):59. 37. Dumas PY, Bertoli S, Bérard E, et al. Delivering HDAC over 3 or 5 days as consolidation in AML impacts health care resource consumption but not outcome. Blood Adv. 2020;4(16):3840-3849. 38. Schaich M, Röllig C, Soucek S, et al. Cytarabine dose of 36 g/m2 compared with 12 g/m2 within first consolidation in acute myeloid leukemia: results of patients enrolled onto the prospective randomized AML96 study. J Clin Oncol. 2011;29(19):2696-2702. 39. Cytarabine dose of 36 g/m² compared with 12 g/m² within first consolidation in acute myeloid leukemia: results of patients enrolled onto the prospective randomized AML96 study. Schaich M, Röllig C, Soucek S, Kramer M, Thiede C, Mohr B, Oelschlaegel U, Schmitz N, Stuhlmann R, Wandt H, Schäfer-Eckart K, Aulitzky W, Kaufmann M, Bodenstein H, Tischler J, Ho A, Krämer A, Bornhäuser M, Schetelig J, Ehninger G J Clin Oncol. 2011 Jul 1; 29(19):2696-702. 40. Cornelissen JJ, Blaise D. Hematopoietic stem cell transplantation for patients with AML in first complete remission. Blood. 2016;127(1):62-70.
Информация
Сокращения, используемые в протоколе:
|
АЛТ
|
Аланинаминотрансфераза |
| АСТ | аспартатаминотрансфераза |
| БФ | бластная фаза |
| ГСК | гемопоэтические стволовые клетки |
| ГГТП | гаммаглютамилтранспептидаза |
| Гр | Грей |
|
Ед
|
единица измерения |
| МЕ | международная единица |
| Мг | Миллиграмм |
| ИФА | иммунноферментный анализ |
| ИФТ | иммуннофенотипирование |
|
КП
|
клинический протокол |
| КТ | компьютерная томография |
| ЛДГ | лактатдегидрогеназа |
| 6-МП | 6-меркаптопурин |
| Ara-C | Цитарабин |
| Ida | Идарубицин |
|
DNR
|
Даунорубицин |
| Mito | Митоксантрон |
| аллоТКМ | аллогенная трансплантация костного мозга |
| CD | кластер дифференцировки |
|
МНО
|
международное нормализованное отношение |
| CALGB | Cаncer and Leukemia Group B |
| EBMT | European Group for blood and Marrow |
| Transplantation ECOG | Eastern Cooperative Oncology Group |
|
HLA
|
система лейкоцитарных антигенов человека |
| МКБ | международная классификация болезней |
|
МПО
|
миелопероксидаза |
| PICC | peripherally inserted central catheter |
| Мл | Миллилитр |
| НЭ | нафтилэстераза |
| ОМЛ | острый миелобластный лейкоз |
| ОАК | общий анализ крови |
|
ОБП
|
органы брюшной полости |
| ПХТ | полихимиотерапия |
| ПЦР | полимеразная цепная реакция |
| РКИ | рандомизированное клиническое исследование |
| ТКМ | трансплантация костного мозга |
| УД | уровень доказательности |
| УЗДГ | ультразвуковая доплерография |
|
УЗИ
|
ультразвуковое исследование |
| ЭКГ | электрокардиограмма |
| ПЭТ/КТ | позитронно-эммисионная томография/компьютерная томография |
|
FAB классификация
|
франко-американско-британская классификационная система |
|
FISH
|
Fluorescence in situ hybridization |
| TRM | Тreatment-related mortality |
| ПК | Периферическая кровь |
| КМ | Костный мозг |
|
ELN
|
European LeukemiaNet |
| MFC | многопараметрическая проточная цитометрия |
| LAIP | ассоциированные с лейкемией иммунофенотипы |
| NCCN | Clinical Practice Guidelines in Oncology |
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА:
Список разработчиков протокола с указание квалификационных данных:
1) Кемайкин Вадим Матвеевич – кандидат медицинских наук, гематолог, ТОО «Национальный научный онкологический центр», руководитель отдела онкогематологии и трансплантации костного мозга, главный внештатный гематолог МЗ РК.
2) Клодзинский Антон Анатольевич – кандидат медицинских наук, гематолог, медицинский директор ТОО «Центр гематологии».
3) Тургунова Людмила Геннадьевна – доктор медицинских наук, гематолог, профессор кафедры внутренних болезней №2 НАО «Медицинский университет Караганды».
4) Габбасова Сауле Телембаевна - врач гематолог высшей категории, магистр общественного здравоохранения, член общества онкогематологов РК, член Ассоциации онкологов РК, руководитель центра гематологии с трансплантацией костного мозга КазНИИиОР.
5) Худайбергенова Махира Сейдуалиевна - клинический фармаколог, ТОО «Национальный научный онкологический центр».
6) Рапильбекова Гульмира Курбановна - доктор медицинских наук, профессор. КФ UMC «Национальный научный центр материнства и детства», старший ординатор акушерского отделения №1, врач акушер-гинеколог.
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
1) Рамазанова Райгуль Мухамбетовна – доктор медицинских наук, гематолог, профессор кафедры внутренних болезней НАО «Казахский Национальный медицинский университет имени С.Д.Асфендиярова».
Указание условий пересмотра протокола: пересмотр протокола через 5 лет и/или при появлении новых методов диагностики и/или лечения с более высоким уровнем доказательности.
Диагностические мероприятия: сбор жалоб и анамнеза.
Медикаментозное лечение: симптоматическая терапия.
Диагностика и лечение нейролейкемии (NCCN, 2022)
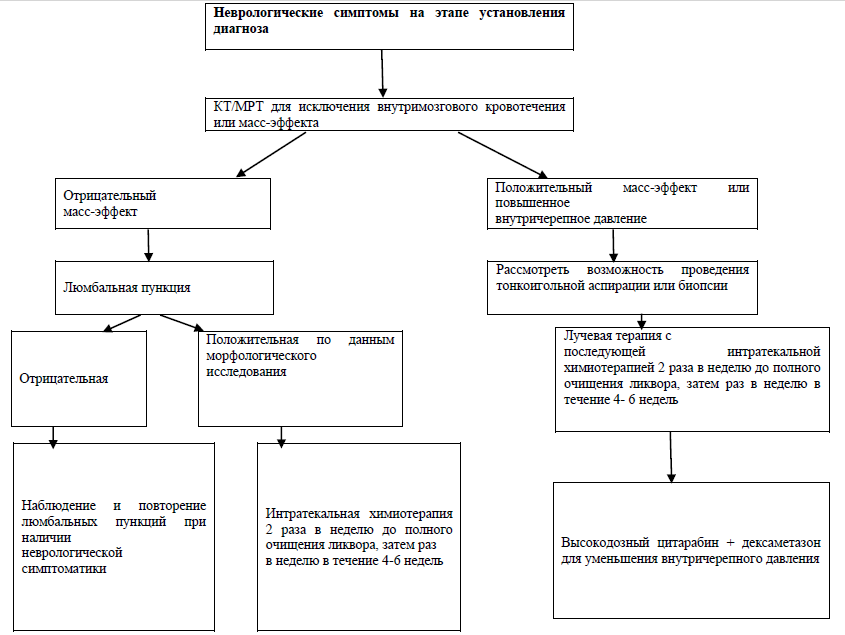
Диагностика и лечение нейролейкемии (NCCN, 2022)
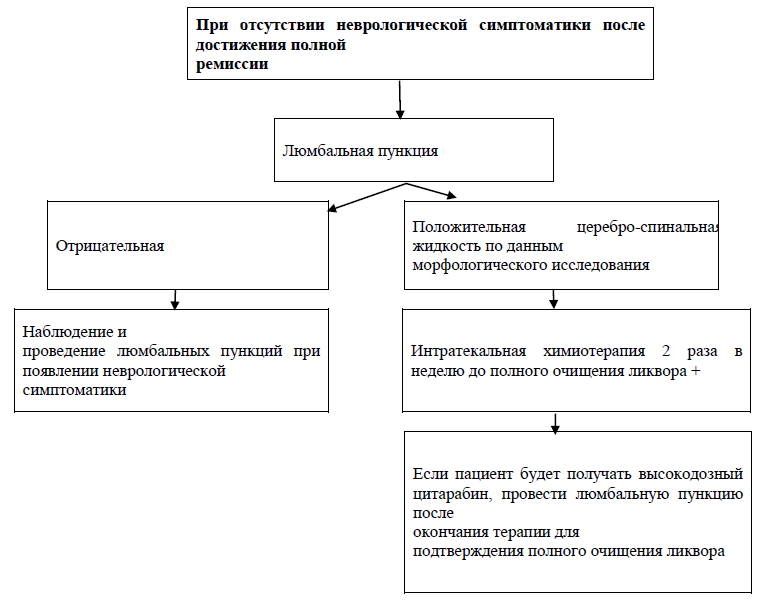
Алгоритм ведения пациента
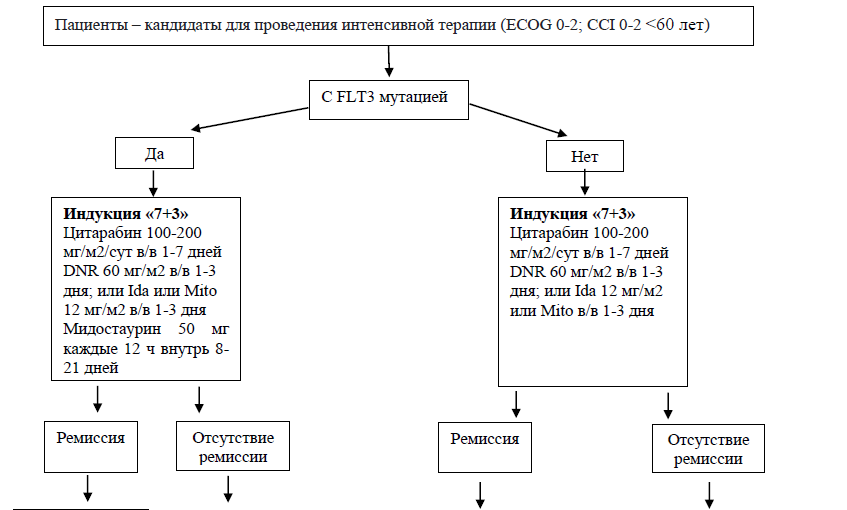
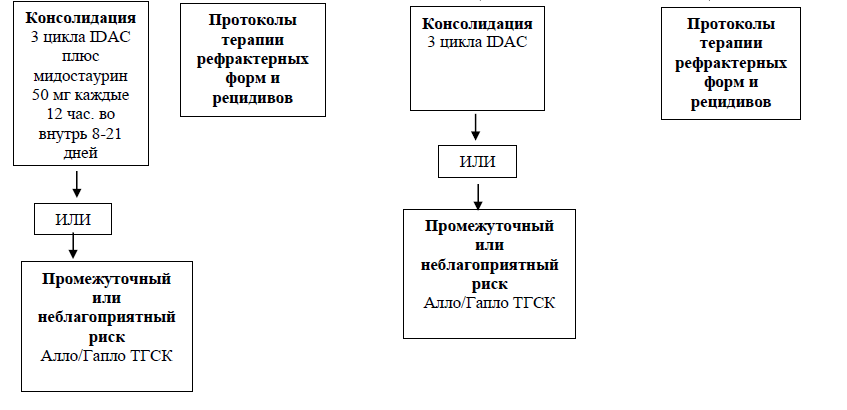
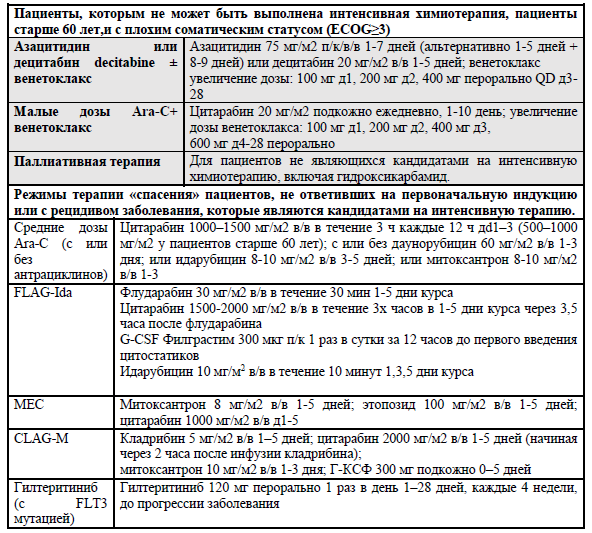
АЛГОРИТМ ДИАГНОСТИКИ И ЛЕЧЕНИЕ НА ЭТАПЕ СКОРОЙ НЕОТЛОЖНОЙ ПОМОЩИ (схемы)
Диагностические мероприятия: сбор жалоб и анамнеза.
Медикаментозное лечение: симптоматическая терапия.
Диагностика и лечение нейролейкемии (NCCN, 2022)

Диагностика и лечение нейролейкемии (NCCN, 2022)

Приложение 1.
Алгоритм ведения пациента



Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.