Острый лимфобластный лейкоз
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Острый лимфобластный лейкоз (C91.0)
Онкогематология
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «18» августа 2023 года
Протокол №187
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
ОСТРЫЙ ЛИМФОБЛАСТНЫЙ ЛЕЙКОЗ
Острые лимфобластные лейкозы – это гетерогенная группа клональных заболеваний системы крови, характеризующаяся неконтролируемой пролиферацией лимфобластов в костном мозге, периферической крови и экстрамедуллярных очагах [2].
Код(ы) МКБ-10;11:
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2022 год).
Категория пациентов: взрослые.
Шкала уровня доказательности [1]:
Острые лимфобластные лейкозы – это гетерогенная группа клональных заболеваний системы крови, характеризующаяся неконтролируемой пролиферацией лимфобластов в костном мозге, периферической крови и экстрамедуллярных очагах [2].
ВВОДНАЯ ЧАСТЬ
Код(ы) МКБ-10;11:
| МКБ-10 | |
|
Код
|
Название |
|
С91.0
|
Острый лимфобластный лейкоз. |
| МКБ-11 | |
| 2В33.3 | Лимфоидный лейкоз, не классифицированный острый лимфобластный лейкоз. |
| XH5J37 | Лимфобластный лейкоз из клеток-предшественников, NOS Острый лимфобластный лейкоз, NOS (без специфических характеристик). |
| 2A90.5 |
Т-клеточная лимфома или лейкоз взрослых, ассоциированная с Т-клеточным лимфотропным вирусом типа 1.
Т-клеточный острый лимфобластный лейкоз.
|
| 2A85.6 |
Лимфома Беркитта, включая лейкоз Беркитта.
Острый лимфобластный лейкоз типа Беркитта.
|
| XH8F29 | Ранний острый лимфобластный лейкоз с предшественниками Т-клеток. |
| XH8NN2 |
Беркиттоподобная лимфома с аберрацией 11q.
Острый лимфобластный лейкоз, зрелый В-клеточный тип.
|
Дата разработки/пересмотра протокола: 2015 год (пересмотр 2022 год).
Пользователи протокола: врачи общей практики, терапевты, гематологи, акушеры гинекологи.
Категория пациентов: взрослые.
Шкала уровня доказательности [1]:
|
Уровень доказательности
|
Характеристика исследований, которые легли в основу рекомендаций |
| А |
Высококачественный мета-анализ, систематический обзор рандомизированных клинических исследований (РКИ) или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых, могут быть распространены на соответствующую популяцию.
|
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых, могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых, могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов |
Классификация
Классификация острого лимфобластного лейкоза (на основе пересмотренной классификации ВОЗ 2022, 5th edition) [3].
|
Новообразования из предшественников В-клеток
|
| В-клеточный лимфобластный лейкоз / лимфома |
| B-лимфобластный лейкоз/лимфома, NOS (без специфических характеристик, NOS – not otherwise specified) |
| В-клеточный лимфобластный лейкоз / лимфома с гипердиплоидией |
| В-клеточный лимфобластный лейкоз / лимфома с гиподиплоидией |
| В-клеточный лимфобластный лейкоз / лимфома с внутрихромосомной амплификацией хромосомы 21 (iAMP21) |
| B-лимфобластный лейкоз/лимфома со слиянием BCR::ABL1 |
| B-лимфобластный лейкоз/лимфома с BCR::ABL1- like признаками |
| В-лимфобластный лейкоз/лимфома с реанжировкой KMT2A |
| B-лимфобластный лейкоз/лимфома со слиянием ETV6::RUNX1 |
| B-лимфобластный лейкоз/лимфома с ETV6::RUNX1- like признаками |
| B-лимфобластный лейкоз/лимфома со слиянием TCF3::PBX1 |
| В-лимфобластный лейкоз/лимфома со слиянием IGH::IL3 |
| B-лимфобластный лейкоз/лимфома со слиянием TCF3::HLF |
| В-лимфобластный лейкоз/лимфома с другими определенными генетическими аномалиями |
| Новообразования из предшественников Т-клеток |
| Т- лимфобластный лейкоз / лимфома |
| Т-лимфобластный лейкоз/ лимфома, NOS (без специфических характеристик, NOS – not otherwise specified) |
| Ранний Т-лимфобластный лейкоз из предшественников / лимфома |
| Зрелые Т-клеточные и NK-клеточные новообразования |
| Зрелые Т-клеточные и NK-клеточные лейкозы |
| Т-пролимфоцитарный лейкоз |
| Т-крупногранулярный лимфоцитарный лейкоз |
| NK-крупногранулярный лимфоцитарный лейкоз |
| Т-клеточный лейкоз/лимфома взрослых |
| Синдром Сезари |
| Агрессивный NK-клеточный лейкоз |
Молекулярно-генетические группы риска В-ОЛЛ [4-6].
| Группы риска | |
| Благоприятный риск |
Гипердиплоидия (51–65 хромосом) Случаи с трисомией хромосом 4, 10 и 17, имеют наиболее благоприятный прогноз
t (12; 21) (p13; q22): ETV6-RUNX1
|
| Высокий риск |
Гипоплоидия (<44 хромосом)
KMT2A реанжировка (t[4;11] или другие)
t (v; 14q32) / IgH
t (9; 22) (q34; q11.2): BCR-ABL1 (определяется как высокий риск до ИТК)
Сложный кариотип (5 и более хромосомных аномалий)
BCR-ABL1-like (Ph-like)
JAK-STAT (CRLF2r, EPORr, JAK1/2/3r, TYK2r, мутации SH2B3, IL7R, JAK1/2/3)
ABL класс (реанжировки ABL1, ABL2, PDGFRA, PDGFRB, FGFR)
Другие (NTRKr, FLT3r, LYNr, PTL2Br)
Внутрихромосомная амплификация хромосомы 21 (iAMP21)
t (17; 19): слияние TCF3-HLF
Альтерации IKZF1
|
Критерии высокого риска [7]:
1) Лейкоцитоз более 30 х109/л для В-ОЛЛ и 100 х109/л для Т-ОЛЛ.
2) ≥5 хромосомных аберраций.
3) Гиподиплоидия (менее 46 хромосом).
4) BCR-ABL1+/MLL+/PBX-E2A+/Ph-like/IKZF1del/ETP/unmutated NOTCH1.
5) Иммунофенотипические варианты B-I, T-I, T-IV.
6) ОЛЛ с t(9;22), t(4;11) /MLL - рассматривать возможность выполнения алло-ТГСК.
7) МОБ - при обнаружении с чувствительностью метода 10–4 (после индукции; сроки определения МОБ должны определяться используемой схемой).
8) Нейролейкоз в дебюте.
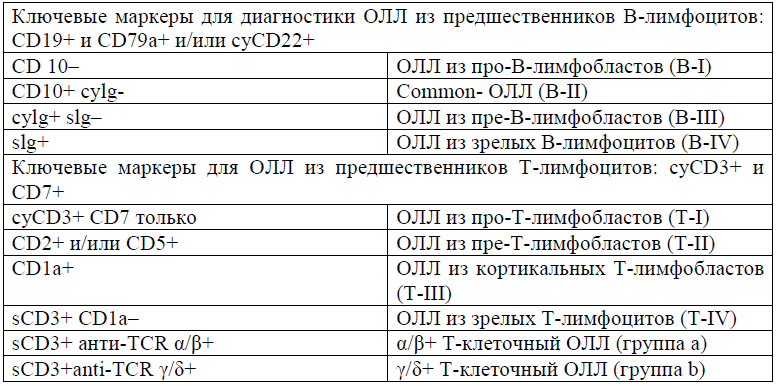
Иммунологическая классификация ОЛЛ [8]:
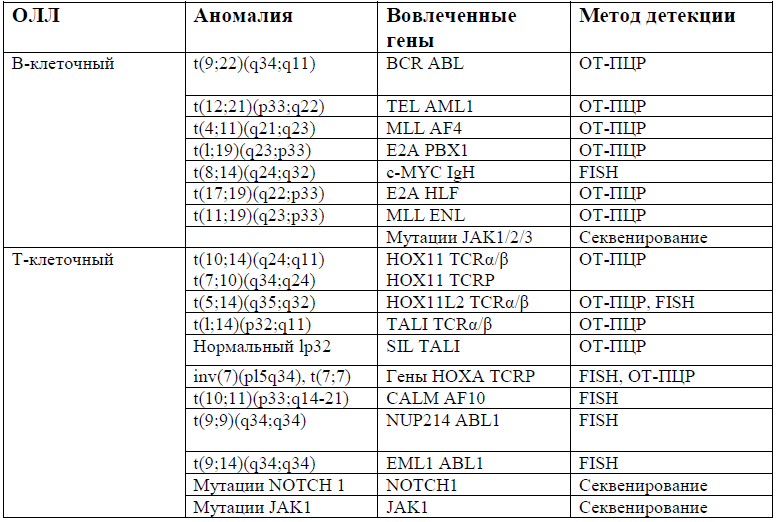
Основные генетические аномалии [9]:
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Диагностические критерии [10,11]
Жалобы:
слабость;
потливость;
утомляемость;
лихорадка;
познабливание;
боли в костях или суставах;
снижение массы тела;
геморрагические высыпания в виде петехий на коже и слизистых;
повышенная кровоточивость;
увеличение лимфоузлов, печени, селезенки.
Анамнез: следует обратить внимание на:
длительно сохраняющуюся слабость;
быструю утомляемость;
частые инфекционные заболевания;
увеличение лимфоузлов, печени, селезенки;
повышенную кровоточивость;
появление геморрагических высыпаний на коже и слизистых оболочках.
Физикальное обследование:
бледность кожных покровов;
геморрагические высыпания на коже, слизистых оболочках;
одышка;
тахикардия;
увеличение лимфоузлов;
увеличение печени;
увеличение селезенки.
Лабораторные исследования [12].
Исследование костного мозга
≥20% лимфобластов костного мозга.
Морфологическая оценка мазков аспирата костного мозга, окрашенных по Райту-Гимзе, и гематоксилином и эозином (уровень доказательности С).
Иммунофенотипирование методом проточной цитометрии.
Базовая проточная цитометрия и/или молекулярная характеристика лейкемического клона для последующего анализа минимальной остаточной болезни.
Кариотипирование метафазных хромосом.
≥20% лимфобластов костного мозга.
Морфологическая оценка мазков аспирата костного мозга, окрашенных по Райту-Гимзе, и гематоксилином и эозином (уровень доказательности С).
Иммунофенотипирование методом проточной цитометрии.
Базовая проточная цитометрия и/или молекулярная характеристика лейкемического клона для последующего анализа минимальной остаточной болезни.
Кариотипирование метафазных хромосом.
Молекулярная характеристика:
Оптимальная стратификация риска и определение лечения требуют исследования лимфобластов костного мозга или периферической крови на специфические рецидивирующие генетические аномалии с использованием:
Тестирование межфазной флуоресцентной гибридизации in situ.
Цитохимическая характеристика лимфобластов (достаточно 1 исследование)
Тестирование межфазной флуоресцентной гибридизации in situ.
Полимеразная цепная реакция с обратной транскриптазой для тестирования BCR-ABL1 при B-ОЛЛ (количественное или качественное), включая определение размера транскрипта (p190 по сравнению с p210).
Тестирование с помощью секвенирования следующего поколения на предмет слияния генов и патогенных мутаций, рекомендуется, особенно если известно, что BCR-ABL1/Ph-отрицательный или Ph-like.
Тестирование с помощью секвенирования следующего поколения на предмет слияния генов и патогенных мутаций, рекомендуется, особенно если известно, что BCR-ABL1/Ph-отрицательный или Ph-like.
Цитохимическая характеристика лимфобластов (достаточно 1 исследование)
| Миелопероксидаза | Отрицательная |
| Судан черный (липиды) | Отрицательная |
| PAS реакция (реакция на гликозаминогликаны с реактивом Шиффа) | Положительная, крупногранулярная |
| α – нафтилэстераза | Отрицательная |
| Хлорацетатэстераза | Отрицательная |
Диагностические критерии [13]
|
Морфология костный мозг и периферическая кровь Цереброспинальная жидкость |
Лимфоидные/недифференцированные бласты (≥20% поражения костного мозга)
морфология FAB L3 лимфома Беркитта
поражение ЦНС |
|
Иммунофенотипирование МПО Маркеры В-линии: CD19, CD79a, cCD22 (не менее 2); другие: TdT, CD10, CD20, CD24, cIgM, sIg (kappa или lambda) Маркеры Т-линии: cCD3; others: TdT, CD1a, CD2, CD5, CD7 CD4,CD8, TCR α/β or γ/δ |
МПО отрицательный; B/T маркеры >20% (CD3, CD79a>10%) В-ОЛЛ: Pro-B/B-I (CD19/CD79a/cCD22+) Common/B-II (CD10+/cIgM−) Pre-B/B-III (cIgM+/sIg−) Mature-B/B-IV (sIg+) Т-ОЛЛ T-lineage ОЛЛ: Pro-T/T-I (cCD3/CD7+) re-T/T-II (CD2/CD5) Cortical-T/T-III (CD1a+) Mature-T/T-IV (CD3+/CD1a−). |
| Цитогенетика/FISH/ОТ-ПЦР | ОЛЛ с неблагоприятными клинико-биологическими особенностями: Ph+ ОЛЛ, t(4;11)+ ОЛЛ, t(1;19)+ ОЛЛ, другая цитогенетика высокого риска |
Инструментальные исследования:
УЗИ органов брюшной полости и селезенки: увеличение размеров печени, селезенки;
УЗИ периферических и внутрибрюшных лимфоузлов: увеличение размеров и изменение структуры лимфоузлов;
КТ грудного сегмента: инфильтративные изменения легочной ткани, увеличение размеров внутригрудных лимфоузлов, органов средостения;
ЭКГ: нарушение проводимости импульсов в сердечной мышце;
ЭхоКГ: признаки сердечной недостаточности (ФВ<60%), снижение сократимости, диастолическая дисфункция, легочная гипертензия, пороки и регургитации клапанов;
ФГДС: признаки эзофагита, гастрита, бульбита, дуоденита (поверхностный, катаральный, эрозивный, язвенный).
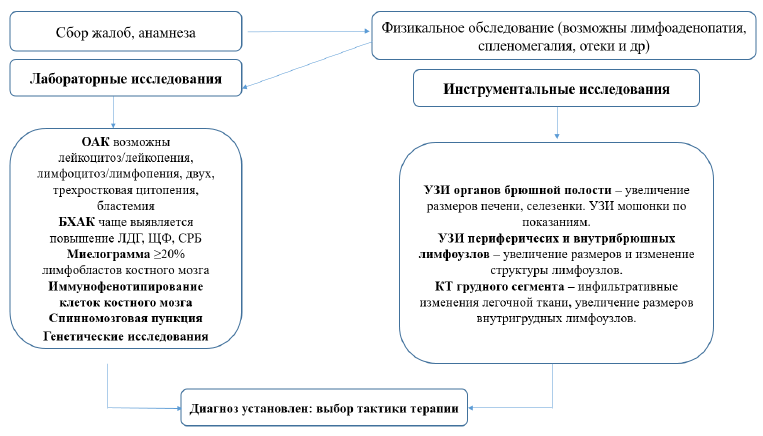
Диагностический алгоритм [14-16]
ФГДС: признаки эзофагита, гастрита, бульбита, дуоденита (поверхностный, катаральный, эрозивный, язвенный).
Показания для консультации специалистов:
Консультация гинеколога – беременность, метроррагии, меноррагии, консультация при назначении комбинированных оральных контрацептивов; для диагностики и лечения заболеваний репродуктивной системы;
Консультация кардиолога – для коррекции/подбора базисной терапии при АГ, хронической сердечной недостаточности, нарушения ритма сердечной деятельности; для диагностики и лечения заболеваний ССС;
Консультация нефролога (эфферентолог) – для диагностики и лечения заболеваний почек;
Консультация оториноларинголога – для диагностики и лечения воспалительных заболеваний придаточных пазух носа и среднего уха;
Консультация офтальмолога – нарушения зрения, воспалительные заболевания глаз и придатков;
Консультация хирурга – для решения вопроса о биопсии лимфатического узла/ образования, при развитии хирургических осложнений на курсах химиотерапии, определение показаний для хирургических вмешательств;
Консультация торакального хирурга – для определения показаний к биопсии легкого/образования средостения;
Консультация реаниматолога – нарушение витальных функций;
Консультация фтизиатра – диагностика туберкулеза;
Консультация челюстно-лицевого хирурга - инфекционно-воспалительные заболевания зубо-челюстной системы.
NB! Консультации узких специалистов – по показаниям.
Диагностический алгоритм [14-16]

| Основные исследования |
|
ОАК с лейкоцитарной формулой и определением количества тромбоцитов.
Цитологическое исследование костного мозга (миеллограмма).
Иммунофенотипирование клеток костного мозга: для установления варианта заболевания, в зависимости от наличия и выраженности экспрессии определенных антигенов:
− Антигены, специфичные для В-лимфобластов – CD10+, CD19+, CD79а+, сCD22+, sCD22+, CD24+, РАХ+, TdT+, возможна экспрессия CD34+, CD20+;
− Антигены, специфичные для Т-лимфобластов – CD1а+, CD2+, CD3+, CD4+, CD5+, CD7+, CD8+, CD34+ [2].
Цитохимическое исследование костного мозга - PAS-положительные гранулы; лимфобласты негативны в реакции на миелопероксидазу и на другие миелоидные цитохимические реакции, определяются как недифференцируемые.
Спинномозговая пункция с цитологическим исследованием клеток спинномозговой жидкости для выявления нейролекоза.
|
| Генетические исследования |
|
Стандартное цитогенетическое исследование костного мозга (исследование не менее 20 метафаз).
Исследование методом флуоресцентной in situ гибридизации, включая зонды для определения основных рецидивирующих генетических аномалий; для определения транслокации t(9;22) (q34; q11) – BCR-ABL и t(4;11) – MLL-AF4 с В-клеточными ОЛЛ и ОЛ смешанного фенотипа, в случаях, когда метод стандартной цитогенетики неинформативный.
ОT-ПЦР для определения транскрипта BCR-ABL1 при B-варианте (количественное или качественное), включая определение транскрипта (р190, p210).
NB! Если в лечебном учреждении определение данных молекулярных аномалий невозможно, необходимо сохранить материал исходного диагностического образца для возможного его молекулярного анализа в другой лаборатории после получения полных цитогенетических данных. |
| Дополнительные исследования |
|
Гистологическое исследование биоптата (гребень подвздошной кости) – при получении «сухих» пунктатов.
КТ и/или ЯМРТ грудного сегмента, брюшного сегмента, головы, малого таза (по показаниям с контрастом) - оценка размеров, структуры инфильтрированных органов, наличие образований и свободной жидкости. КТ/МРТ головы с контрастом при неврологических симптомах.
Сбор жалоб, анамнеза – наличие и время появления. Оценка общего состояния (ECOG / ВОЗ).
Биохимический анализ крови (глюкоза, натрий, калий, кальций, креатинин, аспартат аминотрансфераза, аланин аминотрансфераза, щелочная фосфатаза, ЛДГ, билирубины, мочевина, общий белок, мочевая кислота, креатинин). Для определения синдрома лизиса опухоли: ЛДГ, мочевая кислота, калий, кальций, фосфор.
Коагуляционные тесты: протромбиновое время, международное нормализованное отношение, фибриноген, активированное частичное тромбопластиновое время, Д-димер.
Общий анализ мочи (может наблюдаться гематурия).
ПЦР на вирусные инфекции (вирусные гепатиты, цитомегаловирус, вирус простого герпеса, вирус Эпштейна-Барр, вирус Varicella/Zoster) ВИЧ.
|
| Инструментальные исследования |
|
УЗИ органов брюшной полости и селезенки – увеличение размеров печени, селезенки. УЗИ мошонки по показаниям.
УЗИ периферичесих и внутрибрюшных лимфоузлов – увеличение размеров и изменение структуры лимфоузлов.
КТ грудного сегмента – инфильтративные изменения легочной ткани, увеличение размеров внутригрудных лимфоузлов, органов средостения.
ЭКГ - нарушение проводимости импульсов в сердечной мышце.
ЭхоКГ - признаки сердечной недостаточности (ФВ <60%), снижение сократимости, диастолическая дисфункция, легочная гипертензия, пороки и регургитации клапанов.
ФГДС - признаки эзофагита, гастрита, бульбита, дуоденита (поверхностный, катаральный, эрозивный, язвенный).
|
Дифференциальный диагноз
Дифференциальный диагноз [17-19]
|
Диагноз
|
Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Бифенотипический острый лейкоз | Смешанный иммунофенотип популяции бластных клеток. Коэкспрессия лимфоидных маркеров. |
Цитологическое исследование костного мозга. ИФТ костного мозга на проточном цитофлюориметре (панель острых лейкозов). |
Оценка баллов по шкале ВОЗ, Европейской группы иммунологической характеристики лейкемий (EGIL). |
|
Лимфома Ходжкина.
Неходжкинские лимфомы с миелофиброзом.
Лейкоз из больших гранулированных лимфоцитов.
|
Лимфопролиферативный синдром. |
Цитологическое исследование костного мозга, лимфоузлов.
ИФТ костного мозга.
Гистологическое и иммуногистохимическое исследования костного мозга.
|
Большое количество клеток БШ, эозинофилов и гранулоцитов, при ИФТ СD30 и CD15 позитивны
Очаговая или диффузная пролиферация лимфоцитов и/или признаки миелофиброза.
|
| ХМЛ, бластный криз. |
Бластные клетки в
периферической
крови или костном
мозге.
Уровень
лейкоцитов>
10×109/л.
|
Цитологическое,
Цитогенетическое
исследование костного мозга.
Исследование костного
мозга методом FISH (t 9;22 BCR/ABL)
|
Значительная спленомегалия. Наличие всех переходных форм гранулоцитарного
ряда. Отсутствует
«лейкемический» провал. Нейтрофильный
лейкоцитоз со сдвигом
влево до бластов.
Костный мозг гиперклеточный,
гиперплазия эритроидного
ростка.
Выявление транскрипта p190 позволяет исключить ХМЛ.
|
| ХМПЗ, бластный криз |
Лейкоцитоз
(количество
лейкоцитов ≥11 ×
109 /л).
Пальпируемая
Спленомегалия.
Повышение уровня
ЛДГ.
|
Цитологическое
исследование костного мозга.
Гистологическое
исследование костного мозга.
Молекулярно-генетическое
Исследование
периферической крови.
Стандартное
цитогенетическое
исследование костного мозга.
|
Пролиферация и атипия
мегакариоцитов,
сочетающаяся с
ретикулиновым /или
коллагеновым фиброзом
костного мозга; при
отсутствии выраженного
ретикулинового фиброза
повышенная клеточность
костного мозга с
пролиферацией клеток
гранулоцитарного ряда и
угнетением эритропоза.
Дисплазия в 1 или более
миелоидных ростках
Наличие мутаций JAK2,
CALR или MPL.
|
| ОМЛ |
Бластные клетки в
периферической
крови, костном
мозге.
|
Цитологическое,
Цитогенетическое
исследование костного мозга.
Иммунофенотипирование. |
МПО положительная.
Экспрессия
миелоидных антигенов на бластных клетках.
|
| Промиелоцитарный лейкоз | Панцитопения. Бластные клетки в периферической крови или костном мозге. Геморрагический синдром. | Цитологическое, Цитогенетическое исследование костного мозга. | Инфильтрация костного мозга бластами (более 20%) без обнаружения гипергранулированных промиелоцитов с множественными палочками Ауэра. Отсутствие транслокации t(15;17) (q22; q12); гена PML-RARα. |
| Лимфома из клеток мантии |
Лимфоаденопатия.
Повышение ЛДГ.
Выявление бластов
|
Иммунофенотипирование.
Гистологическое, иммуногистохимическое исследование.
Цитогенетика/FISH.
|
Зрелоклеточная опухоль нодулярный, нодулярно-диффузный или диффузный тип роста. Поверхностные иммуноглобулины классов IgM и IgD, положительны на CD20 и CD79a, положительны на CD5, CD43 и FMC7. Характерно положительное окрашивание на ядерный циклин D1. Транслокация t(11;14)(q13;q32). |
| Плазмоклеточный лейкоз | Бласты в костном мозге, периферической крови. Моноклональная плазмоцитарная инфильтрация костного мозга. | Иммунохимическое исследование (иммунофиксаиця крови, мочи); Иммуноглобулины; Цитологическое исследование костного мозга. | Плазматические клетки в периферической крови (≥ 20% и ≥ 2 × 10 9/L) |
Критерии диагностики острых лейкозов со смешанным фенотипом в соответствии с классификацией ВОЗ [20]:
| Миелоидная линия MPO (проточная цитометрия, иммуногистохимия, цитохимия) или моноцитоидная дифференцировка (по крайней мере 2 из перечисленных: α-нафтилацетатэстераза, ингибируемая натрия фторидом, CD11c, CD14, CD64, лизоцим). |
| Т-лимфоидная линия Цитоплазматический CD3 (цитофлуориметрически с помощью антитела к ε-цепи CD3; иммуногистохимически (для исследования материала трепанобиопсии костного мозга) с помощью неспецифического поликлонального анти-CD3) или поверхностный CD3 (редко используется для диагностики острого лейкоза смешанного фенотипа). |
| В-лимфоидная линия Яркая экспрессия CD19 + один из следующих маркеров: CD79a, cytCD22, CD10; или слабая экспрессия CD19 + яркая экспрессия по крайней мере двух из перечисленных маркеров: CD79a, cytCD22, CD10. |
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ:
Пациентам с установленным диагнозом поддерживающая химиотерапия меркаптопурином и метотрексатом, для пациентов с Ph+ ОЛЛ прием ингибиторов тирозинкиназ может проводиться в амбулаторных условиях, под контролем показателей общего анализа крови.
Пациентам с установленным диагнозом поддерживающая химиотерапия меркаптопурином и метотрексатом, для пациентов с Ph+ ОЛЛ прием ингибиторов тирозинкиназ может проводиться в амбулаторных условиях, под контролем показателей общего анализа крови.
Схема поддерживающей терапии в рамках протокола ALL – 2022 KZ (Hoelzer et al. 08/2019).
| Название препарата | Расчетная доза | Примечания |
| Меркаптопурин | 60 мг/м2 | внутрь ежедневно с коррекцией дозы в зависимости от уровня лейкоцитов и тромбоцитов |
| Метотрексат | 20 мг/м2 | внутрь 1 раз в неделю |
| Поддерживающая терапия состоит из ежедневного приема 6-меркаптопурина и еженедельно метотрексат. Продолжительность лечения 2,5–3 года является оптимальной. | ||
Доза Меркаптопурина и метотрексата корригируется в зависимости от уровня лейкоцитов и тромбоцитов
| Число лейкоцитов | Число тромбоцитов | Доза 6-МП |
| более 2,0х109/л | более 100х109/л | 100% |
| от 1,0х109/л до 2,0х109/л | от 50х109/л до 100х109/л | 50% |
| Менее 1,0х109/л | Менее 50х109/л | - |
После подтверждения диагноза Ph+ ОЛЛ показано назначение препаратов ИТК.
| Название препарата | Примечания | |
| 1-я линия иматинибом | 400-800мг/сут | внутрь |
| 2-я линия нилотинибом | 600-800мг/сут | внутрь |
| 3-я линия дазатинибом | 100-140мг/сут | внутрь |
| 3-я линия понатинибом | 45мг/сут | внутрь |
|
NB! Препараты ИТК принимают длительно, без перерывов (при снижении показателей крови или развитии токсичности коррекция дозы/перевод на другую линию терапии проводиться врачом гематологом.
Для оценки эффективности терапии необходимо проводить своевременный мониторинг гематологических, цитогенетических и молекулярно-генетических показателей.
|
||
Немедикаментозное лечение:
Режим: общеохранительный;
Диета: стол №15 (общая).
Медикаментозное лечение:
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
|
Лекарственная группа
|
Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Антинеопластические лекарственные средства | Меркаптопурин | Внутрь | В |
| Метотрексат | Внутрь | В | |
| Таргетная терапия | Иматиниб | Внутрь | А |
| Дазатиниб | Внутрь | А | |
| Нилотиниб | Внутрь | А | |
| Понатиниб | Внутрь | А | |
| Лекарственные средства, ослабляющие токсическое действие противоопухолевых препаратов | Ондансетрон | Внутривенное введение Внутрь | С |
NB! Дополнительное медикаментозное лечение проводится соответственно протоколам лечения развившихся осложнений.
Хирургическое вмешательство: нет.
Дальнейшее ведение [21]: после завершения лечения согласно протоколу, пациенты в течение 2,5-3х лет получают поддерживающую терапию. При условии сохранения ремиссии заболевания, после окончания поддерживающей терапии, пациенты находятся на «Д» учёте и наблюдаются у гематолога по месту жительства в течение 5 лет.
Индикаторы эффективности лечения и безопасности методов диагностики [22-25].
|
Статус ответ
|
Критерии для оценки ответа |
| Полная ремиссия |
Отсутствие циркулирующих лимфобластов или экстрамедуллярных поражений;
Отсутствие лимфаденопатии, спленомегалии, инфильтрации кожи/десен/мошонки/поражения ЦНС;
Трехлинейный гемопоэз и <5% бластов;
- Абсолютное количество нейтрофилов > 1000 / мкл;
- Тромбоциты > 100,000 / мкл;
- Нет рецидивов в течение 4 недель;
- Отрицательная МОБ чувствительными молекулярными зондами (чувствительность ≥10−4).
|
| Полная ремиссия с неполным восстановлением анализа крови |
Отвечает всем критериям полной ремиссии, за исключением количества тромбоцитов или абсолютного количества нейтрофилов.
NB! оценка МОБ не включена в морфологическую оценку, но обязательно должна быть оценена
|
| Рефрактерность заболевания | Невозможность достижения полного ответа после индукционного курса |
| Прогрессия заболевания | Увеличение как минимум на 25% абсолютного числа циркулирующих бластов или бластов костного мозга или развитие экстрамедуллярной болезни |
| Рецидив заболевания | Повторное появление бластов в крови или костном мозге (> 5%) или в любом экстрамедуллярном участке после полной ремиссии |
|
Статус ответа
|
Критерии ответа при Нейролейкозе |
| Ремиссия | достижение отсутствия лимфобластов в спинномозговой жидкости независимо от количества лейкоцитов; у пациентов с лейкоцитами <5/мкл в спинномозговой жидкости с наличием лимфобластов или ≥5/мкл в спинномозговой жидкости с наличием лимфобластов на момент постановки диагноза. |
| Рецидив ЦНС | определение лейкоцитов ≥5/мкл в спинномозговой жидкости с наличием лимфобластов или клинических признаков лейкемии ЦНС, таких как паралич лицевого нерва, поражение мозга/глаз или гипоталамический синдром без других объяснений. |
Критерии ответа при экстрамедуллярных поражениях:
• УЗИ или КТ шеи/грудного сегмента/брюшного сегмента/органов малого таза с внутривенным контрастированием и ПЭТ/КТ по показаниям.
Минимальная остаточная болезнь [26, 27]
Количественная оценка МОБ является основным известным фактором для определения риска заболевания, должна быть получена для всех пациентов. Если МОБ измеряется с помощью проточной цитометрии, хороший ответ МОБ часто определяется как менее 10−3. Исследования как у детей, так и у взрослых с ОЛЛ продемонстрировали сильную корреляцию между МОБ и риском рецидива, а также прогностическое значение измерений МОБ во время и после индукционной терапии. Наиболее часто используемые методы оценки МОБ включают как минимум 6-цветную проточную цитометрию, специально разработанную для выявления аномальных иммунофенотипов МОБ, количественную полимеразную цепную реакцию (RQ-PCR) в режиме реального времени для обнаружения слитых генов (например, BCR-ABL1) и/или анализы на основе секвенирования следующего поколения NGS для обнаружения клональных реаранжировок в генах. Текущая 6-цветная проточная цитометрия может обнаруживать лейкозные клетки при пороге чувствительности <1×10-4 (<0,01%) мононуклеарных клеток костного мозга. Методы ПЦР/NGS могут обнаруживать лейкозные клетки при пороге чувствительности <1x10-6 (<0,0001%). Уровень соответствия для обнаружения МОБ между этими методами, как правило, высок. Методы, не обеспечивающие такой уровень чувствительности, непригодны. Предпочтительный метод выявления МОБ и его сроки варьируются в зависимости от иммунологических и молекулярных особенностей конкретного случая, а также в соответствии с рекомендациями совместной группы или клиническим протоколом.
Сроки оценки МОБ:
После завершения начальной индукции.
Дополнительные сроки определения МОБ должны определяться используемой схемой.
Частота мониторинга может быть увеличена у пациентов с персистирующей МОБ или молекулярным рецидивом.
Периодический мониторинг МОБ (не чаще, чем каждые 3 месяца) у пациентов с полной молекулярной ремиссией.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ
Предфаза протокола протокола ALL-2022 Kz [28, 29].
При установлении диагноза лечение следует начинать немедленно, желательно в специализированном стационаре c доступом в отделение интенсивной терапии.
Предварительный этап терапии кортикостероидами (дексаметазон) в комбинации с другим препаратом (циклофосфамидом) часто назначают вместе с аллопуринолом и гидратацией в течение ∼5–7 дней. Предфазовая терапия позволяет избежать в большинстве случаев синдром лизиса опухоли (СЛО). [30]. Время, необходимое для предфазовой терапии, позволяет получить результаты диагностических исследований, таких как цитогенетика, молекулярная генетика. Ответ на предфазовую терапию определяет химиочувствительность заболевания и оценку риска [31]. При постановке диагноза и во время индукционной терапии в более 80% случаев наблюдается тяжелая нейтропения (<500/мкл), с высоким риском развития инфекций и летальности от инфекционных осложнений. Совместный анализ пяти рандомизированных исследований выявили более короткую продолжительность нейтропении, и снижение частоты фебрильной нейтропении в большинстве случаев [32], и на этом основании следует учитывать гранулоцитарную профилактику колониестимулирующим фактором [II, B].
Всем пациентам с ОЛЛ и их сибсам вне зависимости от факторов высокого риска на этапе диагностики проводится HLА-типирование. Если после завершения I фазы индукции ремиссия не достигнута, пациента относят к группе высокого риска, проводят лечение по программам для резистентных форм (FLAG±Ida, HyperCVAD, ALL-Rez BFM 2002) при условии достижения ремиссии и наличии донора также выполняют аллогенную ТКМ.
При выявлении t (9; 22) /BCR-ABL пациенты переводятся на лечение по протоколу с использованием ингибиторов тирозинкиназ (уровень доказательности А).
Короткая первая полная ремиссия или первичное рефрактерное заболевание характеризуется как очень высокий риск, при этом следует немедленно рассмотреть новые агенты, которые могут быть не перекрестно устойчивыми к химиотерапии. Для ОЛЛ из В-клеточных предшественников такие агенты более широко доступны. Блинатумомаб [33], инотузумаб [34] показали многообещающие результаты исследований фазы II и оцениваются в рандомизированных, контролируемых исследованиях, в которых группа сравнения является «стандартом лечения» химиотерапии. Клинические исследования с включением иммунотерапии с CD19 CAR-Т клетками [35] также возможно.
Используя текущий подход к терапии, частота достижения ПР увеличилась до 80–90%, для стандартного риска на ≥90% и высокого риска на ∼75%. Результаты лечения ОЛЛ связаны с возрастом пациента, с показателем полной ремиссии от 80% до 90% в детском возрасте, снижаясь до <10% у пожилых пациентов. В связи с этим рекомендованы адаптированные к возрасту протоколы, где возрастные ограничения в основном определяются гематологической и негематологической токсичностью.
Выделяют следующие возрастные группы:
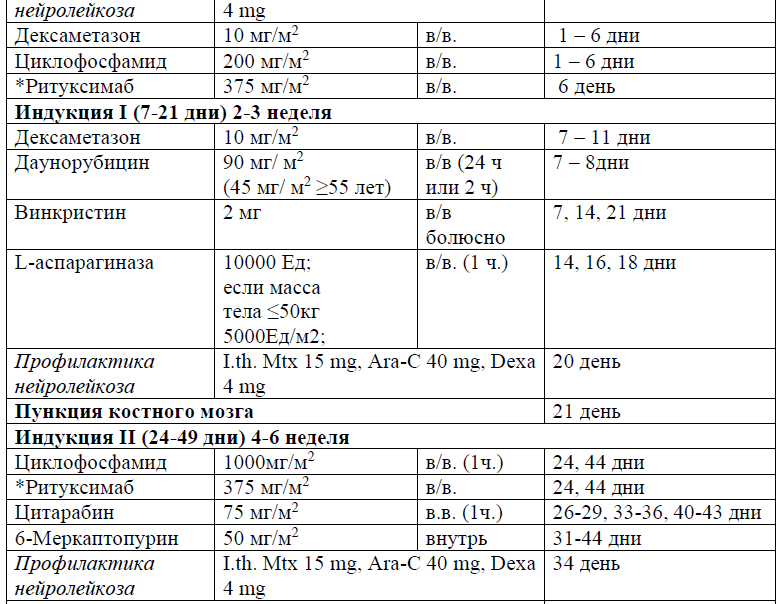
Индукция ремиссии.
Целью индукционной терапии является достижение ПР или молекулярной ПР, оцениваемой в течение 6-16 недель от начала химиотерапии. Большинство схем терапии основаны на винкристине, кортикостероидах и антрациклинах (даунорубицин, доксорубицин, идарубицин), с или без циклофосфамида или цитарабин, L-аспарагиназа, ПЭГ- аспарагиназа (имеет преимущество значительно более длительного действия). Дексаметазон предпочтительнее преднизолона, так как проникает через гематоэнцефалический барьер.
Используя текущий подход к терапии, частота достижения ПР увеличилась до 80–90%, для стандартного риска на ≥90% и высокого риска на ∼75%. Результаты лечения ОЛЛ связаны с возрастом пациента, с показателем полной ремиссии от 80% до 90% в детском возрасте, снижаясь до <10% у пожилых пациентов. В связи с этим рекомендованы адаптированные к возрасту протоколы, где возрастные ограничения в основном определяются гематологической и негематологической токсичностью.
Выделяют следующие возрастные группы:
• Подростки и молодые, определяемые от 15/18 до 35/40 лет,
• ОЛЛ для взрослых, возраст от 35/40 до ≤55/60 лет,
• Пожилые пациенты старше 55/60 лет
• Слабые пациенты, не подходящие для какой-либо интенсивной терапии старше 70/75 лет.
Ни в одном рандомизированном исследовании не проводилось сравнение ИТК в сочетании с химиотерапией с аллогенной ТГСК, аутологичной ТГСК или иммунотерапией. Ретроспективные исследования ИТК в сочетании с химиотерапией, как правило, были небольшими, в них включались пациенты, которые по медицинским показаниям не подходили для аллогенной ТГСК, и/или имели короткий период наблюдения. Врожденные различия в популяциях пациентов затрудняют сравнение этих исследований с исследованиями пациентов, перенесших аллогенную ТГСК.
Уровень сывороточного Метотрексата должен определяться через 24, 36, 42 и 48 часов после начала инфузии Метотрексата. Рекомендуется начинать инфузию Метотрексата в 14-00.
Учитывая широкий спектр лекарственного взаимодействия метотрексата, при проведении курса HD-Mtx, с целью уменьшения цитотоксичности и инактивации данного препарата необходимо отменить приём следующих ЛС:
Лучевая терапия.
Если вследствие осложнений или технических трудностей не представляется возможным провести полную программу профилактики нейролейкемии интратекальными введениями цитостатических препаратов, то пациентам рекомендуется выполнить краниальное облучение в дозе 24 Гр. При поражении ЦНС рекомендуется краниальное облучение 18Гр, рекомендуемая доза зависит от интенсивности проводимой химиотерапии. Пациентам с клиническими признаками поражения яичек на момент постановки диагноза, которое сохраняется к завершению индукционной терапии, следует рассмотреть возможность облучения яичек в мошонке, которое обычно проводится одновременно с первым циклом поддерживающей химиотерапии, общая доза должна составлять 24 Гр при 2,0 Гр / фракция. Частота рецидивов у взрослых может быть снижена с 10% до <5%. Облучение ЦНС может ограничиваться для пациентов с высоким риском.
Основные схемы химиотерапии
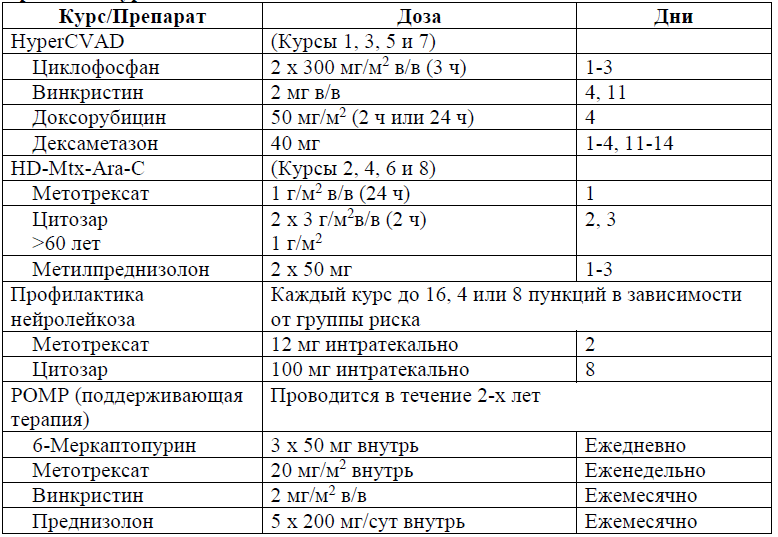
Протокол ALL – 2022 KZ (Hoelzer et al. 08/2019)
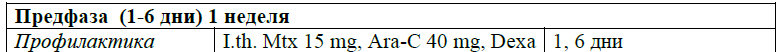




Протокол HyperCVAD/HD-Mtx-Ara-C
Протокол Ph+ ALL – 2022 KZ (Hoelzer et al. 08/2019)
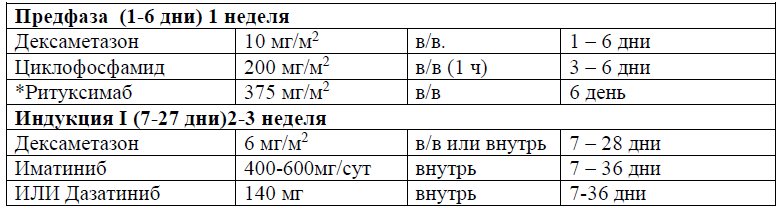
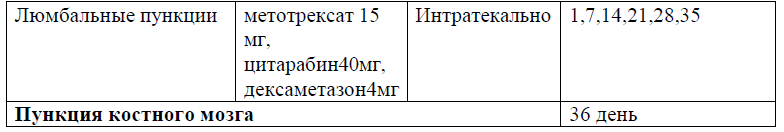
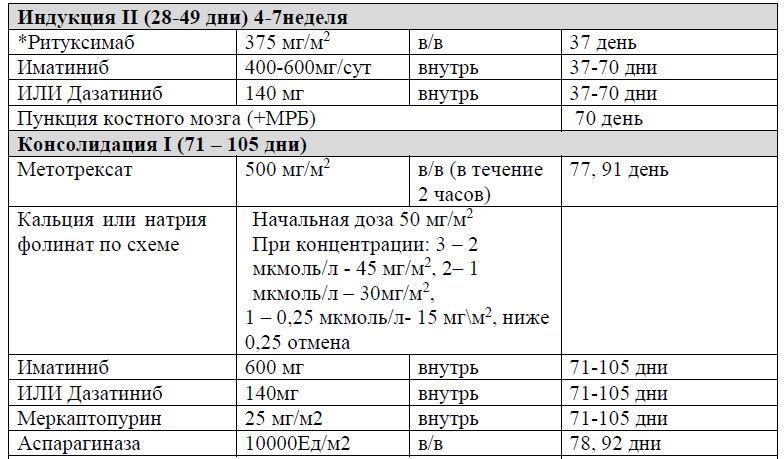

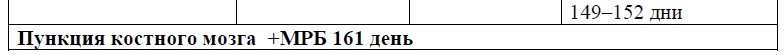

Схема терапии блинатумомабом

Стратегия терапии в зависимости от профиля мутации BCR-ABL1

Т-ОЛЛ



Хирургическое вмешательство:
Дальнейшее ведение.
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе: смотрите амбулаторный уровень.
Подростки и молодые пациенты.
Молодой возраст находится в диапазоне от 15 до 39 лет. Однако этот возраст не является строгим критерием, поскольку некоторые из рекомендуемых схем не были применены во всех возрастных группах. Данные исследований свидетельствуют о том, что для более молодых пациентов (в возрасте ≤ 21 года), особенно для тех, у кого достигнута отрицательная МОБ, аллогенная ТГСК может не давать преимуществ перед химиотерапией + ИТК. Педиатрическая терапия связана с высокой интенсивностью на нескольких этапах лечения, в том числе большие кумулятивные дозы препаратов, таких как кортикостероиды, винкристин, L-аспарагиназа и последующая терапия, направленная на ЦНС, в то время как проведение ТГСК рассматривается в меньшей степени. В исследованиях показатели выживаемости через 5 лет составили 67–78% по сравнению с 34%–41% с прежними протоколами.
Взрослые пациенты [36, 37, 38].
Результаты лечения взрослых пациентов с ОЛЛ значительно улучшились. Среднее значение безрецидивной выживаемости составило 34% (25% через 5 лет, 48% через 3 года), общей выживаемости 38% (27% через 9 лет, 54% через 5 лет). В настоящее время общая выживаемость при стандартном риске составляет 50–70% при применении только химиотерапии. Исход для пациентов с высоким риском также улучшился с 20% до 30% и до ~50% после проведения аллогенной ТГСК в первой ремиссии. При применении одних и тех же препаратов с высокой интенсивностью дозы, достигли идентичных результатов как у молодых с достижением выживаемости 60–70% и более.
Пожилые пациенты.
Пожилые пациенты (55–91 год) с паллиативным лечением имели частоту полного ответа 43% (34–53%), уровень ранней смертности составляет 24% (18–42%) и общей выживаемости всего 7 месяцев (3–10 месяцев). При проведении интенсивной химиотерапии, рекомендуемой для взрослых, частота полного ответа 56% (40–81%), ранняя смертность 23 % (6–42 %), общая выживаемость 14 мес (3–29 %). Принцип протоколов терапии для пожилых – менее интенсивная терапия, на основе кортикостероидов, винкристина и аспарагиназы, и в значительной степени с избежанием применения антрациклинов и алкилирующих агентов, чтобы уменьшить риск ранней смертности, связанной с лечением. В девяти проспективных исследованиях ОЛЛ пожилого возраста (55–81 год) с менее интенсивным протоколом показатель полной ремиссии составил 71% (43–90%), ранняя смертность снизилась до 15% (0–36%), общая выживаемость была значительной 33 месяца (16–71 месяц). Лечение пожилых пациентов с Ph-положительным ОЛЛ может представлять проблему, так как пожилые пациенты или пациенты с сопутствующими заболеваниями могут не переносить агрессивные режимы полихимиотерапии в сочетании с ИТК. В исследовании, в котором пожилые пациенты с Ph-положительным ОЛЛ (n = 55; средний возраст 68 лет; диапазон 54–79 лет; 94,5% были в возрасте 60 лет и старше) были рандомизированы для индукционной терапии иматинибом в сравнении с одной химиотерапией. При консолидирующей терапии, содержащей иматиниб, расчетная двухлетняя выживаемость составила 42%; между группами индукционного лечения не наблюдалось существенных различий. Медиана ОВ была численно выше (но не статистически значимо) среди пациентов, получавших индукцию иматинибом, по сравнению с пациентами, рандомизированными для индукции химиотерапии (23,5 против 12 месяцев). Однако частота тяжелых нежелательных явлений была значительно ниже при индукции иматинибом (39% против 90%; P = 0,005), что позволяет предположить, что индукционная терапия иматинибом может лучше переноситься, чем химиотерапия, у пожилых пациентов с Ph-положительным ОЛЛ.
Рекомендуется лечение у пациентов старше 55 лет начинать с предфазы кортикостероидами. Пациентам старше 55 лет с Ph-негативными ОЛЛ с удовлетворительным соматическим статусом без тяжелой сопутствующей патологии проведение ИТ цитостатическими препаратами в сниженных дозах с последующими курсами консолидации и поддерживающей терапии. Пациентам с Ph-негативными ОЛЛ в неудовлетворительном соматическом статусе и/или с тяжелой сопутствующей патологией выполнение паллиативной терапии – купирование симптомов заболевания, проведение заместительной терапии трансфузионными средами. Пациентам в возрасте старше 65 лет не рекомендуется рассматривать возможность выполнения алло-ТГСК в связи с высоким риском летальности. Пациенты с ОЛЛ пожилого возраста в настоящее время определяются как отдельная группа пациентов, требующая использования специфичных для данного возраста протоколов. В большинстве исследований для ОЛЛ в старшую возрастную группу включают пациентов в возрасте 55 лет и старше. При этом у пациентов старше 55 лет 30–50 % составляют Ph+ ОЛЛ.
В протоколе HyperCVAD/HD-Mtx-Ara-C предусмотрены следующие модификации дозы химиопрепаратов:
Рекомендуется лечение у пациентов старше 55 лет начинать с предфазы кортикостероидами. Пациентам старше 55 лет с Ph-негативными ОЛЛ с удовлетворительным соматическим статусом без тяжелой сопутствующей патологии проведение ИТ цитостатическими препаратами в сниженных дозах с последующими курсами консолидации и поддерживающей терапии. Пациентам с Ph-негативными ОЛЛ в неудовлетворительном соматическом статусе и/или с тяжелой сопутствующей патологией выполнение паллиативной терапии – купирование симптомов заболевания, проведение заместительной терапии трансфузионными средами. Пациентам в возрасте старше 65 лет не рекомендуется рассматривать возможность выполнения алло-ТГСК в связи с высоким риском летальности. Пациенты с ОЛЛ пожилого возраста в настоящее время определяются как отдельная группа пациентов, требующая использования специфичных для данного возраста протоколов. В большинстве исследований для ОЛЛ в старшую возрастную группу включают пациентов в возрасте 55 лет и старше. При этом у пациентов старше 55 лет 30–50 % составляют Ph+ ОЛЛ.
Рефрактерные формы острого лимфобластного лейкоза:
Терапия пациентов с рефрактерной формой острого лимфобластного лейкоза, проводится по протоколу HyperCVAD (уровень доказательности В) [13, 24, 25].
Курсы повторяются каждые 21 день от начала предыдущего, при условии повышения уровня лейкоцитов более 1 х 109/л, тромбоцитов более 50 х 109/л.
В протоколе HyperCVAD/HD-Mtx-Ara-C предусмотрены следующие модификации дозы химиопрепаратов:
Снижение дозы винкристина до 1 мг при повышении уровня билирубина выше 2 мг/дл (34,2 мкмоль/л);
Снижение дозы доксорубицина на 25% при повышении уровня билирубина до 2-3 мг/дл (34,2-51,3 мкмоль/л), на 50% при билирубине 3-4 мг/дл (51,3-68,4 мкмоль/л) и 75% при билирубине более 4 мг/дл (более 68,4 мкмоль/л);
Снижение дозы метотрексата на 25% при уровне креатинина 1,5-2 мг/дл (132,6-176,8 мкмоль/л) и на 50% при повышении уровня креатинина более 2 мг/дл (более 176,8 мкмоль/л). Доза метотрексата снижается на 25-50% при развитии нейротоксических осложнений или мукозите III-IV степени;
Разовая доза цитозара снижается до 1 г/м2 у пациентов старше 60 лет, при повышении уровня креатинина более 2 мг/дл (более 176,8 мкмоль/л) и при уровне метотрексата в конце инфузии 20 мкмоль/л;
При развитии после курса HD-Mtx-Ara-C нейтропении и/или тромбоцитопении III-IV степени в следующих курсах дозы редуцируются на 25-33%. Доза метотрексата снижается: 750 мг/м2 → 500 мг/м2 → 250 мг/м2. Доза цитозара снижается: 2 г/м2 → 1,5 г/м2 → 1 г/м2.
Использование модификаций дозы позволяет применять протокол у лиц пожилого возраста.
Лимфома Беркитта [39].
Пациентам в 1-й линии лечения применение интенсивных протоколов ХТ: R-Hyper-CVAD, ЛБ-М-04+/-R, LMB 95, CODOXM/IVAC+/-R, RNHL-BFM 90/95. Основным правилом в терапии ЛБ является соблюдение принципа «доза – интервал», т. е. проведение курса в полных дозах с соблюдением межкурсового интервала. За исключением ситуаций развития жизнеугрожающих осложнений, не рекомендуется прерывать начатый курс ХТ. В исключительных случаях при наличии тяжелых инфекционных осложнений, с которыми не удалось справиться к окончанию межкурсового перерыва, возможно увеличение интервала между курсами. Пациентам старше 55 лет без поражения ЦНС (не кандидатам для интенсивной ХТ) проведение лечения по протоколу R-DA-EPOCH. Рекомендуется все пациентам с ЛБ обязательная профилактика нейролейкемии путем интратекального введения 3 препаратов (цитарабин** 30 мг, метотрексат** 15 мг, дексаметазон** 4 мг) 1 раз за курс в течение всего периода терапии.
Используются следующие режимы химиотерапии; один является широко распространенной схемой, созданной по образцу педиатрической BFM (Берлин-Франкфурт-Мюнстер) протоколы с индукцией I, индукцией II, Циклы консолидации, иногда прерывистая реиндукция цикла и в основном используется в европейских исследованиях у взрослых. Другой подход заключается в повторении двух разных чередующихся интенсивных курсов химиотерапии, идентичные для индукции и консолидации, в общей сложности восемь циклов, таких как Hyper-CVAD (циклофосфамид, винкристин, доксорубицин, дексаметазон) протокол, преимущественно используемый в Соединенных Штатах. Большинство протоколов используют 6–8 курсов, которые содержат высокие дозы метотрексата либо высокие дозы цитарабин ± аспарагиназа. Высокие дозы цитарабина 4–12 доз по 1–3 г/м2 и метотрексата по 1–1,5 г/м2 и до 3 г/м2.
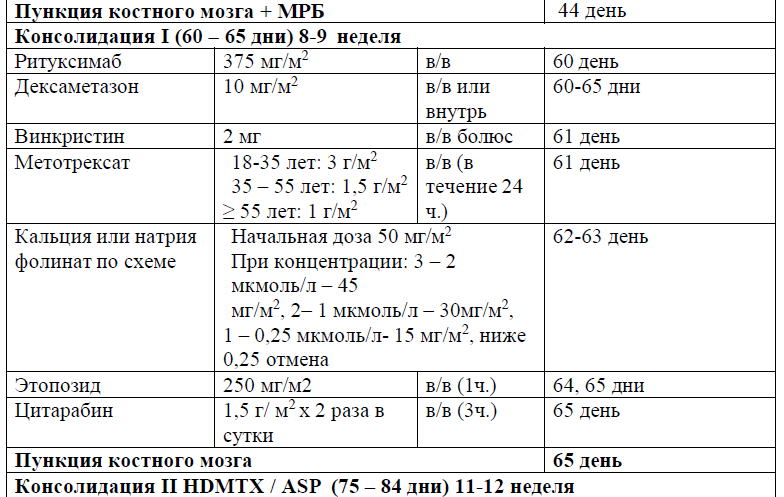
Консолидация ремиссии [40, 41, 42].
Целью постиндукционной консолидации является устранение любых лейкемических клеток, потенциально оставшихся после индукционной терапии, и МРБ. Постремиссионная фаза лечения может быть описана как интенсифицирующая терапия. Комбинация препаратов и продолжительность терапии для режимов консолидации в значительной степени различаются в зависимости от исследований и популяций пациентов, могут включать комбинации препаратов, аналогичные тем, которые используются в фазе индукции. Метотрексат, цитарабин, 6-меркаптопурин (6-МП), циклофосфамид, винкристин, кортикостероиды и L-аспарагиназа включаются в схемы консолидации/интенсификации терапии.
Используются следующие режимы химиотерапии; один является широко распространенной схемой, созданной по образцу педиатрической BFM (Берлин-Франкфурт-Мюнстер) протоколы с индукцией I, индукцией II, Циклы консолидации, иногда прерывистая реиндукция цикла и в основном используется в европейских исследованиях у взрослых. Другой подход заключается в повторении двух разных чередующихся интенсивных курсов химиотерапии, идентичные для индукции и консолидации, в общей сложности восемь циклов, таких как Hyper-CVAD (циклофосфамид, винкристин, доксорубицин, дексаметазон) протокол, преимущественно используемый в Соединенных Штатах. Большинство протоколов используют 6–8 курсов, которые содержат высокие дозы метотрексата либо высокие дозы цитарабин ± аспарагиназа. Высокие дозы цитарабина 4–12 доз по 1–3 г/м2 и метотрексата по 1–1,5 г/м2 и до 3 г/м2.
Для пациентов с Ph+ ОЛЛ лечение ИТК плюс комбинированная химиотерапия является приемлемым вариантом, которым по медицинским показаниям противопоказана аллогенная ТГСК, но как правило, резервируем его для пациентов с обнаруживаемой МОБ. Ни один протокол для комбинации ИТК с химиотерапией не доказал своих преимуществ, и нет единого мнения относительно предпочтительного режима. Консолидация ИТК в сочетании с химиотерапией может обеспечить глубокую молекулярную ремиссию, но продолжительность жизни неясна, и неясно, может ли этот подход регулярно излечивать Ph+ ALL. В большинстве исследований консолидации комбинированной химиотерапии при Ph+ ОЛЛ ингибиторы тирозинкиназы обычно не включались, и неясно, как включение ингибиторов тирозинкиназы в индукционную ремиссию и постремиссионную терапию повлияет на отдаленные результаты.
Ни в одном рандомизированном исследовании не проводилось сравнение ИТК в сочетании с химиотерапией с аллогенной ТГСК, аутологичной ТГСК или иммунотерапией. Ретроспективные исследования ИТК в сочетании с химиотерапией, как правило, были небольшими, в них включались пациенты, которые по медицинским показаниям не подходили для аллогенной ТГСК, и/или имели короткий период наблюдения. Врожденные различия в популяциях пациентов затрудняют сравнение этих исследований с исследованиями пациентов, перенесших аллогенную ТГСК.
Поддерживающая терапия.
Поддерживающая терапия состоит из ежедневного приема 6-меркаптопурина и еженедельно метотрексат. В некоторых схемах лечения рекомендованы повторные циклы винкристина, дексаметазона или других препаратов ежемесячно или более длительные интервалы. Продолжительность лечения 2,5–3 года является оптимальной. Отсутствие поддерживающей терапии значительно ухудшает исход ОЛЛ из В-клеточных предшественников, но в меньшей степени при T-ОЛЛ [43, 44]. Начало поддерживающей терапии возможно при соблюдении следующих условий:
сохранение ремиссии заболевания (пункция костного мозга перед началом поддерживающей терапии);
отсутствие инфекционных осложнений;
лейкоциты более 2,5х109/л;
гранулоциты более 750/мкл;
Поддерживающая терапия проводится амбулаторно. Доза Меркаптопурина и метотрексата корригируется в зависимости от уровня лейкоцитов и тромбоцитов.
тромбоциты более 100х109/л.
Поддерживающая терапия проводится амбулаторно. Доза Меркаптопурина и метотрексата корригируется в зависимости от уровня лейкоцитов и тромбоцитов.
| Число лейкоцитов | Число тромбоцитов | Доза 6-МП |
| более 2,0х109/л | более 100х109/л | 100% |
| от 1,0х109/л до 2,0х109/л | от 50х109/л до 100х109/л | 50% |
| Менее 1,0х109/л | Менее 50х109/л | - |
Химиотерапия при рецидивах ОЛЛ.
Наиболее часто используются схемы содержащие флударабин и антрациклин, например, FLAG-Ida (флударабин, высокие дозы ara-C, гранулоцитарный колониестимулирующий фактор и идарубицин). Липосомальный винкристин [45] рекомендован для лечения рецидива ОЛЛ. Эти стандартные химиотерапевтические подходы применимы как к ОЛЛ из В-клеточных прдшественников, так и к T-ОЛЛ.
Пациентам с рецидивом Ph+ ОЛЛ следует рассмотреть новые поколения ИТК, по результатам мутационного анализа их транскриптов BCR-ABL1. Пациенты, потерявшие ответ на иматиниб могут ответить на нилотиниб или дазатиниб и понатиниб для пациентов с мутацией T315I. ИТК являются значительно лучшим вариантом по сравнению с повторным лечением миелосупрессивной химиотерапией, лучше переносятся пожилыми пациентами. В паллиативной терапии следует провести анализ мутационного домена киназы BCR-ABL1 и использовать его для терапии с ИТК. Нет никаких доказательств долгосрочной выживаемости, достигнутой ИТК после рецидива, и большинству пациентов должна быть проведена аллогенная ТГСК.
Применение интенсивных протоколов обеспечивают долгосрочные показатели общей выживаемости ~70% у молодых пациентов [47]. Учитывая данные результаты, ТГСК в данной группе не рекомендауется, чтобы избежать ранней смертности и отдаленных последствий [III, B]. Мониторинг МРБ (наиболее важный прогностический фактор) необходим для принятия решения о выборе терапии: химиотерапии или ТГСК после достижения ремиссии. Данные недавних исследований продемонстрировали, что при ТГСК достигаются лучшие результаты, чем при химиотерапии, у пациентов с высоким уровнем МРБ после консолидации вне зависимости от факторов риска на исходном уровне [29] [III, A].
Аллогенные родственные ТГСК и неродственные доноры ТГСК могут рассматриваться как сопоставимые варианты по результатам и, следовательно, неродственная аллогенная ТГСК может быть предложена пациентам, у которых нет родственного донора [IV, A]. Гаплоидентичная ТГСК может быть вариантом у пациентов без аллогенных родственных или неродственных доноров. Аутологичная ТГСК считается менее эффективной, чем химиотерапия и аллогенная ТГСК [I, A]. Необходимость ТГСК есть в определенных генетических группах ОЛЛ, такие как BCR-ABL1-положительные или MLL-положительные случаи. В настоящее время аллогенная ТГСК для MLL-реаранжированных ОЛЛ демонстрирует лучшие результаты в большинстве самых крупных исследований, проведенных на сегодняшний день, по сравнению с химиотерапией [IV, A].
Аллогенная трансплантация гемопоэтических стволовых клеток.
Несмотря на исследования и метаанализы, сравнивающих эффективность химиотерапии и ТГСК [46], вопрос о показаниях к ТГСК у взрослых пациентов ОЛЛ при первой полной ремиссии требует обсуждения. Это связано с улучшением результатов при традиционных и таргетных режимах химиотерапии. Для пациентов с высоким риском [I, A] со второй или более ремиссией лучшим терапевтическим вариантом и лучшими результатами общей выживаемости является ТГСК.
Применение интенсивных протоколов обеспечивают долгосрочные показатели общей выживаемости ~70% у молодых пациентов [47]. Учитывая данные результаты, ТГСК в данной группе не рекомендауется, чтобы избежать ранней смертности и отдаленных последствий [III, B]. Мониторинг МРБ (наиболее важный прогностический фактор) необходим для принятия решения о выборе терапии: химиотерапии или ТГСК после достижения ремиссии. Данные недавних исследований продемонстрировали, что при ТГСК достигаются лучшие результаты, чем при химиотерапии, у пациентов с высоким уровнем МРБ после консолидации вне зависимости от факторов риска на исходном уровне [29] [III, A].
Аллогенные родственные ТГСК и неродственные доноры ТГСК могут рассматриваться как сопоставимые варианты по результатам и, следовательно, неродственная аллогенная ТГСК может быть предложена пациентам, у которых нет родственного донора [IV, A]. Гаплоидентичная ТГСК может быть вариантом у пациентов без аллогенных родственных или неродственных доноров. Аутологичная ТГСК считается менее эффективной, чем химиотерапия и аллогенная ТГСК [I, A]. Необходимость ТГСК есть в определенных генетических группах ОЛЛ, такие как BCR-ABL1-положительные или MLL-положительные случаи. В настоящее время аллогенная ТГСК для MLL-реаранжированных ОЛЛ демонстрирует лучшие результаты в большинстве самых крупных исследований, проведенных на сегодняшний день, по сравнению с химиотерапией [IV, A].
Терапевтическая тактика. Ингибиторы тирозинкиназ (ИТК) для Ph+ ОЛЛ [48, 49, 50]
Появление таргетной терапии, включая лечение Ph-положительных заболеваний с помощью ИТК, включая иматиниб, дазатиниб, нилотиниб, понатиниб, представляет собой важное достижение в терапии ОЛЛ. Дазатиниб и иматиниб являются предпочтительными ИТК для индукционной терапии. Использование конкретного ИТК должно учитывать мутации BCR-ABL1 и особенности, связанные с заболеванием. У пациентов с персистирующей МОБ или прогрессирующим заболеванием рекомендуется переключение на другой ИТК во время скрининга. Понатиниб обладает активностью в отношении мутаций T315I и эффективен при лечении пациентов с резистентным или прогрессирующим заболеванием при применении нескольких ИТК. Однако его применение ассоциируется с высокой частотой серьезных сосудистых событий (например, инсультов, инфарктов, ишемии тканей). Показания FDA включает лечение взрослых пациентов с T315I-положительным острым лимфобластным лейкозом (Ph+ ОЛЛ) и лечение взрослых пациентов с Ph+ ОЛЛ, которым не показана никакая другая терапия ИТК. Существуют сложные мутации, которые могут вызывать резистентность к понатинибу, но они редко возникают после лечения дазатинибом или нилотинибом. Нилотиниб может быть предпочтительнее у пациентов с F317L. ИТК третьего поколения понатиниб в настоящее время является единственным вариантом у пациентов с прогрессирующим течением мутации T315I.
Предпосылки для начала терапии HD-MTX:
Терапевтическая тактика в ходе проведения консолидирующего лечения [51]
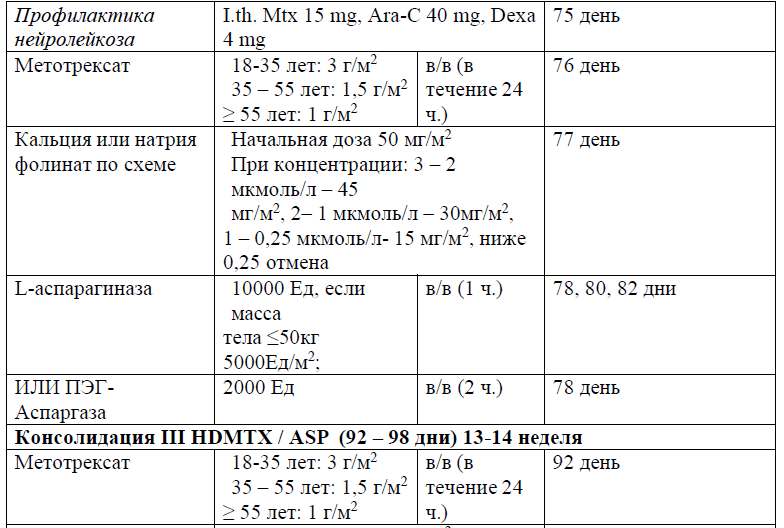
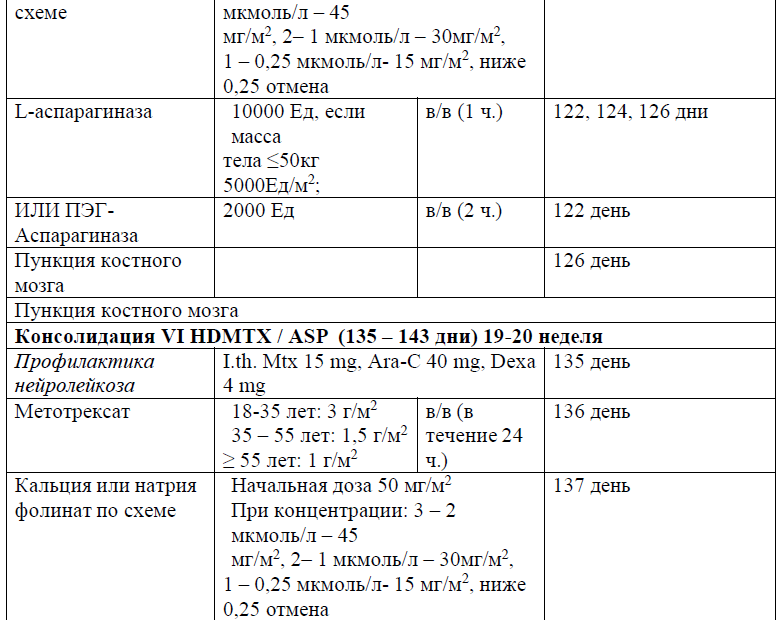
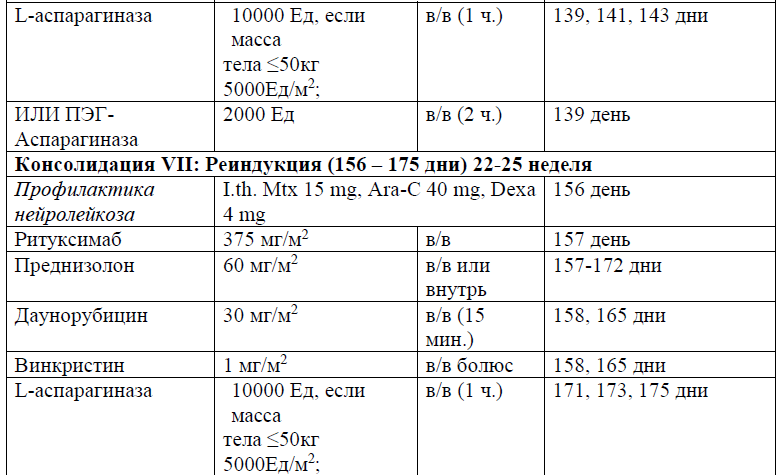
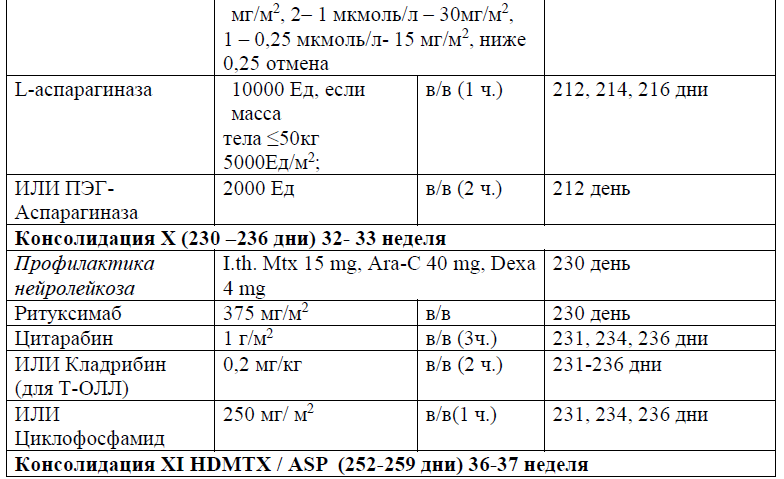
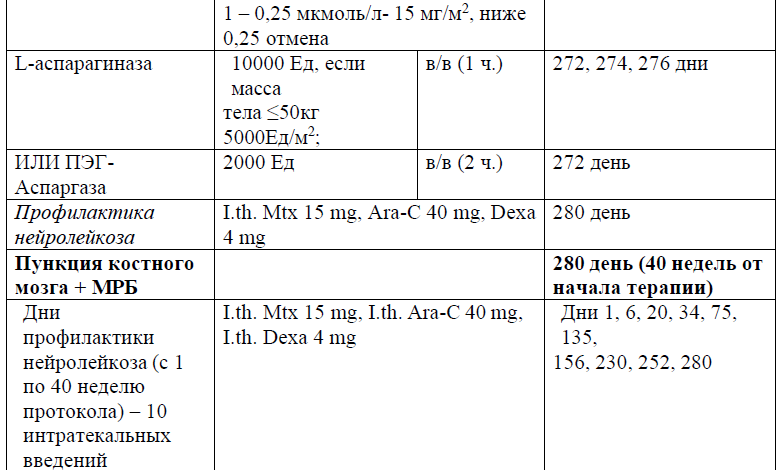
В протоколах консолидации I, II, III, V, VI, VIII, IX, XI, XII используется терапия метотрексатом – 3, 1,5 и 1 г/м2 (HD-Mtx) и 20 мг/м2 1 раз в неделю (поддерживающая терапия).
Частота и кратность введения:
В курсе Консолидация I (61 день), Консолидация II (76 день), Консолидация III (92день), Консолидация V (120 день), Консолидация VI (136 день), Консолидация VIII (190 день), Консолидация IX (210 день), Консолидация XI (254 день), Консолидация XII (270день), в дозе 3, 1,5 и 1 г/м2 в течение 24 часов;
Предпосылки для начала терапии HD-MTX:
удовлетворительное общее состояние (ECOG ≥2);
отсутствие тяжелой инфекции.
нормальный клиренс по эндогенному креатинину;
лейкоциты более 2,0 х 109/л;
гранулоциты более 0,5 х 109/л;
тромбоциты более 50 х 109/л;
отсутствие плеврального выпота и асцита.
рН мочи выше 7,2
Таблица 1. Коррекция дозы Метотрексата при почечной дисфункции
Таблица 2. Коррекция дозы Метотрексата при печеночной дисфункции
Введение Метотрексата осуществляют в течение 24 часов. 1/10 дозы вводится за 30 мин, далее 9/10 дозы вводится за 23 часа 30 мин в 3000 мл/м2 жидкости (5% раствор глюкозы). Диурез стимулируют лазиксом 20-40 мг в/в через 6 и 12 часов от начала инфузии Метотрексата. рН мочи должно поддерживаться более 7,2, что достигается инфузией натрия бикарбоната до 100 мл 4% раствора 4 раза в сутки. Необходим ежедневный контроль креатинина, билирубина, печеночных трансаминаз.
Таблица 1. Коррекция дозы Метотрексата при почечной дисфункции
| Клиренс креатинина | Уровень креатинина | Доза Метотрексата |
| - | 132,6-176,8 мкмоль/л | Снижается на 25% |
| 30-60 мл/мин | Более 176,8 мкмоль/л | Снижается на 50% |
| Менее 30 мл/мин | - | Препарат отменяется |
Таблица 2. Коррекция дозы Метотрексата при печеночной дисфункции
| Уровень билирубина | Уровень АСТ | Дозировка метотрексата |
| 50-80 мкмоль/л | Более 180 мл/дл | Снижается на 25% |
| Более 80 мкмоль/л | - | Препарат отменяется |
Если после первого курса HD-Mtx (консолидация I) развиваются нейтротоксические осложнения или мукозит III-IV степени, то в последующем курсе доза препарата снижается на 25-50%.
Уровень сывороточного Метотрексата должен определяться через 24, 36, 42 и 48 часов после начала инфузии Метотрексата. Рекомендуется начинать инфузию Метотрексата в 14-00.
У некоторых пациентов на фоне применения МТХ развивается глубокий дефицит фолатов в организме с характерными изменениями кожи и слизистых, с длительными периодами лейкопении, резко затрудняющей проведение полихимиотерапии, с нарастанием анемии, требующей заместительной терапии. Косвенными признаками дефицита фолатов являются макроцитоз и мегалобастоидность клеток эритроидного ряда по данным цитологического исследования костного мозга. Уровень фолиевой кислоты в сыворотке крови может быть нормальным или незначительно сниженным. В этих случаях целесообразно применение курсов фолиевой кислоты или лейковорина.
Учитывая широкий спектр лекарственного взаимодействия метотрексата, при проведении курса HD-Mtx, с целью уменьшения цитотоксичности и инактивации данного препарата необходимо отменить приём следующих ЛС:
аллопуринол;
Введения фолинатов (фолинат кальция, фолинат натрия) осуществляют по следующей схеме: первое введение проводят в дозе 50 мг/м2 через 18 часов после завершения введения Метотрексата, затем 30 мг/м2 через 24, 30, 36 часов после завершения введения Метотрексата.
Таблица 3. Схема назначения фолината
Эта схема рассчитана только на стандартные концентрации Метотрексата в сыворотке крови, поэтому для точной дозировки целесообразно измерять концентрацию Метотрексата.
омепразол;
ондансетрон;
все аминокислоты, в т. ч. препараты для парентерального питания;
все ЛС из группы НПВС;
все препараты из группы противогрибковых ЛС (флуконазол, вориконазол, итракназол, амфотерицин и т.д.);
амоксициллин;
оксациллин;
офлоксацин;
триметоприм;
хлорамфеникол;
доксициклин;
ацетилсалициловая кислота;
циклоспорин;
бусульфан;
доксорубицин;
циклофосфамид;
цитарабин;
гидроксикарбамид;
аспарагиназа, в т.ч. пэгаспарагиназа;
фолиевая кислота;
амиодарон;
этамбутол;
вакцины.
Введения фолинатов (фолинат кальция, фолинат натрия) осуществляют по следующей схеме: первое введение проводят в дозе 50 мг/м2 через 18 часов после завершения введения Метотрексата, затем 30 мг/м2 через 24, 30, 36 часов после завершения введения Метотрексата.
Таблица 3. Схема назначения фолината
| Время | Доза фолината пероральная | Доза фолината внутривенная |
| Через 18 часов после завершения введения МТХ | 30 мг/м2 | 50 мг/м2 |
| Через 24 часа после завершения введения МТХ | 15 мг/м2 | 30 мг/м2 |
| Через 30 часов после завершения введения МТХ | ||
| Через 36 часов после завершения введения МТХ |
Эта схема рассчитана только на стандартные концентрации Метотрексата в сыворотке крови, поэтому для точной дозировки целесообразно измерять концентрацию Метотрексата.
Подбор дозы фолинатов в зависимости от концентрации метотрексата:
Начальная доза 50 мг/м2
При концентрации 5–4 мкмоль/л -75 мг/м2,
При концентрации 4–3 мкмоль/л -60 мг/м2,
При концентрации: 3–2 мкмоль/л -45 мг/м2,
При концентрации: 2–1 мкмоль/л -30 мг/м2,
При концентрации: 1–0,25 мкмоль/л -15 мг/м2,
Ниже 0,25 мкмоль/л – отмена.
Еженедельное применение Метотрексата при поддерживающей терапии возможно, как внутривенно, так и внутримышечно, что особенно актуально в амбулаторных условиях терапии. Пероральный прием Метотрексата недопустим в связи с недостаточной биодоступностью препарата при приеме внутрь.
Еженедельное применение Метотрексата при поддерживающей терапии возможно, как внутривенно, так и внутримышечно, что особенно актуально в амбулаторных условиях терапии. Пероральный прием Метотрексата недопустим в связи с недостаточной биодоступностью препарата при приеме внутрь.
L-аспарагиназа и ПЭГаспарагиназа [52, 53, 54].
Аспарагиназу следует использовать только в специализированных центрах, и пациенты должны находиться под тщательным наблюдением в период во время и после инфузии на предмет аллергической реакции.
Гиперчувствительность, аллергия и анафилаксия
• При некоторых схемах лечения наблюдается значительная частота реакций гиперчувствительности на аспарагиназу. Особое значение вызывают системные аллергические реакции 2 степени или более, крапивница или анафилаксия
• Анафилаксия или другие аллергические реакции 3–4 степени тяжести требуют полного прекращения введения аспарагиназы
• При реакциях степени 1 и степени 2 (сыпь, приливы, крапивница и лекарственная лихорадка ≥38°C) без бронхоспазма, гипотензии, отека при необходимости парентерального введения аспарагиназы, терапия может быть продолжена с учетом премедикации
• Меры, которые можно рассмотреть для профилактики или снижения степени тяжести инфузионных реакций или реакций гиперчувствительности, включают замедление инфузии до ≥2 часов с одновременным введением физиологического раствора и применением премедикации
• Если перед введением ПЭГ используется премедикация, следует рассмотреть возможность терапевтического лекарственного мониторинга (ТЛМ) с использованием доступных анализов активности аспарагиназы, поскольку премедикация может «маскировать» системные аллергические реакции, которые могут свидетельствовать о развитии нейтрализующих антител. ТЛМ с определением активности аспарагиназы в сыворотке крови (SAA) доступен в виде сертифицированного CLIA теста, что позволяет принимать решения и корректировать лечение в режиме реального времени. Общепринятые цели анализа SAA включают минимальное значение ≥0,1 МЕ/мл. Учитывая сложность разграничения реакций гиперчувствительности и неаллергических инфузионных реакций, а также доступность ТЛМ, рассматривается возможность универсальной премедикации и ТЛМ, что позволяет снизить частоту и тяжесть нежелательных явлений, и потребность в замене пегаспаргазы.
ПЭГ-аспарагиназа и L-аспарагиназа катализирует гидролиз аспарагина, что приводит к нарушению биосинтеза белков, в первую очередь в быстроделящихся лейкозных клетках. Значительно уменьшает число опухолевых клеток в периферической крови и костном мозге. Медленно проникает из кровеносного русла в межклеточное пространство, обнаруживается в лимфе, в цереброспинальной жидкости, не определяется в моче. При повторном введении с интервалом менее 24 часов кумулирует. Период полувыведения - 8-30 ч (в/в) или 39-49 ч (в/м), не зависит от дозы, возраста, пола, площади поверхности тела, функции почек и/или печени, диагноза и длительности заболевания. Основными отличиями ПЭГ-аспарагиназы и L-аспарагиназы является их фармакокинетическая характеристика – более медленное высвобождение и более длительный эффект пегилированной формы препарата.
Перед началом лечения проводят пробу на индивидуальную переносимость: 0,1 мл раствора, содержащего 10 МЕ аспарагиназы, вводят п/к в латеральную поверхность плеча. Для контроля одновременно рядом вводят 0.1 мл 0.9% раствора NaCl (результат реакции оценивают через 3 ч). При диаметре папулы не более 1 см проба считается отрицательной и лечение может быть начато.
До начала введения необходим контроль следующих показателей:
Развитие лейкопении (нейтропении) без признаков тяжёлой инфекции не является основанием для отказа от терапии ПЭГ-/ L-аспарагиназой или отмены препарата.
Способ применения: для в/в введения разовую дозу растворяют в 400–500 мл изотонического раствора натрия хлорида, вводят через инфузомат в течение 2-3х часов.
ПЭГ-аспарагиназа и L-аспарагиназа катализирует гидролиз аспарагина, что приводит к нарушению биосинтеза белков, в первую очередь в быстроделящихся лейкозных клетках. Значительно уменьшает число опухолевых клеток в периферической крови и костном мозге. Медленно проникает из кровеносного русла в межклеточное пространство, обнаруживается в лимфе, в цереброспинальной жидкости, не определяется в моче. При повторном введении с интервалом менее 24 часов кумулирует. Период полувыведения - 8-30 ч (в/в) или 39-49 ч (в/м), не зависит от дозы, возраста, пола, площади поверхности тела, функции почек и/или печени, диагноза и длительности заболевания. Основными отличиями ПЭГ-аспарагиназы и L-аспарагиназы является их фармакокинетическая характеристика – более медленное высвобождение и более длительный эффект пегилированной формы препарата.
Объем обследований перед началом терапии ПЭГ-/L-аспарагиназой.
Противопоказания к применению аспарагиназ:
Гиперчувствительность (анафилактический шок, отек Квинке);
Тяжелые нарушения функции печени, почек, поджелудочной железы (в т.ч. в анамнезе), панкреатит с выраженным болевым синдромом;
Кровоизлияние в головной мозг.
Беременность, кормление грудью.
Перед началом лечения проводят пробу на индивидуальную переносимость: 0,1 мл раствора, содержащего 10 МЕ аспарагиназы, вводят п/к в латеральную поверхность плеча. Для контроля одновременно рядом вводят 0.1 мл 0.9% раствора NaCl (результат реакции оценивают через 3 ч). При диаметре папулы не более 1 см проба считается отрицательной и лечение может быть начато.
До начала введения необходим контроль следующих показателей:
Коагулограмма (уровень фибриногена, ПТИ);
Активность АЛТ, АСТ, панкреатической амилазы, уровень билирубина;
Уровень альбумина.
Развитие лейкопении (нейтропении) без признаков тяжёлой инфекции не является основанием для отказа от терапии ПЭГ-/ L-аспарагиназой или отмены препарата.
Коагулопатия.
Использование ПЭГ-/L-аспарагиназы должно сопровождаться мониторингом коагуляционных показателей. Введение ПЭГ-/L-аспарагиназы должно быть приостановлено в следующих случаях:
при снижении протромбинового индекса ниже 70%;
при снижении фибриногена ниже 1,0 г/л;
при наличии геморрагического синдрома;
снижении уровня альбумина менее чем на 50% от исходного.;
тромботических осложнениях.
Снижение уровня фибриногена менее чем на 50% от исходного, является основанием для отказа от очередного введения L-аспарагиназы. В этом случае необходимо контролировать уровень фибриногена и возобновить терапию L-аспарагиназой после его нормализации.
При остром кровоизлиянии или тромбозе, по возможности восполнение фибриногена свежезамороженной плазмой внутривенно, в зависимости от результата коагулограммы (при массивном кровоизлиянии - замещение фибриногена до получения результатов коагулограммы);
Тяжелый панкреатит с выраженным болевым синдромом и лабораторным подтверждением в виде высокого уровня амилазы крови/диастазы мочи является основанием для полного отказа от дальнейшей терапии L-аспарагиназой.
При наличии тошноты и рвоты, но отсутствии тяжёлой гепатотоксичности и панкреатита возможно:
В этих случаях проводится заместительная терапия свежезамороженной плазмой и/или Альбумином по клиническим показаниям.
Снижение уровня фибриногена менее чем на 50% от исходного, является основанием для отказа от очередного введения L-аспарагиназы. В этом случае необходимо контролировать уровень фибриногена и возобновить терапию L-аспарагиназой после его нормализации.
При остром кровоизлиянии или тромбозе, по возможности восполнение фибриногена свежезамороженной плазмой внутривенно, в зависимости от результата коагулограммы (при массивном кровоизлиянии - замещение фибриногена до получения результатов коагулограммы);
Органная токсичность.
При появлении лабораторных признаков гепатотоксичности препарата (повышение уровня билирубин более 2-х норм, трансаминаз более 5 норм), очередное введение можно отложить на 5-7 дней. В процессе лечения до и после введения ПЭГаспарагиназы или L-аспарагиназы необходимо контролировать активность панкреатической амилазы.
Тяжелый панкреатит с выраженным болевым синдромом и лабораторным подтверждением в виде высокого уровня амилазы крови/диастазы мочи является основанием для полного отказа от дальнейшей терапии L-аспарагиназой.
При наличии тошноты и рвоты, но отсутствии тяжёлой гепатотоксичности и панкреатита возможно:
8-24 часовая инфузия глюкоза 5% : NaCl 0,9% = 1:1;
применение противорвотных препаратов типа метоклопромид, ондансетрон;
применение ферментных препаратов (фестал, мезим-форте).
Критерии отмены L-аспарагиназы.
Наличие гепатита с высокой активностью (токсический гепатит, связанный с терапией 6-МП) является показанием к временной отмене;
При тяжёлой аллергической реакции (отёк Квинке, анафилактический шок);
Развитие острого панкреатита;
Инсульт.
Факторы, связанные с повышенным риском развития нейролейкоза у взрослых, включают иммунофенотип зрелых В-клеток, иммунофенотип Т-клеток, высокое количество лейкоцитов и повышенный уровень ЛДГ в сыворотке.
Классификация состояния ЦНС:
Пациентам с клиническими признаками поражения яичек на момент постановки диагноза, которое не полностью разрешилось к концу индукционной терапии, следует рассмотреть вопрос о лучевой терапии, что обычно проводится одновременно с первым циклом поддерживающей химиотерапии. Суммарная доза должна составлять 24 Гр по 2,0 Гр/фракцию.
Профилактика, терапия нейролейкоза [55, 56].
Терапия, направленная на профилактику и/или лечение нейролейкоза, может включать интракраниальное облучение (18 Гр в дозах от 1,8 до 2,0 Гр/фракцию), интратекальную химиотерапию (например, метотрексат, цитарабин, кортикостероиды) и/или системную химиотерапию (например, высокие дозы метотрексата, средние/высокие дозы цитарабина, L-аспарагиназы). Профилактику проводят всем пациентам на протяжении всего курса лечения ОЛЛ, от индукции до консолидации и поддерживающих курсов лечения.
Факторы, связанные с повышенным риском развития нейролейкоза у взрослых, включают иммунофенотип зрелых В-клеток, иммунофенотип Т-клеток, высокое количество лейкоцитов и повышенный уровень ЛДГ в сыворотке.
Поражение ЦНС должно оцениваться проведением люмбальной пункции в сроки, которые должны соответствовать выбранной схеме лечения. Интратекальное введение рекомендуется с первой люмбальной пункции.
Классификация состояния ЦНС:
ЦНС-1: отсутствие лимфобластов в спинномозговой жидкости независимо от количества лейкоцитов.
ЦНС-2: лейкоциты <5/мкл в спинномозговой жидкости с наличием лимфобластов.
ЦНС-3: лейкоциты ≥5/мкл в спинномозговой жидкости с наличием лимфобластов.
Пациентам с клиническими признаками поражения яичек на момент постановки диагноза, которое не полностью разрешилось к концу индукционной терапии, следует рассмотреть вопрос о лучевой терапии, что обычно проводится одновременно с первым циклом поддерживающей химиотерапии. Суммарная доза должна составлять 24 Гр по 2,0 Гр/фракцию.
CAR Т-клеточная терапия [57- 61].
Одним из основных методов лечения пациентов с прогрессирующим ОЛЛ была адаптивная клеточная терапия для достижения эффекта «трансплантат против лейкоза» посредством аллогенной ТКМ или DLI, что в свою очередь приводит к значительному риску РТПХ. В настоящее время трансплантация костного мозга является единственным методом лечения рецидивов или резистетного ОЛЛ, но многие пациенты не могут являться кандидатами на трансплантацию из-за возраста или прогрессирования заболевания. Создание Т-клеток с химерным антигенным рецептором (CAR) для лечения ОЛЛ представляет собой значительный прогресс и показало значительно более высокую общую выживаемость по сравнению с существующими схемами. Пациенты, которые ранее не могли быть трансплантированы из-за плохого статуса ремиссии, могут достичь полного ответа и рассматриваться на проведение ТКМ. Терапия CAR Т-клетками основана на генетическом манипулировании Т-клетками пациента с целью достижения ответа против лейкемического клеточного поверхностного антигена CD19. CAR Т-клеточная терапия была рекомендована для ускоренного одобрения консультативным комитетом FDA в июле 2017 г. и полностью одобрена FDA в августе 2017 г. для лечения пациентов в возрасте до 25 лет (в возрасте <26 лет) с резистетным или рецидивирующим B-ОЛЛ. По результатам исследований показатель ремиссии значительно выше по сравнению со средним показателем ремиссии у пациентов, получавших стандартную химиотерапию после рецидива (88% против 30%). У пациентов, перенесших аллогенную ТГСК, рецидивов не наблюдалось (наблюдение в течение 2–24 мес). Данные последующего наблюдения за взрослыми пациентами, включенными в это исследование (n = 53), показали частоту полного ответа 83%, у 32 пациентов был достигнут МРБ-отрицательный полный ответ. При медиане наблюдения 29 месяцев (диапазон 1– 65), медиана общей выживаемости составила 12,9 месяца (95% ДИ, 8,7–23,4 месяца).
При диагностике острого лимфобластного лейкоза в первый триместр беременности до начала химиотерапии рекомендуется обсудить вопрос о прерывании беременности. Химиотерапия в первом триместре беременности имеет 10-20% риск развития тяжелых аномалий развития. Необходимо обсудить с пациентом все аргументы за и против искусственного прерывания беременности (УД - IIС). Химиотерапию у беременных рекомендуется начинать не раньше второго триместра (после 14-15 недель гестации), когда завершается формирование гемоплацентарного барьера. Препараты в высоких дозах могут проникать через гематоэнцефалический барьер. Использование высоких доз метотрексата во время беременности ассоцируется с развитием аминоптеринового синдрома (диостоз черепа, задержка окостенения, гипертелоризм, микрогнатия, аномалия глаз). Иматиниб не проникает через гематоэнцефалический барьер и, вероятно, через гематоплацентарный барьер. Поэтому врожденные аномалии очек, костей, головного мозга, кишечника и сердца при использовании данного препарата возможны только при использовании в первом триместре, причем данная патология возникает в 19% случаев.
Применение циклофосфамида, треотинина, ритуксимаба во втором и третьем триместрах является безопасным для плода.
По данным двух ретроспективных исследований, охвативших соответственно 84 и 111 детей, матери которых получали в период беременности химиотерапию по поводу гемобластозов и других опухолей, в отдаленном периоде (медиана наблюдения 18,7 лет) не выявлено нарушений нервно-психического, полового развития и увеличения риска новообразований. С медицинской точки зрения необходимости аборта в поздние сроки беременности (16—28 нед) нет, более того, риск выполнения этой процедуры (малое кесарево сечение, искусственные роды) превышает риск проведения химиотерапии: вероятность массивного кровотечения, наличие очага инфекции, затягивание начала индукционного курса, возможность гибели плода. При выявлении ОЛЛ на сроке беременности более 34 недель целесообразно выполнить родоразрешение с последующим проведением ПХТ (УД - IIC). Современные методы лечения позволяют женщинам во время беременности проходить химиотерапию и рожать абсолютно здоровых детей. Шансы на успешное лечение и выживаемость, абсолютно такие же, как и у всех остальных пациентов. Беременность не влияет на исход болезни, если лечение проводится в полной мере и вовремя.
Карта наблюдения пациента, маршрутизация пациента:
Особенности введения беременных с острым лимфобластным лейкозом [62-64].
Пациентки женского пола должны пройти тестирование на беременность до начала терапии. Консультирование по вопросам фертильности и вариантов сохранения беременности должны быть представлены всем пациенткам.
При диагностике острого лимфобластного лейкоза в первый триместр беременности до начала химиотерапии рекомендуется обсудить вопрос о прерывании беременности. Химиотерапия в первом триместре беременности имеет 10-20% риск развития тяжелых аномалий развития. Необходимо обсудить с пациентом все аргументы за и против искусственного прерывания беременности (УД - IIС). Химиотерапию у беременных рекомендуется начинать не раньше второго триместра (после 14-15 недель гестации), когда завершается формирование гемоплацентарного барьера. Препараты в высоких дозах могут проникать через гематоэнцефалический барьер. Использование высоких доз метотрексата во время беременности ассоцируется с развитием аминоптеринового синдрома (диостоз черепа, задержка окостенения, гипертелоризм, микрогнатия, аномалия глаз). Иматиниб не проникает через гематоэнцефалический барьер и, вероятно, через гематоплацентарный барьер. Поэтому врожденные аномалии очек, костей, головного мозга, кишечника и сердца при использовании данного препарата возможны только при использовании в первом триместре, причем данная патология возникает в 19% случаев.
При проведении терапии у беременных необходимо исключить использование фторхинолонов (риск развитии артропатии, нарушение остеогенеза), сульфаниламидов (дефекты нервной трубки, мальформация сердца).
Применение циклофосфамида, треотинина, ритуксимаба во втором и третьем триместрах является безопасным для плода.
По данным двух ретроспективных исследований, охвативших соответственно 84 и 111 детей, матери которых получали в период беременности химиотерапию по поводу гемобластозов и других опухолей, в отдаленном периоде (медиана наблюдения 18,7 лет) не выявлено нарушений нервно-психического, полового развития и увеличения риска новообразований. С медицинской точки зрения необходимости аборта в поздние сроки беременности (16—28 нед) нет, более того, риск выполнения этой процедуры (малое кесарево сечение, искусственные роды) превышает риск проведения химиотерапии: вероятность массивного кровотечения, наличие очага инфекции, затягивание начала индукционного курса, возможность гибели плода. При выявлении ОЛЛ на сроке беременности более 34 недель целесообразно выполнить родоразрешение с последующим проведением ПХТ (УД - IIC). Современные методы лечения позволяют женщинам во время беременности проходить химиотерапию и рожать абсолютно здоровых детей. Шансы на успешное лечение и выживаемость, абсолютно такие же, как и у всех остальных пациентов. Беременность не влияет на исход болезни, если лечение проводится в полной мере и вовремя.
Карта наблюдения пациента, маршрутизация пациента:

Немедикаментозное лечение:
• Режим: общеохранительный.
• Диета: №15.
Лучевая терапия.
Если вследствие осложнений или технических трудностей не представляется возможным провести полную программу профилактики нейролейкемии интратекальными введениями цитостатических препаратов, то пациентам рекомендуется выполнить краниальное облучение в дозе 24 Гр. При поражении ЦНС рекомендуется краниальное облучение 18Гр, рекомендуемая доза зависит от интенсивности проводимой химиотерапии. Пациентам с клиническими признаками поражения яичек на момент постановки диагноза, которое сохраняется к завершению индукционной терапии, следует рассмотреть возможность облучения яичек в мошонке, которое обычно проводится одновременно с первым циклом поддерживающей химиотерапии, общая доза должна составлять 24 Гр при 2,0 Гр / фракция. Частота рецидивов у взрослых может быть снижена с 10% до <5%. Облучение ЦНС может ограничиваться для пациентов с высоким риском.
Медикаментозное лечение
Основные схемы химиотерапии
Протокол ALL – 2022 KZ (Hoelzer et al. 08/2019)
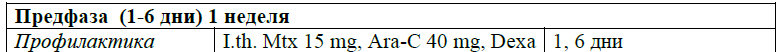











| Поддерживающая терапия с 41 до 130 недели включительно т.е. до общей продолжительности лечения от его начала 2.5 года |
|
1Ритуксимаб 375 мг/м2 в/в при CD20+ В-ОЛЛ.
меркаптопурин 60 мг/м2 внутрь ежедневно с коррекцией дозы в зависимости от уровня лейкоцитов и тромбоцитов (таблица)
Метотрексат 20 мг/м2 в/м или в/в 1 раз в неделю.
Люмбальная пункция (метотрексат 15 мг, цитарабин 30 мг, дексаметазон 4 мг), пункция костного мозга 1 раз в 3 месяца.
|
Протокол HyperCVAD/HD-Mtx-Ara-C

Протокол Ph+ ALL – 2022 KZ (Hoelzer et al. 08/2019)




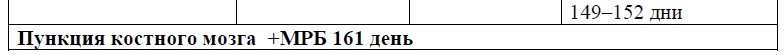

Схема терапии блинатумомабом

Стратегия терапии в зависимости от профиля мутации BCR-ABL1

Т-ОЛЛ



Трансфузионая поддержка.
Показания к проведению трансфузионной терапии определяются в первую очередь клиническими проявлениями индивидуально для каждого пациента с учетом возраста, сопутствующих заболеваний, переносимости химиотерапии и развития осложнений на предыдущих этапах лечения.
Лабораторные показатели для определения показаний имеют вспомогательное значение, в основном для оценки необходмиости профилактичесиких трансфузий концентрата тромбоцитов.
Показания к трансфузиям также зависят от времени, после проведения курса химиотерапии – принимаются во внимание, прогнозируемое снижение показателей в ближайшие несколько дней.
Эритроцитарная масса/взвесь (уровень доказательности D):
уровень гемоглобина не нужно повышать, пока обычные резервы и компенсационные механизмы достаточны для удовлетворения потребностей тканей в кислороде;
существует только одно показание для трансфузий эритроцитсодержащих сред при хронических анемиях – симптомная анемия (проявляющаяся тахикардией, одышкой, стенокардией, синкопе, de novo депрессией или элевацией ST);
уровень гемоглобина менее 30 г/л является абсолютным показанием для трансфузии эритроцитов;
при отсутствии декомпенсированных заболеваний сердечно-сосудистой системы и легких показаниями для профилактической трансфузии эритроцитов при хронических анемиях могут быть уровни гемоглобина:
|
Возраст (лет)
|
Триггерный уровень Hb (г/л) |
| <25 | 35-45 |
| 25-50 | 40-50 |
| 50-70 | 55 |
| >70 | 60 |
Концентрат тромбоцитов (уровень доказательности D):
при снижении уровня тромбоцитов менее 10 х109/л или появлении геморрагических высыпаний на коже (петехии, синячки) проводится профилактическая трансфузия аферезных тромбоцитов.
профилактическая трансфузия аферезных тромбоцитов у пациентов с лихорадкой, пациентам, которым планируется инвазивное вмешательство может проводится при более высоком уровне - 10 х109/л.
при наличии геморрагического синдрома петехиально-пятнистого типа (носовые, десневые кровотечения, мено-, метроррагии, кровотечения других локализаций) трансфузия концентрата тромбоцитов проводится с лечебной целью.
Перечень основных лекарственных средств (имеющих 100% вероятность применения)
Свежезамороженная плазма (уровень доказательности D):
трансфузии СЗП проводятся у пациентов с кровотечением или перед проведением инвазивных вмешательств;
пациенты с МНО ≥ 2.0 (при нейрохирургических вмешательствах ≥1.5) рассматриваются как кандидаты для трансфузии СЗП при планировании инвазивных процедур. При плановых вмешательствах возможно назначение не менее, чем за 3 дня до вмешательства фитоменадиона не менее 30 мг/сут внутривенно или внутрь.
Перечень основных лекарственных средств (имеющих 100% вероятность применения)
| Лекарственная группа | Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Антинеопластические лекарственные средства | Даунорубицин | Внутривенное введение | А |
| Метотрексат | Внутривенное введение | А | |
| Меркаптопурин | Внутрь | В | |
| Ритуксимаб | Внутривенное введение | А | |
| ПЭГ - аспарагиназа | Внутривенное введение | А | |
| L-аспарагиназа | Внутривенное введение | А | |
| Этопозид | Внутривенное введение | А | |
| Циклофосфамид | Внутривенное введение | В | |
| Цитарабин | Внутривенное введение | В | |
| Таргетная терапия | Блинатумомаб | Внутривенное введение | В |
| Венетоклакс | Внутривенное введение | В | |
| Дазатиниб | Внутрь | А | |
| Иматиниб | Внутрь | А | |
| Нилотиниб | Внутрь | А | |
| Понатиниб | Внутрь | А |
NB! Дополнительное медикаментозное лечение проводится соответственно протоколам лечения развившихся осложнений.
Хирургическое вмешательство:
Хирургическое вмешательство, оказываемое в стационарных условиях: проводится по жизненным показаниям при развитии острой хирургической патологии.
Дальнейшее ведение.
После завершения лечения согласно протоколу, пациенты в течение 2,5-3х лет получают поддерживающую терапию. При условии сохранения ремиссии заболевнаия, после окончания поддерживающей терапии, пациенты находятся на «Д» учёте и наблюдаются у гематолога по месту жительства в течение 5 лет.
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе: смотрите амбулаторный уровень.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации:
Проведение курсов химиотерапии, таргетной терапии и иных видов лечения.
Проведение гаплоидентичной/аллогенной трансплантации гемопоэтических стволовых клеток.
Контрольное обследование перед/после гапло/аллоТКМ.
Показания для экстренной госпитализации:
Впервые выявленный острый лейкоз;
Соматически тяжелый пациент (ECOG≥3 баллов);
Опухолевая интоксикация, синдром сдавление;
Тяжелой анемический/геморрагический синдром, требующий заместительной терапии;
Полиорганная недостаточность вследствие основного заболевания;
Фебрильная нейтропения.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- 1) Scottish Intercollegiate Guidelines Network (SIGN). SIGN 50: a guideline developer’s handbook. Edinburgh: SIGN; 2014. (SIGN publication no. 50). [October 2014]. Available from URL: http://www.sign.ac.uk. 2) Sant M, Allemani C, Tereanu C et al. Incidence of hematologic malignancies in Europe by morphologic subtype: results of the HAEMACARE project. Blood 2010; 116: 3724–3734 3) The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Lymphoid Neoplasms. Rita Alaggio, Catalina Amador, Ioannis Anagnostopoulos, Ayoma D. Attygalle, Iguaracyra Barreto de Oliveira Araujo, Emilio Berti, Govind Bhagat, Anita Maria Borges, Daniel Boyer, Mariarita Calaminici, Amy Chadburn, John K. C. Chan, Wah Cheuk, Wee-Joo Chng, John K. Choi, Shih-Sung Chuang, Sarah E. Coupland, Magdalena Czader, Sandeep S. Dave, Daphne de Jong, Ming-Qing Du, Kojo S. Elenitoba-Johnson, Judith Ferry, Julia Geyer, Wenbin Xiao Leukemia volume 36, pages1720–1748 (2022). 4) There are other results that are not less than 44 chromosomes that may be equivalent to hypodiploidy and have the same implications. It is important to distinguish true hypodiploidy from masked hypodiploidy, which results from the doubling of hypodiploid clones. Carroll AJ, Shago M, Mikhail FM, et al. Masked hypodiploidy: Hypodiploid acute lymphoblastic leukemia (ALL) mimicking hyperdiploid ALL in children: A report from the Children's Oncology Group. Cancer Genet 2019;238:62-68. 5) Jain N, Roberts KG, Jabbour E, et al. Ph-like acute lymphoblastic leukemia: a high-risk subtype in adults. Blood 2017;129:572-581. 6) IKZF1plus defines a new minimal residual disease-dependent very-poor prognostic profile in pediatric B-cell precursor acute lymphoblastic leukemia. J Clin Oncol 2018;36:1240-1249. 7) Inaba H, Greaves M, Mullighan CG. Acute lymphoblastic leukaemia. Lancet 2013; 381: 1943–1955. 8) U.S. National Library of Medicine-Key MEDLINE® Indicators. Available at: Accessed February 1, 2019. 9) Paul S, Kantarjian H, Jabbour EJ. Adult Acute Lymphoblastic Leukemia. Mayo Clin Proc 2016; 91: 1645–1666. 10) Faderl S, O'Brien S, Pui CH, et al. Adult acute lymphoblastic leukemia: concepts and strategies. Cancer 2010;116:1165-1176. 11) Jabbour EJ, Faderl S, Kantarjian HM. Adult acute lymphoblastic leukemia. Mayo Clin Proc 2005;80:1517-1527. 12) ALL arising from prior chemotherapy or underlying hematologic malignancy may be associated with adverse outcomes. Saygin C, et al. Blood Adv 2019;3:4228-4237. 13) Beldjord K, Chevret S, Asnafi V et al. Oncogenetics and minimal residual disease are independent outcome predictors in adult patients with acute lymphoblastic leukemia. Blood 2014; 123: 3739–3749. 14) Jabbour E, O'Brien S, Konopleva M, Kantarjian H. New insights into the pathophysiology and therapy of adult acute lymphoblastic leukemia. Cancer 2015; 121: 2517–2528. 15) Mullighan CG, Goorha S, Radtke I, Miller CB, Coustan-Smith E, Dalton JD et al. Genome-wide analysis of genetic alterations in acute lymphoblastic leukaemia. Nature 2007; 446: 758–764. 16) Alvarnas JC, Brown PA, Aoun P, Ballen KK, Barta SK, Borate U et al. Acute lymphoid leukemia (version 2.2015). Natl Comprehens Cancer Netw 2015; 13: 1240–1279. 17) Brown P.A. et al. NCCN Clinical Practice Guidelines in Oncology. Acute Lymphoblastic Leukemia. Version 2.2019. 2019. 115 p. 18) Gökbuget N. et al. Recommendations of the European Working Group for Adult ALL (EWALL) // UNI-MED Verlag AG. 2011. 204 p. 19) Lymph node pathology for clinicians / Michel R Nasr, Anamarija M. Perry, Pamela Skrabek Springer Nature Switzerland 2019., стр 159-167. 20) Borowitz M.J., Bene M.C., Harris N.L. et al. Acute leukemias of ambiguous lineage. In: WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Ed by S.H. Swerdlow, E. Campo, N.L. Harris et al. Lyon: IARC Press, 2008: 150–5. 21) Faderl, S HM Kantarjian, et al, T.U.o.T.M.D.A.C.C. Department of Leukemia, Houston, Texas, T.U.o.T.M.D.A.C.C. Department of Leukemia, P.O. Box 428, 1515 Holcombe Blvd., Houston, TX 77030, S. Jeha, T.U.o.T.M.D.A.C.C. Department of Leukemia, Houston, Texas, The biology and therapy of adult acute lymphoblastic leukemia. Cancer, 2017; 98: 1337–1354. 22) Cassaday RD, Alan Potts D, Jr., Stevenson PA, et al. Evaluation of allogeneic transplantation in first or later minimal residual disease - negative remission following adult-inspired therapy for acute lymphoblastic leukemia. Leuk Lymphoma 2016;57:2109-2118. 23) Ram R, Gafter-Gvili A, Vidal L, et al. Management of adult patients with acute lymphoblastic leukemia in first complete remission: systematic review and meta-analysis. Cancer 2010;116:3447-3457. 24) Vora A, Goulden N, Mitchell C, et al. Augmented post-remission therapy for a minimal residual disease-defined high-risk subgroup of children and young people with clinical standard-risk and intermediate-risk acute lymphoblastic leukaemia (UKALL 2003): a randomised controlled trial. Lancet Oncol 2014;15:809-818. 25) ALL arising from prior chemotherapy or underlying hematologic malignancy may be associated with adverse outcomes. Saygin C, et al. Blood Adv 2019;3:4228-4237. 26) ALL arising from prior chemotherapy or underlying hematologic malignancy may be associated with adverse outcomes. Saygin C, et al. Blood Adv 2019;3:4228-4237. 27) Clinical significance of minimal residual disease quantification in adult patients with standard-risk acute lymphoblastic leukemia. Brüggemann M, Raff T, Flohr T, Gökbuget N, Nakao M, Droese J, Lüschen S, Pott C, Ritgen M, Scheuring U, Horst HA, Thiel E, Hoelzer D, Bartram CR, Kneba M, German Multicenter Study Group for Adult Acute Lymphoblastic Leukemia. Blood. 2006 Feb 1; 107(3):1116-23. 28) Roberts KG. Genetics and prognosis of ALL in children vs adults. Hematology Am Soc Hematol Educ Program. 2018 Nov 30;2018(1):137-145. 29) Jain T, Litzow MR. No free rides: management of toxicities of novel immunotherapies in ALL, including financial. Hematology Am Soc Hematol Educ Program. 2018 Nov 30;2018(1):25-34. 30) Bassan R, Hoelzer D. Modern therapy of acute lymphoblastic leukemia. J Clin Oncol 2011; 29: 532–543. 31) Annino L, Vegna ML, Camera A et al. Treatment of adult acute lymphoblastic leukemia (ALL): long-term follow-up of the GIMEMA ALL 0288 randomized study. Blood 2002; 99: 863–871. 32) Gökbuget N, Bassan R, Dombret H et al. Recommendations of the European Working Group for Adult ALL (EWALL), 1st edition. Bremen: UNI-MED Science Verlag, 2011. 33) Topp MS, Gökbuget N, Stein AS et al. Safety and activity of blinatumomab for adult patients with relapsed or refractory B-precursor acute lymphoblastic leukaemia: a multicentre, single-arm, phase 2 study. Lancet Oncol 2015; 16: 57–66. 34) Kantarjian H, Thomas D, Jorgensen J et al. Results of inotuzumab ozogamicin, a CD22 monoclonal antibody, in refractory and relapsed acute lymphocytic leukemia. Cancer 2013; 119: 2728–2736. 35) Grupp SA, Kalos M, Barrett D et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. N Engl J Med 2013; 368: 1509–1518. 36) DeAngelo DJ, Stevenson KE, Dahlberg SE et al. Long-term outcome of a pediatric-inspired regimen used for adults aged 18–50 years with newly diagnosed acute lymphoblastic leukemia. Leukemia 2015; 29: 526–534. 37) Guru Murthy GS, Venkitachalam R, Mehta P. Trends in survival outcomes of Blineage acute lymphoblastic leukemia in elderly patients: analysis of Surveillance, Epidemiology, and End Results database. Leuk Lymphoma 2015; 56: 2296–2300. 38) Topp MS, Gökbuget N, Stein AS et al. Safety and activity of blinatumomab for adult patients with relapsed or refractory B-precursor acute lymphoblastic leukaemia: a multicentre, single-arm, phase 2 study. Lancet Oncol 2015; 16: 57–66. 39) Mead GM, Barrans SL, Qian W, et al. A prospective clinicopathologic study of dose-modified CODOX-M/IVAC in patients with sporadic Burkitt lymphoma defined using cytogenetic and immunophenotypic criteria (MRC/NCRI LY10 Trial). Blood 2008; 112:2248. 40) Dinner S, Liedtke M. Antibody-based therapies in patients with acute lymphoblastic leukemia. Hematology Am Soc Hematol Educ Program. 2018 Nov30;2018(1):9-15. 41) Valentin R, Grabow S, Davids MS. The rise of apoptosis: targeting apoptosis in hematologic malignancies. Blood. 2018 Sep 20;132(12):1248-1264. 42) Brown PA, Shah B, Fathi A, Wieduwilt M, Advani A, Aoun P, Barta SK, Boyer MW, Bryan T, Burke PW, Cassaday R, Coccia PF, Coutre SE, Damon LE, DeAngelo DJ, Frankfurt O, Greer JP, Kantarjian HM, Klisovic RB, Kupfer G, Litzow M, Liu A, Mattison R, Park J, Rubnitz J, Saad A, Uy GL, Wang ES, Gregory KM, Ogba N. NCCN Guidelines Insights: Acute Lymphoblastic Leukemia, Version 1.2017. J Natl Compr Canc Netw. 2017 Sep;15(9):1091-1102. 43) Marks DI, Paietta EM, Moorman AV et al. T-cell acute lymphoblastic leukemia in adults: clinical features, immunophenotype, cytogenetics, and outcome from the large randomized prospective trial (UKALL XII/ECOG 2993). Blood 2009; 114: 5136–5145. 44) Hoelzer D, Walewski J, Döhner H et al. Improved outcome of adult Burkitt lymphoma/leukemia with rituximab and chemotherapy: report of a large prospective multicenter trial. Blood 2014; 124: 3870–3879. 45) O’Brien S, Schiller G, Lister J et al. High-dose vincristine sulfate liposome injection for advanced, relapsed, and refractory adult Philadelphia hromosomenegative acute lymphoblastic leukemia. J Clin Oncol 2013; 31: 676–683. 46) Nishiwaki S, Miyamura K, Ohashi K et al. Impact of a donor source on adult Philadelphia chromosome-negative acute lymphoblastic leukemia: a retrospective analysis from the Adult Acute Lymphoblastic Leukemia Working Group of the Japan Society for Hematopoietic Cell Transplantation. Ann Oncol 2013; 24: 1594–1602. 47) Alvarnas JC, Brown PA, Aoun P, Ballen KK, Barta SK, Borate U, Boyer MW, Burke PW, Cassaday R, Castro JE, Coccia PF, Coutre SE, Damon LE, DeAngelo DJ, Douer D, Frankfurt O, Greer JP, Johnson RA, Kantarjian HM, Klisovic RB, Kupfer G, Litzow M, Liu A, Rao AV, Shah B, Uy GL, Wang ES, Zelenetz AD, Gregory K, Smith C. Acute Lymphoblastic Leukemia, Version 2.2015. J Natl Compr Canc Netw. 2015 Oct;13(10):1240-79. 48) Jabbour E, Kantarjian H, Ravandi F, et al. Combination of hyper-CVAD with ponatinib as first-line therapy for patients with Philadelphia chromosome-positive acute lymphoblastic leukaemia: a single-centre, phase 2 study. Lancet Oncol 2015;16:1547-1555. 49) Ottmann OG, Pfeifer H, Cayuela JM, et al. Nilotinib (Tasigna®) and low intensity chemotherapy for first-line treatment of elderly patients with BCR-ABL1- positive acute lymphoblastic leukemia: Final results of a prospective multicenter trial (EWALL-PH02). Blood 2018;132:31. 50) Slayton WB, Schultz KR, Kairalla JA, et al. Dasatinib plus intensive chemotherapy in children, adolescents, and young adults with Philadelphia chromosome-positive acute lymphoblastic leukemia: Results of Children's Oncology Group Trial AALL0622. J Clin Oncol 2018;36:2306-2314. 51) DeAngelo DJ, Stevenson KE, Dahlberg SE et al. Long-term outcome of a pediatric-inspired regimen used for adults aged 18–50 years with newly diagnosed acute lymphoblastic leukemia. Leukemia 2015; 29: 526–534. 52) Geyer MB, Ritchie EK, Rao AV, et al. Pediatric-inspired chemotherapy incorporating pegaspargase is safe and results in high rates of minimal residual disease negativity in adults up to age 60 with Philadelphia chromosome-negative acute lymphoblastic leukemia. Haematologica 2020;Online ahead of print. 53) Wieduwilt MJ, Jonas BA, Schiller GJ, et al. A phase II study of pegylated asparaginase, cyclophosphamide, rituximab, and dasatinib added to the UCSF 8707 (Linker 4-drug) regimen with liposomal cytarabine CNS prophylaxis for adults with newly diagnosed acute lymphoblastic leukemia (ALL) or lymphoblastic lymphoma (LBL): University of California Hematologic Malignancies Consortium Study (UCHMC) 1401. Blood 2018;132:4018-4018. 54) Vrooman LM, Stevenson KE, Supko JG, et al. Postinduction dexamethasone and individualized dosing of Escherichia Coli L-asparaginase each improve outcome of children and adolescents with newly diagnosed acute lymphoblastic leukemia: results from a randomized study--Dana-Farber Cancer Institute ALL Consortium Protocol 00-01. J Clin Oncol 2013;31:1202-1210. 55) Lazarus HM, Richards SM, Chopra R, et al. Central nervous system involvement in adult acute lymphoblastic leukemia at diagnosis: results from the international ALL trial MRC UKALL XII/ECOG E2993. Blood 2006;108:465-472. 56) Wieduwilt MJ, Jones BA, Schiller GJ, et al. A phase II study of pegylated asparaginase, cyclophosphamide, rituximab, and dasatinib added to the UCSF 8707 (Linker 4-drug) regimen with liposomal cytarabine CNS prophylaxis for adults with newly diagnosed acute lymphoblastic leukemia (ALL) or lymphoblastic lymphoma (LBL): University of California Hematologic Malignancies Consortium Study (UCHMC) 1401. Blood 2018:132:4018. 57) Grupp SA, Kalos M, Barrett D, et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. N Engl J Med 2013;368:1509-1518. 58) Sadelain M, Riviere I, Brentjens R. Targeting tumours with genetically enhanced T lymphocytes. Nat Rev Cancer 2003;3:35-45. 59) Shah NN, Lee DW, Yates B, et al. Long-Term Follow-Up of CD19-CAR T-Cell Therapy in Children and Young Adults With B-ALL. J Clin Oncol 2021;39:1650-1659 60) Park JH, Riviere I, Gonen M, et al. Long-term follow-up of CD19 CAR therapy in acute lymphoblastic leukemia. N Engl J Med 2018;378:449-459. 61) Sheth VS, Gauthier J. Taming the beast: CRS and ICANS after CAR T-cell therapy for ALL. Bone Marrow Transplant 2021;56:552-566. 62) Mainor C.B. et al. Treatment of Philadelphia chromosome-positive acute lymphoblastic leukemia in pregnancy // J. Oncol. Pharm. Pract. SAGE Publications Ltd, 2016. Vol. 22, № 2. P. 374–377. 63) Vlijm-Kievit A. et al. Acute lymphoblastic leukemia during the third trimester of pregnancy // Leuk. Lymphoma. 2018. Vol. 59, № 5. P. 1274–1276. 64) Kemp M.W. et al. The clinical use of corticosteroids in pregnancy // Human Reproduction Update. Oxford University Press, 2016. Vol. 22, № 2. P. 240–259.
Информация
Сокращения, используемые в протоколе:
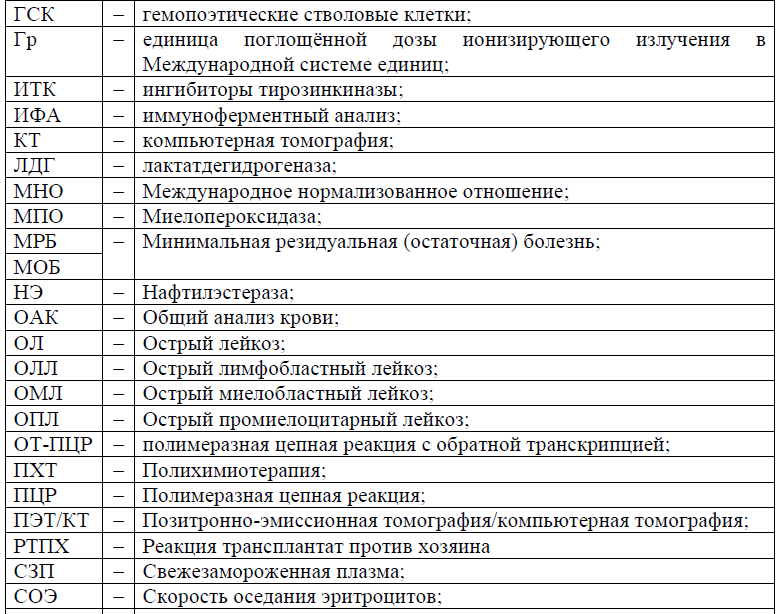

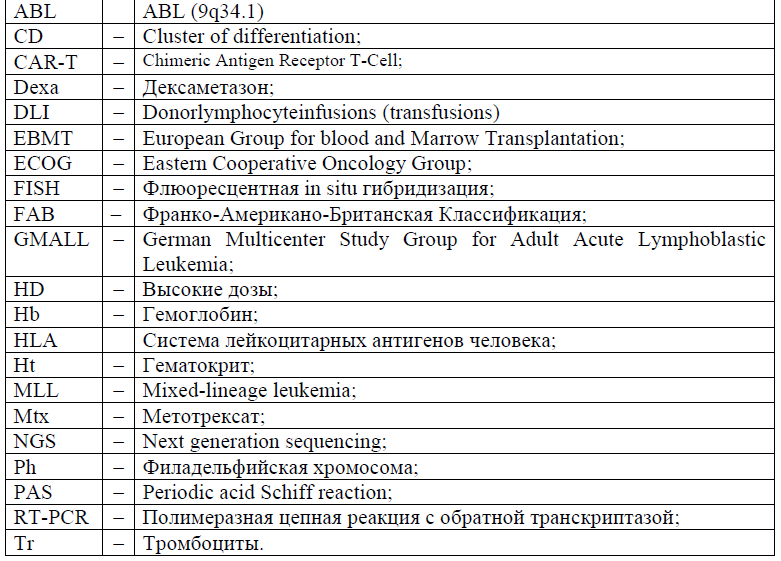
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ВНЕДРЕНИЯ ПРОТОКОЛА
Список разработчиков протокола с указанием квалификационных данных:
1) Dieter Hoelzer, MD, PhD, is currently a Hematologist/Oncologist and Professor of Internal Medicine at the University of Frankfurt, Frankfurt, Germany.
2) Кемайкин Вадим Матвеевич – кандидат медицинских наук, Национальный научный онкологический центр, руководитель отдела онкогематологии и трансплантации костного мозга. Гематолог высшеей категории.
3) Клодзинский Антон Анатольевич – кандидат медицинских наук, медицинский директор ТОО «Центр гематологии». Гемаптолог высшей категории
4) Рамазанова Райгуль Мухамбетовна – доктор медицинских наук, профессор АО «Казахский медицинский университет непрерывного образования», заведующая курсом гематологии. Гематолог высшей категории.
5) Габбасова Сауле Тленбаевна – РГП на ПХВ «Казахский научно-исследовательский институт онкологии и радиологии» заведующая отделением гемобластозов. Гематолог высшей категории.
6) Рапильбекова Гульмира Курбановна - доктор медицинских наук, профессор КФ UMC «Национальный научный центр материнства и детства», старший ординатор акушерского отделения №1, врач акушер-гинеколог.
7) Макалкина Лариса Геннадьевна – клинический фармаколог, доцент кафедры кардиологии, внутренних болезней, медико-социальной экспертизы и реабилитации АО «Медицинский Университет Астана».
Указание на отсутствие конфликта интересов: нет.
Рецензенты: Тургунова Людмила Геннадьевна – доктор медицинских наук, гематолог, профессор кафедры внутренних болезней №2 НАО «Медицинский университет Караганды».
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.