Острые лимфобластные лейкозы взрослых
 Версия: Клинические рекомендации РФ 2024 (Россия)
Версия: Клинические рекомендации РФ 2024 (Россия)
Общая информация
Краткое описание
Разработчик клинической рекомендации:
Некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга "Национальное гематологическое общество"
Одобрено Научно-практическим Советом Минздрава РФ
Клинические рекомендации
Острые лимфобластные лейкозы
Возрастная категория: Взрослые
Год утверждения: 2024
Пересмотр не позднее: 2026
Статус: Действует
ID: 496_2
Определение заболевания или состояния (группы заболеваний или состояний)
Острые лимфобластные лейкозы (далее – ОЛЛ)/острые лимфобластные лимфомы (ЛБЛ) – это гетерогенная группа злокачественных клональных заболеваний системы крови, происходящих из клеток-предшественниц гемопоэза преимущественно лимфоидной направленности дифференцировки и характеризующиеся чаще всего исходным поражением костного мозга (далее – КМ), вытеснением нормального кроветворения и вовлечением в процесс различных органов и систем организма (центральная нервная система (далее – ЦНС), яички, лимфатическая ткань любой локализации), а также возможностью исходного поражения органов лимфатической ткани без вовлечения КМ [1–5].
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Лимфоидный лейкоз (С91):
-
С91.0 Острый лимфобластный лейкоз
-
С91.5 Т-клеточный лейкоз взрослых
-
С91.7 Другой уточненный лимфоидный лейкоз
-
С91.9 Лимфоидный лейкоз неуточненный
-
С83.5 Лимфобластная (диффузная) лимфома
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
В классификации Всемирной организации здравоохранения (далее – ВОЗ) ОЛЛ рассматриваются в разделе опухолей из предшественников Т- и В-лимфоцитов [3]:
-
лимфобластный лейкоз/лимфома из В-предшественников (синоним: ОЛЛ из предшественников В-клеток);
-
лимфобластный лейкоз/лимфома из Т-предшественников (синоним: ОЛЛ из предшественников Т-клеток).
Возможно равноценное использование описанных определений, и авторы классификации лишь полагают, что при 25% и более бластных клеток в КМ целесообразно говорить об ОЛ, а при менее 25% – об ЛБЛ. Но чаще всего эти терминологические сложности не имеют практического значения, поскольку их терапия одинакова.
B-лимфобластный лейкоз/лимфома
-
B-лимфобластный лейкоз/лимфома, без дополнительного уточнения (БДУ) (NOS – not otherwise specified).
-
B-лимфобластный лейкоз/лимфома, определяемый рекуррентными (неслучайными, повторяющимися) генетическими аномалиями:
– B-лимфобластный лейкоз/лимфома с t(9:22)(q34;q11.2)/BCR::ABL1; Ph+-ОЛЛ;
– B-лимфобластный лейкоз/лимфома с t(v;11q23)/KMT2A (ранее MLL);
– B-лимфобластный лейкоз/лимфома с t(12;21) (p13;q22)/ETV6::RUNX1 (ранее TEL::AML1));
– B-лимфобластный лейкоз/лимфома с гипердиплоидией;
– B-лимфобластный лейкоз/лимфома с гиподиплоидией;
– B-лимфобластный лейкоз/лимфома с t(5;14)(q31;q32)/IL3::IGH;
– B-лимфобластный лейкоз/лимфома с t(1;19)(q23;p13.3)/TCF3::PBX1;
– B-лимфобластный лейкоз/лимфома с интрахромосомной амплификацией хромосомы 21(iAMP21);
– B-лимфобластный лейкоз/лимфома с различными генетическими нарушениями (цитогенетическими аномалиями и мутациями в генах), которые активируют сигнальные пути рецепторов цитокинов и киназ (BCR::ABL1-подобный );
T-лимфобластный лейкоз/лимфома
– Лимфобластный лейкоз из ранних Т-клеточных предшественников;
– NK-клеточный лимфобластный лейкоз/лимфома.
Согласно классификации ВОЗ 2017 г., ЛБЛ с поражением КМ и без него объединяются в единую группу «лимфобластные лейкозы/лимфомы из предшественников B- или T-клеток». Несмотря на широко распространенную точку зрения о том, что ОЛЛ и ЛБЛ характеризуются различными клиническими проявлениями одного и того же заболевания, в процессе выполненного анализа экспрессии генов [5] было показано четкое разделение между T-клеточной ОЛЛ и T-клеточной ЛБЛ ввиду различия экспрессии отдельных генов. Ряд этих различий может быть обусловлен специфичными механизмами, имеющими отношение к стромальным клеткам. В то же время имеются доказательства в пользу того, что важные сигнальные пути, регулирующие рост клеток при T-клеточных ОЛЛ и T-клеточных ЛБЛ, могут быть различны, что частично объясняет различие клинических проявлений обоих заболеваний [5].
В 2022 году опубликована статья, посвященная 5 пересмотру ВОЗ классификации острых лимфобластных лейкозов, однако, утвержденная классификация ВОЗ на момент пересмотра настоящих клинических рекомендаций еще не опубликована [236].
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Этиология точно не установлена. Этиология и патогенез объясняются общепринятой клоновой теорией: все лейкемические клетки являются потомками одной родоначальной клетки, которая прекратила свою дифференцировку на одной из ранних стадий созревания. Из-за неконтролируемой пролиферации опухолевых клеток угнетается нормальное кроветворение, образуются метастазы (лейкемические инфильтраты) вне органов кроветворения [1–5].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
ОЛЛ может встречаться у лиц любого возраста, начиная с младенческого возраста и заканчивая пожилым, однако максимальные значения заболеваемости приходятся на детский возраст (60% пациентов ОЛЛ моложе 20 лет) [1, 2, 6].
ОЛЛ является самой распространенной опухолью кроветворной ткани у детей, составляя 30% всех злокачественных опухолей детского возраста. У пациентов моложе 15 лет ОЛЛ диагностируется в 75% случаев всех острых лейкозов (далее – ОЛ). Пик заболеваемости ОЛЛ приходится на возраст 3-4 года, затем частота его снижается, и второй подъем, хотя не столь существенный, отмечается в возрасте 50-60 лет [1–5, 7].
В РФ в 2014 г. диагноз ОЛЛ был установлен у 1731 пациента, половина из которых – это лица моложе 18 лет [8].
Заболеваемость ОЛЛ у пациентов пожилого возраста неуклонно возрастает. Согласно данным регистров, ежегодная частота ОЛЛ увеличивается с 0,39 случая на 100 000 населения в возрасте 35-39 лет, до 2,1 случая на 100 000 населения – в возрасте ≥85 лет. Кроме того, приблизительно 30% ОЛЛ диагностируются в возрасте ≥60 лет. Филадельфийская хромосома (Ph) определяется у 20-30% взрослых пациентов В-ОЛЛ. В то время как Ph+ ОЛЛ составляет у детей менее 5% всех случаев, его частота возрастает до 40% у взрослых в возрасте 40 лет, a затем на 10% в течение каждого последующего десятилетия жизни [9].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Длительность анамнеза заболевания от момента появления первых клинических признаков до морфологической верификации диагноза составляет от нескольких недель до нескольких месяцев. Клиническая картина определяется степенью нарушения функций КМ в виде анемии, геморрагического синдрома и развитием инфекций различной степени тяжести; наличием опухолевой массы в виде органомегалии, большого количества опухолевых клеток в периферической крови, лимфоаденопатии и масс в средостении; в некоторых случаях с развитием болевого синдрома, связанного с поражением костей, с появлением клинических признаков поражения ЦНС и с поражением кожи [1, 2, 4, 5, 10, 11].
Клинические проявления у пациентов с ОЛЛ очень неспецифичны и связаны с развитием тех или иных симптомов, обусловленных вытеснением опухолевыми клетками нормального кроветворения. Основные симптомы заболевания – слабость, лихорадка, не связанная с инфекцией, оссалгии и артралгии, геморрагический синдром. Инфекционные осложнения встречаются нечасто, и в основном в тех случаях, когда число нейтрофилов не превышает 0,2×109/л. У 1% пациентов отмечаются головные боли, тошнота, рвота, чаще всего при вовлечении ЦНС [12].
ЛБЛ чаще встречается у мужчин (61-75%). У большинства (58–95%) пациентов на момент постановки диагноза заболевание имеет III-IV стадию. У значительной доли пациентов определяются лихорадка, ночная потливость и снижение массы тела (16-48%), а также повышение активности лактатдегидрогеназы (далее – ЛДГ) (48-84%). Частота первичного поражения ЦНС аналогична данному показателю при ОЛЛ (0-10%). Пациенты с T-клеточной ЛБЛ имеют более молодой возраст по сравнению с пациентами с B-клеточной ЛБЛ [13], более высокую частоту поражения лимфоузлов средостения и КМ, а также IV стадию заболевания, в то время как экстранодальное поражение встречается чаще при B-клеточных ЛБЛ [14]. В противоположность ОЛЛ при ЛБЛ параметры периферической крови, в частности концентрация гемоглобина и количество тромбоцитов в целом, приближаются к нормальным значениям, что свидетельствует о потенциально более высоком костномозговом резерве и лучшей переносимости химиотерапии (далее – ХТ).
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу (в соответствии с шкалами оценки уровня достоверности доказательств (далее – УДД) и уровня убедительноси рекомендаций (далее – УУР)) по причине отсутствия, посвященных им КИ. Невзирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Для интерпретации диагностических исследований могут применяться технологии искусственного интеллекта (при наличии и адаптированности для диагностики при острых лимфобластных. лейкозах).
1. Жалобы и анамнез
-
Рекомендуются всем пациентам пациентам при постановке диагноза, ежедневно в процессе лечения тщательный сбор анамнеза и жалоб заболевания с уточнением терапии, которая проводилась в связи с данным заболеванием и ранее по поводу других заболеваний, а также подробное описание жалоб пациентов для верификации диагноза [1, 2, 4, 5].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
2. Физикальное обследование
-
Рекомендуются всем пациентам при подтверждении диагноза, ежедневно в процессе лечения при физикальном осмотре измерение роста и массы тела, термометрия общая; оценка состояния кожных покровов, костно-суставной системы; выявление признаков геморрагического синдрома; наличие гепатоспленомегалии, лимфоаденопатии; наличие признаков дисфункции сердца, легких, печени, органов эндокринной системы для верификации диагноза [1, 2, 4, 5].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: при физикальном обследовании могут обнаруживаться различной степени выраженности бледность кожных покровов, петехиальные высыпания, синяки, кровоточивость десен, повышение температуры тела, лимфоаденопатия, в том числе увеличение небных миндалин, спленомегалия, гепатомегалия, увеличение размеров почек, болезненность при поколачивании костей. Вовлечение кожи при ОЛЛ бывает редко, и если диагностируется, то ассоциируется с пре-В-иммунофенотипом [11].
-
Рекомендуется всем пациентам оценить соматический статус по шкале Восточной кооперативной онкологической группы (далее – ECOG) с целью определения необходимого объема и экстренности медицинской помощи (приложение Г1) [15, 16].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
3. Лабораторные диагностические исследования
-
Рекомендуется всем пациентам при постановке диагноза для верификации диагноза, во время лечения для оценки динамики на фоне терапии 2-3 раза в неделю выполнение общего (клинического) анализа крови развернутого (далее – ОАК) (с подсчетом лейкоцитарной формулы и исследованием уровня тромбоцитов) [1, 2, 4, 5].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: при диагностике ОЛЛ у части пациентов показатели крови могут быть нормальными. Число лейкоцитов может варьировать от 0,5×109/л до 700×109/л; увеличение числа лейкоцитов выше 10,0×109/л отмечается у 60% пациентов, выше 100,0×109/л – у 10%; тромбоцитопения менее 50,0×109/л определяется у 60% пациентов.
-
Рекомендуется всем пациентам при постановке диагноза для определения объема опухолевого поражения, вероятности развития синдрома лизиса опухоли, а также всем пациентам во время лечения 2 раза в неделю с целью динамики изменений на фоне терапии и выявления осложнений выполнить анализ крови биохимический общетерапевтический (Исследование уровня общего белка в крови, Определение соотношения белковых фракций методом электрофореза, Исследование уровня мочевины в крови, Исследование уровня креатинина в крови, Исследование уровня общего билирубина в крови, Определение активности аспартатаминотрансферазы в крови (далее – АСТ), Определение активности аланинаминотрансферазы в крови (далее – АЛТ), Определение активности лактатдегидрогеназы в крови, Исследование уровня общего магния в сыворотке крови, Исследование уровня натрия в крови, Исследование уровня калия в крови, Исследование уровня общего кальция в крови, Исследование уровня глюкозы в крови) [1, 2, 4, 5, 17, 18].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: дополнительно при наличии показаний на любом этапе диагностики и лечения ОЛЛ могут исследоваться другие показатели крови: Исследование уровня железа сыворотки крови, Исследование уровня трансферрина сыворотки крови, Исследование уровня эритропоэтина крови, Исследование уровня фолиевой кислоты в сыворотке крови, Исследование уровня иммуноглобулинов в крови; Определение соотношения белковых фракций методом электрофореза; исследование функции нефронов по клиренсу креатинина (проба Реберга) и другие.
-
Рекомендуется всем пациентам при подтверждении диагноза для определения вероятности развития тяжелых коагуляционных нарушений, как геморрагических, так и тромботических, а также всем пациентам во время лечения 2 раза в неделю, с целью выявления осложнений на фоне терапии выполнить скрининговое исследование свертывающей системы крови (активированное частичное тромбопластиновое время (далее – АЧТВ), Определение протромбинового (тромбопластинового) времени в крови или в плазме, Определение тромбинового времени в крови, Исследование уровня фибриногена в крови). Пациентам, получающим терапию аспарагиназой**, необходимо Определение активности антитромбина III в крови [19–22].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: при выявлении изменений в результатах скрининговых исследований и наличии клинических показаний исследуются дополнительные параметры коагуляции (например, исследование уровня продуктов паракоагуляции в крови, протеина C в крови, Определение активности протеина S в крови, антитромбина III, и другие).
-
Рекомендуется всем пациентам выполнить исследование общего (клинического) анализа мочи с целью исключения поражения почек [1, 2, 4, 5, 23].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: при наличии показаний выполняются дополнительные исследования мочи, например, для исключения инфекции и уточнения типа возбудителя – исследование мочи методом Нечипоренко, исследование мочи методом Зимницкого, различные микробиологические (культуральные) исследования мочи и микроскопическое исследование мочи. Также по показаниям выполняются на любом этапе диагностики и лечения ОЛЛ исследование гемосидерина в моче, исследование уровня свободного кортизола в моче, определение активности альфа-амилазы в моче, и другие.
-
Рекомендуется всем пациентам при подозрении и при установленном ОЛЛ, а также в ходе терапии с частотой 1 раз в 3-6 месяцев определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови; определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови для уточнения необходимости одновременного проведения противоопухолевой и антиретровирусной терапии, и определение антител к бледной трепонеме (Treponema pallidum) в крови для исключения сопутствующей патологии [1, 2].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
-
Рекомендуется всем пациентам при подозрении и при подтвержденном ОЛЛ, а также в ходе терапии с частотой 1 раз в 3-6 месяцев выполнять определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови и антигена вируса гепатита C (Hepatitis C virus) в крови и, при необходимости, молекулярно-биологическое исследование крови на вирус гепатита B (Hepatitis B virus) и гепатита C (Hepatitis C virus) в целях уточнения риска реактивации вирусного гепатита и, в случае необходимости, ее профилактики [24, 25].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется всем пациентам с ОЛЛ по показаниям с целью уточнения риска и в случае необходимости профилактики реактивации вирусного гепатита В выполнение развернутого вирусологического исследования для выявления маркеров вирусов гепатита B, которое должно включать определение [1, 2]:
-
антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови;
-
антител к поверхностному антигену (HBsAg) вируса гепатита B (Hepatitis B virus) в крови;
-
антител к ядерному антигену (HBcAg) вируса гепатита B (Hepatitis B virus) в крови;
-
ДНК вируса гепатита B (Hepatitis B virus) в крови методом полимеразной цепной реакции (качественное исследование).
-
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется всем пациентам исследование микробиоценоза кишечника (дисбактериоз) культуральными методами с целью выявления колонизации нестерильных локусов патогенной флорой [26].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется пациентам при подозрении и при установленном ОЛЛ, в процессе лечения по показаниям, выполнение необходимых исследований и проб для гемотрансфузии, включающих [27, 240]:
-
всем пациентам:
§ определение основных групп по системе AB0;
§ определение антигена D системы Резус (резус-фактор);
§ определение подгруппы и других групп крови меньшего значения A-1, A-2, D, Cc, E, Kell, Duffy;
§ проба на совместимость перед переливанием компонентов крови;
§ определение фенотипа по антигенам C, c, E, e, Cw, K, k и определение антиэритроцитарных антител;:
-
при необходимости:
§ определение HLA-антигенов;
§ определение содержания мембранных иммуноглобулинов;
§ определение содержания антилейкоцитарных антител;
§ определение содержания антитромбоцитарных антител;
§ определение содержания антител к антигенам эритроцитов в сыворотке крови.
-
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: назначение необходимых исследований и проб, а также выбор конкретного вида компонента крови для гемотрансфузии (тип эритроцитосодержащего компонента крови, тип концентрата тромбоцитов, тип препарата плазмы) осуществляется лечащим врачом или врачом-трансфузиологом в соответствии с клинической ситуаций и на основании Приказа Минздрава России от 28.10.2020 № 1170н"Об утверждении порядка оказания медицинской помощи населению по профилю "трансфузиология", Приказа Минздрава России от 20.10.2020 № 1134н «О порядке медицинского обследования реципиента, проведения проб на индивидуальную совместимость, включая биологическую пробу, при трансфузии донорской крови и (или) ее компонентов», рекомендациями «Клиническое использование эритроцитсодержащих компонентов крови» (2018 г), Постановления от 22.06.2019 г. № 797 «Об утверждении правил заготовки, хранения, транспортировки и клинического использования донорской крови и ее компонентов и о признании утратившими силу некоторых актов Правительства Российской Федерации», другими нормативными актами (см. Приложение А3.9).
-
Рекомендуются всем пациентам получение цитологического препарата КМ путем пункции (стернальная пункция, пункция задней ости подвздошной кости) и цитологическое исследование мазка КМ (миелограмма) из стернального пунктата с целью верификации диагноза и определения прогноза пациентов [1, 2, 4, 5, 11].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: диагноз ОЛ устанавливают при обнаружении в КМ 20% и более бластных клеток. Однако для ОЛЛ из клеток-предшественников лимофпоэза и для ЛБЛ из тех же клеток-предшественников существует иное общепринятное определение: диагноз ОЛЛ (В-клеточного или Т-клеточного) устанавливают при обнаружении 25% и более бластных клеток в КМ. Если процент бластных клеток в КМ менее 25% или бластные клетки отсутствуют в КМ, но присутствуют в иных очагах поражения (лимфатические узлы любой локализации, тимус, кожа, и т. д.), то устанавливают диагноз Т- или В-ЛБЛ [1, 2, 4, 5].
-
Рекомендуется всем пациентам выполнить цитохимическое исследование микропрепарата КМ (бластных клеток КМ) с целью верификации диагноза [28, 29].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: при цитохимическом исследовании бластные клетки оценивают как недифференцируемые, поскольку активность миелопероксидазы в них негативная, а PAS-позитивные гранулы, которые часто содержатся в них, не являются специфичным маркером, определяющим принадлежность к лимфоидной линии дифференцировки. Поэтому одним из ключевых методов диагностики ОЛЛ является иммунофенотипирование. Тем не менее, проведение цитохимических реакций на миелопероксидазу, неспецифическую эстеразу и гликоген является обязательным, так как определение линии дифференцировки бластных клеток осуществляется при комплексном анализе данных цитохимического исследования и иммунофенотипирования, при этом исключаются/верифицируются варианты острых лейкозов со смешанным фенотипом. [1, 2, 236].
-
Рекомендуется выполнить патолого-анатомическое исследование биопсийного (операционного) материала очага поражения (опухолевого образования), в том числе с применением иммуногистохимических методов, у пациентов без поражения КМ с целью точной верификации диагноза [30].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
-
Рекомендуется у всех пациентов с подозрением на ЛБЛ выполнять патолого-анатомическое исследование биопсийного (операционного) материала лимфоузла или другого очага поражения с применением иммуногистохимических методов с целью оценки субтипов ЛБЛ, а также сохранять биопсийный материал для последующего выполнения молекулярно-генетических исследований, что позволит разработать новые таргетные стратегии терапии [14].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: иммунофенотипические характеристики приблизительно 80% ЛБЛ характеризуются экспрессией T-клеточных маркеров, в отличие от ОЛЛ, при котором >70% относятся к B-клеточным. Среди всех ЛБЛ доминирует T-клеточный субтип. Иммунофенотипические характеристики опухолевых клеток при Т-ЛБЛ позитивны по следующим маркерам: TdT, CD7 и цитоплазматическая CD3; вариабельны СD1a, CD2, CD4, СD5, CD8; может быть коэкспрессия CD4 и CD8, CD10 +/–; редко определяется коэкспрессия миеломаркеров CD13; 33; 117. В трети Т-ЛБЛ выявлены транслокации с участием генов Т-клеточных рецепторов (α, ß, γ, δ) и различных партнерских генов, включая MYC, TAL1, HOX11 и др.
Иммунофенотипические характеристики опухолевых клеток при В-ЛБЛ позитивны: по ТdT (ядерная окраска), HLA-DR, CD19 и цитоплазматической (cyt)CD79a; CD20 и CD22 вариабельны. Иногда в цитоплазме определяются легкие цепи иммуноглобулина (cyt-µ). Поверхностные иммуноглобулины чаще отсутствуют, однако их обнаружение не исключает диагноза В-ЛБЛ; CD45 может быть негативен. Молекулярно-генетические особенности охарактеризованы мало, не имеют прогностического значения.
-
Рекомендуется всем пациентам выполнить иммунофенотипирование гемопоэтических клеток-предшественниц в КМ с целью верификации диагноза [31, 32].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: иммунофенотипирование выполняют с помощью мультипараметрической проточной цитофлуориметрии (обычно как минимум 6-цветной). Его используют для более четкого определения принадлежности бластных клеток к той или иной линии клеточной дифференцировки после установления морфологического диагноза ОЛЛ. Иммунофенотипическая характеристика бластных клеток при ОЛЛ представлена в приложении Г2. ОЛЛ из предшественников B-лимфоцитов (70-80% случаев) могут классифицироваться на четыре группы в соответствии со стадиями раннего развития B-клеток. ОЛЛ из предшественников Т-лимфоцитов (20-30% случаев) также могут делиться на 4 группы, в соответствии со стадиями раннего развития Т-клеток. В ряде случаев бластные клетки имеют одновременно признаки как лимфоидной, так и миелоидной дифференцировки. Эти варианты ОЛ могут быть определены как острый лейкоз со смешанным фенотипом (MPAL) (В-/миелоидный, Т-/миелоидный), если соответствуют необходимым критериям классификации ВОЗ (2017 г.) [3]. Другие случаи ОЛ могут отличаться отсутствием экспрессии необходимого сочетания или достаточного количества маркеров, которые позволили бы определить их линейную направленность. В таком случае могут быть диагностированы острый недифференцированный лейкоз или острый лейкоз неопределенной линейности, без дополнительного уточнения в соответствии с определениями, указанными в классификации ВОЗ.
В классификации ВОЗ 2017 г. отдельно выделяется лимфобластный лейкоз из ранних Т-клеточных предшественников (early T-precursor (ETP-ALL). Бластные клетки при ETP имеют признаки миелоидных и стволовых клеток, иммунофенотип должен соответствовать определенным критериям:
-
Т-линейная направленность (наличие экспресии cyCD3+CD7+)
-
Отсутствие экспрессии CD1a и CD8(<5% позитивных бластных клеток)
-
Отсутствие или слабая экспрессия CD5 (<75% позитивных бластных клеток)
-
позитивен хотя бы один из следующих маркеров: CD34, CD117, HLA-DR, CD13, CD33, CD11b, CD65(≥25% позитивных бластных клеток).
В случае яркой и более мономорфной экспрессии CD5 (≥75%), но выполнении остальных критериев Т-лимфобластного лейкоза из ранних предшественников, устанавливается диагноз near-ETP-ALL, что можно перевести как «подобный-ETP-ALL».
Приблизительно 80% ЛБЛ характеризуются экспрессией T-клеточных маркеров в отличие от ОЛЛ, при котором >70% относятся к B-клеточным. Поэтому среди всех ЛБЛ доминирует T-клеточный субтип.
Иммуноморфологические характеристики опухолевых клеток при Т-ЛБЛ: позитивны терминальная дезоксинуклеотидилтрансфераза (далее – TdT), CD7 и цитоплазматическая CD3; вариабельны СD1a, CD2, CD4, СD5, CD8; может быть коэкспрессия CD4 и CD8, CD10 +/–; редко определяется коэкспрессия миеломаркеров CD13; 33; 117. В трети Т-ЛБЛ выявлены транслокации с участием генов Т-клеточных рецепторов (α, ß, γ, δ) и различных партнерских генов, включая MYC, TAL1, HOX11 и др.
Иммуноморфологические характеристики опухолевых клеток при В-ЛБЛ: позитивны: ТdT (ядерная окраска), HLA-DR, CD19 и цитоплазматическая (cyt)CD79a; CD20 и CD22 вариабельны. Поверхностные иммуноглобулины чаще отсутствуют, однако их обнаружение не исключает диагноза В-ЛБЛ; CD45 может быть негативен.
1. антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови;
2. антител к поверхностному антигену (HBsAg) вируса гепатита B (Hepatitis B virus) в крови;
3. антител к ядерному антигену (HBcAg) вируса гепатита B (Hepatitis B virus) в крови;
-
Рекомендуется всем пациентам при первичной диагностике ОЛЛ, а также при обследовании по поводу диагностированного рецидива ОЛЛ выполнить цитогенетическое исследование (кариотип) клеток аспирата КМ и исследование биопсийного (операционного) материала тканей или КМ с применением метода флуоресцентной гибридизации in situ (FISH) с целью верификации диагноза и определения группы риска и тактики лечения [3, 236].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: Цитогенетическое исследование клеток аспирата костного мозга должно включать кариотипирование и исследование методом флуоресцентной гибридизации in situ (FISH) для выявления характерных цитогенетических аномалий. В случае технических сложностей с получением аспирата костного мозга хромосомные аномалии могут устанавливаться на основании исследования клеток периферической крови при наличии более чем 10% циркулирующих опухолевых клеток. При отсутствии поражения КМ, которое бывает у пациентов с ЛБЛ, цитогенетическое исследование должно быть выполнено на субстрате биопсированного опухолевого образования.
Наиболее значимыми генетическими диагностическими и прогностическими факторами В-ОЛЛ у взрослых являются t(9;22)(q34;q11)/BCR::ABL1; t(11q23)/KMT2A (MLL) и t(1;19)(q23;p13)/TCF3::PBX1. Вариант В-ОЛЛ с t(12;21)(р12;q22)/ETV6::RUNX1 характерен для детей, вариант В-ОЛЛ с iAMP21 в редких случаях встречаются также у молодых взрослых. При кариотипировании по возможности анализируют 20 метафаз для выявления хромосомных аберраций как в основном клоне, так и в возможных субклонах. Отсутствие выявленных аномалий при анализе менее 20 метафаз не может надежно исключать их наличие в опухолевом клоне. Всем больным В-клеточным ОЛЛ и ОЛ смешанного фенотипа выполняется исследование методом FISH на наличие t(9;22)(q34;q11)/BCR::ABL1 и t(v;11q23)/KMT2A, если не были выявлены при кариотипировании. Детекция этих цитогенетических аномалий во время проведения предфазы определяет всю дальнейшую терапевтическую тактику.
В транслокациях с вовлечением локуса гена KMT2A (ранее MLL) могут участвовать более 100 хромосомных партнеров. При обнаружении перестройки в локусе гена KMT2A методом FISH, при возможности, следует провести исследование на наличие самых часто встречающихся транслокаций, таких как t(4;11)(q21;q23)/KMT2A::AFF1, t(9;11)(p21;q23)/KMT2A::MLLT3, t(11;19)(q23;p13)/KMT2A::MLLT1, t(6;11)(q27;q23)/KMT2A::AFDN, t(10;11)(p12;q23)/MLLT10::KMT2A и t(11;19)(q23;p13.1)/KMT2A::ELL, для мониторинга динамики опухолевого клона на фоне терапии методом ПЦР.
Учитывая выделение BCR::ABL1-подобного В-ОЛЛ в отдельную подгруппу, требующую в некоторых случаях отдельных терапевтических опций, крайне желательно при установлении диагноза или при резистентном течении заболевания определение с помощью метода FISH перестроек с вовлечением локусов генов CRLF2 (IGH::CRLF2, P2RY8::CRLF2), ABL1, ABL2, JAK2, EPOR, PDGFRB (CSF1R).
Больным Т-ОЛЛ из ранних предшественников (ETP ОЛЛ) желательно выполнить исследование методом FISH на наличие перестройки в локусе гена транскрипционного фактора Т-клеточной линии BCL11B/14q32. Транслокация BCL11B/14q32 встречается в 30% случаев ЕТР ОЛЛ и определяет более благоприятный прогноз заболевания по сравнению с ETP ОЛЛ без транслокации [236].
-
Рекомендуется выполнить цитогенетическое исследование биопсийного (операционного) материала тканей или КМ с применением метода флуоресцентной гибридизации in situ (FISH) у всех больных с В-ОЛЛ со зрелым иммунофенотипом для определения транслокации с вовлечением локуса гена MYC, а в случае их обнаружения проводить дополнительное исследование на наличие транслокаций c вовлечением локусов генов BCL2 и BCL6 – с целью верификации double-/triple-hit В-ОЛЛ. [3, 236].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: Больных В-ОЛЛ с транслокациями MYC и/или BCL2 и BCL6 относят к группе высокого риска [236].
-
Рекомендуется выполнить молекулярно-генетическое исследование точечных мутаций гена BCR::ABL1 (химерный ген, образованный слиянием области кластера разрывов на 22-й хромосоме и гена тирозин-киназы Абельсона на 9-й хромосоме); молекулярно-генетическое исследование минимальной остаточной болезни при лейкозах при помощи пациент-специфичных праймеров (молекулярно-генетические исследования на наличие MYC::IgH, MLL::AF4 и других, в зависимости от ранее выявленных цитогенетических поломок), с целью дальнейшего мониторирования эффективности ХТ и оценки минимальной остаточной болезни (МОБ) в рамках КИ всем пациентам с В-клеточным ОЛЛ [35–37].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: детекция молекулярных транскриптов при ОЛЛ с BCR::ABL1, MYC::IgH, MLL::AF4 необходима с целью мониторинга противоопухолевого ответа и принятия терапевтических решений. Молекулярное исследование других многочисленных поломок является в настоящее время за рубежом одним из ключевых методов стартификации пациентов на группы риска. Детекция химерных транскриптов, мутации генов, перестройки и дупликации генов доступны только в больших исследовательских центрах. На молекулярно-генетическом уровне транскрипт гена BCR::ABL1 может определяться посредством полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР). Расположение точки разрыва в гене BCR приводит к тому, что белок p190BCR-ABL выявляется в 66,3% случаев Ph+ ОЛЛ, также у данных пациентов часто определяется белок p210BCR-ABL (31,2%). В остальных случаях определяются транскрипты обоих типов либо атипичные транскрипты. Определение точечных мутаций гена BCR::ABL1может позволить определить резистентность к терапии ингибиторами тирозинкиназ и способствовать подбору таргетного препарата, который работает при возникновении мутаций.
-
Рекомендуется всем пациентам выполнить молекулярно-генетическое исследование T-клеточной клональности (по генам бета-, гамма- и дельта-цепей T-клеточного рецептора) или молекулярно-генетическое исследование B-клеточной клональности (по генам IgH, IgK, IgL) в аспирате КМ с целью дальнейшей оценки молекулярного ответа и верификации диагноза при сложных диагностических случаях [38].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: с молекулярной точки зрения все случаи ОЛЛ развиваются из клеток-предшественников B- или T-лимфоцитов, поэтому все они демонстрируют клональные перестройки генов тяжелых цепей Ig и/или генов TCR. Этот феномен позволяет определять пациент-специфические перестройки и использовать их в качестве молекулярного маркера заболевания при мониторинге МОБ. Помимо пациент-специфических маркеров, ОЛЛ имеют большое количество генетических и молекулярных перестроек, мутаций, в которых участвуют различные гены. Перечень основных молекулярно-генетических аномалий, идентифицированных при ОЛЛ у взрослых и детей и используемых в настоящее время при молекулярной диагностике, приведен в приложении Г2. Данный перечень не является полным и представляет собой компромисс между современным и более адекватным молекулярным методом выявления или исключения аномалии и наиболее часто используемой методикой.
-
Рекомендуется всем пациентам выполнить спинномозговую пункцию с цитологическим исследованием клеток спинномозговой жидкости (микроскопическое исследование спинномозговой жидкости, подсчет клеток в счетной камере) для исключения/подтверждения вовлечения ЦНС. Микроскопическое исследование спинномозговой жидкости необходимо выполнять всем пациентам при цитозе ≥5/мкл. Рекомендуется с целью повышения точности анализа использовать для приготовления цитологических препаратов ликвора цитологическую центрифугу [12, 39].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: при всех вариантах ОЛЛ высока вероятность вовлечения оболочек головного мозга. Поэтому всем пациентам показано выполнение диагностической спинномозговой пункции с морфологическим исследованием спинномозговой жидкости. Если уровень тромбоцитов не удается повысить до 30×109/л и выше, от пункции можно воздержаться до восстановления показателей тромбоцитов после курса. Если у пациентов определяется лейкоцитоз выше 30×109/л, то первую спинномозговую пункцию следует отложить до редукции числа лейкоцитов менее 10×109/л. Проведение иммунофенотпического исследования спинномозговой жидкости в части случаев позволяет верифицировать этиологию повреждения при наличии цитоза, особенно в диагностически сложных случаях необходимости верификации специфического поражения, инфекционного или токсического.
-
Рекомендуется всем пациентам при диагностике нейролейкемии увеличить частоту спинномозговых пункций и выполнять их в среднем 1 раз в 3 дня до получения трех спинномозговых пункций без бластных клеток в спинномозговой жидкости, затем частоту пункций можно снизить до 1 пункции в неделю во время индукции (во время дальнейших этапов терапии спинномозговые пункции выполняются в соответствии с протоколом) для контроля динамики заболевания на терапии [1, 2, 4, 5].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: в рамках общей программы ХТ всем пациентам с ОЛЛ необходима терапия поражения ЦНС. В отсутствие профилактики поражения мозговых оболочек рецидивы в ЦНС в течение нескольких месяцев с момента регистрации ПР возникают приблизительно у трети пациентов. Рецидив в ЦНС при ОЛЛ у взрослых характеризуется неблагоприятным прогнозом, поскольку за ним обычно следует гематологический рецидив. При этом подходы к лечению поражения ЦНС и его профилактике различаются и учитывают характеристики пациента, его возраст и другие прогностические факторы.
-
Рекомендуется у всех выделять и сохранять первичную ДНК или РНК из клеток КМ пациентов в биобанке или направлять материал на хранение в лаборатории федеральных центров для возможности последующего выполнения молекулярных исследований [40].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: сохранение первичного биологического материала (ДНК, выделенная из костномозговых клеток, или замороженные клетки) для выполнения в будущем молекулярных исследований, позволяющих четко определить группы риска.
-
Рекомендуется всем пациентам, у которых при получении цитологического препарата КМ путем пункции (стернальной пункции) не получен диагностический материал (так называемый «сухой пунктат»), выполнять гистологическое и иммуногистохимическое исследование препарата КМ (трепанобиопсия), а также цитологическое и цитохимическое исследование (при наличии бластных клеток) отпечатков трепанобиоптата КМ с целью верификации точного диагноза [29, 30].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Не рекомендуется выполнять пункционную (аспирационную) биопсию очага поражения (опухолевого экстрамедуллярного образования) в связи с малой информативностью исследований данного материала [1, 2]
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется всем пациентам с ОЛЛ при проведении пункции любого органа и ткани и/или аспирации биологического материала выполнение исследований пунктата/аспирата для дифференциальной диагностики специфического лейкозного и иного типа поражения [1, 2]:
-
Цитологическое исследование и просмотр цитологического препарата
-
Цитохимическое исследование биологического материала (при наличии бластных клеток)
-
Иммунофенотипирование биологического материала для выявления маркеров гемобластозов (при наличии бластных клеток по данным морфологического исследования)
-
Уровень убедительности рекомендации – C (уровень достоверности доказательств – 5)
Комментарии: наиболее часто выполняется пункция плевральной полости с цитологическим исследованием плевральной жидкости, бронхо-альвеолярный лаваж с цитологическим исследованием лаважной жидкости, спинномозговая пункция с цитологическим исследованием клеток спинномозговой жидкости, однако по показаниям может выполняться пункция любого доступного органа и ткани с последующим цитологическим исследованием, в том числе – микропрепарата тканей полости рта, перитонеальной жидкости, микропрепарата кожи, препарата тканей лимфоузла, пунктатов опухолей, опухолеподобных образований костей, тканей печени, тканей толстой кишки, аспирата из полости матки, тканей влагалища, тканей матки, тканей предстательной железы, тканей яичка, почки, мочевого пузыря, пунктатов и отпечатков биоптатов опухолей забрюшинного пространства. Биологический материал, полученный после аспирации/пункции, при подтверждении информативности полученного материала (наличие опухолевых клеток) может быть отправлен на цитогенетические и молекулярные исследования для верификации варианта заболевания.
-
Рекомендуется всем пациентам с ОЛЛ при проведении пункции с получением экссудата (жидкого биологического материала) выполнение дополнительных исследований для дифференциальной диагностики специфического лейкозного, инфекционного и иного типа поражения [1, 2]:
-
При исследовании спинномозговой жидкости (ликвора):
§ Цитологическое исследование спинномозговой жидкости, подсчет клеток в счетной камере (определение цитоза)
§ Иммунофенотипическое исследование бластных клеток спинномозговой жидкости (при возможности)
§ Исследование уровня глюкозы в спинномозговой жидкости
§ Исследование уровня белка в спинномозговой жидкости
§ Тесты на аномальный белок в спинномозговой жидкости (при необходимости)
§ Определение концентрации водородных ионов (pH) в спинномозговой жидкости
§ Исследование уровня хлоридов в спинномозговой жидкости (при необходимости)
§ Микробиологическое (культуральное) исследование спинномозговой жидкости на различные бактерии, грибы
§ Молекулярно-биологическое исследование спинномозговой жидкости на различные бактерии, грибы, вирусы
-
При исследовании плевральной жидкости
§ Микроскопическое исследование нативного и окрашенного препарата плевральной жидкости
§ Исследование уровня белка в плевральной жидкости
§ Микробиологическое (культуральное) исследование плевральной жидкости на различные бактерии, грибы.
§ Молекулярно-биологическое исследование плевральной жидкости на различные бактерии, грибы, вирусы
-
При исследовании бронхоальвеолярной или асцитической жидкости
§ Микроскопическое исследование лаважной жидкости
§ Микроскопическое исследование перитонеальной (асцитической) жидкости
§ Микробиологическое (культуральное) исследование бронхоальвеолярной жидкости или асцитической жидкости на различные бактерии, грибы
§ Молекулярно-биологическое исследование бронхоальвеолярной или асцитической жидкости на различные бактерии, грибы, вирусы
-
Уровень убедительности рекомендации – C (уровень достоверности доказательств – 5)
-
Рекомендуется всем пациентам с ОЛЛ при проведении биопсии любого органа и ткани выполнение макроскопического исследования удаленного операционного материала, гистологического исследования биопсийного (операционного) материала биоптата, в том числе, с применением иммуногистохимических методов, для дифференциальной диагностики специфического лейкозного поражения и иного типа поражения биопсированного органа, ткани [1, 2].
Уровень убедительности рекомендации – C (уровень достоверности доказательств – 5)
Комментарии: наиболее часто выполняется биопсия очага поражения кожи, костного мозга (трепанобиопсия), лимфоузла. Однако по показаниям может выполняться биопсия любого органа и ткани, в том числе, слизистой полости рта, слизистой оболочки полости носа, тканей легкого, опухоли средостения, селезенки, печени, пищевода, желудка, толстой кишки, молочной железы, кости, женских половых органов, предстательной железы, мужских половых органов, мочевого пузыря, почки, тканей забрюшинного пространства.
-
Рекомендуется всем пациентам с ОЛЛ на любом этапе диагностики и лечения по показаниям выполнять исследование кала на скрытую кровь для исключения кишечного кровотечения как осложнения цитопении [1, 2].
Уровень убедительности рекомендации – C (уровень достоверности доказательств – 5)
4. Инструментальные диагностические исследования
-
Рекомендуется всем пациентам до начала специфической терапии и в ходе лечения с частотой от 1 раза в неделю до ежемесячного (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения регистрация электрокардиограммы (далее – ЭКГ) и эхокардиография (далее – ЭхоКГ) для выявления сопутствующей кардиологической патологии и профилактики/лечения возможных кардиологических осложнений или сердечной коморбидности [41].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: рутинно применяется регистрация электрокардиограммы, при наличии клинических показаний также проводятся регистрация электрической активности проводящей системы сердца, холтеровское мониторирование сердечного ритма, мониторирование электрокардиографических данных, кардиотокография плода.
-
Рекомендуется всем пациентам выполнение компьютерной томографии (далее – КТ) и/или магнитно-резонансной томографии головного мозга, органов грудной и брюшной полостей, а также других областей по показаниям, для выявления возможных очагов поражения и сопутствующей патологии [42].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: наиболее часто проводятся МРТ-исследования костной ткани, головного мозга с контрастированием, спинного мозга с контрастированием, органов малого таза, позвоночника с контрастированием; и КТ-исследования лицевого отдела черепа, позвоночника, придаточных пазух носа, гортани, верхних дыхательных путей и шеи, КТ-ангиография одной анатомической области, органов малого таза у женщин, органов таза у мужчин, головного мозга, органов брюшной полости, органов брюшной полости с внутривенным болюсным контрастированием, забрюшинного пространства. ПЭТ у пациентов с поражением средостения и других экстрамедуллярных очагов вовлечения рекомендовано выполнять до начала терапии и в контрольные точки для принятия решений – после окончания индукции и консолидации, при подозрении на рецидив заболевания и в другие сроки динамического наблюдения.
-
Рекомендуется всем пациентам выполнение ультразвукового исследования (далее – УЗИ) периферических и внутрибрюшных лимфоузлов, органов брюшной полости, органов малого таза у женщин и предстательной железы у мужчин для выявления сопутствующей патологии [1, 2, 5, 13, 14].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: также при наличии клинических показаний на любом этапе диагностики и лечения ОЛЛ выполняется УЗИ иных анатомических областей (наиболее часто – УЗИ мягких тканей, сустава, лимфатических узлов, плевральной полости, средостения, допплерография сосудов (артерий и вен) верхних конечностей, сосудов (артерий и вен) нижних конечностей, толстой кишки, матки и придатков трансабдоминальное, исследование матки и придатков трансвагиальное, молочных желез, щитовидной железы и паращитовидных желез, паращитовидных желез, почек и надпочечников, мочевыводящих путей, забрюшинного пространства).
-
Рекомендуется всем пациентам с ОЛЛ на любом этапе диагностики и лечения при наличии клинических показаний проведение необходимых инструментальных исследований (ларингоскопия, бронхоскопия, трахеоскопия, торакоскопия, эзофагогастродуоденоскопия, колоноскопия, цистоскопия и других) для уточнения типа поражения и контроля лечения [1, 2].
Уровень убедительности рекомендации С (уровень достоверности доказательств – 5)
-
Рекомендуется всем пациентам с ЛБЛ при оценке эффективности лечения сравнивать размеры поражения до начала терапии и после на всех этапах химиотерапевтического воздействия (по данным КТ, ПЭТ/КТ или УЗИ-исследования очага поражения) [13, 14].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется пациентам при наличии клинических симптомов поражения желудочно-кишечного тракта выполнение эзофагогастродуоденоскопии для оценки состояния слизистой оболочки пищевода, желудка, двенадцатиперстной кишки, обнаружения возможного источника кровотечения [14, 43].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется пациентам при наличии клинических симптомов поражения органов дыхания (дыхательной недостаточности, обусловленной обширной пневмонией, кровохарканья) выполнение бронхоскопии для оценки состояния слизистой оболочки трахеи, бронхов, обнаружения источника кровотечения [44].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется пациентам с диагностированной ЛБЛ применение позитронно-эмиссионной компьютерной томографии (ПЭТ/КТ) при верификации диагноза и для стадирования заболевания [45].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: у многих пациентов с ЛБЛ, имеющих массивное поражение медиастинальных лимфоузлов исходно, после завершения ХТ при рентгенографии или КТ остаются резидуальные образования. Целью дополнительных диагностических процедур является получение ответа на вопрос, представляют ли эти образования участки некротической или рубцовой ткани, либо содержат жизнеспособные опухолевые клетки. Лучевые методы исследования, в частности ПЭТ/КТ, вероятно, полезны при стадировании заболевания. Было показано, что позитивные результаты ПЭТ/КТ позволяют с высокой вероятностью прогнозировать резидуальное или поражение при рецидиве НХЛ [95].
5. Иные диагностические исследования
-
Рекомендуется выполнение женщинам репродуктивного возраста теста на беременность (исследование хорионического гонадотропина человека) с целью выявления беременности [1, 5].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется всем пациентам с ОЛЛ/ЛБЛ из группы высокого риска и при рецидиве заболевания, а также их сиблингам определение HLA-антигенов с целью поиска потенциального донора ГСК [46, 47].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
-
Рекомендуется всем пациентам с ОЛЛ при наличии показаний и определении сопутствующей патологии (с коморбидностью, которая может повлиять на выбор программы противоопухолевой терапии), на любом этапе диагностики и лечения прием (осмотр, консультация) соответствующего врача-специалиста (врача-хирурга, врача-сердечно-сосудистого хирурга, врача-кардиолога, врача-невролога, врача-нейрохирурга, врача-оториноларинолога, врача-офтальмолога, врача-уролога, врача-нефролога, врача-колопроктолога, врача-эндокринолога, врача-пульмонолога, врача-фтизиатра, врача-гастроэнтеролога, врача-дерматовенеролога врача-стоматолога-терапевта, врача-стоматолога-хирурга, врача-травматолога-ортопеда, врача-психиатра и др. – первичный и повторный) [1, 2, 4, 5].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется прием (осмотр, консультация) врача-акушера-гинеколога первичный для женщин и врача-уролога для мужчин с целью выявления соматического статуса пациентов и решения вопроса о необходимости овариопротекции или криоконсервации гамет (ооцитов, сперматозоидов) [1, 2, 4, 5].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: невыполнение указанных процедур и методов обследования возможно только в крайних случаях, когда пациент находится в терминальном состоянии при поступлении в специализированное учреждение или его соматический статус таков, что никакого специфического лечения выполняться не будет – только паллиативное, или, если пациент отказывается от обследования и лечения, что должно быть задокументировано в истории болезни.
-
Рекомендуется беременным женщинам выполнять полный объем диагностических исследований при ОЛЛ/ЛБЛ, как и у небеременных, кроме выполнения стандартных рентгенологических методов обследования (см. клинические руководства по ведению беременных пациенток) [1, 48].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: с диагностической целью при беременности целесообразно применение магнитно-резонансной томографии и УЗИ, в том числе легочной ткани [1, 2].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется всем пациентам с ОЛЛ на любом этапе диагностики, наблюдения, лечения, при подозрении на развитие или при развитии инфекционных осложнений выполнение необходимых для диагностики очага инфекции процедур обследования (УЗИ, КТ, микробиологическое (культуральное) исследование крови на стерильность; микробиологическое (культуральное) исследование мочи на бактериальные патогены; микробиологическое (культуральное) исследование отделяемого из полости рта; исследование микробиоценоза кишечника (дисбактериоз), молекулярно-биологические исследования с целью верификации бактерий, грибов, вирусов для уточнения характера инфекции и выработки адекватной тактики лечения [26, 49–51].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Комментарии: инфекции являются одними из ведущих осложнений при лечении ОЛЛ/ЛБЛ, особенно на этапах индукции и консолидации ремиссии, в период нейтропении. Инфекционные осложнения учащаются при резистентном варианте опухоли, при высокодозной химиотерапии, при сопутствующей гипогаммаглобулинемии, в период вынужденной гиподинамии и постоянного постельного режима. Инфекционные осложнения у пациентов с гематологическими заболеваниями характеризуются разнообразием как по этиологии, так и по локализации инфекционного процесса, и требует применения комплекса лабораторных исследований для диагностики инфекционных осложнений и особых подходов к их терапии, которые отличаются от тактики лечения инфекционных проявлений у пациентов без онкогематологического заболевания. Основным фактором, определяющим развитие инфекционных осложнений, является нейтропения (нейтрофилы <0,5х109/л) или лейкопения (лейкоциты ≤1,000х109/л), а также темп снижения количества нейтрофилов и длительность нейтропении. Риск развития инфекций возрастает при повреждении слизистых оболочек желудочно-кишечного тракта (особенно мукозитах III-IV степени), наличии центрального венозного катетера (ЦВК).
При ОЛЛ/ЛБЛ могут развиваться различные вирусные, бактериальные, грибковые инфекционные осложнения, в том числе, оппортунистические инфекции, своевременная диагностика и лечение которых является важнейшим компонентом успешного лечения пациентов. Диагностические исследования включают необходимые исследования лучевой диагностики (КТ и магнитно-резонансная томография вовлеченнных областей, в том числе, по показаниям – компьютерная томография головного мозга); эндоскопические, пункционные и биопсийные исследования (в том числе, по показаниям – бронхо-альвеолярный лаваж, пункция плевральной полости, спинномозговая пункция); лабораторные исследования (в том числе, по показаниям – исследование кислотно-основного состояния и газов крови, исследование уровня прокальцитонина в крови), посевы и другие микробиологические (культуральные), молекулярно-биологические, микроскопические и иные бактериологические исследования на аэробные и факультативно-анаэробные микроорганизмы (в том числе, аэробные и факультативно-анаэробные условно-патогенные микроорганизмы), пнвмоцисты, микоплазму, легионеллу, микобактерии туберкулеза, грибы (дрожжевые и мицелильные), клостридии и другие.
-
Всем пациентам с ОЛЛ/ЛБЛ на любом этапе диагностики, наблюдения, лечения, по показаниям для исключения очага поражения головного мозга с патологической электрической активностью рекомендуется выполнение электроэнцефалографии [1, 2].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Всем пациентам с ОЛЛ/ЛБЛ на любом этапе диагностики, наблюдения, лечения, по показаниям для исключения очага поражения или развития осложнения рекомендуется выполнение рентгенографии пораженной области [1, 2].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: наиболее часто применяется рентгенография всего черепа, в одной или более проекциях, придаточных пазух носа (в том числе, придаточных пазух носа с контрастированием), позвоночника, таза, бедренной кости, перикарда, средостения, почек и мочевыводящих путей, обзорный снимок брюшной полости и органов малого таза, а также рентгеноскопия легких.
Динамическая оценка эффективности терапии
-
Рекомендуется всем пациентам на этапах индукции и консолидации контрольное исследование КМ (получение цитологического препарата КМ путем пункции (стернальная пункция) и цитологическое исследование мазка КМ (миелограмма) из стернального пунктата) выполнять перед началом каждого последующего этапа (оптимально) либо 1 раз в 2 месяца (не реже!) с целью верификации статуса пациента по заболеванию (ремиссия, резистентность, рецидив, прогрессия) [1, 2, 4, 5, 11].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется пациентам на фоне поддерживающей терапии повторять получение цитологического препарата КМ путем пункции (стернальная пункция) и цитологическое исследование мазка КМ (миелограмма) из стернального пунктата 1 раз в 3 месяца в течение 2 лет и в дальнейшем, после снятия с лечения, каждые полгода до 3 лет наблюдения с целью верификации статуса пациента по заболеванию (ремиссия, рецидив) [1, 2, 4, 5, 11].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: стандартизованные временные точки взятия КМ необходимы при мониторинге МОБ. Мониторинг МОБ является ключевым исследованием во всех современных протоколах лечения ОЛЛ. В России, где в КИ включается минимальное число пациентов, рекомендовать стандартизованный мониторинг МОБ и принимать терапевтические решения в зависимости от получаемых показателей представляется преждевременным. Это связано с тем, что в большинстве случаев программы терапии ОЛЛ модифицируются, не соблюдаются принципы «доза – интенсивность», интервалы, в ряде случаев отсутствуют предусмотренные конкретным протоколом препараты. Определение МОБ необходимо для решения вопроса о целесообразности выполнения трансплантации аллогенных гемопоэтических стволовых клеток (далее – алло-ТГСК). Поэтому представляется разумным всех пациентов с ОЛЛ, которые не включены в контролируемые КИ, рассматривать в качестве кандидатов для трансплантации алло-ТГСК, особенно если речь идет о родственной полностью совместимой трансплантации.
Вопреки сомнительной в условиях РФ рекомендации мониторировать МОБ у пациентов с Ph-негативными ОЛЛ, мониторинг МОБ у пациентов с Ph-позитивным ОЛЛ является ключевым условием лечения для ВСЕХ (!) пациентов и в условиях РФ, поскольку это напрямую связано с требованием рекомендаций по смене ингибитора тирозинкиназы брутона (BTK) (далее – ИТК) в случае недостижения молекулярного ответа [1, 2, 52].
МОБ
В настоящее время стандартом мониторинга эффективности лечения ОЛЛ стал мониторинг остаточной опухолевой популяции клеток (МОБ) с помощью методов проточной цитофлуориметрии и/или молекулярно-биологических методов. Указанные методы обладают высокой чувствительностью (обнаруживается 1 лейкемическая клетка на 104–6 нормальных гемопоэтических клеток) и с их помощью можно отслеживать в динамике персистенцию лейкемического клона. Обнаружение МОБ после цитостатического воздействия, особенно после окончания индукции, является самым мощным прогностическим фактором у пациентов с ОЛЛ, свидетельствующим о необходимости изменения терапевтической тактики и применения в программе лечения алло-ТГСК.
Meтоды оценки МОБ
Разработано несколько методов оценки МОБ при ОЛЛ. Эти методы отличаются по трудоемкости, временным затратам, применимости в отдельных ситуациях, чувствительности, стоимости и некоторым другим аспектам. Самое важное в исследовании МОБ – это многократное исследование, оценка в динамике, с течением времени.
Как уже отмечалось ранее, методы детекции и мониторинга МОБ позволяют оценивать эффективность проводимого лечения на молекулярном уровне. Оценка МОБ осуществляется ТОЛЬКО у пациентов, у которых получена полная клинико-гематологическая ремиссия.
-
Рекомендуется мониторинг МОБ осуществлять методом проточной цитофлуориметрии и/или методом ПЦР, то есть теми методами, у которых чувствительность составляет не менее 10–4 (т. е. возможность определить одну опухолевую клетку на 10 000 нормальных) [53, 54].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: не рекомендуется осуществлять мониторинг МОБ методом FISH и методом стандартного цитогенетического исследования. При оценке МОБ у пациента необходимо пользоваться только одним из методов для принятия терапевтических решений, при этом мониторинг должен осуществляться с первых дней терапии и выполняться в одной лаборатории. Анализ МОБ выполняется в образцах КМ. В качестве материала для исследования МОБ используется первая порция аспирата КМ объемом не более 1 мл. Если объем аспирата КМ значительно превышает 1 мл или для исследования МОБ в лабораторию отправлена не первая порция КМ, можно ожидать значительную примесь крови в образце. Настоятельно рекомендуется отправлять образец костного мозга пациента в дебюте заболевания для поиска лейкоз-ассоциированного иммунофенотипа (ЛАИФ) методом проточной цитофлуориметрии той же панелью антител, по которой в дальнейшем будет производиться детекция МОБ. Результат исследования МОБ считается положительным, если при цитофлуориметрическом исследовании выявлена популяция лейкемических клеток, состоящая по меньшей мере из 10-50 клеток с аберрантной гомогенной экспрессией определенных антигенов. Число клеток, формирующих минимальную популяцию, в разных лабораториях может отличаться. Если среди собранных клеток не обнаружено 10-50 лейкемических клеток, то делается заключение, что МОБ не выявлена при достигнутой чувствительности анализа. Требуемая чувствительность метода составляет 0,01%. Для того, чтобы достичь такой чувствительности, необходимо проанализировать 200 000 клеток и более (если за минимальную была принята популяция, состоящая из 20 клеток). Если такая чувствительность не достигается, например, вследствие низкой клеточности КМ или значительного разведения образца КМ периферической кровью, то необходимо провести повторную пункцию КМ и повторное исследование МОБ.
Временные точки мониторинга
В разных КИ ключевые точки исследования МОБ, определяющие прогноз, и соответственно, изменение стратегии терапии, несколько отличаются. В целом исследователи оценивают остаточную популяцию опухолевых клеток в конце 1-й индукционной фазы (6-я неделя от начала терапии) и на этапе консолидации (12-16 недель от начала терапии). Представляется целесообразным использовать временные точки оценки МОБ у пациентов в соответствии с используемым протоколом лечения и только при условии его адекватного выполнения (немецкая группа – 10 и 16 недель, французская – 6 и 12 недель (6-я неделя для определения тактики лечения), Великобритания – 10 и 15 недель, Италия – 10-16-22 недели (22-я неделя для определения тактики лечения)).
При использовании протокола российской исследовательской группы «ОЛЛ-2009» и «ОЛЛ-2016» образцы КМ анализируют на 10-й, 16-й и 28-й неделе терапии и перед/после выполнения алло-ТГСК. В ситуациях, когда у пациента отмечалась персистенция МОБ или при подозрении на рецидив, могут быть рассмотрены дополнительные точки мониторинга МОБ, в том числе на поддерживающей терапии и перед снятием с терапии.
Рекомендации по мониторингу МОБ
-
Рекомендуется всем пациентам перед и после трансплантации осуществление мониторинга транскрипта р190 или р210 посредством количественной ПЦР в реальном времени, которая должна комбинироваться со скринингом на предмет мутаций BCR::ABL1 домена тирозинкиназ (молекулярно-генетическое исследование точечных мутаций гена BCR::ABL1 (химерный ген, образованный слиянием области кластера разрывов на 22 хромосоме и гена тирозин-киназы Абельсона на 9 хромосоме) методом прямого секвенирования) в случае подозрения на рецидив или резистентность [52].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
-
Рекомендуется всем пациентам выполнять исследование МОБ после окончания индукции, консолидации и перед/после ТГСК [4, 53, 68, 69, 71, 241].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
-
Рекомендуется всем пациентам с ОЛЛ МОБ оценивать методом проточной цитофлуориметрии не менее чем 8-ми цветным анализом при достаточной чувствительности и специфичности [71, 241].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Комментарии: при мониторинге МОБ B-ОЛЛ обязательным является анализ семи антигенов не менее 7 антигенов. Обязательно исследование хотя бы: CD19, CD10, CD34, CD38, CD20, CD45, CD58. Дополнительно также могут анализироваться другие маркеры, например, CD11a, CD13, CD33, CD9, CD22, CD81.
При мониторинге МОБ T-ОЛЛ рекомендовано исследование 9 и более маркеров, главным образом: CD7, CD5, CD2, CD3 (поверхностного и внутриклеточного), CD4, CD5, CD1a, CD16/CD56, CD45, CD99, TdT, CD48.
Особую проблему представляет собой исследование образцов КМ больных, получающих терапию таргетными препаратами против CD19 (блинатумомаб**), против CD22 (инотузумаб озогамицин) и T-клеточную терапию (Chimeric Antigen Receptor T-cell — CAR-T). Иммунотерапия может приводить к изменению иммунофенотипа бластных клеток и требует пересмотра стандартно применяющейся в лаборатории панели моноклональных антител, поэтому при поступлении образца КМ для анализа МОБ информация о применении таргентных препаратов в обязательном порядке должна отображаться в сопроводительных документах.
-
Не рекомендуется выполнять мониторинг МОБ при несоблюдении протоколов. Мониторинг МОБ имеет значение только при проведении адекватной ХТ согласно выбранному протоколу, при соблюдении принципа «доза – интенсивность», интервалов и этапов лечения [55].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
-
Оценка МОБ у пациентов может осуществляться разными методами, но обязательно рекомендуется [53, 54]:
-
определение лейкоз-специфических маркеров, пациент-специфических клональных перестроек, аберрантного иммунофенотипа до начала терапии;
-
проведение мониторинга либо одним из методов, либо одновременно двумя (не чередуя, не заменяя один другим);
-
выполнение исследования в одной лаборатории согласно рекомендуемым стандартизованным подходам в четкие сроки, предусмотренные протоколами при их адекватном исполнении.
-
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Основные принципы химиотерапии ОЛЛ/ЛБЛ
При любом принципе химиотерапевтического воздействия в лечении ОЛЛ/ЛБЛ существует несколько основных этапов терапии – индукция ремиссии, консолидация ремиссии, поддерживающая терапия и профилактика (лечение) нейролейкемии.
Период начального лечения, целью которого является существенное уменьшение опухолевой массы и достижение ПР, называется периодом индукции ремиссии. В терапии ОЛЛ используют две фазы индукции длительностью 4 нед каждая. Именно в этот период на фоне применения противоопухолевых препаратов количество лейкемических клеток в КМ уменьшается примерно в 100 раз, т. е. в момент констатации ПР в КМ морфологически определяется менее 5% опухолевых клеток. При использовании импульсного подхода (программы Hyper-CVAD) этапом индукции считаются два курса – собственно 2-недельный курс Hyper-CVAD и следующий за ним после перерыва курс высокодозного цитарабина** и метотрексата**. В большинстве случаев ПР достигается уже после 1-й фазы индукции (или после 1-го курса Hyper-CVAD), и лишь у части пациентов (10-30%) – после 2-й фазы индукции (или 2-го курса высокодозного цитарабина** и метотрексата**) [56–60].
Вторым этапом терапии ОЛ является консолидация ремиссии (закрепление достигнутого противоопухолевого эффекта). В настоящее время в большинстве случаев консолидация является наиболее агрессивным и высокодозным этапом в лечении ОЛЛ. Задачей этого периода является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток. Чаще всего предусмотрены 1-2 таких курса, затем, перед поддерживающим лечением, могут использоваться программы реиндукции (более длительные, аналогичные ИТ). В протоколе российской исследовательской группы периодом консолидации названы пять продолжительных последовательных (3-4-недельных) этапа, между которыми не предусмотрены перерывы (!), но изменяется лишь набор лекарственных препаратов, используемых в данный период, и модифицируются дозировки ряда противоопухолевых препаратов. Следует подчеркнуть, что возможна ротация предусмотренных протоколом этапов консолидации, в зависимости от цитопенического синдрома и вариантов осложнений [56–60].
После завершения этапа консолидации следует период поддерживающего лечения, т.е. продолжение цитостатического воздействия в меньших дозах, чем в период индукции ремиссии, на возможно остающийся опухолевый клон [56–60].
В настоящее время базисом всей программной терапии ОЛЛ/ЛБЛ является дифференцированное воздействие: 1) для иммунологически зрелых В-ОЛЛ доказана эффективность мощного импульсного короткого воздействия в сочетании с CD20 (кластеры дифференцировки 20) ингибиторами (90% 5-летняя БРВ) [61]; 2) для Ph-позитивных ОЛЛ ключевым фактором эффективности является использование ингибиторов тирозинкиназы BCR-ABL (80% 3-летняя выживаемость) [52]; 3) для пациентов, у которых определяется персистенция минимальной остаточной популяции опухолевых клеток, – терапия направленная на редукцию минимального остаточного клона и алло-ТГСК [55, 62].
Принципиально необходимо выделять три ключевые, требующие разного лечения группы ОЛЛ: 1) В-зрелые ОЛЛ, в том числе с транслокацией MYC; 2) Ph-позитивные ОЛЛ; 3) Ph-негативные ОЛЛ [1, 2, 4, 5, 52, 55, 61, 62].
-
Рекомендуется для иммунологически В-зрелого варианта ОЛЛ (в том числе Беркитт-подобными вариантами) использовать интенсивное импульсное (блоковое) воздействие противоопухолевыми препаратами (R-Hyper-CVAD/HMA, NHL-BFM-90 и т. д. см. приложение А3.1) в сочетании с CD20 (кластеры дифференцировки 20) ингибиторами (#ритуксимабом** 375 мг/м2) [61, 63, 258].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4). – для схемы NHL-BFM-90
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3). – для схемы R-Hyper-CVAD/HMA
Комментарии: обычно после выполнения 4-6 блоков пациенты снимаются с терапии, им не проводится поддерживающее лечение, они не нуждаются в выполнении ауто- или алло-ТГСК.
-
Рекомендуется при Ph-позитивных ОЛЛ использование ингибиторов тирозинкиназы BCR-ABL, начиная с иматиниба** в 1-й линии, c дальнейшей модификацией таргетного воздействия на основании мониторинга минимальной остаточной популяции опухолевых клеток и наличия мутаций киназного домена BCR::ABL1 (протокол ОЛЛ-2012m, ОЛЛ-2012 и др. см. приложение А3.1) [64, 65, 249]
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Комментарии: это воздействие должно быть постоянным. Объем ХТ при Ph-позитивных ОЛЛ до сих пор остается предметом дискуссий. Используют как минимальное цитостатическое воздействие (либо одни глюкокортикоды, либо глюкокортикоиды в сочетании с винкристином**), так и более интенсивное (классические химиотерапевтические протоколы лечения ОЛЛ, высокодозные импульсные протоколы).
-
Рекомендуется в терапии Ph-негативных ОЛЛ взрослых пациентов использовать в основном два принципа химиотерапевтического воздействия: 1) импульсное, высокодозное с последующей постоянной поддерживающей терапией (программа Hyper-CVAD/HMA); 2) более традиционное (стандартное) – 8-9-недельная непрерывная индукция с последующими неоднократными высокодозными миелоаблятивными курсами и в последующем – поддерживающим лечением (протокол ОЛЛ-2009, ОЛЛ-2016, GMALL и др. см. приложение А3.1) [55, 56, 66, 77, 250].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Комментарии: результаты крупнейших исследовательских групп по лечению Ph-негативных ОЛЛ у взрослых, в зависимости от принципа химиотерапевтического воздействия, отражены в приложении А3.2. Суммируя данные таблицы, можно отметить, что в целом 5-летняя общая выживаемость (далее – ОВ) взрослых пациентов с ОЛЛ, варьируя в зависимости от группы риска и возраста, составляет 45–55%. Результаты российского исследования абсолютно сопоставимы и даже превышают данные зарубежных исследований, несмотря на малую долю алло-ТГСК и 5-летняя ОВ составляет 65% [66].
-
Рекомендуется пациентам с ОЛЛ, особенно относящимся к группам высокого риска, одним из этапов лечения выполнять ТГСК либо аутологичных (далее – ауто-ТГСК – только при Ph-позитивных ОЛЛ в полной молекулярной ремиссии), либо аллогенных (от родственного или неродственного HLA-совместимого донора – алло-ТГСК) для достижения терапевтического эффекта [55, 62].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарии: Раньше в России ауто-ТГСК проводилась как поздняя высокодозная консолидация чаще всего в лечении Т-клеточных ОЛЛ/ЛБЛ, однако рандомизированное исследование «ОЛЛ-2016» не показало улучшения результатов терапии в группе пациентов с ауто-ТГСК в сравнении с химиотерапией. В зарубежных исследованиях ауто-ТГСК рекомендуется у пациентов в молекулярной ремиссии Ph-позитивного ОЛЛ при отсутствии потенциального донора аллогенных гемопоэтических стволовых клеток. Алло-ТГСК является обязательным этапом терапии пациентов с ОЛЛ из группы высокого риска, и ее эффективность связана с формированием постоянного иммунологического контроля за оставшимся после цитостатического воздействия опухолевым клоном (реакции «трансплантат против опухоли»).
-
Рекомендуется всем пациентам выполнять профилактику или, при необходимости, лечение нейролейкемии [12, 39].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: этот этап распределяется на все периоды программного лечения – индукцию ремиссии, консолидацию и поддерживающее лечение. Обычно профилактику нейролейкемии (основной период – 5-6 интратекальных введений препаратов) осуществляют в период ХТ, затем в течение всех этапов консолидации и поддерживающей терапии выполняются профилактические пункции с разной частотой на разных этапах (в среднем число профилактических спинномозговых пункций должно соствлять 15-20). Лечение нейролейкемии осуществляют по иным принципам. Сначала проводят интратекальные введения противоопухолевых препаратов с частотой 1 раз в 2-3 дня до нормализации показателей цереброспинальной жидкости и получения минимум 3 нормальных результатов анализа спинномозговой жидкости. Затем пункции в течение полугода проводятся с частотой 1 раз в 2-3 недели с последующим переходом на профилактический режим введения. В большинстве случаев облучение головы в дозе 2400 рад не требуется. Этот подход может быть использован лишь у тех пациентов, у кого вследствие различных причин (анатомические особенности, крайне тяжелая переносимость спинномозговой пункции) профилактика нейролейкемии с помощью интратекальных введений противоопухолевых препаратов выполнена быть не может. Также вопрос о применении облучения головы поднимается при рефрактерном течении нейролейкемии (отсутствие полного ответа через 5-6 введений препаратов).
-
Рекомендуется всем пациентам при возникновении аллергической реакции на нативную аспарагиназу** препарат заменять на пэгилированную форму – пэгаспаргазу** [1, 5, 218].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: если не предписано иное (согласно применяемому протоколу), рекомендуемый режим дозирования у взрослых старше от 18 до 21 года – до 2500 МЕ/м2 пэгаспаргазы** каждые 14 дней, для взрослых старше 21 года – 2000 МЕ/м2, при этом по данным различных протоколов доза для взрослых может варьировать и от 500 до 1000 МЕ/м2 (в российском протоколе ОЛЛ-2009 для пациентов старше 55 лет – 500 МЕ/м2, в протоколе ОЛЛ-2016 доза составляет 1000 МЕ/м2). При этом суммарная доза на 1 введение не должна превышать 3750 МЕ и вводиться чаще чем 1 раз в 14 дней. Противопоказанием для применения нативной аспарагиназы** и пэгаспаргазы** является анафилактический шок при применении нативной аспарагиназы** или пэгаспаргазы**, тяжёлая печёночная недостаточность (билирубин в 3 раза превышает верхний предел нормы; трансаминазы в 10 раз превышают ВПН); серьёзный тромбоз в анамнезе после терапии аспарагиназой**; панкреатит в анамнезе, включая панкреатит, связанный с предшествующей терапией аспарагиназой**; серьезные геморрагические осложнения в анамнезе после терапии аспарагиназой**. Некоторые протоколы и схемы, в частности педиатрические, предполагают применение именно пэгаспаргазы** и указанные дозы не могут быть применены или перерасчитаны на нативную аспарагиназу**. Премедикация пациентам за 30-60 мин до введения пэгаспаргазы** проводится в соответствии с инструкцией к препарату, чтобы снизить риск и тяжесть реакций, связанных как с инфузией, так и с гиперчувствительностью. Лечение можно контролировать по активности сывороточной аспарагиназы, определяемой перед следующим введением пэгаспаргазы**. Если активность аспарагиназы не достигает целевого значения, можно рассмотреть возможность перехода на другой препарат аспарагиназы**. Многие зарубежные протоколы терапии ОЛЛ у взрослых, в том числе российские протоколы по терапии ОЛЛ у детей включают исходно применение пэгаспаргазы**, а не только в случаях развития реакции гиперчувствительности. Данная тактика может быть применима и многие протоколы предусматривают эквивалентную дозу нативной аспарагиназы** и пэгаспаргазы** в рамках одного протокола (например, протокол ОЛЛ-2016, протокол при терапии рецидивов, содержащий #бортезомиб**, дексаметазон**, винкристин**, #митоксантрон** и аспарагиназу**/пэгаспаргазу**).
2. Прогностические факторы эффективности лечения
-
Рекомендуется применять факторы риска с целью оценки группы риска и определения показаний к использованию в период первой ПР алло-ТГСК в соответствии с конкретным протоколом лечения [5, 10].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: положение о прогностических факторах при ОЛ возникло с появлением адекватной ХТ, так как только использование стандартных программ позволяет выделить пациентов с определенными клиническими, морфологическими, иммунофенотипическими, цитогенетическими, молекулярно-генетическими характеристиками заболевания, у которых удается или не удается добиться эффекта. Детальное изучение причин неуспеха при использовании стандартных протоколов приводит к формированию групп риска и, соответственно, созданию новых дифференцированных подходов к лечению этих пациентов. Следует подчеркнуть, что наличие у пациента фактора неблагоприятного прогноза ни в коем случае не может быть основанием для перехода к паллиативной терапии. Все факторы прогноза используют и исследуют только в контексте возможности такого изменения терапии, которое повысило бы ее эффективность у таких пациентов.
В течение как минимум двух десятилетий для взрослых пациентов ОЛЛ так называемые факторы риска, ассоциированные с эффективностью лечения, остаются неизменными. Исключение составляют Ph-позитивные ОЛЛ и В-ОЛЛ со зрелым иммунофенотипом, которые были выделены в совершенно отдельные группы, нуждающиеся в особом терапевтическом воздействии (ИТК и блоковая иммунохимиотерапия соответственно), и прогноз при которых вследствие этого изменился существенным образом.
При Ph-негативных ОЛЛ, несмотря на интенсификацию терапии, выполнение значительного числа алло-ТГСК на разных протоколах разных исследовательских групп, определенные клинико-лабораторные параметры продолжают определять прогноз заболевания, так же как и несколько десятков лет назад. Для Ph-негативных В-клеточных ОЛЛ факторами риска большинством исследователей признаются: более старший возраст (30 лет и более), инициальный лейкоцитоз (30×109/л и более), ранний фенотип (ранний пре-В или BI по классификации EGIL), увеличение активности ЛДГ в 2 раза и более, позднее (более чем на 35-й день) достижение ПР, обнаружение t(4;11). Для Т-клеточных ОЛЛ – ранние и зрелый иммунофенотипы (TI/II и TIV по классификации EGIL), инициальный лейкоцитоз (100×109/л и более), позднее достижение ПР. А также отдельно выделяют Т-ОЛЛ из ранних предшественников (ETP вариант), пациенты этой группы должны рассматриваться как группа очень высокого риска. Помимо этого, последние десять лет ключевым фактором прогноза для всех ОЛЛ стал показатель, оценивающий МОБ: при ее обнаружении с чувствительностью метода 10–4 в течение 6 месяцев лечения прогноз определяется как негативный. Пациентам с ОЛЛ определение группы риска, по которой определяется терапевтическая тактика, должно выполняться только в рамках того протокола, который используется у конкретного пациента [1, 2, 4, 5, 11].
Необходимо считать невыполнение протокола терапии, нерегламентированное снижение доз препаратов, длительные интервалы без лечения, не предусмотренные протоколом, грубыми нарушениями химиотерапевтического протокола, и оценивать таких пациентов как пациентов с крайне неблагоприятными исходами терапии [1, 2].
3. Прогностическая значимость МОБ
Известно, что персистирование МОБ после индукционной/консолидационной терапии ассоциируется с неблагоприятным прогнозом и высокой частотой рецидивов, несмотря на продолжение ХТ, и при Ph-позитивных и Ph-негативных ОЛЛ [55, 67–72].
Также крайне неблагоприятным фактором является молекулярный (МОБ) рецидив. Медиана времени от детекции МОБ в КМ до развития гематологического развернутого рецидива составляет около 1-4 месяцев.
-
Рекомендуется лечение молекулярного рецидива Ph-позитивных ОЛЛ и Ph-негативных ОЛЛ в соответствии со стандартами, разработанными для развернутого морфологического рецидива, как минимум при ОЛЛ у взрослых [69–71].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарий: при молекулярном рецидиве Ph+ ОЛЛ необходимо выполнить смену ИТК (Ингибиторы протеинкиназы), рекомендовано при этом исследование мутационного статуса гена BCR::ABL1 с целью назначения эффективного ИТК (Ингибиторы протеинкиназы). Кроме того, и при Ph-, и при Ph+ ОЛЛ показана высокая эффективность применения блинатумомаба** [73] и инотузумаба озогамицина, в том числе с включением ИТК (Ингибиторы протеинкиназы), при молекулярном рецидиве или персистенции МОБ. Наличие молекулярного рецидива может являться критерием включения в КИ по использованию экспериментальных лекарственных средств.
Фактором негативного прогноза в плане безрецидивного течения заболевания является обнаружение МОБ как до, так и после ТГСК. Вероятность развития рецидива достоверно выше у пациентов, у которых определяется МОБ.
4. Лечение пациентов с Ph-негативными ОЛЛ
Выбор программы ХТ у пациентов в возрасте до 55 лет
Различные исследовательские группы применяют различные схемы терапии (приложение А3.1), единого протокола терапии ОЛЛ не существует. Общий принцип терапии представляет собой выполнение предфазы, индукции ремиссии, консолидации ремиссии, поддерживающей терапии.
-
Рекомендуется пациентам с Ph-негативным ОЛЛ в возрасте моложе 55 лет выполнять терапию по протоколу ОЛЛ-2009 или ОЛЛ-2016 (см. приложение А3.1) [66, 250].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Комментарии: российская исследовательская группа провела проспективные многоцентровые исследования и продемонстрировала результаты терапии Ph-негативных ОЛЛ/ЛБЛ у взрослых сопоставимые с другими исследовательскими химиотерапевтическими протоколами.
-
Рекомендуется в качестве альтернативы для молодых пациентов в возрасте до 28 лет применение протокола российской педиатрической группы по лечению ОЛЛ – МВ-2008 [74].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
-
Рекомендуется в качестве альтернативы протоколу ОЛЛ-2009 или ОЛЛ-2016 применение программ лечения немецких (GMALL) и американских (MD Anderson CRC) исследователей (программы терапии приведены в приложении А3.1) [75–78].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
-
Рекомендуется использовать факторы риска, определяющие стратегию терапии ОЛЛ, в зависимости от конкретного выбранного врачом протокола лечения (см. раздел 3.2 «Прогностические факторы эффективности лечения») [1, 2].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: независимо от выбранного протокола терапии пациентов с ОЛЛ с перестройками 11q23/KMT2A (t(4;11) и другие), t(9;22), t(1;19), ETP вариантами, а также с синдромом Ниймеген, необходимо относить к группе очень высокого риска и у всех с самого начала рассматривать возможность выполнения алло-ТГСК.
-
Рекомендуется при грубых нарушениях любого протокола переводить пациентов в группу очень высокого риска и принимать решение о возможности выполнения алло-ТГСК (см. раздел 3.2 «Прогностические факторы эффективности лечения») [1, 2].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Предфаза
Предфазу необходимо начинать сразу после того, как все диагностические мероприятия будут завершены.
-
Рекомендуется всем пациентам с верифицированным диагнозом начинать предфазу преднизолоном** с целью циторедукции и определения чувствительности к преднизолону** [79].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: монотерапия глюкокортикоидами является основой предфазы – инициальной терапии ОЛЛ. Длительность префазы составляет 7 дней, и непосредственно после нее следует индукционная фаза I. Предфаза позволяет стабилизировать состояние пациентов, которые поступают в отделение гематологии с тяжелыми инфекционными осложнениями, метаболическими нарушениями и/или серьезными кровотечениями (антибактериальными и противогрибковыми препаратами системного действия, трансфузионной терапией, заместительной терапией, факторами свертывания крови, #аллопуринолом**)[23, 240], и начать 1-ю фазу индукции без задержки или с минимальными отклонениями. Во время выполнения предфазы осуществляется цитогенетическая диагностика, что позволяет выделить пациентов с Ph-позитивным ОЛЛ и безотлагательно начать им первую фазу индукции по менее токсичному протоколу для Ph+ ОЛЛ. Есть небольшая доля взрослых пациентов с ОЛЛ, у которых регистрируется очень высокая чувствительность опухолевых клеток к преднизолону**, и полная ремиссия (далее – ПР) может быть достигнута после 7 дней монотерапии глюкокортикоидами. Несмотря на то, что в ряде протоколов предфаза не является обязательным компонентом, например, в программе MDACRC (Hyper-CVAD/HMA), российские эксперты полагают, что выполнение предфазы крайне целесообразно.
Индукция ремиссии
-
Рекомендуется всем пациентам строго выполнять индукционный курс терапии согласно выбранному протоколу лечения Ph-негативных ОЛЛ [1, 2].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: I фаза индукции является наиболее критичной, ее продолжительность составляет 4 недели (или 2 недели в протоколе Hyper-CVAD). Именно во время выполнения этого этапа ХТ регистрируется самое большое число осложнений, как токсических, так и инфекционных, с ожидаемой частотой ранних летальных исходов приблизительно ≥5%. В российском многоцентровом КИ, включившем информацию по 300 пациентам с ОЛЛ в возрасте от 15 до 55 лет, показатель ранней летальности составил 9%.
В этот период необходимо выполнять весь объем сопроводительной терапии, включая мониторинг и коррекцию плазменного гемостаза, тромбоцитопении, анемии, лечение инфекционных осложнений, метаболических нарушений (сахарного диабета), психических расстройств, неврологической симптоматики, острых гепатитов, панкреатитов и т. д. В случае развития крайне тяжелых осложнений и/или глубокой цитопении (лейкоцитов менее 500 кл в мкл) цитостатическая терапия должна быть прервана (кроме преднизолона**) и возобновлена с момента остановки при коррекции осложнений и восстановлении показателей крови.
Все программы лечения включают винкристин**, преднизолон** и антрациклины и родственные соединения (даунорубицин**).
Часто в I фазе индукции применяют аспарагиназу**, которая в дальнейшем может использоваться и на протяжении всей программы лечения ОЛЛ. Полагают, что этот препарат увеличивает продолжительность ПР (но не вероятность ее достижения). Однако ранняя отмена аспарагиназы** вследствие развития токсических реакций не оказывает влияния на долгосрочные результаты, в то время как нарушения коагуляционного гемостаза отмечаются часто (более чем у 60%) и требуют мониторинга коагуляционных параметров, а при необходимости – замещения антитромбина III и/или фибриногена.
Недостижение ПР после этой фазы индукции расценивается как рефрактерность, и пациенты переводятся на программы лечения рефрактерных форм ОЛЛ, которые существенно отличаются, в зависимости от иммунофенотипического варианта. Протоколы ХТ приведены в приложении А3.1.
-
Рекомендуется всем пациенам с 15-го дня от начала лечения на все время ХТ выполнять профилактику пневмоцистной пневмонии #ко-тримоксазолом [сульфаметоксазол+Триметоприм]** (480 мг 1 раз в день ежедневно) [1, 2].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
-
Рекомендуется рассмотреть возможность включения в терапию #ритуксимаба** в терапию у пациентов с CD20-позитивными ОЛЛ [247].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Консолидация
-
Рекомендуется всем пациентам, достигшим ПР после завершения индукционного этапа, выполнить этап консолидирующего лечения строго по тому же протоколу, по которому проводилась индукция [1, 2, 4, 5].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: терапия, которую проводят после достижения ПР – консолидация, в разных протоколах лечения существенно отличается по своей интенсивности. Большинство европейских исследовательских групп применяют высокодозные протоколы с включением нескольких курсов цитарабина** и метотрексата** в высоких дозах, обладающих значимым миелосупрессивным эффектом и сопровождающихся длительными периодами миелотоксического агранулоцитоза и периодами без лечения. Широко используемый американский протокол Hyper-CVAD/HMA этапом консолидации называет 4 последовательных чередующихся курса, аналогичных индукции, два из которых – высокодозные [56]. Принципиально отличающимся подходом является этап консолидации в российском протоколе «ОЛЛ-2009», который представляет собой непрерывное цитостатическое низкодозное воздействие. Интервал между завершением II фазы индукции и началом этапа консолидации представляет собой 7 дней, все остальные этапы консолидации (1–3-й этапы) проводят без перерывов. Консолидация 4 в протоколе ОЛЛ-2009 (см. приложение А3.1) представлена однократным введением метотрексата** в высокой дозе (1,5 г/м2) на фоне 3 дней дексаметазона** и однократным введением аспарагиназы**; консолидация 5 – однодневным введением цитарабина** в дозе 2 г/м2 2 раза в день на фоне 3 дней дексаметазона** и однократным введением аспарагиназы** [66].
Хотелось бы отметить, что в российских гематологических центрах фактически отсутствует возможность мониторинга концентрации метотрексата**, что неукоснительно требуется при выполнении высокодозной терапии. Вследствие этого даже однократное использвание метотрексата** в высокой дозе сопровождается летальностью, связанной с токсичностью препарата. В связи с этим хотелось бы обратить внимание врачей-гематологов, которые выбирают иные зарубежные программы лечения, на то, что в этих протоколах метотрексат** в высоких дозах применяют неоднократно и использование метотрексата** в предписанных дозах без наличия адекватного мониторинга с высокой вероятностью может закончиться летальным исходом.
Протокол «ОЛЛ-2016» полностью соответствует принципам терапии протоколу «ОЛЛ-2009», однако в нем предусмотрен уход от применения высоких доз метотрексата** и цитарабина** в консолидации 4 и 5, и консолидация 4 и 5 представляет собой 4-х недельные курсы с применением меркаптопурина**, метотрексата**, цитарабина** в стандартных дозах при ОЛЛ. Результаты многоцентрового исследования показали, что по долгосрочным результатам эффективность обоих протоколов сопоставима.
-
Рекомендуется пациентам использование метотрексата** в высоких дозах, согласно протоколам лечения, только в гематологических центрах, где есть возможность осуществлять измерение концентрации препарата в сыворотке крови, для предотвращения тяжелых нежелательных явлений, обусловленных неадекватной элиминацией метотрексата**. При отсутствии этой возможности целесообразно выбирать протоколы без высокодозных курсов [1, 2, 4, 5].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется всем пациентам неукоснительно соблюдать временной регламент протоколов [1, 2, 4, 5].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется всем пациентам на всех этапах консолидации выполнять профилактику пневмоцистной пневмонии #ко-тримоксазолом [сульфаметоксазол + триметоприм]** (480 мг 1 раз в день ежедневно) [1, 2].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Профилактика и лечение нейролейкемии
Начало профилактики поражения ЦНС, как ключевого компонента терапии ОЛЛ, проводится одновременно с началом системной ХТ [1, 2, 4, 5].
-
Рекомендуется всем пациентам в качестве профилактики нейролейкемии осуществлять спинномозговые пункции с интратекальным введением (введение лекарственных препаратов в спинномозговой канал) трех препаратов: #метотрексата** (15 мг) [1, 4, 158], цитарабина** (30 мг/м2), #преднизолона** (40 мг) [251] или #дексаметазона** (4 мг) [1, 4, 251] согласно схеме выбранного протокола (см. приложение А3.1) [1, 2, 4].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: интратекальное введение противоопухолевых препаратов рекомендуется выполнять всем пациентам в момент первой, так называемой диагностической спинномозговой пункции с лечебно-профилактической целью.
-
Не рекомендуется при высоком инициальном лейкоцитозе (более 30х109/л), выполнение спинномозговой пункции в 1-й день терапии; ее выполнение должно быть отложено до момента снижения числа бластных клеток в периферической крови для избежания контаминации бластными клетками спинномозговой жидкости при травматичной пункции [1, 2].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется выполнение профилактической лучевой терапии ЦНС (ЛТ) (в дозе 24-30 Гр) только у пациентов, получающих лечение в рамках протоколов, включающих ЛТ в программу (см. приложение А3.1), либо у пациентов, у которых вследствие анатомических особенностей не могут быть выполнены спинномозговые пункции [6, 39, 74, 76].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: в рамках Российского протокола выполнение профилактической ЛТ ЦНС не рекомендуется [66]. При наличии анатомических особенностей, которые не позволяют выполнить спинномозговые пункции возможно установление резервуара Оммайя (имплантируемое под кожу головы устройство для введения лекарственных препаратов в желудочки головного мозга).
-
Рекомендуется всем пациентам микроскопическое исследование спинномозговой жидкости, подсчет клеток в счетной камере (определение цитоза) и/или цитологическое исследование клеток спинномозговой жидкости для исключения/подтверждения нейролейкемии [39].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: диагноз нейролейкемии устанавливают при обнаружении в спинномозговой жидкости бластных клеток (в любом количестве) или так называемого цитоза более 15/3 (или 5 клеток в микролитре). Микроскопическое исследование спинномозговой жидкости необходимо выполнять всем пациентам при цитозе ≥5/мкл. Рекомендуется с целью повышения точности анализа использовать для приготовления цитологических препаратов ликвора цитологическую центрифугу.
-
Рекомендуется всем пациентам при констатации нейролейкемии в момент первой диагностической спинномозговой пункции перевести пациента на #дексаметазон** (дозы согласно протоколу терапии – см. приложение А3.1), как препарат, проникающий через гематоэнцефалический барьер [80].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется при персистенции МОБ при Ph-негативных В-ОЛЛ после окончания индукции (протокола ОЛЛ-2009 или ОЛЛ-2016) проведение 1-2 курсов таргетной терапии (блинатумомаб** или инотузумаб озогамицин или #венетоклакс** или #даратумумаб**) с целью быстрой редукции остаточного опухолевого клона с дальнейшим продолжением консолидации согласно изначально начатого протокола (см. приложение А3.1) [166, 200].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Комментарии: у пациентов с ETP ОЛЛ в настоящее время не разработан высокоэффективный подход терапии и даже применение алло-ТГСК не во всех случаях позволяет достигнуть долгосрочных благоприятных результатов терапии, поэтому некоторые исследовательские группы применяют #венетоклакс при ETP варианте ОЛЛ начиная с индукционного периода терапии и/или при рефрактерности нейролейкемии при интратекальной терапии. При подозрении на Ph-подобный ОЛЛ (подтверждение специфических транслокаций и аббераций) могут применяться при персистенции МОБ такие таргетные препараты как дазатиниб**[237], #руксолитиниб**, #венетоклакс**, #сорафениб** в зависимости от обнаруженной генетической поломки с целью быстрой редукции химиорефрактерного опухолевого клона [237].
-
Рекомендуется пациентам с персистенцией МОБ при В-клеточных ОЛЛ применение блинатумомаба** в монотерапии или #блинатумомаба**в сочетании с ИТК в связи с эффективностью (приложение А3.1) [73].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: Внедрение иммунотерапии блинатумомабом** показывает высокую эффективность, и современные клинические исследования изучают в настоящее время в том числе необходимую продолжительность данной терапии, так как уже появляются публикации о возможности коротких 14 дневных курсов с той же эффективностью у части пациентов, что позволяет снизить не только токсичность терапии, но и увеличить экономическую эффективность [245]. В том числе в настоящее время уже зарегистрировано показание FDA на применение блинатумомаба** в первой линии терапии в консолидации вне зависимости от статуса МОБ [246].
Поддерживающая терапия
Поддерживающая терапия является неотъемлемой и необходимой частью стандартной терапии ОЛЛ у взрослых, за исключением ОЛЛ из зрелых B-лимфоцитов. Ее продолжительность составляет в среднем 2 года.
-
Пациентам с Ph- ОЛЛ (кроме терапии зрелого варианта В-ОЛЛ) рекомендуется проведение поддерживающей терапии, состоящей из ежедневного приема меркаптопурина**, метотрексата** (дозировка согласно применяемому у данного пациента протоколу лечения, см. приложение А3.1) – 1 раз в неделю, пульсов глюкокортикоидов и винкристина**– 1 раз в месяц или по схеме POMP в течение 2-х лет [1, 2, 4, 5, 56].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: этот этап лечения может осложняться развитием миелотоксического агранулоцитоза, поэтому необходимо четко выполнять рекомендации по коррекции доз противоопухолевых препаратов.
-
Пациентам рекомендуется проведение поддерживающей терапии с учетом указанных в применяемом у данного пациента протоколе лечения рекомендаций по редукции доз с целью минимизации числа инфекционных осложнений, связанных с развитием цитопенического синдрома (см. приложение А3.1) [1, 2, 4, 5].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Не рекомендуется проведение поддерживающей терапии после алло-ТГСК (исключение составляет Ph/BCR::ABL1-позитивный ОЛЛ, при котором показано применение ИТК (Ингибиторы протеинкиназы) после алло-ТГСК в течение 2 лет) [1, 2, 4, 5]
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: у пациентов с ОЛЛ при достижении ПР только после применения таргетных препаратов может быть применена соответсвующая таргетная терапия после алло-ТГСК (например, при достижении ПР при Ph-подобном ОЛЛ на терапии с включением дазатиниба** – поддерживающая терапия дазатинибом** может проводиться после алло-ТГСК, или при ETP варианте ОЛЛ – при достижении МОБ-негативности или терапии рецидива только после применения #венетоклакса** – может проводиться терапия #венетоклаксом**).
-
Рекомендуется проведение поддерживающей терапии пациентам после ауто-ТГСК с учетом редукции доз препаратов, результатов регулярного исследования общего (клинического) анализа крови и анализа крови биохимического общетерапевтического, и при отсутствии инфекционных осложнений [1, 2, 4, 5]
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Всем пациентам рекомендуется прием #ко-тримоксазола [сульфаметоксазол + триметоприм]** (480 мг 1 раз в день ежедневно) во время всей поддерживающей терапии с целью профилактики пневмоцистной пневмонии [1, 2].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Лечение лимфобластной лимфомы
-
Рекомендуется во всех случаях ЛБЛ (даже при отсутствии поражения КМ) проводить терапию пациентам согласно принципам и по протоколу лечения ОЛЛ (в соответствией с классификацией ВОЗ см. приложение A3.1) [1, 13, 14].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется всем пациентам выполнить дистанционную лучевую терапию при поражении средостения в дозе 36 Гр в конце консолидации или после ауто-ТГСК, если размеры средостения после выполнения всех этапов консолидации остаются увеличенными (3 см и более) и/или имеется ПЭТ-позитивное остаточное образование (более 3 баллов) [1, 2, 4, 5].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: при ОЛЛ поражение лимфатических узлов, печени, селезенки, средостенных лимфоузлов и тимуса не относят к экстрамедуллярным, поскольку вышеперечисленные органы являются частью лимфатической системы организма и при ОЛЛ их вовлечение в процесс является обычным проявлением заболевания. К экстрамедуллярным относят нейролейкемию (см. выше), поражение кожи (кожные лейкемиды), мягких тканей, костей, яичек, яичников и др.
5. Ph-негативные ОЛЛ у пожилых пациентов
-
Рекомендуется лечение у пациентов старше 55 лет начинать с предфазы глюкокортикоидами (дозировка согласно протоколу ОЛЛ-2009 для лиц старше 55 лет, протокол европейской группы для лечения лиц старше 55 лет – см. схемы в приложении А3.1) [1, 2, 4, 5].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется пациентам старше 55 лет с Ph-негативными ОЛЛ с удовлетворительным соматическим статусом без тяжелой сопутствующей патологии проведение ХТ противоопухолевыми препаратами в сниженных дозах с последующими курсами консолидации и поддерживающей терапии (приложение А3.1, протокол ОЛЛ-2009 для пациентов старше 55 лет, протокол европейской группы по лечению лиц старше 55 лет) [1, 2, 4, 5].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Не рекомендуется пациентам ОЛЛ в возрасте старше 65 лет рассматривать возможность выполнения алло-ТГСК в связи с высоким риском летальности [81].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется пациентам старше 65 лет проводить лечение по программам ХТ с коррекцией доз противоопухолевых препаратов (см. приложение А3.1 – протоколы ОЛЛ-2009 для лиц старше 55 лет) [1, 2, 4, 5, 81].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется пациентам с Ph-негативными ОЛЛ в неудовлетворительном соматическом статусе и/или с тяжелой сопутствующей патологией выполнение паллиативной терапии – купирование симптомов заболевания, проведение заместительной терапии трансфузионными средами [81].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
6. Лечение пациентов с Ph-позитивным ОЛЛ
-
Пациентам в возрасте <55 лет, либо кандидатам для выполнения алло-ТГСК рекомендуется проведение терапии иматинибом** (600 мг/сут) в комбинации с ХТ на основе 4-5 препаратов (протокол ОЛЛ-2012m, ОЛЛ-2012 – схему терапии см. в приложении А3.1) [52, 249].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: обнаружение у ~30% пациентов с ОЛЛ транслокации t(9;22)(q34;q11) и, соответственно, химерного транскрипта BCR-ABL позволяет использовать в лечении этой формы ОЛЛ иматиниб** – ИТК (Ингибиторы протеинкиназы) 1-го поколения, подавляющий активность тирозинкиназы BCR::ABL1, позволяющий достичь в монорежиме гематологический ответ у 70% пациентов, с частотой достижения ПР лишь в 19-20% случаев. В связи с этим в настоящее время разрабатываются различные комбинированные схемы с использованием противоопухолевых препаратов, позволяющих достичь ПР у 90-95% пациентов, а также улучшить качества ответа перед ТГСК.
-
Рекомендуется пациентам старше 55 лет, не являющимся кандидатами на выполнение ТГСК, терапия иматинибом** с возможным добавлением к нему глюкокортикоидов и/или ХТ (протокол ОЛЛ-2012m с применением доз для лиц старше 55 лет – схему терапии см. в приложении А3.1) [81, 158].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: терапевтические подходы к лечению пациентов старше 55 лет направлены в большей степени на снижение интенсивности терапии за счет применения в качестве базовой терапии иматиниба** (в фиксированной дозе 600 мг/сутки) в комбинации с пероральным преднизолоном** (в дозе 40 мг/м2 в сутки), а также с низкоинтенсивными режимами ХТ (винкристином** и дексаметазоном**).
-
Рекомендуется выполнять профилактику нейролейкемии всем пациентам согласно выбранному протоколу (см. приложение A3.1) [39].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: иматиниб** недостаточно проникает через гематоэнцефалический барьер, и его концентрация в спинномозговой жидкости достигает лишь 1-2% от таковой в сыворотке крови. Поэтому всем пациентам с Ph+ ОЛЛ необходимо проведение активной нейропрофилактики.
Постиндукционная терапия
-
Рекомендуется выполнение алло-ТГСК от сиблинга или неродственного донора пациентам, которые имеют показания и относятся к группе высокого риска (см. раздел 3.2 «Прогностические факторы эффективности лечения») [47, 55].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: Современные исследования демонстрируют, что выполнение алло-ТГСК значимо улучшает прогноз у молодых пациентов до 40 лет, а для группы старше 40 лет возможно выполнение алло-ТГСК во второй полной ремиссии с учетом трансплантационных рисков и решение должно быть принято на основании оценки риска этих осложнений.
-
Рекомендуется выполнение ауто-ТГСК при отсутствии HLA-идентичного донора у МОБ-негативных пациентов с последующей поддерживающей терапией ИТК [82].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: МОБ-негативностью при Ph+ОЛЛ является полное отсутствие транскрипта (р190 и/или р210) определяемого количественным методом.
Поддерживающая терапия
-
Рекомендуется всем пациентам с Ph+ ОЛЛ использование комбинации ИТК (Ингибиторы протеинкиназы) с ХТ (протокол ОЛЛ-2012m, Hyper-CVAD/HMA c ИТК (Ингибиторы протеинкиназы) – схему терапии см. в приложении А3.1) [52, 158, 249].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Терапия Ph-позитивного ОЛЛ у пожилых пациентов
-
Рекомендуется всем пациентам с Ph-позитивным ОЛЛ старше 55 лет проведение ХТ иматинибом** +/– глюкокортикоидами +/– винкристином** с последующей консолидационной терапией и поддерживающей терапией (схему протокола ОЛЛ-2012m ветвь для лиц старше 55 лет см. в приложении А3.1) [52, 81].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется пациентам старше 55 лет с Ph-позитивным ОЛЛ выполнять алло-ТГСК с немиелоаблятивными режимами кондиционирования после оценки рисков трансплантационной летальности и коморбидности [81].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: результаты лечения у пожилых пациентов значительно хуже, нежели у детей и более молодых взрослых. Это объясняется ограниченными возможностями проведения интенсивной терапии за счет соматического статуса пациентов и сопутствующих заболеваний в пожилом возрасте, а также неблагоприятными факторами прогноза, присущими пациентам данной возрастной группы. Пациенты с ОЛЛ пожилого возраста в настоящее время определяются как отдельная группа пациентов, требующая использования специфичных для данного возраста протоколов. В большинстве исследований для ОЛЛ в старшую возрастную группу включают пациентов в возрасте 55 лет и старше. При этом у пациентов старше 55 лет 30-50% составляют Ph+ ОЛЛ.
-
Рекомендуется использование иматиниба** в качестве поддерживающей терапии после алло-ТГСК (приложение А3.1), или того ИТК, на котором достигнута ремиссия до алло-ТГСК [83].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется переход на ИТК 2-го поколения при развитии резистентности к иматинибу** (дазатиниб**, #нилотиниб**) (приложение А3.1) [83].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: выбор препарата должен быть основан на анализе мутационного статуса BCR::ABL.
Рецидив
-
Рекомендуется у пациентов ОЛЛ с рецидивом заболевания использование дазатиниба**, #нилотиниба**, #бозутиниба**, понатиниба, #асциминиба [252, 257] при отсутствии мутаций, ассоциированных с резистентностью к ним (в монотерапии или в сочетании с протоколами терапии рецидивов В-ОЛЛ (блинатумомаб**, инотузумаб озогамицин, Hyper-CVAD/HMA) - см. приложение А3.1) [52, 252, 257].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: бластные клетки при Ph+ ОЛЛ характеризуются приобретенными генетическими аномалиями, что значимо влияет на его прогноз и способствует прогрессированию заболевания. Приблизительно 80% пациентов с Ph+ ОЛЛ, у которых отмечается рецидив на фоне терапии иматинибом**, имеют мутации bcr-abl, среди которых доминируют T315I.
Дазатиниб** является более активным препаратом по сравнению с иматинибом** и эффективен при резистентных к иматинибу** конформациях киназного домена. Он способен ингибировать пролиферацию и активность киназы дикого типа, а также 14 из 15 мутантных вариантов BCR-ABL1, за исключением мутации T315I. В КИ II фазы была подтверждена эффективность дазатиниба** при резистентности к иматинибу** у пациентов с Ph+ ОЛЛ, а также у пациентов, не переносивших иматиниб**.
В настоящее время #нилотиниб**, #бозутиниб** и понатиниб, #асциминиб могут рассматриваться в качестве альтернативы иматинибу** и дазатинибу**. В то же время до сих пор они формально для лечения ОЛЛ не зарегистрированы. Назначение того или иного ИТК должно быть осуществлено после определения мутационного статуса.
7. Особые состояния при лечении острого лимфобластного лейкоза
Гиперлейкоцитозы
-
Рекомендуется всем пациентам проведение сеансов лейкоцитафереза при бессимптомном течении гиперлейкоцитоза при числе лейкоцитов >300×109/л, а также при наличии клинической картины лейкостазов при числе лейкоцитов >150×109/л [84].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: число лейкоцитов в гемограмме >100×109/л в дебюте ОЛЛ наблюдается в 10-30% случаев ОЛЛ и является, как и при других вариантах ОЛ, фактором неблагоприятного прогноза. Чаще лейкоцитоз при ОЛЛ развивается в молодом возрасте, у мужчин, при Т-клеточном варианте (в 38% случаев число лейкоцитов >100×109/л), при наличии поражения средостения, массивной гепатоспленомегалии, нейролейкемии, а также при Ph+ ОЛЛ и MLL-лейкемии. Клинические проявления гиперлейкоцитоза при ОЛЛ обусловлены проявлениями лейкостазов. Однако тяжесть их значительно меньше, чем при остром миелоидном лейкозе (далее – ОМЛ), и, соответственно, ниже ранняя летальность (2-6%). Реже встречается клиника лейкостазов, проявляющаяся признаками тканевой гипоксии, ДВС-синдромом, органной дисфункцией, геморрагическими осложнениями, в том числе со стороны ЦНС (2-3%), а также поражением легочной ткани с развитием острого респираторного дистресс-синдрома (далее – ОРДС) (6%) и почечной недостаточностью. Терапия данного состояния при ОЛЛ преимущественно направлена на предотвращение синдрома лизиса опухоли и ДВС-синдрома на фоне начала ХТ. Для этого применяются лейкоцитаферезы, однако эффективность их при ОЛЛ значимо ниже, чем при ОМЛ.
-
Рекомендуется всем пациентам с момента диагностики ОЛЛ проведение терапии #аллопуринолом** (200-800 мг) [23], адекватная гидратационная терапия (до 3 л/м2), при необходимости – форсированный диурез с помощью инфузий и петлевых диуретиков с целью профилактики синдрома лизиса опухоли [1, 2, 4, 5, 23].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Всем пациентам при быстром снижении числа лейкоцитов на фоне предфазы преднизолоном** рекомендуется проведение плазмафереза с целью удаления токсичных продуктов распада опухолевых клеток [84].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется всем пациентам профилактика синдрома лизиса опухоли [84].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
ОЛЛ при беременности
Частота злокачественных новообразований, ассоциированных с беременностью, относительно низкая и составляет 0,02-0,1% всех беременностей. Лейкозы в период беременности встречаются редко (приблизительно 1 случай на 75 000-100 000 беременностей). Большинство из них представляют собой ОЛ, треть которых приходится на ОЛЛ. Относительная редкость этих патологических состояний является основным лимитирующим фактором, затрудняющим проведение крупных проспективных исследований, оценку принципов лечения и исходов; в результате описаны лишь небольшие ретроспективные исследования и отдельные случаи. Также беременность является критерием исключения в большинстве КИ, что также ограничивает возможность выработки единых подходов к ведению этих пациентов и оценке результатов их лечения. В рамках многоцентрового КИ (ALL-2009) (ClinicalTrials.gov: NCT01193933) было принято решение о включении в исследование женщин, которым диагноз ОЛЛ был установлен на различных сроках беременности.
Всего с 1990 по 2016 г. врачами российской исследовательской группы по лечению лейкозов были исследованы 28 беременных женщин с ОЛЛ. Распределение по иммунологическим вариантам ОЛЛ соответствует таковому в общей популяции пациентов с ОЛЛ: в 68% случаев диагностирован В-ОЛЛ и в 32% – Т-ОЛЛ. Была отмечена более высокая частота встречаемости факторов негативного прогноза у пациентов на фоне беременности. Так, MLL-лейкемия (t(4;11)) была выявлена практически в 10 раз чаще на фоне берменности в сравнении с общей популяцией обследованных пациентов с ОЛЛ (27,3 и 3,2% соответственно). Также по совокупности факторов прогноза и ответа на предфазу преднизолоном** практически все пациенты были отнесены к группе высокого риска. При проведении терапии по протоколу ОЛЛ-2009 у беременных женщин отмечено, что в сравнении с общей популяцией пациентов статистически значимых различий как в частоте инфекционных и токсических осложнений, так и в длительности интервалов в лечении по протоколу выявлено не было.
Проведение лечения ОЛЛ на фоне беременности осуществляется мультидисциплинарной командой врачей, включающей врача-гематолога, врача-акушера-гинеколога, врача-анестезиолога-реаниматолога, в стационаре, имеющем возможности оказания акушерской помощи родоразрешения в экстренных ситуациях [85, 86].
-
Не рекомендуется при установлении диагноза ОЛЛ во время беременности отсрочка начала лечения лейкоза [86].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется при диагностике ОЛЛ в течение первого триместра беременности рассмотреть вопрос об искусственном прерывании беременности по медицинским показаниям [86].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: если женщина и ее семья настаивают на сохранении беременности, лечение может быть начато и в первом триметре беременности.
-
При выявлении ОЛЛ на сроке беременности 13-36 недели (после завершения первого триместра беременности) рекомендуется начало проведения ХТ при условии возможности своевременного проведения всего комплекса диагностических и лечебных мероприятий как по поводу ОЛЛ, так и по поводу беременности [86].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
При выявлении ОЛЛ после 36-й недели беременности рекомендуется родоразрешение в ходе предфазы преднизолоном** с последующим проведением ХТ [87].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется использование любых лекарственных веществ, в том числе противоопухолевых и антибактериальных препаратов системного действия во время беременности, руководствуясь соотношением «риск – польза» для матери и плода [86].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: соблюдение доз противоопухолевых препаратов в соответствии с выбранной программой лечения (без редукции доз), рассчитанных на поверхность тела пациентки с корректировкой по весу во время лечения.
При развитии угрожающих жизни осложнений (например, пневмоцистной пневмонии, ЦМВ-инфекции) использовать регламентированные препараты (например, ко-#тримоксазол [Сульфаметоксазол+Триметоприм]**, ганцикловир** и другие) допустимо [253].
-
Рекомендуется с учетом возможного тератогенного воздействия #метотрексата** выполнение интратекальных введений противоопухолевых препаратов на фоне беременности без использования #метотрексата** [85, 86].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется с учетом возможных коагулогических нарушений перенести введения аспарагиназы** на этапы лечения после родоразрешения [86].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется при Ph+ ОЛЛ на фоне беременности проведение терапии #иматинибом** (400 мг в сутки) и интратекальным введением #цитарабина** (100 мг) [88] в сочетании с глюкокортикоидами
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
или по протоколу ОЛЛ-2012m [253] (приложение А3.1) [253].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется предпочитать метилпреднизолон** и преднизолон** дексаметазону** ввиду возможности развития неблагоприятных неврологических последствий у плода в случае применения последнего [89].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется планировать срок родоразрешения с учетом дней введения противоопухолевых препаратов не ранее чем через 2-3 недели после введения противоопухолевых препаратов с целью уменьшения вероятности миелосупрессии у плода [90].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется выполнять родоразрешение путем кесарева сечения [90].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: выбор способа родоразрешения определяется состоянием плода, соматическим статусом пациентки, гематологическими показателями и строго в соответствии с акушерскими показаниями. Самопроизвольные роды могут быть выбраны как способ родоразрешения только при наличии у пациентов ремиссии ОЛЛ, удовлетворительных показателей гемограммы и при хорошем соматическом статусе пациента и состоянии плода. В остальных ситуациях предпочтительно выполнять родоразрешение методом кесарева сечения.
-
Не рекомендуется выполнять эпидуральную анестезию при тромбоцитопении <80×109/л и/или нейтропении <1×109/л при родоразрешении во избежание осложнений, связанных со спинномозговой пункцией [91].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется пациенткам при плановом преждевременном родоразрешении на сроке 24-35 недель проводить профилактику острого респираторнрого дистресс-синдрома (ОРДС) плода в соответствии с профильными рекомендациями [92]
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
8. Лимфобластные лимфомы
Ранние публикации об использовании стандартных протоколов ХТ, предназначенных для лечения неходжкинских лимфом (далее – НХЛ), в частности CHOP подобных режимов, приводили к достижению крайне низкой частоты ПР (53-71%) и выживаемости без признаков заболевания (0-53%). С середины 70-х годов в лечении лимфобластных НХЛ у взрослых используют ОЛЛ-ориентированные программы ХТ.
-
Рекомендуется лечение ЛБЛ по следующим протоколам ХТ: ОЛЛ-2009, ОЛЛ-2016, Hyper-CVAD ± R (см. приложение А3.1) [13, 14, 66, 158, 250].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: поскольку режимы терапии, разработанные для НХЛ, не были успешными при ЛБЛ, представляется, что режимы терапии, используемые при лечении ОЛЛ, обеспечат более благоприятные результаты.
-
Рекомендуются обязательная профилактика и лечение поражения ЦНС, включающие интратекальное введение противоопухолевых препаратов [13, 14].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: от использования краниального облучения для профилактики ЦНС поражения в большинстве протоколов отказались, его применяют только пациентам с инициальным поражением ЦНС (краниальное облучение 12–18 Гр на линейном γ-ускорителе).
-
Рекомендуется всем пациентам лучевая терапия резидуальных опухолевых образований средостения [13, 14].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: в большинстве случаев поражение медиастинальных лимфатических узлов при ЛБЛ характеризуется весьма хорошим ответом на первичную ХТ. Четкое определение резидуальной опухолевой массы средостения отсутствует; в качестве такового могут расцениваться остаточная опухоль размером >3 см, по данным КТ, и/или положительный результат ПЭТ (более 3 баллов). Лучевая терапия резидуальных опухолевых образований средостения, как представляется, является наилучшим вариантом терапии. Вопрос об оптимальной дозе в данном случае (24 или 36 Гр) остается открытым.
-
Рекомендуется считать ремиссию полной у всех пациентов при лечении ЛБЛ из Т- и В-предшественников, при наличии критериев (на 70-й день ХТ либо после индукции)::
-
Отсутствие доказательства наличия остаточного образования (при массивном поражении могут оставаться резидуальные образования менее 3 см) или сокращение размеров опухоли более чем на 75% от исходного.
-
Присутствие в КМ менее 5% бластов при восстановлении показателей нормального кроветворения.
-
Отсутствие бластов при исследовании ликвора на 29-й день протокола [13, 14].
-
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Лечение рецидива
Прогноз при рецидиве ЛБЛ крайне неблагоприятный. Рецидивы ЛБЛ развиваются, как правило, в первые 2 года после достижения ремиссии и чаще бывают локальными. Терапия рецидива определяется характеристиками рецидива (локализация и сроки развития) и тактикой лечения 1-го острого периода. Используют протоколы лечения рецидивов ОЛЛ, высокодозную терапию, препараты, не применявшиеся в 1-м остром периоде (курсы ICE, препараты неларабин**, #гемцитабин** и др. – см. приложение А3.1); при достижении второй ремиссии рекомендуется алло-ТГСК. Эффективность терапии рецидивов Т-клеточных ЛБЛ остается крайне низкой, В-ЛБЛ – несколько лучше.
-
Рекомендуется алло-ТГСК при рецидивах и рефрактерном течении после достижения ответа на ХТ [13, 14].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: опыт выполнения алло-ТГСК при ЛБЛ в первой ПР ограничен [13].
9. Рецидивы Ph-негативных ОЛЛ
Рецидив лейкемии у взрослых пациентов с Ph- ОЛЛ остается неразрешенной терапевтической проблемой. Результаты лечения данной фазы заболевания невелики, и рецидив ОЛЛ до настоящего времени расценивается как обычно инкурабельное патологическое состояние. Хотя у ряда пациентов возможно достижение второй полной ремиссии (далее – ПР2), частота ПР2 остается низкой, а медиана выживаемости после рецидива – короткой. Представляется общепринятым, что пациенты, у которых отмечается рецидив заболевания, не могут быть излечены только путем ХТ. Единственным вариантом радикального лечения является алло-ТГСК. В целом это требует достижения относительно стойкой ПР2 на фоне терапии спасения, которая должна ассоциироваться с минимальной токсичностью. В этом контексте рецидивы, развившиеся после алло-ТГСК, являются еще более значительной терапевтической проблемой. Вследствие неблагоприятных общих исходов у этих пациентов сохраняется значительная потребность в разработке и исследовании новых лекарственных средств. Возможным вариантом лечения данной группы пациентов является включение в протоколы КИ, в том числе новых препаратов. Таким образом, одним из основных клинических решений у пациентов с рецидивным Ph- ОЛЛ является выбор между стандартной ХТ спасения и экспериментальной терапией, за которыми должна следовать алло-ТГСК во всех случаях, когда это возможно; лечение данных пациентов производится в рамках КИ.
-
Рекомендуется пациентам при позднем рецидиве (более 6 месяцев от окончания поддерживающей терапии) использовать стандартную терапию 1-й линии или новые таргетные подходы (блинатумомабом** или инотузумаб озогамицин), а также терапию #венетоклакс** в сочетании с #децитабином** или #азацитидином**[158, 244] (см. приложение А3.1) [93, 94, 158, 241, 244]. В качестве возможных ХТ комбинаций возможно использовать программы FLAG-Ida, FLAM или Hyper-CVAD, либо #бортезомиба** в комбинации с ХТ (например, #митоксантроном**, дексаметазоном** и аспарагиназой** (см. приложение А3.1) [94, 241].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется пациентам при раннем рецидиве В-ОЛЛ использование экспериментальных комбинаций в рамках КИ, в том числе с применением #венетоклакса**, #децитабина**, блинатумомаба** и инотузумаба озогамицина, Т-клетками с химерным антигенным рецептором. В качестве возможных ХТ комбинаций возможно использовать программы FLAG-Ida, FLAM или Hyper-CVAD, либо #бортезомиба** в комбинации с ХТ (например, #митоксантроном**, дексаметазоном** и аспарагиназой** (см. приложение А3.1) [94, 241].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется при терапии рецидивов предпочтительное использование дексаметазона** вместо преднизолона** в связи с большей эффективностью [79].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
-
Рекомендуется всем пациентам, у которых достигнута ПР2, консультанция в трансплантологическом центре для уточнения возможности выполнения им HLA-совместимой алло-ТГСК [55].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется пациентам с ранним рецидивом или персистенцией МОБ при В-клеточных ОЛЛ применение блинатумомаба** в монотерапии или #блинатумомаба** в сочетании с ИТК в связи с эффективностью (приложение А3.1) [73].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: Внедрение иммунотерапии блинатумомабом** показывает высокую эффективность, и современные клинические исследования изучают в настоящее время в том числе необходимую продолжительность данной терапии, так как уже появляются публикации о возможности коротких 14 дневных курсов с той же эффективностью у части пациентов, что позволяет снизить не только токсичность терапии, но и увеличить экономическую эффективность [245].
-
Рекомендуется пациентам с ранним рецидивом или персистенцией МОБ при В-клеточных ОЛЛ применение инотузумаба озогамицина в связи с эффективностью (приложение А3.1) [4, 241, 243].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: Инотузумаб озогамицин показал высокую эффективность при экстрамедуллярных рецидивах ОЛЛ по сравнению со стандартной ХТ.
-
Рекомендуется пациентам до 25 лет включительно с рецидивом при В-клеточных ОЛЛ рассмотреть возможность применение терапии Т-клетками с химерным антигенным рецептором (Chimeric Antigen Receptor T-cell - CAR-T - #тисагенлеклейцел) в связи с эффективностью (схему терапии см. в приложении А3.1) [222-223].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: Внедрение в клиническую практику терапии Т-клетками с химерным антигенным рецептором (Chimeric Antigen Receptor T-cell - CAR-T) открывает новые перспективы лечения этой группы больных. СAR-T-клетки представляют собой генно-инженерные модифицированные Т-лимфоциты, способные экспрессировать на своей поверхности химерный антигенный рецептор (CAR), распознающий специфический опухолевый антиген. CAR состоит из антиген-распознающего домена, который фактически является вариабельным фрагментом опухоль-специфичного моноклонального антитела с необходимой аминокислотной последовательностью для таргетного воздействия, соединенного с частью Т-клеточного рецептора, состоящего из трансмембранного домена, сигнального домена и костимуляторных молекул, которые опосредует активацию Т-клетки. Как итог такого слияния, клетка с CAR способна распознавать опухолевый антиген, активироваться и уничтожать опухолевую клетку, то есть имеет преимущества как моноклонального антитела с высокой аффинностью и специфичностью, так и лимфоцита со способностью к пролиферации и цитотоксическому действию [221]. После получения результатов, свидетельствующих об эффективности CD19 CAR-T клеток в исследовании ELIANA в 2017 г. [222], Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA) впервые был одобрен препарат CTL019 (тисагенлеклейцел) для лечения детей и молодых взрослых до 25 лет с Р/Р B-ОЛЛ). В России зарегистрирован тисагенлеклейцел по показанию рецидив В-ОЛЛ у детей и молодых взрослых до 25 лет включительно. Кроме того, внедрение в клиническую практику в рамках КИ в академических центрах применения CAR-Т, специально произведенного для отдельного пациента непосредственно в медицинской организации, в которой применяется данный биомедицинский клеточный продукт, продемонстрировали эффективность [238, 239].
-
Рекомендуется пациентам с ранним рецидивом или персистенцией МОБ при Т-клеточных ОЛЛ применение неларабина** в сочетании с циклофосфамидом** и #этопозидом** (см. приложение А3.1) [96].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется пациентам с рецидивом или персистенцией МОБ при Т-клеточных ОЛЛ (в том числе с коэкспрессией миелоидных маркеров) применение #венетоклакса** в сочетании с #децитабином** (или #азацитидином**) или в других комбинациях (см. приложение А3.1) [97, 158, 244].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется пациентам с рецидивом или персистенцией МОБ при Т-клеточных ОЛЛ с экспрессией CD38 применение #даратумумаба** (см. приложение А3.1) [224, 225].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется пациентам с рецидивом или персистенцией МОБ при ОЛЛ с делецией гена IKZF1 применение дазатиниба** в сочетании с #третиноином** в сочетании с ХТ или блинатумомабом** (см. приложение А3.1) [226, 228, 234].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется пациентам с рецидивом или персистенцией МОБ при ОЛЛ с мутациями генов KRAS/NRAS применение #сорафениба** в сочетании с ХТ или #блинатумомабом** (см. приложение А3.1) [226, 227].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется пациентам с рецидивом или персистенцией МОБ при ОЛЛ с перестройками JAK2/CLRF2/EPOR применение #руксолитиниба** в сочетании с ХТ или #блинатумомабом** (см. приложение А3.1) [226, 228, 231].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
-
Рекомендуется пациентам с рецидивом или персистенцией МОБ при ОЛЛ с вовлечением ЦНС применение #венетоклакса** или #сорафениба** в сочетании с ХТ или #блинатумомабом** (см. приложение А3.1) [226, 227, 229-233].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
10. Трансплантация гемопоэтических стволовых клеток
Аллогенная ТГСК
Показания к выполнению алло-ТГСК определяются в зависимости от конкретного, выбранного гематологическим центром протокола лечения (ОЛЛ-2009, ОЛЛ-2016, GMALL, MB2008, Hyper-CVAD/HMA) (см. приложение А3.1 и А3.3) [55, 56, 62, 66, 98].
-
Пациентам с ОЛЛ в возрасте до 55 лет, получающим лечение по протоколу ОЛЛ 2009 (приложение А3.1), из группы очень высокого риска, которая устанавливается в дебюте заболевания (цитогенетические нарушения с перестройкой 11q23, t(4;11) или t(1;19), а также Ph+ ОЛЛ (t(9;22/BCR::ABL1) и ETP вариант Т-ОЛЛ, а также с врожденными синдромами ассоциированными с возниконовением опухолевых заболеваний – например, синдром Ниймеген), в связи высоким риском развития рецидива заболевания рекомендуется выполнение алло-ТГСК от совместимого родственного или неродственного донора [66, 99].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется рассматривать возможность выполнения алло-ТГСК у пациентов в возрасте старше 55 лет из группы очень высокого риска (см. раздел 3.2 «Прогностические факторы эффективности лечения») при наличии полностью HLA-совместимого донора и только при отсутствии значимой коморбидности, при которой риск трансплантационной летальности не превышал бы риски развития рецидива [55].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
-
Рекомендуется выполнение ТГСК при длительной (после окончания индукции/консолидации) персистенции МОБ, даже после применения таргетной терапии направленной на быструю редукцию МОБ, но для этого необходимо выполнять весь объем ХТ и мониторинг МОБ в предусмотренные временные точки согласно выбранному протоколу [55, 69, 70].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
Комментарий: выполнение ТГСК на фоне детектируемой МОБ имеет достоверно меньшую долгосрочную эффективность по сравнению с теми, кто получил ТГСК на фоне МОБ-негативного статуса.
-
Рекомендуется всем пациентам выполнение алло-ТГСК от родственного донора в первой ПР при неадекватном выполнении любого из протоколов программной терапии в связи с высоким риском рецидива [1, 2].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется рассматривать возможность выполнения алло-ТГСК у пациентов во второй и более поздних ремиссиях заболевания с целью улучшения долгосрочных результатов терапии [100].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: алло-ТГСК в развернутом рецидиве заболевания и при рефрактерности к ХТ воздействию нецелесообразна.
-
Рекомендуется выполнять трансплантацию от альтернативного донора (гаплоидентичного, трансплантация пуповинной крови в рамках КИ) при отсутствии HLA-идентичного донора [94, 100, 101].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Ауто-ТГСК
-
Рекомендуется выполнение ауто-ТГСК у пациентов с Ph+ ОЛЛ (в случае невозможностми выполнения алло-ТГСК) при отсутствии минимальной резидуальной болезни с проведением поддерживающей терапии ИТК после трансплантации [83].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
11. Сопроводительная терапия
Общие мероприятия
Протоколы лечения ОЛЛ предусматривают проведение интенсивной индукционной и консолидационной ХТ. При этом использование противоопухолевых препаратов и иммунодепрессантов наряду с основным заболеванием может приводить к закономерно развивающимуся широкому спектру тяжелых осложнений, в частности к инфекциям, кровотечениям, мукозиту, проявлению токсичности со стороны различных органов, рвоте и т.д, требующих коррекции непосредственно в процессе лечения ОЛЛ. По этой причине пациенты с ОЛЛ нуждаются в тщательном мониторинге, а также в проведении соответствующей профилактической и поддерживающей терапии.
Aнтиэметическая профилактика и терапия
-
Рекомендуется всем пациентам проводить антиэметическую терапию с целью полной профилактики тошноты и рвоты у пациентов, получающих ХТ [102].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: с антиэметической целью применяются антагонисты серотониновых рецепторов и глюкокортикоиды. Эти препараты рекомендуются для применения в комбинации при использовании режимов ХТ, характеризующихся умеренной и высокой эметогенностью. В отдельных ситуациях, в частности при проведении высокодозной комбинированной ХТ, выбор препарата должен определяться наиболее эметогенным компонентом (см. приложение А3.5) [102].
Трансфузионная терапия
Успешное лечение ОЛ, в частности ОЛЛ, невозможно при отсутствии заместительной терапии компонентами крови и сопроводительной терапии.
Трансфузии эритроцитной и тромбоцитарной массы
-
Рекомендуется осуществлять трансфузии эритроцитной массы пациентам для поддержания концентрации гемоглобина на уровне ≥80 г/л [103].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуются выполнение трансфузии тромбоконцентратов осуществлять при снижении количества тромбоцитов <10×109/л, при более высоких значениях количества тромбоцитов (20×109/л) в случае повышения температуры тела >38 °C, при развитии клинически значимых кровотечений либо перед выполнением инвазивных интервенционных вмешательств [104].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
-
Рекомендуется облучение эритроцитной массы и тромбоконцентратов с целью профилактики реакции «трансфузат против хозяина» [1, 2].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Профилактика геморрагических и тромботических осложнений
-
Рекомендуется пациентам на фоне терапии аспарагиназой** контролировать параметры свертывания крови с целью начала заместительной терапии при их дефиците (например, режим дозирования антитромбина III с профилактической целью: 50 МЕ/кг массы тела в течение 7-10 последовательных дней со дня начала терапии аспарагиназой** (подкожно, в дозе 6000 МЕ/м2, в течение 7 дней) [105].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарии: терапия глюкокортикоидами, антрациклинами и родственными соединениями, и особенно аспарагиназой** может приводить к тяжелому приобретенному дефициту белков класса серпинов (ингибиторов серинсодержащих протеаз), преимущественно антитромбинов и альфа-1-антитрипсина. Распространенность этих осложнений от 2,1–15%.
Aнтитромбин представляет собой основной физиологический ингибитор тромбина и факторов свертывания IXa, Xa, XIa. Он также является антагонистом фактора свертывания VII, ускоряя диссоциацию комплексов, образованных фактором VIla и тканевым фактором. Aнтитромбин образует необратимые связи с активными ферментами, лишая их протеолитической активности. Кроме того, при использовании аспарагиназы** сообщалось об изменении конформации молекулы антитромбина, что приводило к утрате стабильности и в результате к образованию агрегатов белка, накапливавшихся в цистернах эндоплазматического ретикулума. Таким образом, пациенты, которым вводят аспарагиназу**, характеризуются повышенным риском тромбозов. Хотя снижение концентрации антитромбина часто сопровождается гипофибриногенемией, было показано, что низкая концентрация фибриногена предрасполагает в большей степени к тромбозам, нежели к кровотечениям.
-
При массивных экстрамедуллярных очагах поражения (чаще всего орагнов средостения при ОЛЛ/ЛБЛ), тромботических осложнениях на фоне терапии или наличии тромбозов в анамнезе рекомендуется проводить антикоагулянтную терапию согласно существующим протоколам лечения венозных тромбоэмболических осложнений (см. соответствующие клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений, раздел 7.5) [1, 2, 4, 5, 106].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
-
Рекомендуется при развитии аллосенсибилизации проведение 4-10 сеансов лечебного плазмафереза для повышения эффективности трансфузий концентратов тромбоцитов [240].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Заместительная терапия иммуноглобулинами
-
Рекомендуется пациентам с ОЛЛ введение иммуноглобулинов при доказанной генерализованной вирусной инфекции (вирусами группы герпеса, цитомегаловирусом (далее – ЦМВ)), а также при снижении показателей нормальных иммуноглобулинов ниже нормальных значений [107].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: у пациентов с ОЛЛ часто определяется гипогаммаглобулинемия, но до настоящего времени не было получено доказательств эффективности профилактических инфузий иммуноглобулинов. Пациентам на фоне терапии блинатумомабом** или #ритуксимабом** необходимо контролировать содержание иммуноглобулинов 1 раз в 2-4 недели, в зависимости от клинической ситуации, и, при необходимости, выполнять заместительную терапию иммуноглобулинами [1, 2].
Иная сопроводительная терапия
Факторы роста
-
Не рекомендуется назначение пациентам колониестимулирующих факторов (Г-КСФ) ни на одном этапе лечения ОЛЛ. Исключение составляют ЛБ без поражения КМ, при которых возможно использовать Г-КСФ с целью сохранения сроков выполнения протокола [1, 2].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: в большинстве европейских национальных протоколах Г-КСФ используется с профилактической целью в процессе индукции и консолидации ремиссии. Применение Г-КСФ возможно у пациентов ОЛЛ при развитии жизнеугрожающих септических осложнений.
Диетическое лечебное питание
Диетическое лечебное питание пациентов с острым лимфобластным лейкозом при стационарном лечении в медицинских организациях назначается в соответствии с действующими приказами Министерства Здравоохранения Российской Федерации, с учетом соматического статуса и коморбидности пациента, а также с учетом ограничений в питании, связанных с наличием и степенью выраженности цитопении.
Подавление менструации, сохранение фертильности и терапия при аномальных маточных кровотечениях
-
У всех женщин с ОЛЛ в пременопаузе рекомендуется подавление менструаций с целью минимизации рисков кровотечения на фоне тромбоцитопении [108]
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
-
Рекомендуется женщинам с ОЛЛ/ЛБЛ при развитии аномальных маточных кровотечений при отсутсвии ответа на трансфузионную терапию проведение гормонального гемостаза, применение антифибринолитических средств и проведение хирургических методов купирования кровотечения при необходимости [112, 240]
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: В качестве антифибринолитического средства применяется транексамовая кислота** – 1000-1500 мг внутрь х 2-3 р/день или внутривенно 1000-1500 мг х 2-3 раза в сутки, курс лечения 5-7 дней. Гормональный гемостаз может проводиться гормональными контрацептивами системного действия (КОК) или препаратами группы гестагенов. Гормональный гемостаз КОК целесообразно проводить женщинам раннего и активного репродуктивного возраста, которые не относятся к группе риска относительно развития пролиферативных процессов эндометрия; пациенткам, у которых диагностическое выскабливание проводилось не более 3 месяцев назад и при этом не было выявлено патологических изменений эндометрия. При тяжелых меноррагиях целесообразно «выключение» менструации аналогами гонадотропин-рилизинг-гормона (ГнРГ) – #гозерелин** 3,6 мг п/к 1 раз в 28 дней [253], курс терапии до 6 месяцев. При длительном течении АМК также проводится утеротоническая терапия препаратом #окситоцин** в/в капельно по 10 МЕ [253] на 100 мл 0,9% физиологического раствора натрия хлорида** до прекращения кровотечения, данная терапия применяется при исключении органической патологии матки.
-
Рекомендуется женщинам с ОЛЛ/ЛБЛ при терапии аномальных маточных кровотечений с показаниями к лечению в раннем или позднем послеродовом периоде проводить терапию, направленную на подавление лактации [240]
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: В качестве терапии направленной на подавление лактации применяют каберголин** 0,5 мг 1 мг (2 таб.) однократно в первый день после родов, или для подавления установившейся лактации по 0,25 мг (1/2 таб.) 2 р/сут через каждые 12 ч в течение 2 дней (общая доза 1 мг).
-
Рекомендуется женщинам с ОЛЛ/ЛБЛ после развития аномальных маточных кровотечений в последующем проводить противорецидивную терапию гормональными контрацептивами системного действия в контрацептивном режиме или в непрерывном режиме (постоянно) [240]
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
-
Рекомендуется женщинам с ОЛЛ/ЛБЛ после развития аномальных маточных кровотечений при неэффективности или неприменимости в определенной клинической ситуации консервативных методов гемостаза применять хирургические методы остановки кровотечения [112, 113, 240].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: К хирургическим методам купирования аномальных маточных кровотечений относят: гистероскопию и раздельное диагностическое выскабливание стенок полости матки, резектоскопию при наличии внутриматочной патологии. Данная операция преследует как диагностическую (для исключения органической патологии полости матки), так и лечебную цель остановки аномального маточного кровотечения. Также при неэффективности и/или показаниям может выполняться гистерэктомия, эмболизация или склерозирование маточных сосудов — при их аномалиях или аблация эндометрия.
Обезболивающая терапия
-
При возникновении острого или хронического болевого синдрома пациенту рекомендуется проводить обезболивающую терапию согласно существующим протоколам обезболивания (см. соответствующие клинические рекомендации по хронической боли, клинические рекомендации по анестезиологии) [1, 2, 4, 5, 109].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: Следует учесть, что у пациента могут быть нестандартные проявления болезни, а также сочетание конкретной болезни с другими патологиями, что может диктовать лечащему врачу изменения в алгоритме выбора оптимальной тактики диагностики и лечения.
Гастропротективная терапия и профилактика
-
Рекомендуется с антисекреторной целью для лечения или профилактики язвенной болезни желудка и двенадцатиперстной кишки, в том числе на фоне терапии глюкокортикоидами, применять ингибиторы протонного насоса или блокаторы Н2-гистаминовых рецепторов [118, 119, 240] (см. раздел 7.7).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 1).
Применение антидотов при проведении химиотерапии
-
Рекомендуется при терапии метотрексатом** проводить гидратационную терапию, в / в введение кальция фолината** в дозе от 25 до 100 мг / м2 каждые 3 и 6 ч 2-7 дней после введения метотрексата** с целью профилактики отсроченных токсических осложнений [1, 2, 240]
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: Нефротоксичность метотрексата** зависит от дозы препарата и скорости элиминации. При введении в больших дозах (1 г / м2) в условиях кислой реакции мочи происходит преципитация кристаллов метаболитов внутри канальцев, и через 1-2 дня развивается кристаллиндуцированная неолигурическая и непротеинурическая почечная недостаточность. Препарат вызывает гипокалиемический ацидоз и гипокальциурию, а также токсическое поражение печени, миелодепрессию. Экстраренальные осложнения могут наблюдаться в течение в среднем 7 дней после введения метотрексата**. Факторами риска, вызывающими повышение метотрексат-опосредованной нефротоксичности, являются пожилой возраст, мужской пол, высокие дозы препарата, низкий уровень клиренса креатинина и параллельная терапия некоторыми антибактериальными препаратами системного действия, ингибиторами протонного насоса. С целью снижения риска нефротоксичности метотрексата** рекомендуется проводить гипергидратацию сбалансированными по электролитному составу и осмолярности растворами в дозе 40-60 мл / кг / сутки и подщелачивание мочи введением натрия гидрокарбоната** (реакция должна быть щелочной в день введения и в последующие 2-3 дня). Для этого в / в кап вводят смесь из 40 мл 4,2 % раствора натрия гидрокарбоната** (NaHCO3) и 400-800 мл изотонического раствора натрия хлорида** накануне, в день лечения и в последующие 2-3 дня. Лечение метотрексатом** в повышенных и высоких дозах (2-15 г / м2) сочетают с усиленной гидратацией (до 2 л жидкости в сутки). При выявлении ацидоза необходимо устранение дефицита оснований натрия гидрокарбонатом** из расчёта (ВЕ х масса тела) / 2 = Х мл 5 % раствора натрия гидрокарбоната** под контролем КЩС крови (ВЕ – отклонение концентрации буферных оснований от нормального уровня). При необходимости назначить «петлевые» диуретики. При назначение высоких доз метотрексата** (2-15 г / м2) необходимо в / в введение кальция фолината** в дозе от 25 до 100 мг / м2 каждые 3 и 6 ч после введения метотрексата**. При сохранении высокой концентрации метотрексата** в крови, вне зависимости от уровня азотемии показано проведение высокопоточного гемодиализа или гемо(диа)фильтрации с расчётом индивидуального клиренса, в зависимости от уровня сывороточного метотрексата**. При проведении вышеуказанной экстракорпоральной гемокоррекции уровень метотрексата** уменьшается в среднем на 75 % (в пределах от 42 до 94 %). Мониторировать необходимо уровень креатинина и концентрацию метотрексата** в крови в течение первых 24-48 ч после введения, что позволят своевременно организовать необходимые экстренные меры, включающие назначение кальция фолината**, и позволяющие значительно снизить системную токсичность и нефротоксичность.
-
Рекомендуется при терапии #ифосфамидом** или высокими дозами циклофосфамида** (более 1000 мг/м2) проводить гидратационную терапию, в / в введение месны** в дозе 20% от дозы противоопухолевого препарата во время введения препарата, через 4 и 8 часов после введения с целью профилактики отсроченных токсических осложнений [1, 2]
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: Метаболит #ифосфамида** акролеин оказывает повреждающее действие на эпителий мочевыводящих путей и вызывает развитие геморрагического цистита. Токсической кумулятивной дозой #ифосфамида** является 60-72 г / м2 за период лечения. Риск нефротоксичности #ифосфамида** значительно возрастает с возрастом и при наличии сопутствующего заболевания почек. При комбинации #ифосфамида** с #аллопуринолом** [23] повышается концентрация мочевой кислоты в крови, что увеличивает риск нефропатии и усиливает миелотоксическое действие препарата. Для предотвращения нефротоксичности препарата и развития геморрагического цистита необходимо введение физиологического раствора натрия хлорида** из расчёта 25-30 мл / кг / сутки до введения #ифосфамида**, в период введения #ифосфамида** необходимо назначение месны**, являющейся антидотом акролеина и метаболитов оксазафосфоринов (циклофосфамида** и #ифосфамида**). Разовая доза месны** для взрослых составляет 20 % от дозы противоопухолевого препарата, первое введение проводят одновременно с первым введением #ифосфамида**, второе и третье – через 4 и 8 часов после первого введения. При непрерывной инфузии (24 ч) #ифосфамида** или циклофосфамида** месну** следует вводить в дозе 20 % от дозы противоопухолевого препарата в начале инфузии, затем – в дозе 100 % от дозы противоопухолевого препарата в виде 24‑часовой инфузии; по окончании введения противоопухолевого препарата введение месны** продолжают ещё 6-12 часов в той же дозе. При появлении симптомов токсического поражения почек следует прекратить введение препарата.
Противомикробная терапия и профилактика
-
Рекомендуется пациентам ОЛЛ при возниконовении инфекционных осложнений проводить терапию согласно методическим рекомендациям по профилактике, диагностике и терапии инфекционных осложнений у пациентов с гематологическими заболеваниями [240] (см. раздел 7.9 Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния. Диагностика и лечение инфекционных осложнений при остром лимфобластном лейкозе)
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
-
Не рекомендуется проводить профилактику бактериальных инфекций больным ОЛЛ [118, 119, 240] (см. раздел 7.9 Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния. Диагностика и лечение инфекционных осложнений при остром лимфобластном лейкозе).
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: Профилактика бактериальных инфекций реципиентам алло-ГСК допустима только после предварительного исследования у них колонизации слизистой оболочки кишечника микроорганизмами. Профилактика бактериальных инфекций у других категорий больных исключена по причине неэффективности из-за высокой частоты детекции полирезистентных бактерий.
-
Рекомендуется проводить профилактику #ко-тримаксазолом [Сульфаметоксазол+Триметоприм]** по 480 мг ежедневно пневмоцистной пневмонии больным ОЛЛ с 14-го дня полихимиотерапии и проводят весь период лечения, включая этап поддерживающей терапиибактериальных инфекций больным ОЛЛ [1, 2, 240] (см. раздел 7.9 Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния. Диагностика и лечение инфекционных осложнений при остром лимфобластном лейкозе).
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
-
Рекомендуется проводить вторичную противогрибковую профилактику больным ОЛЛ, у которых в анамнезе был инвазивный микоз, вызванный плесневыми грибами (аспергиллез, мукормикоз и другие), а также диссеминированный инвазивный кандидоз (инвазия в органы) [1, 2, 240] (см. раздел Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния. Диагностика и лечение инфекционных осложнений при остром лимфобластном лейкозе).
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: Профилактика грибковых инфекций больным ОЛЛ проводится в зависимости от вида грибкового осложнения: при кандидемии – флуконазол** 400 мг в/в или внутрь в сутки, или #каспофунгин** 50 мг в/в в сутки, или #микафунгин** 100 мг в/в в сутки, или #анидулафунгин** 100 мг в/в в сутки [240]; инвазивный аспергиллез - вориконазол** по 200 мг в/в или внутрь в 2 раза сутки, или позаконазол** по 200 мг 3 раза в сутки или по 300 мг 2 раза в сутки внутрь, изавуконазол по 200 мг 3 раза в сутки в 1-2 дни и далее по 200 мг 1 раз в сутки; мукормикоз – позаконазол** по 200 мг 3 раза в сутки или по 300 мг 2 раза в сутки внутрь, изавуконазол по 200 мг 3 раза в сутки в 1-2 дни и далее по 200 мг 1 раз в сутки
-
Рекомендуется проводить вторичную противовирусную профилактику больным ОЛЛ, которым проводится иммуносупрессивная терапия, #ацикловиром** 200 мг 3 раза в сутки или валацикловир по 500 мг 2 раза в сутки [1, 2, 240] (см. раздел 7.9 Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния. Диагностика и лечение инфекционных осложнений при остром лимфобластном лейкозе).
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
-
Рекомендуется проводить эмпирическую антибактериальную терапию 1-й линии при фебрильной нейтропении у больных ОЛЛ внутривенными антибиотиками с активностью против грамотрицательных бактерий, включая синегнойную палочку – #пиперациллин+[Тазобактам]** 4,5 г 3 раза в сутки в/в или #цефепим+[Сульбактам]** 4 г 2 раза в сутки в/в [1, 2, 240] (см. раздел 7.9 Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния. Диагностика и лечение инфекционных осложнений при остром лимфобластном лейкозе).
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарий: Цефепим** 2 г 2 раза в сутки в/в остается препаратом выбора только для беременных с ОЛЛ и фебрильной нейтропенией.
-
Рекомендуется при неэффективности и отсутсвии клинически значимых микробиологических исследований проводить антибактериальную терапию заменой антибактериальных препаратов системного действияв 1-й линии на антипсевдомонадные карбапенемы (Имипенем+[Циластатин]**, меропенем**) [1, 2, 240] (см. раздел 7.9 Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния. Диагностика и лечение инфекционных осложнений при остром лимфобластном лейкозе).
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарий: Показаниями к назначению антипсевдомонадных карбапенемов (Имипенем+[Циластатин]**, меропенем**) в 1-й линии фебрильной нейтропении при ОЛЛ являются септический шок, пневмония с дыхательной недостаточностью.
-
Рекомендуется эмпирическое назначение противогрибковых препаратов системного действия на 4-7 дни фебрильной нейтропении в группе высокого риска возникновения инвазивных микозов при условии отсутсвия у них других клинических симптомов и лабораторных, инструментальных данных за иную инфекцию [1,2, 240] (см. раздел 7.9 Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния. Диагностика и лечение инфекционных осложнений при остром лимфобластном лейкозе).
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарий: Препарат выбора – каспофунгин** 70 мг в/в 1-й день, далее по 50 мг/сут, или #микафунгин** 100 мг в/в в сутки, или #анидулафунгин** 200 мг в1-й день, далее по 100 мг в сутки в/в; альтернативные – #вориконазол** 6 мг/кг внутривенно 2 раза в сутки в 1-й день, далее по 4 мг/кг 2 раза в сутки, #амфотерицин В** 0,8-1 мг/кг в/в в сутки [240].
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
1. Полноценное соблюдение протоколов лечения (режима терапии) острого лимфобластного лейкоза/лимфомы
Способность завершить полный курс индукционно-консолидационной терапии в течение указанного периода времени, а затем выполнять поддерживающую терапию в полном объеме является четким прогностическим фактором, неоднократно продемонстрировавшим свою значимость в российских исследованиях. С этой концепцией согласны и зарубежные исследователи. Адекватное ХТ воздействие остается фундаментом успешного лечения. К сожалению, неадекватность выполнения протоколов лечения до сих является одной из основных причин значительно меньшей эффективности лечения пациентов с острыми лейкозами во многих гематологических центрах.
2. Профилактика, диагностика и лечение геморрагических осложнений у пациентов с острым лимфобластным лейкозом/лимфомой
Геморрагические проявления у пациентов с ОЛЛ/ЛБЛ отличаются многообразием и могут быть обусловлены как самим заболеванием, так и его осложнениями, в том числе вследствие проведения специфической терапии, а также появиться в результате проводимой антитромботической терапии. Профилактика, диагностика и лечение геморрагичсеких осложнений у пациентов с ОЛЛ/ЛБЛ проводится в соответсвии с действующими методическими рекомендациями [103, 104, 240].
3. Профилактика и лечение меноррагий у пациенток с острым лимфобластным лейкозом
Аномальные маточные кровотечения (АМК) – распространенная патология у женщин с острыми лимфобластными лейкозами, которая включает нарушения менструального цикла, связанные с частотой, регулярностью, продолжительностью и объемом теряемой крови у пациенток. Частота встречаемости АМК в общей популяции женщин варьирует от 14 до 30%, частота у пациенток с острыми лимфобластными лейкозами неизвестна. Профилактика, диагностика и лечение меноррагий у пациенток с ОЛЛ/ЛБЛ проводится в соответсвии с действующими методическими рекомендациями [112, 113, 240].
4. Внутричерепные кровоизлияния у пациентов с острыми лимфобластными лейкозами.
Внутричерепные кровоизлияния (ВЧК) – это нередкое (ожидаемое) осложнение основного заболевания и/или специфического (в том числе, химиотерапевтического) лечения у пациентов с острыми лимфобластными лейкозами, часто сопряженное с патологией плазменного и/или тромбоцитарного гемостаза [114]. Без оказания неотложной нейрохирургической помощи массивные ВЧК у больных ОЛЛ закономерно приводят к фатальному исходу.
Диагностика и лечение ВЧК, возникающих у пацентов с острыми лимфобластными лейкозами, осуществляется непосредственно в период проведения противоопухолевого химиотерапевтического лечения острого лейкоза. Профилактика, диагностика и лечение внутричерепных кровоизлияний у пациентов с ОЛЛ/ЛБЛ проводится в соответсвии с действующими методическими рекомендациями [114, 240].
5. Профилактика, диагностика и лечение тромботических осложнений
При ОЛЛ, как первично, так и в процессе химиотерапевтического и иного лечения часто возникают тромботические осложнения, требующие профилактики и терапии. Частота тромботических нарушений при опухолях системы крови различна, проведение химиотерапии увеличивает частоту тромботических осложнений практически в 2 раза с 2.21% до 4.24% относительно исходного уровня [109, 110]. Профилактика, диагностика и лечение тромботических осложнений у пациентов с ОЛЛ/ЛБЛ проводится в соответсвии с действующими методическими рекомендациями [109, 110, 111, 240].
Диагностика и лечение тромботических осложнений, закономерно возникающих у пацентов с ОЛЛ, осуществляется непосредственно в период проведения противоопухолевого химиотерапевтического лечения [240].
Для оценки риска развития тромботических нарушений и их рецидивов при ОЛЛ необходим тщательный сбор анамнеза с уточнением наличия тромбозов у пациента и родственников первой линии, а также оценка общего состояния пациента и выявление сопутствующих заболеваний.
Лабораторную оценку состояния системы свертывания крови осуществляют при первичном обследовании больного, до начала проведения специфической терапии, в том числе перед каждым курсом ХТ (по показаниям), а также в случае развития тромботических нарушений на любом этапе диагностики, наблюдения, лечения.
6. Диагностика и лечение неврологических проявлений при остром лимфобластном лейкозе
Вовлечение центральной нервной системы (ЦНС) и периферической нервной системы может выявляться при ОЛЛ. Неврологические проявления могут быть как проявлением специфического поражения нервной системы (опухолевое поражение ЦНС), так и проявлением осложнений ОЛЛ и его лечения (геморрагические, тромботические, токсические поражения нервной системы). Для диагностики и лечения неврологических проявлений и осложнений ОЛЛ применяется комплекс неврологических исследований и терапия сообразно виду нарушения, с учетом характера основного заболевания [240]. Специфическое опухолевое поражение ЦНС с вовлечением головного мозга, спинного мозга и оболочек может быть проявлением острого лимфобластного лейкоза. Чаще всего опухолевое поражение ЦНС локализуется в лобной доле – 50%, реже отмечается в мозолистом теле и глубинных структурах мозга (40%) мультифокальное поражение (35%), лептоменингеальное поражение (16%), изолированное поражение спинного мозга (1%). Кроме того, специфическое поражение ЦНС может развиваться по типу лейкемической инфильтрации оболочек мозга и поражения спиномозговой жидкости (нейролейкемия).
Профилактика, диагностика и лечение неврологических проявлений у пациентов с ОЛЛ/ЛБЛ проводится в соответсвии с действующими методическими рекомендациями [240].
7. Профилактика язвенной болезни желудка и 12-перстной кишки на фоне терапии глюкокортикоидами при ОЛЛ
В абсолютное большинство протоколов противоопухолевого лечения ОЛЛ включены высокие дозы глюкокортикоидов (ГКС). Язва желудка или двенадцатиперстной кишки является одним из серьёзных побочных эффектов терапии ГКС. Механизм ульцерогенного действия ГКС заключается в повышении секреции соляной кислоты в желудке, изменении качественного состава слизи, торможении регенерации поверхностного эпителия. При сочетанном применении ГКС с нестероидными противовоспалительными и противоревматическими средствами и антитромботичнескими средствами риск развития стероидных язв возрастает. В связи с ульцерогенностью, при использовании ГКС необходимо проводить антисекреторную терапию с целью профилактики стероидных язв [115, 116, 118, 119, 240]. Профилактика язвенной болезни желудка и 12-перстной кишки у пациентов с ОЛЛ/ЛБЛ проводится в соответсвии с действующими методическими рекомендациями [115, 116, 240].
8. Профилактика, диагностика и лечение асептических остеонекрозов у пациентов с острыми лимфобластными лейкозами.
Асептический остеонекроз (АОН) у пациентов с острыми лимфобластными лейкозами относится к группе вторичных остеонекрозов. Его развитие связано с нарушением кровоснабжения и гибелью костных клеток в определенном участке костной ткани на фоне химиотерапии или воздействия глюкокортикоидов. Наиболее часто к развитию АОН приводит терапия острого лимфобластного лейкоза (глюкокортикоиды и другие препараты) и трансплантация аллогенного костного мозга.
АОН у больных острыми лейкозами преимущественно локализуется в длинных трубчатых костях. По расположению в трубчатой кости очаги могут выявляться как вне связи с эпифизами, это медуллярные остеонекрозы, так и поражать эпифизы, суставные отделы трубчатых костей. В этих случаях остеонекроз определяют, как – асептический некроз, и далее, название эпифиза, например, асептический некроз головки бедренной кости. Как синоним, часто используется определение – аваскулярный некроз (АВН) головки бедренной кости или других локализаций остеонекрозов эпифизов длинных костей, хотя, словосочетание «асептический некроз» более точно отражает патологический процесс (аваскулярный некроз кости часто сопровождает инфекционные заболевания костей и суставов, что не относится к рассматриваемой проблеме). Профилактика, диагностика и лечение асептических некрозов у пациентов с ОЛЛ/ЛБЛ проводится в соответствии с действующими методическими рекомендациями [240].
9. Диагностика и лечение инфекционных осложнений при остром лимфобластном лейкозе
Инфекции являются ведущими осложнениями при лечении заболеваний системы крови. Наиболее высокая частота определяется у пациентов с острыми лейкозами и у реципиентов аллогенного трансплантата стволовых гемопоэтических клеток (ТГСК), варьирует от 30 до 90%. Так, у пациентов с острыми лимфоидными лейкозами инфекции развиваются преимущественно на этапе индукции ремиссии (55%), реже – в период консолидации ремиссии (10%), у реципиентов аллогенных ТГСК – в период гранулоцитопении на этапе приживления гемопоэтических клеток (40-70%) и при развитии реакции “трансплантат против хозяина” (10-70%) [49, 122]. Частота инфекционных осложнений выше в период индукции ремиссии, при резистентном варианте опухоли, при высокодозной химиотерапии, при сопуствующей гипогаммаглобулинемии, в период вынужденной гиподинамии и постоянного постельного режима.
Основным фактором, определяющим развитие инфекционных осложнений у пациентов с ОЛЛ, является нейтропения (нейтрофилы <0,5х109/л) или лейкопения (лейкоциты ≤1 000х109/л), а также длительность нейтропении – частота инфекций существенно возрастает при длительности нейтропении более 10 дней. Риск развития инфекций возрастает при нарушении фагоцитарной функции нейтрофилов, при дефектах клеточного и гуморального иммунитета, повреждении слизистых оболочек желудочно-кишечного тракта (особенно мукозитах III-IV степени), наличии центрального венозного катетера (ЦВК). Источником развития инфекции, как правило, является желудочно-кишечный тракт, когда активно происходит транслокация микроорганизмов со слизистой оболочки, поврежденной в результате химиотерапии. Другие основные входные ворота инфекции при нейтропении – ЦВК. Диагностика и лечение инфекционных осложнений, закономерно возникающих у пацентов с ОЛЛ, осуществляется непосредственно в период проведения противоопухолевого химиотерапевтического лечения [240]. Профилактика, диагностик и лечение инфекционных осложнений у пациентов с ОЛЛ/ЛБЛ проводится в соответсвии с действующими методическими рекомендациями [122-124, 240].
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Специальных методов реабилитации при ОЛЛ/ЛБЛ не существует.
-
Рекомендуется пациентам проведение реабилитации при возникновении осложнений после завершения программы терапии ОЛЛ/ЛБЛ в рамках соответствующих нозологий [110, 111].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: после окончания лечения рекомендуется вести здоровый образ жизни, исключить инсоляцию и физиотерапевтические процедуры.
Госпитализация
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с федеральным законом от 21.11.2011 № 323-ФЗ (ред. от 25.05.2019) «Об основах охраны здоровья граждан в Российской Федерации» организуется и оказывается:
– в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным федеральным органом исполнительной власти;
– в соответствии с порядком оказания помощи по профилю «гематология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
– на основе настоящих клинических рекомендаций;
– с учетом стандартов медицинской помощи, утвержденных уполномоченным федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-гематологом и иными врачами-специалистами в центре амбулаторной гематологической/онкологической помощи либо в первичном гематологическом/онкологическом кабинете, первичном гематологическом отделении, поликлиническом отделении онкологического диспансера.
При выявлении у больного острого лимфобластного лейкоза (далее – ОЛЛ) или подозрении на него врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют больного на консультацию в центр амбулаторной гематологической/онкологической помощи либо в первичный гематологический кабинет, первичное гематологическое отделение медицинской организации для оказания ему первичной специализированной медико-санитарной помощи.
Врач-гематолог амбулаторного или стационарного звена гематологической помощи организует выполнение диагностических исследований, необходимых для установления диагноза, включая распространенность и стадию заболевания.
В случае невозможности проведения диагностических исследований пациент направляется лечащим врачом в медицинскую организацию, оказывающую медицинскую помощь больным с гематологическими заболеваниями для установления диагноза и оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При выявлении ОЛЛ или подозрении на него в ходе оказания скорой медицинской помощи больного переводят или направляют в медицинские организации, оказывающие медицинскую помощь больным с гематологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Специализированная, в том числе высокотехнологичная, медицинская помощь оказывается врачами-гематологами в медицинских организациях, оказывающих медицинскую помощь больным ОЛЛ, имеющих лицензию, необходимую материально-техническую базу, сертифицированных специалистов, в стационарных условиях и условиях дневного стационара и включает в себя профилактику, диагностику, лечение гематологических заболеваний, требующих использования специальных методов и сложных уникальных медицинских технологий, а также медицинскую реабилитацию.
В медицинской организации, оказывающей медицинскую помощь больным ОЛЛ, тактика медицинского обследования и лечения устанавливается врачами-гематологами с привлечением при необходимости других врачей-специалистов, при необходимости с проведением консилиума. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию больного.
Показания к госпитализации в круглосуточный или дневной стационар медицинской организации, оказывающей специализированную, в том числе высокотехнологичную, медицинскую помощь по профилю «гематология» определяются врачом-гематологом/консилиумом врачей с привлечением при необходимости других врачей-специалистов.
Показания для плановой госпитализации:
-
Подозрение/установление диагноза ОЛЛ.
-
Диагностика рецидива ОЛЛ.
-
Проведение очередного курса ХТ в условиях круглосуточного либо дневного стационара.
-
Проведение запланированной ТГСК.
-
Выполнение плановых хирургических вмешательств.
-
Выполнение плановых экстракорпоральных методов очищения крови и заместительной почечной терапии.
-
Проведение заместительной гемокомпонентной терапии.
Показания для экстренной госпитализации:
Неотложные состояния у пациентов с ОЛЛ и при подозрении на ОЛ:
– лейкоцитоз более 100×109/л
– фебрильная лихорадка и инфекционные осложнения на фоне нейтропении после курса ХТ;
– геморрагический синдром;
– тромботические осложнения;
– необходимость проведения экстренной заместительной гемокомпонентной терапии;
– другие системные нарушения, обусловленные течением основного заболевания или развившиеся вследствие проведенного лечения.
Показания к выписке пациента из стационара:
-
Восстановление показателей периферической крови (лейкоциты более 1×109/л, гранулоциты более 0,5×109/л, тромбоциты более 50×109/л, гемоглобин более 80 г/л) после очередного курса ХТ.
-
Нормотермия в течение 3-5 сут и отсутствие неконтролируемых инфекционных осложнений в послекурсовом периоде.
-
Купирование геморрагических осложнений.
-
Купирование тромботических осложнений.
-
Купирование системных нарушений, обусловленных течением основного заболевания или развившихся вследствие проведенного лечения.
Заключение о целесообразности перевода больного в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра больного врачами – специалистами медицинской организации, в которую планируется перевод.
Перед началом проведения терапии рекомендуется информировать всех пациентов о риске бесплодия после проведения терапии и потенциальных методах сохранения фертильности, а также о необходимости использования эффективных методов контрацепции в течение минимум одного года после завершения терапии.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Профилактики возникновения ОЛЛ не существует.
-
Рекомендуется после окончания программы терапии ОЛЛ выполнять исследование ОАК каждый месяц в течение первых 2 лет и затем 1 раз в 2-3 месяца до 5 лет от начала лечения с целью раннего выявления рецидива заболевания [1, 2, 4, 5].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
-
Рекомендуется после окончания программы терапии ОЛЛ в течение первого года выполнять получение цитологического препарата КМ путем пункции (стернальную пункцию) 1 раз в 3 мес, далее – 1 раз в 6 мес в течение 2-го года, далее – 1 раз в год до 5 лет наблюдения с целью динамического наблюдения [1, 2, 4, 5].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
Комментарии: внеплановое исследование КМ показано при выявлении любых изменений гемограммы. Большинство рецидивов происходят в течение 1-5 лет после окончания терапии.
Информация
Источники и литература
-
Клинические рекомендации Национального гематологического общества
- 1. Алгоритмы диагностики и протоколы лечения заболеваний системы крови. Под ред. В.Г. Савченко. М.: Практика; 2018: 887–959. 2. Савченко В.Г., Паровичникова Е.Н. Острые лейкозы // Клиническая онкогематология: руководство для врачей. Под ред. Волковой М.А.. 2-е изд., перераб. и доп. 2007. P. 409–502. 3. Swerdlow S.H. et al. WHO classification of tumours of haematopoietic and lymphoid tissues. Revised 4th ed. Lyon, France: International Agency for Research in Cancer (IARC) / ed. Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pileri SA, Stein H T.J. 2017. 585 p. 4. Brown P.A. et al. NCCN Clinical Practice Guidelines in Oncology. Acute Lymphoblastic Leukemia. Version 2.2019. 2019. 115 p. 5. Gökbuget N. et al. Recommendations of the European Working Group for Adult ALL (EWALL) // UNI-MED Verlag AG. 2011. 204 p. 6. Румянцев А.Г. Эволюция лечения острого лимфобластного лейкоза у детей: эмпирические, биологические и организационные аспекты // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2015. Vol. 14, № 1. P. 5–15. 7. Масчан М.А., Мякова Н.В. Острый лимфобластный лейкоз у детей // Вместе против рака. 2006. Vol. 1–2. P. 50–63. 8. Ахмерзаева З.Х. et al. Эпидемиологическое исследование острых лейкозов в отдельных регионах Российской Федерации // Гематология и трансфузиология. 2014. Vol. 59, № S1. P. 13–14. 9. Burmeister T. et al. Patients’ age and BCR-ABL frequency in adult B-precursor ALL: A retrospective analysis from the GMALL study group // Blood. 2008. Vol. 112, № 3. P. 918– 919. 10. Rowe J.M. Prognostic factors in adult acute lymphoblastic leukaemia. // Br. J. Haematol. 2010. Vol. 150, № 4. P. 389–405. 11. Hoelzer D. et al. Prognostic factors in a multicenter study for treatment of acute lymphoblastic leukemia in adults. // Blood. 1988. Vol. 71, № 1. P. 123–131. 12. Lazarus H.M. et al. Central nervous system involvement in adult acute lymphoblastic leukemia at diagnosis: results from the international ALL trial MRC UKALL XII/ECOG E2993. // Blood. 2006. Vol. 108, № 2. P. 465–472. 13. Bassan R., Maino E., Cortelazzo S. Lymphoblastic lymphoma: an updated review on biology, diagnosis, and treatment. // Eur. J. Haematol. 2016. Vol. 96, № 5. P. 447–460. 14. Cortelazzo S. et al. Lymphoblastic lymphoma. // Crit. Rev. Oncol. Hematol. 2017. Vol. 113. P. 304–317. 15. Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group // Am. J. Clin. Oncol. 1982. Vol. 5, № 6. P. 649–655. 16. Roila F. et al. Intra and interobserver variability in cancer patients’ performance status assessed according to Karnofsky and ECOG scales // Ann. Oncol. Oxford University Press (OUP), 1991. Vol. 2, № 6. P. 437–439. 17. Kornberg A., Polliack A. Serum lactic dehydrogenase (LDH) levels in acute leukemia: marked elevations in lymphoblastic leukemia // Blood. 1980. Vol. 56, № 3. 18. Olgar S. et al. Electrolyte abnormalities at diagnosis of acute lymphocytic leukemia may be a clue for renal damage in long-term period. // J. Pediatr. Hematol. Oncol. 2005. Vol. 27, № 4. P. 202–206. 19. Ku G.H. et al. Venous thromboembolism in patients with acute leukemia: Incidence, risk factors, and effect on survival // Blood. 2009. Vol. 113, № 17. P. 3911–3917. 20. Nur S. et al. Disseminated intravascular coagulation in acute leukaemias at first diagnosis. // Eur. J. Haematol. 1995. Vol. 55, № 2. P. 78–82. 21. Törnebohm E. et al. Bleeding complications and coagulopathy in acute leukaemia. // Leuk. Res. 1992. Vol. 16, № 10. P. 1041–1048. 22. Галстян Г.М. et al. Тромбогеморрагические осложнения при лечении больных острым лимфобластным лейкозом L-аспарагиназой. // Клиническая онкогематология. 2018. Vol. 11, № 1. P. 89–99. 23. Coiffier B. et al. Guidelines for the management of pediatric and adult tumor lysis syndrome: An evidence-based review // Journal of Clinical Oncology. 2008. Vol. 26, № 16. P. 2767–2778. 24. Ratner L. et al. Adverse prognostic influence of hepatitis B virus infection in acute lymphoblastic leukemia. // Cancer. 1986. Vol. 58, № 5. P. 1096–1100. 25. Bianco E. et al. Prevalence of hepatitis C virus infection in lymphoproliferative diseases other than B-cell non-Hodgkin’s lymphoma, and in myeloproliferative diseases: an Italian Multi-Center case-control study. // Haematologica. 2004. Vol. 89, № 1. P. 70–76. 26. Zhu R., et al. Intestinal colonization with carbapenem-resistant enterobacteriaceae in acute leukemia patients: risk factors and molecular characteristics. Infect Drug Resist. 2022; 15: 4275-4283. 27. Приказ Министерства здравоохранения РФ от 20 октября 2020 г. N 1134н "Об утверждении порядка медицинского обследования реципиента, проведения проб на индивидуальную совместимость, включая биологическую пробу, при трансфузии донорской крови и (или) ее компонентов" 28. Thomas X. et al. Bone marrow biopsy in adult acute lymphoblastic leukemia: morphological characteristics and contribution to the study of prognostic factors. // Leuk. Res. 2002. Vol. 26, № 10. P. 909–918. 29. Kröber S.M. et al. Acute lymphoblastic leukaemia: Correlation between morphological/immunohistochemical and molecular biological findings in bone marrow biopsy specimens // J. Clin. Pathol. - Mol. Pathol. 2000. Vol. 53, № 2. P. 83–87. 30. Olsen R.J. et al. Acute leukemia immunohistochemistry: a systematic diagnostic approach. // Arch. Pathol. Lab. Med. 2008. Vol. 132, № 3. P. 462–475. 31. Bene M.C. et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL). // Leukemia. 1995. Vol. 9, № 10. P. 1783–1786. 32. McKenna R.W. et al. Immunophenotypic analysis of hematogones (B-lymphocyte precursors) in 662 consecutive bone marrow specimens by 4-color flow cytometry. // Blood. 2001. Vol. 98, № 8. P. 2498–2507. 33. Moorman A. V et al. Karyotype is an independent prognostic factor in adult acute lymphoblastic leukemia (ALL): analysis of cytogenetic data from patients treated on the Medical Research Council (MRC) UKALLXII/Eastern Cooperative Oncology Group (ECOG) 2993 trial. // Blood. 2007. Vol. 109, № 8. P. 3189–3197. 34. Moorman A. V et al. A population-based cytogenetic study of adults with acute lymphoblastic leukemia. // Blood. 2010. Vol. 115, № 2. P. 206–214. 35. Yilmaz M. et al. Philadelphia Chromosome-Positive Acute Lymphoblastic Leukemia in Adults: Current Treatments and Future Perspectives // Clinical Advances in Hematology & Oncology. 2018. Vol. 16. 36. Angi M. et al. The t(8;14)(q24.1;q32) and its variant translocations: A study of 34 cases // Hematol. Oncol. Stem Cell Ther. King Faisal Specialist Hospital and Research Centre, 2017. Vol. 10, № 3. P. 126–134. 37. Cimino G. et al. The therapeutic response and clinical outcome of adults with ALL1(MLL)/AF4 fusion positive acute lymphoblastic leukemia according to the GIMEMA experience // Haematologica. 2010. Vol. 95, № 5. P. 837–840. 38. Gazzola A. et al. The evolution of clonality testing in the diagnosis and monitoring of hematological malignancies // Therapeutic Advances in Hematology. 2014. Vol. 5, № 2. P. 35–47. 39. Thomas X., Le Q.-H. Central nervous system involvement in adult acute lymphoblastic leukemia. // Hematology. 2008. Vol. 13, № 5. P. 293–302. 40. Aguirre-Guillén W.A. et al. Omics techniques and biobanks to find new biomarkers for the early detection of acute lymphoblastic leukemia in middle-income countries: a perspective from Mexico // Boletin Medico del Hospital Infantil de Mexico. Masson-Doyma Mexico, S.A., 2017. Vol. 74, № 3. P. 227–232. 41. Herrmann J. et al. Evaluation and management of patients with heart disease and cancer: Cardio-oncology // Mayo Clin. Proc. 2014. Vol. 89, № 9. P. 1287–1306. 42. Roberts A.S. et al. Extramedullary haematopoiesis: radiological imaging features // Clinical Radiology. 2016. Vol. 71, № 9. P. 807–814. 43. Soylu A.R. et al. Overt gastrointestinal bleeding in haematologic neoplasms // Dig. Liver Dis. 2005. Vol. 37, № 12. P. 917–922. 44. Hummel M. et al. Diagnostic yield of bronchoscopy with bronchoalveolar lavage in febrile patients with hematologic malignancies and pulmonary infiltrates. // Ann. Hematol. 2008. Vol. 87, № 4. P. 291–297. 45. Sengar M. et al. Whole Body PET-CT In Management Of Lymphoblastic Lymphomas In Adults: Does It Have a Prognostic Impact? // Blood. American Society of Hematology, 2013. Vol. 122, № 21. P. 4314–4314. 46. Khaled S.K., Thomas S.H., Forman S.J. Allogeneic hematopoietic cell transplantation for acute lymphoblastic leukemia in adults // Current Opinion in Oncology. 2012. Vol. 24, № 2. P. 182–190. 47. Ribera J.M. Allogeneic stem cell transplantation for adult acute lymphoblastic leukemia: When and how // Haematologica. 2011. Vol. 96, № 8. P. 1083–1086. 48. Woitek R. et al. Radiological staging in pregnant patients with cancer // ESMO Open. 2016. Vol. 1, № 1. P. e000017. 49. Охмат В.А. et al. Инфекционные осложнения у взрослых больных острыми лимфобластными лейкозами на разных этапах химиотерапии по протоколу ОЛЛ- 2009. // Онкогематология. 2017. Vol. 12, № 3. P. 31–40. 50. Biswal S., Godnaik C. Incidence and management of infections in patients with acute leukemia following chemotherapy in general wards // Ecancermedicalscience. ecancer Global Foundation, 2013. Vol. 7, № 1.
Информация
Список сокращений
Алло-ТГСК – трансплантация аллогенных гемопоэтических стволовых клеток
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
Ауто-ТГСК – трансплантация аутологичных гемопоэтических стволовых клеток
АЧТВ – активированное частичное тромбопластиновое время
БРВ – безрецидивная выживаемость
ВОЗ классификация – классификация Всемирной организации здравоохранения
Г-КСФ – гранулоцитарный колониестимулирующий фактор (L03AA Колониестимулирующие факторы)
ГСК – гемопоэтические стволовые клетки
ИТ – индукционная терапия
ИТК – тирозинкиназный ингибитор (ингибиторы тирозинкиназы Брутона (BTK), Ингибиторы тирозинкиназы BCR-ABL, Ингибиторы протеинкиназы),
КИ – клинические исследования
КМ – костный мозг
КТ – компьютерная томография
ЛБ – лимфома Беркитта
ЛБЛ – лимфобластная лимфома
ЛДГ – лактатдегидрогеназа
МОБ – минимальная остаточная болезнь
НХЛ – неходжкинские лимфомы
ОАК – общий (клинический) анализ крови
ОВ – общая выживаемость
ОЛ – острый лейкоз
ОЛЛ – острый лимфобластный лейкоз
ОМЛ – острый миелоидный лейкоз
ОРДС – острый респираторный дистресс-синдром
ОТ-ПЦР – полимеразная цепная реакция с обратной транскрипцией
ПР – полная ремиссия
ПЦР – полимеразная цепная реакция
ПЭТ/КТ – позитронно-эмиссионная компьютерная томография
ТГСК – трансплантация гемопоэтических стволовых клеток
УДД – уровень достоверности доказательств
УЗИ – ультразвуковое исследование
УУР – уровень убедительности рекомендаций
ХТ – химиотерапия
ХМЛ – хронический миелолейкоз
ЦМВ – цитомегаловирус
ЦНС – центральная нервная система
ЭКГ – электрокардиография
ЭхоКГ – эхокардиография
CD – кластер дифференцировки
ECOG (Eastern Cooperative Oncology Group status) – шкала оценки состояния пациента по критериям Восточной кооперативной онкологической группы
EWALL – Европейская исследовательская группа по изучению острого лимфобластного лейкоза
FISH-исследование – исследование методом флуоресцентной гибридизации in situ
GMALL – Немецкая исследовательская группа по изучению острого лимфобластного лейкоза
GRAALL – Французская исследовательская группа по изучению острого лимфобластного лейкоза
MD Anderson CRC – Американская исследовательская группа онкологического научного центра имени М.Д. Андерсона
Ph+ ОЛЛ или Ph-позитивный ОЛЛ – острый лимфобластный лейкоз, при котором определеяется транслокация t(9;22)
Ph– ОЛЛ или Ph-негативный ОЛЛ – острый лимфобластный лейкоз, при котором не обнаруживается транслокация t(9;22)
RALL – Российская исследовательская группа по лечению острого лимфобластного лейкоза у взрослых
TdT – терминальная дезоксинуклеотидилтрансфераза
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
Острые лимфобластные лейкозы – это гетерогенная группа клональных заболеваний системы крови, возникающих вследствие мутации в Т- или В-клетках-предшественницах.
Ph-негативные острые лимфобластные лейкозы – это группа, объединяющая несколько подтипов острых лимфобластных лейкозов, при которых не обнаруживается филадельфийская хромосома (t(9;22)(q34;q11)). В нее включены все В-клеточные и Т-клеточные острые лимфобластные лейкозы и лимфобластные лимфомы.
Ph-позитивный острый лимфобластный лейкоз – это вариант острого лимфобластного лейкоза, при котором методом стандартного цитогенетического исследования (G-banding) или методом FISH определяется транслокация t(9;22)(q34;q11). Диагноз Ph-позитивного острого лимфобластного лейкоза не может быть основан только на методе молекулярной детекции химерного транскрипта. Цитогенетическое или FISH (метод флуоресцентной гибридизации in situ) исследования являются обязательными. Методом полимеразной цепной реакции определяется вариант химерного транскрипта, который в дальнейшем используется для мониторинга минимальной остаточной болезни.
Полная ремиссия – это состояние кроветворной ткани, при котором в пунктате костного мозга обнаруживается 5% и менее бластных клеток при нормальном соотношении всех ростков кроветворения, при количестве нейтрофилов в периферической крови более 1,0×109/л, при количестве тромбоцитов более или равном 100×109/л, при отсутствии экстрамедуллярных очагов лейкемического роста. Констатация морфологически полной ремиссии (соответственно, оценка резистентности) осуществляется либо после первой фазы индукционной терапии, либо после второй. При отсутствии полной ремиссии после завершения двух этапов индукционной терапии регистрируется рефрактерная форма острого лимфобластного лейкоза. В этой связи необходимо подчеркнуть, что у ряда пациентов после завершения второй фазы индукционной терапии на фоне восстановления кроветворения после цитостатического воздействия в ранние сроки после его завершения может определяться увеличенный процент бластных клеток (до 10-12%). В этом случае (особенно если полная ремиссия была зафиксирована после первой фазы индукционной терапии) через неделю на фоне восстановленного кроветворения целесообразно выполнить повторную стернальную пункцию (получение цитологического препарата костного мозга путем пункции).
Полная ремиссия в том числе может характеризоваться как: 1) цитогенетическая, 2) молекулярная, 3) с неполным восстановлением показателей периферической крови, когда число нейтрофилов менее 1×109/л, а тромбоцитов менее 100×109/л. Последняя категория оговаривается специально, поскольку, по ряду данных, прогноз у таких пациентов несколько хуже. При этом эксперты не рекомендуют констатировать у таких пациентов полную ремиссию. Тем не менее вне клинических исследований эту формулировку ответа применяют редко.
Частичная ремиссия (частичный ответ) – этот термин рекомендуют использовать только в клинических исследованиях I-II фазы, оценивающих противоопухолевую эффективность, токсичность, переносимость новых препаратов и определяющих оптимальные дозы этих препаратов.
Резистентная форма – эта форма заболевания, которая констатируется при отсутствии полной ремиссии после завершения двух фаз индукционной терапии.
Ранняя смерть – это смерть пациента в период индукционной терапии (двух фаз индукции для острых лимфобластных лейкозов). Следует подчеркнуть, что этот критерий является обобщающим для понятия гибели пациента в процессе индукционной терапии. Чаще используют термин «смерть в период индукции», что более четко отражает ситуацию, поскольку в ряде случаев смерть пациента происходит на второй фазе индукционной терапии, при этом у них была зарегистрирована полная ремиссия после первой фазы индукционной терапии. В этих случаях смерть рассматривают как смерть в консолидации или смерть после достижения полной ремиссии.
Рецидив – это состояние констатируется при обнаружении в пунктате костного мозга более 5% бластных клеток. Рецидив заболевания не констатируется при обнаружении в очередном контрольном пунктате костного мозга более 5% бластных клеток, но менее 10%, в тех случаях, когда пункция костного мозга производится в ранние сроки после курса химиотерапии, или использовались ростовые гемопоэтические факторы с целью сокращения периода нейтропении, при этом анализ периферической крови нормальный и отсутствуют экстрамедуллярные поражения. Вторая диагностическая пункция осуществляется через 7-10 дней после первой. Если сохраняется процент бластных клеток выше 5 или отмечается их увеличение (например, с 7 до 13%), то констатируется рецидив.
Ранний рецидив – эта форма рецидива называется в том случае, если он регистрируется раньше, чем через полгода от момента окончания поддерживающей терапии или на терапии после достижения ремиссии. Поздним считается тот рецидив, который возникает через полгода и более от окончания поддерживающей терапии. Рецидивом также является и внекостномозговое поражение (нейролейкемия, поражение яичек, увеличение селезенки и т. д.) даже при отсутствии изменений в крови и костном мозге. Внекостномозговые рецидивы (особенно поражение центральной нервной системы) при использовании современных протоколов лечения встречаются приблизительно в 4-8% случаев. Если констатирован изолированный внекостномозговой рецидив, то, кроме локальной терапии (лечение нейролейкемии, облучение/удаление яичка, удаление лейкемического очага в яичнике и т.д.), обязательно проведение и системной индукционной терапии по протоколам, предусмотренным для таких рецидивов.
Минимальная остаточная болезнь, или минимальная резидуальная болезнь – это небольшая популяция опухолевых клеток, которая не может быть зафиксирована с помощью светового микроскопа, но обнаруживается более тонкими методами исследования, выявляющими 1 лейкемическую клетку на 104-6 исследуемых. Основными методами детекции минимальной остаточной болезни являются проточная цитофлуориметрия и полимеразная цепная реакция. Методы стандартного цитогенетического исследования и метод FISH не используются в целях оценки минимальной остаточной болезни.
Цитогенетическая ремиссия – это полная клинико-гематологическая ремиссия, при этом методами стандартной цитогенетики не выявляются исходные аномалии кариотипа; кариотип должен быть нормальным, а число проанализированных метафаз должно составлять не менее 20. Цитогенетическая ремиссия – новое понятие, появившееся при регулярном использовании методов цитогенетики для исследований пунктатов костного мозга в период полной ремиссии.
Цитогенетический рецидив – это рецидив, который констатируется при наличии в пунктате костного мозга митозов с хромосомными аберрациями, которые обнаружены в дебюте заболевания на фоне сохраняющейся клинико-гематологической ремиссии.
Молекулярная ремиссия – это полная клинико-гематологическая ремиссия при отсутствии в костном мозге исходно определявшихся методом полимеразной цепной реакции молекулярных маркеров острого лейкоза с чувствительностью метода 10–4. Это также новое понятие, ставшее в настоящее время ключевым. Следует отметить, что может быть достигнута цитогенетическая ремиссия, но при этом молекулярные маркеры могут еще определяться.
Молекулярный рецидив – это появление исходно определявшихся молекулярных маркеров острых лейкозов в двух повторных анализах (проведенных с коротким интервалом времени) на фоне сохраняющейся клинико-гематологической ремиссии.
Важным и одним из самых точных способов оценки эффективности терапии острых лейкозов являются применение статистических методов и построение кривых выживаемости пациентов, которым проводили то или иное лечение. Чаще всего оценивают общую, безрецидивную, бессобытийную выживаемость и вероятность сохранения полной ремиссии (или обратное понятие – вероятность развития рецидива).
Общая выживаемость. Для оценки общей выживаемости анализируют временные параметры всех пациентов, включенных в исследование. Точкой отсчета является день начала терапии. Событием считается только смерть пациента от любой причины (ранняя летальность, смерть в период ремиссии от любой причины, смерть в период рецидива). Событие на кривой выживаемости графически отображается ступенькой, идущей вниз. Пациентов, живых во время проведения анализа, расценивают как случай и отмечают на кривой черточкой, т. е. цензурируют. Пациентов, судьба которых неизвестна, цензурируют в тот момент, когда было известно, что они живы. Больных, отказавшихся от лечения, цензурируют в день отказа от терапии.
Безрецидивная выживаемость. При оценке безрецидивной выживаемости учитывают данные только тех пациентов, у которых была достигнута полная ремиссия. Точкой отсчета считается дата достижения полной ремиссии. Событиями считаются рецидив или смерть от любой причины (в период консолидации или поддерживающего лечения, от рецидива, в период ремиссии от другой причины, например, суицида). Цензурируют только тех пациентов, которые были живы и находились в полной ремиссии в момент проведения анализа. Больных, судьба которых неизвестна, цензурируют в тот момент, когда было известно, что они живы в полной ремиссии. Пациентов, у которых была достигнута полная ремиссия, но они отказались от лечения в ремиссии, цензурируют в день отказа от терапии.
Вероятность сохранения полной ремиссии (обратное от вероятности развития рецидива). При оценке вероятности сохранения полной ремиссии учитываются данные только тех пациентов, у которых достигнута полная ремиссия. При этом точкой отсчета служит дата достижения полной ремиссии. Событием считается только рецидив заболевания. Цензурируют всех больных, кто жив в полной ремиссии в момент проведения анализа. Пациенты, умершие в период полной ремиссии от осложнений, связанных с лечением, или от других причин, цензурируют в день смерти, как больных, находившихся в полной ремиссии. Пациентов, судьба которых неизвестна, цензурируют на тот момент, когда было известно, что они живы в полной ремиссии. Пациентов, у которых была достигнута полная ремиссия и которые отказались от лечения в период ремиссии, цензурируют в день отказа от терапии.
Вероятность сохранения полной ремиссии является тем показателем, который позволяет оценивать истинную противоопухолевую эффективность какой-либо терапии без учета таких субъективных моментов, как выхаживание пациентов от осложнений, связанных с самим лечением.
Бессобытийная выживаемость. Этот показатель оценивает выживаемость всех больных, включенных в анализ, с момента начала терапии. Событием считается ранняя летальность, факт недостижения полной ремиссии через два месяца от начала лечения, смерть в период ремиссии от осложнений химиотерапии или других причин, а также рецидив заболевания. Цензурируют только пациентов, у которых была достигнута полная ремиссия в течение первых двух курсов химиотерапии, и они остаются живыми, сохраняя полную ремиссию, на момент проведения анализа.
Индукция – это период начального лечения, целью которого является максимально быстрое и существенное сокращение опухолевой массы и достижение полной ремиссии, называется периодом индукции (обычно 1-2 курса). Именно в этот период на фоне применения противоопухолевых препаратов количество лейкемических клеток в костном мозге уменьшается примерно в 100 раз, т. е. в момент констатации полной ремиссии в костном мозге морфологически определяется менее 5% опухолевых клеток.
Консолидация. Второй этап терапии острых лейкозов – закрепление достигнутого противоопухолевого эффекта (разное количество, в зависимости от протокола). Задачей этого периода является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток.
Поддерживающее лечение – это продолжение цитостатического воздействия в меньших дозах, чем в период индукции ремиссии, на возможно остающийся опухолевый клон.
Лейкоз/лимфома Беркитта – это высокоагрессивное лимфопролиферативное заболевание из иммунологически зрелых В-клеток с преимущественно экстранодальной локализацией. Клинически выделяют 3 варианта лимфомы Беркитта: эндемический, спорадический и ВИЧ-ассоциированный.
Эндемический вариант лимфомы Беркитта – это вариант лимфомы Беркитта характерен для темнокожих детей-аборигенов экваториальной Африки и мигрантов из Африки в Новую Гвинею. В клинической картине часто наблюдается поражение лицевого скелета: верхней и нижней челюстей, орбиты, а также почек, яичек, яичников, слюнных, молочных желез и центральной нервной системы.
Спорадический вариант лимфомы Беркитта – это типичная лимфома Беркитта по морфологическим, иммунофенотипическим и цитогенетическим признакам, возникающая вне эндемичной зоны.
Иммунодефицит-ассоциированный вариант лимфомы Беркитта – это лимфома Беркитта, возникающая на фоне иммунодефицитных состояний (у пациентов с ВИЧ-инфекцией, после трансплантации органов, у пациентов с первичными иммунодефицитами). Чаще всего встречается у ВИЧ- инфицированных пациентов, причем на ранних этапах развития (до снижения CD4+-клеток).
Критерии оценки качества медицинской помощи
|
№ |
Критерии качества |
Оценка выполнения |
|---|---|---|
|
1 |
При постановке диагноза для верификации диагноза выполнен общий (клинический) анализ крови развернутый (с подсчетом лейкоцитарной формулы и исследованием уровня тромбоцитов) |
Да/Нет |
|
2 |
Выполнено получение цитологического препарата костного мозга путем пункции (стернальная пункция, пункция задней ости подвздошной кости) и цитологическое исследование мазка костного мозга (миелограмма) из стернального пунктата с целью верификации диагноза и определения прогноза пациентов |
Да/Нет |
|
3 |
Выполнено цитохимическое исследование микропрепарата костного мозга (бластных клеток КМ) с целью верификации диагноза |
Да/Нет |
|
4 |
Выполнено при первичной диагностике ОЛЛ, а также при обследовании по поводу диагностированного рецидива ОЛЛ цитогенетическое исследование (кариотип) клеток аспирата костного мозга и исследование биопсийного (операционного) материала тканей или костного мозга с применением метода флуоресцентной гибридизации in situ (FISH) с целью верификации диагноза и определения группы риска и тактики лечения |
Да/Нет |
|
5 |
Выполнено иммунофенотипирование гемопоэтических клеток-предшественниц в КМ с целью верификации диагноза |
Да/Нет |
|
6 |
Выполнена компьютерная томография и/или магнитно-резонансной томографии головного мозга, органов грудной и брюшной полостей, а также других областей по показаниям, для выявления возможных очагов поражения и сопутствующей патологии |
Да/Нет |
|
7 |
Выполнена спинномозговая пункция с цитологическим исследованием клеток спинномозговой жидкости (микроскопическое исследование спинномозговой жидкости, подсчет клеток в счетной камере) для исключения/подтверждения вовлечения ЦНС. |
Да/Нет |
|
8 |
Выполнена в качестве профилактики нейролейкемии спинномозговые пункции с интратекальным введением (Введение лекарственных препаратов в спинномозговой канал) трех препаратов: #метотрексата** (15 мг мг) [1, 4, 158], цитарабина** (30 мг/м2), #преднизолона** (40 мг) [251] или #дексаметазона** (4 мг) [1, 4, 251] согласно схеме выбранного протокола |
Да/Нет |
|
9 |
Взрослому пациенту с Ph-негативным ОЛЛ проведена ХТ, согласно одному из двух принципов химиотерапевтического воздействия: 1) импульсное, высокодозное с последующей постоянной поддерживающей терапией (программа Hyper-CVAD); 2) более традиционное (стандартное) – 8-9-недельная непрерывная индукция с последующими неоднократными высокодозными миелоаблятивными курсами и в последующем – поддерживающим лечением |
Да/Нет |
|
10 |
Выполнен выбранный для данного пациента протокол с неукоснительным соблюдением временного регламента |
Да/Нет |
|
11 |
Пациенту, независимо от применяемого протокола (кроме терапии зрелого варианта В-ОЛЛ), выполнено поддерживающее лечение, состоящее: из ежедневного приема меркаптопурина**, метотрексата** (дозировка согласно протоколу) – 1 раз в неделю, пульсов глюкокортикоидов и винкристина** – 1 раз в месяц или по схеме POMP в течение 2-х лет |
Да/Нет |
|
12 |
Пациентам с ОЛЛ/ЛБЛ из группы высокого риска и при рецидиве заболевания, а также их сиблингам выполнено определение HLA-антигенов с целью поиска потенциального донора ГСК |
Да/Нет |
|
13 |
Пациенту на этапах индукции и консолидации перед началом каждого последующего этапа либо 1 раз в 2 месяца выполнено контрольное исследование КМ (получение цитологического препарата КМ путем пункции (стернальная пункция) и цитологическое исследование мазка КМ (миелограмма) из стернального пунктата) |
Да/Нет |
|
14 |
Пациенту на фоне поддерживающей терапии 1 раз в 3 месяца в течение 2 лет и в дальнейшем, после снятия с лечения, каждые полгода до 3 лет наблюдения выполнено контрольное исследование КМ (получение цитологического препарата КМ путем пункции (стернальная пункция) и цитологическое исследование мазка КМ (миелограмма) из стернального пунктата) |
Да/Нет |
|
15 |
Пациенту с поздним рецидивом ОЛЛ/ЛБЛ назначена стандартная терапия ОЛЛ 1-й линии или другие варианты 2-й линии терапии (возможные ХТ комбинации FLAG-Ida, FLAM или Hyper-CVAD, либо #бортезомиба** в комбинации с ХТ (например, #митоксантроном**, дексаметазоном** и аспарагиназой** или иммунотерапию (блинатумомабом** или инотузумаб озогамицин**), а также терапию #венетоклакс** в сочетании с #децитабином** |
Да/Нет |
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
1. Савченко В.Г., академик, д.м.н., профессор
2. Паровичникова Е.Н., д.м.н., генеральный директор ФГБУ «НМИЦ гематологии» Минздрава России
3. Троицкая В.В., д.м.н., первый заместитель генерального директора ФГБУ «НМИЦ гематологии» Минздрава России
4. Алешина О.А., к.м.н., заведующий отделом клеточной и иммунной терапии ФГБУ «НМИЦ гематологии» Минздрава России
5. Соколов А.Н., к.м.н., старший научный сотрудник научно-клинического отделения химиотерапии гемобластозов и депрессий кроветворения ФГБУ «НМИЦ гематологии» Минздрава России
6. Кузьмина Л.А., к.м.н., заведующая научно-клиническим отделением трансплантации костного мозга ФГБУ «НМИЦ гематологии» Минздрава России
7. Клясова Г.А., д.м.н., профессор, заведующая научно-клинической лабораторией микробиологии ФГБУ «НМИЦ гематологии» Минздрава России
8. Двирнык В.Н., к.м.н., заведующий централизованной клинико-диагностической лабораторией ФГБУ «НМИЦ гематологии» Минздрава России
9. Гальцева И.В., д.м.н., заведующий лабораторией иммунофенотипирования клеток крови и костного мозга ФГБУ «НМИЦ гематологии» Минздрава России
10. Бондаренко С.Н., к.м.н., НИИ детской гематологии и трансплантологии им. Р.М. Горбачевой, Санкт-Петербургский государственный медицинский университет
11. Баранова О.Ю., к.м.н., старший научный сотрудник отделения противоопухолевой лекарственной терапии и гематологии ФГБУ «НМИЦ им. Н.Н. Блохина»
12. Константинова Т.С., к.м.н., заведующая отделением гематологии ГБУЗ СО «Областной гематологический центр Свердловской областной клинической больницы № 1»
13. Самойлова О.С., к.м.н., заведующая отделением гематологии ГБУЗ НО «Нижегородская областная клиническая больница им. Н.А. Семашко»
14. Капорская Т.С., к.м.н., заведующая отделением гематологии, ГБУЗ «Иркутская ордена «Знак Почета» областная клиническая больница»
15. Лапин В.А., к.м.н., заведующий отделением гематологии ГБУЗ ЯО «Областная клиническая больница»
16. Птушкин В.В., д.м.н., профессор, заместитель главного врача по гематологии ГБУЗ ГКБ им. С.П. Боткина ДЗМ
17. Капланов К.Д., д.м.н., заведующий гематологическим отделением №11 ГБУЗ ГКБ им. С.П. Боткина ДЗМ
18. Обухова Т.Н., к.м.н., заведующий лабораторией кариологии ФГБУ «НМИЦ гематологии» Минздрава России
Блок по организации медицинской помощи:
19. Лазарева О.В., к.м.н., руководитель управления регионального и межведомственного сотрудничества по профилю "гематология" ФГБУ «НМИЦ гематологии» Минздрава России
Блок по трансплантации аллогенных гемопоэтических стволовых клеток
20. Дроков М.Ю., к.м.н., руководитель сектора по изучению иммунных воздействий и осложнений после ТКМ ФГБУ «НМИЦ гематологии» Минздрава России
21. Васильева В.А., к.м.н., заведующая отделением иммунохимиотерапии с дневным стационаром для больных после ТКМ ФГБУ «НМИЦ гематологии» Минздрава России
22. Власова Ю.Ю., к.м.н., зав. отделением транспантации костного мозга для взрослых НИИ детской онкологии, гематологии и трансплантологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Министерства здравоохранения Российской Федерации
23. Гапонова Т.В., д.м.н., главный внештатный специалист-трансфузиолог Министерства здравоохранения РФ, заместитель Генерального директора ФГБУ «НМИЦ гематологии» Минздрава России, зав. отделом процессинга клеток крови и криоконсервирования
24. Грицаев С.В., д.м.н., руководитель Республиканского центра ТКМ ФГБУ РосНИИГТ ФМБА России
25. Зюзгин И.С., заведующий отделением гематологии и трансплантации костного мозга ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
26. Климко Н.Н., д.м.н, профессор, заведующий кафедрой клинической микологии, аллергологии и иммунологии СЗГМУ им.И.И. Мечникова.
27. Кулагин А.Д., д.м.н., и.о. директора НИИ детской онкологии, гематологии и трансплантологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Министерства здравоохранения Российской Федерации,
28. Минаева Н.В., зам. директора по лечебной работе ФГБУН КНИИ ГПК ФМБА России
29. Моисеев И.С., д.м.н., зам. директора по науке НИИ детской онкологии, гематологии и трансплантологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Министерства здравоохранения Российской Федерации
30. Морозова Е.В., д.м.н., руководитель отдела гематологии, онкологии и трансплантации для взрослых НИИ детской онкологии, гематологии и трансплантологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Министерства здравоохранения Российской Федерации
31. Петрова Г.Д., к.м.н., заведующая отделением трансплантации костного мозга и гемопоэтических стволовых клеток отдела гематологии и трансплантации костного мозга ФГБУ "НМИЦ онкологии им Н. Н. Блохина" Минздрава России,
32. Попова М.О., к.м.н., доцент кафедры гематологии, трансфузиологии и трансплантологии ФПО ПСПбГМУ им. И.П. Павлова
33. Эстрина М.А., к.м.н., зав. отделением клинической трансфузиологии НИИ детской онкологии, гематологии и трансплантологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Министерства здравоохранения Российской Федерации
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория клинических рекомендаций:
-
врачи-гематологи;
-
врачи-онкологи;
-
врачи-терапевты;
-
врачи-акушеры-гинекологи;
-
врачи-анестезиологи-реаниматологи;
-
врачи-клинические фармакологи.
Российская исследовательская группа по изучению острых лейкозов с 1995 г. провела 3 многоцентровых КИ по лечению пациентов с ОЛЛ в возрасте от 15 до 55 лет, в которых принимали участие гематологические центры из более чем 30 городов России. Результаты этих исследований неоднократно опубликованы и обсуждены на ежегодных рабочих совещаниях исследовательской группы. Кроме того, при создании национальных рекомендаций использован опыт и отдельных федеральных гематологических центров, в которых концентрируются больные этим заболеванием.
Российская исследовательская группа по лечению ОЛЛ взрослых (далее – RALL) является участником общеевропейской кооперации в этой области гематологии и входит в европейскую рабочую группу по изучению ОЛЛ и объединяет 14 исследовательских групп из различных европейских стран. При разработке рекомендаций также учитывался опыт американских исследовательских групп и рекомендации NCCN.
Поскольку ОЛЛ представляет собой редкое заболевание и характеризуется существенной гетерогенностью, в настоящее время общей программы лечения ОЛЛ не существуют. Терапия ОЛЛ четко дифференцирована. В основе Российских рекомендаций лежат результаты собственных исследований, Европейские рекомендации по лечению ОЛЛ, Американские рекомендации NCCN.
Таблица 2. Шкала оценки УДД для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1 |
Систематические обзоры исследований с контролем референтным методом или систематический обзор рандомизированных КИ с применением метаанализа |
|
2 |
Отдельные исследования с контролем референным методом или отдельные рандомизированные КИ и систематические обзоры исследований любого дизайна, за исключением рандомизированных КИ, с применением метаанализа |
|
3 |
Исследования без последовательного контроля референтным методом или исследования с референтным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 3. Шкала оценки УДД для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1 |
Систематический обзор рандомизированных КИ с применением метаанализа |
|
2 |
Отдельные рандомизрованные КИ и систематические обзоры исследований любого дизайна, за исключением рандомизированных КИ, с применением метаанализа |
|
3 |
Нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай – контроль» |
|
5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 4. Шкала оценки УУР для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР |
Расшифровка |
|---|---|
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций
Механизм обновления КИ предусматривает их систематическую актуализацию – не реже чем 1 раз в 3 года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Приложение А3.1. Протоколы лечения ОЛЛ
Протокол российской исследовательской группы для Ph-негативных ОЛЛ у пациентов в возрасте моложе 55 лет – «ОЛЛ-2009» [1, 66]





Протокол российской исследовательской группы для Ph-негативных ОЛЛ у пациентов в возрасте моложе 55 лет – «ОЛЛ-2016» [1]

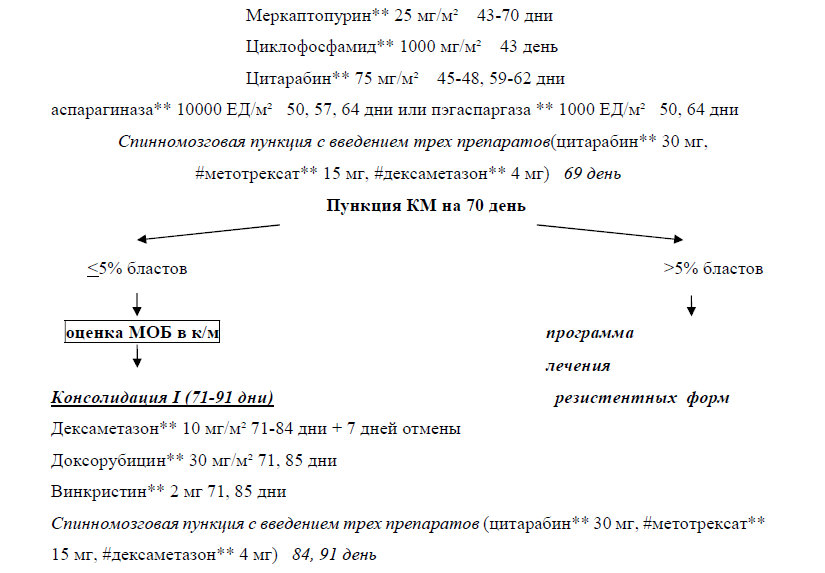






Протокол немецкой исследовательской группы GMALL (06/99 and 07/03) [5, 254]



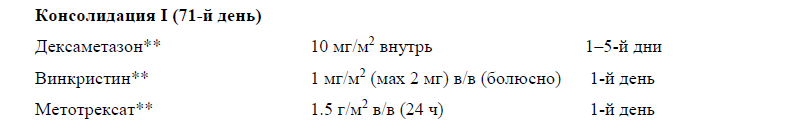






Протокол M.D. Anderson CRC R±Hyper-CVAD/HMA [56, 61]


- Метотрексат** – 12 мг интратекально, 2-й день.
- Цитарабин** – 100 мг интратекально, 7-й день.
Всем пациентам с ОЛЛ/ЛБЛ (кроме пациентов со зрелым В-ОЛЛ) необходимо проведение поддерживающей терапии в течение 2-х лет. Поддерживающая терапия начинается через 2 недели после окончания интенсивной терапии.
- Меркаптопурин** 50 мг/м2 в день внутрь ежедневно
- #Метотрексат** 30 мг/м2 внутрь 1 раз внеделю
Доза меркаптопурина** и метотрексата** коррегируется в зависимости от показателей лейкоцитов и тромбоцитов. На фоне поддерживающей терапии выполняются интратекальные введения 1 раз в 3 месяца.
Протокол «ОЛЛ-2009», адаптированный для лечения пациентов с ОЛЛ старшей возрастной группы (55 лет и старше) [1]

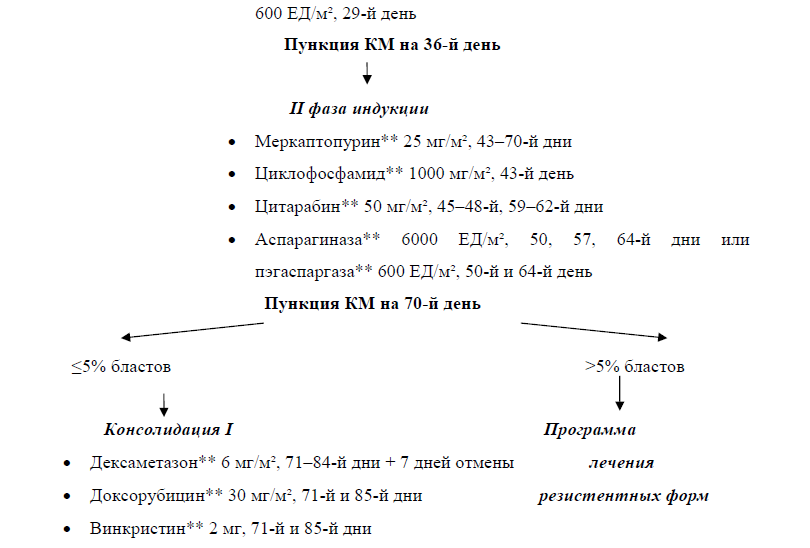
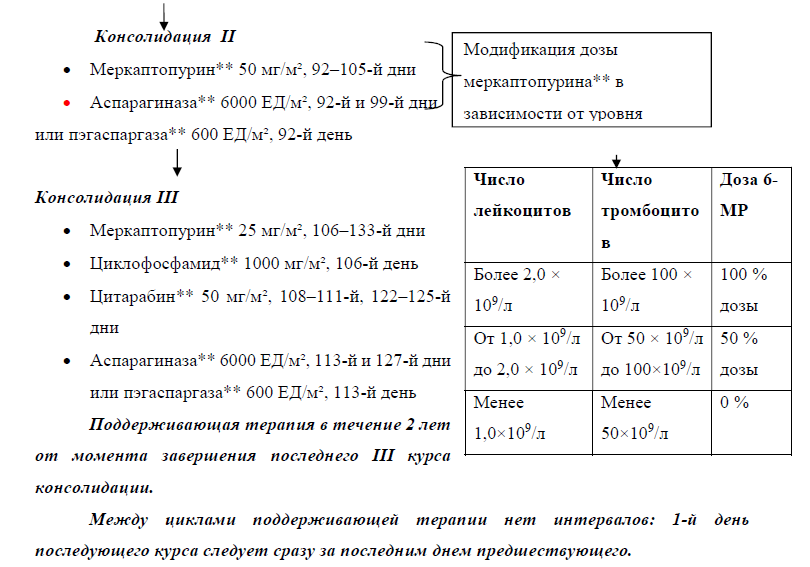

Протокол европейской группы по лечению пациентов старше 55 лет с ОЛЛ [5]
Предфаза: дексаметазон** (перорально, 10 мг/м2, в 1-5-й дни), метотрексат** (интратекально 12 мг, в 1-й день).
Индукция, фаза I: дексаметазон** (перорально, 10 мг/м2 в 6-7-й*, 13-16-й дни); винкристин** (внутривенно, 1 мг в 6-й, 13-й дни); #идарубицин** (внутривенно, 10 мг, в 6-7-й, 13-14-й дни); метотрексат** (внутриоболочечно, 12 мг) + #дексаметазон** (внутриоболочечно, 4 мг) + цитарабин** (внутриоболочечно, 40 мг) в 12, 20, 27, 34-й дни; филграстим** (подкожно, 5 мкг/кг, в 6-й день, до восстановления количества нейтрофилов >1,0×109/л).
Индукция, фаза Il: циклофосфамид** (внутривенно, 300 мг/м2 в 20–22-й дни)[1]; цитарабин** (внутривенно, 60 мг/м2 в 21–24-й, 28–31-й дни).
Консолидация (каждые 4-6 нед): циклы 1, 3, 5 – метотрексат** (1000 мг/м2; у пациентов >70 лет – 500 мг/м2, внутривенно, в 1-й день); аспарагиназа** (10000 ЕД/м2; у пациентов >70 лет – 5000 ЕД/м2, внутримышечно, во 2-й день); циклы 2, 4, 6 – цитарабин** (1000 мг/м2; у пациентов >70 лет – 500 мг/м2, внутривенно, в 1, 3, 5-й дни).
Поддерживающая терапия (длительностью до 2 лет): дексаметазон** (перорально, 40 мг в 1-2-й дни); винкристин** (внутривенно, 1 мг в 1-й день); меркаптопурин** (перорально, 60 мг/м2 в 1-90-й дни); метотрексат** (внутривенно, 25 мг/м2, 1 раз в неделю).
_____________________
[1] Дни указаны относительно начала префазы терапии.
Терапия по программе POMP (поддерживающая терапия и программа для лиц старше 55 лет) [56, 241] – 1 цикл составляет 28 дней:
-
Преднизолон** 60 мг/м2 внутрь 1-5 дни
-
Винкристин** 1,4 мг/м2 (2 мг максимально) в/в 1-й день
-
Меркаптопурин** 60 мг/м2 внутрь 1-28 дни
- #Метотрексат** 20 мг/м2 внутрь 1,8,15,22 дни
Программы лечения лейкоза/лимфомы Беркитта ЛБ-М-04 [63, 1]
Схема лечения: предфаза – 4-6 блоков (-А-С-)
Предфаза:
-
Циклофосфамид** 200 мг/м2 в/в, 1-5-й дни
-
Дексаметазон** 20 мг внутрь, 1-5-й дни
Блок А:
-
#Ифосфамид** 800 мг/м2 в/в, 1-5-й дни
-
Метотрексат** 1,5 г/м2 в/в (в течение 12 ч), 1-й день
-
Винкристин** 2 мг в/в, 1-й день
-
Доксорубицин** 50 мг/м2 в/в, 3-й день
-
Цитарабин** 150 мг/м2 в/в каждые 12 ч, 4-5-й дни (всего 4 введения)
-
#Этопозид** 100 мг/м2 в/в, 4-5-й дни
-
#Дексаметазон** 10 мг/м2 в/в, 1-5-й дни
Блок С:
-
Метотрексат** 1,5 г/м2 в/в (в течение 12 ч), 1-й день
-
#Винбластин** 5 мг/м2 в/в, 1-й день
-
Цитарабин** 2 г/м2 в/в каждые 12 ч, 2-3-й дни (всего 4 введения)
-
#Этопозид** 150 мг/м2 в/в, 3-5-й дни
-
#Дексаметазон** 10 мг/м2 в/в, 1-5-й дни
Профилактику нейролейкемии проводят в 1-й день предфазы и в 1-й день каждого блока в виде интратекального введения ХТ: цитарабин** 30 мг, #метотрексат** 15 мг, #преднизолон** 30 мг.
Профилактика при проведении терапии #ифосфамидом** – месна** 20% от дозы #ифосфамида** во время введения препарата и через 4 и 8 часов, при проведении терапии метотрексатом** – кальция фолинат** 25 мг/м2 в/в и внутрь каждые 3-6 часов через 24 час и 2-7 суток после.
#Ритуксимаб** 375 мг/м2 вводят в 0-й день каждого блока (всего 4 введения)
Hyper-CVAD/HMA [56]
Циклы 1, 3, 5, 7 (Hyper-CVAD):
-
Циклофосфамид** 300 мг/м2 в/в каждые 12 ч, 1-3-й дни (всего 6 введений)
-
#Дексаметазон** 40 мг в/в или внутрь, 1-4-й, 11-14-й дни
-
Доксорубицин** 50 мг/м2 в/в непрерывной 24-часовой инфузией в центральный катетер, 4-й день
-
Винкристин** 2 мг в/в, 4-й, 11-й дни
Циклы 2, 4, 6, 8 (HMA):
-
Метотрексат** 1000 мг в/в непрерывной 24-часовой инфузией, 1-й день
-
Цитарабин** 3 г/м2 (у больных старше 60 лет – 1 г/м2) в/в каждые 12 ч, 2-3-й дни (всего 4 введения)
-
Метилпреднизолон** 50 мг в/в каждые 12 ч, дни 1-3-й дни (всего 6 введений)
-
#Ритуксимаб** 375 мг/м2 в/в, 1-й, 11-й дни (циклы 1, 3) и 2-й, 8-й (циклы 2, 4) – всего 8 введений
-
Профилактика поражения ЦНС проводится на каждом курсе, суммарно 16 интратекальных введений: метотрексат** 12 мг интратекально, 2-й день, цитарабин** 100 мг интратекально, 7-й день
-
Поддерживающая терапия по схеме POMP в течение 2-х лет
R-DA-EPOCH [241]
-
#Ритуксимаб** 375 мг/м2 в/в, 0-й день
-
#Этопозид** 50 мг/м2 в/в за 24 ч, 1-4-й дни1
-
Доксорубицин** 10 мг/м2 в/в за 24 ч, 1-4-й дни1
-
#Винкристин** 0,5 мг в/в за 24 ч, 1-4-й дни
-
Преднизолон** 60 мг/м2 внутрь 1-5-й дни
- Циклофосфамид** 750 мг/м2 в/в, 5-й день[2]
______________________
NHL-BFM 90 (B-НХЛ2004 маб.) [63]
Схема лечения:
-
Группа низкого риска: V – A – B
-
Группа промежуточного риска или высокого риска: V – AA – BB, далее – рестадирование :
-
если ПР, то АА – ВВ (– AA – BB – у пациентов высокого риска);
-
если неполный ответ, то CC, далее – рестадирование;:
-
если достигнута вторая ПР или отсутствие опухолевой ткани, по данным повторной биопсии, то AA – BB – CC
-
если опухолевая ткань, по данным повторной биопсии, то ауто-ТГСК
-
-
Профаза (V):
-
#Преднизолон** 30 мг/м2 внутрь или в/в, 1-5-й дни
-
Циклофосфамид** 200 мг/м2 в/в, 1-5-й дни
-
Метотрексат** 12 мг интратекально, 1-й день
-
Цитарабин** 30 мг интратекально, 1-й день
-
#Преднизолон** 10 мг интратекально, 1-й день
Блок А:
-
#Дексаметазон** 10 мг/м2 в/в или внутрь, 1-5-й дни
-
#Ифосфамид** 800 мг/м2 в/в, 1-5-й дни
-
Метотрексат** 500 мг/м2 в/в, 1-й день (24-часовая инфузия)
-
Цитарабин** 150 мг/м2 в/в каждые 12 ч, 4-5-й дни (всего 4 введения)
-
#Этопозид** 100 мг/м2 в/в, 4-5-й дни
-
Метотрексат** 12 мг интратекально, 1-й день
-
Цитарабин** 30 мг интратекально, 1-й день
-
#Преднизолон** 10 мг интратекально, 1-й день
Блок В:
-
#Дексаметазон** 10 мг/м2 в/в или внутрь, 1-5-й дни
-
Циклофосфамид** 200 мг/м2 в/в, 1-5-й дни
-
Метотрексат** 500 мг/м2 в/в, 1-й день (24-часовая инфузия)
-
Доксорубицин** 25 мг/м2 в/в, 4-5-й дни
-
Метотрексат** 12 мг интратекально, 1-й день
-
Цитарабин** 30 мг интратекально, 1-й день
-
#Преднизолон** 10 мг интратекально, 1-й день
Блок АА:
-
#Дексаметазон** 10 мг/м2 в/в или внутрь, 1-5-й дни
-
#Ифосфамид** 800 мг/м2 в/в, 1-5-й дни
-
#Метотрексат** 5 г/м2 в/в, 1-й день (24-часовая инфузия) (при лечении по протоколу В-НХЛ 2004 маб. – 1 г/м2)
-
Винкристин** 1,4 мг/м2 (не более 2 мг) в/в, 1-й день
-
Цитарабин** 150 мг/м2 в/в каждые 12 ч, 4-5-й дни (всего 4 введения)
-
#Этопозид** 100 мг/м2 в/в, 4-5-й дни
-
Метотрексат** 12 мг интратекально, 1-й, 5-й дни
-
Цитарабин** 15 мг интратекально, 1-й, 5-й дни
-
#Преднизолон** 5 мг интратекально, 1-й, 5-й дни
Блок ВВ:
-
#Дексаметазон** 10 мг/м2 в/в или внутрь, 1-5-й дни
-
Циклофосфамид** 200 мг/м2 в/в, 1-5-й дни
-
#Метотрексат** 5 г/м2 в/в, 1-й день (24-часовая инфузия) (при лечении по протоколу В-НХЛ 2004 маб. – 1 г/м2)
-
Винкристин** 1,4 мг/м2 (не более 2 мг) в/в, 1-й день
-
Доксорубицин** 25 мг/м2 в/в, 4-5-й дни
-
#Метотрексат** 6 мг интратекально, 1й, 5-й дни
-
Цитарабин** 15 мг интратекально, 1й, 5-й дни
-
#Преднизолон** 5 мг интратекально, 1й, 5-й дни
Блок СС:
-
#Дексаметазон** 20 мг/м2 в/в или внутрь, 1-5-й дни
-
Винкристин** 1 мг/м2 (не более 2 мг) в/в, 1-й день
-
Цитарабин** 2 г/м2 в/в каждые 12 ч, 1-2-й дни (всего 4 введения)
-
#Этопозид** 150 мг/м2 в/в, 3-5-й дни
-
Метотрексат** 12 мг интратекально, 5-й день
-
Цитарабин** 30 мг интратекально, 5-й день
-
#Преднизолон** 10 мг интратекально, 5-й день
-
#Ритуксимаб** 375 мг/м2 в/в 6-8 часов, 0-й день каждого блока (в рамках протокола В-НХЛ 2004 маб. в 0-й день 1-х 4 блоков)
Программы лечения рецидивов и рефрактерных форм ОЛЛ
Flag-Ida [241]:
-
#Флударабин** 25 мг/м2 в/в за 30 мин, каждые 12 ч, 1, 2, 8, 9-й дни
-
Цитарабин** 100 мг/м2 в/в за 45 мин каждые 3 часа (8 введений), 1, 2, 8, 9-й дни
-
#Идарубицин** 10 мг/м2 в/в за 15 мин, 1-й и 3-й дни
-
Филграстим** 5 мкг/кг подкожно с 7-го дня до выхода из цитопении
FLAM [241]:
-
#Флударабин** 15 мг/м2 в/в за 30 мин, 1-5-й дни
-
Цитарабин** 2 г/м2 в/в за 4 ч через 4 ч после #флударабина**, 1-5-й дни
-
#Митоксантрон** 10 мг/м2 в/в за 15 мин, 3,10-й дни
#Бортезомиб** + дексаметазон** + #митоксантрон** + винкристин** + аспарагиназа**[1]
-
#Бортезомиб** 1,3 мг/м2 в/в капельно, 1, 4, 8, 11-й дни
-
Дексаметазон** 10 мг/м2, разделив на 2 введения внутрь, 1-14-й дни
-
#Митоксантрон** 10 мг/м2 в/в капельно за 15-30 мин, 1-й, 2-й день
-
Винкристин** 2 мг в/в струйно, 1, 8, 15-й дни
-
Аспарагиназа** 5 тыс. ЕД/м2 в/в капельно, 15-21-й дни
Всем пациентам проводится интратекальная терапия: в 1-й день цитарабин** 30 мг.
Если есть вовлечение ЦНС: интратекально #метотрексат** 15 мг, цитарабин** 30 мг, #дексаметазон** 4 мг, 8, 15, 22-й дни. У пациентов с развившейся полинейропатией доза винкристина** редуцируется до 1 мг и вводится в дни 1-й и 8-й дни.
Бортезомиб + дексаметазон** + #митоксантрон** + винкристин** + аспарагиназа**[1]
-
#Бортезомиб** 1,3 мг/м2 подкожно, 1, 4, 8, 11-й дни
-
Дексаметазон** 10 мг/м2, разделив на 2 введения внутрь, 1-14-й дни
-
#Митоксантрон** 10 мг/м2 в/в капельно за 15-30 мин, 1-й, 2-й день
-
Винкристин** 2 мг в/в струйно, 1, 8, 15-й дни
-
Аспарагиназа** 10 тыс. ЕД/м2 в/в капельно, 21-й день или пэгаспаргаза** 1000 ЕД/м2 в/в капельно
Всем пациентам проводится интратекальная терапия: в 1-й день цитарабин** 30 мг.
Если есть вовлечение ЦНС: интратекально #метотрексат** 15 мг, цитарабин** 30 мг, #дексаметазон** 4 мг, 8, 15, 22-й дни. У пациентов с развившейся полинейропатией доза винкристина** редуцируется до 1 мг и вводится в дни 1-й и 8-й дни. Для лиц старше 55 лет – доза аспарагиназы** 6 тыс ЕД/м2 или пэгаспаргаза** 500 ЕД/м2.
#Неларабин** + циклофосфамид** + #этопозид**[1, 96]
Схема: блок N и блок CE проводят с интервалом 2 дня между собой в любой последовательности.
Блок N:
-
#Неларабин** 650 мг/м2 в/в капельно за 1 ч, 1-5-й дни (или 8-12-й)
Блок CE:
-
Циклофосфамид** 440 мг/м2 в/в капельно, 8–12-й дни (или 1-5-й)
#Этопозид** 100 мг/м2 в/в капельно за 1 ч, 8–12-й дни (или 1-5-й)
Схема протокола «ОЛЛ-2012m» для терапии Ph-позитивных ОЛЛ [1, 158]

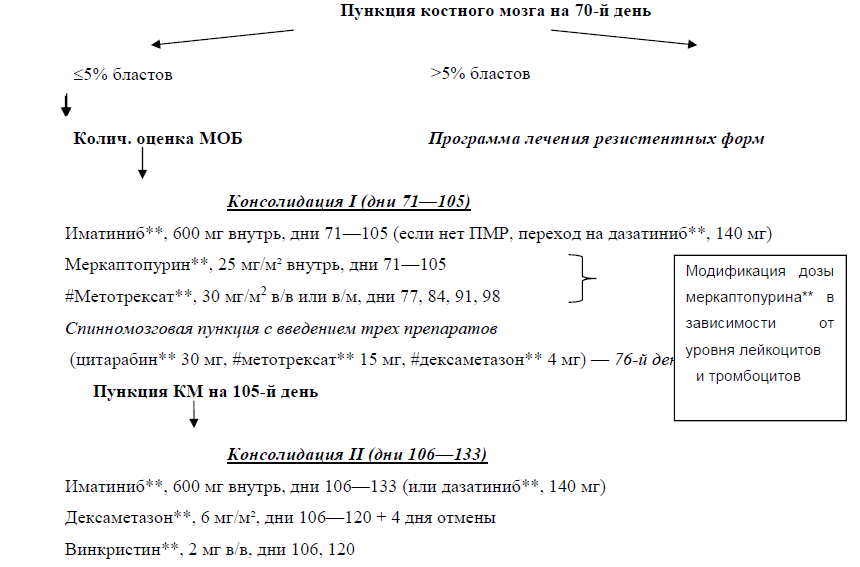


Режимы применения ИТК при Ph-позитивных ОЛЛ в монорежиме (поддерживающая терапия) или в сочетании с ХТ (например, ОЛЛ-2012m) [241]
- #дазатиниб** 140 мг/сут 1 раз внутрь ежедневно
- #нилотиниб** 400 мг внутрь 2 раза или 1 раз (при развитии токсичности) в сутки ежедневно
- #бозутиниб** 500 мг или 400 мг (при развитии токсичности) 1 раз в сутки ежедневно
- понатиниб 45 мг или 30 мг (при развитии токсичности) 1 раз в сутки ежедневно
- #асциминиб 200 мг или 40 мг (при развитии токсичности) 2 раза в сутки ежедневно
Схема терапии блинатумомабом** [1, 73]
Предфаза: блинатумомаб** 9 мкг/сут, 1-7-й дни, круглосуточная непрерывная инфузия.
Курс: блинатумомаб** 28 мкг/сут, 8-28-й дни, круглосуточная непрерывная инфузия.
NB! Дозы препарата для пациента весом более 45 кг.
Интервал между курсами – 14 дней.
Рекомендовано 2-4 курса.
При терапии персистенции МОБ – начало терапии возможно без проведения предфазы.
Схема терапии инотузумабом озогамицин [243]
1 цикл (21-28 дней): инотузумабом озогамицин день 1-й – 0,8 мг/м2, день 8-й и 15-й – 0,5 мг/м2.
2-й и последующие циклы: инотузумабом озогамицин день 1-й, день 8-й и 15-й – 0,5 мг/м2.
Рекомендовано 2-4 курса.
Схема терапии #венетоклакс** + #децитабин** [158, 229, 233]
1-й цикл (28 дней): #децитабин** 20 мг/м2, 1-5-й дни + #венетоклакс** 400 мг, 1 р/сут, 28 дней.
Cледует обратить внимание на необходимость коррекции дозы #венетоклакса** в случае его использования вместе с ингибиторами CYP3A. Доза #венетоклакса** снижается на 50% при совместном использовании с умеренными ингибиторами CYP3A (например, флуконазол**, вориконазол**) и снижается на 75% при совместном использовании с мощными ингибиторами CYP3A (например, карбамазепин**, фенитоин**).
Схема терапии #венетоклакс** + #азацитидин** [244, 158]
1-й цикл (28 дней): #азацитидин** 75 мг/м2, 1-7-й дни + #венетоклакс** 400 мг, 1 р/сут, 28 дней.
Cледует обратить внимание на необходимость коррекции дозы #венетоклакса** в случае его использования вместе с ингибиторами CYP3A. Доза #венетоклакса** снижается на 50% при совместном использовании с умеренными ингибиторами CYP3A (например, флуконазол**, вориконазол**) и снижается на 75% при совместном использовании с мощными ингибиторами CYP3A (например, карбамазепин**, фенитоин**).
Режимы применения таргетных препаратов в монотерапии или в сочетании с ХТ/иммунотерапией [226, 228]
- #дазатиниб** 140 мг/сут внутрь ежедневно ± #блинатумомаб** 9 мкг/сут 1-7 дни, 28 мкг/сут, 8-28-й дни, круглосуточная непрерывная инфузия.
- #сорафениб** 400 мг (при развитии токсичности или цитопении – 200 мг) 2 раза в день, ежедневно ± #блинатумомаб** 9 мкг/сут 1-7 дни, 28 мкг/сут, 8-28-й дни,круглосуточная непрерывная инфузия.
- #дазатиниб** 140 мг, внутрь + #третиноин** 45 мг/м2 внутрь за 2 приема в день ± #блинатумомаб** 9 мкг/сут 1-7 дни, 28 мкг/сут, 8-28-й дни, круглосуточная непрерывная инфузия.
- #венетоклакс** 400 мг внутрь, ежедневно (7-21 день в зависимости от переносимости и развития цитопении) ± #блинатумомаб** 9 мкг/сут 1-7 дни, 28 мкг/сут, 8-28-й дни, круглосуточная непрерывная инфузия.
- #траметиниб** 2 мг/сут внутрь, ежедневно ± #блинатумомаб** 9 мкг/сут 1-7 дни, 28 мкг/сут, 8-28-й дни, круглосуточная непрерывная инфузия.
- #руксолитиниб** 15 мг 2 раза в день, ежедневно ± #блинатумомаб** 9 мкг/сут 1-7 дни, 28 мкг/сут, 8–28-й дни, круглосуточная непрерывная инфузия.
Терапия при персистенции МОБ или рецидиве Т-клеточных ОЛЛ [224, 225]
#Даратумумаб** 16 мг/кг в\в 1 раз в неделю, 8 недель
Схема CAR-T терапии с применением #тисагенлеклейцела [222, 256]
Лимфодеплетирующая терапия: #флударабин** 25 мг/м2 в дни -6, -5,-4,-3,-2, в/в кап за 30 мин, циклофосфамид** 60 мг/кг в\в за 60 мин в день -3,-2, в день 0 после введения #тоцилизумаба** 8 мг/кг за 30 мин вводится #тисагенлеклейцел
Приложение A3.2. Долгосрочные результаты терапии Ph-негативных ОЛЛ взрослых в зависимости от принципа химиотерапевтического воздействия
Таблица 5. Долгосрочные результаты терапии Ph-негативных ОЛЛ взрослых в зависимости от принципа химиотерапевтического воздействия
|
Принцип химиотерапевтического воздействия |
Исследовательская группа |
Пациенты |
Аллогенная ТГСК в 1 ПР |
5-летняя ОВ |
|---|---|---|---|---|
|
Импульсное (Hyper-CVAD) |
Онкологический научный центр имени М.Д. Андерсона [56] |
n = 178 |
Нет |
38% |
|
Традиционное |
MRC UKALL XII/ECOG E2993 [62] |
n = 1031, 15-55 лет |
Реализована у 76% |
Есть донор = 53% Нет донора = 45% (р = 0,01) |
|
GMALL [55] |
n = 504, 15-55 лет |
Реализована у 70% из группы высокого риска |
54% |
|
|
Педиатрический подход |
PETHEMA [64] |
n = 81, 15-30 лет, группа стандартного риска |
Нет |
До 21 года = 77% В возрасте от 21 до 30 = 63% |
|
Неинтенсивное, но непрерывное |
ОЛЛ-2009 [65] |
n = 298,15-55 лет |
Реализована у 7% |
60% |
Приложение А3.3. Рекомендации по профилактической противорвотной терапии [240]
Таблица 1. Рекомендации по профилактической противорвотной терапии
|
Риск эметогенности |
|
|
|---|---|---|
|
Высокий |
Комбинация блокаторов серотониновых 5HT3-рецепторов, #дексаметазона** [240] и апрепитанта (у пациентов старше 18 лет) Блокаторы серотониновых 5HT3-рецепторов (выбирается 1 из приведенного перечня):
|
|
|
||
|
||
|
||
|
Умеренный |
Комбинация блокаторов серотониновых 5HT3-рецепторов и дексаметазона** (апрепитант (у пациентов старше 18 лет) может использоваться у отдельных пациентов, в зависимости от получаемого ими режима химиотерапии). |
|
|
1-й день |
2–3-й дни |
|
|
Блокаторы серотониновых 5HT3-рецепторов (выбирается 1 из приведенного перечня):
|
Блокаторы серотониновых 5HT3-рецепторов (выбирается 1 из приведенного перечня):
|
|
|
|
|
|
|
|
|
Низкий |
|
|
|
||
|
Минимальный |
Рутинная профилактическая терапия не требуется (следует рассмотреть вопрос об использовании противорвотных препаратов, перечисленных для первичной профилактики тошноты/рвоты у пациентов низкого риска) |
|
[1] Дни указаны относительно начала префазы терапии.
[2] В зависимости от переносимости предыдущего курса дозы препаратов увеличиваются или уменьшаются на 20%.
Приложение Б. Алгоритмы действий врача
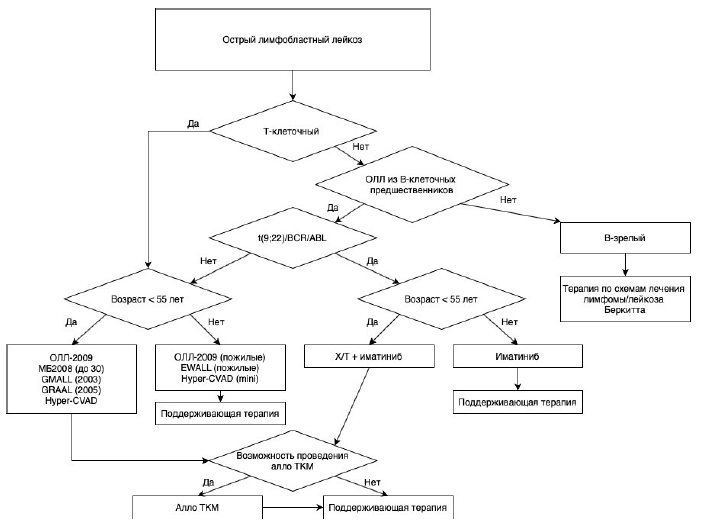
Рис. 1. Алгоритм принятия решения на момент диагностики ОЛЛ
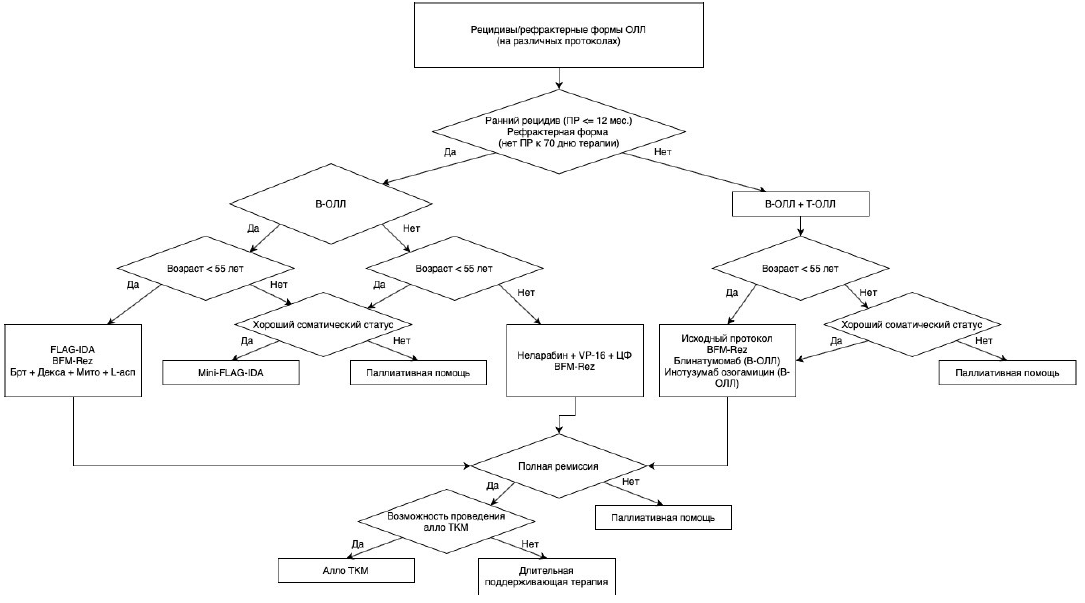
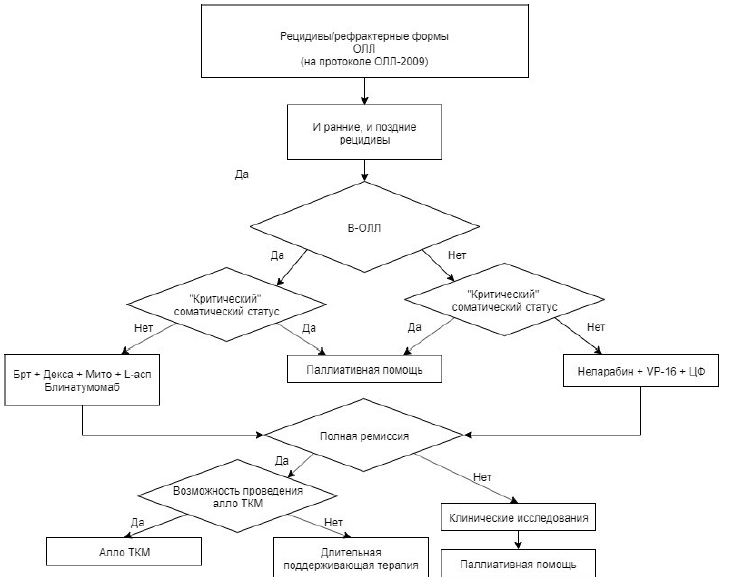
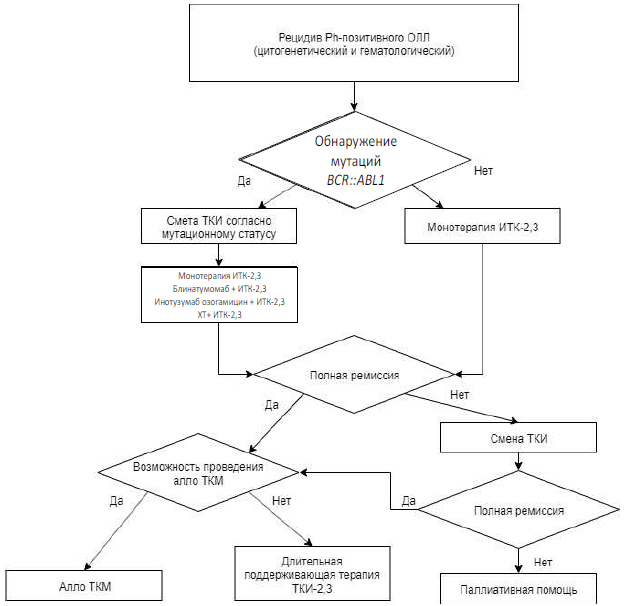
Приложение В. Информация для пациента
ОЛЛ или острый лимфобластный лейкоз – это злокачественное заболевание кровеносной системы. КМ, в котором вырабатываются клетки крови, производит слишком большое количество незрелых белых кровяных телец. В норме у человека все клетки крови растут и обновляются достаточно равномерно, происходит сложный процесс их созревания. Однако при возникновении ОЛЛ этот процесс выходит из-под контроля. Белые кровяные тельца не растут и вызревают, превращаясь в полноценные функциональные клетки, а начинают быстро и бесконтрольно делиться. Постоянно увеличиваясь, они вытесняют здоровые белые клетки крови (лейкоциты), красные клетки крови (эритроциты) и кровяные пластинки (тромбоциты). В результате развивается нехватка необходимого числа здоровых клеток. Малокровие (анемия), инфекции и кровоточивость являются не только следствием ОЛЛ, но и его первыми симптомами. Изначально лейкозы не ограничиваются какой-то определенной частью огранизма. Распространяясь из КМ в кровь, они поражают и лимфатическую ткань (лимфатическая система), и другие органы, и, как следствие, всю систему органов. Поэтому, как и остальные лейкозы, ОЛЛ относится к системным злокачественным заболеваниям. Течение ОЛЛ острое. Без лечения лейкемические клетки увеличиваются и поражают органы человека. Заболевание принимает тяжелые формы, смерть наступает через несколько месяцев.
ОЛЛ – самая распространенная форма лейкоза у детей и подростков, он составляет приблизительно одну треть от числа злокачественных заболеваний в детском и подростковом возрасте. ОЛЛ могут развиваться в любом возрасте, в том числе и во взрослом. Однако чаще всего они поражают детей от 1 до 5 лет, а мальчиков – намного чаще, чем девочек.
При ОЛЛ происходит злокачественное изменение (мутация) незрелых клеток-предшественников лимфоцитов. Мутация может происходить на различных стадиях развития клетки. А это значит, что поражаются не только различные подгруппы лимфоцитов, но и их родоначальники. Поэтому в ОЛЛ существует множество форм заболевания. Например, В-клеточная форма ОЛЛ называется так по имени клеток-предшественников В-лимфоцитов, Т-клеточные лейкозы указывают на происхождение от клеток-предшественников Т-лимфоцитов. Важно знать, что существуют разные формы или подварианты ОЛЛ. Они могут достаточно сильно отличаться друг от друга и по течению болезни, и по возможности излечиться (прогноз). Эти различия учитываются в выборе терапевтической стратегии.
Симптомы, с которых начинается ОЛЛ, как правило, развиваются за несколько недель. Злокачественные клетки распространяются по КМ и другим органам. Беспрепятственно размножаясь в КМ, лейкозные клетки не дают расти нормальным клеткам крови. Поэтому у заболевших ОЛЛ сначала появляются общие симптомы болезненного состояния: вялость, слабость, бледность (анемия). Эти симптомы объясняются нехваткой красных кровяных телец, которые должны доставлять кислород для других клеток организма. Дефицит полноценных белых кровяных телец (например, лимфоцитов и гранулоцитов) приводит к ослаблению иммунитета, развиваются частые инфекции с высокой температурой. Из-за отсутствия тромбоцитов, ответственных за быстрое свертывание крови, могут возникать точечные кровоизлияния на коже и кровотечения слизистых оболочек. Распространяясь по организму, лейкемические клетки приводят не только к изменениям в составе крови. У детей появляются боли в различных органах. Так как лейкозные клетки заполняют костные полости и КМ, то кости начинают болеть, прежде всего кости рук и ног. Злокачественные клетки заполняют печень, селезенку и лимфатические узлы. Их отек приводит к болям в животе. В принципе ни у одного из органов нет защиты от лейкемических клеток. У пациентов с ОЛЛ злокачественные клетки могут проникнуть и в мягкую мозговую оболочку, поэтому появляются головные боли, паралич лицевого нерва, нарушение зрения и/или рвота. Симптомы ОЛЛ могут сильно отличаться у разных людей. Один или даже несколько симптомов не обязательно указывают на то, что человек заболел лейкемией. Многие из них появляются при сравнительно безобидных заболеваниях, не имеющих отношения к лейкозу. Однако если появляются боли, мы рекомендуем немедленно обращаться к врачу, чтобы выяснить их природу. И если действительно поставлен диагноз ОЛЛ, его нужно срочно лечить.
Если в истории болезни (анамнез) или данных осмотра врач находит признаки ОЛ, пациент получает направление на развернутый анализ крови. Если определенные изменения в гемограмме (записи состава крови) подтверждают подозрения на лейкоз, то для окончательного диагноза необходимо получить клетки костного мозга. Поэтому врач дает пациенту направление на дальнейшее обследование в стационар, специализирующийся на болезнях крови и злокачественных заболеваниях. По анализу крови и КМ можно точно определить наличие и вид лейкоза у пациента. Кроме того, современный иммунологический и генетический лабораторный анализ позволяет не только выделить ОЛЛ из других видов лейкоза, но и определить конкретный тип ОЛЛ. Это важное условие для планирования точной терапии, потому что различные типы ОЛЛ отличаются друг от друга на клеточном и молекулярном уровне, по-разному протекает ход болезни, по-разному оцениваются шансы на выздоровление (прогноз) и чувствительность к терапии. Как только поставлен диагноз ОЛЛ, для плана лечения выясняют, поражены ли лейкемическими клетками другие органы, кроме КМ, например, головной мозг, печень, селезенка, лимфатические узлы или кости. Диагноз определяется по изображению из различных исследований, таких как ультразвуковое, рентгеновское, магнитно-резонансная и компьютерная томография, сцинтиграфия костей скелета. Чтобы определить, поражена ли ЦНС, берут пробу спинномозговой жидкости и исследуют ее на наличие лейкемических клеток. Дальнейшая подготовка к лечению заключается в проверке сердечной деятельности и функционального состояния мозга. Изменения, которые могут произойти во время терапии, должны оцениваться на основании этих исходных данных. Комплексные лабораторные исследования помогают оценить общее состояние пациента и установить, имеются ли у него нарушения обмена веществ или функций каких-либо органов (например, почек или печени), возникших из-за лейкоза, что может быть особенно важно до или во время лечения. Для возможно необходимых переливаний крови следует установить группу крови пациента.
Не все исследования обязательны для каждого пациента. От медицинских работников вы получите информацию о том, какие именно диагностические процедуры необходимы для планирования терапии.
В случае подтверждения диагноза ОЛЛ пациента срочно направляют в гематологическое отделение или центр, где имеются и возможность наиболее современного и эффективного лечения, и узкие специалисты по гематологическим заболеваниям (врачи, медсестры). Врачи специализированных отделений постоянно находятся в тесном рабочем контакте, лечение пациента проводится ими по совместно разработанным и систематично усовершенствуемым планам терапии.
Центральное место в лечении ОЛЛ занимает ХТ. ХТ – это лечение медикаментами, которые мешают росту клеток (цитостатики). У некоторых пациентов дополнительно облучается ЦНС (облучение головы). В некоторых случаях применяется ХТ высокими дозами препаратов с последующей ТГСК. Цель лечения – по возможности полностью уничтожить лейкемические клетки во всем организме, чтобы КМ вновь смог работать как кроветворный орган. Интенсивность и продолжительность ХТ, необходимость облучения ЦНС или ТГСК, а также прогноз болезни зависят прежде всего от того, каким именно типом ОЛЛ болен пациент, насколько лейкемические клетки распространились по организму и как лейкоз реагирует на терапию. Лечение зрелоклеточной В-формы ОЛЛ отличается от лечения всех остальных подтипов ОЛЛ. Пациенты с таким диагнозом получают ту же терапию, что и пациенты с неходжкинской лимфомой из зрелых В-клеток. Поэтому следующая информация о ходе лечения к ним не относится.
Лечение пациентов с диагнозом ОЛЛ (кроме зрелоклеточной В-формы ОЛЛ) подразделяется на 4 больших этапа. Четыре фазы терапии отличаются друг от друга по продолжительности, по использованию некоторых медикаментов, а также по интенсивности и целям лечения. 1. Индукция: этап интенсивной ХТ, его цель – уничтожить за короткое время максимальное число лейкозных клеток и достичь ремиссии. Лечение длится приблизительно от пяти до восьми недель. 2. Консолидация и интенсивная терапия: лечение проводится несколько месяцев (примерно от 2 до 5), его цель – с помощью новых комбинаций препаратов продолжить уничтожение лейкемических клеток и закрепить ремиссию. Важным элементом является профилактика поражения ЦНС (превентивное лечение). Для этого в спинномозговой канал вводятся медикаменты и при необходимости дополнительно назначается облучение головного мозга (например, если имеются данные о поражении ЦНС). Этот этап должен не допустить попадания лейкемических клеток в головной и спинной мозг или, что бывает чаще, их размножения. 3. Реиндукция: лечение проводится как в период индукции, его цель – окончательно разрушить все лейкемические клетки и тем самым минимизировать риск возврата болезни. Общая продолжительность реиндукции может составлять от нескольких недель до месяцев, на этом этапе фазы интенсивного лечения чередуются с паузами в ХТ. 4. Поддерживающее лечение или длительная терапия: на этом этапе назначаются невысокие дозы ХТ. Особенность лечения заключается в том, что оно проводится длительное время, как правило, пока его общий срок не составит 2 года. Лечение происходит в основном амбулаторно, его цель – уничтожить все те лейкемические клетки, которые смогли выжить даже после интенсивной терапии.
Большой прогресс в терапии за последние три десятилетия значительно увеличил шансы излечиться от ОЛЛ. Благодаря внедрению современных методов исследования и более эффективных стандартизированных протоколов комбинированной ХТ выздоравливают около 70% заболевших ОЛЛ. Если пациент прожил после лечения 5 лет без рецидивов, он считается здоровым (5-летняя выживаемость). У части пациентов может наблюдаться возврат заболевания (рецидив). Как правило, рецидив наступает в первые 2-3 года после установления диагноза и в крайне редких случаях – после 5 лет. В целом шансы выздороветь при рецидиве значительно ниже, чем при первичном заболевании, хотя у некоторых заболевших повторное лечение достигает хорошего результата. Необходимое замечание: названные проценты выздоровевших являются статистическими показателями. Они точно и достоверно описывают лишь совокупность заболевших ОЛЛ. Статистика не может предсказать, выздоровеет пациент, или нет. Лейкозы даже при самых благоприятных или неблагоприятных условиях могут протекать абсолютно непредсказуемо.Приложение Г. Шкалы оценки, опросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала оценки общего состояния пациента по версии ECOG
Шкала оценки общего состояния пациента по версии ECOG
Орининальное название: The ECOG Scale of Performance Status.
Источник: Oken M.M. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982;5(6):649–65 [16].
Тип: шкала оценки.
Назначение: клиническая оценка общего состояния пациента.
Содержание и интерпретация:
Таблица 1. Шкала оценки общего состояния пациента по версии ECOG
|
Статус (баллы) |
Описание общего состояния пациента |
|---|---|
|
0 |
Пациент полностью активен, способен выполнять все, как и до заболевания |
|
1 |
Пациент не способен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу) |
|
2 |
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени проводит активно – в вертикальном положении |
|
3 |
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования |
|
4 |
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели |
Приложение Г2. Иммунологическая классификация ОЛЛ
При иммунологической характеристике ОЛЛ используется классификация Европейской группы иммунологической характеристики острых лейкозов (EGIL).
Для В-ОЛЛ в ней выделяют 4 иммунофенотипических варианта, условно соответствующие стадиям развития В-клеточных предшественников (Таблица 1).
-
BI (про-В-ОЛЛ) – бластные клетки экспрессируют CD19, cyCD79a, cyCD22, ядерную TdT, отсутствует CD10, тяжелые и легкие цепи иммуноглобулина.
-
BII (“common” B-ОЛЛ) – CD10 позитивен, тяжелые и легкие цепи иммуноглобулина отрицательны.
-
BIII (пре-В-ОЛЛ) – выявляется цитоплазматическая тяжелая цепь иммуноглобулина (IgM).
-
BIV (зрелый В-ОЛЛ; переходный пре-В-ОЛЛ) – опухолевые клетки позитивны по мембранным тяжёлым и/или лёгким цепям IgM.
В случае выявления данного варианта В-ОЛЛ часто необходимы дополнительные методы исследования (гистологические, иммуногистохимические, цитогенетические, молекулярно-генетические) для дифференциальной диагностики зрелого варианта В-лимфобластного лейкоза и зрелой В-клеточной лимфомы (фолликулярной лимфомы, лимфомы Беркитта, ДБККЛ, В-клеточной лимфомы высокой степени злокачественности).
Таблица 1. EGIL классификация В-ОЛЛ.
|
Маркер |
Pro-B (BI) |
Common B (BII) |
Pre-B (BIII) |
B-ALL (BIV) |
|---|---|---|---|---|
|
CD19 |
+ |
+ |
+ |
+ |
|
cyCD22 |
+ |
+ |
+ |
+ |
|
cyCD79a |
+ |
+ |
+ |
+ |
|
CD10 |
- |
+ |
+/- |
+/- |
|
CD20 |
-/+ |
+/- |
+/- |
+/- |
|
CD34 |
+/- |
+/- |
-/+ |
- |
|
HLA-DR |
+ |
+ |
+ |
+ |
|
nuTdT |
+/- |
+/- |
+/- |
+/- |
|
cyIgM |
- |
- |
+ |
+ |
|
Surf IgM |
- |
- |
- |
+ |
Cy – цитоплазматическая экспрессия. Surf – поверхностная экспрессия. Nu – ядерная экспрессия.
По аналогии со стадиями интратимической дифференцировки Т-лимфоцитов выделяют 4 варианта Т-ОЛЛ: про-Т, пре-Т, кортикальный Т, медуллярный (зрелый) Т-ОЛЛ. В классификации EGIL эти варианты называются TI, TII, TIII, TIV (Таблица 2).
-
TI – экспрессия только ранних маркеров (cyCD3, CD7, возможно CD10, HLA-DR, CD34) и отсутствие CD4 и CD8, CD1a.
-
TII – появляется CD2 и/или CD5.
-
TIII (кортикальный Т-ОЛЛ) – обязательно наличие CD1a; мембранный CD3 -/+.
-
TIV (медуллярный Т-ОЛЛ) характеризуется яркой экспрессией мембранного CD3 и/или экспрессией Т-клеточного рецептора (TCR); CD1a отрицателен.
|
Маркер |
|
Pro-T (TI) |
Pre-T (TII) |
Cortical T (TIII) |
T-ALL (TIV) |
|---|---|---|---|---|---|
|
cyCD3 |
|
+ |
+ |
+ |
+ |
|
CD7 |
|
+ |
+ |
+ |
+ |
|
CD2 |
|
- |
+ |
+ |
+ |
|
CD1a |
|
- |
- |
+ |
- |
|
CD10 |
|
+/- |
+/- |
-/+ |
- |
|
CD5 |
|
- |
+ |
+ |
+ |
|
CD34 |
|
+/- |
+/- |
+/- |
+/- |
|
HLA-DR |
|
+/- |
+/- |
+/- |
+/- |
|
TdT |
|
+/- |
+/- |
+/- |
+/- |
|
Surf CD3 |
|
- |
- |
-/+ |
+ яркая экспрессия |
|
CD4+CD8 |
|
- |
- |
+ |
- |
|
CD4 или CD8 |
|
- |
- |
+/- |
+ |
|
TCRab или TCRgd |
|
- |
- |
- |
+ |
Таблица 2. EGIL классификация Т-ОЛЛ.
Cy – цитоплазматическая экспрессия. Surf – поверхностная экспрессия
В классификации ВОЗ 2016 отдельно выделяется Т-лимфобластный лейкоз из ранних предшественников (early T-precursor (ETP-ALL). Бластные клетки при ETP имеют признаки миелоидных и стволовых клеток, иммунофенотип должен соответствовать определенным критериям:
-
Т-линейная направленность (cyCD3+CD7+)
-
CD1a и CD8 отрицательные (<5%)
-
CD5 позитивны менее 75% бластов, слабая экспрессия антигена.
-
позитивен хотя бы один из следующих маркеров: CD34, CD117, HLA-DR, CD13, CD33, CD11b, CD65.
В случае яркой и более мономорфной экспрессии CD5 (≥75%), но выполнении остальных критериев Т-лимфобластного лейкоза из ранних предшественников, устанавливается диагноз near-ETP-ALL, что можно перевести как «подобный-ETP-ALL».
Приложение Г3. Основные генетические аномалии при ОЛЛ
Таблица 1. Основные генетические аномалии при ОЛЛ
|
ОЛЛ |
Аномалия |
Вовлеченные гены |
Частота |
Метод детекции |
|---|---|---|---|---|
|
B-клеточный |
t(9;22)(q34;q11) |
BCR::ABL1 |
Взрослые: 30% Дети: 3 % |
ОТ-ПЦР |
|
|
t(12;21)(p33;q22) |
TEL::AML1 |
Взрослые: <1% Дети: 20% |
ОТ-ПЦР |
|
|
t(4;11)(q21;q23) |
MLL::AF4 |
Взрослые: 5% Дети младшего возраста: 60% |
ОТ-ПЦР |
|
|
t(l;19)(q23;p33) |
E2A::PBX1 |
5% |
ОТ-ПЦР |
|
|
t(8;14)(q24;q32) |
c-MYC::IgH |
1% |
FISH |
|
|
t(17;19)(q22;p33) |
E2A::HLF |
<1% |
ОТ-ПЦР |
|
|
t(11;19)(q23;p33) |
MLL::ENL |
<1% |
ОТ-ПЦР |
|
|
|
Мутации генов JAK1/2/3 |
10% |
Секвенирование |
|
T-клеточный |
t(10;14)(q24;q11) t(7;10)(q34;q24) |
HOX11::TCRA/B HOX11::TCRP |
Взрослые: 31% Дети: 7% |
ОТ-ПЦР |
|
|
t(5;14)(q35;q32) |
HOX11L2::TCRA/B |
Взрослые: 13% Дети: 20% |
ОТ-ПЦР, FISH |
|
|
t(l;14)(p32;q11) |
TALI::TCRA/B |
1-3% |
ОТ-ПЦР |
|
|
Нормальный lp32 |
SILTALI |
9-30% |
ОТ-ПЦР |
|
|
inv(7)(pl5q34), t(7;7) |
Гены HOXA TCRP |
5% |
FISH, ОТ-ПЦР |
|
|
t(10;11)(p33;q14-21) |
CALM::AF10 |
10% |
FISH |
|
|
t(9;9)(q34;q34) |
NUP214::ABL1 |
6% |
FISH |
|
|
t(9;14)(q34;q34) |
EML1::ABL1 |
<1% |
FISH |
|
|
Мутации NOTCH 1 |
NOTCH1 |
50% |
Секвенирование |
|
|
Мутации JAK1 |
JAK1 |
18% |
Секвенирование |
Приложение Г4. Расчет трансплантационного риска по шкале EBMT
Оценка трансплантационного риска проводится не более чем за 10 дней до начала предтрансплантационного кондиционирования [218].
|
Факторы риска |
Характеристика факторов риска |
Баллы |
|---|---|---|
|
Возраст |
<20 лет |
0 |
|
20-40 лет |
1 |
|
|
>40 лет |
2 |
|
|
Статус заболевания1 |
Ранний |
0 |
|
Промежуточный |
1 |
|
|
Развернутый |
2 |
|
|
Время от постановки диагноза до ТГСК2 |
<12 мес |
0 |
|
≥12 мес |
1 |
|
|
Донор |
HLA-идентичный сиблинг |
0 |
|
Неродственный донор |
1 |
|
|
Пол донора и реципиента |
Донор – женщина, реципиент – мужчина |
1 |
|
Другие сочетания |
0 |
|
|
1 Не применяется у пациентов с АА. Ранний – острый лейкоз в ПР1; МДС в ПР1 или без предшествующего лечения; ХМЛ в 1 хронической фазе; НХЛ нелеченная или в ПР1; ММ нелеченная или в ПР1. Промежуточный – острый лейкоз в ПР2; ХМЛ за исключением хронической фазы 1 и БК; МДС в ПР2 или ЧР; НХЛ в ПР2, ЧР или стабилизация заболевания; ММ в ПР2, ЧР или стабилизация заболевания. Развернутый – острый лейкоз в других стадиях кроме ПР1 и ПР2; ХМЛ в БК; МДС во всех других стадиях; НХЛ во всех других стадиях; ММ во всех других стадиях. 2 Не применяется у пациентов в ПР1. |
||
Пятилетняя летальность (%), связанная с трансплантацией, согласно шкале риска EBMT
|
Баллы |
0 |
1 |
2 |
3 |
4 |
5 |
6–7 |
|---|---|---|---|---|---|---|---|
|
ОМЛ |
14 |
20 |
25 |
30 |
36 |
40 |
41 |
|
ОЛЛ |
15 |
23 |
24 |
30 |
40 |
47 |
53 |
|
ХМЛ |
15 |
22 |
30 |
38 |
45 |
52 |
55 |
|
АА |
18 |
26 |
40 |
49 |
52 |
– |
– |
|
МДС |
25 |
28 |
30 |
35 |
38 |
46 |
50 |
|
ММ |
– |
– |
29 |
35 |
40 |
42 |
52 |
|
НХЛ |
15 |
24 |
28 |
30 |
34 |
36 |
38 |
Приложение Г5. Расчет трансплантационного риска по шкале HCT-CI
Оценка трансплантационного риска проводится при первичном рассмотрении пациента в качестве кандидата на проведение алло-ТГСК и повторно не более чем за 10 дней до начала предтрансплантационного кондиционирования [219,220].
Низкий риск – 0 баллов.
Промежуточный риск – 1-2 балла.
Высокий риск – 3-4 балла.
Крайне высокий – 5 и более баллов.
|
Статус |
Баллы |
|---|---|
|
Дыхательная система |
|
|
ОФВ1 66-80% или одышка при небольшой физической нагрузке |
2 |
|
ОФВ1 ≤65% или одышка в покое или потребность в кислородной поддержке |
3 |
|
Сердечно-сосудистая система |
|
|
Мерцательная аритмия или трепетание предсердий, синдром слабости синусового узла или желудочковые аритмии |
1 |
|
Ишемическая болезнь сердца, застойная сердечная недостаточность, инфаркт миокарда или фракция выброса менее 50% |
1 |
|
Пороки сердца за исключением пролапса митрального клапана |
1 |
|
ЖКТ |
|
|
Хронический гепатит, билирубин до 1,5 норм или АЛТ либо АСТ до 2,5 норм |
1 |
|
Цирроз, билирубин более 1,5 норм или АЛТ либо АСТ более 2,5 норм |
3 |
|
Болезнь Крона или язвенный колит |
1 |
|
Язвенная болезнь, требующая лечения |
2 |
|
Нарушение обмена |
|
|
Сахарный диабет, требующий лечения |
1 |
|
Индекс массы тела >35 кг/м2 |
1 |
|
Неврологический статус |
|
|
Транзиторная ишемическая атака или острое нарушение мозгового кровообращения в анамнезе |
1 |
|
Психический статус |
|
|
Депрессия или тревога, требующие консультации врача-психиатра или лечения |
1 |
|
Мочевыделительная система |
|
|
Концентрация креатинина сыворотки >176 мкмоль/л, диализ или почечный трансплантат |
2 |
|
Системные заболевания |
|
|
Системная красная волчанка, ревматоидный артрит, полимиозит и другие болезни соединительной ткани, требующие лечения |
2 |
|
Инфекции |
|
|
Инфекционные осложнения, требующие терапии до и после трансплантации |
1 |
|
Онкологические заболевания |
|
|
Любые опухоли в анамнезе, кроме рака кожи (исключая меланому) |
3 |
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.