Ожирение у детей
 Версия: Клинические рекомендации РФ 2024 (Россия)
Версия: Клинические рекомендации РФ 2024 (Россия)
Общая информация
Краткое описание
- Российская ассоциация эндокринологов
- Общество бариатрических хирургов
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968 с изменения, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 января 2024 года – с 1 января 2025 года.
Возрастная категория: Дети
Пересмотр не позднее: 2026
Определение заболевания или состояния (группы заболеваний или состояний)
Ожирение – это гетерогенная группа наследственных и приобретенных заболеваний, связанных с избыточным накоплением жировой ткани в организме [1,2]
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
E66.0 Ожирение, обусловленное избыточным поступлением энергетических ресурсов
E66.1 Ожирение, вызванное приемом лекарственных средств
E66.2 Крайняя степень ожирения, сопровождающаяся альвеолярной гиповентиляцией
E66.8 Другие формы ожирения
E66.9 Ожирение неуточненное
E67.8 Другие уточненные формы избыточности питания
Примеры:
(Е66.0) Конституционально-экзогенное ожирение III степени. Дислипидемия. Нарушение толерантности к глюкозе.
(Е89.3) Краниофарингиома, состояние после удаления. Гипоталамическое морбидное ожирение. Гипопитуитаризм.
(Е66.8) Моногенное ожирение, обусловленное дефицитом проопиомеланокортина II степени. Вторичная надпочечниковая недостаточность.
(Е67.8) Синдром Прадера-Вилли: ожирение III степени, задержка психомоторного развития. Состояние после орхидопексии (05.2013). Дислипидемия.
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Классификация ожирения у детей (В.А Петеркова, О.В. Васюкова, 2014 [1,2]):
-
По этиологии:
простое (конституционально-экзогенное, идиопатическое) — ожирение, связанное с избыточным поступлением калорий в условиях гиподинамии и наследственной предрасположенности;
гипоталамическое — ожирение, связанное с наличием и лечением опухолей гипоталамуса и ствола мозга, лучевой терапией опухолей головного мозга и гемобластозов, травмой черепа или инсультом;
ожирение при нейроэндокринных заболеваниях (гиперкортицизме, гипотиреозе и др.);
ожирение ятрогенное (вызванное длительным приемом кортикостероидов, антидепрессантов и других препаратов);
моногенное ожирение — вследствие мутаций генов лептина, рецептора лептина, рецепторов меланокортинов 3-го и 4-го типа, проопиомеланокортина, проконвертазы 1-го типа, рецептора нейротрофического фактора — тропомиозин-связанной киназы B, см. табл.2);
синдромальное ожирение (при хромосомных нарушениях, заболеваниях вследствие геномного импринтинга, других генетических синдромах — Прадера—Вилли, хрупкой X-хромосомы, Альстрема, Кохена, Дауна, при псевдогипопаратиреозе и др.; см. табл.3).
-
По наличию осложнений и коморбидных состояний:
нарушения углеводного обмена (нарушение толерантности к глюкозе, нарушение гликемии натощак, инсулинорезистентность, сахарный диабет),
неалкогольная жировая болезнь печени (жировой гепатоз и стеатогепатит как наиболее часто встречающиеся у детей состояния),
дислипидемия,
артериальная гипертензия,
задержка полового развития,
ускоренное половое развитие,
синдром гиперандрогении,
синдром апноэ-гипопноэ,
нарушения опорно-двигательной системы (болезнь Блаунта, остеоартрит, спондилолистез и др),
желчнокаменная болезнь
-
По степени ожирения:
SDS ИМТ 2.0 – 2.5 ¾ I степень
SDS ИМТ 2.6 – 3.0 ¾ II степень
SDS ИМТ 3.1 – 3.9 ¾ III степень
SDS ИМТ ≥ 4.0 ¾ морбидное
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Ожирение относится к многофакторным заболеваниям, возникающим в результате определенного взаимодействия генетических и негенетических причин. Роль “наследственности“ в развитии ожирения доказывается разной частотой встречаемости данного заболевания в различных этнических группах и более высокой конкордантностью в развитии патологии у однояйцовых близнецов.
Самый частый вид ожирения, связанный с избыточным поступлением калорий в условиях гиподинамии и наследственной предрасположенности - конституционально-экзогенное (простое, идиопатическое) ожирение.
Наиболее масштабное на сегодняшний день исследование по изучению генетического влияния на величину ИМТ (Genetic Investigation of Anthropometric Traits-GIANT), основанное на геномном анализе ассоциаций, выявило 97 хромосомных участков, связанных с развитием ожирения. Суммарно аллели данных сегментов хромосом объясняют от 2,5 до 20% общей вариабельности ИМТ [3]. Кроме того, сравнительный анализ результатов исследования отдельно для детей и взрослых показал обширное перекрытие аллелей риска для избыточной массы тела и ожирения во всех группах, так что на сегодняшний день нет молекулярно-генетического объяснения раннего и позднего дебюта ожирения [4,5]. Таким образом, простое ожирение является полигенным заболеванием. Однако при этом, по современным представлениям, вклад каждого из генов в предрасположенность к ожирению относительно невелик.
Перспективными выглядят современные исследования особенностей количественного и качественного развития самой жировой ткани ¾ как бурой, так и белой, гормонов и секретируемых ею активных веществ.
С учетом особенностей развития современного общества среди основных факторов риска развития избыточной массы тела и ожирения можно выделить несбалансированное питание, дефицит физической активности, отсутствие режима питания и отдыха, эмоциональные нагрузки, влияние образования и семейных традиций, изменения микробиоценоза кишечника, социальные влияния (агрессивная реклама нездорового питания). Таким образом, несмотря на то, что конституционально-экзогенное ожирение является заболеванием с наследственной предрасположенностью, вероятность его развития и степень проявления во многом зависят от образа жизни и характера питания.
Генетическая составляющая является определяющей для моногенных и некоторых синдромальных форм ожирения [6]. Значительно реже ожирение в детском и подростковом возрасте связано с применением лекарственных препаратов (например, глюкокортикостероидов, антидепрессантов, нейролептиков (антипсихотиков), противоэпилептических препаратов) или наличием заболеваний (опухолей гипоталамуса и ствола мозга, лучевой терапией опухолей головного мозга и гемобластозов, травмой черепа, инсультом, гиперкортицизмом, гипотиреозом и др. нейроэндокринными заболеваниями, хромосомными нарушениями).
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Распространенность детского ожирения в мире стремительно увеличивается в течение последних 40 лет, приобретая эпидемический тренд. Так, распространенность ожирения у девочек в период с 1975 по 2016 г. увеличилась с 0,7 до 5,6%; у мальчиков – с 0,9 до 7,8%, а общее число детей с ожирением в мире к 2016 г. достигло 124 млн. [7].
Одной из самых негативных тенденций можно назвать увеличение числа избыточной массы тела у детей младшего возраста. По оценке ВОЗ, существующие тренды могут обусловить наличие ожирения у 70 млн детей до 5 лет к 2025 году [8].
По результатам национального популяционного исследования, включившего более 5 тыс. детей в возрасте 5,10 и 15 лет, распространенность избыточной массы тела среди детей составила 19,9%, ожирения – 5,7%. Максимально высокая распространенность избыточной массы тела (28,9%) и ожирения (9,6%) отмечена среди мальчиков 10-летнего возраста; минимальная – в подгруппе девочек 15-летнего возраста (11,5 и 2,2% соответственно) [9].
По данным мета-анализа (65 исследований), включившего более 350 тысяч детей и подростков продемонстрировано, что частота ожирения и избыточной массы тела в РФ составляет 25,3%. Также авторы демонстрируют, что за последние 15 лет число детей с избыточной массой тела и ожирением в РФ имеет тенденцию к увеличению, причем рост обусловлен преимущественно увеличением доли детей раннего и дошкольного возраста [10].
В 2007 году Европейское региональное бюро ВОЗ разработало инициативу по эпиднадзору за детским ожирением (Childhood Obesity Surveillance Initiative – COSI), целью которой является определение причин развития избыточной массы тела, а также разработка и внедрение норм питания и физической активности у детей школьного возраста. Исследование 2017-2018 гг, проведенное в г. Москве в рамках данной инициативы, включившее 2166 детей 7-летнего возраста, выявило наличие избыточной массы тела у 27% мальчиков и 22% девочек, а ожирение ― у 10% и 6% детей соответственно [11].
Принимая во внимание возраст обследуемых, можно утверждать, что общемировые тренды наблюдаются и в нашей стране ― от проблемы ожирения как чаще подросткового состояния мы пришли к проблеме избыточной массу тела у детей дошкольного и младшего школьного возраста.
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клиническая картина определяется этиопатогенетической формой ожирения. Самая многочисленная группа, на долю которой приходится до 98-99% всех случаев ожирения - простое (конституционально-экзогенное, идиопатическое) ожирение. Дебют заболевания чаще всего в возрасте после 5 лет, или в периоде полового созревания. Как правило, ожирение прогрессирует постепенно, на фоне хороших (часто ускоренных) темпов роста. Наличие стрий, фолликулярного кератоза, полифагии, черного акантоза, артериальной гипертензии и др. не всегда коррелирует со степенью ожирения. Характерно наличие избыточной массы тела и ожирения у родственников (родители, бабушки, дедушки).
Гипоталамическое ожирение в большинстве случаев отличается быстропрогрессирующим характером, развивается после оперативного вмешательства (лучевой терапии), реже ¾ предшествует периоду постановки диагноза. В случае краниофарингиомы для большинства пациентов характерно замедление темпов роста; для глиом - симптомы преждевременного полового развития; неврологические жалобы (головные боли, нарушение зрения) зависят от локализации и прогрессии опухоли. У детей с гипоталамическим ожирением часто отмечаются нарушения ритма сна и бодрствования, и поведенческие нарушения.
Следует особо отметить, что встречающийся в русскоязычной литературе и практике “гипоталамический синдром пубертатного периода” является не гипоталамическим ожирением, а простым конституционально-экзогенным ожирением с коморбидными состояниями.
При моногенных формах ожирение дебютирует в первые месяцы и годы жизни, для большинства синдромальных форм характерна задержка психомоторного развития.
-
Скрининг на наличие моногенных и синдромальных форм ожирения рекомендуется детям с ранним (до 5 лет жизни) ожирением на фоне выраженной полифагии, особенно при наличии выраженного ожирения в семейном анамнезе [1, 6, 12].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Синдромальные формы ожирения характеризуются ранним дебютом ожирения и его быстрым прогрессированием. Для большинства синдромальных форм характерна задержка нервно-психического развития от умеренной до тяжелой степени выраженности, наличие дисморфических признаков и органоспецифических аномалий развития. К настоящему времени изучено не менее 30 синдромов, ассоциированных с ожирением (наиболее известные приведены в табл. 1). Причинами синдромального ожирения могут быть мутации как одного (с. Альстрема, с. Коэна), так и нескольких генов (с. Барде-Бидля), хромосомные перестройки и/или патология импринтинга (с. Прадера-Вилли, наследственная остеодистрофия Олбрайта-Брайцева).
Синдром Прадера-Вилли (СПВ) является самой частой синдромальной формой ожирения и встречается у 1 из 10-30 тыс. новорожденных. Развитие СПВ обусловлено нарушением экспрессии генов отцовской аллели 15-й хромосомы (микроделеция, материнская дисомия, мутации центра импринтинга, хромосомные транслокации). Диагноз можно заподозрить еще пренатально по наличию сниженной двигательной активности плода, а неонатальная гипотония с отсутствием сосательного рефлекса, является настолько значимым клиническим признаком синдрома, что позволяет установить диагноз еще в роддоме, особенно в сочетании с характерными фенотипические стигмами (долихоцефалия, акромикрия, тонкие губы с опущенными вниз углами, миндалевидные глаза, страбизм) и признаками гипогонадизма (гипоплазия наружных половых органов, крипторхизм) у новорожденных [13]. В неонатальном периоде из-за трудностей с кормлением дети с СПВ могут отставать в весе, тогда как с 2-х лет жизни отмечается второй характерный для синдрома период, сопровождающийся избыточным набором веса, повышенной заинтересованностью в пище, гиперфагией, приводящей к морбидному ожирению. Задержка психомоторного развития отмечается практически у всех детей с СПВ. Гипоталамическая дисфункция лежит в основе многих проявлений синдрома (гиперфагия, температурная, болевая дисрегуляция, эндокринопатии, включая дефицит гормона роста, гипогонадизм, гипотиреоз, надпочечниковую недостаточность центрального генеза). ДНК-метилирование при помощи метил-специфической полимеразной цепной реакции (ПЦР) является высоко специфичным методом исследования, позволяющим подтвердить или исключить диагноз СПВ [14].
Синдром Барде–Бидля (СББ) – аутосомно-рецессивное заболевание, характеризующееся ожирением, пигментным ретинитом, полидактилией, умственной отсталостью, гипогонадизмом и почечной патологией (аномалии развития почек, почечная недостаточность). Частота встречаемости данной патологии составляет 1:160 000. По крайней мере 25 различных генов участвуют в развитии СББ, а также в развитии и функционировании цилий (первичных ресничек), которые в основном являются сенсорными органеллами и принимают участие в работе сигнальных путей, включая регуляцию пищевого поведения. СББ считается цилиопатией, а механизмы развития ожирения при СББ до сих пор изучаются [15].
Псевдогипопаратиреоз 1 А типа характеризуется сочетанием резистентности к паратгормону и специфическим фенотипом, названным наследственной остеодистрофией Олбрайта (НОО). НОО объединяет в себе специфические (брахидактилия, подкожные кальцинаты) и неспецифические проявления (ожирение, низкорослость, лунообразное лицо, умственная отсталость). Псевдогипопаратиреоз 1а типа развивается в результате нарушений пострецепторной передачи сигнала от рецептора к клетке и наиболее частой причиной являются инактивирующие мутации гена GNAS, приводящие к снижению экспрессии и функции стимулирующей α-субъединицы G белка (Gas). Заболевание характеризуется аутосомно-доминантным типом наследования. Ген GNAS импринтирован тканеспецифично и Gas образуется в ряде тканей (соматотрофах, гонадах, щитовидной железе, проксимальных почечных канальцах) только с материнского аллеля. В большинстве тканей Gas экспрессируется биаллельно, но даже 50% активности белка может быть недостаточно в некоторых тканях, поэтому развивается фенотип НОО. В силу этих особенностей экспрессии GNAS, если мутация унаследована от матери, то развивается как НОО, так и резистентность к паратгормону (ПТГ), также может отмечаться резистентность к ТТГ, гонадотропным гормонам и соматолиберину [16]. При инактивирующей мутации GNAS отцовской аллели экспрессия Gα с материнской аллели сохранена, поэтому, как правило, развиваются только специфические фенотипические признаки остеодистрофии Олбрайта (см. табл. 1).
В исследовании Edson Mendes de Oliveira et al., где было проведено секвенирование экзома 2548 детям с тяжелым ожирением, где было выявлено 22 ребёнка с генетическими вариантами в гене GNAS. У 16 детей было изучено влияние мутаций GNAS на передачу сигналов с помощью рецептора меланокортина 4 типа (MC4R), который связан с Gas и имеет решающее значение для регуляции аппетита и веса. Gas запускает один из двух путей проведения сигнала от меланокортиновых рецепторов MC2R и MC4R, обеспечивая в первом случае эффекты АКТГ, а во втором способствуя регуляции основного обмена. Регуляция энергетического гомеостаза осуществляется через меланокортиновые рецепторы 4-го типа (MC4R). Все это объясняет механизм развития ожирения при псевдогипопаратиреозе, которое опосредовано резистентностью данных рецепторов [17].
Таблица 1. Синдромальные формы ожирения
|
Синдром |
Генетический дефект, наследование |
Встречаемость |
Ожирение |
Клинические признаки |
Лабораторная и инструментальная диагностика |
|---|---|---|---|---|---|
|
Прадера-Вилли |
Болезнь импринтинга, снижение экспрессии генов отцовской аллели 15q11-q13 (SNURF-SNRPN, MRKN3, MAGEL2, NDN, NPAP1) В основном спорадические случаи |
1:10000 -1:30000 новорожденных |
с 2 лет жизни |
Мышечная гипотония с вялостью сосания, задержка психомоторного развития, Низкий рост, акромикрия, лицевой дисморфизм (долихоцефалия, миндалевидный разрез глаз, гипопигментация, страбизм), гипопигментация, гипоплазия наружных половых органов (крипторхизм у мальчиков) |
Гипогонадизм смешанного генеза (первичный+вторичный), вторичный гипотиреоз, СТГ-дефицит,вторичный гипокортицизм, апноэ сна (при проведении полисомнографии) |
|
Барде-Бидля
|
BBS1(11q13) BBS2 (16q12.2) BBS3(3q11) BBS4(15q24.1) BBS5 (2q31.1) BBS6 (20p12) BBS7 (4q27) BBS8 (14q31) BBS9 (7p14) BBS10(12q21.2) BBS 11 (9q33.1) BBS12 (4q27) BBS13 (17q23) BBS14(12q21.3) BBS15 (2p15) BBS16 (1q43) BBS17 (3p21) BBS18 (10q25) BBS19 (22q12) Аутосомно-рецессивное |
1:135000-1:175000 среди европейского населения
1:13500-16:17500 в изолированных этнических группах и среди населения с высоким процентом близкородственных браков |
с первых лет |
Низкий рост Задержка умственного развития, прогрессирующая потеря зрения (с 7-8 лет жизни), аномалии развития конечностей (синдактилия, брахидактилия, полидактилия) |
Пигментная дистрофия сетчатки, аномалии строения и функции почек, гипогонадизм, нейросенсорная тугоухость |
|
Псевдогипо-паратиреоз 1 А типа |
GNAS (20q13) аутосомно-доминантное наследование |
1:100000 - 1:300000 человек в популяции |
с первых лет |
Низкий рост, задержка умственного развития, лунообразное лицо,короткая шея, брахидактилия, укорочение 4 и 5 карпальных и метакарпальных костей, подкожные эктопические оссификаты |
Гормональная резистентность: - Псевдогипопаратиреоз (высокий уровень паратгормона в крови, гипокальциемия, гиперфосфатемия) - СТГ-дефицит - гипотиреоз - гипогонадизм |
|
Ломкой Х-хромосомы |
FMR1 (Xq27.3) Х-сцепленное наследование |
1:4000 – 1: 8000 человек в популяции |
с первых лет |
Задержка умственного развития, высокий лоб, выступающий подбородок, большие уши, макроорхидизм, расстройства аутистического спектра |
Гипогонадизм |
|
Альстрема |
ALMS1 (2p 13-р14) Аутосомно-рециссивное |
950 пациентов в мире |
с первых лет |
Задержка психомоторного развития, нарушение поведения, нистагм, светобоязнь, снижение зрения с 1 года жизни |
Нейросенсорная тугоухость, дистрофия сетчатки, сахарный диабет 2 типа, дилатационная кардиомиопатия, нефропатия, нейросенсорная тугоухость, гипогонадизм |
|
Боресона-Форсмана-Лемана |
PHF6 (Xq26-27) Х-сцепленное |
около 50 пациентов |
с 6-7 лет, умеренное |
Гипотония, выраженная задержка умственного развития, низкий рост, микроцефалия, гинекомастия большие уши |
Гипогонадизм, эпилепсия |
|
Паллистера (ульнарно- маммарный синдром)
|
TBX3 (12q24.21) Аутосомно-доминантное наследование |
|
|
Дефекты локтевой кости, нарушение развития грудных желез, зубов, задержка полового созревания |
|
|
Коэна |
COH1 (8q22-q23) Аутосомно-рециссивное
|
менее чем 1 000 пациентов |
с 8-10 лет, умеренное |
Гипотония, сниженный интеллект, выступающие передние резцы, микроцефалия, прогрессирующее снижение зрения, гипермобильность суставов |
Пигментная дистрофия сетчатки, нейтропения, гипогонадизм
|
|
Карпентера |
RAB23 |
1:1000000 |
|
«Башенная» форма черепа, синдактилия, полидактилия, гипогонадизм, сниженный интеллект |
|
Моногенные формы ожирения встречаются крайне редко, отличаются ранним дебютом (с первых месяцев жизни – до 1 года), полифагией. Для большинства пациентов характерно нормальное нервно-психическое развитие (см. табл. 2). Моногенные формы ожирения развиваются из-за мутации одного из генов, кодирующих белки лептин-меланокортиновой системы. Эта система является ключевой в регуляции пищевого поведения и энергетического обмена, активируется лептином (LEP), который секретируется адипоцитами, но свое действие оказывает через лептиновый рецептор (LEPR) аркуатных ядер гипоталамуса, приводя к активации проопиомеланокортина (ПОМК). Под воздействием фермента конвертазы прогормона 1 (КП1) из ПОМК образуются адренокортикотропный гормон (АКТГ) и α-меланоцитстимулирующий гормон (α-МСГ), который в свою очередь активирует рецептор МС4R в паравентрикулярных ядрах, что приводит к сигнализации о насыщении. Фермент КП 1 расщепляет прогормоны в парах основных аминокислот, оставляя С-терминальные основные остатки, которые удаляет карбоксипептидаза Е (КПЕ). Нейротрофический фактор головного мозга (BDNF) и его рецептор (TrkB) также участвуют в регуляции сигнального пути MC4R, а ген SIM 1 (single-minded homolog 1) кодирует транскрипционный фактор, участвующий в развитии супраоптичексих и паравентрикулярных ядер [15].
Таблица 2. Моногенные формы ожирения
|
Дефицит |
Тип мутации, наследование |
Встречаемость |
Ожирение |
Клинические признаки |
Лабораторная и инструментальная диагностика |
|---|---|---|---|---|---|
|
Лептина (LEP) |
Гомозиготная мутация Аутосомно-рецессивное
|
менее чем у 100 пациентов в мире |
Выраженное ожирение с первых дней жизни |
Частые респираторные заболевания (иммунодефицит с дефицитом Т-клеточного звена) |
Вторичный гипотиреоз, гипогонадотропный гипогонадизм, низкий или неопределяемый уровень лептина (гиполептинемия), гиперинсулинемия |
|
Рецептора лептина (LEPR) |
Гомозиготная мутация Аутосомно-рецессивное |
у 2-3% пациентов с ранним ожирением |
Выраженное ожирение с первых дней жизни |
Частые респираторные заболевания (иммунодефицит с дефицитом Т-клеточного звена) |
Вторичный гипотиреоз, гипогонадотропный гипогонадизм, гиперлептинемия, гиперинсулинемия |
|
Проопиомеланокортина (РОМС) |
Гомозиготная или компаундная гетерозиготная мутация Аутосомно-рецессивное |
менее чем у 10 пациентов в мире |
Выраженное ожирение с первых месяцев жизни |
Гипопигментация (рыжий цвет волос)
|
Вторичный гипотиреоз, гипогонадотропный гипогонадизм, гипокортицизм, возможен гипогликемический синдром |
|
Прогормонконвертазы 1 типа (PCSK1) |
Гомозиготная или компаундная гетерозиготная мутация Аутосомно-рецессивное или доминантное наследование |
менее чем у 20 пациентов в мире |
Выраженное ожирение с первых месяцев жизни |
Тяжелая мальабсорбция в неонатальном периоде, полиурия, полидипсия |
Вторичный гипотиреоз, гипогонадотропный гипогонадизм, гипокортицизм (повышенные уровни POMC, низкое содержание АКТГ), СТГ-дефицит, постпрандиальная гипогликемия (повышенный уровень проинсулина и низкое содержание инсулина в плазме), центральный несахарный диабет |
|
SIM 1 |
Транслокация хромосомы 1р22.1 и 6q16.2 гена SIM 1 Аутосомно-доминантное наследование |
менее чем у 50 пациентов в мире |
Выраженное ожирение первых месяцев жизни |
Задержка развития, психоневрологические расстройства (эмоциональная лабильность, расстройства аутистического спектра). Артериальная гипотония. Встречаются признаки СПВ (неонатальная гипотония, дисморфия, низкий рост) |
Возможно наличие эндокринопатий: вторичный гипотиреоз, гипогонадотропный гипогонадизм, СТГ-дефицит |
|
Нейротрофического фактора головного мозга (BDNF) и его рецептора –тирозинкиназы В (NTRK2) |
Гетерозиготная мутация de novo Аутосомно-доминантное наследование |
менее чем у 10 пациентов в мире |
Выраженное ожирение с первых месяцев жизни |
Задержка моторного и психо-речевого развития, гиперактивность, нарушение концентрации внимания и краткосрочной памяти, низкая болевая чувствительность |
|
|
Src-подобного адаптерного белка 2 (SH2B1)
|
Гетерозиготная мутация Аутосомно-доминантное наследование |
|
Выраженное ожирение с первых лет жизни |
Низкий конечный рост, задержка психоречевого развития, агрессивное поведение |
Выраженная инсулинорезистентность |
|
Киназы супрессора белков Ras 2 типа (KSR2) |
Гетерозиготная мутация Аутосомно-доминантное наследование |
около 65 пациентов в мире |
Выраженное ожирение с первых месяцев жизни |
Брадикардия |
Выраженная инсулинорезистентность, сниженный основной обмен |
|
Tubby-образного белка (TUB) |
Гомозиготная мутация Аутосомно-рецессивное наследование |
3 сибса |
с первых месяцев жизни |
Нарушение зрения (снижение остроты), ночная слепота, тугоухость |
Пигментная дистрофия сетчатки |
|
Карбоксипептидазы (CPE) |
Гомозиготная Мутация |
|
|
Задержка умственного развития |
Сахарный диабет 2 типа, гипогонадотропный гипогонадизм |
|
Рецептора меланокортина 4-го типа (MC4R) |
Гетерозиготная мутация, гомозиготная мутация Аутосомно-доминантное или рецессивное наследование |
у 2-6% детей с ожирением Самая распространенная форма моногенного ожирения |
Выраженное ожирение с первых месяцев жизни |
Ускорение темпов роста или высокорослость |
Повышенное содержание «тощей массы» и минеральной плотности костей Гиперинсулинемия Артериальная гипотония |
Дефицит лептина
Врожденный дефицит лептина — редкий синдром, характеризующийся морбидным ожирением с первых месяцев жизни на фоне выраженной гиперфагии и низким, неопределяемым уровнем лептина. Для этих пациентов характерен гипогонадотропный гипогонадизм, дефицит гормона роста, гипотиреоз центрального генеза, также дети с дефицитом лептина часто болеют респираторными инфекционными заболеваниями из-за гипофункции Т-клеток.
Дефицит рецептора лептина
Характеризуется схожей с дефицитом лептина клинической картиной, однако отличительным лабораторным признаком этого синдрома является повышенное содержание лептина в сыворотке крови.
Дефицит ПОМК
Сочетание быстропрогрессирующего морбидного ожирения, повышенного аппетита и надпочечниковой недостаточности с неопределяемыми в сыворотке крови уровнями кортизола и АКТГ характерны для дефицита проопиомеланокортина. Дефицит ПОМК приводит к гиперфагии и раннему развитию ожирения из-за потери передачи сигнала меланокортина на рецептор меланокортина-4 (MC4R). В постнатальном периоде жизни у новорожденного развивается надпочечниковая недостаточность (вторичная, из-за дефицита АКТГ, поскольку ПОМК — его предшественник) с характерной гипогликемией, длительной желтухой, предрасположенностью к тяжелым инфекциям. Из- за отсутствия воздействия меланоцитостимулирующего гормона (МСТ) на рецепторы меланокортина-1 у большинства таких детей бледная кожа и рыжие волосы.
Дефицит конвертазы прогормона 1 (КП 1)
Мутации в этом ферменте приводят к нарушению расщепления множества прогормонов, таких как, прогонадотропин-рилизинг-гормон, проинсулин, протиротропин-рилизинг-гормон, ПОМК, способствуя развитию СТГ-дефицита, вторичного гипокортицизма, гипотиреоза, гипогонадизма. Неспособность расщеплять ПОМК — вероятный механизм развития ожирения у таких пациентов. Интестинальная дисфункция и постпрандиальная гипогликемия объясняются нарушением созревания гастрина, глюкагона, глюкагоно-подобного пептида-1 и инсулина (повышено содержание проинсулина) при дефиците КП 1.
Дефицит нейротрофического фактора головного мозга (BDNF) и его рецептора (TrkB)
Развитие и дифференцировка нейронов центральной и периферической нервной системы зависит от нейротрофических факторов (нейротрофинов), которые секретируются тканями-мишенями. Сигналинг нейротрофинов осуществляется через специфическую активацию рецепторов тирозинкиназы В. Гетерозиготная мутация в гене NTRK2, кодирующего тирозинкиназу В (TrkB) была выявлена у 8-летнего мальчика с выраженной задержкой развития (снижение краткосрочной памяти, стереотипное поведение), нарушением болевой чувствительности и тяжелым ожирением.
Мутация в гене SIM1
De novo транслокация между 1-й и 6-й хромосомами была обнаружена у девочки, имевшей массу тела 47 кг в возрасте 5,5 лет [18]. Мутация приводит к разрыву в SIM1 гене, человеческом гомологе Drosophila Single-minded (Sim) гена, регулирующего нейрогенез. SIM1 ген кодирует транскрипционный фактор, вовлеченный в формирование паравентрикулярного и супраоптического ядер. Делеция области 6q16.2-6q16.3 выявлена у пациентов с ожирением и наличием фенотипа СПВ [19].
Дефицит MC4R
Мутации гена MC4R — самая частая моногенная причина ожирения. Пациенты с дефицитом MC4R характеризуются повышенным аппетитом, ожирением в сочетании с высокими темпами роста. Наряду с избытком жировой массы при мутациях гена MC4R характерно увеличение количества тощей массы и минеральной плотности костей, поэтому такие люди часто кажутся «ширококостными». У больных с дефицитом MC4R отмечаются более высокие концентрации инсулина натощак по сравнению с детьми аналогичного возраста, пола и ИМТ. Гомозиготные мутации встречаются намного реже гетерозиготных, и отличаются более выраженной клинической симптоматикой [20]. У взрослых пациентов отмечается менее выраженная гиперфагия, гиперинсулинемия, чем у детей с аналогичной мутацией.
Нейроэндокринные заболевания являются редкими причинами ожирения в детском возрасте и отличаются характерными клиническими признаками. Так, для гиперкортицизма характерно снижение темпов роста наряду с прогрессирующим ожирением, тогда как появления сухости кожных покровов, непереносимости холода, быстрой утомляемости может свидетельствовать о наличии гипотиреоза.
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния:
В качестве диагностического критерия избыточной массы тела и ожирения у детей рекомендовано определение величины стандартных отклонений индекса массы тела (SDS ИМТ).
С учетом рекомендаций ВОЗ, ожирение у детей и подростков от 0 до 19 лет следует определять, как ИМТ, равный или более +2,0 SDS ИМТ, а избыточную массу тела от +1,0 до +2,0 SDS ИМТ. Нормальная масса тела диагностируется при значениях ИМТ в пределах ± 1,0 SDS ИМТ [1, 21, 22].
На сайте ВОЗ представлены новые нормативные значения роста и веса для детей в виде таблиц и кривых для возраста 0 ― 5-ти лет (http://who.int/childgrowth/standards/ru/) и для возраста 5 ― 19 лет (https://www.who.int/tools/growth-reference-data-for-5to19-years/indicators/bmi-for-age) (см. приложение Г1, Г2).
Кроме этого, для диагностики избыточной массы тела и ожирения у детей могут использоваться программные средства ВОЗ Anthro (для возраста 0 – 5 лет) и AnthroPlus (для возраста 5 – 19 лет) для персональных компьютеров (https://www.who.int/tools/growth-reference-data-for-5to19-years/application-tools).
Поскольку непосредственно оценить количество жировой ткани в организме сложно, наиболее информативным является определение ИМТ, который рассчитывается как отношение массы тела в килограммах к квадрату роста человека, выраженному в метрах. Доказано, что ИМТ коррелирует с количеством жировой ткани в организме как у взрослых, так и у детей. Согласно критериям ВОЗ, у взрослых нормальной массе тела соответствует ИМТ 18,5—24,9, ИМТ 25—29,9 — избыточному весу, а ожирение диагностируется при ИМТ выше 30. Критерии избыточной массы тела у детей определяются по данным перцентильных таблиц или стандартных отклонений ИМТ (SDS — standard deviation score). В них учитывается не только рост, вес, но также пол и возраст ребенка. Это связано с тем, что значение ИМТ у детей меняется с развитием ребенка: от высокого в первый год жизни, сниженного в период раннего детства (2—5 лет) и постепенно увеличивающегося в период полового развития, что в целом отражает динамику жировой ткани.
Данные нормативы объединяет общий принцип: перцентили должны быть симметричны относительно медианы (50-й перцентили). ВОЗ пользуется стандартными отклонениями –1, –2, –3 SDS, медиана и +1, +2, +3 SDS.
1. Жалобы и анамнез
При сборе анамнеза выявляют вес при рождении, возраст дебюта ожирения, психомоторное развитие, наследственный анамнез по ожирению (включая рост и вес родителей), сахарному диабету 2 типа и сердечно-сосудистым заболеваниям, динамику роста и веса, наличие неврологических жалоб (головные боли, нарушение зрения), храпа (≥ 3 ночей в неделю), остановок дыхания во сне.
2. Физикальное обследование
-
Всем детям с ожирением и избыточной массой тела для определения наличия и степени ожирения рекомендуется проводить измерения роста, SDS роста, веса с расчетом SDS ИМТ, окружности талии, оценивать характер распределения подкожной жировой клетчатки.[1, 22, 23, 24, 25, 26].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
-
Всем детям с ожирением и избыточной массой тела для выявления артериальной гипертензии рекомендуется проводить измерение артериального давления на периферических артериях (АД) и оценивать его с учетом пола, возраста и роста [1, 12, 23, 27, 28]:
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
-
Для диагностики наличия артериальной гипертензии, выявленной при обычном измерении, рекомендуется проведение суточного мониторирования АД [23,27,28].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии:
Измерение и последующая оценка артериального давления (АД) проводится согласно “Клиническим рекомендациям по артериальной гипертензии у детей” МЗ РФ и рекомендациям по диагностике, лечению и профилактике артериальной гипертензии у детей и подростков, разработанными экспертами ассоциаций детских кардиологов России и Российского медицинского общества по артериальной гипертонии [27,28].
У детей и подростков выделяют: нормальное АД, высокое нормальное АД и артериальную гипертензию 1 и 2 степени. Оценка уровней АД проводится с использованием перцентильных таблиц, учитывающих пол, возраст и рост пациентов
Нормальное АД – систолическое (САД) и диастолическое артериальное давление (ДАД), уровень которого ≥10-го и <90-го процентиля кривой распределения АД в популяции для соответствующего возраста, пола и роста.
Высокое нормальное АД – САД и/или ДАД, уровень которого ≥90-го и <95-го процентиля кривой распределения АД в популяции для соответствующего возраста, пола и роста или ≥120/80 мм. рт.ст. (даже если это значение <90-го процентиля).
Артериальная гипертензия определяется как состояние, при котором средний уровень САД и/или ДАД, рассчитанный на основании трех отдельных измерений ≥значения 95-го процентиля кривой распределения АД в популяции для соответствующего возраста, пола и роста.
Если уровни САД и ДАД попадают в разные категории, то степень АГ устанавливается по более высокому значению одного из этих показателей.
У детей и подростков выделяют 2 степени АГ:
1 степень – средние уровни САД и/или ДАД из трех измерений равные или превышающие значения 95-го процентиля, установленные для данной возрастной группы, при условии, что они превышают 99-й процентиль не более чем на 5 мм рт.ст.
2 степень (тяжелая) – средние уровни САД и/или ДАД из трех измерений, превышающие значения 99-го процентиля более чем на 5 мм рт.ст., установленные для данной возрастной группы.
-
Всем детям с ожирением и избыточной массой тела для скрининга ассоциированных с ожирением заболеваний рекомендуется определять наличие и характер стрий, фолликулярного кератоза, acanthosis nigricans, андрогензависимой дермопатии (у девочек – гирсутим, акне, жирная себорея) [1, 12, 23, 24]:
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
-
Всем детям с ожирением и избыточной массой тела для объективной оценки состояния ребенка рекомендуется оценивать стадию полового развития по шкале Таннера (Приложение Г3) [1,12,23,24]:
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
-
Всем детям с ожирением и избыточной массой тела для выявления генетических синдромов, ассоциированных с ожирением, рекомендуется выявлять характерные специфические фенотипические особенности (см. табл. 2) [1,12,23,25]:
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
3. Лабораторные диагностические исследования
-
Всем пациентам с ожирением с целью скрининга осложнений рекомендовано выполнение анализа крови биохимического общетерапевтического для выявления нарушений липидного обмена, с определением активности аланинаминотрансферазы (АлАТ) и аспартатаминотрансферазы (АсАТ) в крови в сочетании с ультразвуковым исследованием органов брюшной полости (печени) [23,27,28, 29,30].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии:
Для диагностики дислипидемии у всех определяют уровень общего холестерина, уровни холестерина липопротеидов высокой и низкой плотности, триглицеридов в крови. Установлены критерии оптимальных, повышенных, высоких и низких значений липидов и липопротеидов у детей и подростков (см. табл. 3)
Диагноз дислипидемии устанавливается при наличии 2-х и более “высоких” и/или “низких” показателей:
-
Холестерин ³ 5,2 ммоль/л
-
Триглицериды >1,3 (для детей до 10 лет); ³ 1,7 (для детей старше 10 лет) ммоль/л
-
ЛПВП ≤ 0,9 (мальчики) и ≤ 1,03 (девочки) ммоль/л
-
ЛПНП ³ 3,0 ммоль/л
Таблица 3. Классификация уровней липидов и липопротеидов сыворотки крови у детей и подростков [31,32]
|
Показатели |
Уровни липидов и липопротеидов сыворотки крови |
|||
|
Оптимальные |
Повышенные |
Высокие |
низкие |
|
|
ниже 75 перцентиля |
75-95 перцентиль |
выше 95 перцентиля |
ниже 10 перцентиля |
|
|
Холестерин общий, ммоль/л |
< 4,4 |
4,4 - 5,1 |
³ 5,2 |
|
|
ТГ, ммоль/л 0 - 9 лет 10 - 19 лет |
< 0,85 < 1,0 |
0,85 - 1,12 1,0 - 1,46 |
³ 1,13 ³ 1,47 |
|
|
ХС ЛНП, ммоль/л |
< 2,85 |
2,85 - 3,34 |
³ 3,35 |
|
|
ХС ЛВП, ммоль/л |
> 1,2 |
1 - 1,2 |
|
< 1 |
Исследование активности АлАТ и АсАТ в сочетании с ультразвуковым исследованием печени рекомендуется всем пациентам с ожирением для скрининга неалкогольной жировой болезни печени. Жировой гепатоз имеют 25-45% подростков с ожирением; с длительностью ожирения может прогрессировать и поражение печени: стеатогепатит, фиброз, цирроз. Так, в США неалкогольная жировая болезнь печени является наиболее частой причиной развития цирроза у подростков и самой частой причиной для трансплантации печени у взрослых [33].
Активность АлАТ, превышающая верхнюю границу нормы, установленной для данной лаборатории, у детей с признаками НАЖБП по УЗИ при отсутствии других причин синдрома цитолиза (вирусные, метаболические поражения печени и др.) расценивается как проявление стеатогепатита [29]. В сомнительных случаях достоверная диагностика неалкогольного стеатогепатита возможна только после морфологического исследования ткани печени.
-
Всем пациентам с ожирением старше 10 лет для выявления нарушений углеводного обмена рекомендовано проведение глюкозотолерантного теста (ОГТТ) с определением глюкозы натощак и через 120 минут [34, 35, 36].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии:
Условия проведения теста: утром натощак, на фоне 8-14 часового голодания, пациент выпивает глюкозу из расчета 1,75 г сухого вещества на 1 кг веса, но не более 75 г, разведенную в 250 мл воды. В течение трех дней до проведения пробы пациенту рекомендуется прием пищи с содержанием углеводов не менее 250—300 г/сутки и обычная физическая активность.
Оценка ОГТТ теста (проводится по уровню глюкозы плазмы крови):
-
Нормогликемия – это уровень глюкозы натощак менее 6,1 ммоль/л и уровень глюкозы через 2 часа стандартного ПГТТ менее 7,8 ммоль/л.
-
Нарушение гликемии натощак: уровень глюкозы натощак составляет 6,1 – 6,9 ммоль/л;
-
Нарушение толерантности к глюкозе: уровень глюкозы через 2 часа ОГТТ соответствует 7,8 – 11,1 ммоль/л.
Диагноз СД у детей выставляется если
-
Уровень глюкозы натощак ³ 7,0 ммоль/л; состояние натощак определяется как отсутствие потребления калорий в течение, по крайней мере, 8 ч.a или
-
Уровень гликемии через 2 часа стандартного ОГТТ ³11,1 ммоль/л, или
-
Имеются классические симптомы сахарного диабета (полиурия, полидипсия, необъяснимое снижение веса) в сочетании со случайным определением гликемии крови ³ 11,1 ммоль/л. “Случайным” считается измерение уровня глюкозы в любое время дня без взаимосвязи со временем приема пищи, или
-
Гликированный гемоглобин (HbA1c) > 6,5% b. Исследование рекомендуется проводить в сертифицированной лаборатории (с использованием метода, одобренного Национальной программой стандартизации гликогемоглобина (National Glycohemoglobin Stadardization Program) и стандартизированного в соответствии с исследованием по контролю за диабетом и его осложнениями (DCCT - Diabetes Control and Complications Trial).
a - При отсутствии явной гипергликемии диагноз СД, поставленный на основании этих критериев, необходимо подтверждать повторными тестами.
b - Уровень менее 6,5% не исключает возможности диагностики СД по уровню глюкозы.
Не целесообразно исследование уровня глюкозы в крови с помощью глюкометров для диагностики нарушений углеводного обмена, так как глюкометры не обладают достаточной точностью для убедительной постановки диагноза и могут привести к ошибкам при диагностике [34].
При клинически манифестном СД проводить ОГТТ не рекомендуется, нарушения углеводного обмена можно диагностировать с помощью показателей гликемии натощак, постпрандиально или в течение дня, исследованием уровня гликированного гемоглобина.
Проведение ОГТТ детям с ожирением, не достигших 10 лет, показано при наличии у ребенка дополнительных факторов риска: клинических признаков инсулинорезистентности (акантоз), гестационного диабета у матери, СД у родственников 1-й и 2-й линии родства, при подозрении на врожденные синдромы, связанные с ранним развитием СД и др. и в каждом случае решается индивидуально [35].
Согласно эпидемиологическим исследованиям, лица с нарушением гликемии натощак и нарушением толерантности к глюкозе составляют группу риска по развитию сахарного диабета 2 типа, а данные нарушения углеводного обмена расцениваются как “предиабет”.
4. Инструментальные диагностические исследования
-
Для скрининга НАЖБП и желчнокаменной болезни у детей и подростков с ожирением рекомендовано проведение ультразвукового исследования органов брюшной полости (комплексного) [1, 29,30,33,37].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии:
Инструментальные методы исследования являются ведущими в установлении диагноза НАЖБП и желчнокаменной болезни. Ультразвуковое исследование помогает выявить стеатоз печени и наличие калькулезного холецистита с достаточно высокой точностью. Диагностическими ультразвуковыми признаками жирового гепатоза являются гепатомегалия, неоднородность паренхимы и ослабление ультразвукового сигнала в дистальных отделах печени, обеднение сосудистого рисунка.
«Золотым стандартом» диагностики НАЖБП является чрескожная биопсия печени под контролем ультразвукового исследования. Однако ее широкое использование, особенно в педиатрической практике ограничено ввиду инвазивности методики.
-
Проведение ночной полисомнографии рекомендуется детям и подросткам с ожирением при клинических признаках синдрома обструктивного апноэ сна (СОАС): повышенная сонливость в дневное время, храп во время сна, остановки дыхания во время сна [1, 12, 23, 26, 38, 39].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3).
-
В качестве альтернативного метода диагностики СОАС у детей и подростков с ожирением рекомендуется проведение кардиореспираторного (респираторного) мониторирования [26,38,39,40].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарии:
Синдром обструктивного апноэ сна (СОАС) характеризуется нарушением дыхания во время сна в виде длительной частичной обструкции верхних дыхательных путей и (или) полной интермиттирующей обструкции (обструктивное апноэ), что вызывает нарушение нормальной легочной вентиляции во сне и снижает качество сна [26]. Избыточное отложение жировой ткани в области глотки, шеи, грудной клетки, брюшной полости, инфильтрация диафрагмы жировой тканью, повышенная миорелаксация во сне, гипертрофия миндалин и аденоидов приводят к развитию синдрома обструктивного апноэ сна [38]. Ожирение является независимым фактором риска СОАС [39]. Частота СОАС у детей с избыточной массой тела и ожирением достигает 38% по сравнению с 3% в общей популяции [40]. СОАС средней и тяжелой степени ассоциирован с повышенным риском сердечно сосудистых заболеваний, метаболических, когнитивных и эмоционально-поведенческих нарушений у детей [41-45].
Ночная полисомнография является «золотым стандартом» диагностики обструктивного апноэ во сне и включает анализ структуры сна и индекса дыхательных расстройств (ИДР; индекс апноэ-гипопноэ) для определения степени тяжести СОАС. Кардиореспираторное (респираторное) мониторирование также регистрируют параметры дыхания и позволяет оценить ИДР, но не включает анализ стадий сна. Поэтому, данное исследование не рекомендовано для пациентов с нарушениями сна [26,38].
5. Иные диагностические исследования
-
Всем детям и подросткам с ожирением и избыточной массой тела рекомендуется проводить оценку фактического питания с использованием метода 24-часового (суточного) воспроизведения питания с помощью пищевого дневника для назначения диетотерапии или ее коррекции [1,12,23].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Оценка статуса питания имеет большую клиническую значимость, так как способствует своевременному выявлению групп риска по развитию ожирения и избыточной массы тела, а также других заболеваний, обусловленных неправильным питанием. Изучение пищевого статуса в клинической практике у детей и подростков полезно как при выборе, так и при оценке эффективности диетотерапии и фармакотерапии.
Для оценки фактического питания и изменений пищевого статуса используются различные методы, в том числе, метод 24-часового (суточного) воспроизведения питания (ведение пищевого дневника) и метод анализа частоты потребления пищи.
Метод регистрации потребляемой пищи посредствам пищевого дневника является наиболее точным и достоверным в оценке фактического питания. К его недостаткам можно отнести трудоемкость метода и влияние на привычное питание пациента.
-
Проведение дополнительных исследований (исследование гормонального профиля, МРТ головного мозга, молекулярно-генетические и цитогенетические методы) у детей и подростков с ожирением рекомендовано только при подозрении на гипоталамическую, синдромальную, эндокринную или моногенную формы ожирения [1, 12, 23, 28].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии:
Гормональные исследования проводятся строго по показаниям.
Исследования уровня тиреотропного гормона (ТТГ) в крови и уровня свободного тироксина (СТ4) сыворотки крови целесообразно при подозрении на гипотиреоз; исследование уровня общего кортизола сыворотки крови, исследование уровня адренокортикотропного гормона (АКТГ) в крови и исследование уровня лептина в крови - при подозрении на моногенное ожирение, связанное с дефицитом проопиомеланокортина, лептина; исследование уровня общего кортизола и АКТГ в крови, суточного ритма их секреции, исследование уровня свободного кортизола в моче, супрессивные тесты с дексаметазоном** при подозрении на эндогенный гиперкортизицм; исследование уровня паратиреоидного гормона, проинсулина в крови – при подозрении на синдромальные формы ожирения – псевдогипопаратиреоз, дефицит проконвертазы 1 типа.
Исследование уровня инсулиноподобного ростового фактора I в крови (ИРФ1) в крови показано при подозрении на гипоталамическое ожирение. Исследование уровня пролактина в крови показано при подозрении на гипоталамическое ожирение, а также при нарушении менструального цикла у девочек. Исследование уровней лютеинизирующего гормона в сыворотке крови, фолликулостимулирующего гормона в сыворотке крови, общего тестостерона, исследование уровня глобулина, связывающего половые гормоны, исследование уровня антимюллерова гормона в крови проводится при синдроме гиперандрогении, дисменорее у девочек и нарушениях полового развития у мальчиков.
Исследование уровня альдостерона в крови, уровня ренина в крови, исследование уровней метанефринов и норметанефринов в моче показано для уточнения генеза впервые выявленной при обследовании пациента с ожирением артериальной гипертензии в зависимости от клинических проявлений.
При подозрении на гипоталамическое ожирение показано проведение МРТ головного мозга.
Определение мутаций в генах, цитогенетическое исследование (кариотип) проводятся при подозрении на моногенное ожирение и синдромальные формы. Особенностью синдромальных форм ожирения является наличие выраженной неврологической симптоматики – задержка психомоторного развития, сниженный интеллект и др. В данном случае желательна консультация врача-невролога, врача-генетика, проведение генетических исследований с учетом клинической картины и фенотипических особенностей.
-
Рутинное определение ТТГ для исключения эндокринных причин ожирения у детей и подростков не рекомендуется [46].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Согласно рекомендациям Европейской Тиреодологической Ассоциации по лечению субклинического гипотиреоза повышение уровня ТТГ у детей и подростков с ожирением в диапазоне от 5 до 7 мЕд/л в подавляющем большинстве случаев является следствием, а не причиной ожирения и не требует назначения гормональной терапии препаратами левотироксина натрия [46].
-
Приёмы (осмотры, консультации) специалистов: врача-кардиолога, врача-акушера-гинеколога, врача-офтальмолога, медицинского психолога, врача-психиатра, врача-сомнолога, врача-оториноларинголога, врача-диетолога и др. рекомендованы детям и подросткам с избыточной массой тела и ожирением при выявлении профильных сопутствующих заболеваний ― артериальной гипертензии, нарушений менструального цикла, депрессии, СОАС и др. [1, 12, 23, 26, 28].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
-
Оценка инсулинорезистентности (ИР) у детей и подростков с ожирением проводится по строгим показаниям и не рекомендуется в рутинной клинической практике [1,12, 23].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: «Золотым стандартом» диагностики ИР являются эугликемический и гипергликемический клэмп, а также внутривенный глюкозотолерантный тест с частыми заборами крови, оцениваемый с помощью минимальной модели Бергмана [47,48].
К сожалению, эти тесты неприменимы в повседневной практике, так как они весьма продолжительны, дорогостоящи и инвазивны, требуют специально обученного медицинского персонала и сложной статистической обработки результатов.
В повседневной практике для оценки ИР при ожирении у детей и подростков наибольшей диагностической значимостью обладают значения стимулированного выброса инсулина и индекса Matsuda, определяемые по данным глюкозотолерантного теста [49]. Для уменьшения инвазивности исследования и снижения риска гемолиза предпочтительна установка внутривенного катетера. Исследование уровня инсулина плазмы крови (ИРИ) и глюкозы в крови проводится натощак, а также через 30, 60, 90 и 120 минут после нагрузки глюкозой с расчетом индекса Matsuda:
Matsuda=10000/√(ИРИ0 х Гл0 х ИРИсред х Глсред),
где ИРИ — иммунореактивный инсулин, мкЕд/мл; Гл — глюкоза, мг/%. ИРИ0, Гл0 — инсулин и глюкоза плазмы натощак; ИРИсред, Глсред — средний уровень инсулина и глюкозы при проведении ОГТТ. Значения индекса ниже 2,6 свидетельствуют о наличие инсулинорезистентности [50,51].
Следует отметить, что ввиду спорности оценки ИР, а также отсутствия на сегодняшний день официально разрешенной эффективной медикаментозной терапии данного состояния, оценка инсулинорезистентности должна проводиться по показаниям и не является обязательной в рутинной клинической практике. К показаниям для проведения глюкозотолерантного теста с оценкой ИР можно отнести наличие у пациента ранее выявленных нарушений углеводного обмена, отягощенный семейный анамнез (по СД 2 типа, гиперандрогении и др.), наличие объективных маркеров инсулинорезистентности - acanthosis nigricans или выраженная гиперпигментация кожных складок шеи, подмышечных или паховой областей, клинические признаки гиперандрогени.
-
Детям и подросткам с ожирением и избыточной массой тела с целью оценки композиционного состава тела рекомендуется, по возможности, определение процентного соотношения воды, мышечной и жировой ткани с помощью биоимпедансометра.[52 -56].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: Биоимпедансный анализ состава тела основан на измерении электрического сопротивления тканей (импеданса) при прохождении через них низкоинтенсивного электрического тока и позволяет оценить количество жировой и тощей массы, а также воды в организме (композиционный состав тела). По точности получаемых результатов биоимпедансный анализ приближается к данным, полученным при проведении рентгеновской денситометрии. Преимуществами метода являются отсутствие лучевой нагрузки и возможность проведения исследований в динамике. Существуют нормативы для оценки исследуемых параметров состава тела в зависимости от пола, возраста и этнической принадлежности, а также вида используемого анализатора [52,53].
Исследование целесообразно для поддержания мотивационной приверженности пациента к лечению, оценке изменения композиционных параметров тела в динамике, но не является обязательным.
-
Для персонификации проводимой диетотерапии детям и подросткам с ожирением и избыточной массой тела рекомендуется, по возможности, исследование показателей основного обмена с помощью метода непрямой респираторной калориметрии [57,58].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: С целью повышения эффективности лечения ожирения у детей и подростков диетологами активно используется определение энерготрат покоя и метаболизма макронутриентов, которые относится к ведущим составляющим персонифицированной диетотерапии. Основным методом исследования основного обмена в настоящее время является непрямая респираторная калориметрия. Данная методика рекомендована Американской ассоциацией диетологов и нутрициологов и Американской академией педиатрии в качестве предпочтительного метода для оценки основного обмена у детей и подростков.
Вместе с тем, учитывая дороговизну метода, необходимость дополнительного обучения врача проведению данного исследования, оценка основного обмена возможна на базе крупных центров с наличием специализированного эндокринологического отделения; не является обязательной.
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Изменение образа жизни (диетотерапия, расширение физической активности и коррекция пищевого поведения) у детей и подростков с ожирением или избыточной массой тела, а также членов их семьи составляют основу терапии ожирения и его профилактики. В случае неэффективности модификации образа жизни возможно использование фармакологических средств, список которых у детей и подростков на сегодняшний день ограничен орлистатом. Бариатрическая хирургия является еще одним методом лечения морбидного осложненного ожирения у подростков.
Целью лечения ожирения у детей и подростков является в краткосрочном периоде удержание значения SDS ИМТ (в течение 6-12 месяцев наблюдения), в долгосрочном периоде ― уменьшение величины SDS ИМТ, достижение “избыточной массы тела” и “нормальной массы тела”, нормальное физическое и соматическое развитие ребенка, развитие самостоятельности и мотивации к самоконтролю пищевого поведения, профилактика ассоциированных с ожирением коморбидных состояний.
1. Диетотерапия
-
Для контроля массы тела у детей и подростков с ожирением и избыточной массой тела рекомендовано формирование и поддержание норм рационального питания с учетом возрастных особенностей [12,57, 59, 60, 61].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Современный тренд в диетологии детского ожирения ― нормокалорийный рацион по возрасту с достаточным количеством белков, углеводов, витаминов и микроэлементов и необходимым минимумом жиров, составленный с учетом вкусовых предпочтений ребенка.
Все виды диет ― гипокалорийная, кетогенная, низкожировая, со сниженным гликемическим индексом и др. являются альтернативными вариантами терапии, применяются по показаниям и часто в условиях специализированных отделений.
Это связано с несколькими факторами. Во первых, актуальные исследования показали, что длительное применение рестриктивных диет приводит к нарушениям пищевого статуса, что нежелательно у детей. Во вторых, исходный уровень суточной калорийности рациона у детей и подростков с ожирением достаточно высокий, и резкое ограничение его сопровождается усилением чувства голода, что приводит к срыву мотивации, невыполнению данных рекомендаций и потере комплаентности.
Необходимые условия эффективного лечения:
-
ограничение сладких напитков: запрет (потребление не более 1 порции не чаще чем 1 раз в неделю) не только газированных сладких напитков, но и соков, компотов, морсов) с разрешением приема питьевой воды по желанию ребенка,
-
ограничение сладких фруктов до 1 порции (100 г) в день,
-
как минимум 4-х разовое питание, обязательный завтрак,
-
запрет сладких молочных продуктов,
-
контроль размера/количества порций. Для наглядности желательного размера порций в настоящее время широко применяются “тарелки питания”. Если ребенок хочет съесть вторую порцию обеда/ужина – разрешить ее через 20 минут от первой, при условии регулярного (как минимум 4-х разового приема пищи в день)
-
обогащение рациона овощами (для детей младшего возраста – 300 г, подростков – 400 г в день, с ограничением применения в таких количествах картофеля как единственного овоща), пищевыми волокнами, цельнозерновыми продуктами
-
учить детей есть медленно, без компьютерного/телевизионного/мобильного сопровождения.
2. Физические нагрузки и профилактика «малоподвижного образа жизни»
-
Детям и подросткам с ожирением и избыточной массой тела в возрасте от 6 до 17 лет рекомендованы ежедневные физические нагрузки умеренной и высокой интенсивности (в том числе в рамках назначения комплекса упражнений (лечебной физкультуры) в общей сложности не менее 60 минут [61,62,63].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
-
Физические нагрузки высокой интенсивности (в том числе в рамках назначения комплекса упражнений (лечебной физкультуры)) рекомендовано включать в обязательный час ежедневной физической активности и выполнять не менее трех раз в неделю [62,63].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Регулярная физическая активность является важным компонентом здорового образа жизни. Научные исследования показали, что физическая активность оказывает значимый положительный эффект на состояние здоровья детей и подростков, в частности на риск появления у них избыточной массы тела, развития ожирения и сахарного диабета 2-го типа, а также на состояние костно-мышечной системы. В последние десятилетия физическая активность детей и подростков падает, что значительно повышает вероятность развития избыточной массы тела и ожирения, которые могут привести к сердечно-сосудистым, онкологическим заболеваниям и остеопорозу в более старшем возрасте. Напротив, хорошее физическое развитие и высокий уровень физической активности детей и подростков ассоциируются с более низким риском указанных заболеваний.
Согласно глобальным рекомендациям ВОЗ, адекватная физическая активность для детей и подростков в возрасте 6-17 лет подразумевает ежедневные занятия продолжительностью не менее 60 минут в день. Физическая активность свыше 60 минут в день дает дополнительные преимущества для здоровья. Рекомендованная ежедневная продолжительность физических нагрузок (60 минут и более) может складываться в течение дня из более коротких нагрузок (например, 2 раза в день по 30 минут). Минимально эффективными считаются 10-минутные периоды физической активности — от умеренной до высокой интенсивности.
К физическим нагрузкам легкой интенсивности относятся: домашние дела (глажка, уборка, чистка), ходьба прогулочным шагом (3-4 км/час); к нагрузкам умеренной интенсивности – рисование, ходьба умеренным (4-6 км/час) и быстрым шагом (более 6 км/час), парный теннис, гольф, езда на велосипеде (16-19 км/час); к нагрузкам высокой интенсивности – аэробика, езда на велосипеде (19-22 км/час), аэробика, плавание (45м/мин), одиночный теннис и бег (от 9 до 14 км/час).
Физическая активность в зависимости от ее частоты, продолжительности и интенсивности подразделяется на три категории – низкую, умеренную и высокую (табл.4)
Таблица 4. Классификация физической активности
|
Категория |
Частота |
Продолжительность |
Характеристика |
|---|---|---|---|
|
Низкая |
Менее 3 дней в неделю |
Менее 3 часов в неделю |
Во время физической нагрузки человек может петь и поддерживать непринужденный разговор с партнером |
|
Умеренная |
3 дня в неделю |
3 часа в неделю |
Во время физической нагрузки человек в состоянии вести разговор с партнером, но с некоторыми затруднениями |
|
Высокая |
Более 3 дней в неделю |
Более 3 часов в неделю |
Во время физической нагрузки человек тяжело дышит и отвечает на вопросы односложными словами |
-
Для детей в возрасте 1― 4 лет рекомендуются различные виды двигательной активности любой интенсивности в общей сложности не менее 180 минут в день для профилактики избыточной массы тела и ожирения [64].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Согласно рекомендациям ВОЗ от 2019 года по вопросам физической активности, сна и малоподвижного образа жизни у детей до 5 лет разработаны отдельные дефиниции по продолжительности физической активности для различных возрастных групп [64]. Под физической активностью для детей младшего возраста подразумеваются различные игры: например, лежа на полу, с игрушками, ползание, гимнастика для малышей и т.д. Если ребенок еще не может ползать, рекомендуется проводить не меньше 30 минут в день лежа на животе.
-
Не рекомендуется оставлять детей в возрасте от 1 до 4 лет в удерживающих устройствах более 1 часа подряд [64].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
-
Детям в возрасте 1 года не рекомендуется проводить время перед экраном [64].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
-
Детям в возрасте от 1 года до 4 лет не рекомендуется проводить более 1 часа в день перед экраном [64].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Рекомендации ВОЗ у детей до 5 лет лимитируют время, проводимое маленьким ребенком в удерживающих устройствах и перед экраном смартфона или телевизора (например, просмотр мультфильмов по телевизору или на переносных устройствах, игры на смартфонах и др.).
Время, в течение которого ребенок находится в удерживающих устройствах, исключая сон, родителям стоит использовать для общения: читать сказки, рассказывать стихи, петь песенки. Под удерживающими устройствами имеются в виду различные люльки, коляски, детские кресла или переноски.
-
Для детей и подростков с ожирением и избыточной массой тела с целью профилактики гиподинамии рекомендовано сокращение неактивного времени, проводимого перед экраном телевизора, монитором компьютера до 2 часов в день или меньше [63, 65, 66, 67].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Гиподинамия является важным предрасполагающим фактором развития избыточной массы тела и ожирения, а также сердечно-сосудистой патологии у детей и подростков. У 64-75% подростков отмечается низкая физическая активность. Необходимо сокращение времени, затрачиваемого на физически неактивные виды времяпрепровождения: телевидение, видеофильмы, компьютерные игры, «брожение» по Интернету. С первого дня рекомендуется и на протяжении всего первого месяца экранное время сокращается на 30 минут, со второго месяца – на 45 минут, с 3 месяца – на 60 минут и т.д.
-
Всем детям и подросткам с ожирением и избыточной массой тела в рамках формирования «здорового образа жизни» рекомендуется нормализация режима сна [64, 68, 69, 70].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Продолжительность сна, время отхода ко сну и время пробуждения, качество сна (архитектура сна, субъективная удовлетворенность сном) и эффективность (скорость засыпания или латентность ко сну и непрерывность сна) влияют на массу тела и аппетит [69]. Важно отметить, что поздний отход ко сну ассоциирован с повышенным риском ожирения и увеличения SDS ИМТ, независимо от времени пробуждения [69,70].
Нарушение сна и несоблюдение режима дня способствуют изменению секреции ряда гормонов (лептина, грелина, кортизола, СТГ, снижению уровня мелатонина), приводят к снижению ежедневной физической активности, повышению аппетита и потреблению высококалорийной пищи [68,69].
Рекомендации ВОЗ 2019 года определяют продолжительность сна у детей [64]. Так, для детей до года длительность сна составляет 14–17 часов (в возрасте от 0 до 3 месяцев) или 12–16 часов (в возрасте от 4 до 11 месяцев), включая дневной сон. Для детей от года до 2 лет длительность сна составляет 11–14 часов, включая дневной сон. Для детей от 3 до 4 лет длительность сна составляет 10–13 часов.
Оптимальная продолжительность сна для детей младшего школьного возраста (5-13 лет) - 9-11 часов в сутки, для подростков (14-18 лет) - 8-10 часов в сутки [69].
3. Медикаментозная терапия
-
Использование фармакотерапии (в комбинации с изменением образа жизни) у детей и подростков с ожирением рекомендуется с 12 летнего возраста при неэффективности мероприятий, направленных на формирование здорового образа жизни, длительность которых составляла не менее 1 года [12, 71].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Медикаментозная терапия ожирения у подростков ограничена. Препараты, разрешенные для лечения ожирения у детей старше 12 лет в мире и Российской Федерации – это лираглутид и орлистат.
-
Детям старше 12 лет с ожирением в качестве дополнения к здоровому питанию и физической активности при неэффективности мероприятий, направленных на формирование здорового образа жизни, длительность которых составляла не менее 1 года, может быть рекомендована терапия лираглутидом [72, 73].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Лираглутид является аналогом глюкогоноподобного пептида 1 (ГПП-1). На уровне гипоталамуса лираглутид, активируя рецепторы ГПП-1, усиливает сигналы насыщения и ослабляет сигналы голода, тем самым сокращая потребление пищи. Кроме того, лираглутид глюкозозависимым путем стимулирует секрецию инсулина и уменьшает секрецию глюкагона. Эффективность и безопасность лираглутида у подростков с ожирением в возрасте 12-17 лет оценена в рандомизированном клиническом исследовании SCALЕ TEENS. Лираглутид снижал массу тела (в среднем на 2,7 кг по сравнению с набором веса в группе плацебо +2,1 кг), уменьшал величину SDS ИМТ больше (на 0.25), чем плацебо (0.02); также отмечено большее достижение пациентами 5% и 10% снижения массы тела в группе лираглутида по сравнению с плацебо [72,73].
Препарат вводится подкожно один раз в сутки в любое время, независимо от приема пищи, в область живота, бедра или плеча. Начальная доза составляет 0,6 мг в сутки с последующей стандартной титрацией дозы препарата согласно инструкции: доза увеличивается на 0,6 мг с интервалами не менее одной недели. Дозу препарата следует увеличивать до тех пор, пока не будет достигнуто значение 3,0 мг (терапевтическая доза) или максимально переносимая доза. Среди побочных действий описаны диспепсические явления (снижение аппетита, тошнота, рвота, запор, диарея), которые отмечаются, как правило, в первые недели лечения, в большинстве случаев носят преходящий характер и не требуют отмены терапии.
-
Детям старше 12 лет при неэффективности мероприятий, направленных на формирование здорового образа жизни, длительность которых составляла не менее 1 года, может быть рекомендован прием орлистата [12, 71].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Орлистат является ингибитором желудочной и панкреатической липаз, которые участвуют в гидролизе триглицеридов и необходимы для всасывания жиров в тонком кишечнике. В результате действия препарата нарушается расщепление пищевых жиров и уменьшается их всасывание. После отмены препарата его действие быстро прекращается, а активность липаз восстанавливается. Эффективность орлистата в комплексной терапии ожирения у подростков оценена в контролируемых клинических исследованиях. Согласно данным работам, средняя динамика веса в группе орлистата составила от +0,53 кг (12 месяцев терапии, 12 месяцев наблюдения, 539 подростков) [74], до – 6,9 кг (6 месяцев терапии, 60 пациентов) [75]. Орлистат назначается по 1 капсуле (120 мг) перед основными приемами пищи, максимальная суточная доза составляет 360 мг (3 капсулы, по 1 капсуле 3 раза в день). Длительность лечения может составлять от 3 месяцев до 12 месяцев.
-
Метформин** не рекомендован для лечения ожирения у детей без осложнений и коморбидных состояний [24,71,76-79].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Метформин** относится к группе бигуанидов, гипогликемических препаратов для лечения сахарного диабета. Применение метформина** в педиатрической практике разрешено в возрастной группе старше 10 лет с установленным диагнозом сахарного диабета 2 типа [76-78]. Мета-анализы демонстрируют умеренный положительный эффект метформина**, выражающийся преимущественно в стабилизации веса и SDS ИМТ, а также уменьшении количества жировой массы и улучшении метаболического профиля, инсулинорезистентности у детей и подростков с ожирением [24, 71, 78, 79].
Лечение метформином** не влияет отрицательно на количество тощей массы и не приводит к снижению темпов роста у подростков [77].
Важно отметить, что лечение метформином** у детей и подростков не сопровождается развитием лактацидоза, описанного для взрослых [80].
Согласно обновленным данным, представленным Международным консорциумом детских эндокринологов по вопросам диагностики и лечения синдрома поликистозных яичников у подростков, метформин** оказывает благоприятное влияние на течение синдрома поликистозных яичников (СПЯ) у пациенток с избыточной массой тела и ожирением в краткосрочном периоде (6 месяцев) и может применяться в качестве монотерапии.[х] Терапия метформином** снижает частоту ановуляции и уровень тестостерона у пациенток с СПЯ без ожирения и также может использоваться в качестве монотерапии. Суточная доза метформина** у подростков варьирует от 0,5 до 2 г. [24]. Использование метформина** в качестве адъювантной терапии СПЯ (в сочетании с комбинированным оральными контрацептивами) имеет преимущества в случае наличия у пациенток ожирения в сочетании с нарушениями углеводного обмена (нарушение толерантности к глюкозе, сахарный диабет, инсулинорезистентность). При длительном применении метформина** возможно развитие дефицита витамина В12, особенно в группах риска (состояние после бариатрических операций, сахарный диабет 2 типа, вегетарианство, пернициозная анемия в анамнезе), в связи с чем целесообразно мониторирование данного показателя на фоне лечения [81].
Таким образом, терапия метформином** «офф-лейбл» наиболее целесообразна в группе пациенток с гиперандрогенией и нарушениями менструального цикла, входящих в группу риска развития СПЯ.
Механизм влияния метформина** на снижение массы тела до настоящего времени полностью не ясен. Основными эффектами метформина** являются торможение процессов глюконеогенеза и скорости образования глюкозы печенью, повышение чувствительности тканей печени, скелетной мускулатуры и адипоцитов к действию инсулина, в том числе за счет индукции образования транспортеров глюкозы (GLUT-1 и GLUT-4). Глюкозонормализующее действие метформина** реализуется в основном через образование инсулинрецепторного субстрата 2, наибольшая концентрация которого регистрируется в печени.
В начале лечения возможны гастроинтестинальные побочные эффекты: метеоризм, тошнота, вздутие живота, жидкий стул, металлический привкус во рту. Также на фоне приема метформина** описаны случаи лактацидоза. На риск развития лактатацидоза не влияют ни длительность лечения, ни дозировка метформина**, а также - возраст и пол пациента. Однако вероятность лактатацидоза возрастает при почечной либо печеночной недостаточности.
-
Не рекомендуется назначение октреотида** пациентам с гипоталамическим ожирением детского возраста, поскольку применение препарата ограничено данными клинических исследований и отсутствуют данные реальной практики [82,83].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
-
Детям с синдромом Прадера-Вилли может быть рекомендована терапия #соматропином** [84].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Препарат #соматропин** одобрен базой данных Управления по контролю качества пищевых продуктов и лекарственных препаратов (Food and Drug Administration, FDA) для лечения детей с синдромом Прадера-Вилли (СПВ). Согласно данным многочисленных исследований, терапия #соматропином**, особенно при назначении в раннем возрасте (до развития ожирения), приводит к улучшению антропометрических параметров и композиционного состава тела (снижение жировой и увеличение мышечной массы), что может способствовать уменьшению риска развития ожирения у этих пациентов (при условии соблюдения диеты и режима двигательной активности) [84].
Перед началом и на фоне терапии #соматропином** проводится оценка антропометрических параметров, состояния аденотонзиллярной системы, показателей костного возраста, значений уровня инсулиноподобного ростового фактора I в крови (ИФР-1), параметров углеводного обмена (исследования уровня глюкозы, исследование уровня инсулина плазмы крови, исследование уровня гликированного гемоглобина). Учитывая потенциальный эффект #соматропина** на гипертрофию лимфоидной ткани носоглоточного кольца и ухудшение параметров дыхания во сне с риском развития апноэ рекомендовано проведение полисомнографии как перед, так и на фоне терапии, особенно в первые 3-6 месяцев лечения #соматропином**. Средняя суточная доза #соматропина** для лечения СПВ - 1мг/м2/сутки, однако начинать терапию, особенно детям раннего возраста, рекомендовано с меньших доз (0,5 мг/м2/сут) с последующей титрацией до среднесуточной под контролем значений ИФР-1, избегая превышения референсных значений [79, 84]. У детей с СПВ раннего возраста (до 2-х лет жизни) терапия #соматропином** в меньших дозах (0,6 мг/м2/сут) показала эффективность, аналогичную с использованием среднетерапевтических доз (1 мг/м2/сут) и характеризовалась меньшим количеством побочных эффектов на начальном этапе лечения [84, 85]. Противопоказаниями для назначения #соматропина** у пациентов с синдромом Прадера-Вилли являются тяжелое осложненное ожирение, некомпенсированный сахарный диабет, тяжелая степень апноэ, активные злокачественные новообразования, психотические расстройства [79, 84].
В настоящее время в мире в рамках клинических исследований изучается лекарственная терапия некоторых моногенных форм ожирения ― врожденного дефицита лептина, рецептора лептина, дефицита проопиомеланокортина [86,87,88].
Исследования последних лет показывают, что мероприятия, направленные на изменение образа жизни, включающие проведение школ для пациентов с избыточной массой тела и ожирением, а также применение медикаментозной терапии с целью снижения ожирения у детей и подростков, имеют краткосрочную эффективность. В связи с этим лечение ожирения у детей и подростков должно быть длительным.
4. Хирургическое лечение
-
Хирургические методы лечения ожирения (бариатрическая хирургия) могут быть рекомендованы подросткам с морбидным ожирением только при соблюдении следующих условий [12, 89,90,91]:
-
ИМТ >35 кг/м² в сочетании с клинически значимыми сопутствующими метаболическими нарушениями (неалкогольный стеатогепатит, сахарный диабет 2 типа, синдром обструктивного апноэ во сне, болезнь Блаунта, тяжелая артериальная гипертензия);
-
ИМТ >40 кг/м² (SDS ИМТ > 4,0 для данного пола и возраста) независимо от наличия осложнений;
-
Завершенное или близкое к завершению физическое развитие (частичное или полное закрытие зон роста), достижение 4-5 стадий полового развития по шкале Таннера;
-
Документально подтвержденная неэффективность консервативных методов лечения ожирения в течение 6 месяцев в специализированных центрах;
-
Отсутствие психических заболеваний, психологических или поведенческих нарушений, которые могут препятствовать адекватному соблюдению послеоперационных рекомендаций (в том числе обусловленных наличием синдромальных и гипоталамических форм ожирения);
-
Готовность/способность подростка и членов его семьи к длительному и регулярному послеоперационному динамическому наблюдению
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Хирургические методы лечения морбидного ожирения (бариатрическая хирургия) у подростков получают все большее распространение в мире в последние десятилетия. Основными преимуществами бариатрической хирургии являются быстрое снижение веса, улучшение метаболических показателей и качества жизни пациентов с морбидным ожирением. Согласно клиническим рекомендациям Международного Эндокринологического общества, бариатрическая хирургия является методом выбора для лечения морбидного осложненного ожирения у подростков.
В хирургии ожирения у подростков предпочтительным является лапароскопический доступ, как наименее инвазивный. Бариатрические операции делятся на три группы: рестриктивные (гастроограничивающие), мальабсорбтивные (шунтирующие) и комбинированные. Рестриктивные операции направлены на уменьшение объема желудка. Снижение массы тела при этом происходит за счет ограничения количества потребляемой пищи и быстрого насыщения во время еды. К наиболее распространенным гастроограничивающим операциям относятся бандажирование желудка лапароскопическое (БЖ) (в настоящее время БЖ применяется крайне редко) и продольная резекция желудка лапароскопическая (ПРЖ). К комбинированным операциям – различные модификации гастрошунтирования лапароскопическое (ГШ по Ру)с межкишечным анастомозом по Ру.
В настоящее время существует несколько консенсусов, посвященных вопросам метаболический хирургии у подростков с морбидным ожирением: клинические рекомендации по хирургическому лечению морбидного ожирения у подростков под эгидой Международной группы детских эндоскопических хирургов (IPEG); Европейские междисциплинарные клинические рекомендации по хирургическом лечению морбидного ожирения под эгидой бариатрический исследовательской группы сотрудничества (BSCG); и рекомендации педиатрической рабочей группы Американского общества метаболических и бариатрических хирургов (ASMBS) (см. табл. 5).
По данным мета-анализа 23 исследований, включившего 637 подростков, которым были проведены различные бариатрические операции, среднее снижение ИМТ через год составило 13,5 кг/м² (8 исследований, 256 пациентов). При анализе эффективности различных хирургических методик минимальное снижение веса отмечалось при проведении РБЖ (Δ ИМТ = 10,5 кг/м²- 11 исследований, 271 пациентов), максимальное – при ГШ по Ру (Δ ИМТ = 17,2 кг/м²- 8 исследований, 256 пациентов). При проведении продольной резекции желудка среднее снижение ИМТ составило 14,5 кг/м² (3 исследования; 90 пациентов) [92].
В настоящее время опубликованы проспективные исследования, в которых отражены данные о безопасности бариатрической хирургии у подростков [93,94]. По данным Inge с соавт. (277 пациентов; средний возраст -17 лет) 19 подросткам (6,8%) в течение 30 дней после плановой бариатрической операций проведено повторное оперативное вмешательство. Повторная госпитализация в связи с развитие обезвоживания потребовалась 36 пациентам. При этом 66% всех операций в данном исследовании составило ГШ по Ру; 28% - ПРЖ, 6% - РБЖ. Все операции проводились лапароскопическим доступом. Максимальное число осложнений зарегистрировано после ГШ по Ру [52]. Последующее наблюдение за данной группой пациентов в течение 3 лет продемонстрировало, что снижение массы тела носит стойкий характер и сохраняется в течение 3х летнего периода наблюдения. Также показано, что за все время наблюдения 13% детей потребовалось повторное оперативное вмешательство [95]. По результатам анализа 5 летнего динамического наблюдения за 81 ребенком (от 13 до 18 лет) из Шведского национального регистра подростков после проведения лапароскопического ГШ Ру показано, что среднее снижение ИМТ на фоне лечения составило 13 кг/м² и достигнуто оно было по истечении двух лет после оперативного лечения. При дальнейшем динамическом наблюдении отмечается незначительное увеличение ИМТ в группе оперированных детей.
Таблица 5. Международные консенсусы по бариатрической хирургии у подростков
|
Рекомендации |
Показания |
Противопоказания |
Рекомендуемые хирургические методы |
Ссылка |
|---|---|---|---|---|
|
IPEG, 2009 |
Завершенное или близкое к завершению физическое развитие (частичное или полное закрытие зон роста) ИМТ >35 кг/м² + тяжелые осложнений ожирения ИМТ >40 кг/м² + 1 любое осложнение ожирения Завершенное или близкое к завершению физическое развитие (частичное или полное закрытие зон роста) |
Психические заболевания Алкогольная или наркотическая зависимость Неиспользование всех консервативных возможностей лечения ожирения Неготовность/неспособность пациента к послеоперационному регулярному динамическому наблюдению |
БЖ ПРЖ ГШ по Ру |
[89] |
|
Европейские рекомендации (BSCG),2009 |
Завершенное или близкое к завершению физическое развитие (частичное или полное закрытие зон роста) ИМТ >40 кг/м² (ИМТ более 99,5 перцентиля для данного пола и возраста) + 1 любое осложнение ожирения. Документально подтвержденная неэффективность консервативных методов лечения ожирения в течение как минимум 6-12 месяцев в специализированных центрах. Завершенное или близкое к завершению физическое развитие (частичное или полное закрытие зон роста) Возможность последующего регулярного наблюдения мультидисциплинарной командой специалистов Синдромальные формы ожирения |
Психические заболевания (некомпенсированные) Алкогольная или наркотическая зависимость Неготовность/неспособность ребенка и членов его семьи к послеоперационному регулярному длительному динамическому наблюдению Заболевания, снижающие краткосрочную продолжительность жизни Невозможность пациента самостоятельно заботиться о себе |
БЖ ВГ ГШ по Ру БПШ |
[90] |
|
Американские рекомендации (ASMBS), 2022 |
ИМТ ≥35 кг/м² + тяжелые осложнений ожирения ИМТ >40 кг/м² независимо от наличия осложнение ожирения
|
Возможность коррекции ожирения с помощью медикаментозной терапии в сочетании с изменением образа жизни Неготовность/неспособность ребенка и/или членов его семьи к послеоперационному длительному и регулярному динамическому наблюдению. Психические заболевания (некомпенсированные). Алкогольная или наркотическая зависимость. |
ПРЖ
|
[99] |
За пятилетний период наблюдения 20 подросткам (25%) потребовались повторные оперативные вмешательства, половина из которых пришлась на лапароскопическую холецистэктомию по поводу калькулезного холецистита, развившегося на фоне быстрого и существенного снижения веса [96].
По данным 94% исследований, включённых в систематический обзор и мета-анализ, хирургическое лечение ожирения продемонстрировало статистически значимые преимущества в отношении снижения массы тела и ремиссии диабета 2 типа [98]. Более того, важно отметить, что пациенты, у которых диабет существовал менее 5 лет в 76% случаев достигали ремиссию в долгосрочной перспективе, в то время как среди тех, у кого диабет больше 5 лет – только 21% [99].
Получены многочисленные данные проспективных когортных исследований о благоприятном влиянии бариатрической хирургии на обратное развитие метаболических нарушений, ассоциированных с ожирением у подростков. На фоне снижения веса у подростков отмечается значительное улучшение показателей углеводного и липидного обмена, снижение уровней печеночных трансаминаз, уменьшение выраженности синдрома обструктивного апноэ во сне. Кроме того, следует отметить существенное повышение качества жизни и снижение психологического дискомомфорта пациентов при динамическом наблюдении [95,96,97].
ПРЖ и ГШ по Ру можно считать безопасными и эффективными методами лечения тяжелого ожирения у детей. При принятии решения о том, какую операцию использовать, первостепенное значение должно иметь рассмотрение осложнений, связанных с дефицитом витаминов, длительностью операции и необходимостью повторной операции. Риск повторных операций значительно выше при билиопанкреатическом шунтировании и бандажировании желудка, чем при двух других операциях, что делает этот выбор менее желательным. Достоверные исследования показали, что ПРЖ так же эффективна, как ГШ по Ру, в снижении веса и улучшении сопутствующих заболеваний. Таким образом, ПРЖ получила всеобщее признание и стала наиболее часто выполняемой процедурой у подростков [100].
Хотя в последние годы использование бариатрической хирургии у подростков увеличилось, лишь незначительная часть детей, у которых есть показания и ожидается значимая польза в отношении здоровья, направляются на хирургическое лечение [101].
Всем подросткам после бариатрических операций требуется мониторинг уровня витаминов и микроэлементов для своевременной диагностики их дефицита. Наиболее часто у данной группы пациентов развивается дефицит кальция и витамина Д, которые при несвоевременной коррекции приводят к развитию вторичного гиперпаратиреоза и остеопороза. Часто регистрируется дефицит железа, фолиевой кислоты и других витаминов (тиамин, пиридоксин, цианокобаламин), а также жирорастворимых витаминов [95,96,97].
Обязательным условием являются долгосрочные диспансерные наблюдения, которые должны проводиться в специализированных центрах под руководством детского и бариатрического хирурга, педиатра/детского эндокринолога, психолога.
Условия для выполнения бариатрических операций у детей:
Для определения возможности выполнения бариатрических операций ребенок должен быть проконсультирован врачом – детским эндокринологом, включенным в программы снижения веса у детей. Перед направлением на хирургическое лечение специалист должен убедиться, что ребенок проходил программы снижения веса и был консультирован психологом или психиатром.
Выполнение бариатрических операций у детей должно производиться в детских отделениях хирургического профиля. Подразделение должно быть оснащено специализированным для бариатрической хирургии оборудованием и инструментами. Персонал должен иметь опыт работы с бариатрическими пациентами.
Согласие на бариатрическую операцию:
При принятии решения о возможности выполнить бариатрическую операцию ребенку, нужно учитывать возможность разногласий между родителем(ями) и подростком. Необходимо провести тщательную оценку понимания проблем ожирения и бариатрической хирургии как родителями, так и подростками. Бариатрическую операцию следует проводить только в том случае, если на процедуру согласны как родитель, так и подросток. В случаях, когда ребенок не обладает способностью принимать решения, он должен продемонстрировать способность вносить изменения в образ жизни, после бариатрической операции, и только тогда следует рассмотреть возможность бариатрической хирургии. Родители и мультидисциплинарная команда должны принять решение, что бариатрическая операция является лучшим курсом действий для ребенка.
Особые случаи: В случаях синдрома Прадера-Вилли (СПВ), ожидаемая потеря массы тела меньше чем у детей без синдромального ожирения [102]. Alqahtani с соавт. опубликовали исследование с участием 24 детей с СПВ и без него, которое подтвердило результаты набора веса после продольной резекции желудка (ПРЖ) у пациентов с СПВ. В то же время применение ПРЖ оказалось безопасным и эффективным, продемонстрировав устойчивое снижение ИМТ на 10 пунктов в течение 5 лет [103].
5. Обезболивание
Не предусмотрено.
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Специфические меры реабилитации и санаторно – курортного лечения не разработаны.
Госпитализация
Организация оказания медицинской помощи
Показания для госпитализации в медицинскую организацию:
1) Форма - плановая; условия - стационар, дневной стационар:
a. Комплексный скрининг осложнений, в отсутствии возможности обследования в амбулаторных условиях;
b. Комплексное лечение с проведением Школы для пациентов с избыточной массой тела и ожирением (дневной стационар), в отсутствии возможности лечения и проведения Школы в амбулаторных условиях;
c. При планировании хирургического лечения ожирения
2) Форма - экстренная, неотложная; условия - стационар: не предусмотрены. При развитии неотложных состояний, связанных с ухудшением течения коморбидных заболеваний (гипертонический криз, острый живот при ЖКБ, апноэ) показана госпитализация пациента в профильное отделение согласно основному неотложному состоянию.
Показания к выписке пациента из медицинской организации
1) Форма - плановая; условия - стационар, дневной стационар:
a. Проведение запланированного обследования/лечения.
2) Форма - экстренная, неотложная; условия - стационар: купирование жизнеугрожающего состояния.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
-
Детям и подросткам с избыточной массой тела и ожирением рекомендуется диспансерное наблюдение врача – педиатра/врача – детского эндокринолога с контролем антропометрических показателей, оценкой ИМТ и фактического питания [12,23,61].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: Врач-педиатр наблюдает детей дошкольного и младшего школьного возраста с избыточной массой тела или метаболически неосложненным ожирением. Дети до года наблюдаются врачом-педиатром ежемесячно. Им проводят контроль антропометрических показателей, SDS ИМТ. При развитии ожирения показана консультация детского эндокринолога.
Дети раннего возраста (1—3 года) наблюдаются врачом-педиатром 1 раз в 3—6 месяцев. При развитии ожирения также показана консультация детского эндокринолога, а при сопутствующей задержке психомоторного развития — консультация генетика.
Диспансерное наблюдение детей дошкольного и младшего школьного возраста с избыточной массой тела может проводиться как врачом-педиатром, так и врачом-детским эндокринологом. Самым важным компонентом такого наблюдения по-прежнему будет оценка динамики антропометрических показателей, SDS ИМТ, оценка образа жизни ребенка и подробная беседа с родителями. В первые 3 месяца необходимы ежемесячные визиты, далее (при положительной динамике) — 1 раз в 6—12 месяцев.
При диспансерном наблюдении подростков с ожирением показана консультация врача- детского эндокринолога. Обязательным является скрининг коморбидных состояний. Диспансерное наблюдение осуществляется ежемесячно в первые 3 месяца, далее (при положительной динамике) — 1 раз в 6 месяцев. Дети с осложненным ожирением наблюдаются у врача- детского эндокринолога 1 раз в 3—6 месяцев. При сохранении осложнений объем обследований и наблюдений узкими специалистами определяется индивидуально.
При нормализации массы тела дети наблюдаются у врача-педиатра в декретированные сроки для здоровых детей (I группа здоровья).
-
Для профилактики ожирения у детей рекомендуется активное выявление избыточной массы тела в возрасте от 2 до 9 лет и проведение школ для пациентов с избыточной массой тела и ожирением [12,23,61].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Информация
Источники и литература
-
Клинические рекомендации Российской ассоциации эндокринологов
- 1. Петеркова В.А., Безлепкина О.Б., Болотова Н.В. с соавт. Клинические рекомендации«Ожирение у детей». Проблемы Эндокринологии. 2021;67(5):67-83.https://doi.org/10.14341/probl12802. 2. Петеркова В.А., Васюкова О.В. К вопросу о новой классификации ожирения у детей иподростков. Проблемы Эндокринологии, №2, 2015, стр. 39-45. 3. Locke AE., Kahali B, Berndt S I et al. Genetic studies of body mass index yield new insights forobesity biology. Nature 2015, Vol. 518: 197 - 206. 4. Speliotes EK, Willer CJ, Berndt SI, et al. Association analyses of 249,796 individuals revealeighteen new loci associated with body mass index. Nat Genet 2010; 42: 937–48. 5. Hebebrand J, Hinney A, Knoll N, Volckmar AL, Scherag A. Molecular genetic aspects of weightregulation. Dtsch Arztebl Int 2013;110(19): 338–44. 6. Петеркова В.А., Васюкова О.В. Редкие формы ожирения у детей. Лечащий врач. 2008; 3: 29-33. 7. González-Álvarez, M.A.; Lázaro-Alquézar, A.; Simón-Fernández, M.B. Global Trends in ChildObesity: Are Figures Converging? Int. J. Environ. Res. Public Health 2020, 17, 9252.https://doi.org/10.3390/ijerph17249252. 8. World Health Organization. [Электронный ресурс] // Режим доступа: http://www.who.int/mediacentre/factsheets/fs311/ru/ 9. Тутельян В.А., Батурин А.К., Конь И.Я. с соавт. Распространенность ожирения иизбыточной массы тела среди детского населения РФ: мультицентровое исследование.Педиатрия им. Г.Н. Сперанского. 2014; 93 (5): 28-31. 10. Грицинская В.Л., Новикова В.П., Хавкин А.И. К вопросу об эпидемиологии ожирения удетей и подростков (систематический обзор и мета-анализ научных публикаций за 15-летний период). Вопросы практической педиатрии. 2022; 17(2): 126–135. DOI:10.20953/1817-7646-2022-2-126-135. 11. Spinelli A, Buoncristiano M, Nardone P. et al. Thinness, overweight, and obesity in 6- to 9-year-old children from 36 countries: The World Health Organization European Childhood ObesitySurveillance Initiative-COSI 2015-2017. Obes Rev. 2021 Nov;22 Suppl 6: e13214. doi:10.1111/obr.13214 12. Styne DM, Arslanian SA, Connor EL, Farooqi IS, Murad MH, Silverstein JH, Yanovski JA.Pediatric Obesity-Assessment, Treatment, and Prevention: An Endocrine Society Clinical PracticeGuideline. J Clin Endocrinol Metab. 2017 Mar 1;102(3):709-757. doi: 10.1210/jc.2016-2573. 13. Богова Е.А. Клинические, генетические и гормонально-метаболические особенностиожирения при синдроме Прадера-Вилли: автореф. дис. канд. мед. наук, М, 2014, 27 с. 14. Butler MG, Miller JL, Forster JL. Prader-Willi Syndrome - Clinical Genetics, Diagnosis andTreatment Approaches: An Update. Curr Pediatr Rev. 2019;15(4):207-244.doi:10.2174/1573396315666190716120925 15. Tomlinson JW. Bardet-Biedl syndrome: A focus on genetics, mechanisms and metabolicdysfunction. Diabetes Obes Metab. 2024 Apr;26 Suppl 2:13-24. doi: 10.1111/dom.15480. 16. Abbas A, Hammad AS, Al-Shafai M. The role of genetic and epigenetic GNAS alterations in thedevelopment of early-onset obesity. Mutat Res Rev Mutat Res. 2024 Jan-Jun;793:108487. doi:10.1016/j.mrrev.2023.108487. 17. Kleinendorst L, Boon E, van Haelst MM. Obesity-Associated GNAS Mutations and theMelanocortin Pathway. N Engl J Med. 2022 Jul 21;387(3):285. doi: 10.1056/NEJMc2119110. 18. Holder JL Jr, Butte NF, Zinn AR . Profound obesity associated with a balanced translocation thatdisrupts the SIM1 gene. Hum Mol Genet 2000; 9: 101–108 19. Bonaglia MC, Ciccone R, Gimelli G, Gimelli S, Marelli S, Verheij J et al. Detailed phenotype-genotype study in five patients with chromosome 6q16 deletion: narrowing the critical region forPrader-Willi-like phenotype. Eur J Hum Genet 2008; 16: 1443–1449 20. Drabkin M, Birk OS, Birk R. Heterozygous versus homozygous phenotype caused by the sameMC4R mutation: novel mutation affecting a large consanguineous kindred. BMC Med Genet.2018 Aug 2;19(1):135. doi: 10.1186/s12881-018-0654-1. PMID: 30068297; PMCID:PMC6090656 21. Васюкова О.В. Ожирение у детей и подростков: критерии диагноза. Ожирение иметаболизм. Том 16, № 1 (2019): 70-73. doi.org/10.14341/omet10170 22. Петеркова В.А., Нагаева Е.В., Ширяева Т.Ю. Методические рекомендации: Оценкафизического развития детей и подростков.. Москва, 2017 г, 98 стр 23. Рекомендации по диагностике, лечению и профилактике ожирения у детей и подростков. –М.: Практика, 2015. – 136 стр. 24. Ibáñez L, Oberfield SE, Witchel S, Auchus RJ, Chang RJ, Codner E, Dabadghao P, Darendeliler F,Elbarbary NS, Gambineri A, Garcia Rudaz C, Hoeger KM, López-Bermejo A, Ong K, Peña AS,Reinehr T, Santoro N, Tena-Sempere M, Tao R, Yildiz BO, Alkhayyat H, Deeb A, Joel D,Horikawa R, de Zegher F, Lee PA. An International Consortium Update: Pathophysiology,Diagnosis, and Treatment of Polycystic Ovarian Syndrome in Adolescence. Horm Res Paediatr.2017;88(6):371-395. doi: 10.1159/000479371. 25. Петеркова В.А., Ремизов О.В. Ожирение в детском возрасте. Ожирение и метаболизм2004;1:17–23. 26. Marcus CL, Brooks LJ, Draper KA, et al: American Academy of Pediatrics. Diagnosis andmanagement of childhood obstructive sleep apnea syndrome. Pediatrics. 2012 Sep;130(3):e714-55. doi: 10.1542/peds.2012-1672. 27. Александров А.А., Кисляк О.А., Леонтьева И.В. Клинические рекомендации. Диагностика,лечение и профилактика артериальной гипертензии у детей и подростков. Системныегипертензии 2020; Том 17;№2, стр. 7-35; https://doi.org/10.26442/2075082X.2020.2.200126. 28. Агапитов Л.И., Александров А.А., Баранов А.А., Кисляк О.А., Леонтьева И.В., Намазова-Баранова Л.С., Плотникова И.В., Розанов В.Б. Артериальная гипертензия у детей.Клинические рекомендации МЗ РФ, 2016. 29. Molleston J. P., Schwimmer J. B., Yates K. P. et al. NASH Clinical Research Network.Histological Abnormalities in Children with Nonalcoholic Fatty Liver Disease and Normal orMildly Elevated Alanine Aminotransferase Levels. J Pediatr. 2014; 164:707—713 30. Ивашкин В.Т., Маевская М.В., Павлов Ч.С. и др. Клинические рекомендации подиагностике и лечению неалкогольной жировой болезни печени Российского общества поизучению печени и Российской гастроэнтерологической ассоциации. Российский журналгастроэнтерологии, гепатологии, колопроктологии. 2016;26(2):24-42.https://doi.org/10.22416/1382-4376-2016-26-2-24-42 31. Expert Panel on Integrated Guidelines for Cardiovascular Health and Risk Reduction in Childrenand Adolescents Summary Report, National Heart Lung and Blood Institute, NIH Publication No.12-7486-A, 2012, 140 p. 32. Expert Panel on Integrated Pediatric Guidelines for Cardiovascular Health and Risk Reduction inChildren and Adolescents. National Heart, Lung and Blood Institute, NIH, Bethesda, MD.Pediatrics (Supplement 5) 2011;128:S213-S309. Режим доступа: www.nhlbi.nih.gov/guidelines/cvd_ped/index.htm. 33. Giorgio V., Graziano F., Nobili V. Pediatric non alcoholic fatty liver disease: old and new conceptson development, progression, metabolic insight and potential treatment targets. BMC Pediatr.2013; 13: 40 34. ISPAD Clinical Practice Consensus Guidelines 2018: Definition, epidemiology, and classificationof diabetes in children and adolescents / E.J. Mayer-Davis [et al.] // Pediatric Diabetes. – 2018. –Vol. 19. – P. 7-19. 35. American Diabetes Association. 2. Classification and Diagnosis of Diabetes: Standards ofMedical Care in Diabetes 2020 / American Diabetes Association // DiabetesCare.2020.Vol.43(Sup1):Р.S14-S31. https://doi.org/10.2337/dc20-S002. 36. World Health Organization. Definition and diagnosis of diabetes mellitus and intermediatehyperglycaemia: report of a WHO/IDF consultation / World Health Organization, InternationalDiabetes Federation. – 2006. 37. Ивашкин В.Т., Маев И.В., Баранская Е.К., Охлобыстин А.В., Шульпекова Ю.О., ТрухмановА.С., Шептулин А.А., Лапина Т.Л. Рекомендации Российской гастроэнтерологическойассоциации по диагностике и лечению жёлчнокаменной болезни. Российский журналгастроэнтерологии, гепатологии, колопроктологии. 2016;26(3):64-80.https://doi.org/10.22416/1382-4376-2016-26-3-64-80 38. Cомнология и медицина сна. Национальное руководство памяти A.M. Вейна и Я.И. Левина /под ред. М. Г. Полуэктова. Москва: «Медфорум», 2016. 39. Kaditis AG, Alonso Alvarez ML, Boudewyns A, et al. Obstructive sleep disordered breathing in 2-to 18-year-old children: diagnosis and management. Eur Respir J. 2016 Jan;47(1):69-94. doi:10.1183/13993003.00385-2015. 40. Solano-Pérez, E., Coso, C., Castillo-García, M. et al. Diagnosis and Treatment of Sleep Apnea inChildren: A Future Perspective Is Needed. Biomedicines 2023, 11, 1708.https://doi.org/10.3390/biomedicines11061708 41. Bhattacharjee R, Kheirandish-Gozal L, Pillar G, Gozal D. Cardiovascular complications ofobstructive sleep apnea syndrome: evidence from children. Prog Cardiovasc Dis. 2009 Mar-Apr;51(5):416-33. doi: 10.1016/j.pcad.2008.03.002. 42. Smith DF, Amin RS. OSA and Cardiovascular Risk in Pediatrics. Chest. 2019 Aug;156 (2):402-413. doi: 10.1016/j.chest.2019.02.011. 43. Redline S, Storfer-Isser A, Rosen CL et al. Association between metabolic syndrome and sleep-disordered breathing in adolescents. Am J Respir Crit Care Med. 2007 Aug 15;176 (4):401-8. doi:10.1164/rccm.200703-375OC. 44. Menzies B, Teng A, Burns M, Lah S. Neurocognitive outcomes of children with sleep disorderedbreathing: A systematic review with meta-analysis. Sleep Med Rev. 2022 Jun;63:101629. doi:10.1016/j.smrv.2022.101629. 45. Ai S, Li Z, Wang S, Chen S, Chan JW, Au CT, Bao Y, Li AM, Zhang J, Chan KC, Wing YK. Bloodpressure and childhood obstructive sleep apnea: A systematic review and meta-analysis. SleepMed Rev. 2022 Oct;65:101663. doi: 10.1016/j.smrv.2022.101663. 46. Lazarus J, Brown RS, Daumerie C, Hubalewska-Dydejczyk A, Negro R, Vaidya B. 2014 EuropeanThyroid Association Guidelines for the Management of Subclinical Hypothyroidism in Pregnancyand in Children. European Thyroid Journal. 2014;3(2):76-94. doi: 10.1159/000362597 47. Arslanian SA. Clamp techniques in pediatrics: what have we learned? Horm Res. 2005; Vol. 64(3):p.16-24.
Информация
Список сокращений
АД – артериальное давление
АГ – артериальная гипертензия
АКТГ – адренокортикотропный гормон
АлАТ – аланинаминотрансфераза
АсАТ – аспартатаминотрансфераза
БПШ – билиопанкреатическое шунтирование
ВГ – вертикальная гастропластика
ГШ – гастрошунитрование
ДАД – диастолическое артериальное давление
ИМТ – индекс массы тела
ИР –инсулинорезистентность
ИРИ – иммунореактивный инсулин
ИДР – индекс дыхательных расстройств
ИФР-1 – инсулиноподобный фактор роста -1
КТ – компьютерная томография
ЛГ – лютеинизирующий гормон
ЛПВП – липопротеиды высокой плотности
ЛПНП –липопротеиды низкой плотности
МРТ – магнитно-резонансная томография
НАЖБП – неалкогольная жировая болезнь печени
ЖКБ – желчно-каменная болезнь
НПР – нервно-психическое развитие
ОГТТ – глюкозотолерантный тест
ПТГ – паратиреоидный гормон
ПОМК – проопиомеланокортин
ПРЖ – продольная резекция желудка
САД – систолическое артериальное давление
СББ – синдром Барде-Бидля
СОАС – синдром обструктивого апноэ сна
СТГ – соматотропный гормон
СССГ- глобулин, связывающий половые стероиды
СД – сахарный диабет
СПВ – синдром Прадера-Вилли
ТТГ – тиреотропный гормон
УЗИ – ультразвуковое исследование
ФСГ – фолликулостимулирующий гормон
ЭКГ – электрокардиография
ЭхоКГ – эхокардиография
SDS – коэффициент стандартного отклонения (standard deviation score)
Т3 - трийодтиронин
СТ4 – свободный тироксин
СД2 – сахарный диабет 2 типа
Термины и определения
Простое (конституционально-экзогенное, идиопатическое) ожирение - ожирение, связанное с избыточным поступлением калорий в условиях гиподинамии и наследственной предрасположенности.
Гипоталамическое ожирение - ожирение, связанное с наличием и лечением опухолей гипоталамуса и ствола мозга, лучевой терапией опухолей головного мозга и гемобластозов, травмой черепа или инсультом.
Ятрогенное ожирение – ожирение, связанное с длительным приемом лекарственных препаратов (глюкокорткоиды, антидепрессанты и др.)
Синдромальное ожирение – ожирение, развивающееся при хромосомных и других генетических синдромах (Прадера-Вилли, хрупкой Х-хромосомы, Альстрема, Кохена, Дауна, псевдогипопаратиреозе и др.)
Моногенное ожирение – ожирение, развивающееся вследствие мутации в гене (лептин, рецептор лептина, рецептор меланокортинов 3 и 4 типа, проопиомеланокортин, проконвертаза 1 типа, рецептор нейротрофического фактора - тропомиозин-связанная киназа В).
Инсулинорезистентность - нарушение действия инсулина и реакции на него инсулинчувствительных тканей на пре-, пост- и рецепторном уровнях, приводящее к хроническим метаболическим изменениям и сопровождающееся на первых этапах компенсаторной гиперинсулинемией.
Индекс массы тела – индекс, который рассчитывается как отношение массы тела в килограммах к квадрату роста человека, выраженному в метрах и позволяет косвенно судить о количестве жировой ткани в организме.
Физическая активность – любая работа, совершаемая скелетными мышцами и приводящая к затрате энергии сверх уровня, характерного для состояния покоя.
Физическая активность умеренной интенсивности – физическая активность, сопровождающаяся учащением пульса, ощущением тепла и небольшой одышкой.
Физическая активность высокой интенсивности – физическая активность, сопровождающаяся усилением потоотделения и резким учащением дыхания
Основной обмен — расход энергии на поддержание жизни в теле (т.е. дыхания, кровообращения и др). Определяется количеством калорий, который организм тратит в покое без физической нагрузки.
Критерии оценки качества медицинской помощи
|
№№ |
Критерии качества |
Оценка выполнения |
|---|---|---|
|
1 |
Назначен прием (осмотр, консультация) врача – детского эндокринолога первичный |
Да/Нет |
|
2 |
Назначено исследование уровня глюкозы в крови и/или проведение глюкозотолерантного теста |
Да/Нет |
|
3 |
Выполнен анализ крови биохимический общетерапевтический (исследование уровня холестерина, аланинаминотрансферазы и аспартатаминотрансефразы) |
Да/Нет |
|
4 |
Выполнено исследование уровня глюкозы в крови и/или проведение глюкозотолерантного теста |
Да/Нет |
|
5 |
Выполнено ультразвуковое исследование органов брюшной полости (комплексное) |
Да/Нет |
|
6 |
Выполнено лечение орлистатом или лираглутидом (в зависимости от медицинских показаний и при отсутствии медицинских противопоказаний) |
Да/Нет |
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
РУКОВОДИТЕЛИ:
Петеркова Валентина Александровна – академик РАН, профессор, доктор медицинских наук, научный руководитель Института детской эндокринологии ФГБУ «НМИЦ эндокринологии» Минздрава России, заведующая кафедрой детской эндокринологии-диабетологии Института высшего и дополнительного профессионального образования ФГБУ «НМИЦ эндокринологии» Минздрава России, главный внештатный детский специалист эндокринолог Минздрава России.
Безлепкина Ольга Борисовна – доктор медицинских наук, заместитель директора Центра - директор Института детской эндокринологии ФГБУ «НМИЦ эндокринологии» Минздрава России, профессор кафедры детской эндокринологии-диабетологии Института высшего и дополнительного профессионального образования ФГБУ НМИЦ эндокринологии Минздрава России.
АВТОРЫ ТЕКСТА:
Васюкова Ольга Владимировна - кандидат медицинских наук, ведущий научный сотрудник Института детской эндокринологии и руководитель центра лечения и профилактики метаболических заболеваний и ожирения ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России.
Окороков Павел Леонидович - кандидат медицинских наук, старший научный сотрудник Института детской эндокринологии ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России.
Малиевский Олег Артурович - доктор медицинских наук, профессор кафедры госпитальной педиатрии ФГБОУ ВО «Башкирский государственный медицинский университет» Минздрава России, главный внештатный специалист детский эндокринолог Приволжского Федерального округа.
Неймарк Александр Евгеньевич - кандидат медицинских наук, врач-хирург, руководитель НИЛ хирургии метаболических нарушений, ведущий научный сотрудник, доцент НМИЦ им.В.А.Алмазова.
Зорин Евгений Александрович –кандидат медицинских наук, врач - хирург, заведующий хирургическим отделением ФГАУ НМИЦ "Лечебно-реабилитационный центр" Минздрава России
Яшков Юрий Иванович - доктор медицинских наук, руководитель службы «Хирургия ожирения» АО «ЦЭЛТ», Почетный президент МОО «Общество бариатрических хирургов»
Бурмицкая Юлия Вадимовна - кандидат медицинских наук, врач - детский эндокринолог, врач - сомнолог центра лечения и профилактики метаболических заболеваний и ожирения ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России.
Копытина Дарья Александровна - врач -детский эндокринолог ГНЦ РФ ФГБУ «НМИЦ эндокринологии» Минздрава России.
РЕЦЕНЗЕНТЫ:
Башнина Елена Борисовна - доктор медицинских наук, профессор кафедры эндокринологии имени академика В.Г. Баранова ФГОУВО «Северо-Западный государственный медицинский университет имени И.И. Мечникова», главный внештатный специалист детский эндокринолог Северо-Западного ФО.
Галкина Галина Александровна - доктор медицинских наук, заведующая детским эндокринным отделением НИИ акушерства и педиатрии ФГБОУ ВО "Ростовский государственный медицинский университет" Минздрава России, главный внештатный специалист детский эндокринолог Ростовской области, главный внештатный специалист детский эндокринолог Южного ФО.
Колодкина Анна Александровна - заведующая отделением наследственных заболеваний и эндокринопатий раннего возраста Института детской эндокринологии ФГБУ «НМИЦ эндокринологии» Минздрава России, кандидат медицинских наук.
Кострова Ирина Борисовна - заведующая отделением детской эндокринологии ГБУ "Детская республиканская клиническая больница им. Н. М. Кураева", главный внештатный специалист детский эндокринолог республики Дагестан, главный внештатный специалист детский эндокринолог Северо- Кавказского ФО.
Нагаева Елена Витальевна - заведующая отделением тиреоидологии, нарушений соматического и репродуктивного развития Института детской эндокринологии ФГБУ «НМИЦ эндокринологии» Минздрава России ФГБУ «НМИЦ эндокринологии» Минздрава России, доктор медицинских наук
Петряйкина Елена Ефимовна - доктор медицинских наук, директор Российской детской клинической больницы ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И.Пирогова» Минздрава России, главный внештатный специалист детский эндокринолог г. Москвы, главный внештатный специалист детский эндокринолог Центрального ФО.
Светлова Галина Николаевна – заместитель главного врача ФГБУ «НМИЦ эндокринологии» Минздрава России ФГБУ «НМИЦ эндокринологии» Минздрава России, врач детский эндокринолог, кандидат медицинских наук.
Таранушенко Татьяна Евгеньевна - доктор медицинских наук, заведующая кафедрой педиатрии института последипломного образования ГБОУ ВО "Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясеневского" Минздрава России, главный внештатный специалист детский эндокринолог Красноярского края, главный внештатный специалист детский эндокринолог Сибирского ФО.
Чугунов Игорь Сергеевич - заведующий детским отделением опухолей эндокринной системы Института детской эндокринологии ФГБУ «НМИЦ эндокринологии» Минздрава России, кандидат медицинских наук
Конфликт интересов: авторы клинических рекомендаций декларируют отсутствие конфликта интересов.
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму
Приложение А2. Методология разработки клинических рекомендаций
Методы, используемые для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для оценки качества и силы доказательств: доказательной базой для рекомендаций являлись публикации, вошедшие в Кохрейновскую библиотеку, базы данных EMBASE, MEDLINE и PubMed. Глубина поиска - 15 лет.
Методы, использованные для оценки качества и силы доказательств:
консенсус экспертов;
оценка значимости в соответствии с рейтинговой схемой.
Методы, использованные для анализа доказательств:
обзоры опубликованных мета-анализов;
систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее валидности. Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь, влияет на силу рекомендаций.
Для минимизации потенциальных ошибок каждое исследование оценивалось независимо. Любые различия в оценках обсуждались всей группой авторов в полном составе. При невозможности достижения консенсуса привлекался независимый эксперт.
Таблицы доказательств: заполнялись авторами клинических рекомендаций.
Методы, использованные для формулирования рекомендаций: консенсус экспертов.
Индикаторы доброкачественной практики (Good Practice Points – GPPs)
Рекомендуемая доброкачественная практика базируется на клиническом опыте авторов разработанных рекомендаций.
Экономический анализ
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидации рекомендаций
Внешняя экспертная оценка.
Внутренняя экспертная оценка.
Описание метода валидации рекомендаций
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых, прежде всего, попросили прокомментировать, насколько доступна для понимания интерпретация доказательств, лежащая в основе рекомендаций.
От врачей первичного звена (детских эндокринологов) получены комментарии в отношении доходчивости изложения данных рекомендаций, а также их оценка важности предлагаемых рекомендаций, как инструмента повседневной практики.
Все комментарии, полученные от экспертов, тщательно систематизировались и обсуждались членами рабочей группы (авторами рекомендаций). Каждый пункт обсуждался в отдельности.
Консультация и экспертная оценка
Проект рекомендаций был рецензирован независимыми экспертами, которых, прежде всего, попросили прокомментировать доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Рабочая группа
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Основные рекомендации
Сила рекомендаций (1-5) на основании соответствующих уровней доказательств (А-С) (таблица П1 и таблица П2) приводятся при изложении текста рекомендаций.
Целевая аудитория данных клинических рекомендаций:
-
Врачи – детские эндокринологи;
-
Врачи – педиатры;
-
Врачи общей практики.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1 |
Систематический обзор РКИ с применением мета-анализа |
|
2 |
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
|
3 |
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
|
5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР |
Расшифровка |
|---|---|
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Решение об обновлении принимает Минздрав России на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
-
Приказ Минздрава России от 09.11.2012 N 851н "Об утверждении стандарта первичной медико-санитарной помощи детям при ожирении" (Зарегистрировано в Минюсте России 28.02.2013 N 27399)
-
Приказ Минздрава России от 07.11.2012 N 677н Об утверждении стандарта специализированной медицинской помощи детям при ожирении (Зарегистрировано в Минюсте России 17.01.2013 N 26564)
Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение 1. Нормативные значения ИМТ для детей от 0 до 5 лет (по ВОЗ).
Источник: (http://who.int/childgrowth/standards/ru/) Назначение: для оценки нормальной, избыточной массы тела и степени ожирения.
Приложение 2. Нормативные значения ИМТ для детей от 5 до 19 лет (по ВОЗ).
Источник: https://www.who.int/tools/growth-reference-data-for-5to19-years/indicators/bmi-for-age
Назначение: для оценки нормальной, избыточной массы тела и степени ожирения
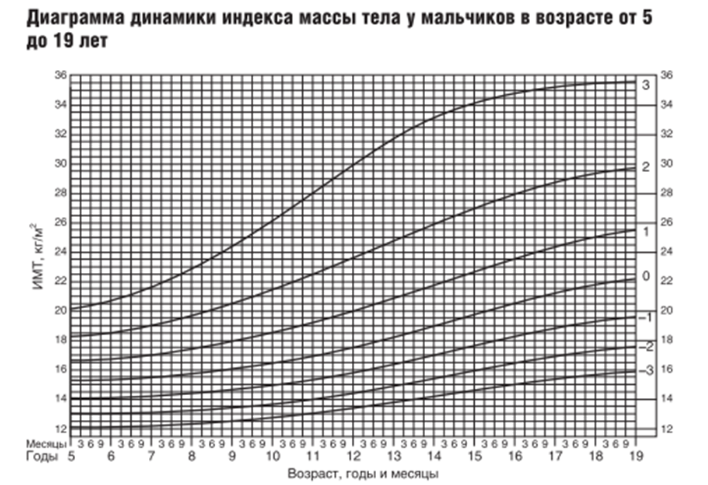
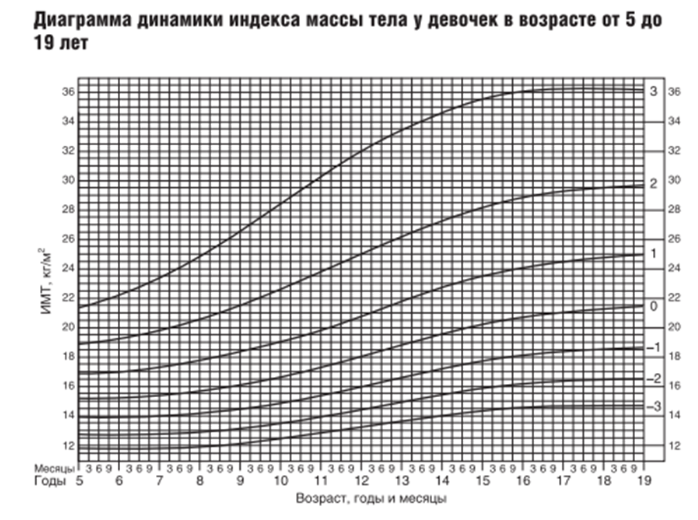
Приложение 3. Стадии полового развития по шкале Tanner.
3. Стадии развития молочных желез и полового оволосения у девочек по Tanner
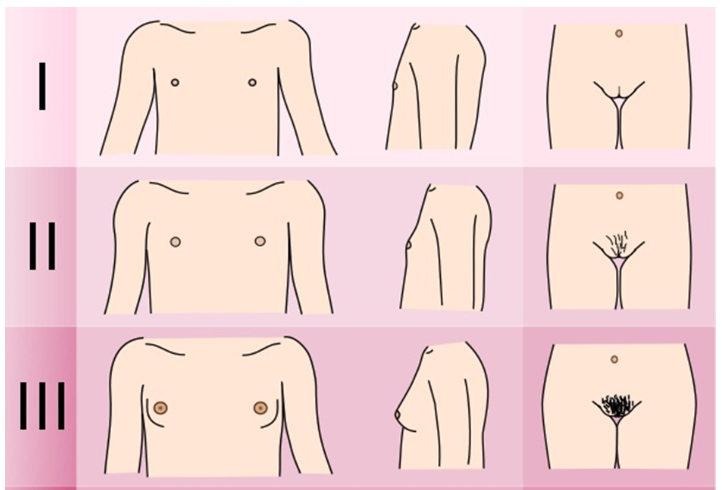
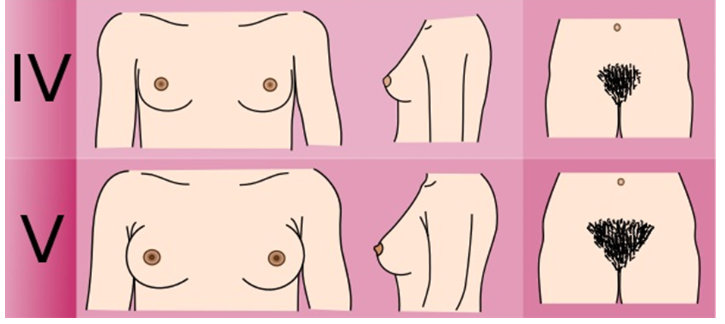
Рисунок 1. Стадии развития молочных желез и полового оволосения у девочек по Tanner.
Молочные железы: 1 стадия: молочные железы препубертатные, Препубертатный железистая ткань отсутствует, диаметр ареолы < 2 см, ареолы бледно окрашены. 2 стадия: молочные железы и ареолы выступают в виде конуса без выделения их контуров, появляется пигментация ареолы. 3 стадия - Ареола интенсивно окрашена, выступает в виде второго конуса над тканью молочной железы. 4 стадия -зрелая грудь, выступает только сосок.
Половое оволосение: 1 стадия - оволосение отсутствует. 2 стадия - рост редких пигментированных волос на половых губах. 3 стадия - волосы становятся темнее и гуще, располагаются на лонном сочленении. 4 стадия- оволосение лобковой области полное.
3. Стадии полового развития у мальчиков по Tanner
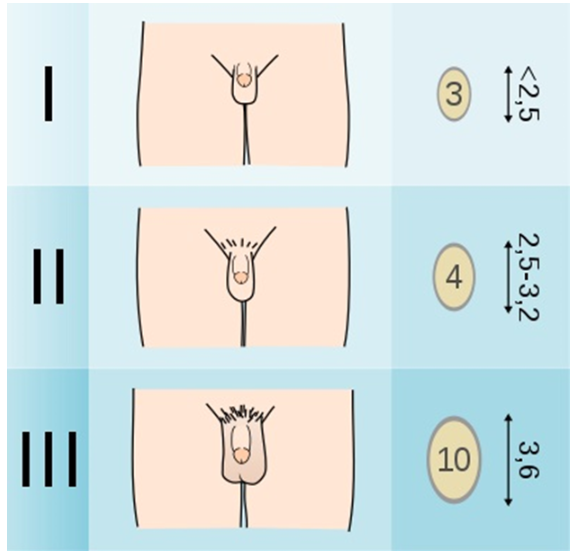
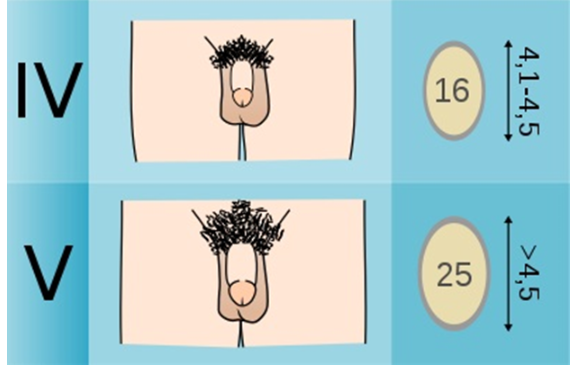
Рисунок 2. Стадии полового развития у мальчиков. 1 стадия -оволосение отсутствует; яички, мошонка и половой член допубертатные. Объем яичек 2-3 мл. 2 стадия - рост редких пигментированных волос вокруг основания полового члена; мошонка увеличивается, становится слегка окрашенной. Объем яичек 4 мл. 3 стадия - волосы становятся темнее и гуще, располагаются на лонном сочленении; начинается рост полового члена в длину; мошонка начинает приобретать складчатость. Объем яичек 10 мл. 4 стадия - оволосение лобковой области полное, но отсутствует оволосение бёдер и нижней части живота; половой член продолжает расти в длину; увеличивается диаметр головки; наружные гениталии приобретают пигментацию. Объем яичек – от 12 мл. 5 стадия - Взрослый «ромбовидный» тип оволосения; наружные гениталии достигают максимальных размеров. Объем яичек – от 15 мл.
Приложение Б. Алгоритмы действий врача
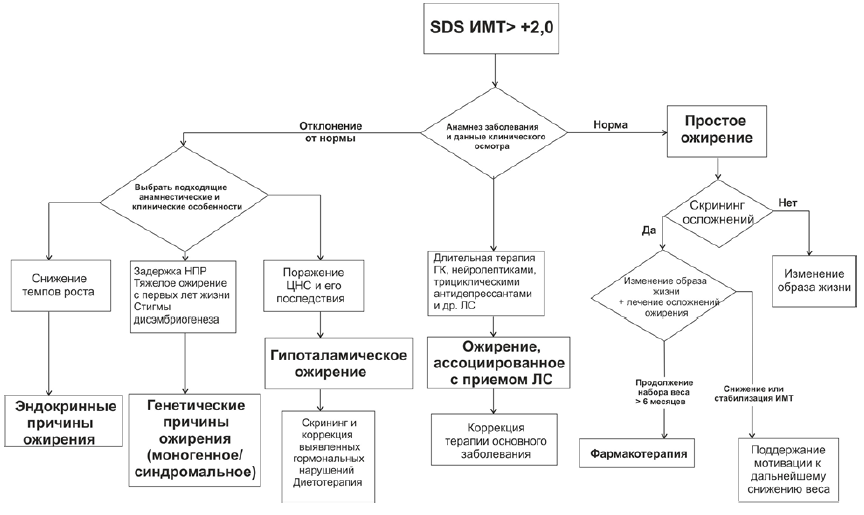
Приложение В. Информация для пациента
Рекомендации для детей и подростков с избыточной массой тела.
Лучшая диета для снижения веса — это здоровое питание!
ОСНОВНЫЕ ПРАВИЛА ЗДОРОВЬЯ
1. ОБРАЗ ЖИЗНИ
-
Составь для себя распорядок дня на неделю (сон, завтрак, школа, обед, компьютер, встреча с друзьями, секция или кружок, репетитор, ужин, ”ничегонеделание”, помощь по дому, чтение для себя и т.д.) и старайся его выполнять: регулярность ¾ залог успеха.
-
Помощь родителей: попроси родителей помочь тебе (даже если у них тоже есть избыточная масса тела и они уверены, что это хорошо и у тебя проблем нет), правильно сформулируй свою просьбу: если есть вопросы, которые ты бы хотел обсудить с врачом, попроси родителей записаться на прием; приготовить для тебя еду, которую ты бы хотел взять с собою в школу на перекус; погулять с тобою, записать тебя в секцию или вместе сходить на тренировку; организовать еженедельные (в идеале ¾ ежедневные семейные обеды или ужины).
-
Полноценный сон: здоровый сон должен длиться не менее 8-9 часов; для желающих похудеть нужно спать крепко как минимум с 24 ночи до 6 утра, поэтому старайся быть в кровати в 22 – 22-30 часа.
-
Режим питания не должен вызывать чувство голода: чтобы худеть, нужно есть чаще (завтрак, обед, ужин и два перекуса), но меньше. Научись брать еду для перекуса в школу с собой.
-
От ужина при желании можно отказаться. Но завтрак в твоей жизни обязателен!
-
Во время еды ¾ только еда. Не читай, не смотри телевизор, не сиди за компьютером. И тогда ты счастливо избежишь “переедания”.
-
То, что съедается и выпивается в течение дня, должно соответствовать твоей активности. Поэтому необходимо устранить привычку принимать основное количество пищи на ночь, стараться прекращать приём пищи за 2-3 часа до сна. Исключи еду "на ходу" и “фаст фуд”- хот-доги, чипсы, бутерброды, жареные продукты.
-
Просмотр телевизора, работа и игра на компьютере ¾ не более 1-2 часов в день!
-
Постепенность — никакого голодания и супер-диет! Снижение веса должно быть постепенным, не более 500 г в неделю.
-
“Не заедать обиды”: неприятные ситуации, волнения и переживания в школе, дома лучше “не заедать” под подушкой, а “заговаривать” в беседе с родителями и друзьями, если необходимо – попроси родителей сходить с тобой к психологу.
-
Обязательно следи за весом. Взвешиваться лучше с утра, до еды, 1 раз в неделю. Не забывай записывать свой вес. Радуйся каждому потерянному и не набранному килограмму.
2. ФИЗИЧЕСКИЕ УПРАЖНЕНИЯ
-
Главный принцип — двигайся!
-
Помни, что для эффективного снижения веса физические упражнения должны быть ежедневными, продолжительностью не менее 60 минут.
-
Ходи на аэробику, шейпинг, фитнес, аквааэробику, в бассейн, просто ходи пешком.
-
Не нравится спорт — ходи на танцы.
-
Помогай дома — мой посуду, полы, протирай пыль.
-
Если есть время, пройдись пешком до школы и обратно, а не добирайся на автобусе или метро.
3. ПИТАНИЕ
-
Все сладкие напитки (это не только газированные напитки, но также все покупные соки и холодные чаи) нежелательны! Во-первых, это вредно, во-вторых – сладко. Лучше всего пить простую или минеральную воду, чай и кофе с 1 чайной ложкой сахара, лимоном или молоком, отвары ягод (шиповника), по желанию – компот из свежих фруктов без сахара, 0,5 - 1 стакан свежевыжатого фруктового сока (яблоко, апельсин, ягоды), на 1/3 разведенного водой, или овощного сока.
-
Ешь кашу на завтрак: овсяная каша с яблоками, изюмом, пшенная с тыквой, гречневая каша с молоком. Гречка с мясом на завтрак тоже очень даже хорошо. Дело в том, что каши содержат «длинные» углеводы (в отличие от «коротких» углеводов, которыми обладают твои любимые булочки) и дают тебе необходимую энергию до обеда. Также для завтрака подойдут овсяные хлопья (не кукурузные!), которые можно смешать с кефиром, молоком, фруктами.
-
Полюби фрукты и овощи: яблоки (хороши в запеченном виде), цитрусовые (грейпфрут, апельсин, несладкие мандарины), ягоды (свежие и замороженные), ананас, капусту (белокочанную, цветную, брюссельскую и т.д.), огурцы, тыкву, томаты, кабачки, баклажаны (только все не жареное), стручковую фасоль и зеленый горошек, зелень (салат, петрушка, сельдерей, укроп) запеченный или отварной картофель. Исключи: бананы, груши, виноград, финики, сухофрукты, орехи и семечки, чипсы, картофель жареный и “фри”.
-
Не увлекайся сладкими йогуртами и творожками: большинство из них содержат в своем составе много сахара и крахмал. Забудь про глазированные сырки и творожную массу. Можно – творог до 5% жирности, натуральный йогурт, кефир, ряженку, простоквашу.
-
Старайся регулярно есть рыбные или мясные блюда. Диетические сорта мяса – это курица, телятина, индейка, говядина. Избегай: колбасу, сосиски, сардельки, рыбные консервы в масле, копченую рыбу.
-
Ограничь потребление сладостей до 1 приема в течение дня. Старайся заменить конфеты фруктами и ягодами. Предпочтительны (редко, немного): мармелад, пастила, зефир – вместо шоколада и халвы, сорбет - вместо мороженого.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Информация отсутствует.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.