Меланома кожи и слизистых оболочек
 Версия: Клинические рекомендации РФ 2025 (Россия)
Версия: Клинические рекомендации РФ 2025 (Россия)
Вторичное злокачественное новообразование других локализаций (C79), Вторичное злокачественное новообразование органов дыхания и пищеварения (C78), Вторичное и неуточненное злокачественное новообразование лимфатических узлов (C77), Злокачественная меланома кожи (C43), Злокачественное новообразование влагалища (C52), Злокачественное новообразование вульвы (C51), Злокачественное новообразование гортани (C32), Злокачественное новообразование конъюнктивы (C69.0), Злокачественное новообразование мошонки (C63.2), Злокачественное новообразование полового члена неуточненной локализации (C60.9), Злокачественное новообразование полости носа и среднего уха (C30), Злокачественное новообразование придаточных пазух (C31), Злокачественное новообразование шейки матки (C53), Злокачественные новообразования губы, полости рта и глотки (C00-C14), Злокачественные новообразования органов пищеварения (C15-C26), Меланома in situ (D03)
Онкология, Онкология детская
Общая информация
Краткое описание
Разработчик клинической рекомендации
Ассоциация онкологов России,
Ассоциация специалистов по проблемам меланомы,
Общероссийская общественная организация «Российское общество клинической онкологии»,
Российское общество детских онкологов и гематологов
Ассоциация специалистов по проблемам меланомы,
Общероссийская общественная организация «Российское общество клинической онкологии»,
Российское общество детских онкологов и гематологов
Одобрено Научно-практическим Советом Минздрава России
Клинические рекомендации
Меланома кожи и слизистых оболочек
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 921_1
Возрастная категория: Взрослые, Дети
Определение заболевания или состояния (группы заболеваний или состояний)
Меланома кожи – злокачественная опухоль нейроэктодермального происхождения, исходящая из меланоцитов (пигментных клеток) кожи [1]. В некоторых случаях при наличии отдаленных метастазов первичный очаг на коже (или в других органах) не может быть обнаружен (например, вследствие так называемой спонтанной регрессии первичной опухоли или удаления очага во время медицинской или косметологической манипуляции без морфологического исследования) – такую болезнь следует называть метастазами меланомы без выявленного первичного очага. С учетом того, что меланоциты в норме представлены в различных органах (включая слизистые оболочки желудочно-кишечного тракта, половых путей, мозговые оболочки, сосудистую оболочку глаза и др.) [2], первичная опухоль (меланома) может возникнуть в любом из этих органов. В этом случае опухоль следует называть меланомой соответствующего органа, например, меланомой слизистой оболочки подвздошной кишки или меланомой сосудистой оболочки глаза.
Злокачественная меланома кожи (С43, C51, C60.9, C63.2) [33]:
Метастазы меланомы без выявленного первичного очага:
Меланома слизистых оболочек:
Меланома in situ:
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
По Международной статистической классификации болезней и проблем, связанных со здоровьем (далее - МКБ-10) такие опухоли классифицируются в соответствии с органом первичного происхождения, например, меланома подвздошной кишки будет иметь код С17.2, меланома сосудистой оболочки глаза – С69.3, меланома кожи – С43.
Злокачественная меланома кожи (С43, C51, C60.9, C63.2) [33]:
• C43.0 Злокачественная меланома губы;
• C43.1 Злокачественная меланома века, включая спайку век;
• C43.2 Злокачественная меланома уха и наружного слухового прохода;
• C43.3 Злокачественная меланома других и неуточненных частей лица;
• C43.4 Злокачественная меланома волосистой части головы и шеи;
• C43.5 Злокачественная меланома туловища (включая кожу перианальной области, ануса и пограничной зоны, грудной железы);
• C43.6 Злокачественная меланома верхней конечности, включая область плечевого сустава;
• C43.7 Злокачественная меланома нижней конечности, включая область тазобедренного сустава;
• C43.8 Злокачественная меланома кожи, выходящая за пределы одной и более вышеуказанных локализаций;
• C43.9 Злокачественная меланома кожи неуточненная;
• С51 Злокачественное новообразование вульвы;
• C60.9 Злокачественные новообразования полового члена неуточненной локализации;
• C63.2 Злокачественные новообразования мошонки;
• C69.0 Злокачественное новообразование конъюнктивы.
Метастазы меланомы без выявленного первичного очага:
• C77 Вторичное и неуточненное злокачественное новообразование лимфатических узлов (для случаев впервые выявленных метастазов меланомы в лимфатические узлы без выявленного первичного очага);
• C78 Вторичное злокачественное новообразование органов дыхания и пищеварения;
• C79 Вторичное злокачественное новообразование других локализаций.
Меланома слизистых оболочек:
• C00–С14 Злокачественные новообразования губы, полости рта и глотки;
• С15–С26 Злокачественные новообразования органов пищеварения;
• С30-С32: Злокачественное новообразование полости носа и среднего уха, Злокачественное новообразование придаточных пазух, Злокачественное новообразование гортани;
• С51–С53 Злокачественные новообразования женских половых органов;
• C60.9 Злокачественные новообразования полового члена неуточненной локализации.
Меланома in situ:
• D03.0 Меланома in situ губы;
• D03.1 Меланома in situ века, включая спайку век;
• D03.2 Меланома in situ уха и наружного слухового прохода;
• D03.3 Меланома in situ других и неуточненных частей лица;
• D03.4 Меланома in situ волосистой части головы и шеи;
• D03.5 Меланома in situ туловища;
• D03.6 Меланома in situ верхней конечности, включая область плечевого пояса;
• D03.7 Меланома in situ нижней конечности, включая тазобедренную область;
• D03.8 Меланома in situ других локализаций;
• D03.9 Меланома in situ неуточненной локализации.
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
1. Международная гистологическая классификация
Международная гистологическая классификация меланоцитарных опухолей кожи [34]:
Меланоцитарные опухоли кожи, эпизодически подвергающейся солнечному воздействию:
-
меланома на коже с низким кумулятивным солнечным повреждением (поверхностно-распространяющаяся меланома): 8743/3
-
простое лентиго и лентигинозный меланоцитарный невус 8742/0 (новый код)
-
пограничный невус 8740/0
-
сложный невус 8760/0
-
дермальный невус 8750/0
-
диспластический невус 8727/0
-
пятинстый невус (nevus spilus) 8720/0
-
невус особых локализаций (молочной железы, подмышечной области, волосистой части головы и уха):
-
гало-невус 8723/0
-
невус Мейерсона 8720/0
-
-
рецидивирующий невус
-
глубокопенетрирующий невус 8720/0
-
пигментированная эпителиодная меланоцитома 8780/1 (новый код)
-
комбинированный невус, включая невус/меланоцитому с инактивацией BAP1 8720/0
-
Меланоцитарные опухоли, возникающие на коже, подвергаемой хронической инсоляции:
-
меланома по типу злокачественного лентиго 8742/3
-
десмопластическая меланома 8745/3
Спицоидные опухоли:
-
злокачественная опухоль Спитц (Спитц-меланома) 8770/3
-
Спитц-невус 8770/0
-
пигментированный веретеноклеточный невус (невус Рида) 8770/0
Меланоцитарные опухоли, возникающие на коже акральной локализации:
-
акральная меланома 8744/3
-
акральный невус 8744/0 (новый код)
Меланоцитарные опухоли гениталий и слизистых оболочек:
-
меланомы слизистых оболочек (гениталии, полость рта, пазухи носа): 8720/3
-
лентиго-меланома слизистых оболочек 8746/3
-
узловая меланома слизистых оболочек 8721/3
-
-
генитальный невус 8720/0
Меланоцитарные опухоли, происходящие из голубого невуса:
-
меланома из голубого невуса 8780/3
-
голубой невус, без дополнительного уточнения 8780/0
-
клеточный голубой невус 8790/0
-
монгольское пятно
-
невус Ито
-
невус Ота
Меланоциатрные опухоли из врожденных невусов:
-
меланома из гигантского врожденного невуса 8761/3
-
врожденный меланоцитарный невус 8761/0
-
пролиферативные узелки во врожденном невусе 8762/1
Меланоцитарные опухоли глаза:
-
увеальная меланома
-
эпителиодноклеточная меланома 8771/3
-
веретеноклеточная меланома, тип А 8773/3
-
веретеноклеточная меланома, тип В 8774/3
-
-
меланома конъюнктивы
-
меланома, без дополнительного уточнения 8720/3
-
конъюнктивальный первичный приобретенный меланоз с атипией/меланома in situ 8720/2
-
конъюнктивальный невус 8720/0
Узловая, невоидная и метастатическая меланома:
-
узловая меланома 8721/3
-
невоидная меланома 8720/3
-
метастатическая меланома 8720/6
2. Стадирование
Стадирование меланомы кожи по классификации TNM AJCC/UICC 8-го пересмотра (2017 г.) [35,36]. Для процедуры стадирования меланомы гистологическое подтверждение обязательно. Оценку состояния лимфатических узлов для установления стадии выполняют при помощи клинического осмотра, инструментальных исследований и процедуры биопсии сторожевого лимфатического узла.
Критерий Т отражает распространенность первичной опухоли. Классификация по критерию Т возможна только после удаления первичной опухоли и ее гистологического исследования (Таблица 3).
Таблица 3.
Критерий Т (первичная опухоль)
Критерий Т (первичная опухоль)
|
Критерий T
|
Толщина опухоли по Бреслоу
|
Изъязвление первичной опухоли
|
|---|---|---|
|
Тx: толщина первичной опухоли не может быть определена (например, при удалении опухоли кюретажем, бритвенной биопсии или частичной регрессии меланомы)
|
Неприменимо
|
Неприменимо
|
|
Т0: нет признаков первичной̆ опухоли (например, не выявлен первичный̆ очаг или полная регрессия меланомы)
|
Неприменимо
|
Неприменимо
|
|
Tis: меланома in situ (уровень инвазии по Кларку I) (атипическая меланоцитарная гиперплазия, тяжелая меланоцитарная дисплазия, неинвазивная злокачественная опухоль)
|
Неприменимо
|
Неприменимо
|
|
T1
|
≤1,0 мм
|
Неизвестно или не определено
|
|
T1a
|
<0,8 мм
|
Без изъязвления
|
|
T1b
|
<0,8 мм
|
C изъязвлением
|
|
0,8–1,0 мм
|
C изъязвлением или без него
|
|
|
T2
|
>1,0 и ≤2,0 мм
|
Неизвестно или не определено
|
|
T2a
|
>1,0 и ≤ 2,0 мм
|
Без изъязвления
|
|
T2b
|
>1,0 и ≤2,0 мм
|
C изъязвлением
|
|
T3
|
>2,0 и ≤4,0 мм
|
Неизвестно или не определено
|
|
T3a
|
>2,0 и ≤4,0 мм
|
Без изъязвления
|
|
T3b
|
>2,0 и ≤4,0 мм
|
C изъязвлением
|
|
T4
|
>4,0 мм
|
Неизвестно или не определено
|
|
T4a
|
>4,0 мм
|
Без изъязвления
|
|
T4b
|
>4,0 мм
|
C изъязвлением
|
Критерий N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах (Таблица 4).
Для опухолей, расположенных преимущественно на одной стороне тела (левой или правой), регионарными лимфатическими узлами следует считать:
-
голова, шея: ипсилатеральные околоушные, подчелюстные, шейные и надключичные лимфатические узлы;
-
грудная стенка: ипсилатеральные подмышечные лимфатические узлы;
-
верхняя конечность: ипсилатеральные локтевые и подмышечные лимфатические узлы;
-
живот, поясница и ягодицы: ипсилатеральные паховые лимфатические узлы;
-
нижняя конечность: ипсилатеральные подколенные и паховые лимфатические узлы;
-
край ануса и кожа перианальной области: ипсилатеральная паховые лимфатические узлы.
В случае расположения опухоли в пограничных зонах лимфатические узлы с обеих сторон могут считаться регионарными.
Таблица 4
Критерий N (поражение регионарных лимфатических узлов)
|
Критерий N (соответствует pN)
|
Количество пораженных лимфатических узлов
|
Транзитные, сателлитные или микросателлитные метастазы
|
|---|---|---|
|
Nх1
|
Регионарные лимфатические узлы не могут быть оценены
|
Неприменимо
|
|
N0
|
Нет признаков поражения регионарных лимфатических узлов
|
Отсутствуют
|
|
N1
|
Один пораженный регионарный лимфатический узел или наличие транзитных, сателлитных либо микросателлитных метастазов
|
|
|
N1а
|
Один пораженный клинически не определяемый регионарный лимфатический узел (т. е. выявленный по данным биопсии сторожевого лимфатического узла)
|
Отсутствуют
|
|
N1b
|
Один пораженный клинически определяемый регионарный лимфатический узел
|
Отсутствуют
|
|
N1c
|
Нет метастазов в регионарных лимфатического узлах
|
Присутствуют
|
|
N2
|
Два или три пораженных регионарных лимфатических узла или один пораженный регионарный лимфатический узел в сочетании с наличием транзитных, сателлитных или микросателлитных метастазов
|
|
|
N2а
|
Два или три пораженных клинически не определяемых регионарных лимфатического узла (т. е. выявленных по данным биопсии сторожевого лимфатического узла)
|
Отсутствуют
|
|
N2b
|
Два или три пораженных клинически определяемых регионарныих лимфатического узла
|
Отсутствуют
|
|
N2c
|
Один пораженный клинически не определяемый или определяемый регионарный лимфатический узел
|
Присутствуют
|
|
N3
|
Четыре и более пораженных регионарных лимфатических узла или два и более пораженных регионарных лимфатических узла в сочетании с наличием транзитных, сателлитных или микросателлитных метастазов
|
|
|
N3а
|
Четыре и более пораженных клинически не определяемых регионарных лимфатических узла (т. е. выявленных по данным биопсии сторожевого лимфатического узла)
|
Отсутствуют
|
|
N3b
|
Четыре и более пораженных регионарных лимфатических узла, среди которых хотя бы один определяется клинически, или наличие конгломератов лимфатических узлов
|
Отсутствуют
|
|
N3c
|
Два или более клинически не определяемых или определяемых регионарных лимфатического узла, или конгломераты регионарных лимфоузлов
|
Присутствуют
|
1В соответствии с правилами классификации UICC для оценки состояния регионарных узлов допускается клинический или радиологический метод, в то время как правила AJCC строго рекомендуют выполнять морфологическую оценку состояния регионарных лимфатических узлов и указывать Nx всегда, когда биопсия сторожевого лимфатического узла не выполнялась или регионарные лимфатические узлы ранее удалены по иной причине). Исключение: морфологическое стадирование не требуется для меланомы с категорией̆ Т1, следует использовать клинические данные.
Примечание. Сателлитами называют опухолевые отсевы или узелки (макро- или микроскопические) в пределах 2 см от первичной опухоли. Транзитными метастазами называют метастазы в кожу или подкожную клетчатку на расстоянии более 2 см от первичной опухоли, но не распространяющиеся за пределы регионарных лимфатических узлов.
Изолированные опухолевые клетки, которые представляют собой отдельные клетки или кластеры клеток не более 0,2 мм в наибольшем измерении и которые могут быть обнаружены при помощи рутинного окрашивания гематоксилином и эозином или иммуногистохимического окрашивания, выявляемые в регионарных лимфатических узлах, классифицируются как метастазы (N1, N2 или N3 в зависимости от количества пораженных лимфатических узлов).
Ниже приведены анатомические ориентиры для определения пограничных зон шириной 4 см (Таблица 5).
Таблица 5.
Анатомические ориентиры пограничных зон для определения регионарных лимфатических бассейнов
|
Области
|
Линия границы (шириной 4 см)
|
|---|---|
|
Левая и правая половины тела
|
Срединная линия тела
|
|
Голова и шея/грудная стенка
|
Ключица – акромион – верхний край плеча
|
|
Грудная стенка/верхняя конечность
|
Плечо – подмышечная впадина – плечо
|
|
Грудная стенка/живот, поясница или ягодицы
|
Спереди: середина расстояния между пупком и реберной дугой; сзади: нижняя граница XII грудного позвонка (поперечный отросток)
|
|
Живот, поясница или ягодицы/нижняя конечность
|
Паховая складка – большой вертел – ягодичная борозда
|
При обнаружении метастазов в лимфатических узлах за пределами указанных регионарных зон метастазирования следует классифицировать их как отдаленные метастазы.
Критерий М характеризует наличие или отсутствие отдаленных метастазов (Таблица 6).
Таблица 6.
Критерий М (отдаленные метастазы)
Критерий М (отдаленные метастазы)
|
Критерий М
|
Анатомическая локализация метастазов
|
Уровень активности лактатдегидрогеназы в крови
|
|---|---|---|
|
М0
|
Нет признаков отдаленных метастазов
|
Неприменимо
|
|
M1
|
Есть отдаленные метастазы
|
–
|
|
M1a
|
Отдаленные метастазы в кожу, мягкие ткани (включая мышечную) и/или нерегионарные лимфатические узлы
|
Не указан или не определен
|
|
M1a(0)
|
Не повышен
|
|
|
M1a(1)
|
Повышен
|
|
|
M1b
|
Отдаленные метастазы в легкие с метастазами, соответствующими локализациям М1a, или без них
|
Не указан или не определен
|
|
M1b(0)
|
Не повышен
|
|
|
M1b(1)
|
Повышен
|
|
|
M1c
|
Отдаленные метастазы во внутренние органы, за исключением центральной нервной системы, с метастазами, соответствующими локализациям М1a и m1b, или без них
|
Не указан или не определен
|
|
M1c(0)
|
Не повышен
|
|
|
M1c(1)
|
Повышен
|
|
|
M1d
|
Отдаленные метастазы в центральную нервную систему
|
Не указан или не определен
|
|
M1d(0)
|
Не повышен
|
|
|
M1d(1)
|
Повышен
|
Группировка критериев для определения стадии меланомы представлена ниже (Таблица 7).
Таблица 7.
Группировка критериев TNM для определения стадии меланомы кожи
|
T
|
N
|
M
|
Стадия
|
|---|---|---|---|
|
Tis
|
N02
|
M0
|
0
|
|
T1a
|
N0
|
M0
|
IA
|
|
T1b
|
N0
|
M0
|
IA
|
|
T2a
|
N0
|
M0
|
IB
|
|
T2b
|
N0
|
M0
|
IIA
|
|
T3a
|
N0
|
M0
|
IIA
|
|
T3b
|
N0
|
M0
|
IIB
|
|
T4a
|
N0
|
M0
|
IIB
|
|
T4b
|
N0
|
M0
|
IIC
|
|
T0
|
N1b, N1c
|
M0
|
IIIB
|
|
T0
|
N2b, N2c, N3b или N3c
|
M0
|
IIIC
|
|
T1a/b–T2a
|
N1a или N2a
|
M0
|
IIIA
|
|
T1a/b–T2a
|
N1b/c или N2b
|
M0
|
IIIB
|
|
T2b/T3a
|
N1a–N2b
|
M0
|
IIIB
|
|
T1a–T3a
|
N2c или N3a/b/c
|
M0
|
IIIC
|
|
T3b/T4a
|
Любая категория N ≥N1
|
M0
|
IIIC
|
|
T4b
|
N1a–N2c
|
M0
|
IIIC
|
|
T4b
|
N3a/b/c
|
M0
|
IIID
|
|
Любая T, Tis
|
Любая категория N
|
M1
|
IV
|
2При стадии Tis или T1 не требуется морфологическая верификация состояния лимфатических узлов. Допускается использовать клиническую оценку состояния лимфатических узлов для патологического стадирования.
Метастазы меланомы кожи без выявленного первичного очага в периферические лимфатические узлы одного региона следует стадировать как III стадию (IIIB (T0N1b, T0N1c) или IIIC (T0N2b, N2c, N3b или N3c)).
Онлайн-калькулятор для определения стадии pTNM по классификации TNM AJCC/UICC 8-го пересмотра доступен на сайте http://melanoma.pro/site/calctnm.
Стадирование меланомы верхних дыхательных и пищеварительных путей (С00–06, C10–14, C30–32) по классификации TNM UICC 8-го пересмотра (2017 г.) [36].
Для процедуры стадирования меланомы гистологическое подтверждение обязательно. Оценку состояния лимфатических узлов для установления стадии выполняют при помощи клинического осмотра и инструментальных исследований.
Критерий Т отражает распространенность первичной опухоли:
-
Тx – недостаточно данных для оценки первичной опухоли (включая случаи спонтанной регрессии опухоли, а также ошибки при хирургическом удалении опухоли);
-
Т0 – отсутствие первичной опухоли;
-
Тis – критерий неприменим;
-
Т1 – критерий неприменим;
-
Т2 – критерий неприменим;
-
Т3 – опухоль ограничена только эпителием и/или подслизистым слоем (болезнь слизистой оболочки);
-
Т4а – опухоль прорастает в подлежащие мягкие ткани, хрящ, кость или прилежащую кожу;
-
Т4b – опухоль прорастает в любую из следующих структур: головной мозг, твердая мозговая оболочка, основание черепа, черепно-мозговые нервы основания черепа (IX, X, XI, XII), жевательную клетчатку, превертебральноую клетчатку, средостение.
Меланома слизистых оболочек является агрессивной опухолью, поэтому критерии T1 и Т2 пропущены, как и стадия I и II.
Критерий N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах:
-
Nx – недостаточно данных для оценки регионарных лимфатических узлов;
-
N0 – поражения регионарных лимфатических узлов нет;
-
N1 – наличие метастазов в регионарных лимфатического узлах.
Критерий М характеризует наличие или отсутствие отдаленных метастазов:
-
М0 – отдаленных метастазов нет;
-
М1 – наличие отдаленных метастазов.
Ниже приведена группировка критериев TNM для определения стадии меланомы слизистых оболочек (Таблица 8).
Таблица 8.
Группировка критериев TNM для определения стадии меланомы слизистых оболочек верхних отделов дыхательных и пищеварительных путей
|
Стадия
|
Т
|
N
|
M
|
|
III
|
Т3
|
N0
|
M0
|
|
IVA
|
Т4a
|
N0
|
M0
|
|
|
Т3, Т4a
|
N1
|
M0
|
|
IVB
|
Т4b
|
Любая
|
M0
|
|
IVC
|
Любая
|
Любая
|
M1
|
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Не существует единого этиологического фактора для развития меланомы. Самым значимым фактором риска спорадических (ненаследственных) форм меланомы кожи следует считать воздействие на кожу ультрафиолетового излучения типа В (длина волны 290–320 нм) и типа А (длина волны 320–400 нм). При этом чувствительность кожи к ультрафиолетовому воздействию различается у людей и может быть классифицирована на 6 типов, где 1-й и 2-й отличаются наибольшей чувствительностью (и, соответственно, вероятностью возникновения солнечного ожога), а 5-й и 6-й – наименьшей [3]. Другими факторами риска также считают наличие более 10 диспластических невусов, наличие более 100 обычных приобретенных невусов, рыжие волосы (как правило, сопряжено с I фототипом кожи), интенсивное периодически повторяющееся воздействие солнечного ультрафиолета (солнечные ожоги) в детстве [4-6]. Эпидемиологические данные показывают, что риск меланомы, связанный с ультрафиолетовым облучением, самый высокий у людей с прерывистым воздействием солнца и солнечными ожогами в детстве [7]. Также следует отметить такие факторы риска, как наличие гигантского или крупного врожденного невуса (площадью более 5 % площади поверхности тела), семейный анамнез меланомы кожи, личный анамнез меланомы кожи, синдром диспластических невусов, использование PUVA-терапии (по поводу псориаза и других хронических дерматозов), пигментная ксеродерма, врожденный или приобретенный иммунодефицит (например, после трансплантации органов или других заболеваниях, связанных с необходимостью принимать иммунносупрессоры) [8]. Факторы риска меланомы других локализаций (например, меланомы слизистых оболочек, меланомы акральных локализаций, увеальной меланомы) изучены недостаточно [9-12].
Большинство случаев меланомы у детей являются спорадическими, чаще связаны с ультрафиолетовым излучением (УФ), и по своим биологическим характеристикам этот вариант меланомы наиболее близок к меланоме у взрослых [13,14].
Этиология меланомы кожи у детей является предметом обсуждений. Вполне вероятно, что существует взаимодействие наследуемых факторов и факторов окружающей среды. Есть, однако, несколько известных факторов риска у детей, к которым, в том числе, относят и врожденный гигантский меланоцитарный невус (ВГМН) [15], ретинобластому, пигментную ксеродерму и случаи семейной меланомы [16], врожденный или приобретенный иммунодефицит (например, после трансплантации органов или других заболеваниях, связанных с необходимостью принимать иммунносупрессоры) [8].
Например, в исследовании подростков в возрасте 15–19 лет было выявлено, что риск развития меланомы в 34 раза выше у детей с наличием 100+ невусов на коже и в 15 раз выше у детей с наличием 10+ крупных невусов диаметром > 5 мм. [13,17] В исследовании, проведенном в Австралии, были обследованы дети младше 15 лет. В этом исследовании Whiteman et al. обнаружили, что наличие многочисленных невусов, веснушек на лице, повышенная чувствительность к ультрафиолетовому воздействию кожных покровов и меньшая способность к загару свидетельствуют о более высокой частоте развития меланомы [18].
Меланома у детей традиционно подразделяется на три основные варианта, которые отличаются друг от друга этиологически, механизмами канцерогенеза и клиническим течением [19,20]:
1) Меланома, возникшая на фоне ВГМН [21] – редкий вариант меланомы с наиболее неблагоприятным прогнозом;
2) Спитцоидная (Spitzoid) меланома – на ее долю приходится примерно половина случаев всех меланом у подростков, и она характеризуется благоприятным течением;
3) Меланома кожи, возникшая de novo – порядка 40-50% всех меланом кожи у детей, характеризуется узловым типом роста и агрессивным течением, по своим биологическим и молекулярно-генетическим характеристикам близка к меланоме кожи взрослых. Различие между этими подтипами важно для понимания, потому что существуют свои факторы риска и морфологические характеристики.
Меланома кожи, возникшая de novo, демонстрирует генетическое сходство с меланомой кожи у взрослых и в 40-60% случаев встречается мутация в гене BRAF. Меланома, возникающая на фоне ВГМН, имеет более низкую частоту, связанных с ультрафиолетом, мутаций.
Некоторые механизмы канцерогенеза при меланоме были изучены in vitro и in vivo: способность ультрафиолетового излучения индуцировать и стимулировать рост меланомы также была показана на нескольких моделях животных. Ультрафиолетовое излучение может способствовать меланомагенезу через различные пути. Мутации, характерные для ультрафиолетового облучения (особенно мутации, индуцированные ультрафиолетовым излучением типа B), встречаются в генах, участвующих в развитии меланомы. Ультрафиолетовое излучение инактивирует белок-супрессор опухолей p16INK4A, тем самым способствуя прогрессированию меланомы. Ультрафиолетовое излучение уменьшает экспрессию E- и P-кадгерина как на нормальных, так и на злокачественных меланоцитах, повышая передачу сигналов B-катенина, что способствует появлению злокачественного фенотипа у меланоцитов, а также нарушает клеточную адгезию, что, в свою очередь, позволяет клеткам меланомы отсоединяться от соседних кератиноцитов, тем самым способствуя инвазивному фенотипу [7].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В 2023 г. в Российской Федерации меланомой кожи заболело 13270 человек [22]. В 2023 г. грубый показатель заболеваемости (оба пола) составил 9,07 на 100 000 населения (в 2019 – 6,94), стандартизованный – 5,15 на 100 000 населения (в 2019 - 4,89)[22]. Стандартизованный показатель заболеваемости составил 4,94 и 5,47 на 100 000 населения у мужчин и женщин соответственно. В структуре заболеваемости меланома кожи в 2023 г. составила 1,7 % у мужчин и 2,2 % у женщин. Среднегодовой темп прироста грубого показателя заболеваемости за 10 лет составил 3,28% у мужчин и 2,61% у женщин. Средний возраст заболевших оказался равным 61,9 года (оба пола), 61,5 года (мужчины), 62,1 года (женщины) [22].
В 2023 г. от меланомы кожи в России умерло 1539 мужчин и 1552 женщины, грубый показатель смертности (оба пола) – 2,09 на 100 000 населения (2,45 – в 2019), стандартизованный – 1,13 на 100 000 населения (1,44 у мужчин и 0,94 у женщин)[22]. Среднегодовой темп прироста смертности на интервале 2013-2023 годы оказался отрицательными -1,33% (снижение смертности на 12,3% за 10 лет – грубый показатель и 24,93% стандартизованный показатель).
Средний возраст умерших – 65,6 года (оба пола), 64,4 года (мужчины), 66,7 года (женщины) [22].
В 2023 г. было зарегистрировано следующее распределение заболевших по стадиям: стадия I – 42,5 %, стадия II – 37,8 %, стадия III – 10,8 %, стадия IV – 7,9 %, стадия не установлена у 1,0 %. Среди впервые заболевших активно заболевание выявлено у 27,8 %. Летальность на 1-м году составила 6,9 % (в сравнении с 12,3% в 2013 г)[23].
Под наблюдением на конец 2022 г. состояли 106 061пациента (72,7 на 100 000 населения), из них 5 лет и более наблюдались 65 123пациентов (61,4%). Индекс накопления контингентов составил 10,0, а летальность – 2,8 % (в сравнении с 4,3 % в 2011 г.). При этом, согласно имеющимся отчетным формам, в 2022 г. 88,5 % пациентов меланомой кожи (среди тех, кто подлежал радикальному лечению) получили только хирургическое лечение [23].
Меланома является одной из самых агрессивных форм опухолей кожи и является второй по значимости причиной ЗНО у подростков и молодых людей в возрасте 15–29 лет [24]. Заболеваемость меланомой резко возрастает с возрастом с 1,1 на миллион в возрасте от 1 до 4 лет до 10,4 на миллион в возрасте от 15 до 19 лет [25]. С 1970-х годов заболеваемость меланомой у детей увеличилась со среднегодовым процентным изменением на 2–2,9% [16,26,27]. Однако обновленные анализы базы данных SEER (Surveillance, Epidemiology and End Results) демонстрируют снижение общих тенденций в период с 2000 по 2010 год [28,29]. По данным базы SEER, ежегодно в США заболевает 4 ребенка на 1 миллион населения, и большинство детей находится в возрасте старше 10 лет [30]. Кэмпбелл и соавторы отметили снижение заболеваемостью меланомой у детей на 11,6% в год в возрасте до 20 лет в период с 2004 по 2010 годы [29]. Существуют также различия по полу: у лиц женского пола наблюдается несколько более высокий уровень заболеваемости [29]. У девочек старше 4 лет чаще встречается меланома нижней части туловища, а у мальчиков старше 10 лет - меланома в области головы и шеи [26].
В 2022 г. в Российской Федерации меланомой кожи до 19 лет (0-19 лет) заболели – 35 пациентов [31,32], при этом до 14 лет – только 4 пациента (2 девочки и 2 мальчика) – см. также (Таблица 1). В структуре заболеваемости меланома кожи в 2023 г. составила менее 1 % и мальчиков и у девочек в обеих возрастных группах, и только в группе подростков 15-19 лет составила 2,3% [31,32].
У 2023 году в возрасте 0-19 лет от меланомы кожи умерло 4 пациентов (3 мальчиков и 1 девочка), при этом в возрасте до 5 лет не было зарегистрировано ни одной смерти от меланомы. В таблице ниже (см. Таблица 2) приведены данные по заболеваемости меланомой у детей в России в 2023 году [31,32].
Таблица 1.
Заболеваемость меланомой кожи в России по полу и возрасту среди детей в 2023 году
| Пол/возраст | 0-4 | 5-9 | 10-14 | 15-19 |
|---|---|---|---|---|
| Оба пола | 1 (0,01 на 100 тыс) | 0 (0,00 на 100 тыс) | 3 (0,03 на 100 тыс) | 31 (0,4 на 100 тыс) |
| Мальчики | 0 (0,00 на 100 тыс) | 0 (0,00 на 100 тыс) | 2 (0,00 на 100 тыс) | 14 (0,38 на 100 тыс) |
| Девочки | 1 (0,03 на 100 тыс) | 0 (0,00 на 100 тыс) | 1 (0,02 на 100 тыс) | 21 (0,56 на 100 тыс) |
Таблица 2.
Смертность от меланомы кожи в России по полу и возрасту среди детей в 2023 году
| Пол/возраст | 0-4 | 5-9 | 10-14 | 15-19 |
|---|---|---|---|---|
| Оба пола | 0 (0,01 на 100 тыс) | 1 (0,01 на 100 тыс) | 1 (0,01 на 100 тыс) | 2 (0,03 на 100 тыс) |
| Мальчики | 0 (0,00 на 100 тыс) | 0 (0,00 на 100 тыс) | 1 (0,02 на 100 тыс) | 2 (0,05 на 100 тыс) |
| Девочки | 1 (0,03 на 100 тыс) | 1 (0,02 на 100 тыс) | 0 (0,00 на 100 тыс) | 0 (0,05 на 100 тыс) |
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
В большинстве случаев клиническая диагностика первичной меланомы кожи не вызывает затруднений у подготовленного специалиста [37].
Выделяют 4 наиболее распространенные клинические формы меланомы: поверхностно-распространяющуюся, узловую, лентиго-меланому и акрально-лентигинозную.
Поверхностно-распространяющаяся меланома составляет около 70 % случаев меланомы кожи и в целом имеет относительно благоприятный прогноз, что связано с присутствием 2 фаз в ее развитии. Для фазы радиального роста характерен низкий потенциал метастазирования (II уровень инвазии по Кларку), и она может продолжаться в течение нескольких лет. Затем меланома переходит в фазу вертикального роста, которая характеризуется инвазией клеток опухоли в ретикулярный и подкожно-жировой слои и высоким потенциалом метастазирования. Поверхностно-распространяющаяся форма меланомы развивается на внешне неизмененной коже – de novo или на фоне пигментного невуса в виде небольшого плоского узелка темного, почти черного цвета, диметром 1–3 мм, с постепенным развитием уплотнения и изменением границ; поверхность его становится неровной, очертания неправильными, легко травмируется и кровоточит. Нередко рост опухоли сопровождается субъективными ощущениями в виде зуда и дискомфорта («ощущения опухоли»).
Узловая (нодуляpная) меланома характеризуется первично вертикальным ростом и считается самым неблагоприятным в плане прогноза типом опухоли. Узловой вариант меланомы представлен плотным узлом с бугристой поверхностью различных размеров, поверхность ее изъязвляется, кровоточит и покрывается корками.
Лентиго-меланома, как и поверхностно-распространяющаяся меланома, в своей эволюции претерпевает двухфазность процесса, причем фаза радиального роста при этом типе опухоли может длиться гораздо дольше – 10 лет и более. Условно можно выделить 2 стадии в фазе радиального роста: 1-я стадия не является инвазивной и соответствует злокачественному лентиго – облигатному предраку. Далее начинается инвазивный рост и переход злокачественного лентиго в лентиго-меланому; скорость инвазии в данном случае менее выражена, чем при меланоме поверхностно-распространяющегося типа. Вертикальный рост в глубину дермы и подкожно-жирового слоя характерен и для лентиго-меланомы, однако может реализоваться в течение ряда лет, а не месяцев, как при меланоме поверхностно-распространяющегося типа, что объясняет отсутствие заметных изменений в биологическом течении опухоли и низкий риск развития метастазов. Прогноз при этой форме меланомы более благоприятный, чем при поверхностно-распространяющейся.
Акрально-лентигинозная меланома локализуется на дистальных участках конечностей – коже кистей и стоп, в области ногтевого ложа и проксимального околоногтевого валика. Для нее также свойственна двухфазность развития: фаза горизонтального роста, что соответствует биологическому поведению лентиго-меланомы, и фаза вертикального инвазивного роста. Этот тип опухоли отличается более агрессивным характером течения, чаще и раньше метастазирует, кроме того, специфическая локализация затрудняет визуализацию опухоли, и в большинстве случаев она диагностируется уже на стадии инвазивного роста.
При клинико-анамнестическом анализе картина поверхностно-распространяющейся меланомы кожи лучше всего описывается классической аббревиатурой ABCDE:
- А (asymmetry) – поверхностно-распространяющаяся меланома кожи имеет вид пигментного пятна, характеризующегося асимметрией: если провести через образование воображаемую линию, одна его половина по форме не будет соответствовать другой.
- B (border) – границы меланомы кожи имеют неравномерный характер: они могут быть неровными, нечеткими, иметь «географические» очертания.
- С (color) – для поверхностно-распространяющейся меланомы кожи характерна полихромия – наличие нескольких цветов в одном образовании.
- D (diameter) – размеры поверхностно-распространяющейся меланомы кожи чаще всего превышают 0,5 см. E (evolution или elevation – эволюция или возвышение) – для меланомы кожи всегда характерна какая-либо эволюция с течением времени.
Правило ABCDE неприменимо для меланомы малых размеров (менее 0,5 см), а также для узловой меланомы, поскольку формирующийся узел на первых порах может быть симметричным, с ровными границами, гомогенного черного или сине-черного цвета, диаметр может быть любым. Симптом эволюции образования, тем не менее, остается актуальным – пациенты отмечают рост узелка с течением времени, иногда – чувство боли или жжения, появившееся в области опухоли. Более редкие клинические формы меланомы (меланома по типу злокачественного лентиго, акрально-лентигинозная меланома, подногтевая меланома, беспигментная форма опухоли и др.) могут вызывать затруднения в клинической диагностике, в связи с чем рекомендованы дополнительные неинвазивные методы диагностики (дерматоскопия), применяемые подготовленными специалистами [37], при этом в случае затруднения интерпретации полученных данных или неоднозначности дерматоскопической картины показано выполнение биопсии новообразования (см. раздел 2.5).
Другим приемом клинической диагностики меланомы кожи является внутрииндивидуальный сравнительный анализ (симптомы «гадкого утенка» и «красной шапочки»). Симптом «гадкого утенка» основан на общей оценке всех имеющихся новообразований кожи и явном отличии меланомы от имеющихся доброкачественных пигментных новообразований. Другим вариантом симптома «гадкого утенка» является обнаружение единственного изменяющегося с течением времени новообразования в определенной топографической области, особенно если динамические изменения противоречат стереотипным эволюционным и возрастным особенностям течения доброкачественных пигментных опухолей кожи. Симптом «красной шапочки» характеризуется дерматоскопическими отличиями злокачественного новообразования от доброкачественных невусов при клинически однотипной картине [38,39].
В некоторых случаях меланома манифестирует с увеличения лимфатических узлов, которые на первом этапе неверно расцениваются как лимфаденит, лимфома или метастазы рака без выявленного первичного очага. Своевременно проведенная тонкоигольная биопсия или core-биопсия (иногда с последующим иммуногистохимическим или иммуноцитохимическим анализом) увеличенного лимфатического узла позволяет отличить другие причины лимфаденопатии от метастазов меланомы.
При локализации меланомы на слизистых оболочках полости носа и околоносовых пазухах самыми частыми симптомами бывают заложенность носа и носовые кровотечения. Реже встречаются диплопия, экзофтальм, боли и деформация контуров лица. При локализации меланомы на слизистых оболочках полости клинически заболевание на ранних стадиях протекает бессимптомно, на поздних стадиях появляются такие симптомы, как боль, изъязвление и кровоточивость.
Особенности клинической картины меланомы кожи у детей.
Cordoro и соавт. обнаружили, что у 60% детей в возрасте до 10 лет и 40% подростков клиническая картина меланомы не соответствовала традиционным критериям ABCDE [14]. У детей встречалась симметричность новообразования, ровные границы, однородный цвет и диаметры ≤6 мм. Таким образом, Кордоро и соавторы [14] предложили следующие критерии, более специфичные для детской меланомы: A = амеланотичность; B = кровоточивость, узел; C = однородность цвета; D = de novo, любой диаметр; E = эволюция образования. Меланомы у детей имеют тенденцию быть беспигментными и узловыми, представляя собой быстро растущую опухоль, которая может имитировать пиогенную гранулему, келоидный рубец или бородавку, а не меняющийся невус [14,40-42].
Еще одно мнемоническое правило – это CUP, которое включает в себя однородность цвета (розовый, красный) (С - color uniformity (pink/red)), наличие изъязвления и вертикального утолщения (U - ulceration and upward thickening), наличие признаков пиогенной гранулемы и появление de novo (P - pyogenic granuloma–like lesions and pop-up of new lesions) [43].
Особую проблему у детей вызывает клиническая и инструментальная дифференциальная диагностика невуса Спитц и меланомы из невуса Спитц.
Существует широкий спектр атипичных меланоцитарных новообразований, и различие между невусом Спитц (Spitz), атипичной опухолью Спитц (Spitz), спитцоидной (Spitzoid) меланомой и меланоцитарными опухолями с неопределенным злокачественным потенциалом является спорным с небольшим диагностическим согласием среди дерматопатологов [44-46]. Многие из этих меланоцитарных образований исходно были диагностированы неправильно как доброкачественные и только позже признаны злокачественными после их рецидива. В одном исследовании 35% случаев, первоначально классифицированных как невус Спитц, после дополнительной проверки были отнесены к эпителиоидной или веретеноклеточной меланоме кожи [45]. Из-за трудности дифференциальной диагностики доброкачественных и злокачественных меланоцитарных новобразований у детей, все гистологические препараты должны быть оценены врачами-патологоанатомами (дерматопатологами), которые имеют большой опыт в диагностике таких образований.
Невус Спитц — это особый тип доброкачественного меланоцитарного новообразования, который чаще всего развивается у детей. Невус Спитц классически представляет собой одиночную розовую, красную или коричневую папулу, чаще всего на лице (особенно у маленьких детей) или нижней конечности. Первоначальный рост имеет тенденцию быть быстрым, что может вызывать тревогу у родителей и врачей. Поверхность может быть гладкой или покрытой бороздками, в связи с чем невус обычно ошибочно диагностируется как вульгарная бородавка, пиогенная гранулема, дерматофиброма или ювенильная ксантогранулема [47,48].
Особая клиническая картина, до крайности затрудняющая раннюю диагностику, наблюдается при возникновении меланомы во врождённом гигантском меланоцитарном невусе. Врожденные меланоцитарные невусы классически определяются как присутствующие при рождении. Множественные недавние клинические исследователи свидетельствуют, что ВМН встречаются приблизительно у 2-3% новорожденных вне зависимости от этнической принадлежности [49,50]. Хотя малые и средние ВМН относительно распространены, большие или гигантские ВМН встречаются только приблизительно в 1 случае на 20 000 – 50 000 новорожденных. Врожденные невусы классифицируют по их размерам во взрослом возрасте, которых они могут достичь по мере роста ребенка: малые врожденные невусы (менее 1,5 см); средние врожденные невусы (от 1,5 до 20 см), большие врожденные невусы (от 20 до 40 см) и гигантские врожденные невусы (от 40 до 60 см и более 60 см) [21]. Риск развития меланомы в малом и среднем ВМН составляет <1% в течение жизни [51, 52]. На основании нескольких крупных перспективных и ретроспективных когортных исследований риск появления меланомы (кожной или внекожной), связанной с крупным или гигантским ВМН, считается 5% или более [53]. Развитие меланомы наиболее вероятно у пациентов с ВМН, у которых размер предполагаемого невуса взрослого человека превышает 40-60 см в диаметре, что составляет около 75% ВМН-ассоциированных меланом, при этом меланомы чаще возникают глубоко в дерме или подкожной клетчатке и проявляются в виде растущего узелка [21].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния:
- данные анамнеза;
- данные физикального обследования и, в ряде случаев, дерматоскопического исследования;
- данные прижизненного патолого-анатомического исследования биопсийного материала.
Клинический диагноз основан на комбинации результатов 3 анализов любого пигментированного образования:
- визуальный анализ каждого поражения в отдельности: экспертиза невооруженным глазом оценивает так называемые A (асимметрия), B (нерегулярные границы), C (неоднородный цвет) и D (диаметр 5 мм и более) критерии, которые указывают на подозрительные меланоцитарные новообразования (правило ABCD);
- внутрииндивидуальный сравнительный анализ: поиск пигментированного образования, которое не похоже на другие у того же пациента (симптом «гадкого утенка»);
- хронологический анализ изменений: поиск быстрого и недавнего изменения данного пигментного образования (Е как эволюция), которое может быть подтверждено пациентом или документально, в сравнении с предыдущими фотографиями [38,39].
Ниже приведен план обследования в зависимости от результатов биопсии пигментного новообразования кожи и клинического осмотра (Таблица 9). Рекомендации по применению самих медицинских вмешательств представлены в соответствующих разделах.
Таблица 9.
План обследования в зависимости от результатов биопсии пигментного новообразования кожи и клинического осмотра
| Стадия заболевания | Физикальный осмотр | Инструментальная диагностика | Лабораторная диагностика | Биопсия сторожевого лимфатического узла | Молекулярно-генетические исследования |
|---|---|---|---|---|---|
| 0, I | Да |
1. Ультразвуковое исследование (далее – УЗИ) регионарных лимфатических узлов.
2. Лучевая диагностика не рекомендуется, если нет симптомов
|
Нет | Да (при толщине опухоли 0,8 мм и более) | Нет |
| IIA | Да |
1. УЗИ регионарных лимфатических узлов.
2. Лучевая диагностика рекомендуется в полном объеме
|
Нет | Да | Нет |
| IIB, IIC, III | Да |
1. УЗИ регионарных лимфатических узлов.
2. Лучевая диагностика в полном объеме.
3. Магнитно-резонанса томография (далее – МРТ) головного мозга с в/в контрастированием (для стадии III)
|
Общий клинический и биохимический анализы крови при необходимости | Да (для стадий IIB, IIC) | Молекулярно-генетическое исследование мутаций в гене BRAF обязательно (для стадии III) |
| IV | Да |
1. УЗИ регионарных лимфатических узлов.
2. Лучевая диагностика в полном объеме.
3. МРТ головного мозга с в/в контрастированием
|
1. Определение активности лактатдегидрогеназы в крови.
2. Общий клинический и биохимический анализы крови
|
Не применимо | Молекулярно-генетическое исследование мутаций в гене BRAF обязательно (при меланоме кожи), при отсутствии мутации в гене BRAF – молекулярно-генетическое исследование мутаций в гене KIT |
1. Жалобы и анамнез
- Рекомендуется сбор жалоб и анамнеза у всех пациентов с целью выявления факторов риска и факторов, которые могут повлиять на выбор тактики лечения, методов диагностики и вторичной профилактики [54,55].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: ключевые факторы риска развития меланомы кожи приведены в подразделе 1.2 «Этиология и патогенез».
Чаще всего пациент обращается с жалобой на то, что «родинка» начала изменяться – отмечается рост, изменение конфигурации границ, появление в пределах новообразования разных цветовых оттенков. Одной из нередких жалоб является жалоба на появление зуда, жжения или субъективного дискомфорта в области существующего или появившегося de novo новообразования.
У детей изменение невуса не должно использоваться в качестве единственного критерия для его удаления. Естественная эволюция доброкачественных пигментных поражений у детей в определенный момент может соответствовать критериям диагностики меланомы, в частности алгоритму «ABCDE» (асимметрия, неравномерность границы, изменчивость цвета, диаметр > 6 мм, эволюция)[56]. Следует помнить, модификацию правила ABCDE для детской меланомы: A = амеланотичность; B = кровоточивость, узел; C = однородность цвета; D = de novo, любой диаметр; E = эволюция образования. Меланомы у детей имеют тенденцию быть беспигментными и узловыми, представляя собой быстро растущую опухоль, которая может имитировать пиогенную гранулему, келоидный рубец или бородавку, а не меняющийся невус [14,40-42].
2. Физикальное обследование
- Рекомендуется при первом обращении всех пациентов с жалобами на пигментное новообразование кожи расширить зону осмотра и оценить состояние всех кожных покровов и видимых слизистых оболочек, включая волосистую часть головы, ногтевые пластинки, кожу стоп и кистей, слизистые оболочки полости рта, половых органов и конъюнктивы в целях выявления других подозрительных новообразований кожи [54,57-63].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств –1) – для взрослых.
Уровень убедительности рекомендаций – 3 (уровень достоверности доказательств – С) – для детей.
Комментарий: существует значительная вариация и неопределенность в отношении диагностической точности визуального осмотра, частота ошибок при визуальном осмотре достаточно высока, для обеспечения точной диагностики злокачественных новообразований кожи необходимо также использовать другие методы диагностики. Также необходимо отметить, что первично-множественные синхронные опухоли (меланомы и немеланомные опухоли кожи) могут быть обнаружены у 5–10 % пациентов [57-61].
Наибольшую сложность в дифференциальной диагностике меланоцитарных образований у детей представляют собой спитцоидные образования (доброкачественные и атипические).
Пигментированные невусы (невус Рида) дерматоскопически имеют характерную симметричную структуру, напоминающую «взрыв звезды». Такая структура состоит из центральной темной, однородной пигментированной бесструктурной области, окруженной периферическими радиальными линиями (псевдоподиями) или многоуровневыми глобулами. Непигментированные невусы Шпиц могут дерматоскопически демонстрировать точечные сосуды и негативную сеть (белые линии) и представляют наибольшую диагностическую сложность Последовательная цифровая дермоскопическая визуализация включает фиксацию и оценку последовательных дермоскопических изображений одного или нескольких меланоцитарных очагов, разделенных интервалом времени, для выявления подозрительных изменений [64-66].
- Рекомендуется осмотр пациента с жалобами на пигментное новообразование кожи проводить врачам, имеющим навыки ранней диагностики злокачественных новообразований кожи (включая навыки дерматоскопии), с целью оценки всех кожных покровов и лимфатических узлов и выявления подозрительных образований [62,67-71].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
- Рекомендуется в рамках осмотра пациента с жалобами на пигментное новообразование кожи использование эпилюминисцентной микроскопии (дерматоскопии) кожного покрова, ногтевых пластин, доступных для исследования участков слизистых оболочек, так как она повышает точность неинвазивной диагностики и уменьшает потребность в выполнении биопсии, но может быть рекомендована к применению только обученным этому методу специалистам [72-74].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств 1) – для взрослых.
Уровень убедительности рекомендаций – 5 (уровень достоверности доказательств – С) – для детей.
Комментарий: специфические для поверхностно распространяющейся меланомы признаки включают атипичную пигментную сеть, участки регресса, точки и глобулы неправильной формы, полосы и полихромию, распределенные асимметрично. Дополнительные критерии, такие как бело-голубые структуры и полиморфные сосуды, часто встречаются при инвазивной меланоме [75-78].
Амеланотическая меланома может представлять диагностическую сложность. Типичным для нее является полиморфный сосудистый паттерн, либо диагноз устанавливается методом исключения при отсутствии типичных меланоцитарных и немеланоцитарных дерматоскопических признаков [79, 80].
Для злокачественного лентиго характерно наличие ромбовидных структур, псевдосети, точечных кровеносных сосудов, серых кругов и незавершенных фолликулов [81,82].
Отличительными дерматоскопическими признаками инвазивной акральной меланомы являются параллельный гребешковый паттерн и диффузная нерегулярная пигментация [83-85].
- Рекомендуется для первичной диагностики меланомы применение последовательной (динамической) цифровой фотодерматоскопии у пациентов с подозрением на злокачественное новообразование кожи, которые не имеют специфических дерматоскопических критериев злокачественности [74,86-89].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1) – для взрослых.
Уровень убедительности рекомендаций – 4 (уровень достоверности доказательств – С) – для детей.
Комментарий: последовательная цифровая дермоскопическая визуализация включает фиксацию и оценку последовательных дермоскопических изображений одного или нескольких меланоцитарных очагов, разделенных интервалом времени, для выявления подозрительных изменений. Возможно проведение краткосрочного цифрового мониторинга (в течение 1,5–4,5 мес) для контроля подозрительных меланоцитарных новообразований и долгосрочного мониторинга для наблюдения (обычно с интервалами 6–12 мес). Долгосрочный цифровой мониторинг обычно используется для наблюдения за пациентами группы высокого риска, как правило, с множественными атипичными невусами [86-88,90-93]. Динамическая цифровая дерматоскопия может быть очень полезна у детей с невусами Спитц, трудно отличимыми от беспигментной меланомы. Так, по данным Argenziano и соавт.. в течение 25 месяцев полному регрессу подверглись 80% невусов Спитц (51/64); данный процесс не зависел от пола, возраста и локализации элементов [94]. Фотографирование всего тела может быть полезно для раннего выявления меланомы кожи у пациентов с высоким риском возникновения меланомы кожи (например, у пациентов с синдромом диспластических невусов, FAMM-синдромом (Famial Atypic Mole Melanoma Syndrome) и т. д.) [95-98].
- Рекомендуется включить в физикальное обследование также оценку состояния регионарных лимфатических узлов у пациентов с подозрением на злокачественное новообразование кожи с целью исключения метастатического поражения регионарных лимфатических узлов [54,62,99].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 1).
Комментарий: необходимо отметить, что пальпация лимфатических узлов у пациентов не исключает необходимость проведения УЗИ лимфатических узлов у пациентов с установленным диагнозом, так как физикальное обследование лимфатических узлов не обладает достаточной точностью.
- Рекомендуется по результатам анализа жалоб, анамнеза и данных физикального обследования пациента на приеме принять решение о целесообразности инвазивной диагностики (биопсии) новообразования с целью морфологической верификации диагноза и составления дальнейшего плана обследования и лечения [100-107] (см. приложение Б, рис. 1).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
3. Лабораторные диагностические исследования
- Не рекомендуется проведение пациентам до морфологического подтверждения диагноза лабораторных диагностических исследований, если только интеркуррентная патология или общее состояние пациента не требует ее для безопасного проведения биопсии, так как диагноз устанавливается на основе результатов иных диагностических методов (см. подразделы 2.4 и 2.5), а результаты лабораторной диагностики влияют на прогноз у пациентов с уже установленным диагнозом [54,108-114].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: повышенное соотношение нейтрофилов к лимфоцитам, а также высокий уровень лактатдегидрогеназы могут быть предикторами плохого прогноза у пациентов с меланомой III-IV стадии, но именно уровень лактатдегидрогеназы является критерием, необходимым для установления стадии у больных метастатической меланомой [35,115,116].
- При подтверждении диагноза при подготовке к проведению дальнейшего этапа лечения рекомендуется выполнять общий клинический и биохимический общетерапевтический анализы крови (а именно, определение уровня лактатдегидрогеназы в крови и соотношение нейтрофилов и лимфоцитов) в целях оценки прогноза меланомы [114-121] (см. также таблицу 7).
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2).
Комментарий: также в рамках подбора оптимального алгоритма лечения пациента с установленным диагнозом необходима лабораторная диагностика в объеме, позволяющем выявить риски неблагоприятного ответа на лечения и противопоказания к различным видам терапии.
4. Инструментальные диагностические исследования
- Рекомендуется при наличии соответствующих показаний (симптомов метастазирования) проводить инструментальные диагностические мероприятия (включая лучевую диагностику) в полном объеме вне зависимости от стадии заболевания для своевременного выявления метастазов меланомы [54].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендовано после установления диагноза в отсутствие любых жалоб и симптомов для выявления скрытых метастазов выполнять диагностические исследования различного объема в зависимости от стадии заболевания (установленной по данным клинического осмотра и патолого-анатомического исследования биопсийного или операционного материала), отражающей риск выявления регионарных и отдаленных метастазов, суммированные в таблице 7 [122-128].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств –1).
- Не рекомендуется до морфологического подтверждения диагноза инструментальная диагностика, если только интеркуррентная патология или общее состояние пациента не требует ее для безопасного проведения биопсии [54].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: план лечения и обследований не следует составлять до получения данных патолого-анатомического исследования.
- Рекомендуется после установления диагноза выполнять ультразвуковое исследование (далее – УЗИ) регионарных лимфатических узлов пациентам с 0-IV стадией в целях выявления метастазов в лимфатические узлы [99,128].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
- Рекомендуется с целью оценки распространённости опухолевого процесса пациентам с клинической стадией IIA-IV после установления диагноза выполнять для оценки состояния органов грудной клетки, брюшной полости и малого таза – компьютерную томографию (далее – КТ) органов грудной клетки, брюшной полости и малого таза. Внутривенное контрастирование следует проводить во всех случаях, если не выявлены противопоказания к введению йодсодержащих контрастирующих препаратов - в этом случае КТ с в/в контрастированием допускается заменить на МРТ с в/в контрастированием. Альтернативной может быть позитронно-эмиссионная томография, совмещенная с компьютерной томографией (далее ПЭТ/КТ) с флудезоксиглюкозой [18F] в режиме «все тело» [126,128-132].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1) - для взрослых.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5) – для детей.
Комментарий: если оптимальный вариант лучевой диагностики не может быть проведен в течение 4 недель после установки диагноза, КТ органов грудной полости допускается заменить на обзорную в двух проекциях рентгенографию органов грудной клетки, а КТ органов брюшной полости и малого таза с в/в контрастированием – на УЗИ органов брюшной полости и малого таза [133].
-
Рекомендуется проведение магнитно-резонансной томографии (МРТ) головного мозга с контрастированием:
- пациентам с меланомой IIB-IV стадии для скрининга бессимптомных метастазов в головной мозг,
- пациентам с неврологической симптоматикой независимо от стадии заболевания,
- пациентам с метастазами меланомы в головном мозге после локального и системного лечения для оценки эффективности проведенного лечения [128,134-140].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1) - для взрослых
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2) – для детей
Комментарии: МРТ головного мозга рекомендуется выполнять в следующих режимах: до внутривенного введения контрастного средства в режимах Т1в аксиальной проекции (толщина среза 1-1,5 мм), Т2, ДВИ, FLAIR (толщина среза 3-5 мм). После внутривенного введения контрастного вещества: Т1 в аксиальной проекции (толщина среза 1-1,5 мм), 3D T1 взвешенные изображения высокого разрешения в аксиальной (или сагиттальной) плоскости с захватом всей головы с применением технологии изотропного воксела (1мм×1мм×1мм). Проведение компьютерной томографии (КТ) с контрастированием для диагностики метастатического поражения головного мозга возможно только при наличии противопоказаний к проведению магнитно-резонансной томографию.
- Рекомендуется всем пациентам с меланомой анального канала или прямой кишки выполнять ректороманоскопию и биопсию с целью точного измерения расстояния от анокутанной линии до нижнего полюса опухоли и получения материала для гистологического исследования [141,142].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 3) – для взрослых.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5) – для детей.
Комментарий: точное определение локализации нижнего полюса опухоли необходимо при планировании хирургического лечения, в особенности при решении вопроса о возможности выполнения сфинктеросохраняющей операции у пациентов с меланомой прямой кишки. Выполнение биопсии необходимо для дифференциальной диагностики меланомы и рака прямой кишки. Макроскопической картины опухоли недостаточно для постановки диагноза. До 30% случаев меланомы анального канала и прямой кишки представлены беспигментными меланомами, которые макроскопически могут быть интерпретированы как полипы или внутренние геморроидальные узлы [143].
- Рекомендуется после установления диагноза всем взрослым пациентам с аноректальной локализацией меланомы выполнить колоноскопию для оценки распространенности опухолевого поражения со стороны слизистой оболочки с биопсией из очагов, подозрительных в отношении меланомы [144].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 4).
- Рекомендуется с целью определения распространенности заболевания выполнить МРТ малого таза всем пациентам с меланомой анального канала или прямой кишки перед определением тактики лечения [141].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: МРТ малого таза позволяет определить локализацию, протяженность, глубину инвазии опухоли, оценить состояние регионарных лимфатических узлов. Несмотря на отсутствие исследований о роли МРТ малого таза в диагностике меланомы анального канала и прямой кишки, принципы планирования хирургического лечения схожи с таковыми для рака прямой кишки, что позволило экстраполировать показания для данного метода диагностики [145-148].
- Рекомендуется указывать в протоколе заключения МРТ малого таза при меланоме анального канала или прямой кишки у всех пациентов с целью оптимального составления плана лечения следующую информацию: размеры опухоли, глубину инвазии в стенку прямой кишки, минимальное расстояние от края опухоли до мезоректальной фасции, количество и размеры лимфатических узлов параректальной клетчатки, наличие МР-признаков их злокачественного поражения, наличие вовлечения мезоректальной фасции потенциально поражёнными лимфатическими узлами, наличие венозной инвазии, количество и размеры экстрафасциальных лимфатических узлов, наличие МР-признаков их злокачественного поражения; для рака нижнеампулярного отдела прямой кишки – наличие инвазии внутреннего сфинктера/межсфинктерного пространства/наружного сфинктера/мышц поднимающих задний проход [141,149].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4) - для взрослых.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5) - для детей.
Комментарий: современные режимы МРТ с использованием диффузно-взвешенных изображений могут повысить информативность проводимого исследования. Внутривенное контрастирование не повышает информативность оценки распространённости опухоли [150]. Окончательное принятие решение о тактике лечения пациентов раком прямой кишки возможно только по результатам МРТ-исследования.
- Рекомендуется после установления диагноза выполнить пациентам биопсию очагов метастазирования под контролем УЗИ или КТ при подозрении на метастазы по данным КТ или МРТ в случаях, когда их подтверждение принципиально меняет тактику лечения, с целью морфологического подтверждения метастатического процесса [54].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
- Рекомендуется у пациентов детского возраста использовать седацию, общую анестезию или альтернативные методики (такие как «кормление-сон», игровая терапия и т.д.) для получения качественных диагностически значимых изображений во время МРТ или КТ или ПЭТ-КТ или других инструментальных методов исследования [151-156].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
5. Иные диагностические исследования
- Рекомендуется для подтверждения диагноза, а также составления дальнейшего плана обследований и лечения на первом этапе использование эксцизионной биопсии подозрительного пигментного образования с отступом не более 5 мм (приемлемый отступ от 1–3 мм (0,1–0,3 см)) [8,157-159].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 1).
Комментарий: Эксцизионная биопсия является рекомендуемым стандартом для установления диагноза меланомы кожи. Однако в ряде клинических ситуаций (например, обширный участок лентиго на лице, требующий дифференциальной диагностики с лентиго-меланомой, гигантские врожденные невусы с участками, подозрительными на озлокачествление и т.д.) выполнение эксцизионной биопсии всего пигметного новообразования сопряжено со значительными трудностями и неоправданной хирургической травмой для пациента. В этом случае безопасно выполнить инцизионную (или панч) биопсию на всю толщину кожи. Судя по систематическому обзору 9 исследований, в том числе рандомизированных контролируемых исследований, выполнение инцизионной биопсии меланомы не оказывает негативного влияния на прогноз [157].
Также следует помнить, что у детей меланома кожи представляет собой крайне редкое заболевание. Недавний анализ более 20 000 меланоцитарных новообразований, удаленных у итальянских детей и подростков за 20-летний период, показал, что 87% из 38 меланом были в возрасте 15-19 лет, без случаев меланомы у детей моложе 10 лет [40], а для диагностики 1 меланомы у ребенка моложе 18 лет иссекают 594 доброкачественных новообразования [160]. В этой связи тщательное динамическое наблюдение за подозрительным новообразованием может быть наилучшей тактикой у детей [161].
- Рекомендуется ориентировать разрезы кожи при проведении эксцизионной биопсии в направлении ближайшего лимфатического коллектора параллельно лимфатическим сосудам кожи (а не по кожным линиям или естественным складкам) так, чтобы повторное иссечение рубца (если оно потребуется) могло быть выполнено без затруднений [54,100-107].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: эксцизионная биопсия подозрительного плоского пигментного образования кожи может быть безопасно выполнена с использованием местной инфильтрационной анестезии. При этом рекомендуется избегать повреждений удаляемого новообразования до его иссечения [8,100,101,103-106].
-
Рекомендуется проводить прижизненное патолого-анатомическое исследование операционного материала, в заключении рекомендуется отразить следующие характеристики для определения стадии заболевания и прогноза [162-172]:
Обязательные характеристики:- определение максимальной толщины опухоли в миллиметрах по Бреслоу;
- определение уровня инвазии по Кларку;
- указание о наличии или отсутствии изъязвления первичной опухоли;
- определение митотического индекса (количество митозов на 1 мм2) при толщине опухоли до 1 мм включительно;
- оценка периферического и глубокого краев резекции на наличие опухолевых клеток;
- наличие транзиторных или сателлитных метастазов.
Дополнительные характеристики:- локализация опухоли;
- наличие или отсутствие спонтанной регрессии;
- нейротропизм;
- лимфоидная инфильтрация;
- гистологический подтип;
- ангиолимфатическая инвазия.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется пациентам с меланомой кожи, если диагностированы или заподозрены регионарные и отдаленные метастазы меланомы, и при метастазах меланомы без выявленного первичного очага выполнить молекулярно-генетическое исследование мутаций в гене BRAF (экзон 15) в биопсийном материале (или ранее удаленных лимфатических узлов, или первичной опухоли (если материал удовлетворяет требованиям лаборатории для достоверного определения наличия или отсутствия молекулярно-генетических изменений)) – это может повлиять на выбор таргетного агента (ингибитора протеинкиназы) в лечении метастатического процесса [54,173-184].
Уровень убедительности рекомендаций А (уровень достоверности доказательств –1) – взрослые.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2) – дети.
- Рекомендуется пациентам с меланомой кожи при отсутствии мутации в гене BRAF выполнить молекулярно-генетическое исследование мутаций в генах NRAS (экзон 3) и KIT (экзоны 8,9,11,13,14,17,18) в биопсийном (операционном) материале или выполнить широкое молекулярное тестирование, если диагностированы или заподозрены отдаленные метастазы меланомы, и это может повлиять на выбор схемы таргетной терапии (в частности, назначение ингибиторов протеинкиназы или моноклональных антител) при лечении метастатического процесса [185-200].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4) – взрослые.
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5) – дети.
- Рекомендуется при меланоме слизистых оболочек, если диагностированы или заподозрены отдаленные метастазы меланомы, выполнить молекулярно-генетическое исследование мутаций в гене KIT в биопсийном (операционном) материале (экзоны 8,9,11,13,14,17,18 ) – это может повлиять на выбор таргетного агента (ингибитора протеинкиназы) в лечении метастатического процесса [185-198] [197,201-203], при отсутствии мутации в гене KIT рекомендуется выполнить молекулярно-генетическое исследование мутаций в гене BRAF (экзон 15) в биопсийном материале.
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4) – взрослые.
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5) – дети.
- Детям старше 12 лет рекомендовано выполнять эксцизионную биопсию новообразований кожи при подозрении на невус Спитц с целью дифференциальной диагностики с ювенильной меланомой кожи [161].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: подозрение должны вызывать беспигментные папулонодулярные образования, размер более 8-10 мм, быстрое увеличение размеров. При наличии асимметрии образования или изъязвления поверхности эксцизионную биопсию целесообразно выполнить пациентам любого возраста [161].
- Рекомендуется все случаи меланомы кожи у детей в возрасте до 18 лет направлять на консультацию очно или посредством телемедицины для получения второго мнения относительно патологоанатомического диагноза в референсный центр [44-46].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется пациентам с меланомой кожи и слизистых оболочек при выявлении регионарных и/или отдаленных метастазов меланомы выполнить молекулярно-генетическое исследование мутаций в гене BRAF в биопсийном (операционном) материале и молекулярно-генетическое исследование мутаций в гене NRAS в биопсийном (операционном) материале; при отсутствии данных мутаций рекомендуется выполнить комплексное геномное профилирование на мутации и транслокации в протоонкогенах методом высокопроизводительного секвенирования (NGS), когда такой анализ может повлиять на выбор лекарственной терапии [175-177,179-183,190,204-226].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
- Рекомендуется пациентам с меланоцитарными опухолями кожи и слизистых оболочек: при невозможности однозначного определения злокачественного или доброкачественного характера новообразования по результатам гистологического исследования в лаборатории экспертного уровня выполнить молекулярно-генетическое исследование на «модификаторные» молекулярные нарушения в биопсийном или операционном материале (если материал удовлетворяет требованиям лаборатории для достоверного определения наличия или отсутствия молекулярно-генетических изменений) – это может помочь в прояснении гистологической картины. Молекулярное-генетическое исследование целесообразно начинать с тестирования на делецию гена CDKN2A и амплификацию гена RREB1; при отсутствии данных нарушений рекомендуется выполнить комплексное геномное профилирование на нарушения копийности протоонкогенов и генов-супрессоров методом мультиплексной амплификации лигированных проб (MLPA) или высокопроизводительного секвенирования (NGS) [227-229].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
- Рекомендуется пациентам с установленным диагнозом спитцоидной меланомы выполнить молекулярно-генетическое исследование на мутации в промоторной области гена TERT в биопсийном или операционном материале (если материал удовлетворяет требованиям лаборатории для достоверного определения наличия или отсутствия молекулярно-генетических изменений) – это может помочь в выявлении опухолей с высоким и очень высоким риском метастазирования [230].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
- Рекомендуется при подозрении на наследственный характер заболевания (первично-множественные злокачественные опухоли и/или отягощенный семейный онкологический анамнез) – рекомендовать консультацию врача-генетика с последующим молекулярно-генетическим исследованием для исключения или подтверждения какого-либо из синдромов предрасположенности к опухолям [231] .
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
-
Рекомендуется рассматривать хирургическое вмешательство как основной метод радикального лечения пациентов меланомой кожи 0–III стадии [54,158,173,232-248].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 1).
Комментарий: по показаниям дополнительно проводится адъювантная терапия (см. раздел 3.3).
1. Лечение локальных стадий заболевания (I–II)
Комментарий: по показаниям дополнительно проводится адъювантная терапия (см. раздел 3.3).
1. Лечение локальных стадий заболевания (I–II)
-
Рекомендуется пациентам с I–II стадиями меланомы выполнять радикальное иссечение первичной опухоли в пределах здоровых тканей как основой этап лечения локальной меланомы кожи [158,159,235-237,239,241,243,249,250].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1).
-
Выбор хирургического отступа формируется на основании результатов патолого-анатомического исследования биопсийного (операционного) материала, а именно толщины опухоли. В настоящее время для улучшения отдаленных результатов лечения и профилактики рецидивов опухоли при уже установленной стадии рекомендуется выполнять следующие отступы [158,159,235-237,239,241,243,249,250]:
-
0,5 см для меланомы in situ;
-
1 см при толщине опухоли по Бреслоу ≤2 мм;
-
2 см при толщине опухоли >2 мм.
-
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1).
Комментарий: модифицированные варианты резекции с меньшими отступами возможны для сохранения функции органа при меланоме кожи пальцев или кожи ушной раковины [245,251-254].
Комментарий: модифицированные варианты резекции с меньшими отступами возможны для сохранения функции органа при меланоме кожи пальцев или кожи ушной раковины [245,251-254].
-
Рекомендуется для определения толщины опухоли на первом этапе использовать эксцизионную биопсию пигментного образования с отступом от видимого края пигментной опухоли не более 0,5 см. В случае подтверждения диагноза меланомы кожи рубец после биопсии иссекается с большим отступом в сроки 4–8 нед (см. также раздел 2.5) [158,159,235-237,239,241,243,249,250].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1).
-
Если эксцизионная биопсия не проводится из-за очевидности диагноза, установленного клинически, отступы от видимых краев опухоли не рекомендуется расширять более чем на 2 см, так как без точных знаний микростадии это будет приводить к излишним манипуляциям, связанным с закрытием послеоперационной раны (например, различным видам сложной пластики) [158,159,235-237,239,241,243,249,250].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
-
Рекомендуется в случае подтверждения у пациента диагноза меланомы кожи рубец после биопсии иссечь с большим отступом в сроки до 4–8 недель в зависимости от гистологических характеристик опухоли с целью профилактики рецидива меланомы в области рубца (см. раздел 3.1) [158,159,235-237,239,241,243,249,250].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
-
В случае невозможности выполнения хирургического иссечения первичной опухоли из-за наличия выраженных сопутствующих заболеваний или при наличии опухолевых клеток в краях резекции после удаления первичной опухоли и невозможности повторного удаления опухоли взрослым пациентам рекомендуется проведение локальной лучевой терапии в следующих режимах: 64–68 Гр за 32–35 фракций в течение 6–7 нед; 50,0–57,5 Гр за 20–23 фракции в течение 4–5 нед [255-258].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
У взрослых пациентов не рекомендуется рутинное выполнение профилактической лимфаденэктомии или проведение предоперационной лучевой терапии как на регионарные лимфатические узлы, так и на область первичной опухоли [259-264].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется выполнять пациентам биопсию сторожевого лимфатического узла при толщине первичной опухоли более 0,8 мм по Бреслоу с целью правильного определения стадии заболевания, прогноза течения заболевания и определения показаний к адъювантной терапии [248,265-281].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
Комментарий: биопсия сторожевого лимфатического узла проводится в специализированных учреждениях, укомплектованных оборудованием и имеющих обученный персонал.
Комментарий: биопсия сторожевого лимфатического узла проводится в специализированных учреждениях, укомплектованных оборудованием и имеющих обученный персонал.
-
Вопрос о выполнении лимфодиссекции у взрослых пациентов в случае обнаружения микрометастазов в сторожевом лимфатическом узле рекомендуется обсудить с пациентом, взвесив потенциальные риски такой операции и ожидаемую пользу с учетом данных исследования MSLT-II [273]. Альтернативой выполнения безотлагательной лимфодиссекции может стать тщательное наблюдение за регионарным лимфоколлектором при помощи экспертного УЗИ [273].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
-
Особое внимание в рамках патолого-анатомического исследования операционного материала рекомендуется уделить морфологическому исследованию удаленного сторожевого лимфатического узла (узлов) при биопсии сторожевого лимфатического узла: настоятельно рекомендуется выполнить как можно больше срезов, а также помимо окраски гематоксилином и эозином использовать иммуногистохимическое окрашивание на меланома-специфические маркеры (Melan A, тирозиназа, HMB45 или SOX-10). Иммуногистохимическое окрашивание рекомендуется рутинно выполнять в при отсутствии признаков метастатического поражения по данным окрашивания гематоксилином и эозином [282-297].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
-
В отсутствие возможности выполнения биопсии сторожевого лимфатического узла рекомендуется максимально тщательно исследовать регионарные лимфатические узлы, используя УЗИ для навигации на подозрительный лимфатический узел с последующей тонкоигольной пункцией и цитологическим исследованием [298-302].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Лечение локальных стадий заболевания при меланоме слизистых оболочек.
Лечение локальных стадий заболевания при меланоме слизистых оболочек.
-
При меланоме слизистых оболочек взрослым пациентам рекомендуется рассматривать хирургическое вмешательство как основной метод лечения пациентов с локальными стадиями болезни (например, T3-4a N0-1 при локализации на слизистых верхних дыхательных и пищеварительных путей). Принципы лечения более распространенных стадий – см. раздел 3.4. «Лечение пациентов метастатической и нерезектабельной меланомой кожи (IIIC/D нерезектабельная – IV)» [303-309].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
При меланоме слизистых оболочек полости и придаточных пазух носа при стадии T3-4a, N0 взрослым пациентам рекомендуется выполнение оперативного вмешательства с широкой резекцией в пределах здоровых тканей с адъювантной лучевой терапией на область первичной опухоли через 4-6 недель на область первичной опухоли c СОД 60 – 70 Гр (при наличии паталогических факторов высокого риска рецидива), 46 – 55 Гр на зоны низкого риска и 54 – 63 Гр на зоны среднего риска [303,304,306,307,309-322].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств 4).
-
При меланоме слизистых оболочек полости и придаточных пазух носа при стадии T3-4a, N1 взрослым пациентам рекомендуется на первом этапе лечения выполнение оперативного вмешательства в объеме удаления первичной опухоли и фасциально-футлярного иссечения клетчатки шеи на стороне поражения или с двух сторон при двустороннем поражении. На втором этапе лечения – адъювантная лучевая терапия через 4-6 недель на область первичной опухоли СОД 60 – 70 Гр (при наличии паталогических факторов высоко риска рецидива), 46 – 55 Гр на область низкого риска и 54 – 63 Гр на зоны среднего риска [303,304,306,307,309-322].
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
-
При меланоме слизистых оболочек полости рта, ротоглотки, гортаноглотки и гортани при стадии T3-4a, N0 у пациентов рекомендуется на первом этапе выполнение оперативного вмешательства в объеме удаления первичной опухоли и профилактической шейной лимфодиссекции с ипсилатеральной стороны. На втором этапе лечения – адъювантная лучевая терапия через 4 – 6 недель на область первичной опухоли СОД 60 – 70 Гр (при наличии паталогических факторов высоко риска рецидива), 46 – 55 Гр на область низкого риска и 54 – 63 Гр на зоны среднего риска [303,304,306,307,309-322].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств – 4).
-
При меланоме слизистых оболочек полости рта, ротоглотки, гортаноглотки и гортани при стадии T3-4a, N1 рекомендуется на первом этапе лечения выполнение оперативного вмешательства пациентам в объеме удаления первичной опухоли и фасциально-футлярного иссечения клетчатки шеи на ипсилатеральной стороне или с двух сторон при двустороннем поражении. На втором этапе лечения – адъювантная лучевая терапия через 4 – 6 недель на область первичной опухоли СОД 60 – 70 Гр (при наличии паталогических факторов высоко риска рецидива), 46 – 55 Гр на область низкого риска и 54 – 63 Гр на зоны среднего риска [303-316].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств – 4).
-
При меланоме слизистых оболочек области головы и шеи при стадии T4b, N0-1 взрослым пациентам рекомендуется лучевая терапия в самостоятельном варианте на область первичной опухоли и пораженные регионарные лимфатические узлы в СОД от 66-70Гр, на зоны низкого и среднего риска рецидива и 50-63 Гр [303,304,306,307,309-322].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств – 4).
Комментарий: Всех пациентов с меланомой слизистых оболочек, локализованных в области головы и шеи до лечения должен оценивать хирург-онколог, специализирующийся на опухолях головы и шеи, которому следует предпринять следующие действия: рассмотреть адекватность биопсийного материала, стадирования и визуализации опухолевого процесса (КТ,МРТ) для определения степени распространения опухоли, исключить наличие синхронной первичной опухоли, оценить текущий функциональный статус и возможность назначения потенциального хирургического лечения, если первичное лечение было нехирургическим, разработать проспективный план наблюдения, который будет включать адекватное обследование зубов, питания и здорового образа жизни, а также вмешательства и любые другие дополнительные исследования, которые необходимы для полной реабилитации. Для пациентов, которым выполняют плановые операции, необходимо проработать хирургическое вмешательство, края и план реконструкции для резекции клинически определяемой опухоли со свободными от опухоли хирургическими краями. Оценка операбельности. Поражение опухолью следующих структур связано с плохим прогнозом или классифицируется как стадия Т4b (например, неоперабельность, ассоциированная с технической невозможностью получить чистые края резекции): значительное поражение крыловидно-небной ямки, тяжелые тризмы из-за инфильтрации опухолью крыловидных мышц; макроскопическое распространение опухоли на основание черепа (например, эрозия крыловидных пластинок или основной кости, расширение овального отверстия и др.); возможная инвазия (охват) стенки общей или внутренней сонной артерии. Охват обычно оценивается радиологически (по данным КТ и МРТ) и диагностируется, если опухоль окружает ≥270° окружности сонной артерии; непосредственное распространение опухоли из регионарных ЛУ с поражением кожи, прямое распространение на структуры средостения предпозвоночную фасцию или шейные позвонки [303-309].
Удаление первичного очага. По возможности необходимо выполнять удаление первичной опухоли единым блоком. Необходимо планировать хирургическое удаление в зависимости от степени распространения первичной опухоли, установленной при клиническом исследовании, и тщательной интерпретации соответствующих радиографических снимков. В случае если опухоль прилежит к двигательному или сенсорному нерву, не исключено наличие периневральной инвазии. В данной ситуации следует выделить нерв в проксимальном и дистальном направлениях и выполнить его резекцию для получения чистого края резекции. Подтверждено, что для получения ткани, свободной от опухоли, полезна диагностика проксимального и дистального краев нерва методом замороженных срезов (срочное патолого-анатомическое исследование биопсийного материала). Адекватное вмешательство может потребовать выполнения краевой, плоскостной или сагиттальной резекции подлежащих костных структур при опухолях, поражающих надкостницу или прилежащих к ней. Резекция костей показана при массивной инфильтрации опухолью надкостницы кости (что определяется при фиксации к ней опухоли) или при обнаружении во время операции либо при полном дооперационном обследовании признаков прямого прорастания кости опухолью. Степень резекции окружающих мягких тканей и кости будет зависеть от степени поражения, оцениваемой клинически и во время операции [303,306,323-330].
Края резекции. Адекватное удаление опухоли в мягких тканях определяется как расстояние от края резекции до макроскопически видимой опухоли ≥ 2 см или отрицательный край замороженного среза. В целом оценку замороженных срезов обычно проводят интраоперационно, если зона, макроскопически свободная от опухоли по краю резекции составляет <2 см, невозможно определить линию резекции в связи с нечеткой границей опухоли или имеется подозрение на наличие резидуальной опухоли. Необходимо включать подробное описание края резекции в операционный журнал. Края можно оценить по удаленному препарату или, как альтернатива, из ложа опухоли с правильным ориентированием. Чистый край определяется как расстояние от инвазивного края опухоли, который составляет ≥ 5 мм от края резекции. Близкий край определяется как расстояние от инвазивного края опухоли до края резекции, равное <5 мм. Первичную опухоль следует помечать таким образом, чтобы врач-патологоанатом мог адекватно оценить ориентацию препарата. Шейную диссекцию необходимо ориентировать или выполнять срезы по порядку для определения уровня ЛУ, включенных в зону диссекции. Реконструкцию хирургических дефектов нужно проводить с использованием конвенциальной техники по усмотрению хирурга. По возможности рекомендуется первичное ушивание, но при этом не следует пренебрегать широкими краями резекции, свободными от опухоли. По усмотрению хирурга выполняется пластическое ушивание с применением местных/регионарных лоскутов, свободных лоскутов, расщепленного кожного лоскута или других лоскутов с/без реконструкции дефекта [303,306,309,323-330].
Комментарий: Всех пациентов с меланомой слизистых оболочек, локализованных в области головы и шеи до лечения должен оценивать хирург-онколог, специализирующийся на опухолях головы и шеи, которому следует предпринять следующие действия: рассмотреть адекватность биопсийного материала, стадирования и визуализации опухолевого процесса (КТ,МРТ) для определения степени распространения опухоли, исключить наличие синхронной первичной опухоли, оценить текущий функциональный статус и возможность назначения потенциального хирургического лечения, если первичное лечение было нехирургическим, разработать проспективный план наблюдения, который будет включать адекватное обследование зубов, питания и здорового образа жизни, а также вмешательства и любые другие дополнительные исследования, которые необходимы для полной реабилитации. Для пациентов, которым выполняют плановые операции, необходимо проработать хирургическое вмешательство, края и план реконструкции для резекции клинически определяемой опухоли со свободными от опухоли хирургическими краями. Оценка операбельности. Поражение опухолью следующих структур связано с плохим прогнозом или классифицируется как стадия Т4b (например, неоперабельность, ассоциированная с технической невозможностью получить чистые края резекции): значительное поражение крыловидно-небной ямки, тяжелые тризмы из-за инфильтрации опухолью крыловидных мышц; макроскопическое распространение опухоли на основание черепа (например, эрозия крыловидных пластинок или основной кости, расширение овального отверстия и др.); возможная инвазия (охват) стенки общей или внутренней сонной артерии. Охват обычно оценивается радиологически (по данным КТ и МРТ) и диагностируется, если опухоль окружает ≥270° окружности сонной артерии; непосредственное распространение опухоли из регионарных ЛУ с поражением кожи, прямое распространение на структуры средостения предпозвоночную фасцию или шейные позвонки [303-309].
Удаление первичного очага. По возможности необходимо выполнять удаление первичной опухоли единым блоком. Необходимо планировать хирургическое удаление в зависимости от степени распространения первичной опухоли, установленной при клиническом исследовании, и тщательной интерпретации соответствующих радиографических снимков. В случае если опухоль прилежит к двигательному или сенсорному нерву, не исключено наличие периневральной инвазии. В данной ситуации следует выделить нерв в проксимальном и дистальном направлениях и выполнить его резекцию для получения чистого края резекции. Подтверждено, что для получения ткани, свободной от опухоли, полезна диагностика проксимального и дистального краев нерва методом замороженных срезов (срочное патолого-анатомическое исследование биопсийного материала). Адекватное вмешательство может потребовать выполнения краевой, плоскостной или сагиттальной резекции подлежащих костных структур при опухолях, поражающих надкостницу или прилежащих к ней. Резекция костей показана при массивной инфильтрации опухолью надкостницы кости (что определяется при фиксации к ней опухоли) или при обнаружении во время операции либо при полном дооперационном обследовании признаков прямого прорастания кости опухолью. Степень резекции окружающих мягких тканей и кости будет зависеть от степени поражения, оцениваемой клинически и во время операции [303,306,323-330].
Края резекции. Адекватное удаление опухоли в мягких тканях определяется как расстояние от края резекции до макроскопически видимой опухоли ≥ 2 см или отрицательный край замороженного среза. В целом оценку замороженных срезов обычно проводят интраоперационно, если зона, макроскопически свободная от опухоли по краю резекции составляет <2 см, невозможно определить линию резекции в связи с нечеткой границей опухоли или имеется подозрение на наличие резидуальной опухоли. Необходимо включать подробное описание края резекции в операционный журнал. Края можно оценить по удаленному препарату или, как альтернатива, из ложа опухоли с правильным ориентированием. Чистый край определяется как расстояние от инвазивного края опухоли, который составляет ≥ 5 мм от края резекции. Близкий край определяется как расстояние от инвазивного края опухоли до края резекции, равное <5 мм. Первичную опухоль следует помечать таким образом, чтобы врач-патологоанатом мог адекватно оценить ориентацию препарата. Шейную диссекцию необходимо ориентировать или выполнять срезы по порядку для определения уровня ЛУ, включенных в зону диссекции. Реконструкцию хирургических дефектов нужно проводить с использованием конвенциальной техники по усмотрению хирурга. По возможности рекомендуется первичное ушивание, но при этом не следует пренебрегать широкими краями резекции, свободными от опухоли. По усмотрению хирурга выполняется пластическое ушивание с применением местных/регионарных лоскутов, свободных лоскутов, расщепленного кожного лоскута или других лоскутов с/без реконструкции дефекта [303,306,309,323-330].
-
Рекомендуется пациентам с меланомой анального канала или прямой кишки с целью радикального удаления первичной опухоли отдавать предпочтение выполнению местного иссечения при условии отсутствия данных обследования о поражении регионарных лимфатических узлов, возможности достижения краёв резекции более 1 мм (R0) и сохранения функции запирательного аппарата прямой кишки [141,331-333].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: отсутствуют данные о повышении общей выживаемости при расширении объёма операции до экстирпации прямой кишки или экстралеваторной экстирпации прямой кишки. Выполнение расширенных объёмов операций допустимо, но только после получения от пациента письменного информированного согласия на операцию, в котором указано об отсутствии достоверных данных о преимуществе такого подхода. Достижение R0 резекции достоверно улучшает локальный контроль заболевания и является важной целью хирургического лечения [334].
Комментарий: отсутствуют данные о повышении общей выживаемости при расширении объёма операции до экстирпации прямой кишки или экстралеваторной экстирпации прямой кишки. Выполнение расширенных объёмов операций допустимо, но только после получения от пациента письменного информированного согласия на операцию, в котором указано об отсутствии достоверных данных о преимуществе такого подхода. Достижение R0 резекции достоверно улучшает локальный контроль заболевания и является важной целью хирургического лечения [334].
-
Рекомендуется пациентам с меланомой анального канала или прямой кишки с целью паллиативного удаления первичной опухоли выполнять местное иссечение при условии возможности достижения краёв резекции более 1 мм (R0) и сохранения функции запирательного аппарата прямой кишки [141,331-333].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: расширение объёма хирургического вмешательства до экстирпации прямой кишки или экстралеваторной экстирпации прямой кишки возможно только при наличии выраженных симптомов со стороны первичной опухоли – клинически значимое кровотечение, кишечная непроходимость, некупируемый ненаркотическими анальгетиками болевой синдром.
Комментарий: расширение объёма хирургического вмешательства до экстирпации прямой кишки или экстралеваторной экстирпации прямой кишки возможно только при наличии выраженных симптомов со стороны первичной опухоли – клинически значимое кровотечение, кишечная непроходимость, некупируемый ненаркотическими анальгетиками болевой синдром.
-
Рекомендуется взрослым пациентам с меланомой анального канала или прямой кишки с поражением регионарных лимфатических узлов с целью радикального удаления первичной опухоли выполнять экстралеваторную экстирпацию прямой кишки, экстирпацию прямой кишки или низкую резекцию прямой кишки (в зависимости от точной локализации опухоли и степени распространённости опухолевого процесса) [335].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарий: поражение регионарных лимфатических узлов без развития отдалённых метастазов сравнительно редко отмечается у пациентов с меланомой прямой кишки и анального канала. При планировании радикального хирургического лечения целесообразно выполнить независимый пересмотр МРТ малого таза вторым специалистом для исключения ложноположительной оценки поражения регионарных лимфатических узлов. Данные о преимуществе удаления регионарных лимфатических узлов при меланоме анального канала противоречивы. Большинство авторов пишут об отсутствии влияния поражения регионарных лимфатических узлов на выживаемость [336-338]. Тем не менее, есть клинические наблюдения, в которых демонстрируется долгосрочная выживаемость пациентов с поражением мезоректальных лимфатических узлов после выполнения экстирпации прямой кишки [335]. В условиях отсутствиях данных высокой степени доказательности решение об объёме операции следует принимать совместно с пациентом, отдавая предпочтение потенциально излечивающему методу – экстралеваторной экстирпации прямой кишки, хотя и вероятность достижения отдалённой выживаемости остаётся неустановленной.
Комментарий: поражение регионарных лимфатических узлов без развития отдалённых метастазов сравнительно редко отмечается у пациентов с меланомой прямой кишки и анального канала. При планировании радикального хирургического лечения целесообразно выполнить независимый пересмотр МРТ малого таза вторым специалистом для исключения ложноположительной оценки поражения регионарных лимфатических узлов. Данные о преимуществе удаления регионарных лимфатических узлов при меланоме анального канала противоречивы. Большинство авторов пишут об отсутствии влияния поражения регионарных лимфатических узлов на выживаемость [336-338]. Тем не менее, есть клинические наблюдения, в которых демонстрируется долгосрочная выживаемость пациентов с поражением мезоректальных лимфатических узлов после выполнения экстирпации прямой кишки [335]. В условиях отсутствиях данных высокой степени доказательности решение об объёме операции следует принимать совместно с пациентом, отдавая предпочтение потенциально излечивающему методу – экстралеваторной экстирпации прямой кишки, хотя и вероятность достижения отдалённой выживаемости остаётся неустановленной.
-
Рекомендуется пациентам с меланомой анального канала или прямой кишки с целью достижения локального контроля после местного иссечения в случае обнаружения поражения опухолью границы резекции (R1) выполнять повторное местное иссечение, при условии технической выполнимости и сохранения функции запирательного аппарата прямой кишки [141,331-333].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: в случае, если исходно было принято решение о выполнении хирургического лечения в объёме местного иссечения опухоли, выявление опухолевых клеток по границе резекции (R1) является показанием для повторного местного иссечения, но не для пересмотра тактики лечения. Расширение объёма операции целесообразно только в случае, если повторное местное иссечение технически невыполнимо или повлечёт за собой необратимое нарушение функции запирательного аппарата прямой кишки.
Комментарий: в случае, если исходно было принято решение о выполнении хирургического лечения в объёме местного иссечения опухоли, выявление опухолевых клеток по границе резекции (R1) является показанием для повторного местного иссечения, но не для пересмотра тактики лечения. Расширение объёма операции целесообразно только в случае, если повторное местное иссечение технически невыполнимо или повлечёт за собой необратимое нарушение функции запирательного аппарата прямой кишки.
-
Рекомендуется пациентам с метастазами меланомы анального канала в паховые лимфатические узлы выполнять паховую лимфаденэктомию только с целью контроля возможных симптомов заболевания (кровотечение из опухоли, распад опухоли, сдавление сосудистых структур [337].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: отсутствуют данные о возможном повышении выживаемости при выполнении паховой лимфаденэктомии, а также о долгосрочной выживаемости после выполнения паховой лимфаденэктомии [337].
2. Лечение пациентов с резектабельной меланомой кожи III стадии и эквивалентом III стадии
Пациенты с меланомой кожи III стадии представляют собой неоднородную группу пациентов с позиции лечебной тактики. С практической точки зрения следует различать резектабельный процесс и нерезектабельный местно-распространенный процесс (включая конгломераты лимфатических узлов и/или транзитные или сателлитные метастазы – клинические варианты IIIB или IIIC/D стадии). Рекомендации по лечению пациентов нерезектабельной меланомой кожи IIIC/D будут рассмотрены в разделе 3.4.
Комментарий: отсутствуют данные о возможном повышении выживаемости при выполнении паховой лимфаденэктомии, а также о долгосрочной выживаемости после выполнения паховой лимфаденэктомии [337].
2. Лечение пациентов с резектабельной меланомой кожи III стадии и эквивалентом III стадии
Пациенты с меланомой кожи III стадии представляют собой неоднородную группу пациентов с позиции лечебной тактики. С практической точки зрения следует различать резектабельный процесс и нерезектабельный местно-распространенный процесс (включая конгломераты лимфатических узлов и/или транзитные или сателлитные метастазы – клинические варианты IIIB или IIIC/D стадии). Рекомендации по лечению пациентов нерезектабельной меланомой кожи IIIC/D будут рассмотрены в разделе 3.4.
-
Рекомендуется выполнить адекватное иссечение первичной опухоли (если не было выполнено ранее) (см. раздел 3.1) для улучшения отдаленных результатов лечения и профилактики рецидивов опухоли [158,159,235-237,239,241,243,249,250].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1).
-
Рекомендуется выполнять регионарную лимфаденэктомию всем пациентам с резектабельной меланомой кожи III стадии при наличии клинически или радиологически определяемых метастазов в регионарных лимфоузлах для улучшения отдаленных результатов лечения и профилактики рецидивов опухоли [339-342].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
При проведении лимфаденэктомии пациентам меланомой кожи III стадии для улучшения отдаленных результатов лечения и профилактики рецидивов опухоли рекомендуется выполнять максимально полное удаление клетчатки анатомической области, в лимфатических узлах которой выявлены метастазы меланомы (например, Ib–V уровни клетчатки шеи (Ia – по показаниям), I–III уровни клетчатки подмышечной области, поверхностные и глубокие паховые лимфатические узлы) [339-342].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: при клинически определяемом поражении глубоких паховых лимфатических узлов большое внимание следует уделить наружным подвздошным лимфатическим узлам. Некоторые исследователи в случае массивного поражения глубоких паховых лимфатических узлов (более 3) или поражения узла Пирогова–Розенмюллера–Клоке рекомендуют расширять объем операции до удаления ипсилатеральных наружных подвздошных лимфатических узлов, так как частота их поражения может достигать 20–24 % [343].
Комментарий: при клинически определяемом поражении глубоких паховых лимфатических узлов большое внимание следует уделить наружным подвздошным лимфатическим узлам. Некоторые исследователи в случае массивного поражения глубоких паховых лимфатических узлов (более 3) или поражения узла Пирогова–Розенмюллера–Клоке рекомендуют расширять объем операции до удаления ипсилатеральных наружных подвздошных лимфатических узлов, так как частота их поражения может достигать 20–24 % [343].
-
Рекомендуется определять следующие параметры при патолого-анатомическом исследовании метастазов меланомы в регионарные лимфатические узлы для правильного стадирования и определения прогноза заболевания [54,168,344]:
-
количество удаленных лимфатических узлов;
-
количество пораженных лимфатических узлов;
-
характер поражения лимфатических узлов:
-
частичное поражение (количество лимфатических узлов);
-
полное поражение (количество лимфатических узлов);
-
прорастание капсулы (количество лимфатических узлов).
-
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Рекомендуется предлагать пациентам после радикальной лимфаденэктомии при отсутствии противопоказаний адъювантную лекарственную терапию, информируя пациента о потенциальных преимуществах и ограничениях данного метода лечения (см. раздел 3.3) [223, 345-352].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1).
-
Рекомендуется взрослым пациентам с высоким риском регионарного рецидива после радикальной лимфаденэктомии в целях снижения вероятности регионарного рецидива при отсутствии противопоказаний предлагать профилактическую послеоперационную лучевую терапию на область пораженного лимфоколлектора, информируя пациента о потенциальных преимуществах и ограничениях данного метода лечения [353,354].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Комментарий: по данным проведенных исследований, послеоперационная лучевая терапия снижает риск регионарного рецидива у пациентов с высоким риском, но не оказывает влияния на общую выживаемость [354]. К факторам высокого риска регионарного рецидива относят:
Комментарий: по данным проведенных исследований, послеоперационная лучевая терапия снижает риск регионарного рецидива у пациентов с высоким риском, но не оказывает влияния на общую выживаемость [354]. К факторам высокого риска регионарного рецидива относят:
-
поражение 1 и более околоушного лимфатического узла, 2 и более шейных или подмышечных лимфатических узлов (или при размерах лимфатического узла более 3 см), 3 и более пахово-бедренных лимфатических узлов (или при их размерах более 4 см);
-
прорастание метастаза за пределы капсулы лимфатического узла [354,355]179].
Адъювантная дистанционная лучевая терапия проводится в следующих режимах: 50–66 Гр за 25–33 фракций в течение 5–7 нед (УДД 4, УУР С) [356]; 48 Гр за 20 фракций в течение 4 нед (УДД 2, УУР В) [354]. Использование новых методик дистанционной лучевой терапии, таких как IMRT, VMAT, позволяет снижать повреждение здоровых тканей [357,358].
При наличии нерезектабельных метастазов в регионарные лимфатические узлы возможно проведение паллиативной лучевой терапии на эту область. Используются различные режимы лечения, например: 48 Гр за 20 фракций в течение 4 нед.[353]; 50–Гр за 20–фракции в течение 4 нед [258].
3. Рекомендации по проведению адъювантной терапии меланомы кожи II и III стадии и эквивалентом III стадии
-
Рекомендуется для определения показаний к назначению адъювантной терапии оценить риск прогрессирования и смерти от меланомы кожи после радикального хирургического лечения. Для оценки риска рекомендуется использовать классификацию TNM AJCC/UICC 8-го пересмотра, которая включает основные прогностические факторы (см. подраздел 1.5.2 и раздел 7) [344,359].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
-
Рекомендуется предлагать пациентам с высоким и промежуточным риском прогрессирования после радикального хирургического лечения (т. е. пациентам со стадиями IIB–III) при отсутствии противопоказаний адъювантную лекарственную терапию (Таблица 10), информируя пациента о потенциальных преимуществах и ограничениях данного метода лечения) [54,223,345-348,350-352,360-363].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Таблица 10.
Рекомендуемые режимы адъювантной терапии меланомы кожи в зависимости от стадии заболевания для взрослых3

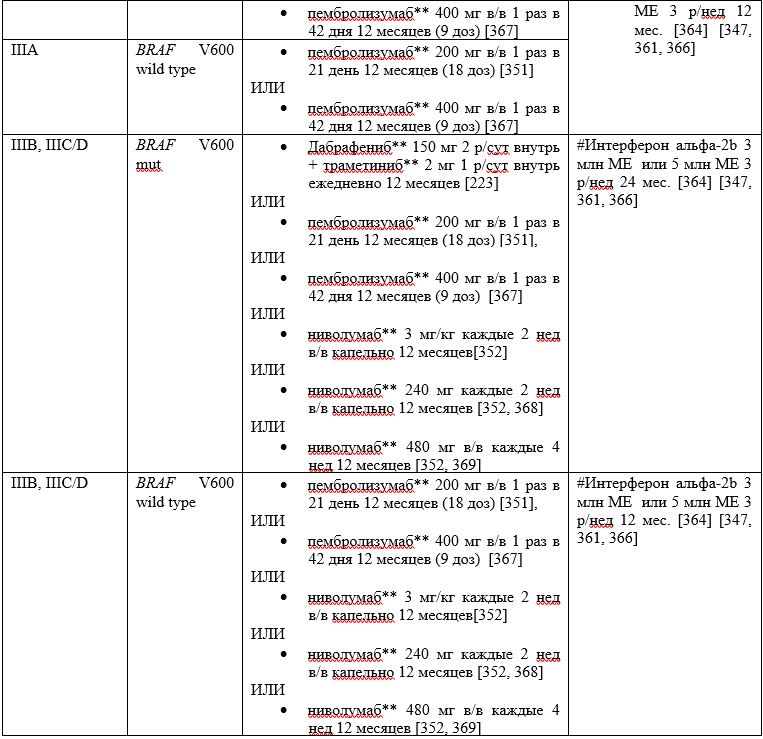
3Пациентам всех групп следует предлагать участие в клинических исследованиях при наличии такой возможности.
Примечание. BRAF V600 mut – активирующая мутация в гене BRAF в 600-й позиции экзона 15 с заменой нуклеотида, кодирующего валин, на другую аминокислоту (чаще всего на нуклеотид, кодирующий глутаминовую кислоту). BRAF V600 wild type – «дикий тип» (отсутствие активирующих мутаций V600) гена BRAF.
Комментарий: Адъювантная терапия #интерфероном альфа-2b имеет преимущества только у пациентов с изъязвленной первичной меланомой кожи. Назначение #интерферона альфа-2b в адъювантном режиме у пациентов с неизъязвленной первичной опухолью не рекомендуется. Адъювантная терапия МКА-блокаторами PD1 изучается для пациентов с IIB-IIC стадией, продемонстрирован эффект в отношении времени без прогрессирования, однако ее эффект в отношении общей выживаемости к настоящему моменту не представлен [363,370,371]. У пациентов с эквивалентом стадии IIIA магнитуда пользы от назначения такой терапии невысока и для такой популяции пациентов альтернативой может служить тщательное динамическое наблюдение [223,351].
Таблица 10.
Рекомендуемые режимы адъювантной терапии меланомы кожи в зависимости от стадии заболевания для взрослых3


3Пациентам всех групп следует предлагать участие в клинических исследованиях при наличии такой возможности.
Примечание. BRAF V600 mut – активирующая мутация в гене BRAF в 600-й позиции экзона 15 с заменой нуклеотида, кодирующего валин, на другую аминокислоту (чаще всего на нуклеотид, кодирующий глутаминовую кислоту). BRAF V600 wild type – «дикий тип» (отсутствие активирующих мутаций V600) гена BRAF.
Комментарий: Адъювантная терапия #интерфероном альфа-2b имеет преимущества только у пациентов с изъязвленной первичной меланомой кожи. Назначение #интерферона альфа-2b в адъювантном режиме у пациентов с неизъязвленной первичной опухолью не рекомендуется. Адъювантная терапия МКА-блокаторами PD1 изучается для пациентов с IIB-IIC стадией, продемонстрирован эффект в отношении времени без прогрессирования, однако ее эффект в отношении общей выживаемости к настоящему моменту не представлен [363,370,371]. У пациентов с эквивалентом стадии IIIA магнитуда пользы от назначения такой терапии невысока и для такой популяции пациентов альтернативой может служить тщательное динамическое наблюдение [223,351].
-
Для взрослых пациентов, радикально оперированных по поводу отдаленных метастазов меланомы кожи, рекомендовано проводить адъювантное лечение с применением моноклональных антител (далее – МКА), блокирующих взаимодействие между рецептором программируемой смерти (PD-1) и его лигандами (далее - МКА-блокаторы PD1) (ниволумаб**). При наличии противопоказаний альтернативой может быть динамическое наблюдение или участие в клинических исследованиях (если таковые имеются) [54,346-348,350,352,360-362].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 1).
-
Не рекомендуется проводить адъювантную терапию пациентам меланомой кожи группы благоприятного прогноза, имеющим низкий риск прогрессирования заболевания (IA, IB, IIA стадии) [364,372].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Не рекомендуется проводить адъювантную терапию интерфероном альфа-2а и интерфероном альфа-2b пациентам меланомой кожи, у которых риски, связанные с развитием нежелательных явлений на фоне применения адъювантной терапии, превышают ожидаемую пользу [360,361,373-375].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 1)
Комментарий: учитывая, что проведение иммунотерапии интерфероном альфа-2а или интерфероном альфа-2b сопряжено с известными рисками развития нежелательных явлений, следует выделить группу пациентов, которым это лечение противопоказано. После анализа данных литературы эксперты пришли к выводу о том, что риск превосходит пользу от назначения терапии интерфероном альфа-2а и интерфероном альфа-2b в следующих случаях (но не ограничивается ими) [360,373-375]:
Комментарий: учитывая, что проведение иммунотерапии интерфероном альфа-2а или интерфероном альфа-2b сопряжено с известными рисками развития нежелательных явлений, следует выделить группу пациентов, которым это лечение противопоказано. После анализа данных литературы эксперты пришли к выводу о том, что риск превосходит пользу от назначения терапии интерфероном альфа-2а и интерфероном альфа-2b в следующих случаях (но не ограничивается ими) [360,373-375]:
-
психические расстройства, в том числе тяжелая депрессия;
-
цирроз печени любой этиологии;
-
аутоиммунные болезни;
-
выраженная (III–IV степени по CTCAE v. 3.0 [376]) органная недостаточность (сердечная, печеночная, почечная и др.);
-
беременность или планируемая беременность;
-
псориаз;
-
неспособность пациента адекватно выполнять назначения врача.
В связи с этим эксперты рекомендуют перед назначением адъювантной иммунотерапии #интерфероном альфа 2b исключить наличие у пациентов перечисленных противопоказаний, при необходимости прибегнув к консультации специалистов (врача-терапевта, врача-психиатра, врача-дерматовенеролога и т. д.). Следует также учесть противопоказания к назначению препарата, указанные производителем в инструкции по применению.
-
Рекомендуется начинать адъювантную иммунотерапию пациентам в сроки не позже 3 месяцев с момента хирургического лечения после полного заживления послеоперационной раны. Не рекомендуется начинать адъювантное лечение в том случае, если с момента операции прошло более 3 месяцев, так как при начале адъювантной терапии в более отдаленные сроки ее эффективность не изучена [223,351,352,361].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
-
В рандомизированных исследованиях не было показано преимуществ прерывистых режимов назначения #интерферона альфа-2b, потому они не рекомендуются к использованию в рутинной практике [373,377].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
-
Не рекомендуется использовать химиотерапию в рутинной практике для адъювантного лечения взрослых пациентов с меланомой кожи [378-385].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
Комментарий: По данным многочисленных международных исследований, применение химиотерапии в адъювантном режиме после радикального лечения меланомы кожи IIB–III стадии не приносит клинической пользы и может снижать общую выживаемость.
Комментарий: По данным многочисленных международных исследований, применение химиотерапии в адъювантном режиме после радикального лечения меланомы кожи IIB–III стадии не приносит клинической пользы и может снижать общую выживаемость.
-
Не рекомендуется использовать иммуностимуляторы (группа АТХ - L03AX Другие иммуностимуляторы) или другие интерфероны (в том числе, интерферон гамма**) [386], за исключением #интерферона альфа-2b в адъювантном режиме при меланоме кожи [361,364,365].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 2).
Комментарий: Имеющиеся данные клинических исследований свидетельствуют об отсутствии эффективности интерферона гамма** в адъювантном режиме относительно других препаратов имеющихся научных данных недостаточно для их безопасного применения [54].
Комментарий: Имеющиеся данные клинических исследований свидетельствуют об отсутствии эффективности интерферона гамма** в адъювантном режиме относительно других препаратов имеющихся научных данных недостаточно для их безопасного применения [54].
-
При меланоме кожи с высоким риском прогрессирования у лиц моложе 18 лет рекомендуется проводить адъювантную терапию #пембролизумабом** 2 мг/кг каждые 21 день в/в капельно (30 минут) 12 месяцев, информируя пациента (и/или его родителей, законных представителей) о потенциальных преимуществах и ограничениях данного метода лечения по решению врачебной комиссии [387,388].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарий: адъювантная терапия меланомы кожи пациентов детского возраста изучена недостаточно: в виду редкости данной болезни у детей крупных рандомизированных исследований современных противоопухолевых препаратов у этой категории пациентов не проводилось. Рабочая группа по разработке и пересмотру клинических рекомендаций рекомендует участие пациентов моложе 18 лет в клинических исследованиях. Исследованным режимом в педиатрической практике в адъювантом режиме к настоящему времени стал #интерферон альфа-2b в различных режимах [347,348,389-391] (рекомендуемые режимы применения интерферона – см. Таблица 10. Рекомендуемые режимы адъювантной терапии меланомы кожи в зависимости от стадии заболевания для взрослых) и #пембролизумаб [388]. Назначение иной адъювантной терапии (в соответствии с рекомендациями для взрослых пациентов) возможно консилиумом врачей по жизненным показаниям.
Рекомендации по проведению неоадъювантной терапии меланомы кожи III стадии и эквивалентом III стадии
Введение: Данные недавно проведенных исследований демонстрируют весьма обнадеживающие результаты при проведении неоадъювантной иммунотерапии, у пациентов с меланомой с поражением регионарных лимфатических узлов. Судя по всему, такая тактика обладает преимуществом перед стандартным подходом. Вероятно, в ближайшее время, объемы хирургических вмешательств при эквиваленте IIIB-D стадии меланомы также будут пересмотрены в сторону уменьшения травматичности и объема удаляемых тканей (удаление индексных узлов вместо полного удаления всего лимфоколлектора). Однако к настоящему времени у нас недостаточно данных, чтобы рекомендовать уменьшение объема хирургического вмешательства, тем не менее вполне достаточно данных, чтобы рекомендовать неоадъювантный подход для пациентов с резектабельными метастазами меланомы [392-397].
Комментарий: адъювантная терапия меланомы кожи пациентов детского возраста изучена недостаточно: в виду редкости данной болезни у детей крупных рандомизированных исследований современных противоопухолевых препаратов у этой категории пациентов не проводилось. Рабочая группа по разработке и пересмотру клинических рекомендаций рекомендует участие пациентов моложе 18 лет в клинических исследованиях. Исследованным режимом в педиатрической практике в адъювантом режиме к настоящему времени стал #интерферон альфа-2b в различных режимах [347,348,389-391] (рекомендуемые режимы применения интерферона – см. Таблица 10. Рекомендуемые режимы адъювантной терапии меланомы кожи в зависимости от стадии заболевания для взрослых) и #пембролизумаб [388]. Назначение иной адъювантной терапии (в соответствии с рекомендациями для взрослых пациентов) возможно консилиумом врачей по жизненным показаниям.
Рекомендации по проведению неоадъювантной терапии меланомы кожи III стадии и эквивалентом III стадии
Введение: Данные недавно проведенных исследований демонстрируют весьма обнадеживающие результаты при проведении неоадъювантной иммунотерапии, у пациентов с меланомой с поражением регионарных лимфатических узлов. Судя по всему, такая тактика обладает преимуществом перед стандартным подходом. Вероятно, в ближайшее время, объемы хирургических вмешательств при эквиваленте IIIB-D стадии меланомы также будут пересмотрены в сторону уменьшения травматичности и объема удаляемых тканей (удаление индексных узлов вместо полного удаления всего лимфоколлектора). Однако к настоящему времени у нас недостаточно данных, чтобы рекомендовать уменьшение объема хирургического вмешательства, тем не менее вполне достаточно данных, чтобы рекомендовать неоадъювантный подход для пациентов с резектабельными метастазами меланомы [392-397].
-
Рекомендуется взрослым пациентам с поражением регионарных лимфоузлов (IIIВ-D стадия заболевания или ее эквивалент) проведение предоперационной иммунотерапии с последующим выполнением регионарной лимфаденэктомии и последующей адъювантной терапией (вместе с неоадъювантной терапией – общей длительностью до 12 мecяцев [398] [399]. Режимы применения приведены в таблице ниже (Таблица 11).
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
Таблица 11.
Режимы применения неоадъювантной терапии.
Таблица 11.
Режимы применения неоадъювантной терапии.
|
|
Лекарственный препарат
|
Доза
|
Путь введения
|
Дни введения / приема
|
Длительность цикла
|
|
Комбинированная иммунотерапия aCTLA4+aPD1[398] (предпочтительный режим)
|
Ипилимумаб**
|
80 мг
|
в/в кап
|
1 раз в 21 день
|
С последующей полной регионарной лимфаденэктомией и, если применимо, резекцией транзитных метастазов на 6-й неделе. Пациентам, с полным или почти полным патоморфологически м ответом на лечение (≤10% остаточной жизнеспособной опухоли), не получают никакого адъювантного лечения (только наблюдение), а пациентов, с неполным патоморфологически м ответом частичный ответ (от 11 до 50% остаточной жизнеспособной опухоли) или отсутствием ответа (>50% остаточной жизнеспособной опухоли), далее получают адъювантную терапию дабрафенибом** (в дозе 150 мг два раза в день) и траметинибом** (в дозе 2 мг один раз в день) в течение 46 недель (при мутации BRAF V600E или V600K), или получают дополнительные 11 циклов адъювантной терапии ниволумабом** (в дозе 480 мг) каждые 4 недели (при отсутствии мутации в BRAF).
|
|
|
Ниволумаб**
|
240 мг
|
в/в кап
|
||
|
Монотерапия aPD1 [399]
|
Пембролизумаб**
|
200 мг
|
в/в кап
|
1 раз в 21 день,
|
до 2 мес. (3 введения) перед лимфаденэктомией, с последующим продолжением суммарно до 12 мес. терапии
|
-
Рекомендуется пациентам, получающим предоперационную (неоадъювантную) иммунотерапию с поражением регионарных лимфоузлов (IIIВ-D стадия заболевания или ее эквивалент) провести оценку патоморфологического ответа после проведения регионарной лимфаденэктомии [396,398-402].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Рекомендуется пациентам с прогрессированием на фоне предоперационной (неоадъювантной) иммунотерапии с поражением регионарных лимфоузлов (IIIВ-D стадия заболевания или ее эквивалент) и наличием мутации в гене BRAF переключение на адъювантную комбинированную терапию ИПК BRAF и MEK [398] [403] (Таблица 11).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
4. Лечение пациентов метастатической и нерезектабельной меланомой кожи (IIIC/D нерезектабельная – IV стадия или их эквивалент)
1. Общие принципы выбора терапии 1-й линии у пациентов метастатической или неоперабельной меланомой кожи
4. Лечение пациентов метастатической и нерезектабельной меланомой кожи (IIIC/D нерезектабельная – IV стадия или их эквивалент)
1. Общие принципы выбора терапии 1-й линии у пациентов метастатической или неоперабельной меланомой кожи
-
Рекомендуется выполнить оценку состояния взрослого пациента по шкале ВОЗ/ECOG (см. приложение Г1), наличия сопутствующей патологии, ожидаемой продолжительности жизни для принятия решения об оптимальной тактике ведения пациента [404,405].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств 4).
-
Рекомендуется при выборе терапии 1-й линии всем пациентам с метастатической или неоперабельной меланомой провести молекулярно-генетическое исследование опухоли на наличие мутаций в экзоне 15 гена BRAF (если этого не было выполнено ранее). Для исследования может быть использован архивный опухолевый материал или свежий материал, который можно получить при биопсии (открытой, толстоигольной (core-биопсии) и др.) в случае, если это повлияет на выбор дальнейшей тактики лечения [54,173-184].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –4).
-
При отсутствии мутации в гене BRAF ("дикий тип") рекомендуется при выборе терапии 1-й линии всем пациентам с метастатической или неоперабельной меланомой выполнить молекулярно-генетическое исследование мутаций в генах NRAS (экзон 3) и KIT (экзоны 8, 9, 11, 13, 14, 17, 18) в биопсийном (операционном) материале или выполнить широкое молекулярное тестирование, если диагностированы или заподозрены отдаленные метастазы меланомы, и это может повлиять на выбор схемы таргетной терапии (в частности, назначение ингибиторов протеинкиназы или моноклональных антител) при лечении метастатического процесса [185-200].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Комментарий: Также имеются сведения о том, что ингибитор протеинкиназы KIT может быть эффективен при наличии мутаций в 8, 18 экзонах гена KIT [197,201-203].
Комментарий: Также имеются сведения о том, что ингибитор протеинкиназы KIT может быть эффективен при наличии мутаций в 8, 18 экзонах гена KIT [197,201-203].
-
При отсутствии возможности выполнить молекулярно-генетическое исследование опухоли на наличие мутации в гене BRAF (или KIT) в течение 4 недель после установления диагноза метастатической меланомы (отсутствует материал для анализа, нет соответствующего оборудования в учреждении и т. д.) при отсутствии других противопоказаний рекомендуется начинать противоопухолевую терапию пациенту в соответствии с подразделом 3.4.4 настоящих рекомендаций [406,407].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
-
Рекомендуется пациентам с мутацией в гене BRAF (при отсутствии клинически значимых симптомов, небольшой опухолевой массе, невысокой скоростью прогрессирования заболевания и клинически значимых нарушений со стороны иммунной системы), и/или с бессимптомными метастазами в головном мозге (вне зависимости от молекулярного статуса опухоли), и/или при меланоме слизистых оболочек отдавать предпочтение комбинированной иммунотерапии МКА-блокаторами CTLA4 и МКА-блокаторами PD1 (вне зависимости от молекулярного статуса опухоли перед монотерапией МКА-блокаторами PD1 или комбинированным лечением ИПК BRAF и МЕК [408-413].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
2. Выбор терапии 1-й линии у взрослых пациентов метастатической или неоперабельной меланомой кожи с мутацией в гене BRAF
2. Выбор терапии 1-й линии у взрослых пациентов метастатической или неоперабельной меланомой кожи с мутацией в гене BRAF
-
У пациентов с мутацией в гене BRAF в 1-й линии терапии рекомендуется использовать комбинированное лечение МКА-блокаторами PD1 и МКА-блокаторы CTLA4, либо комбинацию ингибиторов протеинкиназы (далее – ИПК) BRAF и МЕК, либо монотерапию МКА-блокаторами PD1. При недоступности комбинированного лечения ИПК BRAF и МЕК или МКА-блокаторами PD1 возможно проведение монотерапии ИПК BRAF [180,181,408,414-420]. Лечение ИПК BRAF и МЕК проводится до прогрессирования заболевания или развития выраженных некупируемых токсических явлений. Режимы применения приведены ниже (Таблица 12 и Таблица 13).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
-
У пациентов с большой опухолевой массой и высокой скоростью прогрессирования заболевания и/или клинически выраженными симптомами рекомендуется отдавать предпочтение комбинации ИПК BRAF и МЕК. У пациентов с метастатической меланомой, не имеющих симптомов заболевания и без активирующей мутации в гене BRAF, предпочтительным вариантом лечения следует считать монотерапию МКА-блокаторами PD1, а у пациентов без симптомов заболевания и активирующей мутации в гене BRAF предпочтительным вариантом лечения следует считать комбинированную терапию МКА-блокаторами PD1 и МКА-блокаторами CTLA4 [413].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Таблица 12.
Режимы назначения ИПК BRAF и МЕК у взрослых пациентов (для всех режимов назначения УДД 2, УУР А).
Таблица 12.
Режимы назначения ИПК BRAF и МЕК у взрослых пациентов (для всех режимов назначения УДД 2, УУР А).
|
Схема терапии
|
Препарат
|
Доза
|
Путь введения
|
Дни приема
|
Длительность цикла, дни, режим
|
|---|---|---|---|---|---|
|
Комбинированная терапия [215,216,421,422]
|
Энкорафениб
|
450 мг 1 р/сут
|
внутрь
|
ежедневно
|
длительно
|
|
Биниметиниб
|
45 мг 2 р/сут
|
внутрь
|
ежедневно
|
длительно
|
|
|
Комбинированная терапия [218,423,424]
|
Вемурафениб**
|
960 мг 2 раза в день
|
внутрь
|
ежедневно
|
длительно
|
|
Кобиметиниб**
|
60 мг 1 раз в сутки
|
внутрь
|
с 1-го по 21-й день, 7 дней перерыв
|
длительно
|
|
|
Комбинированная терапия [175,425,426]
|
Дабрафениб**
|
150 мг 2 раза в день
|
внутрь
|
ежедневно
|
длительно
|
|
Траметиниб**
|
2 мг 1 раз в сутки
|
внутрь
|
ежедневно
|
длительно
|
|
|
Монотерапия [424,427]
|
Вемурафениб**
|
960 мг 2 раза в день
|
внутрь
|
ежедневно
|
длительно
|
|
Монотерапия [428]
|
Дабрафениб**
|
150 мг 2 раза в день
|
внутрь
|
ежедневно
|
длительно
|
|
Монотерапия [215,216,421,422]
|
#Энкорафениб
|
300 мг 1 р/сут
|
внутрь
|
ежедневно
|
длительно
|
-
Не рекомендуется проводить терапию ИПК BRAF или комбинацией ИПК BRAF и MEK пациентам с неизвестным статусом опухоли в отношении мутации в гене BRAF, так как имеются сведения о возможности парадоксальной активации MAPK -сигнального пути и ускорения роста опухоли при применении ИПК BRAF на клеточных линиях без мутации в гене BRAF [406,407].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств –5).
-
Учитывая особый профиль дерматологических нежелательных явлений ИПК BRAF и MEK, в частности риск развития плоскоклеточного рака и других опухолей кожи, на фоне лечения рекомендуется регулярно проводить осмотр кожных покровов пациента [176,219,429].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств –4).
Комментарий: При подозрении на развитие плоскоклеточного рака или кератоакантомы необходимо их хирургическое удаление с последующим патолого-анатомическим исследованием биопсийного или операционного материала, при этом терапия ИПК BRAF или комбинацией ИПК BRAF и МЕК может быть продолжена без перерыва в лечении и/или без редукции дозы препарата [221,427].
Комментарий: При подозрении на развитие плоскоклеточного рака или кератоакантомы необходимо их хирургическое удаление с последующим патолого-анатомическим исследованием биопсийного или операционного материала, при этом терапия ИПК BRAF или комбинацией ИПК BRAF и МЕК может быть продолжена без перерыва в лечении и/или без редукции дозы препарата [221,427].
-
При проведении терапии ИПК BRAF или комбинацией ИПК BRAF и МЕК оценку эффекта лечения рекомендовано проводить каждые ~8 нед., не допуская перерывов в приеме препаратов на период оценки эффекта лечения. Для оценки эффекта терапии рекомендуется использовать оценку общего состояния пациента и методы лучевой диагностики (см. Таблица 9, раздел 2.4) а также стандартные критерии ответа на цитостатическую терапию (RECIST 1.1, Приложение Г3) [180,430,431].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
При наличии признаков прогрессирования заболевания на фоне применения ИПК BRAF либо комбинации ИПК BRAF и МЕК или появления признаков непереносимости такой терапии при сохранении удовлетворительного общего состояния пациента (ECOG 0–2) и при ожидаемой продолжительности жизни более 3 месяцев рекомендуется перевести взрослого пациента на терапию МКА-блокаторами PD1 или комбинацию МКА-блокаторов PD1 и CTLA4 [408,414-418,432]. Режимы применения приведены ниже (Таблица 13).
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
Комментарий: монотерапия МКА-блокаторами PD-1 и комбинированная терапия МКА-блокаторами PD1 и CTLA4 демонстрируют сходные результаты у пациентов с меланомой, резистентной к ИПК BRAF и MEK. Однако комбинированная терапия МКА-блокаторами PD1 и CTLA4 была связана с более высокой частотой нежелательных явлений по сравнению с монотерапией [433].
Таблица 13.
Режимы применения МКА-блокаторов PD1 и CTLA4 у взрослых пациентов.
Комментарий: монотерапия МКА-блокаторами PD-1 и комбинированная терапия МКА-блокаторами PD1 и CTLA4 демонстрируют сходные результаты у пациентов с меланомой, резистентной к ИПК BRAF и MEK. Однако комбинированная терапия МКА-блокаторами PD1 и CTLA4 была связана с более высокой частотой нежелательных явлений по сравнению с монотерапией [433].
Таблица 13.
Режимы применения МКА-блокаторов PD1 и CTLA4 у взрослых пациентов.
|
Схема терапии
|
Препарат
|
Доза
|
Путь введения
|
Дни введения
|
Длительность цикла, дни, режим
|
|---|---|---|---|---|---|
|
Монотерапия [414-416]
|
Ниволумаб**
|
3 мг/кг ИЛИ
|
В/в капельно 30–60 мин
|
1 раз в 14 дней
|
Длительно
|
|
240 мг [434]
ИЛИ |
В/в капельно
|
1 раз в 14 дней
|
Длительно
|
||
|
480 мг[369]
|
В/в капельно
|
1 раз в 28 дней
|
Длительно
|
||
|
Монотерапия [416-418]
|
Пембролизумаб**
|
200 мг
ИЛИ |
В/в капельно 30 мин
|
1 раз в 21 день
|
Длительно
|
|
|
Пембролизумаб**
|
400 мг [367]
|
В/в капельно 30 мин
|
1 раз в 42 дня
|
Длительно
|
|
Монотерапия [435, 436]
|
Пролголимаб**
|
1 мг/кг
|
В/в капельно 30 – 60 мин
|
1 раз в 14 дней
|
Длительно (УДД 2, УУР В)
|
|
Комбинированная терапия МКА-блокаторами CTLA4 и МКА-блокаторами PD1 (ИПИ 3/НИВО 1) [408, 409, 414, 437]
|
Ниволумаб** (в один день с ипилимумабом**)
|
1 мг/кг
|
В/в капельно 30 мин
|
1 раз в 21 день
|
Суммарно не более 4 введений
|
|
Ипилимумаб** (в один день с ниволумабом**)
|
3 мг/кг
|
В/в капельно 30 минут
|
1 раз в 21 день
|
Суммарно не более 4 введений
|
|
|
Поддерживающая фаза: ниволумаб**
|
3 мг/кг ИЛИ
|
В/в капельно
|
1 раз в 14 дней
|
Длительно
|
|
|
240 мг ИЛИ
|
В/в капельно
|
1 раз в 14 дней
|
Длительно
|
||
|
480 мг в/в
|
В/в капельно
|
1 раз в 28 дней
|
Длительно
|
||
|
Комбинированная терапия МКА- блокаторами CTLA4 и МКА- блокаторами PD1 (ИПИ 1/НИВО 3) [437]
(Уровень убедительности рекомендаций – В) (уровень достоверности доказательств – 4). |
Ниволумаб** (в один день с ипилимумабом**)
|
3 мг/кг
|
В/в капельно 30 мин
|
1 раз в 21 день
|
Суммарно не более 4 введений
|
|
Ипилимумаб** (в один день с ниволумабом**)
|
1 мг/кг
|
В/в капельно 30 мин
|
1 раз в 21 день
|
Суммарно не более 4 введений
|
|
|
Поддерживающая фаза: ниволумаб**
ИЛИ |
3 мг/кг
|
В/в капельно 30 мин
|
1 раз в 14 дней
|
Длительно
|
|
|
Поддерживающая фаза: ниволумаб**
ИЛИ |
240 мг
|
В/в капельно 30 мин
|
1 раз в 14 дней
|
Длительно
|
|
|
Поддерживающая фаза:ниволумаб**
|
480 мг
|
В/в капельно 30 мин
|
1 раз в 28 дней
|
Длительно
|
|
|
Комбинированная терапия МКА- блокаторами CTLA4 и МКА- блокаторами PD1 (ИПИ 1/ПЕМБРО 200) [438]
(Уровень убедительности рекомендаций – С) (уровень достоверности доказательств – 4). |
Пембролизумаб** (в один день с ипилимумабом**)
|
200 мг
|
В/в капельно 30 мин
|
1 раз в 21 день
|
Суммарно не более 4 введений
|
|
Ипилимумаб** (в один день с пембролизумабом**)
|
1 мг/кг
|
В/в капельно 30 мин
|
1 раз в 21 день
|
Суммарно не более 4 введений
|
|
|
Поддерживающая фаза: пембролизумаб** ИЛИ
|
200 мг
|
В/в капельно 30 мин
|
1 раз в 21 день
|
Длительно
|
|
|
Поддерживающая фаза: пембролизумаб**
|
400 мг
|
В/в капельно 30 мин
|
1 раз в 42 дня
|
Длительно
|
-
При наличии признаков прогрессирования заболевания на фоне применения монотерапии ИПК BRAF переключение взрослых пациентов на комбинированную терапию ИПК BRAF + MEK не рекомендуется, так как вероятность получить ответ на лечение остается низкой, а медиана времени до прогрессирования не превышает 3 месяца [179].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 3).
-
При наличии признаков прогрессирования заболевания на фоне применения одного из ИПК BRAF или одной из комбинаций ИПК BRAF и МЕК (Таблица 12) не рекомендуется переключать взрослых пациентов на другой ИПК BRAF или другую комбинацию ИПК BRAF и МЕК [439-441].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: Имеющиеся преклинические данные позволяют предположить аналогичные механизмы действия и формирования резистентности к вемурафенибу**/кобиметинибу** и дабрафенибу**/траметинибу** Сведения о наличии клинической эффективности подобного переключения также отсутствуют.
Комментарий: Имеющиеся преклинические данные позволяют предположить аналогичные механизмы действия и формирования резистентности к вемурафенибу**/кобиметинибу** и дабрафенибу**/траметинибу** Сведения о наличии клинической эффективности подобного переключения также отсутствуют.
-
При медленно прогрессирующей метастатической и/или местно-распространенной меланоме (III неоперабельной – IV стадии) у взрослых пациентов с ожидаемой продолжительностью жизни не менее 6 мес. при отсутствии противопоказаний независимо от статуса мутации BRAF рекомендуется использование препарата ипилимумаб** [442] или комбинации МКА-блокаторов PD1 и CTLA4 после прогрессирования болезни на фоне стандартной терапии (МКА-блокаторы PD1, ИПК BRAF, комбинация ИПК BRAF и МЕК) или в случае ее непереносимости [443-447]. Режим применения ипилимумаба** приведен ниже (Таблица 14).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
Таблица 14.
Режим применения ипилимумаба** при меланоме кожи у взрослых пациентов.
Таблица 14.
Режим применения ипилимумаба** при меланоме кожи у взрослых пациентов.
|
Схема терапии
|
Препарат
|
Доза
|
Путь введения
|
Дни введения
|
Длительность цикла, дни, режим
|
|---|---|---|---|---|---|
|
Монотерапия [409,411,414,420,442-444,446-449]
|
Ипилимумаб**
|
3 мг/кг массы тела
|
В/в капельно 90 мин
|
1 раз в 21 день
|
Максимум 4 введения
|
-
При невозможности проведения терапии (или сроке ожидания начала такой терапии более 1 мес.) ИПК BRAF или комбинацией ИПК BRAF и МЕК, или МКА-блокаторами PD1, или МКА-блокаторами CTLA4 в 1-й или во 2-й линии у пациентов с метастатической или нерезектабельной меланомой и мутацией в гене BRAF в опухоли при сохранении удовлетворительного общего состояния взрослого пациента (ECOG 0–2) и при ожидаемой продолжительности жизни более 3 мес. рекомендуется проведение цитотоксической химиотерапии [450-458]. Наиболее распространенные режимы химиотерапии (монотерапия или комбинации) приведены ниже (Таблица 15). Назначение других лекарственных препаратов для лечения диссеминированной формы меланомы проводится решением консилиума или врачебной комиссии.
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 1).
Комментарий: данный вид лечения менее эффективен в отношении увеличения общей продолжительности жизни, времени до прогрессирования, частоты объективных ответов на лечение и в большинстве случаев сопровождается более выраженными нежелательными реакциями в сравнении с ИПК BRAF или комбинацией ИПК BRAF и МЕК, или МКА-блокаторами PD1 или CTLA4. В связи с этим следует избегать применения химиотерапии в 1-й линии лечения пациентов метастатической или нерезектабельной меланомой и мутацией в гене BRAF всегда, когда это возможно.
Таблица 15.
Наиболее распространенные режимы химиотерапии при метастатической меланоме кожи у взрослых.
Комментарий: данный вид лечения менее эффективен в отношении увеличения общей продолжительности жизни, времени до прогрессирования, частоты объективных ответов на лечение и в большинстве случаев сопровождается более выраженными нежелательными реакциями в сравнении с ИПК BRAF или комбинацией ИПК BRAF и МЕК, или МКА-блокаторами PD1 или CTLA4. В связи с этим следует избегать применения химиотерапии в 1-й линии лечения пациентов метастатической или нерезектабельной меланомой и мутацией в гене BRAF всегда, когда это возможно.
Таблица 15.
Наиболее распространенные режимы химиотерапии при метастатической меланоме кожи у взрослых.
|
Схема терапии
|
Препарат
|
Доза
|
Путь введения
|
Дни приема
|
Длительность цикла, дни, режим
|
Ссылка
|
|---|---|---|---|---|---|---|
|
Монотерапия
|
Дакарбазин**
|
1000 мг/м2
|
в/в
|
1-й
|
21
|
[176,219,450-452,459,460]
|
|
Монотерапия
|
Дакарбазин**
|
250 мг/м2
|
в/в
|
1–5-й
|
21
|
|
|
Монотерапия
|
Темозоломид**
|
200 мг/м2
|
внутрь или в/в
|
1–5-й
|
28
|
[453,461]
|
|
Монотерапия
|
Ломустин**
|
130 мг/м2
|
внутрь
|
1-й
|
42
|
[462-464]
|
|
Комбинация
|
Цисплатин**
|
20 мг/м2
|
в/в
|
1–4-й
|
21 (2 курса и обследование, максимально – до 6 курсов)
|
[457,458,465,466]
|
|
Винбластин**
|
1,2 - 2 мг/м2
|
в/в
|
1–4-й
|
|||
|
Дакарбазин**
|
800 мг/м2
|
в/в
|
1-й
|
|||
|
Комбинация
|
#Паклитаксел**
|
225 мг/м2
|
в/в
|
1-й
|
21
|
[281][467][388]
|
|
#Карбоплатин**
|
AUC 6
|
в/в
|
1-й
|
|
||
|
Комбинация
|
#Паклитаксел**
|
175мг/м2
|
в/в
|
1-й
|
21
|
[455,456,468]
|
|
#Карбоплатин**
|
AUC 5-6
|
в/в
|
1-й
|
-
При проведении химиотерапии оценку эффекта лечения рекомендовано проводить после каждого 2–3-го цикла (каждые 6–12 нед). Для оценки эффекта терапии рекомендуется использовать оценку общего состояния пациента и методы лучевой диагностики (Таблица 9, раздел 2.4), а также стандартные критерии ответа на цитостатическую терапию (RECIST 1.1, приложение Г3) [430,431].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
При проведении противоопухолевого лекарственного лечения при расчете доз препаратов на поверхность или массу тела рекомендуется проводить округление фактических доз в пределах 5 % расчетных [469,470].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
При прогрессировании после первой линии терапии одним из МКА-блокаторов PD1 у взрослых пациентов с меланомой кожи с мутацией в гене BRAF предпочтение рекомендуется отдавать монотерапии блокатором CTLA4 или комбинированной терапии ИПК BRAF и MEK [433,449,471-473].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарий: В исследовании I.P. da Silva с соавт. показано увеличение частоты объективных ответов с 9% при монотерапии ипилимумабом** до 38% при комбинированной терапии ипилимумабом** и ниволумабом** у пациентов с без мутации в гене BRAF. При наличии мутации частота ответов была похожей (24% и 19% соответственно) [449].
Комментарий: В исследовании I.P. da Silva с соавт. показано увеличение частоты объективных ответов с 9% при монотерапии ипилимумабом** до 38% при комбинированной терапии ипилимумабом** и ниволумабом** у пациентов с без мутации в гене BRAF. При наличии мутации частота ответов была похожей (24% и 19% соответственно) [449].
-
У взрослых пациентов c BRAF мутированной меланомой (III неоперабельной – IV стадии) в 3 линии терапии, после проведения иммунотерапии и терапии ИПК (iBRAF +/- MEK), а так же у пациентов без мутации в гене BRAF (III неоперабельной – IV стадии) во 2 линии после применения иммунотерапии (МКА-блокаторов PD-1+/- анти CTLA4) при зарегистрированной приобретенной резитентности к aPD1 (стабилизация или ответ на aPD1 >= 6 мес.) рекомендуется применение терапии по схеме #ленватиниб** + пембролизумаб** [474-476]. Режим применения приводится ниже (Таблица 16).
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4).
Таблица 16.
Комбинированная терапия МКА- блокаторами - блокаторами PD1 и ИТК #ленвантинибом** у взрослых.
Таблица 16.
Комбинированная терапия МКА- блокаторами - блокаторами PD1 и ИТК #ленвантинибом** у взрослых.
|
Схема терапии
|
Препарат
|
Доза
|
Путь введения
|
Дни введения
|
Длительность цикла, дни, режим
|
|---|---|---|---|---|---|
|
Комбинированная терапия МКА- блокаторами - блокаторами PD1 и ИТК ленвантинибом [474]
|
Пембролизумаб**
|
200 мг
|
в/в капельно 30 мин
|
1 раз в 21 день
|
длительно
|
|
#Ленватиниб** 20 мг внутрь
|
20 мг
|
внутрь
|
1 раз /сут ежедневно
|
длительно
|
-
Рекомендуется повторное назначение комбинированной терапии ИПК BRAF и MEK у взрослых пациентов, которые ранее длительно (более 6 мес.) получали терапию ИПК BRAF и MEK и у которых был отмечен объективный ответ на лечение, в случае прогрессирования или непереносимости МКА-блокаторами PD1 или комбинации МКА-блокаторов PD1 и CTLA4, назначенных во второй линии [225,477].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
-
Рекомендуется продолжить комбинированную терапию ИПК BRAF и MEK или монотерапию МКА-блокаторами PD1 у пациентов, при изолированном прогрессировании единичных метастазов с возможностью их хирургического удаления или проведения стереотаксической радиохирургии на прогрессирующие очаги («олигопрогрессирование») [220,478-485].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
-
Взрослым пациентам с мутацией в гене BRAF при отсутствии противопоказаний рекомендуется проводить комбинированную иммунную и таргетную терапию МКА-блокаторами PD1 (пембролизумаб**) и ингибиторами протеинкиназы дабрафенибом** и траметинибом** [486].
Режимы применения приведены ниже (Таблица 17).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарий: комбинация пембролизумаба**, дабрафениба** и траметиниба** изучалась у больных с BRAF-мутированной меланомой в первой линии терапии и оказалась лучше, чем комбинированная таргетная терапия дабрафенибом** и траметинибом* в отношении времени без прогрессирования, однако это улучшение не достигло статистической значимости. (При периоде наблюдения 36,6 месяцев медиана ВБП составила 16,9 мес. в группе тройной комбинации и 10,7 мес. в группе таргетной терапии (ОР 0,53; 95% ДИ от 0,34 до 0,83). Общая выживаемость также имела тенденцию к улучшению в группе тройной комбинации (не значимо). Мы полагаем, что тройная комбинация может быть предпочтительнее, чем терапия дабрафенибом** и траметинибом** у определенной части пациентов с мутацией в гене BRAF, тем не менее, к настоящему времени нет достаточных научных данных эту часть пациентов определить точнее. Врачу-онкологу при назначении этого режима лечения следует взвесить все потенциальные риски и ожидаемую пользу.
Таблица 17.
Режимы применения МКА-блокатора aPD1 пембролизумаба** и ИПК дабрафениба** и траметиниба** у взрослых.
|
Схема терапии
|
Препарат
|
Доза
|
Путь введения
|
Дни введения
|
Длительность цикла, дни, режим
|
|---|---|---|---|---|---|
|
Пембролизумаб** + дабрафениб** + траметиниб**
|
Дабрафениб**
|
150 мг 2 раза в день
|
Внутрь
|
Ежедневно
|
Длительно
|
|
Траметиниб**
|
2 мг 1 р/сут
|
Внутрь
|
Ежедневно
|
Длительно
|
|
|
Пембролизумаб**
|
200 мг
|
Внутривенно
|
День 1, 22
|
Каждые 21 день
|
3. Выбор терапии у пациентов метастатической или неоперабельной меланомой кожи с мутацией в гене KIT
-
У взрослых пациентов с мутацией в гене KIT и ожидаемой продолжительностью жизни более 3 месяцев в качестве терапии 1-й или последующих линий рекомендована монотерапия МКА-блокаторами PD1 или комбинацией МКА-блокаторов CTLA4 и PD1[410,414,416,417,420,487]. Стандартные режимы применения приведены выше (Таблица 13).
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1).
Комментарий: популяция пациентов с мутацией в гене KIT в опухоли не изучалась отдельно в рандомизированных исследованиях, однако ее следует рассматривать как популяцию больных без мутации в гене BRAF.
Комментарий: популяция пациентов с мутацией в гене KIT в опухоли не изучалась отдельно в рандомизированных исследованиях, однако ее следует рассматривать как популяцию больных без мутации в гене BRAF.
-
У взрослых пациентов с мутацией в гене KIT и ожидаемой продолжительности жизни более 3 месяцев в качестве терапии 2-й или последующих линий рекомендована терапия ИПК KIT #иматинибом**. Лечение #иматинибом** проводится до прогрессирования заболевания или развития выраженных, не купируемых редукцией дозы токсических явлений. Режим применения приведен ниже (Таблица 18) [199,200].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Таблица 18.
Режим применения #иматиниба** при меланоме кожи.
Таблица 18.
Режим применения #иматиниба** при меланоме кожи.
|
Схема терапии
|
Препарат
|
Доза
|
Путь введения
|
Дни введения
|
Длительность цикла, дни, режим
|
|---|---|---|---|---|---|
|
Монотерапия
|
#Иматиниб**
|
400 мг 2 р/сут
|
Внутрь
|
Ежедневно
|
Длительно, до прогрессирования
|
-
Оценку эффекта терапии ИПК #иматинибом** рекомендуется проводить не реже 1 раза через каждые 6–8 нед. терапии, не допуская перерывов в приеме препарата на период оценки эффекта. Для оценки эффекта терапии рекомендуется использовать оценку общего состояния пациента и методы лучевой диагностики (Таблица 9), а также стандартные критерии ответа на цитостатическую терапию (RECIST 1.1) [191,199,430,431].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Не рекомендуется проводить терапию #иматинибом** пациентам с неизвестным статусом опухоли в отношении мутации в гене KIT, так как сведения о клинической пользе от применения #иматиниба** у пациентов без активирующей мутации в гене KIT отсутствуют [200,203,488,489].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
При наличии признаков прогрессирования заболевания на фоне применения #иматиниба** при сохранении удовлетворительного общего состояния взрослого пациента (ECOG 0–2) и ожидаемой продолжительности жизни более 3 месяцев рекомендуется проводить терапию МКА-блокаторами PD1 и/или CTLA4 (в случае, если она не проводилась ранее) [490,491].
Режимы применения приведены выше (Таблица 13,Таблица 14).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
При невозможности проведения терапии (или сроке ожидания начала такой терапии более 1 месяца) #иматинибом** или МКА-блокаторами PD1 и/или CTLA4 в 1-й или во 2-й линии у взрослых пациентов с метастатической или нерезектабельной меланомой с мутацией в гене KIT в опухоли при сохранении удовлетворительного общего состояния пациента (ECOG 0–2) и при ожидаемой продолжительности жизни более 3 месяцев рекомендуется проведение цитотоксической химиотерапии [415,450-458,466]. Наиболее распространенные режимы химиотерапии (монотерапия или комбинации) приведены в выше (Таблица 15). Назначение других лекарственных препаратов для лечения диссеминированной формы меланомы проводится решением консилиума или врачебной комиссии.
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1).
Комментарий: данный вид лечения менее эффективен в отношении увеличения общей продолжительности жизни, времени до прогрессирования, частоты объективных ответов на лечение и в большинстве случаев сопровождается более выраженными нежелательными реакциями в сравнении с ИПК KIT или МКА-блокаторами PD1 или CTLA4. В этой связи следует избегать применения химиотерапии в 1-й линии лечения пациентов метастатической или нерезектабельной меланомой и мутацией в гене KIT или NRAS всегда, когда это возможно.
Комментарий: данный вид лечения менее эффективен в отношении увеличения общей продолжительности жизни, времени до прогрессирования, частоты объективных ответов на лечение и в большинстве случаев сопровождается более выраженными нежелательными реакциями в сравнении с ИПК KIT или МКА-блокаторами PD1 или CTLA4. В этой связи следует избегать применения химиотерапии в 1-й линии лечения пациентов метастатической или нерезектабельной меланомой и мутацией в гене KIT или NRAS всегда, когда это возможно.
-
У взрослых пациентов без мутаций в генах BRAF, KIT при сохранении удовлетворительного общего состояния пациента (ECOG 0–2) и при ожидаемой продолжительности жизни более 3 месяцев рекомендуется терапия комбинацией МКА-блокаторов PD1 и CTLA4 или монотерапия МКА-блокаторами PD1 [410,414,416,417,420,487]. Стандартные режимы применения приведены выше (Таблица 13).
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 1).
-
При очевидном прогрессировании болезни на фоне терапии одним из МКА-блокаторов PD1 рекомендуется рассмотреть возможность проведения терапии комбинацией МКА-блокаторов PD1 и CTLA4 [492] или монотерапию МКА-блокатором CTLA4 [442,493] .
Режимы применения приведены выше (Таблица 13,Таблица 14).
Уровень убедительности рекомендаций – B (уровень достоверности доказательств –3).
-
При невозможности проведения терапии (или сроке ожидания начала такой терапии более 1 мес.) МКА-блокаторами PD1 и CTLA4 в 1-й или во 2-й линии у взрослых пациентов с метастатической или нерезектабельной меланомой без мутаций в генах BRAF, и KIT в опухоли при сохранении удовлетворительного общего состояния пациента (ECOG 0–2) и при ожидаемой продолжительности жизни более 3 мес. рекомендуется проведение цитотоксической химиотерапии [450-458]. Наиболее распространенные режимы химиотерапии (монотерапия или комбинации) приведены выше (Таблица 15). Назначение других лекарственных препаратов для лечения диссеминированной формы меланомы проводится решением консилиума или врачебной комиссии.
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 1).
Комментарий: данный вид лечения менее эффективен в отношении увеличения общей продолжительности жизни, времени до прогрессирования, частоты объективных ответов на лечение и в большинстве случаев сопровождается более выраженными нежелательными реакциями в сравнении с МКА-блокаторами PD1 или CTLA4. В связи с этим следует избегать применения химиотерапии в 1-й линии лечения пациентов метастатической или нерезектабельной меланомой без мутаций в генах BRAF и KIT всегда, когда это возможно.
Комментарий: данный вид лечения менее эффективен в отношении увеличения общей продолжительности жизни, времени до прогрессирования, частоты объективных ответов на лечение и в большинстве случаев сопровождается более выраженными нежелательными реакциями в сравнении с МКА-блокаторами PD1 или CTLA4. В связи с этим следует избегать применения химиотерапии в 1-й линии лечения пациентов метастатической или нерезектабельной меланомой без мутаций в генах BRAF и KIT всегда, когда это возможно.
-
При прогрессировании после адъювантной терапии одним из МКА-блокаторов PD1 у взрослых пациентов предпочтение рекомендуется отдавать комбинации МКА-блокаторов PD1 и блокаторов CTLA4 [449].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарий: В исследовании I.P. da Silva с соавт. показано увеличение частоты объективных ответов с 13% при монотерапии ипилимумабом** до 36% при комбинированной терапии ипилимумабом** и ниволумабом** [449].
Комментарий: В исследовании I.P. da Silva с соавт. показано увеличение частоты объективных ответов с 13% при монотерапии ипилимумабом** до 36% при комбинированной терапии ипилимумабом** и ниволумабом** [449].
-
При прогрессировании после первой линии терапии у больных без мутации в гене BRAF одним из МКА-блокаторов PD1 предпочтение рекомендуется отдавать комбинации МКА-блокаторов PD1 и блокаторов CTLA4) [449].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4).
Комментарий: В исследовании I.P. da Silva с соавт. показано увеличение частоты объективных ответов с 9% при монотерапии ипилимумабом** до 38% при комбинированной терапии ипилимумабом** и ниволумабом** у пациентов с без мутации в гене BRAF. При наличии мутации частота ответов была похожей (24% и 19% соответственно [449].
Комментарий: В исследовании I.P. da Silva с соавт. показано увеличение частоты объективных ответов с 9% при монотерапии ипилимумабом** до 38% при комбинированной терапии ипилимумабом** и ниволумабом** у пациентов с без мутации в гене BRAF. При наличии мутации частота ответов была похожей (24% и 19% соответственно [449].
-
При прогрессировании на фоне терапии одним из МКА-блокаторов PD1 у взрослых больных с или без мутации в гене BRAF рекомендуется повторное назначение МКА-блокаторов PD1 (или назначение комбинированной терапии МКА-блокаторами PD1 и CTLA4) в случае если соблюдаются 4 условия: 1) контроль над заболеванием (объективный ответ или стабилизация) при первом назначении МКА-блокаторов PD1 составил 6 мес. и более; 2) лечение 2-й (или последующих линий) более не приносит пользы (отмечается прогрессирование заболевания или непереносимость лечения); 3) состояние пациента по шкале ECOG <=2 или ожидаемая продолжительность жизни более 3 мес.; 4) имевшиеся ранее нежелательные явления при применении МКА-блокаторов PD1 разрешились (<=1 степ. по СТСАЕ v 5.0) И никогда не достигали 4 степ. по СТСАЕ v 5.0 [494].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
-
У взрослых пациентов без мутации в гене BRAF (III неоперабельной – IV стадии) во 2 линии после применения иммунотерапии (МКА-блокаторов PD-1+/- анти CTLA4), учитывая малую эффективность химиотерапии, рекомендуется применение терапии по схеме #ленватиниб** + пембролизумаб** [474-476]. Режим применения приводится выше (Таблица 16).
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
5. Особенности оценки ответа на лечение МКА-блокаторами PD1 или CTLA4
МКА-блокаторы PD1 или CTLA4 представляют собой принципиально новый класс лекарственных препаратов, эффект которых развивается в результате воздействия на элементы иммунной системы пациента. Сами лекарственные средства не обладают противоопухолевым эффектом, а элиминация опухолевых клеток достигается за счет активации клеток иммунной системы пациента. Это обусловливает особенности развития клинического и радиологического ответа на лечение.
5. Особенности оценки ответа на лечение МКА-блокаторами PD1 или CTLA4
МКА-блокаторы PD1 или CTLA4 представляют собой принципиально новый класс лекарственных препаратов, эффект которых развивается в результате воздействия на элементы иммунной системы пациента. Сами лекарственные средства не обладают противоопухолевым эффектом, а элиминация опухолевых клеток достигается за счет активации клеток иммунной системы пациента. Это обусловливает особенности развития клинического и радиологического ответа на лечение.
-
Всем пациентам с меланомой на фоне лечения МКА-блокаторами PD1 или CTLA4 рекомендуется проводить первоначальную радиологическую оценку ответа на лечение не ранее 12 недель от начала терапии (при отсутствии клинического ухудшения состояния пациента). Повторные исследования проводятся через 8–12 недель (при отсутствии клинического ухудшения состояния пациента) [414,416,417,487,495].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4).
-
Рекомендуется для оценки ответа на лечение МКА-блокаторами PD1 или CTLA4 использовать модифицированные критерии ответа на лечение, которые допускают появление новых очагов (при отсутствии клинического ухудшения состояния пациента) [495] (Таблица 19).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Таблица 19
Сравнение традиционных критериев (на примере RECIST) и критериев оценки ответа на МКА-блокаторы PD1 или CTLA4 (mRECIST или irRC) [495-497]
Таблица 19
Сравнение традиционных критериев (на примере RECIST) и критериев оценки ответа на МКА-блокаторы PD1 или CTLA4 (mRECIST или irRC) [495-497]
|
Опухолевый ответ
|
RECIST
|
irRC
|
|---|---|---|
|
Полный ответ
|
Исчезновение всех очагов
|
Исчезновение всех очагов, в том числе новых
|
|
Частичный ответ
|
Уменьшение суммы максимальных диаметров таргетных очагов более чем на 30 % при отсутствии прогрессирования со стороны других очагов поражения либо появления новых
|
Уменьшение суммы произведений поперечных диаметров таргетных и новых очагов более чем на 30 %. Допускается появление новых очагов
|
|
Стабилизация
|
Уменьшение опухолевых образований менее чем на 30 % или увеличение не более чем на 20 % при отсутствии новых поражений
|
Уменьшение опухолевых образований менее чем на 30 % при отсутствии новых поражений или увеличение не более чем на 20 %. Допускается появление новых очагов
|
|
Прогрессирование
|
Увеличение сумы максимальных диаметров таргетных очагов более чем на 20 % и/или появление новых очагов
|
Увеличение суммы произведений поперечных диаметров таргетных и новых очагов более чем на 20 %
|
6. Длительность лечения МКА-блокаторами PD1 или CTLA4
-
Рекомендуется у взрослых применять МКА-блокатор CTLA4 (ипилимумаб**) в режиме ограниченного количества введений – не более 4. В некоторых случаях (при стабилизации заболевания или объективном ответе на лечение более 6 мес, сменившимися прогрессированием заболевания) допускается повторное применение курса лечения ипилимумабом** (также не более 4 введений) [443].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 2).
-
Рекомендуется МКА-блокаторы PD1 у взрослых назначать в постоянном режиме до наступления прогрессирования или непереносимости или истечения 2 лет с момента первого цикла терапии с интервалом введения в 2 недели или 4 недели для ниволумаба** в зависимости от режима дозирования, в 3 или 6 недель - для пембролизумаба** и 1 раз в 14 дней для пролголимаба** Продолжение терапии более 2 лет возможно в отдельных клинических ситуациях по решению врачебной комиссии. (см. также раздел 3.4.5 и Таблица 13) [414,416,417,435,436,448,487].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
Комментарий: в исследовании KEYNOTE-006 длительность режимов иммунотерапии у пациентов с метастатической меланомой и сохранением пользы от терапии не превышала 24 мес., что может свидетельствовать о том, что возможно безопасно завершить терапию у пациентов с ответом на лечение после 24 мес. терапии.
7. Лечение пациентов с особыми формами метастатической меланомы: олигометастатической, местно-распространенной, с метастазами в костях
Комментарий: в исследовании KEYNOTE-006 длительность режимов иммунотерапии у пациентов с метастатической меланомой и сохранением пользы от терапии не превышала 24 мес., что может свидетельствовать о том, что возможно безопасно завершить терапию у пациентов с ответом на лечение после 24 мес. терапии.
7. Лечение пациентов с особыми формами метастатической меланомы: олигометастатической, местно-распространенной, с метастазами в костях
-
Пациентов с солитарными отдаленными метастазами меланомы (в мягкие ткани, легкие, головной мозг и др.) и хорошим соматическим статусом рекомендуется рассматривать в качестве кандидатов для радикального хирургического лечения, которое может обеспечить длительный безрецидивный период [498-500].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Комментарии: Роль хирургии возрастает в связи с появлением для этой группы пациентов эффективной адъювантной терапии МКА--блокатором PD1 – препаратом ниволумаб**, который в рандомизированном исследовании продемонстрировал увеличение безрецидивной выживаемости в сравнении с наблюдением [352].
Комментарии: Роль хирургии возрастает в связи с появлением для этой группы пациентов эффективной адъювантной терапии МКА--блокатором PD1 – препаратом ниволумаб**, который в рандомизированном исследовании продемонстрировал увеличение безрецидивной выживаемости в сравнении с наблюдением [352].
-
При достижении эффекта от проводимой системной терапии может рассматриваться проведение полных циторедуктивных вмешательств. Проведение неполной циторедукции не рекомендовано [501,502].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
Пациентов с местно-распространенной нерезектабельной формой меланомы кожи и изолированным поражением конечности, не ответившим на стандартную терапию (ингибиторы BRAF или MEK, МКА-блокаторы PD1 или CTLA4), рекомендуется рассматривать в качестве кандидатов для проведения изолированной гипертермической перфузии конечности с мелфаланом** [503-506].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
Комментарий: данная процедура проводится в отдельных специализированных центрах.
Комментарий: данная процедура проводится в отдельных специализированных центрах.
-
При обширных по площади поражениях кожи лица (меланома по типу злокачественного лентиго) для взрослых пациентов, не желающих быть подвергнутыми реконструктивно-пластической операции на лице, рекомендуется использование крема #имихимод в качестве средства для уменьшения площади злокачественного лентиго в предоперационном периоде (5 раз в неделю в течение 3 месяцев с использованием 5% крема #имихимод перед иссечением) [507-509].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств –2).
-
При меланоме по типу злокачественного лентиго 0 стадии для взрослых пациентов, не желающих быть подвергнутыми реконструктивно-пластической операции на лице, рекомендуется использование крема #имихимод в качестве самостоятельного метода лечения (ежедневно в течение 3 месяцев с использованием 5% крема #имихимод) [507-509].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
-
При метастазах в регионарных лимфатических узлах и невозможности их хирургического удаления рекомендуется рассмотреть возможность проведения дистанционной лучевой терапии в различных режимах: 50 Гр за 20 фракций в течение 4 недель; 32 Гр за 4 фракции в течение 4 недель [258].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств 2).
Комментарий: Также может применяться режим лучевой терапии 30 Гр за 10 фракций в течение 2 нед [510].
Комментарий: Также может применяться режим лучевой терапии 30 Гр за 10 фракций в течение 2 нед [510].
-
При симптомных метастазах в костях с обезболивающей целью рекомендуется проведение паллиативной лучевой терапии в одном из следующих режимов: 30 Гр за 10 фракций в течение 2 недель; 20 Гр за 5 фракций за 5-7 дней, 24 Гр за 6 фракций в течение 3 нед. [258,510-512].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств –– 1).
8. Лечение пациентов с метастазами в головном мозге
Введение: Частота развития метастазов в головном мозге у пациентов с генерализованной меланомой достигает 28% и превышает аналогичный показатель у пациентов с немелкоклеточным раком легкого (26,8%) и Her2- позитивным раком молочной железы (11,5%). С учетом особенного течения болезни при поражении ЦНС в клинической рекомендации выделен отдельны раздел по тактике ведения пациентов с метастазами в ЦНС.
8. Лечение пациентов с метастазами в головном мозге
Введение: Частота развития метастазов в головном мозге у пациентов с генерализованной меланомой достигает 28% и превышает аналогичный показатель у пациентов с немелкоклеточным раком легкого (26,8%) и Her2- позитивным раком молочной железы (11,5%). С учетом особенного течения болезни при поражении ЦНС в клинической рекомендации выделен отдельны раздел по тактике ведения пациентов с метастазами в ЦНС.
-
Рекомендуется строить алгоритм выбора тактики лечения у пациентов с метастазами в головном мозге в ходе мультидисциплинарного консилиума с участием врача-нейрохирурга, врача-радиотерапевта и врача-онколога на основании следующих критериев [134-136,513-515]:
-
экстракраниальное распространение заболевания и его контроль;
-
наличие резервов противоопухолевой лекарственной терапии;
-
размер метастазов в головном мозге (более или менее 2 см);
-
количество метастазов в головном мозге (солитарный метастаз, олигометастатическое поражение (2-4 метастаза), множественные метастазы (5 и более));
-
общее состояние по шкале Карновского (более 70 %, менее 70 %) (Приложение Г2);
-
прогноз общей выживаемости (больше или меньше 6 мес. по шкале GPA (он-лайн калькулятор на сайте https://brainmetgpa.com/), Приложение Г4;
-
расположение метастазов в функционально значимых частях мозга;
-
наличие или отсутствие неврологической симптоматики, обусловленной метастатическим поражением головного мозга.
-
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: Радиотерапевтическое лечение следует рассматривать у пациентов с первично выявленными метастазами меланомы в головном мозге в самостоятельном варианте лечения или как компонент комбинированного варианта лечения (с нейрохирургческим этапом), а также у пациентов с интракраниальной прогрессией (локальные рецидивы или развитие новых дистантных метастазов) после ранее проведенного лечения. Вариантами радиотерапии в лечении пациентов с метастазами меланомы в головном мозге являются: стереотаксическая радиотерапия (СРТ) и облучение всего головного мозга (ОВГМ). СРТ может быть реализована в режиме радиохирургии (1 фракция) или гипофракционирования (от 3 до 7 фракций) и используется в самостоятельном варианте лечения или в комбинации с ОВГМ или нейрохирургией [1,2]. Проведение радиотерапии не рекомендуется у пациентов с бессимптомными метастазами в головной мозг с низким функциональным статусом (индекс Карновского 50% и ниже) или у пациентов с индексом Карновского <70%, экстракраниальной прогрессией болезни и отсутствием резервов лекарственной противоопухолевой терапии. Выбор режима фракционирования СРТ зависит от дозовой нагрузки на нормальную ткань мозга, которая определяется количеством и размерами метастазов меланомы в головном мозге. СРТ в режиме радиохирургии может быть реализована при условии, что при подведение очаговой дозы 20-24 Гр объем нормальной ткани мозга, облученной дозой 12 Гр не превышает 10 см3 (V12Гр ≤10 см3). Для любых метастазов меланомы в головном мозге, при которых V12Гр >10 см3 показано проведение СРТ в режиме гипофракционирования [134-136].
Комментарий: Радиотерапевтическое лечение следует рассматривать у пациентов с первично выявленными метастазами меланомы в головном мозге в самостоятельном варианте лечения или как компонент комбинированного варианта лечения (с нейрохирургческим этапом), а также у пациентов с интракраниальной прогрессией (локальные рецидивы или развитие новых дистантных метастазов) после ранее проведенного лечения. Вариантами радиотерапии в лечении пациентов с метастазами меланомы в головном мозге являются: стереотаксическая радиотерапия (СРТ) и облучение всего головного мозга (ОВГМ). СРТ может быть реализована в режиме радиохирургии (1 фракция) или гипофракционирования (от 3 до 7 фракций) и используется в самостоятельном варианте лечения или в комбинации с ОВГМ или нейрохирургией [1,2]. Проведение радиотерапии не рекомендуется у пациентов с бессимптомными метастазами в головной мозг с низким функциональным статусом (индекс Карновского 50% и ниже) или у пациентов с индексом Карновского <70%, экстракраниальной прогрессией болезни и отсутствием резервов лекарственной противоопухолевой терапии. Выбор режима фракционирования СРТ зависит от дозовой нагрузки на нормальную ткань мозга, которая определяется количеством и размерами метастазов меланомы в головном мозге. СРТ в режиме радиохирургии может быть реализована при условии, что при подведение очаговой дозы 20-24 Гр объем нормальной ткани мозга, облученной дозой 12 Гр не превышает 10 см3 (V12Гр ≤10 см3). Для любых метастазов меланомы в головном мозге, при которых V12Гр >10 см3 показано проведение СРТ в режиме гипофракционирования [134-136].
-
Рекомендуется открытая нейрохирургическая операция пациентам с первично выявленными или рецидивирующими краниальными метастазами меланомы при наличии:
-
метастатического очага с максимальным диаметром 2 см и более;
-
метастатического очага любого размера, определяющего клиническую картину внутричерепной гипертензии, дислокации срединных структур мозга, обширного перифокального отека, а также при наличии угрозы блокирования ликворных путей;
-
клинических ситуаций, контроль которых невозможен с помощью других лечебных мероприятий (радиорезистентный локальный рецидив после стереотаксической радиотерапии, симптоматический радионекроз, резистентный к проводимой терапии) [134].
-
Уровень убедительности рекомендаций С (уровень достоверности доказательств –5).
Комментарии: Необходимым условием проведения нейрохирургического лечения является локализация метастатического очага в зонах мозга, где его удаление не сопровождается развитием/нарастанием неврологического дефицита. Лучшие показатели общей выживаемости достигаются у пациентов с высоким функциональным статусом (индекс Карновского ≥ 80) и контролем экстракраниального опухолевого процесса. При наличии первично выявленных или рецидивирующих метастазов меланомы в головном мозге целесообразно проводить нейрохирургического лечение в комбинации со стереотаксической радиотерапией (предоперационная радиохирургия или послеоперационная стереотаксическая радиотерапия ложа удаленного метастатического очага) для снижения риска локального рецидива. Целесообразно проведение КТ головного мозга с/без контрастирования в течение 24-48 часов после проведения нейрохирургической резекции для диагностики послеоперационного кровоизлияния.
Комментарии: Необходимым условием проведения нейрохирургического лечения является локализация метастатического очага в зонах мозга, где его удаление не сопровождается развитием/нарастанием неврологического дефицита. Лучшие показатели общей выживаемости достигаются у пациентов с высоким функциональным статусом (индекс Карновского ≥ 80) и контролем экстракраниального опухолевого процесса. При наличии первично выявленных или рецидивирующих метастазов меланомы в головном мозге целесообразно проводить нейрохирургического лечение в комбинации со стереотаксической радиотерапией (предоперационная радиохирургия или послеоперационная стереотаксическая радиотерапия ложа удаленного метастатического очага) для снижения риска локального рецидива. Целесообразно проведение КТ головного мозга с/без контрастирования в течение 24-48 часов после проведения нейрохирургической резекции для диагностики послеоперационного кровоизлияния.
-
У пациентов с наличием от 1 до 4 метастазов в головном мозге и благоприятным прогнозом общей выживаемости по шкале GPA рекомендуется: проведение СРТ в режиме радиохирургии при наличии метастатических очагов в головном мозге с максимальным диаметром 2,0 см и меньше без клинических проявлений масс-эффекта [135,136].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: благоприятный прогноз общей выживаемости определяется наличием у пациентов высокого функционального статуса (индекс Карновского ≥80, или ECOG 0–1), выживаемость по шкале GPA 6 и более мес., стабилизацией экстракраниальных метастазов и/или наличием резервов системного противоопухолевого лечения. СРТ в режиме радиохирургии является оптимальной лечебной опцией у пациентов с очагами <2 см. в максимальном измерении и реализуемой очаговой дозой радиации 20–24 Гр. У пациентов с очагами ≥2 см в максимальном измерении СРТ в режиме радиохирургии может быть реализована при условии, что при очаговой дозе радиации не ниже 20 Гр, объем нормальной ткани мозга, облученной дозой 12 Гр не превышает 10 см3 (V12Гр ≤10 см3).
Комментарии: благоприятный прогноз общей выживаемости определяется наличием у пациентов высокого функционального статуса (индекс Карновского ≥80, или ECOG 0–1), выживаемость по шкале GPA 6 и более мес., стабилизацией экстракраниальных метастазов и/или наличием резервов системного противоопухолевого лечения. СРТ в режиме радиохирургии является оптимальной лечебной опцией у пациентов с очагами <2 см. в максимальном измерении и реализуемой очаговой дозой радиации 20–24 Гр. У пациентов с очагами ≥2 см в максимальном измерении СРТ в режиме радиохирургии может быть реализована при условии, что при очаговой дозе радиации не ниже 20 Гр, объем нормальной ткани мозга, облученной дозой 12 Гр не превышает 10 см3 (V12Гр ≤10 см3).
-
Рекомендуется проведение СРТ в режиме гипофракционирования при наличии метастатических очагов в головном мозге с максимальным диаметром 2,0 см и больше, без клинических проявлений масс-эффекта и наличии противопоказаний к проведению нейрохирургии [135,136,513].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4).
Комментарии: СРТ в режиме гипофракционирования является оптимальной опцией у пациентов с наличием очагов ≥ 2 см в максимальном измерении, либо при наличии очагов, локализованных в критических структурах мозга (зрительные тракты, ствол головного мозга и пр.). Рекомендуемыми режимами гипофракционирования являются: 3 фракции разовой дозой 8 Гр/9 Гр, 5 фракций разовой дозой 6 Гр и 7 фракций разовой дозой 5 Гр. При проведении гипофракционирования необходимо соблюдать дозовые ограничения: объем 10 см3 нормальной ткани мозга не должен быть облучен дозой выше 19,2Гр (за 3 фракции), 23,4 Гр (за 5 фракций) и 26,5 Гр (за 7 фракций).
Комментарии: СРТ в режиме гипофракционирования является оптимальной опцией у пациентов с наличием очагов ≥ 2 см в максимальном измерении, либо при наличии очагов, локализованных в критических структурах мозга (зрительные тракты, ствол головного мозга и пр.). Рекомендуемыми режимами гипофракционирования являются: 3 фракции разовой дозой 8 Гр/9 Гр, 5 фракций разовой дозой 6 Гр и 7 фракций разовой дозой 5 Гр. При проведении гипофракционирования необходимо соблюдать дозовые ограничения: объем 10 см3 нормальной ткани мозга не должен быть облучен дозой выше 19,2Гр (за 3 фракции), 23,4 Гр (за 5 фракций) и 26,5 Гр (за 7 фракций).
-
У пациентов с наличием от 5 и более метастазов меланомы в головном мозге и благоприятным прогнозом общей выживаемости рекомендуется проведение СРТ в режиме радиохирургии или гипофракционирования или облучение всего головного мозга [135,136].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: у пациентов с множественными метастазами меланомы в головном мозге, благоприятным прогнозом общей выживаемости (изолированная интракраниальной прогрессия, отсутствие или стабилизация экстракраниальных метастазов, наличие резервов лекарственной противоопухолевой терапии), проведение СРТ в режиме радиохирургии или радиотерапии в самостоятельном варианте лечения является предпочтительной лечебной опцией. Необходимо регулярное проведение МРТ головного мозга для раннего выявления интракраниальной прогрессии и проведения повторного локального лечения (нейрохирургия и/или радиотерапия). Проведение ОВГМ в самостоятельном варианте лечения следует рассматривать у пациентов с прогрессирующим множественным, диссеминированным или лептоменингиальными поражением головного мозга, при котором невозможно проведение стереотаксической радиотерапии и нейрохирургии, а также в случае неэффективности противоопухолевой лекарственной терапии и отсутствии резервов системного лечения. Стандартные суммарные дозы ОВГМ - 20 Гр (за 5 фракций), 30Гр (за 10 фракций), 37,5 Гр (за 15 фракций). Применение ОВГМ, как компонента комбинированного со СРТ варианта лечения, снижает риск и откладывает время развития новых (дистантных) метастазов в головном мозге, но не обеспечивает увеличение общей выживаемости и увеличивает риск развития когнитивных расстройств. В случае комбинации стереотаксической радиотерапии с последующим проведением ОВГМ целесообразно редуцировать дозы стереотаксической радиотерапии на 20–25% от первоначальной дозы радиации с целью уменьшения риска развития постлучевых изменений [135,136].
Комментарии: у пациентов с множественными метастазами меланомы в головном мозге, благоприятным прогнозом общей выживаемости (изолированная интракраниальной прогрессия, отсутствие или стабилизация экстракраниальных метастазов, наличие резервов лекарственной противоопухолевой терапии), проведение СРТ в режиме радиохирургии или радиотерапии в самостоятельном варианте лечения является предпочтительной лечебной опцией. Необходимо регулярное проведение МРТ головного мозга для раннего выявления интракраниальной прогрессии и проведения повторного локального лечения (нейрохирургия и/или радиотерапия). Проведение ОВГМ в самостоятельном варианте лечения следует рассматривать у пациентов с прогрессирующим множественным, диссеминированным или лептоменингиальными поражением головного мозга, при котором невозможно проведение стереотаксической радиотерапии и нейрохирургии, а также в случае неэффективности противоопухолевой лекарственной терапии и отсутствии резервов системного лечения. Стандартные суммарные дозы ОВГМ - 20 Гр (за 5 фракций), 30Гр (за 10 фракций), 37,5 Гр (за 15 фракций). Применение ОВГМ, как компонента комбинированного со СРТ варианта лечения, снижает риск и откладывает время развития новых (дистантных) метастазов в головном мозге, но не обеспечивает увеличение общей выживаемости и увеличивает риск развития когнитивных расстройств. В случае комбинации стереотаксической радиотерапии с последующим проведением ОВГМ целесообразно редуцировать дозы стереотаксической радиотерапии на 20–25% от первоначальной дозы радиации с целью уменьшения риска развития постлучевых изменений [135,136].
-
У пациентов с благоприятным прогнозом общей выживаемости после нейрохирургической резекции метастазов в головном мозге рекомендуется проведение послеоперационной СРТ ложа удаленных очагов в режиме радиохирургии или гипофракционирования [135,136].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –5).
Комментарии: СРТ в режиме радиохирургии или гипофракционирования после нейрохирургии проводится в интервале от 4 до 6 недель после нейрохирургической резекции. Перед радиотерапией выполняется МРТ головного мозга с оценкой размера послеоперационного ложа, наличия дислокации структур мозга, появления новых или рост имевшихся не резецированных метастазом меланомы в головном мозге. Обязательно совмещение с дооперационной МРТ, после чего определяется объем облучения: послеоперационное ложе + 2 мм краевой отступ (+ 5 мм по твердой мозговой оболочке) и очаги контрастирования не резецированных метастатических очагов без краевого отступа. Для пациентов, которым планируется нейрохирургическая резекция метастазов в головном мозге, предоперационная радиохирургия может быть альтернативой послеоперационной СРТ в режиме радиохирургии или гипофракционирования.
Комментарии: СРТ в режиме радиохирургии или гипофракционирования после нейрохирургии проводится в интервале от 4 до 6 недель после нейрохирургической резекции. Перед радиотерапией выполняется МРТ головного мозга с оценкой размера послеоперационного ложа, наличия дислокации структур мозга, появления новых или рост имевшихся не резецированных метастазом меланомы в головном мозге. Обязательно совмещение с дооперационной МРТ, после чего определяется объем облучения: послеоперационное ложе + 2 мм краевой отступ (+ 5 мм по твердой мозговой оболочке) и очаги контрастирования не резецированных метастатических очагов без краевого отступа. Для пациентов, которым планируется нейрохирургическая резекция метастазов в головном мозге, предоперационная радиохирургия может быть альтернативой послеоперационной СРТ в режиме радиохирургии или гипофракционирования.
-
У пациентов с неблагоприятным прогнозом общей выживаемости рекомендуется проведение симптоматического лечения [135,136].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5).
Комментарии: неблагоприятный прогноз общей выживаемости определяется наличием у пациентов низкого функционального статуса (индекс Карновского ≤70, или ECOG 3–4), прогноз выживаемости по шкале GPA- меньше 6 мес., наличием экстракраниальной прогрессии и отсутствием резервов системного противоопухолевого лечения. В отдельных клинических ситуациях возможно проведение локального лечения (нейрохирургия и/или радиотерапия) с целью коррекции неврологических расстройств. Решение о проведении локального лечения должно приниматься на мультидисциплинарном консилиуме с учетом потенциальной клинической эффективности и возможных лечебных рисков для пациента.
Комментарии: неблагоприятный прогноз общей выживаемости определяется наличием у пациентов низкого функционального статуса (индекс Карновского ≤70, или ECOG 3–4), прогноз выживаемости по шкале GPA- меньше 6 мес., наличием экстракраниальной прогрессии и отсутствием резервов системного противоопухолевого лечения. В отдельных клинических ситуациях возможно проведение локального лечения (нейрохирургия и/или радиотерапия) с целью коррекции неврологических расстройств. Решение о проведении локального лечения должно приниматься на мультидисциплинарном консилиуме с учетом потенциальной клинической эффективности и возможных лечебных рисков для пациента.
-
У пациентов с крупными метастазами меланомы в головном мозге (или очагами любого размера с перифокальным отеком), которые являются кандидатами для проведения противоопухолевой лекарственной терапии с установленной эффективностью в ЦНС, рекомендуется проведение предварительной локальной терапии (нейрохирургия или стереотаксическая радиотерапия) [134].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарии: у отдельных пациентов с крупными метастазами в головной мозг BRAF позитивной меланомы (или метастазами в головном мозге любого размера с перифокальным отеком), требующих назначения стероидной терапии, при отсутствии угрожающих жизни неврологических расстройств и невозможности проведения локального лечения (нейрохирургия, СРТ в режиме радиохирургии или гипофракционирования), возможно проведение комбинированной таргетной терапии BRAF и MEK ингибиторами на первом этапе лечения [435].
Лекарственная терапия пациентов с метастатическим поражением головного мозга проводится по тем же принципам, что и для пациентов с метастазами других локализаций.
Комментарии: у отдельных пациентов с крупными метастазами в головной мозг BRAF позитивной меланомы (или метастазами в головном мозге любого размера с перифокальным отеком), требующих назначения стероидной терапии, при отсутствии угрожающих жизни неврологических расстройств и невозможности проведения локального лечения (нейрохирургия, СРТ в режиме радиохирургии или гипофракционирования), возможно проведение комбинированной таргетной терапии BRAF и MEK ингибиторами на первом этапе лечения [435].
Лекарственная терапия пациентов с метастатическим поражением головного мозга проводится по тем же принципам, что и для пациентов с метастазами других локализаций.
-
У взрослых пациентов со стабильными метастазами меланомы, в головном мозге рекомендуется отдавать предпочтение комбинированной иммунотерапии (МКА-блокаторы CTLA4 и PD1) по сравнению с монотерапией МКА-блокаторами PD1 или CTLA4 [409,411].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
-
При наличии мутации V600 в гене BRAF у взрослых пациентов с меланомой и с метастазами в головном мозге рекомендуется отдавать предпочтение комбинированной таргетной терапии ИПК BRAF и MEK по сравнению с применением монотерапии ИПК BRAF [222,516] (Таблица 12).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 3).
-
Взрослым пациентам с мутацией в гене BRAF (с эквивалентом IV M1d стадии и наличии неврологических симптомов) при отсутствии противопоказаний рекомендуется проводить комбинированную иммунную и таргетную терапию МКА-блокаторами PDL1 (атезолизумаб**) и ингибиторами протеинкиназы вемурафенибом** и кобиметинибом** [218]. Режимы применения приведены ниже (Таблица 20).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 3).
Комментарий: комбинация атезолизумаба**, вемурафениба** и кобиметиниба** изучалась у больных с BRAF-мутированной меланомой в первой линии терапии и оказалась лучше, чем комбинированная таргетная терапия вемурафенибом** и кобиметинибом** в отношении времени без прогрессирования с пограничной значимостью. Мы полагаем, что тройная комбинация может быть предпочтительнее, чем терапия вемурафенибом** и кобиметинибом** у определенной части пациентов с мутацией в гене BRAF, тем не менее, к настоящему времени нет достаточных научных данных эту часть пациентов определить точнее. Врачу-онкологу при назначении этого режима лечения следует взвесить все потенциальные риски и ожидаемую пользу.
Таблица 20.
Режимы применения МКА-блокатора PDL1 атезолизумаба** и ИПК вемурафениба** и комбиметиниба** у взрослых.
Комментарий: комбинация атезолизумаба**, вемурафениба** и кобиметиниба** изучалась у больных с BRAF-мутированной меланомой в первой линии терапии и оказалась лучше, чем комбинированная таргетная терапия вемурафенибом** и кобиметинибом** в отношении времени без прогрессирования с пограничной значимостью. Мы полагаем, что тройная комбинация может быть предпочтительнее, чем терапия вемурафенибом** и кобиметинибом** у определенной части пациентов с мутацией в гене BRAF, тем не менее, к настоящему времени нет достаточных научных данных эту часть пациентов определить точнее. Врачу-онкологу при назначении этого режима лечения следует взвесить все потенциальные риски и ожидаемую пользу.
Таблица 20.
Режимы применения МКА-блокатора PDL1 атезолизумаба** и ИПК вемурафениба** и комбиметиниба** у взрослых.
|
Схема терапии
|
Препарат
|
Доза
|
Путь введения
|
Дни введения
|
Длительность цикла, дни, режим
|
|---|---|---|---|---|---|
|
Атезолизумаб** + вемурафениб** + кобиметиниб**
[217, 218, 423, 517] |
Вемурафениб**
|
960 мг 2 раза в день
|
Внутрь
|
Ежедневно дни 1-21
|
День 1-21 (вводный период комбинированной таргетной терапии)
|
|
Кобиметиниб**
|
60 мг 1 р/сут
|
Внутрь
|
Ежедневно дни 1-21
|
День 1-21 (вводный период комбинированной таргетной терапии)
|
|
|
Вемурафениб**
|
720 мг 2 раза в день
|
Внутрь
|
Ежедневно дни 22-28
|
День 22-28 (вводный период комбинированной таргетной терапии))
|
|
|
Атезолизумаб**
ИЛИ (!) |
840 мг
|
В/в кап
|
День 1 (29), 15 (44)
|
Начиная с 29-го дня цикла каждый 1 и 15 день
|
|
|
Атезолизумаб**
|
1200 мг
|
В/в кап
|
День 1 (29), 22
|
Начиная с 29-го дня цикла каждые 3 недели
|
|
|
ИЛИ (!) Атезолизумаб**
|
1680 мг
|
В/в кап
|
День 1 (29)
|
Начиная с 29-го дня цикла каждые 4 недели
|
|
|
Вемурафениб**
|
720 мг 2 раза в день
|
Внутрь
|
Ежедневно дни 1-28
|
День 1-28 (период лечения тройной комбинацией)
|
|
|
Кобиметиниб**
|
60 мг 1 р/сут
|
Внутрь
|
Ежедневно дни 1-21
|
День 1-21 (период лечения тройной комбинацией)
|
|
|
Вемурафениб** 960 мг (четыре таблетки по 240 мг) перорально два раза в сутки вместе с кобиметинибом** 60 мг (три таблетки по 20 мг) перорально 1 раз в сутки с 1 по 21 день с последующим приемом вемурафениба** 720 мг (три таблетки по 240 мг) перорально два раза в сутки с 22 по 28 дни. Период тройной комбинации (с 29 дня и далее): атезолизумаб** 840 мг внутривенно в день 1 и 15, кобиметиниб** 60 мг (три таблетки по 20 мг) перорально 1 раз в сутки в дни с 1 по 21, вемурафениб** 720 мг (три таблетки по 240 мг) перорально 2 раза в день с 1 по 28 день 28-дневного цикла. Лечение проводят до прогрессирования или неприемлемой токсичности. При необходимости вводный период (лечение только комбинацией вемурафениба** и кобиметиниба**) может быть продлен до 56 дней, а режим введения атезолизумаба** изменен на атезолизумаб** 1200 мг внутривенно в день 1, каждые 21 день или на атезолизумаб** 1680 мг внутривенно в день 1, каждые 28 дней.
|
|||||
-
При наличии мутации V600 в гене BRAF у пациентов с метастазами меланомы в головном мозге и наличии неврологических симптомов рекомендуется отдавать предпочтение комбинированной иммуно-таргетной терапии ИПК BRAF и MEK и PDL1 [217,518] (см. также таблицу 13).
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
-
Не рекомендуется проведение стероидной терапии у пациентов с метастазами меланомы в головном мозге без клинических симптомов и проявлений масс-эффекта [57,519-523].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –2).
Комментарии: у пациентов с метастазами меланомы в головном мозге и наличием неврологических симптомов, связанными с масс-эффектом, рекомендуется проведение стероидной терапии (дексаметазон**) для ликвидации или временного облегчения симптомов, связанных с повышением внутричерепного давления и вторичным отеком мозга. Доза стероидной терапии должна быть минимально достаточной для купирования симптомов и обычно составляет 4–8-12 мг / сут.
При проведении иммунотерапии (блокаторы CTLA4, PD1 и PD-L1) не рекомендуется превышать дозу дексаметазона** более 4 мг в сутки. Альтернативным вариантом противоотечной терапии в этой клинической ситуации является назначение #бевацизумаба** (см. Таблица 21).
Комментарии: у пациентов с метастазами меланомы в головном мозге и наличием неврологических симптомов, связанными с масс-эффектом, рекомендуется проведение стероидной терапии (дексаметазон**) для ликвидации или временного облегчения симптомов, связанных с повышением внутричерепного давления и вторичным отеком мозга. Доза стероидной терапии должна быть минимально достаточной для купирования симптомов и обычно составляет 4–8-12 мг / сут.
При проведении иммунотерапии (блокаторы CTLA4, PD1 и PD-L1) не рекомендуется превышать дозу дексаметазона** более 4 мг в сутки. Альтернативным вариантом противоотечной терапии в этой клинической ситуации является назначение #бевацизумаба** (см. Таблица 21).
-
Рекомендуется проведение терапии #бевацизумабом** при наличии симптоматического перифокального отека метастатических очагов или радионекроза, резистентных к проводимой стероидной терапии или при наличии противопоказаний к проведению стероидной терапии (например, при необходимости проводить конкурентную терапию МКА-блокаторами PD1 / PDl1, или МКА-блокаторами CTLA4 ) (см. также Таблица 21) [57,519-522,524].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –4).
Таблица 21
Рекомендуемые режимы применения #бевацизумаба** при симптоматическом перифокальном отеке или радионекрозе в головном мозге.
Таблица 21
Рекомендуемые режимы применения #бевацизумаба** при симптоматическом перифокальном отеке или радионекрозе в головном мозге.
|
Схема терапии
|
Препарат
|
Доза
|
Путь введения
|
Дни введения
|
Длительность цикла, дни, режим
|
|---|---|---|---|---|---|
|
Монотерапия [520]
|
#Бевацизумаб **
|
5 мг/кг массы тела
|
В/в капельно
|
1 раз в 14 дней
|
Длительно (от 4 введений до до регресса неврологических симптомов или улучшения рентгенологической картины или явлений непереносимости)
|
|
Монотерапия [520]
|
#Бевацизумаб **
|
7,5 мг/кг массы тела
|
В/в капельно
|
1 раз в 21 дней
|
Длительно (от 4 введений до до регресса неврологических симптомов или улучшения рентгенологической картины или явлений непереносимости)
|
9. Конкурентное применение лучевой терапии и системного противоопухолевого лечения
-
Поскольку имеются сведения о радиосенсибилизирующем эффекте ИПК BRAF и MEK в случаях выраженной висцеральной токсичности при их одновременном применении с лучевой терапией, рекомендуется всем пациентам с меланомой прервать прием ИПК BRAF или MEK:
-
не менее чем за 3 дня до начала лучевой терапии и возобновить не ранее чем через 3 дня после окончания фракционированной лучевой терапии;
-
как минимум за 1 день до начала стереотаксической радиохирургии (или радиотерапии) и возобновить через 1 день после ее завершения [525-528].
-
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
-
В настоящее время не существует убедительных данных, свидетельствующих об ухудшении переносимости лечения при одновременном проведении лучевой терапии и терапии МКА-блокаторами PD1 или CTLA4. Анализ результатов представленных исследований показал, лучевая терапия рекомендуется совместно с терапией МКА-блокаторами PD1 или CTLA4 без потери эффективности и повышения частоты нежелательных реакций [525,528-530].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 3).
10. Подходы к лечению пациентов после полного удаления всех метастатических очагов (эквивалент стадии IV, без признаков заболевания).
10. Подходы к лечению пациентов после полного удаления всех метастатических очагов (эквивалент стадии IV, без признаков заболевания).
-
Рекомендуется взрослым пациентам после полного (R0) удаления отдаленных метастазов меланомы кожи или метастазов меланомы без выявленного первичного очага (в мягкие ткани, легкие, головной мозг и др.) в течение 3 мес. после хирургического лечения при отсутствии противопоказаний проводить адъювантную терапию ниволумабом** по схеме ниволумаб** 3 мг/кг каждые 2 нед в/в капельно 12 месяцев) (УУР А, УДД 2) или ниволумаб** 240 мг каждые 2 нед в/в капельно 12 месяцев, или ниволумаб** 480 мг в/в каждые 4 нед 12 месяцев (УУР С УДД 5) [352,368,369,434,531,532].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2) – для 3 мг/кг каждые 2 нед в/в капельно 12 месяцев.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5) – для 240 мг каждые 2 нед в/в капельно 12 месяцев и 480 мг в/в каждые 4 нед. 12 месяцев.
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5) – для 240 мг каждые 2 нед в/в капельно 12 месяцев и 480 мг в/в каждые 4 нед. 12 месяцев.
-
Рекомендуется взрослым пациентам с метастатической меланомой (эквивалент стадии M1) после хирургического удаления всех метастатических узлов, без признаков заболевания) проведение адъювантной комбинированной терапия МКА-блокаторами CTLA4 и МКА-блокаторами PD1 [533,534]. Режим применения приведен ниже (Таблица 22).
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
Таблица 22.
Режим применения комбинированной иммунотерапии у больных после полного (R0) удаления отдаленных метастазов меланомы.
Таблица 22.
Режим применения комбинированной иммунотерапии у больных после полного (R0) удаления отдаленных метастазов меланомы.
|
Ниволумаб** (в один день с ипилимумабом**)
|
1 мг/кг
|
в/в капельно 30 мин
|
1 раз в 21 день
|
суммарно не более 4 введений
|
|---|---|---|---|---|
|
Ипилимумаб** (в один день с ниволумабом**)
|
3 мг/кг
|
в/в капельно 30 минут
|
1 раз в 21 день
|
суммарно не более 4 введений
|
|
После окончания терапии комбинацией, монотерапия ниволумабом**
|
3 мг/кг (но не более 240 мг) или 240 мг
|
в/в капельно 30 минут
|
1 раз в 14 дней
|
до 12 месяцев с момента начала адъювантной терапии
|
|
480 мг
|
в/в капельно 30 минут
|
1 раз в 21 день
|
до 12 месяцев с момента начала адъювантной терапии
|
11. Подходы к лечению метастатической и нерезектабельной меланомой кожи (IIIC/D нерезектабельная – IV) у лиц моложе 18 лет.
Введение: терапия метастатической и нерезектабельной меланомы кожи пациентов детского возраста изучена недостаточно: в виду редкости данной болезни у детей крупных рандомизированных исследований современных противоопухолевых препаратов у этой категории пациентов не проводилось. Рабочая группа по разработке и пересмотру клинических рекомендаций рекомендует участие пациентов моложе 18 лет в клинических исследованиях. Ряд лекарственных препаратов изучалась в небольших не рандомизированных исследованиях или имеются отдельные клинические наблюдения их применения, что стало основой для их включения в клинические рекомендации (см. Таблица 23) . При наличии противопоказаний к применению данных лекарственных препаратов или их неэффективности, возможно назначение иной противоопухолевой терапии (в соответствии с рекомендациями для взрослых пациентов) консилиумом врачей по жизненным показаниям.
-
У пациентов детского возраста с метастатической и нерезектабельной меланомой кожи рекомендуется проводить системное противоопухолевое лечение, информируя пациента (и/или его родителей, законных представителей) о потенциальных преимуществах и ограничениях данного метода лечения (см. Таблица 23) [214,535-541].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств –4).
Комментарий: к настоящему времени ответы на лечение были зарегистрированы при применении #ипилимумаба** в монотерапии, и #ниволумаба** в монотерапии, #дакарбазина** в монотерапии. Эти лекарственные препараты должны быть рассмотрены как препараты первой линии.
Таблица 23.
Режимы назначения противоопухолевой лекарственной терапии у пациентов моложе 18 лет с метастатической и нерезектабельной меланомой (для всех режимов УУР С, УДД 4).
Комментарий: к настоящему времени ответы на лечение были зарегистрированы при применении #ипилимумаба** в монотерапии, и #ниволумаба** в монотерапии, #дакарбазина** в монотерапии. Эти лекарственные препараты должны быть рассмотрены как препараты первой линии.
Таблица 23.
Режимы назначения противоопухолевой лекарственной терапии у пациентов моложе 18 лет с метастатической и нерезектабельной меланомой (для всех режимов УУР С, УДД 4).
|
Схема терапии
|
Препарат
|
Доза
|
Путь введения
|
Дни приема
|
Длительность цикла, дни, режим
|
Особые условия
|
Минимальный возраст, в котором есть опыт применения
|
ссылка
|
УДД / УУР
|
|
МКАблокаторы PD1 или CTLA4
|
#Пембролизумаб**
|
2 мг/кг массы тела
|
в/в капельно
|
День 1, инфузия 30 мин
|
цикл 21 день
|
Вне зависимости от мутации в гене BRAF
|
С 6 месяцев
|
[536]
|
4/С
|
|
#Ипилимумаб**
|
3 мг/кг массы тела
|
в/в капельно
|
День 1, инфузия 90 мин
|
цикл 21 день, максимум 4 цикла
|
Вне зависимости от мутации в гене BRAF
|
С 2 лет
|
[535, 537]
|
4/С
|
|
|
#Ниволумаб**
|
3 мг/кг массы тела
|
в/в капельно
|
День 1, инфузия 60 мин
|
цикл 14 день
|
Вне зависимости от мутации в гене BRAF
|
Менее 6 мес.
|
[538]
|
4/С
|
|
|
ИПК BRAF
|
#Вемурафениб**
|
375 мг/м2 - 960 мг 2 раза в день
|
Внутрь
|
Ежедневно
|
Длительно
|
Только у пациентов с активирующей мутацией в гене BRAF
|
С 3 лет
|
[214, 539, 540]
|
4/С
|
|
Химиотерапия
|
#Дакарбазин**
|
250 мг/м2
|
в/в
|
День 1-5
|
цикл 21 день
|
Вне зависимости от мутации в гене BRAF
|
С 5 мес.
|
[541]
|
4/С
|
Комментарий: #Пембролизумаб** (анти-PD1) был изучен в рамках II фазы (исследование KEYNOTE 051) [536]. В исследование было включено 155 пациентов в возрасте от 6 мес. до 17 лет с меланомой или PDL+ солидными опухолями и лимфомой, среди которых было 8 пациентов (5%) с меланомой. Не было зарегистрировано ни одного объективного ответа среди 8 пациентов, которые были включены. Возможно, это обусловлено тем, что 4 пациента были в возрасте 3 лет или младше, что еще раз подчеркивает различия меланомы в этой возрастной группе от меланомы подростков, которая по своим биологическим характеристикам близка к меланоме кожи взрослых.
#Ипилимумаб** (анти - CTLA4) был исследован у детей в возрасте 2 - 18 лет и 12 – 18 лет, с метастатической или неоперабельной формой, было включено 12 пациентов, #ипилимумаб** 3мг/кг (n=4) и ипилимумаб 10мг/кг (n=8). При сроке наблюдения более года #ипилимумаб** демонстрировал результаты схожие с результатами терапии у взрослых. Частота нежелательных явлений 3 и 4 степени – 1 случай при дозе 3мг/ кг и 5 случаев при дозе 10 мг/кг, соответственно [535,537].
Ингибиторы BRAF также не были хорошо изучены у детей. Исследование I фазы (BRIM-P) включало 6 пациентов в возрасте 12-17 лет с метастатической меланомой с мутацией в гене BRAF. Сравнивалось два дозовых режима #вемурафениб ** 720 мг х 2 раза в день внутрь vs 960 мг х 2 раза в сутки внутрь [214]. Исследователи заключили, что эффективная и переносимая доза не определена в виду малой выборки пациентов, объективных ответов зарегистрировано не было [214]. Однако, положительные результаты использования комбинированной таргетной терапии при лечении детей с глиомой с мутацией в гене BRAF [542,543] позволяют высказаться в пользу назначения комбинированной таргетной терапии у детей с меланомой кожи и с мутацией в гене BRAF. Особенно это касается меланомы кожи подростков, которая наиболее близка к меланоме кожи взрослых, хотя в исследованиях ранних фаз была показана переносимость #дабрафениба** у детей младше 12 лет в дозе 3,75 - 5,25 мг/кг/сут [543].
Любые другие препараты, положительно зарекомендовавшие себя при лечении взрослых больных меланомой, могут быть использованы в детской практике только после проведения консилиума в федеральном центре и по решению врачебной комиссии.
5. Обезболивание
Принципы обезболивания и оптимального выбора противоболевой терапии у пациентов меланомой с хроническим болевым синдромом соответствуют принципам обезболивания, изложенным в клинических рекомендациях «Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи» [544].
6. Сопутствующая терапия у больных меланомой кожи
1. «Принципы профилактики острой и отсроченной̆ тошноты и рвоты при лекарственном лечении
меланомы кожи изложены в методических рекомендациях «ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПРОФИЛАКТИКЕ И ЛЕЧЕНИЮ ТОШНОТЫ И РВОТЫ У ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ» [545].
2. Принципы лечения и профилактики костных осложнений
у пациентов с меланомой кожи изложены в методических рекомендациях «ИСПОЛЬЗОВАНИЕ ОСТЕОМОДИФИЦИРУЮЩИХ АГЕНТОВ (ОМА) ДЛЯ
ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ПАТОЛОГИИ КОСТНОЙ ТКАНИ ПРИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЯХ» [546].
3. «Принципы профилактики и лечения иммуноопосредованных нежелательных явлений
у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО УПРАВЛЕНИЮ ИММУНООПОСРЕДОВАННЫМИ НЕЖЕЛАТЕЛЬНЫМИ ЯВЛЕНИЯМИ» [547].
4. Принципы профилактики и лечения инфекционных осложнений и фебрильной нейтропении
у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях «ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ДИАГНОСТИКЕ И ЛЕЧЕНИЮ ФЕБРИЛЬНОЙ НЕЙТРОПЕНИИ» [548].
5. Принципы профилактики и лечения гепатотоксичности
у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях «КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО КОРРЕКЦИИ ГЕПАТОТОКСИЧНОСТИ, ИНДУЦИРОВАННОЙ ПРОТИВООПУХОЛЕВОЙ ТЕРАПИЕЙ» [549].
6. Принципы профилактики и лечения сердечно-сосудистых осложнений
у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях «ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО КОРРЕКЦИИ КАРДИОВАСКУЛЯРНОЙ ТОКСИЧНОСТИ ПРОТИВООПУХОЛЕВОЙ ЛЕКАРСТВЕННОЙ ТЕРАПИИ» [550].
7. Принципы профилактики и лечения кожных осложнений
у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях «ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ЛЕКАРСТВЕННОМУ ЛЕЧЕНИЮ ДЕРМАТОЛОГИЧЕСКИХ РЕАКЦИЙ У ПАЦИЕНТОВ, ПОЛУЧАЮЩИХ ПРОТИВООПУХОЛЕВУЮ ЛЕКАРСТВЕННУЮ ТЕРАПИЮ» [551].
8. Принципы нутритивной поддержки
у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях «ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО НУТРИТИВНОЙ ПОДДЕРЖКЕ ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ» [552].
9. Принципы профилактики и лечения тромбоэмболических осложнений
у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях «ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ПРОФИЛАКТИКЕ И ЛЕЧЕНИЮ ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ У ОНКОЛОГИЧЕСКИХ БОЛЬНЫХ» [553].
10. Принципы профилактики и лечения нефротоксичности
у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО КОРРЕКЦИИ НЕФРОТОКСИЧНОСТИ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ» [554].
11. Принципы профилактики и лечения последствий экстравазации лекарственных препаратов
у пациентов с меланомой кожи соответствуют принципам, изложенным в методических рекомендациях «РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ ПОСЛЕДСТВИЙ ЭКСТРАВАЗАЦИИ ПРОТИВООПУХОЛЕВЫХ ПРЕПАРАТОВ» [555].
7. Диетотерапия.
-
К настоящему моменту не получены сколько-нибудь надежные сведения о влиянии пищевого поведения на риск заболеть меланомой кожи, меланомой иных локализаций или на риск рецидива или прогрессирования этого заболевания у лиц с уже установленным диагнозом. Имеются противоречивые сведения о том, что диета, состоящая из продуктов, богатых витамином D и каротиноидами, а также снижение потребления алкоголя, могут быть связаны со снижением риска развития меланомы В этой связи не рекомендованы какие-либо изменения в привычном рационе пациентов, если только они не продиктованы необходимостью коррекции ко-морбидных состояний или купирования или профилактики осложнений проводимого лечения (хирургического, лекарственного или лучевого) [556].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
В настоящее время для большинства видов медицинской реабилитации отсутствуют клинические исследования с участием пациентов с меланомой. Данные рекомендации сделаны на основании того, что во многих исследованиях, в том числе мете-анализах (Steffens, D et al 2018 и др.) и систематических обзорах (Nicole L. Stout et al, 2017 и R. Segal et al, 2017 и др.) доказано, что различные виды медицинской реабилитации значительно ускоряют функциональное восстановление, сокращают сроки пребывания в стационаре после операции и снижают частоту развития осложнений и летальных исходов у пациентов с другими злокачественными новообразованиями.
1. Предреабилитация
- Рекомендуется проведение предреабилитации всем пациентам с меланомой кожи в целях ускорения функционального восстановления, сокращения сроков пребывания в стационаре после операции, снижения частоты развития осложнений и летальных исходов на фоне лечения меланомы. Предреабилитация включает физическую подготовку (ЛФК), психологическую и нутритивную поддержку, информирование пациентов [557].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: Рекомендуется советовать пациенту увеличить физическую активность за 2 недели до операции в целях снижения сроков пребывания в стационаре и риска развития послеоперационных осложнений, а также повышения качества жизни в послеоперационном периоде [558].
2. Реабилитация при хирургическом лечении
1. Первый этап реабилитации
- Рекомендуется мультидисциплинарный подход при проведении реабилитации взрослых пациентов в онкодерматологии с включением двигательной реабилитации, психологической поддержки, работы со специалистами по трудотерапии (инструкторами по трудовой терапии) [559].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуется раннее начало восстановительного лечения у взрослых пациентов, поскольку оно улучшает функциональные результаты после операций в онкодерматологии [560].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется комплекс ЛФК в каждом конкретном случае разрабатывать индивидуально, исходя из особенностей и объема операции у детей [561].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется назначение всем пациентам медицинского массажа (исключая оперированную анатомическую зону) в раннем послеоперационном периоде, поскольку медицинский массаж повышает тонус мышц, улучшает заживление послеоперационной раны, уменьшает болевой синдром и отек, способствует профилактике тромботических осложнений [562].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется взрослым пациентам применение пневмокомпрессии для профилактики послеоперационных отеков [563].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств –5).
- Рекомендуется применение взрослым пациентам кинезиологического тейпирования для лечения и профилактики послеоперационных отеков, что сопоставимо по эффекту с применением прессотерапии [563].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств –5).
- Рекомендуется у взрослых пациентов сочетать лечение положением, ЛФК, криотерапию на область операции, медицинский массаж, электротерапию в целях обезболивания [564].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется у взрослых пациентов постепенно расширять объем ЛФК. При появлении возможности активного отведения разрешается полная нагрузка на оперированную конечность [560].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
2. Второй этап реабилитации
- Рекомендовано у взрослых пациентов использовать методики, направленные на мобилизацию рубцов для профилактики формирования грубых рубцовых изменений, в том числе в глубоких слоях мягких тканей: глубокий медицинский массаж, упражнения на растяжку, ультразвуковую терапию с целью размягчения рубцовых изменений [565].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется у взрослых пациентов при возникновении лимфедемы проводить полную противоотечную терапию, включающую мануальный лимфодренаж (медицинский массаж нижней или верхней конечности), ношение компрессионного трикотажа, выполнение комплекса ЛФК, уход за кожей [566].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется у взрослых пациентов в сочетании с полной противоотечной терапией применение перемежающей пневмокомпрессии, длящейся не менее 1 ч с давлением в камерах 30–60 мм рт. ст. [566].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется у взрослых пациентов в сочетании с полной противоотечной терапией применение низкоинтенсивной лазеротерапии [567].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
3. Третий этап реабилитации
- Рекомендуется у взрослых пациентов выполнение и постепенное расширение комплекса ЛФК с включением аэробной нагрузки, что улучшает результаты комбинированного лечения злокачественных новообразований и качество жизни [568].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендован у взрослых пациентов медицинский массаж для улучшения качества жизни, уменьшения болевого синдрома, слабости [569].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
3. Реабилитация при химиотерапии
- Рекомендуется у взрослым пациентов раннее начало физических нагрузок на фоне химиотерапии, что помогает профилактике мышечной слабости, гипотрофии, снижения толерантности к физической нагрузке [570].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется у взрослых пациентов применение аэробной нагрузки на фоне химиотерапии, что повышает уровень гемоглобина, эритроцитов и снижает длительность лейко- и тромбоцитопении, а также повышает вероятность завершить запланированный курс химиотерапии [571,572].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств –5).
- Рекомендуется взрослым пациентам проведение ЛФК на фоне химиотерапии, что позволяет уменьшать слабость и депрессию. Сочетание ЛФК с психологической поддержкой в лечении слабости и депрессии на фоне химиотерапии более эффективно, чем только медикаментозная коррекция [573].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
- Рекомендуется взрослым пациентам индивидуально подбирать объем и интенсивность ЛФК на фоне химиотерапии, исходя из степени слабости (легкая, средняя, тяжелая), и увеличивать интенсивность ЛФК при улучшении общего состояния [570].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется взрослым пациентам сочетание аэробной нагрузки и силовой для управления побочными эффектами лечения, повышения толерантности к лечению [570].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется взрослым пациентам проведение курса медицинского массажа в течение 6 недель после начала химиотерапии, что уменьшает слабость на фоне комбинированного лечения [574].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется пациентам взрослым проводить упражнения на тренировку баланса, что более эффективно для коррекции полинейропатии, чем сочетание упражнений на выносливость и силовых упражнений [575].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется взрослым пациентам назначать 6-недельный курс ходьбы (теренного лечения) пациентам с меланомой кожи или слизистых и полинейропатией, вызванной токсическим воздействием химиотерапии, как часть общего комплекса реабилитации с целью контроля клинических проявлений полинейропатии [576].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств –2).
- Рекомендуется взрослым пациентам низкочастотная магнитотерапия в лечении периферической полинейропатии на хоне химиотерапии [577].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2).
- Рекомендуется взрослым пациентам чрескожная короткоимпульсная электростимуляция в течение 20 минуты в день 4 недель для лечения полинейроватии на фоне химиотерапии [578].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 3).
- Рекомендуется взрослым пациентам низкоинтенсивная лазеротерапия в профилактике мукозитов полости рта на фоне химиотерапии [579].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 1).
- Рекомендуется взрослым пациентам использование систем охлаждения кожи головы (аппарата для профилактики алопеции при химиотерапии), что обеспечивает профилактику алопеции на фоне химиотерапии [580].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
4. Реабилитация при лучевой терапии
- Рекомендуется взрослым пациентам выполнение комплекса ЛФК (аэробной нагрузки в сочетании с силовой) на фоне лучевой терапии, что позволяет проводить профилактику слабости и улучшает качество жизни у на фоне лучевой терапии [581].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется взрослым пациентам проведение комплекса ЛФК, что увеличивает плотность костной ткани и выносливость пациента на фоне лучевой терапии в первую очередь у пациентов с костными метастазами [582].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
- Рекомендуется взрослым пациентам через 3 дня после начала лучевой терапии подключить низкоинтенсивную лазеротерапию на 3 дня в неделю для профилактики лучевого дерматита [583].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
5. Принципы психологической реабилитации пациентов со злокачественными новообразованиями кожи.
- Рекомендуется у взрослых пациентов выполнять информирование пациентов о заболевании, психических реакциях; зоне ответственности в процессе лечения; способах коммуникации с родственниками, медицинским персоналом; способах получения дополнительной информации о своем заболевании или состоянии; способах получения социальной поддержки, что приводит к улучшению качества жизни и исхода заболевания [584-586].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Рекомендуется у взрослых пациентов добиваться комбинированного эффекта совладающего поведения и воспринимаемой социальной поддержки, что приводит к меньшему количеству навязчивых и избегающих мыслей до лечения и обеспечивает лучшую психологическую адаптацию пациента через 1 месяц после лечения [587,588].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
- Рекомендуются взрослым пациентам психообразовательные мероприятия и психологическая поддержка (самодиагностика патологических психических реакций; способы совладания со стрессом; отслеживание взаимовлияния психических реакций и физического состояния), что может рассматриваться как основной механизм трансформации стрессовых событий в личный опыт, способствующий социальной и психической адаптации в условиях заболевания и лечения [589,590].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: чаще всего в научных исследованиях в рамках онкопсихологии встречаются 3 стиля совладания среди пациентов с меланомами:
- активное поведенческое преодоление эмоциональных, физических и социальных трудностей, ассоциированных с заболеванием и лечением;
- активно-познавательное преодоление, включающее в себя отношение, убеждения и размышления о заболевании;
- преодоление избегания, включающее попытки активного избегания проблем или косвенного снижения эмоционального напряжения с помощью отвлечения внимания.
В целом, исследования показывают, что пациенты, которые используют активные (проблемно-ориентированные) стратегии выживания, демонстрируют лучшую адаптацию к заболеванию, чем те, кто использует пассивные или избегающие стили выживания [591-594].
Пациенты, которые использовали активно-поведенческие методы преодоления трудностей, сообщали о более высоком уровне самооценки и энергии, меньшем количестве физических симптомов и снижении раздражительности и астенизации [595,596].
В противоположность этому, у пациентов с меланомой на ранних стадиях была продемонстрирована положительная корреляция между методами преодоления избегания и тревожностью, депрессией, растерянностью и нестабильным фоном настроения [591,595-597].
Boesen et al. продемонстрировали, что структурированные вмешательства, предлагающие психо-образовательную поддержку, способствуют снижению дистресса и расстройств настроения, приводят к более активному использованию стратегий выживания среди пациентов с меланомой [598,599].
- Рекомендуется проводить взрослым пациентам прицельные психокоррекционные мероприятия психических реакций, ассоциированных с меланомой (реакции по астено-тревожно-депрессивному типу, нарциссические реакции, реакции в рамках ПТС, социальная изоляция), что приводит к уменьшению тревожности, расстройств, связанных со здоровьем, а также с положительным изменениям в борьбе с болезнью [600].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
Комментарий: Результаты психокоррекционных мероприятий демонстрируют низкий уровень депрессии, спутанности сознания, астенизации, апатии и общего снижения фона настроения среди пациентов с меланомой [591]. Также многие исследования демонстрируют положительное влияние вмешательства на функции иммунной системы, в том числе увеличение некоторых типов естественных киллеров (NK) и увеличение потенциала NK-клеток в борьбе с опухолями [596]. За 5 лет наблюдения данные исследователи смогли показать, что психологические и биологические изменения, в свою очередь, были связаны с показателями рецидивов и выживаемости [595].
Госпитализация
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
- в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
- в соответствии с порядками оказания медицинской помощи, утверждаемыми уполномоченным федеральным органом исполнительной власти и обязательными для исполнения на территории Российской Федерации всеми медицинскими организациями
- на основе настоящих клинических рекомендаций;
- с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи, а при его отсутствии в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы).
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи, а при отсутствии в первичный онкологический кабинет, поликлиническое отделение онкологического диспансера (онкологической больницы) для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы) должна быть проведена не позднее 3 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или поликлинического отделения онкологического диспансера (онкологической больницы организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет) биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется врачом-онкологом в онкологический диспансер (онкологическую больницу) или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественных новообразований не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
Сроки проведения диагностических инструментальных и лабораторных исследований в случае подозрения на онкологическое заболевание не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации, 7 рабочих дней со дня назначения исследований.
Диагноз онкологического заболевания устанавливается врачом-специалистом на основе результатов диагностических исследований, включающих в том числе проведение цитологической и (или) гистологической верификации диагноза, за исключением случаев, когда взятие биопсийного и (или) пункционного материала не представляется возможным.
Врач-онколог (врач-детский онколог) центра амбулаторной онкологической помощи (первичного онкологического кабинета) направляет пациента в онкологический диспансер (онкологическую больницу) или иную медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями, в том числе подведомственную федеральному органу исполнительной власти (далее – федеральная медицинская организация), для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания), определения тактики лечения, а также в случае наличия медицинских показаний для оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
В сложных клинических случаях для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания) в целях проведения оценки, интерпретации и описания результатов врач-онколог (врач-детский онколог) организует направление:
- цифровых изображений, полученных по результатам патоморфологических исследований, в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр) путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
- цифровых изображений, полученных по результатам лучевых методов исследований, в дистанционный консультативный центр лучевой диагностики, путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
- биопсийного (операционного) материала для повторного проведения патоморфологических, иммуногистохимических, и молекулярно-генетических исследований: в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр), а также в молекулярно-генетические лаборатории для проведения молекулярно-генетических исследований.
Тактика лечения устанавливается консилиумом врачей, включающим врачей-онкологов, врачей-детских онкологов (в случае пациента моложе 18 лет), врача-радиотерапевта, врача-нейрохирурга (при опухолях нервной системы) медицинской организации, в составе которой имеются отделения хирургических методов лечения злокачественных новообразований, противоопухолевой лекарственной терапии, радиотерапии (далее – онкологический консилиум), в том числе онкологическим консилиумом, проведенным с применением телемедицинских технологий, с привлечением при необходимости других врачей-специалистов.
Диспансерное наблюдение врача-онколога (врача-детского онколога в случае пациента моложе 18 лет) за пациентом с выявленным онкологическим заболеванием устанавливается и осуществляется в соответствии с порядком диспансерного наблюдения за взрослыми с онкологическими заболеваниями.
С целью учета информация о впервые выявленном случае онкологического заболевания направляется в течение 3 рабочих дней врачом-онкологом медицинской организации, в которой установлен соответствующий диагноз, в онкологический диспансер или организацию субъекта Российской Федерации, исполняющую функцию регистрации пациентов с впервые выявленном злокачественным новообразованием, в том числе с применением единой государственной информационной системы в сфере здравоохранения. В случае подтверждения у пациента наличия онкологического заболевания информация об уточненном диагнозе направляется из онкологического диспансера или организации субъекта Российской Федерации, исполняющей функции регистрации пациентов с впервые выявленном злокачественным новообразованием, в медицинскую организацию, осуществляющую диспансерное наблюдение пациента
Специализированная, в том числе высокотехнологичная, медицинская помощь в медицинских организациях, оказывающих медицинскую помощь взрослому населению при онкологических заболеваниях, оказывается по медицинским показаниям, предусмотренным положением об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Специализированная, за исключением высокотехнологичной, медицинская помощь в медицинских организациях, подведомственных федеральным органам исполнительной власти, оказывается по медицинским показаниям, предусмотренным пунктом 5 порядка направления пациентов в медицинские организации и иные организации, подведомственные федеральным органам исполнительной власти, для оказания специализированной (за исключением высокотехнологичной) медицинской помощи, предусмотренного в приложении к положению об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи. (Пункт 5: для получения специализированной медицинской помощи в плановой форме выбор федеральной медицинской организации осуществляется по направлению лечащего врача.) В случае если в реализации Программы принимают участие несколько федеральных медицинских организаций, оказывающих специализированную медицинскую помощь при заболеваниях, состояниях (группе заболеваний, состояний), соответствующих заболеваниям, состояниям (группе заболеваний, состояний) пациента, лечащий врач обязан проинформировать пациента (законного представителя пациента) о возможности выбора федеральной медицинской организации, в том числе о возможных сроках ожидания специализированной медицинской помощи, которые могут превышать сроки ожидания, установленные программой государственных гарантий бесплатного оказания гражданам медицинской помощи.
Сроки ожидания оказания специализированной (за исключением высокотехнологичной) медицинской помощи не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации, 7 рабочих дней.
При наличии у пациента с онкологическим заболеванием медицинских показаний для проведения медицинской реабилитации врач-онколог организует ее проведение в соответствии с порядком организации медицинской реабилитации взрослых.
При наличии у пациента с онкологическим заболеванием медицинских показаний к санаторно-курортному лечению врач-онколог организует его в соответствии порядком организации санаторно-курортного лечения.
Паллиативная медицинская помощь пациенту с онкологическими заболеваниями оказывается в соответствии с положением об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья.
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
- наличие осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
- наличие осложнений лечения онкологического заболевания (хирургическое вмешательство, лучевая терапия, лекарственная терапия и т.д.), требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
- необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, а также проведение эндоскопических исследований при невозможности выполнить их амбулаторно, требуют последующего наблюдения в условиях круглосуточного или дневного стационара;
- наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, лучевая терапия, в том числе контактная, дистанционная и другие виды лучевой терапии, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
- завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
- отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь;
- в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
- необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
Показания для направления пациента в другую медицинскую организацию:
- исполнение клинических рекомендаций призвано максимально повысить качество оказываемой медицинской помощи пациентам в различных клинических ситуациях. Если в медицинской организации отсутствует возможность проводить рекомендуемый объем медицинской помощи (например, отсутствует возможность проведения процедуры биопсии сторожевого лимфатического узла), рекомендуется воспользоваться системой маршрутизации в федеральные центры, имеющие соответствующую оснащенность и кадры;
- с учетом редкости данной патологии, все случаи меланомы кожи у детей в возрасте 17 лет и моложе рекомендуется направлять на консультацию очно или посредством телемедицинских технологий для получения второго мнения относительно прижизненного патологоанатомического диагноза в референсный центр;
- всех пациентов с врожденными крупными и гигантскими невусами кожи в возрасте 17 лет и моложе рекомендуется направлять на консультацию очно или посредством телемедицинских технологий в федеральный центр для принятия решения об индивидуальной тактике дальнейшего лечения или наблюдения;
- клинические рекомендации не позволяют описать все многообразие реальной клинической практики и охватывают лишь наиболее частые и типовые клинические ситуации. Если практикующий врач или медицинская организация сталкивается с клинической ситуацией, не имеющей соответствующего отражения в настоящей клинической рекомендации (нетипичное течение болезни, необходимость начала противоопухолевой терапии при выявлении противопоказаний к ней, прогрессирование на фоне применения рекомендуемых видов лечения и т. д.), рекомендуется воспользоваться системой телемедицинских консультаций или маршрутизации в национальные медицинские исследовательские центры для уточнения тактики лечения;
- выявление или обострение сопутствующей патологии, не относящейся к профилю онкологического учреждения, которая препятствует проведению данного этапа лечения требует маршрутизации в профильные медицинские организации.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Профилактика
- Всем людям в целях снижения риска возникновения как первичной меланомы, так и с целью профилактики возникновения новых меланом или иных злокачественных новообразований кожи рекомендуется избегать солнечных ожогов или действия искусственного ультрафиолета [601-605].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
Диспансерное наблюдение.
Диспансерному наблюдению подлежат взрослые с онкологическими заболеваниями, включенными в рубрики С00-D09 МКБ-10.
Диспансерное наблюдение организуется в центре амбулаторной онкологической помощи, либо в первичном онкологическом кабинете медицинской организации, онкологическом диспансере (онкологической больнице) или иных медицинских организациях, оказывающих медицинскую помощь больным с онкологическими заболеваниями.
Комментарии: на сегодняшний день нет единого мнения относительно частоты и интенсивности наблюдения за пациентами с меланомой кожи. Целями наблюдения за пациентами следует считать раннее выявление рецидива заболевания (в особенности отдаленных метастазов), ранее выявление 2-х опухолей (в частности, новых меланом), а также психосоциальную поддержку пациентов.
- В целях снижения риска возникновения как первичной меланомы, так и с целью профилактики возникновения новых меланом или иных злокачественных новообразований кожи рекомендуется избегать солнечных ожогов или действия искусственного ультрафиолета [601-605].
Уровень убедительности рекомендаций – B (уровень достоверности доказательств – 2).
- Всем пациентам с ранее установленным диагнозом «меланома кожи» рекомендуется проводить регулярное самообследование кожных покровов и периферических лимфатических узлов и своевременно обращаться к врачу при выявлении каких-либо отклонений [606-608].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3).
В таблице 21 представлен рекомендуемый в рамках диспансерного наблюдения график обследований пациента с ранее установленным диагнозом, составленный на основании рекомендаций, данных в разделе «Диагностика» и на рисках возникновения прогрессирования болезни.
Таблица 21.
График обследований пациентов с меланомой кожи.
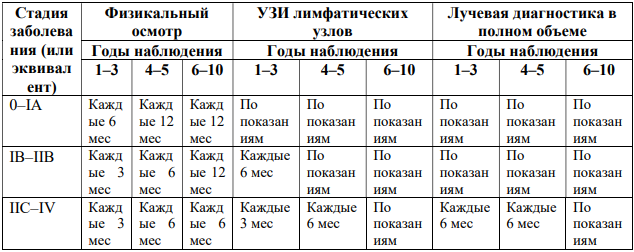
1. Наблюдение за пациентами с очень низким риском прогрессирования заболевания (стадия 0–IA).
- Рекомендованы физикальные осмотры с тщательной оценкой состояния кожных покровов и периферических лимфатических узлов каждые 6 месяцев в течение 3 лет, затем ежегодно 10 лет наблюдения. Проведение инструментального обследования рекомендуется только по показаниям – в соответствии с рекомендациями, данными в подразделе «Инструментальные диагностические исследования» [54,609].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5).
2. Пациенты с низким риском прогрессирования (IB–IIB стадии).
- Рекомендованы физикальные осмотры с тщательной оценкой состояния кожных покровов и периферических лимфатических узлов каждые 6 месяцев в течение 5 лет, затем ежегодно 10 лет наблюдения, УЗИ регионарных лимфатических узлов в течение 3 лет [54,609].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств –5).
3. Пациенты с высоким риском прогрессирования заболевания (IIC–III стадии и IV стадия после удаления солитарных метастазов).
- Рекомендованы физикальные осмотры с тщательной оценкой состояния кожных покровов и периферических лимфатических узлов каждые 3 месяца в течение 3 лет, затем каждые 6 месяцев до 10 лет наблюдения, УЗИ регионарных лимфатических узлов каждые 3 месяца в течение 3 лет, затем каждые 6 месяцев до 10 лет наблюдения, лучевая диагностика (КТ органов грудной клетки, КТ или МРТ органов брюшной полости и малого таза с в/в контрастированием или ПЭТ/КТ в режиме всего тела с фтордезоксиглюкозой) каждые 6 месяцев до 5 лет наблюдения [126,127,610].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств ––3).
- У пациентов с впервые выявленными отдаленными метастазами рекомендуется выполнение МРТ головного мозга с в/в контрастированием для исключения метастатического поражения головного мозга [128,136-138,140].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
- Рекомендуется семейное генетическое консультирование при FAMMМ-синдроме (синдром семейных множественных атипичных невусов и меланомы), пигментной ксеродерме, нейрокожном меланозе [611-617].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
Информация
Источники и литература
-
Клинические рекомендации Ассоциации онкологов России
- Клинические рекомендации Ассоциации онкологов России - 1. Clark W. H., Jr., Elder D. E., Guerry D. t., Epstein M. N., Greene M. H., Van Horn M. A study of tumor progression: the precursor lesions of superficial spreading and nodular melanoma // Hum Pathol. ‒ 1984. ‒ T. 15, № 12. ‒ C. 1147-65. 2. Plonka P. M., Passeron T., Brenner M., Tobin D. J., Shibahara S., Thomas A., Slominski A., Kadekaro A. L., Hershkovitz D., Peters E., Nordlund J. J., Abdel-Malek Z., Takeda K., Paus R., Ortonne J. P., Hearing V. J., Schallreuter K. U. What are melanocytes really doing all day long...? // Exp Dermatol. ‒ 2009. ‒ T. 18, № 9. ‒ C. 799-819. 3. Fitzpatrick T. B. The validity and practicality of sun-reactive skin types I through VI // Arch Dermatol. ‒ 1988. ‒ T. 124, № 6. ‒ C. 869-71. 4. Dubin N., Pasternack B. S., Moseson M. Simultaneous assessment of risk factors for malignant melanoma and non-melanoma skin lesions, with emphasis on sun exposure and related variables // Int J Epidemiol. ‒ 1990. ‒ T. 19, № 4. ‒ C. 811-9. 5. Carli P., Biggeri A., Nardini P., De Giorgi V., Giannotti B. Sun exposure and large numbers of common and atypical melanocytic naevi: an analytical study in a southern European population // Br J Dermatol. ‒ 1998. ‒ T. 138, № 3. ‒ C. 422-5. 6. Elwood J. M., Koh H. K. Etiology, epidemiology, risk factors, and public health issues of melanoma // Curr Opin Oncol. ‒ 1994. ‒ T. 6, № 2. ‒ C. 179-87. 7. Anna B., Blazej Z., Jacqueline G., Andrew C. J., Jeffrey R., Andrzej S. Mechanism of UV-related carcinogenesis and its contribution to nevi/melanoma // Expert Rev Dermatol. ‒ 2007. ‒ T. 2, № 4. ‒ C. 451-469. 8. Lotze T. M., Dallal R. M., Kirkwood J. M., Flickinger J. C. Cutaneous Melanoma // Cancer: Principles and Practice of Oncology 6th edition / Devita V. T. и др.Lippincott Williams & Wilkins. 9. Whiteman D. C., Pavan W. J., Bastian B. C. The melanomas: a synthesis of epidemiological, clinical, histopathological, genetic, and biological aspects, supporting distinct subtypes, causal pathways, and cells of origin // Pigment Cell Melanoma Res. ‒ 2011. ‒ T. 24, № 5. ‒ C. 879-97. 10. Mihajlovic M., Vlajkovic S., Jovanovic P., Stefanovic V. Primary mucosal melanomas: a comprehensive review // Int J Clin Exp Pathol. ‒ 2012. ‒ T. 5, № 8. ‒ C. 739-53. 11. Mahendraraj K., Lau C. S., Lee I., Chamberlain R. S. Trends in incidence, survival, and management of uveal melanoma: a population-based study of 7,516 patients from the Surveillance, Epidemiology, and End Results database (1973-2012) // Clin Ophthalmol. ‒ 2016. ‒ T. 10. ‒ C. 2113-2119. 12. Seddon J., Gragoudas E., Egan K., Polivogianis L., Finn S., Albert D. Standardized data collection and coding in eye disease epidemiology: the Uveal Melanoma Data System // Ophthalmic Surg. ‒ 1991. ‒ T. 22, № 3. ‒ C. 127-36. 13. Pappo A. S. Melanoma in children and adolescents // Eur J Cancer. ‒ 2003. ‒ T. 39, № 18. ‒ C. 2651-61. 14. Cordoro K. M., Gupta D., Frieden I. J., McCalmont T., Kashani-Sabet M. Pediatric melanoma: results of a large cohort study and proposal for modified ABCD detection criteria for children // J Am Acad Dermatol. ‒ 2013. ‒ T. 68, № 6. ‒ C. 913-25. 15. Дорошенко М. Б., Утяшев И. А., Демидов Л. В., Алиев М. Д. Клинические и биологические особенности гигантских врожденных невусов у детей // Педиатрия. ‒ 2016. ‒ T. 95, № 4. ‒ C. 50-56. 16. Austin M. T., Xing Y., Hayes-Jordan A. A., Lally K. P., Cormier J. N. Melanoma incidence rises for children and adolescents: an epidemiologic review of pediatric melanoma in the United States // J Pediatr Surg. ‒ 2013. ‒ T. 48, № 11. ‒ C. 2207-13. 17. Youl P., Aitken J., Hayward N., Hogg D., Liu L., Lassam N., Martin N., Green A. Melanoma in adolescents: a case-control study of risk factors in Queensland, Australia // Int J Cancer. ‒ 2002. ‒ T. 98, № 1. ‒ C. 92-8. 18. Whiteman D. C., Valery P., McWhirter W., Green A. C. Risk factors for childhood melanoma in Queensland, Australia // Int J Cancer. ‒ 1997. ‒ T. 70, № 1. ‒ C. 26-31. 19. Merkel E. A., Mohan L. S., Shi K., Panah E., Zhang B., Gerami P. Paediatric melanoma: clinical update, genetic basis, and advances in diagnosis // Lancet Child Adolesc Health. ‒ 2019. ‒ T. 3, № 9. ‒ C. 646-654. 20. Pappo A. S. Pediatric melanoma: the whole (genome) story // Am Soc Clin Oncol Educ Book. ‒ 2014.10.14694/EdBook_AM.2014.34.e432. ‒ C. e432-5. 21. Krengel S., Scope A., Dusza S. W., Vonthein R., Marghoob A. A. New recommendations for the categorization of cutaneous features of congenital melanocytic nevi // J Am Acad Dermatol. ‒ 2013. ‒ T. 68, № 3. ‒ C. 441-51. 22. Злокачественные новообразования в России в 2020 году (заболеваемость и смертность) /. ‒ Москва: "МНИОИ им. П.А. Герцена" − филиал ФГБУ «НМИЦ радиологии» Минздрава России. 23. России,, 2021. ‒ 252 с. 24. Состояние онкологической помощи населению России в 2019 году. /. ‒ Москва: "МНИОИ им. П.А. Герцена" − филиал ФГБУ «НМИЦ радиологии» 2020. ‒ 239 с. 25. Barr R. D., Ries L. A., Lewis D. R., Harlan L. C., Keegan T. H., Pollock B. H., Bleyer W. A., Adolescent U. S. N. C. I. S. o., Young Adult Oncology Epidemiology Working G. Incidence and incidence trends of the most frequent cancers in adolescent and young adult Americans, including "nonmalignant/noninvasive" tumors // Cancer. ‒ 2016. ‒ T. 122, № 7. ‒ C. 1000-8. 26. Group U. S. C. S. W. United States Cancer Statistics: 1999–2013 Incidence and Mortality Web-based Report. // Atlanta: U.S. Department of Health and Human Services, Centers for Disease Control and Prevention and National Cancer Institute ‒2016 (дата обращения: August 1, 2016). 27. Lange J. R., Palis B. E., Chang D. C., Soong S. J., Balch C. M. Melanoma in children and teenagers: an analysis of patients from the National Cancer Data Base // J Clin Oncol. ‒ 2007. ‒ T. 25, № 11. ‒ C. 1363-8. 28. Strouse J. J., Fears T. R., Tucker M. A., Wayne A. S. Pediatric melanoma: risk factor and survival analysis of the surveillance, epidemiology and end results database // J Clin Oncol. ‒ 2005. ‒ T. 23, № 21. ‒ C. 4735-41. 29. Siegel D. A., King J., Tai E., Buchanan N., Ajani U. A., Li J. Cancer incidence rates and trends among children and adolescents in the United States, 2001-2009 // Pediatrics. ‒ 2014. ‒ T. 134, № 4. ‒ C. e945-55. 30. Campbell L. B., Kreicher K. L., Gittleman H. R., Strodtbeck K., Barnholtz-Sloan J., Bordeaux J. S. Melanoma Incidence in Children and Adolescents: Decreasing Trends in the United States // J Pediatr. ‒ 2015. ‒ T. 166, № 6. ‒ C. 1505-13. 31. Noone A. M., Howlader N., Krapcho M., Miller D., Brest A., Yu M., Ruhl J., Tatalovich Z., Mariotto A., Lewis D. R., Chen H. S., Feuer E. J., Cronin K. A. SEER Cancer Statistics Review, 1975-2015 // Bethesda, MD. ‒ 2018. 32. Состояние онкологической помощи населению России в 2022 году /. ‒ Москва: "МНИОИ им. П.А. Герцена" − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2023. ‒ 239 с. 33. Злокачественные новообразования в России в 2022 году (заболеваемость и смертность) /. ‒ Москва: "МНИОИ им. П.А. Герцена" − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2023. ‒ 275 с. 34. International Statistical Classification of Diseases and Related Health Problems 10th Revision. ‒ 2016. ‒ URL: http://apps.who.int/classifications/icd10/browse/2016/en (дата обращения: 08JAN2017.2017). 35. Состояние онкологической помощи населению России в 2017 году /. ‒ М.: "МНИОИ им. П.А. Герцена" − филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018. 36. Gershenwald J., Scolyer R., Hess K., al. e. Melanoma of the skin // AJCC Cancer Staging Manual 8th ed / Amin M. и др. ‒ New York: Springer International Publishing, 2017. ‒ C. 563-585. 37. Barr R. G. Foreword to the Second Set of WFUMB Guidelines and Recommendations on the Clinical Use of Ultrasound Elastography // Ultrasound Med Biol. ‒ 2017. ‒ T. 43, № 1. ‒ C. 1-3. 38. Синельников И. Е., Барышников К. А., Демидов Л. В. КЛИНИЧЕСКАЯ ДИАГНОСТИКА МЕЛАНОМЫ КОЖИ // Вестник ФГБУ «РОНЦ им. Н.Н. Блохина». ‒ 2017. ‒ T. 28, № 1-2. ‒ C. 68-73. 39. Grob J. J., Bonerandi J. J. The 'ugly duckling' sign: identification of the common characteristics of nevi in an individual as a basis for melanoma screening // Arch Dermatol. ‒ 1998. ‒ T. 134, № 1. ‒ C. 103-4. 40. Garbe C., Peris K., Hauschild A., Saiag P., Middleton M., Bastholt L., Grob J. J., Malvehy J., Newton-Bishop J., Stratigos A. J., Pehamberger H., Eggermont A. M., European Dermatology F., European Association of D.-O., European Organisation for R., Treatment of C. Diagnosis and treatment of melanoma. European consensus-based interdisciplinary guideline - Update 2016 // Eur J Cancer. ‒ 2016. ‒ T. 63. ‒ C. 201-17. 41. Ferrari A., Bisogno G., Cecchetto G., Santinami M., Maurichi A., Bono A., Vajna De Pava M., Pierani P., Bertolini P., Rossi C. R., De Salvo G. L. Cutaneous melanoma in children and adolescents: the Italian rare tumors in pediatric age project experience // J Pediatr. ‒ 2014. ‒ T. 164, № 2. ‒ C. 376-82 e1-2. 42. Rajput A., Faizi S. A., Nir I., Morris K. T., Fahy B., Russell J., Wiggins C. Pediatric melanoma in New Mexico American Indians, Hispanics, and non-Hispanic whites, 1981-2009 // Am J Surg. ‒ 2014. ‒ T. 207, № 3. ‒ C. 412-6; discussion 416. 43. Mitkov M., Chrest M., Diehl N. N., Heckman M. G., Tollefson M., Jambusaria-Pahlajani A. Pediatric melanomas often mimic benign skin lesions: A retrospective study // J Am Acad Dermatol. ‒ 2016. ‒ T. 75, № 4. ‒ C. 706-711 e4. 44. Silverberg N., McCuaig C. Melanoma in Childhood: Changing Our Mind-set // Cutis. ‒ 2013. ‒ T. 92. ‒ C. 217-8. 45. Berk D. R., LaBuz E., Dadras S. S., Johnson D. L., Swetter S. M. Melanoma and melanocytic tumors of uncertain malignant potential in children, adolescents and young adults--the Stanford experience 1995-2008 // Pediatr Dermatol. ‒ 2010. ‒ T. 27, № 3. ‒ C. 244-54. 46. Massi D., Tomasini C., Senetta R., Paglierani M., Salvianti F., Errico M. E., Donofrio V., Collini P., Tragni G., Sementa A. R., Rongioletti F., Boldrini R., Ferrari A., Gambini C., Montesco M. C. Atypical Spitz tumors in patients younger than 18 years // J Am Acad Dermatol. ‒ 2015. ‒ T. 72, № 1. ‒ C. 37-46. 47. Zhao G., Lee K. C., Peacock S., Reisch L. M., Knezevich S. R., Elder D. E., Piepkorn M. W., Elmore J. G., Barnhill R. L. The utilization of spitz-related nomenclature in the histological interpretation of cutaneous melanocytic lesions by practicing pathologists: results from the M-Path study // J Cutan Pathol. ‒ 2017. ‒ T. 44, № 1. ‒ C. 5-14. 48. Tlougan B. E., Orlow S. J., Schaffer J. V. Spitz nevi: beliefs, behaviors, and experiences of pediatric dermatologists // JAMA Dermatol. ‒ 2013. ‒ T. 149, № 3. ‒ C. 283-91. 49. Marghoob A. A. Practice gaps. Underuse of dermoscopy in assessing Spitz nevi in children : comment on "Spitz nevi: beliefs, behaviors, and experiences of pediatric dermatologists" // JAMA Dermatol. ‒ 2013. ‒ T. 149, № 3. ‒ C. 291-2. 50. Chaithirayanon S., Chunharas A. A survey of birthmarks and cutaneous skin lesions in newborns // J Med Assoc Thai. ‒ 2013. ‒ T. 96 Suppl 1. ‒ C. S49-53. 51. Haveri F. T., Inamadar A. C. A cross-sectional prospective study of cutaneous lesions in newborn // ISRN Dermatol. ‒ 2014. ‒ T. 2014. ‒ C. 360590. 52. Wong J. R., Harris J. K., Rodriguez-Galindo C., Johnson K. J. Incidence of childhood and adolescent melanoma in the United States: 1973-2009 // Pediatrics. ‒ 2013. ‒ T. 131, № 5. ‒ C. 846-54. 53. Nikfarjam J., Chambers E. Congenital Melanocytic Nevi and the Risk of Malignant Melanoma: Establishing a Guideline for Primary-Care Physicians // Einstein Journal of Biology and Medicine. ‒ 2016. ‒ T. 27. ‒ C. 59. 54. Yun S. J., Kwon O. S., Han J. H., Kweon S. S., Lee M. W., Lee D. Y., Kim M. B., Kim Y. C., Yoon T. Y., Chung K. Y., Kim I. H., Kim K. H., Suh K. S., Lee S. J., Seo Y. J., Kim K. H., Park H. J., Roh M. R., Ahn K. J., Yoon T. J., Kim M. H., Li K. S., Park J. S., Shin B. S., Ko J. Y., Ahn H. H., Kim H. J., Park S. D., Jang S. J., Won Y. H. Clinical characteristics and risk of melanoma development from giant congenital melanocytic naevi in Korea: a nationwide retrospective study // Br J Dermatol. ‒ 2012. ‒ T. 166, № 1. ‒ C. 115-23. 55. Coit D. G., Thompson J. A., Albertini M., Algazi A., Andtbacka R., Bichakjian C., Carson W. E., 3rd, Daniels G. A., DiMaio D., Fields R. C., Fleming M. D., Gastman B., Gonzalez R., Guild V., Johnson D., Joseph R. W., Lange J. R., Martini M. C., Margolin K., Olszanski A. J., Ott P. A., Gupta A., Ross M. I., Salama A. K., Skitzki J., Sosman J. A., Swetter S. M., Tanabe K. K., Torres-Roca J. F., Urist M., Engh A., McMillian N. NCCN Clinical Practice Guidelines in Oncology. Melanoma. Version 3.2018. ‒ National Comprehensive Cancer Network, Inc, 2018. ‒ Pages p. ‒. 56. Rat C., Grimault C., Quereux G., Dagorne M., Gaultier A., Khammari A., Dreno B., Nguyen J. M. Proposal for an annual skin examination by a general practitioner for patients at high risk for melanoma: a French cohort study // BMJ Open. ‒ 2015. ‒ T. 5, № 7. ‒ C. e007471. 57. Abbasi N. R., Shaw H. M., Rigel D. S., Friedman R. J., McCarthy W. H., Osman I., Kopf A. W., Polsky D. Early diagnosis of cutaneous melanoma: revisiting the ABCD criteria // JAMA. ‒ 2004. ‒ T. 292, № 22. ‒ C. 2771-6. 58. Fang P., Jiang W., Allen P., Glitza I., Guha N., Hwu P., Ghia A., Phan J., Mahajan A., Tawbi H., Li J. Radiation necrosis with stereotactic radiosurgery combined with CTLA-4 blockade and PD-1 inhibition for treatment of intracranial disease in metastatic melanoma // J Neurooncol. ‒ 2017. ‒ T. 133, № 3. ‒ C. 595-602. 59. Grange F. [Multiple primary melanoma and familial melanoma. Risk evaluation and screening tests. How to evaluate the risk of developing a second melanoma? In what family? Should screening methods be implemented? Which ones and why?] // Ann Dermatol Venereol. ‒ 1995. ‒ T. 122, № 5. ‒ C. 365-71. 60. Claeson M., Holmstrom P., Hallberg S., Gillstedt M., Gonzalez H., Wennberg A. M., Paoli J. Multiple Primary Melanomas: A Common Occurrence in Western Sweden // Acta Derm Venereol. ‒ 2016.10.2340/00015555-2598. 61. Moore M. M., Geller A. C., Warton E. M., Schwalbe J., Asgari M. M. Multiple primary melanomas among 16,570 patients with melanoma diagnosed at Kaiser Permanente Northern California, 1996 to 2011 // J Am Acad Dermatol. ‒ 2015. ‒ T. 73, № 4. ‒ C. 630-6. 62. De Giorgi V., Savarese I., D'Errico A., Gori A., Papi F., Colombino M., Sini M. C., Grazzini M., Stanganelli I., Rossari S., Covarelli P., Massi D., Palmieri G. Epidemiological features and prognostic parameters of multiple primary melanomas in CDKN2A-mutations patients // Pigment Cell Melanoma Res. ‒ 2015. ‒ T. 28, № 6. ‒ C. 747-51. 63. Watts C. G., Dieng M., Morton R. L., Mann G. J., Menzies S. W., Cust A. E. Clinical practice guidelines for identification, screening and follow-up of individuals at high risk of primary cutaneous melanoma: a systematic review // Br J Dermatol. ‒ 2015. ‒ T. 172, № 1. ‒ C. 33-47. 64. Dinnes J., Deeks J. J., Grainge M. J., Chuchu N., Ferrante di Ruffano L., Matin R. N., Thomson D. R., Wong K. Y., Aldridge R. B., Abbott R., et al. Visual inspection for diagnosing cutaneous melanoma in adults // Cochrane Database of Systematic Reviews. ‒ 2018.10.1002/14651858.CD013194 № 12. 65. Nino M., Brunetti B., Delfino S., Brunetti B., Panariello L., Russo D. Spitz nevus: follow-up study of 8 cases of childhood starburst type and proposal for management // Dermatology. ‒ 2009. ‒ T. 218, № 1. ‒ C. 48-51. 66. Pizzichetta M. A., Talamini R., Marghoob A. A., Soyer H. P., Argenziano G., Bono R., Corradin M. T., De Giorgi V., Gonzalez M. A., Kolm I., Kopf A. W., Malvehy J., Nami N., Oliviero M., Pellacani G., Puig S., Rabinovitz H., Rubegni P., Seidenari S., Stanganelli I., Veronesi A., Zalaudek I., Zampieri P., Menzies S. W. Negative pigment network: an additional dermoscopic feature for the diagnosis of melanoma // J Am Acad Dermatol. ‒ 2013. ‒ T. 68, № 4. ‒ C. 552-559. 67. Zalaudek I., Kittler H., Hofmann-Wellenhof R., Kreusch J., Longo C., Malvehy J., Puig S., Moscarella E., Piana S., Massone C., Cota C., Ferrara G., Fleischer M., Argenziano G. "White" network in Spitz nevi and early melanomas lacking significant pigmentation // J Am Acad Dermatol. ‒ 2013. ‒ T. 69, № 1. ‒ C. 56-60.
Информация
Список сокращений
AJCC – Американский объединенный комитет по раку
ASCO – Американское общество клинической онкологии
SNO – Общество нейроонкологии
ASTRO – Американское общество радиационной онкологии
CTCAE – Общие терминологические критерии неблагоприятных эффектов
ECOG – Восточная объединенная группа онкологов
GPA – шкала поэтапной прогностической оценки
МАРК - митоген-активируемый протеинкиназный путь
RECIST – Критерии ответа солидных опухолей на терапию
UICC – Международный союз по борьбе с раком
в/в – внутривенный
ВОЗ – Всемирная организация здравоохранения
Гр – Грей
ИПК – ингибиторы протеинкиназы (код АТХ-классификации: L01E)
ИПИ 3/ НИВО 1 – Ипилимумаб** 3 мг/ кг (в один день с ниволумабом** 1 мг/ кг)
ИПИ 1/НИВО 3 – Ипилимумаб** 1 мг/ кг (в один день с ниволумабом** 3 мг/ кг)
ИПИ 1/ПЕМБРО 200 – Ипилимумаб** 1 мг/ кг (в один день с пембролизумабом** 200 мг)
КТ – компьютерная томография
ЛФК – лечебная физкультура
МКА – моноклональные антитела (код АТХ-классификации: L01XС)
МКБ-10 – Международная классификация болезней 10-го пересмотра
МРТ – магнитно-резонансная томография
ПЭТ/КТ – позитронная эмиссионная томография, совмещенная с компьютерной томографией
РОД – разовая очаговая доза
СОД – суммарная очаговая доза
СРТ – стереотаксическая радиотерапия
СРХ – стереотаксическая радиохирургия
УЗИ – ультразвуковое исследование
ОВГМ – облучение всего головного мозга
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
BRAF - человеческий ген (протоонкоген), который кодирует серин-треониновую протеинкиназу BRAF.
Ингибиторы BRAF (ингибиторы протеинкиназы BRAF, ИПК BRAF) - лекарственные средства, блокирующие активность серин-треониновую протеинкиназы BRAF (L01EC Ингибиторы B-Raf серин-треонинкиназы (BRAF))
KIT - человеческий ген, кодирующий рецептор фактора роста тучных и стволовых клеток (SCFR) или белковая тирозинкиназа KIT (CD117) - рецепторная тирозинкиназа, продукт гена KIT.
Ингибиторы KIT (ингибиторы протеинкиназы KIT, ИПК KIT) - лекарственные средства, блокирующие активность рецептора KIT (L01EA Ингибиторы BCR-ABL-тирозинкиназы).
MEK - внутриклеточная сигнальная молекула, протеинкиназа, также известная как MAPK/ERK-киназа.
Ингибиторы MEK (ингибиторы протеинкиназы MEK, ИПК MEK) - лекарственные средства, блокирующие активность протеинкиназы MEK (L01EE Ингибиторы митоген-активированной протеинкиназы (MEK)).
CTLA4 - антиген цитотоксических Т-лимфоцитов 4-го типа, также известен как СD152. Выполняет функции рецептора, лигандом служит молекула B7.1 или B7.2.
PD1 - рецептор программируемой смерти 1.
Ингибитор CTLA4 ( Ингибитор CTLA4 (также в тексте МКА-блокатор CTLA4, блокатор CTLA4, анти-CTLA4 ) - L01FX Прочие моноклональные антитела) - моноклональное антитело, блокирующее тормозные сигналы каскада CTLA4.
Блокатор PD1 (также в тексте МКА-блокатор PD1, анти-PD1, МКА-блокатор aPD1, МКА-блокаторами PD1 / PDl1) - L01FF Ингибиторы PD-1 / PDL-1 (белок запрограммированной гибели клеток 1 / лиганд запрограммированной смерти 1) - моноклональное антитело, блокирующее взаимодействие между рецептором программируемой смерти (PD-1) и его лигандами.
Второй этап реабилитации - реабилитация в стационарных условиях медицинских организаций (реабилитационных центров, отделений реабилитации), в ранний восстановительный период течения заболевания, поздний реабилитационный период, период остаточных явлений течения заболевания.
Врожденные меланоцитарные невусы (ВМН) представляют собой доброкачественную пролиферацию меланоцитов, происходящих из нервного гребня и возникающую в утробе матери. Основным критерием для классификации ВМН является их размер. Поскольку размер ВМН увеличивается в детском возрасте пропорционально росту ребенка, ВМН обычно классифицируют в соответствии с максимальным размером, которого, как ожидается, невус достигнет к взрослому возрасту. Большие размеры ВМН связаны с большим риском развития меланомы кожи.
Инцизионная панч-биопсия - метод получения образца тканей кожи на всю его толщину, при этом латеральные края резекции могут содержать элементы опухоли (или невуса). Выполняется при помощи специальной панч-иглы (диаметром от 1 до 5 мм). Применяется в исключительных случаях, когда эксцизионная биопсия не может быть применена.
Меланоцитарный невус - доброкачественное новообразование кожи, патогенез которого лежит в дефекте развития эпидермальных и дермальных меланоцитов, синтезирующих пигмент меланин. Основные различия между обычными меланоцитами, которые находятся в базальном слое эпидермиса и клетками невуса, заключаются в том, что клетки невуса группируются наподобие гнезд либо на уровне эпидермиса, либо в дерме, тогда как эпидермальные меланоциты равномерно распределяются между базальными кератиноцитами как самостоятельные единицы. Клетки невуса не имеют дендритных отростков.
Первый этап реабилитации - реабилитация в период специализированного лечения основного заболевания (включая хирургическое лечение/химиотерапию/лучевую терапию) в отделениях медицинских организаций по профилю основного заболевания.
Плоскостная (бритвенная) резекция новообразований кожи - способ удаления экзофитных и плоских новообразований кожи в плоскости кожи при помощи бритвенного лезвия или скальпеля. В случае подозрений на меланому кожи является субоптимальным методом диагностики, так как не позволяет гарантированно определить толщину новообразования и тем самым правильно стадировать заболевание.
Предреабилитация (prehabilitation) - реабилитация с момента постановки диагноза до начала лечения (хирургического лечения/химиотерапии/лучевой терапии).
Радиологическая оценка ответа на лечение - оценка ответа на лечение с использованием результатов радиологических исследований (компьютерной томографии, магнитно-резонансной томографии, позитронно-эмиссионной томографии, рентгенографии и т.д.) в сравнении с результатами ранее проведенных радиологических исследований в соответствии с одной или несколькими системами оценки ответа (такими как RECIST или ВОЗ).
Резектабельная меланома кожи и/или резектабельные метастазы меланомы кожи - меланома кожи или ее метастазы (как правило, метастазы в регионарные лимфатические узлы), которые могут быть подвергнуты радикальному хирургическому удалению R0. На оценку резектабельности могут влиять такие факторы, как объем (количество и размеры) метастатического поражения лимфатических узлов, соотношение с магистральными сосудами, наличие сателлитов и транзитных метастазов, лимфангоита и др. Оценка резектабельности процесса весьма субъективна и может варьировать от учреждения к учреждению и от хирурга к хирургу.
Третий этап реабилитации - реабилитация в ранний и поздний реабилитационный периоды, период остаточных явлений течения заболевания в отделениях (кабинетах) реабилитации, физиотерапии, лечебной физкультуры, рефлексотерапии, мануальной терапии, психотерапии, медицинской психологии, кабинетах логопеда (учителя-дефектолога), оказывающих медицинскую помощь в амбулаторных условиях, дневных стационарах, а также выездными бригадами на дому (в том числе в условиях санаторно-курортных организаций).
Эквивалент клинической стадии - оценка распространенности болезни в соответствии с международной классификацией UICC/AJCC TNM безотносительно анамнеза течения болезни. Иначе говоря, поражение регионарных лимфоузлов является эквивалентом III стадии (IIIA, B, C, D - соответственно распространенности), поражение висцеральных органов или нерегионарных лимфоузлов - эквивалент IV стадии (IV M1a - кожа или нерегионарные лимфоузлы, M1b - легких, M1c - других внутренних органов, кроме легких, M1d - поражение ЦНС). Здесь и далее в рекомендации подходы к диагностике и лечению пациентов будут ориентированы именно на эквивалент стадии (т.е. актуальную в настоящий момент распространенность болезни).
Эксцизионная биопсия новообразования кожи - метод получения образца тканей кожи, при котором новообразование удаляется тотально (целиком) с небольшим (1-3 мм) захватом прилежащих здоровых тканей. Такой способ получения морфологического материала является предпочтительным при подозрении на меланому кожи.
Эпилюминесцентная микроскопия (дерматоскопия) - неинвазивная техника исследования кожи при помощи дерматоскопа, который обычно состоит из лупы (×10), неполяризованного источника света, прозрачной пластины и жидкой среды между инструментом и кожей. Современные дерматоскопы могут работать с использованием жидкой среды или вместо этого применяют поляризованный свет, чтобы компенсировать отражения поверхности кожи. Когда получаемые изображения или видеоклипы записываются либо обрабатываются цифровым способом, прибор можно называть цифровым эпилюминесцентным дерматоскопом.
Также в таблице А3-1 приведены термины, описывающие процедуры в клинической рекомендации и возможные (наиболее близкие) термины из действующей номенклатуры медицинских услуг.
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Известные прогностические факторы при меланоме кожи, которые рекомендуется регистрировать, приведены в табл. 22.
Таблица 22.
Прогностические факторы при меланоме кожи (по классификации TNM 8-го пересмотра) [359].
|
Категория факторов
|
Прогностические факторы
|
||
|---|---|---|---|
|
Ассоциированные с опухолью
|
Ассоциированные с пациентом
|
Ассоциированные с окружающей средой
|
|
|
Необходимые для оценки
|
Толщина опухоли, митотический индекс, изъязвление, распространенность метастатической болезни
|
Лимфоцитарный инфильтрат, регрессия
|
Прием лекарственных препаратов, особенно иммуносупрессоров
|
|
Дополнительные
|
Лимфоваскулярная инвазия, периневральное распространение
|
Локализация первичной опухоли, семейная история, иммунодефицит, пол, возраст (у женщин и пациентов молодого возраста более благоприятный прогноз)
|
Солнечные ожоги в анамнезе, посещение соляриев
|
|
Новые и перспективные
|
Молекулярные: мутации, экспрессия генов, протеомика, микроРНК
|
Иммуногенетика, другие характеристики иммунного ответа пациента
|
|
Критерии оценки качества медицинской помощи
Критерии оценки качества медицинской помощи приведены в табл. 23.
Таблица 23.
Критерии оценки качества медицинской помощи.
|
№ п/п
|
Критерии качества
|
Оценка выполнения
|
|---|---|---|
|
1.
|
Выполнено УЗИ регионарных лимфатических узлов (при установлении диагноза для всех стадий)
|
Да/Нет
|
|
2.
|
Выполнено УЗИ органов малого таза и/или КТ органов малого таза и/или МРТ органов малого таза (при установлении диагноза для стадии IIА–IV)
|
Да/Нет
|
|
3.
|
Выполнена рентгенография органов грудной клетки и/или КТ органов грудной клетки (при установлении диагноза для стадии IIА–IV)
|
Да/Нет
|
|
4.
|
Выполнено УЗИ органов брюшной полости (комплексное) и/или КТ органов брюшной полости, и/или МРТ органов брюшной полости (при установлении диагноза для стадии IIB–IV)
|
Да/Нет
|
|
5.
|
Выполнен хирургический отступ не менее 1 см и не более 2 см при первичной инвазивной меланоме кожи (при хирургическом вмешательстве)
|
Да/Нет
|
|
6.
|
Дана рекомендация по проведению биопсии сторожевого лимфатического узла пациентам с толщиной меланомы кожи по Бреслоу более 0,8 мм
|
Да/Нет
|
|
7.
|
Выполнена химиотерапия и/или иммунотерапия, и/или таргетная терапия и/или лучевая терапия при наличии морфологической верификации диагноза (при наличии показаний к проведению химиотерапии и/или иммунотерапии и/или таргетной терапии, и/или лучевой терапии)
|
Да/Нет
|
|
8.
|
Выполнена дозиметрическая верификация рассчитанного плана (при лучевой терапии)
|
Да/Нет
|
|
9.
|
Выполнена МРТ головного мозга с внутривенным контрастированием при впервые выявленной IV стадии не позднее 30 дней от момента установления диагноза метастатической меланомы (при отсутствии медицинских противопоказаний)
|
Да/Нет
|
|
10.
|
Выполнена морфологическая верификация диагноза до начала лечения, за исключением случаев явной клинической картины опухоли кожи и случаев экстренной хирургии
|
Да/Нет
|
|
11.
|
Выполнена оценка риска прогрессирования у пациентов с I–III стадией заболевания в соответствии с классификацией AJCC/UICC TNM 8
|
Да/Нет
|
|
12.
|
Сделано назначение на молекулярно-генетическое исследование мутаций в гене BRAF в биопсийном материале (при отрицательном результате – молекулярно-генетическое исследование мутаций в гене KIT в биопсийном (операционном) материале) в случае метастатической болезни (III и IV стадия или эквивалент), если ранее тест не выполнялся
|
Да/Нет
|
|
13.
|
Даны рекомендации по проведению адъювантной терапии у пациентов после хирургического лечения по поводу меланомы кожи высокого риска в соответствии с настоящими рекомендациями
|
Да/Нет
|
|
14.
|
Наличие консультации врача-онколога, врача-нейрохирурга и/или врача-радиотерапевта у пациента с метастатическим поражением головного мозга
|
Да/Нет
|
|
15.
|
Наличие назначений на терапию МКА-блокаторами PD1 и/или CTLA4, ИПК BRAF или BRAF в комбинации с ИПК MEK при отсутствии противопоказаний у пациентов с метастатической меланомой или нерезектабельной и наличием мутации V600 в гене BRAF в соответствии с настоящими рекомендациями
|
Да/Нет
|
|
16.
|
Наличие назначений на терапию МКА-блокаторами PD1 и/или CTLA4 при отсутствии противопоказаний у пациентов с метастатической или нерезектабельной меланомой без мутации V600 в гене BRAF
|
Да/Нет
|
|
17.
|
Выполнение патолого-анатомического исследования биопсийного или операционного материала с указанием толщины первичной опухоли по Бреслоу, наличие или отсутствие изъязвления, оценки расстояния от всех (латеральных и глубокого) краев резекции до ближайшего края опухоли (у пациентов, получивших хирургическое лечение по поводу первичной меланомы кожи)
|
Да/Нет
|
|
18.
|
Выполнение патолого-анатомического исследования биопсийного или операционного материала с указанием количества удаленных лимфатических узлов, количества метастатически пораженных лимфатических узлов и характера поражения метастатических узлов (конгломераты, прорастание капсулы) (у пациентов, получивших хирургическое лечение в объеме регионарной лимфаденэктомии)
|
Да/Нет
|
|
19.
|
Выполнение патолого-анатомического исследования биопсийного или операционного материала при окраске гематоксилином и эозином и иммуногистохимического исследования (при отсутствии признаков опухоли на уровне световой микроскопии) сторожевого лимфатического узла (узлов) с указанием количества удаленных лимфатических узлов, количества метастатически пораженных лимфатических узлов и характера поражения метастатических узлов (рамзера микрометастазов при их выявлении) (у пациентов, получивших хирургическое лечение в объеме биопсии сторожевого лимфатического узла (узлов))
|
Да/Нет
|
|
20.
|
Начат 1й курс системного противоопухолевого лечения (таргетной терапии, иммунотерапии, химиотерапии) не позднее 30-го дня от выявления метастатической болезни (при отсутствии противопоказаний)
|
Да/Нет
|
|
21.
|
Выполнение 1-го курса адъювантной терапии не позднее 12 нед от хирургического лечения (у пациентов, которым показано проведение адъювантной терапии, при условии отсутствия послеоперационных осложнений и отсутствия противопоказаний)
|
Да/Нет
|
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Модератор рабочей группы:
1. Самойленко И.В., к.м.н., старший научный сотрудник отделения опухолей кожи отдела лекарственного лечения ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; член правления Ассоциации специалистов по проблемам меланомы.
Рабочая группа
2. Банов С.М., д.м.н., ведущий научный сотрудник отделения радиологии и радиохирургии ФГАУ «НМИЦ Нейрохирургии им. ак. Н.Н. Бурденко» Минздрава России.
3. Белышева Т.С., д.м.н., ведущий научный сотрудник научно-консультативного отделения НИИ детской онкологии и гематологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
4. Демидов Л.В., д.м.н., профессор, заведующий отделением опухолей кожи отдела лекарственного лечения ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, председатель правления Ассоциации специалистов по проблемам меланомы.
5. Зарецкий А.Р., заведующий лабораторией молекулярной онкогенетики ФГБУ «НМИЦ акушерства, гинекологии и перинатологии им. акад. В. И. Кулакова» Минздрава России, руководитель онкологического направления Ассоциации специалистов в области молекулярной медицины, лабораторной и клинической генетики им. проф. Е. И. Шварца.
6. Зиновьев Г.В., к.м.н. заведующий отделением опухолей кожи, костей и мягких тканей ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
7. Новик А.В., д.м.н., старший научный сотрудник научного отдела онкоиммунологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, член правления Ассоциации специалистов по проблемам меланомы.
8. Орлова К.В., к.м.н., старший научный сотрудник отделения опухолей кожи отдела лекарственного лечения ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; член правления Ассоциации специалистов по проблемам меланомы.
9. Строяковский Д.Л., к.м.н., заведующий отделением химиотерапии Московской городской онкологической больницы № 62, член правления Российского общества клинической онкологии.
10. Трофимова О.П., д.м.н., ведущий научный сотрудник радиологического отделения отдела радиационной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
11. Феденко А.А., д.м.н., руководитель отдела лекарственного лечения опухолей «Московского научно-исследовательского онкологического института им. П.А. Герцена" – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
12. Харкевич Г.Ю., к.м.н., ведущий научный сотрудник отделения опухолей кожи отдела лекарственного лечения ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; член правления Ассоциации специалистов по проблемам меланомы.
13. Юрченков А.Н., к.м.н., врач-онколог отделения химиотерапии Московской городской онкологической больницы № 62.
Блок по меланоме слизистых оболочек:
1. Алиева С.Б., д.м.н., ведущий научный сотрудник отделения радиологического ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
2. Алымов Ю.В., к.м.н., врач-онколог, отделение хирургическое №11 опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, исполнительный директор Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
3. Гордеев С.С., д.м.н., доцент кафедры онкологии, радиологии и радиотерапии Тюменского Государственного Медицинского Университета, заведующий отделом планирования и координации научных исследований ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, исполнительный директор Российского общества специалистов по колоректальному раку.
Блок по ранней диагностике:
1. Гаранина О.Е., к.м.н., ассистент кафедры кожных и венерических болезней, Федеральное государственное бюджетное образовательное учреждение высшего образования «Приволжский исследовательский медицинский университет» Министерства здравоохранения Российской Федерации.
2. Кубанов А.А., д.м.н., профессор, академик РАН, президент ООО «РОДВК», директор ФГБУ «ГНЦДК» Минздрава России.
3. Дубенский В.В., к.м.н., профессор кафедры дерматовенерологии с курсом дерматовенерологии и косметологии ФДПО, интернатуры и ординатуры ФГБОУ ВО «Тверской ГМУ» Минздрава России.
4. Мордовцева В.В., д.м.н., профессор кафедры кожных и венерических болезней с курсом косметологии ФГБОУ ВО "МГУПП".
5. Шливко И. Л., д.м.н., заведующая кафедрой кожных и венерических болезней, Федеральное государственное бюджетное образовательное учреждение высшего образования «Приволжский исследовательский медицинский университет» Министерства здравоохранения Российской Федерации.
Блок по медицинской реабилитации:
1. Семиглазова Т.Ю., д.м.н., ведущий научный сотрудник научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, профессор кафедры онкологии ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России.
2. Филоненко Е.В., д.м.н., профессор, заведующая центром лазерной и фотодинамической диагностики и терапии опухолей МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России, врач-онколог.
Блок по организации медицинской помощи:
1. Варфоломеева С.Р., д.м.н., профессор, заместитель директора ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, директор НИИ детской онкологии и гематологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина», исполнительный директор Национального общества детских гематологов и онкологов.
2. Иванов С.А., д.м.н., профессор, член-корреспондент РАН, заслуженный врач РФ, директор МРНЦ им. А.Ф. Цыба — филиала ФГБУ «НМИЦ радиологии» Минздрава России, главный внештатный специалист-онколог ЦФО Минздрава России.
3. Фоменко Ю.А., к.м.н., заместитель генерального директора по клинико-экспертной работе ФГБУ "НМИЦ онкологии" Минздрава России.
4. Хайлова Ж.В., к.м.н. заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
5. Геворкян Т.Г., заместитель директора по реализации федеральных проектов ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России.
6. Комаров Ю.И., к.м.н., заместитель директора по организационно-методической работе ФГБУ «НМИЦ онкологии им. Н. Н. Петрова» Минздрава России.
Блок по сопроводительной терапии
1. Гладков О.А., профессор, д.м.н., директор медицинского центра ООО “ЭВИМЕД”.
2. Карасева В.В., д.м.н., доцент, профессор, кафедра онкологии ИНОПР ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России.
Конфликта интересов нет.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
-
врачи-онкологи;
-
врачи-хирурги;
-
врачи-радиологи;
-
врачи-генетики;
-
врачи-дерматовенерологи;
-
врачи-патологоанатомы;
-
врачи-терапевты;
-
врачи-терапевты участковые;
-
врачи общей практики (семейные врачи);
-
студенты медицинских вузов, ординаторы и аспиранты.
-
врачи-детские онкологи;
-
врачи-детские хирурги;
-
врачи-педиатры;
Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств)
|
Уровень достоверности доказательств
|
Расшифровка
|
|---|---|
|
1
|
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
|
|
2
|
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
|
|
3
|
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
Уровень достоверности доказательств
|
Расшифровка
|
|---|---|
|
1
|
Систематический обзор рандомизированных контролируемых исследований с применением метаанализа
|
|
2
|
Отдельные рандомизированные контролируемые исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных контролируемых исследований, с применением метаанализа
|
|
3
|
Нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай–контроль»
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
Уровень убедительности рекомендаций
|
Расшифровка
|
|---|---|
|
A
|
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
B
|
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C
|
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, при наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1. Приказ Минздрава России от 19.02.2021 № 116н «Об утверждении Порядка оказания медицинской помощи взрослому населению при онкологических заболеваниях».
2. Приказ Минздрава России от 04.06.2020 № 548н «Об утверждении порядка диспансерного наблюдения за взрослыми с онкологическими заболеваниями».
3. Приказ Минздрава России от 27.04.2021 № 404н «Об утверждении порядка проведения профилактического медицинского осмотра и диспансеризации определенных групп взрослого населения».
4. Приказ Минздрава России от 10.05.2017 №203н «Об утверждении критериев оценки качества медицинской помощи».
5. Приказ Минздрава России от 11.03.2021 № 194н «Об утверждении стандартов медицинской помощи взрослы при меланоме кожи и слизистых оболочек».
6. Распоряжение Правительства Российской Федерации от 12.10.2019 г. № 2406-р «Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи».
7. Приказ Минздрава России от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации» (зарегистрировано в Минюсте России 08.05.2019 № 54588).
8. Методические рекомендации по проведению оценки научной обоснованности, включаемой в клинические рекомендации информации, ФГБУ «Центр экспертизы и контроля качества» Министерства здравоохранения Российской Федерации, 2019 г.
9. Актуальные инструкции к лекарственным препаратам, упоминаемым в данных клинических рекомендациях, можно найти на сайте http://grls.rosminzdrav.ru.
10. Приказ Минздрава России от 13.10.2017 N 804н «Об утверждении номенклатуры медицинских услуг»
Таблица А3-1.
Термины, описывающие процедуры в клинической рекомендации и возможные (наиболее близкие) термины из действующей номенклатуры медицинских услуг.
|
Термин, встречающийся в клинической рекомендации
|
Виды и подвиды медицинских услуг, наиболее подходящих под термин клинической рекомендации (на основании номенклатуры медицинских услуг, утвержденной приказом от 13 октября 2017 г. N 804н МЗ РФ)
|
|---|---|
|
Дерматоскопия
|
A03.01.001 Осмотр кожи под увеличением (дерматоскопия)
A03.01.001.001 Конфокальная отражательная микроскопия кожи
|
|
Цифровая дермоскопическая визуализация
|
A03.01.001 Осмотр кожи под увеличением (дерматоскопия)
A03.01.001.001 Конфокальная отражательная микроскопия кожи
|
|
Прижизненное патолого-анатомическое исследование биопсийного материала
|
A10.30.001 Макроскопическое исследование удаленного операционного материала
A08.01.001 Патолого-анатомическое исследование биопсийного (операционного) материала кожи;
A08.01.001.002 Патолого-анатомическое исследование биопсийного (операционного) материала кожи с применением иммуногистохимических методов
|
|
Цитологического исследования опухолевого материала
|
A08.01.002 Цитологическое исследование микропрепарата кожи
|
|
УЗИ регионарных лимфоузлов
|
A04.06.002 Ультразвуковое исследование лимфатических узлов (одна анатомическая зона)
|
|
Компьютерная томография (КТ) с внутривенным контрастом пораженной анатомической области
|
A06.08.007.004 Компьютерная томография придаточных пазух носа с внутривенным болюсным контрастированием
A06.08.009.002 Компьютерная томография шеи с внутривенным болюсным контрастированием
A06.09.005.002 Компьютерная томография органов грудной полости с внутривенным болюсным контрастированием
A06.30.005.002 Компьютерная томография органов брюшной полости и забрюшинного пространства с внутривенным болюсным контрастированием
A06.20.002.003 Компьютерная томография органов малого таза у женщин с контрастированием
A06.21.003.003 Компьютерная томография органов таза у мужчин с контрастированием
A06.23.004.002 Компьютерная томография мягких тканей головы контрастированием A06.23.004.006 Компьютерная томография головного мозга с внутривенным контрастированием
A06.12.050 Компьютерно-томографическая ангиография одной анатомической области
|
|
Магнитно-резонансная томография (МРТ) с внутривенным контрастом пораженной анатомической области
|
A05.01.002 Магнитно-резонансная томография мягких тканей A05.01.002.001 Магнитно-резонансная томография мягких тканей с контрастированием
A05.03.004 Магнитно-резонансная томография лицевого отдела черепа A05.03.004.001 Магнитно-резонансная томография лицевого отдела черепа с внутривенным контрастированием
|
|
Цитологическое исследование соскоба или мазков отпечатков
|
A11.01.016 Получение мазка-отпечатка с поверхности кожи
A11.01.009 Соскоб кожи
A11.01.001 Биопсия кожи
A11.01.005 Биопсия узелков, тофусов
|
|
Инцизионная (панч) биопсия на всю толщину кожи
|
A11.01.001 Биопсия кожи
A11.30.013 Биопсия опухолей, опухолеподобных образований мягких тканей
A11.30.014 Трепанбиопсия опухолей наружных локализаций, лимфатических узлов под визуальным контролем
|
|
Плоскостная резекция (новообразования кожи)
|
A11.01.001 Биопсия кожи
|
|
Биопсия метастаза под контролем УЗИ/ КТ
|
A11.06.001.001 Пункция лимфатического узла под контролем ультразвукового исследования
A11.06.002.001 Биопсия лимфатического узла под контролем ультразвукового исследования
A11.30.024.001 Пункция мягких тканей под контролем ультразвукового исследования
A04.30.009 Ультразвуковая навигация для проведения малоинвазивной манипуляции
A11.03.001.002 Трепанбиопсия костей позвоночника под контролем компьютерной томографии A11.03.001.003 Трепанбиопсия костей таза под контролем компьютерной томографии
A11.09.003.002 Пункция плевральной полости под контролем ультразвукового исследования
A11.14.001.001 Биопсия печени под контролем ультразвукового исследования
A11.15.001.001 Биопсия поджелудочной железы пункционная под контролем ультразвукового исследования
|
|
Лазерная хирургия с помощью СО2 лазера
|
A22.01.003 Лазерная деструкция ткани кожи
A22.30.013 Лазерная хирургия при новообразованиях мягких тканей
|
|
Кожная пластика век
|
A16.26.111 Пластика века (блефаропластика) без и с пересадкой тканей
A16.26.111.001 Пластика верхних век без пересадки тканей чрескожным доступом
A16.26.111.002 Пластика верхних век без пересадки тканей трансконъюнктивальным доступом
A16.26.111.003 Пластика нижних век чрескожным подресничным доступом с формированием кожного лоскута
A16.26.111.004 Пластика нижних век чрескожным подресничным доступом с кожно-мышечным лоскутом
A16.26.111.005 Пластика нижних век чрескожным подресничным доступом с миопексией
A16.26.111.006 Пластика нижних век чрескожным подресничным доступом с каптопексией
A16.26.111.007 Пластика нижних век чрескожным подресничным доступом с перемещением части жирового тела орбиты в "слезную борозду"
A16.26.111.008 Пластика нижних век трансконъюктивальным доступом
A16.26.111.009 Бипланарная пластика нижних век
A16.26.111.010 Ориентальная пластика век
|
|
Фотодинамическая терапия
|
A22.01.007 Фотодинамическая терапия при заболеваниях кожи, подкожножировой клетчатки, придатков кожи
A22.01.007.001 Фотодинамическая терапия при новообразованиях кожи, подкожной клетчатки, придатков кожи интраоперационная
A22.30.020 Фотодинамическая терапия злокачественного новообразования
|
|
Медико-генетическое консультирование
|
B01.006.001 Прием (осмотр, консультация) врача-генетика первичный
B01.006.002 Прием (осмотр, консультация) врача-генетика повторный
A01.30.013 Сбор анамнеза и жалоб при генетическом консультировании
A01.30.014 Визуальное исследование при генетическом консультировании
A01.30.015 Составление родословной
|
|
Реконструктивно-пластические хирургические методы
|
A16.01.005.005 Широкое иссечение новообразования кожи с реконструктивнопластическим компонентом
A16.30.032.002 Иссечение новообразований мягких тканей с реконструктивнопластическим компонентом
A16.30.075 Реконструктивно-пластические операции с перемещением комплексов тканей (кожа, мышцы, сухожилия)
A16.30.058 Пластика мягких тканей
A16.01.010 Аутодермопластика
A16.01.010.001 Кожная пластика для закрытия раны с использованием метода дерматензии
A16.01.010.002 Пластика раны местными тканями
A16.01.010.004 Перекрестная кожная пластика
A16.01.010.005 Свободная кожная пластика дерматомным перфорированным лоскутом
A16.09.032.005 Реконструктивно-пластические операции на грудной стенке и диафрагме при опухолях грудной стенки (мягких тканей, ребер, грудины, ключицы)
A16.23.048.001 Удаление черепно-лицевого новообразования микрохирургическое с пластикой дефекта основания черепа ауто- или искусственными имплантами
A16.23.048.002 Удаление черепно-лицевого новообразования микрохирургическое с применением эндоскопической техники и пластикой дефекта основания черепа ауто- или искусственными имплантами
A16.23.049.001 Резекция черепно-лицевого комплекса с микрохирургической пластикой ауто- или искусственными имплантами
A16.23.049.002 Резекция черепно-лицевого комплекса с реконструктивно- пластическим компонентом
A16.23.049.003 Резекция черепно-лицевого комплекса с микрохирургической пластикой
A16.23.049.004 Резекция черепно-лицевого комплекса с микрохирургической пластикой с использованием видеоэндоскопических технологий
A16.23.050 Реконструктивные операции при черепно-лицевых новообразованиях
A16.23.050.001 Микрохирургическая пластика черепно-лицевого комплекса с микрохирургической пластикой ауто- или искусственными имплантами
|
|
Эксцизия (или ре-эксцизия, или удаление, или повторное удаление или иссечение, или повторное иссечение) опухоли кожи с интраоперационным морфологическим контролем всех краев резекции
|
A16.01.005.005 Широкое иссечение новообразования кожи с реконструктивнопластическим компонентом
+
A08.30.017 Срочное интраоперационное патолого-анатомическое исследование
|
|
Криодеструкция опухолей кожи (или криохирургия при опухолях кожи)
|
A24.01.004 Криодеструкция кожи
|
|
Близкофокусная рентгенотерапия
|
A06.01.007 Рентгенотерапия при новообразованиях кожи
A06.01.007.001 Рентгенотерапия при новообразованиях кожи близкофокусная
|
|
Гамма- терапия
|
A07.01.004 Дистанционная гамма-терапия при новообразованиях кожи
|
|
Электронная терапия
|
A07.30.025.001 Дистанционная лучевая терапия при поражении мягких тканей на медицинских ускорителях электронов
|
|
Брахитерапия
|
A07.30.014 Внутритканевая лучевая терапия
A07.30.028 Установка эндостата (эндостатов) при проведении внутритканевой лучевой терапии
A07.30.007 Аппликационная лучевая терапия с изготовлением и применением индивидуальных аппликаторов. 3D - 4D планирование
|
|
Дистанционная лучевая терапия электронным или фотонным пучком
|
A07.30.025 Дистанционная лучевая терапия при поражении мягких тканей
|
|
Гипофракционированная лучевая терапия
|
A07.30.025 Дистанционная лучевая терапия при поражении мягких тканей
|
|
Регионарная лимфаденэктомия, полная регионарная лимфаденэктомия или лимфаденэктомия
|
A16.06.006 Лимфаденэктомия шейная A16.06.006.001 Лимфаденэктомия подмышечная A16.06.006.002 Лимфаденэктомия шейная расширенная
A16.06.006.003 Лимфаденэктомия шейная расширенная с ангиопластикой A16.06.006.004 Лимфаденэктомия шейная расширенная с реконструктивнопластическим компонентом
A16.06.006.003 Лимфаденэктомия шейная расширенная с ангиопластикой A16.06.006.004 Лимфаденэктомия шейная расширенная с реконструктивнопластическим компонентом
A16.06.016.003 Лимфаденэктомия подвздошно-пахово-бедренная (операция Дюкена)
A16.06.016.004 Лимфаденэктомия подвздошно-пахово-бедренная (операция Дюкена) двухсторонняя
A16.06.014 Лимфаденэктомия паховая
A16.06.014.001 Лимфаденэктомия паховая двухсторонняя
A16.06.014.002 Лимфаденэктомия пахово-бедренная
A16.06.014.003 Лимфаденэктомия пахово-бедренная двухсторонняя
A16.06.015 Лимфаденэктомия бедренная
A16.06.016 Лимфаденэктомия подвздошная
A16.06.016.001 Лимфаденэктомия подвздошная односторонняя
A16.06.016.002 Лимфаденэктомия подвздошная двухсторонняя
|
|
Массаж
|
A21.01.001 Общий массаж медицинский
A21.01.009 Массаж нижней конечности медицинский
|
|
Пневмокомпрессия
|
A15.12.002.001Прерывистая пневмокомпрессия нижних конечностей
A17.30.009 Баровоздействие - прессотерапия конечностей, пневмокомпрессия
B05.027.001 Услуги по медицинской реабилитации пациента, перенесшего операцию по поводу онкологического заболевания
B05.027.002 Услуги по медицинской реабилитации пациента, перенесшего химиотерапию
B05.027.003 Услуги по медицинской реабилитации пациента, перенесшего лучевую терапию
|
|
Кинезиологическое тейпирование, электротерапия, лазеротерапия, низкоинтенсивная лазеротерапия, магнитотерапия
|
B05.027.001 Услуги по медицинской реабилитации пациента, перенесшего операцию по поводу онкологического
B05.027.002 Услуги по медицинской реабилитации пациента, перенесшего химиотерапию
B05.027.003 Услуги по медицинской реабилитации пациента, перенесшего лучевую терапию заболевания
|
|
Чрескожная электростимуляция
|
A17.24.010 Многофункциональная электростимуляция мышц
A17.30.006 Чрескожная короткоимпульсная электростимуляция (ЧЭНС)
|
Приложение Б. Алгоритмы действий врача
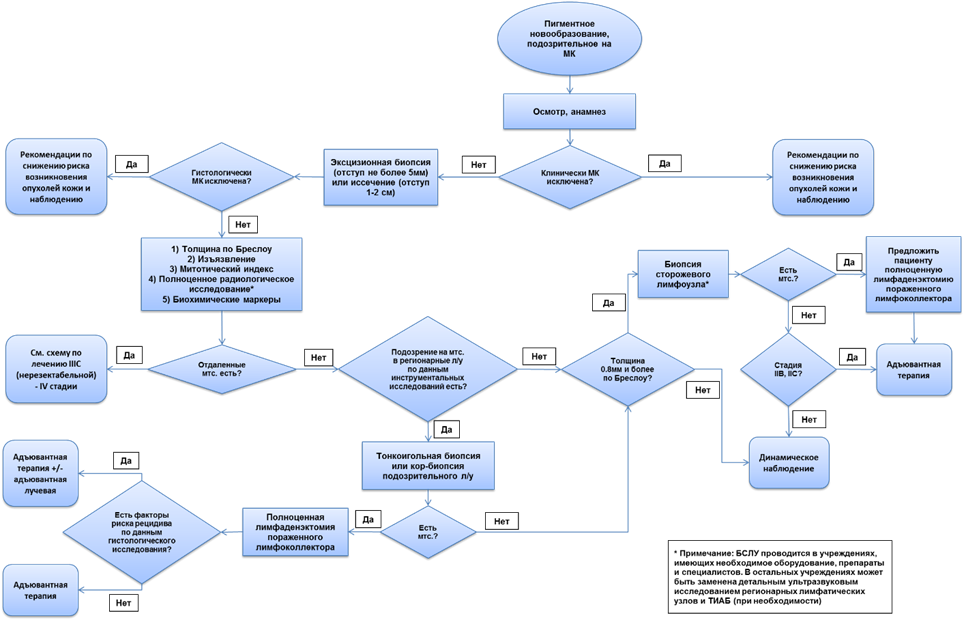
Рис. 1. Схема диагностики и лечения пациентов с меланомой кожи с локальными (0–III) стадиями заболевания.
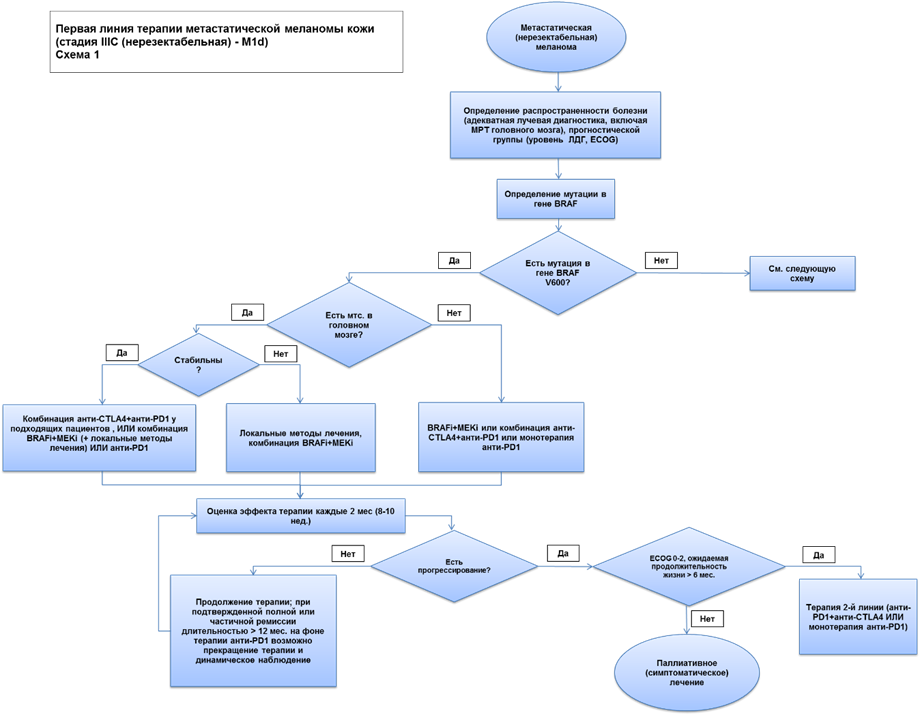
Рис. 2. Схема диагностики и лечения пациентов с метастатической или нерезектабельной меланомой кожи и мутацией в гене BRAF.
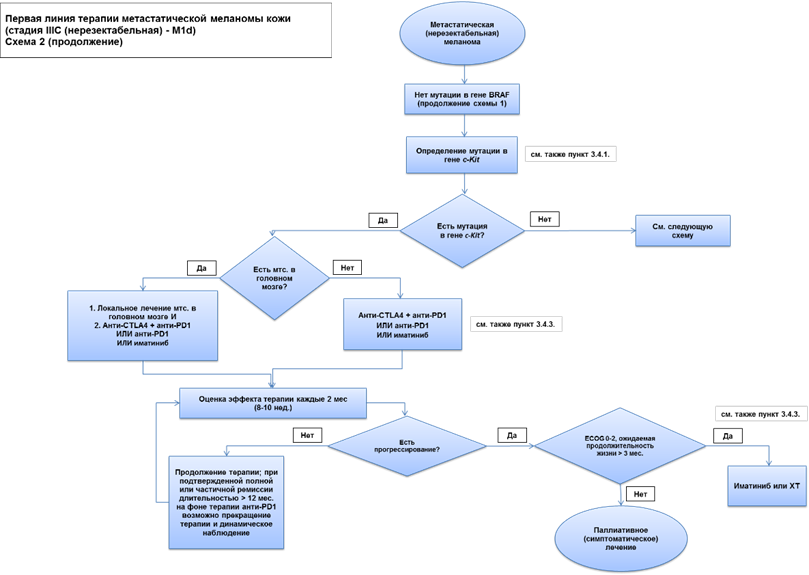
Риc. 3. Схема диагностики и лечения пациентов с метастатической или нерезектабельной меланомой кожи и мутацией в гене KIT.
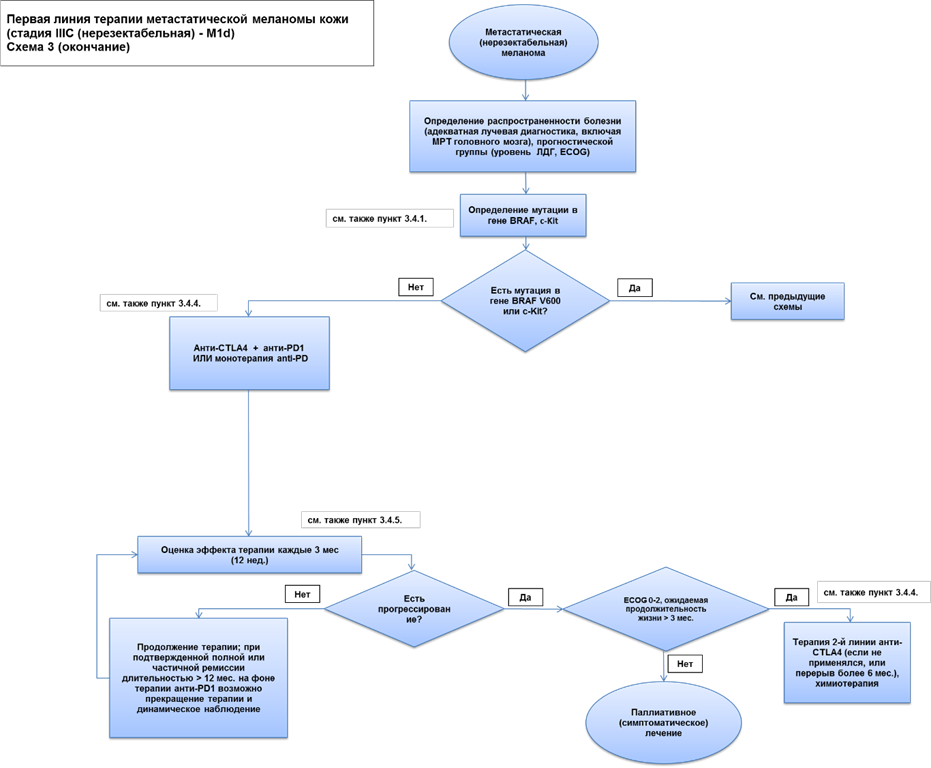
Рис. 4. Схема диагностики и лечения пациентов с метастатической или нерезектабельной меланомой кожи без мутаций в генах BRAF и KIT.
Приложение В. Информация для пациента
Рекомендации по самостоятельному осмотру кожи и первичной профилактике меланомы
Главный фактор риска развития меланомы и других опухолей кожи – ультрафиолетовое повреждение, которое возникает в результате естественных причин (солнечные ожоги) или искусственных причин (особые условия труда или посещение соляриев).
Различные типы кожи по-разному реагируют на одинаковую дозу ультрафиолетового излучения, при этом у одних людей (со светлой кожей, так называемого I фототипа) даже минимальные дозы ультрафиолета всегда вызывают солнечные ожоги (начальная степень – гиперемия кожи), в то время как у других вред солнечного ультрафиолета минимален (у лиц со смуглой или темной кожей). Большая часть населения России имеет I–III (т. е. «светлые») фототипы кожи и потому весьма чувствительна к солнечным ожогам.
Предотвращение солнечного ожога кожи является ключевым фактором первичной профилактики. Особенно серьезный вклад в повышение риска возникновения меланомы вносят солнечные ожоги в детском и подростковом возрасте. Общие рекомендации сводятся к следующим несложным правилам.
1. Используйте данные мобильного приложения, прогноза погоды об уровне УФ-индекса (УФ-индекс – это показатель, характеризующий уровень ультрафиолетового излучения). При УФ-индексе более 2 необходима защита от солнца (см. таблицу).
Меры защиты в зависимости от УФ-индекса
|
УФ-индекс
|
Меры защиты
|
|---|---|
|
0–2
|
Защита не нужна. Пребывание вне помещения не представляет опасности
|
|
3–7
|
Необходима защита. В полуденные часы оставайтесь в тени. Носите одежду с длинными рукавами и шляпу. Пользуйтесь солнцезащитным кремом
|
|
8
|
Необходима усиленная защита. Полуденные часы пережидайте внутри помещения. Вне помещения оставайтесь в тени. Обязательно носите одежду с длинными рукавами, шляпу, пользуйтесь солнцезащитным кремом
|
2. Использование солнцезащитного крема широкого спектра действия (предотвращающего воздействие ультрафиолета как типа А, так и типа В), сила которого (для ультрафиолетовых лучей типа В – SPF (Sun Protecting Factor), для ультрафиолетовых лучей типа A – PPD (Persistent Pigment Darkening)) адекватна для вашего фототипа кожи (т. е. лицам с более светлой кожей требуется крем с большим SPF или PPD). В целом лицам с I или II фототипом кожи рекомендуют использовать кремы с SPF 30–50+ и максимальным PPD 42.
3. Солнцезащитные средства необходимо сочетать с другими способами защиты от солнца: носить одежду, очки, не пропускающие ультрафиолетовое излучение, головные уборы с широкими полями (подсчитано, что для того чтобы тень от шляпы закрыла лицо и шею, ее поля должны быть не менее 10 см) и находиться в тени.
4. Детям рекомендуется дополнительно носить специальную одежду с защитой от ультрафиолетового излучения.
5. Не пользуйтесь оборудованием и лампами для искусственного загара.
Правила применения солнцезащитных препаратов:
-
солнцезащитные средства следует наносить за 30 мин до выхода на улицу на все участки кожи, которые подвергаются солнечному облучению;
-
повторное нанесение нужно осуществлять каждые 2 ч, а также сразу после купания и после избыточного потения;
-
фотопротекция, соответствующая указанной на маркировке солнцезащитного средства, проявляется при нанесении его на кожу в количестве 2 мг/см2, применение в меньшем объеме резко снижает степень защиты кожи от ультрафиолетового излучения. Для понимания количества солнцезащитного средства, необходимого для заявленной маркировкой защиты кожи, т. е. 2 мг/см2, разработано «правило чайной ложки» [618]:
-
рука: 1/2 чайной ложки средства;
-
голова и шея: 1/2 чайной ложки;
-
нога: 1 чайная ложка;
-
грудь: 1 чайная ложка;
-
спина: 1 чайная ложка;
-
-
при невозможности одномоментно нанести необходимый объем солнцезащитного средства необходимо раннее повторное (через 15 до 30 мин) использование крема;
-
солнцезащитные кремы должны храниться при температуре ниже +30 °С, не использоваться после истечения срока годности.
Осмотр кожи:
Рекомендуется периодически (не реже 1 раза в 3–6 мес) самостоятельно осматривать полностью свои кожные покровы с использованием как панорамного, так и ручного зеркала. Алгоритм осмотра схематически представлен на рис. 5;
При осмотре следует уделять особое внимание пигментным пятнам размерами 4–5 мм и более с асимметрией формы или окраски, неровным (фестончатым) краем, неравномерной окраской (различные оттенки коричневого). Если вы отмечаете пигментные пятна, к которым подходят хотя бы 2 из указанных характеристик, обратитесь к врачу-дерматовенерологу или врачу-онкологу. Совсем не обязательно, что данная родинка окажется злокачественной, но дальнейшую оценку ее состояния следует поручить врачу. Особое внимание следует уделить образованиям на коже, у которых какие-либо характеристики меняются с течением времени (например, увеличивается площадь пигментного пятна, или «родинка» становится толще, или, напротив, часть «родинки» начинает бледнеть и исчезать) – такие образования также потребуют проверки у врача, специализирующегося на ранней диагностике опухолей кожи.
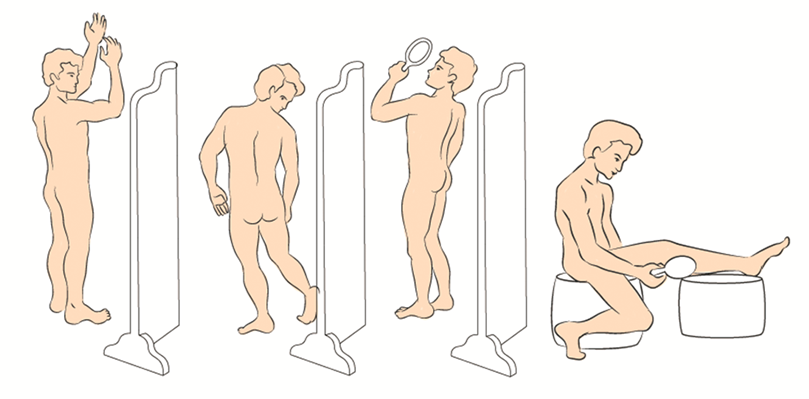
Рис.5. Алгоритм осмотра кожи.
Рекомендации при осложнениях химиотерапии
При осложнениях химиотерапии необходимо связаться с врачом-онкологом (химиотерапевтом).
1. При повышении температуры тела до +38 °C и выше начать прием антибиотиков в соответствии с назначением врача-онколога.
2. При стоматите:
-
диета – механическое, термическое щажение;
-
часто (каждый час) полоскать полость рта отварами ромашки, коры дуба, шалфея, смазывать десна облепиховым (персиковым) маслом;
-
обрабатывать полость рта по рекомендации врача-онколога.
3. При диарее:
-
диета – исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно употреблять нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье;
-
принимать лекарственные препараты в соответствии с назначением врача-онколога
4. При тошноте принимать лекарственные препараты в соответствии с назначением врача-онколога.
Информация для пациента, получающего терапию моноклональными антителами – блокаторами CTLA4 и/или PD1.
Своевременное взаимодействие с вашим лечащим врачом и медицинской̆ сестрой по поводу состояния вашего здоровья является важной составляющей помощи медицинской команде в защите вас в процессе лечения настолько безопасно, насколько это возможно.
Очень важно, чтобы любые симптомы (побочные явления), связанные с лечением блокаторами CTLA4 и/или PD1, были выявлены и излечены в самом начале их проявлений, это поможет предотвратить их переход в более тяжелые степени.
Блокаторы CTLA4 и/или МКА-блокаторы PD1 разработаны, чтобы помочь иммунной системе вашего организма бороться с опухолевым процессом. Наиболее частые побочные эффекты, с которыми Вы можете столкнуться в процессе лечения, являются результатом высокой активности иммунной системы. Такие побочные эффекты называются связанными с иммунной системой и отличаются от побочных эффектов, которые вы можете наблюдать при других видах лечения злокачественных опухолей.
Побочные явления, которые могут появиться у вас, обычно возникают в первые 12 нед лечения, но могут появиться и позже.
Очень важно, чтобы вы информировали вашего лечащего врача о любых симптомах, которые появились у вас во время лечения блокаторами CTLA4 и/или PD1. Распознавание побочных эффектов на ранних стадиях дает возможность вашему лечащему врачу сразу же начать соответствующую терапию и предотвратить переход побочных явлений в более тяжелые степени.
Если после лечения блокаторами CTLA4 и/или МКА-блокаторами PD1 у вас возникли симптомы из указанных ниже, пожалуйста, сообщите об этом вашему лечащему врачу незамедлительно.
Возможные побочные явления после терапии блокаторами CTLA4 и/или PD1:
-
увеличение числа актов дефекации до 2 и более в день или любая диарея в ночное время, любой̆ стул со слизью и кровью;
-
боль в животе или чувство озноба, а также боль, требующая медицинского вмешательства;
-
красные болезненные глаза или желтоватая окраска белков глаз, затуманенный взгляд, воспаление или припухлость глаз;
-
желтая окраска или покраснение кожи, зудящая сыпь, чувствительность кожи на солнце;
-
вновь возникший̆ кашель или одышка;
-
усталость или сонливость;
-
затрудненная концентрация внимания или спутанность сознания;
-
головная боль, боль в теле или в месте опухоли;
-
лихорадка (повышение температура тела до +38 °C);
-
внезапное снижение или увеличение массы тела;
-
вновь появившаяся эректильная дисфункция или потеря интереса к интимной̆ жизни.
Пожалуйста, уделите особое внимание любым изменениям в актах дефекации. Записываете количество актов каждый̆ день. Если у вас диарея, попробуйте ее описать, используя один из нижеприведенных терминов, и определите уровень срочности в вашем конкретном случае:
-
стул неплотный;
-
водянистый;
-
болезненный;
-
кровянистый;
-
слизистый.
Диарея не всегда может проявляться в виде жидкого стула. Увеличение числа актов дефекации в день даже при твердом стуле потенциально может указывать на проблему.
Важно: побочные эффекты могут возникнуть в период от 1 нед до нескольких месяцев от начала лечения блокаторами CTLA4 и/или PD1. Если у вас возник любой̆ из вышеназванных симптомов, незамедлительно сообщите об этом вашему лечащему врачу или медицинской̆ сестре.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG [404].
Название на русском языке: Шкала оценки тяжести состояния пациента по версии ВОЗ/ECOG
Оригинальное название: The Eastern Cooperative Oncology Group/World Health Organization Performance Status (ECOG/WHO PS)
Источник (официальный сайт разработчиков, публикация с валидацией): https://ecog-acrin.org/resources/ecog-performance-status
Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, Carbone PP: Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982, 5(6):649-655
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. д.).
Содержание:
|
Балл
|
Описание
|
|---|---|
|
0
|
Пациент полностью активен, способен выполнять все, как и до заболевания (90–100 % по шкале Карновского)
|
|
1
|
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70–80 % по шкале Карновского)
|
|
2
|
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно – в вертикальном положении (50–60 % по шкале Карновского)
|
|
3
|
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования (30–40 % по шкале Карновского)
|
|
4
|
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10–20 % по шкале Карновского)
|
|
5
|
Пациент мертв
|
Ключ (интерпретация): приведен в самой шкале
Приложение Г2. Шкала Карновского [619]
Название на русском языке: Шкала Карновского
Оригинальное название (если есть): KARNOFSKY PERFORMANCE STATUS
Источник (официальный сайт разработчиков, публикация с валидацией): Karnofsky DA, Burchenal JH: The clinical evaluation of chemotherapeutic agents in cancer. In: Evaluation of chemotherapeutic agents. edn. Edited by MacLeod C. New York: Columbia University Press; 1949: 191-205
Тип: шкала оценки
Назначение: описать уровень функционирования пациента с точки зрения его способности заботиться о себе, повседневной активности и физических способностях (ходьба, работа и т. д.).
Содержание (шаблон):
|
Шкала Карновского
|
|---|
|
100— Состояние нормальное, жалоб нет
90— Способен к нормальной деятельности, незначительные симптомы или признаки заболевания
|
|
80— Нормальная активность с усилием, незначительные симптомы или признаки заболевания
70— Обслуживает себя самостоятельно, не способен к нормальной деятельности или активной работе
|
|
60— Нуждается порой в помощи, но способен сам удовлетворять большую часть своих потребностей
50— Нуждается в значительной помощи и медицинском обслуживании
|
|
40— Инвалид, нуждается в специальной помощи, в т.ч. медицинской
30— Тяжелая инвалидность, показана госпитализация, хотя смерть непосредственно не угрожает
|
|
20— Тяжелый больной. Необходимы госпитализация и активное лечение
10— Умирающий
|
|
0— Смерть
|
Ключ (интерпретация): приведен в самой шкале
Приложение Г3. Критерии оценки ответа опухоли на лечение (RECIST 1.1)
Название на русском языке: Критерии оценки ответа опухоли на химиотерапевтическое лечение (RECIST 1.1)
Оригинальное название (если есть): Response evaluation criteria in solid tumors 1.1
Источник (официальный сайт разработчиков, публикация с валидацией):
Оригинальная публикация: Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, Dancey J, Arbuck S, Gwyther S, Mooney M et al: New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009, 45(2):228-247
Тип: шкала оценки
Назначение: оценка ответа на химиотерапевтическое лечение
Содержание, ключ и шаблон на русском языке представлены в методических рекомендациях №46 ГБУЗ «Научно-практический центр медицинской радиологии» департамента здравоохранения города Москвы [620].
Содержание:
-
Область применения: Хотя настоящее руководство может быть применимо при проведении исследований злокачественных опухолей головного мозга, для данной нозологической категории также опубликованы отдельные критерии оценки ответа на лечение. Настоящий документ не предназначен для использования в исследованиях, касающихся злокачественных лимфом, поскольку для оценки ответа при лимфомах существуют международные руководства, опубликованные отдельно.
-
Следует также отметить, что в повседневной клинической практике онкологи нередко осуществляют мониторинг злокачественного процесса у пациентов посредством серии визуализирующих исследований и принимают решения о продолжении терапии на основании как объективных данных, так и клинической симптоматики. Руководство RECIST не предполагается в качестве обязательного инструмента для поддержки таких решений, за исключением случаев, когда лечащий врач сочтёт его применение целесообразным.
-
Оценка измеримости опухолевого процесса до начала лекарственного лечения.
3.1. Определения
Исходно (до начала терапии) опухолевые очаги и/или лимфатические узлы классифицируются как измеряемые либо неизмеряемые по следующим критериям:
3.1.1.Измеряемые поражения
Опухолевые очаги: подлежат точному измерению по крайней мере в одном измерении (необходимо фиксировать наибольший диаметр в плоскости измерения), при этом минимальный размер должен составлять:
-
10 мм по данным КТ (при толщине среза не более 5 мм);
-
10 мм при измерении штангенциркулем во время клинического осмотра (если точное измерение невозможно — очаг считается неизмеряемым);
-
20 мм по рентгенограмме органов грудной клетки.
Метастатически измененные лимфатические узлы: признаются патологически увеличенными и измеряемыми, если их короткая ось составляет 15 мм и более (по данным КТ при толщине среза не более 5 мм). До лечения и в дальнейшем следует измерять и отслеживать только короткую ось узла.
3.1.2. Неизмеряемые поражения
К таковым относятся:
-
Очаги с наибольшим диаметром менее 10 мм;
-
Лимфатические узлы с короткой осью от 10 до <15 мм;
-
Очаги, объективно не поддающиеся измерению, в том числе:
-
лептоменингеальный карциноматоз;
-
асцит;
-
плевральный или перикардиальный выпот;
-
воспалительный рак молочной железы;
-
лимфангит легких или кожи;
-
абдоминальные массы или гепато-/спленомегалия, выявленные при физикальном осмотре, но не поддающиеся воспроизводимому визуализирующему измерению.
3.1.3. Особые соображения по измеримости очагов
3.1.3.1. Костные поражения:
Остеосцинтиграфия, ПЭТ или обычные рентгеновские снимки не считаются адекватными методами визуализации для измерения костных поражений. Однако они могут быть использованы для подтверждения наличия или исчезновения костных очагов.
Литические или смешанные литико-склеротические поражения, обладающие измеряемыми мягкотканными компонентами, которые могут быть оценены с помощью КТ или МРТ, могут считаться измеряемыми, если соответствуют критериям измеримости, изложенным выше.
Бластические костные поражения считаются неизмеряемыми.
3.1.3.2. Кистозные поражения:
Очаги, соответствующие признакам простых кист, по данным визуализации, не должны расцениваться как злокачественные и, соответственно, не подлежат классификации как измеряемые или неизмеряемые.
Так называемые "кистозные поражения", предполагаемые как кистозные метастазы, могут рассматриваться как измеряемые, если соответствуют установленным критериям. Однако при наличии других (некистозных) поражений предпочтение следует отдавать последним при выборе целевых очагов.
3.1.3.3.Поражения после локального лечения:
Опухолевые очаги, расположенные в ранее облучённых зонах или в областях, подвергшихся иному локорегионарному воздействию, обычно не считаются измеряемыми, если только не продемонстрировано достоверное прогрессирование в данных очагах.
3.2. Спецификации по методам измерений
3.2.1. Измерение очагов
Все измерения должны фиксироваться в метрических единицах, предпочтительно с использованием штангенциркуля при клинической оценке.
Первичное обследование должно проводиться максимально приближенно к началу терапии, но не позднее, чем за 4 недели до старта лечения.
3.2.2. Метод оценки
Следует использовать один и тот же метод визуализации и одинаковую технику на всех этапах — как на исходном, так и при последующих контролях.
Оценка с применением визуализирующих методов предпочтительна, если только очаг не может быть визуализирован, но доступен для объективной клинической оценки.
-
Клинически определяемые очаги: рассматриваются как измеряемые только в случае, если они поверхностны и имеют диаметр ≥10 мм при измерении штангенциркулем (например, кожные узлы). Рекомендуется фотодокументация с цветной фотографией и линейкой для определения размеров. Если очаг доступен как для клинической оценки, так и для визуализации, предпочтение следует отдавать визуализирующей методике, поскольку она более объективна и позволяет провести последующий аудит.
-
Рентгенография органов грудной клетки: предпочтение следует отдавать компьютерной томографии (КТ) перед рентгенографией, особенно в случаях, когда прогрессирование заболевания является важной конечной точкой. КТ обладает большей чувствительностью в выявлении новых очагов. Однако очаги, визуализируемые на рентгенограмме грудной клетки, могут считаться измеряемыми, если они чётко определяются и окружены аэрированным лёгким.
-
КТ и МРТ: КТ на текущий момент считается наиболее предпочтительным и воспроизводимым методом измерения очагов, выбранных для оценки ответа. Настоящее руководство определяет измеримость очагов на КТ, исходя из предположения, что толщина среза составляет не более 5 мм. В случаях, когда используется КТ срезом более 5 мм, минимальный размер измеряемого очага должен быть в два раза больше толщины среза. МРТ также допустима в отдельных ситуациях, особенно для обследования определённых областей тела.
-
Ультразвуковое исследование (УЗИ): УЗИ не является надёжным методом измерения размеров опухолевых очагов и не должно использоваться в качестве основного метода оценки. Ультразвуковые исследования невоспроизводимы в полном объёме при повторных оценках и зависят от оператора, что делает затруднительным получение сопоставимых данных при разных временных точках. При выявлении новых очагов на УЗИ во время исследования рекомендуется подтверждение данных КТ или МРТ. При наличии противопоказаний к КТ (например, опасения по поводу облучения) может рассматриваться МРТ как альтернатива.
-
Эндоскопия, лапароскопия: Использование этих методов не рекомендуется для объективной оценки опухоли. Однако они могут быть полезны в подтверждении полного патоморфологического ответа (например, при биопсии) или в установлении рецидива в исследованиях, где рецидив после полной резекции или ремиссии является конечной точкой.
-
Опухолевые маркёры: Опухолевые маркёры не могут использоваться самостоятельно для определения объективного ответа опухоли. Если уровень маркёров изначально был выше нормы, их нормализация может свидетельствовать о полном ответе (CR). Поскольку маркёры являются специфичными для конкретных заболеваний, их использование должно быть чётко описано в протоколах в зависимости от типа опухоли. Существуют отдельные рекомендации для CA-125 (рецидивирующий рак яичников) и ПСА (рецидивирующий рак простаты). Кроме того, Гинекологическая онкологическая группа разработала критерии прогрессирования по CA-125, которые интегрируются с объективной оценкой опухоли для использования в исследованиях первой линии при раке яичников.
-
Цитология и гистология: Эти методы могут применяться для дифференциации между частичным и полным ответом, в редких случаях, если это предусмотрено протоколом (например, при опухолях яичка, где возможно наличие остаточной доброкачественной ткани). В случае появления или усиления экссудативных проявлений (например, плевральный выпот), цитологическое подтверждение злокачественного характера может использоваться для разграничения между стабильным состоянием/ответом и прогрессированием заболевания, если при этом достигнуты критерии ответа или стабилизации по измеряемым очагам.
4. Оценка общей опухолевой нагрузки и измеряемого заболевания
4.1. Для оценки объективного ответа на лечение или последующего прогрессирования
необходимо определить общую опухолевую нагрузку на исходном этапе (до лечения), величина которой затем используется в качестве контрольной точки для всех последующих измерений.
4.2. Документация «целевых» и «нецелевых» очагов на исходном этапе
Если на исходном этапе выявлено несколько измеряемых очагов, следует выбрать не более пяти очагов в сумме, при этом не более двух очагов на один орган, чтобы они представляли все вовлечённые органы. Эти очаги считаются целевыми и подлежат фиксации и измерению на исходной визуализации. (Пример: если поражены один или два органа — будет выбрано, соответственно, максимум два или четыре очага.) Целевые очаги должны отбираться с учётом:
-
их размера (наибольший диаметр),
-
репрезентативности поражённых органов,
-
и возможности для воспроизводимых повторных измерений.
Если самый крупный очаг не позволяет провести воспроизводимое измерение, следует выбрать следующий по размеру, но воспроизводимый очаг.
Особое внимание лимфатическим узлам:
Лимфоузлы — это нормальные анатомические структуры, которые могут визуализироваться даже при отсутствии метастатического поражения. Как указано в разделе 3, патологически изменённые лимфоузлы, подлежащие оценке как целевые, должны иметь короткую ось ≥15 мм по данным КТ. Только короткая ось узла включается в расчёт общей суммы измерений. Короткая ось — это наименьшее измерение из двух, зафиксированных в плоскости изображения (при КТ — чаще всего аксиальная плоскость; при МРТ — аксиальная, сагиттальная или корональная). Например, лимфоузел 20×30 мм (в аксиальной плоскости) имеет короткую ось 20 мм и считается измеряемым злокачественным узлом. Именно это значение — 20 мм — подлежит регистрации.
4.3. Критерии оценки ответа
4.3.1. Оценка целевых очагов
Таблица Г3-1.
Оценка целевых очагов
Оценка целевых очагов
|
Категория
|
Критерии
|
|---|---|
|
Полный ответ (ПО)
|
Исчезновение всех целевых очагов. Все патологические лимфоузлы (в том числе нецелевые) должны уменьшиться до короткой оси менее 10 мм.
|
|
Частичный ответ (ЧО)
|
Уменьшение суммы диаметров целевых очагов минимум на 30% по сравнению с исходной суммой.
|
|
Прогрессирование заболевания (ПР)
|
Увеличение суммы диаметров целевых очагов минимум на 20% по сравнению с минимальной зафиксированной суммой на исследовании (включая исходную, если она минимальна), и увеличение хотя бы на 5 мм в абсолютном выражении. Также появление одного или более новых очагов считается прогрессированием.
|
|
Стабильное заболевание (СТ)
|
Не соответствует критериям ни для ПО, ни для ПР (то есть недостаточное уменьшение и недостаточное увеличение).
|
4.3.2. Особые примечания по оценке целевых очагов
-
Лимфатические узлы: даже если лимфоузлы регрессировали до <10 мм (норма), их фактическое значение короткой оси следует фиксировать при каждом обследовании, даже при достижении полного ответа. Поэтому суммарное измерение может не равняться нулю даже при наличии CR.
-
Очаги, ставшие "слишком маленькими для измерения": если очаг визуализируется, но радиолог не может точно измерить его размер, следует:
-
поставить 0 мм, если, по мнению радиолога, очаг исчез;
-
поставить 5 мм, если очаг "едва различим", но присутствует.
-
Это позволяет избежать ложных заключений об ответе или прогрессировании.
-
Слияние или фрагментация очагов:
-
При фрагментации: суммируются длины всех видимых частей.
-
При слиянии: измеряется наибольший диаметр объединённого очага.
-
4.3.3. Оценка нецелевых очагов
Таблица Г3-2.
Оценка нецелевых очагов
Оценка нецелевых очагов
|
Категория
|
Критерии
|
|---|---|
|
Полный ответ (ПО)
|
Исчезновение всех нецелевых очагов и нормализация уровня опухолевых маркеров. Все лимфоузлы — <10 мм по короткой оси.
|
|
Не ПО / не ПР
|
Сохраняются один или несколько нецелевых очагов и/или уровень маркеров остаётся повышенным.
|
|
Прогрессирование (ПР)
|
Недвусмысленное прогрессирование существующих нецелевых очагов. Также появление новых очагов считается прогрессом.
|
4.3.4. Примечания по прогрессированию нецелевых очагов
-
Если у пациента также есть измеряемые очаги, то прогрессирование по нецелевым очагам считается достоверным, только если есть значительное ухудшение общего состояния, даже при наличии ЧО или СТ в целевых очагах.
-
Если у пациента только нецелевые очаги, прогресс считается «достоверным», если степень ухудшения сопоставима с увеличением опухолевого объёма на 73% (эквивалент 20% увеличения диаметра).
4.3.5. Новые очаги
-
Появление новых злокачественных очагов свидетельствует о прогрессировании.
-
Очаг должен быть недвусмысленно новым — важно исключить артефакты, изменение методики, или естественные изменения (например, некроз в ответ на терапию).
-
Если очаг обнаружен в области, не охваченной исходной визуализацией, он считается новым.
-
При сомнительных находках — лечение может продолжаться до следующей оценки для подтверждения.
Наилучший общий ответ — это наиболее выраженный ответ на лечение, зафиксированный с начала терапии и до её окончания, с учётом необходимости подтверждения (если это предусмотрено протоколом).
Иногда ответ может быть зафиксирован уже после завершения терапии, поэтому протокол должен чётко указывать, учитываются ли такие постлечебные оценки при определении наилучшего ответа.
Если до прогрессирования у пациента начинается новая терапия, протокол также должен содержать указания, влияет ли это на классификацию ответа.
Оценка наилучшего ответа должна учитывать:
-
изменения целевых и нецелевых очагов,
-
появление новых очагов,
-
необходимость подтверждения ответа.
Таблица Г3-3.
Ответ на лечение в определённую временную точку: пациенты с целевыми (± нецелевыми) очагами
|
Целевые очаги
|
Нецелевые очаги
|
Новые очаги
|
Общий ответ
|
|---|---|---|---|
|
ПО
|
ПО
|
Нет
|
ПО
|
|
ПО
|
Не ПО / не ПР
|
Нет
|
ЧО
|
|
ПО
|
Не оценен
|
Нет
|
ЧО
|
|
ЧО
|
ПО
|
Нет
|
ЧО
|
|
ЧО
|
Не ПР или не все очаги оценены
|
Нет
|
ЧО
|
|
СТ
|
Не ПР или не все очаги оценены
|
Нет
|
СТ
|
|
Не все оценены
|
Не ПР
|
Нет
|
NE (неоценимо)
|
|
ПР
|
Любые
|
Есть или нет
|
ПР
|
|
Любые
|
ПР
|
Есть или нет
|
ПР
|
|
Любые
|
Любые
|
Да
|
ПР
|
Обозначения:
-
ПО — Полный ответ (Complete Response)
-
ЧО — Частичный ответ (Partial Response)
-
СТ — Стабильное заболевание (Stable Disease)
-
ПР — Прогрессирование заболевания (Progressive Disease)
-
NE — Не оценен (Not Evaluable)
Приложение Г4. Шкала расчета меланома-специфичного балла GPA [515]
Название на русском языке: Градуированная прогностическая оценка (GPA)
Оригинальное название (если есть): The Graded Prognostic Assessment (GPA)
Источник (официальный сайт разработчиков, публикация с валидацией):
Оригинальная публикация: Sperduto PW, Jiang W, Brown PD, et al. Estimating Survival in Melanoma Patients with Brain Metastases: An Update of the Graded Prognostic Assessment for Melanoma Using Molecular Markers (Melanoma-molGPA). Int J Radiat Onc Biol Phys 2017, on-line 10/17/17, print issue 11/15/17. [621,622]
Тип: шкала оценки
Назначение: оценка прогноза выживаемости пациентов с метастазами меланомы в головном мозге
Содержание, ключ и шаблон представлены на сайте https://brainmetgpa.com
|
Прогностические параметры/Баллы
|
0 баллов
|
0,5 балла
|
1 балл
|
|---|---|---|---|
|
Состояние по шкале Карновского
|
<=70
|
80
|
90-100
|
|
Возраст, годы
|
>=70
|
<70
|
НД
|
|
Количество метастазов в головном мозге
|
>=5
|
2-4
|
1
|
|
Экстракраниальные метастазы
|
Есть
|
НД
|
Нет
|
|
Мутация в гене BRAF
|
Отсутствует или неизвестно
|
Имеется
|
НД
|
|
|
|
|
|
|
Сумма баллов
|
Медиана общей выживаемости (мес.) в соответствии с GPA
|
|---|---|
|
0-1
|
5
|
|
1,5 – 2,0
|
8
|
|
2,5 -3,0
|
16
|
|
3,5 – 4,0
|
34
|
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.