Мезотелиома плевры
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Мезотелиома плевры (C45.0)
Онкология
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «08» сентября 2023г
Протокол №189
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
МЕЗОТЕЛИОМА ПЛЕВРЫ
Мезотелиома плевры – злокачественная агрессивно растущая опухоль, развивающаяся из серозной оболочки грудной полости.
Код(ы) МКБ-10:
Дата разработки/пересмотра протокола: 2017 год (пересмотр 2023 год)
Категория пациентов: взрослые.
Шкала уровня доказательности:
Мезотелиома плевры – злокачественная агрессивно растущая опухоль, развивающаяся из серозной оболочки грудной полости.
ВВОДНАЯ ЧАСТЬ
Код(ы) МКБ-10:
|
Код
|
Название |
| C45.0 | Мезотелиома плевры |
Дата разработки/пересмотра протокола: 2017 год (пересмотр 2023 год)
Пользователи протокола: врачи онкологи, химиотерапевты, торакальные хирурги, онкорадиологи, врачи общей практики, терапевты, общие хирурги.
Категория пациентов: взрослые.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследование случай-контроля с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов |
Классификация
Классификация [54]:
Гистологическая классификация мезотелиомы (МКБ-О) (Международная классификация онкологических заболеваний, 3-е издание (МКБ-О-3))
|
МКБ-О
|
Название |
|
9050/0
|
Мезотелиома, доброкачественная |
| 9050/3 | Мезотелиома, злокачественная |
|
9051/0
|
Фиброзная мезотелиома, доброкачественная |
| 9051/3 | Фиброзная мезотелиома, злокачественная |
|
9052/0
|
Эпителиоидная мезотелиома, доброкачественная |
| 9052/3 | Эпителиоидная мезотелиома, злокачественная |
|
9053/3
|
Мезотелиома, бифазная, злокачественная |
| 9054/0 | Аденоматоидная опухоль, БДУ |
|
9055/0
|
Поликистозная мезотелиома, доброкачественная |
| 9055/1 | Кистозная мезотелиома, БДУ |
Классификация мезотелиомы плевры по TNM: IMIG Staging System for Diffuse Malignant Pleural Mesothelioma (AJCC, 8-е изд. – 2017 г.).
Первичная опухоль:
Tх – первичная опухоль не может быть оценена.
Tо – первичная опухоль не определяется.
Т1 – опухоль, вовлекающая ипсилатеральную париетальную плевру (включая медиастинальную и диафрагмальную плевру) с или без вовлечения висцеральной плевры
T2 – опухоль прорастает в любую поверхность париетальной плевры на стороне поражения (париетальная, медиастинальная, диафрагмальная и висцеральная плевры). Присутствует одна из следующих характеристик:
сливающаяся опухоль висцеральной плевры (включая междолевую борозду);
инвазия в мышцы диафрагмы;
инвазия в легочную паренхиму.
T3 – опухоль местно-распространенная, но потенциально резектабельная. Опухоль, вовлекающая все ипсилатеральные плевральные поверхности (париетальная, медиастинальная, диафрагмальная и висцеральная плевры). Присутствует хотя бы одна из следующих характеристик:
инвазия во внутригрудную фасцию;
инвазия в жировую клетчатку средостения;
единичный, полностью резектабельный, опухолевый узел, инвазирующий мягкие ткани грудной стенки;
нетрансмуральное поражение перикарда.
T4 – местно-распространенная технически нерезектабельная опухоль. Опухоль прорастает все поверхности париетальной плевры на стороне поражения. Присутствует хотя бы одна из следующих характеристик:
диффузная или многоочаговая инвазия в мягкие ткани грудной клетки с поражением ребер или без него;
трансдиафрагмальное распространение в брюшину;
прорастание в любой орган (органы) средостения;
непосредственное распространение на контрлатеральную плевру;
инвазия позвоночника или плечевого сплетения;
трансмуральная инвазия перикарда (с выпотом в полости перикарда или без него);
инвазия в миокард.
Вовлечение региональных лимфатических узлов:
Nх – региональные лимфатические узлы не могут быть оценены;
N0 – нет метастазов в региональных лимфатических узлах;
N1 – метастазы в ипсилатеральных бронхолегочных, корня легкого или медиастинальных лимфатических узлах (включая внутренние грудные, перидиафрагмальные, межреберные лимфатические узлы, перикардиальная жировая клетчатка);
N2 – метастазы в контралатеральных бронхопульмональных лимфатических узлах, лимфатических узлах корня легкого или медиастинальных лимфатических узлах или ипсилатеральных или контралатеральных надключичных лимфатических узлах.
Отдаленные метастазы:
Mx – наличие отдаленных метастазов не может быть оценено;
М0 – нет отдаленных метастазов;
М1 – есть отдаленные метастазы.
Стадии:
При клинической оценке распространенности опухолевого процесса перед символами TNM ставится «с», а при патогистологической классификации – «р».
М0 – нет отдаленных метастазов;
М1 – есть отдаленные метастазы.
Стадии:
|
Стадия
|
T | N | M |
|
IA
|
T1 | N0 | M0 |
| IB | T2, T3 | N0 | M0 |
| II | T1, T2 | N1 | M0 |
| IIIA | T3 | N1 | M0 |
| IIIB | T1, T2, T3 | N2 | M0 |
| IV | T4 | N0, N1, N2 | M0 |
| Любой T | Любой N | M1 |
При клинической оценке распространенности опухолевого процесса перед символами TNM ставится «с», а при патогистологической классификации – «р».
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ [7-16]:
Диагностические критерии [1-7]:
Диагностические критерии – патогномоничных симптомов нет. Скрининговых программ для выявления мезотелиомы не существует. Диагностика мезотелиомы плевры сложная, особенно в плане дифференциального диагноза с метастазами рака молочной железы, легкого, почки, толстой кишки, яичников по плевре; с поражением плевры синовиальной саркомой и др. Основную роль в этиологии мезотелиомы плевры играет контакт с асбестом. У лиц контактирующих с асбестом, риск развития мезотелиомы плевры в 300 раз выше.
Жалобы и анамнез [8-14]:
Пациенты жалуются на боль в грудной клетке на стороне поражения, сухой или продуктивный кашель, на одышку, общую слабость, потливость по ночам, лихорадку, потерю веса, редко гемоптизис, синдром Горнера, синдром сдавления верхней полой вены. В анамнезе характерно постепенное нарастание жалоб по мере прогрессирования болезни. (УД – В).
Физикальное обследование [8-14]:
Осмотр, пальпация, перкуссия грудной клетки, аускультация легких.
Отставание дыхательной экскурсии на стороне поражения, Выбухание межреберных промежутков на стороне поражения, укорочение легочного тона, ослабление голосового дрожания и дыхания на пораженной стороне с большой степенью вероятности свидетельствуют о наличии значимого количества жидкости в плевральной полости.
Инструментальные исследования [15, 16, 17, 18, 19, 20, 21, 22, 23, 46, 47]:
Лабораторные исследования [8-14]:
- Общий (клинический) развернутый анализ крови, СОЭ (для диагностики анемии, лейкоцитоза/пении, тромбоцитоза/пении)
- Общий биохимический анализ крови (общий белок, глюкоза, общий билирубин, креатинин, мочевина, железо, аланинаминотрасфераза (АЛТ), аспартатаминотрансфераза (АСТ), щелочная фосфатаза, электролиты плазмы (калий, натрий, хлор), С-реактивный белок (СРБ).
- Коагулограмма (фибриноген, МНО, протромбиновое время, протромбиновый индекс, активированное частичное тромбопластиновое время (АЧТВ), тромбиновое время (ТВ) (характерна коагулопатия с повышенной свертываемостью).
- Общий (клинический) анализ мочи (для выявлений скрытых отклонений, которые могут послужить поводом провести более тщательное обследование)
Для исключения сопутствующей патологии и как минимальный диагностический объем обследования с целью определения функциональных возможностей организма [10, 12, 13, 14].
Инструментальные исследования [15, 16, 17, 18, 19, 20, 21, 22, 23, 46, 47]:
КТ органов грудной клетки (для определения органических изменений органов грудной клетки);
Диагностический алгоритм: (схема)
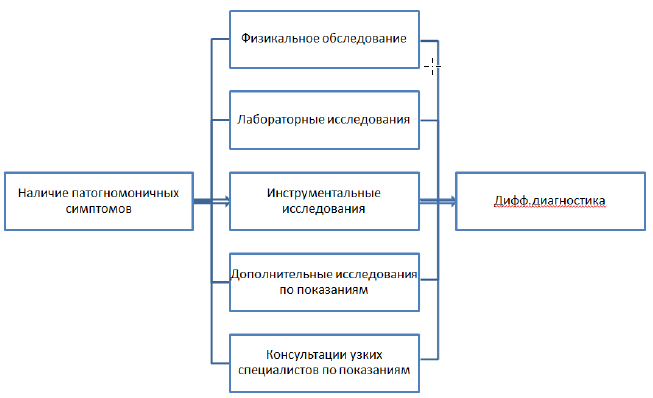
УЗИ шейно-надключичных, подключичных лимфатических узлов, органов брюшной полости, забрюшинного пространства и малого таза (для определения распространенности заболевания);
рентгенография органов грудной клетки (лишь для определения уровня гидроторакса); диагноз МП не может быть установлен по обычной рентгенограмме;
УЗИ плевральных полостей при выявлении наличия гидроторакса (для определения объема и характера жидкости, наличия сращений, а также для определения наиболее подходящей точки для пункции или дренирования плевральной полости);
спирография – для определения функции внешнего дыхания.
КТ или МРТ головного мозга с контрастным усилением (при наличии неврологических симптомов или при ранней стадии для исключения поражения);
ЭКГ и ЭхоКГ при поражении перикарда, а также для определения функциональной способности.
Торакоскопическая биопсия плевры или перикарда – для верификации;
ИГХ исследование опухоли – для морфологического диагностирования;
ИГХ исследование экспрессии PD-L1 в опухоли при прогрессировании после I-II линии терапии;
выполнение ПЭТ-КТ с целью первичного стадирования не рекомендуется.
Проведение дополнительных методов обследований, таких как сцинтиграфия костей всего тела или МРТ головного мозга, рекомендуется при наличии жалоб у пациента или при ранней стадии (I-III) болезни для исключения отдаленных метастазов перед операцией. (УД – В).
Рекомендуется проведение ПЭТ/КТ с фтордезоксиглюкозой в диагностике поражения плевры и в качестве контроля после проведенного лечения [18, 19]. (УД – В).
Рекомендуется при выявлении поражения плевры выполнить торакоскопическую биопсию с обязательным патологоанатомическим исследованием биопсийного (операционного) материала с применением иммуногистохимических (ИГХ) методов для морфологического подтверждения диагноза, определения гистотипа опухоли и выработки адекватной стратегии лечения [10, 14, 20, 21, 22, 23]. Мезотелиальные клетки могут быть дифференцированы от фибробластических и эпителиальных только при электронной микроскопии и иммунофенотипировании. (УД – В). Диагностическая торакоскопия является наиболее важным методом диагностики, позволяющим получить необходимое количество материала для последующего морфологического анализа опухоли и визуально оценить характер изменений по плевре. Диагноз может считаться на 100 % доказанным только после ИГХ. Для мезотелиомы характерно наличие ряда маркеров: кальретинин, антиген WT-1, виментин, мезотелин.
Рекомендуется всем пациентам с подозрением на мезотелиому плевры выполнить компьютерную томографию (КТ) органов грудной клетки с контрастированием с целью определения распространенности опухолевого процесса, дифференциального диагноза, а также в процессе лечения – для оценки эффективности проводимой терапии [15, 16, 17] (УД – В).
Проведение дополнительных методов обследований, таких как сцинтиграфия костей всего тела или МРТ головного мозга, рекомендуется при наличии жалоб у пациента или при ранней стадии (I-III) болезни для исключения отдаленных метастазов перед операцией. (УД – В).
Рекомендуется проведение ПЭТ/КТ с фтордезоксиглюкозой в диагностике поражения плевры и в качестве контроля после проведенного лечения [18, 19]. (УД – В).
Рекомендуется при выявлении поражения плевры выполнить торакоскопическую биопсию с обязательным патологоанатомическим исследованием биопсийного (операционного) материала с применением иммуногистохимических (ИГХ) методов для морфологического подтверждения диагноза, определения гистотипа опухоли и выработки адекватной стратегии лечения [10, 14, 20, 21, 22, 23]. Мезотелиальные клетки могут быть дифференцированы от фибробластических и эпителиальных только при электронной микроскопии и иммунофенотипировании. (УД – В). Диагностическая торакоскопия является наиболее важным методом диагностики, позволяющим получить необходимое количество материала для последующего морфологического анализа опухоли и визуально оценить характер изменений по плевре. Диагноз может считаться на 100 % доказанным только после ИГХ. Для мезотелиомы характерно наличие ряда маркеров: кальретинин, антиген WT-1, виментин, мезотелин.
Показания для консультации специалистов:
консультация кардиолога (при наличии сопутствующей патологии ССС);
консультация невропатолога (при неврологических нарушениях, в том числе инсультах, травмах головного и спинного мозга, эпилепсии, миастении, нейроинфекционных заболеваниях, а также во всех случаях потери сознания);
консультация гастроэнтеролога (при наличии сопутствующей патологии органов ЖКТ в анамнезе);
консультация нейрохирурга (при наличии метастазов в головной мозг, позвоночник);
консультация эндокринолога (при наличии сопутствующей патологии эндокринных органов);
консультация фтизиатра (при подозрении на туберкулезный процесс или перенесенный туберкулезный процесс).
Диагностический алгоритм: (схема)

Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований [53]:
|
Диагноз
|
Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Плевропневмония | Клиническая и рентгенологическая симптоматика имеют ряд сходств. | Физикальное обследование, общеклинические анализы, рентгенография ОГК, КТ ОГК, плевральная пункция с микроскопией плевральной жидкости. |
Начало болезни обычно острое с лихорадкой; кашля в начале может не быть; одышка при большом поражении легочной ткани; кровохарканье редко, интоксикация
не выражена. Физикальные данные
выражены ярко: меняется характер дыхания и появляются влажные хрипы. Лабораторные данные: лейкоцитоз, рост СОЭ, которые снижаются после разрешения пневмонии. Рентгенологические данные: резко выражены, чаще поражаются нижние доли, очаговые тени однородные, границы расплывчатые, усиление легочного рисунка, увеличение корней легкого. Эффект от антибиотиков выражен, обратное
развитие процесса через 9-12 дней.
|
| Туберкулез легких и туберкулезный плеврит | Клиническая и рентгенологическая симптоматика имеют ряд сходств. | Общеклинические анализы, рентгенография ОГК, КТ ОГК, плевральная пункция с микроскопией плевральной жидкости, микроскопия мокроты, посев мокроты на микобактерии туберкулеза и смешанную фло-ру, туберкулиновая проба | Преимущественно о туберкулезе могут свидетельствовать молодой возраст больного, признаки туберкулезной интоксикации, контактный анамнез, положительные результаты туберкулиновой пробы, бактериологического исследования мокроты и промывных вод бронхов, кровохарканье, вовлечение плевры, а также результат пробной противотуберкулезной терапии (диагноз "ex juvantibus"). |
| Метастатическое поражение легких и плевры | Характер поражения ткани легкого и плевры (множественные специфические поражения легких и/или плевры, канцероматоз, плеврит) | Физикальное обследование, общеклинические анализы, рентгенография ОГК, КТ ОГК, плевральная пункция с микроскопией плевральной жидкости, трансторакальная биопсия опухоли с гистологическим исследованием, онкомаркеры, КТ ОБП, МРТ головного мозга, УЗИ периферических лимфоузлов. | Прогрессирующая одышка, нарастает со временем. Кашель обычно сухой, через длительное время может стать продуктивным за счет присоединения вторичной инфекции. Бывает кровохарканье, боль в грудной клетке. Возможен бронхоспастический синдром. Необходимо учитывать анамнез, предшествующие оперативные вмешательства, профессиональные вредности, стаж курения. Диагноз подтверждается результатом гистологического или цитологического исследования. |
Дополнительные методы исследований [10, 11, 15, 46, 47]:
Радиоизотопное исследование скелета – при подозрении на поражение костей;
УЗДГ сосудов шеи и нижних конечностей – при гиперкоагуляции; наличие в анамнезе тромбоза, ОНМК и т.п.;
Гастродуоденоскопия – при наличии у пациента язвенного анамнеза, а также при наличии жалоб со стороны пищеварительного тракта; необходима для оценки функционального состояния желудка и ДПК, при необходимости взятие соответствующего анализа.
Гастродуоденоскопия – при наличии у пациента язвенного анамнеза, а также при наличии жалоб со стороны пищеварительного тракта; необходима для оценки функционального состояния желудка и ДПК, при необходимости взятие соответствующего анализа.
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ [45]
Немедикаментозное лечение [45]:
Режим общий;
Диета стол №15 (или с учетом сопутствующих заболеваний).
Медикаментозное лечение: нет.
Хирургическое вмешательство: нет.
Дальнейшее ведение [24]:
Реабилитацию необходимо проводить, ориентируясь на общие принципы реабилитации пациентов после проведенных хирургических вмешательств и/или химиотерапии.
Рекомендуется всем пациентам после проведенного лечения согласно общим принципам проведения онкологического компонента диспансеризации проходить активное динамическое наблюдение с целью выявления ранних признаков прогрессирования заболевания/рецидива: 1-й год – каждые 3 мес, 2-й год – каждые 6 мес. до общей продолжительности 5 лет с проведением инструментальных исследований [24]. Обязательными диагностическими процедурами являются КТ органов грудной клетки, УЗИ шейно-надключичных, подключичных лимфоузлов, органов брюшной полости, забрюшинного пространства и малого таза, ЭКГ + ЭхоКГ при поражении оболочек сердца.
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе:
Критерии RECIST: - измерение опухолевых очагов для оценки динамики опухолевого процесса в ходе лечения.
Полный ответ (Complete Response - CR) - исчезновение всех опухолевых очагов.
Частичный ответ (Partial Response - PR) - уменьшение суммы диаметров очагов не менее чем на 30%.
Стабилизация заболевания (Stable Disease - SD) - увеличение очагов менее чем на 20% или уменьшение менее чем 30% без появления новых очагов.
Прогрессирование заболевания (Progressive Disease - PD) - увеличение суммы диаметров основных очагов более чем на 20% или появление новых очагов.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ [45]
Карта наблюдения пациента, маршрутизация пациента
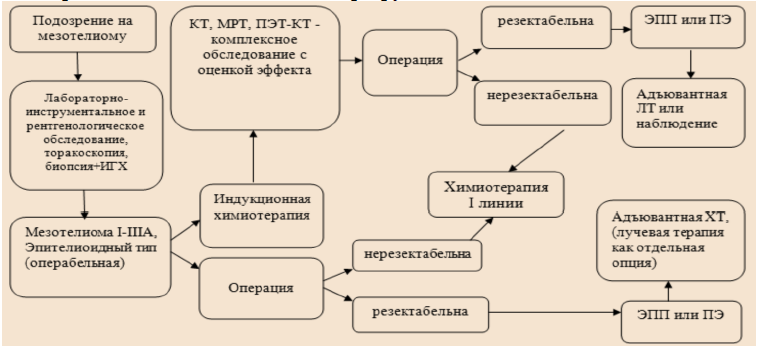
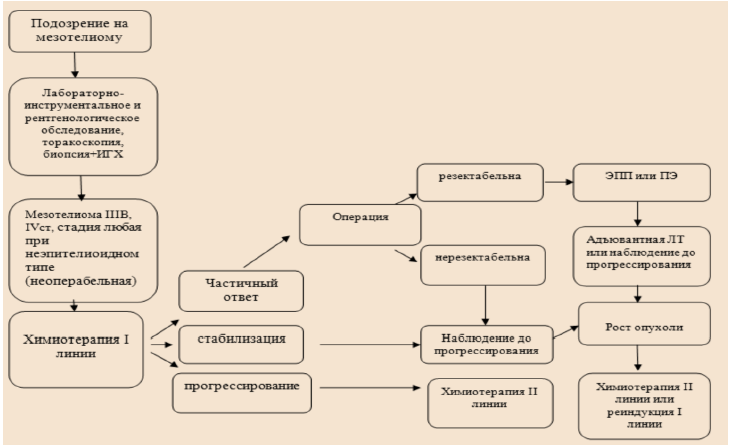
Немедикаментозное лечение [45]:
Режим общий;
Диета стол №15 (или с учетом сопутствующих заболеваний).
Лучевая терапия [54]:
Показания к лучевой терапии [54, 55]:
морфологически установленный диагноз злокачественного новообразования;
при рецидивах, продолженном росте опухоли или прогрессировании заболевания после ранее проведенного комбинированного или комплексного лечения;
радикальное хирургическое лечение не показано в связи с функциональным состоянием;
при отказе больного от хирургического лечения;
при неоперабельности процесса.
Противопоказания к лучевой терапии [54, 55]:
тяжелое состояние больного ECOG III–IV;
туберкулез в активной фазе;
сопутствующая патология в стадии декомпенсации;
острые неотложные состояния (инфаркт миокарда, инсульт);
острые воспалительные заболевания;
септические состояния;
опухоли в стадии распада, сопряженные с риском кровотечения;
наличие экссудативного плеврита;
беременность;
психические заболевания (шизофрения, эпилепсия с выраженным судорожным синдромом);
общее тяжелое состояние больного, активность по шкале Карновского менее 60% или любое иное состояние, препятствующее проведению лечения по мнению врача радиационного онколога или МДГ.
Целевая функция лучевой терапии [56, 57, 58]:
Лучевая терапия как самостоятельный метод лечения не используется. При проведении адъювантной лучевой терапии поле облучения обязательно включает париетальную плевру при декортикации легкого, границы хирургических клипс после экстраплевральной пневмонэктомии и участки с возможными остаточными проявлениями. Облучение лимфатических узлов средостения и надключичных зон не рекомендуется.
Послеоперационная ЛТ возможна у пациентов в удовлетворительном состоянии (ECOG 0–1), с сохранной легочной функцией, при которой пациент не нуждается в кислородотерапии, без признаков почечной недостаточности, при отсутствии отдаленных метастазов.
ЛТ проводится квалифицированными специалистами в специализированных центрах с применением методик IMRT, VMAT, TomoTherapy, которые исключают большую часть легкого из облучения.
Целевая функция лучевой терапии [56, 57, 58]:
• радикальная лучевая терапия;
Виды лучевой терапии [58, 59, 60, 61]:
• паллиативная лучевая терапия;
• симптоматическая лучевая терапия;
• профилактическая лучевая терапия.
Виды лучевой терапии [58, 59, 60, 61]:
• фотонная терапия (тормозное излучение высоких энергий, гамма терапия);
• корпускулярная терапия (быстрые электроны высоких энергий, протонная, ионная, нейтронная).
Способы лучевой терапии [58, 59, 60, 61]:
Методики лучевой терапии [58, 59, 60, 61]:
послеоперационная лучевая терапия;
самостоятельная лучевая терапия в последовательности с химиотерапией.
Способы лучевой терапии [58, 59, 60, 61]:
1-мерная лучевая терапия (1D RT);
2-х мерная конвенциальная (стандартная) лучевая терапия (2D RT);
3-х мерная конформная лучевая терапия (3D CRT);
интенсивно-модулированная лучевая терапия (IMRT);
лучевая терапия, управляемая по изображениям (IGRT);
лучевая терапия, синхронизированная с дыханием (4D RT);
адаптивная лучевая терапия (ART);
томотерапия на томоаппаратах;
стереотаксическая радиохирургия (SRS);
стереотаксическая радиотерапия (SRT);
стереотаксическая радиотерапия туловища (SBRT);
интраоперационная лучевая терапия (IORT);
протонная лучевая терапия (PRT).
Методы лучевой терапии [58, 62, 63, 64, 65]:
однофракционная лучевая терапия при SRS - Стереотаксическая радиохирургия (SRS) – одномоментное подведение высокой дозы (РОД 12 Гр и более) с использованием стереотаксической техники; применяется при небольших опухолях (до 3 см в максимальном измерении) с четкими границами.
ультрагипофракционирование при SRT/SBRT - Стереотаксическая радиотерапия туловища (SRT/SBRT) - крупнофракционное облучение от 3-х до 5 фракций РОД от 5,0 до 10,0 Гр ежедневно до СОД 20,0-50,0 Гр. В основном применяется при опухолях диаметром более от 3 см до 5,0, но можно и при небольших опухолях до 3,0 см в наибольшем измерении.
стандартное фракционирование – классический режим фракционирования: РОД 1,8-2,2 Гр до 5 фракций в неделю, расщепленный или непрерывный курс, до СОД 40,0-70,0 Гр. Используется в предоперационном, послеоперационном, самостоятельном режиме.
Таблица – Основные рекомендуемые дозы лучевой терапии при мезотелиоме плевры.
|
Назначение
|
СОД | РОД | Длительность лечения |
| После операции экстраплевральная пневмонэктомия | 50,0 - 60,0 Гр | 1,8 - 2,0 Гр | 6 -7 недель |
| После операции плеврэктомия | 45,0 - 54,0 Гр | 1,8 - 2,0 Гр | 5 - 6 недель |
| После циторедуктивных (R2) резекций | 50,0 - 54,0 Гр | 1,8 - 2,0 Гр | 5 - 6 недель |
| Паллиативная: с обезболивающей целью на грудную клетку | 20, 0 – 40,0 Гр | 3,0 - 4,0 Гр | 1 - 2 недели |
| Паллиативная: на область асимптомного рецидива | 30,0 – 40,0 Гр | 3,0 - 4,0 Гр | 2 недели |
| Метастазы в головном мозге или костях | Возможны варианты см пункт: «Методика лучевой терапии при отдаленных метастазах» | ||
Техническое обеспечение предлучевой подготовки и лучевой терапии [54, 56, 57, 59, 65]:
Предлучевая топометрическая подготовка может проводиться на рентгеновском диагностическом аппарате, рентгеновском симуляторе, рентгеновском симуляторе с компьютерно-томографической приставкой для CBCT, компьютерном томографе со специально приспособленной декой стола, компьютерном томографе-симуляторе с функцией виртуальной симуляции.
Дистанционная лучевая терапия может проводиться на гамма-терапевтических аппаратах с источником кобальт (Co60), линейных ускорителях электронов, томоаппаратах, системе протонной терапии (ускоритель, ESS, BTS, систему облучения роботизированный стол). При наличии у ЛУЭ MLC и EPID возможно проведение высокотехнологических методик облучения: 3D-CRT, IMRT, IGRT, ART. При наличии у ЛУЭ OBI для киловольтной визуализации возможно проведение высокотехнологических методик облучения: IGRT, SRS, SRT.
Интраоперационная лучевая терапия должна проводиться на специальных радиотерапевтических аппаратах для интраоперационного облучения – мини линейных ускорителях или мини бетатронах, доза подбирается индивидуально.
Обязательно наличие иммобилизационных и фиксирующих приспособлений: специальных фиксирующих досок для термопластических масок и подголовников, стереотаксической рамки для проведения SRS или SRT, подколенников и подстопников, вакуумных матрасов.
Наличие программ компьютерного дозиметрического планирования для конвенциальной и высокотехнологичной лучевой терапии (3D CRT, IMRT, SRS, SRT).
Минимальный или расширенный пакет стандартного дозиметрического оборудования.
Тотальное облучение головного мозга до С1 шейного позвонка:
Лучевая терапия при метастазах в кости скелета.
Методика лучевой терапии при отдаленных метастазах [55, 57]:
Локальное облучение головного мозга:
стереотаксическая радиохирургия (SRS) – РОД 10,0-30,0 Гр 1 фракция при размерах метастаза не более 3 см в диаметре;
стереотаксическая радиотерапия (SRT) – РОД 6,0-10,0 Гр 3-5 фракций при размерах метастаза от 3,0 до 6,0 см;
локальное облучение метастазов РОД 2,0-3,0 до СОД 20-60 Гр.
Тотальное облучение головного мозга до С1 шейного позвонка:
РОД 2,0 Гр 5 фракций в неделю СОД 30-40 Гр;
РОД 2,5 Гр 5 фракций в неделю СОД 30-35 Гр;
РОД 3,0 Гр 5 фракций в неделю СОД 30-33 Гр;
РОД 4,0 Гр 5 фракций СОД 20 Гр.
Лучевая терапия при метастазах в кости скелета.
РОД 2,0 Гр 5 фракций в неделю СОД 40-50 Гр;
РОД 2,5 Гр 5 фракций в неделю СОД 40-50 Гр;
РОД 3,0 Гр 5 фракций в неделю СОД 30-45 Гр;
РОД 4,0 Гр 3-5 фракций в неделю СОД 20-40 Гр;
РОД 8,0 Гр 1-2 фракции.
Перечень основных лекарственных средств (имеющих 100% вероятность применения)
Назначается проведение 6 курсов химиотерапии с последующим динамическим наблюдением. Смена режима химиотерапии должна проводиться только при доказанном прогрессировании заболевания или в случае непереносимости лекарственного лечения. В случае прогрессирования болезни после 6 месяцев и более от последнего курса химиотерапии желательна реиндукция режима 1-й линии лечения. При раннем прогрессировании (на фоне химиотерапии или менее 6 месяцев после завершения химиотерапии) назначается вторая линия терапии.
Рекомендуется в качестве II-III линии лечения иммунотерапия пембролизумабом 200мг в/в капельно каждые 3 недели у пациентов c мезотелиомой плевры при экспрессии PD-L1 ≥1%, которая помогает достичь частоту объективных ответов в 22% случаев, а контроль роста опухоли у 76% пациентов, но не увеличивает время до прогрессирования и общую выживаемость [43, 44].
Медикаментозное лечение [35-44]:
При невозможности выполнения оперативного вмешательства при ранней стадии, смешанном или саркоматоидном подтипе и при распространенном опухолевом процессе (IIIB–IV стадии для мезотелиомы плевры) применяется химиотерапия (Таблица 1).
Перечень основных лекарственных средств (имеющих 100% вероятность применения)
|
Фармакотерапевтическая группа
|
МНН лекарственного средства | Способ применения | Уровень доказательности |
|
Противоопухолевое средство, антиметаболит
|
Пеметрексед | в/в 1 раз в 3 недели | А |
|
Противоопухолевое средство, цитостатик
|
Цисплатин | в/в – 1 раз в 3 недели | А |
|
Противоопухолевое средство, цитостатик
|
Карбоплатин | в/в – 1 раз в 3 недели | А |
|
Противоопухолевое средство, цитостатик
|
Гемцитабин | в/в – 1,8 дни – в 3 недели | А |
|
Таргетный препарат
|
Бевацизумаб | в/в – 1 раз в 3 недели | А |
|
Противоопухолевое средство, цитостатик
|
Винорельбин | в/в – 1,8,15 дни - 1 раз в 4 недели | В |
|
Противоопухолевое средство, цитостатик, антрациклиновый антибиотик
|
Доксорубицин | в/в – 1 раз в 3 недели | С |
|
Иммуноонкологический препарат
|
Ниволумаб | в/в – 1 раз в 2 недели | А |
|
Иммуноонкологический препарат
|
Ипилимумаб | в/в – 1 раз в 6 недель | А |
|
Иммуноонкологический препарат
|
Пембролизумаб | в/в – 1 раз в 3 недели | А |
Таблица 1.
|
Схема лечения
|
Режим химиотерапии |
| 1 линия | |
| PP | пеметрексед 500 мг/м2 в/в в 1-й день + цисплатин 75 в/в мг/м2 в 1-й день, каждый 21 день до 4-6 курсов с последующей поддерживающей терапией пеметрекседа до прогрессирования или непереносимой токсичности |
| PP + бевацизумаб | пеметрексед 500 мг/м2 в/в в 1-й день + цисплатин 75 мг/м2 в/в в 1-й день + бевацизумаб 15 мг/кг в/в в 1-й день, каждый 21 день до 4-6 курсов с последующей поддерживающей терапией пеметрекседа + бевацизумаб каждые 3 недели до прогрессирования или непереносимой токсичности |
| GP | гемцитабин 1000-1250 мг/м2 в/в в 1-й и 8-й дни + цисплатин 75 мг/м2 в/в в 1-й день, каждый 21 день до 4-6 курсов |
| АР | доксорубицин 60 мг/м2 в/в в 1-й день + цисплатин 60 мг/м2 в/в в 1-й день, каждый 21 день до 4-х курсов |
|
Ниволумаб*
+ ипилимумаб*
|
ниволумаб 3мг/кг или 240 мг в/в 1 раз в 14 дней или 360 мг в/в каждые 3 недели + ипилимумаб 1 мг/кг в/в 1 раз в 6 недель не более 2 лет либо до прогрессирования или непереносимой токсичности [51, 52, 53, 54] |
| Схемы химиотерапии для пациентов с сопутствующими заболеваниями или пациентов, не способных переносить цисплатин: | |
| PC | пеметрексед 500 мг/м2 в/в в 1-й день + карбоплатин AUC5 (6) в/в в 1-й день, каждый 21 день с последующей поддерживающей терапией пеметрекседа 500 мг/м2 до прогрессирования или непереносимой токсичности |
| PC + бевацизумаб | пеметрексед 500 мг/м2 в/в в 1-й день + карбоплатин AUC5 (6) в/в в 1-й день + бевацизумаб 15 мг/кг в/в в 1-й день, каждый 21 день с последующей поддерживающей терапией пеметрекседа + бевацизумаб каждые 3 недели до прогрессирования или непереносимой токсичности |
| GC | гемцитабин 1000-1250 мг/м2 в/в в 1-й и 8-й дни + карбоплатин AUC5 (6) в/в в 1-й день, каждый 21 день до 4-6 курсов |
| 2 и последующие линии (или 1 линия при противопоказаниях к препаратам платины и комбинированной ХТ) | |
|
гемцитабин
|
750–1200 мг/м² в/в в 1-й, 8-й, 15-й дни, каждые 28 дней |
|
винорелбин
|
20 мг/м2 в/в в 1-й, 8-й, 15-й дни, каждые 28 дней |
|
винорелбин
|
25–30 мг/м2 в/в в 1-й и 8-й дни, каждый 21 день |
|
пеметрексед
|
500 мг/м2 в/в в 1-й день, каждый 21 день |
|
пембролизумаб
|
200 мг каждые 3 недели при PD-L1 ≥ 1% либо MSI-H, до прогрессирования или непереносимой токсичности |
*не зарегистрирован на территории Республики Казахстан
Рекомендуется два основных режима химиотерапии первой линии – это платиносодержащие режимы в комбинации с пеметрекседом или гемцитабином:
1) пациентам с I–IIIA стадиями возможно проведение 2–4 курсов неоадъювантной химиотерапии. Оптимальный режим лекарственного лечения 1-й линии: пеметрексед + цисплатин (или карбоплатин) [35, 36].
(УД – А).
2) альтернативный режим лекарственного лечения 1-й линии: гемцитабин + цисплатин [37, 38].
(УД – С).
Назначается проведение 6 курсов химиотерапии с последующим динамическим наблюдением. Смена режима химиотерапии должна проводиться только при доказанном прогрессировании заболевания или в случае непереносимости лекарственного лечения. В случае прогрессирования болезни после 6 месяцев и более от последнего курса химиотерапии желательна реиндукция режима 1-й линии лечения. При раннем прогрессировании (на фоне химиотерапии или менее 6 месяцев после завершения химиотерапии) назначается вторая линия терапии.
Рекомендуется добавление бевацизумаба 15 мг/кг в/в каждые 3 недели к основным режимам химиотерапии пациентам, который может оставаться в поддерживающем режиме до 1 года с целью получения максимально возможной эффективности и увеличения продолжительности жизни [39, 40, 41, 42].
(УД – С).
Рекомендуется в качестве II-III линии лечения иммунотерапия пембролизумабом 200мг в/в капельно каждые 3 недели у пациентов c мезотелиомой плевры при экспрессии PD-L1 ≥1%, которая помогает достичь частоту объективных ответов в 22% случаев, а контроль роста опухоли у 76% пациентов, но не увеличивает время до прогрессирования и общую выживаемость [43, 44].
(УД – В).
Перечень дополнительных лекарственных средств (менее 100% вероятности применения)
Хирургический метод лечения является основным для локализованного процесса и эпителиоидного типа опухоли. Как и при других видах опухолей, хирургический метод лечения направлен на удаление опухолевого проявления болезни. Целью циторедукции при мезотелиоме плевры является «максимально возможное макроскопическое удаление» опухоли. Иными словами, необходимо удаление всех «видимых» проявлений. Операция типа R0 представляется сомнительной.
Перечень дополнительных лекарственных средств (менее 100% вероятности применения)
|
Фармакотерапевтическая группа
|
МНН лекарственного средства | Способ применения | Уровень доказательности |
|
Глюкокортикостероид
|
Преднизолон | 30 мг/м 2 в/в в 1–3-й день | С |
| Человеческий гранулоцитарный колониестимулирующий фактор, стимуляторы лейкопоэза |
Филграстим
|
Филграстим 5 мкг / кг п / к | С |
Хирургическое вмешательство [25-32]:
Прицельная биопсия опухоли (с целью забора материала для цитологического или/и гистологического исследования) путем трансторакальной пункции – для верификации диагноза.
Показания: наличие опухоли плевры доступной для трансторакальной биопсии под УЗИ или КТ контролем.
Противопоказания: тяжелые сопутствующие заболевания (инфаркт миокарда, сепсис, энцефалопатия, декомпенсированный цирроз, терминальная стадия основной болезни, активное желудочно-кишечное кровотечение), некоррегируемая коагулопатия, расположение опухоли рядом с крупными сосудами, мтс позвоночника не позволяющие пациенту принять необходимую укладку во время трансторакальной пункции.
Плевроцентез
Симптоматический метод лечения.
Показаниями для плевроцентеза являются:
— наличие жидкости в плевральной полости с уровнем выше 2–3 ребра при рентгенографии; или при УЗИ более 1000 мл жидкости.
— симптомы легочно-сердечной недостаточности (выраженная одышка в покое, приглушенный ритм сердца, распирающая боль в грудной клетке и т.д.). При отсутствии клинических симптомов выполнение плевроцентеза не показано. У 70 % больных отмечается повторное накопление жидкости. При быстром и клинически значимом накоплении жидкости, требующем повторных плевральных пункций с частотой более 3 раз в месяц, показано проведение плевродеза (облитерации плевральной полости). Для плевродеза применяют лекарственные препараты с местно-раздражающим действием, такие как блеомицин или цисплатин, а также поверхностно активное вещество с неспецифическим склерозирующим эффектом — тальк. Плевродез является малым хирургическим вмешательством и должен проводиться только в стационаре хирургом с участием химиотерапевта. Следует учитывать системное воздействие цитотоксических веществ, вводимых внутриплеврально, и по возможности не выполнять эту процедуру одновременно с ХТ во избежание усиления токсичности.
Хирургический метод лечения является основным для локализованного процесса и эпителиоидного типа опухоли. Как и при других видах опухолей, хирургический метод лечения направлен на удаление опухолевого проявления болезни. Целью циторедукции при мезотелиоме плевры является «максимально возможное макроскопическое удаление» опухоли. Иными словами, необходимо удаление всех «видимых» проявлений. Операция типа R0 представляется сомнительной.
Вариантами выбора объема оперативного лечения являются:
1) плеврэктомия/декортикация с медиастинальной лимфодиссекцией с/без резекции перикарда с/без резекции диафрагмы с их реконструкцией;
2) экстраплевральная пневмонэктомия (далее – ЭПП) с плеврэктомией, с резекцией перикарда, диафрагмы или без нее.
Рекомендуется пациентам с ранними стадиями эпителиоидной мезотелиомы плевры I-III (без N2) проведение ЭПП с резекцией перикарда и диафрагмы или без нее, которая считается более оптимальной с онкологической точки зрения, хотя и сопряжена с большим числом осложнений и послеоперационной смертности – 7%. Декортикация в данном случае будет более безопасной (2-3% послеоперационных осложнений и смертности). Выбор объема операции зависит от многих факторов в каждом конкретном случае [25-30] (УД – А).
Cаркоматоидный гистологический тип опухоли и поражение лимфатических узлов N2 являются спорными факторами для хирургического вмешательства. ЭПП с резекцией перикарда и диафрагмы может сопровождаться высокой частотой осложнений и должна выполняться опытными торакальными хирургами. Хирургическое лечение МП проводится при соблюдении критериев отбора, которыми являются: ранняя стадия заболевания, удовлетворительный функциональный статус (ECOG 0–1).
Плеврэктомия рекомендуется при любой стадии болезни для купирования постоянного накопления жидкости в плевральной полости, как этап при мультимодальном лечении для достижения максимального лечебного противоопухолевого эффекта и улучшения качества жизни (УД – А). Плеврэктомия не показала увеличения выживаемости по сравнению с ЭПП, но смогла сократить рецидивы накопления плевральной жидкости лучше, чем плевродез тальком. Париетальная плеврэктомия или плевродез показаны для купирования рецидивирующего плеврита [31, 32].
Дальнейшее ведение [24]:
Плеврэктомия рекомендуется при любой стадии болезни для купирования постоянного накопления жидкости в плевральной полости, как этап при мультимодальном лечении для достижения максимального лечебного противоопухолевого эффекта и улучшения качества жизни (УД – А). Плеврэктомия не показала увеличения выживаемости по сравнению с ЭПП, но смогла сократить рецидивы накопления плевральной жидкости лучше, чем плевродез тальком. Париетальная плеврэктомия или плевродез показаны для купирования рецидивирующего плеврита [31, 32].
Комбинированные методы лечения [33]:
Вопрос о комбинированной терапии решается индивидуально.
Пациентам при метастатической мезотелиоме плевры возможен комбинированный подход: циторедуктивная операция + гипертермическая химиоперфузия плевральной полости для увеличения продолжительности жизни пациента (УД – С). Данный метод лечения позволяет достичь медианы выживаемости в 15,4 мес.
Дальнейшее ведение [24]:
Реабилитацию необходимо проводить, ориентируясь на общие принципы реабилитации пациентов после проведенных хирургических вмешательств и/или химиотерапии, лучевой терапии.
Рекомендуется всем пациентам после проведенного лечения согласно общим принципам проведения онкологического компонента диспансеризации проходить активное динамическое наблюдение с целью выявления ранних признаков прогрессирования заболевания/рецидива: 1-й год – каждые 3 месяца, 2-й год – каждые 6 месяцев до общей продолжительности 5 лет с проведением инструментальных исследований. Обязательными диагностическими процедурами являются КТ грудной клетки, УЗИ шейно-надключичных, подключичных, органов брюшной полости, забрюшинного пространства и малого таза.
При выраженном болевом синдроме лечение осуществляется в соответствии с рекомендациями протокола «Паллиативная помощь больным с хроническими прогрессирующими заболеваниями в инкурабельной стадии, сопровождающимися хроническим болевым синдромом».
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе:
«ответ опухоли» - регрессия опухоли после проведенного лечения;
безрецидивная выживаемость (трех и пятилетняя);
«качество жизни» включает кроме психологического, эмоционального и социального функционирования человека, физическое состояние организма больного.
Критерии RECIST:
Полный ответ (Complete Response - CR) - исчезновение всех опухолевых очагов.
Частичный ответ (Partial Response - PR) - уменьшение суммы диаметров очагов не менее чем на 30%.
Стабилизация заболевания (Stable Disease - SD) - увеличение очагов менее чем на 20% или уменьшение менее чем 30% без появления новых очагов.
Прогрессирование заболевания (Progressive Disease - PD) - увеличение суммы диаметров основных очагов более чем на 20% или появление новых очагов.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ [45]
Показания для плановой госпитализации:
Cпециализированное противоопухолевое лечение при морфологически верифицированной мезотелиоме плевре (хирургическое вмешательство, ЛТ, медикаментозная терапия и др.), а также при подозрении на мезотелиому плевры с целью проведения оперативной биопсии плевры, требующему наблюдения пациента в условиях круглосуточного стационара.
Показания для экстренной госпитализации: нет.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- 1) Carbone M., Kanodia S., Chao A. et al. Consensus Report of the 2015 Weinman International Conference on Mesothelioma. J Thorac Oncol 2016; 11:1246–1262. 2) Linton A., Vardy J., Clarkeet S. et al. The ticking time-bomb of asbestos: Its insidious role in the development of malignant mesothelioma. J Critical Rev Oncol 2012;84(2):200–212. 3) Teta M.J., Lau E., Sceurman B.K. et al. Therapeutic radiation for lymphoma: risk of malignant mesothelioma. Cancer 2017;109:1432–1438. 4) Dogan A.U., Baris Y.I., Dogan M. et al. Genetic predisposition to fiber carcinogenesis causes a mesothelioma epidemic in Turkey. Cancer Res 2016; 66,10:5063–5068. 5) Bocchetta M.I., Resta Di, Powers A. et al. Human mesothelial cells are unusually susceptible to simian virus 40-mediated transformation and asbestos co-carcinogenesis. Proc Natl Acad Sci USA 2014;97:10214–10219. 6) Finn R.S., Brims F.J.H., Gandhi A. et al. Postmortem Findings of Malignant Pleural Mesothelioma: A Two-Center Study of 318 Patients. Chest 2017; 142(5):1267–1273. 7) Tural Onur et al. Are neutrophil/lymphocyte ratio and platelet/lymphocyte ratio reliable parameters as prognostic indicator in malignant mesothelioma? Therap and Clin Risk Management. 2016;12:651-656 8) Rochet N. et al. The role of complete blood cell count in prognosis – watch this space! Oncol and Hematol rew. 2018; 8(1):76-82 9) Van Zandwijk N. et al. Guidelines for the diagnosis and treatment of malignant pleural mesothelioma. J. Thorac Dis. 2013; 5:E254-307 10) Koksal D. et al. Thromboembolic events in malignant pleural mesothelioma //Clinical and Applied Thrombosis/Hemostasis. – 2016. – Т. 22. – №. 4. – С. 390-394 11) Takamori S. et al. The C-reactive protein/albumin ratio is a novel significant prognostic factor in patients with malignant pleural mesothelioma: a retrospective multiinstitutional study //Annals of surgical oncology. – 2018. – Т. – №. 6. – С. 1555-1563 12) Harris E. J. A. et al. Prediction modelling using routine clinical parameters to stratify survival in Malignant Pleural Mesothelioma patients undergoing cytoreductive surgery //Journal of Thoracic Oncology. – 2019. – Т. 14. – №. 2. – С. 288-293 13) Rump A, Morikawa Y, Tanaka M, Minami S, Umesaki N, Takeuchi M, Miyajima A. Binding of ovarian cancer antigen CA125/MUC16 to mesothelin mediates cell adhesion. J Biol Chem. 2014;279:9190–8 14) Truong M.T., Viswanathan C., Godoy M.B. et al. Malignant Pleural Mesothelioma: Role of CT, MRI, and PET/CT in Staging Evaluation and Treatment Considerations. J Semin Roentgenol 2013; 48(4):323–334. 15) Kawashima A., Libshitz H. I. Malignant pleural mesothelioma: CT manifestations in 50 cases //AJR. American journal of roentgenology. – 2013. – Т. 155. – №. 5. – С. 965-969. 16) Heelan R. T. et al. Staging of malignant pleural mesothelioma: comparison of CT and MR imaging //AJR. American journal of roentgenology. – 2019. – Т. 172. – №. 4. – С. 1039- 1047. 17) Kruse M., Sherry S., Paidpally V. et al. FDG PET/CT in the Management of Primary Pleural Tumors and Pleural Metastases. Am J Roentgenol 2013; 201:215–226. 18) Yildirim H. et al. Clinical value of fluorodeoxyglucose-positron emission tomography/computed tomography in differentiation of malignant mesothelioma from asbestosrelated benign pleural disease: an observational pilot study //Journal of Thoracic Oncology. – 2019. – Т. 4. – №. 12. – С. 1480-1484 19) Kao SC et al. Accuracy of diagnostic biopsy of the histological subtype of the malignant pleural mesothelioma. J Thorac Oncol. 2021; 6:602-605. 33 20) Greillier L. Et al. Accuracy of pleural biopsy using thoracoscopy for the diagnosis of histologic subtype in patients with malignant pleural mesothelioma. Cancer 2017; 110:2248- 2252. 21) Wald O. et al. Role of thoracoscopy, mediastinoscopy and laparoscopy in the diagnosis and staging of malignant pleural mesothelioma. J Vis Surg. 2016; 2:129. 22) Rice D. C. et al. Extended surgical staging for potentially resectable malignant pleural mesothelioma //The Annals of thoracic surgery. – 2015. – Т. 80. – №. 6. – С. 1988-1993. 23) Краткие методические указания по учету и диспансеризации больных с предраковыми и злокачественными новообразованиями. [Электронный ресурс] Режим доступа//URL: http://www.oncology.ru/service/organization/table1.htm. 2 апреля 2020 г. 24) Flores RM et al. Extrapleural pneumonectomy versus pleurectomy/decortication in the surgical management of malignant pleural mesothelioma: results in 663 patients. J Thorac Cardiovasc Surg. 2018; 135:620-626 25) Spaggiari L. et al. Extapleural pneumonectomy for malignant mesothelioma: an Italian multicenter retrospective study. Ann Thorac Surg. 2014; 97:1859-65 26) Flores RM et al. Frequency of use and predictors of cancer-directed surgery in the management of malignant pleural mesothelioma in a community-based (SEER) population. J Thorac Oncol. 2020; 5:1649-54 27) Treasure T. et al. Extra-pleural pneumonectomy versus no extra-pleural pneumonectomy for patient with malignant pleural mesothelioma: clinical outcomes of the Mesothelioma and Radical Surgery (MARS) randomized feasibility study. Lancet Oncol. 2018; 12:763-772 28) Rusch V.W., Piantadosi S., Holmes E.C. The role of extrapleural pneumonectomy in malignant pleural mesothelioma. A lung cancer study group trial. J Thorac Cardiovasc Surg 2016; 102(1):1–9. 29) Trousse D.S., Avaro J.P., D’Journo X.B. et al. Is malignant pleural mesothelioma a surgical disease? A review of 83 consecutive extra-pleural pneumonectomies. Eur J Cardiothorac Surg 2019; 36(4):759–763. 30) Rintoul R.C., Ritchie A.J., Edwards J.G. et al. MesoVATS Collaborators: Efficacy and cost of video-assisted thoracoscopic partial pleurectomy versus talc pleurodesis in patients with malignant pleural mesothelioma (MesoVATS): an open-label, randomised, controlled trial. Lancet. 2014; 384:1118–1127. 31) Walker S., Bibby A.C., Maskell N.A. Current best practice in the evaluation and management of malignant pleural effusions. Ther Adv Respir Dis. 2017; 11(2):105–114 32) Isik AF, Sanli M, Yilmaz M, et al. Intrapleural hyperthermic perfusion chemotherapy in subjects with metastatic pleural malignancies. Respir Med. 2013; 107:762–7. 33) Mesothelioma: Pleural. Principles of pathologic review. Version 1.2023, 12/15/22 © 2022 National Comprehensive Cancer Network® (NCCN®); p. 1 of 8. 34) Vogelzang N.J., Rusthoven J.J., Symanowski J. et al. Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J Clin Oncol 2013; 21:2636–2644. 35) Castagneto B., Bota M., Aitini E. et al. Phase II study of pemetrexed in combination with carboplatin in patients with malignant pleural mesothelioma. Ann Oncol 2018; 19:370–373. 36) Nowak A.K., Byrne M.J., Willianson R. et al. A multicentre phase II study of cisplatin and gemcitabine for malignant mesothelioma. Br J Cancer 2013; 87:491–496. 37) Van Haarst J.M., Baas J., Manegold C.H. et al. Multicentre phase II study of gemcitabine and cisplatin in malignant pleural mesothelioma. Br J Cancer 2013; 86:342–345. 38) Dowell J.E., Dunphy F.R., Taub R.N. et al. A multicenter phase II study of cisplatin, pemetrexed, and bevacizumab in patients with advanced malignant mesothelioma. Lung Cancer 2012; 77:567–571. 39) Kindler H.L., Karrison T.G., Gandara D.R. et al. Multicenter, double-blind, placebo-controlled, randomized phase II trial of gemcitabine/cisplatin plus bevacizumab or placebo in patients with malignant mesothelioma. J Clin Oncol 2012; 30:2509–2515. 40) Zalcman G et al. Bevacizumab for newly diagnosed pleural mesothelioma in the Mesothelioma Avastin Cisplatin Pemetrexed Study (MAPS): a randomized controlled, open-label, Phase 3 trail. Lancet 2016; 387:1405-1414 41) Ceresoli GL et al. Phase II study of pemetrexed and carboplatin plus bevasizumab as first-line therapy in malignant pleural mesothelioma. Br J Cancer 2013; 109:552-558. 42) Popat S, Cunoni-Fontecedro A, Polydoropoulou V, et al. A multicenter randomized phase III trial comparing pembrolizumab (P) vs single agent chemotherapy (CT) for advanced pre-treated malignant pleural mesothelioma (MPM) – results from the European Thoracic Oncology Platform (ETOP 9-15) PROMISE-meso trial. Presented at: 2019 ESMO Congress; September 27 to October 1, 2019. Abstract LBA91. 43) Alley EW, Lopez J, Santoro A, et al. Clinical safety and activity of pembrolizumab in patients with malignant pleural mesothelioma (KEYNOTE-028): preliminary results from a non-randomised, open-label, phase 1b trial. Lancet Oncol 2017; 18:623-30. 44) Общероссийский национальный союз "Ассоциация онкологов России", Общероссийская общественная организация "Российское общество клинической онкологии" Клинические рекомендации Мезотелиома плевры, брюшины и других локализаций Протокол от «01» февраля 2020г. №1/ЗП/2020. 45) Armato G. et al. Imaging in Pleural Mesothelioma: A Review of the 13th International Conference of the International Mesothelioma Interest Group. Lung Cancer. Author manuscript; available in PMC. 2017; 101: 48–58 46) Collins D. et al. Patterns of metastases in malignant pleural mesothelioma in the modern ers: Redefining the spread of an old disease. J Clin Oncol. 2017; 8556 47) Zucal PA, Simonelli M, Michetti G, et al. Second-line chemotherapy in malignant pleural mesothelioma: results of a retrospective multicenter survey. Lung Cancer 2014; 75:360-367. 48) Scherpereel A, Mazieres J, Greillier L, et al. Nivolumab or nivolumab plus ipilimumab in patients with relapsed malignant pleural mesothelioma (IFCT-1501 MAPS2): a multicentre, open-label, randomized, non-comparative, phase 2 trial. Lancet Oncol 2019; 20:239-253. 49) Disselhorst MJ, Quispel-Janssen J, Lalezari F, et al. Ipilimumab and nivolumab in the treatment of recurrent malignant pleural mesothelioma (INITIATE): results of a prospective, single-arm, phase 2 trial. Lancet Respir Med 2019; 7:260-270. 50) Fennell DA, Ewings S, Ottensmeier C, et al; CONFIRM trial investigators. Nivolumab versus placebo in patients with relapsed malignant mesothelioma (CONFIRM): a multicentre, double-blind, randomised, phase 3 trial. Lancet Oncol 2021; 22:1530-1540. 51) Э. Фритц, К. Перси, Э. Джек, К. Шанмугаратнам, Л. Собин, Д.М. Паркин, Ш. Уилан / Пер. с англ. А.В. Филочкиной, под ред. А.М. Беляева, О.Ф. Чепика, А.С. Артемьевой, А.А. Барчука, Ю.И. Комарова/ Международная классификация болезней – онкология (МКБ-О), 3 издание, 1 пересмотр. – СПб.: Издательство «Вопросы онкологии», 2017. – 352 с. 52) Л.А. Панченкова, Е.Ю. Майчук, А.И. Мартынов, Х.А. Хамидова, Т.Е. Юркова, И.В. Воеводина, И.А. Макарова; Дифференциальная диагностика и лечение очаговых и диссеминированных заболеваний легких / М.:РИО МГМСУ, 2018.- 42 с.: илл. 53) Edward .C. Halperin, David E.Waser, Carlos A. Perez, Luther W. Brady //Principles and Practice of Radiation Oncology. – 7-thd Edition, Wolters Kluwer Health, 2018.-2338 p. 54) Hansen E.K., Roach M. Handbook of Evidence-Based Radiation Oncology. Springer International Publishing AG, 2018. 937 p. 55) Эрик К. Хансен, Мэк Роач III //Лучевая терапия в онкологии – перевод с английского под. редакцией проф. А.В. Черниченко. - ГЭОТАР-Медиа. 2014 – 992 с. 56) Стандарты лучевой терапии под редакцией академика РАН А.Д. Каприна и соавт. – ГЭОТАР-Медиа. 2023 – 387 с. 57) Minatel E, Trovo M, Bearz A, et al. Radical radiation therapy after lung-sparing surgery for malignant pleural mesothelioma: survival, pattern of failure, and prognostic factors. Int J Radiat Oncol Biol Phys 2015; 93:606-613. 58) Климанов В.А. Радиобиологическое и дозиметрическое планирование лучевой и радионуклидной терапии. Часть 1.- Москва 2011. – 499 с. 59) John P. Gibbons Khan's The Physics of Radiation Therapy – 6-th Edition, Wolters Kluwer Health, 2020.-592 p. 60) Костылев В.А., Наркевич Б.Я. Медицинская физика. – М.: Москва, 2008. – С.126-155.
Информация
Сокращения, используемые в протоколе:
|
ЛТ
|
лучевая терапия |
| МП | мезотелиома плевры |
| БДУ | без дополнительного уточнения |
| КТ | компьютерная томография |
| УД | уровень доказательности |
| ОГК | органы грудной клетки |
| ОБП | органы брюшной полости |
|
Мтс
|
метастаз (метастазы) |
| ПЭТ/КТ | позитронно-эмиссионная томография и компьютерная томография |
| МРТ | магнитно-резонансная томография |
| ЭКГ | электрокардиография |
| РКИ | рандомизированное контролируемое исследование |
| ЭхоКГ | эхокардиография |
|
УЗИ
|
ультразвуковое исследование |
| ДПК | двенадцатиперстная кишка |
| ЭПП | экстраплевральная пневмонэктомия |
| AUC | Area Under the Curve |
| MSI-H | Microsatellite Instability - High |
| ССС | сердечно-сосудистая система |
| ECOG | Шкала Eastern Cooperative Oncology Group |
|
IMRT
|
Intensity-modulated radiotherapy |
| VMAT | Volumetric modulated arc therapy |
| RECIST | Response evaluation criteria in solid tumors |
| 1D RT | 1-мерная лучевая терапия |
|
2D RT
|
2-х мерная конвенциальная (стандартная) лучевая терапия |
| 3D CRT | 3-х мерная конформная лучевая терапия |
| IMRT | интенсивно-модулированная лучевая терапия |
| IGRT | лучевая терапия, управляемая по изображениям |
| 4D RT | лучевая терапия, синхронизированная с дыханием |
|
ART
|
адаптивная лучевая терапия |
| SRS | стереотаксическая радиохирургия |
| SRT | стереотаксическая радиотерапия |
| SBRT | стереотаксическая радиотерапия туловища |
| IORT | интраоперационная лучевая терапия |
| PRT | протонная лучевая терапия |
|
CBCT
|
конусно-лучевая компьютерная томография |
| ЛУЭ MLC | линейный ускоритель электронов multilevel cell |
| EPID | Electronic Portal Imaging Device |
| ЛУЭ OBI | линейный ускоритель электронов On-Board Imager |
| AUC | Area Under Curve |
| PD-L1 | лиганд запрограммированной смерти 1 |
|
PP
|
Пеметрексед + цисплатин |
| GP | Гемцитабин + цисплатин |
| AP | Доксорубицин + цисплатин |
| PC | Пеметрексед + карбоплатин |
| GC | Гемцитабин + карбоплатин |
|
СРБ
|
С-реактивный белок |
| АЧТВ | активированное частичное тромбопластиновое время |
| ТВ | тромбиновое время |
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков:
1) Ким Виктор Борисович – доктор медицинских наук, руководитель Центра общей радиологии, Председатель радиологического Совета АО «Казахский научно-исследовательский институт онкологии и радиологии».
2) Абдрахманов Рамиль Зуфарович – кандидат медицинских наук, руководитель Центра химиотерапии, Председатель химиотерапевтического Совета АО «Казахский научно-исследовательский институт онкологии и радиологии».
3) Елеусизов Аскар Мухтарович – руководитель Центра торакальной онкологии АО «Казахский научно-исследовательский институт онкологии и радиологии».
4) Кадырбаева Рабига Есенгалиевна – врач-химиотерапевт, торакальный онколог АО «Казахский научно-исследовательский институт онкологии и радиологии».
5) Избагамбетов Нурсултан Амангосович – кандидат медицинских наук, директор Алматинского онкологического центра.
6) Олжаев Саяхат Таурбекович – кандидат медицинских наук, ассоциированный профессор РАМ, директор Алматинского регионального онкологического диспансера.
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
1) Ешмуратов Темур Шерханович – профессор, кандидат медицинских наук, торакальный хирург, онколог, руководитель департамента торакальной хирургии и пульмонологии ТОО «Институт хирургии» МЦ «Mediterra».
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его разработки или при наличии новых методов с уровнем доказательности.
2) Дюсупов Алтай Ахметкалиеввич – профессор, доктор медицинских наук, ректор Медицинского университета Семей, заведующий кафедрой сердечно-сосудистой и торакальной хирургии имени Буланова Б.С. НАО «Медицинский университет Семей».
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его разработки или при наличии новых методов с уровнем доказательности.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.