Лечение бесплодия с помощью вспомогательных репродуктивных технологий
 Версия: Клинические протоколы МЗ РК - 2024 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2024 (Казахстан)
Другие формы женского бесплодия (N97.8), Женское бесплодие (N97), Женское бесплодие маточного происхождения (N97.2), Женское бесплодие неуточненное (N97.9), Женское бесплодие трубного происхождения (N97.1), Женское бесплодие цервикального происхождения (N97.3), Женское бесплодие, связанное с мужскими факторами (N97.4), Женское бесплодие, связанное с отсутствием овуляции (N97.0), Мужское бесплодие (N46)
Акушерство и гинекология, Генетика, Репродуктология, Урология
Общая информация
Краткое описание
Одобрено
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «24» января 2025 года
Протокол №223
КЛИНИЧЕСКИЙ ПРОТОКОЛ МЕДИЦИНСКОГО ВМЕШАТЕЛЬСТВА
ЛЕЧЕНИЕ БЕСПЛОДИЯ С ПОМОЩЬЮ ВСПОМОГАТЕЛЬНЫХ РЕПРОДУКТИВНЫХ ТЕХНОЛОГИЙ
Вспомогательные репродуктивные технологии (далее - ВРТ) – это методы лечения бесплодия: (внутриматочная инсеминация (далее -ВМИ), искусственное оплодотворение и перенос эмбрионов (далее ПЭ), при применении которых отдельные или все этапы зачатия и раннего развития эмбрионов осуществляются вне материнского организма (в том числе с использованием донорских и (или) криоконсервированных половых клеток, тканей репродуктивных органов и эмбрионов, а также суррогатного материнства) [1].
Код(ы) МКБ:
Вспомогательные репродуктивные технологии (далее - ВРТ) – это методы лечения бесплодия: (внутриматочная инсеминация (далее -ВМИ), искусственное оплодотворение и перенос эмбрионов (далее ПЭ), при применении которых отдельные или все этапы зачатия и раннего развития эмбрионов осуществляются вне материнского организма (в том числе с использованием донорских и (или) криоконсервированных половых клеток, тканей репродуктивных органов и эмбрионов, а также суррогатного материнства) [1].
ВВОДНАЯ ЧАСТЬ
Код(ы) МКБ:
| МКБ - 10 | МКБ - 11 | ||
|
МКБ - 10
|
Название |
МКБ - 11
|
Название |
| N 97.0 | Женское бесплодие, связанное с отсутствием овуляции | 5A80.0 | Клиническая гиперандрогения |
| 5A80.1 | Синдром поликистозных яичников | ||
| 5A80.2 | Поликистоз яичников | ||
| 5A80.3 | Ановуляция | ||
| 5A80.4 | Олиго-овуляция | ||
| 5A80.Y | Другие уточненные дисфункции яичников | ||
| 5A80.Z | Дисфункция яичников, неуточненная | ||
| N 97.1 | Женское бесплодие трубного происхождения |
GA31.01
|
Первичное женское бесплодие трубного происхождения |
|
GA31.11
|
Вторичное женское бесплодие трубного происхождения | ||
| N 97.2 | Женское бесплодие маточного происхождения |
GA31.00
|
Первичное женское бесплодие маточного происхождения |
|
GA31.10
|
Вторичное женское бесплодие маточного происхождения | ||
| N 97.3 | Женское бесплодие цервикального происхождения | ||
| N 97.4 | Женское бесплодие, связанное с мужскими факторами |
GB04.0
|
Азооспермия |
|
GB04.Y
|
Другое уточненное мужское бесплодие | ||
|
GB04.Z
|
Мужское бесплодие неуточненное | ||
| N 97.8 | Другие формы женского бесплодия |
GA31.0Y
|
Первичное женское бесплодие другого указанного происхождения |
|
GA31.1Y
|
Вторичное женское бесплодие другого указанного происхождения | ||
|
5A80.5
|
Снижение овариального резерва | ||
| N 97.9 | Женское бесплодие неуточненное |
GA31.0Z
|
Первичное женское бесплодие неуточненного происхождения |
|
GA31.1Z
|
Вторичное женское бесплодие неуточненного происхождения | ||
|
N46
|
Мужское бесплодие | GB04 | Мужское бесплодие |
| GB04.0 | Азооспермия | ||
| GB04.Y | Другое уточненное мужское бесплодие | ||
| GB04.Z | Мужское бесплодие неуточненное | ||
Дата разработки/пересмотра протокола: 2019 год/ пересмотр 2024 год.
Пользователи протокола: акушеры-гинекологи (репродуктологи), урологи (андрологи), генетики, специалисты лаборатории ЭКО (эмбриологи), специалисты клинико- диагностических лабораторий.
Категория пациентов: взрослые мужчины и женщины.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ сочень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или+), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Перечень основных и дополнительных диагностических мероприятий [2]
Основные лабораторные исследования для женщин:
определение группы крови и резус-фактора;
общий анализ крови;
биохимический анализ крови (АЛТ, АСТ, общий билирубин, глюкоза, общий белок, креатинин, мочевина);
коагулограмма (ПВ, ПТИ, МНО, АЧТВ, фибриноген);
общий анализ мочи;
микроскопическое исследование отделяемого мочеполовых органов (мазок);
определение антител к HBsAg вируса гепатита B в сыворотке крови методом ИФА;
определение суммарных антител к вирусу гепатита C в сыворотке крови методом ИФА;
исследование на антитела в сыворотке крови методом ИФА к Treponema pallidum lgM, lgG, или RW;
определение суммарных антител к ВИЧ-1,2 и антигена p24 в сыворотке крови методом ИФА;
онкоцитологическое исследование мазка из шейки матки (ПАП-тест);
определение IgМ к возбудителю хламидиа трахоматис (Chlamydia trachomatis) сыворотке крови методом ИФА;
определение Ig G, М к возбудителю краснухи (Rubella) в сыворотке крови методом ИФА (однократно при отсутствии подтверждающих данных о прививке, либо перенесенном заболеваний);
определение ФСГ, ЛГ, АМГ, ТТГ, пролактина в сыворотке крови.
Основные инструментальные исследования для женщин:
УЗИ органов малого таза;
УЗИ органов брюшной полости и почек;
УЗИ молочных желез;
УЗИ щитовидной железы;
Консультации специалистов:
Дополнительные исследования для женщин по показаниям:
Основные лабораторные исследования для мужчин:
Основные инструментальные исследования для мужчин:
Дополнительные исследования для мужчин по показаниям:
электрокардиографическое исследование (ЭКГ) (в 12 отведениях) с расшифровкой;
флюорография (1 проекция) или обзорная рентгенография грудной клетки.
Консультации специалистов:
Консультация терапевта с предоставлением заключения о состоянии здоровья, допустимости проведения экстракорпорального оплодотворения, вынашивания беременности и родов.
Дополнительные исследования для женщин по показаниям:
цитогенетическое исследование клеток периферической крови (кариотип);
гистеросальпингография/ метросальпингография (ГСГ/МСГ), эхогистеросальпингоскопия, гистероскопия, лапароскопия;
определение эстрадиола, прогестерона, кортизола, свободного трийодтиронина (T3), общего тироксина (T4), АТ-ТГ, АТ-ТПО, тестостерона, дегидроэпиандростерона (ДГЭА) в сыворотке крови;
определение гомоцистеина, инсулина, гликолизированного гемоглобина в сыворотке крови;
определение IgG и М к кардиолипину, определение IgG и М к b2-Гликопротеину I, волчаночного антикоагулянта (LA1/LA2) в сыворотке крови;
бактериологическое исследование отделяемого из уретры и цервикального канала с определением чувствительности к антибиотикам;
инфекционное обследование на обнаружение в биологическом материале методом полимеразной цепной реакции (ПЦР) или методом ИФА IgG и IgM: трихомониаза (Trichomonas vaginalis), гонореи (Neisseria gonorrhoeae), токсоплазмоза (Toxoplasma gondii), Цитомегаловируса, Вируса простого герпеса 1 и 2 типов;
консультация узких специалистов (генетика, маммолога, эндокринолога, кардиолога), согласно показаниям с предоставлением заключения о состоянии здоровья и допустимости проведения экстракорпорального оплодотворения и вынашивания беременности;
определение онкомаркеров: СA 125, HE-4, индекс ROMA, СА 15-3 - для диагностики онкологических заболеваний яичников и молочной железы.
Основные лабораторные исследования для мужчин:
определение антител к HBsAg вируса гепатита B в сыворотке крови методом ИФА;
определение суммарных антител к вирусу гепатита C в сыворотке крови методом ИФА;
исследование на антитела в сыворотке крови к Treponema pallidum lgM, lgG или RW;
определение суммарных антител к ВИЧ-1,2 и антигена p24 в сыворотке крови методом ИФА;
исследование семенной жидкости (спермограмма с морфологией);
определение группы крови и резус-фактора;
определение IgМ к возбудителю хламидиа трахоматис (Chlamydia trachomatis) в сыворотке крови методом ИФА;
микроскопическое исследование мазка из уретры.
Основные инструментальные исследования для мужчин:
флюорография (1 проекция) или обзорная рентгенография грудной клетки.
Консультации специалистов:
консультация уролога-андролога.
Дополнительные исследования для мужчин по показаниям:
цитогенетическое исследование клеток периферической крови (кариотип);
УЗИ органов мошонки, ТРУЗИ предстательной железы;
определение в сыворотке крови ФСГ, ЛГ, ТТГ, пролактина, тестостерона, эстрадиола, кортизола, ДГЭА, ингибина В;
определение уровня ДНК-фрагментации сперматозоидов, МАR-тест;
определение делеций в AZF локусе Y хромосомы молекулярно-генетическим методом;
определение муковисцидоза (мутации гена CFTR);
микроскопическое исследование секрета простаты;
бактериологическое исследование спермы;
определение онкомаркеров: ЛДГ, АФП, ХГЧ, общий ПСА;
инфекционное обследование на обнаружение в биологическом материале методом полимеразной цепной реакции (ПЦР) или методом ИФА IgG и IgM: трихомониаза (Trichomonas vaginalis), гонореи (Neisseria gonorrhoeae);
консультации узких специалистов (генетика, эндокринолога) [2]
микроскопическое исследование осадка мочи (исследование постэякуляторной мочи), для исключения ретроградной эякуляции, азооспермии или при объеме эякулята менее 1,0 мл.
Лечение
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
1. Цель проведения процедуры/вмешательства: наступление беременности и рождение здорового ребенка.
1. Цель проведения процедуры/вмешательства: наступление беременности и рождение здорового ребенка.
2. Показания и противопоказания для проведения процедуры ВРТ
Показания для применения ВРТ:
женское бесплодие (отсутствие матки, яичников, отсутствие или непроходимость обеих маточных труб и др.);
отсутствие беременности при лечении бесплодия в течение 6 месяцев при возрасте женщины до 35 лет или в течение 3 месяцев при возрасте женщины 35 лет и старше (при наличии других показании рассмотреть вопрос о проведении ВРТ раньше);
вероятность преодоления различных формы бесплодия, при которых применение методов ВРТ результативней, чем с другими методами (при ановуляции, эндометриозе, наличии спаечного процесса ОМТ, субфертильных показателях спермограммы у супруга и др.); мужское бесплодие (азооспермия, аспермия, тяжелые формы нарушения сперматогенеза, неподдающиеся терапии и др.);
комбинированные факторы бесплодия: наличие как мужских, так и женских факторов бесплодия;
идиопатическое бесплодие после полного обследования, лечения и неудачных попыток наступления беременности в течение 12 месяцев.
Преимущества протокола с аГнРГ («короткий» протокол):
Недостатки протокола с аГнРГ:
Порядок выполнения основных этапов:
Рекомендован пациенткам:
Преимущества протокола с антГнРГ:
Недостатки протокола с антГнрГ:
Порядок выполнения основных этапов:
Рекомендован пациенткам:
Преимущества протокола:
Недостатки протокола:
Порядок выполнения основных этапов:
Рекомендован пациенткам:
Преимущества протокола:
Недостатки протокола:
Порядок выполнения основных этапов:
Рекомендован пациенткам:
Преимущества протокола:
Недостатки протокола:
Порядок выполнения основных этапов:
Схематическое изображение протокола
Рекомендован пациенткам:
Преимущества протокола:
Недостатки протокола:
Порядок выполнения основных этапов:
Схематическое изображение протокола
Рекомендован пациенткам:
Преимущества протокола:
Недостатки протокола:
Порядок выполнения основных этапов:
Схематическое изображение протокола
Рекомендован пациенткам:
Преимущества протокола:
Порядок выполнения основных этапов:
Схематическое изображение протокола
Рекомендован пациенткам:
Преимущества протокола:
Недостатки протокола:
Порядок выполнения основных этапов:
Схематическое изображение протокола
Рекомендован пациенткам:
Преимущества протокола:
Недостатки протокола:
Порядок выполнения основных этапов:
Схематическое изображение протокола
Рекомендован пациенткам:
Преимущества протокола:
Порядок выполнения основных этапов:
Схематическое изображение протокола

1) При угрозе развития СГЯ (12-15 и более фолликулов на день триггера и уровне эстрадиола более 3000 пг/л), рекомендуется в качестве триггера финального созревания ооцитов использовать агонист ГнРГ (кроме протоколов с десенситизацией гипофиза аГнРГ). Уровень убедительности рекомендаций A (уровень достоверности доказательств -1a).
2) Рекомендуется осуществлять ультразвуковой мониторинг овариальной стимуляции [44]. Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Перечень дополнительных лекарственных средств (менее 100% вероятности применения):
Предгравидарная подготовка.
Осложнения в программах ВРТ
Синдром гиперстимуляции яичников (СГЯ) [58] См. КП «Осложнения, связанные с искусственным оплодотворением»
Классификация СГЯ по системе Голана
Лечение СГЯ
1) Легкая форма:
Аллергические реакции на применяемые препараты – см. КП «Лекарственная гиперчувствительность (лекарственная аллергия) с различными клиническими проявлениями»
При отсутствии бесплодия программы ВРТ могут быть выполнены:
при наличии показаний к преимплантационному генетическому тестированию (ПГТ-A, ПГТ-M, ПГТ-Р, ПГТ-SR) – наличие хромосомных и генетических заболеваний, заболеваний, сцепленных с полом, бесплодии, связанном с указанной патологией, при риске передачи этих заболеваний потомству;
при сексуальных нарушениях и пороках развития половых органов, препятствующих естественному зачатию;
для профилактики передачи ВИЧ, гепатитов B и C и др. трансмиссивных заболеваний партнеру и риске передачи их потомству;
для сохранения репродуктивной функции у онкологических больных перед проведением гонадотоксичной или радикальной оперативной терапии (для мужчин – криоконсервация спермы);
для сохранения биоматериала (спермы, ооцитов или эмбрионов) при планировании отложенного материнства и родительства, желании сохранить половые клетки и др. [4–7];
при привычном невынашивании (с переносом суррогатной матери);
при наличии тяжелой экстрагенитальной патологии и противопоказаний к вынашиванию беременности и родам (с переносом суррогатной матери);
проведение процедур ЭКО и ПЭ с HLA типированием эмбрионов для последующего лечения имеющихся детей в семье (при лейкозах у детей и др.);
при резус-конфликте и гемолитической болезни новорожденного в предыдущих беременностях, с проведением ПГТ – М и переносом Rh mA (-) эмбриона.
по желанию пациентов [3].
Противопоказания для лечения бесплодия с применением ВРТ:
1) соматические и психические заболевания, являющиеся противопоказанием для вынашивания беременности (см. Приказ №122 МЗ РК от 09.10.2020) (исключение составляют случаи, при которых возможно проведение контролируемой стимуляции яичников (КОС) и пункции яичников, при наличии заключения профильного специалиста; с дальнейшем переносом суррогатной матери за исключением психических заболеваний);
2) врожденные пороки развития, приобретенные деформации полости матки (препятствующие имплантации/переносу эмбрионов и развитию беременности – возможно проведение овариальной стимуляции с/без заморозкой биологического материала с переносом суррогатной матери);
3) доброкачественные опухоли яичников, требующие оперативного лечения и (или) препятствующие забору ооцита (ооцитов); (при сниженном уровне АМГ рекомендуется первоначально проводить забор ооцитов и криоконсервацию биологического материала);
Указание в анамнезе или выявление в процессе обследования специфической патологии (онкологической, ВИЧ, туберкулеза и т.д.) являются показаниями для консультации у профильного специалиста, который должен дать заключение о возможности проведения ВРТ.
Требования к соблюдению мер безопасности: согласно санитарным правилам «Санитарно-эпидемиологические требования к объектам здравоохранения» Приказ Министра здравоохранения Республики Казахстан от 11августа 2020 года № ҚР ДСМ-96/2020. Зарегистрирован в Министерстве юстиции Республики Казахстан 12 августа 2020 года № 21080.
Требования к оснащению, расходным материалам:
Требования к подготовке пациента (описание процесса подготовки пациента к проведению процедуры):

4) гиперпластические процессы эндометрия не установленной этиологии;
5) доброкачественные опухоли матки, требующие оперативного лечения и снижающие результативность имплантации эмбриона/ов (при сниженном уровне АМГ рекомендуется первоначально проводить забор ооцитов и криоконсервацию биологического материала);
6) острые воспалительные заболевания любой локализации на начало цикла ВРТ;
7) злокачественные новообразования любой локализации, исключение составляют случаи, при которых показано и возможно проведение контролируемой стимуляции яичников и пункции яичников, перед химио-, лучевой и оперативной терапией. Обязательно наличие заключения мультидисциплинарной группы специалистов, в составе не менее 2х человек [8].
Указание в анамнезе или выявление в процессе обследования специфической патологии (онкологической, ВИЧ, туберкулеза и т.д.) являются показаниями для консультации у профильного специалиста, который должен дать заключение о возможности проведения ВРТ.
4. Требования к проведению процедуры и вмешательства:
Требования к соблюдению мер безопасности: согласно санитарным правилам «Санитарно-эпидемиологические требования к объектам здравоохранения» Приказ Министра здравоохранения Республики Казахстан от 11августа 2020 года № ҚР ДСМ-96/2020. Зарегистрирован в Министерстве юстиции Республики Казахстан 12 августа 2020 года № 21080.
Требования к оснащению, расходным материалам:
трансвагинальный датчик УЗ аппарата со специальным адаптером;
пункционные иглы диаметром 16-22G;
ламинарный шкаф для поиска ооцит – кумулюсных комплексов;
среда отмывания - буферный раствор;
среда для оплодотворения и другие по требованию;
4-х луночный планшет;
стерильные одноразовые чашки Петри;
одноразовые стерильные капилляры диаметром 130 и 150 мкм.
Требования к подготовке пациента (описание процесса подготовки пациента к проведению процедуры):
подготовка паховой области; влагалища;
правильное положение пациента на операционном столе;
обеспечение венозного доступа;
стандартная для пациентов подготовка операционного поля антисептиком;
трансвагинальный УЗ – датчик с презервативом или стерильным чехлом и адаптером (возможно применение трансабдоминального датчика или забор ооцитов путем лапароскопии).
Проведение овариальной стимуляции в программах ЭКО
Согласно классификации ВОЗ пациенток, можно разделить на следующие группы:
Методика проведения процедуры:
Проведение овариальной стимуляции в программах ЭКО
Контролируемая овариальная стимуляция (КОС) в программах ЭКО – это фармакологическая стимуляция одномоментного развития и созревания пула фолликулов с целью получения нескольких ооцитов при пункции.
Рекомендуется предлагать овариальную стимуляцию, а не естественный цикл в программе ЭКО так как при стимуляции частота беременности выше [5,16–21]. Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1a).
Перед началом стимуляции необходимо учитывать следующие параметры пациентки: анамнез, овариальный резерв (уровень АМГ и количество антральных фолликулов - КАФ), возраст, ИМТ, оценку исходов предыдущих стимуляций и программ ЭКО [18,20–22]. Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1a).
Согласно классификации ВОЗ пациенток, можно разделить на следующие группы:
- пациентки с нормальным овариальным резервом (нормответчики);
- пациентки с избыточным овариальным резервом (гиперответчики);
- пациентки с низким овариальным резервом (гипоответчики, с учетом критериев группы POSEIDON).
Это деление условно и пациентки могут по-разному реагировать на стимуляцию яичников, вне зависимости от параметров овариального резерва и причисления к определенной группе ответчиков [21,23–25]. Уровень убедительности рекомендаций A (уровень достоверности доказательств 1a).
Выбор протокола овариальной стимуляции.
Не существует единого, универсального протокола овариальной стимуляции в программах ЭКО для всех групп пациенток.
С целью овариальной стимуляции в программах ЭКО рекомендуется использовать как рекомбинантные, так и мочевые гонадотропины [21,26]. Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1a). Возможно применение антиэстрогенов (ингибиторы ароматазы, модуляторы эстрогенных рецепторов) для овариальной стимуляции в программах ВРТ [27,28] Уровень убедительности рекомендаций С (уровень достоверности доказательств – 2b).
Для предотвращения преждевременного пика ЛГ при овариальной стимуляции в программах ЭКО используют аналоги ГнРГ — агонисты ГнРГ (аГнРГ) и антагонисты ГнРГ (антГнРГ), препараты прогестерона/прогестины в дозах достаточных для подавления паразитарного пика ЛГ, антиэстрогены (ингибиторы ароматазы, модуляторы эстрогенных рецепторов), НПВС и др.
Наиболее часто используются следующие протоколы стимуляции яичников:
1) Длинный или ультрадлинный протокол с агонистом ГнРГ;
2) Короткий протокол с агонистом ГнРГ;
3) Протокол с антагонистом ГнРГ;
4) Протокол стимуляции с прогестогенами/прогестинами;
5) Протокол стимуляции в лютеиновую фазу цикла (стимуляция во вторую фазу);
6) Протокол с многократной стимуляцией в одном цикле или подряд в нескольких циклах (дуостим, тристим);
7) Протокол стимуляции с низкими дозами гонадотропинов и/или с антиэстрогенами (малая стимуляция);
8) Протокол забора ооцита в естественном цикле или модифицированном естественном цикле;
9) «Стоп» протокол – протокол с начала лютеиновой фазы до десенситизации гипофиза аГнРГ, с переходом в протокол с антГнРГ;
10) Протокол IVM – забор ооцитов без стимуляции с дозреванием их in vitro вне организма;
11) Протокол с произвольным стартом – стимуляция с любого дня цикла (ургентная стимуляция);
12) Протокол с отложенным стартом стимуляции.
Рекомендован пациенткам:
Преимущества протокола с аГнРГ:
Недостатки протокола с аГнРГ:
Порядок выполнения основных этапов:
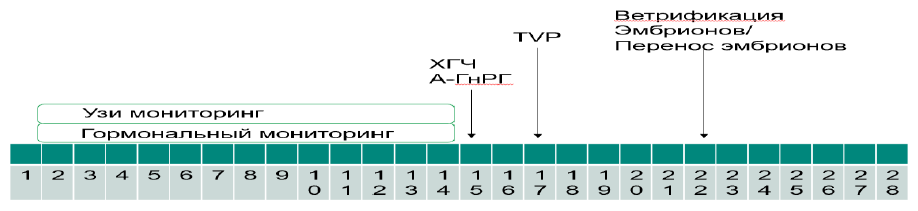
1) Протокол с длительной блокадой гипофиза агонистом ГнРГ («long-term protocol», «длинный или ультрадлинный протокол с аГнРГ») - при котором производится предварительная блокада гипофиза аГнРГ с середины лютеиновой фазы предыдущего менструального цикла/ов (при ультрадлинном протоколе за 2-3 месяца до планируемой стимуляции) и начало стимуляции со 2-3 дня (возможен отложенный старт).
Рекомендован пациенткам:
- с нормальным или низким резервом яичников при отсутствии риска развития СГЯ,
- при асинхронном росте фолликулов,
- при преждевременной овуляции на фоне протокола с антГнРГ,
- при неудовлетворительных результатах предыдущей стимуляции.
Преимущества протокола с аГнРГ:
- синхронный рост фолликулов,
- низкий риск преждевременной овуляции,
- большое число полученных ооцитов.
Недостатки протокола с аГнРГ:
- вероятность применения аГнРГ на фоне наступившей беременности (не является показанием к прерыванию беременности),
- необходимость применения в качестве триггера только препаратов ХГЧ, что увеличивает риск развития синдрома гиперстимуляции яичников при избыточном ответе.
Порядок выполнения основных этапов:
- десенситизация гипофиза агонистами гонадолиберинов с середины лютеиновой фазы предыдущего цикла до пункции (суточная доза агонистов ГнРГ 0,025 – 0,2 мг/либо однократно на стар 3,75/11,25 мг);
- овариальная стимуляция по достижении десенситизации гипофиза на основании критериев гормонального и УЗИ мониторинга (гонадотропины в суточной дозе от 37,5МЕ(4мкг) до 450МЕ (12 мкг));
- введение триггера – хорионического гонадотропина (суточная доза от 1000МЕ до 20000МЕ/хориогонадотропин альфа 250 мкг (6500 МЕ)) за 32-40 часов до пункции;
- пункция яичников на 10-30 день от начала стимуляции яичников;
- оплодотворение ооцитов, культивирование эмбрионов, витрификация ооцитов/эмбрионов с или без биопсии трофэктодермы,
- перенос эмбрионов на 2-6-й день после пункции;
- поддержка беременности 14 дней, осуществляется после пункции, заканчивается по рекомендации врача акушера-гинеколога;
- контроль беременности по УЗИ на 21 день после переноса эмбрионов;
- общая длительность протокола примерно 20-50 дней [29,30].
Схематическое изображение «длинного» протокола
Схематическое изображение «длинного» протокола

2) Протокол с кратковременной блокадой гипофиза агонистом ГнРГ («short-term protocol», «короткий протокол с аГнРГ»), при котором стимуляция начинается со 2-3 дня менструального цикла с одновременным добавлением аГнРГ.
Рекомендован пациенткам:
Рекомендован пациенткам:
- с нормальным или низким резервом яичников при отсутствии риска развития СГЯ,
- при асинхронном росте фолликулов,
- при преждевременной овуляции на фоне протокола с антГнРГ,
- при неудовлетворительных результатах предыдущей стимуляции.
Преимущества протокола с аГнРГ («короткий» протокол):
- меньшее количество инъекций,
- большое число полученных ооцитов.
Недостатки протокола с аГнРГ:
- высокий риск преждевременной овуляции,
- необходимость применения в качестве триггера только препаратов ХГЧ, что кратно увеличивает риск развития синдрома гиперстимуляции яичников при избыточном ответе.
Порядок выполнения основных этапов:
- десенситизация гипофиза с 1-3 дня цикла до пункции агонистами ГнРГ(суточная доза агонистов ГнРГ 0,025 – 0,2 мг/либо однократно на стар 3,75/11,25 мг);
- стимуляция яичников с 2-5 день менструального цикла (гонадотропины в суточной дозе от 37,5МЕ(4мкг) до 450МЕ (12 мкг);
- введение триггера – хорионического гонадотропина за 32-40 часов до пункции (суточная доза от 1000МЕ до 20000МЕ/хориогонадотропин альфа 250 мкг (6500 МЕ);
- пункция яичников на 10-30 день от начала стимуляции яичников;
- оплодотворение ооцитов, культивирование эмбрионов, витрификация ооцитов/эмбрионов с или без биопсии трофэктодермы,
- перенос эмбрионов на 2-6-й день после пункции;
- поддержка беременности 14 дней, осуществляется после пункции, заканчивается по рекомендации врача акушера-гинеколога;
- контроль беременности по УЗИ на 21 день после переноса эмбрионов;
Схематическое изображение «короткого» протокола

Общая длительность протокола примерно 20-50 дней [31].
Схематическое изображение «короткого» протокола

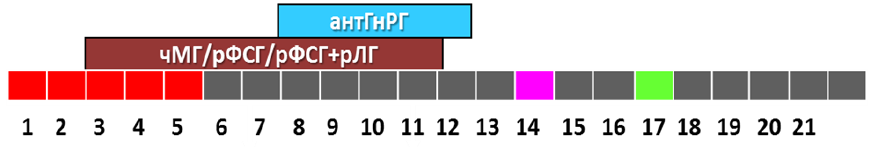
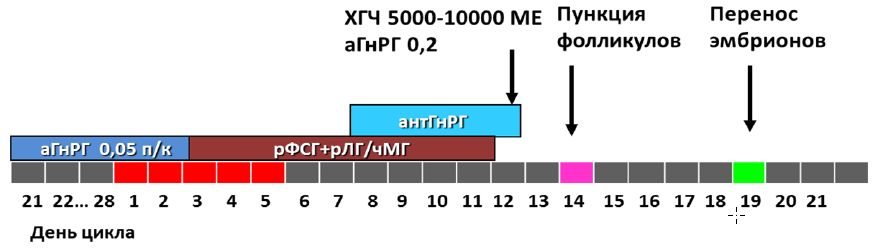
3) Протокол с кратковременной блокадой гипофиза антагонистом ГнРГ («short-term protocol», «короткий протокол с антГнРГ»), при котором стимуляция начинается со 2-3 дня менструального цикла с добавлением антГнРГ в фиксированном или гибком режиме.
Рекомендован пациенткам:
- с избыточным (МФЯ, СПКЯ), нормальным или низким резервом яичников,
- первым предстоящим протоколом ЭКО,
- донорам ооцитов,
- с СГЯ в анамнезе (41–43).
Преимущества протокола с антГнРГ:
- меньшее количество используемых препаратов и инъекций,
- меньшая длительность овариальной стимуляции,
- возможность применения в качестве триггера не только препаратов ХГЧ, но и аналогов аГнРГ, что значительно снижает риск развития СГЯ (41–43).
Недостатки протокола с антГнрГ:
- более высокий риск преждевременной овуляции,
- асинхронный рост фолликулов,
- меньшее число полученных ооцитов.
Порядок выполнения основных этапов:
- стимуляция яичников с 1-4 дня цикла (гонадотропины в суточной дозе от 37,5МЕ(4мкг) до 450МЕ (12 мкг);
- блокада гипофиза антГнРГ на 6 день стимуляции (фиксированный режим дозирования), или при достижении большинством фолликулов диаметра 12-14мм и более (произвольный режим). Суточная доза антГнРГ 250мкг (0,25мг);
- введение триггера – хорионического гонадотропина и/или аГнРг за 24-40 часов до пункции (суточная доза ХГЧ от 1000МЕ до 20000МЕ или хориогонадотропин альфа 250мкг (6500 МЕ), или аГнРГ в дозе 0,1 – 0,3 мг);
- пункция яичников;
- оплодотворение ооцитов, культивирование эмбрионов, витрификация ооцитов/эмбрионов с или без биопсии трофэктодермы,
- перенос эмбрионов на 2-6-й день после пункции;
- поддержка беременности 14 дней, осуществляется после пункции, заканчивается по рекомендации врача акушера-гинеколога;
- контроль беременности по УЗИ на 21 день после переноса эмбрионов;
- общая длительность протокола примерно 10-50 дней [32,33].
Схематическое изображение протокола с ант-ГнРГ
Схематическое изображение протокола с ант-ГнРГ

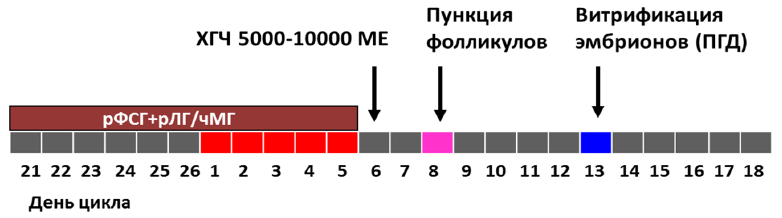
4) Протокол овариальной стимуляции с использованием препаратов экзогенных прогестагенов/прогестинов («PPOS - Progestin-primed ovarian stimulation») для блокады гипофиза и преждевременного пика ЛГ.
Рекомендован пациенткам:
- с избыточным (МФЯ, СПКЯ), нормальным или низким резервом яичников,
- с аллергическими реакциями на аналоги ГнРГ,
- первым предстоящим протоколом ЭКО,
- донорам ооцитов,
- с СГЯ в анамнезе.
Преимущества протокола:
- синхронный рост фолликулов,
- низкий риск преждевременной овуляции,
- возможность применения в качестве триггера не только препаратов ХГЧ, но и аналогов аГнРГ, что значительно снижает риск развития СГЯ [34–37].
Недостатки протокола:
- протокол требует криоконсервации ооцитов/эмбрионов и отсроченного переноса.
Порядок выполнения основных этапов:
- блокада гипофиза препаратами экзогенных прогестагенов/прогестинов с начала стимуляции (суточная доза дидрогестерон 10-30 мг или микронизированный прогестерон 100-400мг и др.) и до триггера финального созревания ооцитов (ХГЧ/а-ГнРГ);
- стимуляция яичников с 1-4 дня цикла (гонадотропины в суточной дозе от 37,5МЕ(4мкг) до 450МЕ (12 мкг);
- введение триггера – хорионического гонадотропина и/или аГнРг за 24-40 часов до пункции (суточная доза ХГЧ от 1000МЕ до 20000МЕ или хориогонадотропин альфа 250мкг (6500 МЕ), или аГнРГ в дозе 0,1 – 0,3 мг);
- пункция яичников;
- оплодотворение ооцитов, культивирование эмбрионов, витрификация ооцитов/эмбрионов с или без биопсии трофэктодермы;
- общая длительность протокола примерно 10-50 дней [38].
Схематическое изображение протокола

Схематическое изображение протокола

5) Протокол стимуляции в лютеиновую фазу цикла («стимуляция во вторую фазу цикла»), при котором блокада преждевременного пика ЛГ осуществляется собственным желтым телом, которое продуцирует эндогенный прогестерон.
Рекомендован пациенткам:
- с избыточным (МФЯ, СПКЯ), нормальным или низким резервом яичников,
- с аллергическими реакциями на аналоги ГнРГ,
- с неудачными результатами стимуляции в первую фазу цикла,
- донорам ооцитов,
- с СГЯ в анамнезе.
Преимущества протокола:
- синхронный рост фолликулов,
- меньшее количество используемых препаратов и инъекций,
- возможность применения в качестве триггера не только препаратов ХГЧ, но и аналогов аГнРГ, что значительно снижает риск развития СГЯ.
Недостатки протокола:
- протокол требует криоконсервации ооцитов/эмбрионов и отсроченного переноса.
Порядок выполнения основных этапов:
- блокада гипофиза осуществляется выработкой эндогенного прогестерона желтым телом яичника (по усмотрению врача добавление дидрогестерона 10-30 мг или микронизированного прогестерона 100-400 мг);
- стимуляция яичников с момента начала выработки прогестерона желтым телом яичника (гонадотропины в суточной дозе от 37,5МЕ(4мкг) до 450МЕ (12 мкг);
- введение триггера хорионического гонадотропина и/или аГнРг за 24-40 часов до пункции (суточная доза ХГЧ от 1000МЕ до 20000МЕ или хориогонадотропин альфа 250мкг (6500 МЕ), или аГнРГ в дозе 0,1 – 0,3 мг);
- пункция яичников;
- оплодотворение ооцитов, культивирование эмбрионов, витрификация ооцитов/эмбрионов с или без биопсии трофэктодермы;
- общая длительность протокола примерно 10-20 дней [39].
Схематическое изображение протокола
Схематическое изображение протокола

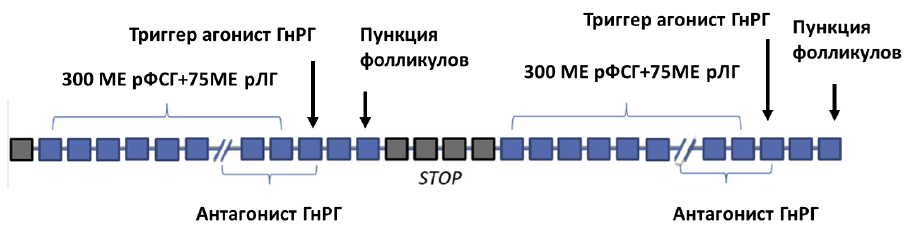
6) Протокол с многократной стимуляцией в одном цикле или подряд в нескольких циклах («Duostim, tristim, etc») при котором возможно проведение стимуляции и забор ооцитов на протяжении одного или нескольких циклов подряд, непосредственно один за другим.
Рекомендован пациенткам:
- позднего репродуктивного возраста (старше 38 лет или отсутствии результата предыдущей программы лечения);
- ожидаемый низкий ответ яичников на стимуляцию (менее 5 ооцитов или АМГ менее 1нг/мл);
- в ситуациях, когда необходимо получить как можно больше ооцитов за короткий отрезок времени (например, перед гонадотоксичной терапией).
Преимущества протокола:
- возможность получения большего числа ооцитов
Недостатки протокола:
- протокол требует криоконсервации ооцитов/эмбрионов и отсроченного переноса.
Порядок выполнения основных этапов:
- блокада гипофиза осуществляется либо введением антГнРГ, либо прогестинами/прогестагенами (суточная доза антГнРГ 250мкг (0,25мг) или дидрогестерон 10-30 мг или микронизированный прогестерон 100-400мг);
- первый тур стимуляции яичников (гонадотропины в суточной дозе от 37,5МЕ (4мкг) до 450МЕ (12 мкг));
- введение триггера аГнРГ (суточная доза аГнРГ в дозе 0,1 – 0,3 мг);
- пункция яичников через 24-40 часов после введения триггера;
- оплодотворение ооцитов, культивирование эмбрионов, витрификация ооцитов/эмбрионов с или без биопсии трофэктодермы;
- второй тур стимуляции яичников можно начать через 2-5 дней от забора ооцитов при условии наличия антральных фолликулов (гонадотропины в суточной дозе от 37,5МЕ (4мкг) до 450МЕ (12 мкг));
- триггер финального дозревания ооцитов аГнРГ (суточная доза аГнРГ 0,1-0,3 мг) (в случае продолжения стимуляции яичников в этом цикле) или ХГЧ и его аналоги в достаточных дозах в случае завершения данного протокола (суточная доза ХГЧ от 1000МЕ до 20000МЕ или хориогонадотропин альфа 250мкг (6500 МЕ)). Введение триггера – хорионического гонадотропина и/или аГнРг за 24-40 часов до пункции;
- пункция яичников;
- оплодотворение ооцитов, культивирование эмбрионов, витрификация ооцитов/эмбрионов с или без биопсии трофэктодермы;
- общая длительность протокола примерно 20-40 дней [40,41].
Схематическое изображение протокола

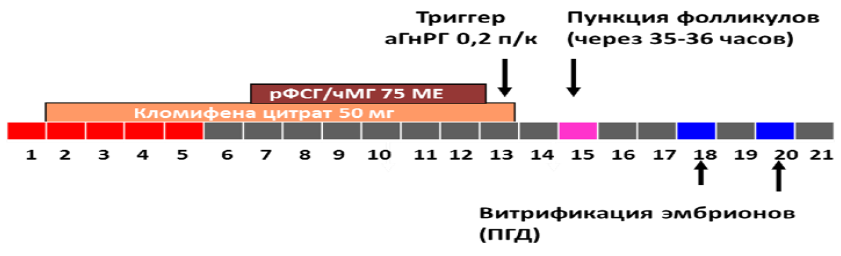
7) Протокол овариальной стимуляции с низкими дозами гонадотропинов и/или с применением антиэстрогенов («малая стимуляция», «mild stimulation protocol»).
Рекомендован пациенткам:
с избыточным (МФЯ, СПКЯ), нормальным или низким резервом яичников,
с СГЯ в анамнезе.
в программах кумулятивного сбора ооцитов
при наличии противопоказаний или аллергических реакций на гонадотропины и аналоги ГнРГ
в ургентной репродукции (при онкологических заболеваниях)
при наличии противопоказаний к стимуляции.
Преимущества протокола:
меньшее количество используемых препаратов и инъекций,
меньшая конечная стоимость услуги.
низкий риск СГЯ.
Недостатки протокола:
низкая частота наступления беременности.
Порядок выполнения основных этапов:
стимуляция яичников со 2-5 дня цикла препаратами антиэстрогенов (кломифен цитрат 25-150мг, летрозол 2,5-10 мг, тамоксифен 10-40 мг).
Ими же осуществляется блокада гипофиза (по усмотрению врача возможна блокада гипофиза препаратами антГнРГ (суточная доза антГнРГ 250мкг (0,25мг)).
При отсутствии достаточного ответа яичников, возможно добавление препаратов гонадотропинов либо с начала приёма антиэстрогенов, либо на 6 день стимуляции (гонадотропины в суточной дозе от 37,5МЕ (4мкг) до 150МЕ (10 мкг)).
введение триггера – хорионического гонадотропина и/или аГнРГ за 24-40 часов до пункции (суточная доза ХГЧ от 1000МЕ до 20000МЕ или хориогонадотропин альфа 250мкг (6500МЕ), или аГнРГ в дозе 0,1 – 0,3 мг);
пункция яичников;
оплодотворение ооцитов, культивирование эмбрионов, витрификация ооцитов/эмбрионов с или без биопсии трофэктодермы;
перенос эмбрионов на 2-6-й день после пункции;
поддержка беременности 14 дней, осуществляется после пункции, заканчивается по рекомендации врача акушера-гинеколога;
контроль беременности по УЗИ на 21 день после переноса эмбрионов;
общая длительность протокола примерно 10-20 дней [42].
Схематическое изображение протокола

8) Протокол программы ЭКО в естественном цикле или модифицированном естественном цикле («Natural cycle protocol»).
Рекомендован пациенткам:
с нормальным или низким резервом яичников,
с СГЯ в анамнезе,
в программах кумулятивного сбора ооцитов (при низком и крайне низком овариальном резерве и др),
при наличии противопоказаний или аллергических реакций на гонадотропины и аналоги ГнРГ
Преимущества протокола:
меньшее количество используемых препаратов и инъекций,
меньшая конечная стоимость услуги,
низкий риск СГЯ.
Недостатки протокола:
высокий риск преждевременной овуляции,
самая низкая частота наступления беременности.
Порядок выполнения основных этапов:
в течение менструального цикла со 2-5 дня проводиться УЗ-мониторинг (при необходимости гормональный мониторинг) роста и созревания фолликула и эндометрия;
при достижении доминантным фолликулом диаметра 14-22мм проводить забор ооцита, что возможно после контроля пика ЛГ в крови (при модифицированном цикле возможно ведение рФСГ или ЧМГ в дозе 75МЕ и антГнРГ в дозе 0,25мг). Также возможно введение триггера – хорионического гонадотропина и/или аГнРГ за 24-40 часов до пункции (суточная доза ХГЧ от 1000МЕ до 20000МЕ или хориогонадотропин альфа 250мкг (6500МЕ), или аГнРГ в дозе 0,1 – 0,3 мг);
пункция яичников;
оплодотворение ооцитов, культивирование эмбрионов, витрификация ооцитов/эмбрионов с или без биопсии трофэктодермы;
перенос эмбрионов на 2-6-й день после пункции;
поддержка беременности 14 дней, осуществляется после пункции, заканчивается по рекомендации врача акушера-гинеколога;
контроль беременности по УЗИ на 21 день после переноса эмбрионов;
общая длительность протокола примерно 10-40 дней [17].
Схематическое изображение протокола

9) «Стоп» протокол («Stop protocol») – протокол с начала лютеиновой фазы до десенситизации гипофиза аГнРГ, с переходом в протокол с антГнРГ.
Рекомендован пациенткам:
с нормальным или низким резервом яичников при отсутствии риска развития СГЯ,
при асинхронном росте фолликулов,
при преждевременной овуляции на фоне протокола с антГнРГ,
при прекращении приема агонистов в «длинном» протоколе,
при неудовлетворительных результатах предыдущей стимуляции.
Преимущества протокола:
меньшее количество инъекций,
низкий риск преждевременной овуляции,
большое число полученных ооцитов.
Порядок выполнения основных этапов:
десенситизация гипофиза аГнРГ (суточная доза 0,025 – 0,2 мг) с середины лютеиновой фазы цикла до 2-5 дня цикла, по достижении десенситизации гипофиза на основании критериев гормонального или УЗИ мониторинга;
отмена аГнРГ.
стимуляция яичников (гонадотропины в суточной дозе от 37,5МЕ(4мкг) до 450МЕ (12 мкг) с 2-5 дня цикла, при достижении десенситизации гипофиза на основании критериев гормонального или УЗИ мониторинга;
блокада гипофиза антГнРГ (суточная доза 250 мкг) на 6 день стимуляции (или достижения большинства фолликулов диаметра 12-14 мм и более);
введение триггера – хорионического гонадотропина и/или аГнРГ за 24-40 часов до пункции (суточная доза ХГЧ от 1000МЕ до 20000МЕ или хориогонадотропин альфа 250мкг (6500МЕ), или аГнРГ в дозе 0,1 – 0,3 мг);- пункция яичников на 10-30 день от начала стимуляции яичников;
оплодотворение ооцитов, культивирование эмбрионов, витрификация ооцитов/эмбрионов с или без биопсии трофэктодермы;
перенос эмбрионов на 2-6-й день после пункции;
поддержка беременности 14 дней, осуществляется после пункции, заканчивается по рекомендации врача акушера-гинеколога;
контроль беременности по УЗИ на 21 день после переноса эмбрионов;
общая длительность протокола примерно 30-50 дней [33,43].
Схематическое изображение протокола

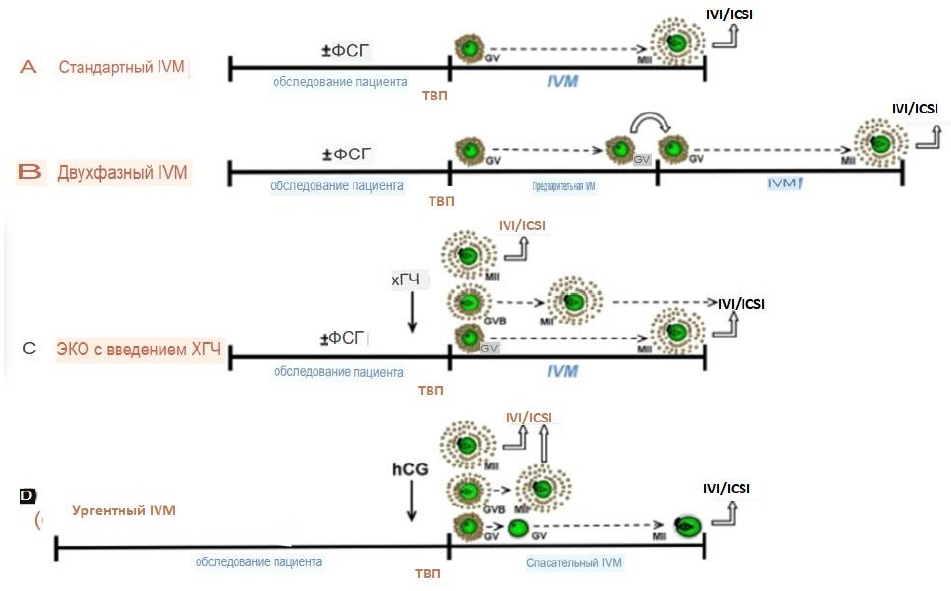
10) Протокол IVM – забор ооцитов с дозреванием их in vitro вне организма («In vitro maturation»), с проведением и без проведением стимуляции яичников.
Рекомендован пациенткам:
с избыточным (МФЯ, СПКЯ), нормальным или низким резервом яичников,
с аллергическими реакциями на аналоги ГнРГ, рФСГ, ЧМГ;
с неудачными результатами стимуляции в других протоколах,
с СГЯ в анамнезе,
в ургентной репродукции (при онкологических заболеваниях, перед гонадотоксичной терапией и др.),
при наличии противопоказаний к стимуляции.
Преимущества протокола:
меньшее количество или отсутствие препаратов и инъекций,
отсутствует риск СГЯ.
Недостатки протокола:
низкая частота наступления беременности.
Порядок выполнения основных этапов:
- на любой день менструального цикла (в стимулированных циклах (гонадотропины (рекомбинантные или менопаузные) в суточной дозе от 37,5МЕ (4мкг) до 450МЕ (12 мкг)) либо без стимуляции – «чистый IVM») проводится УЗИ (при необходимости гормональный мониторинг) для оценки фолликулярного аппарата.
- Забор ооцитов проводится при любом диаметре фолликулов с введением триггера (суточная доза ХГЧ от 1000МЕ до 20000МЕ или хориогонадотропин альфа 250мкг (6500МЕ), или аГнРГ в дозе 0,1 – 0,3 мг) за 24-40 часов до пункции или без введения триггера – «чистый IVM»;
- пункция яичников;
- дозревание ооцитов, оплодотворение ооцитов, культивирование эмбрионов, витрификация ооцитов/эмбрионов с или без биопсии трофэктодермы;
- перенос эмбрионов на 2-6-й день после пункции;
- поддержка беременности 14 дней, осуществляется после пункции, заканчивается по рекомендации врача акушера-гинеколога;
- контроль беременности по УЗИ на 21 день после переноса эмбрионов.
Схематическое изображение протокола

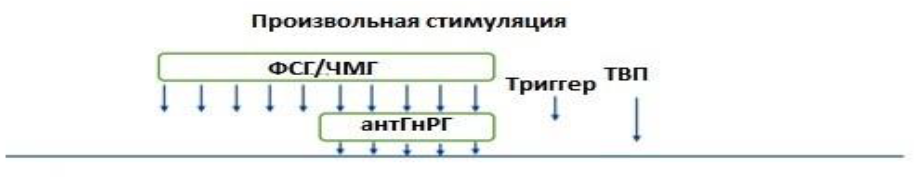
11) Протокол с произвольным стартом – стимуляция с любого дня цикла (ургентная стимуляция) («Random start protocol»).
Рекомендован пациенткам:
- в ургентной репродукции (при онкологических заболеваниях, перед гонадотоксичной терапией и др.);
- с неудачными результатами стимуляции в других протоколах.
Преимущества протокола:
- позволяет проводить процедуру стимуляции яичников в любой день цикла, при невозможности отложить процедуру.
Недостатки протокола:
- возможно получение меньшего числа ооцитов;
- криоконсервация ооцитов/эмбрионов.
Порядок выполнения основных этапов:
- на любой день менструального цикла проводится УЗИ (при необходимости гормональный мониторинг) для оценки фолликулярного аппарата;
- стимуляция яичников (гонадотропины в суточной дозе от 37,5МЕ (4мкг) до 450МЕ (12 мкг));
- блокада гипофиза антГнРГ (суточная доза антГнРГ 250мкг (0,25мг)) на 6 день стимуляции или при достижении большинством фолликулов диаметра 12-14мм и более;
- введение триггера – хорионического гонадотропина или аГнРГ за 24-40 часов до пункции (суточная доза ХГЧ от 1000МЕ до 20000МЕ или хориогонадотропин альфа 250мкг (6500МЕ), или аГнРГ в дозе 0,1 – 0,3 мг);
- пункция яичников;
- оплодотворение ооцитов, культивирование эмбрионов, витрификация
ооцитов/эмбрионов с или без биопсии трофэктодермы.
Схематическое изображение протокола

12) Протокол с отложенным стартом стимуляции («Delayed start protocol»).
Рекомендован пациенткам:
- Позднего репродуктивного возраста (старше 38 лет или отсутствии результата предыдущей программы лечения);
- Ожидаемый низкий ответ яичников на стимуляцию (менее 5 ооцитов или АМГ менее 1нг/мл).
Преимущества протокола:
- возможность получения большего числа ооцитов.
Порядок выполнения основных этапов:
- на 2-3 день цикла однократно вводится препарат аГнРГ в дозе 0,2-0,3мг и далее назначается препарат эстрадиола в дозе 2-6мг на 5-7 дней;
- затем проводится УЗИ-мониторинг, при выявлении антральных фолликулов – старт стимуляции (гонадотропины в суточной дозе от 37,5МЕ (4мкг) до 450МЕ (12 мкг))
- УЗИ-мониторинг роста и созревания фолликулов и эндометрия (при необходимости гормональный мониторинг);
- блокада гипофиза антГнРГ (суточная доза антГнРГ 250мкг (0,25мг)) на 6 день стимуляции или при достижении большинством фолликулов диаметра 12-14мм и более;
- при достижении доминантным фолликулом диаметра 14-22мм введение триггера – хорионического гонадотропина за 24-40 часов до пункции (суточная доза ХГЧ от 1000 МЕ до 20000 МЕ или хориогонадотропин альфа 250мкг (6500 МЕ), или аГнРГ в дозе 0,1 – 0,3 мг);
- пункция яичников;
- оплодотворение ооцитов, культивирование эмбрионов, витрификация ооцитов/эмбрионов с или без биопсии трофэктодермы;
- перенос эмбрионов на 2-6-й день после пункции;
- поддержка беременности 14 дней, осуществляется после пункции, заканчивается по рекомендации врача акушера-гинеколога;
- контроль беременности по УЗИ на 21 день после переноса эмбрионов;
- общая длительность протокола примерно 10-40 дней.
Схематическое изображение протокола

Особенности стимуляции яичников
1) При угрозе развития СГЯ (12-15 и более фолликулов на день триггера и уровне эстрадиола более 3000 пг/л), рекомендуется в качестве триггера финального созревания ооцитов использовать агонист ГнРГ (кроме протоколов с десенситизацией гипофиза аГнРГ). Уровень убедительности рекомендаций A (уровень достоверности доказательств -1a).
2) Рекомендуется осуществлять ультразвуковой мониторинг овариальной стимуляции [44]. Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии: Задачи мониторинга роста фолликулов:
- определение условий для начала овариальной стимуляции,
- оценка ответа яичников на стимуляцию (количество растущих фолликулов, их диаметр),
- оценка критериев назначения триггера финального созревания ооцитов,
- оценка толщины и структуры эндометрия.
Этапы проведения ЭКО.
3) Назначение комбинированных оральных контрацептивов (КОК), а также прогестогенов/прогестинов и/или эстрогенов перед КОС.
КОК, прогестогены/прогестины и/или эстрогены перед овариальной стимуляцией могут использоваться:
- при рецидивирующих функциональных кистах для профилактики их образования перед началом стимуляции,
- при синдроме поликистозных яичников при нерегулярном менструальном цикле (олиго/ановуляции),
- для синхронизации циклов донора ооцитов и реципиента или генетической и суррогатной матерей,
- при планировании дня начала овариальной стимуляции.
Этапы проведения ЭКО.
- стимуляция яичников;
- пункция фолликулов для получения ооцитов;
- оценка ооцит-кумулюсного комплекса;
- подготовка сперматозоидов для ЭКО/ICSI;
- инсеминация яйцеклеток обработанной спермой/ICSI;
- культивирование эмбрионов;
- перенос эмбрионов в полость матки и/или витрификация эмбрионов.
Пункция фолликулов яичников
- Пункция фолликулов яичников – медицинская манипуляция с целью получения ооцитов для экстракорпорального оплодотворения.
- Аспирация содержимого фолликулов проводится с использованием специальной вакуумной помпы, либо с помощью стерильных шприцев.
В редких случаях при невозможности выполнения трансвагинальной пункции (атипичное расположение яичников, выраженный спаечный процесс) ооциты могут быть получены лапароскопическим или другим возможным доступом трансабдоминально, трансректально, трансдермально.
- Пункцию фолликулов (аспирацию фолликулярной жидкости) рекомендуется проводить через 24-40 часов после введения триггера финального созревания ооцитов, а также возможно применение «двойного» или «двухкратного» триггера или проведение забора ооцитов без использования триггера. Также возможно проведение пункции экстренно без введения триггера или через 24 часа, если при гормональном мониторинге определяется предовуляторный уровень ЛГ (чаще при проведении ЭКО в естественном цикле). Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2а).
- Манипуляция выполняется в амбулаторных условиях или в условиях стационара (дневного/круглосуточного), в асептических условиях, может проводиться под местной (парацервикальная блокада) анестезией, под общей анестезией или без анестезии с помощью трансвагинального ультразвукового датчика со специальным адаптером и пункционных игл диаметром 16-22G.
- При «бедном» овариальном ответе или подозрении на синдром «пустого» фолликула, рекомендуется промывание фолликулов во время аспирации [49].
Эмбриологическая часть:
Оценка ооцит-кумулюсного комплекса: полученную жидкость исследуют с помощью микроскопа для обнаружения яйцеклеток. Визуально производится оценка ооцит-кумулюсного комплекса. Обнаруженные яйцеклетки отмывают от фолликулярной жидкости в специальной среде с буфером, и переносят в лабораторную посуду с культуральной средой. В качестве лабораторной посуды используют чашки Петри, либо культуральные планшеты. Чашки с яйцеклетками помещают в СО2-инкубаторы, в которых поддерживается соответствующая температура и содержание СО2 в зависимости от рабочего pH культуральной среды (у разных производителей разная концентрация компонентов в составе сред, в том числе бикарбонатного буфера. В связи с этим, уровень СО2 в инкубаторе может варьироваться между лабораториями).
Подготовка сперматозоидов для процедуры ЭКО:
- оценка качества спермы в эякуляте, используя камеру Маклера и микроскоп. Оценивается подвижность сперматозоидов, и проводится подсчет концентрации сперматозоидов категории А+В;
- обработка сперматозоидов специальными средами;
- конечная оценка качества сперматозоидов в обработанной среде;
- подсчет концентрации сперматозоидов в камере Маклера.
Инсеминация яйцеклеток обработанной спермой (IVI):
- день оплодотворения считается нулевым днем. Оплодотворение проводится обработанной спермой через 2-6 часа после получения яйцеклеток. Для обычного оплодотворения используется приблизительно 50–100 тысяч сперматозоидов на каждую яйцеклетку;
- чашка с яйцеклетками и сперматозоидами находятся в инкубаторе до следующего дня, где температура и подача СО2 выдерживаются 37,0-37,5оC и 5-7% в зависимости от рабочего pH культуральной среды, соответственно оценка оплодотворения проводится через 12-20 часов после инсеминации.
Необходимые условия для проведения ICSI:
- получение подвижных или неподвижных сперматозоидов, пригодных для оплодотворения;
- для диагностической оценки жизнеспособности неподвижных сперматозоидов необходимо проведение теста на витальность (во время проведения ICSI, можно использовать HOS тест или стерильную воду, или другие реагенты такие как пентоксифиллин, для оплодотворения жизнеспособными сперматозоидами).
- наличие зрелых ооцитов у женщины: наличие первого полярного тельца (возможно проведение оплодотворения у ооцитов с лизированными первыми полярными телами после размораживания, ооциты с двумя полярными телами или фрагментированные полярные тела).
- наличие оборудования, сред и расходных материалов для проведения ICSI.
Этапы проведения ICSI
Эмбриологический этап:
Показания к проведению ICSI:
- олигозооспермия - снижение концентрации сперматозоидов менее 15 млн/мл;
- астенозооспермия - менее 25% активноподвижных сперматозоидов в 1 мл эякулята;
- тератозооспермия - менее 4% сперматозоидов с нормальной морфологией;
- сочетанная патология спермы (возможно различное сочетание изменений в концентрации, подвижности и строения сперматозоидов, что значительно снижает оплодотворяющую способность спермы);
- наличие антиспермальных антител в эякуляте (MAR-тест более 50%), которые препятствуют естественному оплодотворению даже в случаях нормальной концентрации сперматозоидов.
- неудачные предыдущие попытки ЭКО в анамнезе, включая отсутствие оплодотворения;
- размороженные ооциты;
- сперматозоиды, полученные при биопсии яичка;
- в старшем репродуктивном возрасте супругов.
Этапы проведения ICSI
- пункция фолликулов после стимуляции суперовуляции для получения
- ооцитов;
- денудация ооцитов;
- подготовка сперматозоидов для ICSI;
- иммобилизация сперматозоида;
- аспирация сперматозоида в иглу (инжектор);
- закрепление ооцита на присоске (холдинге);
- введение сперматозоида в цитоплазму яйцеклетки.
Эмбриологический этап:
1) Полученную фолликулярную жидкость исследуют с помощью микроскопа для обнаружения яйцеклеток. Обнаруженные яйцеклетки отмывают от фолликулярной жидкости, и переносят в лабораторную посуду с культуральной средой. В качестве лабораторной посуды используют чашки Петри, либо культуральные планшеты. Посуду с яйцеклетками помещают в СО2-инкубаторы, в которых поддерживается соответствующая температура и содержание СО2 в зависимости от рабочего pH культуральной среды. (У разных производителей разная концентрация компонентов в составе сред, в том числе бикарбонатного буфера. В связи с этим, уровень СО2 в инкубаторе может варьироваться между лабораториями.)
2) Денудация ооцитов проводится через 2-4 часа после ТВП. Денудирование ооцитов следует проводить, избегая сильного механического воздействия (риск разрыва оболочки клетки, повреждение мейотического веретена деления и искусственного разделения цитоплазмы). Денудированные (очищенные) ооциты помещают в чашки со специалильными средами для проведения ICSI.
Инъекция проводится не ранее, чем через 30 минут после денудации.
3) Подготовка сперматозоидов для ICSI. Суспензию сперматозоидов для ICSI добавляют в специальные среды непосредственно перед началом проведения микроманипуляции.
4) Иммобилизация сперматозоида. Выбрать сперматозоид правильной морфологии, и иммобилизировать его двумя-тремя поперечными движениями инъекционной пипетки, прижимая хвост ко дну чашки или с помощью лазера.
5) Аспирация сперматозоида проводится как со стороны головки, так и со стороны хвоста. Во время аспирации сперматозоида необходимо остановить движение жидкости в пипетке.
6) Закрепление ооцита на присоске. Переместить чашку так, чтобы капля с ооцитом была в фокусе. Ооцит фиксируют присоской.
7) Введение сперматозоида в цитоплазму яйцеклетки. Инъекция сперматозоида проводится путем введения пипетки через оболочку до середины цитоплазмы яйцеклетки. Перенести инжектированные ооциты в среду для культивирования.
8) Культивирование эмбрионов
9) Вспомогательный хэтчинг (BX) – методика, применяемая для возможного улучшения имплантации эмбрионов в эндометрий матки путем надрезания наружной оболочки эмбриона.
10) Перенос эмбриона в полость матки или криоконсервация эмбрионов.
Перенос эмбрионов:
Перенос эмбрионов – медицинская манипуляция, при которой эмбрионы переносят в полость матки женщины.
Перенос эмбрионов в полость матки рекомендуется осуществлять через 48-168 часов после получения и оплодотворения ооцитов, т.е. на 2-7 сутки развития. Рекомендуется перенос только одной бластоцисты во избежание развития многоплодной беременности. Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2a). Содержимое катетера вводится в полость матки с минимальной скоростью.
После завершения процедуры необходимо проверить оставшееся в катетере содержимое на наличие эмбрионов. Если эмбрионы не были перенесены, их следует поместить в катетер и сделать повторный перенос.
Пробный перенос - попытка прохождения цервикального канала катетером перед началом протокола, за 1–2 дня до переноса эмбрионов или непосредственно перед переносом.
Показания: предполагается нарушение проходимости цервикального канала, например, при наличии в анамнезе операций на шейке матки, стеноза или ложного хода и т.д.
Условия: перенос эмбрионов рекомендуется проводить под ультразвуковым контролем (трансабдоминальным или трансвагинальным), что повышает частоту наступления беременности и роды живым плодом. Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1а)
Рекомендуется использование мягкого катетера при переносе эмбрионов, что позволяет избежать травмы эндометрия и повышает вероятность наступления беременности. Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1b)
Для повышения вероятности наступления беременности перед переносом рекомендуется удаление слизи из цервикального канала стерильным тампоном, смоченным физиологическим раствором или питательной средой, или аспирация слизи с помощью катетера и шприца. Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2a)
Повторный перенос, выполненный сразу после первого, не снижает вероятность имплантации и наступления беременности и не повышает частоту выкидышей. Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2b)
При наличии сложностей в технике операции (вагинизм и др.), перенос эмбриона осуществляется под общей анестезией [50].
Поддержка лютеиновой фазы (посттрансферная поддержка).
Одномоментное созревание нескольких фолликулов и аспирация их содержимого являются причиной функциональной недостаточности желтых тел, в связи с чем, в программах ВРТ проводится гормональная поддержка лютеиновой фазы (ПЛФ) [51–54]. Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1а)
Гормональную ПЛФ рекомендуется начинать в день пункции яичников или первые 3 суток после нее [55]. Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1а)
Препараты, применяемые для ПЛФ:
Для ПЛФ рекомендуется использовать препараты прогестогены/прогестины. Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1а).
Прогестогены/прогестины в разных формах одинаково эффективны для поддержки лютеиновой фазы в циклах ВРТ. Препараты ХГЧ не рекомендуется использовать для ПЛФ из-за повышения риска развития СГЯ (в циклах свежего переноса), связанного с механизмом их действия. Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2). Также рекомендовано дополнительное применение эстрогенов для ПЛФ. Уровень убедительности рекомендаций С
Тонкий эндометрий во время лечебного цикла ВРТ (толщина 6,0-7,0мм и менее на день триггера или в день добавления прогестерона в циклах переноса размороженных эмбрионов на ЗГТ или в естественном цикле, в день пика ЛГ (около 30 МЕ/л)) может сопровождаться снижением шансов наступления беременности. Решение о переносе эмбрионов или сегментации цикла рекомендуется принимать исходя из особенностей конкретного случая. Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4) [45,46].
Тонкий эндометрий во время лечебного цикла ВРТ (толщина 6,0-7,0мм и менее на день триггера или в день добавления прогестерона в циклах переноса размороженных эмбрионов на ЗГТ или в естественном цикле, в день пика ЛГ (около 30 МЕ/л)) может сопровождаться снижением шансов наступления беременности. Решение о переносе эмбрионов или сегментации цикла рекомендуется принимать исходя из особенностей конкретного случая. Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4) [45,46].
Преимплантационное генетическое тестирование (ПГТ)
ПГТ является важным инструментом в рамках вспомогательных репродуктивных технологий (ВРТ), позволяющим снизить риск передачи генетических заболеваний и повысить вероятность успешной беременности. ПГТ позволяет выявить наличие у эмбрионов тяжелых нарушений, вызванных генетическими и/или хромосомными аномалиями, которые препятствуют развитию эмбриона и его имплантации, наступлению беременности, являются причиной выкидыша, неразвивающейся беременности или рождения ребенка с различной патологией.
Методики ПГТ - биотехнологические методы определения хромосомной и генетической патологии. На данный момент применяют: FISH, aCGH, NGS, SNP, PCR.
Виды преимплантационного генетического тестирования:
1. PGT-A - на наличие анеуплоидий;
2. PGT-M - на наличие моногенных заболеваний;
3. PGT-P - на наличие полигенных заболеваний;
4. PGT-SR - на наличие структурных перестроек хромосом.
Методики ПГТ - биотехнологические методы определения хромосомной и генетической патологии. На данный момент применяют: FISH, aCGH, NGS, SNP, PCR.
1. FISH (флуоресцентная гибридизация in situ);
2. aCGH (сравнительная геномная гибридизация);
3. NGS (секвенирование нового поколения);
4. SNP (определение однонуклеотидного полиморфизма).
5. PCR (полимеразная цепная реакция).
Каждый из этих методов имеет свои преимущества и ограничения, и применяется для конкретных целей.
Показания для проведения (ПГТ):
Методики получения материала для исследования:
1. Биопсия трофэктодермы (внешний слой эмбриона), проводится на стадии бластоцисты, при которой изымается несколько клеток для генетического анализа.
2. Биопсия бластомера, проводится на стадии дробления, при которой изымается бластомер для генетического анализа.
3. Неинвазивное ПГТ (niPGT), при котором на генетический анализ отправляется культуральная среда, в которой развивался эмбрион. Процедура абсолютна безопасна для эмбриона.
Показания для проведения (ПГТ):
1. Возраст супружеской пары старше 35 лет;
2. Рецидивирующие выкидыши и неразвивающиеся беременности;
3. Неудачные попытки ЭКО;
4. Носительство генетических заболеваний;
5. Тяжелые мужские факторы бесплодия;
6. Наличие в анамнезе ребенка с генетическим заболеванием;
7. Структурные хромосомные перестройки у одного из родителей;
8. Семейная история генетических заболеваний;
9. Половая селекция по медицинским показаниям;
10. При резус-конфликте и гемолитической болезни новорожденного в предыдущих беременностях.
Показания к криоконсервации эмбрионов:
Перенос размороженных эмбрионов (криопротокол).
Показания к криоконсервации эмбрионов:
1. риск развития СГЯ;
2. дефекты толщины, структуры и рецептивности эндометрия в день переноса эмбриона/ов;
3. высокий уровень прогестерона в день введения триггера (более 2,5 нг/мл или 8 нмоль/л);
4. отмена переноса в связи с различными причинами сегментации цикла;
5. «накопительные» программы, программы «отложенного родительства»;
6. суррогатное материнство;
7. соматические заболевания препятствующие вынашиванию беременности;
8. проведение ПГТ-A, ПГТ-M, ПГТ-Р, ПГТ-SR;
9. развитие осложнения в программе ЭКО;
10. особенности применяемого протокола стимуляции.
2. Цикл с применением заместительной гормональной терапии рекомендован пациенткам с нерегулярным менструальным циклом, при наличии любой патологии матки и эндометрия, в старшей возрастной группе, суррогатным матерям, при синхронизации циклов с использованием донорских ооцитов, в любых других случаях, когда шансы на имплантацию эмбриона будут выше при использовании ЗГТ.
Протоколы подготовки эндометрия при криопереносе:
1. Естественный или модифицированный естественный цикл рекомендован пациенткам с регулярным овуляторным менструальным циклом без признаков патологии эндометрия на день пика ЛГ или овуляции (В)
1) С 1- 3го дня менструального цикла проводится УЗИ мониторинг за ростом эндометрия и фолликула. Диагностика времени овуляции путем УЗИ-мониторинга и/или гормонального мониторинга (определение уровней ЛГ, прогестерона, эстрадиола). Возможно применение препаратов антиэстрогенов (селективных модуляторов эстрогенных рецепторов в модифицированном естественном цикле).
2) Возможно применение триггера овуляции (ХГЧ или аГнРГ) при диаметре фолликула диаметром 16-22мм – в случае использования модифицированного естественного цикла
3) Поддержка лютеиновой фазы препаратами прогестогенов/прогестинов [47].
2. Цикл с применением заместительной гормональной терапии рекомендован пациенткам с нерегулярным менструальным циклом, при наличии любой патологии матки и эндометрия, в старшей возрастной группе, суррогатным матерям, при синхронизации циклов с использованием донорских ооцитов, в любых других случаях, когда шансы на имплантацию эмбриона будут выше при использовании ЗГТ.
1) С 1-5го дня менструального цикла проводится УЗИ мониторинг и назначаются препараты эстрогенов (0,5-12 мг/сутки) per os или трансдермально до УЗИ/гормональных критериев готовности эндометрия к формированию лютеиновой фазы (возможно применение препаратов антиэстрогенов (селективных модуляторов эстрогенных рецепторов (10-60мг/сутки)).
2) Поддержка лютеиновой фазы препаратами прогестерона или прогестинами (100 – 800 мг микронизированный/10-40 мг дидрогестерон/2,5-5мг водный раствор прогестерона) начинается за 5-8 дней перед переносом эмбриона.
3) Для блокады преждевременной овуляции, ранней продукции прогестерона и соответственно рассинхронизации со структурой и толщиной эндометрия, рекомендуется протокол с применением депо аГнРГ на 19-21 день предыдущего цикла или со 2-3 дня текущего менструального цикла, и добавление ЗГТ с 2-5 дня менструального цикла. Также благодаря применению препаратов аГнРГ, возможен сдвиг дня переноса при наличии показаний, например проведение гистероскопии и криопереноса в одном цикле [48].
Тайминги переноса эмбрионов (пример)
1. Криоперенос в естественном цикле (модифицированном естественном цикле):
2. Криоперенос на фоне ЗГТ (пример):
Обычно рекомендуется проводить перенос через 4-8 суток после овуляции или добавления препаратов прогестерона. Также рекомендуется измерять уровень прогестерона в день триггера или в день добавления экзогенного прогестерона, который не должен превышать 2,5нг/мл или 8 нмоль/л.
Тайминги переноса эмбрионов (пример)
1. Криоперенос в естественном цикле (модифицированном естественном цикле):
| Триггер | Овуляция | ПЭ | ||||||
| Дни |
-2
|
-1 | 0 | 1 | 2 | 3 | 4 | 5 |
| Часы | 0 | 24 | 48 | 72 | 96 | 120±3 | ||
| Часы от триггера | 0 | 24 | 48 | 72 | 96 | 120±3 | 144 | 168 |
2. Криоперенос на фоне ЗГТ (пример):
| P4 | ПЭ | |||||
| Дни | 0 | 1 | 2 | 3 | 4 | 5 |
| Часы | 0 | 24 | 48 | 72 | 96 |
120±3 |
Перечень основных лекарственных средств (имеющих 100% вероятность применения): нет
Перечень дополнительных лекарственных средств (менее 100% вероятности применения):
|
Фармакологическая группа
|
МНН лекарственного средства | Способ применения | Уровень доказательности |
| Гормоны и их антагонисты | Менотропин |
75 МЕ (суточная доза от 37,5МЕ до 450МЕ) внутримышечно, подкожно
|
А |
| Гормоны и их антагонисты | Фолитропин бета |
75 МЕ (суточная доза от 37,5МЕ до 450МЕ)
подкожно
|
А |
| Гормоны и их антагонисты | Фолитропин альфа |
75 МЕ (суточная доза от 37,5МЕ до 450МЕ)
подкожно
|
А |
| Гормоны и их антагонисты | Фоллитропин альфа + лутропин альфа |
150 МЕ (эквивалентно 11 мкг) + 75 МЕ (эквивалентно 3 мкг)
подкожно
|
А |
| Гормоны и их антагонисты | Фоллитропин дельта | 12 мкг подкожно (от 4 до 12 мкг) | В |
| Гормоны и их агонисты | Трипторелин | 0,1мг, 3,75мг, 11,25мг внутримышечно, подкожно | В |
| Гормоны и их агонисты | Хорионический гонадотропин |
1000-20000 МЕ
внутримышечно
|
А |
| Гормоны и их агонисты | Хориогонадотропин альфа (рекомбинантный) | 6500 МЕ подкожно | А |
| Гормоны и их агонисты | Эстрадиол | 0,5мг, 1,0мг, 1,53мг, 2мг перорально, трансдермально (суточная доза от 0,5 до 12 мг) | А |
| Гормоны и их агонисты |
Микронизированный
прогестерон
|
90мг, 100мг, 200мг, 400мг вагинально, ректально,
перорально
|
А |
| Гормоны и их агонисты | Прогестерон |
масляный раствор / водный раствор
25 мг внутримышечно/ подкожно
|
А |
| Гормоны и их агонисты | Дидрогестерон | 10мг перорально (суточная доза 10-40 мг) | В |
|
Комбинированные оральные
контрацептивы
|
Прогестогены и эстрогены |
перорально,
трансдермально
|
С |
| Гормоны и их антагонисты | Цетрореликс | 0,25мг подкожно | В |
| Гормоны и их антагонисты | Ганиреликс | 0,25мг подкожно | В |
| Противоопухолевое средство | Летрозол | 2,5мг (до 10мг), перорально | В |
| Противоопухолевое средство | Тамоксифен | 10мг (до 40мг) перорально | С |
| Гормоны и их антагонисты | Соматотропный гормон | 10мг подкожно | С[12] |
| Стимулятор продукции гонадотропинов | Кломифен | 50мг (до150мг), перорально | В |
| Нестероидные противовоспалительные средства | Ибупрофен | 200мг перорально, ректально | С [57] |
| Плазмозамещающие препараты | Желатин | 4% внутривенно, капельно | С |
| Плазмозамещающие препараты | Альбумин 10-20% | внутривенно, капельно | С |
| Электролитные растворы | Кальций глюконат | 10% внутривенно, капельно | С |
| Агонисты дофамина | Каберголин | 0,5мг перорально | С |
| Агонисты дофамина | Бромокриптин | 2,5мг перорально | С |
| Гемостатические препараты | Транексамовая кислота | 500мг перорально, внутривенно | С |
| Альфа-адреномиметики | Фенилэфрина гидрохлорид | 10мг внутривенно, подкожно, внутримышечно | С |
| Антикоагулянт прямого действия | Эноксапарин натрия | 40-60мг подкожно | С |
| Антикоагулянт прямого действия | Надропарин кальция | 0,4мл подкожно | С |
*В соответствии с правилами применения ЛС незарегистрированных на территории РК.
Предгравидарная подготовка.
Пациентам, планирующим процедуры ВРТ, так же проводится предгравидарная подготовка (см. протокол «Предгравидарная подготовка») и адъювантная терапия, которая может включать витамины, микроэлементы, биологически активные добавки, гормоны и их аналоги, в том числе гормон роста [12], андрогены, и другие с целью улучшения результатов ВРТ [9–15].
Осложнения в программах ВРТ
К возможным осложнениям в программах ВРТ относятся:
1. Синдром гиперстимуляции яичников (СГЯ);
2. Многоплодная беременность;
3. Внематочная беременность;
4. Кровотечения, связанные с пункцией фолликулов яичников;
5. Аллергические реакции;
6. Перекрут яичника;
7. Инфекционные осложнения;
8. Ранение соседних органов.
Синдром гиперстимуляции яичников (СГЯ) [58] См. КП «Осложнения, связанные с искусственным оплодотворением»
Классификация СГЯ по системе Голана
| Мягкий | Клинические особенности | |
| 1-й класс | Вздутие живота и дискомфорт | |
| 2 класс | Признаки степени 1 плюс тошнота/рвота и/или диарея. Яичники увеличены до 5-12 см. | |
| Умеренный | Стационарное/амбулаторное лечение | |
| 3-й степени | Признаки легкого СГЯ плюс ультразвуковые признаки асцита. | |
| Серьезный | Стационарное лечение | |
| 4 класс | Признаки умеренного СГЯ плюс клинические признаки асцита и/или гидроторакса (или затрудненного дыхания). Парацентез из-за симптомов СГЯ. | |
| 5 класс | Все вышеперечисленное плюс изменение объема крови, повышение вязкости крови из-за гемоконцентрации, нарушения коагуляции и снижение перфузии и функции почек. Госпитализация из-за симптомов СГЯ. | |
Профилактика СГЯ:
• Индивидуальный подбор дозы в стимуляции яичников
• Выбор протокола с антагонистами, с прогестогенами/прогестинами
• Применение coasting в контролируемой овариальной стимуляции яичников
• Отмена контролируемой овариальной стимуляции яичников
• Назначение агонистов ГнРГ как триггер овуляции
• Отмена переноса и криоконсервация эмбрионов
• Назначение агонистов дофамина со дня введения триггера
• Назначение антагонистов ГнРГ со дня введения триггера
• Назначение интраоперационно 10% раствора кальция глюконата, в/в капельно
Лечение СГЯ
1) Легкая форма:
-обильное питье
-отказ от алкоголя и газированных жидкостей
-полноценное, сбалансированное и рациональное питание
-исключение физических и психоэмоциональных перегрузок
-отказ от сексуальной активности
-ежедневная оценка диуреза
-контроль за колебаниями массы тела
Многоплодная беременность [50]. См. КП «Многоплодная беременность»
Внематочная беременность
2) Тяжелую форму СГЯ необходимо наблюдать и лечить в условиях амбулаторной или стационарной помощи. Применяются следующие препараты:
• Агонисты дофамина (каберголин 0,5мг, бромокриптин 2,5 мг)
• 10% раствор кальция глюконата
• Антагонисты ГнРГ (цетрореликс/ганиреликс 0,25 мг)
• Ингибиторы ароматазы (летрозол 2,5 мг)
• Растворы для поддержания осмотического и онкотического давления крови: альбумин 10-20%, сукцинилированный желатин 4%
• Низкомолекулярные гепарины (эноксапарин натрия 40-60 мг (4000-6000 МЕ анти-Ха)/надропарин кальция 0,4 мл (3800 МЕ анти-Ха))
При выраженном асците проводится парацентез, кульдоцентез.
При безэффективности терапии возможно прерывание беременности по медицинским показаниям [59].
Многоплодная беременность [50]. См. КП «Многоплодная беременность»
Внематочная беременность
См. КП «Внематочная беременность»
Диагностика:
Клинические проявления:
Кровотечения, связанные с пункцией фолликулов яичников
Внутрибрюшное кровотечение является серьезным, угрожающим жизни состоянием, возникает из-за травмы сосудов яичника или ранения крупных сосудов (встречается с частотой от 0,03 до 0,5%). К предрасполагающим факторам относят нефизиологическое увеличение стимулированного яичника, нарушенная анатомия органов малого таза, повышенная васкуляризация тканей яичников, нарушение целости тканей пункционной иглой, избыточное скопление в пунктируемом фолликуле геморрагической жидкости, приводящее к разрыву яичника. Все это может обусловить как наружное, так и внутреннее кровотечение.
Диагностика:
- Динамическое наблюдение в первые 2 часа;
- Данные лабораторного исследования позволяют выявить признаки кровопотери (снижение концентрации гемоглобина, гематокрита в динамике);
- Трансвагинальная/трансабдоминальная эхография – наличие жидкости в брюшной полости и сгустков крови.
Клинические проявления:
Клиническая картина определяется объемом кровопотери. Болевому приступу (локализация — нижний отдел живота) сопутствуют слабость, головокружение, тошнота, иногда рвота, холодный пот, вплоть до потери сознания. Обращает на себя внимание бледность кожных покровов, тахикардия, снижение артериального давления. Живот обычно несколько вздут, при пальпации обнаруживают болезненность подвздошных областей. Симптомы раздражения брюшины выражены в разной степени. При перкуссии возможно притупление перкуторного звука, вследствие наличия свободной жидкости в брюшной полости.
Оценка тяжести кровопотери и коагулопатии:
Таблица: оценка степени тяжести кровопотери

Лечение:
При отсутствии обильного кровотечения, стабильных показателях гемодинамики, возможна выжидательная тактика. Рекомендован постельный режим, лечение вазоконстрикторами и кровоостанавливающими препаратами.
При признаках продолжающегося выраженного кровотечения показано оперативное лечение с применением лапароскопии/лапаротомии.
Оценка тяжести кровопотери и коагулопатии:
Для оценки тяжести кровопотери традиционно используют шкалу American College of Surgeons Advanced Trauma Life Support (ATLS)
Таблица: оценка степени тяжести кровопотери

Тактика оперативного вмешательства должна быть максимально щадящей: проводится эвакуация крови из брюшной полости, выявляется источник кровотечения; проводится коагуляцию стенок капсулы лютеиновой кисты или жёлтого тела в области разрыва с помощью биполярного коагулятора.
Аллергические реакции на применяемые препараты – см. КП «Лекарственная гиперчувствительность (лекарственная аллергия) с различными клиническими проявлениями»
Перекрут яичника [61]
Перекрут яичника — это патологическое состояние, которое возникает, когда яичник перекручивается вокруг собственных кровеносных сосудов. Практически всегда этот процесс сопровождается нарушением кровоснабжения, и поэтому требует срочного медицинского вмешательства.
Перекрут яичников относится к категории неотложных состояний, которые требуют, как можно более раннего начала лечения. Чем раньше будет восстановлена нормальная анатомия органов малого таза, тем выше шансы сохранить гонаду. Лечение всегда заключается в немедленном проведении хирургического вмешательства.
Инфекционные осложнения
Стимуляция яичников и последующая пункция яичников могут спровоцировать обострение хронического воспалительного процесса органов малого таза. В этом случае возможна отмена переноса эмбрионов и комплексное консервативное или оперативное лечение.
Возможные инфекционные осложнения:
сальпингит
оофорит
аднексит
пельвиоперитонит
метроэндометрит
См. КП «Воспалительные заболевания органов малого таза (сальпингит, оофорит, сальпингоофорит)».
Инфекционные осложнения
Стимуляция яичников и последующая пункция яичников могут спровоцировать обострение хронического воспалительного процесса органов малого таза. В этом случае возможна отмена переноса эмбрионов и комплексное консервативное или оперативное лечение.
Возможные инфекционные осложнения:
сальпингит
оофорит
аднексит
пельвиоперитонит
метроэндометрит
См. КП «Воспалительные заболевания органов малого таза (сальпингит, оофорит, сальпингоофорит)».
Ранение соседних органов.
В клинической практике осложнения трансвагинальной пункции яичников в программе ЭКО и ПЭ от общего числа осложнений лечебных циклов ВРТ наблюдают достаточно редко (1-2%).
Наиболее типичны кровотечения из пунктированного яичника и ранение органов малого таза (кишечника, мочевого пузыря, ранение магистральных сосудов), возникающие во время проведения пункции яичников.
Провоцирующие риски: спаечный процесс в малом тазу, наличие оперативных вмешательств.
Симптомы ранения мочевого пузыря: боль, которая возникает вскоре после пункции и продолжается в течение длительного времени; при проведении контрольного исследования УЗИ малого таза визуализируется свободная жидкость в большом количестве в малом тазу и появление гиперэхогенной взвеси в полости мочевого пузыря; дизурические явления и кровь в моче.
Симптомы ранения кишечника: болевой синдром; дисфункция кишечника, вплоть до пареза кишечника; интоксикация, высокая температура.
Лечение: комплексное, стационарное, включающее-оперативное вмешательство (чревосечение или лапароскопия), ушивание кишечника или мочевого пузыря, в случае необходимости с участием общего хирурга, и проведение инфузионно-трансфузионной терапии при развитии симптомов перитонита.
Консервативно-выжидательная тактика, при незначительных клинических проявлениях ранения мочевого пузыря
Необходима ранняя реабилитации данного контингента больных. Включение в программу ЭКО и ПЭ рекомендовано через 1-3 месяцев.
II. Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе: согласно Мариборскому консенсусу ESHRE.
1) Эффективность стимуляции яичников: частота отмены цикла до пункции; частота СГЯ.
2) Эффективность мониторинга стимуляции, введения триггера и пункции: частота отсутствия ооцитов на пункции, частота получения ооцитов; соотношение зрелых ооцитов при ИКСИ; частота осложнений пункции.
3) Эффективность переноса эмбрионов и исходы беременности: частота клинической беременности; частота эктопической беременности; частота многоплодия; частота родов живым плодом; кумулятивная частота родов [60].
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2024
- 1. Кодекс. О здоровье народа и системе здравоохранения Кодекс. 2019; 2. Приказ Министра здравоохранения Республики Казахстан от 15 декабря 2020 года № ҚР ДСМ-272/2020 Об утверждении правил и условий проведения вспомогательных репродуктивных методов и технологий. Vol. 4. 2023. 3. WHO. Infertility [Internet]. Available from: https://www.who.int/news-room/fact-sheets/detail/infertility 4. Theobald R, SenGupta S, Harper J. The status of preimplantation genetic testing in the UK and USA. Hum Reprod. 2021;35(4):986–98. 5. Niederberger C, Pellicer A, Cohen J, Gardner DK, Palermo GD, O’Neill CL, et al. Forty years of IVF. Fertil Steril. 2018;110(2):185-324.e5. 6. Harton G, Braude P, Lashwood A, Schmutzler A, Traeger-Synodinos J, Wilton L, et al. ESHRE PGD consortium best practice guidelines for organization of a PGD centre for PGD/preimplantation genetic screening. Hum Reprod. 2011;26(1):14–24. 7. Carvalho F, Coonen E, Goossens V, Kokkali G, Rubio C, Meijer-Hoogeveen M, et al. ESHRE PGT Consortium good practice recommendations for the organisation of PGT. Hum Reprod Open. 2020;2020(3). 8. Назаренко ПТА, Назаренко ТА, Краснопольская КВ, Попов АА. Эко при гинекологических и эндокринных заболеваниях. 2016. 1 p. 9. Noventa M, Vitagliano A, Andrisani A, Blaganje M, Viganò P, Papaelo E, et al. Testosterone therapy for women with poor ovarian response undergoing IVF: a meta-analysis of randomized controlled trials. J Assist Reprod Genet. 2019;36(4):673–83. 10. Alviggi C, Humaidan P, Howles CM, Tredway D, Hillier SG. Biological versus chronological ovarian age: implications for assisted reproductive technology. Reprod Biol Endocrinol [Internet]. 2009 Dec 22;7(1):101. Available from: https://rbej.biomedcentral.com/articles/10.1186/1477-7827-7-101 11. Zhao J, Huang X, Xu B, Yan Y, Zhang Q, Li Y. Whether vitamin D was associated with clinical outcome after IVF/ICSI: A systematic review and meta-analysis. Reprod Biol Endocrinol. 2018;16(1):1–7. 12. Lan KC, Lin PY, Chang YC, Chen YJ, Tsai YR, Ismaeil Mohamed IS, et al. Growth hormone supplementation may improve the pregnancy rate and endometrial receptivity among women aged more than 40 years undergoing in vitro fertilization. Biomed J [Internet]. 2019;42(6):411–6. Available from: https://doi.org/10.1016/j.bj.2019.05.003 13. Ozcil MD. Dehydroepiandrosterone supplementation improves ovarian reserve and pregnancy rates in poor responders. Eur Rev Med Pharmacol Sci. 2020;24(17):9104–11. 14. Kuroda K, Horikawa T, Gekka Y, Moriyama A, Nakao K, Juen H, et al. Effects of Periconceptional Multivitamin Supplementation on Folate and Homocysteine Levels Depending on Genetic Variants of Methyltetrahydrofolate Reductase in Infertile Japanese Women. Nutrients [Internet]. 2021 Apr 20;13(4):1381. Available from: https://doi.org/10.3390/nu13041381 15. Showell MG, Mackenzie-Proctor R, Jordan V, Hart RJ. Antioxidants for female subfertility. Cochrane Database Syst Rev [Internet]. 2020 Aug 27;2020(11). Available from: www.cochranelibrary.com 16. Локшин ВН, Джусубалиева ТМ. Клиническая практика в репродуктивной медицине. MedMedia. 2015. 464 p. 17. Ho JR, Paulson RJ. Modified natural cycle in in vitro fertilization. Fertil Steril. 2017;108(4):572–6. 18. Mol BW, Bossuyt PM, Sunkara SK, Garcia Velasco JA, Venetis C, Sakkas D, et al. Personalized ovarian stimulation for assisted reproductive technology: study design considerations to move from hype to added value for patients. Fertil Steril. 2018;109(6):968–79. 19. Vlaisavljevic V, Apter S, Capalbo A, D’Angelo A, Gianaroli L, Griesinger G, et al. The Maribor consensus: report of an expert meeting on the development of performance indicators for clinical practice in ART. Hum Reprod Open. 2021;2021(3):1–17. 20. Younis JS, Ben-Ami M, Ben-Shlomo I. The Bologna criteria for poor ovarian response: A contemporary critical appraisal. J Ovarian Res [Internet]. 2015;8(1):1–10. Available from: http://dx.doi.org/10.1186/s13048-015-0204-9 21. Esteves SC, Alviggi C, Humaidan P, Fischer R, Andersen CY, Conforti A, et al. The POSEIDON Criteria and Its Measure of Success Through the Eyes of Clinicians and Embryologists. Front Endocrinol (Lausanne). 2019;10(November):1–8. 22. La Marca A, Sunkara SK. Individualization of controlled ovarian stimulation in IVF using ovarian reserve markers: From theory to practice. Hum Reprod Update. 2014;20(1):124–40. 23. Grisendi V, Mastellari E, La Marca A. Ovarian Reserve Markers to Identify Poor Responders in the Context of Poseidon Classification. Front Endocrinol (Lausanne) [Internet]. 2019 May 8;10:281. Available from: www.frontiersin.org 24. Lensen SF, Wilkinson J, Leijdekkers JA, La Marca A, Mol BWJ, Marjoribanks J, et al. Individualised gonadotropin dose selection using markers of ovarian reserve for women undergoing in vitro fertilisation plus intracytoplasmic sperm injection (IVF/ICSI). Cochrane Database Syst Rev. 2018;2018(2). 25. Leijdekkers JA, Torrance HL, Schouten NE, van Tilborg TC, Oudshoorn SC, Mol BWJ, et al. Individualized ovarian stimulation in IVF/ICSI treatment: It is time to stop using high FSH doses in predicted low responders. Hum Reprod. 2020;35(9):1954–63. 26. Gleicher N, Kushnir VA, Albertini DF, Barad DH. Improvements in IVF in women of advanced age. J Endocrinol. 2016;230(1):F1–6. 27. Costello M, Garad R, Hart R, Homer H, Johnson L, Jordan C, et al. A Review of First Line Infertility Treatments and Supporting Evidence in Women with Polycystic Ovary Syndrome. Med Sci (Basel, Switzerland). 2019;7(9). 28. Guo W, Li HWR, Yang Z, Zeng L, Yang R, Qiao J, et al. Live birth after letrozole as an adjunct to follicle-stimulating hormone versus follicle-stimulating hormone alone for ovarian stimulation in in vitro fertilisation cycles—study protocol for a randomised controlled trial. Trials. 2022;23(1):1–9. 29. Kadoura S, Alhalabi M, Nattouf AH. Conventional GnRH antagonist protocols versus long GnRH agonist protocol in IVF/ICSI cycles of polycystic ovary syndrome women: a systematic review and meta-analysis. Sci Rep [Internet]. 2022;12(1):1–22. Available from: https://doi.org/10.1038/s41598-022-08400-z 30. Jing M, Lin C, Zhu W, Tu X, Chen Q, Wang X, et al. Cost-effectiveness analysis of GnRH-agonist long-protocol and GnRH-antagonist protocol for in vitro fertilization. Sci Rep. 2020;10(1):1–8. 31. OS Guideline Development Group. Ovarian Stimulation for IVF/ICSI. Eur Soc Hum Reprod Embryol. 2019;(October):1–136. 32. Xiao Z ni, Peng J li, Yang J, Xu W ming. Flexible GnRH Antagonist Protocol versus Progestin-primed Ovarian Stimulation (PPOS) Protocol in Patients with Polycystic Ovary Syndrome: Comparison of Clinical Outcomes and Ovarian Response. Curr Med Sci [Internet]. 2019 Jun 17;39(3):431–6. Available from: http://link.springer.com/10.1007/s11596-019-2055-x 33. Orvieto R. Stop GnRH-agonist/GnRH-antagonist protocol: a different insight on ovarian stimulation for IVF. Reprod Biol Endocrinol [Internet]. 2023;21(1):23–6. Available from: https://doi.org/10.1186/s12958-023-01069-7 34. Huang TC, Lin YH, Pan SP, Tu YA, Huang CC, Chen MJ, et al. A novel GnRH-antagonist protocol by switching to medroxyprogesterone when patients being at risk of ovarian hyperstimulation syndrome during ovarian stimulation. J Formos Med Assoc. 2020;119(11):1642–9. 35. Mu Z, Sa Y, Sun Z, Yi Y. Ovulation induction with high progesterone levels may be more suitable for elderly patients with low ovarian response. J Gynecol Obstet Hum Reprod [Internet]. 2021;50(2):101661. Available from: https://doi.org/10.1016/j.jogoh.2019.101661 36. Wang L, Wang J, Zhang Y, Qian C, Wang X, Bai J, et al. Analysis of euploidy rates in preimplantation genetic testing for aneuploidy cycles with progestin-primed versus GnRH agonist/antagonist protocol. Eur J Med Res. 2023;28(1):1–9. 37. Xu S, Wang X, Zhang Y, Han Y, Zhang C. Comparison the effects of progestin-primed ovarian stimulation (PPOS) protocol and GnRH-a long protocol in patients with normal ovarian reserve function. Gynecol Endocrinol [Internet]. 2023;39(1). Available from: https://doi.org/10.1080/09513590.2023.2217263 38. Guan S, Feng Y, Huang Y, Huang J. Progestin-Primed Ovarian Stimulation Protocol for Patients in Assisted Reproductive Technology: A Meta-Analysis of Randomized Controlled Trials. Front Endocrinol (Lausanne). 2021;12(August). 39. Ubaldi FM, Capalbo A, Vaiarelli A, Cimadomo D, Colamaria S, Alviggi C, et al. Follicular versus luteal phase ovarian stimulation during the same menstrual cycle (DuoStim) in a reduced ovarian reserve population results in a similar euploid blastocyst formation rate: new insight in ovarian reserve exploitation. Fertil Steril. 2016;105(6):1488-1495.e1. 40. Vaiarelli A, Cimadomo D, Petriglia C, Conforti A, Alviggi C, Ubaldi N, et al. DuoStim – a reproducible strategy to obtain more oocytes and competent embryos in a short time-frame aimed at fertility preservation and IVF purposes. A systematic review. Ups J Med Sci [Internet]. 2020 Apr 2;125(2):121–30. Available from: https://doi.org/10.1080/03009734.2020.1734694 41. Vaiarelli A, Cimadomo D, Petriglia C, Conforti A, Alviggi C, Ubaldi N, et al. DuoStim–a reproducible strategy to obtain more oocytes and competent embryos in a short time-frame aimed at fertility preservation and IVF purposes. A systematic review. Ups J Med Sci. 2020;125(2):121–30. 42. Palomba S, Costanzi F, Nelson SM, Caserta D, Humaidan P. Interventions to prevent or reduce the incidence and severity of ovarian hyperstimulation syndrome: a systematic umbrella review of the best clinical evidence. Reprod Biol Endocrinol [Internet]. 2023;21(1). Available from: https://doi.org/10.1186/s12958-023-01113-6 43. Wald K, Hariton E, Morris JR, Chi EA, Jaswa EG, Cedars MI, et al. Changing stimulation protocol on repeat conventional ovarian stimulation cycles does not lead to improved laboratory outcomes. Fertil Steril [Internet]. 2021;116(3):757–65. Available from: https://doi.org/10.1016/j.fertnstert.2021.04.030 44. Lundin K, Bentzen JG, Bozdag G, Ebner T, Harper J, Le Clef N, et al. Good practice recommendations on add-ons in reproductive medicine. Hum Reprod [Internet]. 2023 Nov 2;38(11):2062–104. Available from: https://academic.oup.com/humrep/article/38/11/2062/7281712 45. Puente E, Alonso L, Laganà AS, Ghezzi F, Casarin J, Carugno J. Chronic endometritis: Old problem, novel insights and future challenges. Int J Fertil Steril. 2020;13(4):250–6. 46. Bellver J. BMI and miscarriage after IVF. Curr Opin Obstet Gynecol. 2022;34(3):114–21. 47. Cardellicchio L, Reschini M, Paffoni A, Guarneri C, Restelli L, Somigliana E, et al. Frozen–thawed blastocyst transfer in natural cycle: feasibility in everyday clinical practice. Arch Gynecol Obstet. 2017;295(6):1509–14. 48. Azimi Nekoo E, Chamani M, Shahrokh Tehrani E, Hossein Rashidi B, Davari Tanha F, Kalantari V. Artificial Endometrial Preparation for Frozen-Thawed Embryo Transfer with or without Pretreatment with Depot Gonadotropin Releasing Hormone Agonist in Women with Regular Menses. J Fam Reprod Heal [Internet]. 2015;9(1):1–4. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25904960 http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=PMC4405510 49. D’Angelo A, Panayotidis C, Amso N, Marci R, Matorras R, Onofriescu M, et al. Recommendations for good practice in ultrasound: oocyte pick up†. Hum Reprod Open [Internet]. 2019 Nov 1;2019(4):1–25. Available from: https://academic.oup.com/hropen/article/doi/10.1093/hropen/hoz025/5625062 50. Society E, Reproduction H. Number of embryos to transfer during IVF / ICSI Guideline of European Society of Human. 2023; Available from: https://www.eshre.eu/Guidelines-and-Legal/Guidelines/Embryo-transfer 51. Liu XR, Mu HQ, Shi Q, Xiao XQ, Qi HB. The optimal duration of progesterone supplementation in pregnant women after IVF/ICSI: A meta-analysis. Reprod Biol Endocrinol. 2012;10:1–8. 52. Segal L, Breyzman T, Kol S. Luteal phase support post IVF: Individualized early stop. Reprod Biomed Online [Internet]. 2015;31(5):633–7. Available from: http://dx.doi.org/10.1016/j.rbmo.2015.07.011 53. Ecochard R, Bouchard T, Leiva R, Abdulla S, Dupuis O, Duterque O, et al. Characterization of hormonal profiles during the luteal phase in regularly menstruating women. Fertil Steril [Internet]. 2017;108(1):175-182.e1. Available from: http://dx.doi.org/10.1016/j.fertnstert.2017.05.012 54. de Ziegler D, Ayoubi JM, Frydman R, Fanchin R. Luteal phase support in assisted reproductive technologies: from here to there. Fertil Steril. 2018;109(1):57–8. 55. van der Linden M, Buckingham K, Farquhar C, Kremer JAM, Metwally M. Luteal phase support for assisted reproduction cycles. Cochrane Database Syst Rev [Internet]. 2015 Jul 7;2016(10). Available from: http://doi.wiley.com/10.1002/14651858.CD009154.pub3 56. Glujovsky D, Pesce R, Fiszbajn G, Sueldo C, Hart RJ, Ciapponi A. Endometrial preparation for women undergoing embryo transfer with frozen embryos or embryos derived from donor oocytes. Cochrane Database Syst Rev [Internet]. 2010 Jan 20; Available from: https://doi.wiley.com/10.1002/14651858.CD006359.pub2 57. Nyachieo A, Siristatidis CS, Vaidakis D. Nonsteroidal anti-inflammatory drugs for assisted reproductive technology. Cochrane Database Syst Rev [Internet]. 2019 Oct 19;2019(10). Available from: https://doi.wiley.com/10.1002/14651858.CD007618.pub2 58. Golan A, Weissman A. Symposium: Update on prediction and management of OHSS - A modern classification of OHSS. Reprod Biomed Online [Internet]. 2009;19(1):28–32. Available from: http://dx.doi.org/10.1016/S1472-6483(10)60042-9 59. Humaidan P, Nelson SM, Devroey P, Coddington CC, Schwartz LB, Gordon K, et al. Ovarian hyperstimulation syndrome: Reviewand new classification criteria for reporting in clinical trials. Hum Reprod. 2016;31(9):1997–2004. 60. ESHRE Clinic PI Working Group; Vlaisavljevic V, Apter S, Capalbo A, D'Angelo A, Gianaroli L, Griesinger G, Kolibianakis EM, Lainas G, Mardesic T, Motrenko T, Pelkonen S, Romualdi D, Vermeulen N, Tilleman K. The Maribor consensus: report of an expert meeting on the development of performance indicators for clinical practice in ART. Hum Reprod Open. 2021 Jul 3;2021(3):hoab022. doi: 10.1093/hropen/hoab022. PMID: 34250273; PMCID: PMC8254491. 61. Hasson J, Tsafrir Z, Azem F, Bar-On S, Almog B, Mashiach R, Seidman D, Lessing JB, Grisaru D. Comparison of adnexal torsion between pregnant and nonpregnant women. Am J Obstet Gynecol. 2010 Jun;202(6):536.e1-6. doi: 10.1016/j.ajog.2009.11.028. Epub 2010 Jan 8. PMID: 20060090.
Информация
Сокращения, используемые в протоколе:
|
аГнРГ
|
Агонисты гонадотропин-рилизинг гормона |
| АЛТ | Аланинаминотрансфераза |
| АМГ | Антимюллеров гормон |
|
антГнРГ
|
Антагонисты гонадотропин-рилизинг гормона |
| Анти-ТПО | Антитела к тиреопероксидазе |
| АСТ | Аспартатаминотрансфераза |
|
АЧТВ
|
Активированное частичное тромбопластиновое время |
| АФП | Альфа-фетопротеин |
| ВИЧ | Вирус иммунодефицита человека |
| ВМИ | Внутриматочная инсеминация спермой мужа/партнера |
|
ВМИ-Д
|
Внутриматочная инсеминация спермой донора |
| ВРТ | Вспомогательные репродуктивные технологии |
| ВПГ | Вирус простого герпеса |
| ВХ | Вспомогательный хетчинг |
|
ГБН
|
Гемолитическая болезнь новорожденных |
| ГнРГ | Гонадотропин-рилизинг гормон |
| ДГЭА | Дегидроэпиандростерон |
| ДНК | Дезоксирибонуклеиновая кислота |
|
ДО
|
Донорство ооцитов |
| ЗГТ | Заместительная гормональная терапия |
| ИКСИ | Интрацитоплазматическая инъекция сперматозоида в ооцит |
| ИМТ | Индекс массы тела |
|
ИО
|
Индукция овуляции |
| ИФА | Иммуноферментный анализ |
| КАФ | Количество антральных фолликулов |
| КОК | Комбинированные оральные контрацептивы |
|
КП
|
Клинический протокол |
| ЛГ | Лютеинизирующий гормон |
| ЛДГ | Лактатдегидрогеназа |
| МЗ | Министерство здравоохранения |
|
МНО
|
Международное нормализованное отношение |
| МФЯ | Мультифолликулярные яичники |
| НПВС | Нестероидные противовоспалительные средства |
|
КОС
|
Контролируемая овариальная стимуляция |
| ОСМС | Обязательное социальное медицинское страхование |
| ПВ | Протромбиновое время |
| ПГТ | Преимплантационное генетическое тестирование |
|
ПГТ-А
|
ПГТ на анэуплоидии |
| ПГТ-М | ПГТ на моногенные заболевания/дефект одного гена |
| ПГТ-P | ПГТ на полигенные заболевания |
| ПГТ-SR | ПГТ на структурные / хромосомные перестройки |
|
ПЛФ
|
Поддержка лютеиновой фазы |
| ПТИ | Протромбиновый индекс |
| ПЦР | Полимеразная цепная реакция |
| ПЭ | Перенос эмбриона (ов) в полость матки |
|
РКИ
|
Рандомизированное клиническое исследование |
| рЛГ | Рекомбинантный лютеинизирующий гормон |
| рФСГ | Рекомбинантный фолликулостимулирующий гормон |
| СМ | Суррогатное материнство/суррогатная мать |
|
СГЯ
|
Синдром гиперстимуляции яичников |
| СПКЯ | Синдром поликистозных яичников |
| Т3 св | Трийодтиронин свободный |
| Т4 | Тироксин общий |
|
ТТГ
|
Тиреотропный гормон |
| ТВП | Трансвагинальная пункция |
| УЗИ | Ультразвуковое исследование |
| ХГЧ | Хорионический гонадотропин человеческий |
|
ЭКО (IVF - IVI)
|
Экстракорпоральное оплодотворение |
|
ЭКО/ИКСИ
(IVI/ICSI)
|
Комбинация двух методов оплодотворения ооцитов в одном цикле |
|
FET
|
Перенос размороженных эмбрионов |
|
HLA
|
(human leucocyte antigens) - человеческие лейкоцитарные антигены, антигены тканевой совместимости |
|
HOS тест
|
Тест на гипоосмотическое набухание |
| HBsAg | Поверхностный антиген вируса гепатита В |
|
IMSI Intracytoplasmic
|
Morphologically selected Sperm Injection |
| IVM | In Vitro Maturation - созревание ооцитов вне организма |
|
Ig M, G
|
Иммуноглобулины |
| LA 1/ LA2 | Волчаночный антикоагулянт |
|
MAR-тест
|
Смешанный антиглобулиновый тест |
| PICSI | Physiologic Intra Cytoplasmic Sperm Injection |
| POSEIDON | Patient-Oriented Strategies Encompassing IndividualizeD Oocyte Number |
|
pH
|
Водородный показатель или показатель кислотности |
| Rh mA (-) | Резус отрицательный эмбрион |
|
RW
|
Реакция Вассермана |
| SET | Селективный перенос одного эмбриона |
| TESA | Testicular Sperm Aspiration - Аспирация сперматозоидов из яичка |
| MicroTESE | Микрохирургическая биопсия яичка |
Организационные аспекты протокола:
Список разработчиков протокола с указанием квалификационных данных:
1) Валиев Равиль Камилевич – кандидат медицинских наук, НАО «Казахский национальный медицинский университет имени С.Д. Асфендиярова», доцент, клинический наставник, сотрудник ГПХ - Школа Общей Медицины-2, врач акушер-гинеколог ТОО «Международный клинический центр репродуктологии «Persona»» город Алматы.
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
Указание условий пересмотра протокола: пересмотр не реже 1 раза в 5 лет и не чаще 1 раза в 3 года при наличии новых методов диагностики и лечения с уровнем доказательности.
2) Вячеслав Нотанович Локшин – доктор медицинских наук, профессор, академик Национальная академия наук Казахстана, президент Казахстанской ассоциации репродуктивной медицины, генеральный директор ТОО «Международного клинического центра репродуктологии "Persona"» город Алматы, президент Международной академии репродуктологии, главный внештатный репродуктолог Министерства здравоохранения Республики Казахстан.
3) Ожмухаметова Эльвира Келгембаевна – MD, PhD, врач клинический фармаколог, заведующий госпитальной фармации ГКП на ПХВ «Городская многопрофильная больница №2» Управление общественного здравоохранения города Астана, главный внештатный клинический фармаколог Министерства здравоохранения Республики Казахстан.
4) Комогорцев Анатолий Николаевич – магистр общественного здравоохранения, врач репродуктолог, акушер-гинеколог, ТОО «Институт репродуктивной медицины» города Алматы.
5) Абшекенова Айгерим Темирхановна – НАО «Казахский национальный медицинский университет имени С.Д. Асфендиярова», клинический наставник, врач акушер-гинеколог, ТОО «Международный клинический центр репродуктологии «Persona»», города Алматы
6) Ажетова Жанерке Рахимбаевна – кандидат медицинских наук, асс. Профессор, доцент кафедры акушер-гинеколог №1 НАО «Медицинский университет Астана», стратегический директор сети клиник «Экомед» город Астана
7) Мустафин Рамиль Табрисович – кандидат медицинских наук, врач акушер-гинеколог, медицинский директор ТОО «Астана Эколайф» город Астана
8) Нигматова Ноира Пайзуллаевна – магистр медицинских наук (MMedSci), сертифицированный эмбриолог от Европейской Ассоциации (ESHRE), заведующая лаборатории Эмбриологии, клиника «Геном» город Астана
9) Онлас Анна Руслановна – врач репродуктолог, акушер-гинеколог, ТОО «Институт репродуктивной медицины» город Алматы
10) Рыбина Анастасия Николаевна – НАО «Казахский национальный медицинский университет имени С.Д. Асфендиярова», клинический наставник, магистр медицины, врач акушер-гинеколог ТОО «Международный клинический центр репродуктологии «Persona»», город Алматы
11) Арипова Радха Сайдалимовна – врач акушер-гинеколог высшей категории, репродуктолог АО «Научный центр акушерства, гинекологии и перинатологии»
12) Чалова Лейла Рашидовна – врач акушер-гинеколог - репродуктолог, высшей категории, магистр медицины, главный врач Научно-медицинского центра репродукции и генетики человека «Health and Science Center M1».
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
1) Юлдашева Сураё Зарифовна – доктор медицинских наук, доцент кафедры акушерства, гинекологии и детской гинекологии Ташкентского педиатрического медицинского института;
2) Амбарцумян Эдуард Мартынович – доктор медицинских наук, президент Армянской Ассоциации репродуктивной медицины, заведующий кафедры акушерства, гинекологии и репродукции человека НИЗ РА;
3) Корсак Владислав Станиславович – доктор медицинских наук, президент Общероссийской общественной организации «Российская ассоциация репродукции человека».
4) Рапильбекова Гульмира Курбановна – доктор медицинских наук, медицинский директор Корпоративный фонд «University Medical Center», акушер-гинеколог, репродуктолог.
Указание условий пересмотра протокола: пересмотр не реже 1 раза в 5 лет и не чаще 1 раза в 3 года при наличии новых методов диагностики и лечения с уровнем доказательности.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.