Лапароскопическая робот-ассистированная нефрэктомия
Лапароскопическая робот-ассистированная хирургия
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Доброкачественное новообразование почки (D30.0), Злокачественное новообразование почки, кроме почечной лоханки (C64), Новообразования неопределенного или неизвестного характера почки (D41.0)
Онкология, Урология, Хирургия
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «21» декабря 2023 года
Протокол №200
КЛИНИЧЕСКИЙ ПРОТОКОЛ МЕДИЦИНСКОГО ВМЕШАТЕЛЬСТВА ЛАПАРОСКОПИЧЕСКАЯ РОБОТ-АССИСТИРОВАННАЯ ХИРУРГИЯ (брюшной полости, малого таза и забрюшинного пространства)
ЛАПАРОСКОПИЧЕСКАЯ РОБОТ-АССИСТИРОВАННАЯ НЕФРЭКТОМИЯ
Робот-ассистированная система состоит из открытой хирургической консоли, лапароскопической колонны и имеет до четырех роботизированных рук. Конфигурация открытой платформы системы позволяет использовать существующее лапароскопическое оборудование. Система оснащена функцией зрения 3D4K, отслеживанием взгляда, эргономичной хирургической консолью и тактильной обратной связью [2].
Робот-ассистированная нефрэктомия является минимально инвазивной операцией для хирургического лечения пациентов с новообразованиями почек, при которых невозможно проведение парциальной нефрэктомии с органосохраняющей функцией.
Код(ы) МКБ-10:
Сокращения, используемые в протоколе:
Пользователи протокола: врач-уролог, врач-онколог, хирург.
Категория пациентов:
Вводная часть
Код(ы) МКБ-10:
|
Код
|
Название |
| С64.0 | Злокачественное образование почки кроме почечной лоханки |
| С64.9 | Злокачественное образование почки кроме почечной лоханки неуточненной локализации |
| D30.0 | Доброкачественное новообразование почки |
| D41.0 | Новообразование неопределенного или неизвестного характера почки |
Дата разработки и пересмотра протокола: 2022 год.
Сокращения, используемые в протоколе:
ПКР - Почечно-клеточный рак
сПКР - Светлоклеточный вариант почечно-клеточного рака почки
пПКР - Папиллярный вариант почечно-клеточного рака почки
хПКР - Хромофобный вариант почечно-клеточного рака почки
НПВ - Нижняя полая вена
ХПН - Хроническая почечная недостаточность
Пользователи протокола: врач-уролог, врач-онколог, хирург.
Категория пациентов:
взрослые пациенты с новообразованиями почек диаметром более 4 см, с опухолями стадии Т2 и выше и локализованным ПКР, при которых нельзя выполнить резекцию почки. [18].
Классификация
Клиническая классификация (наиболее распространенные подходы, по этиологии, стадии) [13, 14, 15].
К настоящему времени для стандартизации описания опухолей почки предложены объективные анатомические системы классификации, такие как система классификации PADUA (Preoperative Aspects and Dimensions Used for an Anatomical – Дооперационные аспекты и измерения, используемые для анатомической оценки), нефрометрическая шкала R.E.N.A.L, С-индекс и Zonal NePhRО. Эти системы включают оценку размера опухоли, экзофитных / эндофитных свойств, близость к чашечно-лоханочной системе и почечному синусу, расположение по передней/задней поверхности, в нижнем/верхнем полюсе.
Нефрометрическая шкала R.E.N.A.L:
Показатель нефрометрии R.E.N.A.L состоит из пяти анатомических рентгенологических характеристик: (R - raduis) диаметр / максимальный диаметр опухоли, (E - exophytic/endophytic) экзофитные / эндофитные свойства, (N - nearness) близость к собирательной системе или пазухе почки, (A - anterior(a)/posterior(p)) спереди (a) / задний (p) / не передний или задний (x) признак и (L - location) положение относительно полярной линии. Полярные линии определяются плоскостями, в которых впервые видна медиальная губа паренхимы. Суффикс hilar (h) добавляется к опухолям, примыкающим к главной почечной артерии или вене (таблица 1).
Для каждой переменной, кроме A, присваивается от одного до трех баллов, что дает всего 3 балла за наименее сложную массу и 12 баллов за наиболее сложную массу. Оценка читается как каждая отдельная переменная (например, 1 + 2 + 2 + A + 3), суммируемая с оценкой, за которой следует полярное положение (например, 8A). Массы классифицируются как низкая сложность (оценка 4–6 по RENAL), средняя сложность (7–9 баллов) или высокая сложность (10–12 баллов).
Таблица 1. Обзор параметров по шкалам R.E.N.A.L и PADUA
_______________
T – первичная опухоль
Классификация PADUA: состоят из шести параметров оценки и переднего/заднего признака. Переменные включают полярное расположение, степень экзофитности/эндофитности, почечный край, поражение почечного синуса, вовлечение мочевыводящей системы и максимальный размер опухоли (Таблица 1). Полярные линии определяются как верхняя и нижняя относительно края жировой ткани почечного синуса. Классификация дается как единая сумма этих параметров с минимальным баллом 6 и максимальным 14. Стратификация делится на низкую сложность (6–7 баллов), среднюю сложность (8–9 баллов) или высокую сложность (10–14 баллов). При этом учитывается факт корреляции с риском общих осложнений.
Таблица 1. Обзор параметров по шкалам R.E.N.A.L и PADUA
|
Переменная
|
R.E.N.A.L | PADUA |
| Максимальный диаметр опухоли | 1 балл: ≤4 см | 1 балл: ≤4 см |
| 2 балла:> 4 - <7 см | 2 балла: 4–7 см | |
| 3 балла: ≥7 см | 3 балла:> 7 см | |
| Степень экзофитности / эндофитности | 1 балл: ≥50% | 1 балл: ≥50% |
| 2 балла: <50% | 2 балла: <50% | |
| 3 балла: эндофитный | 3 балла: эндофитный | |
| Собирательная система | Или почечный синус | 1 балл: не задействован |
|
1 балл: близость > 7 мм
2 балла: приближение
4–7 мм
3 балла: близость ≤4 мм
|
2 балла: вывих / инфильтрация | |
| Полярное положение | 1 балл: полностью выше или ниже полярных линий3 | 1 балл: выше / ниже4 |
| 2 точки: пересекает полярную линию | 2 точки: середина | |
|
3 балла: > 50% пересекает полярную линию или пересекает осевую срединную линию почки или полностью
между полярными линиями
|
||
| Почечный край | - | 1 балл: латеральный |
| 2 балла: средний | ||
| Почечный синус | Включен в собирательную систему |
1 балл: не задействован
2 балла: участвует
|
| Передний / задний | Нет баллов | Нет баллов |
3 Полярные линии определяются как плоскость почки, выше или ниже которой медиальная часть паренхимы прерывается жировой оболочкой почечного синуса, сосудами, или собирательной системой на осевом изображении
4 Полярные линии определяются в соответствии с почечным синусом
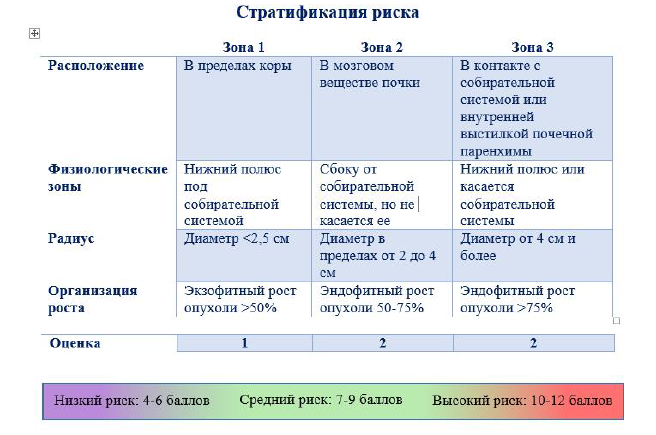
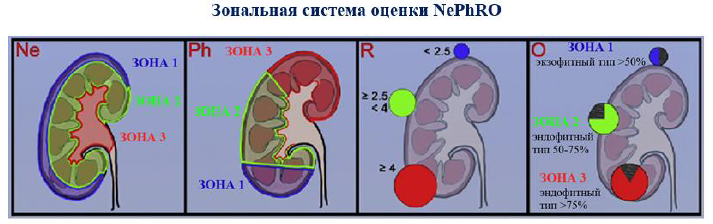
Зональная система оценки NePhRO: состоит из 4 компонентов, где Ne – Nearness (Расположение), Ph – Physical Zones (Физиолоические зоны), R – Radius (Радиус), O – Organization (Организацяи роста). Первые 2 компонента разделяют почку на анатомические зоны, а последние 2 компонента делят опухоль на зоны для облегчения оценки. Всем анатомическим компонентам присваивается оценка 1, 2 или 3. После того, как все 4 параметра были оценены, подсчитываются индивидуальные числа. Окончательный совокупный балл классифицирует опухоль почки как опухоль почки низкой, средней или высокой сложности.
Первый почечный компонент - это связь опухоли с собирательной системой. Его количественно определяют не по длине в сантиметрах, а по архитектуре паренхимы почек, такой как кортикальный или медуллярный, или по ее контакту с собирательной системой. Каждый сегмент почечной архитектуры обозначается как зона, как показано на рисунке 1, а почечной единице присваивается номер в зависимости от ее расположения в данной зоне. Если опухоль расположена исключительно в пределах коры, ей присваивается 1 балл; если он находится в мозговом веществе почки, дается 2 балла. Наконец, если опухоль находится в контакте с собирательной системой или внутренней выстилкой почечной паренхимы, ей дается 3 балла.
Рисунок 1. Зональная система оценки NePhRO [15]
С-индекс: индекс центральности (CI) существенно отличается от оценки по шкале R.E.N.A.L и классификации PADUA. CI - это непрерывный индекс, основанный на размере опухоли и расстоянии от периферии опухоли до центра почки, которые считаются наиболее важными факторами, определяющими сложность резекции. CI определяется как отношение c к радиусу опухоли r (диаметр / 2). Переменная c уравнивает расстояние от центра опухоли до центра почек и может быть вычислена в соответствии с теоремой Пифагора на аксиальных изображениях. Для опухоли в центре почек CI = 0. CI увеличивается с увеличением расстояния периферии опухоли от центра почек, и хирургическая резекция становится проще.
Зональная система оценки NePhRO: состоит из 4 компонентов, где Ne – Nearness (Расположение), Ph – Physical Zones (Физиолоические зоны), R – Radius (Радиус), O – Organization (Организацяи роста). Первые 2 компонента разделяют почку на анатомические зоны, а последние 2 компонента делят опухоль на зоны для облегчения оценки. Всем анатомическим компонентам присваивается оценка 1, 2 или 3. После того, как все 4 параметра были оценены, подсчитываются индивидуальные числа. Окончательный совокупный балл классифицирует опухоль почки как опухоль почки низкой, средней или высокой сложности.
Первый почечный компонент - это связь опухоли с собирательной системой. Его количественно определяют не по длине в сантиметрах, а по архитектуре паренхимы почек, такой как кортикальный или медуллярный, или по ее контакту с собирательной системой. Каждый сегмент почечной архитектуры обозначается как зона, как показано на рисунке 1, а почечной единице присваивается номер в зависимости от ее расположения в данной зоне. Если опухоль расположена исключительно в пределах коры, ей присваивается 1 балл; если он находится в мозговом веществе почки, дается 2 балла. Наконец, если опухоль находится в контакте с собирательной системой или внутренней выстилкой почечной паренхимы, ей дается 3 балла.
Рисунок 1. Зональная система оценки NePhRO [15]


Классификация TNM рака почки [12]
T – первичная опухоль
Тх – нельзя оценить первичную опухоль
Т0 – первичная опухоль не определяется
Т1 – опухоль ˃7 см в наибольшем измерении
Т1а – опухоль ≤4 см в наибольшем измерении, ограниченная почкой
Т1б – опухоль ˃4 см, но ≤7 см в наибольшем измерении
Т2 – опухоль ˃7 см в наибольшем измерении, ограниченная почкой
Т2а – опухоль ˃7 см, но ≤10 см в наибольшем измерении
Т2б – опухоль ˃10 см, ограниченная почкой
Т3 – опухоль распространяется в крупные вены или паранефральную клетчатку, но не прорастает надпочечник и не выходит за пределы фасции Герота
Т3а – опухоль макроскопически распространяется на почечную вену или ее сегментарные (содержащие гладкомышечную ткань) ветви или прорастает паранефральную клетчатку или клетчатку почечного синуса, но не выходит за пределы фасции Герота
Т3б – опухоль макроскопически распространяется на НПВ до уровня ниже диафрагмы
Т3с - опухоль макроскопически распространяется на НПВ выше уровня диафрагмы или прорастает стенку НПВ
Т4 – инвазия опухоли за пределы фасции Герота (в т.ч. смежное распространение на ипсилатеральный надпочечник)
М – отдаленные метастазы
Таблица 2. Группировка по стадиям
Таблица 3. Классификация кист почки по Bosniak
N – регионарные лимфатические узлы
Nx – нельзя оценить регионарные лимфатические узлы
N0 – нет метастазов в регионарных лимфатических узлах
N1 – метастаз(ы) в регионарном(ых) лимфатическом(их) узле(ах)
М – отдаленные метастазы
М0 – нет отдаленных метастазов
М1 – отдаленные метастазы имеются
Таблица 2. Группировка по стадиям
| I стадия | Т1 | N0 | М0 |
| II стадия | Т2 | N0 | М0 |
| III стадия | Т3 | N0 | М0 |
| IV стадия | Т1, Т2, Т3 | N1 | М0 |
| Т4 | Любая N | М0 | |
| Любая Т | Любая N | М1 |
Классификация кист почки по Bosniak [12]
По классификации Bosniak кисты почки подразделяются на 5 категорий на основании их характеристик на КТ с целью прогнозирования риска малигнизации. В системе Bosniak также приводится рекомендуемое лечение для каждой из категорий (таблица 1).
Таблица 3. Классификация кист почки по Bosniak
|
Категория по Bosniak
|
Характерные черты | Тактика ведения |
| I | Простая доброкачественная тонкостенная киста без перегородок, кальцификатов или солидных включений. Ее плотность равна плотности воды, она не накапливает контраст | Доброкачественный характер |
| II | Доброкачественная киста, может содержать несколько тонкостенных перегородок. В стенках или перегородках возможно наличие мелких кальцификатов. Образования с однородным высоким значением коэффициента поглощения размером менее 3 см с четкими границами, не накапливающие контраст | Доброкачественный характер |
| IIF | Эти кисты могут содержать большое количество тонкостенных перегородок. Иногда отмечается незначительное накопление контраста в перегородках или стенках. Возможно незначительное утолщение перегородки или стенки. Киста может содержать кальцификаты, которые могут изменить узловой характер и плотную структуру, но не накапливают контраст. Отсутствует мягкотканный компонент, накапливающий контраст. В эту категорию также включены полностью паренхиматозные образования почки, не накапливающие контраст, с высоким значением коэффициента поглощения, размером 3 см и более. Эти образования, как правило, имеют четкие границы. | Динамическое наблюдение до 5 лет. Часть образований имеет злокачественный характер |
| III | Эти новообразования представляю собой неопределенные кистозные образования с неровными утолщенными стенками или перегородками, которые накапливают контраст. | Хирургическое вмешательство или активное наблюдение. Более 50% образований имеют злокачественный характер |
| IV | Эти новообразования имеют злокачественный характер с мягкотканным компонентом, накапливающим контраст | Хирургическое вмешательство. Преимущественно злокачественные опухоли |
Лечение
Методы, подходы и процедуры диагностики и лечения
Цель проведения процедуры и вмешательства [12]:
Нефрэктомия или полное удаление почки производится в тех случаях, когда проведение парциальной нефрэктомии невозможно вследствие значительного нарушения функциональности и анатомического строения почки. Нефрэктомия проводится с целью полного удаления почки вместе с опухолью в случаях, когда проведение частичной резекции не представляется возможным. Кроме того, нефрэктомия проводится с целью извлечения почки у живого донора.
Противопоказания к процедуре и вмешательству:
Абсолютные противопоказания встречаются редко, но сопутствующие заболевания пациентов, такие как патологическое ожирение, острая ишемическая или клапанная болезнь сердца, острые респираторные заболевания или повышенное внутричерепное давление считаются относительными противопоказаниями к использованию роботизированной системы [4].Также относительными противопоказаниями, которые могут повлиять на решение о проведении процедуры, могут быть наличие обширных операций на брюшной полости или тазу в анамнезе, выраженный спаечный процесс [5]. Не рекомендуется проведение нефрэктомии при опухолях почки Т3 и Т4 с поражением лимфатических узлов и полостей.
Перечень основных и дополнительных диагностических мероприятий:
Показания к процедуре и вмешательству:
Проведение операции показано пациентам с новообразованиями почек диаметром более 4 см, с опухолями почек стадии Т2 и выше и локализованном ПКР, при которых нельзя выполнить резекцию почки. Кроме того, Европейской ассоциацией урологов отмечается, что в рамках установленных программ трансплантации почки предпочтительным для нефрэктомии у живого донора является эндоскопический (лапароскопический доступ), который включает среди прочих и робот-ассистированный трансперитонеальный или ретроперитонеальный доступ [12].
Перечень основных и дополнительных диагностических мероприятий:
Обследования, необходимые до плановой госпитализации и в плановом стационаре проводятся согласно клиническому протоколу диагностики и лечения «Почечно-клеточный рак» и Стандарту организации оказания хирургической (абдоминальной, торакальной, колопроктологической) помощи в Республике Казахстан.
Дополнительных обследований не требуется.
Операции на роботизированной системе могут выполняются врачами-хирургами, имеющими:
Требования к проведению процедуры и вмешательства:
Операции на роботизированной системе могут выполняются врачами-хирургами, имеющими:
сертификат по специальностям «Урология и андрология» (взрослая, детская)», «Онкология (взрослая)», «Общая хирургия (онкологическая хирургия)».
стаж работы по специальности не менее 3 лет.
свидетельство о повышении квалификации по вопросам роботизированной хирургии не менее 120 часов за последние 5 лет.
При выполнении лапароскопической робот-ассистированной нефрэктомии используются как трансперитонеальный, так и забрюшинный доступы. Чаще всего применяется трансперитонеальный доступ. Применение забрюшинного доступа оправдано при расположении опухоли по латеральной или по задней поверхности почки. При этом имеется низкая вероятность повреждения кишки и развития послеоперационного пареза кишечника. Выбор доступа, как правило, определяется хирургом на основе его индивидуальных предпочтений и опыта. При локализации опухоли на передней поверхности органа целесообразно применять трансабдоминальный доступ, тогда как при расположении опухоли по задней поверхности предпочтительнее выполнение забрюшинного доступа, чтобы избежать ротации почки.
Операционная бригада, в общем, состоит из 5 человек и включает в себя оперирующего хирурга, ассистирующего хирурга, анестезиолога, операционной медсестры и санитарного работника. Средняя длительность проведения операции составляет 242,3 минут [20, 21]. Следует учитывать тот факт, что некоторым специалистам, возможно, потребуется время для установки робота, которое может увеличиваться для тех специалистов, которые имеют небольшой опыт проведения подобных операций и управления роботом.
2 этап. Проведение собственно операции лапароскопической робот-ассистированной нефрэктомии. Оперирующий хирург переходит к хирургической консоли, ассистент хирурга и оперирующая медсестра находятся около пациента. Ассистирующий хирург управляет лапароскопическими инструментами, оперирующая медсестра производит подачу хирургического инструментария и материалов. Анестезиолог проводит контроль за состоянием пациента в состоянии наркоза.
3 этап. Завершение операции лапароскопической робот-ассистированной нефрэктомии. Производится закрытие операционной раны, удаление иссеченной массы опухоли почки, удаление троакаров и накладываются швы. Санитарный работник производит уборку операционной.
Индикаторы эффективности процедуры [12]:
Порядок выполнения лапароскопической робот-ассистированной нефрэктомии на роботизированной хирургической системе:
Роботизированная хирургическая система состоит из открытой хирургической консоли, лапароскопической колонны и имеет до четырех роботизированных рук. Конфигурация открытой платформы системы позволяет использовать существующее лапароскопическое оборудование. Система оснащена функцией зрения 3D4K, отслеживанием взгляда, эргономичной хирургической консолью и тактильной обратной связью (haptic feedback) [2]. Инструменты применяются многоразовые, доступные с различными формами браншей и аналогичные лапароскопическим инструментам. Таким образом, хирург, имеющий опыт лапароскопии, может легко адаптировать и использовать эти инструменты [2]. Доступные инструменты имеют диаметр от 5 до 10 мм, и все они могут быть повторно стерилизованы и использованы повторно [7].
При выполнении лапароскопической робот-ассистированной нефрэктомии используются как трансперитонеальный, так и забрюшинный доступы. Чаще всего применяется трансперитонеальный доступ. Применение забрюшинного доступа оправдано при расположении опухоли по латеральной или по задней поверхности почки. При этом имеется низкая вероятность повреждения кишки и развития послеоперационного пареза кишечника. Выбор доступа, как правило, определяется хирургом на основе его индивидуальных предпочтений и опыта. При локализации опухоли на передней поверхности органа целесообразно применять трансабдоминальный доступ, тогда как при расположении опухоли по задней поверхности предпочтительнее выполнение забрюшинного доступа, чтобы избежать ротации почки.
Пациент находится в положении частично на боку (при нефрэктомии слева пациента укладываю на правый бок, при правосторонней нефрэктомии – на левый бок), предплечье приведено вдоль бока и бедра.
1) Под эндотрахеальным наркозом в положении больного на боку, после классической обработки операционного поля, выполняется разрез на расстоянии 8-10 см ниже реберной дуги по оси 90 град. к реберному краю. Предварительно по нижнему краю пупочного кольца вводят игу Вереша и накладывают пневмоперитонеум 12 мм рт. ст. Вводится троакпорт камеры для визуализации операционного поля. Для того чтобы получить беспрепятственный доступ к воротам почек и опухоли, хирургом определяется точки для установки роботизированных манипуляционных троакпортов. На практике правый и левый роботизированные троакпорты размещаются примерно на передней подмышечной линии. Дополнительный манипулятор робота устанавливается при необходимости в области нижнего квадранта в случае сложных опухолей почки или отсутствии квалифицированного ассистента хирурга [18]. Важно, чтобы установленные роботизированные руки не мешали друг другу и не ограничивали движения хирурга и ассистента, необходимо минимизировать вероятность столкновения рук во время проведения манипуляций.
2) Доступ к почке производится посредством отведения вниз петель толстого кишечника с помощью инструментов. Ассистент хирурга проводит тракцию кишечника вниз, в то время как оперирующий хирург обеспечивает восходящее противодействие, чтобы максимально обнажить промежуточные структуры. Двенадцатиперстная кишка отводится по Кохеру до тех пор, пока не будет четко визуализирована НПВ. Следует проявлять осторожность при идентификации и выборочного пересечения связочного аппарата почки, чтобы минимизировать риск повреждения селезенки и печени. Боковые связки почки и фасция Герота остаются нетронутыми [18].
3) Доступ к воротам почки проводится после тщательной идентификации, после которой производится рассечение почечной сосудистой сети. В случае затруднения доступа к воротам почки напрямую, подход обеспечивается посредством идентификации мочеточника, гонадной вены и нижнего большого сосуда на соответствующей стороне с осторожным продвижением вверх к воротам. С помощью инструментов производится отделение сосудов почки от окружающих тканей. Полная свобода сосудов от подлежащих тканей имеет решающее значение для обеспечения эффективного сосудистого контроля [18].
4) После получения полного доступа к сосудам почки, производится перевязка гонадной вены, чтобы свести к минимуму риск тракционного отрыва и кровотечения. После этого диссектором производится мобилизация почечной артерии по окружности и клипирование или перевязка ее. Затем производится клипирование или перевязка почечной вены. Поясничная и надпочечниковая вены коагуляционным путем перерезаются и разделяются. Все фиброзно-жировые ткани с лимфатическими узлами вокруг ворот почек рассекаются вверх. Почка мобилизуется с фасцией Герота из окружающих структур. Затем производится отделение почки от боковой стенки живота.
5) Рассечение мочеточника. Сухожилие поясничной мышцы является надежным ориентиром при поиске гонадной вены и мочеточника. После обнаружения мочеточник поднимается над поясничной мышцей, клипируется и отсекается.
6) Проводится проверка гемостаза. При необходимости накладываются дополнительные швы или используются другие приспособления и кровоостанавливающие средства. Удаленный орган помещается в контейнер и выводится наружу.
7) Роботизированные манипуляторы и троакпорты отстыковываются. Проводится проверка кровотечения из раны, при необходимости устанавливается дренаж. Наносятся швы на кожу, асептические повязки.
Операционная бригада, в общем, состоит из 5 человек и включает в себя оперирующего хирурга, ассистирующего хирурга, анестезиолога, операционной медсестры и санитарного работника. Средняя длительность проведения операции составляет 242,3 минут [20, 21]. Следует учитывать тот факт, что некоторым специалистам, возможно, потребуется время для установки робота, которое может увеличиваться для тех специалистов, которые имеют небольшой опыт проведения подобных операций и управления роботом.
Проведение операции лапароскопической робот-ассистированной нефрэктомии выполняется условно в несколько этапов:
1 этап. Подготовка и расположение пациента на столе, установка катетера в уретру, установка робот-системы. Правильное расположение троакпортов и роботизированных рук является обязательным условием, поскольку роботизированные руки и инструменты относительно велики и требуют достаточного пространства для идеального функционирования. Если они расположены слишком близко и мешают друг другу, система оповестит хирурга, что движение ограничено. Ассистент хирурга располагается с той стороны пациента, в которой установлена только одна роботизированная рука [2]. Установка роботизированных рук на пациенте производится под эндотрахеальным наркозом. В установке робот-системы участвуют оперирующий хирург, ассистент хирурга, оперирующая медсестра, врач-анестезиолог.
2 этап. Проведение собственно операции лапароскопической робот-ассистированной нефрэктомии. Оперирующий хирург переходит к хирургической консоли, ассистент хирурга и оперирующая медсестра находятся около пациента. Ассистирующий хирург управляет лапароскопическими инструментами, оперирующая медсестра производит подачу хирургического инструментария и материалов. Анестезиолог проводит контроль за состоянием пациента в состоянии наркоза.
3 этап. Завершение операции лапароскопической робот-ассистированной нефрэктомии. Производится закрытие операционной раны, удаление иссеченной массы опухоли почки, удаление троакаров и накладываются швы. Санитарный работник производит уборку операционной.
Индикаторы эффективности процедуры [12]:
При нефрэктомии – заживление раны первичным натяжением, состоятельность швов, сухая и чистая послеоперационная рана;
В лабораторных анализах – отсутствие высокого лейкоцитоза, допускается лейкоцитурия, умеренное снижение уровней гемоглобина и эритроцитов.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- 1. S. Gravas (Chair), J.N. Cornu, M. Gacci, C. Gratzke, T.R.W. Herrmann, C. Mamoulakis, M. Rieken, M.J. Speakman, K.A.O. Tikkinen Guidelines Associates: M. Karavitakis, I. Kyriazis, S. Malde, V. Sakalis, R. Umbach. Management of Non-Neurogenic Male Lower Urinary Tract Symptoms (LUTS), incl. Benign Prostatic Obstruction (BPO). UPDATE MARCH 2021. URL https://uroweb.org/guideline/treatment-of-non-neurogenic-male-luts. 2. Željko Kaštelan et al. Extraperitoneal radical prostatectomy with the Senhance Surgical System robotic platform. Croat Med J. 2019;60:556-9 https://doi.org/10.3325/cmj.2019.60.556. 3. Алчинбаев М.К. Клинический протокол диагностики и лечения «Доброкачественная гиперплазия предстательной железы». Утвержден протоколом заседания Экспертной комиссии по вопросам развития здравоохранения МЗ РК № 23 от 12 декабря 2013 года. 8 стр. 4. S. Pathirana, P. C. A. Kam. Anaesthetic issues in robotic-assisted minimally invasive surgery. Anaesth Intensive Care 2018 | 46:1. 5. Linda M. Huynh, MSc and Thomas E. Ahlering, MD. Robot-Assisted Radical Prostatectomy: A Step-by-Step Guide. JOURNAL OF ЕNDOUROLOGY. Volume 32, Supplement 1, May 2018. Mary Ann Liebert, Inc. Pp. S-28–S-32 DOI: 10.1089/end.2017.0723. 6. Урология. Российские клинические рекомендации / под ред. Ю. Г. Аляева, П. В. Глыбочко, Д. Ю. Пушкаря. — М. : ГЭОТАРМедиа, 2016. — 496 с. ISBN 978-5-9704-3649-3. 7. TransEnterix. The first in digital laparoscopy. Senhance Surgical System [Internet]. Morrisville: TransEnterix; 2020 [cited 2020 Jun 13]. Available from: https://www.senhance.com/us/digital-laparoscopy. 8. Marcio Covas Moschovas et al. Robotic surgery techniques to approach benign prostatic hyperplasia disease: A comprehensive literature review and the state of art. 2021 Editorial Office of Asian Journal of Urology. https://doi.org/10.1016/j.ajur.2020.10.002. 9. Adolfsson, J. Watchful waiting and active surveillance: the current position. BJU Int, 2008. 102: 10. https://pubmed.ncbi.nlm.nih.gov/18422774. 10. N. Mottet, P. Cornford, R.C.N. van den Bergh et. al. EAU-EANM-ESTRO-ESUR-ISUP-SIOG Guidelines on Prostate Cancer. European Association of Urology 2021. 212 p. 11. Нургалиев Н.С., Онгарбаев Б.Т., Ишкинин Е.И. и соавт. Клинический протокол диагностики и лечения «Рак предстательной железы». Одобрен Объединенной комиссией по качеству медицинских услуг Министерства здравоохранения Республики Казахстан от «07» марта 2019 года, протокол №57. 73 стр. 12. Ljungberg и др. Клинические рекомендации по почечно-клеточному раку. Европейская ассоциация урологов, 2020. 13. Klatte T. et al. A Literature Review of Renal Surgical Anatomy and Surgical Strategies for Partial Nephrectomy. Eur Urol. 2015 Dec; 68(6):980-92. doi: 10.1016/j.eururo.2015.04.010. 14. Spaliviero M. et al. An Arterial Based Complexity (ABC) Scoring System to Assess the Morbidity Profile of Partial Nephrectomy. Eur Urol. 2016 Jan;69(1):72-9. doi: 10.1016/j.eururo.2015.08.008. 15. Hakky T.S. et al. Zonal NePhRO scoring system: a superior renal tumor complexity classification model. Clin Genitourin Cancer. 2014 Feb;12(1):e13-8. doi: 10.1016/j.clgc.2013.07.009. 16. E Jason Abel et al. Robotic-Assisted Laparoscopic Partial Nephrectomy. Medscape. Oct. 3 2018. 17. Steven Campbell et al. Renal mass and localized renal cancer: AUA guideline. American Urological Association (AUA), April 2017. 18. E Jason Abel et al. Robotic-Assisted Laparoscopic Partial Nephrectomy. Oct 03, 2018. Medscape. 19. Zhonghua Shen et al. The comparison of perioperative outcomes of robot-assisted and open partial nephrectomy: a systematic review and meta-analysis. World Journal of Surgical Oncology (2016) 14:220, p. 7-8. DOI 10.1186/s12957-016-0971-9. 20. Anastasios D Asimakopoulos et al. Robotic radical nephrectomy for renal cell carcinoma: a systematic review. BMC Urology 2014, 14:75 http://www.biomedcentral.com/1471-2490/14/75. 21. Thekke Adiyat Kishore et al. Robot-assisted laparoscopic radical nephrectomy and inferior vena cava thrombectomy: A multicentre Indian experience. Arab Journal of Urology, 18:2, 124-128, DOI: 10.1080/2090598X.2020.1738104. 22. C. Radmayr et al. Paediatric Urology. EAU, 2020. 23. Клинический протокол диагностика и лечения. Врожденный гидронефроз у детей. Рекомендовано Экспертным советом РГП на ПХВ «Республиканский центр развития здравоохранения» Министерства здравоохранения и социального развития Республики Казахстан от «27» ноября 2015 года Протокол № 17, стр.2. 24. Клинический протокол диагностика и лечения. Гидронефроз почек. Одобрено Объединенной комиссией по качеству медицинских услуг Министерства здравоохранения Республики Казахстан от «29» июня 2017 года, Протокол №24. 25. Костюк, И.П. Классификация местно-распространенных новообразований малого таза и вторичного опухолевого поражение мочевого пузыря/ И.П.Костюк, Л.А.Васильев, С.С.Крестьянинов //Онкоурология. - 2014. -№1. - С. 39-43. 26. Guglielmo Mantica et al. Comparison of Safety, Efficacy and Outcomes of Robot Assisted Laparoscopic Pyeloplasty vs Conventional Laparoscopy. Research and Reports in Urology 2020:12 555–562. 27. Kulthe Ramesh Seetharam Bhat et al. The robot-assisted ureteral reconstruction in adult: A narrative review on the surgical techniques and contemporary outcomes. Asian Journal of Urology (2021) 8, 38e49. 28. Guglielmo Mantica et al. Comparison of Safety, Efficacy and Outcomes of Robot Assisted Laparoscopic Pyeloplasty vs Conventional Laparoscopy. Research and Reports in Urology 2020:12 555–562. 29. Ханалиев Б.И. Реконструктивно-пластические операции с применением васкуляризированных лоскутов на органах мочевыводящей системы. Диссертация на соискание степени доктора медицинских наук. Москва, 2017. 30. Клинический протокол диагностики и лечения. Дивертикул мочевого пузыря у детей. Одобрен объединенной комиссией по качеству медицинских услуг МЗСР РК от 13 октября 2016 года, протокол №13. 31. Федеральные клинические рекомендации по оказанию медицинской помощи детям с дивертикулом мочевого пузыря. МЗ РФ, Союз педиатров России, Межрегиональная общественная организация детских урологов-андрологов, 2015. 32. Клинический протокол диагностика и лечения. Врожденный пузырно-мочеточниковый рефлюкс. Рекомендовано Экспертным советом РГП на ПХВ «Республиканский центр развития здравоохранения» Министерства здравоохранения и социального развития Республики Казахстан от «12» декабря 2014 года протокол № 9. 33. Поляков Н.В. и др. Оперативное лечение стриктур нижней трети мочеточника после лучевой терапии органов малого таза. Журнал Онкоурология 3’2016, Том 12. 34. Lee Z et al. Single-Surgeon Experience With Robot-Assisted Ureteroneocystostomy for Distal Ureteral Pathologies in Adults. Korean J Urol. 2013 Aug;54(8):516-521. English. Published online Aug 07, 2013. https://doi.org/10.4111/kju.2013.54.8.516. 35. Najib Isse Dirie et al. Robot-assisted laparoscopic ureteroneocystostomy in adults: A single surgeon experience and literature review. Asian Journal of Urology (2020) 7, 37e44. 36. Esteban Emiliani et al. Reperfusion and Compartment Syndrome After Flexible Ureteroscopy in a Patient with an Iliac Vascular Graft. Journal of Endourology case reports. Volume 2.1, 2016 Mary Ann Liebert, Inc. Pp. 224–226 DOI: 10.1089/cren.2016.0108. 37. Guangpu Ding et al. Experience managing distal ureteral strictures with Boari flap psoas hitch and comparison of open and laparoscopic procedures. Transl Androl Urol 2021;10(1):56-65 | http://dx.doi.org/10.21037/tau-20-789. 38. Filippos Kapogiannis et al. Laparoscopic and Robotic Management of Ureteral Stricture in Adults. in vivo 34: 965-972 (2020) doi:10.21873/invivo.11864. 39. Клинический протокол диагностики и лечения. Киста почки. Рекомендовано Экспертным советом РГП на ПХВ «Республиканский центр развития здравоохранения» МЗСР РК от 12 декабря 2014 года, протокол №9. 40. Okan Bas et al. Management of Renal Cysts. JSLS, Journal of the Society of Laparoendoscopic Surgeons. 2015 Volume 19 Issue 1 e2014.00097. DOI: 10.4293/JSLS.2014.00097. 41. Yi-Chun Wang† et al. Robotic renal cyst decortication with calyceal diverticulectomy in a toddler – technical practicalities: a case report. Wang et al. Journal of Medical Case Reports (2018) 12:284 https://doi.org/10.1186/s13256-018-1830-9. 42. Нестеров С.Н. и др. Современный взгляд на проблемы нефроптоза. Вестник Национального медико-хирургического Центра им. Н.И. Пирогова 2014, т. 9, № 2. 43. Антонов А. В. Эндовидеохирургическое лечение нефроптоза. Кафедра урологии Первого Санкт-Петербургского государственного медицинского университета имени акад. И. П. Павлова. Лекции для врачей. Урологические ведомости, Том III, № 2, 2013. 44. Мамбетов Ж.С. и др. Методы хирургического лечения нефроптоза. Международный научный журнал «Символ науки» №11-4/2016. 45. David W. Sobel et al. The Case of the Wandering Kidney. Case Reports in Urology. Volume 2013, Article ID 498507, 3 pages http://dx.doi.org/10.1155/2013/498507.
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков протокола с указанием квалификационных данных:
1) Касымов Бахтияр Галыулы – врач-уролог высшей категории, заведующий хирургическим отделением №4 РГП «Больница Медицинского центра Управления Делами Президента Республики Казахстан» на ПХВ;
2) Енсебаев Ерлан Жалелович – доктор медицинских наук, профессор, врач-уролог высшей категории РГП «Больница Медицинского центра Управления Делами Президента Республики Казахстан» на ПХВ;
3) Габбасов Ергали Мухтарович – врач-хирург высшей категории, заведующий хирургическим отделением №2 РГП «Больница Медицинского центра Управления Делами Президента Республики Казахстан» на ПХВ;
4) Башарова Гульбарам Есенбековна – кандидат медицинских наук, врач-гинеколог высшей категории, заведующий отделением гинекологии РГП «Больница Медицинского центра Управления Делами Президента Республики Казахстан» на ПХВ;
5) Уразов Талгат Даутович – врач-хирург высшей категории хирургического отделения №2, руководитель Центра роботизированной хирургии РГП «Больница Медицинского центра Управления Делами Президента Республики Казахстан» на ПХВ;
6) Зейтын Маржангуль Кылышбековна – Магистр бизнес администрирования, специалист Центра роботизированной хирургии РГП «Больница Медицинского центра Управления Делами Президента Республики Казахстан» на ПХВ;
7) Белых Сергей Борисович – врач-хирург высшей категории, заведующий операционным отделением КГП на ПХВ «Восточно-Казахстанский областной специализированный медицинский центр» УЗ ВКО;
8) Тураханов Нартай Сейлович – врач-хирург первой категории КГП на ПХВ «Восточно-Казахстанский областной специализированный медицинский центр» УЗ ВКО;
9) Кадырбаева Алия Аркабековна – врач-гинеколог высшей категории, заведующая гинекологическим отделением КГП на ПХВ «Восточно-Казахстанский областной специализированный медицинский центр» УЗ ВКО;
10) Нурпеисова Алтын Алданышовна – клинический фармаколог, начальник клинико-фармакологического отдела РГП «Больница Медицинского центра Управления Делами Президента Республики Казахстан» на ПХВ;
11) Авдеев Андрей Владиславович – доктор философии PhD, руководитель Центра оценки технологий здравоохранения и стратегического развития РГП «Больница Медицинского центра Управления Делами Президента Республики Казахстан» на ПХВ;
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
12) Ахметова Макпал Жапаровна – магистр общественного здоровья, специалист Центра оценки технологий здравоохранения и стратегического развития РГП «Больница Медицинского центра Управления Делами Президента Республики Казахстан» на ПХВ.
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
1) Дэвид Самади – MD (доктор медицины), заведующий отделением урологии, директор роботической хирургии больницы Ленокс-Хилл, профессор кафедры урологии в медицинской школе Ховстра Hofstra North Shore-LIJ (г. Нью-Йорк, США), сертифицированный уролог и онколог, член Американской ассоциации урологов и Американской медицинской ассоциации.
2) Оспанов Орал Базарбаевич – доктор медицинских наук, профессор, руководитель «Центра хирургии ожирения и диабета» “Green Clinic” (г. Астана, Казахстан), президент Республиканского общественного объединения «Казахстанское общество бариатрических и метаболических хирургов».
3) Токпанов Серик Имакович – доктор медицинских наук, профессор, почетный член Казахской Ассоциации хирургов, почетный член Казахской Ассоциации эндоскопических хирургов.
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.