Инфекция мочевых путей у детей
Инфекция мочевыводящих путей у детей
 Версия: Клинические рекомендации РФ 2024 (Россия)
Версия: Клинические рекомендации РФ 2024 (Россия)
Абсцесс почки и околопочечной клетчатки (N15.1), Интерстициальный цистит (хронический) (N30.1), Инфекция мочевыводящих путей без установленной локализации (N39.0), Острый тубулоинтерстициальный нефрит (N10), Острый цистит (N30.0), Пионефроз (N13.6), Хронический тубулоинтерстициальный нефрит (N11), Цистит (N30), Цистит неуточненный (N30.9)
Нефрология детская, Педиатрия
Общая информация
Краткое описание
Разработчик клинической рекомендации
Союз педиатров России
Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии
Творческое объединение детских нефрологов
Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии
Творческое объединение детских нефрологов
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968 с изменения, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 января 2024 года – с 1 января 2025 года.
ID: 281_3
Возрастная категория: Дети
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968 с изменения, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 января 2024 года – с 1 января 2025 года.
Клинические рекомендации
Инфекция мочевых путей
Год утверждения (частота пересмотра): 2024
Пересмотр не позднее: 2026
ID: 281_3
Возрастная категория: Дети
Определение заболевания или состояния
Инфекция мочевых путей (ИМП) – воспалительный процесс уротелия в различных отделах мочевого тракта, возникающий в ответ на появление патогенных микроорганизмов в мочевыводящих путях.
Бактериурия – наличие бактерий в моче, выделенной из мочевого пузыря.
Бессимптомная (асимптоматическая бактериурия) – наличие одного или более видов бактерий, растущих в моче в количестве более 105 КОЕ/мл независимо от наличия пиурии, при отсутствии каких-либо жалоб и клинических симптомов заболевания мочевой системы. Может быть обнаружена при диспансерном или целенаправленном обследовании ребенка.
Острый пиелонефрит – воспалительное заболевание почечной паренхимы и лоханки, возникшее вследствие бактериальной инфекции.
Острый цистит – воспалительное заболевание мочевого пузыря, бактериального происхождения.
Хронический пиелонефрит – повреждение почек, проявляющееся фиброзом и деформацией чашечно-лоханочной системы, в результате повторных атак ИМП. Как правило, возникает на фоне анатомических аномалий мочевыводящего тракта или обструкции.
Пузырно-мочеточниковый рефлюкс (ПМР) – ретроградный ток мочи из мочевого пузыря в мочеточник.
Рефлюкс-нефропатия – фокальный или диффузный склероз почечной паренхимы, первопричиной которого является пузырно-мочеточниковый рефлюкс, приводящий к внутрипочечному рефлюксу, повторным атакам пиелонефрита и склерозированию почечной ткани.
Уросепсис – жизненно-опасный генерализованный патологический процесс, сопровождающийся органной/полиорганной дисфункцией, при котором клинические проявления ИМП осложняются реакцией организма на инфекцию, повреждающей его собственные ткани и органы.
Особенности кодирования заболевания или состояния
Острый тубулоинтерстициальный нефрит (N10);
Хронический тубулоинтерстициальный нефрит (N11);
N11.0 - Необструктивный хронический пиелонефрит, связанный с рефлюксом;
N11.1 - Хронический обструктивный пиелонефрит;
N11.8 - Другие хронические тубулоинтерстициальные нефриты;
N11.9 - Хронический тубулоинтерстициальный нефрит неуточненный;
N13.6 - Пионефроз;
N15.1 - Абсцесс почки и околопочечной клетчатки.
Цистит (N30);
N30.0 - Острый цистит;
N30.1 - Интерстициальный цистит (хронический);
N30.2 - Другой хронический цистит;
N30.8 - Другие циститы;
N30.9 - Цистит неуточненный;
N39.0 - Инфекция мочевыводящих путей без установленной локализации.
Классификация
Классификация заболевания или состояния
1. По наличию структурных аномалий мочевыводящих путей:
- неосложненная - без наличия структурных аномалий мочевыводящих путей;
- осложненная - на фоне структурных аномалий мочевыводящих путей (как правило - с лихорадкой, и, как правило, - пиелонефрит).
2. По локализации:
- пиелонефрит (при поражении почечной паренхимы и лоханки);
- цистит (при поражении мочевого пузыря);
- уретрит;
- уросепсис;
- инфекция мочевыводящих путей без установленной локализации.
3. По стадии:
- активная стадия;
- стадия ремиссии.
4. По течению:
- острый пиелонефрит
- хронический пиелонефрит (крайне редко встречается).
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Среди возбудителей ИМП у детей преобладает грам-отрицательная флора, при этом при внебольничных вариантах инфицирования в значительной степени превалируют представители порядка Enterobacterales и, в частности, – E. coli (70-90% случаев). Грамположительные микроорганизмы обнаруживаются редко в качестве этиологического фактора и представлены, в основном, энтерококками и стафилококками (5-7% всех случаев ИМП). Кроме того, выделяют внутрибольничные (нозокомиальные) инфекции, среди возбудителей которых также преобладают грамотрицательные микроорганизмы порядка Enterobacterales ssp., но также могут выделятся неферментирующие грамотрицательные патогены (Pseudomonas spp., Acinetobacter spp.). У новорождённых детей относительно частой причиной ИМП являются стрептококки групп А и В. В последнее время отмечен рост выявления S. saprophyticus, хотя его роль остается спорной.
Согласно крупному многоцентровому исследованию «ДАРМИС-2018», проведенному в 2017-2018 гг.. продемонстрировано сходство этиологической структуры внебольничных ИМП в различных субпопуляциях пациентов с острыми и обострениями хронических ИМП (дети, взрослые, беременные) что в целом соответствует результатам, полученным ранее [1]. Общая доля представителей порядка Enterobacterales у детей с внебольничными ИМП в HA составила 93,8%, частота выделения E. coli была около 80%, а второго наиболее частого уропатогена K. pneumoniae – 8%.
Данные по резистентности основного уропатогена E. сoli при внебольничных ИМП у детей в РФ проанализированы в рамках проекта «ДАРМИС-2023».
Более 60% изолятов E. сoli, выделенных при ИМП у детей в РФ, устойчивы к ампициллину** (63,4%). Что касается чувствительности к Амоксициллину+[Клавулановая кислота]**, то здесь следует остановиться на различиях в интерпретации данных (EUCAST v13.0 (2023)) для пероральных лекарственных форм Амоксициллину+[Клавулановая кислота]** при неосложенных ИМП и форм препарата для парентерального введения. Для пероральных форм (применение при неосложенных ИМП) доля чувствительных штаммов с МПК ≤32 мг/л составляет 87%, для парентеральных форм Амоксициллину+[Клавулановая кислота]** доля чувствительных штаммов с МПК ≤8 мг/л составляет 63,6%. Именно в связи с этими особенностями будет различаться место Амоксициллину+[Клавулановая кислота]** в рекомендациях по выбору препарата при амбулаторном назначении и в стационаре. По другим ПМП ситуация следующая: к препарату Ко-тримоксазол [Сульфаметоксазол+Триметоприм]** чувствительны 76,6% выделенных штаммов E.coli, чувствительность к цефалоспоринам III-IV поколений варьирует в пределах 82-87%.
Самые высокие показатели чувствительности E. coli к пероральным ПМП продемонстрированы для фосфомицина** (98,7%) и нитрофурантоина (97,4%). Из парентеральных ПМП 100% активность отмечается у карбапенемов (Имипенем+[Циластатин]** и Меропенем**) и 98,7% у эртапенема**, сохраняется высокая чувствительность к амикацину** (98,7%) и гентамицину** (94,8%), фосфомицину** (98,7%), пиперациллину+[тазобактам] 98,1%.
Среди многочисленных факторов, обусловливающих развитие ИМП, приоритетное значение имеют аномалии развития ИМП и нарушения уродинамики (ПМР, обструктивная уропатия, нейрогенная дисфункция мочевого пузыря), а также биологические свойства микроорганизмов, колонизирующих почечную ткань (напр., наличие фимбрий у E. сoli, что способствует не только прикреплению к уроэпителию и проникновению через него, но и образованию конгломератов бактерий и биопленок).
Наиболее частым путем распространения инфекции считается восходящий. Резервуаром уропатогенных бактерий являются прямая кишка, промежность, нижние отделы мочевыводящих путей.
Анатомические особенности женских мочевыводящих путей (короткая широкая уретра, близость аноректальной области) обусловливают большую частоту встречаемости и рецидивирования ИМП у девочек и девушек.
При восходящем пути распространения ИМП после преодоления бактериями везикоуретрального барьера происходит их быстрое размножение с выделением эндотоксинов. В ответ происходит активация местного иммунитета макроорганизма: активация макрофагов, лимфоцитов, клеток эндотелия, приводящая к выработке воспалительных цитокинов (IL 1, IL 2, IL 6, фактора некроза опухоли), лизосомальных ферментов, медиаторов воспаления; происходит активация перекисного окисления липидов, что приводит к повреждению почечной ткани, в первую очередь, канальцев.
Гематогенный путь развития инфекции мочевых путей встречается редко, характерен преимущественно для периода новорожденности при развитии септицемии и у детей грудного возраста, особенно при наличии иммунных дефектов. Этот путь также встречается при инфицировании Actinomycesspp, Brucellaspp., Mycobacteriumtuberculosis.
Эпидемиология
Эпидемиология заболевания или состояния
Распространенность ИМП в детском возрасте составляет около 18 случаев на 1000 детского населения. Частота развития ИМП зависит от возраста и пола, при этом чаще страдают дети первого года жизни. У детей грудного и раннего возраста ИМП – самая частая тяжелая бактериальная инфекция, она наблюдаются у 10-15% госпитализируемых с лихорадкой пациентов этого возраста. На первом году жизни ИМП чаще встречается у мальчиков, в более старшем возрасте – у девочек. В 30% случаев в течение 6-12 мес. после первого эпизода ИМП у младенцев и детей раннего возраста наблюдается рецидивирующее течение [2,3].
Частота возникновения рецидивов:
- девочки:
- у 30% в течение 1-го года после первого эпизода;
- у 50% в течение 5 лет после первого эпизода;
- мальчики:
- у 15-20% в течение 1 года после первого эпизода.
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния
В неонатальном периоде проявления, как правило, неспецифичны. У новорожденных могут быть признаки системного воспалительного процесса, такие как нестабильность температуры тела (периодическое повышение температуры тела до фебрильных цифр)/гипотензия, нарушения периферического кровообращения, вялость, раздражительность, апноэ, обезвоживание, озноб, судороги или метаболический ацидоз. Могут также наблюдаться анорексия, плохое сосание, рвота. Зловонная моча – редкий, но специфический симптом ИМП. У новорожденных с ИМП высока вероятность бактериемии. В этом случае может развиться сепсис, а также, хотя и крайне редко, – септический шок.
Симптомы ИМП остаются неспецифическими у детей первого года жизни. Необъяснимая лихорадка или лихорадка без видимого очага инфекции является наиболее частым проявлением у детей первых двух лет жизни. Фактически, это может быть единственный симптом ИМП.
В целом ИМП (а именно пиелонефрит) с большей долей вероятности следует предположить у младенцев с температурой ≥39°C, чем у детей с температурой <39°C.
Другие неспецифические проявления включают раздражительность, снижение/отсутствие аппетита, рвоту, боли в животе. Специфические симптомы и признаки включают увеличение или уменьшение количества мокрых подгузников, неприятный запах мочи и беспокойство при мочеиспускании.
Слабая или капающая струя мочи указывает на нейрогенный мочевой пузырь или обструкцию нижних отделов мочевыводящих путей, например, клапан задней уретры у мальчиков. Постоянное капание мочи или намокание подгузников может указывать на наличие эктопического мочеточника, предрасполагающего к ИМП.
После второго года жизни симптомы и признаки ИМП становятся более специфичными. Проявления пиелонефрита включают лихорадку (реже субфебрильное повышение температуры тела) без катаральных явлений, озноб, рвоту, недомогание, боль в боку, боль в спине и болезненность реберно-позвоночного угла.
Симптомы и признаки инфекции нижних мочевыводящих путей включают боль в надлобковой области, боль в животе, частое и/или болезненное мочеиспускание, императивные позывы к мочеиспусканию, дневное недержание мочи, недавно возникший энурез, мутную мочу, зловонную мочу.
Уретрит без цистита может проявляться дизурией без частого мочеиспускания или императивных позывов к мочеиспусканию.
При осмотре могут отмечаться:
- бледность кожных покровов;
- тахикардия;
- симптомы дегидратации (преимущественно у новорожденных и детей грудного возраста), отсутствие катаральных явлений при повышении температуры (чаще до фебрильных цифр, реже – субфебрильных);
- при остром пиелонефрите – болезненность при поколачивании или, у маленьких детей, – при надавливании пальцем между основанием 12-го ребра и позвоночником.
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний), медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза:
Для верификации диагноза ИМП прежде всего необходимо подтвердить лейкоцитурию и диагностически значимую бактериурию.
Далее в зависимости от клинических проявлений и результатов обследования (общий (клинический) анализ крови развернутый, анализ крови биохимический общетерапевтический) необходимо провести дифференциальный диагноз между инфекцией нижних и верхних (пиелонефрит) МВП.
1. Жалобы и анамнез
См. раздел 1.6 «Клиническая картина».
2. Физикальное обследование
При физикальном обследовании следует обратить внимание на симптомы, описанные в разделе 1.6 «Клиническая картина», необходимо проводить измерение артериального давления на периферических артериях.
3. Лабораторные исследования
- В качестве диагностического метода рекомендуется проведение общего (клинического) анализа мочи с определением удельного веса мочи, подсчётом количества лейкоцитов, эритроцитов, а также определением белка и нитритов (исследование уровня нитритов в моче), в т.ч. с применением тест-полосок [2,4,5,6,7,8].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Комментарии:
Для подтверждения лейкоцитурии обязателен общий (клинический) анализ мочи. Лейкоцитурией считается обнаружение лейкоцитов более 10 в поле зрения или более 25 в 1 мкл мочи в образце мочи, полученной при спонтанном мочеиспускании.
Следует помнить, что нитриты не вырабатываются всеми микроорганизмами, вызывающими инфекции мочевой системы, поэтому отсутствие нитритов не исключает ИМП [40]. Но и наличие нитритов без лейкоцитурии не является признаком ИМП.
Для правильной интерпретации результатов анализа необходим правильный забор мочи.
Собирать мочу можно следующими способами:
— забор средней части струи спонтанно выпущенной мочи у детей с установившимся спонтанным произвольным мочеиспусканием и у подростков;
— использование мочеприемников у новорожденных и детей младшего возраста после предварительной гигиенической обработки гениталий и промежности;
— катетеризация мочевого пузыря, ее проводят в основном у тяжело больных маленьких детей при необходимости срочной диагностики ИМП, в том числе в динамическом наблюдении при необходимости (в том числе, у пациентов с нейрогенным мочевым пузырем и другими дисфункциями мочеиспускания) [41];
— надлобковая пункция, чаще применяется у тяжелобольных мальчиков младшего возраста [8].
Положительный химический анализ при помощи нитритных тест-полосок (нитритный тест) свидетельствует о высокой вероятности ИМП, однако следует учесть высокую вероятность частых (до 30%) ложнонегативных результатов.
У детей в период лихорадки без симптомов поражения верхних дыхательных путей показано проведение общего (клинического) анализа мочи.
В дальнейшем при динамическом наблюдении рекомендуется исследование общего (клинического) анализа мочи с частотой 1 раз в месяц – 3 месяца, затем 1 раз в 3 месяца – год (планово) и внепланово при каждом эпизоде лихорадки и/или развитии дизурических явлений и других симптомах поражения мочевых путей.
- Рекомендовано детям с подозрением на ИМП бактериологическое исследование мочи (микробиологическое (культуральное) исследование мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы) с определением чувствительности микроорганизмов к антимикробным химиотерапевтическим препаратам до начала АБТ с целью подтверждения диагноза и определения этиологического возбудителя [2,4,5,6,7,9].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Комментарий: Диагностически значимым является наличие более 100 000 колониеобразующих единиц (КОЕ) в 1 мл при заборе мочи из средней струи или 50 000 КОЕ в 1 мл при заборе мочи путем катетеризации. При заборе мочи надлобковой пункцией значимым является любой рост бактерий [2,4,5,6,7,9,10].
Метод определения чувствительности выбирается микробиологом [7].
Эмпирическую антибактериальную терапию следует начинать, не дожидаясь результатов исследования (см. п. 3.1). Невозможность проведения бактериологического исследования (микробиологического (культурального) исследования мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы) не должна являться причиной для отсрочки назначения эмпирической антибактериальной терапии.
- Не рекомендуется проведение бактериологического исследования мочи (микробиологического (культурального) исследования мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы) (посева мочи) детям без лейкоцитурии с целью сокращения объема необоснованного обследования [2,4,5,6,9].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Комментарий: изолированную бактериурию у детей всех возрастов или положительный нитритный тест в отсутствии лейкоцитурии нельзя считать признаками инфекции мочевых путей, так как перечисленные показатели не являются в этом возрасте достоверными признаками данной патологии. Бессимптомная бактериурия, в большинстве случаев, не является показанием для мониторинга бактериологического исследования мочи (микробиологического (культурального) исследования мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы) (посева мочи) [42].
При этом в некоторых случаях отрицательный результат (микробиологического (культурального) исследования мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы) (посева мочи) при низком количестве колоний может указывать на раннюю инфекцию. Поэтому, если у ребенка сохраняются жалобы и клинические проявления ИМП, необходим контроль общего (клинического) анализа мочи или, при диагностировании ИМП, проведение эмпирического лечения, [40].
Также при изолированной бактериурии у пациентов с дисфункциями мочеиспускания (в том числе, у пациентов с нейрогенным мочевым пузырем) проводится в динамике дополнительный контроль микробиологического (культурального) исследования мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы) (посев мочи) при необходимости [41].
- Рекомендовано проведение общего (клинического) анализа крови развернутого у пациентов с лихорадкой и подозрением на ИМП для оценки воспалительной реакции [2,11].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Комментарии: исследование может проводиться при клинической необходимости и в процессе динамического наблюдения.
- У детей с осложненными формами ИМП, при пиелонефрите, а также у пациентов с выраженными изменениями при УЗИ (Ультразвуковое исследование почек, Ультразвуковое исследование мочевого пузыря), при обострении ИМП при рецидивирующем течении, в случае применения ЛС, обладающих нефротоксическим действием (например, аминогликозидов или полимиксинов) рекомендуется исследование почечных функций (Исследование уровня мочевины в крови, креатинина в крови, электролиты сыворотки крови (Исследование уровня натрия в крови, Исследование уровня калия в крови, Исследование уровня хлоридов в крови)), расчет скорости клубочковой фильтрации (СКФ) (Исследование функции нефронов по клиренсу креатинина (проба Реберга)1), при необходимости, мочевой кислоты [2,3,4,5,6,7,9,12].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 3)
Комментарии: 1Для оценки азотовыделительной функции почек (клиренс креатинина (скорость клубочковой фильтрации)) следует применять расчетные формулы, отдавая предпочтение в детском возрасте формуле Шварца, также возможно дополнительно проведение исследования уровня цистатина С в крови (подробнее – см. клинические рекомендации по хронической болезни почек (возрастная категория – дети) – (услуги отсутствуют в Номенклатуре медицинских услуг).
- Не рекомендовано рутинно определять уровень С-реактивного белка (СРБ) в сыворотке крови и/или прокальцитонина (ПКТ) в крови – исследование уровня C-реактивного белка в сыворотке крови, исследование уровня прокальцитонина в крови – при подозрении на ИМП (т.е. при лихорадке, лейкоцитозе и лейкоцитурии) в связи с недостаточной их специфичностью [2,4,5,6,7,9].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 3)
Комментарии: при подтверждении лейкоцитурии у ребенка с лихорадкой, необходимости в определении СРБ и ПКТ для подтверждения ИМП нет.
данные общего (клинического) анализа крови: лейкоцитоз выше 15х109/л; высокие уровни С-реактивного белка (СРБ) (≥30 мг/л) указывают на высокую вероятность бактериальной инфекции. СРБ имеет меньшую специфичность по сравнению с прокальцитонином.
Уровень прокальцитонина >1 нг/мл может свидетельствовать в пользу острого пиелонефрита при ИМП и практически не встречается при инфекциях нижних отделов.
Исследование уровня прокальцитонина в крови является дорогостоящим и целесообразно в составе комплексных диагностических мероприятий при подозрении на уросепсис или при необходимости оценки ответа на АБТ при тяжелом течении пиелонефрита [2,3,13].
Дифференциально-диагностические признаки острого цистита и острого пиелонефрита приведены в таблице 1.
Таблица 1.
Дифференциально-диагностические признаки острого цистита и острого пиелонефрита [14] (с изменениями).
| Симптом | Цистит | Пиелонефрит |
|---|---|---|
| Повышение температуры более 38°С | Не характерно | Характерно |
| Интоксикация | Редко (у детей раннего возраста) | Характерно |
| Дизурия | Характерно | Не характерно |
| Боли в животе/пояснице | Не характерно | Характерно |
| Лейкоцитоз (нейтрофильный) | Не характерно | Характерно |
| Увеличение СОЭ | Не характерно | Характерно |
| Протеинурия | Нет | Небольшая |
| Гематурия | У 40-50% | У 20-30% |
| Макрогематурия | У 20-25% | Не характерна |
| Лейкоцитурия | Да | Да |
| Снижение концентрационной функции почек | Не характерно | Возможно |
| Увеличение размеров почек (УЗИ) | Нет | Может быть |
| Утолщение стенки мочевого пузыря (УЗИ) | Может быть | Не характерно |
4. Инструментальные исследования
- Рекомендуется проводить ультразвуковое исследование (УЗИ) почек, УЗИ мочевого пузыря, УЗИ мочевыводящих путей всем детям во время (при возможности, в первые 24 часа после обращения) и после первого эпизода (через 1-2 недели) ИМП [2,4,5,7].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Комментарий: УЗИ является наиболее доступным методом, позволяет заподозрить наличие аномалий строения мочевой системы (расширение чашечно-лоханочной системы (ЧЛС), стеноз мочеточника, и др.), камней.
При УЗИ почек можно определить или заподозрить абсцесс почки, периренальный абсцесс (редко встречаются).
УЗИ используется также для оценки размеров почек, общего и локального кровотока в них, состояния ЧЛС, объема и состояния стенки мочевого пузыря. Его целесообразно проводить при наполненном мочевом пузыре, а также после микции.
- Рекомендуется проведение цистографии после первого эпизода фебрильной ИМП при наличии признаков нарушения уродинамики по данным УЗИ почек и мочевого пузыря с целью диагностики ПМР и определения его степени, а также выявления уретероцеле, дивертикула, клапана задней уретры и др. [2,3,4,5,7,15].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Комментарий:
У детей после 1-го эпизода ИМП цистография выявляет пузырно-мочеточниковый рефлюкс (ПМР) 3-5-й ст. только в 17% случаев, 1-2-й ст. – у 22% детей, имеющих изменения при УЗИ [4]. ПМР определяется у 25-30% детей с ИМП [7].
Цистографию не следует проводить рутинно в связи с тем, что исследование является инвазивным, а также несет лучевую нагрузку.
Не проводится после первого эпизода ИМП за исключением ситуаций, когда имеются показания, в большинстве случаев – детям до 2 лет.
Цистография не проводится в активную стадию/при обострении.
Цистография также может проводиться при рецидивирующем течении ИМП.
От проведения цистографии с целью выявления ПМР, в том числе низкой степени можно отказаться при возможности проведения сцинтиграфии почек и мочевыделительной системы с функциональными пробами (динамической нефросцинтиграфии) с микционной пробой у детей (Сцинтиграфия почек и мочевыделительной системы с функциональными пробами), контролирующих процесс мочеиспускания [2,3,4,5,6,9,16].
Процедура проводится в соответствии с согласительным документом (в соответствии со стандартом SNMMI/EANM) –[43]
- Рекомендуется проводить Сцинтиграфию почек и мочевыделительной системы (статическую нефросцинтиграфию) для выявления очагов нефросклероза детям до 3 лет с атипичным течением ИМВП не ранее чем через 4-6 месяцев после острого эпизода и при рецидивирующем течении ИМВП [1,2,5,8].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Комментарии: Сцинтиграфия почек и мочевыделительной системы (Статическая нефросцинтиграфия) проводится при:
- Рецидивирующих ИМП на фоне аномалий развития МС, в тч ПМР (1 раз в 1-1,5 года)
- Рецидивирующих ИМП без структурных аномалий мочевой системы (1 раз в 1-1,5 года)
В последние годы больший интерес представляет Магнитно-резонансная томография урография в связи с отсутствием лучевой нагрузки (см. ниже).
- Внутривенную урографию, магнитно-резонансную томографию урографию (МР-урографию) - рекомендуется применять в качестве вспомогательной методики для выявления обструкции мочевыводящих путей, аномалии развития органов мочевой системы (после исключения ПМР) [2,3,4,5,10].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Комментарии: МР-урография имеет определенные преимущества и перед статической нефросцинтиграфией (Сцинтиграфия почек и мочевыделительной системы): она неинвазивна (не нужно вводить фармпрепарат в вену), не несет лучевой нагрузки, не требует много времени (исследование, как правило, длится 20 мин), позволяет дифференцировать очаги острого воспаления от очагов фиброза (при статической нефросцинтиграфии (Сцинтиграфия почек и мочевыделительной системы) они могут быть интерпретированы как рубцовые очаги) [7]. Однако методика требует анестезиологического обеспечения у ряда пациентов, а также предполагает доступность МРТ и совместимого с МР-томографом анестезиологического оборудования.
Анестезиологическое пособие (включая раннее послеоперационное ведение) – по показаниям.
Компьютерная томография почек и надпочечников используется для обнаружения зональных дефектов воспалительного характера (например, абсцесс почки). Из-за высокой степени облучения и риска получения артефактов при движении ребенка рутинно не проводится. Обязательно под контролем функции почек (расчет скорости клубочковой фильтрации (СКФ) (Исследование функции нефронов по клиренсу креатинина (проба Реберга1)
Комментарий: 1расчет скорости клубочковой фильтрации у детей следует проводить по формулам, отдавая предпочтение формуле Шварца.
- Не рекомендуется рутинно проводить цистоскопию детям с ИМП. Только небольшая когорта пациентов с тяжелыми степенями ПМР, уретероцеле, ПМР при плохом ответе на консервативную терапию, подозрении на удвоение собирательной системы, уретероцеле, обструкцию уретры нуждается в данном исследовании [7].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 3)
5. Иные исследования
Не требуются.
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Консервативное лечение
- Рекомендуется безотлагательное назначение антибактериальных препаратов системного действия пациентам с ИМП (не дожидаясь результатов посева) (табл.2) [2,3,5,17].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Комментарий:
Таблица 2.
Эмпирическая АБТ внебольничных ИМП у детей.
| Цистит (пероральный прием ПМП) | |
|---|---|
| Препараты выбора | Альтернативные препараты |
|
Амоксициллин+клавулановая кислота** (с 3 мес)
#Фуразидин (с 3 лет)
#Нитрофурантоин (с 6 лет)
Фосфомицин** (формы для перорального применения - с 12 лет)
|
Цефиксим (с 6 мес)
Цефуроксим** (с 3 мес)
Цефподоксим (с 12 лет)
Ко-тримоксазол [Сульфаметоксазол+Триметоприм] ** (с 6 недель) (только при известной чувствительности возбудителя)
|
| Пиелонефрит (пероральный прием ПМП) | |
| Препараты выбора | Альтернативные препараты |
|
Амоксициллин+клавулановая кислота** (с 3 мес)
Цефиксим (с 6 мес)
Цефуроксим** (с 3 мес)
|
Ко-тримоксазол [Сульфаметоксазол+Триметоприм]** (с 6 недель) (только при известной чувствительности возбудителя) |
| Пиелонефрит (парентеральное введение ПМП)1 | |
| Нетяжелое течение | |
| Препараты выбора | Альтернативные препараты |
|
Цефтриаксон** 1
Цефотаксим** (с 0 мес)2
Цефтазидим** (с 0 мес)
Цефепим** (с 2 мес)
|
Амоксициллин+клавулановая кислота** (только при известной чувствительности возбудителя) (с 0 мес)
Эртапенем** (с 3 мес)
Фосфомицин** (с 0 мес)
Амикацин** (с 0 мес)
|
| Тяжелое течение | |
| Препараты выбора | Альтернативные препараты |
|
Эртапенем** (с 3 мес)
Имипенем+циластатин** (с 3 мес)
Меропенем** (с 3 мес)
Фосфомицин** (с 0 мес)
|
Цефтазидим+[авибактам]** (с 3 мес)
Цефоперазон+[сульбактам]** (с 0 мес)
Пиперациллин+[тазобактам] (с 12 лет (с 2 лет – при инфекции на фоне нейтропении))
Цефотаксим+[сульбактам]** (с 0 мес)2
Цефепим+[сульбактам] (с 2 мес)
Амикацин** (с 0 мес)
Гентамицин** (с 1 мес)3
Амоксициллин+[сульбактам]**4, (с 0 мес)
Ампициллин+[сульбактам]**4, (с 0 мес)
Амоксициллин+[клавулановая кислота]** (только при известной чувствительности возбудителя) (с 0 мес)
|
1 Противопоказание: недоношенные дети в возрасте до 41 недели включительно (суммарно гестационный и хронологический возраст; доношенные новорожденные (≤28-дневного возраста).
2 Имеются возрастные ограничения в зависимости от способа введения препарата.
3 Противопоказан новорожденным (до 1 месяца), в том числе недоношенным дети (в связи с высоким риском развития ототоксического и нефротоксического действия).
4 После парентерального введения могут использоваться пероральные ПМП (ступенчатая терапия).
- При назначении ПМП рекомендуется ориентироваться на региональные данные о чувствительности уропатогенов с целью выбора наиболее эффективного препарата для терапии [2,3,5,17].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
- Рекомендовано поощрять адекватное потребление жидкости, регулярное опорожнение мочевого пузыря каждые 1,5-2 часа и не задерживать мочу до последней минуты [7].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 3)
Комментарий: Также следует проводить тщательную гигиену половых органов. Гигиенические мероприятия следует соблюдать и после острого эпизода ИМП.
- Рекомендуется своевременное выявление и коррекция нарушений уродинамики при их наличии с целью предотвращения рецидивов ИМП [2,3,4,6].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Комментарии: проводится в стадии ремиссии.
- Рекомендуется контролировать регулярность опорожнения кишечника всем пациентам с перенесенной ИМП для предупреждения лимфогенного пути инфицирования [4,15].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Комментарий: при наличии запоров и иной патологии, влияющей на возникновение/рецидивирование ИМП – лечение проводится согласно соответствующим рекомендациям.
- Рекомендуется уменьшение дозы ПМП в зависимости от скорости клубочковой фильтрации пациентам с нарушением функции почек согласно инструкциям по применению с целью достижения максимального эффекта терапии и минимизации побочных явлений [4,17,18].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Комментарий: В таблице 3 представлены дозы препаратов у детей с ИМП с нормальной функцией почек.
Таблица 3.
Дозирование ПМП для приема внутрь у детей с ИМП с нормальной функцией почек (СКФ 90 мл/мин).
| ПМП (МНН) | Режим дозирования |
|---|---|
| Амоксициллин+ [клавулановая кислота]** |
Дети до 12 лет: 45-60 мг/кг/сутки (по амоксициллину) в 2-3 приема
Дети старше 12 лет (или с массой тела >40 кг): 500/125 мг 3 раза в сутки или 875/125 мг 2 раза в сутки
|
| #Нитрофурантоин |
Дети от 6 до 12 лет: 3 мг/кг/сутки в 3-4 приема
Дети старше 12 лет: по 100 мг 2 раза в сутки
|
| Цефиксим |
Дети от 6 мес. до 12 лет: 8 мг/кг/сутки в 1-2 приема
Дети старше 12 лет: 400 мг 1 раз в сутки или 200 мг 2 раза в сутки
|
| Цефуроксим** |
Дети от 3 месяцев до 12 лет: 10-15 мг/кг (но не более 250 мг) каждые 12 ч
Дети старше 12 лет: 250-500 мг каждые 12 ч
|
| Цефподоксим | Дети старше 12 лет: 100 мг каждые 12 ч |
| Фосфомицин** (формы для перорального применения) | Дети старше 12 лет: 3 г однократно |
| Фуразидин (капсулы 25 мг) | Дети старше 3 лет: 25-50 мг 3 раза в сутки (но не более 5 мг/кг/сутки) |
| Ко-тримоксазол [Сульфаметоксазол+Триметоприм]** (суспензия с 6 нед., таблетки с 3 лет) |
Суспензия:
Дети 6 нед-5 мес: 120 мг (2,5 мл суспензии) 2 раза в сутки
Дети 6 мес.-5 лет: 240 мг (5 мл суспензии) 2 раза в сутки
Дети 6-12 лет: 480 мг (10 мл суспензии) 2 раза в сутки
Дети старше 12 лет: 960 мг (20 мл суспензии) 2 раза в сутки
Таблетки:
Дети 3-5 лет: 240 мг 2 раза в сутки
Дети 6-12 лет: 480 мг 2 раза в сутки
Дети старше 12 лет: 960 мг 2 раза в сутки
|
- У госпитализированных пациентов, особенно грудного возраста, которым трудно принимать и усваивать препарат внутрь, обычно АБТ рекомендуется начинать с парентерального (в первую очередь, внутривенного) пути введения ПМП в первые 24-72 часа (табл. 2) с последующим переходом на пероральный прием. При отсутствии выраженной интоксикации и сохранной способности ребенка получать препарат внутрь рекомендовано назначение перорального приема ПМП с первых суток [2,3,4,5,17].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Комментарии: в таблице 4 приведены основные, наиболее часто встречающиеся варианты ступенчатой АБТ, лечение может корректироваться по индивидуальным показаниям.
Таблица 4.
Основные варианты ступенчатой АБТ1.
Основные варианты ступенчатой АБТ1.
| Парентеральный ПМП | ПМП для приема внутрь | |
|---|---|---|
|
Цефтриаксон**
Цефотаксим**
Цефтазидим**
Цефепим**
|
® |
Цефуроксим**
Цефиксим
|
|
Амоксициллин+[Клавулановая кислота]**
Ампициллин+[Сульбактам]**
Амоксициллин+[Сульбактам]**
|
® | Амоксициллин+[Клавулановая кислота]** |
Примечание: при переводе с парентерального введения других ПМП на прием ПМП внутрь следует учитывать результаты бактериологического исследования и определения чувствительности, выбор и дозы ПМП для приема внутрь – см. таблицу 3.
- При остром пиелонефрите рекомендована длительность антибактериальной терапии в среднем, не менее 10 дней. Более длительные курсы не имеют преимуществ в плане предотвращения рецидивов. [3,19,20].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 3)
Комментарии: более короткие курсы при пиелонефрите сопряжены с повышенным риском рецидива инфекции [3,44].
- У детей при инфекциях нижних мочевыводящих путей (цистит, уретрит, ИМП без лихорадки) рекомендован прием ПМП в течение 5-7 дней (исключение – однократный прием фосфомицина** при остром цистите). Такая длительность курса является, в большинстве случаев, достаточной [2,3,4,5,18].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
- Не рекомендуется проведение сверхкоротких курсов АБТ (<5-и дней) при инфекциях нижних мочевыводящих путей (цистит, уретрит, ИМП без лихорадки) (исключение – однократный прием фосфомицина** при остром цистите) [7,17,18].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 3)
- Не рекомендуется назначение АБТ при бессимптомной бактериурии при отсутствии лейкоцитурии за исключением случаев планируемого оперативного вмешательства на мочевыводящих путях [2].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Комментарии: тактика при инфекционных конкрементах – см. клинические рекомендации по мочекаменной болезни у детей. Также возможно рассмотреть проведение АБТ при диабете и у беременных.
- Принимая во внимание высокую распространенность резистентных возбудителей в госпитальной среде, всем пациентам с нозокомиальными ИМП рекомендуется проведение микробиологического (культурального) исследования мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы) с определением чувствительности микроорганизмов к антимикробным химиотерапевтическим препаратам и с последующей коррекцией стартовой АБТ, особенно в случае ее неэффективности (Табл. 5. 6) [3].
(Уровень убедительности рекомендаций С, Уровень достоверности доказательств 5)
Комментарий: исследование желательно проводить до назначения АБТ.
Эмпирический выбор АБТ осуществляется на основании данных о распространенности тех или иных нозокомиальных патогенов в конкретном отделении/стационаре и локальных сведений об их чувствительности к ПМП.
Дозировки пациентам с нарушением функции почек корректируются в соответствии с инструкциями. Дозы парентеральных ПМП при ИМП у детей с нормальной функцией почек представлены в таблице 7.
Таблица 5.
Эмпирическая антибактериальная терапия нозокомиальных ИМП у детей. [21,22,23]
| Препараты выбора | Альтернативные препараты |
|---|---|
|
Стартовая монотерапия
Эртапенем**
Имипенем+циластатин**
Меропенем**
Стартовая комбинированная терапия1
Эртапенем**
Имипенем+циластатин**
Меропенем**
+ Аминогликозид (амикацин**, гентамицин**)
Или
+ Фосфомицин**
|
Стартовая монотерапия
Цефоперазон+сульбактам**
Цефотаксим+сульбактам**
Цефепим+сульбактам
Стартовая комбинированная терапия1
Цефоперазон+сульбактам**
Цефотаксим+сульбактам**
Цефепим+сульбактам
+ Аминогликозид (амикацин**, гентамицин**)
Или
+ Фосфомицин**
При непереносимости β-лактамов (бета-лактамных антибактериальных препаратов)
Аминогликозид (амикацин**, гентамицин**)
± Фосфомицин**
|
1 в случае тяжелого течения
Таблица 6.
Рекомендации по этиотропной АБТ нозокомиальных ИМП у детей1. [23,24,25,26,28,29,30]
| Возбудитель | Препараты выбора | Альтернативные препараты |
|---|---|---|
| Enterobacterales (E.coli, K.pneumoniae, Enterobacter spp.), БЛРС+, карбапенемочувствительные штаммы |
Эртапенем**
Имипенем+циластатин**
Меропенем**
|
При непереносимости β-лактамов (бета-лактамных антибактериальных препаратов)
Амикацин ± Фосфомицин**
|
| Enterobacterales (E.coli, K.pneumoniae, Enterobacter spp.), карбапенеморезистентные штаммы |
Цефтазидим+[авибактам]**
± Азтреонам2
|
Амикацин** ± Фосфомицин**
#Полимиксин В ± Фосфомицин**
|
| P.aeruginosa, штаммы, чувствительные к карбапенемам и ЦС |
Цефтазидим**
Цефепим**
Имипенем+циластатин**
Меропенем**
± Амикацин**
#Полимиксин В +Азтреонам
|
При непереносимости β-лактамов (бета-лактамных антибактериальных препаратов)
Амикацин**
± Фосфомицин**
|
| P.aeruginosa, карбапенеморезистентные штаммы |
#Полимиксин В + карбапенем (имипенем** или меропенем**)
#Полимиксин В + фосфомицин**
Цефтазидим+[авибактам]** + азтреонам
Фосфомицин** + карбапенем (имипенем+циластатин** или меропенем**)
|
|
| Acinetobacter spp., карбапенемочувствительные штаммы |
Имипенем+циластатин**
Меропенем**
|
При непереносимости β-лактамов (бета-лактамных антибактериальных препаратов)
Амикацин**
Ко-тримоксазол**
|
| Acinetobacter spp., карбапенеморезистентные штаммы | #Полимиксин В |
Амикацин**
Ко-тримоксазол**
|
| E.faecalis, ампициллиночувствительные штаммы | Ампициллин** ± Гентамицин** |
Линезолид**
Ванкомицин**
|
| Другие энтерококки (не E.faecalis), чувствительные к ванкомицину |
#Линезолид**
#Ванкомицин**
|
|
| Ванкомицинорезистентные штаммы Enterococcus spp. | Линезолид** | |
| Метициллиночувствительные штаммы S. aureus |
Оксациллин**
Амоксициллин+клавулановая кислота**
Ампициллин+сульбактам**
Цефазолин**
|
При непереносимости β-лактамов (бета-лактамных антибактериальных препаратов)
Ванкомицин**
Линезолид**
Ко-тримоксазол**
|
|
Метициллинорезистентные штаммы S. aureus
Метициллинорезистентные штаммы S. epidermidis
|
#Линезолид** |
Ванкомицин**
Ко-тримоксазол**
|
1 в любом случае выбор ПМП должен проводиться на основании результатов определения чувствительности выделенного возбудителя
2 в случае тяжелого течения
Таблица 7.
Дозировка парентеральных ПМП при ИМП у детей с нормальной функцией почек1. [21,22,23,25,26,28,30,31,32]
| ПМП (МНН) | Путь введения | Суточная доза | Кратность введения |
|---|---|---|---|
| Азтреонам | в/в, в/м |
Дети от 9 месяцев до 12 лет:
90 мг/кг/сут
|
в 3 введения |
|
Дети старше 12 лет:
1-2 г/сут, при тяжелых инфекциях – 6 г/сут (не >8 г/сут)
|
в 2-4 введения | ||
| Амикацин** | в/в, в/м |
Недоношенные новорожденные:
Начальная доза – 10 мг/кг/сут,
затем 7,5 мг/кг/сут
|
в 1 введение |
|
Новорожденные и дети до 6 лет:
Начальная доза – 10 мг/кг,
затем 15 мг/кг/сут
|
в 2 введения | ||
|
Дети старше 6 лет:
15-20 мг/кг/сут
|
в 2-3 введения | ||
| Ампициллин** | в/в, в/м |
Дети с массой тела <40 кг: 50-100 мг/кг/сутки
Дети с массой тела >40 кг: 4,0-8 ,0 г/сут
|
в 4 введения |
| Ампициллин+ сульбактам** | в/в, в/м |
Новорожденные до 1 недели и недоношенные:
50 мг/кг/сут (при пересчете на ампициллин)
|
в 2 введения |
|
Дети от 1 месяца до 12 лет и с массой тела <40 кг: 150 мг/кг/сутки
при тяжелых инфекциях – до 200 мг/кг/сут (при пересчете на ампициллин)
|
в 3-4 введения | ||
|
Дети старше 12 лет:
6-12 г/сутки
|
в 3-4 введения | ||
| Амоксициллин+ клавулановая кислота** | в/в |
Дети до 3 месяцев (или массой тела <4 кг):
60 мг/кг/сут;
|
в 2 введения |
|
Дети до 3 месяцев (или массой тела >4 кг):
60 мг/кг/сут
|
в 3 введения | ||
|
Дети от 3 месяцев до 12 лет:
90 мг/кг/сут
|
в 3 введения | ||
|
Дети от 12 лет:
3,6 г/сутки
|
в 3 введения | ||
| Амоксициллин+ сульбактам | в/в, в/м |
Дети до 2 лет:
до 100 мг/кг/сут (при пересчете на амоксициллин)
|
в 2-3 введения |
|
Дети от 2 лет до 6 лет:
750 мг/сут (при пересчете на амоксициллин)
|
в 3 введения | ||
|
Дети от 6 лет до 12 лет:
1,5 г/сут (при пересчете на амоксициллин)
|
в 3 введения | ||
|
Дети старше 12 лет:
2-3 г/сут (при пересчете на амоксициллин)
|
в 2-3 введения | ||
| #Ванкомицин** | в/в |
Дети от 1 месяца до 12 лет:
30 мг/кг/сутки
|
в 3 введения |
| Гентамицин** | в/в, в/м |
Дети 1 мес.-2 года: 6 мг/кг/сут
Дети старше 2 лет: 3-5мг/кг/сут
|
в 3 введения |
|
Имипенем+ циластатин**
|
в/в
|
Дети ≤3 мес/ (с весом ≥1500 г):
Возраст от 4 нед. до 3 мес. – #25 мг/кг каждые 6 часов;
Возраст от 1 до 4 недель – #25 мг/кг каждые 8 часов
Возраст менее 1 недели – #25 мг/кг каждые 12 часов2
Дозы менее или равные 500 мг следует вводить в/в в течение 20–30 минут
|
в зависимости от возраста (см. столбец «Суточная доза») |
|
Дети от 3 месяцев с массой тела <40 кг:
40-60 мг/кг/сут (не >2 г/сут) (не применяется у детей с весом тела <30 кг и нарушенной функцией почек)1
|
в 4 введения | ||
|
Дети с массой тела >40 кг:
2-3 г/сут
|
в 3-4 введения | ||
| Ко-тримоксазол [Сульфаметоксазол+Триметоприм] ** | в/в |
Дети в возрасте от 3 до 12 лет
Из расчета 30 мг сульфаметоксазола и 6 мг триметоприма/кг/сут в 2 введения.
(схема дозирования: − дети в возрасте от 3 до 5 лет: 2,5 мл каждые 12 часов; − дети в возрасте от 6 до 12 лет: 5 мл каждые 12 часов);
|
в 2 введения |
|
Дети в возрасте от 12 до 18 лет
800 мг сульфаметоксазола и 160 мг триметаприма (2 ампулы (10 мл)) каждые 12 часов.
|
В 2 введения | ||
| В случае очень тяжелых инфекций во всех возрастных группах врач может принять решение увеличить дозу на 50 % | |||
| #Линезолид** | в/в |
30 мг/кг/сутки детям до 12 лет
20 мг/кг/сут детям старше 12 лет
|
в 30 мг/кг/сут – в 3 введения
20 мг/кг/сут в 2 ведения
|
| Меропенем** | в/в |
Дети до 7 дней жизни до 1мес:
#20 мг/кг3
|
в 2 введения |
| Дети от 1 месяца #10-20 мг/кг каждые 8 часов (при осложненных инфекциях) | в 3 введения | ||
|
Дети от 3 месяцев до 12 лет: 30-60 мг/кг/сут,
при тяжелых инфекциях – до 120 мг/кг/сут
|
в 3 введения | ||
| Дети старше 12 лет (или с массой тела >50 кг): 3-6 г/сут | в 3 введения | ||
| Оксациллин** | в/в, в/м |
Дети до 3 месяцев – 60-80 мг/кг/сутки
Дети от 3 месяцев до 2 лет – 1 г/сутки
Дети от 2 до 6 лет – 2 г/сутки
Дети старше 6 лет: 2-4 г/сутки
|
в 4 введения |
| #Полимиксин В (применяется в комбинированной или монотерапии) | в/в |
Дети до 1 года: 4 мг/кг/сутки
Дети старше 1 года: вводная
доза 2,0-2,5 мг/кг в течение 1 ч, затем 2,5-3 мг/кг /сутки
|
в 2 введения |
| Фосфомицин** | в/в | 200-400 мг/кг/сут | в 3 введения |
| Цефотаксим** | в/в, в/м |
Новорожденные:
50 мг/кг/сут,
при тяжелых инфекциях – до 150-200 мг/кг/сут
|
в 2-4 введения |
|
Дети до 12 лет (или с массой тела <50 кг):
100-150 мг/кг/сутки
|
в 2-4 введения | ||
|
Дети от 12 лет (или с массой тела >50 кг):
1-2 г каждые 12 ч
|
в 2-4 введения | ||
| Цефтазидим** | в/в, в/м |
Новорожденные и дети до 2 месяцев:
25-60 мг/кг/сут
|
в 2 введения |
|
Дети от 2 месяцев (или с массой тела <40 кг):
100-150 мг/кг/сутки
|
в 2-3 введения | ||
|
Дети с массой тела >40 кг:
3-6 г
|
в 2-3 введения | ||
| Цефтриаксон** | в/в, в/м |
Новорожденные (до 14 дней):
20-50 мг/кг/сут
|
в 1 введение |
|
Дети от 15 дней до 12 лет:
20-80 мг/кг/сут (не > 2г/сут)
|
в 1 введение | ||
|
Дети старше 12 лет:
1-2 г/сут
|
в 1 введение | ||
| Цефепим** | в/в, в/м |
Дети старше 2 месяцев с массой тела до 40 кг:
100 мг/кг/сут
(при тяжелых инфекциях – 150 мг/кг/сут)
|
в 2-3 введения |
|
Дети с массой тела >40 кг:
2-4 г/сут
|
в 2 введения | ||
| Цефтазидим+ [авибактам]** | в/в |
Дети от 3 до 6 месяцев:
120 мг/кг/сут (при пересчете на цефтазидим)
|
в 3 введения |
|
Дети от 6 месяцев до 18 лет:
150 мг/кг/сут (не >6 г/сут) (при пересчете на цефтазидим)
|
в 3 введения | ||
| Цефоперазон+ [сульбактам]** | в/в, в/м |
Дети:
40-80 мг/кг/сут (при пересчете на цефоперазон – 20-40 мг/кг/сут).
При тяжелых инфекциях доза может быть увеличена до 160 мг/кг/сут (пересчет на цефоперазон и сульбактам в отношении 1:1)
Максимальная суточная доза сульбактама у деней – 80 мг/кг/сут
|
У новорожденных – в 2 введения;
У детей более старшего возраста – в 2-4 введения
|
| Цефотаксим+ [сульбактам]** | в/в, в/м |
Новорожденные:
50 мг/кг/сут (при пересчете на цефотаксим)
|
в 2-4 введения |
|
Дети до 12 лет и с массой тела <50 кг:
100-150 мг/кг/сут (при пересчете на цефотаксим),
при тяжелых инфекциях – до 200 мг/кг/сут (при пересчете на цефотаксим)
|
в 2-4 введения | ||
|
Дети старше 12 лет и с массой тела >50 кг:
2 г/сут (при пересчете на цефотаксим),
при тяжелых инфекциях – до 12 г/сут (при пересчете на цефотаксим), максимальная суточная доза сульбактама – 4 мг (при необходимости повышения дозы препарата – увеличение дозы достигается за счет цефотаксима)
|
в 2 введения
в 3-4 введения
|
||
| Цефепим+ сульбактам | в/в, в/м |
Дети от 2 месяцев с массой тела до 40 кг: 100 мг/кг/сутки (по цефепиму)
Дети с массой тела > 40 кг: 1-2 г/сутки
|
в 2 введения |
| Пиперациллин+ [тазобактам] | в/в, в/м |
Дети старше 12 лет:
12 г пиперациллина + 1,5 г тазобактама
|
в 3-4 введения |
| Эртапенем** | в/в, в/м |
Дети от 3 месяцев до 13 лет: 15 мг/кг 2 раза в сутки (30 мг/кг/сут) (но не более1 г/сут)
Дети от 13 лет – 1 г в сутки однократно
|
в 2 введения |
1 - возможен переход с парентеральной на пероральную терапию тем же препаратом/или ПМП того же класса при улучшении состояния
2 - источники - [45]
3 - источник - [46]
2. Хирургическое лечение
Для терапии острой ИМП не требуется.
Может быть необходимо при заболеваниях/состояниях, обусловливающих развитие ИМП (согласно принятым подходам к лечению соответствующей урологической патологии).
3. Иное лечение
Методы комплементарной и альтернативной медицины (КАМ) в лечении ИМП.
Методы КАМ включают сочетание различных подходов к терапии, не основанных в полной мере на принципах традиционной медицины. В то же время, фундаментом КАМ являются данные реальной научно-обоснованной клинической практики, а в некоторых случаях достоверные результаты, соответствующие традиционным критериям в отношении эффективности и безопасности. Так, доказательства, подтверждающие целесообразность применения отдельных методов КАМ при различных заболеваниях включают результаты, превышающие по своей эффективности плацебо и не уступающие стандартному подходу к лечению [47,48].
Таким образом, методы КАМ, используемые в дополнение к основным рекомендациям, могут повысить взаимопонимание (комплаенс) пациента и его родителей со специалистом в достижении контроля над болезнью, оптимизировав окружающую пациента среду в период длительных курсов традиционного лечения до достижения полного его выздоровления. Альтернативное/комплементарное лечение не заменяет традиционное лечение, в том числе, антибиотикотерапию, тем не менее, может помочь снизить риски избыточного применения противомикробных препаратов системного действия и улучшить комплаентность пациентов/законных представителей [50,51,52].
При решении вопроса о проведении комплементарного лечения необходимо взвесить потенциальную пользу и риски, в том числе, уточнить отсутствие аллергических реакций, например, на фитокомпоненты и учесть особенности заболевания (например, при оксалурии не следует назначать аскорбиновую кислоту**).
- Рекомендовано селективное назначение детям с рецидивирующими ИМП с целью профилактики и антибиотик-сберегающего эффекта препарат - Золототысячника трава+Любистока лекарственного корни+Розмарина обыкновенного листья [53,54,55,56,57,58].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 3)
Комментарии: препарат Золототысячника трава+Любистока лекарственного корни+Розмарина обыкновенного листья может быть назначен детям старше 6 лет в возрастной дозировке (в форме капель или таблеток) курсом 2-4 недели при условии отсутствия чувствительности к растениям семейства зонтичные (в т.ч. к анису и фенхелю), а также к анетолу (компоненту эфирных масел таких растений как анис, фенхель).
- Рекомендовано детям с острыми ИМП селективное применение в качестве дополнительной терапии к АБТ с целью повышения эффективности терапии и снижения риска развития рецидивов препарат Золототысячника трава+Любистока лекарственного корни+Розмарина обыкновенного листья [58].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Комментарии: препарат Золототысячника трава+Любистока лекарственного корни+Розмарина обыкновенного листья может быть назначен детям старше 6 лет в возрастной дозировке (таблеток), с года - в форме капель или в острый период в дополнение к антибактериальной терапии, а также после купирования проявлений курсом 2-4 недели, при условии отсутствия чувствительности к растениям семейства зонтичные (в т.ч. к анису и фенхелю), а также к анетолу (компоненту эфирных масел таких растений как анис, фенхель).
- Рекомендовано детям с симптомами острой ИМП, подтвержденной бактериологически, селективное назначение в качестве дополнительной терапии к АБТ с целью повышения эффективности терапии и снижения риска развития рецидивов, клюквенного сока или экстракта (при отсутствии противопоказаний) [59,60,61,62,63,64].
(Уровень убедительности рекомендаций B Уровень достоверности доказательств 1)
- Рекомендовано детям с острыми ИМП дополнительно к АБТ селективное назначение препаратов, содержащих противодиарейные микроорганизмы, в частности штаммы Lactobacillus, Bifidobacterium lactis и S. boulardii bacteria, с целью повышения эффективности терапии и снижения риска развития рецидивов [65,66,67].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 4)
Комментарии: имеются сообщения о положительном эффекте данного вмешательства, однако требуются дополнительные исследования.
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов реабилитации, в том числе основанных на использовании природных лечебных факторов
Не требуется
Госпитализация
Организация оказания медицинской помощи
Медицинская помощь детям с ИМП может оказываться амбулаторно, в дневном стационаре, стационарно.
Пациента ведет врач-нефролог или врач-педиатр или врач общей практики (семейный врач), при необходимости осуществляются консультации и обследования с участием врача-детского уролога-андролога, врача акушера-гинеколога, врача-генетика, врача-клинического фармаколога, врача-детского хирурга и других.
При необходимости госпитализация осуществляется обычно в нефрологическое или педиатрическое отделение.
Показания к госпитализации в медицинскую организацию
- Дети до 6 месяцев жизни с фебрильной лихорадкой;
- Дети с острым пиелонефритом с симптомами интоксикации и рвоты;
- Отсутствие возможности осуществить оральную регидратацию при наличии признаков обезвоживания;
- Бактериемия и сепсис;
- Острая задержка мочи.
Длительность пребывания в стационаре при ИМП составляет не более 10-14 дней. При отсутствии данных показаний оказание медицинской помощи детям с инфекцией мочевыводящих путей может осуществляться в условиях амбулаторного звена или специализированного дневного стационара.
Показания к выписке из медицинской организации
- Отсутствие лихорадки;
- Отсутствие симптомов интоксикации;
- Нормализация анализа мочи.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Всем детям в качестве первичной профилактики рекомендовано:
- Регулярное опорожнение мочевого пузыря и кишечника
- Достаточное потребление жидкости (в физиологическом объеме)
- Гигиена наружных половых органов [33,34,35,36].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
- В настоящее время не рекомендуется, в большинстве случаев, профилактическое назначение ПМП для предупреждения рецидивов ИМП в связи с недоказанной целесообразностью. [3,37,38].
(Уровень убедительности рекомендаций В уровень достоверности доказательств 1)
Комментарий: По результатам ряда исследований длительное применение антибиотиков может снизить риск повторных симптоматических рецидивов ИМП у детей, но польза небольшая. Антибиотикопрофилактика не предотвращает возникновение новых рубцовых изменений паренхимы почек. В большинстве случаев длительная антимикробная профилактика ИМП не рекомендуется, в том числе, в связи с ростом антибиотикорезистентности уропатогенов.
Тем не менее, возможно рассмотреть такие режимы (Ко-тримоксазол [Сульфаметоксазол+Триметоприм]**) для детей до 1 года при часто рецидивирующих ИМП и при аномалиях строения мочевой системы [68,69].
- Всем детям на 1 году жизни рекомендовано проводить УЗИ почек и мочевого пузыря в рамках диспансеризации с целью раннего выявления аномалий развития почек и МВП [11].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Диспансерное наблюдение
- Рекомендовано динамическое наблюдение за пациентом, перенесшим ИМП, в целях контроля состояния и вторичной профилактики ИМП, объем медицинской помощи при этом зависит от состояния пациента. [70,71,72]
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Комментарии:
Динамическое наблюдение за пациентами, перенесшими острый пиелонефрит должно проводиться не менее 3 лет, острый цистит – не менее 1 года.
В этот период необходимо проведение исследования общего (клинического) анализа мочи детям после перенесенного острого пиелонефрита с частотой 1 раз в месяц – 3 месяца, далее 1 раз в 3 мес в течение года, в дальнейшем – в случае эпизодов лихорадки и/или развитии дизурических явлений и других симптомов поражения мочевых путей.
Детям с циститом – в большинстве случаев динамическое исследование общего (клинического) анализа мочи не требуется, проводится только при наличии симптоматики и у детей с дисфункцией мочеиспускания
Микробиологическое (культуральное) исследование мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы) с определением чувствительности микроорганизмов к антимикробным химиотерапевтическим препаратам (посев мочи) проводится при появлении лейкоцитурии и/или при немотивированных подъемах температуры без катаральных явлений.
Общий (клинический) анализ крови развернутый проводится при клинической необходимости во время динамического наблюдения.
Контроль протеинурии (как фактора почечного повреждения при рецидивирующем пиелонефрите) – в рамках общего (клинического) анализа мочи.
Оценка почечных функций – концентрационной и фильтрационной – при рецидивирующем течении ИМП (определение уровня креатинина крови и расчет СКФ, при необходимости – исследование уровня цистатина С в крови – с определением стадии ХБП – см. клинические рекомендации по хронической болезни почек (возрастная категория - дети) – 1 раз в год.
Ультразвуковое исследование почек и ультразвуковое исследование мочевого пузыря – 1 раз в год. При рецидивирующих ИМП – каждый раз при рецидиве, далее в период ремиссии согласно плановому по диспансерному наблюдению.
Повторные инструментальные обследования проводят со следующей частотой:
- цистография – 1 раз в 1-2 года при рецидивирующем пиелонефрите с частыми обострениями и установленным ПМР;
- статическая нефросцинтиграфия (Сцинтиграфия почек и мочевыделительной системы) при рецидивирующих ИМВП на фоне ПМР – 1 раз в 1-1,5 года, при рецидивирующей ИМП без структурных аномалий мочевой системы – 1 раз в 1-1,5 года.
Контроль степени выраженности нарушения уродинамики в динамике (обструктивная уропатия, ПМР) (см. подраздел «Инструментальная диагностика») при наличии таковой и своевременное направление на хирургическую коррекцию при необходимости.
Контроль уровня артериального давления при аномалиях развития МВП и рецидивирующем пиелонефрите (при каждом посещении врача, при необходимости – по рекомендации врача – контроль дома ежедневно или при появлении жалоб (головная боль, слабость и др.).
Контроль эффективности проводимых лечебно-профилактических мероприятий и их коррекция при необходимости (в зависимости от клинических проявлений, при необходимости проведения и оценки результатов лабораторных и/или инструментальных обследований).
Вакцинация в рамках Национального календаря прививок в период ремиссии ИМП [Приказ МЗ РФ от 06.12.2021 №1122н «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям», Методические указания МУ 3.3.1.1095—02. Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок].
- Рекомендовано проведение приема (осмотра, консультации) врача-акушера-гинеколога или приема (осмотра, консультации) врача-детского уролога-андролога при клинических признаках или подозрении на локальное воспаление гениталий (вульвит или баланит), так как у части детей оно может быть причиной дизурических расстройств и лейкоцитурии. К развитию ИМП может предрасполагать наличие фимоза [3].
(Уровень убедительности рекомендаций С Уровень достоверности доказательств 5)
Комментарий: Применение кремов с глюкокортикоидами, применяемыми в дерматологии при физиологическом фимозе у мальчиков с ИМП статистически достоверно снижает частоту рецидивов ИМП [39].
Информация
Источники и литература
-
Клинические рекомендации Союза педиатров России
- Клинические рекомендации Союза педиатров России - 1. Палагин И.С., Сухорукова М.В., Дехнич А.В., Эйдельштейн М.В. и др. Исследовательская группа «ДАРМИС». Современное состояние антибиотикорезистентности возбудителей внебольничных инфекций мочевых путей в России: результаты исследования «ДАРМИС» (2010-2011). КМАХ 2012; 14(4): 280-302 2. Stein R, Dogan HS, Hoebeke P, et al. European Association of Urology; European Society for Pediatric Urology. Urinary tract infections in children: EAU/ESPU guidelines. Eur Urol. 2015 Mar;67(3):546-58. doi: 10.1016/j.eururo.2014.11.007. Epub 2014 Dec 2. PMID: 25477258 3. "t Hoen LA, Bogaert G, Radmayr C, et al. Update of the EAU/ESPU . Journal of Pediatric Urology. 2021 Apr;17(2):200-207. DOI: 10.1016/j.jpurol.2021.01.037. PMID: 33589366. 4. Детская нефрология: практическое руководство / под ред. Э. Лоймана, А. Н. Цыгина, А. А. Саркисяна. М.: Литтерра, 2010. 400 с. 5. CLINICAL PRACTICE GUIDELINE from American Academy of pediatrics.Urinary Tract Infection: Clinical Practice Guideline forthe Diagnosis and Management of the Initial UTI in Febrile Infants and Children 2 to 24 Months. Pediatrics, 2011, v 128, N3, p. 593-610 6. Ammenti A, Cataldi L, Chimenz R, et al. Febrile urinary tract infections in young children: recommendations for the diagnosis, treatment and follow-up. Acta Paediatr, 2012, v. 10, p.451–457. 7. Leung AKC, Wong AHC, Leung AAM, Hon KL. Urinary Tract Infection in Children. Recent Pat Inflamm Allergy Drug Discov. 2019;13(1):2-18 8. Williams G.J., Macaskill P., Chan S.F., et al. Absolute and relative accuracy of rapid urine tests for urinary tract infection in children: A meta-analysis. Lancet Infect. Dis. 2010;10(4):240–250 9. Whiting P, Westwood M, Watt I, Cooper J, Kleijnen J. Rapid tests and urine sampling techniques for the diagnosis of urinary tract infection (UTI) in children under five years: A systematic review. BMC Pediatr, 2005, v. 5(1): 4. 10. National Institute for Health and Clinical Excellence. Urinary tract infection in children: Diagnosis, treatment and long-term management. https://www.nice.org.uk/guidance/cg54/evidence/full-guideline-pdf-196566877 (Accessed on: November 25, 2020 11. Piñeiro Pérez R, Cilleruelo Ortega MJ, Ares Álvarez J, et al; Grupo Colaborador de Infección Urinaria en Pediatría; Grupo colaborador de infección urinaria en pediatría. Recomendaciones sobre el diagnóstico y tratamiento de la infección urinaria [Recommendations on the diagnosis and treatment of urinary tract infection]. An Pediatr (Engl Ed). 2019 Jun;90(6):400.e1-400.e9. Spanish. doi: 10.1016/j.anpedi.2019.02.009. Epub 2019 Apr 10. PMID: 30979681. 12. Megged O. Bacteremic vs nonbacteremic urinary tract infection in children. Am J Emerg Med. 2017 Jan;35(1):36-38 13. Dreger NM, Degener S, Ahmad-Nejad P, Wöbker G, Roth S. Urosepsis--Etiology, Diagnosis, and Treatment. Dtsch Arztebl Int. 2015 Dec 4;112(49):837-47 14. Маргиева Т. В., Комарова О. В., Вашурина Т. В., и др. Рекомендации по диагностике и лечению инфекций мочевыводящих путей у детей. Педиатрическая фармакология. 2016; 13 (1): 17–21. doi: 10.15690/pf.v13i1.1509 15. Toffolo A, Ammenti A, Montini G. Long-term clinical consequences of urinary tract infections during childhood: A review. Acta Pædiatr 2012, v.101, p.1018-31. 16. DeMuri G. P., Wald E.R. Imaging and antimicrobial prophylaxis following the diagnosis of urinary tract infection in children. Pediatr. Inf. Dis. J. 2008; 27(6): 553-554. 17. Hodson EM, Willis NS, Craig JC. Antibiotics for acute pyelonephritis in children. Cochrane Database Syst Rev 2007(4):CD003772. 18. Hewitt I.K. et al. Early treatment of acute pyelonephritis in children fails to reduce renal scarring: data from the Italian Renal Infection Study trials. Pediatrics 2008; 122: 486. 19. Fitzgerald A, Mori R, Lakhanpaul M, Tullus K. Аntibiotics for treating lower urinary tract infection in children. Cochrane Database Syst Rev. 2012 Aug 15; (8):CD006857 20. Okarska-Napierała M, Wasilewska A, Kuchar E. Urinary tract infection in children: Diagnosis, treatment, imaging – Comparison of current guidelines. J Pediatr Urol. 2017 Dec;13(6):567-573. Doi: 10.1016/j.jpurol.2017.07.018. 21. Iacovelli V, Gaziev G, Topazio L, Bove P, Vespasiani G, Finazzi Agrò E. Nosocomial urinary tract infections: A review Urologia. 2014 Oct-Dec;81(4):222-7. doi: 10.5301/uro.5000092. 22. G. Bonkat, R. Bartoletti, F. Bruyère, T. Cai, S.E. Geerlings, B. Köves, S. Schubert, F. Wagenlehner. Guidelines Associates: W. Devlies, J. Horváth, G. Mantica, T. Mezei, A. Pilatz, B. Pradere, R. Veeratterapillay. Urological infections EAU Guidelines. Edn. presented at the EAU Annual Congress Milan Italy 2021. ISBN 978-94-92671-13-4, 23. Елисеева Е.В., Азизов И.С., Зубарева Н.А. Обзор международных согласительных рекомендаций по оптимальному использованию полимиксинов Клиническая микробиология и антимикробная химиотерапия. 2019; 21(4):282-309 24. Tamma PD, Aitken SL, Bonomo RA, et al. Infectious Diseases Society of America Guidance on the Treatment of Extended-Spectrum β-lactamase Producing Enterobacterales (ESBL-E), Carbapenem-Resistant Enterobacterales (CRE), and Pseudomonas aeruginosa with Difficult-to-Treat Resistance (DTR-P. aeruginosa). Clin Infect Dis. 2021 Apr 8;72(7):e169-e183. Doi: 10.1093/cid/ciaa1478. 25. Белобородов Б.В., Гусаров В.Г., Дехнич А.В., Замятин М.Н., Зубарева Н.А., Зырянов С.К., Камышова Д.А., Климко Н.Н., Козлов Р.С., Кулабухов В.В., Полушин Ю.С., Руднов В.А., Сидоренко С.В., Шлык И.В., Эдельштейн М.В., Яковлев С.В. МЕДОДИЧЕСКИЕ РЕКОМЕНДАЦИИ Российской некоммерческой общественной организации «Ассоциация анестезиологов-реаниматологов», Межрегиональной общественной организации «Альянс клинических химиотерапевтов и микробиологов», Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ), общественной организации «Российский Сепсис Форум» «Диагностика и антимикробная терапия инфекций, вызванных полирезистентными микроорганизмами». Вестник анестезиологии и реаниматологии. 2020;17(1):52-83. https://doi.org/10.21292/2078-5658-2020-16-1-52-83 26. https://www.antibiotic.ru/library/diagnostika-i-antimikrobnaya-terapiya-infekcij-vyzvannyh-polirezistentnymi-mikrorganizmami/ 27. Kristich CJ, Rice LB, Arias CA. Enterococcal Infection—Treatment and Antibiotic Resistance. 2014 Feb 6. In: Gilmore MS, Clewell DB, Ike Y, Shankar N, editors. Enterococci: From Commensals to Leading Causes of Drug Resistant Infection [Internet]. Boston: Massachusetts Eye and Ear Infirmary; 2014–. PMID: 24649502. 28. Gilmore MS, Clewell DB, Ike Y, Shankar N, editors. Enterococci: From Commensals to Leading Causes of Drug Resistant Infection [Internet]. Boston: Massachusetts Eye and Ear Infirmary; 2014–. PMID: 24649510 29. Marcus N, Ashkenazi S, Samra Z, Cohen A, Livni G. Community-acquired enterococcal urinary tract infections in hospitalized children. Pediatr Nephrol. 2012 Jan;27(1):109-14. doi: 10.1007/s00467-011-1951-5. Epub 2011 Aug 7. PMID: 21822790 30. Treatment of enterococcal infections Authors:Barbara E Murray, MDWilliam R Miller, MDSection Editor:Daniel J Sexton, MDDeputy Editor:Milana Bogorodskaya, MD https://www.uptodate.com/contents/treatment-of-enterococcal infections?search=enterococcus faecalis моча&source=search_result&selectedTitle=1~150&usage_type=default&display_rank=1 (last updated: Mar 02, 2021) 31. https://grls.rosminzdrav.ru/grls.aspx 32. Mercuro NJ, Davis SL, Zervos MJ, Herc ES. Combatting resistant enterococcal infections: a pharmacotherapy review. Expert Opin Pharmacother. 2018 Jun;19(9):979-992. doi: 10.1080/14656566.2018.1479397. Epub 2018 Jun 7. PMID: 29877755 33. Desai DJ, Gilbert B, McBride CA. Paediatric urinary tract infections: Diagnosis and treatment. Aust Fam Physician. 2016 Aug; 45(8):558-63. 34. Williams GJ, Hodson EH, Isaacs D, Craig JC Diagnosis and management of urinary tract infection in children. J Paediatr Child Health. 2012 Apr; 48(4):296-301 35. Korbel L, Howell M, Spencer JD The clinical diagnosis and management of urinary tract infections in children and adolescents. Paediatr Int Child Health. 2017 Nov; 37(4):273-279. 36. Robinson JL, Finlay JC, Lang ME, Bortolussi R, Canadian Prophylactic antibiotics for children with recurrent urinary tract infections. Paediatric Society, Community Paediatrics Committee, Infectious Diseases and Immunization Committee. Paediatr Child Health. 2015 Jan-Feb; 20(1):45-51 37. Williams G, Craig JC. Long-term antibiotics for preventing recurrent urinary tract infection in children. Cochrane Database Syst Rev. 2019 Apr 1;4(4):CD001534. doi: 10.1002/14651858.CD001534.pub4. 38. Alsubaie SS, Barry MA. Current status of long-term antibiotic prophylaxis for urinary tract infections in children: An antibiotic stewardship challenge. Kidney Res Clin Pract. 2019 Dec 31;38(4):441-454. doi: 10.23876/j.krcp.19.091. 39. Chen CJ, Satyanarayan A, Schlomer BJ. The use of steroid cream for physiologic phimosis in male infants with a history of UTI and normal renal ultrasound is associated with decreased risk of recurrent UTI. J Pediatr Urol. 2019 Oct;15(5):472.e1-472.e6. doi: 10.1016/j.jpurol.2019.06.018. 40. Cyriac J, Holden K, Tullus K. How to use… urine dipsticks. Arch Dis Child Educ Pract Ed. 2017 Jun;102(3):148-154 41. Ben-David R, Carroll F, Kornitzer E, Dekalo S, Mano R, Ben-Chaim J, Cleper R, Bar-Yosef Y. Asymptomatic bacteriuria and antibiotic resistance profile in children with neurogenic bladder who require clean intermittent catheterization. Spinal Cord. 2022 Mar;60(3):256-260 42. Nicolle LE, Gupta K, Bradley SF, Colgan R, DeMuri GP, Drekonja D, Eckert LO, Geerlings SE, Köves B, Hooton TM, Juthani-Mehta M, Knight SL, Saint S, Schaeffer AJ, Trautner B, Wullt B, Siemieniuk R. Clinical Practice Guideline for the Management of Asymptomatic Bacteriuria: 2019 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2019 May 2;68(10):1611-1615 43. Vali, R., Armstrong, I.S., Bar-Sever, Z. et al. SNMMI procedure standard/EANM practice guideline on pediatric [99mTc]Tc-DMSA renal cortical scintigraphy: an update. Clin Transl Imaging 10, 173–184 (2022). https://doi.org/10.1007/s40336-022-00484-x 44. Zaoutis T, Shaikh N, Fisher BT, Coffin SE, Bhatnagar S, Downes KJ, Gerber JS, Shope TR, Martin JM, Muniz GB, Green M, Nagg JP, Myers SR, Mistry RD, O"Connor S, Faig W, Black S, Rowley E, Liston K, Hoberman A. Short-Course Therapy for Urinary Tract Infections in Children: The SCOUT Randomized Clinical Trial. JAMA Pediatr. 2023 Aug 1;177(8):782-789 45. https://www.accessdata.fda.gov/drugsatfda_docs/label/2016/050587s074lbl.pdf, imipenem/cilastatin (Rx) (https://reference.medscape.com/drug/primaxin-imipenem-cilastatin-342562) 46. И.В.Андреева, О.У.Стецюк, Р.С.Козлов «Применение меропенема при лечении тяжелых инфекций у детей» Клиническая микробиология и антимикробная химиотерапия; 2008 №10; т.4: с. 322-332 47. Harbell MW, Barendrick LN, Mi L, Quillen J, Millstine DM. Patient Attitudes Toward Acupuncture in the Perioperative Setting. J Integr Complement Med. 2022 Apr;28(4):349-354. doi: 10.1089/jicm.2021.0311. Epub 2022 Jan 13. PMID: 35426737. 48. Millstine D, Chen CY, Bauer B. Complementary and integrative medicine in the management of headache. BMJ. 2017 May 16;357:j1805. doi: 10.1136/bmj.j1805. PMID: 28512119 49. van Wietmarschen H, van Steenbergen N, van der Werf E, Baars E. Effectiveness of herbal medicines to prevent and control symptoms of urinary tract infections and to reduce antibiotic use: A literature review. Integr Med Res. 2022 Dec;11(4):100892. doi: 10.1016/j.imr.2022.100892. Epub 2022 Oct 9 50. Ching CB. Non-antibiotic Approaches to Preventing Pediatric UTIs: a Role for D-Mannose, Cranberry, and Probiotics? Curr Urol Rep. 2022 Jun;23(6):113-127. doi: 10.1007/s11934-022-01094-w. Epub 2022 Apr 20. PMID: 35441976 51. Bladder infection. Do herbal remedies help with recurrent bladder infection?Institute for Quality and Efficiency in Health Care (IQWiG); 2022 Feb 24 https://www.ncbi.nlm.nih.gov/books/NBK590220/ 52. van Wietmarschen H, van Steenbergen N, van der Werf E, Baars E. Effectiveness of herbal medicines to prevent and control symptoms of urinary tract infections and to reduce antibiotic use: A literature review. Integr Med Res. 2022 Dec;11(4):100892. doi: 10.1016/j.imr.2022.100892. Epub 2022 Oct 9, Ching CB. Non-antibiotic Approaches to Preventing Pediatric UTIs: a Role for D-Mannose, Cranberry, and Probiotics? Curr Urol Rep. 2022 Jun;23(6):113-127. doi: 10.1007/s11934-022-01094-w. Epub 2022 Apr 20. PMID: 35441976, Bladder infection. Do herbal remedies help with recurrent bladder infection?Institute for Quality and Efficiency in Health Care (IQWiG); 2022 Feb 24 53. Hudson RE, Job KM, Sayre CL, Krepkova LV, Sherwin CM, Enioutina EY. Examination of Complementary Medicine for Treating Urinary Tract Infections Among Pregnant Women and Children. Front Pharmacol. 2022 Apr 27;13:883216. doi: 10.3389/fphar.2022.883216. PMID: 35571128; PMCID: PMC9094615 54. Sukalo A. V., Krokhina S. A., Tur N. I. (2004). The Use of Canephron as a Part of Complex Therapy of Urinary System Infections in Children, 84–86. (11) 55. Kirillov V. I., Bogdanova N. A., Rudenko V. I., Nikitina S. Y., Goritskiy M. I. (2007). Effects of Complex Therapy on Kidney Functions in Children with Questions of Modern Pediatrics, 84–87. 6(2) 56. Voznesenskaya T. S., Kutafina E. K. (2007). Phytotherapy in the Urinary System Infection Treatment in Children. Pediatr. Pharmacol. 4 (5), 38–40 57. Dilin V. V., Shatochina O. V., Osmanova I. M., Yur"eva E. A. (2008). Effectiveness of Canephron N in Children with Dysmetabolic Syndrome with Oxalate-Calcium Crystallization. Vestnik Pediatr. Pharmacol. nutriciology 4, 24 58. Gesellschaft für Pädiatrische Nephrologie und Arbeitskreis Kinder- und Jugendurologie der Deutschen Gesellschaft für Urologie: Interdisziplinäre S2k-Leitlinie: Harnwegsinfektionen im Kindesalter: Diagnostik, Therapie und Prophylaxe. Version 1, 23.08.2021, verfügbar unter: https://www.awmf.org/leitlinien/detail/anmeldung/1/ll/166-004.html. (Zugriff am: TT.MM.JJ) 59. Meena J, Thomas CC, Kumar J, Raut S, Hari P. Non-antibiotic interventions for prevention of urinary tract infections in children: a systematic review and meta-analysis of randomized controlled trials. Eur J Pediatr. 2021 Dec;180(12):3535-3545 60. Fernández-Puentes V., Uberos J., Rodríguez-Belmonte R., Nogueras-Ocaña M., Blanca-Jover E., Narbona-López E. (2015). Efficacy and Safety Profile of cranberry in Infants and Children with Recurrent Urinary Tract Infection. Pediatr. (Barc) 82 (6), 397–403. 10.1016/j.anpedi.2014.08.012 61. Ferrara P., Romaniello L., Vitelli O., Gatto A., Serva M., Cataldi L. (2009). Cranberry Juice for the Prevention of Recurrent Urinary Tract Infections: a Randomized Controlled Trial in Children. Scand. J. Urol. Nephrol. 43 (5), 369–372. 10.3109/00365590902936698 62. Foda M. M., Middlebrook P. F., Gatfield C. T., Potvin G., Wells G., Schillinger J. F. (1995). Efficacy of cranberry in Prevention of Urinary Tract Infection in a Susceptible Pediatric Population. Can. J. Urol. 2 (1), 98–102] 63. Wan K. S., Liu C. K., Lee W. K., Ko M. C., Huang C. S. (2016). Cranberries for Preventing Recurrent Urinary Tract Infections in Uncircumcised Boys. Altern. Ther. Health Med. 22 (6), 20–23 64. Williams G, Hahn D, Stephens JH, Craig JC, Hodson EM. Cranberries for preventing urinary tract infections. Cochrane Database Syst Rev. 2023 Apr 17;4(4):CD001321. doi: 10.1002/14651858.CD001321.pub6
Информация
Список сокращений
АБТ – антибактериальная терапия
БЛРС – бета-лактамазы расширенного спектра
ИМП – инфекция мочевых путей
ИЛ (IL) – интерлейкин
КОЕ – колониеобразующая единица
ЛС – лекарственное средство
МВП – мочевыводящие пути
МНН – международное непатентованное наименование
МРТ – магнитно-резонансная томография
ПКТ – прокальцитонин
ПМП – противомикробные препараты системного действия
ПМР – пузырно-мочеточниковый рефлюкс
СРБ – С-реактивный белок
УЗИ – ультразвуковое исследование
ЧЛС – чашечно-лоханочная система
E. coli – Escherichia coli
EANM – The European Association of Nuclear Medicine (Европейская ассоциация по ядерной медицине),
E.faecalis – Enterococcus faecalis
K. pneumoniae – Klebsiella pneumoniae
MRSE – метициллинорезистентный Staphylococcus epidermidis
MRSA – метициллинорезистентный Staphylococcus aureus
P. aeruginosa – Pseudomonas aeruginosa
S. saprophyticus – Staphylococcus saprophyticus
S. aureus – Staphylococcus aureus
SNMMI – The Society of Nuclear Medicine and Molecular Imaging (Общество ядерной медицины и молекулярной визуализации)
** – лекарственный препарат, входящий в Распоряжение Правительства РФ от 12.10.2019 № 2406-р (ред. от 09.06.2023) <Об утверждении перечня жизненно необходимых и важнейших лекарственных препаратов, а также перечней лекарственных препаратов для медицинского применения и минимального ассортимента лекарственных препаратов, необходимых для оказания медицинской помощи>.
# – Применение лекарственного препарата в соответствии с показателями (характеристиками), не указанными в инструкции по его применению (off-label), осуществляется по решению врачебной комиссии при условии подписанного информированного добровольного согласия (согласно ФЗ №323-ФЗ от 21.11.2011г. с изменениями).
Термины и определения
Новые и узконаправленные профессиональные термины в настоящих клинических рекомендациях не используются.
Дополнительная информация
1. Осложнения
-
Бактериемия развивается редко (в 5,6% случаев ИМП) факторами риска бактериемии могут быть также недоношенность, ранний возраст (первый год жизни). Уросепсис может развиться также при неадекватном лечении пиелонефрита.
-
При рецидивирующем течении и/или развитии ИМП на фоне ПМР высок риск формирования рефлюкс-нефропатии.
[7]:
При остром пиелонефрите возможно развитие электролитных расстройств и нарушений кислотно-щелочного баланса. Острое почечное повреждение может развиться как в результате тяжелого течения самого пиелонефрита (чаще в результате его возникновения на фоне тяжелой аномалии развития почек), так и в результате нефротоксического воздействия применяемых антибиотиков, а также активной жаропонижающей терапии. При прогрессировании поражения почек в результате повторных атак пиелонефрита возможно значительное уменьшение объема функционирующей паренхимы и развитие хронической почечной недостаточности вплоть до конечной стадии, требующей заместительной почечной терапии. Такие осложнения ИМП как абсцесс, пионефроз, эмфизематозный пиелонефрит и ксантогранулематозный пиелонефрит в настоящее время (в антибактериальную эру) встречаются крайне редко.
2. Исходы и прогноз
Подавляющее большинство случаев острой ИМП заканчивается выздоровлением.
Очаговое поражение почечной паренхимы развивается у 5% девочек и 13% мальчиков после первого эпизода фебрильной ИМП; в целом обнаруживается у 10-20% пациентов, перенесших пиелонефрит, и преобладающими провоцирующими факторами наряду с рецидивами инфекции являются ПМР высоких степеней, обструктивные уропатии и гиподисплазия (одной или обеих почек), позднее начало АБТ, а также вирулентность бактерий и индивидуальная восприимчивость.
В первые два года жизни ребенка почки наиболее уязвимы для повреждающего действия с развитием рубцовых изменений, этот риск уменьшается примерно к восьми годам, после чего значительно снижается. При обнаружении ПМР в раннем возрасте (менее 2-х лет) рубцовые изменения в почке через 5 лет обнаруживаются в 24% случаев, у более старших детей – в 13% случаев. Таким образом, более активная диагностика и лечение в раннем возрасте снижают риск прогрессирования до стадии хронической почечной недостаточности.
Артериальная гипертензия приблизительно в 25% случаев развивается у детей с рефлюкс-нефропатией.
ИМП нарушает качество жизни самого ребенка и его родителей, привычный уклад жизни всей семьи. особенно при рецидивирующих ИМП или развитии необратимого повреждения почек.
ИМП в младенчестве является фактором риска повторных болей в животе в детстве.
Критерии оценки качества медицинской помощи
Таблица 1.
Критерии оценки качества первичной медико-санитарной помощи детям при инфекции мочевых путей (коды по МКБ - 10: N10, N11, N13.6, N30.0, N30.1, N39.0).
Критерии оценки качества первичной медико-санитарной помощи детям при инфекции мочевых путей (коды по МКБ - 10: N10, N11, N13.6, N30.0, N30.1, N39.0).
|
№ п/п
|
Критерии оценки качества
|
Оценка выполнения
|
|---|---|---|
|
1.
|
Выполнен общий (клинический) анализ мочи
|
Да/Нет
|
|
2.
|
Выполнен анализ крови биохимический общетерапевтический (с исследованием уровня креатинина в крови и исследованием уровня мочевины в крови) (при обострении, рецидивирующем течении, с осложненными формами, в случае применения групп нефротоксичных лекарственных препаратов)
|
Да/Нет
|
|
3.
|
Выполнено ультразвуковое исследование почек и ультразвуковое исследование мочевого пузыря (при установлении диагноза)
|
Да/Нет
|
|
4.
|
Проведено лечение антибактериальными препаратами системного действия (при наличии медицинских показаний и отсутствии медицинских противопоказаний)
|
Да/Нет
|
Таблица 2.
Критерии оценки качества специализированной медицинской помощи детям при инфекции мочевых путей (коды по МКБ - 10: N10, N11, N13.6, N30.0, N30.1, N39.0).
|
№ п/п
|
Критерии оценки качества
|
Оценка выполнения
|
|---|---|---|
|
1.
|
Выполнен общий (клинический) анализ мочи
|
Да/Нет
|
|
2.
|
Выполнен анализ крови биохимический общетерапевтический (с исследованием уровня креатинина в крови и исследованием уровня мочевины в крови) (при обострении, рецидивирующем течении, с осложненными формами, в случае применения групп нефротоксичных лекарственных препаратов)
|
Да/Нет
|
|
3.
|
Выполнено ультразвуковое исследование почек и ультразвуковое исследование мочевого пузыря (при установлении диагноза)
|
Да/Нет
|
|
4.
|
Выполнено микробиологическое (культуральное) исследование мочи на аэробные и факультативно-анаэробные условно-патогенные микроорганизмы с определением чувствительности микроорганизмов к антимикробным химиотерапевтическим препаратам (до начала антибактериальной терапии и при необходимости коррекции терапии)
|
Да/Нет
|
|
5.
|
Проведено лечение антибактериальными препаратами системного действия (при наличии медицинских показаний и отсутствии медицинских противопоказаний)
|
Да/Нет
|
Приложение А1. Состав рабочей группы
Баранов А.А., акад. РАН, профессор, д.м.н.; почетный президент Союза педиатров России, советник руководителя НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В. Петровского», главный внештатный специалист педиатр Минздрава России
Козлов Р.С., член-корреспондент РАН, профессор, д.м.н, ректор ФГБОУ ВО СГМУ Минздрава России, Главный внештатный специалист Минздрава России по клинической микробиологии и антимикробной резистентности, Президент МАКМАХ
Намазова-Баранова Л.С., акад. РАН, профессор, д.м.н., президент Союза педиатров России; паст-президент EPA/UNEPSA; руководитель НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В. Петровского», заведующая кафедрой факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, главный внештатный детский специалист по профилактической медицине Минздрава России
Андреева И.В., начальник отдела по разработке клинических рекомендаций, доцент, НИИ антимикробной химиотерапии ФГБОУ ВО СГМУ Минздрава России, член МАКМАХ
Вишнёва Е.А., д.м.н., профессор РАН, заместитель руководителя по научной работе НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им. акад. Б.В. Петровского» , доцент кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, член Союза Педиатров России
Зокиров Н.З., д.м.н., заведующий кафедрой Академии последипломного образования ФГБУ ФНКЦ ФМБА России, ФГБУ «ФНКЦ детей и подростков ФМБА России», член Союза педиатров России.
Куличенко Т.В., д.м.н., профессор РАН, ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, эксперт Всемирной Организации Здравоохранения, член Союза педиатров России
Маргиева Т.В., к.м.н., главный специалист Методического центра аккредитации специалистов ФГАОУ ВО «Первый МГМУ им.И.М. Сеченова» Минздрава России (Сеченовский Университет), врач-нефролог, член Союза педиатров России
Довгань Е.В., зав. отделением клинической фармакологии ОГБУЗ «Смоленская областная клиническая больница», член МАКМАХ
Стецюк О.У., ст.н.с., НИИ антимикробной химиотерапии ФГБОУ ВО СГМУ Минздрава России, член МАКМАХ
Таточенко В.К., д.м.н., профессор, советник директора ФГАУ «НМИЦ здоровья детей» Минздрава России, член Союза Педиатров России
Чумакова О.В., проф., д.м.н., член Союза педиатров России
Шилова М.М., к.м.н., доцент кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России
Эмирова Х.М., к.м.н., профессор кафедры педиатрии ФГБОУ ВО «Московского государственного медико-стоматологического университета имени А.И. Евдокимова» Минздрава России; врач-нефролог Центра гравитационной хирургии крови и гемодиализа ГБУЗ «Детская городская клиническая больница св. Владимира» ДЗМ, член ТОДН, РДО
Цыгин А.Н., проф., д.м.н., член Союза педиатров России (участие в исходной версии документа). д.м.н., профессор, заведующий нефрологическим отделением ФГАУ «НМИЦ здоровья детей» Минздрава России, профессор кафедры нефрологии НОИ Клинической медицины им. Н.А. Семашко ФГБОУ ВО «Российского университета медицины» Минздрава России, президент МОО «Творческое объединение детских нефрологов»
Шишиморов И.Н., д.м.н., заведующий кафедрой педиатрии и неонатологии Института непрерывного медицинского и фармацевтического образования ФГБОУ ВО Волгоградский государственный медицинский университет Минздрава России, Президент Волгоградского регионального отделения Союза педиатров России;
Шапошникова Н.Ф., к.м.н., доцент кафедры педиатрии и неонатологии Института непрерывного медицинского и фармацевтического образования ФГБОУ ВО Волгоградский государственный медицинский университет Минздрава России
Сергеева Т.В., проф., д.м.н., член Союза педиатров России (участие в исходной версии документа).
Паунова С.С., проф., д.м.н. (участие в исходной версии документа).
Комарова О.В., д.м.н., член Союза педиатров России (участие в исходной версии документа).
Бакрадзе М.Д., проф., д.м.н., член Союза педиатров России (участие в исходной версии документа).
Цыгина Е.Н., проф., д.м.н., член Союза педиатров России (участие в исходной версии документа).
Зробок О.И., к.м.н., член Союза педиатров России (участие в исходной версии документа).
Вашурина Т.В., к.м.н., член Союза педиатров России (участие в исходной версии документа).
Лупан И.Н., к.м.н. (участие в исходной версии документа).
Каган М.Ю., к.м.н. (участие в исходной версии документа).
Матвеева М.В., к.м.н. (участие в исходной версии документа).
Чащина И.Л., член Союза педиатров России (участие в исходной версии документа).
Полякова А.С., к.м.н., член Союза педиатров России.
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
-
Врачи-детские урологи-андрологи;
-
Врачи-педиатры;
-
Врачи общей практики (семейные врачи);
-
Врачи-нефрологи;
-
Студенты медицинских ВУЗов;
-
Обучающиеся в ординатуре и аспирантуре.
Методы, использованные для сбора/селекции доказательств:
-поиск в электронных базах данных.
Методы, использованные для анализа доказательств:
-обзоры опубликованных мета-анализов;
-системные обзоры с таблицами доказательств.
Методы, использованные для формулирования рекомендаций:
-Консенсус экспертов;
-Оценка значимости в соответствии с рейтинговой схемой.
Сила и качество рекомендаций в соответствии с проведенным анализом доказательств (табл. П1, П2) приведены в тексте.
Таблица 1.
Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств).
|
УДД
|
Расшифровка
|
|---|---|
|
1
|
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
|
|
2
|
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
|
|
3
|
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Таблица 2.
Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств).
|
УДД
|
Расшифровка
|
|---|---|
|
1
|
Систематический обзор РКИ с применением мета-анализа
|
|
2
|
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
|
|
3
|
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль»
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Таблица 3.
Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
|
УУР
|
Расшифровка
|
|---|---|
|
A
|
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
B
|
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C
|
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
-
Приказ Министерства здравоохранения и социального развития РФ от 16 апреля 2012 г. № 366н "Об утверждении Порядка оказания педиатрической помощи".
-
Приказ Минздрава России 203н от 10 мая 2017г «Об утверждении критериев оценки качества медицинской помощи».
-
Информация о лекарственных препаратах: Государственный реестр лекарственных средств: https://grls.rosminzdrav.ru
-
Федеральный закон от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (Собрание законодательства Российской Федерации, 2011 г., № 48, ст. 6724).
-
Международная классификация болезней, травм и состояний, влияющих на здоровье (МКБ-10).
-
Приказ МЗ РФ от 20 декабря 2012г. № 1183н «Об утверждении номенклатуры должностей медицинских работников и фармацевтических работников».
-
Приказ МЗ РФ от 23 июля 2010 г. № 541н. Единый квалификационный справочник должностей руководителей, специалистов и служащих, раздел Квалификационные характеристики должностей работников в сфере здравоохранения.
-
Федеральный закон от 25.12.2018 № 489 489-ФЗ «О внесении изменений в статью 40 Федерального закона "Об обязательном медицинском страховании в Российской Федерации" и Федеральный закон "Об основах охраны здоровья граждан в Российской Федерации" по вопросам клинических рекомендаций».
-
Приказ Минздрава России № 103н от 28.02.2019 г. «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации».
-
Приказ Минздрава России от 13.10.2017 № 804н "Об утверждении номенклатуры медицинских услуг".
-
Приказ Министерства здравоохранения РФ от 14 января 2019 г. № 4н «Об утверждении порядка назначения лекарственных препаратов, форм рецептурных бланков на лекарственные препараты, порядка оформления указанных бланков, их учета и хранения».
-
Медицинские противопоказания к проведению профилактических прививок препаратами национального календаря прививок: Методические указания.—М.: Федеральный центр госсанэпиднадзора Минздрава России, 2002.— 16 с.
-
«Методические рекомендации по выявлению, расследованию и профилактике побочных проявлений после иммунизации» (утв. Минздравом России 12.04.2019).
Примеры диагнозов:
-
Острый пиелонефрит, активная стадия. Функции почек сохранены.
-
Инфекция мочевыводящих путей, 1 эпизод, активная стадия. Функции почек сохранены
-
Инфекция мочевыводящих путей, рецидивирующее течение, активная стадия. Функции почек сохранены.
-
Рефлюкс-нефропатия. Вторичный хронический пиелонефрит. Стадия ремиссии. Хроническая болезнь почек 1 стадии.
-
Острый цистит, активная стадия. Функции почек сохранены.
Приложение Б. Алгоритмы действий врача
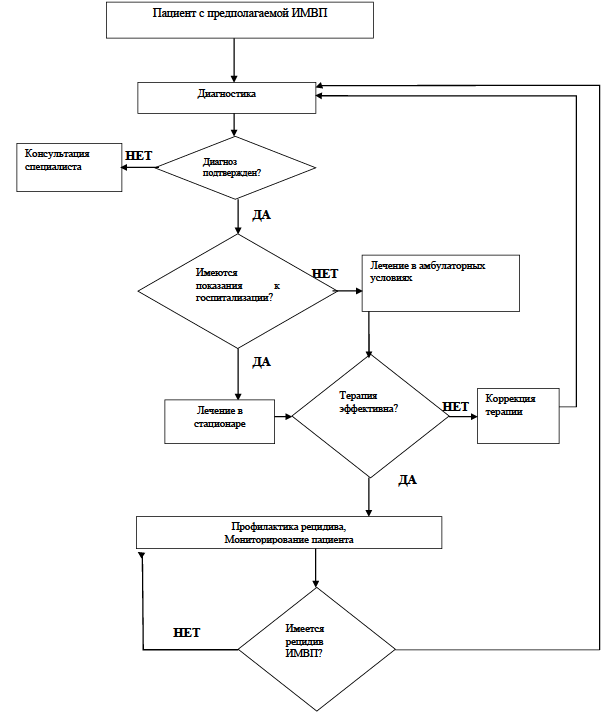
Приложение В. Информация для пациента
Мочевая система состоит из почек, мочеточников, мочевого пузыря и уретры. Мочевая система служит для образования, накопления и выведения мочи из организма.
Инфекции мочевой системы (мочевыводящих путей: пиелонефриты, циститы) вызываются бактериями.
Наиболее подвержены инфекциям мочевыводящих путей дети с:
-
Аномалиями развития мочевой системы
-
Нарушениями функции мочевого пузыря
-
Мальчики с фимозом.
Признаки, которые могут отмечаться у детей с инфекцией мочевыводящих путей:
У ребенка до 2 лет может наблюдаться неспецифическая картина:
-
Высокая температура тела без других видимых причин;
-
Рвота и понос;
-
Отсутствие аппетита;
-
Плач.
У ребенка старше 2 лет:
-
Высокая температура тела без других видимых причин
-
Частые и/или болезненные мочеиспускания;
-
Боль в спине или в боку.
При подозрении на инфекцию мочевыводящих путей необходимо обратиться к педиатру (или нефрологу).
Доктор назначает анализ мочи. Обратите внимание, что сбор анализа мочи нужно осуществить именно так, как предпишет врач.
Инфекцию мочевыводящих путей лечат антибиотиками. Крайне важно соблюдать режим и длительность лечения, которое назначит врач. Несвоевременно законченное лечение не будет эффективным.
Если инфекции мочевыводящих путей у ребенка повторяются, ему может потребоваться более углубленное обследование, которое назначит нефролог.
Приложение Г1 - Г... Шкалы оценки, вопросники
Не используются шкалы, вопросники и другие оценочные механизмы.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.