Злокачественные опухоли слюнных желез
 Версия: Клинические рекомендации РФ 2024 (Россия)
Версия: Клинические рекомендации РФ 2024 (Россия)
Общая информация
Краткое описание
-
Ассоциация онкологов России
-
Общероссийская общественная организация «Федерация специалистов по лечению заболеваний головы и шеи»
-
Некоммерческая организация "Ассоциация онкологических организаций Сибири и Дальнего Востока
-
Общероссийская общественная организация «Российское общество клинической онкологии»
-
Общероссийская общественная организация "Российское общество специалистов по опухолям головы и шеи"
Одобрено Научно-практическим Советом Минздрава РФ
– размещенные в Рубрикаторе после 1 января 2024 года – с 1 января 2025 года.
Определение заболевания или состояния (группы заболеваний или состояний)
Злокачественное новообразование околоушной слюнной железы (C07).
Злокачественное новообразование других и неуточненных больших слюнных желез (C08).
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Доброкачественные эпителиальные опухоли:
Злокачественные эпителиальные опухоли:
Мезенхимальные опухоли, специфичные для слюнных желез:
В соответствии с рекомендациями ВОЗ (2022) и САР (College of American Pathologists) трехступенчатая система градации (оценки степени злокачественности) (высоко-, умеренно-, низкодифференцированная карцинома) применима к следующим гистотипам:
Двухступенчатая система градации (low/high grade) используется для внутрипротоковой карциномы слюнных желез.
Для аденокистозного рака указывается доля солидного компонента: в целом, наличие более 30% солидных структур, ассоциировано с более агрессивным клиническим течением. В соответствии с актуальными международными рекомендациями следует указывать наличие и долю (любое количество) солидного компонента, как индикатор high grade трансформации аденокистозного рака. Помимо аденокистозного рака, high grade трансформация описана для следующих гистологических вариантов карцином слюнных желез:
Остальные карциномы слюнных желез градировать не рекомендуется, т.к. сам гистотип (нозологическая единица) опухоли ассоциированы с клиническим течением. Можно сгруппировать опухоли по их поведению, индолетным течением отличаются: секреторная карцинома, микросекреторная карцинома, базальноклеточная аденокарцинома, склерозирующая микрокистозная аденокарцинома, лимфоэпителиальная карцинома, сиалобластома. К опухолям с агрессивным клиническим поведением относятся: протоковая карцинома слюнных желез, миоэпителиальная карцинома, карцинома из плеоморфной аденомы, карциносаркома слюнных желез.
Основную группу новообразований слюнных желез составляют опухоли эпителиального происхождения (95 %), причем в 80–90 % случаев они развиваются в больших слюнных железах, в 10 % – в малых слюнных железах. Значительную роль в прогнозе имеет степень злокачественности опухоли.
Символ Т содержит следующие градации:
Символ сN указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах (ЛУ) по данным клинико-инструментальных исследований.
| NX | Недостаточно данных для оценки состояния регионарных ЛУ. |
|---|---|
| N0 | Нет признаков метастатического поражения регионарных ЛУ. |
| N1 | Метастазы в одном ЛУ на стороне поражения до 3 см и менее в наибольшем измерении, экстракапсулярное распространение (ENE) отсутствует. |
| N2 | Метастазы в одном ЛУ на стороне поражения более 3 см, но не более 6 см в наибольшем измерении и ENE отсутствует, или метастазы в нескольких ЛУ шеи на стороне поражения, до 6 см в наибольшем измерении и ENE отсутствует, или с обеих сторон либо с противоположной стороны до 6 см в наибольшем измерении и ENE отсутствует. |
| N2a | Метастазы в одном ЛУ на стороне поражения более 3 см, но не более 6 см в наибольшем измерении. |
| N2b | Метастазы в нескольких ЛУ на стороне поражения до 6 см в наибольшем измерении |
| N2c | Метастазы в ЛУ с обеих сторон или с противоположной стороны до 6 см в наибольшем измерении и ENE отсутствует. |
| N3 | Метастазы в ЛУ более 6 см в наибольшем измерении и ENE отсутствует или метастазы любого размера и ENE+. |
| N3a | Метастазы в ЛУ более 6 см в наибольшем измерении и ENE отсутствует. |
Символ pN указывает на наличие или отсутствие метастазов в регионарных ЛУ по данным планового патолого-анатомического исследования операционного материала.
| NX | Недостаточно данных для оценки состояния регионарных ЛУ. |
|---|---|
| N0 | Нет признаков метастатического поражения регионарных ЛУ. |
| N1 | Метастазы в одном ЛУ на стороне поражения до 3 см и менее в наибольшем измерении, экстракапсулярная инвазия (ENE) отсутствует. |
| N2 | Метастазы в одном ЛУ на стороне поражения ≤3 см и ENE+, более 3 см и менее 6 см в наибольшем измерении и ENE отсутствует, или метастазы в нескольких ЛУ шеи на стороне поражения, до 6 см в наибольшем измерении и ENE отсутствует, или с обеих сторон либо с противоположной стороны до 6 см в наибольшем измерении и ENE отсутствует. |
| N2a | Метастазы в одном ЛУ на стороне поражения ≤ 3 см и ENE+; или >3 см, но не более 6 см в наибольшем измерении, ENE отсутствует. |
| N2b | Метастазы в нескольких ЛУ на стороне поражения до 6 см в наибольшем измерении и ENE отсутствует. |
| N2c | Метастазы в ЛУ с обеих сторон или с противоположной стороны до 6 см в наибольшем измерении и ENE отсутствует. |
| N3 | Метастазы в ЛУ более 6 см в наибольшем измерении и ENE отсутствует, или в одном ипсилатеральном лимфатическом узле и ENE+, или множественные ипсилатеральные, контралатеральные или билатеральные метастазы с ENE+, или единственный контралатеральный метастаз любых размеров и ENE+. |
| N3a | Метастазы в ЛУ более 6 см в наибольшем измерении и ENE отсутствует. |
| N3b | Метастазы в одном ипсилатеральном лимфатическом узле и ENE+, или множественные ипсилатеральные, контралатеральные или билатеральные метастазы с ENE+, или единственный контралатеральный метастаз любых размеров и ENE+. |
Символ М указывает наличие или отсутствие отдаленных метастазов:
|
Стадия
|
I
|
II
|
III
|
IVА
|
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
T
|
T1
|
T2
|
T3
|
T1
|
T2
|
T3
|
Т1
|
Т2
|
Т3
|
Т4а
|
Т4а
|
T4a
|
||
|
N
|
N0
|
N0
|
N0
|
N1
|
N1
|
N1
|
N2
|
N2
|
N2
|
N0
|
N1
|
N2
|
||
|
M
|
M0
|
N0
|
M0
|
M0
|
M0
|
M0
|
M0
|
M0
|
M0
|
M0
|
M0
|
M0
|
||
|
Стадия
|
IVВ
|
IVС
|
||||||||||||
|
T
|
любое Т
|
T4b
|
любое T
|
|||||||||||
|
N
|
N3
|
любое N
|
любое N
|
|||||||||||
|
M
|
M0
|
M0
|
M1
|
|||||||||||
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
- воспалительные заболевания;
- алиментарные факторы;
- гормональные и генетические нарушения;
- курение [1].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
- анамнестических данных, а именно наличие новообразования;
- физикального обследования, включающего тщательный клинический осмотр, пальпацию образования и прилежащих тканей и регионарных ЛУ;
- цитологического исследования материала, полученного с помощью ТАБ при трепан-биопсии, cor-биопсии, инцизионной или эксцизионной биопсии(первичной опухоли, увеличенных или подозрительных ЛУ);
- патолого-анатомическое исследование биопсийного (операционного) материала тканей слюнной железы;
- инструментального обследований, включая ультразвуковое исследование (УЗИ) мягких тканей лица, дна полости рта, УЗИ шеи, компьютерную томографию (КТ)/ магнитно-резонансную томографию (МРТ), позитронно-эмиссионную компьютерную томографию, совмещенную с компьютерной томографией (ПЭТ-КТ) [5].
1. Жалобы и анамнез
- Рекомендуется тщательный сбор жалоб и анамнеза у всех пациентов при подозрении на злокачественное новообразование слюнных желез с целью выявления факторов, которые могут повлиять на выбор тактики лечения [6][7].
2. Физикальное обследование
- Рекомендуется при подозрении на злокачественное новообразование слюнных желез тщательный физикальный осмотр пациента, включающий осмотр и бимануальную пальпацию очага поражения и регионарных ЛУ, оценку нутритивного статуса и других аспектов с целью выявления факторов, которые могут повлиять на выбор тактики лечения [4,7].
3. Лабораторные диагностические исследования
- Рекомендуется в рамках проведения цитологического исследования микропрепарата тканей слюнной железы (см. 2.5) и патолого-анатомического исследования биопсийного (операционного) материала тканей слюнной железы (см. 3.1) с целью выявления факторов, которые могут повлиять на выбор тактики лечения и прогноз заболевания оценить следующие параметры с их отражением в заключении [92 – 95] :
- 1.размер опухоли (наибольший, или в трех взаимно перпендикулярных измерениях)
- 2.гистологический вариант (нозологическая единица) опухоли
- 3.степень дифференцировки (если применимо) или наличие high grade трансформации
- 4.наличие или отсутствие лимфоваскулярной и/или периневральной инвазии
- 5.рТ
- 6.рN (с указанием общего числа исследованных и пораженных лимфоузлов, наличия или отсутствия экстранодального распространения опухоли)
- 7.статус краев резекции (позитивный/негативный, минимальное расстояние от опухоли до края резекции)
4. Инструментальные диагностические исследования
- Рекомендуется всем пациентам с подозрением на злокачественное новообразование слюнных желез выполнить УЗИ мягких тканей, ЛУ шеи и ТАБ подозрительных ЛУ с целью верификация и определения распространенности [12].
- Рекомендуется при местно-распространенных процессах выполнить КТ или МРТ лицевого отдела черепа с внутривенным контрастированием в случае подозрения распространения опухоли на нижнюю/верхнюю челюсти, основание черепа, с целью исключения вовлечения указанных структур [7,13].
- Рекомендуется всем пациентам со злокачественными новообразованиями слюнных желез выполнить КТ органов грудной полости с целью выявления факторов, которые могут повлиять на выбор тактики лечения – для исключения отдаленных мета- стазов [7].
- Рекомендуется выполнить позитронную эмиссионную томографию всего тела с туморотропными РФП при подозрении на наличие отдаленных метастазов с целью уточнения распространенности [14].
- Рекомендуется всем пациентам с подозрением на злокачественное новообразование слюнных желез выполнить тонкоигольную аспирационную биопсию (ТАБ) под УЗИ-навигацией первичной опухоли и подозрительных ЛУ с последующим цитологическим исследованием микропрепарата тонкоигольной аспирационной биопсии в целях дифференциальной диагностики с доброкачественными новообразованиями, определения степени распространенности опухолевого процесса [12,15].
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Выбор метода лечения
- Рекомендуется рассматривать хирургическое вмешательство как основной метод радикального лечения пациентов с эпителиальными злокачественными новообразованиями слюнных желез [16,17].
- При стадиях T1–T2, N0 рекомендовано полное хирургическое удаление первичной опухоли. В случае выявления при плановом патолого-анатомическом исследовании операционного материала тканей слюнной железы аденокистозного рака, мукоэпидермоидного рака низкой степени дифференцировки, неблагоприятных гистологических признаков (положительные края, периневральная инвазия) рекомендовано проведение послеоперационной дистанционной лучевой терапии (ДЛТ) [16,18].
- При стадиях T1–2, N+M0 рекомендовано полное хирургическое удаление первичной опухоли в сочетании с лимфаденэктомией шейной с последующим проведением в послеоперационном периоде ДЛТ [16,19].
- При стадиях T3–4a, N0 M0 рекомендовано полное хирургическое удаление первичной опухоли, в случае аденокистозного, протокового рака и аденокрациномы – в сочетании с лимфаденэктомией шейной, в послеоперационном периоде рекомендовано проведение ДЛТ [16].
- При стадиях T3–4a, N0 M0 в случае выявления при плановом патолого-анатомическом исследовании операционного материала неблагоприятных гистологических признаков (низкодифференцированная опухоль, положительные края, периневральная инвазия, сосудистая эмболия) рекомендовано рассмотреть вопрос о проведении одновременной химиолучевой терапии (ХЛТ) [7].
- При стадии T3–4a, N + M0 рекомендовано полное хирургическое удаление первичной опухоли в сочетании с лимфаденэктомией шейной с последующим проведением в послеоперационном периоде ДЛТ [16].
- При стадии T3–4a, N + M0 в случае выявления при плановом патолого-анатомическом исследовании операционного материала тканей слюнной железы неблагоприятных гистологических признаков (низкодифференцированная опухоль, положительные края, периневральная инвазия, опухолевые эмболы в сосудах) рекомендовано рассмотреть вопрос о проведении одновременной ХЛТ [7,13]
- При невозможности выполнения радикального оперативного вмешательства на первом этапе всем пациентам рекомендовано проведение ЛТ или одновременной ХЛТ с учетом общего состояния пациента [7].
- При стадии T4b рекомендована ЛТ или одновременная ХЛТ с учетом общего состояния пациента [16].
- При локорегионарном рецидиве заболевания без предшествующей лучевой терапии (ЛТ) рекомендовано полное хирургическое удаление с решением вопроса о ЛТ/ХЛТ. При невозможности выполнения радикального оперативного вмешательства рекомендовано рассмотреть вопрос о ЛТ/ХЛТ или лекарственного лечения [7].
- При локорегионарном рецидиве после ЛТ рекомендовано полное хирургическое удаление с решением вопроса о повторной ЛТ/ХЛТ. При невозможности выполнения радикального оперативного вмешательства рекомендовано рассмотреть вопрос о повторной ЛТ [7].
2. Принципы ЛТ
- В случае назначения ЛТ в самостоятельном варианте рекомендована дистанционная ЛТ при поражении мягких тканей в следующем режиме - первичный очаг и клинически определяемые регионарные метастазы (лимфоузлы размером ≥1см или с наличием центрального некроза) - СОД 66–70 Гр. Профилактическое облучение регионарных зон шеи (Ib - III уровень) со стороны поражения, при отсутствии клинически определяемых метастазов проводится при всех низкодифференцированных или местно-распространенных (Т3-4) опухолях, исключение составляют ацинозноклеточный и аденокистозный рак. При наличии пораженных лимфоузлов в зону облучения включаются лимфоузлы Ib - V уровней. Элективное облучение противоположной половины шеи включая I - III уровни проводится при наличии метастазов в нескольких регионарных лимфоузлах шеи на стороне поражение и при злокачественных опухолях подчелюстной слюнной железы до СОД 50Гр.
Лучевая терапия осуществляется в режиме РОД 2 Грей (Гр)/фракция, 5 раз в неделю в течение 6–7 недель; [1-4, 96]
- В качестве послеоперационного облучения при наличии одного или нескольких неблагоприятных гистологических признаков (низкодифференцированная опухоль, положительные или близкорасположенные края резекции, периневральная инвазия, сосудистая эмболия, метастазы в регионарные лимфоузлы, Т3-4а, аденокистозный рак, нарушение целостности опухолевого узла во время удаления) рекомендована дистанционная ЛТ в следующем режиме: на ложе удаленной опухоли, с формированием дополнительного объема при наличии периневральной инвазии включающего канал лицевого нерва до коленчатого ганглия, язычного и подъязычного нерва вплоть до основания черепа - СОД 50 - 66Гр. Профилактическая послеоперационная лучевая терапия на регионарные зоны (уровень I-III) проводится при всех злокачественных опухолях подчелюстной слюнной железа (кроме ацинозно-клеточной и аденокистозной опухоли в стадии Т1)- СОД 50Гр. Во всех остальных случаях необходимость профилактического облучения зависит от стадии, гистологического подтипа и локализации опухоли. При наличии клинически определяемых метастазов в объём облучения включаются лимфоузлы I - V уровней - СОД 50-60Гр. Рекомендуемый интервал между оперативным вмешательством и сроком начала послеоперационной ЛТ 6-8 недель.
Лучевая терапия проводится в режиме РОД 2 Грей (Гр)/фракция, 5 раз в неделю в течение 5–6,5 недель; [1-4, 96]
- В качестве одновременной ХЛТ рекомендовано назначение цисплатина**+ ЛТ с соблюдением следующего режима: ЛТ на первичный очаг (70 Гр) и ЛУ (50 Гр) – фракция 2 Гр/сут ежедневно (понедельник – пятница) в течение 7 нед.; Цисплатин** в дозе 100 мг/м² на фоне гипергидратации в 1, 22 и 43-й дни ЛТ (суммарная доза во время ЛТ – 300 мг/м²) [25].
В случае выявления отдаленных метастазов и состояния пациента 0–3 по шкале оценки общего состояния онкологического больного по версии Восточной объединенной группы онкологов (ECOG) рекомендовано проведение лекарственной терапии, или выжидательная тактика (при медленной прогрессии опухоли), или селективная метастазэктомия, или антиандрогенная терапия при наличии гиперэкспрессии рецепторов к андрогенам [7,13]
При рецидивных неоперабельных опухолях или наличии инкурабельных отдаленных метастазов рекомендованными предпочтительными режимами ХТ являются:
- #паклитаксел** 175 мг / м2 в / в в 1-й день (3-часовая инфузия) + карбоплатин** AUC 5-6 в / в в 1-й день, каждые 3 нед. [26,89];
- Доксорубицин** 50 мг/м2 в 1 день + #блеомицин** 30 мг в/в в 1-5 дни + цисплатин** 20 мг/м2 1-5 дни каждые 3 нед. [27].
- Доксорубицин** 60мг/м2 в/в в 1-й день + #блеомицин** 10мг в/в в 1–5-й дни + #винкристин** 1,4 мг/м2 в/в в 1-й и 8-й дни, каждые 3 нед. [28]
- Цисплатин** 50мг/м2 в/в + доксорубицин** 50мг/м2 в/в + #циклофосфамид** 500мг/м2 в/в в 1-й день каждые 4 нед. [90].
При рецидивных неоперабельных опухолях или наличии инкурабельных отдаленных метастазов рекомендованными дополнительными режимами ХТ являются:
4. Принципы хирургического лечения
- Рекомендована оценка всех пациентов до лечения врачом-онкологом, специализирующимся на опухолях головы и шеи, которому рекомендовано предпринять следующие действия:
Хирургическое вмешательство не следует модифицировать на основании клинического ответа, полученного до лечения, при настоящем осмотре (регрессии опухоли), за исключением случаев прогрессии опухоли, которая вынуждает проводить более обширную операцию для охвата всей опухоли во время окончательной резекции [7,29]
Комментарии:
Удаление первичного очага.
Края резекции.
5. Обезболивание
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- Всем пациентам со злокачественными новообразованиями слюнных желез рекомендовано проведение пререабилитации, так как она значительно ускоряет функциональное восстановление, сокращает сроки пребывания в стационаре после операции и снижает частоту развития осложнений и летальных исходов на фоне лечения онкологического заболевания. Пререабилитация включает в себя физическую подготовку, психологическую и нутритивную поддержку, информирование пациентов [32].
- Пациентам со злокачественными новообразованиями слюнных желез, в особенности тем из них, у которых имеется выраженная мышечная слабость и высокая утомляемость, рекомендованы занятия лечебной физкультурой. Физическая пререабилитация, как правило, состоит из аэробной нагрузки средней интенсивности, которая улучшает толерантность к физическим нагрузкам, улучшает качество жизни и увеличивает тонус мышц [33].
- Пациентам со злокачественными новообразованиями слюнных желез, которым назначено хирургическое лечение, рекомендовано проведение лечебной физкультуры на предоперационном этапе, так как это уменьшает общее число осложнений в послеоперационном периоде, снижает частоту развития лимфедемы [34].
- Пациентам со злокачественными новообразованиями слюнных желез, которым назначено комплексное противоопухолевое лечение, рекомендованы программы профилактической гимнастики и обучение тактике глотания до начала лечения, так как может уменьшить нарушения глотания при проведении данного вида лечения [35,36]
- Нутритивно-метаболическая реабилитация в предоперационном периоде рекомендована при наличии хотя бы одного из указанных факторов: непреднамеренном снижении веса за последние 3 месяца (потеря 10 % и более), индексе массы тела менее 18,5 кг/м2, ухудшении возможности приема пищи за последнюю неделю, низкого объема пищи (калорийность менее 1500 ккал/сутки) [37].
- При невозможности перорального приема пищи пациентом рекомендуется зондовое, парентеральное или смешанное питание согласно расчетной потребности [37– 39]
- При хирургическом лечении пациента рекомендовано выполнение протоколов Fast track rehabilitation («быстрый путь») и Enhanced recovery after surgery (ускоренное восстановление после операции), в которые входит комплексное обезболивание, раннее начало кормления тяжелобольного пациента через рот и/или назогастральный зонд, отказ от рутинного использования катетеров и дренажей, ранняя мобилизация пациентов с первых-вторых послеоперационных су- ток (активизация и вертикализация), с целью уменьшения длительности пребывания пациента в стационаре, снижения числа нехирургических осложнений и общего количества послеоперационных осложнений [41,42]
- Ранняя мобилизация (вертикализация, выполнение комплекса упражнений лечебной физкультуры для укрепления мышц лица и шеи с аэробной нагрузкой, упражнениями лечебной физкультуры, направленными на уменьшение спастики, под контролем инструктора) рекомендована все пациентам при хирургическом лечении с целью улучшения функциональных возможностей пациента [43,44]
- Купирование болевого синдрома в раннем послеоперационном периоде в сочетании с и физиотерапией, упражнений для укрепления мышц лица и шеи, лечением положением, методами психологической коррекции, чрескожной электростимуляцией и применением акупунктуры рекомендовано всем пациентам с ЗНО слюнных желез с целью улучшения функциональных результатов [44].
- Массаж медицинский в послеоперационном периоде у пациентов, перенесших операцию на органах головы и шеи, рекомендован с целью улучшения качества жизни [45].
- В предоперационном периоде и в раннем послеоперационном периоде рекомендована консультация логопеда, который назначает комплекс специальных упражнений лечебной физкультуры при дисфагии для восстановления функции глотания и обучения пациента способности говорить. Для логопедической реабилитации существует ряд ограничений: не рекомендуется проводить активную функциональную тренировку в раннем послеоперационном периоде, на этапе первичного заживления и при возникновении свищей. Недопустимо нарушение режима функциональных тренировок [46].
- Выполнение комплексов упражнений для укрепления мышц лица и шеи, лечебной физкультуры при дисфагии после проведения радикального хирургического лечения по поводу рака головы и шеи рекомендовано всем пациентам с целью быстрейшего восстановления физической формы и улучшения качества жизни пациента [51].
- Поддержание стабильной массы тела и активный образ жизни всем пациентам с злокачественными новообразованиями слюнных желез после проведения хирургического лечения рекомендованы с целью увеличения общей выживаемости. Режим – аэробная нагрузка умеренной интенсивности 3–5 раз в неделю (суммарно 150 мин в неделю) в сочетании с тренировками на сопротивление 2–3 раза в неделю. Упражнения на сопротивление должны вовлекать основные группы мышц (8–10 групп мышц, 8–10 повторений, 2 подхода). Каждый сеанс должен включать разминку и заминку [52].
4. II этап реабилитации при хирургическом лечении
- С целью преодоления тризма – тонического спазма группы жевательных мышц, который приводит к ограничению подвижности височно-нижнечелюстного сустава, – всем пациентам после проведения хирургического лечения рекомендованы упражнения, регулирующие степень открытия рта. Это статические, динамические упражнения и упражнения на сопротивление. Движения выполняются не только в плоскости опускания и поднятия челюсти. Для восстановления функции необходимы также другие движения: боковые, передние, задние и круговые [53].
- Рекомендовано раннее выявление и начало терапии при лимфедеме области головы и шеи, так как помогает избежать проблем, связанных с речью, дыханием, глотанием. Наибольшая эффективность терапии лимфедемы после комбинированного лечения опухолей головы и шеи отмечается при использовании всего комплекса противозастойной терапии (complete decongestive therapy) [54].
- Полная противоотечная терапия (complete decongestive therapy) рекомендована в качестве «золотого стандарта» в лечении лимфедемы всех локализаций. Она включает упражнения для укрепления мышц лица и шеи, компрессионную терапию, массаж шеи, волосистой части головы и лица медицинский и уход за кожей [55].
- В лечении лимфедемы области головы и шеи в качестве ведущего метода рекомендован массаж шеи, волосистой части головы и лица медицинский [56].
- С целью лечения лимфедемы рекомендована низкочастотная магнитотерапия в сочетании с полной противоотечной терапией [57].
- Использование низкоинтенсивной лазеротерапии (внутривенного облучения крови) в комбинации с полной противозастойной терапией рекомендовано с целью ускорения снижения выраженности отека [58].
5. Реабилитация при химиотерапии, комбинированной химиолучевой терапии
- Всем пациентам, получающим послеоперационную ХТ, рекомендовано выполнение упражнений с нагрузкой с целью уменьшения слабости, улучшения качества жизни и психологического состояния. Раннее начало физических нагрузок на фоне ХТ рекомендовано в качестве профилактики мышечной слабости, возникновения и прогрессирования саркопении, снижения толерантности к физической нагрузке [60].
- Всем пациентам, получающим ХТ, рекомендовано проведение комплекса упражнений лечебной физкультуры с включением аэробной нагрузки, элементов Тайчи в течение 4 месяцев на фоне ХТ с целью увеличения жизненной емкости легких, насыщенности крови кислородом, силы мышц, объема движений в крупных суставах, снижения индекса массы тела [61].
- Для уменьшения утомляемости и повышения выносливости на фоне проведения ХЛТ рекомендовано проведение упражнений лечебной физкультуры, направленных на уменьшение спастики. Оптимальный эффект дают аэробные упражнения средней интенсивности в сочетании с упражнениями на сопротивление [62].
- Сочетание упражнений лечебной физкультуры с психологической поддержкой рекомендовано для лечения слабости на фоне ХТ [63].
- Рекомендуется применение низкоинтенсивной лазеротерапии (внутривенного облучения крови) для лечения периферической полинейропатии, возникщей на фоне ХТ [64].
- Рекомендована низкочастотная магнитотерапия для лечения периферической полинейропатии, возникщей на фоне ХТ [65].
- Рекомендована чрескожная электростимуляция в течение 1 часа с перерывом в 5 часов в день на протяжении 4 недель для лечения полинейропатии на фоне химиотерапии [66].
- Рекомендована низкоинтенсивная лазеротерапия (внутривенное облучение крови) в профилактике мукозитов полости рта на фоне ХТ [67].
- Рекомендовано проведение низкоинтенсивной лазеротерапии (внутривенного облучения крови) для лечения мукозита полости рта, возникшего на фоне ХТ [68].
6. Реабилитация при лучевой терапии
- Через 3 дня после начала лучевой терапии рекомендовано подключить низкоинтенсивную лазеротерапию (внутривенное облучение крови), 3 дня в неделю для профилактики лучевого дерматита [69].
Госпитализация
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы).
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, поликлиническое отделение онкологического диспансера (онкологической больницы) для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы) должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или поликлинического отделения онкологического диспансера (онкологической больницы организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер (онкологическую больницу) или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественных новообразований не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
Сроки проведения диагностических инструментальных и лабораторных исследований в случае подозрения на онкологическое заболевание не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
Диагноз онкологического заболевания устанавливается врачом-онкологом, а при злокачественных новообразованиях лимфоидной, кроветворной и родственных им тканей, входящих в рубрики МКБ-10 С81-С96, также врачом-гематологом.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета) направляет пациента в онкологический диспансер (онкологическую больницу) или иную медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями, в том числе подведомственную федеральному органу исполнительной власти (далее – федеральная медицинская организация), для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания), определения тактики лечения, а также в случае наличия медицинских показаний для оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При онкологических заболеваниях, входящих в рубрики С37, C38, C40–C41, C45–C49, С58, D39, C62, C69–C70, С72, C74 МКБ-10, а также соответствующих кодам международной классификации болезней – онкология (МКБ-О), 3 издания 8936, 906-909, 8247/3, 8013/3, 8240/3, 8244/3, 8246/3, 8249/3 врач-онколог онкологического диспансера (онкологической больницы) или иной медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, для определения лечебной тактики организует проведение консультации или консилиума врачей, в том числе с применением телемедицинских технологий, в федеральных государственных бюджетных учреждениях, подведомственных Министерству здравоохранения Российской Федерации, оказывающих медицинскую помощь (далее в целях настоящего Порядка – национальные медицинские исследовательские центры).
В сложных клинических случаях для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания) в целях проведения оценки, интерпретации и описания результатов врач-онколог организует направление:
- цифровых изображений, полученных по результатам патоморфологических исследований, в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр)[1] путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
- цифровых изображений, полученных по результатам лучевых методов исследований, в дистанционный консультативный центр лучевой диагностики, путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
- биопсийного (операционного) материала для повторного проведения патоморфологических, иммуногистохимических, и молекулярно-генетических исследований: в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр), а также в молекулярно-генетические лаборатории для проведения молекулярно-генетических исследований.
Тактика лечения устанавливается консилиумом врачей, включающим врачей-онкологов, врача-радиотерапевта, врача-нейрохирурга (при опухолях нервной системы) медицинской организации, в составе которой имеются отделения хирургических методов лечения злокачественных новообразований, противоопухолевой лекарственной терапии, радиотерапии (далее – онкологический консилиум), в том числе онкологическим консилиумом, проведенным с применением телемедицинских технологий, с привлечением при необходимости других врачей-специалистов.
Диспансерное наблюдение врача-онколога за пациентом с выявленным онкологическим заболеванием устанавливается и осуществляется в соответствии с порядком диспансерного наблюдения за взрослыми с онкологическими заболеваниями.
С целью учета информация о впервые выявленном случае онкологического заболевания направляется в течение 3 рабочих дней врачом-онкологом медицинской организации, в которой установлен соответствующий диагноз, в онкологический диспансер или организацию субъекта Российской Федерации, исполняющую функцию регистрации пациентов с впервые выявленном злокачественным новообразованием, в том числе с применением единой государственной информационной системы в сфере здравоохранения.
Специализированная, в том числе высокотехнологичная, медицинская помощь в медицинских организациях, оказывающих медицинскую помощь взрослому населению при онкологических заболеваниях, оказывается по медицинским показаниям, предусмотренным положением об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Специализированная, за исключением высокотехнологичной, медицинская помощь в медицинских организациях, подведомственных федеральным органам исполнительной власти, оказывается по медицинским показаниям, предусмотренным пунктом 5 порядка направления пациентов в медицинские организации и иные организации, подведомственные федеральным органам исполнительной власти, для оказания специализированной (за исключением высокотехнологичной) медицинской помощи, предусмотренного в приложении к положению об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Сроки ожидания оказания специализированной (за исключением высокотехнологичной) медицинской помощи не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
При наличии у пациента с онкологическим заболеванием медицинских показаний для проведения медицинской реабилитации врач-онколог организует ее проведение в соответствии с порядком организации медицинской реабилитации взрослых.
При наличии у пациента с онкологическим заболеванием медицинских показаний к санаторно-курортному лечению врач-онколог организует его в соответствии порядком организации санаторно-курортного лечения.
Паллиативная медицинская помощь пациенту с онкологическими заболеваниями оказывается в соответствии с положением об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья.
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1) наличие осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения (хирургическое вмешательство, ЛТ, лекарственная терапия и т.д.) онкологического заболевания.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, ДЛТ и другие виды ЛТ, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
4) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Рекомендуется в целях своевременного выявления и предупреждения осложнений и обострений заболевания соблюдать следующую периодичность обследований пациентов после завершения лечения - в первые 1–2 года обследование пациента с рекомендуется проводить каждые 3–6 месяца, на сроке 3–5 лет – 1 раз в 6–12 месяцев, после 5 лет с момента операции обследование проводятся ежегодно или при появлении жалоб. У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен. Обследование пациента включает следующие мероприятия:
- Рекомендуется наблюдение всех пациентов до, во время и после лучевой терапии у врача-стоматолога с целью оценки состояния полости рта, риска развития кариеса и пародонтоза, удаления «проблемных» зубов, профилактики радиоиндуцированного остеонекроза, устранения потенциальных источников инфекции, мотивации пациента к поддержанию гигиены полости рта. Проблемные зубы должны быть удалены не менее чем за 2 недели до начала специализированного лечения [72–77].
- Рекомендуется всем пациентам после окончания лучевой терапии с целью профилактики кариеса применять ежедневно длительно местные средства с фтором – 0,4% гель с фторидом олова или 1,1 % гель с фторидом натрия (NaF) (эффективность ниже фторида олова), или комбинацию - 0,4% гель с фторидом олова, 0,32% зубной порошок с NaF и препараты-заменители слюны с фосфатом кальция [78,79].
Информация
Источники и литература
-
Клинические рекомендации Ассоциации онкологов России
- Клинические рекомендации Ассоциации онкологов России - 1. Давыдов М.И. Энциклопедия клинической онкологии. – М. : ООО «РЛС-2004», 2004. 2. Каприн А.Д., Старинский В.В. Злокачественные новообразования в России в 2015 году (заболеваемость и смертность). – М.: МНИОИ им. П. А. Герцена – филиал ФГБУ «НМИРЦ» Минздрава России, 2017. – С.11, 15, 16. 3. CANCER TODAY. URL: https://gco.iarc.fr/today/online-analysis-ta- ble? v=2018&mode=cancer&mode_population=continents&population=900&populations =908_643&key=asr&sex=0&cancer=2&type=0&statistic=5&prevalence=0&population_ group=0&ages_group[]=0&ages_group[. 4. Snyderman N.L., Johnson J.T. Salivary gland tumors. Diagnostic characteristics of the common types. Postgrad Med. 1987 Oct. 82(5):105–8, 110–2. 5. Calearo C, Pastore A, Storchi OF, Polli G. Parotid gland carcinoma: analysis of prognos-tic factors. Ann Otol Rhinol Laryngol 1998; 107:969–973. 6. Bobati S.S., Patil B.V., Dombale V.D. Histopathological study of salivary gland tumors J Oral Maxillofac Pathol. 2017 Jan-Apr; 21(1): 46–50. 7. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Salivary Gland Tumors. Version 4.2024. 8. Hocwald, E., Korkmaz, H., Yoo, G. H., Adsay, V., Shibuya, T. Y., Abrams, J., & Jacobs, J. R. (2001). Prognostic Factors in Major Salivary Gland Cancer. The Laryngoscop. 9. Stodulski, D., Mikaszewski, B., & Stankiewicz, C. (2011). Are all prognostic factors in parotid gland carcinoma well recognized? European Archives of Oto-Rhino-Laryngology, 269(3), 1019– 1025. 10. Suzuki M., Ichimiya I., Matsushita F., et al. Histological features and prognosis of pa-tients with mucoepidermoid carcinoma of the parotid gland. J Laryngol Otol. 1998 Oct. 112(10):944–7. 11. Ghosh-Laskar S., Murthy V., Wadasadawala T., Agarwal J., Budrukkar A., Patil N., et al. Mucoepidermoid carcinoma of the parotid gland: Factors affecting outcome. Head Neck. 2011 Apr. 33(4):497–503. 12. De Bondt R. B. J. et al. Detection of lymph node metastases in head and neck cancer: a meta-analysis comparing US, USgFNAC, CT and MR imaging //European journal of ra- diology. – 2007. – Т. 64. – №. 2. – С. 266-272. 13. Rice D.H., Becker T. Magnetic resonance imaging of the salivary glands. A comparison with computed tomographic scanning. Arch Otolaryngol Head Neck Surg. 1987 Jan. 113(1):78–80.14. Ruhlmann V., Poeppel T.D., Veit J. et al. Diagnostic accuracy of 18F–FDG PET/CT and MR imaging in patients with adenoid cystic carcinoma. BMC Cancer. 2017; 17: 887. 15. Liu C. C. et al. Sensitivity, specificity, and posttest probability of parotid fine-needle as- piration: a systematic review and meta-analysis //Otolaryngology--Head and Neck Sur- gery. – 2016. – Т. 154. – №. 1. – С. 9-23. 16. Wang X., Luo Y., Li M. et al., Management of salivary gland carcinomas - a review. Oncotarget, 2017, Vol. 8, (No. 3), pp: 3946-3956. 17. Johns M.E. Parotid cancer: a rational basis for treatment. Head Neck Surg. 1980 NovDec. 3(2):132–41. 18. Chen AM, Garcia J, Granchi PJ. Late recurrence from salivary gland cancer: when does “cure” mean cure? Cancer. 2008;112(2):340-4. 19. Sood, S., McGurk, M., & Vaz, F. (2016). Management of Salivary Gland Tumours: Unit- ed Kingdom National Multidisciplinary Guidelines. The Journal of Laryngology & Otol- ogy, 130(S2), S142–S149. 20. Boon E, van Boxtel W, Buter J, et al. Androgen deprivation therapy for androgen recep-tor-positive advanced salivary duct carcinoma: A nationwide case series of 35 patients in The Netherlands. Head Neck 2018;40:605-613. 21. Haddad, R., Colevas, A. D., Krane, J. F., Cooper, D., Glisson, B., Amrein, P. C., … Pos- ner, M. (2003). Herceptin in patients with advanced or metastatic salivary gland carcino- mas. A phase II study. Oral Oncology, 39(7), 724–727. 22. Perissinotti A. J. et al. The role of trastuzumab in the management of salivary ductal car- cinomas //Anticancer research. – 2013. – Т. 33. – №. 6. – С. 2587-2591. 23. Terhaard C. H. J. et al. The role of radiotherapy in the treatment of malignant salivary gland tumors //International Journal of Radiation Oncology* Biology* Physics. – 2005. – Т. 61. – №. 1. – С. 103-111. 24. Cheraghlou S, Kuo P, Mehra S et al. Adjuvant therapy in major salivary gland cancers: Analysis of 8580 patients in the National Cancer Database. Head Neck. 2018 Jul;40(7):1343-1355. 25. Adelstein, D. J., Li, Y., Adams, G. L., Wagner, H., Kish, J. A., Ensley, J. F., … Foras-tiere, A. A. (2003). An Intergroup Phase III Comparison of Standard Radiation Therapy and Two Schedules of Concurrent Chemoradiotherapy in Patients With Unresectable S. 26. Airoldi M, Fornari G, Pedani F, et al. Paclitaxel and carboplatin for recurrent sali-vary gland malignancies. Anticancer Res 2000; 20: 3781–83. 27. Dick Haan, L. D., De Mulder, P. H. M., Vermorken, J. B., Schornagel, J. H., Vermey, A.,& Verweij, J. (1992). Cisplatin-based chemotherapy in advanced ad-enoid cystic carcinoma of thehead and neck. Head & Neck, 14(4), 273–277. 28. Болотина Л. В., Бяхов М. Ю., Владимирова Л. Ю., Деньгина Н. В., Михайличенко Т. Д., Новик А. В. и соавт. Практические рекомендации по лекарственному лечению опухолей головы и шеи // Злокачественные опухоли. – 2015. – №. 4, спецвыпуск. – С. 47–54. 29. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Principles of Surgery. Version 1.2024. 30. Domenick N.A., Johnson J.T. Parotid tumor size predicts proximity to the facial nerve. Laryngoscope. 2011 Nov. 121(11):2366–70. 31. Ord, R. A., & Ghazali, N. (2017). Margin Analysis. Oral and Maxillofacial Surgery Clin- ics of North America, 29(3), 315–324. 32. Silver J.A., Baima J. Cancer prehabilitation: anopportunity to decrease treatment related morbidity, increase cancer treatment options, and improve physical and psychological health outcomes. Am J Phys Med Rehabil 2103; 92: 715–727. 33. Buffart L.M., Sweegers M.G., May A.M., et al. Targeting Exercise Interventions to Pa- tients With Cancer in Need: An Individual Patient Data Meta-Analysis. J Natl Cancer Inst. 2018 Nov 1;110(11):1190–1200. DOI: 10.1093/jnci/djy161. 34. Paskett ED, Dean JA, Oliveri JM, Harrop JP. Cancer-related lymphedema risk fac-tors, diagnosis treatment and impact: a review. J Clinl Oncol. 2012;30(30):3726-3733. 35. Clarke P., Radford K., Coffey M., Stewart M. Speech and swallow rehabilitation in head and neck cancer: United Kingdom National Multidisciplinary Guidelines. J Laryngol Otol. 2016 May;130(S2):S176–S180. 36. Colevas A.D., Yom S.S., Pfister D.G., et al. NCCN Guidelines Insights: Head and Neck Cancers, Version 1.2018. J Natl Compr Canc Netw. 2018 May;16(5):479–490. DOI: 10.6004/jnccn.2018.0026. 37. Практические рекомендации по нутритивной поддержке у онкологических боль-ных / Снеговой А.В., Бесова Н.С., Веселов А.В., Кравцов С.А., Ларионова В.Б., Сельчук В.Ю. и соавт. Злокачественные опухоли. 2016. № 4. Спецвыпуск 2. С. 434-450. 38. Arends J., Bachmann P., Baracos V., et al. ESPEN guidelines on nutrition in cancer pa- tients. Clinical Nutrition. 2017;36: Pp. 11–48. Thompson KL, Elliott L, Fuchs-Tarlovsky V, Levin RM, Voss AC, Piemonte T. Oncology Evidence-Based Nutrition Practice Guideline for Adults. J Acad Nutr Diet. 2017 Feb;117(2):297-310.e47. doi: 10.1016/j.jand.2016.05.010. Epub 2016 Jul 16. 39. Kim W.S., Lee H.S., Park Y.M., et al. Surgical Outcomes of Parotid Cancer: A 10-Year Experience. Otolaryngol Head Neck Surg. 2012 Aug. 147(2 suppl):Pp. 180–181.40. Hubera G.F., Dort J.C. Reducing morbidity and complications after major head and neck cancer surgery: the (future) role of enhanced recovery after surgery protocols. Curr Opin Otolaryngol Head Neck Surg 2018. 41. Coyle, M. J., Main, B., Hughes, C., et al. (2016). Enhanced recovery after surgery (ERAS) for head and neck oncology patients. Clinical Otolaryngology, 41(2), 118–126. 42. Midgley A.W., Lowe D., Levy A.R., Mepani V., Rogers S.N. Exercise program design considerations for head and neck cancer survivors. Eur Arch Otorhinolaryngol. 2018;275(1):169– 179. 43. Guru K., Manoor U.K., Supe S.S. A comprehensive review of head and neck cancer re-habilitation: physical therapy perspectives. Indian J Palliat Care. 2012 May-Aug;18(2):87– 97. 44. Goel V., Nemade H., Raju K.V.V.N., Rao C.S. (2017) Physiotherapy and Head and Neck Cancers. J Nov Physiother 7:337. 45. Logemann J.A., Pauloski B.R., et al. Speech and Swallowing Rehabilitation for Head and Neck Cancer Patients. ONCOLOGY 11(5):651-659, 1997. 46. Wall L.R., Ward E.C., Cartmill B., Hill A.J. Physiological changes to the swallowing mechanism following (chemo)radiotherapy for head and neck cancer: a systematic review. Dysphagia 2013;28(4):481–93.
- Клинические рекомендации Ассоциации онкологов России - 47. Govender R., Smith C.H., Taylor S.A. et al. Swallowing interventions for the treatment of dysphagia after head and neck cancer: a systematic review of behavioural strategies used to pro-mote patient adherence to swallowing exercises. BMC Cancer 2017;17(1). 48. Zagari, P.R.P.P., Paulon, R.M.C., Farias, L.P. (2018). Rehabilitation After Tracheostomy. In: de Farias, T. (eds) Tracheostomy. Springer, Cham. https://doi.org/10.1007/978-3-319-67867-2_24 49. Starmer, H. M., Ayoub, N., Byward, C., Kizner, J., Le, Q., Hara, W., & Holsinger, F. C. (2017). The impact of developing a speech and swallow rehab program: Improving patient satis-faction and multidisciplinary care. The Laryngoscope, 127(11), 2578–2581. 50. Mina D.S., Alibhai S.M.H., Matthew A.G., Guglietti C.L., Steele J., Trachtenberg J., Ritvo P.G. Exercise in clinical cancer care: a call to action and program development de-scription. Curr Oncol, 2012;19(3), pp. e136–144. 51. Segal R., Zwaal C., Green E., Tomasone J.R., Loblaw A., Petrella T. Exercise for people with cancer: a clinical practice guideline. Curr Oncol. 2017;24(1):40-46. 52. Pauli N., Svensson U., Karlsson T., Finizia C. Exercise intervention for the treatment of trismus in head and neck cancer − a prospective two-year follow-up study. Acta Oncol. 2016 Jun;55(6):686-92.53. Smith B.G., Lewin J.S. Lymphedema management in head and neck cancer. Curr Opin Otolaryngol Head Neck Surg 2010;18(3):153–8. 54. Vignes S. Lymphedema: from diagnosis to treatment. Rev Med Interne 2017;38(2):97–105. 55. Doke K.N., Bowman L., Shnayder Y., et al. Quantitative clinical outcomes of therapy for head and neck lymphedema. Adv Radiat Oncol. 2018 Apr 27;3(3):366–371. 56. Tacani P.M., Franceschini J.P., Tacani R.E., et al. Retrospective study of the physical therapy modalities applied in head and neck lymphedema treatment. Head Neck. 2016 Feb;38(2):301–8. 57. Wigg J. Use and response to treatment using low level laser therapy. J Lymphoedema 2009;4(2):73–6. Lee N., Wigg J., Carroll J. D. The use of low level light therapy in the treatment of head and neck oedema. J Lymphoedema 2013;8(1):35–42. 58. Ткаченко Г.А. Клинико-психологическое исследование качества жизни больных, страда-ющих злокачественными новообразованиями челюстно-лицевой области. Вестник психо-терапии. 2012. № 44 (49). С. 57−63. 59. Zhao, S. G., Alexander, N. B., Djuric, Z., Zhou, J., Tao, Y., Schipper, M., … Jolly, S. (2015). Maintaining physical activity during head and neck cancer treatment: Results of a pilot controlled trial. Head & Neck, 38(S1), E1086–E1096. 60. Segal R., Zwaal C., Green E. et al. Exercise for people with cancer: a systematic review. Curr Oncol. 2017 Aug; 24(4): e290–e315. 61. Samuel SR, Maiya AG, Fernandes DJ, Guddattu V, Saxena PUP, Kurian JR, Lin PJ, Mustian KM. Effectiveness of exercise-based rehabilitation on functional capacity and quality of life in head and neck cancer patients receiving chemo-radiotherapy. Support Care Cancer. 2019 Oct;27(10):3913-3920. doi: 10.1007/s00520-019-04750-z. Epub 2019 Mar 27. 62. Mustian K.M., Alfano C.M., Heckler C., et al: Comparison of pharmaceutical, psycholog- ical, and exercise treatments for cancer-related fatigue: a meta-analysis. JAMA Oncol 2017;3:961–968. 63. Lee J.M., Look R.M., Turner C. et al. Low-level laser therapy for chemotherapy-induced peripheral neuropathy. J Clin Oncol 2012;30(15):90-91. 64. Rick O., von Hehn U., Mikus E., Dertinge H., Geiger G. Magnetic field therapy in pa-tients with cytostatics-induced polyneuropathy: A prospective randomized placebo-controlled phase-III study. Bioelectromagnetics, 2016:38(2), 85–94. 65. Gewandter J. S. et al. Wireless transcutaneous electrical nerve stimulation device for chemotherapy-induced peripheral neuropathy: an open-label feasibility study //Supportive Care in Cancer. – 2019. – Т. 27. – №. 5. – С. 1765-1774. 66. Oberoi S., Zamperlini-Netto G., Beyene J., Treister N.S., Sung L. Effect of prophylactic low level laser therapy on oral mucositis: a systematic review and meta-analysis. Send to PLoS One. 2014Sep 8;9(9):e107418. 67. Anschau, F., Webster, J., Capra, M. E. Z., de Azeredo da Silva, A. L. F., & Stein, A. T. (2019). Efficacy of low-level laser for treatment of cancer oral mucositis: a systematic re- view and meta-analysis. Lasers in Medical Science. doi:10.1007/s10103-019-. 68. Bensadoun R.J., Nair R.G. Low-level laser therapy in the management of mucositis and dermatitis induced by cancer therapy. Photomed Laser Surg. 2015;33(10):487–491. 69. Renehan A1, Gleave EN, Hancock BD et al. Long-term follow-up of over 1000 patients. Br J Surg. 1996 Dec;83(12):1750-4. 70. Решетов И.В., Славнова Е.Н., Волченко Н.Н. и др. Опухоли головы и шеи. Технологии лечения, реконструкции, реабилитации. Монография. − Москва, 2016. С. 514. 71. Walker M.P., Wichman B., Cheng A.L., Coster J., Williams K.B. Impact of radiotherapy dose on dentition breakdown in head and neck cancer patients. Pract Radiat Oncol 2011;1:142–148. 72. Little M., Schipper M., Feng F.Y., et al. Reducing xerostomia after chemo-IMRT for head- and-neck cancer: beyond sparing the parotid glands. Int J Radiat Oncol Biol Phys 2012;83:1007–1014. 73. Studer G., Glanzmann C., Studer S.P., et al. Risk-adapted dental care prior to intensity- modulated radiotherapy (IMRT). Schweiz Monatsschr Zahnmed 2011;121:216–229. 74. Murdoch-Kinch C.A., Zwetchkenbaum S. Dental management of the head and neck can- cer patient treated with radiation therapy. J Mich Dent Assoc 2011;93:28–37. 75. Epstein J.B., Thariat J., Bensadoun R.J., et al. Oral complications of cancer and cancer therapy: from cancer treatment to survivorship. CA Cancer J Clin 2012;62:400–422. 76. Lee I.J., Koom W.S., Lee CGet al. Risk factors and dose-effect relationship for mandibu- lar osteoradionecrosis in oral and oropharyngeal cancer patients. Int J Radiat Oncol Biol Phys 2009;75:1084–1091. 77. Sim, C. P. C., Walker, G. D., Manton, D. J., Soong, Y.-L., Wee, J. T. S., Adams, G. G., & Reynolds, E. C. (2018). Anticariogenic efficacy of a saliva biomimetic in head-and-neck cancer patients undergoing radiotherapy. Australian Dental Jour-nal.doi:10.11. 78. Al-Joburi W., Clark C., Fisher R. A comparison of the effectiveness of two systems for the prevention of radiation caries //Clinical preventive dentistry. – 1991. – Т. 13. – №. 5. – С. 15-19. 79. Tchekmedyian V, Sherman EJ, Dunn L, et al. Phase II study of lenvatinib in patients with progressive, recurrent or metastatic adenoid cystic carcinoma. J Clin Oncol 2019;37:1529-1537 80. Thomson DJ, Silva P, Denton K, et al. Phase II trial of sorafenib in advanced salivary adenoid cystic carcinoma of the head and neck. Head Neck 2015;37:182-18781. Lin VTG, Nabell LM, Spencer SA, et al. First-Line Treatment of Widely Metastatic BRAF-Mutated Salivary Duct Carcinoma With Combined BRAF and MEK Inhibition. J Natl Compr Canc Netw. 2018 Oct;16(10):1166-1170. doi: 10.6004/jnccn.2018.7056. 82. Marabelle A, Fakih MG, Lopez J, et al. 1192OAssociation of tumour mutational burden With outcomes in patients with select advanced solid tumours treated with pembrolizumab in KEYNOTE-158. Ann Oncol. (2019) 30:v477–8. doi: 10.1093/annonc/mdz253.018. 83. Elkrief A, Saleh R. Androgen deprivation therapy for metastatic salivary gland cancer. CMAJ. 2018 Aug 20;190(33):E985-E987. doi: 10.1503/cmaj.180286. PMID: 30127038; PMCID: PMC6102105. 84. Drilon A, Laetsch TW, Kummar S, et al. Efficacy of larotrectinib in TRK fusion-positive cancers in adults and children. N Engl J Med 2018;378:731-739. 85. Hong DS, Bauer TM, Lee JJ, et al. Larotrectinib in adult patients with solid tumours: a multi-centre, open-label, phase I dose-escalation study. Ann Oncol 2019;30:325-331. 86. Doebele RC, Drilon A, Paz-Ares L, et al. Entrectinib in patients with advanced or metastatic NTRK fusion-positive solid tumours: integrated analysis of three phase 1-2 trials. Lancet Oncol 2020;21:271-282. 87. Airoldi M, Pedani F, Succo G, et al. Phase II randomized trial comparing vinorelbine versus vinorelbine plus cisplatin in patients with recurrent salivary gland malignancies. Cancer 2001;91:541-547 88. Nakano K, Sato Y, Sasaki T, et al. Combination chemotherapy of carboplatin and paclitaxel for advanced/metastatic salivary gland carcinoma patients: differences in responses by different pathological diagnoses. Acta Otolaryngol. 2016;136:948-951. 89. Licitra L, Cavina R, Grandi C, Pet al. Cisplatin, doxorubicin and cyclophosphamide in advanced salivary gland carcinoma. A phase II trial of 22 patients. Ann Oncol 1996;7:640-642. 90. Laurie SA, Siu LL, Winquist E, et al. A phase 2 study of platinum and gemcitabine in patients with advanced salivary gland cancer: a trial of the NCIC Clinical Trials Group. Cancer 2010;116:362-368. 91. Calearo C, Pastore A, Storchi OF, Polli G. Parotid gland carcinoma: analysis of prognos-tic factors. Ann Otol Rhinol Laryngol 1998; 107:969–973. 92. Bobati S.S., Patil B.V., Dombale V.D. Histopathological study of salivary gland tumors J Oral Maxillofac Pathol. 2017 Jan-Apr; 21(1): 46–50. 93. Hocwald, E., Korkmaz, H., Yoo, G. H., Adsay, V., Shibuya, T. Y., Abrams, J., & Jacobs, J. R. (2001). Prognostic Factors in Major Salivary Gland Cancer. The Laryngoscop.94. Stodulski, D., Mikaszewski, B., & Stankiewicz, C. (2011). Are all prognostic factors in parotid gland carcinoma well recognized? European Archives of Oto-Rhino-Laryngology, 269(3), 1019– 1025. 95. Terhaard C. H. J. et al. The role of radiotherapy in the treatment of malignant salivary gland tumors //International Journal of Radiation Oncology* Biology* Physics. – 2005. – Т. 61. – №. 1. – С. 103-111. 96. Salama AKS, Li S, Macrae ER, Park JI, Mitchell EP, Zwiebel JA, Chen HX, Gray RJ, McShane LM, Rubinstein LV, Patton D, Williams PM, Hamilton SR, Armstrong DK, Conley BA, Arteaga CL, Harris LN, O"Dwyer PJ, Chen AP, Flaherty KT. Dabrafenib and Trametinib in Patients With Tumors With BRAFV600E Mutations: Results of the NCI-MATCH Trial Subprotocol H. J Clin Oncol. 2020 Nov 20;38(33):3895-3904. doi: 10.1200/JCO.20.00762. Epub 2020 Aug 6. 97. Инструкция по медицинскому применению препарата Китруда (пембролизумаб). https://grls.minzdrav.gov.ru/Grls_View_v2.aspx?routingGuid=fbb58f31-939d-410b-af2b-6b7eb80d7880. С.- 9.
Информация
ЗНО – злокачественное новообразование
ЛУ – лимфатические узлы
КТ – компьютерная томография
ЛТ – лучевая терапия
УУР – уровень убедительности рекомендаций
ХЛТ – химиолучевая терапия
Термины и определения
Комплексное противоопухолевое лечение – специализированное лечение онкологических пациентов, включающее в себя сочетание трех методов (хирургическое лечение, лучевая терапия и химиотерапия)
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
- размеры и распространенность первичной опухоли;
- степень дифференцировки опухоли;
- наличие/отсутствие периваскулярной, перилимфатической, периневральной инвазии;
- статус регионарных ЛУ (рN) (метастазы в ЛУ шеи вдвое снижают выживаемость пациентов)
- экстранодальное распространение опухоли;
- активность клеточной пролиферации (индекс ki-67);
- статус краев резекции (R0-1).
Критерии оценки качества медицинской помощи
| № | Критерии качества | УУД, УУР |
Тезис-рекомендация, на основе которого сформирован критерий
|
|---|---|---|---|
| 1. | Выполнена тонкоигольная аспирационная биопсия первичной опухоли и подозрительных ЛУ с последующим цитологическим исследованием микропрепарата тонкоигольной аспирационной биопсии (при установлении диагноза) | 1В | Рекомендуется всем пациентам с подозрением на злокачественное новообразование слюнных желез выполнить тонкоигольную аспирационную биопсию (ТАБ) первичной опухоли и подозрительных ЛУ с последующим цитологическим исследованием микропрепарата тонкоигольной аспирационной биопсии в целях дифференциальной диагностики с доброкачественными новообразованиями, верификации диагноза и определения степени распространенности опухолевого процесса |
| 2. | Выполнено УЗИ ЛУ шеи (при установлении диагноза) | 1В | Рекомендуется всем пациентам с подозрением на злокачественное новообразование слюнных желез выполнить УЗИ мягких тканей, ЛУ шеи и подозрительных ЛУ с целью верификация заболевания и определения распространенности [11]. |
| 3. | Выполнена КТ органов грудной полости | 5С | Рекомендуется всем пациентам со злокачественными новообразованиями слюнных желез выполнить КТ органов грудной полости с целью выявления факторов, которые могут повлиять на выбор тактики лечения – для исключения отдаленных метастазов [6]. |
| 5. | Выполнено патологоанатомическое исследование операционного материала (при хирургическом вмешательстве) | 4С |
Рекомендуется в рамках проведения цитологического исследования микропрепарата тканей слюнной железы (см. 2.5) и патологоанатомического исследования операционного материала (см. 3.1) с целью выявления факторов, которые могут повлиять на выбор тактики лечения и прогноз заболевания оценить следующие параметры с их отражением в заключении:
1)размеры опухоли;
2)глубина инвазии опухоли;
3) гистологическое строение опухоли;
4) степень дифференцировки опухоли;
5) наличие лимфоваскулярной, периневральной инвазии (отрицательный результат также должен быть констатирован);
6) рТ;
7)рN (с указанием общего числа исследованных и поражённых лимфоузлов, признаков экстранодального распространения опухоли);
8)наличие поражения краев резекции (отрицательный результат также должен быть констатирован) [5][7][4][8][9][10]. |
| 6. | При распространенности опухоли T1-4aN+M0 или аденокистозном раке сред- ней или низкой степени дифференцировки с распространенностью T3- 4aN0M0 выполнена шейная лимфаденэктомия при хирургическом вмешательстве | 3В |
При стадиях T1–2, N+M0 рекомендовано полное хирургическое удаление первичной опухоли в сочетании с шейной лимфаденэктомией с последующим проведением в послеоперационном периоде ДЛТ [15] [18].
При стадиях T3–4a, N0 M0 рекомендовано полное хирургическое удаление первичной опухоли, в случае аденокистозного рака средней или низкой степени дифференцировки – в сочетании с шейной лимфаденктомией, в послеоперационном периоде рекомендовано проведение ДЛТ [15].
При стадии T3–4a, N + M0 рекомендовано полное хирургическое удаление первичной опухоли в сочетании с шейной лимфаденэктомией с последующим проведением в послеоперационном периоде ДЛТ [15].
|
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
- Кропотов Михаил Алексеевич, д.м.н., заведующий отделением хирургическим отделением №10 опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
- Саприна Оксана Александровна, к.м.н., врач-онколог, отделение хирургическое №11 опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
- Игнатова Анастасия Валерьевна, к.м.н., врач-онколог отделения хирургических методов лечения №5 НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи», старший преподаватель кафедры общей и клинической стоматологии им. В.С. Дмитриевой ФГАОУ ВО РУДН. ORCID: https://orcid.org/0000-0002-6796-0968
- Агабабян Татев Артаковна, заведующая отделением лучевой диагностики МРНЦ им. А.Ф. Цыба — филиала ФГБУ «НМИЦ радиологии» Минздрава России, к.м.н., Обнинск https://orcid.org/0000-0002-9971-3451
- Алиева Севил Багатуровна, д.м.н., ведущий научный сотрудник отделения радиационной онкологии ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
- Алымов Юрий Владимирович, к.м.н., врач-онколог отделения хирургических методов лечения №5 (эндокринной онкологии) НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, исполнительный директор Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»; ORCID: https://orcid.org/0000-0002-6851-9867
- Артемьева Анна Сергеевна, к.м.н., врач-патоморфолог, руководитель научной лаборатории морфологии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, доцент отделения дополнительного профессионального образования НМИЦ онкологии им. Н.Н. Петрова
- Бойко Анна Владимировна, д.м.н., профессор, заведующая отделением лучевой терапии с модификацией МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
- Болотин Михаил Викторович, к.м.н., научный сотрудник отделения хирургического № 11 опухолей верхних дыхательно-пищеварительных путей ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
- Болотина Лариса Владимировна, д.м.н., доцент РАН, заведующая отделением химиотерапии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России. Председатель группы опухолей головы и шеи практических рекомендаций Российского общества клинической онкологии, член Правления.
- Виноградов Вячеслав Вячеславович, д.м.н., профессор, руководитель научно-клинического отдела лор-онкологии ФГБУ «Научно-клинический центр оториноларингологии» ФМБА России.
- Владимирова Любовь Юрьевна, д.м.н., профессор, руководитель отдела лекарственного лечения опухолей, ФГБУ «НМИЦ онкологии» МЗ РФ
- Геворков Артем Рубенович, к.м.н., с.н.с., врач-радиотерапевт отделения лучевой терапии с модификацией МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»
- Гиршович Михаил Маркович, к.м.н., врач-радиотерапевт ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России; https://orcid.org/0000-0002-7925-9570
- Гулидов Игорь Александрович, заведующий отделом лучевой терапии МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России
- Гузь Александр Олегович, к.м.н., врач-онколог, заведующий отделением опухолей головы и шеи ГБУЗ «Челябинский областной клинический центр онкологии и ядерной медицины»
- Дайхес Николай Аркадьевич, член-корр. РАН, д.м.н., профессор, директор ФГБУ «Научно-клинический центр оториноларингологии» ФМБА России.
- Дронова Екатерина Леонидовна, врач-радиолог ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
- Енгибарян Марина Александровна, д.м.н., заведующая отделением опухолей головы и шеи ФГБУ «НМИЦ онкологии» МЗ РФ, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
- Клименко Вероника Викторовна, к.м.н., врач клинико-диагностического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России; https://orcid.org/0000-0003-1079-4492
- Корниецкая Анна Леонидовна, к.м.н., старший научный сотрудник отделения химиотерапии отдела лекарственного лечения опухолей МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
- Костромина Екатерина Викторовна, к.м.н., врач ультразвуковой диагностики, врач-рентгенолог отделения лучевой диагностики, научный сотрудник научного отделения диагностической и интервенционной радиологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» МЗ РФ, доцент кафедры лучевой диагностики и медицинской визуализации ФП и ДПО ФГБОУ ВО СПбГМУ; https://orcid.org/0000-0002-4245-687X
- Красильникова Лариса Анваровна, к.м.н., врач-цитолог ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
- Кутукова Светлана Игоревна, д.м.н., доцент, ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Министерства здравоохранения Российской Федерации, СПб ГБУЗ «Городской клинический онкологический диспансер»
- Кульбакин Денис Евгеньевич, д.м.н., старший научный сотрудник, врач-онколог отделения опухолей головы и шеи НИИ онкологии Томского НИМЦ
- Мордовский Александр Валентинович – к.м.н., научный сотрудник отделения микрохирургии МНИОИ им. П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России
- Мудунов Али Мурадович, д.м.н., профессор РАН, заведующий отделением хирургических методов лечения № 10 опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, президент Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»
- Мусин Шамиль Исмагилович, к.м.н., заведующий хирургическим отделением N6 ГАУЗ РКОД Минздрава РБ
- Подвязников Сергей Олегович, д.м.н., профессор, ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, вице-президент Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
- Полькин Вячеслав Викторович, к.м.н. заведующий отделения лучевого и хирургического лечения заболеваний головы, шеи МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России
- Поляков Андрей Павлович, д.м.н., доцент, заведующий отделением микрохирургии МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»
- Пономарева Ольга Игоревна, врач-рентгенолог отделения радиотерапии НМИЦ онкологии им. Н.Н. Петрова; https://orcid.org/0000-0002-7004-9630
- Раджабова Замира Ахмед-Гаджиевна, д.м.н., доцент РАН, заведующий отделением опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, доцент отделения дополнительного профессионального образования НМИЦ онкологии им. Н.Н. Петрова https://orcid.org/0000-0002-6895-0497
- Решетов Игорь Владимирович, д.м.н., академик РАН, заведующий кафедрой онкологии, радиотерапии и реконструктивной хирургии Первого Московского медицинского университета им. И.М. Сеченова, президент Общероссийской общественной организации «Федерация специалистов по лечению заболеваний головы и шеи»
- Романов Илья Станиславович, д.м.н, старший научный сотрудник отделения онкоэндокринологии ФГБУ «НМИЦ Онкологии им. Н.Н. Блохина», доцент кафедры онкологии ФДПО, РНИМУ им Н.И. Пирогова
- Рубцова Наталья Алефтиновна, д.м.н., заведующая отделом лучевой диагностики МНИОИ им. П.А. Герцена – филиал «НМИЦ радиологии» Минздрава России. Главный внештатный специалист по лучевой и инструментальной диагностике Минздрава России по Центральному федеральному округу Российской Федерации.
- Рудык Андрей Николаевич, к.м.н., врач-онколог онкологического отделения №5 (опухолей головы и шеи) ГАУЗ «Республиканский клинический онкологический диспансер Министерства здравоохранения Республики Татарстан имени профессора М.З.Сигала», и.о. заведующего кафедрой челюстно-лицевой хирургии и хирургической стоматологии, доцент кафедры онкологии, радиологии и паллиативной медицины КГМА - филиал ФГБОУ ДПО РМАНПО Минздрава России, доцент кафедры хирургических болезней постдипломного образования ИФМиБ ФГАОУ ВО "Казанский (Приволжский) федеральный университет", г. Казань.
- Семиглазова Татьяна Юрьевна, д.м.н., профессор, заведующий научным отделом инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
- Степанова Александра Михайловна, заведующая отделением реабилитации МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России
- Сукорцева Наталья Сергеевна, ассистент кафедры онкологии, реконструктивной хирургии и радиотерапии, врач онколог Университетской клинической больницы №1 Сеченовского университета
- Ткаченко Елена Викторовна, к.м.н., заведующий отделением краткосрочной противоопухолевой лекарственной терапии, научный сотрудник научного отдела инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, https://orcid.org/0000-0001-6375-8335
- Фалалеева Наталья Александровна, заведующий отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России
- Феденко Александр Александрович, д.м.н., профессор РАН, заведующий Отделом лекарственного лечения опухолей МНИОИ им. П.А. Герцена-филиал ФГБУ «НМИЦ радиологии» Минздрава России
- Хмелевский Евгений Витальевич, д.м.н., профессор, заведующий отделом лучевой терапии МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, врач-радиотерапевт МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России.
- Ходжибекова Малика Маратовна, д.м.н., врач-радиолог отделения радионуклидной диагностики МНИОИ им. П.А. Герцена – филиал «НМИЦ радиологии» Минздрава России.
- Цырлина Евгения Владимировна, к.м.н., врач-эндокринолог отделения функциональной диагностики ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
- Чойнзонов Евгений Лхамацыренович, д.м.н., академик РАН, директор НИИ онкологии Томского НИМЦ, заведующий отделением опухолей головы и шеи НИИ онкологии Томского НИМЦ, заведующий кафедрой онкологии ФГБОУ ВО СибГМУ Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»
-
Яковлева Лилия Павловна, к.м.н., врач-онколог, заведующая центром диагностики и лечения опухолей головы и шеи ГБУЗ МКНЦ имени А.С. Логинова МЗ РФБлок Организация оказания медицинской помощи
- Геворкян Тигран Гагикович, заместитель директора ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
- Иванов Сергей Анатольевич, д.м.н., профессор РАН, директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России
- Невольских Алексей Алексеевич, д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
- Хайлова Жанна Владимировна, к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных; анализ современных научных разработок по проблеме РБ в РФ и за рубежом; обобщение практического опыта российских и зарубежных специалистов.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
| УДД | Расшифровка |
| 1 | Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
| 2 | Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
| 3 | Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
| УДД | Расшифровка |
| 1 | Систематический обзор РКИ с применением мета-анализа |
| 2 | Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
| 3 | Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
| 4 | Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
| УУР | Расшифровка |
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| B | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| C | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Информация отсутствует.
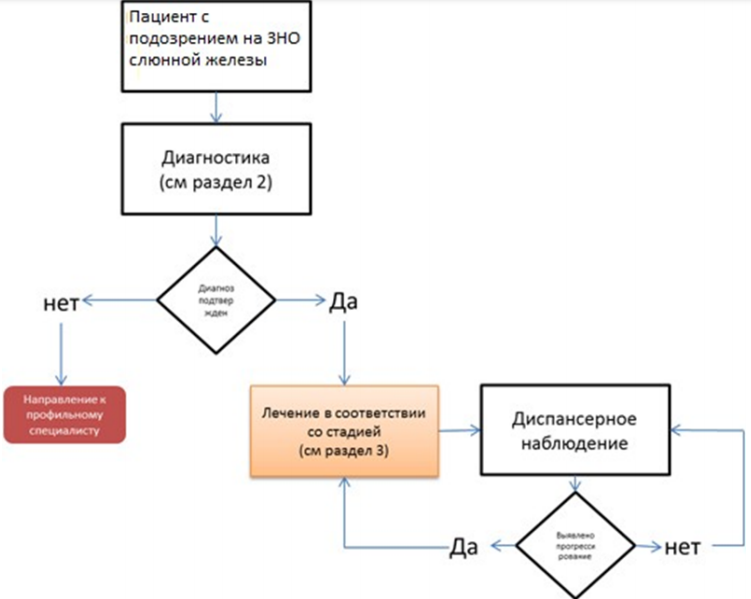
Наблюдение после завершенного лечения имеет важное значение для поддержания здоровья пациента. Обычно в первые 1–2 года наблюдаться у врача-онколога рекомендуется с частотой каждые 3-6 месяцев, на сроке 3–5 лет – 1 раз в 6–12 месяцев. После 5 лет с момента операции визиты проводятся ежегодно или при появлении жалоб. Тем не менее, частота визитов к врачу может быть увеличена в зависимости от характеристик заболевания и ассоциированных рисков и оговаривается индивидуально в каждом конкретном случае. При появлении жалоб, а также возобновлении симптомов, отмечавшихся до лечения, необходимо незамедлительно обратиться к врачу, не дожидаясь очередного срока запланированного визита.
Рекомендации относительно образа жизни и питания должны быть индивидуализированы с учетом объема проведенного лечения, рисков и выраженности осложнений, особенностей пациента.
- Более высокие показатели выживаемости;
- большая эффективность лечения;
- меньшее количество и выраженность побочных эффектов противоопухолевого лечения (сердечно-легочные осложнения, утомляемость, снижение массы тела, мукозиты, потеря вкуса);
- ускоренное восстановление общего состояния после лечения;
- ниже риск рецидива;
- меньший риск вторых опухолей;
- меньший риск инфекций;
- выше качество жизни.
Рекомендации при осложнениях химиотерапии/химиолучевой терапии – связаться с химиотерапевтом, радиологом:
1. При повышении температуры тела 38 °C и выше: начать прием антибиотиков (по назначению врача).
2. При стоматите:
- Диета – механическое, термическое и химическое щажение, а также применение лечебного питания (препараты по назначению врача).
- Частое полоскание рта (каждый час) – ромашка, кора дуба, шалфей, смазывать рот облепиховым (персиковым) маслом.
- Обрабатывать полость рта по назначению врача.
3. При диарее:
- Диета – исключить жирное, острое, копченое, сладкое, молочное, клетчатку. Можно нежирное мясо, мучное, кисломолочное, рисовый отвар. Обильное питье.
- Принимать препараты по назначению врача.
4. При тошноте.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала ECOG (0-5 балла)
Предназначена для оценки общего состояния онкологического пациента.
В левом столбце представлены баллы, в правом – описание состояния, соответствующее указанному баллу.
| Баллы | Состояние больного |
|---|---|
|
0
|
Больной полностью активен, способен выполнять все, как и до заболевания |
|
1
|
Больной неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу) |
|
2
|
Больной лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50% времени бодрствования проводит активно – в вертикальном положении. |
|
3
|
Больной способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50% времени бодрствования. |
|
4
|
Инвалид, совершенно не способен к самообслуживанию, при- кован к креслу или постели. |
| 5 | Смерть |
Материал адаптирован из Oken, M.M., Creech, R.H., Tormey, D.C., Horton, J., Davis, T.E., McFadden, E.T., Carbone, P.P.: Toxicity And Response Criteria Of The Eastern Cooperative Oncology Group. Am J Clin Oncol 5:649-655, 1982
Приложение Г2. Шкала оценки лечебного патоморфоза опухоли по Г.А. Лавниковой
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.