Злокачественное новообразование яичка
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Общая информация
Краткое описание
КЛИНИЧЕСКОГО ПРОТОКОЛА ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Злокачественное новообразование яичка – злокачественное новообразование формирующаяся из эпителиальных тканей мужских половых желез.
Код(ы) МКБ-10:
| Код | Название |
| С.62 | Злокачественные новообразования яичка |
| С62.0 | Злокачественное новообразование неопустившегося яичка |
| С62.1 | Злокачественное новообразование опущенного яичка |
| С62.9 | Злокачественное новообразование яичка неуточненное |
Сокращения, используемые в протоколе:
| АФП | альфа-фетопротеин |
| ВГН | верхняя граница нормы |
| Гр | Грей |
| ЗЛАЭ | забрюшинная лимфоаденэктомия |
| КТ | компьютерная томография |
| UICC | Международный противораковый союз |
| ЛГ | лютеинизирующий гормон |
| ЛДГ | лактатдегидрогеназа |
| МРТ | магнитно-резонансная томография |
| НСЗЛАЭ | нервсберегающая забрюшинная лимфаденэктомия |
| ПЭТ | позитронно-эмиссионная томография |
| BEP | блеомицин, этопозид, цисплатин |
| EP | этопозид, цисплатин |
| СР | степень рекомендаций |
| ТИН | тестикулярная интраэпителиальная неоплазия |
| ФСГ | фолликулстимулирующий гормон |
| ХГЧ | хорионический гонадотропин человека |
| IMRT | (intensive modulated radiation therapy) - интенсивно-модулированная лучевая терапия |
| IGRT | (image guide radiation therapy) управляемая изображениями лучевая терапия |
| TNM Tumor Nodulus Metastasis | международная классификация стадий злокачественных новообразований |
| ВГННТ | внутрипротоковая герминогенная неоплазия неклассифицированного типа |
| ПХТ | Полихимиотерапия |
| VIP | винбластин, ифосфамид, цисплатин |
| PЕI | этопозид, ифосфамид, цисплатин |
| VеIР | винбластин, ифосфамид, месна, цисплатин |
| TIP | паклитаксел, ифосфамид, месна, цисплатин |
| TGO | паклитаксел, гемцитабин, оксалиплатин |
| GemOX | гемцитабин, оксалиплатин |
| Gem/Pac | гемцитабин, раклитаксел |
Категория пациентов: мужчины, старше 18 лет.
Шкала уровня доказательности:
Таблица 1. Степень рекомендаций [1]:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С |
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+).
Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++или+), результаты которых не могут быть непосредственно распространены на соответствующую популяцию.
|
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
Классификация
Герминогенные опухоли:
Опухоли, развивающиеся из внутрипротоковой герминогенной неоплазии неклассифицированного типа:
Герминогенные опухоли, не связанные с внутрипротоковой герминогенной неоплазией неклассифицированного типа:
Опухоли стромы полового тяжа/гонадные стромальные опухоли:
Опухоли, содержащие герминогенные клетки и клетки стромы полового тяжа:
Редкие неспецифические стромальные опухоли:
Опухоли собирательных протоков и сети яичка:
Опухоли паратестикулярных структур:
NB! Рекомендуется гистологическое исследование хирургически удаленного опухолевого препарата, при этом в морфологическом заключении рекомендуется отразить следующие параметры:
T – первичная опухоль
N – регионарные лимфатические узлы (клиническая оценка)
S – сывороточные опухолевые маркеры
Таблица 2. Уровни опухолевых маркеров.
| Уровень маркеров, S | ЛДГ*(Ед/л) | β-ХГ** (мМЕ/мл) | АФП*** (нг/мл) | ||
| S1 | < 1,5 N | и | < 5000 | и | < 1000 |
| S2 | 1,5–10 N | или | 5000–50000 | или | 1000 – 10000 |
| S3 | > 10 N | или | > 50000 | или | > 10000 |
Таблица 3. Распределение по стадиям (UICC, Международный противораковый союз 2016 год, 8 -е издание).
| Стадия 0 | рТis N0, M0, S0, Sх |
| Стадия I | pT1–4, N0, M0, Sх |
| IA | pT1, N0, M0, S0 |
| IB | pT2–4, N0, M0, S0 |
| IS | pT1–4/Тх, N0, M0, S1–3 |
| Стадия II | Любая рТ/Тх, N1–3, М0, Sх |
| IIA | pT1–4, N1, M0, S0-1 |
| IIB | pT1–4, N2, M0, S0–1 |
| IIC | pT1–4, N3, M0, S0–1 |
| Стадия III | Любая рТ/Тх, N1–3, М1а, Sх |
| IIIA | pT1–4/Тх, N1–3, M1a, S0–1 |
| IIIB | pT1–4/Тх, N1–3, M0–1a, S2 |
| IIIC |
pT1–4/Тх, N1–3, M0–1a, S3 pT1–4/Тх, N1–3, M1b, S0–3 |
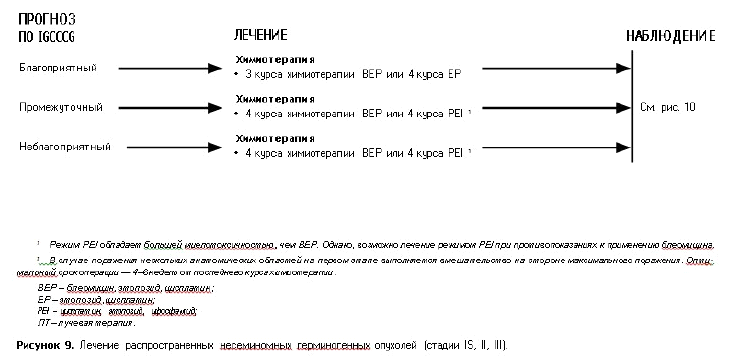
Таблица 4. Прогностическая классификация метастатических герминогенных опухолей (IGCCCG) [7,8].
| Группа хорошего прогноза | |
| Несеминомные опухоли (56 % случаев) Пятилетняя безрецидивная выживаемость 90% Пятилетняя общая выживаемость 96% |
Все перечисленные критерии: • локализация первичной опухоли в яичке или забрюшинно • отсутствие нелегочных висцеральных метастазов • АФП < 1000 нг/мл • ХГЧ < 5000 МЕ/л (1000 нг/мл) • ЛДГ< 1,5 × ВГН* |
| Семинома (90 % случаев) Пятилетняя безрецидивная выживаемость 89% Пятилетняя общая выживаемость 95% |
Все перечисленные критерии: • любая локализация первичной опухоли • отсутствие нелегочных висцеральных метастазов • нормальный уровень АФП • любой уровень ХГЧ • любой уровень ЛДГ |
| Группа умеренного прогноза | |
| Несеминомные опухоли (28 % случаев) Пятилетняя безрецидивная выживаемость 78% Пятилетняя общая выживаемость 89% |
Все перечисленные критерии: • локализация первичной опухоли в яичке или опухоли забрюшинной пространстве • отсутствие нелегочных висцеральных метастазов • АФП 1000–10 000 нг/мл, либо • ХГЧ 5000–50 000 МЕ/л, либо • ЛДГ 1,5–10 × ВГН* |
| Семинома (10 % случаев) Пятилетняя безрецидивная выживаемость 79% Пятилетняя общая выживаемость 88% |
Любой из следующих критериев: • любая локализация первичной опухоли • наличие нелегочных висцеральных метастазов • нормальный уровень АФП • любой уровень ХГЧ • любой уровень ЛДГ |
| Группа плохого прогноза | |
| Несеминомные опухоли (16 % случаев) Пятилетняя безрецидивная выживаемость 54% Пятилетняя общая выживаемость 67% |
Любой из следующих критериев: • локализация первичной опухоли в средостении • наличие нелегочных висцеральных метастазов АФП > 10 000 нг/мл, либо • ХГЧ > 50 000 МЕ/л (10 000 нг/мл), либо • ЛДГ > 10 × ВГН* |
| Семинома | Пациенты с семиномой в группу плохого прогноза не включаются |
Диагностика
Диагностические критерии [2,3]:
Жалобы и анамнез: Рак яичка проявляет симптомы вначале появлением плотной, иногда болезненной, опухоли в мошонке. Основная клиника связана с метастазированием в забрюшинные лимфатические узлы, что вызывает сильную боль в пояснице, и легкие, что приводит к кровохарканью и кашлю. Иногда наблюдается гинекомастия – увеличение грудных желез.
Физикальное обследование: пальпация мошонки наиболее важным моментом в постановке диагноза. При осмотре кожа мошонки не изменена. Может быть асимметрия яичек, за счет увеличения в размере пораженной стороны. Иногда можно пропальпировать образование яичка.
Показания для консультации специалистов – консультация узких специалистов по показаниям.
Таблица 5. Рекомендуемые методы обследования для стадирования при постановке диагноза [2,3].
| Для стадирования рекомендуется | ||
| тест | рекомендация | СР |
| Сывороточные опухолевые маркеры |
АФП ХГЧ ЛДГ |
А |
| КТ брюшной полости, забрюшинного пространства и малого таза | Всем пациентам | А |
| КТ грудной клетки | Всем пациентам | А |
| УЗИ яичек (с обеих сторон) | Всем пациентам | А |
| Остеосцинтиграфия костей скелета | При наличии симптомов | А |
| Сканирование головного мозга (КТ/МРТ) | При наличии симптомов или у пациентов с метастатической болезнью с множественными метастазами в легких и/или высоким уровнем ХГЧ | А |
| Дальнейшие исследования | ||
|
Исследование фертильности: Общий тестостерон ЛГ ФСГ Спермограмма |
В | |
| Обсуждение сохранения спермы в «банке спермы» (криоконсервация) со всеми мужчинами до начала лечения рака яичка | А | |
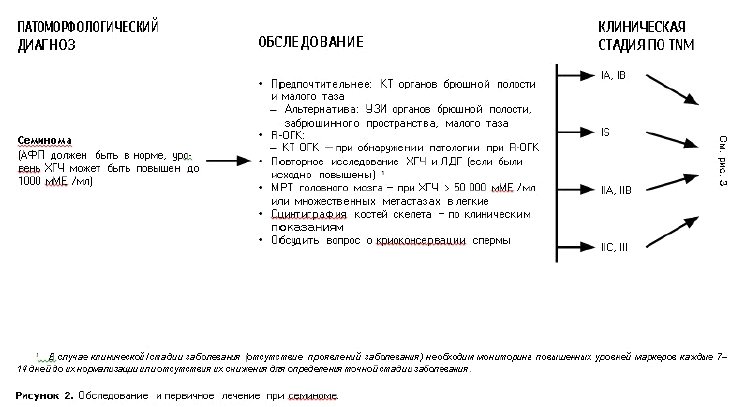
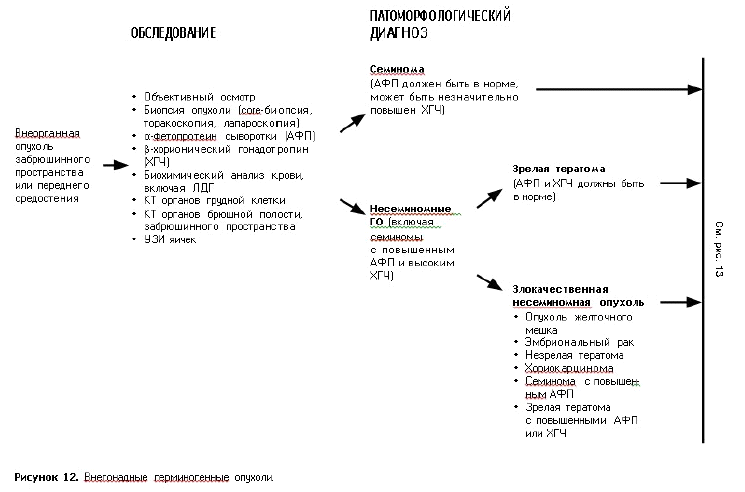
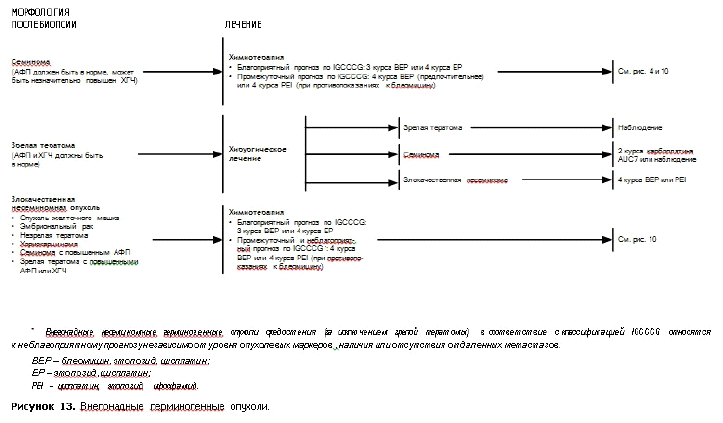
Диагностический алгоритм:
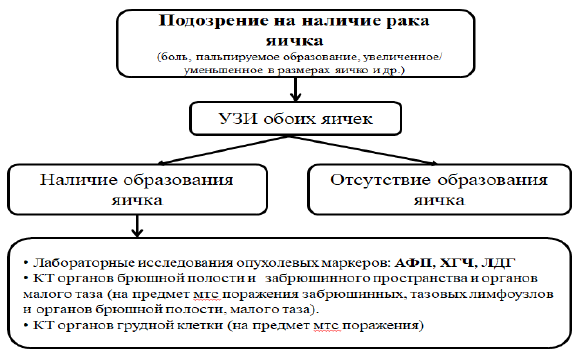
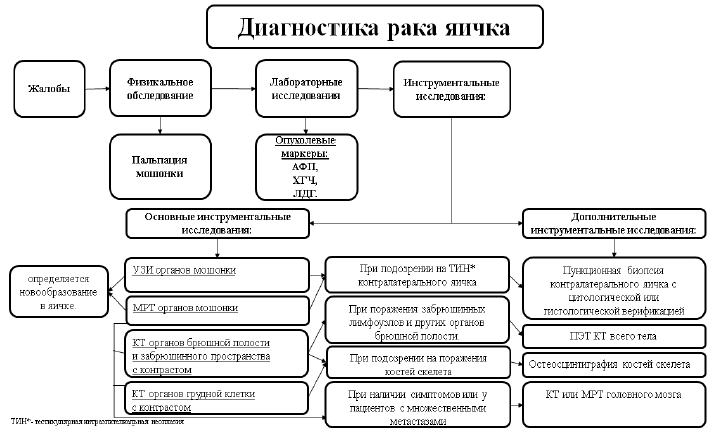
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований
Таблица 6. Дифференциальная диагностика рака яичка [9]
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Острый орхит-эпидидимит | Боль, увеличение в размере яичка | Визуальный осмотр, пальпация | Гиперемия соответствующей половины мошонки, гипертермия локальная и общая, отсутствие складчатости – отек кожи мошонки, в некоторых ситуациях флюктуация |
| УЗИ яичек | Отсутствие образования в яичке, отек паренхимы, выпот в оболочках яичка | ||
| Хронический эпидидимит | Пальпируемое образование | Визуальный осмотр, пальпация | Как правило яички обычных размеров, симметричны, при пальпации придатка отмечается уплотненный болезненный участок придатка |
| УЗИ яичек | Отсутствие образования в яичке, наличие локального увеличения по ходу придатка | ||
| Орхит/эпидидимит специфический (бруцеллез) | Увеличение в размере яичка | Анализ крови на бруцеллез | При бруцеллезе сопровождается клиникой основного заболевания, как правило, орхит двухсторонний, положительный анализ на Райта-Хедельсона; |
| Орхит/эпидидимит специфический (туберкулез) | Увеличение в размере яичка, боль | Визуальный осмотр, УЗИ яичек, Исследование гнойного отделяемого на микобактерии туберкулеза | Часто сопровождается наличием туберкулеза легких в активной фазе, боль бывает редко, часто гнойное воспаление яичка с прорывом через кожу мошонки, по УЗИ картина гнойного воспаления яичка |
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ: нет.
Лечение (стационар)
Карта наблюдения пациента, маршрутизация пациента: – см. приложение 1.
Немедикаментозное лечение:
Таблица –7. Лечение семиномы яичка в зависимости от стадии
| Стадия заболевания | Методы лечения |
| Стадия IА (рT1N0M0S0) | Радикальная орхофуникулэктомия. Активное наблюдение. |
| Стадия IВ (pT1–4, N0, M0, S0) | Радикальная орхофуникулэктомия. Химиотерапия карбоплатином (1 курс в дозе AUC7) (площадь под кривой) или лучевая терапия. |
| Стадия IС (pT1–4, N0, M0, S1–3) | Радикальная орхофуникулэктомия. Химиотерапия карбоплатином (1 курс в дозе AUC7) или лучевая терапия. |
| Стадия IIА (pT1–4, N1, M0, S0–1) | Радикальная орхофуникулэктомия. Лучевая терапия и/или ПХТ. Удаление резидуальных опухолей |
| Стадия IIВ (pT1–4, N2, M0, S0–1) | Радикальная орхофуникулэктомия. Лучевая терапия и/или ПХТ. Удаление резидуальных опухолей |
| Стадия IIС (pT1–4, N3, M0, S0–1) | Радикальная орхифуникулэктомия. ПХТ. Удаление резидуальных опухолей |
| Стадия IIIА (pT1–4, N1-3, M1а, S0–1) | Радикальная орхифуникулэктомия. ПХТ. Удаление резидуальных опухолей |
| Стадия IIIВ (pT1–4, N1–3, M0–1a,S2) | Радикальная орхифуникулэктомия. ПХТ. Удаление резидуальных опухолей |
| Стадия IIIС (pT1–4, N1–3, M0–1a, S3 pT1–4, N1–3, M1b, S0–3) | Радикальная орхифуникулэктомия. ПХТ. Удаление резидуальных опухолей |
Таблица – 8. Лечение несеминомного рака яичка в зависимости от стадии:
| Стадия заболевания | Методы лечения |
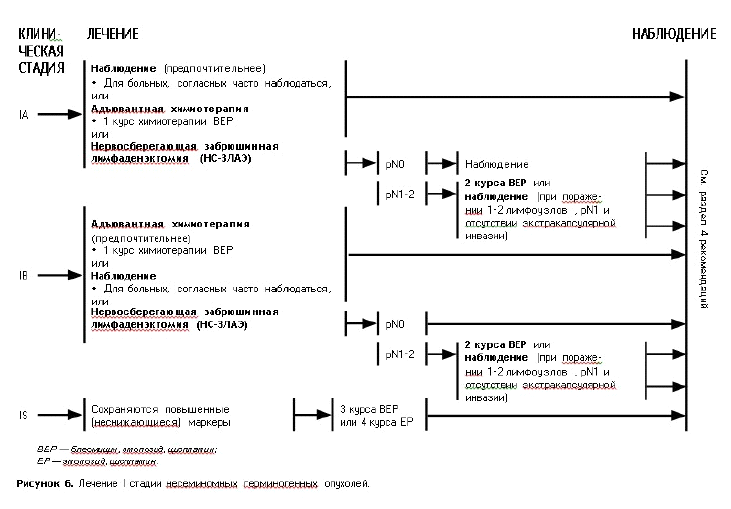
| Стадия IА (рT1N0M0 S0) | Радикальная орхифуникулэктомия. Активное наблюдение. Риск адаптированное лечение |
| Стадия IB (pT2–4, N0, M0, S0) | Радикальная орхифуникулэктомия с НСЗЛАЭ*. Активное наблюдение. ПХТ. |
| Стадия IS (pT1–4, N0, M0, S1–3) | Радикальная орхифуникулэктомия с ЗЛАЭ*. Активное наблюдение. ПХТ |
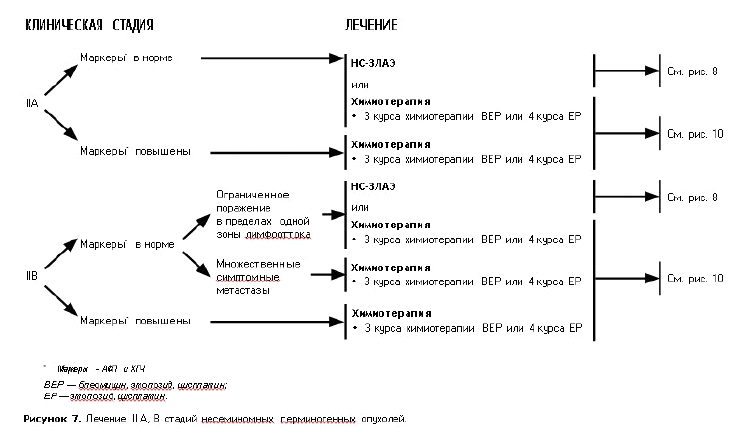
| Стадия IIА (pT1–4, N1, M0, S0–1) | Радикальная орхифуникулэктомия. ПХТ. ЗЛАЭ*. |
| Стадия IIВ (pT1–4, N2, M0, S0–1) | Радикальная орхифуникулэктомия. ПХТ. ЗЛАЭ*. |
| Стадия IIС (pT1–4, N3, M0, S0–1) | Радикальная орхифуникулэктомия. ПХТ. ЗЛАЭ*. |
| Стадия IIIА (pT1–4, N1-3, M1а, S0–1) | Радикальная орхифуникулэктомия. ПХТ. Удаление резидуальных опухолей |
| Стадия IIIВ (pT1–4, N1–3, M0–1a, S2) | Радикальная орхифуникулэктомия. ПХТ. Удаление резидуальных опухолей. |
| Стадия IIIС (pT1–4, N1–3, M0–1a, S3 pT1–4, N1–3, M1b, S0–3) | Радикальная орхифуникулэктомия. ПХТ. Удаление резидуальных опухолей |
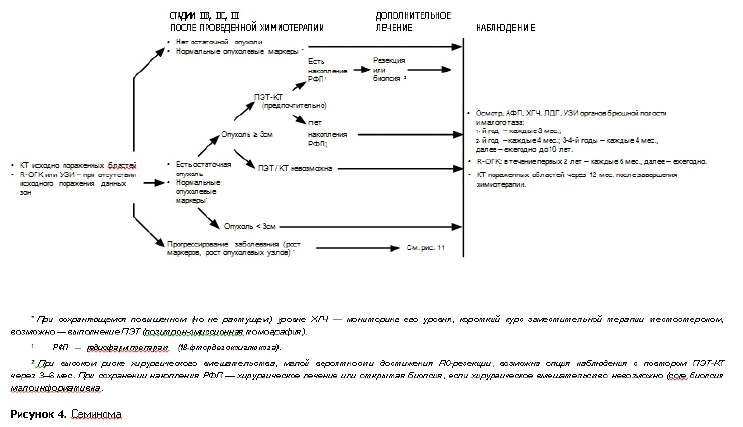
Семинома
Этапы предлучевой подготовки должны включать в себя:
Основанием для облучения паховой зоны (с одного переднего поля) являются следующие клинические ситуации:
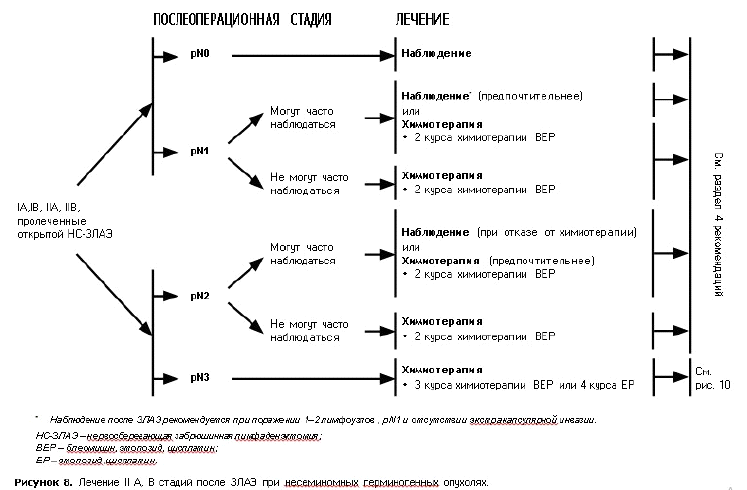
Риск адаптированное лечение у пациентов с клинической стадией 1 при несеминомных опухолях (схема-2)
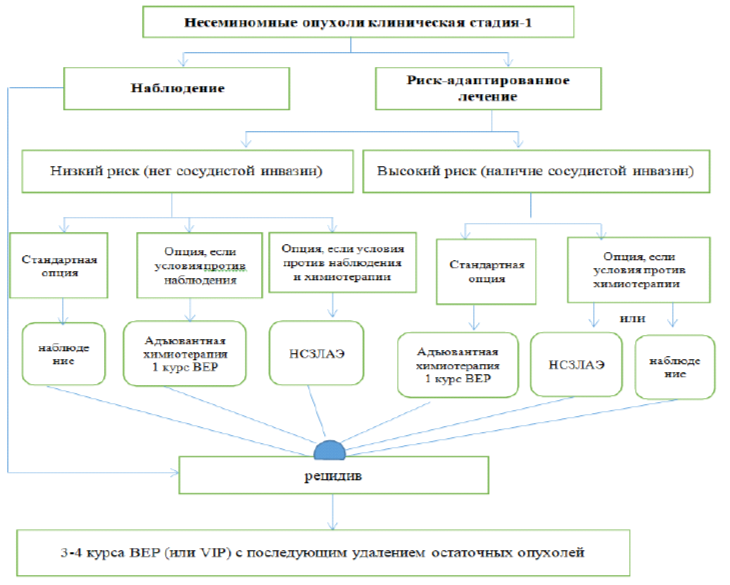
Режимы химиотерапии
Лечебные схемы I линии:
ЕР: Повторение циклов каждые 3 нед. 4 курса с 3-недельным интервалом для больных с хорошим прогнозом (при противопоказаниях к блеомицину)
| Цисплатин | 20мг/м2 в/в капельно ежедневно в 1,2,3,4,5-й дни |
| Этопозид | 100мг/м2 в/в капельно ежедневно в 1,2,3,4, 5-й дни |
| Цисплатин | 20 мг/м2, в/в капельно (в течении 40 минут) ежедневно в 1,2,3,4,5-й дни |
| Этопозид | 100 мг/м2 в/в капельно ежедневно в 1,2,3,4,5-й дни |
| Блеомицин | 30 мг в/в (2-20минут; 1,3,5 дни) или в/м 1 раз в неделю течение 12 нед |
| Этопозид | 75 мг/м2, в/в (40 минут) 1,2,3,4, 5-й дни |
| Ифосфамид | 1,2 г/м2 в/в капельно (1-2 часа) 1,2,3,4,5 дни + Месна 800мг в/в струйно до введения ифосфамида, через 4ч и 8ч после его инфузии 1,2,3,4,5 дни |
| Цисплатин | 20 мг/м2 в/в капельно (1 час) 1,2,3,4,5-й дни |
| Винбластин | 0,11мг/кг в/в струйно, 1-й и 2-й дни |
| Ифосфамид | 1200 мг/м2, в/в (60-120-минутная инфузия) в 1,2,3,4,5-й дни |
| Месна | 800 мг в/в струйно до введения ифосфамида, через 4 и 8ч после его инфузии в 1,2,3,4,5-й дни |
| Цисплатин | 20 мг/м2 в/в (1 час) 1,2,3,4,5-й дни |
| Филграстим | 5 мкг/кг п/к, 6-15дни |
| Паклитаксел | 175 мг/м2 в/в 3-часовая инфузия в 1-й день |
| Ифосфамид | 1200 мг/м2 в/в (30-60-минутная инфузия) в 1,2,3,4,5 дни |
| Месна | 800 мг в/в струйно до введения ифосфамида, через 4 и 8ч после его инфузии в 1,2,3,4,5-й дни |
| Цисплатин | 20 мг/м2 в/в (30-60-минутная инфузия) 1,2,3,4,5-й дни |
| Филграстим | 5 мкг/кг п/к, 6-15дни |
| Паклитаксел | 80 мг/м2 в/в 1-часовая инфузия в 1,8 дни |
| Гемцитабин | 800 мг/м2 в/в (30-минутная инфузия) в 1,8 дни |
| Оксалиплатин | 130 мг/м2 в/в (120 мин) в 1 день |
GemOX: 4 курса
| Гемцитабин | 800 мг/м2 в/в (30-минутная инфузия) в 1,8 дни |
| Оксалиплатин | 130 мг/м2 в/в (120 мин) в 1 день |
Gem/Pac: 6 курсов – Повтор цикла каждые 28 дней
| Гемцитабин | 1000 мг/м2 в/в (30 минутная инфузия) в 1,8, 15 дни |
| Паклитаксел | 100 мг/м2 в/в (60 минут) в 1,8, 15 дни |
| Этопозид р. о. До прогрессирования | |
| Этопозид | 100 мг/сут. внутрь в 1–10 дни, перерыв 2 нед. |
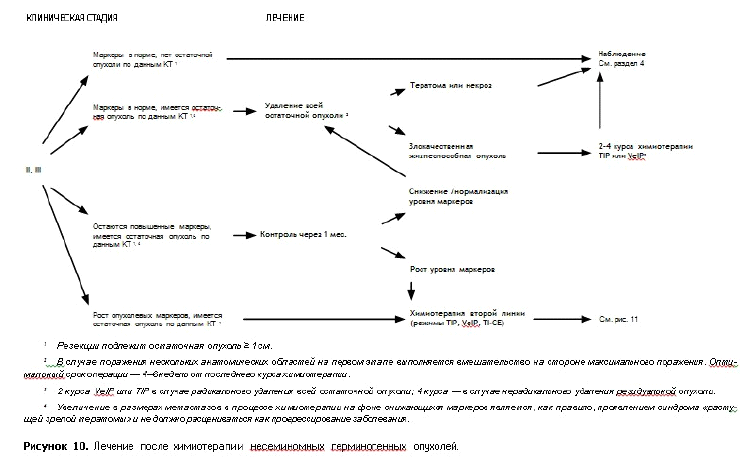
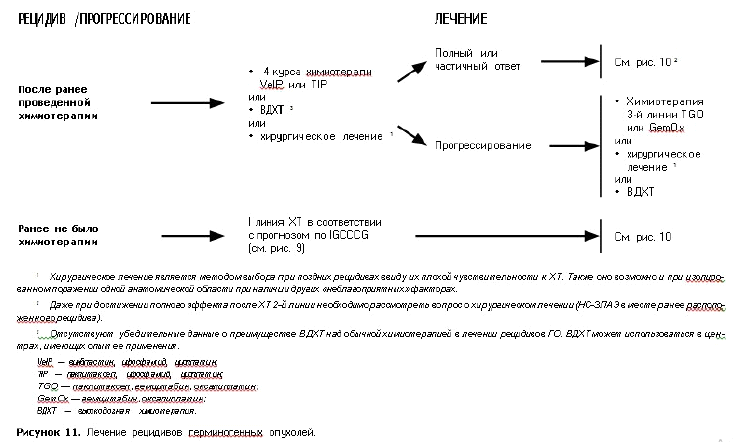
Высокодозная ПХТ (II–III линии терапии)
TI: 1–2 курса, длительность курса — 2 недели
| Паклитаксел | 200 мг/м2 в/в 3-часовая инфузия в 1-й день |
| Ифосфамид | 2000 мг/м2 в/в (30-60-минутная инфузия) в 1-3 дни |
| Месна | 100% от дозы ифосфамида в/в струйно в 1–3-й дни |
| Цисплатин | 20 мг/м2 в/в (30-60-минутная инфузия) 1,2,3,4,5-й дни |
| Филграстим | 10 мкг/кг п/к в 4–12-й дни |
СЕ: 3 курса, длительность курса — 3 недели
| Карбоплатин | AUC8 в/в в 1–3-й дни |
| Этопозид | 400 мг/м2 в/в 1–3-й дни |
| Филграстим | 5 мкг/кг п/к в 4–12-й дни |
Перечень основных лекарственных средств (имеющих 100% применения):
|
Лекарственная группа
|
Международное непатентованное наименование ЛС | Дозировка и способ применения | УД |
|
Платиносодержащие препараты
|
Цисплатин | 20 мг/м2 в/венно капельно | А |
|
Производные подофиллотоксина
|
Этопозид | 100 мг/м2 в/венно капельно | А |
|
Гликопептидный антибиотик
|
Блеомицин | 30 мг в/венно (2-20 минут) или в/мышечно 1 раз в неделю | А |
|
Таксаны
|
Паклитаксел | 175 мг/м2 в/венно | А |
|
Алкилирующие агенты
|
Ифосфамид | 1200 мг/м2 в/венно | А |
|
Уропротекторы
|
Месна | 800 мг в/венно | А |
|
Винкоалколоиды
|
Винбластин | 0,11 мг/кг в/венно струйно | А |
|
Стимуляторы гемопоэза.
|
Филграстим | 5 или 10 мкг/кг п/кожно | В |
Перечень дополнительных лекарственных средств (имеющих вероятность менее 100% применения):
|
Лекарственная группа
|
Международное непатентованное наименование ЛС | Дозировка и способ применения | УД |
|
Антиметаболиты
|
Гемцитабин | 800 мг/м2 в/венно | В |
|
Платиносодержащие препараты
|
Оксалиплатин | 130 мг/м2 в/венно | В |
|
Платиносодержащие препараты
|
Карбоплатин | AUC 7 или AUC 8 в/венно | В |
Таблица 9. Рекомендуемый минимум обследований после выбора стратегии активного наблюдения при несеминомных опухолях яичка I стадии (выжидательная тактика).
| Процедура | Год | |||
| 1-й | 2-й | 3-й | 4-5-й | |
| Физикальное обследование | 4 раза | 4 раза | 4 раза | раз в год |
| Опухолевые маркеры | 4 раза | 4 раза | 4 раза | раз в год |
| Рентгенография грудной клетки | 2 раза | 2 раза | 2 раза | 2 раза |
| КТ брюшной полости и малого таза | дважды (через 3 и 12 месяцев) | 1раз в 24 месяца | 1 в 36 месяцев | |
Таблица 10. Рекомендуемый режим наблюдения после ЗЛАЭ или химиотерапии при несеминомных опухолях яичка I стадии.
| Процедура | Год | ||
| 1-3-й | 4-5-й | 6-10 | |
| Физикальное обследование | 4 раза | 1 раз в год | 1 раз в год |
| Опухолевые маркеры | 4 раза | 1 раз в год | 1 раз в год |
| Рентгенография грудной клетки | 2 раза | По показаниям (нет необходимости в выполнении исследования) | |
| КТ брюшной полости и малого таза | 1 раз в год | По показаниям (нет необходимости в выполнении исследования) | |
Таблица 11. Наблюдение после орхиэктомии, лучевой терапии или химиотерапии при семиноме I стадии.
| Процедура | Год | ||
| 1-й | 2-й | 3-5-й | |
| Физикальное обследование | 3 раза | 3 раза | раз в год |
| Опухолевые маркеры | 3 раза | 3 раза | раз в год |
| Рентгенография грудной клетки | 2 раза | 2 раза | |
| КТ брюшной полости и малого таза | 2 раза | 2 раза | в 36 и 60 месяцев |
Таблица 12. Рекомендуемый минимум обследований при метастатическом процессе у больных с семиномой и несеминомными метастатическими опухолями.
| Процедура | Год | |||
| 1-й | 2-й | 3-5-й | В последующем | |
| Физикальное обследование | 4 раза | 4 раза | 2 раза | раз в год |
| Опухолевые маркеры | 4 раза | 4 раза | 2 раза | раз в год |
| Рентгенография грудной клетки | 4 раза | 4 раза | 2 раза год | раз в год |
| КТ брюшной полостиа, б | 2 раза | 2 раза | раз в год | По показаниям |
| КТ грудной клетки | раз в год | раз в год | раз в год | |
| КТ головного мозга | раз в год | раз в год | раз в год | |
апосле ТЗЛАЭ выполняется исходная КТ, затем исследование повторяется, если имеются клинические показания;
Таблица 13. Наблюдение при семиноме в стадии IIА–IIВ после лучевой терапии.
| Процедура | Год | |||||
| 1-й | 2-й | 3-й | 4-й | 5-й | >5 | |
| Физикальное обследование | 6 раз | 4 раза | 3 раза | 2 раза | 2 раза | раз в год |
| Опухолевые маркеры | 6 раз | 4 раза | 3 раза | 2 раза | 2 раза | раз в год |
| Рентгенография грудной клетки | 6 раз | 4 раза | 3 раза | 2 раза | 2 раза | раз в год |
| КТ брюшной полости и таза1 | по показаниям | |||||
| КТ грудной клетки2 | ||||||
Таблица 14. Наблюдение при распространенных несеминомных опухолях яичка и семиноме.
| Процедура | Год | |||||
| 1-й | 2-й | 3-й | 4-й | 5-й | В последующем | |
| Физикальное обследование | Раз в месяц | Раз в 2 месяца | 4 раза | 3 раза | 2 раза | раз в год |
| Опухолевые маркеры | Раз в месяц | Раз в 2 месяца | 4 раза | 3 раза | 2 раза | раз в год |
| Рентгенография грудной клетки | Раз в месяц | Раз в 2 месяца | 4 раза | 3 раза | 2 раза | раз в год |
| КТ брюшной полости1,2 | по показаниям | |||||
| КТ грудной клетки2,3 | ||||||
| КТ головного мозга4 | ||||||
Дальнейшее ведение:
Сроки наблюдения:
Госпитализация
Показания для плановой госпитализации: наличие у больного рака яичка (либообразования яичка, требующее хирургической ревизии), подлежащего специализированному лечению.
Показания для экстренной госпитализации: нет.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- 1 Phillips, B., et al. Oxford Centre for Evidence-based Medicine Levels of Evidence. Update by Jeremy Howick March 2009. 2 Park, J.S., et al. Recent global trends in testicular cancer incidence and mortality. Medicine (Baltimore), 2018. 97: e12390. https://pubmed.ncbi.nlm.nih.gov/30213007/ 3 Nigam, M., et al. Increasing incidence of testicular cancer in the United States and Europe between 1992 and 2009. World J Urol, 2014.https://pubmed.ncbi.nlm.nih.gov/25030752/ 4 Gurney, J.K., et al. International Trends in the Incidence of Testicular Cancer: Lessons from 35 Years and 41 Countries. Eur Urol, 2019. 76: 615. https://pubmed.ncbi.nlm.nih.gov/31324498/. 5 Williamson, S.R., et al. The World Health Organization 2016 classification of testicular germ cell tumours: a review and update from the International Society of Urological Pathology Testis Consultation Panel. Histopathology, 2017. 70: 335. https://pubmed.ncbi.nlm.nih.gov/27747907 6 Brierley, J.E., et al. The TNM Classification of Malignant Tumours 8th edition. 2016. https://www.wiley.com/en-gb/TNM+Classification+of+Malignant+Tumours,+8th+Edition-p-9781119263579 7 Gillessen, S., et al. Predicting Outcomes in Men With Metastatic Nonseminomatous Germ Cell Tumors (NSGCT): Results From the IGCCCG Update Consortium. J Clin Oncol, 2021. 39: 1563. https://pubmed.ncbi.nlm.nih.gov/33822655/ 8 Beyer, J., et al. Survival and New Prognosticators in Metastatic Seminoma: Results From the IGCCCG-Update Consortium. J Clin Oncol, 2021. 39: 1553. https://pubmed.ncbi.nlm.nih.gov/33729863/ 9 «Клиническая онкоурология» под редакцией Б.П. Матвеева (Москва, 2011 год) 10 Aparicio, J., et al. Patterns of relapse and treatment outcome after active surveillance or adjuvant carboplatin for stage I seminoma: a retrospective study of the Spanish Germ Cell Cancer Group. Clin Transl Oncol, 2021. 23: 58. ttps://pubmed.ncbi.nlm.nih.gov/32462393/ 11 Nayan, M., et al. Conditional Risk of Relapse in Surveillance for Clinical Stage I Testicular Cancer. Eur Urol, 2017. 71: 120. ttps://pubmed.ncbi.nlm.nih.gov/27527805/ 12 Garcia-del-Muro, X., et al. Chemotherapy as an alternative to radiotherapy in the treatment of stage IIA and IIB testicular seminoma: Spanish Germ Cell Cancer Group Study. J Clin Oncol, 2008. 26: 5416 13 Albers, P., et al. Randomized phase III trial comparing retroperitoneal lymph node dissection with one course of bleomycin and etoposide plus cisplatin chemotherapy in the adjuvant treatment of clinical stage I Nonseminomatous testicular germ cell tumors: AUO Trial AH 01/94 by the German Testicular Cancer Study Group. J Clin Oncol, 2008. 26: 2966 14 Tandstad, T., et al. Risk-adapted treatment in clinical stage I nonseminomatous germ cell testicular cancer: the SWENOTECA management program. J Clin Oncol, 2008. 26: 2966 15 Nicolai, N., et al. Retroperitoneal lymph node dissection with no adjuvant chemotherapy in clinical stage I nonseminomatous germ cell tumors: long-term outcome and analysis of risk factors of recurrence. Eur urol, 2010. 58: 912 16 Thibault, C., et al. Compliance with guidelines and correlation with outcome in patients with advanced germ-cell tumours. Eur J Cancer, 2014. 50: 1284. 17 Клинические рекомендации ESMO (утверждено группой по подготовке рекомендаций ESMO, 2016 года); 18 Журнал Онкоурология 2005г-2017, Ежеквартальный научно практический журнал. 19 Клинические рекомендации Европейской ассоциации урологов 2023г/ http://www.uroweb.org/guideline/testicular-cancer/. 20 NCCN клинические рекомендации 2023 года.
Информация
Список разработчиков протокола:
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его разработки или при наличии новых методов с уровнем доказательности.


Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.