Доброкачественные и злокачественные новообразования центральной нервной системы
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Общая информация
Краткое описание
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Доброкачественная опухоль ЦНС патологическое новообразование в головном и спинном мозге, а также в других отделах ЦНС, из зрелых клеток разных тканей, соответственно типу опухоли [8].
|
С 70
|
Злокачественное новообразование мозговых оболочек
|
| С 70.0 | Злокачественное новообразование оболочек головного мозга |
| С 70.1 | Злокачественное новообразование оболочек спинного мозга |
| С 70.9 | Злокачественное новообразованием мозговых оболочек неуточненных |
| С 71 | Злокачественное новообразование головного мозга |
| С 71.0 | Злокачественное новообразование большого мозга, кроме долей и желудочков |
| С 71.1 | Злокачественное новообразование лобной доли |
| С 71.2 | Злокачественное новообразование височной доли |
| С 71.3 | Злокачественное новообразование теменной доли |
| С 71.4 | Злокачественное новообразование затылочной доли |
| С 71.5 | Злокачественное новообразование желудочка мозга |
| С 71.6 | Злокачественное новообразование мозжечка |
| С 71.7 | Злокачественное новообразование ствола мозга |
| С 71.8 | Поражение, выходящее за пределы одной и более вышеуказанных локализаций головного мозга |
| С 71.9 | Злокачественное новообразование головного мозга неуточненной локализации |
| С 72 | Злокачественное новообразование спинного мозга, черепных нервов и других отделов центральной нервной системы |
| С 72.0 | Злокачественное новообразование спинного мозга |
| С 72.1 | Злокачественное новообразование конского хвоста спинного мозга |
| С 72.2 | Злокачественное новообразование обонятельного нерва |
| С 72.3 | Злокачественное новообразование зрительного нерва |
| С 72.4 | Злокачественное новообразование слухового нерва |
| С 72.5 | Злокачественное новообразование других и неуточненных черепных нервов |
| С 72.8 | Поражение головного мозга и других отделов центральной нервной системы, выходящее за пределы одной и более вышеуказанных локализаций |
| С 72.9 | Злокачественное новообразование центральной нервной системы неуточненного отдела |
| C75.1 | Гипофиза |
| C75.2 | Краниофарингеального протока |
| C75.3 | Шишковидной железы |
| C79 | Вторичное злокачественное новообразование других локализаций |
| C79.3 | Вторичное злокачественное новообразование головного мозга и мозговых оболочек |
| C79.4 | Вторичное злокачественное новообразование других и неуточненных отделов нервной системы |
| D 32.0 | Доброкачественное новообразование оболочек головного мозга |
| D 32.1 | Доброкачественное новообразование оболочек спинного мозга |
| D 32.9 | Доброкачественное новообразование оболочек мозга неуточненных |
| D 33 | Доброкачественное новообразование головного мозга и других отделов центральной нервной системы |
| D 33.0 | Доброкачественное новообразование головного мозга над мозговым наметом |
| D 33.1 | Доброкачественное новообразование головного мозга под мозговым наметом |
| D 33.2 | Доброкачественное новообразование головного мозга неуточненное |
| D 33.3 | Доброкачественное новообразование черепных нервов |
| D 33.4 | Доброкачественное новообразование спинного мозга |
| D 33.7 | Доброкачественное новообразование других уточненных частей центральной нервной системы |
| D 33.9 | Доброкачественное новообразование центральной нервной системы неуточненной локализации |
| D 35.2 | Доброкачественное новообразование гипофиза |
| D 35.3 | Доброкачественное новообразование краниофарингеального протока |
| D 35.4 | Доброкачественное новообразование шишковидной железы |
| D 35.5 | Доброкачественное новообразование каротидного гломуса |
| D 35.6 | Доброкачественное новообразование аортального гломуса и других параганглиев |
| D 42.0 | Новообразование неопределенного или неизвестного характера оболочек головного мозга |
| D 42.1 | Новообразование неопределенного или неизвестного характера оболочек спинного мозга |
| D 42.9 | Новообразование неопределенного или неизвестного характера мозговых оболочек неуточненных |
| D 43 | Новообразование неопределенного или неизвестного характера головного мозга и центральной нервной системы |
| D 43.0 | Новообразование неопределенного или неизвестного характера головного мозга над мозговым наметом |
| D 43.1 | Новообразование неопределенного или неизвестного характера головного мозга под мозговым наметом |
| D 43.2 | Новообразование неопределенного или неизвестного характера головного мозга неуточненное |
| D 43.3 | Новообразование неопределенного или неизвестного характера черепных нервов |
| D 43.4 | Новообразование неопределенного или неизвестного характера спинного мозга |
| D 43.7 | Новообразование неопределенного или неизвестного характера других отделов центральной нервной системы |
| D 43.9 | Новообразование неопределенного или неизвестного характера других отделов центральной нервной системы |
| D44.3 | Гипофиза |
| D44.4 | Краниофарингеального протока |
| D44.5 | Шишковидной железы |
Категория пациентов: взрослые
Шкала уровня доказательности
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++или+), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
|
Категория
|
Доказательства |
| 1A |
Мета-анализ рандомизированных контролируемых исследований
|
| 1В |
По крайней мере, 1 рандомизированное контролируемое исследование
|
| 2A |
По меньшей мере, 1 контролируемое исследование без рандомизации
|
| 2В |
По крайней мере, 1 квази экспериментальное исследование
|
| 3 |
Описательные исследования, такие как сравнительные исследования, корреляционные исследования или «случай контроль» исследования
|
| 4 |
Отчет экспертного комитета или мнение и/или клинический опыт уважаемых авторитетов
|
Классификация
Клиническая классификация:
• Для медуллобластомы используется система стадирования TM по Chang и Harisiadis.
| Т |
первичная опухоль
|
| Т1 | опухоль менее 3 см в диаметре расположена в классической срединной позиции в черве, крыше IV желудочка и реже в полушариях мозжечка |
| Т2 | опухоль диаметром не менее 3 см прорастает в одну из соседних структур или частично заполняет IV желудочек |
| Т3а | опухоль прорастет в соседние структуры или полностью заполняет IV желудочек, распространяясь в водопровод мозга, срединную апертуру IV желудочка (Мажанди) или латеральную апертуру IV желудочка (Люшка), что приводит к развитию тяжелой гидроцефалии |
| Т3b | опухоль исходит из крыши IV желудочка или ствола мозга и заполняет IV желудочек |
| Т4 | опухоль прорастает через водопровод мозга, переходит на III желудочек или срединный мозг, распространяется на верхний отдел спинного мозга |
| М | отдаленные метастазы |
| М0 | нет признаков явного субарахноидального или отдаленного гематогенного распространения опухоли |
| М1 | микроскопические клетки опухоли найдены в ликворе |
| М2 | большие узлы опухоли обнаруживаются в субарахноидальном пространстве мозжечка либо мозга, или в III, или в боковых желудочках |
| М3 | большие метастатические узлы в субарахноидальном пространстве спинного мозга |
| М4 | метастазы вне ЦНС |
Гистологическая классификация [29,30] (УД-А).
В настоящее время используется гистологическая классификация опухолей центральной нервной системы (ВОЗ 2020 года), которая основана на гистологическом варианте опухоли, степени злокачественности и молекулярногенетическом профиле [29]. Она использует двойную систему градации степени злокачественности. Первая кодирует по системе МКБ/О, где степень злокачественности обозначена цифрами через дробь:
• /0 – доброкачественная опухоль.
• /1 – опухоль промежуточной степени злокачественности.
• /2 – карцинома “in situ”.
• /3 – злокачественная опухоль.
Вторая градация степени злокачественности для новообразований ЦНС была предложена американским нейропатогистологом J.W.Kernogen и включает 4 степени злокачественности, обозначаемых арабскими цифрами (1 степень наиболее доброкачественная, a 2, 3 и 4 свидетельствуют о возрастании степени злокачественности). Степень злокачественности по данной шкале определяется ретроспективным анализом прогностических значимых факторов множества опухолей аналогичного строения, а не морфологической оценки отдельно взятой опухоли. Таким образом, она является важной с прогностической точки зрения.
Таблица 4. Классификация опухолей ЦНС по степени злокачественности
| Степень злокачественности | Клиническое течение |
| I степень (G1)* | опухоль растет медленно, имеет клетки, которые очень похожи на нормальные клетки, и редко распространяется на близлежащие ткани. Имеет низкий пролиферативный потенциал с минимальной ядерной атипией. |
| II степень (G2)* | опухоль растет медленно, но может распространиться на близлежащие ткани и может рецидивировать, т.е. характеризуются инфильтративным ростом и низким уровнем пролиферативной активности, однако склонны к рецидивированию. Также некоторые типы опухолей G2 (астроцитомы, олигодендроглиомы) обладают способностью к повышению степени злокачественности (например, астроцитома G2 с течением времени может трансформироваться в астроцитому G3-4 и глиобластому). |
| III степень (G3)** | опухоль растет быстро, это может привести к распространению в близлежащие ткани, опухолевые клетки значительно отличаются от нормальных клеток, имеют гистологические признаки злокачественности, включая ядерную атипию и выраженную митотическую активность. |
| IV степень(G4 )** | опухоль растет и распространяется очень быстро, клетки не похожи на нормальные клетки, имеют гистологические признаки злокачественного новообразования с высоким уровнем митотической активности, очаговыми некрозами и сосудистой (эндотелиальной) пролиферацией. |
| Примечание – *к опухолям низкой степени злокачественности (low grade) принадлежат опухоли G1–2 – ** к высокой степени злокачественности (high grade) – G3–4 | |
Таблица 5. Гистологическая классификация опухолей центральной нервной системы (ВОЗ 2021 года)
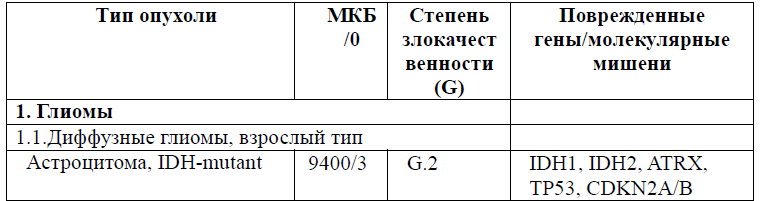
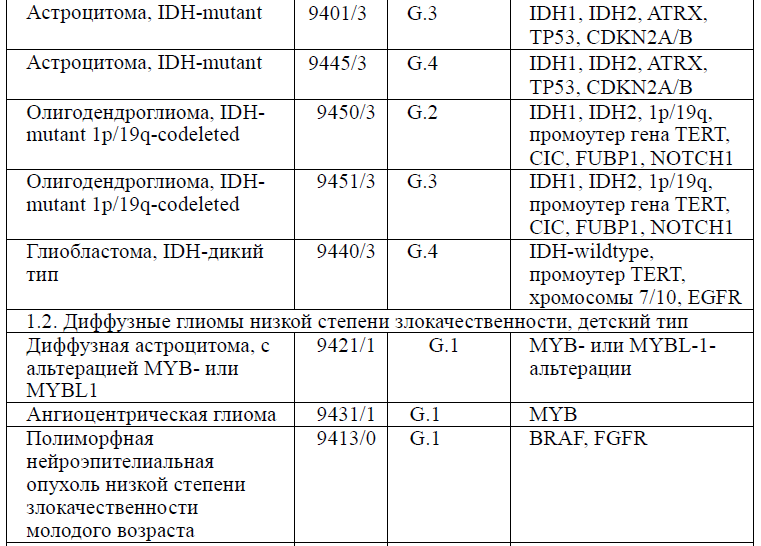
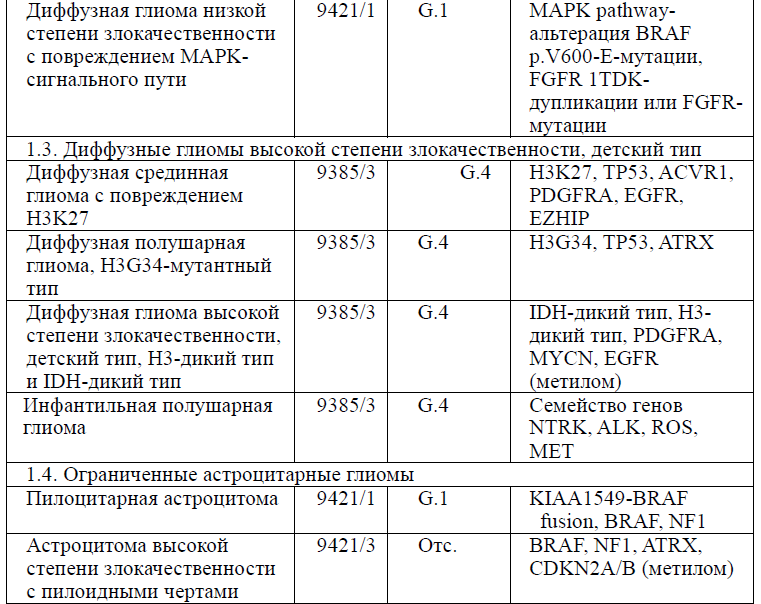
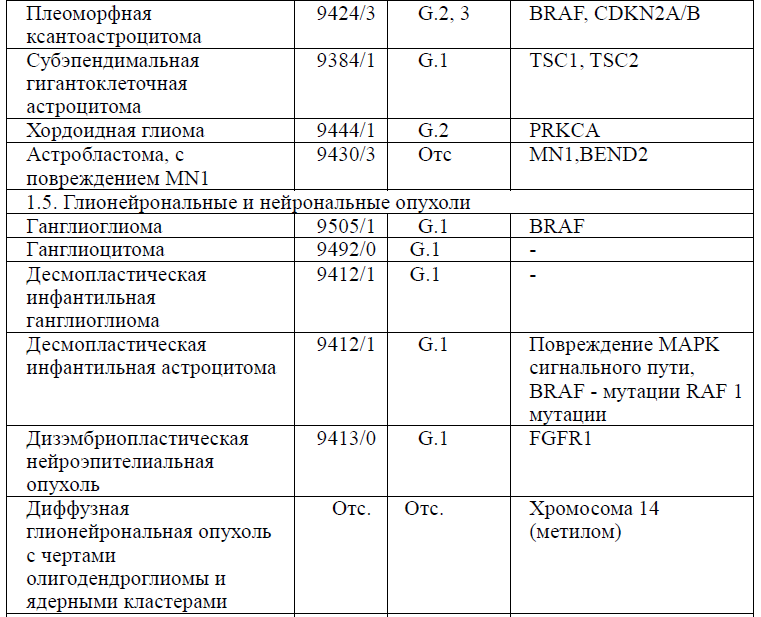
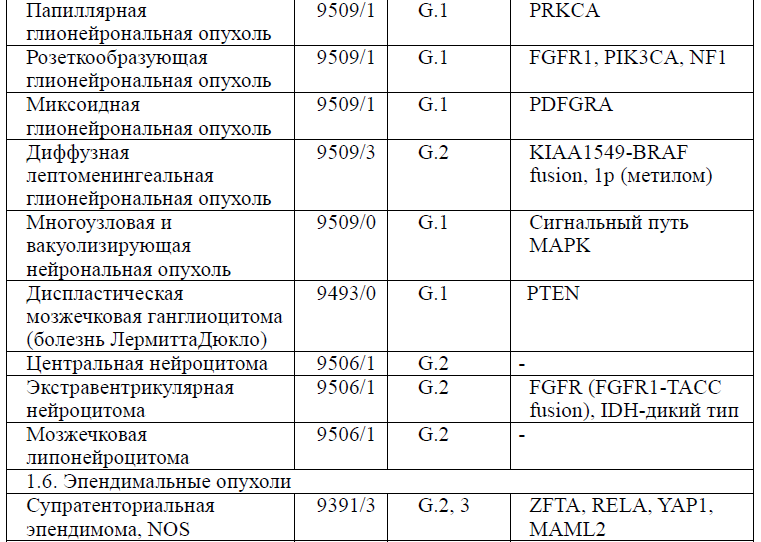
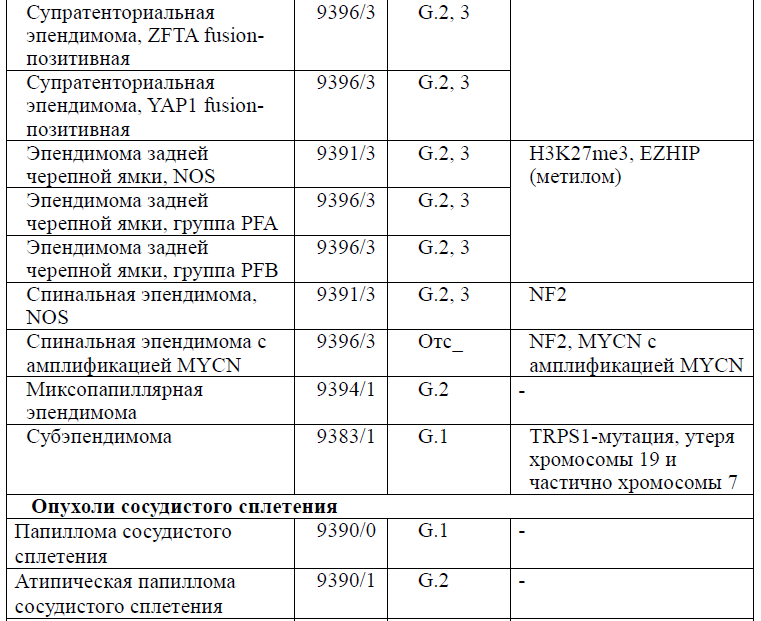
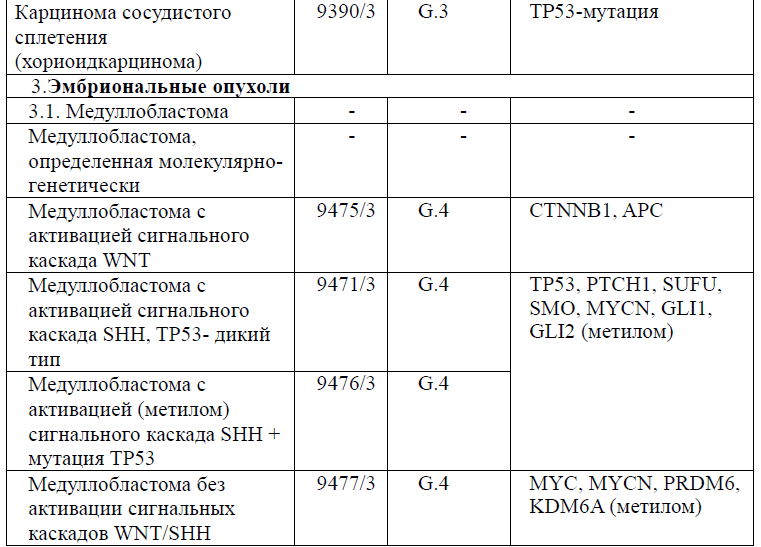
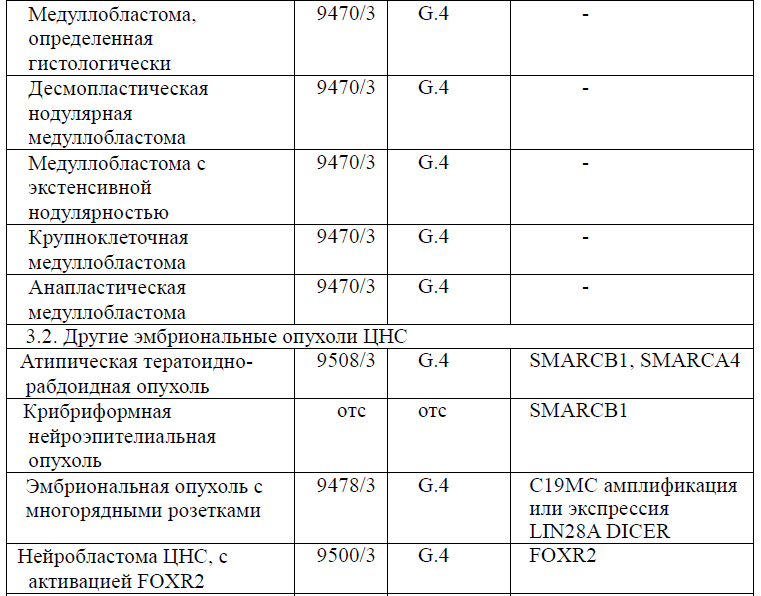
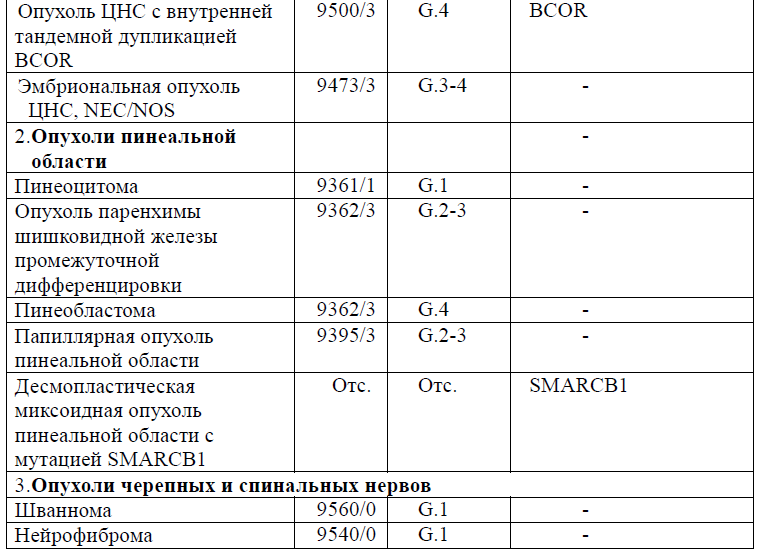
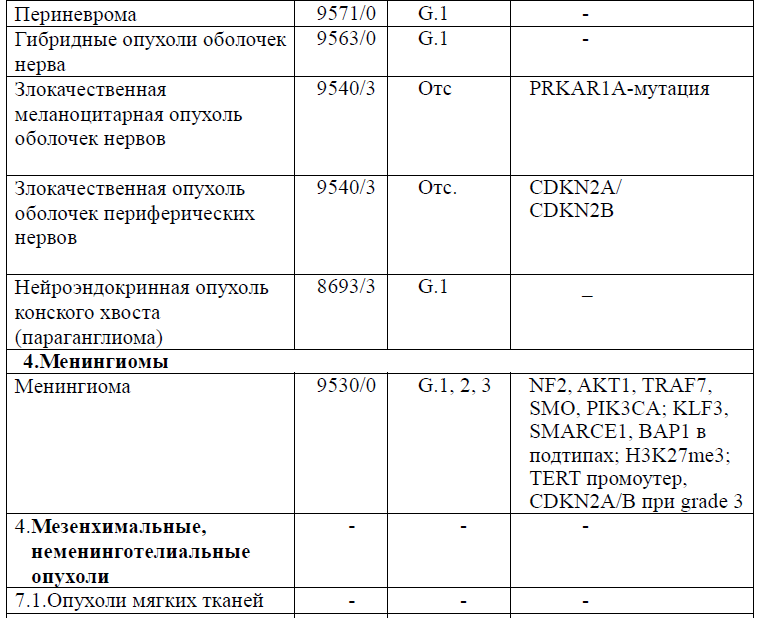
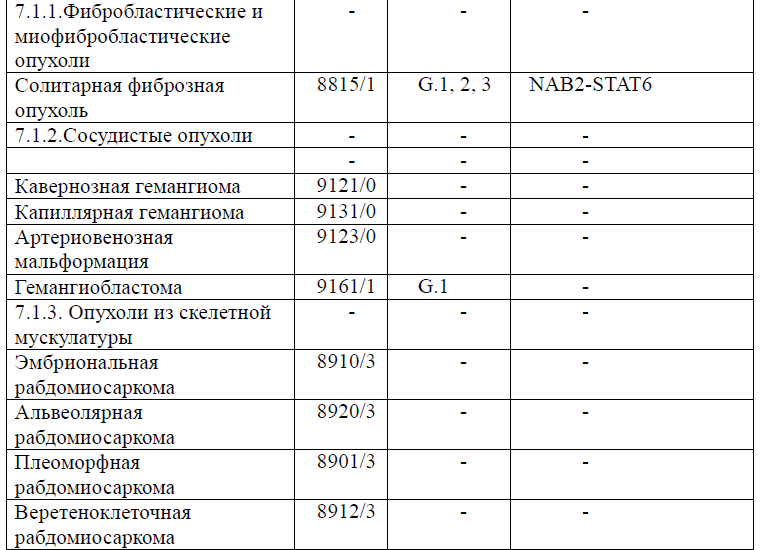
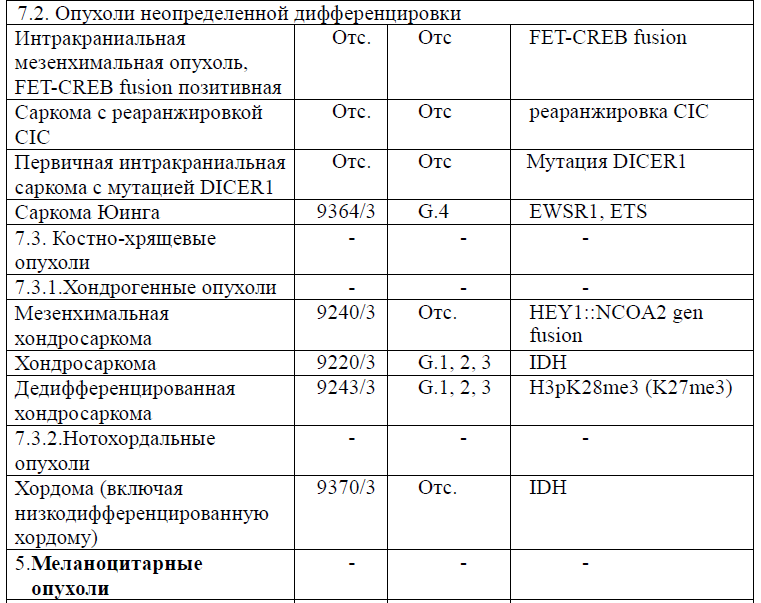
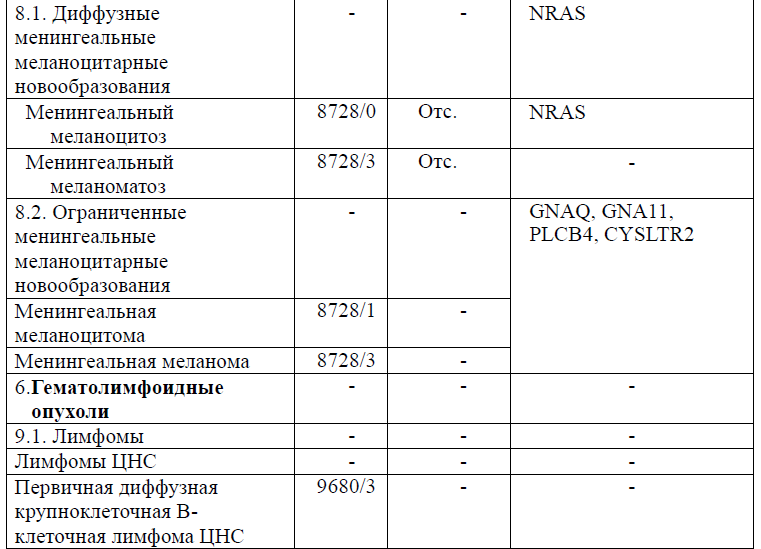
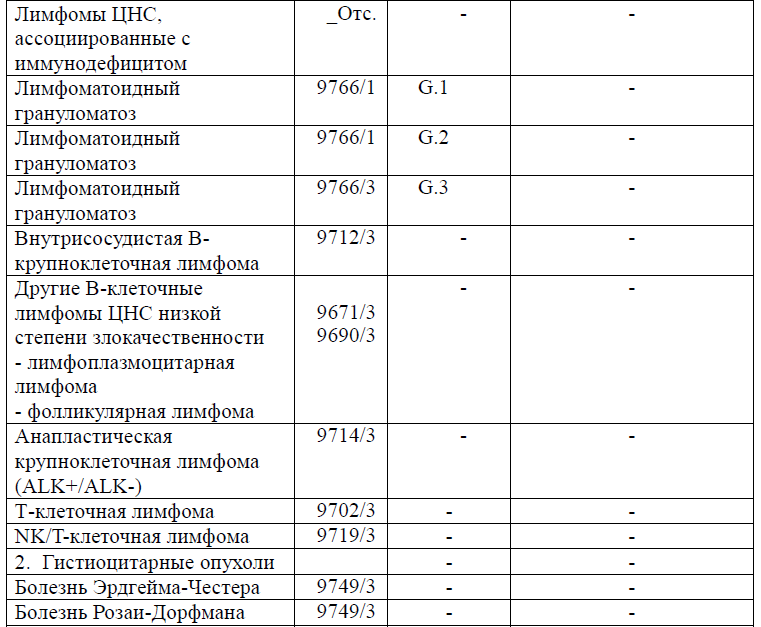
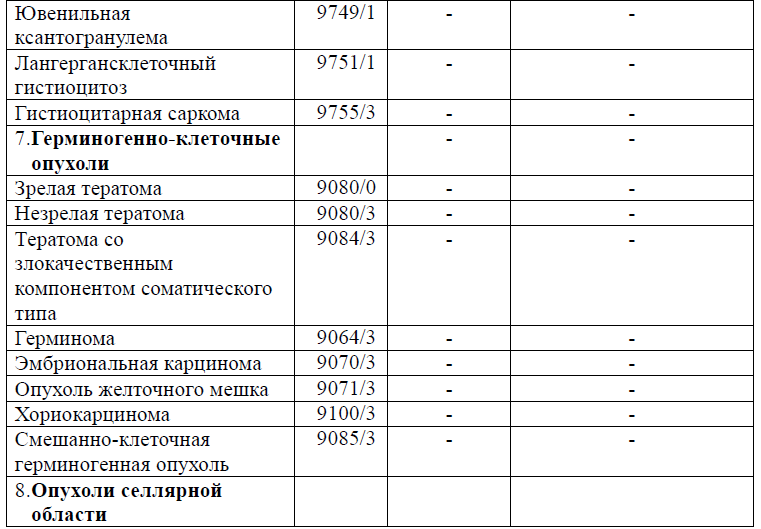
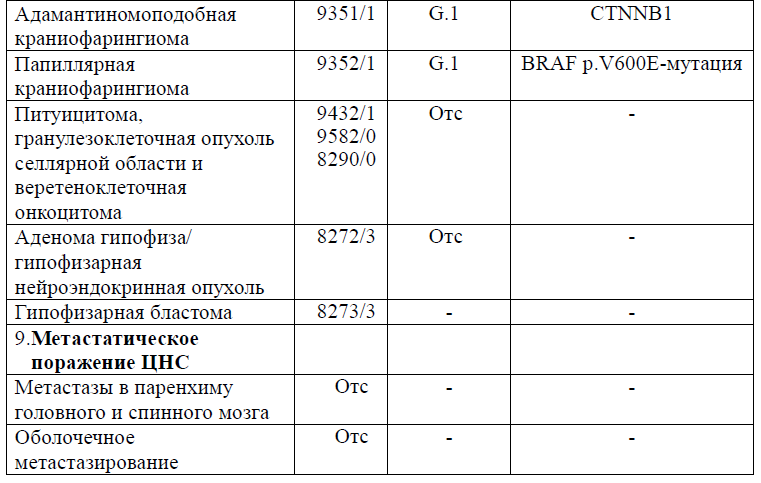
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Диагностические критерии
Жалобы и анамнез
:
• при повышении внутричерепного давления становится интенсивной, диффузной, постоянной, приступообразно усиливается и сопровождается тошнотой и рвотой. Из супратенториальных опухолей ранними головными болями сопровождаются лобные и височные опухоли.
• рвота: при опухолях головного мозга характеризуется особенностями, типичными вообще для так называемой "мозговой рвоты". В большинстве случаев рвота наступает при сильном приступе головной боли.
• головокружение: По характеру субъективного восприятия головокружение может быть зрительным и осязательным. В первом случае оно воспринимается больным, как зрительное вращение или перемещение окружающей обстановки. Во втором случае головокружение воспринимается как тактильное, или проприоцептивное ощущение вращения или движения предметов, с которыми больной соприкасается, и может сохраниться при закрытых глазах. К осязательному головокружению следует отнести и латеропульсию, т.е. ощущение влечения в сторону. При субтенториальных опухолях обычно наступает после развития других симптомов повышения внутричерепного давления. Ощущается в виде взлета на воздух, вращения окружающей обстановки или самого больного. При супратенториальных новообразованиях предметы "танцуют", что получило название "синдром гибели мира".
• судорожные припадки: в большинстве случаев протекают по общему типу. Как первый признак болезни, развиваются еще задолго до развития гипертензионного синдрома. Наблюдаются чаще всего при медленнорастущих доброкачественных опухолях.
Общие синдромы:
• гипертензионный синдром, связанный с повышением внутричерепного давления;
• очаговые неврологические симптомы;
• окклюзионная гидроцефалия;
• дислокационный синдром.
• Гипертензионный синдром. Повышение внутричерепного давления в результате увеличения объема мозга и нарушения гемо - и ликвородинамики. Головная боль, рвота, головокружение, психические расстройства, эпилептические припадки, застойные диски зрительных нервов.
• Очаговые неврологические симптомы. Эпилептические припадки различного характера, своеобразные нарушения ВНД, нарушение координации движений в виде фронтальной атаксии (расстройства стояния и ходьбы), изолированное нарушение иннервации лицевой мускулатуры по центральному типу, нарушение обоняния, нарушения функции зрительных нервов.
• Окклюзионная гидроцефалия. Закрытая форма гидроцефалии встречается при окклюзии отверстий Монро, сильвиева водопровода, 4-го желудочка, отверстия Мажанди или Люшка. Причинами является полная или частичная окклюзия ликворопроводящих путей, нарушение резорбции ликвора, а при опухолях боковых желудочков – гиперпродукция спинномозговой жидкости.
• Дислокационный синдром. Обусловлен сдавлением мозга опухолью, кровоизлиянием или другим очаговым процессом, что приводит к появлению вторичных симптомов поражения мозга на отдалении патологического очага. С повышением внутричерепного давления мозговое вещество выдавливается в различные щели, образованные плотными отростками твердой мозговой оболочки (большой серповидный отросток, мозжечковый намет), перегораживающий полость черепа на разные этажи и отделяющий части мозга друг от друга, а так же в большое затылочное отверстие.
• При опухолях позвоночного канала - парезы, параличи верхних и нижних конечностей, парестезии, гиперестезии, нарушения функций внутренних органов, боли по ходу позвоночного столба или в месте локализации опухоли, патологические неврологические симптомы.
Физикальное обследование:
• Оценка неврологического статуса: наличие жалоб на головную боль, тошноту и рвоту, головокружение, судорожные припадки и общемозговых синдромов и очаговых неврологических симптомов.
• Общесоматического статус по Карновскому ниже 80 % (приложение 1), Статус по шкала Глазго (приложение 2).
Лабораторные исследования:
• Общеклинические и специфические лабораторные исследования для оценки соматического статуса и выявления патологии внутренних органов по показаниям.
• Гистологическое, иммуногистохимическое и молекулярно-генетическое исследование биоптата и операционного материала по показаниям.
• Для уточнения прогноза, пациентам при анапластической астроцитоме и глиобластоме: молекулярно-генетическое исследование мутаций в генах IDH1 и IDH2 в биопсийном (операционном) материале, определение метилирования гена MGMT в биопсийном (операционном) материале, при олигодендроглиоме (Grade II–III) и олигоастроцитоме (Grade II–III) – молекулярно-генетическое исследование транслокации 1p/19q в биопсийном (операционном) материале.
Инструментальные исследования:
• Клинический диагноз выставляется на основании данных МРТ головного или спинного мозга с контрастным усилением, когда выявляется объемное образование - опухоль.
• В случаях, когда МРТ исследование противопоказано диагноз выставляется на основании КТ исследования с контрастированием.
• По необходимости могут быть выполнены КТ или МР ангиография, МР- трактография, функциональная МРТ, ПЭТ КТ. • ПЭТ/КТ исследование головного мозга с использованием радиофармацевтического препарата – 11С метионин применяется для определения злокачественности первичной опухоли и для дифференциации рецидива опухоли от радиационного некроза.
• КТ исследование головного мозга с контрастированием применяется для диагностики ранних послеоперационных осложнений [33] (УД-A).
Показания для консультации специалистов:
• Врача терапевта, кардиолога – при обострении общесоматической сопутствующей патологии, коррекция лечения общесоматической сопутствующей патологии на фоне специального лечения;
• Врача оториноларинголога - при обострении сопутствующей патологии со стороны ухо, горло, носа, перед и после операции: трансназальное и трансфеноидальное удаление опухолей;
• Врача офтальмолога – у всех больных с внутримозговыми опухолями;
• Врача психиатра, невропатолога – для коррекции психосоматического состояния.
Диагностический алгоритм:
• Клиническая картина складывается из общемозговых и локальных знаков. Общемозговые симптомы обусловлены повышением внутричерепного давления: головная боль, рвота, застойные диски зрительных нервов и др. В зависимости от гистологической структуры опухоли и ее локализации быстрота развития общемозговых и очаговых симптомов широко варьирует. Чаще всего клиническая картина формируется на протяжении многих месяцев, а иногда и лет. Очаговые симптомы зависят от локализации опухоли [2-5,8,23] (УД-А).
• При наличии клинических проявлений МРТ исследование головного и/или спинного мозга и позвоночника с контрастированием. При имеющихся противопоказаниях к МРТ исследованию КТ исследование головного и/или спинного мозга и позвоночника с контрастированием.
Схема - 1. Алгоритм диагностики доброкачественных и злокачественных новообразований центральной нервной системы.
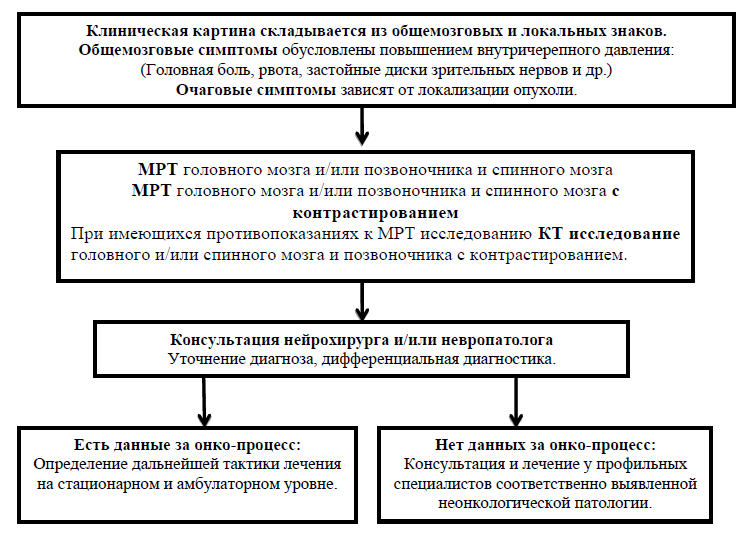
Дифференциальный диагноз
Дифференциальный диагноз
Таблица 6. Дифференциальная диагностика между опухолями головного мозга и неонкологическими заболеваниями.
| Неонкологические заболевания | Диагностические признаки | Критерии дифференциальной диагностики |
| Инсульт ишемический или гемморагический | Очаговые неврологические симптомы | МРТ головного мозга в сосудистом режиме, с контрастным усилением, церебральная ангиография выявляются признаки опухолевого процесса |
| Абцесс, инфекционные или паразитарные заболевания | Очаговые неврологические симптомы |
В спинномозговой жидкости после люмбальной пункции – незначительный цитоз, чаще всего лимфоцитарный, умеренная белковоклеточная диссоциация. На ангиограмме обнаруживается бессосудистая зона, что является очень показательным отличием абсцесса от опухоли (при опухоли нередко, наоборот, выявляется зона избыточной васкуляризации). На МРТ головного мозга в сосудистом режиме, с контрастным усилением, выявляются признаки опухолевого процесса. |
| Мальформация | Очаговые неврологические симптомы | На МРТ головного мозга с контрастным усилением, выявляются признаки опухолевого процесса. |
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ
План лечения обсуждается мультидисциплинарной группой на базе специализированных центров и должен учитывать [24;27]:
• Распространенность опухолевого процесса (клиническая стадия течения заболевания);
• Объективное состояние пациента;
• Прогноз основного заболевания;
• Сопутствующую патологию;
• Пожелания пациента.
Немедикаментозное лечение:
• Режим: при проведении консервативного лечения – общий;
• Диета: стол №15.
Медикаментозное лечение:
Противоопухолевая лекарственная терапия проводится с использованием химиопрепарата темозоламид, перорально, с учетом морфологического варианта опухоли. Целью лекарственной терапии опухолей головного мозга является увеличение продолжительности жизни, снижение частоты симптомов заболевания и улучшение качества жизни пациентов.
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
| Лекарственная группа | Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
|
Алкилирующие агенты
|
Темозоломид |
150 - 200 мг/м2
внутрь в 1-5 й дни, цикл 28 дней
|
А |
| Лекарственная группа | Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Ингибиторов BRAF | Дабрафениб |
150 мг внутрь 2 раза в день ежедневно
|
А |
| Ингибиторов МЕК | Траметиниб |
2 мг внутрь 1 раз в день ежедневно
|
В |
| Ингибиторов BRAF | Вемурафениб |
960 мг внутрь 2 раза в день ежедневно
|
А |
| Ингибиторов МЕК | Кобиметиниб |
60 мг внутрь 1 раз в день в 1-21-й дни каждые 4 недели
|
В |
Хирургическое вмешательство: нет.
Дальнейшее ведение:
Режим наблюдения:
первый год – 1 раз в 3 мес.;
второй год – 1 раз в 6 мес.;
в последующем, пожизненно – 1 раз в год.
Объем обследования:
Сбор жалоб, анамнез, осмотр и оценка соматического и неврологического статуса;
лабораторные исследования – ОАК, БАК, ОАМ, коагулограмма и другие по показаниям.
Общеклинические инструментальные обследования: ЭКГ, ЭхоКГ, УЗИ органов брюшной полости, УЗИ органов малого таза и другие по показаниям.
КТ органов грудной клетки с/без контрастирования по показаниям.
КТ органов брюшной полости с/без контрастирования по показаниям.
Обзорная рентгенография органов грудной клетки по показаниям.
МРТ или КТ головного мозга, шейного, грудного, пояснично-крестцового отделов позвоночника с/без контрастного усиления по показаниям.
Консультации специалистов и специфические методы обследования для исключения патологии органов и систем по показаниям.
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе:
• Удовлетворительное состояние при условии отсутствия осложнений и заживления п/о раны;
• Данные, свидетельствующие об отсутствии признаков прогрессирования процесса, полученные клиническими и/или визуализирующими методами исследования, а также повышение качества жизни больного.
Критерии эффективности лечения:
• полный эффект – исчезновение всех очагов поражения на срок не менее 4х недель;
• частичный эффект – большее или равное 50% уменьшение всех или отдельных опухолей при отсутствии прогрессирования других очагов;
• стабилизация – (без изменений) уменьшение менее чем на 50% или увеличение менее чем на 25% при отсутствии новых очагов поражения;
• прогрессирование – увеличение размеров одной или более опухолей более 25% либо появление новых очагов поражения.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ
Цели лечения
:
достижение полной или частичной регрессии;
стабилизации опухолевого процесса, путем оперативного, лучевого или лекарственного (химиотерапия) лечения.
Карта наблюдения пациентов, маршрутизация пациентов. В зависимости от гистологической структуры опухоли, степени злокачественности.
Лечение больных с опухолями ЦНС проводится только в специализированных нейрохирургических и онкологических лечебных учреждениях. В настоящее время стандартные методы лечения опухолей ЦНС – хирургическое лечение, лучевая терапия, химиотерапия.
Первый этап – хирургическое вмешательство (лечебное или диагностическое: открытая или стереотаксическая биопсия). Основной принцип нейрохирургии – анатомическая доступность, физиологическая дозволенность.
Далее учитывается гистологическая форма и степень злокачественности, распространение процесса, размеры и локализация опухоли.
Хирургическое вмешательство проводится в нейрохирургических или нейроонкологических отделениях, после чего пациенты для дальнейшего лечения направляются в учреждения онкологического профиля, куда передаются данные общеклинического обследования, описание оперативного вмешательства, гистологических стеклопрепаратов и парафиновых блоков биоптатов, дооперационной и послеоперационной МРТ и/или КТ в формате DICOM на электронных носителях или пленке.
При наличии показаний проводится специальное противоопухолевоелечение. Показаниями к назначению данного вида лечения являются наличие злокачественной опухоли со степенью злокачественности GI при нерадикальной операции, GII-GIII-GIV при нерадикальной или радикальной операции, а также при доброкачественных опухолях в случае нерадикальности проведенного оперативного вмешательства.
Лучевой терапии принадлежит важная роль в лечении целого ряда опухолей головного мозга и других отделов ЦНС. В случаях, когда лучевая терапия – обязательный компонент лечения, больные после заживления операционной раны и при отсутствии угрозы послеоперационных осложнений переводятся из нейрохирургического отделения в онкологическое учреждение для дальнейшего проведения специального лечения. Лучевую терапию начинают на 14–56 сутки после хирургического вмешательства [4-6,14,17,18,16,23] (УД-А).
Во всех остальных случаях вопрос о необходимости лучевой терапии решается на МДГ (консилиум) в составе лучевого терапевта (радиационного онколога), клинического онколога, нейрохирурга и других специалистов по необходимости.
Химиотерапия назначается только при истинно злокачественных опухолях со степенью злокачественности GIII-GIV. Схема химиотерапии подбирается в зависимости от гистологической формы опухоли, распространенности и группы риска. Используются различные виды химиотерапии (системная, интратекальная) и различные режимы (адъювантный, неоадъювантный, самостоятельный). Также возможно проведение одновременной химио-и лучевой терапии.
Немедикаментозное лечение
Лучевая терапия
Показания к лучевой терапии:
морфологически установленный диагноз – злокачественная или доброкачественная опухоль ЦНС, после операции или биопсии (открытой, стереотаксической);
клиническом диагнозе установленным на основании клинико- инструментальных методов исследования (КТ/МРТ с контрастированием и/или ПЭТ-КТ) без морфологической верификации в виду невозможности проведения оперативного лечения или биопсии опухоли (открытой или стереотаксической) следующих локализаций: ствол головного мозга, аденома гипофиза, опухоль основания черепа, опухоль пинеальной области, опухоль хиазмально-селлярной области и др.;
при рецидивах или продолженном росте опухоли после ранее проведенного комбинированного или комплексного лечения, где использовался лучевой компонент.
Противопоказания к лучевой терапии:
особенности локализации опухоли и характера ее инфильтративного роста в области таких жизненно важных отделов мозга, как ствол, гипоталамус, подкорковые узлы;
отек головного мозга с клиническими признаками дислокации в полости черепа;
послеоперационная гематома;
гнойно-воспалительные очаги в зоне предстоящих хирургических манипуляций;
общесоматическое инкурабельное состояние больного неконтролируемое психомоторное возбуждение, неадекватное поведение больного.
Методики лучевой терапии при опухолях головного мозга и других отделов ЦНС:
2-х мерная конвенциальная (стандартная) лучевая терапия (2D RTC);
3-х мерная конформная лучевая терапия (3D CRT);
интенсивно-модулированная лучевая терапия (IMRT);
лучевая терапия, управляемая по изображениям (IGRT);
стереотаксическая радиохирургия (SRS);
стереотаксическая радиотерапия (SRT);
протонная лучевая терапия (ПЛТ);
интраоперационная лучевая терапия (IORT);
томотерапия на томоаппаратах;
брахитерапия.
Техническое обеспечение предлучевой подготовки и лучевой терапии:
Предлучевая топометрическая подготовка должна проводиться на рентгеновском диагностическом аппарате, рентгеновском симуляторе, рентгеновском симуляторе с компьютерно-томографической приставкой для CBCT, компьютерном томографе со специально приспособленной декой стола, компьютерном томографе-симуляторе, компьютерном томографе с функцией виртуальной симуляции, магнитно-резонансном томографе с функцией виртуальной симуляции.
ДЛТ должна проводиться на гамма-терапевтических аппаратах с источником кобальт (Co60), линейных ускорителях электронов, томоаппаратах. При наличии у ЛУЭ MLC и EPID возможно проведение высокотехнологических методик облучения: 3D CRT, IMRT. При наличии у ЛУЭ OBI для киловольтной визуализации возможно проведение высокотехнологических методик облучения: IGRT, SRS, SRT.
Протонная лучевая терапия должна проводиться на высокотехнологичном оборудовании: медицинском линейном ускорителе заряженных частиц протонами с использованием изохронного циклотрона с суперпроводящими электромагнитами (так называемого суперпроводящего циклотрона). Его энергетические возможности осуществляют доставку доз радиации к опухолям, залегающим на глубине 4-30 см, обеспечивая широчайший энергетический диапазон для лечения – без использования переключателей диапазона действия. Особенность протонной лучевой терапии позволяет значительно уменьшить дозовую нагрузку на здоровые окружающие ткани, окружающие объем мишени, по сравнению с традиционными методами лучевой терапии пучками фотонов и электронов. В результате создаются условия для безопасного повышения дозы в объеме мишени (без превышения толерантных доз для здоровых окружающих тканей), даже если мишень близко примыкает к критическим структурам организма. Более высокая доза приводит, соответственно, к повышению вероятности гибели раковых клеток.
Одним из вариантов высокотехнологичной лучевой терапии является Томотерапия – спиральное (гелическое “helical”) облучение, проводимое на специализированных линейных ускорителях – томоаппаратах. При их работе происходит одновременное ротационное движение во время сеанса облучения головки аппарата и лепестков (секторное IMRT) с одновременным поступательным продольным смещением стола. Используются как стандартные методики фракционирования при подведении разовых и суммарных очаговых доз. Однако упор при томотерапии делается на гипофракционирование при РОД<2,5 Гр.
Интраоперационная лучевая терапия должна проводиться на специальных радиотерапевтических аппаратах для интраоперационного облучения – мини линейных ускорителях или мини бетатронах, доза подбирается индивидуально.
Брахитерапия должна проводиться на брахитерапевтических гамма – аппаратах со специальными иглами и матрицами для внутритканевой лучевой терапии.
Обязательно наличие иммобилизационных и фиксирующих приспособлений: специальных фиксирующих досок для термопластических масок и подголовников, стереотаксической рамки для проведения SRS или SRT, подколенников и подстопников, вакуумных матрасов.
Наличие программ компьютерного дозиметрического планирования для конвенциальной и высокотехнологичной лучевой терапии (3DCRT, IMRT, SRS, SRT).
Минимальный или расширенный пакет стандартного дозиметрического оборудования.
Режимы фракционирования дозы во времени:
а) Классический (стандартный) режим фракционирования: РОД 1,8-2,4 Гр до 5 фракций в неделю, расщепленный или непрерывный курс, до СОД 24,0-70,0 Гр. Используется при крупных и /или диффузно-растущих опухолях различной гистологической природы (в основном глиомы grade I–IV), а также при облучении путей возможного метастазирования опухоли (краниоспинальное облучение);
б) Режим гипофракционирования РОД >2,5 Гр до 5 фракций в неделю, расщепленный или непрерывный курс, до СОД > 15,0 Гр. Используется при опухолях с четкими границами либо с минимальной (до 3–5 мм) зоной возможной инфильтрации тканей, а также при образованиях более 3 см и/или опухолях, располагающихся вблизи критических структур мозга;
в) Режим гиперфракционирования (мультифракционирования): РОД 1,0-1,25 Гр 2 раза в день через 4-6 и 20-18 часов, расщепленный или непрерывный курс, до СОД 24-70 Гр;
г) Стереотаксическая радиохирургия – одномоментное подведение высокой дозы (РОД 12 Гр и более) с использованием стереотаксической техники; применяется при небольших опухолях (до 3 см в максимальном измерении) с четкими границами (пилоидные астроцитомы, эпендимомы, менингиомы, невриномы, аденомы гипофиза, краниофарингиомы и др.);
д) Стереотаксическая радиотерапия (SRT) - крупнофракционное облучение от 2х до 5 фракций РОД > 7,0 Гр ежедневно до СОД >14 Гр. В основном применяется при опухолях диаметром более 3 см, но можно и при небольших опухолях до 3,0 см в наибольшем измерении.
• Стандартным лечением после резекции или биопсии является фракционированная локальная радиотерапия: до СОД 40-60 Гр, при РОД 1,8-2,5 Гр; или эквивалентная им доза/фракционирование (стандарт) с учетом линейно- квадратической модели (α/β 2,0 для головного мозга и α/β 8,0-10,0 для опухоли). При этом общий объем мозгового вещества, облучаемый в высоких суммарных дозах, должен быть максимально уменьшен [2-6].
• Увеличение суммарной очаговой дозы более 60 Гр не влияло на эффект. У пожилых пациентов, а так же у больных с плохим общим статусом предлагается обычно использовать короткие гипофракционированные режимы (например СОД 30,0-45,0 Гр при РОД >3,0 Гр).
• При лечении злокачественных опухолей (grade III–IV) ЛТ следует начинать в сроки от 2 до 6 недель после операции, в ряде случаев – в комбинации с химиотерапией.
• После ЛТ возможно возникновение постлучевых повреждений вещества головного или спинного мозга, в том числе лучевого некроза (до 10−15% случаев). В таких ситуациях необходим тщательный анализ протокола облучения (объем, общая доза) и общемедицинских параметров: возраст пациента, наличие или отсутствие сопутствующих заболеваний (гипертоническая болезнь, диабет и др.). При появлении признаков радионекроза, энцефалопатии показано выполнение ПЭТ с метионином или КТ/МРТ-спектроскопии, КТ/МР-перфузии с целью дифференциального диагноза между лучевым некрозом и рецидивом опухоли (рекомендация). В лечении лучевого некроза может использоваться бевацизумаб.
Подготовка к лучевой терапии:
• Выбор позиции пациента и фиксирующей термопластической маски.
• Разметка (центрация) на рентгеновском симуляторе.
• КТ топометрия на КТ аппаратах. Дополнительная опция топометрия на МРТ аппаратах с функцией виртуальной симуляции (при наличии).
• Совмещение данных КТ и МР (ко-регистрация).
• Контурометрия (очерчивание).
• Компьютерное дозиметрическое планирование лучевой терапии медицинскими физиками, т.е. расчёт плана лучевой терапии.
• Совместное обсуждение и утверждение плана лучевой терапии с медицинскими физиками (утвердить план может только лучевой терапевт- радиолог!).
• Симуляция – проверка дозиметрического плана при рентгеноскопическом контроле рентгеновского симулятора.
• Первая укладка пациента в присутствии врача и медицинского физика. Другие методы облучения, в частности, тяжелыми частицами, брахитерапия, интраоперационная ЛТ, бор-нейтрон-захватная терапия, могут быть использованы только в рамках клинических исследований.
Таблица 7 Спецификация объемов облучения основных форм опухолей ЦНС:
|
Гистологический тип опухоли
|
Выбор объема мишени (GTV и CTV) и оконтуривание
|
|
GIII-IV (высокая степень злокачественности):
астроцитомы, олигодендроглиомы, смешанные глиомы, нейрональные и смешанные нейроглиальные опухоли
|
На КТ: опухоль с зоной контрастного усиления и/или послеоперационная киста.
На МРТ: опухоль с гиперденсивной зоной на Т2 взвешенных снимках (локальные поля)
|
| GTV = объем опухоли с зоной контрастного усиления и/или послеоперационная киста (локальные поля) | |
| CTV = GTV + 2 см - при полном удалении опухоли, + 3 см - при частичном удалении опухоли, включая зону перифокального отека (локальные поля) | |
| CTV = GTV + 1 см - при полном удалении опухоли, +2 см при частичном (локальные поля) | |
|
GI-II IV (низкая степень злокачественности):
астроцитомы, олигодендроглиомы, смешанные глиомы, нейрональные и смешанные нейроглиальные опухоли
|
GTV = объем опухоли с зоной контрастного усиления и/или послеоперационная киста |
| CTV = GTV +1 см при полном удалении | |
|
GI-II менингиома
|
GTV = объем опухоли с зоной контрастного усиления
|
|
CTV = GTV + 2 см
|
|
|
GIII менингиома
|
GTV = объем опухоли с зоной контрастного усиления и/или послеоперационная киста
|
|
CTV = GTV + 2 см при тотальном удалении и + 3 см при частичном удалении
|
|
|
Эмбриональные опухоли, эпендимомы (Spine +), пинеобластома GIV
|
Краниоспинальное облучение
|
|
CTV = объем всего головного и спинного мозга (нижняя граница спинномозгового поля находится на уровне SIII)
|
|
|
GTV = объем опухоли с зоной контрастного усиления либо послеоперационная киста (начальные поля)
|
|
|
CTV = GTV + 1-2 см (отступ для опухолей основания черепа должен составлять1 см; отступ для опухолей спинномозгового канала - 1,5-2 см) (локальные поля)
|
|
|
Эпендимома (Spine -)
|
GTV = объем опухоли с зоной контрастного усиления и/или послеоперационная киста
|
|
CTV = GTV + 1-2 см
|
|
|
Опухоли ствола головного мозга
|
GTV = объем опухоли с зоной контрастного усиления
|
|
СTV = GTV + 2 см
|
|
|
Опухоли гипофиза
|
GTV = объем опухоли с зоной контрастного усиления
|
|
СTV = GTV +1 см
|
|
| Опухоли спинного мозга | GTV = объем опухоли с зоной контрастного усиления |
| СTV = GTV + 2 см | |
| Первичные лимфомы ЦНС | CTV = объем всего головного мозга |
| Герминоклеточные опухоли | При диссеминации по спинномозговой жидкости: CTV = объем всего головного и спинного мозга (начальные поля) |
| При отсутствии диссеминации по спинномозговой жидкости: CTV = желудочковая система (локальные поля) GTV = объем опухоли с зоной контрастного усиления (локальные поля) для головного мозга за весь курс лучевой терапии) CTV = GTV + 2 см | |
| Опухоли паренхимы шишковидной железы (GII– III), опухоли селлярной области | Опухоли паренхимы шишковидной железы (GII– III), опухоли селлярной области |
| GTV = объем опухоли с зоной контрастного усиления | |
| Метастатические опухоли головного мозга (при наличии метастатического поражения других органов вопрос о специальном лечении решается индивидуально) | CTV = объем всего головного мозга |
| При остаточном солитарном очаге возможно дополнительное локальное облучение: CTV = объем опухоли + 1 см | |
| Критические органы |
глазные яблоки хрусталики n. opticus chiasma opticum ствол мозга головной мозг спинной мозг |
Лучевая терапия при отдельных локализациях:
• При диффузно растущих опухолях различной гистологической природы (в основном глиомы Grade I–IV, менингиомы, невриномы и др.), а также при проведении облучения путей возможного метастазирования опухоли (медуллобластомы, герминомы, анапластические эпендимомы и др.) рекомендован режим гипофракционирования с разовой очаговой дозой РОД 3 Гр и более.
• У пациентов со злокачественными глиомами пожилого возраста (старше 70 лет) возможно применение режима гипофракционирования с РОД 3 Гр и СОД 45 Гр.
• При эпендимомах с наличием метастазирования (при до/послеоперационном МРТ головного и спинного мозга) рекомендуется проведение КСО с СОД 36,0 Гр и РОД 1,8 Гр. При выявлении опухоли в спинном мозге рекомендуется проведение буст-терапии до 45,0–59,4 Гр. Следует учитывать, что профилактическое краниоспинальное облучение или облучение всего мозга не улучшает выживаемость по сравнению с локальной лучевой терапией и рекомендовано только пациентам с доказанным распространением по ЦНС. При эпендимоме с локализацией в спинном мозге и неполной резекцией опухоли ЛТ проводится до СОД 45,0 Гр. Возможен буст до СОД 50,4–59,4 Гр.
• При «чистых» гермином рекомендуется облучение желудочковой системы. После полихимиотерапии на основе препаратов платины для контроля заболевания необходимо облучение желудочковой системы в дозе 21,6–25,5 Гр с облучением в ряде случаев ложа опухоли в дозе 30–40 Гр (при наличии остаточной опухоли) с бустом в ряде случаев на область остаточной опухоли и метастазов (если они визуализируются по данным МРТ с контрастным усилением после завершения курса КСО) до СОД 30–45: GTV = область желудочковой системы + ложе опухоли; CTV = GTV + 5 мм; РОД = 1,8–2,0 Гр, СОД = 24,0 Гр.
• При бифокальных герминомах с поражением пинеальной и хиазмальноселлярной областей (без признаков диссеминации) лечение может быть начато с проведения ПХТ (и/или ЛТ) без гистологической верификации (опция). Облучение желудочковой системы проводится с РОД 1,8–2,0 Гр, СОД 24,0 Гр, в ряде случаев с локальным бустом или без него до СОД 40,0 Гр.
• Пациентам с негерминомными герминативно-клеточными опухолями ЦНС рекомендуется применение полихимиотерапии на основе препаратов платины, ЛТ (КСО 24–35 Гр, локально 40–56 Гр), а также резекция остаточной опухоли [18].
• Основной метод лечения зрелых тератом - максимально возможное удаление опухоли. При тотальном удалении адъювантное лечение не требуется. При частичном удалении применяются стереотаксические методики ЛТ и радиохирургия.
• При глиомах низкой степени злокачественности (Grade I-II) показана лучевая терапия с РОД 1,8–2,0 Гр до СОД 50,4–54,0 Гр или РОД 2,5 Гр до СОД 50 Гр. В объем облучения необходимо включать остаточную опухоль и/или ложе опухоли (для определения объемов облучения рекомендовано использование следующих режимов МРТ: Т1 c контрастным усилением, Т2-FLAIR). В СТV входит GTV + 0,5 – 1,0 см.
• При глиомах высокой степени злокачественности (Grade III–IV) в GTV необходимо включать остаточную опухоль и/или ложе опухоли. СTV = GTV + 1,5–2,0 – 3,0 см (рекомендовано использование следующих режимов МРТ: Т1 c контрастным усилением, Т2-FLAIR). Режим фракционирования облучения РОД 1,8 - 2,0 Гр до СОД 59,4 - 60 Гр, РОД 2,5 Гр СОД 55,0-60,0 Гр. При СОД 46,0 Гр при РОД 2,0 Гр и 50,4 Гр при РОД 1,8 Гр возможно сокращение объема облучения (буст). На фоне ЛТ рекомендуется рассмотреть прием темозоломида** [22] (см. раздел 3.3).
• При медуллобластомах (взрослые): стандартном риске – применение КСО с РОД 1,8 Гр до СОД 23,4 Гр. На ложе опухоли подводится буст с РОД 1,8 Гр до СОД 54,0 Гр; при высоком риске – применение КСО с РОД 1,8 Гр до СОД 36,0 Гр. На ложе опухоли подводится буст с РОД 1,8 Гр до СОД 54,0 Гр.
• При диффузной глиоме моста, среднего мозга, ствола мозга необходимо применение стереотаксической техники облучения до СОД 54 Гр за 30 фракций. В CTV включаются видимая опухоль + ствол головного мозга + 0,5–1,0 см.
• При менингиомах (Grade I–III) GTV включает контрастируемую часть опухоли и гиперостотические изменения. Включение «дурального хвоста» в GTV решается в индивидуальном порядке. При менингиоме Grade II в GTV может быть включено ложе удаленной опухоли. При менингиоме Grade III в GTV обязательно следует включать ложе удаленной опухоли. При менингиомах Grade I GTV = CTV. Оптимальный захват CTV при менингиомах Grade II не определен. При менингиомах Grade III CTV = GTV + 1–2 см.
• При менингиоме Grade I рекомендуется лучевая терапия с РОД 1,8 -2,0 Гр до СОД 50-54 Гр; с РОД 7,5 Гр до СОД 22,5 Гр; с РОД 5,5 Гр до СОД 27,5 Гр; при радиохирургическом лечении – 14 -16 Гр. При менингиоме Grade II - лучевая терапия с РОД 1,8-2,0 Гр до СОД 54,0-60,0 Гр; возможны радиохирургическое и гипофракционированное облучение с увеличением дозы по сравнению с Grade I. У пациентов с менингиомой Grade III рекомендуется лучевая терапия с РОД 2,0 Гр до СОД 60,0 Гр; возможны радиохирургическое и гипофракционированное облучение с увеличением дозы по сравнению с Grade I. Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
• Пациентам с первичной лимфомой ЦНС в случае неполного ответа на химиотерапию или невозможности её проведения рекомендовано проведение ЛТ с тотальным облучением всего головного мозга в дозе РОД 1,8 – 2,0 Гр до СОД 30,0 - 36,0 Гр с добавлением буста при необходимости до СОД 44,0 -45,0 Гр на сохраняющийся очаг контрастирования.
• Пациентам с небольшими опухолями (до 3 см в максимальном измерении), имеющими четкие границы, которые располагаются вне критических структур (глиомы (пилоидные астроцитомы, эпендимомы), менингиомы, невриномы, параганглиомы, аденомы гипофиза, краниофарингиомы и др.) возможно проведение радиохирургического лечения – одномоментное подведение высокой дозы с использованием стереотаксической техники. При технической возможности, наличии оборудования для фракционного стереотаксического облучения возможно радиохирургическое лечение опухолей более 3 см в максимальном измерении.
Медикаментозное лечение:
• Химиотерапия.
Химиотерапия – важный компонент лечения при высокозлокачественных астроцитомах, олигодендроглиомах, смешанных глиомах, нейрональных и смешанных нейронально-глиальных опухолях, эмбриональных опухолях, лимфомах ЦНС, герминоклеточных опухолях ЦНС. Схема химиотерапии подбирается прежде всего в соответствии с гистологическим типом опухоли. Ранее применяемые схемы химиотерапии при злокачественных глиомах головного мозга:
1. Темозоломид 150-200 мг/м2 5 дней внутрь Курс повторять через каждые 28 дней. Винкристин 1,4 мг/м21-й, 8-й дни в/в капельно. Курс повторять через каждые 4 недели. Продолжительность лечения 4-6 циклов.
2. Бевацизумаб 10 мг/кг 1-й день Иринотекан 125 мг/м2 1-й день. Курс повторять каждые 2-3 недели. Продолжительность лечения 4-6 циклов.
3. Бевацизумаб 5 мг/кг 1-й, 15-й день . Темозоломид 150 мг/м2 1-5 дни Курс повторять каждые 4 недели. Продолжительность лечения 4-6 циклов
• Адъювантная химиотерапия темозоломидом при глиобластоме продемонстрировала значительное улучшение медианы и 2-летней выживаемости в большом рандомизированном исследовании (УД–А) [2,3,12,15,23].
• Бевацизумаб – таргентный препарат, в инструкции по его применению включены показания в лечении злокачественных глиом III-IV (G3-G4) степени злокачественности – анапластических астроцитом и мультиформных глиобластом. Проводятся широкомасштабные клинические рандомизированные исследования по его применению в сочетании с иритеконам или темозоламидом при злокачественных глиомах G3 и G4. Установлена предварительная высокая эффективность данных схем химио- и таргентной терапии (УД – В) [2,3].
Схемы химиотерапии рекомендованные ранее при первичных примитивных нейроэктодермальных опухолях (PNET), медуллобластомах, первичных герминоклеточных опухолях (секретирующих) ЦНС, паренхиматозных опухолях шишковидной железы (пинеобластома и пинеоцитома с промежуточной дифференцировкой), хориоидкарциономе, злокачественных эпендимомах и менингимоах (УД-C)[14]:
1. Цисплатин 100 мг/м2 в/в капельно 1-й день Винкристин 1,4 мг/м2 в/в капельно 4-й день. Курс повторять через каждые 4 недели Продолжительность лечения 4-6 циклов.
2. Цисплатин 25 мг/м2 в/в капельно 1,2,3,4-й дни Этопозид 80 мг/м2 в/в капельно 1,2,3,4-й дни. Курс повторять через каждые 4 недели Продолжительность лечения 4-6 циклов.
3. Карбоплатин AUC-5 в/в капельно 1-й день Этопозид 140мг/м2 в/в капельно 1,2,3-й дни Винкристин 1,4 мг/м2 в/в капельно 1,8-й день. Курс повторять через каждые 4 недели Продолжительность лечения 4-6 циклов
4. Карбоплатин AUC-5 в/в капельно 1 день. Этопозид 100 мг/м2 в/в капельно 1,2 дни. Метотрексат 8 мг/м2 в/в капельно 3 день. Курс повторять через каждые 4 недели Продолжительность лечения 4-6 циклов
5. Цисплатин 25 мг/м2 в/в капельно 1,2,3,4-й дни. Этопозид 80 мг/м2 в/в капельно 1,2,3,4-й дни Циклофосфан 600 мг/м2 в/в капельно 4-й день. Курс повторять через каждые 4 недели Продолжительность лечения 4-6 циклов.
6. Цисплатин 20 мг/м2 в/в инфузия со скоростью не более 1 мг/мин с пред - и постгидратацией в 1,2.3,4,5-й дни. Этопозид 100 мг/м2 в/в капельно в течении 1 часа в 1,2,3-й дни Ифосфамид 1500 мг/м2 в/в капельно в течении 1 часа в 1,2,3,4,5-й дни Месна 400 мг/м2 в/в струйно до введения Ифосфамида на 4 и 8 часу после начала введения Ифосфамида.
Алгоритмы лечения различных групп первичных опухолей ЦНС.
Диффузные глиомы grade 3–4 и глионейрональные опухоли grade 3: астроцитома с мутацией в генах IDH grade 3; астроцитома с мутацией в генах IDH grade 4; олигодендроглиома с мутацией в генах IDH и ко-делецией 1p/19q; плеоморфная ксантоастроцитома; глиобластома без мутаций в генах IDH; диффузная глиома средней линии с альтерацией в гене H3 K27 grade 4; диффузная полушарная глиома с мутацией H3 G34 grade 4; ганглиоглиома grade 3:
Таблица 8. Рекомендуемые режимы лекарственной терапии диффузных глиом (grade 2–4) и глионейрональных опухолей (grade 3).
| Режим | Схема проведения |
| темозоломид1 | темозоломид (в составе ХЛТ) 75 мг/м2 внутрь ежедневно, начиная с первого дня и на протяжении всего курса ЛТ |
| темозоломид1 | темозоломид 150–200 мг/м2 внутрь в 1–5-й дни, цикл 28 дней (5/23), 6–12 циклов |
| PCV2 | Ломустин* 100 мг/м2 внутрь в 1-й день + винкристин 1,4 мг/м2 в/в в 1-й и 8-й дни + прокарбазин* 60–75 мг/м2 внутрь в 821-й дни, цикл 6–8 недель |
| CV | Ломустин* 90 мг/м2 внутрь в 1-й день + винкристин 1,4 мг/м2 в/в в 1-й и 8-й дни, цикл 6–8 недель |
| ломустин | Ломустин* 90–110 мг/м2 внутрь в 1-й день, цикл 6–8 недель |
| кармустин | Кармустин* 200 мг/м2 в/в 1-часовая инфузия в 1-й день, цикл 6–8 недель |
| кармустин | Кармустин* 80 мг/м2 в/в 30-минутная инфузия в 1–3-й дни, цикл 6–8 недель |
| РС | Прокарбазин* 60 мг/м2 внутрь в 1–10-й дни + ломустин* 100 мг/м2 внутрь в 1-й день, цикл 6–8 недель |
| темозоломид + цисплатин | темозоломид 150 мг/м2 внутрь в 1–5-й дни + цисплатин 20 мг/м2 в/в в 1–5-й дни, цикл 28 дней |
| темозоломид + карбоплатин | темозоломид 150 мг/м2 внутрь в 1–5-й дни + карбоплатин AUC3 в/в в 1-й день, цикл 28 дней |
| темозоломид + бевацизумаб | темозоломид 150–200 мг/м2 внутрь в 1–5-й дни + бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни, цикл 28 дней |
| бевацизумаб + этопозид | бевацизумаб 5 мг/кг в/в в 1-й и 15-й дни + этопозид 80 мг/м2 в/в в 1–5-й дни, цикл 21 или 28 дней |
| бевацизумаб + иринотекан | бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни + иринотекан 125-200 мг/м2 в/в в 1-й и 15-й дни, цикл 28 дней |
| дабрафениб + траметиниб3 | дабрафениб 150 мг внутрь 2 раза в день ежедневно + траметиниб 2 мг внутрь 1 раз в день ежедневно, до прогрессирования или непере носимой токсичности |
| вемурафениб + кобиметиниб3 | вемурафениб 960 мг внутрь 2 раза в день ежедневно + кобиметиниб 60 мг внутрь 1 раз в день в 1–21-й дни каждые 4 недели, до прогрессирования или непереносимой токсичности |
Стандартный режим для астроцитарных опухолей (grade 3–4).
2 Стандартный режим для астроцитарных опухолей (grade 2–3).
3 Для опухолей с мутацией в гене BRAF.
* В соответствии с правилами применения незарегистрированных ЛС.
Пациентам с олигодендроглиомой grade 3 в послеоперационном периоде рекомендованы лучевая терапия и химиотерапия (PCV или монотерапия темозоломидом). Лечение можно начинать как с лучевой, так и с химиотерапии. При полном ответе на химиотерапию проведение лучевой терапии может быть отложено в качестве резерва лечения при развитии рецидива.
Лечение рецидивов/прогрессирования.
При возникновении рецидива/прогрессирования заболевания вопрос о повторном хирургическом вмешательстве, повторной лучевой и лекарственной терапии решается индивидуально. В качестве лекарственной терапии рекомендованы режимы с включением бевацизумаба, схемы с препаратами платины, а также химиотерапия темозоломидом в случае объективного ответа на лечение в первой линии терапии или после ПХТ по схеме PCV/CV (табл. 9).
Таблица 9. Рекомендуемые режимы лекарственной терапии рецидивов диффузных глиом (grade 3–4) и глионейрональных опухолей (grade 3).
| Режим | Схема проведения |
| темозоломид | темозоломид 150–200 мг/м2 внутрь в 1–5-й дни, цикл 28 дней (5/23) |
| темозоломид в метрономном режиме | темозоломид 75 мг/м2 внутрь в 1–7-й дни, цикл 14 дней |
| бевацизумаб | бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни, цикл 28 дней |
| бевацизумаб + темозоломид | бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни + темозоломид 150–200 мг/м2 внутрь в 1–5-й дни, цикл 28 дней |
| бевацизумаб + ломустин | бевацизумаб 5–10 мг/кг в/в в 1-й, 15-й и 29-й дни + ломустин* 90 мг/м2 внутрь в 1-й день, цикл 6 недель |
| бевацизумаб + ломустин | бевацизумаб 5–10 мг/кг в/в в 1-й, 15-й, 29-й и 43-й дни + ломустин* 40 мг внутрь в 1-й, 8-й, 15-й и 22-й дни, цикл 6 недель |
| бевацизумаб + иринотекан | бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни + иринотекан 125–200 мг/м2 в/в в 1-й и 15-й дни, цикл 28 дней |
| бевацизумаб + карбоплатин | бевацизумаб 7,5 мг/кг в/в в 1-й день + карбоплатин AUC5 в/в в 1-й день, цикл 21 день |
| темозоломид + карбоплатин | темозоломид 150 мг/м2 внутрь в 1–5-й дни + карбоплатин AUC3 в/в в 1-й день, цикл 28 дней |
*В соответствии с правилами применения незарегистрированных ЛС.
Эпендимома.
Химиотерапия назначается пациентам с эпендимомой grade 3 и может рекомендоваться в случае рецидива эпендимомы grade 2, даже при отсутствии злокачественной трансформации по данным повторного гистологического исследования (табл. 10).
Таблица 10. Рекомендуемые режимы лекарственной терапии эпендимом.
| Режим | Схема проведения |
| карбоплатин | карбоплатин 100 мг/м2 в/в в 1–5-й дни, цикл 2835 дней |
| цисплатин | цисплатин 80 мг/м2 в/в в 1-й день, цикл 21 день |
| темозоломид | темозоломид 150–200 мг/м2 внутрь в 1–5-й дни, цикл 28 дней |
| этопозид | этопозид 50–100 мг/м2 внутрь или в/в в 1–5-й дни, цикл 21–28 дней |
| цисплатин + этопозид | цисплатин 25 мг/м2 в/в в 1–4-й дни + этопозид 80 мг/м2 в/в в 1–4-й дни, цикл 21 день |
| цисплатин + этопозид + ифосфамид | цисплатин 25 мг/м2 в/в в 1–4-й дни + этопозид 80 мг/м2 в/в в 1–4-й дни, цикл 21 день |
| карбоплатин + этопозид + винкристин | карбоплатин 300 мг/м2 в/в 1 час в 1-й день + этопозид 140 мг/м2 в/в 30 мин. в 1–3-й дни + винкристин 1,4 мг/м2 в/в в 1-й и 8-й дни, цикл 28 дней, 4–6 циклов в зависимости от переносимости |
| темозоломид + лапатиниб | темозоломид 150 мг/м2 внутрь в 1–7-й и 15–21-й дни, цикл 28 дней + лапатиниб2 1250 мг внутрь 1 раз в сутки ежедневно до прогрессирования или непереносимой токсичности |
| темозоломид + бевацизумаб | темозоломид 150–200 мг/м2 внутрь в 1–5-й дни + бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни, цикл 28 дней |
Месна применяется в суточной дозе, равной 100% от дозы ифосфамида и разделенной на три введения в течение дня: непосредственно перед введением ифосфамида и далее через 4 и 8 часов после начала его инфузии.
2 По решению консилиума при рецидиве (возможно при вторичном рецидиве, когда все другие опции исчерпаны)
Менингиома.
В случаях менингиомы grade 3 возможно проведение ХТ (табл. 11).
Таблица 11. Рекомендуемые режимы лекарственной терапии при анапластической менингиоме и/или при агрессивном течении менингиомы grade
| Режим | Схема проведения |
| бевацизумаб + сунитиниб | бевацизумаб 5 мг/кг в/в в 1-й и 15-й дни + сунитиниб 50 мг/сут. внутрь в 1–28-й дни, цикл 6 недель |
| бевацизумаб + сунитиниб | бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни, цикл 28 дней |
| бевацизумаб + эверолимус | бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни, цикл 28 дней + эверолимус 5–10 мг внутрь 1 раз в сутки ежедневно до прогрессирования или непереносимой токсичности |
| сунитиниб | сунитиниб 50 мг внутрь 1 раз в сутки ежедневно в 1–28-й дни цикл, 6 нед |
Эмбриональные опухоли (grade 4): медуллобластома, нейробластома
. Всем пациентам после лучевой терапии проводится химиотерапия (табл. 12, табл. 13).
Таблица 12. Рекомендуемые режимы лекарственной терапии медуллобластомы.
| Режим | Схема проведения |
| цисплатин + этопозид + циклофосфамид | цисплатин 25 мг/м2 в/в в 1–4-й дни + этопозид 80 мг/м2 в/в в 1–4-й дни + циклофосфамид 600 мг/м2 в/в в 4-й день, цикл 4–6 недель, 6 циклов |
| цисплатин + этопозид + ифосфамид | цисплатин 20 мг/м2 в/в 1–5-й дни + этопозид 80 мг/м2 в/в в 1–5-й дни + ифосфамид 1500 мг/м2 (+ месна1) в/в в 1-й, 3-й, 5-й дни, цикл 21–28 дней (в зависимости от переносимости), 4–6 циклов |
| цисплатин + ломустин + винкристин | цисплатин 70 мг/м2 6-часовая в/в инфузия (карбоплатин 400 мг/м2 в/в 1-часовая инфузия) в 1-й день + ломустин* 75 мг/м2 внутрь в 1-й день + винкристин 1,5 мг/м2 (максимальная суммарная доза 2 мг) в/в в 1-й, 8-й и 15-й дни, цикл 41 день, 8 циклов |
Месна применяется в суточной дозе, равной 100% от дозы ифосфамида и разделенной на три введения в течение дня: непосредственно перед введением ифосфамида и далее через 4 и 8 часов после начала его инфузии.
Таблица 13. Рекомендуемые режимы лекарственной терапии нейробластомы/ганглионейробластомы.
| Режим | Схема проведения |
| темозоломид | темозоломид 150–200 мг/м2 внутрь в 1–5-й дни, цикл 28 дней |
| карбоплатин + этопозид | карбоплатин 200 мг/м2 в/в 1-часовая инфузия в 1–3-й дни + этопозид 150 мг/м2 в/в 30-минутная инфузия в 1–3-й дни, цикл 21 день, 4–6 циклов в зависимости от переносимости |
| цисплатин + этопозид | цисплатин 40 мг/м2 в/в 1-часовая инфузия в 1–3-й дни + этопозид 120 мг/м2 в/в 30-минутная инфузия в 1–3-й дни, цикл 21 день, 4–6 циклов в зависимости от переносимости |
| бевацизумаб + иринотекан | бевацизумаб 5–10 мг/кг в/в в 1-й и 15-й дни + иринотекан 125–200 мг/м2 в/в в 1-й и 15-й дни, цикл 28 дней |
| цисплатин + этопозид + ифосфамид | цисплатин 20 мг/м2 в/в в 1–5-й дни + этопозид 75 мг/м2 в/в 1–5-й дни + ифосфамид 750–1200 мг/м2 (+ месна1) в/в в 1-й, 3-й и 5-й дни, цикл 28 дней |
Месна применяется в суточной дозе, равной 100% от дозы ифосфамида и разделенной на три введения в течение дня: непосредственно перед введением ифосфамида и далее через 4 и 8 часов после начала его инфузии.
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
| Лекарственная группа | Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Алкилирующие агенты | темозоломид | 150–200 мг/м2 внутрь в 1–5-й дни, цикл 28 дней | А |
| Алкилирующие агенты – комплексные соединения платины | цисплатин | цисплатин 20 мг/м2 в/в в 1–5-й дни, цикл 28 дней | А |
| Алкилирующие агенты – комплексные соединения платины | карбоплатин | АUC 5-6 1-й день, в/в | А |
| Моноклональные антитела к факторам роста и их рецепторам | бевацизумаб | 5-10 мг/кг, в/в | А |
| Ингибитор топоизомеразы | иринотекан | 125–200 мг/м2 в/в в 1-й и 15-й дни, цикл 28 дней | А |
| Противоопухолевое средство - алкалоид | этопозид | 80-150 мг/м2 1-3 дни, в/в | А |
Перечень дополнительных лекарственных средств
(менее 100% вероятности применения).
| Лекарственная группа | Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
| Алкилирующие агенты – хлорэтиламины | ифосфамид | ифосфамид 7501500 мг/м2 (+ месна) в/в в 1-й, 3-й и 5-й дни, цикл 28 дней | В |
| Антидот акролеина | месна | 400 мг/м2, 3 раза в день в/в в 1-й, 3-й и 5-й дни, цикл 28 дней | В |
| Протеинкиназы ингибиторы (BRAF/MEK) | дабрафениб | 150 мг внутрь 2 раза в день ежедневно | В |
| вемурафениб | 960 мг внутрь 2 раза в день ежедневно | В | |
| траметиниб | 2 мг внутрь 1 раз в день ежедневно | В | |
| кобиметиниб | 60 мг внутрь 1 раз в день в 1–21-й дни каждые 4 недели | В | |
| Протеинкиназы ингибитор (mTOR) | эверолимус | 5–10 мг внутрь 1 раз в сутки ежедневно | В |
| Протеинкиназы ингибитор | сунитиниб | 50 мг внутрь 1 раз в сутки ежедневно в 1–28-й дни цикл, 6 нед | В |
Методика одновременной химио- и лучевой терапии.
Назначается при глиомах высокой степени злокачественности мозга G3-G4. Лучевая терапия проводится в классическом или гипофракционном режиме по методике конвенциального, 3D CRT, IMRT облучения на фоне химиотерапии темозоломидом 75-80 мг/м2 внутрь на весь курс лучевой терапии (в дни проведения сеансов облучения и выходные дни до №40-45 раз).
Хирургическое вмешательство, оказываемое в стационарных условиях.
Показания к хирургическому лечению:
• пациенты с опухолями головного мозга и других отделов ЦНС.
NB! Считается, что установление достоверного диагноза опухоли ЦНС само по себе позволяет считать хирургическое вмешательство показанным.
Задачи хирургического этапа следующие:
• обеспечить максимальное удаление новообразования с соблюдением принципов анатомической и функциональной доступности (дозволенности), установить точный морфологический диагноз, уменьшить эффект объемного воздействия опухоли на головной мозг и уменьшить дислокацию мозга в полости черепа, нормализовать или восстановить ликвороциркуляцию. При этом общим принципом в нейроонкологии является стремление к максимально полному удалению опухоли.
• Паллиативные операции являются вынужденной мерой и обычно направлены на снижение внутричерепного давления при невозможности удаления опухоли головного мозга или на уменьшение компрессии спинного мозга при аналогичной ситуации, обусловленной неудалимой интрамедуллярной опухолью.
• Оперативное лечение является общепризнанным первичным лечебным подходом с целью уменьшения объема опухоли и получения материала для верификации. Резекция опухоли имеет прогностическое значение, и может дать положительные моменты при попытке максимальной циторедукции.
Противопоказания к хирургическому вмешательству:
• факторами, ограничивающими возможности хирургического лечения, являются особенности локализации опухоли и характера ее инфильтративного роста в области таких жизненно важных отделов мозга, как ствол, гипоталамус, подкорковые узлы, наличие гнойно-воспалительных заболеваний с локализацией гнойных очагов в зоне предстоящих хирургических манипуляций, соматическая патология в стадии декомпенсации, общее инкурабельное состояние больного по основному заболеванию.
Основные виды оперативных вмешательств:
• Трепанация черепа, удаление опухоли.
• Ляминэктомия, удаление опухоли.
• Вертеброэктомия, спондилодезникелид-титановыми конструкциями.
• Трефинация черепа, взятие биопсии.
• Эндоскопическое тривентрикулостомия это создание нового пути оттока ликвора из желудочковой системы головного мозга (III желудочка) в цистерны головного мозга, через пути которых происходит реабсорбция (всасывание) ликвора, как у здорового человека.
• Другие шунтирующие операции с применением шунтирующих систем.
• Трансназальныетранссфеноидальные удаления аденом гипофиза с применением эндоскопической и/или микрохирургической техники, нейронавигации.
• Хирургическое удаление новообразований головного мозга с применением вспомогательных технологий (интраоперационного нейромониторинга, нейронавигации, интраоперационного контрастного усиления опухолевой ткани).
• Удаление опухолей спинного мозга с применением интраоперационной нейрофизиологической системы.
• Микрохирургическое удаление опухолей основания черепа с применением эндоскопической ассистенции.
• Микроскопическая декомпрессия структур спинного мозга с полной резекцией и фиксацией переднего и заднего опорного комплексов позвоночника.
Объем хирургического вмешательства при различных видах опухолей ЦНС:
1) Нейроэпителиальные опухоли:
• полное удаление – новообразование удаляется в пределах видимой здоровой ткани;
• частичное удаление – новообразование удаляется с макроскопически видимой остаточной опухолью;
• биопсия опухоли – иссечение участков новообразования для последующего гистологического исследования;
• симптоматические операции – восстановление проходимости ликворных путей и др.
2) Менинготелиальные опухоли:
Для формализации степени радикальности операций при менингиомах используется шкала Симпсона:
• тип 1 – макроскопически полное удаление опухоли с иссечением ТМО в месте исходного роста опухоли и резекцией всей пораженной кости;
• тип 2 – макроскопически полное удаление с коагуляцией ТМО в месте исходного роста;
• тип 3 – макроскопически полное удаление без иссечения или коагуляции ТМО в месте исходного роста и/или без резекции всей пораженной кости;
• тип 4 – частичное удаление опухоли; тип 5 – биопсия или декомпрессия.
3) Метастатические опухоли головного мозга:
• Вопрос о хирургическом лечении рассматривается при наличии в головном мозгу от 1 до 3 метастазов (тотальное симультанное или этапное удаление опухоли). При локализации или распространении метастаза (-ов) на подкорковые центры и ядра и другие жизненно важные структуры головного мозга, травматизация которых сопряжена с высоким риском фатальных осложнений, хирургическое лечение не показано. Тактика лечения пациентов с не удаляемыми солитарными метастазами, множественными метастазами в головном мозгу, неизлеченной первичной опухолью, наличии экстрацеребральных метастазов определяется консилиумом в составе нейрохирурга, онколога (химиотерапевта), радиационного онколога.
• При метастазе в головном мозгу из невыявленного первичного очага и невозможности его удаления выполняется открытая биопсия/резекция метастаза или стереотаксическая биопсия (предпочтительный вариант, если предполагается нехирургическое лечение). Во время операции должна быть обеспечена возможность срочного морфологического исследования биопсийного материала. До выполнения биопсии (при подозрении по данным нейровизуализации на метастатическую природу новообразования в головном мозгу) или при направлении пациента к онкологу проводится системное обследование с целью выявления первичного опухолевого очага.
4) Злокачественные новообразования спинного мозга:
• При локализации опухоли в поверхностных отделах спинного мозга целесообразно проводить удаление новообразования (полное или частичное). Вопрос об объеме хирургического вмешательства при интрамедуллярном новообразовании решается индивидуально: определяется особенностями опухолевого роста и состоянием пациента.
• Контрольное обследование больных после операции. После хирургического вмешательства по поводу новообразования головного или спинного мозга для уточнения степени радикальности удаления в обязательном порядке производится контрольное интраскопическое обследование (МРТ и/или КТ). МРТ выполняется не позднее чем через 24 часа после операции, КТ – на 2–10-е сутки после операции. Для дифференциальной диагностики проводятся иммуногистохимические исследования и молекулярно-цитогенетический анализ.
Дальнейшее ведение:
• Наблюдение онколога и нейрохирурга по месту жительства, осмотр 1 раз в квартал первые 2 года, далее 1 раз в 6 месяцев в течение двух лет, далее 1 раз в год с учетом, полученных результатов МРТ снимков.
• Наблюдение состоит из клинической оценки, особенно функций нервной системы, судорожного синдрома или его эквивалентов, а также использования кортикостероидов. Пациентам следует сокращать прием стероидов как можно раньше. Часто у пациентов с неоперабельными или рецидивными опухолями наблюдаются явления венозного тромбоза.
• Лабораторные показатели не определяются, за исключением пациентов, получающих химиотерапию (клинический анализ крови), кортикостероиды (глюкоза) или противосудорожные препараты (клинический анализ крови, показатели функции печени).
• Инструментальное наблюдение: а) МРТ – через 1-2 месяца после окончания лечения; через 6 месяцев после последней явки на контрольный осмотр; в последующем 1 раз в 6-9 месяцев.
Индикаторы эффективности лечения:
• если ответ на лечение можно оценить, то следует выполнить МРТ исследование. Увеличение контрастности и предполагаемая прогрессия опухоли, в сроки 4-8 недель после окончания лечения (операция, лучевая терапия, химиотерапии) по данным МРТ, могут являться артефактом (псевдо прогрессией), тогда следует выполнить повторное МРТ исследование через 4 недели. Дополнительно ПЭТ головного мозга по показаниям;
• ответ на лучевую терапию и химиотерапию оценивается в соответствии с критериями ВОЗ, но также следует учитывать и состояние функций нервной системы, и применение кортикостероидов (критерии Макдональда). Увеличение общей выживаемости и числа пациентов без признаков прогрессирования в течение 6 месяцев является допустимой целью терапии и предполагает, что больные со стабилизацией заболевания также получают пользу от проводимого лечения;
• полная регрессия – 100% исчезновение опухоли;
• частичная регрессия – уменьшение размера на 50% и более;
• стабилизация процесса – уменьшение размера опухоли менее чем на 50%;
• прогрессирование – увеличение размера опухоли более чем на 25% [28] (УД-А).
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации
:
Пациенты с выявленными опухолями головного и спинного мозга на оперативное лечение, если нет противопоказаний к операции со стороны соматического статуса, на проведение самостоятельной и/или послеоперационной лучевой терапии и/или химиотерапии с морфологически верифицированным диагнозом (после операции, открытой или стереотаксической биопсии).
NB! Допускается госпитализация больных без верификации с метастическим поражением головного или спинного мозга при наличии морфологически верифицированного первичного онкологического заболевания, при первичной опухоли головного мозга, установленной на основании данных клинического обследования и МРТ исследования.
Показания для экстренной госпитализации:
на оперативное лечение пациенты с дислокационным синдромом, в судорожном состоянии и другие больные с опухолями головного и спинного мозга в тяжелом состоянии связанным с основным заболеванием.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- 1) McBainC, Lawrie TA,RogozińskaE, KernohanA, RobinsonT, JefferiesS. Treatment options for progression orrecurrence of glioblastoma: anetworkmeta‐analysis.Cochrane Database of Systematic Reviews 2021, Issue1. Art.No.:CD013579.DOI:10.1002/14651858.CD013579.pub2.Accessed 08August2023. 2) Клинические рекомендации Европейского общества медицинской онкологии//ES MO.–2022(https://esmo.org). 3) Клинические рекомендацииАмериканского общества клинических онкологов//A SCO.–2022(https://www.asco.org). 4) Клинические рекомендации Американского общества лучевых терапевтов//АST RO.–2021.(https://www.astro.org). 5) Клинические рекомендации Европейского общества лучевых терапевтов//ESTR O.–2021гг.(http://www.estro.org). 6) Ed.EdwardC. Halperin, CarlosA. Perez, LutherW. Brady. PerezandBrady's Principlesan dPractice of Radiation Oncology. Lippincott Williams&Wilkins,2013.–7-rdEdition. 7) Машковский М.Д. Лекарственные средства. 16-еиздание. – Москва: Новаяволна, 2021. – 1216с. 8) HansenE.K., RoachM. Handbook of Evidence Based Radiation Oncology.Springer International PublishingAG,2018.937p 9) ГригорьеваВ.Н., БеловаА.Н. Клиническое неврологическое обследование. Издательство:Практическая медицина–2018–400с. 10) Приказ Министраздра воохранения Республики Казахстанот 24 ноября 2009 года №774 «Обутверждении Номенклатуры медицинских и фармацевтических специальностей (с изменениями и дополнениямиот06.05.2013г.)». 11) Приказ №209 от28.04.2014 «О внесении изменений и дополнений в приказ Министра здравоохранения Р Кот 31 декабря 2013 года №770 «Об утверждении тарификатора медицинских услуг». 12) Стандарты лучевой терапии под редакцией академика РАН А.Д. Каприна и соавт.–ГЭОТАР-Медиа.-2023–387с. 13) Стандарты, опциии рекомендации влечении первичных опухолей ЦНС (20122013).–Москва, 2013.-с.55. 14) ТиглиевГ.С., ОлюшинВ.Е. Злокачественные глиомы головного мозга. Проблемы диагностики и современные возможности комплексного лечения//Темодал –новый противоопухолевый препарат для лечения злокачественных глиом, мат. симп. СПб.,2022.–С.2-5. 15) ArnoJ.M.,JohnC.R.//Intensity Modulated Radiation Therapy. A Clinical Perspective. Hamilton London2013. 16) ЭрикК. Хансен, Мэк Роач III//Лучевая терапия в онкологии–перевод с английского под. Редакцией проф. А.В.Черниченко.-ГЭОТАР-Медиа.-2014–992с. 17) Микрохирургическое удаление опухолей основания черепа с применением эндоскопической ассистенции. Клинический протокол МЗ РК. Рекомендовано. 18) Экспертным советом РГП на ПХВ «Республиканский центр развития здравоохранения» Министерства здравоохранения и социального развития Республики Казахстан от «12» декабря 2014 года протокол № 9. 19) Improving Outcomes for People with Brain and Other CNS Tumours. National Institute for Health and Clinical Excellence.–London.-2016–180p. 20) JohnP. Gibbons Khan's The Physics of Radiation Therapy 6 - th Edition, Wolters Kluwer Health, 2020.-592 p. 21) Хирургическое удаление новообразований головного мозга с применением вспомогательных технологий (интраоперационного нейромониторинга, нейронавигации, интраоперационного контрастного усиления опухолевой ткани) Клинический протокол МЗ РК Объединенной комиссией по качеству медицинских услуг Министерства здравоохранения Республики Казахстан от «31» октября 2019 года. Протокол №76. 22) CabreraAR, KirkpatrickJP, FiveashJB, etal. Radiation therapy for glioblastoma: Execut ive summary of an American Society for Radiation Oncology Evidence Based Clinical Practice Guideline. PractRadiatOncol 2016;6:217-225. 23) NCCN Clinical Practice Guidelines in Oncology. Antiemesis. Version 2.2017March2018,2017. 24) ShihHA, ShermanJC, NachtigallLB, etal. Protontherapy for low-gradegliomas: results from aprospectivetrial. Cancer2015;121:1712-1719. 25) Удаление опухолей спинного мозга с применением интраоперационной нейрофизиологической системы. Клинический протокол МЗ РК. 26) StuppR, MasonWP, van den BentM Jetal. Concomitantandadjuvantte mozolomide and radiotherapy for newly diagnosed glioblastoma multiforme//N.Engl.J.Med.-2015.-N352.P.987–996. 27) Van den BentM, BrandesA, Rampling Retal. Randomized phase II trial of erlotinib(E) versus temozolomide(TMZ)or BCN Uinrecurrentglio blastoma multiforme:EORTC26034 .ASCO Ann Meet ProcPartI//J.Clin.Oncol.-2017.-N25.-76S. 28) VandenBentMJ, CarpentierAF, Brandes AAetal. Adjuvant procarbazine, lomustine, and vincristine improves progression free survival but not overall survival in newly diagnosed an aplastic oligoden drogliomasandol igoastrocytomas: Arandomized European Organization for Research and Treatment of Canc erphase III trial//J.Clin.Oncol.-2016.-N24.-P.2715–2722. 29) ЛобановаН.В., ШишкинаЛ.В., РыжоваМ.В., КобяковГ.Л., СычеваР.В., БуровС.А., ЛукьяновА.В., ОмароваЖ.Р. Клинические, иммуногистохимические и молекулярногенетические факторы прогноза у больных c глиобластомой Журнал:Архивпатологии .2016;78(4):10-19. 30) WHO Classification of Tumours of the Central Nervous System(Revised 4th edition,201 6)/Eds.LouisD.N., OhgakiH., WiestlerO.D., CaveneeW.K.-IARC: Lyon.2016;4:408. 31) RogersL, BaraniI, ChamberlainM, etal. Meningiomas: knowledgebase, treatmentoutcomes, and uncertainties. ARANO review. JNeurosurg2015;122:4-23. 32) NCCN Clinical Practice Guidelinesin Oncology(NCCN Guidelines)//Central Nervous System Cancers-Version1.2023–March24,2023–NCCN.org–www.nccn.org/patietnts. 33) Микроскопическая декомпрессия структур спинного мозга с полной резекцией и фиксацией переднего и заднего опорного комплексов позвоночника. Клинический протокол МЗ РК. 34) NaborsLB, PortnowJ, AhluwaliaM, BaehringJ, BremH, BremS, ButowskiN, CampianJ L, ClarkSW, FabianoAJ, ForsythP, Hattangadi-GluthJ, HoldhoffM, HorbinskiC, JunckL, KaleyT, KumthekarP, LoefflerJS, MrugalaMM, NagpalS,PandeyM, ParneyI, PetersK, PuduvalliVK, RobinsI, RockhillJ, RusthovenC, ShonkaN, ShrieveDC, SwinnenLJ, WeissS, WenPY, WillmarthNE, BergmanMA, DarlowSD. Central Nervous System Cancers, Version 3.2020, NCCN Clinical Practice Guidelinesin Oncology. JNatl Compr Canc Netw. 2020 Nov 18(11):15371570.doi:10.6004/jnccn.2020.0052.PMID:33152694.
Информация
Сокращения, используемые в протоколе:
|
АФП
|
Альфафетопротеин |
|
АСТ
|
Аспартатаминотрансфераза |
|
АЛТ
|
Аланинаминотрансфераза |
|
ВИЧ
|
вирус иммунодефицита человека
|
|
в/м
|
Внутримышечно |
|
Гр
|
Грей |
|
ДЛТ
|
дистанционная лучевая терапия
|
|
ИФА
|
иммуноферментный анализ
|
|
КТ
|
компьютерно-томографическое исследование
|
|
ЛУЭ
|
линейный ускоритель электронов
|
|
МДГ
|
мультидисциплинарная группа
|
|
МРТ
|
магнитно-резонансная томография
|
|
ОАК
|
общий анализ крови
|
| ОАМ | общий анализ мочи |
|
ПЭТ
|
позитронно-эмиссионная томография
|
|
РОД
|
разовая очаговая доза
|
|
СОД
|
суммарная очаговая доза
|
|
ТМО
|
твердая мозговая оболочка
|
|
УЗИ
|
ультразвуковое исследование
|
|
ЦНС
|
центральная нервная система
|
|
ПЛТ
|
протонная лучевая терапия
|
|
2D RTC
|
2-х мерная конвенциальная ( стандартная) лучевая терапия (2D Radiotherapy Convetnional)
|
|
3D CRT
|
3-х мерная конформная лучевая терапия (3D Conformal Radiotherapy)
|
| Aria |
информационно-управляющая система Ариа
|
| CTV |
клинический объем мишени (Сlinical Target Volume)
|
| CBCT |
компьютерная томография широким пучком (Cone Beam Computed Tomography)
|
| DICOM |
отраслевой стандарт создания, хранения, передачи и визуализации медицинских изображений и документов обследованных пациентов (Digital Imaging and Communications in Medicine)
|
| ECLIPSE |
система дозиметрического планирования Эклипс
|
| EORTC |
Европейская организация по исследованию и лечению рака (European Organisation for Research and Treatment of Cancer)
|
| EPID |
электронное устройство портальных изображений (система мегавольтажной визуализации) (Electronic Portal Imaging Device)
|
| GTV |
клинически определяемая первичная опухоль по данным осмотра и рентгенографии (Gross Tumor Volume)
|
| IGRT |
лучевая терапия управляемая по изображениям (Image Guided Radiotherapy)
|
| IMRT |
интенсивно модулированная лучевая терапия (Intensity Modulated Radiotherapy)
|
| IORT |
интраоперационная лучевая терапия (Intraoperative Radiotherapy)
|
| MLC |
многолепестковый коллиматор (Multileaf Collimator)
|
| MU |
мониторные единицы (Monitor Units)
|
| OBI |
система киловольтной визуализации (On Board Imager)
|
| PTV |
планируемый объем мишени (Planning Target Volume)
|
|
per os
|
перорально |
| RECIST |
критерии отклика в солидных опухолях (Response EvaluationCriteria In Solid Tumors)
|
| RTC |
2-х мерная конвенциальная лучевая терапия (Radiotherapy Conventional)
|
| SRS |
стереотаксическая радиохирургия (Stereotactic Radiosurgery)
|
| SRT |
стереотаксическая радиотерапия (Stereotactic Radiotherapy)
|
| ОR |
органы риска (organ risk)
|
| РЭА |
Раково-эмбриональный антиген
|
|
Антиген СА
|
Карбогидратный антиген
|
|
GII-GIII-GIV
|
G-Grade (степень злокачественности)
|
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ВНЕДРЕНИЯ ПРОТОКОЛА
Список разработчиков протокола с указанием квалификационных данных:
Рецензенты:
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Оценка качества жизни (функциональная активность) по Карновскому:
| Нормальная физическая активность, больной не нуждается в специальном уходе | 100 баллов | Нормальная физическая активность, больной не нуждается в специальном уходе |
| 90 баллов | Нормальная активность сохранена, но имеются незначительные симптомы заболевания. | |
| 80 баллов | Нормальная активность возможна при дополнительных усилиях, при умеренно выраженных симптомах заболевания. | |
| Ограничение нормальной активности при сохранении полной независимости больного | 70 баллов | Больной обслуживает себя самостоятельно, но не способен к нормальной деятельности или работе |
| 60 баллов | Больной иногда нуждается в помощи, но в основном обслуживает себя сам. | |
| 50 баллов | Больной иногда нуждается в помощи, но в основном обслуживает себя сам. | |
| Больной иногда нуждается в помощи, но в основном обслуживает себя сам. | 40 баллов | Большую часть времени больной проводит в постели, необходим специальный уход и посторонняя помощь. |
| 30 баллов | Больной прикован к постели, показана госпитализация, хотя терминальное состояние не обязательно. | |
| 20 баллов | Сильные проявления болезни, необходима госпитализация и поддерживающая терапия. | |
| 10 баллов | Умирающий больной, быстрое прогрессирование заболевания. | |
| 0 баллов | Смерть |
Приложение 2
Шкала Глазго (Glasgow coma scale или GCS)
| Признак | Баллы |
|
Открывание глаз:
|
|
| • спонтанное | 4 |
| • как реакция на голос | 3 |
| • как реакция на боль | 2 |
| • отсутствует | 1 |
|
Речевая реакция:
|
|
|
• больной ориентирован, дает быстрый и правильный ответ на заданный вопрос
|
5 |
| • больной дезориентирован, спутанная речь | 4 |
|
• словесная окрошка, ответ по смыслу не соответствует вопросу
|
3 |
| • нечленораздельные звуки в ответ на заданный вопрос | 2 |
| • отсутствие речи | 1 |
|
Двигательная реакция:
|
|
| • выполнение движений по команде | 6 |
|
• целесообразное движение в ответ на болевое раздражение (отталкивание)
|
5 |
| • отдергивание конечности в ответ на болевое раздражение | 4 |
| • патологическое сгибание в ответ на болевое раздражение | 3 |
|
• патологическое разгибание в ответ на болевое раздражение
|
2 |
| • отсутствие движений | 1 |
|
Состояние больного, согласно шкале комы Глазго, оценивается по трем признакам, каждый из которых оценивается в баллах. Баллы суммируются.
Интерпретация полученных результатов по шкале комы Глазго:
• 15 баллов сознание ясное
• 13-14 баллов оглушение
• 9-12 баллов сопор
• 4-8 баллов кома
• 3 балла гибель коры
|
|
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.