Дифференцированный рак щитовидной железы
 Версия: Клинические рекомендации РФ 2024 (Россия)
Версия: Клинические рекомендации РФ 2024 (Россия)
Злокачественное новообразование щитовидной железы (C73), Новообразования неопределенного или неизвестного характера щитовидной железы (D44.0)
Онкология, Эндокринология
Общая информация
Краткое описание
Разработчик клинической рекомендации
- Ассоциация онкологов России
- Общероссийская общественная организация «Федерация специалистов по лечению заболеваний головы и шеи»
- Общероссийская общественная организация «Российское общество клинической онкологии»
- Некоммерческая организация "Ассоциация онкологических организаций Сибири и Дальнего Востока
- Ассоциации эндокринных хирургов
- Российская ассоциация эндокринологов
- Общероссийская общественная организация "Российское общество специалистов по опухолям головы и шеи"
Одобрено Научно-практическим Советом Минздрава РФ
– размещенные в Рубрикаторе после 1 января 2024 года – с 1 января 2025 года.
Клинические рекомендации
Дифференцированный рак щитовидной железы
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые
Пересмотр не позднее: 2026
ID: 329
Определение заболевания или состояния (группы заболеваний или состояний)
Дифференцированный РЩЖ (РЩЖ) – злокачественная опухоль из фолликулярных клеток щитовидной железы (ЩЖ), сохраняющих присущие им признаки дифференцировки.
Несмотря на единое кодирование по МКБ-10, дифференцированные формы РЩЖ и медуллярный РЩЖ – различные нозологии. Диффузную закладку С-клеток в ЩЖ по происхождению и функции можно считать самостоятельным органом, например, таким же, как околощитовидные железы. Это объясняет несколько иные свойства С-клеточных опухолей. С опухолями ЩЖ из А- и В-клеток медуллярный РЩЖ объединяет лишь локализация, но на этом их сходство заканчивается. Нейроэндокринная природа медуллярного РЩЖ является причиной принципиального иных подходов к диагностике, лечению и наблюдению. В связи с этим принято решение о разделении клинических рекомендаций по лечению РЩЖ на 2 отдельных документа: клинические рекомендации по диагностике и лечению дифференцированного РЩЖ и клинические рекомендации по диагностике и лечению медуллярного РЩЖ.
Код по Международной классификации болезней 10-го пересмотра (МКБ-10) – D44.0 Новообразование неопределенного или неизвестного характера эндокринных желез, Щитовидной железы.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Код по Международной классификации болезней 10-го пересмотра (МКБ-10) – С73 Злокачественное новообразование щитовидной железы.
Несмотря на единое кодирование по МКБ-10, дифференцированные формы РЩЖ и медуллярный РЩЖ – различные нозологии. Диффузную закладку С-клеток в ЩЖ по происхождению и функции можно считать самостоятельным органом, например, таким же, как околощитовидные железы. Это объясняет несколько иные свойства С-клеточных опухолей. С опухолями ЩЖ из А- и В-клеток медуллярный РЩЖ объединяет лишь локализация, но на этом их сходство заканчивается. Нейроэндокринная природа медуллярного РЩЖ является причиной принципиального иных подходов к диагностике, лечению и наблюдению. В связи с этим принято решение о разделении клинических рекомендаций по лечению РЩЖ на 2 отдельных документа: клинические рекомендации по диагностике и лечению дифференцированного РЩЖ и клинические рекомендации по диагностике и лечению медуллярного РЩЖ.
Код по Международной классификации болезней 10-го пересмотра (МКБ-10) – D44.0 Новообразование неопределенного или неизвестного характера эндокринных желез, Щитовидной железы.
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Международная гистологическая классификация опухолей ЩЖ (классификация Всемирной организации здравоохранения, 2022 г.):
1. Киста щитовидно-язычного протока
2. Другие врожденные аномалии щитовидной железы.
3. Фолликулярно-узловая болезнь щитовидной железы
4. Фолликулярная аденома
5. Фолликулярная аденома с папиллярной архитектурой
6. Онкоцитарная аденома щитовидной железы
7. Неинвазивное фолликулярное новообразование щитовидной железы с папиллярноподобными особенностями ядра
8. Опухоль щитовидной железы с неопределенным злокачественным потенциалом
9. Гиалинизирующая трабекулярная опухоль
10. Фолликулярная карцинома щитовидной железы
11. Инвазивный инкапсулированный фолликулярный вариант папиллярной карциномы
12. Папиллярная карцинома щитовидной железы
-классический подтип папиллярного рака щитовидной железы
-инфильтративный фолликулярный подтип папиллярного рака щитовидной железы
-высококлеточный подтип папиллярного рака щитовидной железы
-столбчато-клеточный подтип папиллярного рака щитовидной железы
-онкоцитарный подтип папиллярного рака щитовидной железы
-hobnail («по типу сапожных гвоздей») подтип папиллярного рака щитовидной железы
-солидный подтип папиллярного рака щитовидной железы
-Уортино-подобный подтип папиллярного рака щитовидной железы
-диффузно-склерозирующий подтип папиллярного рака щитовидной железы
13. Онкоцитарная карцинома щитовидной железы
14. Фолликулярные карциномы высокой степени злокачественности
15. Дифференцированный рак щитовидной железы высокой степени злокачественности
16. Низкодифференцированный рак щитовидной железы
17. Анапластическая фолликулярно-клеточная карцинома щитовидной железы
18. Карцинома щитовидной железы из С-клеток
19. Медуллярный рак щитовидной железы
20. Смешанные медуллярные и фолликулярные карциномы клеточного происхождения
21. Мукоэпидермоидный рак щитовидной железы
22. Секреторная карцинома
23. Склерозирующая мукоэпидермоидная карцинома с эозинофилией.
24. Крибриформная морулярная карцинома щитовидной железы.
25. Тимома
26. Веретенообразная эпителиальная опухоль с тимоподобными элементами.
27. Семья карциномы тимуса
28. Тиробластома
Стадии дифференцированного и анапластического РЩЖ (Американский объединенный комитет по раку (AJCC), 8-е издание, 2017 г.).
Категория Т включает следующие градации:
- T – первичная опухоль;
- Tx – недостаточно данных для оценки первичной опухоли;
- T0 – первичная опухоль не определяется;
- T1 – опухоль размером до 2 см в наибольшем измерении, ограниченная тканью ЩЖ;
- T1a – опухоль размером <1 см, ограниченная тканью ЩЖ;
- T1b – опухоль размером более 1, но менее 2 см в диаметре, ограниченная тканью ЩЖ;
- Т2 – опухоль размером более 2, но не более 4 см в наибольшем измерении, ограниченная тканью ЩЖ;
- Т3 – опухоль размером >4 см в наибольшем измерении, ограниченная тканью ЩЖ, или любая опухоль с минимальным распространением за пределы капсулы (в m. sternothyroid или мягкие ткани около ЩЖ);
- Т3а – опухоль размером >4 см, ограниченная тканью ЩЖ;
- Т3b – любого размера опухоль с макроскопическим распространением за пределы капсулы ЩЖ с инвазией только в подподъязычные мышцы (грудиноподъязычную, грудинощитовидную, щитоподъязычную или лопаточно-подъязычную);
- Т4 – массивное распространение опухоли за пределы капсулы ЩЖ;
- Т4а – опухоль прорастает в капсулу ЩЖ и распространяется на любую из следующих структур: подкожные мягкие ткани, гортань, трахею, пищевод, возвратный нерв;
- Т4b – опухоль распространяется на предпозвоночную фасцию, сосуды средостения или оболочку сонной артерии.
Категория N указывает на наличие или отсутствие метастазов в регионарных лимфатических узлах:
- Nx – недостаточно данных для оценки регионарных лимфатических узлов;
- N0 – нет признаков метастатического поражения регионарных лимфатических узлов;
- N0a – один или несколько лимфатических узлов с цитологическим или гистологическим подтверждением отсутствия опухоли;
- N0b – отсутствие радиологических или клинических признаков метастатического поражения регионарных лимфатических узлов;
- N1 – имеется поражение регионарных лимфатических узлов метастазами;
- N1a – метастазы в лимфатических узлах VI или VII уровней (пре- и паратрахеальные, преларингеальные или верхние средостенные). Как одностороннее, так и двустороннее поражение;
- N1b – метастазы в шейных лимфатических узлах на одной стороне или с обеих сторон, или на противоположной стороне (I, II, III, IV или V), или в заглоточных лимфатических узлах.
Категория М характеризует наличие или отсутствие метастазов:
- М0 – нет признаков отдаленных метастазов;
- М1 – имеются отдаленные метастазы.
Группировка по стадиям
| Дифференцированный рак | |||
|---|---|---|---|
| До 55 лет | |||
| Стадия I | Любая Т | Любая N | М0 |
| Стадия II | Любая Т | Любая N | M1 |
| От 55 лет и старше | |||
| Стадия I |
T1
T2
|
N0/Nx
N0
|
M0
M0
|
| Стадия II |
T1
T2
T3a/b
|
N1
N1
N любая
|
M0
M0
M0
|
| Стадия III | T4a | N любая | M0 |
| Стадия IVА | Т4b | N любая | M0 |
| Стадия IVВ | Т4b | N любая | М1 |
| Анапластический рак | |||
| Стадия IVa | Т1–3a | N0/Nx | M0 |
| Стадия IVВ |
Т1–3a
T3b
T4b
|
N1
N любая
N любая
|
M0
M0
M0
|
| Стадия IVc | T любая | N любая | M1 |
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
На сегодняшний день выделяют ряд основных факторов развития РЩЖ: мутации генов BRAF, PTEN, APC, DICER1, MNG, NRAS, KRAS, TERT и др., воздействие ионизирующего излучения, наследственные синдромы (Гарднера, Каудена, множественной эндокринной неоплазии 2А и 2B типа и др.) [1].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
В 2021 г. в структуре заболеваемости злокачественными новообразованиями РЩЖ составил 2,16 % случаев. Средний возраст пациентов – 54 года. Стандартизированная заболеваемость РЩЖ в РФ в 2021 г. составила 6,14 случаев на 100 тыс. населения (среди мужчин − 2,42; среди женщин − 9,39), смертность от РЩЖ – 0,32 случая на 100 тыс. населения (0,28 – среди мужчин; 0,34 – среди женщин) [1, 2].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Дифференцированный РЩЖ не имеет специфической клинической картины и, как правило, проявляет себя как узловой зоб. Анапластический РЩЖ проявляет себя быстро растущим опухолевидным образованием на передней поверхности шеи. На более поздних стадиях присоединяются нарушения дыхания и глотания, увеличение регионарных лимфатических узлов [4, 5].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза/состояния: на дооперационном этапе – результаты цитологического исследования пунктатов ЩЖ; пунктатов измененных лимфоузлов шеи и смывов из иглы на тиреоглобулин, на послеоперационном этапе – плановое патологоанатомическое исследование операционного материала (при необходимости – с иммуногистохимическим типированием) [1, 6–9].
1. Жалобы и анамнез
Введение: Подавляющее большинство случаев дифференцированного РЩЖ выявляют при обследовании пациентов по поводу узлового зоба. Меньшая часть случаев диагностируется в связи с отягощенным личным или семейным анамнезом, изменением голоса, обнаружением увеличенных шейных лимфатических узлов или отдаленных метастазов [6].
В качестве методов первичной диагностики узлового зоба рекомендуется пальпация ЩЖ и регионарных лимфатических узлов, предварительная оценка голосовой функции, сбор анамнеза для исключения факторов риска принадлежности к группе риска развития агрессивных форм РЩЖ [1, 6–10].
- При сборе жалоб и анамнеза среди пациентов, обратившихся на первичный прием по поводу узлового зоба, рекомендуется обращать внимание на следующие факторы с целью не пропустить РЩЖ высокого риска:
- облучение головы и шеи в анамнезе;
- дисфагия, дисфония;
- узловые образования ЩЖ, случайно выявленные при позитронно-эмиссионной томографии с флудезоксиглюкозой [18F];
- операции по поводу РЩЖ в анамнезе [1, 6–10].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
2. Физикальное обследование
- Рекомендуется при физикальном обследовании обращать внимание на изменение контуров шеи, наличие узлового образования в ЩЖ и увеличение регионарных лимфатических узлов, изменение голоса [5].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
3. Лабораторные диагностические исследования
- При выявлении у пациента узлового образования ЩЖ рекомендовано исследование уровня кальцитонина в крови с целью исключения или подтверждения медуллярного рака щитовидной железы. [3].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
- При выявлении у пациента узлового образования ЩЖ рекомендовано исследование уровня тиреотропного гормона (ТТГ) в крови с целью оценки гормонального статуса [11].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 3)
Комментарии: Оценка базальной концентрации кальцитонина в крови значительно превосходит тонкоигольную аспирационную биопсию (ТАБ) в диагностике медуллярного РЩЖ. Это исследование может повлиять на показания к ТАБ, поэтому должно проводится на первичном этапе обследования.
- Исследование уровня (концентрации) кальцитонина в крови рекомендуется оценивать с учетом гендерных различий верхней границы референсных значений с целью адекватной интерпретации результатов [3].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
Комментарий: Повышение уровня базального кальцитонина >100 пг/мл крайне подозрительно в отношении медуллярного РЩЖ.
- Дооперационное исследование уровня тиреоглобулина (ТГ) в крови у первичных пациентов с узловыми образованиями в ЩЖ не рекомендовано, так как на этом этапе показатель не является маркером РЩЖ [12].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
4. Инструментальные диагностические исследования
Ультразвуковое исследование
Введение: Несмотря на высокую разрешающую способность, ультразвуковое исследование (УЗИ) не следует использовать в популяции в качестве метода скрининга РЩЖ в связи с низкой эффективностью как с клинической, так и с финансовой позиции: метод выявляет большое число случаев узлового коллоидного зоба, который, как правило, не имеет клинического значения и не требует какого-либо лечения.
Раннее выявление папиллярных микрокарцином (опухоли размером <1 см) не оказывает влияния на прогноз общей и безрецидивной выживаемости больных.
Основная роль УЗИ при РЩЖ – уточнение показаний к ТАБ, навигация при ее выполнении, оценка местной распространенности процесса и состояния лимфатических узлов для определения оптимального объема оперативного вмешательства [13, 14].
- УЗИ щитовидной железы и паращитовидных желез, УЗИ лимфатических узлов (одна анатомическая зона) шеи рекомендовано пациентам с подозрением на опухоль ЩЖ в следующих случаях: с целью оценки распространенности процесса, состояния лимфатических узлов и оценки объема предстоящего хирургического лечения:
- пальпируемое образование на шее;
- увеличенные шейные лимфатические узлы;
- семейный анамнез РЩЖ;
- облучение головы и шеи в анамнезе;
- паралич голосовой складки;
- симптомы дисфагии;
- узловые образования ЩЖ, случайно выявленные при позитронно-эмиссионной томографии с фтордезоксиглюкозой [18F];
- операции по поводу РЩЖ в анамнезе [6, 8].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: Протокол УЗИ щитовидной железы и паращитовидных желез включает определение размеров, локализации, ультразвуковых характеристик опухоли. Подозрительными признаками являются (оценивают только в солидных узлах или в солидных участках узлов) [1, 6, 8, 13]:
- гипоэхогенная солидная структура;
- неровный, нечеткий или полициклический контур;
- точечные гиперэхогенные включения (микрокальцинаты);
- преобладание переднезаднего размера узла над шириной («выше/чем/шире»).
- Для ультразвуковой оценки вероятности злокачественности опухоли ЩЖ и определения показаний к ТАБ рекомендуется использовать систему EU-TIRADS (European Thyroid Imaging Reporting and Data System) [15].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2)
Комментарии:
- EU-TIRADS 1 – отсутствие узлов в ЩЖ при УЗИ;
- EU-TIRADS 2 – доброкачественное образование. Риск злокачественности – 0 %. Включает 2 категории узлов: анэхогенные (кисты) и губчатые узлы. Если в кистозных узлах есть пристеночный солидный компонент, они переквалифицируются в категорию низкого риска. ТАБ не показана, но может быть выполнена в лечебных целях;
- EU-TIRADS 3 – образование низкого риска злокачественности. Риск злокачественности – 2–4 %. Образования изо- и гиперхогенные, округлой и овальной формы, с четкими контурами, при отсутствии любых подозрительных признаков. ТАБ показана при узлах размером ≥ 2,0 см;
- EU-TIRADS 4 – образование среднего риска злокачественности. Риск злокачественности – 6–17 %. Образования умеренно гипоэхогенные, округлой и овальной формы, с четкими контурами, при отсутствии любых подозрительных признаков. Основное различие между низким и средним риском заключается в эхогенности солидных участков узла. В случае гетерогенности узла наличие любого гипоэхогенного участка будет относить узел к группе среднего риска. ТАБ показана при узлах размером ≥1,5;
- EU-TIRADS 5 – образование высокого риска злокачественности. Риск злокачественности – 26–87 %. Образование хотя бы с 1 признаком злокачественности: гипоэхогенный узел, неправильная форма, нечеткие контуры, микрокальцинаты (точечные гиперэхогенные включения), переднезадний размер узла больше его ширины («выше, чем шире»). ТАБ показана при узлах размером ≥1 см. При первичном доброкачественном результате ТАБ необходимо повторить в ближайшее время для исключения ложноотрицательного результата. Если узел размером <1 см и нет изменений со стороны регионарных лимфатических узлов, рекомендуется динамическое наблюдение с регулярными УЗИ каждые 3- 6 мес.
Протокол УЗИ лимфатических узлов (одна анатомическая зона) шеи должен включать оценку следующих параметров [8, 13, 16]:
- размер (необходимо оценивать диаметр или переднезадний размер, а не длину. Для всех шейных лимфатических узлов, кроме II уровня фасциально-клетчаточного пространства шеи (поднижнечелюстная зона), наибольший размер составляет не более 0,6 см, для II уровня – не более 0,8 см);
- соотношение длинной и короткой осей;
- наличие/отсутствие ворот;
- кистозные изменения;
- точечные гиперэхогенные включения (микрокальцинаты);
- характер васкуляризации (ворота или весь лимфатический узел);
- повышение эхогенности лимфатического узла (сходство с нормальной тканью ЩЖ).
Наиболее специфичными признаками, позволяющими заподозрить метастатическое поражение лимфатического узла, являются микрокальцинаты, кистозный компонент, периферическая васкуляризация, сходство ткани лимфатического узла с тканью ЩЖ, менее специфичными – увеличение размеров, закругленность контуров, отсутствие ворот.
- При наличии подозрительных ультразвуковых признаков в узловом образовании ЩЖ рекомендуется ультразвуковое исследование гортани с целью оценки подвижности голосовых складок с целью исключения инвазии опухоли в гортань и/или пареза голосовой складки вследствие вовлечения в процесс возвратного гортанного нерва (зависит от анатомического строения гортани) [1, 6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- При РЩЖ или подозрении на него независимо от субъективной оценки голосовой функции всем пациентам на дооперационном этапе рекомендуется проведение видеоларингоскопии с целью объективной оценки подвижности голосовых связок, при невозможности УЗИ голосовых складок [1, 6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Тонкоигольная аспирационная биопсия с последующим цитологическим исследованием микропрепарата тонкоигольной аспирационной биопсии
- Тонкоигольная аспирационная биопсия щитовидной железы с последующим цитологическим исследованием микропрепарата тонкоигольной аспирационной биопсии рекомендуется всем пациентам с подозрением на РЩЖ в качестве основного метода дифференциальной диагностики доброкачественных и злокачественных поражений ЩЖ и лимфатических узлов [17].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4)
- Тонкоигольную аспирационную биопсию щитовидной железы с последующим цитологическим исследованием микропрепарата тонкоигольной аспирационной биопсии рекомендуется проводить под ультразвуковым контролем с целью повышения диагностической точности исследования [18].
Уровень убедительности рекомендаций – В (уровень достоверности доказательств – 2)
Комментарии: ТАБ может выполнять врач любой специальности, владеющий методикой ее проведения (эндокринолог, эндокринный хирург, онколог, врач лучевой диагностики).
Показания к проведению ТАБ [1, 8, 17]:
- узловые образования ЩЖ EU-TIRADS 2 – пункционная биопсия не показана;
- узловые образования ЩЖ EU-TIRADS 3, равные или превышающие 2,0 см в диаметре;
- узловые образования ЩЖ EU-TIRADS 4, равные или превышающие 1,5 см в диаметре;
- узловые образования ЩЖ EU-TIRADS 5, равные или превышающие 1,0 см в диаметре;
- узловые образования ЩЖ EU-TIRADS 5 или других категорий EU-TIRADS размером <1 см при наличии следующих факторов:
- концентрация базального кальцитонина выше гендерных референсных значений;
- наличие увеличенных регионарных лимфатических узлов;
- облучение головы и шеи в анамнезе;
- семейный анамнез МРЩЖ;
- паралич голосовой складки;
- пациенты моложе 18 лет;
- для определения объема операции при наличии узла в контралатеральной доле
При образованиях размером <1 см, если пациент не относится к группе риска наличия агрессивных форм РЩЖ, проведение ТАБ нецелесообразно независимо от ультразвуковых характеристик новообразования [10].
- При получении доброкачественного цитологического заключения Bethesda II из узла с подозрительными ультразвуковыми признаками EU-TIRADS 5 ТАБ рекомендуется повторить в ближайшее время с целью исключения диагностической ошибки [10].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- При обнаружении измененных регионарных лимфатических узлов II – V уровней шеи рекомендована их прицельная ТАБ с целью верификации возможного метастатического поражения [19]. ТАБ измененных лимфоузлов VI уровня шеи проводят по индивидуальным показаниям.
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 3)
Комментарий: Диагностическая точность ТАБ лимфатических узлов повышается при исследовании смыва из иглы на ТГ или кальцитонин в зависимости от предполагаемой морфологической формы РЩЖ
- При выявлении солидного гипоэхогенного узла щитовидной железы, быстро увеличивающегося в размерах (увеличение максимального размера узла более 1 см в месяц), не сопровождающегося болевым синдромом и кистозной трансформацией, особенно при наличии симптомов (затруднение дыхания, нарушение голоса, затруднение глотания) пациента рекомендовано в кратчайшие сроки направить для проведения биопсии узла в специализированный центр [8, 13].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: Наиболее быстро растущими новообразованиями щитовидной железы являются анапластический РЩЖ и лимфома. Обе опухоли имеют высокую скорость увеличения размеров, часто вызывают регионарную лимфаденопатию, при УЗИ гипоэхогенны, чаще всего – без очагов кистозной трансформации в структуре. При росте данные опухоли не вызывают болевого синдрома. При отсутствии лечения могут вызывать симптомы сдавления воздухоносных путей, нарушение функции гортани вследствие врастания в возвратный гортанный нерв. Обе опухоли требуют быстрого начала лечебных мероприятий, при этом для определения тактики лечения необходимо выполнение генетического теста или ИГХ в материале, полученном при тонкоигольной биопсии или трепан-биопсии. Учитывая, что результаты лечения данных опухолей прямо зависят от времени его начала, врачам первичного звена следует приложить максимальные усилия для быстрой маршрутизации пациентов в специализированные центры, располагающие соответствующими диагностическими возможностями.
- При цитологическом исследовании микро препарата тонкоигольной аспирационной биопсии из узловых образований ЩЖ с целью повышения диагностической точности исследования рекомендуется использовать 6 стандартных категорий заключений современной международной цитологической классификации (Bethesda Thyroid Classification, 2009, 2017) при изучении пунктатов из узловых образований ЩЖ с целью повышения диагностической точности исследования [20].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: Международная цитологическая классификация пунктатов из узловых образований ЩЖ включает в себя 6 категорий:
- I категория – неинформативная пункция;
- II категория – доброкачественное образование (коллоидные и аденоматозные узлы, хронический аутоиммунный тиреоидит, подострый тиреоидит);
- III категория – атипия неопределенного значения (сложная для интерпретации пункция с подозрением на опухолевое поражение);
- IV категория – фолликулярная неоплазия или подозрение на фолликулярную неоплазию;
- V категория – подозрение на злокачественную опухоль (подозрение на папиллярный рак, медуллярный рак, метастатическую карциному, лимфому);
- VI категория – злокачественная опухоль (папиллярный, низкодифференцированный, медуллярный, анапластический рак).
Заключения, содержащие только описательную часть, а также заключения без конкретного цитологического диагноза неинформативны. В этих ситуациях необходимо проконсультировать готовые цитологические препараты у опытного морфолога или повторить ТАБ в специализированном лечебном учреждении
Компьютерная томография
- Спиральная компьютерная томография (КТ) шеи и компьютерная томография органов грудной полости с внутривенным болюсным контрастированием рекомендована при размере опухоли T3-4, подозрении на экстратиреоидное распространение, при наличии измененных регионарных лимфатических узлов по данным УЗИ с целью уточнения распространенности опухоли [1, 8, 10].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: Магнитно-резонансную томографию и позитронно-эмиссионную томографию томографию всего тела с туморотропным РФП применяют для диагностики метастазов по индивидуальным показаниям.
5. Иные диагностические исследования
Молекулярно-генетическое исследование
Современные методы молекулярно-генетического исследования (определение точечных мутаций, хромосомных перестановок, различных типов микроРНК) для дифференциальной диагностики опухолей ЩЖ в рамках цитологического заключения III, IV и V групп по Bethesda Thyroid Classification, 2009, 2017, не позволяют отказаться от оперативного лечения, так как надежно не исключают рак щитовидной железы (низкая отрицательная прогностическая ценность), и, как правило, не влияют на объем операции. На сегодняшний день возможности этих методов ограничены и требуют дальнейшего накопления данных [21].
- Рекомендуется молекулярно-генетические исследования патоморфологического материала выполнять при агрессивных формах рака щитовидной железы (радиойодрефрактерный, низкодифференцированный, анапластический, медуллярный) для определения показаний и выбора оптимального препарата таргетной терапии [21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Учитывая различные морфологические варианты рака щитовидной железы, имеющие индивидуальные особенности биологии опухоли, течение и прогноз, лечение дифференцированных форм и анапластического рака в данных клинических рекомендациях рассматривается отдельно. При этом, низкодифференцированный рак щитовидной железы является агрессивным вариантом ЗНО щитовидной железы, происходящим из фолликулярных клеток. Ввиду того, что данный гистологический вариант имеет общее происхождение с дифференцированными формами РЩЖ при выборе лечебной тактике пациентов с данным вариантом ЗНО следует придерживаться рекомендаций, касающихся дифференцированного рака щитовидной железы.
1. Хирургическое лечение
Введение: Лечение и наблюдение пациентов с высокодифференцированным РЩЖ (ВДРЩЖ) должно проводиться в специализированных медицинских учреждениях, обладающих полноценным арсеналом средств диагностики и опытом лечения ВДРЩЖ [1, 6, 8].
Ведение пациента на всех этапах лечения зависит от стратификации риска рецидива, которую можно условно разделить на три основных этапа.
- Дооперационная стратификация риска для определения показаний и оптимального объема операции.
- Послеоперационная стратификация риска для определения адекватности объема операции, показаний к радиойодтерапии/радиойодаблации
- и супрессивной терапии левотироксином натрия**.
- Динамическая стратификация риска для оценки ответа на проведенное лечение и определения оптимальной тактики ведения пациента.
- При IV, V и VI категории цитологического заключения по международной цитологической классификации (Bethesda Thyroid Classification, 2009) рекомендовано хирургическое лечение [21, 65].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4
- При III категории (атипия неясного значения) рекомендуется повторная пункция с целью уточнения степени риска злокачественности узла и показания к оперативному лечению [21, 66].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
- При интратиреоидной опухоли IV, V и VI категории Bethesda Thyroid Classification менее 1,0 см рекомендовано оперативное лечение в объеме гемитиреоидэктомии. Для данной группы пациентов при предпочтении пациента в качестве альтернативы гемитиреоидэктомии возможно активное динамическое наблюдение (с проведением экспертного УЗИ 1 раз в полгода). Оперативное лечение наиболее целесообразно в случаях локализации опухоли в области прохождения возвратного гортанного нерва, при тесном контакте с трахеей (Стадии дифференцированного и анапластического РЩЖ (Американский объединенный комитет по раку 9AJCC), 8-е издание. 2017 г); NCCN Clinical Practice Guidelaines Oncology). Thyroid Carcinoma. Vercion 3.2018). При увеличении одного из трех линейных размеров микрокарциномы на 0,3 см или превышении одного из размеров 1 см или увеличении объема опухолевого узла более 50%, а также при появлении измененных регионарных лимфоузлов или отдаленных метастазов, появлении признаков врастания в возвратный нерв, трахею или пищевод, появление признаков экстратиреоидной инвазии таким больным показано оперативное лечение в объеме в зависимости от характера прогрессии. При больших проспективных исследованиях установлено, что прогрессирует обычно не более 7 - 8% пациентов в группе наблюдения [21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- При опухоли V и VI категории Bethesda Thyroid Classification от 1 до 4 cм без экстратиреоидной инвазии (определяемой клинически или по данным УЗИ) и/или метастатических лимфоузлов (cN0), рекомендуется хирургическое лечение (гемитиреоидэктомия или тиреоидэктомия) с целью повышения выживаемости пациентов [22, 23].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
Комментарии: Гемитиреоидэктомия – адекватный объем операции у пациентов группы низкого риска. Возможный выбор тиреоидэктомии может быть связан с решением о послеоперационной РЙТ и упрощенном наблюдением или предпочтениями пациента.
- При опухоли V и VI категории Bethesda Thyroid Classification размером >4 см или при опухоли с выраженной экстратиреоидной инвазией (клинически T3), клинически выраженными метастазами (сN1) или отдаленными метастазами (M1) в качестве первичного лечения рекомендуется тиреоидэктомия с максимальной хирургической аблацией опухолевой ткани с целью проведения последующей РЙТ и повышения выживаемости пациентов [10, 20, 21].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Хирургическое вмешательство на лимфатических узлах шеи
- Удаление лимфатических узлов центральной зоны (VI уровень) рекомендовано, если по данным до или интраоперационного обследования есть подозрение на наличие метастазов в этой зоне (cN1) с целью адекватного патоморфологического стадирования болезни и определения показаний к РЙТ [6].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
- При узлах V и VI категории Bethesda Thyroid Classification Т1-Т2 и наличии увеличенных лимфоузлов 6 зоны со стороны поражения возможно выполнение профилактической ипсилатеральной лимфодиссекции 6 зоны в дополнение к гемитиреоидэктомии с целью адекватного патоморфологического стадирования болезни и принятия решения о дальнейшей тактике лечения пациента [21].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарий: выполнение ипсилатеральной лимфодиссекции 6 зоны практически не влияет на число осложнений гемитиреоидэктомии (вероятность гипопаратиреоза и повреждения ВГН практически не отличается от гемитиреоидэктомии), но позволяет стадировать заболевание, снизить вероятность рецидива при выявлении метастатического поражения этого клетчаточного пространства. Наличие микрометастазов не увеличивает риск рецидива, наличие метастазов от 0,3 до 1 см незначительно увеличивает риск рецидива и не требует сиюминутного решения о расширении объема операции с целью проведения РЙТ (решение может быть принято на основании динамического УЗИ).
- Профилактическая центральная лимфаденэктомия ( Лимфаденэктомия шейная VI уровеня, ипси- или билатеральная) рекомендована при распространенной форме первичной опухоли (T3–4) или дооперационно верифицированных метастазах в лимфатических узлах боковой клетчатки шеи (cN1b) с целью повышения эффективности лечения [6, 8]:
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарий: профилактическая центральная лимфаденэктомия при первичной опухоли T1–2 увеличивает частоту осложнений, не оказывая влияния на летальность, несмотря на высокую частоту микрометастазирования (25–30 %). Микрометастазы папиллярного рака являются результатом миграции клеток первичной опухоли, которые не способны к пролиферации и подвергаются апоптозу.
- Удаление клетчатки II–V уровней шеи (лимфаденэктомия шейная) рекомендуется только при доказанном метастатическом поражении лимфатических узлов этих зон по результатам ТАБ с целью повышения выживаемости пациентов [8].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарии: Селективное удаление метастатических лимфатических узлов вне футлярно-фасциального блока является неадекватным.
2. Послеоперационная стратификация риска рецидива и персистенции ДРЩЖ
Современные принципы стадирования послеоперационного риска и определения показаний к назначению терапии натрия йодидом [131I] основаны на рекомендациях Американской тиреоидологической ассоциации (American Thyroid Association, АТА) 2015 г [10, 24, 25, 26]. Выделяют 3 группы: высокого, промежуточного и низкого риска.
Группа низкого риска – радиойодтерапия обычно не показана, но возможно проведение радиойодаблации при наличии йоднакапливающей ткани в ложе щитовидной железы:
- ДРЩЖ со всеми перечисленными ниже признаками:
- без локорегионарных или отдаленных метастазов;
- удалена макроскопически вся опухолевая ткань;
- отсутствие экстратиреоидной инвазии;
- отсутствие сосудистой инвазии;
- неагрессивный гистологический вариант;
- cN0 или pN1 при поражении не более 5 лимфатических узлов, микрометастазы (размером <0,2 см в наибольшем измерении);
- интратиреоидный ДРЩЖ с капсулярной инвазией или без нее и минимальной сосудистой инвазией (<4 очагов);
- интратиреоидный папиллярный рак размером <4 см
- интратиреоидная унифокальная или мультифокальная папиллярная микрокарцинома
- неопределямый уровень антител к тиреоглобулину
- уровень нестимулированного ТГ менее или 1 нг/мл через 6-12 недель после тиреоидэктомиии
Группа промежуточного риска – радиойодтерапия назначается индивидуально:
- агрессивный гистологический вариант;
- cN1 или pN1 при поражении >5 лимфатических узлов, макрометастазы (размером <3 см в наибольшем измерении);
- ДРЩЖ с сосудистой инвазией;
- положительный край резекции
- уровень нестимулированного ТГ до 10 нг/мл через 6-12 недель после тиреоидэктомии
Группа высокого риска –абсолютные показания к радиойодтерапии
- резидуальная опухоль;
- pN1 с любым метастатическим лимфатическим узлом размером >3 см в наибольшем изменении;
- макроскопическая экстратиреоидная инвазия;
- широко инвазивный фолликулярный рак (>4 очагов);
- подозрение на отдаленные метастазы и их лечение;
- уровень нестимулированного ТГ более 10 нг/мл через 6-12 недель после тиреоидэктомии
3. Радиойодтерапия/радиойодабляция
Назначается пациентам с верифицированным папиллярным, фолликулярным, Гюртле-клеточным раком щитовидной железы согласно стратификации риска рецидива и персистенции заболевания [21, 27, 28, 29, 30].
- С целью подготовки к РЙТ без применения тиротропина альфа всем пациентам рекомендуется отменить левотироксин натрия** за 3-4 недели до процедуры с целью достижения должного эффекта РЙТ [21, 27, 28, 29, 30,67, 68,69].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: Радиойодтерапия проводится на фоне 2-недельной диеты с низким содержанием йода. После рентгенконтрастных исследований следует воздержаться от назначения натрия йодида [131I] в течение 2х месяцев. Для РЙТ требуется высокая концентрация ТТГ крови (>30 мЕд/л. Последний может достигаться путем эндогенной стимуляции при отмене левотироксина натрия** на 3-4 нед или введения тиротропина альфа. У пациентов группы низкого риска радиойодабляция может проводится при уровне ТТГ более 10 мЕд/л
- Радиойодабляция в группе низкого риска рекомендуется при показателях нестимулированного сывороточного ТГ более 0,2 но менее 1 нг/мл с целью разрушения остаточной тиреоидной ткани, что необходимо для последующей адекватной интерпретации уровня сывороточного ТГ в процессе динамического наблюдения, повышения информативности контрольных исследований с натрия йодидом [131I] [21, 27, 28, 29, 30].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4).
- Рекомендуемый терапевтический интервал лечебной активности натрия йодида [131I] - 30-80 мКи [21, 27, 28, 29, 30].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 3).
- Адьювантная радиойодтерапия рекомендуется с целью снижения риска рецидива заболевания, увеличения общей и безрецидивной выживаемости, у пациентов группы умеренного и высокого риска, в том числе при биохимической персистенции заболевания [21, 27, 28, 30].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Терапевтический интервал лечебной активности натрия йодида [131I] 30-150 мКи рекомендуется пациентам группы умеренного и высокого риска, в том числе при биохимической персистенции заболевания [21, 27, 28, 29, 30].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- Терапевтический интервал лечебной активности натрия йодида [131I] - 100-200 мКи рекомендуется при наличии отдаленных метастатических очагов, нерезектабельного локорегионарного рецидива [21, 27, 28, 29, 30].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
- При активностях натрия йодида более 120 мКи рекомендуется проводить биодозиметрию с целью предотвращения и контроля избыточной лучевой нагрузки на кровь и костный мозг [28, 30,70].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
- При суммарной лечебной активности натрия йодида более 1000 мКи рекомендуется оценка риска отдаленных нежелательных явлений и миелосупрессии [28, 30, 70].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств - 5)
- При выявлении йод-накапливающих очагов рекомендуются повторные курсы радиойодтерапии с интервалом 3-6 месяцев до полного исчезновения накопления йода в метастатических очагах и уровня стимулированного тиреоглобулина < 1 нг/л [28, 30,70].
Уровень убедительности рекомендаций - С (уровень достоверности доказательств -5)
4. Терапия левотироксином натрия**
Заместительная терапия левотироксином натрия** направлена на коррекцию послеоперационного гипотиреоза, супрессивная – на подавление ТТГ-зависимого роста остаточных опухолевых клеток.
- В группе пациентов низкого риска и биохимической ремиссии проведение супрессивной терапии левотироксином натрия** не рекомендуется ввиду отсутствия увеличения выживаемости и ухудшения качества жизни, вместо этого рекомендуется проведение заместительной терапии [32].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
- В группах пациентов промежуточного риска, биохимического рецидива и неопределенного опухолевого статуса рекомендуется супрессивная гормонотерапия левотироксином натрия** с целью повышения показателей выживаемости пациентов [32].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарии: мягкая супрессия целесообразна при тахикардии и менопаузе; заместительная терапия – в возрасте старше 60 лет, при наличии фибрилляции предсердий, остеопороза.
- В группе пациентов высокого риска и структурного рецидива с целью повышения показателей выживаемости рекомендуется супрессивная гормонотерапия левотироксином натрия**, кроме пациентов с фибрилляцией предсердий, которым проводится мягкая супрессия [32].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарии: Целевые диапазоны уровня ТТГ в различных режимах [1, 6, 8]:
- cупрессивная терапия: уровень ТТГ <0,1 мЕд/л, уровень свободного тироксина не превышает верхнюю границу нормы;
- мягкая супрессия: уровень ТТГ 0,1–0,5 мЕд/л;
- заместительная терапия: уровень ТТГ 0,4-4,0 мЕд/л
5. Таргетная терапия
- При развитии радиойодрефрактерности, т.е неэффективности РЙТ и доказанном прогрессировании опухоли в течение последних 12 мес согласно критериям RECIST 1.1, с целью увеличения общей выживаемости пациентов, рекомендована системная таргетная терапия препаратами, зарегистрированными в РФ по данным медицинским показаниям (ленватиниб**, сорафениб**, кабозантиниб**) [21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: При развитии радиойодрефрактерности прогрессирование по данным RECIST 1.1 является обязательным условием для начала таргетной терапии. Увеличение показателей тиреоглобулина и антител к тиреоглобулину само по себе без структурного прогрессирования по данным RECIST не является условием к началу таргетной терапии.
Пациент считается радиойодрефрактерным если имеется хотя бы один из перечисленных ниже признаков:
- отсутствие накопления 131I хотя бы в 1 из всех имеющихся опухолевых очагов при введении лечебной активности 131I не менее 100 мКи;
- прогрессирование опухоли на фоне РЙТ в течение последних 12 мес;
- отсутствие положительного эффекта РЙТ при суммарной терапевтической активности >600 мКи
- При первично нерезектабельном жизнеугрожающем или симптоматическом ДРЩЖ с целью увеличения общей выживаемости пациентов рекомендована системная таргетная терапия препаратами, зарегистрированными в РФ по данным медицинским показаниям (ленватиниб**, сорафениб**, кабозантиниб**) [21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Рекомендуется индивидуальный подбор препарата для системной таргетной терапии каждому пациенту, учитывая его анамнез, а также прогноз эффективности и безопасности конкретного препарата с целью увеличения общей выживаемости пациентов и улучшения переносимости лечения [6,33].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5).
Комментарий: Кабозантиниб** применяется только в качестве препарата 2 или последующей линии таргетной терапии.
- Независимо от выбора препарата, рекомендуется начинать лечение в стартовой дозе, указанной в инструкции по применению препарата, с последующей ее редукцией при развитии нежелательных явлений 3 степени тяжести и более с целью достижения оптимального эффекта терапии и контроля переносимости лечения [34].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2).
- При рецидивном неоперабельном или метастатическом дифференцированном раке щитовидной железы при неэффективности РЙТ в случае прогрессирования заболевания и/или наличии жизнеугрожающего, ассоциированного с опухолью состояния, рекомендуется ленватиниб** в дозе 24 мг/сут перорально до прогрессирования или неприемлемой токсичности с целью повышения выживаемости пациентов [35].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2)
Комментарий: Использование ленвантиниба** предпочтительно по сравнению с сорафенибом** ввиду более значимого клинического ответа, выражающегося в увеличении времени до прогрессирования с медианой выживаемости без прогрессирования в 18,3 месяца, а также частоты объективных ответов до 64,8% против 12,2%.
- При рецидивном неоперабельном или метастатическом дифференцированном раке щитовидной железы при неэффективности РЙТ в случае прогрессирования заболевания и/или наличии жизнеугрожающего, ассоциированного с опухолью состояния, рекомендуется сорафениб** в дозе 400 мг 2 раза в сутки перорально до прогрессирования или неприемлемой токсичности с целью повышения выживаемости пациентов [36].
Уровень убедительности рекомендаций – A (уровень достоверности доказательств – 2)
- При рецидивном неоперабельном или метастатическом радиойодрефрактерном дифференцированном раке щитовидной железы, прогрессирующем на фоне ленватиниба** и/или сорафениба**, рекомендован кабозантиниб** 60 мг/сут перорально до прогрессирования или неприемлемой токсичности с целью повышения выживаемости пациентов [37].
Уровень убедительности рекомендаций – А (уровень достоверности доказательств – 2)
- При рецидивном неоперабельном или метастатическом радиойодрефрактерном дифференцированном раке щитовидной железы, прогрессирующем на стандартных режимах таргетной терапии, рекомендовано проведение комплексного геномного профилирования на основе секвенирования нового поколения с использованием образцов опухолевой ткани или жидкостной биопсии, с целью выявления конкретных молекулярных мишеней и назначением определенной таргетной терапии действующей на них [38].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарий: целевыми мутациями для определения являются мутации в RET-протоонкогене, слияния в гене NTRK.
- При рецидивном неоперабельном или метастатическом радиойодрефрактером дифференцированном раке щитовидной железы, прогрессирующем на стандартных режимах таргетной терапии, при наличии подтверждённого слияния гена NTRK рекомендован ларотректиниб 100 мг х 2 р/сут перорально c целью повышения выживаемости [39].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
- При рецидивном неоперабельном или метастатическом радиойодрефрактером дифференцированном раке щитовидной железы, прогрессирующем на стандартных режимах таргетной терапии, при наличии подтверждённого слияния гена NTRK рекомендован энтректиниб 600 мг х 1 р/сут перорально c целью повышения выживаемости [40].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
- При рецидивном неоперабельном или метастатическом радиойодрефрактером дифференцированном раке щитовидной железы, прогрессирующем на стандартных режимах таргетной терапии, при наличии подтверждённого слияния гена RET рекомендован селперкатиниб в дозе 120 мг два раза в сутки (при массе тела менее 50 кг) и 160 мг два раза в сутки (при массе тела 50 кг и более) перорально c целью повышения выживаемости [21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- В случае прогрессирования опухоли или развития угрожающей жизни токсичности на фоне применения одного из таргетных препаратов рекомендуется перевод пациента на прием другого препарата [21].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
6. Дистанционная лучевая терапия
- Дистанционная лучевая терапия в отдельных случаях рекомендуется пациентам с солитарными опухолевыми метастазами РЩЖ, не накапливающими натрия йодид [131I] и хирургически нерезектабельными, а также в качестве паллиативного лечения при болевом или компрессионном синдроме (например, при сдавлении трахеи, спинного мозга) [41, 42, 74,75,76,77].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 4)
Комментарий: Применение дистанционной лучевой терапии ограничено в связи с низкой чувствительности ВДРЩЖ к данному виду лечения.
7. Системная радионуклидная терапия самарий, 153 Sm оксабифором
- Системная радионуклидная терапия Самарий, 153 Sm оксабифором, с учетом тераностического подхода, рекомендуется при наличии накопления остеотропных РФП по результатам ОФЭКТ(ОФЭКТ/КТ) и подтверждение метастатического поражения скелета по результатам рентгенологических и / или магнитно-резонансного томографического исследований с целью повышения качества жизни пациентов с ДРЩЖ [43, 44, 45, 46, 47].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств - 5)
- Системная радионуклидная терапия Самарий, 153 Sm оксабифором рекомендуется пациентам с подтвержденным метастатическим поражением скелета (количество очагов ≥3) с целью купирования болевого синдрома, при отсутствии симптомов сдавления спинного мозга, с интервалом 3-6 месяцев, лечебной активностью 0,5-1,0 мКи/кг [43, 44, 45, 46, 47].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств - 5)
8. Терапия остеомодифицирующими агентами
- При метастатическом поражении костей скелета всем пациентам показана терапия остеомодифицирующим агентом: золедроновая кислота** 4 мг в/в 1 раз в 28 дней или деносумаб** 120 мг п/к 1 раз в 28 дней [71,72,73].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
9. Лечение анапластического рака щитовидной железы
Проведении тонкоигольной биопсии под ультразвуковым наведением рекомендовано при первичной диагностики анапластического РЩЖ.
- В случае получения неинформативного результата биопсии при клиническом подозрении на наличие анапластического РЩЖ рекомендовано проведение толстоигольной трепан-биопсии образования под контролем УЗИ [21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- При установлении диагноза анапластического РЩЖ рекомендована срочная маршрутизация пациента в специализированный центр, располагающий возможностью проведения генетических исследований, таргетной терапии и опытом хирургического лечения пациентов с анапластическим РЩЖ. Попытки лечения пациентов в онкологических учреждениях общего профиля не рекомендованы [21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- При установлении цитологического диагноза анапластического РЩЖ рекомендовано в кратчайшие сроки определить наличие мутации BRAF V600E в цитологическом материале или в материале, полученном при трепанбиопсии [21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: В АРЩЖ, содержащем области ВДРЩЖ, мутации BRAFV600E были обнаружены как в АРЩЖ так и в ПРЩЖ, что позволяет предположить, что мутации BRAF играют роль в развитии АРЩЖ из ДРЩЖ. Таким образом, процесс дедифференцировки, вероятно, вызван прогрессивным накоплением соматических мутаций в генах, связанных со злокачественными новообразованиями, особенно в TP53 и генах, которые кодируют белки, участвующие в пути фосфатидилинозитол-3-киназы (PI3K)-AKT.
Среди АРЩЖ мутация BRAFV600E является наиболее часто встречающейся мутацией, наблюдаемой в 50–70% случаев. Если ПРЩЖ сосуществует в ткани щитовидной железы с AРЩЖ, более 90% опухолей могут содержать мутацию BRAFV600E.
Также описано, что (MAPK) киназы (MEK) киназы усиливают противоопухолевую активность по сравнению с однокомпонентными ингибиторами серин-треонинкиназы B-raf (BRAF), что позволяет предположить, что двойное ингибирование сигнального пути MAPK улучшает ответ на лечение и задерживает или предотвращает реактивацию пути MAPK, известный механизм резистентности.
Эта стратегия оказалась успешной при лечении меланомы и рака легкого с мутацией BRAF V600, при этом комбинированное ингибирование BRAF и MEK увеличивало общую частоту ответа, продолжительность ответа, выживаемость без прогрессирования и общую выживаемость по сравнению с монотерапией ингибитором серин-треонинкиназы B-raf (BRAF).
- Рекомендовано молекулярно-генетическое исследование мутации BRAF V600 проводить методами ПЦР или секвенирования [21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: Методика ПЦР обеспечивает максимальную скорость получения ответа, при наличии положительной реакции достоверность заключения очень высока, что позволяет быстро начать таргетную терапию, однако встречаются ложно-отрицательные результаты. Методика секвенирования требует большего времени на выполнение, однако обладает большей чувствительностью, в связи с чем ее применение может быть оправданным в случае отрицательного результата ПЦР.
- При проведении молекулярно-генетического исследования мутации BRAF V600 методами ПЦР или секвенирования одновременно рекомендован анализ и других мутаций, потенциально способных повлиять на выбор лекарственного лечения (молекулярно-генетическое исследование мутаций в генах ALK, NTRK, RET, TSC2, PI3K/mTOR/AKT, ROS1). Определение экспрессии белка PDL1 иммуногистохимическим методом [21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- При анапластическом РЩЖ рекомендовано проведение комплексного геномного профилирования на основе секвенирования нового поколения с использованием образцов опухолевой ткани или жидкостной биопсии, с целью выявления молекулярных мишеней и последующей пользы от определенной таргетной терапии [48].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
Комментарий: При наличии генетических мишеней для применения таргетных препаратов следует приложить все усилия для включения пациента в соответствующие клинические исследования, либо применить таргетные препараты по решению врачебной комиссии. Так, если у пациента есть мутации в RET-протоонкогене, то может использоваться терапия селперкатинибом (перорально при весе менее 50 кг 120 мг раз в день, при весе более 50 кг 160 мг раз в день) [21], при наличии слияний в гене NTRK рекомендована терапия ларотректинибом или энтректинибом (в т.ч. при мутации/слиянии в гене ROS1) [21].
- Всем пациентам с установленным диагнозом анапластического РЩЖ рекомендовано выполнение позитронно эмиссионной томографии, совмещенной с компьютерной томографией с туморотропными РФП и МРТ головного мозга с целью исключения отдаленных метастазов опухоли, значительно влияющих на прогноз и тактику лечения [21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: При отсутствии возможности проведения ПЭТ/КТ или необходимости длительного ожидания исследования целесообразно выполнение КТ органов грудной полости, органов брюшной полости, органов малого таза с внутривенным болюсным контрастированием.
- В случае выявления мутации BRAF V600E при рецидивном и/или нерезектабельном и/или метастатическом АПРЩЖ рекомендовано применение #дабрафениба** (перорально150 мг два раза в день) в сочетании с #траметинибом** (перорально 2 мг в день) или #вемурафениб** 960 мг 2 раза в сутки перорально + #кобиметиниб** 60 мг 1 раз в сутки внутрь, длительность курса 21 день, перерыв между курсами 7 дней) до прогрессирования или неприемлемой токсичности [21, 49, 50, 54, 63].
Для #дабрафениба** в сочетании с #траметинибом** Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Для #вемурафениба** с #кобиметинибом** Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
Комментарии: Комбинированная терапия ингибиторами сигнальных путей BRAF и MEK более эффективна, чем терапия L01EC: ингибитором B-raf серин-треонинкиназы (BRAF) в монорежиме. Выявление отдаленных метастазов опухоли не должно являться поводом для отказа от таргетной терапии или задержки с началом терапии, поскольку ответ опухоли на лечение в данный момент непредсказуем, и существуют случаи полного ответа на таргетную терапию. При выраженном клиническом ответе и соответствии опухолевого процесса критериям резектабельности возможно рассмотрение вопроса о хирургическом лечении.
- Оценку резектабельности опухоли, имеющей мутацию BRAF V600E, рекомендовано проводить после таргетной терапии BRAF (АТХ L01EC)/MEK (АТХ L01EE) ингибиторами [49, 50].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- При рецидивном и/или неоперабельном или метастатическом анапластическом раке щитовидной железы при наличии подтверждённого слияния гена NTRK рекомендован ларотректиниб 100 мг х 2 р/сут перорально c целью повышения выживаемости до прогрессирования или неприемлемой токсичности [51].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
- При рецидивном и/или неоперабельном или метастатическом анапластическом раке щитовидной железы при наличии подтверждённого слияния гена NTRK рекомендован энтректиниб 600 мг х 1 р/сут перорально c целью повышения выживаемости [52].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 4)
- При рецидивном и/или неоперабельном или метастатическом анапластическом раке щитовидной железы при наличии подтверждённой мутации гена RET рекомендован селперкатиниб в дозе 120 мг два раза в сутки (при массе тела менее 50 кг) и 160 мг два раза в сутки (при массе тела 50 кг и более) перорально c целью повышения выживаемости [21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- При возможности R0/R1 резекции опухоли рекомендовано радикальное удаление опухоли в объеме тиреоидэктомии с избирательной резекцией всех пораженных локальных или регионарных структур и лимфатических узлов с целью увеличения показателей выживаемости пациентов [53, 54].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Для оценки возможности радикальной резекции опухоли рекомендованы эзофагогастродуоденоскопия и ларинго-бронхоскопия [21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Послеоперационный гистологический диагноз анапластического РЩЖ требует обязательного подтверждения иммуногистохимическим методом [21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- После проведения хирургического лечения рекомендовано использование лучевой терапии на область шеи (предпочтительно, IMRT) в сочетании с химиотерапией [21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: Начало химиотерапии рекомендовано в течение первой недели после хирургического вмешательства с последующим началом лучевой терапии.
- химиотерапия рекомендована в случаях отсутствия генетических мишеней для использования таргетной терапии. рекомендуется применять следующие режимы химиотерапии [21]: #паклитаксел** 60-100 мг/м2 + карбоплатин** AUC 2 в/в еженедельно или #паклитаксел** 60-90 мг/м2 в/в кап, еженедельно или #паклитаксел** 135-175 мг / м 2 + карбоплатин** AUC 5-6 в/в 1 раз в 3 недели или #доцетаксел** 60 мг/м2 + доксорубицин** 60 мг/м2 в/в раз в 3-4 недели до неприемлемой токсичности или #доцетаксел** 20 мг/м2 + доксорубицин** 20 мг / м 2 в/в еженедельно или доксорубицин** 60-75 мг/м2 в/в раз в 3 недели или доксорубицин** 20 мг/м2 в/в еженедельно [21, 55-64].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Обезболивание
Порядок и рекомендации по обезболиванию при дифференцированном РЩЖ соответствуют рекомендациям «Хронический болевой синдром у взрослых пациентов, нуждающихся в паллиативной медицинской помощи», представленным в рубрикаторе клинических рекомендаций Минздрава России.
Диетотерапия
Не применяется.
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Общие принципы реабилитации пациентов после проведенных хирургических вмешательств, РЙТ, лучевой терапии и/или химиотерапии соответствуют таковым при злокачественных новообразованиях головы и шеи, представленным в клинических рекомендациях «Злокачественные новообразования полости рта».
Госпитализация
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) на основе настоящих клинических рекомендаций;
4) с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом и иными врачами-специалистами в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы).
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной онкологической помощи либо в первичный онкологический кабинет, поликлиническое отделение онкологического диспансера (онкологической больницы) для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы) должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или поликлинического отделения онкологического диспансера (онкологической больницы организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной онкологической помощи (первичный онкологический кабинет, биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер (онкологическую больницу) или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественных новообразований не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
Сроки проведения диагностических инструментальных и лабораторных исследований в случае подозрения на онкологическое заболевание не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
Диагноз онкологического заболевания устанавливается врачом-онкологом, а при злокачественных новообразованиях лимфоидной, кроветворной и родственных им тканей, входящих в рубрики МКБ-10 С81-С96, также врачом-гематологом.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета) направляет пациента в онкологический диспансер (онкологическую больницу) или иную медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями, в том числе подведомственную федеральному органу исполнительной власти (далее – федеральная медицинская организация), для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания), определения тактики лечения, а также в случае наличия медицинских показаний для оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При онкологических заболеваниях, входящих в рубрики С37, C38, C40–C41, C45–C49, С58, D39, C62, C69–C70, С72, C74 МКБ-10, а также соответствующих кодам международной классификации болезней – онкология (МКБ-О), 3 издания 8936, 906-909, 8247/3, 8013/3, 8240/3, 8244/3, 8246/3, 8249/3 врач-онколог онкологического диспансера (онкологической больницы) или иной медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, для определения лечебной тактики организует проведение консультации или консилиума врачей, в том числе с применением телемедицинских технологий, в федеральных государственных бюджетных учреждениях, подведомственных Министерству здравоохранения Российской Федерации, оказывающих медицинскую помощь (далее в целях настоящего Порядка – национальные медицинские исследовательские центры).
В сложных клинических случаях для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания) в целях проведения оценки, интерпретации и описания результатов врач-онколог организует направление:
цифровых изображений, полученных по результатам патоморфологических исследований, в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр)[1] путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
цифровых изображений, полученных по результатам лучевых методов исследований, в дистанционный консультативный центр лучевой диагностики, путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
биопсийного (операционного) материала для повторного проведения патоморфологических, иммуногистохимических, и молекулярно-генетических исследований: в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр), а также в молекулярно-генетические лаборатории для проведения молекулярно-генетических исследований.
Тактика лечения устанавливается консилиумом врачей, включающим врачей-онкологов, врача-радиотерапевта, врача-нейрохирурга (при опухолях нервной системы) медицинской организации, в составе которой имеются отделения хирургических методов лечения злокачественных новообразований, противоопухолевой лекарственной терапии, радиотерапии (далее – онкологический консилиум), в том числе онкологическим консилиумом, проведенным с применением телемедицинских технологий, с привлечением при необходимости других врачей-специалистов.
Диспансерное наблюдение врача-онколога за пациентом с выявленным онкологическим заболеванием устанавливается и осуществляется в соответствии с порядком диспансерного наблюдения за взрослыми с онкологическими заболеваниями.
С целью учета информация о впервые выявленном случае онкологического заболевания направляется в течение 3 рабочих дней врачом-онкологом медицинской организации, в которой установлен соответствующий диагноз, в онкологический диспансер или организацию субъекта Российской Федерации, исполняющую функцию регистрации пациентов с впервые выявленном злокачественным новообразованием, в том числе с применением единой государственной информационной системы в сфере здравоохранения.
Специализированная, в том числе высокотехнологичная, медицинская помощь в медицинских организациях, оказывающих медицинскую помощь взрослому населению при онкологических заболеваниях, оказывается по медицинским показаниям, предусмотренным положением об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Специализированная, за исключением высокотехнологичной, медицинская помощь в медицинских организациях, подведомственных федеральным органам исполнительной власти, оказывается по медицинским показаниям, предусмотренным пунктом 5 порядка направления пациентов в медицинские организации и иные организации, подведомственные федеральным органам исполнительной власти, для оказания специализированной (за исключением высокотехнологичной) медицинской помощи, предусмотренного в приложении к положению об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Сроки ожидания оказания специализированной (за исключением высокотехнологичной) медицинской помощи не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
При наличии у пациента с онкологическим заболеванием медицинских показаний для проведения медицинской реабилитации врач-онколог организует ее проведение в соответствии с порядком организации медицинской реабилитации взрослых.
При наличии у пациента с онкологическим заболеванием медицинских показаний к санаторно-курортному лечению врач-онколог организует его в соответствии порядком организации санаторно-курортного лечения.
Паллиативная медицинская помощь пациенту с онкологическими заболеваниями оказывается в соответствии с положением об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья.
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1) наличие осложнений онкологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения (хирургическое вмешательство, ЛТ, лекарственная терапия и т.д.) онкологического заболевания.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, ДЛТ и другие виды ЛТ, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих;
4) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
1. Динамическая стратификация риска и диспансерное наблюдение пациентов
Принадлежность пациента к определенной группе риска не является постоянной и должна подлежать динамической переоценке в зависимости от ответа на проведенное лечение. Это позволяет индивидуализировать динамическое наблюдение, снизить финансовые затраты и своевременно выявить структурный рецидив заболевания, тем самым оказав положительное влияние на прогноз заболевания.
Динамическая стратификация риска позволяет разделить пациентов на следующие 4 основные группы по результатам проведенного лечения [6].
1. Биохимическая ремиссия (вероятность рецидива составляет 1–4 %):
- отрицательные данные УЗИ;
- концентрация нестимулированного TГ <0,2 нг/мл при низком уровне антител к ТГ;
- концентрация стимулированного TГ <1 нг/мл, если больной переквалифицирован из другой группы.
2. Биохимический рецидив:
- отрицательные данные УЗИ, СВТ, КТ;
- концентрация нестимулированного TГ >1 нг/мл;
- концентрация стимулированного TГ >10 нг/мл;
- вираж антител к ТГ (постоянное увеличение уровня антител при динамическом наблюдении).
В данной группе примерно у 30 % больных происходит спонтанное снижение биохимических показателей, у 20 % – ремиссия после дополнительного лечения (РЙТ), у 20 % – структурный рецидив. Смертность, связанная с РЩЖ, составляет <1 %.
При сохранении стабильной концентрации ТГ или ее снижении в большинстве случаев проводят наблюдение, при отсутствии специфических противопоказаний предпочтительна супрессия уровня ТТГ. При росте уровня ТГ или вираже антител к ТГ рекомендуется активное обследование и проведение дополнительных лечебных опций (РЙТ).
В качестве промежуточной группы между пациентами с биохимической ремиссией и с биохимическим рецидивом выделена группа больных с неопределенным опухолевым статусом.
3. Неопределенный опухолевый статус:
- отрицательные или неспецифические данные УЗИ, СВТ, КТ;
- концентрация TГ без стимуляции составляет более 0,2, но менее 1 нг/мл;
- концентрация TГ после стимуляции составляет более 1, но менее 10 нг/мл;
- уровень антител к ТГ стабильный или снижается.
Неспецифические изменения могут быть стабильны или исчезнуть, вероятность структурного рецидива оценивается несколько меньше, чем в группе биохимического рецидива (15–20 %), специфическая смертность составляет <1 %. В большинстве случаев необходимо продолжить наблюдение (визуализация, определение уровня ТГ). При подозрительных изменениях следует прибегнуть к дополнительной визуализации и биопсии.
4. Структурный рецидив: структурные или функциональные признаки опухоли при любой концентрации ТГ и/или антител к ТГ.
Прогноз: около 50–60 % пациентов сохраняют персистенцию, несмотря на дополнительное лечение. Смертность, связанная с РЩЖ, при шейных метастазах составляет 11 %, при отдаленных – 50 %. Выбор лечебной тактики зависит от размера, локализации, объема поражения, скорости роста, захвата натрия йодида [131I] или флудезоксиглюкозы [18F], гистологического варианта опухоли.
2. Определение тиреоглобулина и антител к тиреоглобулину
Наиболее высокочувствительным методом динамического наблюдения является определение ТГ – специфического высокочувствительного маркера тиреоцитов, а также клеток папиллярного и фолликулярного РЩЖ.
Присутствие в крови антител к ТГ может стать причиной ложноотрицательного результата исследования уровня ТГ. Определение ТГ должно осуществляться с помощью чувствительного иммунорадиометрического анализа (функциональная чувствительность – 0,2 нг/мл).
После первичного лечения ТГ может обнаруживаться в крови пациентов в течение нескольких месяцев, поэтому его определение целесообразно выполнять не ранее чем через 3 мес после проведения последнего лечебного этапа [1, 6, 8].
- Послеоперационное исследование уровня тиреоглобулина в крови и определение содержания антител к тиреоглобулину в сыворотке крови на фоне терапии левотироксином натрия** рекомендовано всем пациентам каждые 6–12 мес с целью исключения рецидива заболевания [21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- В группе биохимической ремиссии интервал исследование уровня тиреоглобулина в крови и определение содержания антител к тиреоглобулину в сыворотке крови на фоне терапии левотироксином натрия** рекомендуется изменить до 12–24 мес с целью повышения качества жизни пациентов и снижения экономических затрат [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Интервал исследования уровня ТТГ в крови рекомендуется не более 12 мес для всех пациентов на фоне терапии левотироксином натрия** с целью своевременного выявления рецидива заболевания [6].
Уровень убедительности рекомендаций – C (уровень достоверности доказательств – 5)
- Динамическое исследование уровня ТГ в крови не реже 6–12 мес рекомендуется в группах пациентов высокого риска, структурного рецидива, биохимического рецидива, неопределенного опухолевого статуса с целью повышения выживаемости пациентов [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: Повторное определение стимулированного ТГ рекомендовано в группах пациентов [51]:
- высокого риска;
- структурного рецидива;
- биохимического или неопределенного статуса рецидива;
- Повторное исследование стимулированного уровня ТГ в крови не рекомендовано в группах пациентов низкого риска и биохимической ремиссии ввиду низкой диагностической эффективности [6]/
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
3. Послеоперационное ультразвуковое исследование
- После оперативного лечения УЗИ щитовидной железы и паращитовидных желез, УЗИ лимфатических узлов (одна анатомическая зона) шеи рекомендуется через 6–12 мес в зависимости от группы риска и динамики концентрации ТГ с целью выявления структурного рецидива [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- При выявлении при УЗИ подозрительных лимфатических узлов максимальным размером >0,8–1,0 см рекомендуется прицельная ТАБ, которая дополняется определением ТГ в смыве из иглы с целью морфологической или биохимической верификации рецидива заболевания [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: При меньшем размере лимфатического узла возможно динамическое наблюдение (если размеры узла остаются стабильными и нет угрозы прорастания жизненно важных структур).
4. Сцинтиграфия костей всего тела
- У пациентов с биохимической ремиссией после РЙТ проведение плановой сцинтиграфии костей всего тела не рекомендуется ввиду низкой диагностической ценности [6, 21,78].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Сцинтиграфия костей всего тела рекомендуется через 6–12 мес после РЙТ у пациентов групп высокого и промежуточного риска без достижения биохимической ремиссии и с персистенцией заболевания с целью оценки прогрессии заболевания [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
5. Компьютерная, магнитно-резонансная и позитронно-эмиссионная томография
- Спиральная компьютерная томография шеи и компьютерная томография органов грудной полости рекомендуется при сомнениях в адекватной оценке распространенности заболевания при УЗИ, подозрении на прорастание трахеи, гортани, глотки, пищевода, выявления метастазов в легкие и лимфатические узлы средостения у пациентов группы высокого риска с повышенной концентрацией ТГ (как правило, >10 нг/мл) или с виражом антител к ТГ независимо от результатов сцинтиграфии всего тела с целью адекватной оценки распространенности заболевания [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Магнитно-резонансная томография головного мозга, костной ткани (одна область), органов брюшной полости рекомендуется пациентам группы высокого риска с повышенной концентрацией ТГ (как правило, >10 нг/мл) при отсутствии метастазов в легкие, лимфатические узлы шеи и средостения или наличии характерных симптомов метастатического поражения органов вышеуказанных локализаций с целью адекватной оценки распространенности заболевания и выявления структурного рецидива [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Позитронная эмиссионная томография всего тела с туморотропными РФП рекомендуется пациентам группы высокого риска при высокой концентрации ТГ (>10 нг/мл) и отрицательных данных сцинтиграфии костей всего тела с целью исключения структурного прогрессирования болезни, начального стадирования при низкодифференцированном или широко инвазивном фолликулярном РЩЖ или оценки результатов лечения при радиойодрезистентных формах ВДРЩЖ [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
6. Рак щитовидной железы и беременность
Высокодифференцированный РЩЖ в большинстве случаев является опухолью с латентной прогрессией, и его выявление во время беременности не является показанием к ее прерыванию. Беременность не является фактором, способствующим прогрессированию ВДРЩЖ. Большинство исследований свидетельствуют о том, что отдаленный прогноз ВДРЩЖ, диагностированного во время беременности, ничем не отличается от прогноза РЩЖ, выявленного в других ситуациях. Нет никаких различий в показателях летальности и персистенции ВДРЩЖ у беременных, оперированных во II триместре до 24-й недели, и у женщин, оперированных после родов. Более того, по данным ретроспективных исследований, прогноз не ухудшается даже при проведении оперативного лечения спустя год после первичной диагностики ВДРЩЖ во время беременности.
Если при пункционной биопсии и цитологическом исследовании у беременной поставлен диагноз ВДРЩЖ, ей показано оперативное лечение, однако решение о сроках проведения операции должно быть индивидуализировано.
Существуют исследования, в которых сообщается о более высокой частоте специфических и неспецифических осложнений у женщин, перенесших операцию в период беременности, по отношению к небеременным женщинам, что потребовало более длительного пребывания в стационаре и повышенных затрат на лечение. Объем комплексного лечения пациенток с ВДРЩЖ может быть индивидуализирован исходя из факта планирования беременности (терапия натрия йодидом [131I] может быть в ряде случаев отложена) [6].
- Искусственное прерывание беременности (аборт) не рекомендовано при выявлении ВДРЩЖ [6, 21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Выявление ВДРЩЖ является показанием к оперативному лечению, сроки которого определяются индивидуально, при этом в большинстве случаев оно может быть отложено до послеродового периода. [6, 21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарий: При ВДРЩЖ, диагностированном цитологически на ранних сроках беременности, показано динамическое УЗИ с частотой 1 раз в месяц.
- При прогрессирующем увеличении опухоли или появлении измененных регионарных лимфатических узлов рекомендовано оперативное лечение во II триместре беременности в сроке до 24-й недели [6].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Вопрос о планировании беременности женщинами, получившими лечение по поводу ВДРЩЖ, решается индивидуально: оно может быть рекомендовано сразу после оперативного лечения или спустя 6 месяцев после РЙТ [6, 21].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- Мужчинам, прошедшим радиойодтерапию/радиойодаблацию], не рекомендуют участвовать в планировании беременности в течение 120 дней (период жизни сперматозоида) [6]
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
- При планировании беременности после оперативного вмешательства на ЩЖ рекомендуется поддержание стойкого эутиреоза с целью снижения риска рецидива и нормального развития плода [10, 79,80].
Уровень убедительности рекомендаций – С (уровень достоверности доказательств – 5)
Комментарии: Целесообразно назначение заместительной терапии левотироксином натрия** (в дозе около 2 мкг/кг массы тела) с целевым показателем концентрации ТТГ 0,1–2,5 мЕд/л. Контролировать содержание ТТГ в крови во время беременности необходимо 1 раз в 6–8 нед. Женщинам, которые получили лечение по поводу ВДРЩЖ, не противопоказано грудное вскармливание [6], во время которого требуется прием калия йодид** в дозировке 200 мкг в сутки в связи с сохранением йодного дефицита в стране
Информация
Источники и литература
-
Клинические рекомендации Ассоциации онкологов России
- Клинические рекомендации Ассоциации онкологов России - 1.Поляков Андрей Павлович, д.м.н., доцент, заведующий отделения микрохирургии МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи» 2.Полькин Вячеслав Викторович, к.м.н., заведующий отделением лучевого и хирургического лечения заболеваний головы, шеи МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России, ОК.СГО: 0000-0003-0857-321Х; еЫЪгагу 8Р1Ы: 5604-2012; е-таП: ро1кт83@таП.га. 3.Агабабян Татев Артаковна, к.м.н., заведующая отделением лучевой диагностики МРНЦ им. А.Ф. Цыба — филиала ФГБУ «НМИЦ радиологии» Минздрава России, ЕтаП: ШеУ1к.05@таИ.ги, 8Р1Ы-код: 5752-3393, АиЙюгГО: 622660, Ьирз://огс1с1.ог§/0000-0002-9971 - 3451 4.Алымов Ю рий Владимирович, к.м.н., врач-онколог отделения хирургических методов лечения №5 (эндокринной онкологии) НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, исполнительный директор Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»; ОК.СГО: ЬПрз://огс1с1.ог§/0000-0002-6851 -9867, е-таП: а11те<1регеуо(1@§таП.сот. б.Бельцевич Дмитрий Германович, д.м.н., профессор, заведующий 1 хирургическим отделением отдела хирургии ФГБУ «НМИЦ эндокринологии» Минздрава России; ОК.СШ: Ьир://огс1с1.ог§/0000-0001-7098-4584, еЫЬгагу 8РШ: 4475-6327, е-таП: Ъеиз67@8таП.сот. 6.Бородавина Екатерина Владимировна, к.м.и., старший научный сотрудник, врач- радиолог отделения радиохирургического лечения открытыми радионуклидами МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи». 7.Ванушко Владимир Эдуардович, д.м.н., профессор, заведующий 2 хирургическим отделением отдела хирургии эндокринных органов ФГБУ «НМИЦ эндокринологии» Минздрава России; ОК.СГО: Ьйр://оплс1.ог§/0000-0001-6338-7490, еЫЬгагу 8Р1Ы: 6097-8990, е-таП: уапизЬко@§таП.сот. 8.Владимирова Любовь Ю рьевна, д.м.н., проф., руководитель отдела лекарственного лечения опухолей ФГБУ «НМИЦ онкологии» Минздрава России 9.Геворков Артем Рубенович, к.м.н., старший научный сотрудник, врач-радиотерапевт отделения лучевой терапии с модификацией МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи» 10. Гузь Александр Олегович, к.м.н., заведующий отделением опухолей головы и шеи ГБУЗ «Челябинский областной клинический центр онкологии и ядерной медицины», член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи». 11. Гулидов Игорь Александрович, д.м.н., проф., заведующий отделом лучевой терапии МРНЦ йм. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России 12. Игнатова Анастасия Валерьевна, к.м.н., врач-онколог отделения хирургических методов лечения №5 (эндокринной онкологии) НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи», ассистент кафедры общей и клинической стоматологии ФГАОУ ВО РУДН. ОК.СГО: Ь«Р5://огсЫ.ога/0000-0002-6796-0968 13. Ильин Алексей Амурович, д.м.н. ведущий научный сотрудник отделения лучевого и хирургического лечения заболеваний головы, шеи МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России 14. Исаев Павел Анатольевич, д.м.н. ведущий научный сотрудник отделения лучевого и хирургического лечения заболеваний головы, шеи МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России 15. , Костромина Екатерина Викторовна, к.м.н., старший научный сотрудник научного отделения диагностической и интервенционной радиологии ФБГУ «НМИНЦ онкологии им. Н.Н. Петрова» Минздрава России, доцент отдела учебно-методической работы, доцент кафедры лучевой диагностики и биомедицинской визуализации ФП и ДПО СПбГМУ, врач отделения лучевой диагностики ФБГУ НМИЦ онкологии им. Н.Н.Петрова. 16. Кропотов Михаил Алексеевич, д.м.н. заведующий отделением опухолей головы и шеи ФГБУ «НМИЦ онкологии» М3 РФ 17. Крылов Валерий Васильевич, д.м.н, заведующий отделением радиохирургического лечения открытыми нуклидами МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России. 18. Кульбакин Денис Евгеньевич, д.м.н., старший научный сотрудник, врач высшей категории отделения опухолей головы и шеи НИИ онкологии Томского НИМЦ. 19. Кутукова Светлана Игоревна, д.м.н., доцент кафедры стоматологии и челюстно- лицевой хирургии, доцент кафедры онкологии ФИО ФГБОУ ВО «Первый Санкт- Петербургский государственный медицинский университет имени академика И.П. Павлова» Министерства здравоохранения Российской Федерации, врач-онколог отделения №10 (противоопухолевой лекарственной терапии) СПб ГБУЗ «Городской клинический онкологический диспансер» 20. • М ельниченко Галина Афанасьевна, д.м.н., профессор, академик РАН, заместитель директора ФГБУ «НМИЦ эндокринологии» Минздрава России; СЖСШ: Ьир://огсМ.ог§/0000-0002-5634-7877, еЫЬгагу 8Р1Ы: 8615-0038, е-таП: 1ео&аз12000@та11.ги. 21. Мудунов Али Мурадович, д.м.н., профессор РАН, заведующий отделением опухолей головы' и шеи онкоцентра «Лапино», президент Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи». 22. Мусин Ш амиль Исмагилович к.м.н., заведующий отделением опухолей головы и шеи РКОД М3 Республики Башкортостан 23. Никифорович Петр Алексеевич, к.м.н., врач- онколог, заместитель главного врача по координации онкологической службы ФГБУ "НМИЦ эндокрионологии" Минздрава России. 24. Подвязников Сергей Олегович, д.м.н., профессор, ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, вице-президент Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи». 25. Раджабова Замира Ахмедовна, к.м.н., заведующая хирургическим отделением опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи» 26. Решетов Игорь Владимирович, д.м.н., академик РАН, заведующий кафедрой онкологии, радиотерапии и реконструктивной хирургии Первого Московского медицинского университета им. И.М. Сеченова, президент Общероссийской общественной организации «Федерация специалистов по лечению заболеваний головы и шеи» 27. Романов Илья Станиславович, д.м.н., старший научный сотрудник отделения хирургических методов лечения №5 (эндокринной онкологии), НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи». ОКСГО: Ьирз://огс1(1.ог8/0000-0002-5421-5985 28. Ромащенко Павел Николаевич, д.м.н., профессор, член-корреспондент РАН, начальник кафедры и клиники факультетской хирургии им. С.П. Федорова ФГБВОУ ВО «Военно-медицинская академия имени С.М. Кирова» МО РФ. 29. Рубцова Н аталья Алефтиновна, д.м.н., заведующая отделом лучевой диагностики МНИОИ им. П.А. Герцена - филиал «НМИЦ радиологии» Минздрава России. Главный внештатный специалст по лучевой и инструментальной диагностике Минздрава России по Центральному федеральному округу Российской Федерации. 30. • Рудык Андрей Николаевич, к.м.н., ассистент кафедры «Онкологии, радиологии и паллиативной медицины» КГМА, врач-онколог отделения опухолей головы и шеи РКОД им. Проф. М.З. Сигала Республики Татарстан 31. Румянцев Павел Олегович, д.м.н., заместитель главного врача, главный онколог- радиолог Международного медицинского центра "СОГАЗ МЕДИЦИНА", член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»; ОКСГО: ЬЦр://огсЫ.ог§/0000-0002-7721-634Х, еЫЬгагу 8Р1Ы: 7085- 7976, е-тай: р ауе1тт@ атаи .сот. 32. Северская Н аталья Викторовна, к.м.н., зав. отделением клинической лабораторной диагностики, эндокринолог МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России, ОКСЮ:0000-0002-9426-8459, еЫЬгагу 8РШ: 3999-8816, е-таП: 5еуег5кп@тггс.оЬтп5к.ги 33. Семиглазова Татьяна Ю рьевна, д.м.н., доцент, заведующий научным отделом инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» 34. Слепцов Илья Валерьевич, д.м.н., профессор кафедры хирургии с курсом хирургической эндокринологии Института усовершенствования врачей, заместитель директора по медицинской части; ОК.СГО: 0000-0002-1903-5081; еЫЬгагу 8РП4: 2481-4331; е-таП: пе\у$иг§егу@уапс1ех.ги. 35. Степанова Александра М ихайловна, заведующая отделением реабилитации МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России 36. Фалалеева Н аталья Александровна, д.м.н., заведующий отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России 37. Хмелевский Евгений Витальевич, д.м.н., профессор, заведующий отделом лучевой терапии МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, врач-радиотерапевт МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России 38. Черников Роман Анатольевич, д.м.н., заведующий отделением эндокринологии и эндокринной хирургии клиники высоких медицинских технологий им. Н.И. Пирогова Санкт-Петербургского государственного университета; ОКСГО: 0000-0002-3001-664Х; еЫЬгагу 8РГМ-код: 7093-1088; е-таП: уасШ@уапс1ех.ги. 39. Чойнзонов Евгений Лхамацыренович, д.м.н., академик РАН, директор НИИ онкологии Томского НИМЦ, заведующий отделением опухолей головы и шеи НИИ онкологии Томского НИМЦ, заведующий кафедрой онкологии ФГБОУ ВО СибГМУ Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи» 40. Ш уринов Андрей Ю рьевич, к.м.н., старший научный сотрудник отделения радиохирургического лечения открытыми радионуклидами МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России. Блок Организация оказания медицинской помощи 41. Геворкян Тигран Гагикович, заместитель директора ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России 42. Иванов Сергей Анатольевич, д.м.н., профессор РАН, директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России 43. Невольскнх Алексей Алексеевич, д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России. 44. Хайлова Ж анна Владимировна, к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
Информация
Список сокращений
ВДРЩЖ – высокодифференцированный рак щитовидной железы
КТ – компьютерная томография
МКБ-10 – Международная классификация болезней 10-го пересмотра
РЙТ – радиойодтерапия
РЩЖ – рак щитовидной железы
СВТ – сцинтиграфия всего тела
ТАБ – тонкоигольная аспирационная биопсия
ТГ – тиреоглобулин
ТТГ – тиреотропный гормон
УЗИ – ультразвуковое исследование
ЩЖ – щитовидная железа
Термины и определения
Bethesda Thyroid Classification, 2009, 2017 – стандартизированная система описания протокола цитологического исследования пунктатов щитовидной железы.
EU-TIRADS (European Thyroid Imaging Reporting and Data System) – стандартизированная система описания протокола ультразвукового исследования щитовидной железы.
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Факторы, влияющие на исход РЩЖ:
-
распространенность опухолевого процесса;
-
локализация метастатических очагов;
-
способность опухоли и метастазов накапливать радиоактивный йод;
-
развитие нежелательных явлений препаратов для таргетной терапии.
Критерии оценки качества медицинской помощи
|
№ п/п
|
Критерий качества
|
Оценка выполнения
|
|---|---|---|
|
1
|
Выполнено исследование уровня ТТГ в крови (при установлении диагноза)
|
Да/Нет
|
|
2
|
Выполнено исследование уровня кальцитонина в крови при установлении диагноза
|
Да/Нет
|
|
3
|
Выполнена оценка клинических и анамнестических факторов принадлежности больного к группе агрессивных форм РЩЖ
|
Да/Нет
|
|
4
|
Выполнено УЗИ ЩЖ и паращитовидных желез и УЗИ всех уровней регионарных лимфатических узлов по протоколу EU-TIRADS
|
Да/Нет
|
|
5
|
Выполнена тонкоигольная аспирационная биопсия (ТАБ) ЩЖ (под контролем УЗИ) с последующим цитологическим исследованием микропрепарата по протоколу Bethesda Thyroid Classification, 2009, 2017
|
Да/Нет
|
|
6
|
Выполнена спиральная компьютерная томография (КТ) шеи и компьютерная томография органов грудной полости с внутривенным болюсным контрастированием при подозрении на распространенный опухолевый процесс
|
Да/Нет
|
|
7
|
При IV, V и VI категории цитологического заключения по международной цитологической классификации (Bethesda Thyroid Classification, 2009) выполнено хирургическое лечение
|
Да/Нет
|
|
8
|
Выполнена заместительная гормональная терапия после хирургического вмешательства в группе пациентов низкого риска
|
Да/Нет
|
|
9
|
Выполнена видеоларингоскопия на дооперационном этапе
|
Да/Нет
|
|
10
|
Выполнено исследование уровней ТТГ, ТГ и антител к ТГ в сыворотке крови через 6–12 мес после операции
|
Да/Нет
|
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
-
Поляков Андрей Павлович, д.м.н., доцент, заведующий отделения микрохирургии МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»
-
Полькин Вячеслав Викторович, к.м.н., заведующий отделением лучевого и хирургического лечения заболеваний головы, шеи МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России, ORCID: 0000-0003-0857-321X; eLibrary SPIN: 5604-2012; e-mail: polkin83@mail.ru.
-
Агабабян Татев Артаковна, к.м.н., заведующая отделением лучевой диагностики МРНЦ им. А.Ф. Цыба — филиала ФГБУ «НМИЦ радиологии» Минздрава России, Email: tatevik.05@mail.ru, SPIN-код: 5752-3393, AuthorID: 622660, https://orcid.org/0000-0002-9971-3451
-
Алымов Юрий Владимирович, к.м.н., врач-онколог отделения хирургических методов лечения №5 (эндокринной онкологии) НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, исполнительный директор Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»; ORCID: https://orcid.org/0000-0002-6851-9867, e-mail: allmedperevod@gmail.com.
-
Бельцевич Дмитрий Германович, д.м.н., профессор, заведующий 1 хирургическим отделением отдела хирургии ФГБУ «НМИЦ эндокринологии» Минздрава России; ORCID: http://orcid.org/0000-0001-7098-4584, eLibrary SPIN: 4475-6327, e-mail: belts67@gmail.com.
-
Бородавина Екатерина Владимировна, к.м.н., старший научный сотрудник, врач-радиолог отделения радиохирургического лечения открытыми радионуклидами МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
-
Ванушко Владимир Эдуардович, д.м.н., профессор, заведующий 2 хирургическим отделением отдела хирургии эндокринных органов ФГБУ «НМИЦ эндокринологии» Минздрава России; ORCID: http://orcid.org/0000-0001-6338-7490, eLibrary SPIN: 6097-8990, e-mail: vanushko@gmail.com.
-
Владимирова Любовь Юрьевна, д.м.н., проф., руководитель отдела лекарственного лечения опухолей ФГБУ «НМИЦ онкологии» Минздрава России
-
Геворков Артем Рубенович, к.м.н., старший научный сотрудник, врач-радиотерапевт отделения лучевой терапии с модификацией МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»
-
Гузь Александр Олегович, к.м.н., заведующий отделением опухолей головы и шеи ГБУЗ «Челябинский областной клинический центр онкологии и ядерной медицины», член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
-
Гулидов Игорь Александрович, д.м.н., проф., заведующий отделом лучевой терапии МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России
-
Игнатова Анастасия Валерьевна, к.м.н., врач-онколог отделения хирургических методов лечения №5 (эндокринной онкологии) НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи», ассистент кафедры общей и клинической стоматологии ФГАОУ ВО РУДН. ORCID: https://orcid.org/0000-0002-6796-0968
-
Ильин Алексей Амурович, д.м.н. ведущий научный сотрудник отделения лучевого и хирургического лечения заболеваний головы, шеи МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России
-
Исаев Павел Анатольевич, д.м.н. ведущий научный сотрудник отделения лучевого и хирургического лечения заболеваний головы, шеи МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России
-
Костромина Екатерина Викторовна, к.м.н., старший научный сотрудник научного отделения диагностической и интервенционной радиологии ФБГУ «НМИНЦ онкологии им. Н.Н. Петрова» Минздрава России, доцент отдела учебно-методической работы, доцент кафедры лучевой диагностики и биомедицинской визуализации ФП и ДПО СПбГМУ, врач отделения лучевой диагностики ФБГУ НМИЦ онкологии им. Н.Н.Петрова.
-
Кропотов Михаил Алексеевич, д.м.н. заведующий отделением опухолей головы и шеи ФГБУ «НМИЦ онкологии» МЗ РФ
-
Крылов Валерий Васильевич, д.м.н, заведующий отделением радиохирургического лечения открытыми нуклидами МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России.
-
Кульбакин Денис Евгеньевич, д.м.н., старший научный сотрудник, врач высшей категории отделения опухолей головы и шеи НИИ онкологии Томского НИМЦ.
-
Кутукова Светлана Игоревна, д.м.н., доцент кафедры стоматологии и челюстно-лицевой хирургии, доцент кафедры онкологии ФПО ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Министерства здравоохранения Российской Федерации, врач-онколог отделения №10 (противоопухолевой лекарственной терапии) СПб ГБУЗ «Городской клинический онкологический диспансер»
-
Мельниченко Галина Афанасьевна, д.м.н., профессор, академик РАН, заместитель директора ФГБУ «НМИЦ эндокринологии» Минздрава России; ORCID: http://orcid.org/0000-0002-5634-7877, eLibrary SPIN: 8615-0038, e-mail: teofrast2000@mail.ru.
-
Мудунов Али Мурадович, д.м.н., профессор РАН, заведующий отделением опухолей головы и шеи онкоцентра «Лапино», президент Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
-
Мусин Шамиль Исмагилович к.м.н., заведующий отделением опухолей головы и шеи РКОД МЗ Республики Башкортостан
-
Никифорович Петр Алексеевич, к.м.н., врач- онколог, заместитель главного врача по координации онкологической службы ФГБУ "НМИЦ эндокрионологии" Минздрава России.
-
Подвязников Сергей Олегович, д.м.н., профессор, ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, вице-президент Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи».
-
Раджабова Замира Ахмедовна, к.м.н., заведующая хирургическим отделением опухолей головы и шеи ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»
-
Решетов Игорь Владимирович, д.м.н., академик РАН, заведующий кафедрой онкологии, радиотерапии и реконструктивной хирургии Первого Московского медицинского университета им. И.М. Сеченова, президент Общероссийской общественной организации «Федерация специалистов по лечению заболеваний головы и шеи»
-
Романов Илья Станиславович, д.м.н., старший научный сотрудник отделения хирургических методов лечения №5 (эндокринной онкологии), НИИ клинической онкологии им. Н.Н. Трапезникова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи». ORCID: https://orcid.org/0000-0002-5421-5985
-
Ромащенко Павел Николаевич, д.м.н., профессор, член-корреспондент РАН, начальник кафедры и клиники факультетской хирургии им. С.П. Федорова ФГБВОУ ВО «Военно-медицинская академия имени С.М. Кирова» МО РФ.
-
Рубцова Наталья Алефтиновна, д.м.н., заведующая отделом лучевой диагностики МНИОИ им. П.А. Герцена – филиал «НМИЦ радиологии» Минздрава России. Главный внештатный специалст по лучевой и инструментальной диагностике Минздрава России по Центральному федеральному округу Российской Федерации.
-
Рудык Андрей Николаевич, к.м.н., ассистент кафедры «Онкологии, радиологии и паллиативной медицины» КГМА, врач-онколог отделения опухолей головы и шеи РКОД им. Проф. М.З. Сигала Республики Татарстан
-
Румянцев Павел Олегович, д.м.н., заместитель главного врача, главный онколог-радиолог Международного медицинского центра "СОГАЗ МЕДИЦИНА", член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»; ORCID: http://orcid.org/0000-0002-7721-634X, eLibrary SPIN: 7085-7976, e-mail: pavelrum@gmail.com.
-
Северская Наталья Викторовна, к.м.н., зав. отделением клинической лабораторной диагностики, эндокринолог МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России, ORCID:0000-0002-9426-8459, eLibrary SPIN: 3999-8816, e-mail: severskn@mrrc.obninsk.ru
-
Семиглазова Татьяна Юрьевна, д.м.н., доцент, заведующий научным отделом инновационных методов терапевтической онкологии и реабилитации ФГБУ «НМИЦ онкологии им. Н.Н. Петрова»
-
Слепцов Илья Валерьевич, д.м.н., профессор кафедры хирургии с курсом хирургической эндокринологии Института усовершенствования врачей, заместитель директора по медицинской части; ORCID: 0000-0002-1903-5081; eLibrary SPIN: 2481-4331; e-mail: newsurgery@yandex.ru.
-
Степанова Александра Михайловна, заведующая отделением реабилитации МНИОИ им. П.А. Герцена - филиала ФГБУ «НМИЦ радиологии» Минздрава России
-
Фалалеева Наталья Александровна, д.м.н., заведующий отделом лекарственного лечения злокачественных новообразований МРНЦ им. А.Ф. Цыба- филиал ФГБУ «НМИЦ радиологии» Минздрава России
-
Хмелевский Евгений Витальевич, д.м.н., профессор, заведующий отделом лучевой терапии МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, врач-радиотерапевт МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России
-
Черников Роман Анатольевич, д.м.н., заведующий отделением эндокринологии и эндокринной хирургии клиники высоких медицинских технологий им. Н.И. Пирогова Санкт-Петербургского государственного университета; ORCID: 0000-0002-3001-664X; eLibrary SPIN-код: 7093-1088; e-mail: yaddd@yandex.ru.
-
Чойнзонов Евгений Лхамацыренович, д.м.н., академик РАН, директор НИИ онкологии Томского НИМЦ, заведующий отделением опухолей головы и шеи НИИ онкологии Томского НИМЦ, заведующий кафедрой онкологии ФГБОУ ВО СибГМУ Минздрава России, член Общероссийской общественной организации «Российское общество специалистов по опухолям головы и шеи»
-
Шуринов Андрей Юрьевич, к.м.н., старший научный сотрудник отделения радиохирургического лечения открытыми радионуклидами МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.Блок Организация оказания медицинской помощи
-
Геворкян Тигран Гагикович, заместитель директора ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
-
Иванов Сергей Анатольевич, д.м.н., профессор РАН, директор МРНЦ им. А.Ф. Цыба - филиала ФГБУ «НМИЦ радиологии» Минздрава России
-
Невольских Алексей Алексеевич, д.м.н., заместитель директора по лечебной работе МРНЦ им. А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
-
Хайлова Жанна Владимировна, к.м.н., заместитель директора по организационно-методической работе МРНЦ им. А.Ф. Цыба - филиал ФГБУ "НМИЦ радиологии" Минздрава России.
Конфликт интересов. Авторы декларируют отсутствие конфликта интересов.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
-
Врач-онколог;
-
Врач-хирург;
-
Врач-эндокринолог;
-
Врач-радиолог;
-
Врач-радиотерапевт;
-
Врач общей практики (семейный врач)
-
Врач-патологоанатом.
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных по ключевым словам, связанным с РЩЖ и соответствующими разделами клинических рекомендаций, оценка качества и релевантности найденных источников.
Базы данных, использованные для сбора/селекции доказательств. Доказательной базой для рекомендаций являются публикации, вошедшие в Кокрейновскую библиотеку, базы данных Embase и MedLine. Глубина поиска составляла до 40 лет.
Методы, использованные для определения качества и силы доказательств:
-
консенсус экспертов;
-
оценка значимости в соответствии с уровнями доказательности (табл. 1‒3).
Таблица 1. Шкала оценки уровней достоверности доказательств для методов диагностики (диагностических вмешательств)
|
Уровень достоверности доказательств
|
Расшифровка
|
|---|---|
|
1
|
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
|
|
2
|
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
|
|
3
|
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Таблица 2. Шкала оценки уровней достоверности доказательств для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
Уровень достоверности доказательств
|
Расшифровка
|
|---|---|
|
1
|
Систематический обзор рандомизированных клинических исследований с применением метаанализа
|
|
2
|
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением метаанализа
|
|
3
|
Нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай–контроль»
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Таблица 3. Шкала оценки уровней убедительности рекомендаций для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
Уровень убедительности рекомендаций
|
Расшифровка
|
|---|---|
|
A
|
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
B
|
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C
|
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными))
|
Порядок обновления клинических рекомендаций. Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем 1 раз в 3 года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, при наличии обоснованных дополнений/замечаний к ранее утвержденным клиническим рекомендациям, но не чаще 1 раза в 6 мес.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
-
Бельцевич Д.Г., Ванушко В.Э., Мельниченко Г.А. и др. Клинические рекомендации Российской ассоциации эндокринологов по диагностике и лечению (много)узлового зоба у взрослых (2015 г.). Эндокринная хирургия 2016;(1):5–12.
-
Бельцевич Д.Г., Ванушко В.Э., Румянцев П.О. и др. Российские клинические рекомендации по диагностике и лечению высокодифференцированного РЩЖ у взрослых, 2017 г. Эндокринная хирургия 2017;11(1):6–27. DOI: 10.14341/serg201716-27.
Приложение Б. Алгоритмы действий врача
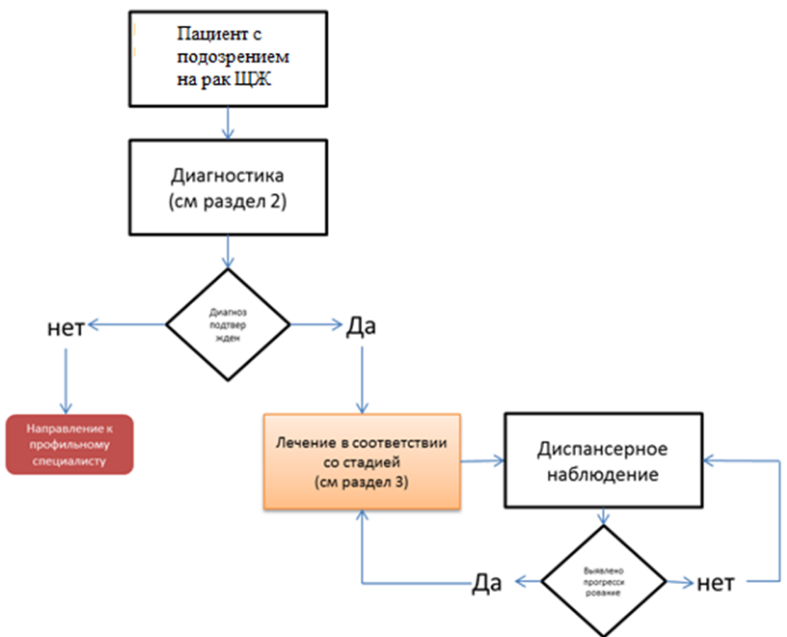
Приложение В. Информация для пациента
-
Послеоперационный прием препаратов левотироксина натрия** в качестве заместительной терапии не оказывает отрицательного виляния на качество жизни.
-
Беременность не приводит к прогрессированию РЩЖ.
-
РЩЖ не является показанием для прерывания беременности.
-
После лечения радиоактивным йодом беременность не рекомендуется планировать в течение 6 мес.
-
Мужчинам не рекомендуется участвовать в планировании беременности в течение 120 дней после лечения радиоактивным йодом.
-
Пациенткам, получившим комплексное лечение по поводу РЩЖ, не противопоказано грудное вскармливание.
Подготовку к диагностике или послеоперационной терапии радиоактивным йодом можно проводить как с помощью 3-4-недельной отмены левотироксина натрия**, так и с помощью инъекций рекомбинантного человеческого ТТГ.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Не предусмотрено.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.