Диагностика, лечение и профилактика венозных тромбоэмболических осложнений в травматологии и ортопедии
 Версия: Клинические рекомендации РФ 2025 (Россия)
Версия: Клинические рекомендации РФ 2025 (Россия)
Общая информация
Краткое описание
Разработчик клинической рекомендации
Общество специалистов по неотложной кардиологии
Ассоциация травматологов-ортопедов России
Одобрено Научно-практическим Советом Минздрава России
Клинические рекомендации
Диагностика, лечение и профилактика венозных тромбоэмболических осложнений в травматологии и ортопедии
Пересмотр не позднее: 2027
Возрастная категория: Взрослые
Определение заболевания или состояния (группы заболеваний или состояний)
Венозные тромбоэмболические осложнения (ВТЭО) – собирательное понятие, объединяющее тромбоз подкожных, глубоких вен, а также легочную тромбоэмболию.
Профилактика ВТЭО – система мер, направленная на предупреждение развития опасных для жизни пациента и функции конечности осложнений (ТЭЛА и ТГВ).
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
I80.1 Флебит и тромбофлебит бедренной вены
I80.2 Флебит и тромбофлебит других глубоких сосудов нижних конечностей. Тромбоз глубоких вен БДУ
I80.3 Флебит и тромбофлебит нижних конечностей неуточненный. Эмболия или тромбоз нижних конечностей БДУ
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Венозные тромбозы можно классифицировать по локализации, направлению тромботического процесса, степени фиксации тромба, степени гемодинамических расстройств и наличию осложнений [14, 15].
По локализации венозные тромбозы можно разделить в зависимости от:
- сосудистого бассейна: верхней или нижней (наиболее опасны в отношении развития ТЭЛА) полой вены;
- венозной системы: поверхностной, глубокой;
- вен, пораженных тромботическим процессом: проксимальный и дистальный уровни поражения.
По распространенности тромботического поражения: сегментарное или распространённое, двустороннее, мультифокальное.
По направлению распространения выделяют восходящий или нисходящий тромботическй процесс.
По степени фиксации тромба к венозной стенке:
- окклюзионный;
- неокклюзионный: пристеночный, флотирующий (эмболоопасный).
Выделяют три степени гемодинамических расстройств:
- легкая;
- средней тяжести;
- тяжѐлая.
По наличию осложнений венозный тромбоз подразделяют на:
- неосложненный;
- восходящий поверхностный тромбофлебит (верхняя граница тромба на уровне верхней трети бедра) – эмболоопасная форма;
- осложненный: ТЭЛА, венозная гангрена, посттромботическая болезнь (хроническая венозная недостаточность), тромбоз вен нижних конечностей с переходом на нижнюю полую вену.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Венозные тромбоэмболические осложнения представляют собой сложное (многофакторное) заболевание, включающее взаимодействие между приобретенной или наследственной предрасположенностью к тромбозу и воздействием окружающей среды. В этиопатогенезе ВТЭО при хирургических вмешательствах можно выделить два основных звена – это непосредственно хирургическая травма и эндотелиальная дисфункция.
В настоящее время под травматичностью операции понимают не просто повреждение тканей в зоне хирургического вмешательства, но и большое количество патологических процессов. Хирургический стресс проявляется многофункциональными изменениями, происходящими в организме пациента под влиянием агрессивных факторов хирургического вмешательства: психоэмоционального возбуждения, боли, повреждения мягких тканей и кровеносных сосудов, патологических рефлексов и массивной кровопотери.
Изменения в организме, происходящие на фоне хирургического вмешательства, представляют собой программируемый стресс, следствием которого являются существенные изменения реологических свойств крови. Совокупность нарушений регуляции в системе гемостаза, приводящих к повышению свёртывающей способности, замедление кровотока в конечности и повреждение сосудистой стенки составляют триаду Вирхова, лежащую в основе патогенеза тромбоэмболических осложнений. В патогенезе развития тромбоэмболических осложнений после эндопротезирования крупных суставов пусковым механизмом является массивная травма тканей, повреждение кровеносных сосудов и обнажение сосудистого коллагена [1].
Выброс катехоламинов в ответ на хирургическую агрессию также увеличивает агрегационные свойства тромбоцитов. При этом активизируется как сосудисто-тромбоцитарное (за счет выброса в кровоток тромбопластических факторов из тромбоцитов), так и коагуляционное (за счет высвобождения тромбопластических веществ из стенки сосудов) звенья гемостаза [2, 3]. Внешний путь коагуляционного гемостаза приводит к образованию первичного сгустка и при массивном повреждении тканей происходит в течение 15 секунд [4]. Повреждение эндотелия сосудов запускает свертывание крови по внутреннему пути. В норме эндотелий секретирует антикоагулянтные факторы, препятствующие адгезии форменных элементов к стенке сосуда. При травме сосуда эта способность теряется и на месте повреждения формируется сначала тромбоцитарный тромб, а затем фибриновый тромб. Другими причинами повышенного риска тромбообразования являются вынужденное положение конечности, к примеру, при эндопротезировании коленного сустава, когда выраженное сгибание в оперированном суставе приводит к компрессии сосудов в подколенной ямке, а также применение турникета гибкого, что вызывает стаз крови, перерастяжение и микроразрывы сосудистой стенки. Кроме того, манипуляции в костномозговом канале во время установки эндопротеза, применение костного цемента, активируют внешний путь свертывания крови за счет образования большого количества тромбина, что также увеличивает риск тромбообразования.
Таким образом, патогенез тромбообразования при хирургическом вмешательстве представлен в виде сменяющих друг друга процессов: хирургическая агрессия запускает классическую триаду Вирхова: интраоперационная травма сосудов, замедление кровотока из-за вынужденного положения конечности и наложения турникета гибкого при эндопротезировании коленного сустава и активация коагуляционного гемостаза. Далее каскад цитокинов и гуморальных медиаторов провоцирует нарушение сосудистого тонуса и миграцию лейкоцитов к месту повреждения сосуда. Вследствие этого на протяжении сосудов образуются конгломераты, состоящие из нитей фибрина и форменных элементов крови. Отрываясь от сосудистой стенки данные конгломераты могут вызывать тромбоэмболию. Действие факторов продолжается в послеоперационном периоде, причем важную роль играют такие факторы, как послеоперационная боль и вынужденная иммобилизация пациентов.
Отдельную группу составляют больные с переломами костей нижних конечностей, костей таза, а также пострадавшие с политравмой. Их особенностью является то, что активация свёртывающей системы крови происходит в несколько этапов. Первичная травма сопровождается значительным повреждением тканей, включая эндотелий сосудов, и выделением большого количества тканевого фактора, способствующего активации свёртывающей системы крови. Затем в течение короткого промежутка времени этим пациентам выполняется операция остеосинтеза перелома, что является дополнительной травмой и повторно активирует свёртывающую систему. Кроме того, пострадавшие с политравмой нередко нуждаются в этапных операциях, которые производятся два-три и более раз с интервалами в одну – две недели. При этом каждое хирургическое вмешательство приводит к активации гемостатического каскада. В результате риск развития посттравматических венозных тромбозов в этой группе больных значительно превышает риск подобных осложнений у больных ортопедического профиля, которым обычно выполняется одна операция. Кроме того, если ортопедического пациента можно подготовить к плановому оперативному вмешательству, компенсировав заболевания сердечно-сосудистой системы, явления венозной недостаточности нижних конечностей и другую сопутствующую патологию, способную увеличить риски венозных тромбозов, то пациент с травмой поступает в стационар и оперируется в экстренном или срочном порядке. Соответственно, возможность адекватного воздействия на сопутствующую соматическую патологию у врачей-хирургов обычно отсутствует в силу дефицита времени.
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Большие ортопедические операции сопряжены с высоким риском развития ВТЭО – симптоматического и бессимптомного тромбоза глубоких вен и тромбоэмболии легочной артерии, которые являются потенциально опасными для жизни пациентов [5]. К основным ортопедическим операциям, вызывающим наибольшую озабоченность, относятся операции тотального эндопротезирования коленного сустава, тотального эндопротезирования тазобедренного сустава и переломы бедра.
Частота различных тробоэмболических осложнений варьирует. Бессимптомные тромбозы глубоких вен (диагностируемые только при скрининговом УЗАС) встречаются в 12,6–31,1% случаев после первичного эндопротезирования [6, 7]. Клинически значимые ТГВ развиваются гораздо реже - в 0,75–2,1% случаев [8, 9]. Наиболее тяжелое осложнение — тромбоэмболия легочной артерии (ТЭЛА) регистрируется в 0,41-1,93% случаев. При этом обструкция легочной артерии или ее ветвей не только потенциально опасна для жизни, но и может привести к хроническим осложнениям с плохим прогнозом, таким как тромбоэмболическая легочная гипертензия [10, 11]. Тромбозы глубоких вен являются основным промежуточным процессом, необходимым для развития ТЭЛА, связанной с хирургическим вмешательством, и повышают риск ее развития. Кроме того, приблизительно у 5-10% пациентов с симптоматическими ТГВ в течение последующих 10 и более лет развивается тяжелый посттромботический синдром, проявляющийся формированием венозных язв, периферических отеков и хронической боли [12].
В настоящее время общепринятой практикой при оценке эффективности тромбопрофилактики является учет только симптоматических тромбоэмболий, что обусловлено отсутствием различий через 2 года после хирургического вмешательства в клинических исходах (смертность от сердечно-сосудистых причин) между пациентами, у которых регистрировались бессимптомные ВТЭО, и при отсутствии данных осложнений [13].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические проявления зависят от локализации тромбоза, распространенности и характера поражения венозного русла, а также длительности заболевания. В начальный период при неокклюзивных формах клиническая симптоматика слабо выражена либо вообще отсутствует. Иногда первым признаком ТГВ могут быть симптомы ТЭЛА. Типичный спектр симптоматики включает отек всей конечности либо ее части; цианоз кожных покровов и усиление рисунка подкожных вен; распирающую боль в конечности; боль по ходу сосудисто-нервного пучка [16].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерием диагноза служит сочетание симптомов тромботической окклюзии глубоких вен (отек голени, отек голени и бедра с болью или без нее в нижней конечности, ощущением тяжести в ней), возникших внезапно, и инструментальных (ультразвуковых, рентгеновских) данных о наличии тромботических масс в просвете глубоких вен. При бессимптомном ТГВ критерием диагноза служит инструментально подтвержденное наличие тромботических масс в просвете глубоких вен у пациента из группы риска ВТЭО, направленного на исследование с целью скрининга [345]. Основными целями диагностики острого венозного тромбоза при подтверждении диагноза являются определение его локализации, распространённости и эмболоопасности. К эмболоопасным ТГВ относят флотирующие тромбы, имеющие единственную точку фиксации в дистальном отделе. Тромбоз поверхностных вен представляет угрозу развития ТЭЛА при переходе на глубокую венозную систему.
Целесообразно провести все диагностические исследования при подозрении на ВТЭО в течение 24 часов, чтобы обеспечить быстрое лечение, если диагноз подтвержден, и избежать ненужных повторных доз антикоагулянтов, если диагноз исключен.
1. Жалобы и анамнез
-
При обследовании пациентов с подозрением на острый венозный тромбоз и/или ТЭЛА рекомендуется активное уточнение жалоб, которые могут свидетельствовать о наличии тромботического поражения вен и лёгочной тромбоэмболии, и тщательный сбор анамнеза для выявления, в том числе, малосимптомных форм венозного тромбоза и тромбоэмболии дистальных ветвей лёгочных артерий [17–20].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии. При сборе анамнеза необходимо уточнить дату получения травмы или выполненной ортопедической операции, проводилась ли пациенту профилактика ВТЭО, если да, какими методами, наличие в анамнезе эпизодов ТГВ и ТЭЛА, семейный анамнез (вероятность врождённой тромбофилии).
При неокклюзивных формах венозного тромбоза у больных с повреждениями ОДА жалобы, свидетельствующие о тромботическом поражении вен, часто минимальны или отсутствуют, поскольку венозный кровоток по сосуду частично сохранён. Для окклюзирующего варианта тромбоза характерно развитие острых (в течение несколько часов) распирающих ногу болей, отека, цианоза соответствующего сегмента. Развитие у пациента коллаптоидного состояния, болей за грудиной и кровохарканья требует экстренного обследования для исключения ТЭЛА.
2. Физикальное обследование
Клинические признаки тромбоза поверхностных (подкожных) и глубоких вен конечностей существенно различаются. Тромбоз поверхностных вен (ТПВ) в клинической практике традиционно обозначают термином «тромбофлебит» в связи с наличием легко выявляемых признаков воспаления (как правило, асептического) стенки вены и паравазальной клетчатки.
Клинические признаки тромбоза поверхностных вен:
-
боль по ходу тромбированных подкожных вен;
-
полоса гиперемии в проекции поражённой вены;
-
при пальпации ‒ шнуровидный, плотный, резко болезненный тяж;
-
местное повышение температуры, гиперестезия кожных покровов.
Клинические проявления ТГВ менее специфичны, зависят от локализации тромбоза, распространённости и характера поражения венозного русла, длительности заболевания. На фоне посттравматического (послеоперационного) отёка клиническое выявление ТГВ представляет сложную задачу. В начальный период при неокклюзивных формах тромбоза клиническая симптоматика не выражена либо вообще отсутствует. Нередко первыми признаками, свидетельствующими о ТГВ, у госпитального пациента могут быть симптомы ТЭЛА.
Типичный спектр симптоматики ТГВ включает:
• отёк всей конечности либо голени;
• цианоз кожных покровов и усиление рисунка подкожных вен;
• распирающую боль в конечности;
• боль по ходу сосудисто-нервного пучка.
-
Всем пациентам с подозрением на ВТЭО рекомендуется выполнить физикальное обследование для исключения других причин клинической симптоматики [21–24].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии. Обследуя больного с подозрением на венозный тромбоз, следует обязательно осмотреть обе нижние конечности. Нередко тромбоз развивается в травмированной и контралатеральной конечностях одновременно. Возможно двустороннее поражение как поверхностных, так и глубоких вен. На фоне травмы (операции), посттравматического (послеоперационного) отёка и болевого синдрома ТГВ не имеет выраженных клинических проявлений и его ранняя диагностика только по клиническим признакам существенно затруднена. Необходимо целенаправленно выявлять наличие симптомов, указывающих на ТЭЛА. Развитие лёгочной эмболии однозначно свидетельствует о тромбозе глубоких вен.
Эмболоопасность тромба не коррелирует с выраженностью клинической симптоматики. Флотирующий тромб, угрожающий фатальной ТЭЛА, может иметь минимальные клинические проявления, поскольку он не перекрывает полностью просвет магистральной вены.
Ценность физикального исследования для точного установления протяженности ТПВ невелика в связи с тем, что истинная распространённость тромбоза подкожных вен значительно превышает клинически определяемые признаки тромбофлебита.
У значительной части пациентов переход тромботического процесса с поверхностных на глубокие венозные магистрали протекает бессимптомно.
-
Для клинической оценки вероятности ТГВ при обследовании пациента рекомендуется использование шкалы Wells (Приложение Г1). По сумме набранных баллов больных разделяют на группы с низкой, средней и высокой вероятностью венозного тромбоза [25–29].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии. Объём и тактика дальнейшего обследования и лечения определяется после консультации врача-сердечно-сосудистого хирурга. Поскольку клинические данные не позволяют с уверенностью исключить наличие ТГВ, диагностический поиск должен включать последующее лабораторное и инструментальное обследование.
-
Для клинической оценки вероятности ТЭЛА при обследовании пациента рекомендуется использование шкалы Wells или модифицированной шкалы Geneva (Приложение Г2 и Г3) [26, 28, 30–32].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
Комментарий. Клинические признаки ТЭЛА разнообразны и мало специфичны. Наличие и выраженность симптомов определяется размерами, локализацией тромбоэмболов и исходным кардиореспираторным статусом пациента. По клиническим данным нельзя категорично ни подтвердить, ни отвергнуть наличие ТЭЛА. Однако такая предварительная оценка необходима, чтобы в последующем надлежащим образом интерпретировать результаты инструментальной и лабораторной диагностики. ТЭЛА может быть условно подразделена на три группы: массивную (эмболическое поражение лёгочного ствола и/или главных лёгочных артерий), субмассивную (окклюзия от 30 до 50% артериального русла лёгких) и тромбоэмболию мелких ветвей лёгочных артерий (суммарное поражение менее 30% артериального русла лёгких). Объём и тактика дальнейшего обследования определяется после консультации врача-сердечно-сосудистого хирурга. Выбор дальнейшей лечебной тактики у больного с ТЭЛА в специализированном отделении определяют на основе определения риска смерти в ближайшие 30 суток (высокий, промежуточный, низкий).
3. Лабораторные диагностические исследования
-
Пациентам без клинических признаков, позволяющих предположить ТГВ и/или ТЭЛА, не рекомендуется проводить определение концентрации Д-димера в крови с целью скрининга [33–36].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии. Повышенный уровень Д-димера в плазме крови свидетельствует об активных процессах образования и распада фибрина. Наряду с высокой чувствительностью тест имеет низкую специфичность. Повышенный уровень Д-димера выявляют при многих состояниях, в том числе после травм, перенесённых оперативных вмешательств, при воспалении, инфекционном процессе, опухолях, а также у пожилых людей и пациентов, длительно находящихся в стационаре.
У больных с повреждениями опорно-двигательного аппарата изолированное повышение уровня Д-димера не может рассматриваться как патогномоничный признак ВТЭО.
-
Пациентам с клинической симптоматикой и анамнезом, не оставляющими сомнений в наличии ТГВ и/или ТЭЛА, не рекомендуется для первичной диагностики проводить определение концентрации Д-димера в крови [11, 37].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
-
Пациентам с клиническими признаками, позволяющими заподозрить ТГВ и/или ТЭЛА, при отсутствии возможности выполнить в ближайшие часы (A04.12.006) Дуплексное сканирование сосудов (артерий и вен) нижних конечностей или (A04.12.002.001) Ультразвуковую допплерографию сосудов (артерий и вен) нижних конечностей, рекомендуется определение концентрации Д-димера в крови [38, 39, 154-160].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии. Повышение уровня Д-димера в крови у пациентов после травм или ортопедических операций не является достоверным признаком венозного тромбоза, поскольку его увеличение является компенсаторной реакцией системы гемостаза на повреждение опорно-двигательного аппарата. Однако нормальный уровень Д-димера позволяет с высокой вероятностью исключить наличие ВТЭО.
4. Инструментальные диагностические исследования
-
Всем пациентам с подозрением на тромбоз поверхностных, глубоких вен нижних конечностей и/или ТЭЛА рекомендуется выполнение (A04.12.006) Дуплексного сканирования сосудов (артерий и вен) нижних конечностей, (A04.12.002.001) или Ультразвуковой допплерографии сосудов (артерий и вен) нижних конечностей и (A04.12.022 ) Дуплексного сканирования сосудов малого таза с целью уточнения диагноза и определения дальнейшей тактики лечения [34, 40–45].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии. В стандартный объём (A04.12.006) Дуплексного сканирования сосудов (артерий и вен) нижних конечностей, (A04.12.002.001) Ультразвуковой допплерографии сосудов (артерий и вен) нижних конечностей, (A04.12.022) Дуплексного сканирования сосудов малого таза обязательно должно входить исследование поверхностных и глубоких вен не только повреждённой, но и контралатеральной конечности для исключения их симультанного поражения, часто протекающего бессимптомно. Глубокое венозное русло обеих нижних конечностей осматривают на всём протяжении, начиная от дистальных отделов голени до уровня паховой связки, а если не препятствует кишечный газ, то и сосуды илиокавального сегмента. Выполняя (A04.12.006) Дуплексное сканирование сосудов (артерий и вен) нижних конечностей, (A04.12.002.001) Ультразвуковую допплерографию сосудов (артерий и вен) нижних конечностей, (A04.12.022) Дуплексное сканирование сосудов малого таза, (A04.12.015.001) Триплексное сканирование нижней полой вены, подвздошных вен и вен нижних конечностей (комплексное) пациентам с тромбозом поверхностных вен, следует визуализировать сафено-феморальное и сафено-поплитеальное соустья и типичные группы перфорантных вен для исключения перехода тромбоза на глубокое венозное русло. При наличии возможности (A04.12.006) Дуплексное сканирование сосудов (артерий и вен) нижних конечностей, (A04.12.002.001) Ультразвуковая допплерография сосудов (артерий и вен) нижних конечностей, (A04.12.022) Дуплексное сканирование сосудов малого таза следует выполнить в течение ближайших 4 часов.
-
При распространении тромбоза на илиокавальный сегмент, в случае невозможности определения его проксимальной границы и эмболоопасности по данным УЗАС рекомендуется выполнение (A06.12.021) Флебография нижней полой вены или компьютерно-томографическая ангиография, с целью определения проксимальной границы тромба и его эмболоопасности [46–49].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии. В случае выявления эмболоопасного тромба вторым этапом исследования возможно выполнение лечебных манипуляций: имплантации кава-фильтра***, (A16.12.003.001) Эндоваскулярная тромбэктомия аспирационная, (A16.23.034.012) локальный эндоваскулярный трансартериальный тромболизис.
-
Пациентам, которым оперативное лечение планируется в отсроченном порядке через несколько дней после травмы, рекомендуется выполнение УЗАС обеих нижних конечностей с максимальным приближением исследования к дате операции для выявления бессимптомных венозных тромбозов, особенно, если адекватная медикаментозная профилактика не проводилось [50–54].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии. В случае выявления эмболоопасного тромба вторым этапом исследования возможно выполнение лечебных манипуляций: имплантации кава-фильтра***, A16.12.003.001 Эндоваскулярная тромбэктомия аспирационная, (A16.23.034.012) локальный эндоваскулярный трансартериальный тромболизис.
-
Пациентам, которым профилактические мероприятия не выполнялись в полном объеме или у которых имеется особенно высокий риск развития ВТЭО, рекомендуется выполнение УЗАС перед началом активизации для выявления бессимптомных тромбозов глубоких вен [52, 55–57].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
-
Пациенту, находящемуся в травматологическом или ортопедическом отделении, при подозрении на лёгочную тромбоэмболию в экстренном порядке необходимо выполнить регистрацию электрокардиограммы и рентгенографию легких для исключения иной патологии сердечно-сосудистой и дыхательной систем [16, 58–60].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии. Регистрация электрокардиограммы и рентгенография легких позволяют исключить иную кардиальную и лёгочную патологию, имеющую сходную с ТЭЛА клиническую картину. При переводе пациента в специализированное отделение сосудистой хирургии при подозрении на ТЭЛА дополнительно выполняют спиральную компьютерную томографию легких с контрастированием лёгочных артерий, позволяющую выявить нарушения перфузии лёгочного артериального русла, эхокардиографию, радионуклидное перфузионное сканирование (сцинтиграфию) лёгких (A07.09.003 Сцинтиграфия легких перфузионная), зондирование правых камер сердца, ангиографию легочной артерии и ее ветвей.
5. Иные диагностические исследования
Не предусмотрены.
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Задачи лечения ТГВ, независимо от его локализации, следующие:
- остановить распространение тромботического процесса;
- предотвратить ТЭЛА;
- не допустить прогрессирование отёка и возможную венозную гангрену;
- восстановить (полностью или частично) проходимость глубоких вен;
- предупредить рецидив тромбоза.
Хирургические и терапевтические методы в лечении ТГВ используют комплексно, в зависимости от приоритета задач, решаемых при лечении больного. Сфера приложения хирургических вмешательств в связи с появлением новых поколений эффективных антикоагулянтов и высокоинформативных неинвазивных методов диагностики, которые возможно использовать для динамического наблюдения за эффективностью лечения, в настоящее время имеет отчётливую тенденцию к сужению. В доминирующей доле наблюдений их задача – предотвращение массивной лёгочной эмболии. В послеоперационном периоде обязательно (при отсутствии противопоказаний к антикоагулянтам) проведение длительной антикоагулянтной терапии.
Выявление признаков острого тромбоза поверхностных, глубоких вен и/или ТЭЛА, а также обоснованное подозрение на них является основанием для консультации врача-сердечно-сосудистого хирурга. Дальнейшее лечение больных с ВТЭО проводят совместно врач-сердечно-сосудистый хирург и врач-травматолог-ортопед.
Операции на ОДА должны быть отложены до устранения опасности возможной лёгочной тромбоэмболии. При наличии гипсовой повязки следует её рассечь и развести края. До инструментального обследования больным с ТГВ и/или ТЭЛА должен быть предписан строгий постельный режим для снижения риска ТЭЛА. После обследования пациенты с неэмболоопасными формами венозного тромбоза могут быть активизированы.
1. Консервативное лечение
Вопросы консервативного лечения ТПВ рассмотрены в клинических рекомендациях «Флебит и тромбофлебит поверхностных сосудов» 2024 г, утвержденных научным комитетом Минздрава России.
-
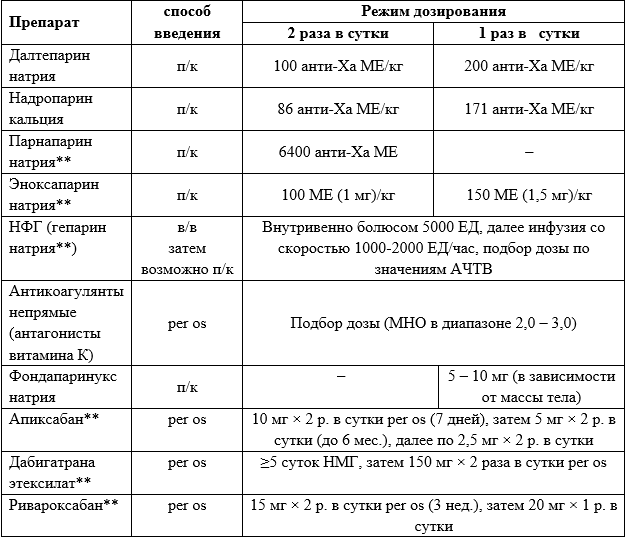
Всем больным с ТГВ и/или ТЭЛА рекомендуется проведение антикоагулянтной терапии (при отсутствии противопоказаний) терапевтическими дозами (табл. 3.1):
нефракционированного гепарина (НФГ; син.: гепарин натрия**) [61-63, 161, 165, 167],
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
НМГ [61-63, 161, 165, 167],
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
фондапаринукса натрия [61-63, 162, 164, 166],
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
апиксабана** [61-64, 161],
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
дабигатрана этексилата** [61-63, 161],
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
ривароксабана** [61-63, 161, 163, 164],
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
непрямым антикоагулянтом (антагонистом витамина К) [61-63, 161, 163].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарий. Основой лечения больных с ВТЭО (в том числе бессимптомными) является антикоагулянтная терапия, поскольку только она способна остановить прогрессирование тромбоза. Введение лечебных доз антикоагулянтов при обоснованном подозрении на ТГВ и/или ТЭЛА и отсутствии противопоказаний должно быть начато ещё до инструментальной верификации диагноза. В условиях, когда дальнейшая тактика ведения больного ещё не определена, целесообразно использовать внутривенную инфузию НФГ (гепарин натрия**).
Таблица 3.1. Режимы использования и дозировка антикоагулянтов для лечения ТГВ
-
При обоснованном подозрении на ВТЭО рекомендуется начинать антикоагулянтную терапию до инструментальной верификации диагноза [61].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии. Экстренная инструментальная диагностика венозного тромбоза возможна, как правило, только в условиях специализированного сосудистого отделения. В связи с этим период времени от постановки клинического диагноза до выполнения УЗАС пациенту отделения травматологии и ортопедии может быть существенным. Известно, что раннее начало антикоагулянтной терапии позволяет в 3-4 раза уменьшить частоту ТЭЛА. В случае исключения ТГВ антикоагулянты отменяют.
-
У больных с неэмболоопасными формами ТГВ антикоагулянтная терапия рекомендуется в качестве основного метода лечения. В случаях выполнения по показаниям хирургического или эндоваскулярного вмешательства, системного или регионарного тромболизиса рекомендуется последующее проведение антикоагулянтной терапии [61, 62, 169, 170].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Рекомендуется использовать одинаковые подходы к применению антикоагулянтов при ТГВ (нижних и верхних конечностей) и ТЭЛА [61, 68–70, 168, 171, 172].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
-
Всем больным с ТГВ нижних конечностей рекомендуется (при отсутствии противопоказаний) эластическая компрессия обеих нижних конечностей с использованием компрессионного трикотажа 2-3-го класса [71, 72].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии. Эластическая компрессия не должна прерываться при операциях на нижних конечностях: чулок (либо бинт, что менее эффективно) должен находиться на неоперируемой конечности во время оперативного вмешательства, на оперированную конечность чулок (бинт) надевают на операционном столе непосредственно после завершения операции. Проводить эластическую компрессию нижних конечностей следует до восстановления обычного двигательного режима больного, продолжая её в амбулаторных условиях.
-
Лечение больных с ТГВ, которым предполагается хирургическое, эндоваскулярное вмешательство или тромболизис, а также которые находятся на ИВЛ, рекомендуется начинать с парентерального введения антикоагулянтов НФГ (гепарина натрия**), далтепарина натрия, надропарина кальция, парнапарина натрия**, эноксапарина натрия** или фондапаринукса натрия [61, 73].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии. В случае развития ТГВ у больного с высоким риском кровотечения или если ему предполагается срочное хирургическое или эндоваскулярное вмешательство, целесообразно антикоагулянтную терапию начать с применения препаратов, для которых существует антидот. Для НФГ (гепарина натрия**) и НМГ таким антидотом служит протамина сульфат**, для дабигатрана этексилата** – идаруцизумаб. В случае использования других ПОАК интервал между последним приёмом препарата и оперативным вмешательством должен составлять, в зависимости от клиренса креатинина, от 24 до 48 часов. В большинстве случаев следует предпочесть НМГ или фондапаринукс натрия. Для НМГ возможно как двукратное, так и однократное введение препаратов (табл.3.1).
-
Антикоагулянтную терапию у больных, находящимся в стабильном состоянии и которым не планируют выполнение оперативного вмешательства или тромболизиса, рекомендуется проводить с использованием апиксабана**, дабигатрана этексилата** или ривароксабана** [61, 62, 73, 168, 173, 174].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии. У стабильного больного терапию апиксабаном** или ривароксабаном** следует начинать сразу после подтверждения диагноза ТГВ или переходить на эти лекарственные средства в первые 2 суток после начатого введения парентеральных антикоагулянтов. Перевод на дабигатрана этексилат** возможен с 5 суток от начала терапии парентеральными антикоагулянтами.
-
Большинству пациентов с ТГВ рекомендуется проведение антикоагулянтной терапии в течение не менее 3-х месяцев [61, 62, 175, 176].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
-
Больным с проксимальной локализацией ТГВ, перенёсшим ТЭЛА, при наличии тромбофилий, сопряжённых с высоким риском рецидива ВТЭО (антифосфолипидный синдром, дефицит антикоагулянтных протеинов C или S, мутации фактора V Лейдена или протромбина G20210A), при низком риске кровотечения и возможности поддерживать стабильный уровень антикоагуляции рекомендуется продолжение антикоагулянтной терапии до 6 мес. и более [61, 62, 177-183].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
-
У больных с ТГВ на фоне злокачественных новообразований с высоким риском кровотечения, а также у беременных, которым противопоказаны оральные антикоагулянты, рекомендуется предпочесть продлённое использование НМГ (подкожное введение лечебной дозы в первый месяц с возможностью последующего снижения до 75% от лечебной) [74–76].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –5)
-
При выявлении в стационаре неэмболоопасной формы ТГВ у больного с повреждениями или заболеваниями ОДА и не нуждающегося по этому поводу в экстренном или срочном оперативном вмешательстве, рекомендуется проведение антикоагулянтной терапии парентеральными препаратами (лечебные дозы НМГ предпочтительны) и динамический ультразвуковой контроль за состоянием тромба и венозного русла. После стабилизации тромботического процесса, подтверждённого данными УЗАС, и стихания острых клинических проявлений тромбоза (через 3-5 суток) возможно выполнение оперативного вмешательства на ОДА [77].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии. За 12 ч до операции лечебную дозировку антикоагулянтов заменяют на профилактическую дозу НМГ. После операции (через 24 ч после предшествующей инъекции) при условии стабильного гемостаза повторно вводят НМГ в профилактической дозе. Со 2-х суток послеоперационного периода используют лечебные дозы антикоагулянтов. В послеоперационном периоде проводят динамический ультразвуковой контроль за состоянием тромба и венозного русла (каждые 3-5 сут.).
-
У пациентов с ТЭЛА давностью до 14 суток, приводящей к шоку или стойкой артериальной гипотензии, рекомендуется тромболитическая терапия (A11.12.003.002 Внутривенное введение лекарственных препаратов для тромболитической терапии) при отсутствии противопоказаний к её проведению [73, 78, 313-339].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
Комментарии. ТЭЛА с выраженными нарушениями гемодинамики (шок, стойкая артериальная гипотензия) является абсолютным показанием для проведения тромболитической терапии (A11.12.003.002 Внутривенное введение лекарственных препаратов для тромболитической терапии). Чем раньше начата тромболитическая терапия, тем лучше ее результаты. Наилучшие результаты достигаются при длительности заболевания до 48 ч от момента эмболизации. В то же время можно рассчитывать на эффект при продолжительности заболевания до 14 сут. [73, 78, 313-318].
Массивная ТЭЛА является жизнеугрожающим состоянием. Одним из абсолютных противопоказаний является операция в предшествующие 10—14 дней, так как проведение тромболизиса при массивной ТЭЛА у больных в раннем послеоперационном периоде всегда связано с риском развития фатального кровотечения. При сохраняющейся нестабильной гемодинамике и выраженных дыхательных расстройствах на 10—12-е сутки послеоперационного периода необходимо провести тромболитическую терапию (A11.12.003.002 Внутривенное введение лекарственных препаратов для тромболитической терапии) в стандартном режиме. У пациентов с крайней тяжестью состояния и верифицированной массивной ТЭЛА проведение тромболитической терапии возможно болюсным введением («жизнеспасающий режим») [319-326]. Многоцентровое открытое рандомизированное сравнительное клиническое исследование ФОРПЕ (n=310) показало не меньшую эффективность рекомбинантного белка, содержащего аминокислотную последовательность стафилокиназы** (B01AD) по сравнению с алтеплазой** (B01AD02), в лечении пациентов с массивной тромбоэмболией легочной артерии с гемодинамической нестабильностью, и имеет более высокий профиль безопасности. Неиммуногенный рекомбинантный белок, содержащий аминокислотную последовательность стафилокиназы** (B01AD) используется в виде однократного болюса независимо от массы тела у всех пациентов с массивной ТЭЛА, что упрощает их лечение [327]. Проведение тромболитической терапии (A11.12.003.002 Внутривенное введение лекарственных препаратов для тромболитической терапии) при массивной ТЭЛА у беременных позволяет нормализовать центральную гемодинамику, уменьшить проявления правожелудочковой недостаточности, устранить гипоксемию у матери и плода и провести роды в срок, а используемый тромболитический препарат алтеплаза** (B01AD02) не обладает тератогенным эффектом на поздних сроках беременности. В доклинических исследованиях показано, что неиммуногенный рекомбинантный белок, содержащий аминокислотную последовательность стафилокиназы** (B01AD) не обладает эмбриотоксическими, тератогенными и репротоксичными свойствами. Подробнее о ведении пациентов с ТЭЛА у беременных рассматривается в соответствующих рекомендациях [328-339].
2. Оперативное лечение
Вопросы оперативного лечения ТПВ рассмотрены в клинических рекомендациях «Флебит и тромбофлебит поверхностных сосудов» 2024 г, утвержденных научным комитетом Минздрава России.
-
Выполнение эндоваскулярных (имплантация кава-фильтра***, катетерная тромбэктомия) и открытых хирургических вмешательств (тромбэктомия, перевязка глубокой вены проксимальнее тромба, пликация НПВ) в качестве метода предотвращения массивной ТЭЛА рекомендуется больным с ТГВ по следующим показаниям [82, 83, 184-190]:
- невозможность проведения надлежащей антикоагулянтной терапии;
- неэффективность адекватной антикоагулянтной терапии, на фоне которой происходит нарастание тромбоза с формированием эмболоопасного тромба (флотирующего тромба значительного диаметра длиной более 5-7 см);
- наличие эмболоопасного тромба илиокавального сегмента в момент первичной диагностики тромбоза;
- рецидивирующая ТЭЛА с высокой (систолическое давление в лёгочном стволе >50 мм рт. ст.) лёгочной гипертензией;
- некорректная позиция установленной ранее постоянной модели кава-фильтра*** (например, миграция его в почечную вену), исключающая возможность повторной имплантации (пликацию производят после флеботомии и удаления кава-фильтра***).
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии. Приоритетным является имплантация кава-фильтров съёмных моделей (Кава-фильтр, временный/постоянный***), которые должны быть удалены после устранения опасности ТЭЛА, а именно перехода флотирующего тромба в неэмболоопасную форму за счёт фиксации подвижной его части к венозной стенке. Для большинства съёмных моделей кава-фильтров (Кава-фильтр, временный/постоянный***), оптимальный период их удаления составляет 3-4 недели.
-
При выявлении в стационаре эмболоопасного (флотирующего) тромба у больного с повреждениями или заболеваниями ОДА, и не нуждающегося по этому поводу в экстренном или срочном оперативном вмешательстве, рекомендуется имплантация съёмной модели кава-фильтра (Кава-фильтр, временный/постоянный***), после чего возможно оперативное вмешательство на ОДА в сроки, определяемые врачом-травматологом-ортопедом. Тактику антикоагулянтной терапии рекомендуется использовать аналогичную применяемой при неэмболоопасной форме ТГВ [84, 85].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
-
При выявлении в стационаре тромбоза илиокавального сегмента у больного с повреждениями или заболеваниями ОДА и нуждающегося по этому поводу в экстренном или срочном оперативном вмешательстве любой формы, из-за высокой вероятности прогрессирования тромботического процесса рекомендуется имплантация съёмной модели кава-фильтра (Кава-фильтр, временный/постоянный***) с последующим выполнением предполагаемого оперативного вмешательства на ОДА [84, 85].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии. После операции (через 6-12 ч) при условии стабильного гемостаза вводят антикоагулянты в профилактической дозе. Со 2-х суток послеоперационного периода используют лечебные дозы антикоагулянтов. В послеоперационном периоде проводят динамический ультразвуковой контроль за состоянием тромба и венозного русла.
-
При выявлении в стационаре эмболоопасного тромба бедренно-подколенного сегмента у больного с повреждениями или заболеваниями ОДА и нуждающегося по этому поводу в экстренном или срочном оперативном вмешательстве, рекомендуется имплантация съёмной модели кава-фильтра (Кава-фильтр, временный/постоянный***) либо, в качестве альтернативы, перевязка (или пликация) поверхностной бедренной вены нитью хирургической рассасывающейся (прим. нить хирургическая из поли (L-лактид кокапролактона***), с последующим выполнением предполагаемого оперативного вмешательства на ОДА [84, 85].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии. Больным с флотирующим тромбом общей бедренной вены первоначально выполняют тромбэктомию из общей бедренной вены. Затем перевязывают (плицируют) поверхностную бедренную вену тотчас дистальнее впадения глубокой вены бедра, проходимость которой является обязательным условием выполнения данной операции. Выполнение вмешательства на глубокой венозной системе возможно первым этапом в одну операционную сессию с вмешательством на ОДА.
-
При выявлении в стационаре изолированного тромбоза вен голени у пациента, нуждающегося в выполнении экстренного или срочного оперативного вмешательства на опорно-двигательном аппарате, рекомендуется проведение необходимого вмешательства и назначение антикоагулянтной терапии в послеоперационном периоде на фоне динамического контроля состояния тромба и венозного русла с помощью УЗАС [84, 85].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Программа реабилитационных мероприятий определяется основным заболевание или его осложнением и (или) характером операции, в частности, использованием высокотехнологичных или миниинвазивных вмешательств.
Прогноз
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
После первого эпизода ТГВ просттромботический синдром развивается в течение 2 лет у 60% пациентов. У каждого четвертого пациента с ТЭЛА развивается рецидив тромбоэмболии в течение последующих 5 лет, особенно при наличии онкологических заболеваний или патологии гемостаза. Около 20% нелеченных проксимальных ТГВ приводят к развитию ТЭЛА, летальность при которой составляет 10-20%. Назначение рациональной антикоагулянтной терапии снижает смертность в 5-10 раз.
С учетом большого количества лекарственных взаимодействий АВК (варфарина**) с лекарственными препаратами и пищей, пациентов, получающих данный АК, следует информировать о необходимости соблюдении диеты и регулярного мониторинга МНО для поддержания его терапевтических значений. У женщин, принимающих гормональные контрацептивы системного действия, риск ТГВ возрастает в 3-5 раз, при этом риск максимален в первые 4 месяца от начала приема данной категории препаратов и снижается до популяционного через 3 месяца после их отмены.
Госпитализация
Организация оказания медицинской помощи
Несмотря на планирование проведения диагностических и лечебных мероприятий пациентам при развитии ТГВ, помощь носит неотложный характер. Отсрочка начала лечения приводит к снижению показателей эффективности лечения у данной категории пациентов и утяжеляет прогноз на реконвалесценцию тромба у конкретного больного, а в ряде случаев при развитии ТЭЛА может привести к летальному исходу.
Проведение диагностических мероприятий на этапе постановки диагноза и в период между этапами лечения может осуществляться в амбулаторных условиях. Проведение этапов хирургического лечения, включающего анестезиологическое пособие и другую сопроводительную терапию, требует пребывания в стационаре.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
В настоящее время оптимальным следует признать подход, согласно которому профилактику ВТЭО проводят абсолютно всем пациентам, поступающим в стационар. Характер профилактических мер определяется степенью риска.
1. Оценка степени риска развития ВТЭО в травматологии и ортопедии
Несмотря на невозможность точного прогнозирования развития венозных тромбоэмболических осложнений, необходимо оценить степень вероятности их развития. Наличие у пациента факторов, предрасполагающих к ВТЭО (табл. 5.1), служит основанием для отнесения его к той или иной группе риска. Одним из наиболее удобных инструментов определения риска ВТЭО в хирургии служит шкала Caprini (Приложение Г5). В зависимости от наличия факторов риска и планируемой операции пациенту присваивают степень риска развития ВТЭО (Приложение Г6) [86]. При отсутствии профилактики у больного с очень низким (0 баллов), низким (1-2 балла), умеренном (3-4 балла) и высоком (≥5 баллов) риске вероятность развития ВТЭО составляет соответственно менее 0,5, 1,5, 3 и 6%. В связи с отсутствием принципиальных различий в частоте ВТЭО и тактике ведения и профилактики пациентов низкого и очень низкого рисков в клинической практике целесообразно объединить в одну группу низкой вероятности ВТЭО.
Таблица 5.1. Вероятность ВТЭО при различных предрасполагающих факторах
|
Факторы, повышающие вероятность ВТЭО более чем в 10 раз |
|---|
|
|
Факторы, повышающие вероятность ВТЭО в 2-9 раз |
|
|
Факторы, повышающие вероятность ВТЭО менее чем в 2 раза |
|
2. Средства профилактики ВТЭО
Для предупреждения ВТЭО у пациента с травмой или операцией на ОДА, прежде всего, следует минимизировать или устранить действие факторов, способствующих тромбообразованию: восстановить объем циркулирующей крови, нормализовать гемодинамику, применить адекватное обезболивание, предупредить развитие инфекционных осложнений. Необходимо стремиться к возможно более ранней мобилизации больного, восстановлению объёма движений в суставах конечностей. При возможности следует стабильно зафиксировать отломки в ранние сроки после перелома. Применение стабильного функционального остеосинтеза, уменьшение травматичности оперативных вмешательств за счёт использования современных технологий закрытого остеосинтеза позволяют сократить время ограничения подвижности пациента с повреждениями и заболеваниями опорно-двигательного аппарата.
Профилактика ВТЭО включает в себя следующие методы:
-
немедикаментозные – применяют у всех пациентов с ограниченной двигательной активностью (мобильностью):
— максимальную и возможно более раннюю активизацию больных после операции, включая методы пассивной нагрузки: вертикализация, механотерапия, кинезотерапия и др.;
— обеспечение максимально возможной активности мышц нижних конечностей пациентов, находящихся на длительном постельном режиме, местные процедуры, увеличивающие объемный поток крови через глубокие вены нижних конечностей (эластическая компрессия нижних конечностей, прерывистая пневмокомпрессия нижних конечностей, миостимуляция мышц голени и т.д.);
— активные и пассивные нагрузки на верхние конечности, улучшающие циркуляцию крови в целом, стимулирующие антитромботическую активность эндотелия;
-
медикаментозные — проведение фармакологической тромбопрофилактики у пациентов с умеренным и высоким риском развития ВТЭО.
2.1 Немедикаментозные средства профилактики ВТЭО
К немедикаментозным средствам относят механические способы профилактки, а именно – статическую эластическую компрессию нижних конечностей, последовательную перемежающуюся пневматическую компрессию (ППК), венозную помпу для стопы, миостимуляцию мышц голени и лечебную физкультуру. Основной целью применения немедикаментозных методов является ускорение венозного кровотока, при этом их использование не увеличивает опасность геморрагических осложнений. Механическую профилактику следует начать до операции, продолжать во время и после нее вплоть до восстановления двигательной активности.
Последовательная перемежающаяся пневматическая компрессия (ПППК) нижних конечностей величиной 40–50 мм рт. ст. с помощью специальных манжет и аппарата является наиболее эффективным из механических способов профилактики. Её следует применять в соответствии с инструкцией к аппарату у пациентов, находящихся на постельном режиме.
Статическую эластическую компрессию нижних конечностей с помощью медицинского компрессионного трикотажа (чулки, обеспечивающие оптимальное распределение давления на нижние конечности) или бинтов эластичных медицинских следует начинать при поступлении больного, поскольку пребывание в стационаре всегда связано с ограничением двигательной активности и замедлением скорости венозного кровотока. Накладывать бинт эластичный медицинский должен обученный персонал (правила наложения эластичных бинтов изложены в Приложении Г7). Ежедневно утром и вечером следует проверять и при необходимости корректировать состояние бинта. Специальный профилактический медицинский компрессионный трикотаж (чулки дозированной компрессии) эффективнее и проще в использовании, самостоятельно поддерживает необходимый градиент давления. Однако он требует предварительного подбора и из-за развивающегося отека не всегда обеспечивает адекватную степень компрессии в ближайшем послеоперационном периоде. Применение компрессионного трикотажа целесообразно при плановых оперативных вмешательствах. Эластическую компрессию продолжают во время операций на нижних конечностях: чулок (бинт) должен находиться на неоперируемой конечности во время оперативного вмешательства, на оперированную конечность его одевают (накладывают) на операционном столе непосредственно после завершения операции [55].
-
A17.02.001 Электростимуляция мышц голени (ЭНСМГ) – процедура рекомендована всем пациентам, находящимся на постельном режиме, как в стационаре, так и на амбулаторном этапе лечения. Проводится с помощью различного рода электронейростимуляторов (стационарных приборов или индивидуальных переносных) согласно прилагаемой инструкции. Необходимым элементом является наличие электродов, накладываемых на икроножные мышцы пациента. Возможно сочетание метода со статической эластической компрессией и ЛФК. Может рассматриваться как альтернатива методу ПППК [88].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Лечебную физическую культуру применяют у всех больных. Особое значение имеют движения в голеностопном суставе и пальцах стопы. Лечебная физкультура не может быть заменой медикаментозным и механическим способам профилактики ВТЭО.
2.2. Медикаментозные средства, их дозы и режимы применения
2.2.1. Антикоагулянты
Группа антикоагулянтов включает в себя препараты НФГ (гепарин натрия**), НМГ, ПОАК (табл. 5.3) и антагонистов витамина К (АВК). Однако в настоящее время препараты из группы АВК (варфарин**) самостоятельно для профилактики ВТЭО в травматологии и ортопедии практически не используются. Единственной группой пациентов, которые нуждаются в их приеме, остаются пациенты, получающие АВК в связи с соматической патологией или имеющие непереносимость всех остальных антикоагулянтов.
Особое внимание во время медикаментозной профилактики ВТЭО следует уделять снижению периоперационной кровопотери. Необходимо добиваться тщательного интраоперационного гемостаза, применять современные гемостатические средства, использовать технологии кровесбережения и антифибринолитические средства (транексамовую кислоту** и др.).
Таблица 5.3. Рекомендуемые дозы и режим введения антикоагулянтовдля профилактики ВТЭО при оперативном лечении пациентов1
|
|
Рекомендуемые дозы и режим введения |
|
|---|---|---|
|
Препарат |
при средней степени риска развития ВТЭО |
при высокой степени риска развития ВТЭО |
|
НФГ (гепарин натрия**) |
Подкожно 2500 МЕ за 2–4 часа до операции, затем 2500 МЕ через 6–8 часов после операции, далее по 5000 МЕ 2–3 раза/сут.4 |
Подкожно 5000 МЕ за 4–6 часов3 до операции, затем 5000 МЕ через 6–8 часов после операции, далее по 5000 МЕ 3 раза/сут. |
|
Бемипарин натрия2 |
Подкожно 2500 анти-Ха МЕ за 2 ч до операции или через 6 ч после операции, затем ежедневно по 2500 анти-Ха МЕ 1 раз/сут. 4 |
Подкожно 3500 анти-Ха МЕ за 2 часа до операции или через 6 часов после операции, затем ежедневно по 3500 анти-Ха МЕ 1 раз/сут. |
|
Далтепарин натрия2 |
Подкожно 2500 анти-Ха МЕ за 2 часа до операции, затем 2500 анти-Ха МЕ 1 раз/сут. 4 |
(1) подкожно 5000 анти-Ха МЕ вечером накануне операции, затем 5000 анти-Ха МЕ каждый вечер. (2) подкожно 2500 анти-Ха МЕ за 2 часа до операции, затем 2500 анти-Ха МЕ через 8–12 часов (но не ранее чем через 4 часа после окончания операции), затем со следующего дня 5000 анти-Ха МЕ каждое утро. (3) подкожно 2500 анти-Ха МЕ через 4–8 часов после операции, затем со следующего дня 5000 анти-Ха МЕ 1 раз/сут. |
|
Надропарин кальция2 |
Подкожно 2850 анти-Ха МЕ (0,3 мл) за 2–4 часа до операции, затем 0,3 мл 1 раз/сут. 4 |
Подкожно 38 анти-Ха МЕ/кг за 12 часов до операции, 38 анти-Ха МЕ/кг через 12 ч после окончания операции, затем 38 анти-Ха МЕ/кг 1 раз/сут. на 2-е и 3-и сутки после операции, с 4-х суток после операции доза может быть увеличена до 57 анти-Ха МЕ/кг 1 раз/сут. |
|
Парнапарин натрия** |
Подкожно 3200 анти-Ха МЕ (0,3) за 2 часа до операции, затем по 0,3 1 раз/сут. 4 |
Подкожно 0,4 мл (4250 анти-Ха МЕ) через 12 часов после окончания операции, затем 1 раз\сутки |
|
Эноксапарин натрия2** |
Подкожно 20 мг за 2 часа до операции, затем 20-40 мг 1 раз/сут. 4 |
Подкожно 40 мг за 12 ч до операции или через 12– 24 час. После операции, затем 40 мг 1 раз/сут. |
|
Фондапаринукс натрия |
Подкожно 2,5 мг через 6-24 часа после операции, затем 1 раз/сут. |
|
|
Апиксабан** |
Перорально по 2,5 мг 2 раза в сутки; первая доза не ранее чем через 12–24 ч после завершения операции по достижении гемостаза |
|
|
Дабигатрана этексилат** |
Перорально по 220 мг или по 150 мг (пациентам: старше 75 лет, при умеренном нарушении функции почек – клиренс креатинина 30–50 мл/мин, принимающим амиодарон**, верапамил**, 1 раз в сутки; первый приём – в половинной суточной дозе не ранее чем через 1–4 часа после завершения операции по достижении гемостаза |
|
|
Ривароксабан** |
Перорально по 10 мг 1 раз в сутки; первая доза не ранее чем через 6–10 ч после завершения операции по достижении гемостаза |
|
1 – препараты сгруппированы в соответствии с фармакологическими свойствами, НМГ и пероральные антикоагулянты перечислены по алфавиту;
2 – у больных с низкой массой тела (менее 50 кг) разумно уменьшить профилактическую дозу НМГ в 2 раза, а у больных с выраженным ожирением (масса тела более 120 кг, индекс массы тела более 50 кг/м2) – увеличить ее на 25%; у таких пациентов оправдана коррекция дозы НМГ по уровню анти-Ха активности в крови;
3 – время введения НФГ (гепарин натрия**) до операции соответствует мнению экспертов с учетом обширности ортопедических операций, связанных с повышенным риском кровопотери;
4 – данные рекомендации отражают мнение экспертов и основаны на дозах и режиме применения препаратов группы гепарина в общей хирургии.
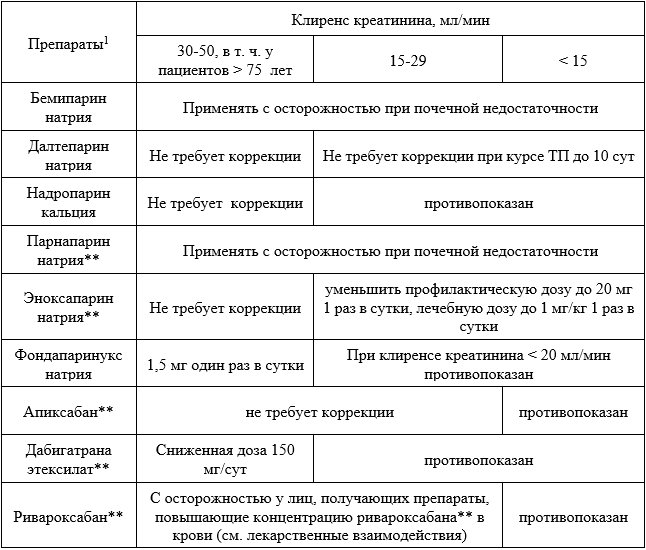
При использовании любых антикоагулянтов необходимо активно мониторировать признаки возможных геморрагических осложнений, исходно определить и регулярно контролировать уровень гемоглобина, гематокрит и клиренс креатинина (см. п. 5.4). При введении препаратов группы гепарина необходимо дополнительно регулярно контролировать количество тромбоцитов в крови.
Согласно инструкциям по применению препаратов при назначении и выборе дозы антикоагулянтов прямого действия (ПОАК) необходимо учитывать функцию почек. Для этого следует определять уровень креатинина в крови (A09.05.020 Исследование уровня креатинина в крови) и рассчитать клиренс креатинина с помощью формулы Кокрофта – Голта:

Если показатель сывороточного креатинина выражен в мкмоль/л, то результат надо умножить на 88. В соответствии с рассчитанным клиренсом креатинина устанавливают степень нарушения функции почек:
Легкая – клиренс креатинина 51–80 мл/мин
Средняя – клиренс креатинина 30–50 мл/мин
Тяжелая – клиренс креатинина менее 30.
В зависимости от степени почечной недостаточности производят назначение и коррекцию дозы ПОАК и НМГ (табл. 5.4).
Таблица 5.4. Дозирование ПОАК и НМГ при проведении профилактики ВТЭО у пациентов со сниженной функцией почек
2.2.2. Антиагреганты, кроме гепарина
Группой лекарственных средств, с принципиально другим механизмом действия препятствующих тромбообразованию, являются антиагреганты, кроме гепарина. В отличие от антикоагулянтов они действуют на первом этапе свертывания крови, во время которого происходит агрегация тромбоцитов, блокируя адгезию тромбоцитов к эндотелию сосудов.
Единственным препаратом, который в настоящее время включен в целый ряд национальных рекомендаций по профилактике ВТЭО после планового эндопротезирования тазобедренного или коленного сустава (см. п. 5.4.1.) у пациентов без дополнительных факторов риска развития тромбозов является АСК** [89–92]. Рандомизированные клинические исследования и опубликованные мета-анализы показывают, что АСК** демонстрирует схожую с антикоагулянтами эффективность в профилактике ВТЭО после эндопротезирования коленного или тазобедренного сустава как при ступенчатой фармакологической профилактике, когда ее назначают после нескольких дней НМГ вне зависимости от дополнительных факторов риска ВТЭО у пациентов [93], так и при приеме с первых суток после операции у пациентов без дополнительных факторов риска [94].
Другие препараты данной группы (клопидогрел**, прасугрел, тикагрелор**) применяют при лечении кардиологической патологии. Пациенты, постоянно принимающие антиагреганты, кроме гепарина или антикоагулянты по терапевтическим показаниям, характеризуется высоким риском развития геморрагических осложнений. Рекомендации по ведению данной категории пациентов изложены в разделе 4.10.
2.2.3. Препараты для экстренного прерывания эффектов антитромботической терапии при неотложных операциях
В таблице 5.5 представлены препараты позволяющие в той или иной степени нейтрализовать эффект антикоагулянтов или антиагрегантов, кроме гепарина в случаях развития тяжелых кровотечений, необходимости выполнения неотложного хирургического вмешательства у пациента, получающего антитромботическую терапию или профилактику [95, 96].
Таблица 5.5. Препараты для купирования действия антитромботических средств
|
Препарат, действие которого необходимо прервать |
Препараты, ингибирующие антитромботическое действие |
|---|---|
|
НФГ (гепарин натрия**) [95] |
протамина сульфат** - медленный в/в болюс (1-3 мин) в дозе 1 мг / 100 МЕ НФГ, введенного за последние 2-3 ч. При неэффективности (продолжающееся кровотечение) – инфузия протамина сульфата** под контролем АЧТВ. |
|
НМГ [95, 348] |
эффективного антидота нет, протамина сульфат** ингибирует не более 50% активности НМГ. Возможно в/в введение протамина сульфата** 1 мг на 100 анти-Хa НМГ; повторно – 0,5 мг/100 анти-Хa НМГ. При продолжающемся жизнеугрожающем кровотечении после применения протамина сульфата** и при подозрении, что сохраняется резидуальный эффект низкомолекулярных гепаринов АТХ Группа гепарина), который вносит вклад в кровотечение, возможно применение #активированного рекомбинантного VII фактора свертывания (rFVIIa) внутривенно в дозе 20 – 106 мкг/кг [348] |
|
Варфарин** [95] |
перед экстренной операцией – свежезамороженная плазма или факторы свертывания крови II,VII,IX и Х в комбинации [Протромбиновый комплекс]** (25 МЕ/кг) фитоменадион от 10 до 20 мг внутривенно |
|
Дабигатрана этексилат** [96] |
специфический ингибитор – идаруцизумаб (2 флакона по 2,5 г/50 мл) в виде двух внутривенных последовательных болюсных введений или инфузий длительностью не более 5-10 минут каждая |
|
Фондапаринукс натрия, апиксабан**, ривароксабан**, дабигатрана этексилат** (при недоступности идаруцизумаба) [96] |
факторы свертывания крови II,VII,IX и Х в комбинации [Протромбиновый комплекс]** - начальная доза 50 МЕ/кг, возможно последующее введение дозы 25 МЕ/кг или антиингибиторный коагулянтный комплекс** - 50 ЕД/кг (максимальная доза – 200 ЕД/кг), или рекомбинантный активированный #фактор свертывания крови VII** - 90 мкг/кг |
|
Клопидогрел**, тикагрелор** [95] |
тромбоконцентрат – 2 дозы/7 кг массы больного (может быть неэффективен в течение 12 ч после введения тикагрелора**) |
3. Общие подходы к профилактике ВТЭО
-
Каждому пациенту с травмой или перед плановой ортопедической операцией рекомендуется оценить и задокументировать степень риска развития ВТЭО [16, 86].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Для оценки риска развития ВЭТО у пациента перед операцией целесообразно использовать шкалы бальной оценки степени риска развития ВЭТО по Caprini (табл. 5.2), но можно использовать и другие шкалы или калькуляторы.
-
Всем пациентам с ограниченной двигательной активностью (мобильностью) вне зависимости от определенной степени риска развития ВТЭО рекомендуется проводить профилактику ВТЭО механическими методами [92].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Всем пациентам с повреждением и/или травмой ОДА при умеренном или высоком риске развития ВТЭО рекомендуется проводить профилактику ВТЭО медикаментозными (фармакологическими) методами, как правило, до восстановления обычной или ожидаемой двигательной активности больного (табл. 5.6) [89, 90, 92].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Таблица 5.6. Лекарственные средства, рекомендуемые для профилактики ВТЭО
|
Планируемое лечение |
Рекомендуемые препараты1 |
Длительность профилактики |
|
|---|---|---|---|
|
Консервативное лечение повреждений и заболеваний ОДА, сопровождающееся длительным ограничением подвижности пациента |
|
До восстановления обычной или ожидаемой двигательной активности |
|
|
Отсроченное оперативное лечение повреждений позвоночника, таза, нижних конечностей (предоперационный период) |
|
До дня операции, далее в зависимости от оперативного вмешательства |
|
|
Остеосинтез бедра |
|
Не менее 5–6 недель |
|
|
Эндопротезирование
|
|
Не менее 5 недель |
|
|
|
- тазобедренного сустава |
||
|
|
- коленного сустава |
Не менее 2 недель |
|
|
Другие большие ортопедические операции на нижних конечностях |
|
До восстановления обычной или ожидаемой двигательной активности или 6 недель, в зависимости от того, что наступит раньше |
|
|
Другие операции на опорно-двигательном аппарате4 |
|
До восстановления обычной или ожидаемой двигательной активности или 6 недель, в зависимости от того, что наступит раньше |
|
1 – препараты пронумерованы в порядке приоритетности назначения (в соответствии с накопленной доказательной базой и суждением экспертов);
2 – эти лекарственные средства изучены при эндопротезировании тазобедренного и коленного сустава, однако, согласно регистрации в Российской Федерации, могут использоваться и при указанных ортопедических операциях;
3 – только в виде таблеток, покрытых кишечнорастворимой пленочной оболочкой;
4 – за исключением острой травмы спинного мозга и тяжелой черепно-мозговой травмы (см. п. 5.4.8).
Комментарии. При выборе антикоагулянта необходимо учитывать противопоказания к применению препарата, изложенные в инструкции производителя. Рекомендуется отдавать предпочтение препаратам, имеющим собственные клинические исследования по оценке их эффективности и безопасности, выполненные у данного контингента больных. Препараты аналоги низкомолекулярных гепаринов (биологические аналоги) (АТХ B01AB Группа гепарина) можно использовать только в случаях, когда в надлежащих проспективных сравнительных клинических испытаниях по профилактике и лечению ВТЭО доказано, что эффективность и безопасность данного лекарственного средства существенно не отличается от оригинального препарата.
-
Пациентам с умеренным/высоким риском развития ВТЭО, нуждающимся в фармакологической профилактике после травмы или операции на ОДА, при противопоказаниях или отказе от назначения антикоагулянтов, развитии нежелательных явлений на фоне их приема рекомендуется рассмотреть назначение АСК** в сочетании с механическими видами профилактики [93, 94, 104, 152, 153].
Уровень убедительности рекомендаций A (уровень достоверности доказательств –1)
Комментарий: Было показано, что АСК** в дозах от 30 мг до 150 мг является достаточным для ингибирования функции тромбоцитов ЦОГ-1 [5]. Недавнее перекрестное исследование показало, что низкие дозы ацетилсалициловой кислоты** связаны с меньшей частотой желудочнокишечных осложнений при сохранении антитромботического эффекта [343]. Наиболее часто используемой дозировкой в России является 100 мг [94, 344].
-
Пациентам с умеренным или высоким риском развития ВТЭО, которым противопоказана любая фармакологическая профилактика или которые отказываются от назначения лекарственных препаратов, рекомендуется назначение механических видов профилактики [16, 55, 90, 92, 97].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Рекомендуется продолжение профилактики до восстановления обычной или ожидаемой двигательной активности больного [55, 90, 92].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
4. Особенности антикоагулянтной профилактики в различных клинических ситуациях
4.1. Плановое эндопротезирование тазобедренного или коленного сустава
-
Всем пациентам после планового ЭП ТБС или КС рекомендуется фармакологическая профилактика ВТЭО [16, 167, 191-198].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
Комментарии. Большие ортопедические операции, к которым относят эндопротезирование коленного и тазобедренного сустава, сопровождаются высоким риском развития ВТЭО [5, 89, 195, 196].
-
Пациентам перед ЭП ТБС или КС, нуждающимся в фармакологической профилактике ВТЭО в дооперационном периоде, рекомендуется применять НМГ, при невозможности их назначения – НФГ (гепарин натрия**) [16, 55, 167, 191, 193, 199-201].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
-
Пациентам с риском развития геморрагических осложнений после ЭП ТБС или КС рекомендуется отсрочить первое введение НМГ, дабигатрана этексилата** или ривароксабана** до достижения гемостаза (не менее чем на 8-12 часов после окончания операции) [13, 98, 202].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии. Для предупреждения послеоперационных геморрагических осложнений целесообразно начать введение НМГ не позднее 12-и часов до или не ранее 12 часов после эндопротезирования, НФГ (гепарин натрия**) – не позднее 4-6 часов до или не ранее 12 часов после операции [13, 202]. При этом известно, что нет принципиальных различий в эффективности и безопасности фармакологической профилактики при ее начале до или после эндопротезирования [98]. Согласно инструкциям по применению минимальное время после операции, когда можно начать прием препаратов, составляет для половинной дозы дабигатрана этексилата** 1-4 часа, для ривароксабана** – 6-10 чаосов, для апиксабана** – 12-24 часа, однако, в случае недостигнутого гемостаза прием антикоагулянтов следует отложить. Эффективность дабигатрана этексилата** сопоставима, а ривароксабана** и апиксабана** – превосходит энаксапарин натрия** [99, 170, 171, 203-205], при этом для всех препаратов характерно быстрое достижение Сmax в кровотоке. Таким образом, по аналогии с отсрочкой первого введения НМГ для снижения риска развития геморрагических осложнений целесообразно отсрочить первый прием ПОАК минимум на 8 часов.
-
Пациентам после планового ЭП ТБС или КС при условии ранней активизации и отсутствии у них других факторов риска развития ВТЭО помимо операции рекомендуется наряду с антикоагулянтами рассматривать АСК** как средство профилактики ВТЭО [89–92, 191, 206-210].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
-
Пациентам после ЭП ТБС, выполненного в экстренном или срочном порядке по поводу перелома проксимального отдела или шейки бедренной кости, при отсутствии противопоказаний к назначению антикоагулянтов, не рекомендуется применение АСК** в качестве единственного средства профилактики ВТЭО [191, 194, 207, 208, 210].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
Комментарии. В последние годы в связи со снижением травматичности планового эндопротезирования коленного или тазобедренного сустава и возможности ранней активизации пациентов возрос интерес к применению АСК** для профилактики ТГВ и ТЭЛА у данной категории пациентов. Опубликованные результаты Датского и Испанского национальных регистров эндопротезирования продемонстрировали на когортах, включающих соответственно 37223 и 58037 пациентов, принимающих АСК**, частоту ТГВ менее 1% и ТЭЛА 0,3% и менее [100, 101]. В 2012 г. препарат был внесен в рекомендации American College of Chest Physicians (США) для применения при ЭП ТБС или КС при невозможности назначения ПОАК и НМГ [5]. Дальнейшие сравнительные исследования и мета-анализы показали сопоставимую частоту тромбозов при приеме АСК** и варфарина** с целевыми значениями МНО 1,5-1,8 [102], при продленной тромбопрофилактике после 10 дней НМГ с последующим приемом АСК** или НМГ [93]. Кроме того, сочетание АСК** с механической профилактикой не показало преимущества в сравнении с только фармакологической профилактикой АСК** [103]. Рандомизированное исследование тромбопрофилактики у пациентов без дополнительных фактров риска ВТЭО после ЭН КС также не выявило различий между группами сравнения в зависимости от приема АСК**, дабигатрана этексилата** или ривароксабана** [94]. В 2018 г. АСК** включили как один из препаратов выбора, наряду с ПОАК и НМГ при плановом эндопротезировании ТБС или КС в Британские (NICE), Австралийские и Европейские национальные рекомендации [90–92]. Несмотря на имеющийся в публикациях разброс дозировок АСК**, в РФ дозами, зарегистрированными для профилактики ТГВ и ТЭЛА при длительной иммобилизации в результате обширного хирургического вмешательства, являются 100-200 мг один раз в сутки. В отечественных РКИ исследовали дозу АСК** 100 мг 1 раз в сутки [104], аналогичный режим примема указанного антиагреганта, кроме гепарина, рекомендует ASA (Arthroplasty Society of Australia) [92]. Таким образом, на сегодняшний день накоплена большая доказательная база для включения АСК** в рекомендации по профилактике ВТЭО при плановых вмешательствах у пациентов без выраженной кардиологической или иной соматической патологии, ведущей к высокому риску развития ТГВ и ТЭЛА. Необходимо помнить, что совместное применение антиагрегантов, кроме гепарина, с антикоагулянтами сопровождается повышенным риском развития кровотечения, применение высоких доз АСК** повышает риск развития язв желудка, что может привести к кровотечению из ЖКТ.
-
Пациентам после эндопротезирования тазобедренного сустава рекомендуется продолжение профилактики ВТЭО до 5 недель, после эндопротезирования коленного сустава – минимум 2 недели или до восстановления ожидаемой двигательной активности больного, в зависимости от того, что наступит раньше [16, 90, 92, 167].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии. Современные национальные руководства определяют продолжительность тромбопрофилактики после эндопротезирования коленного и тазобедренного суставов – минимум 10-14 дней, с продлением до 35-и дней при наличии у пациента дополнительных факторов риска [5, 16, 55, 90, 92, 97, 203, 204, 212-226]. Указанные сроки назначения антикоагулянтов обусловлены изменениями в системе коагуляции, сохраняющимися в течение нескольких недель после хирургического вмешательства. К ним относят угнетение фибринолитической активности крови, активацию коагуляции и снижение уровня естественных антикоагулянтов, таких как АТ-III. Из-за сохраняющейся тенденции к сокращению койко-дня возможные ВТЭО чаще развиваются на амбулаторном этапе после выписки из стационара.
4.1.1. Эндопротезирование тазобедренного или коленного сустава у пациентов с терминальной болезнью почек (ХБП) 5Д стадии, находящихся на гемодиализе
-
Пациентам, находящимся на программном или перитонеальном гемодиализе, с отсутствием спонтанных кровотечений из паренхиматозных органов в анамнезе, рекомендуется проведение медикаментозной и механической профилактики ВТЭО после ЭП ТБС или КС [92, 105, 106].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии. Хроническая почечная недостаточность сопровождается повышением количества провоспалительных и протромботических агентов. Чаcтота глубоких тромбозов у пациентов с ХБП 3-4 стадией – 43,8% [106]. Частота тромбоэмболии легочной артерии у больных с терминальной стадией почечной недостаточности составляет 2,1% [105]. Пациенты, находящиеся на хроническом гемодиализе, должны быть стратифицированы по высокому риску тромбоэмоблических осложнений и введение антикоагулянта должно проводится ежедневно, включая дозу антикоагулянта во время процедуры гемодиализа [92]. Механическая профилактика (эластическая компрессия нижних конечностей) ВТЭО в послеоперационном периоде оказывает более значимый клинический эффект по сравнению с больными обычной популяции [92]. Известно, что пациентам с терминальной ХБП 5Д стадии после ЭП ТБС или КС профилактика ВТЭО только во время процедуры гемодиализа недостаточна [107, 108]. Эндопротезирование тазобедренного и коленного сустава является ортопедическим оперативным вмешательством с высоким риском развития ВТЭО у больных, находящихся на хроническом гемодиализе. Вероятность глубокого тромбоза при эндопротезированиие крупных суставов у больных на гемодиализе в 1,65 (95% ДИ: 1,13–2,40; p = 0,01) раз выше по сравнению с больными без ХБП [106]. Однократное введение НМГ в стандартной дозировке в конце процедуры гемодиализа после эндопротезирования тазобедренного и коленного сустава не снижает риск развития ВТЭО, повышая риск смерти в 1,32 раза (95% ДИ: 1,01 – 1,71 p<0,05) [107].
-
Пациентам, находящимся на программном или перитонеальном гемодиализе, при наличии в анамнезе спонтанных кровотечений из паренхиматозных органов, не рекомендуется проведение медикаментозной профилактики ВТЭО в междиализный день после ЭП ТБС или КС [109, 227-229].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии. Дополнительное введение НМГ пациентам с терминальной стадией ХБП в междиализные дни после больших хирургических операций повышает риск кровотечений и общесоматических осложнений [109].
-
Пациентам с терминальной ХБП 5Д стадией после «больших» ортопедических операций для проведения фармакологической профилактики ВТЭО рекомендуется назначать в междиализный день НМГ (далтепарин натрия 2500 анти-Ха МЕ п/к в сутки или эноксапарин натрия** в дозе 20 мг п/к в сутки), при их недоступности НФГ (гепарин натрия**) [63, 109–112, 227, 230-232].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4) – для эноксапарина натрия**
Комментарии. Наиболее частой причиной являются сердечно-сосудистые осложнения, вызванные гиперкалиемией и дислипедемией, усугубляемые НФГ (гепарин натрия**) [111, 112]. Частота ВТЭО при ежедневном использовании НМГ – 5,6%, что значимо ниже по сравнению с НФГ (гепарин натрия**) [110]. НФГ (гепарин натрия**) приводят к повышению уровня калия и нарушениям липидного обмена, вследствие выделения липопротеинлипазы из сосудистой стенки в кровяное русло, проявляющееся в хилезе крови, что в свою очередь усугубляет имеющиеся сердечно-сосудистые заболевания [109]. При применении НМГ после ЭП ТБС и КС у пациентов, получающих программный гемодиализ, необходимо учитывать биоаккумуляцию препарата. Далтепарин натрия имеет самую большую молекулярную массу среди НМГ, обладая при этом наименьшей анти-Xа активностью, а его клиренс менее зависим от почечной функции [113].
-
У пациентов с терминальной ХБП 5Д стадии профилактика ВТЭО прямыми пероральными антикоагулянтами (АТХ B01AE Прямые ингибиторы тромбина, B01AF Прямые ингибиторы фактора Xa) в послеоперационном периоде не рекомендуется [114].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
4.2. Переломы таза, шейки бедренной кости и проксимального отдела бедра
-
При невозможности выполнения операции в первые сутки, рекомендуется начать медикаментозную профилактику с применением НМГ или НФГ (гепарин натрия**) сразу после госпитализации пациента, при высоком риске или продолжающемся кровотечении проводить профилактику следует немедикаментозными средствами [5, 16, 55].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии. Целесообразно начинать применение антикоагулянтов по достижении первичного гемостаза, после обследования и исключения у пострадавшего возможных противопоказаний (обычно через 6–24 часа после травмы). Если операцию у пациента с травмой планируется выполнить в отсроченном порядке (через несколько суток после повреждения), то медикаментозную профилактику рекомендуется проводить в течение всего предоперационного периода НМГ, при невозможности их назначения – НФГ (гепарин натрия**). Последнюю дозу до операции рекомендовано вводить не позднее, чем за 12 часов до операции для НМГ [90, 92], или за 4-6 часов – для НФГ (гепарин натрия**) [8, 11].
-
В случаях, когда введение антикоагулянтов вынужденно откладывается на 24 часа и более, рекомендуется проведение ультразвукового ангиосканирования (УЗАС) для исключения ТГВ [55, 233-235].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
-
Пациентам после оперативного вмешательства рекомендуется, исходя из клинической ситуации: продолжить парентеральное введение НМГ, НФГ (гепарин натрия**), или назначить фондапаринукс натрия или выполнить перевод пациента на пероральные препараты: дабигатрана этексилат**, ривароксабан**, при невозможности их назначения – АВК (варфарин**) [8, 11].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
-
Не рекомендуется при отсутствии противопоказаний к назначению антикоагулянтов применение АСК** у данной категории больных [346, 347].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
Комментарии. До настоящего времени существуют противоречивые результаты сравнения эффективности АСК** и НМГ в отношении профилактики ВТЭО у пациентов после переломов костей таза и проксимального отдела бедра. Некоторые исследования демонстрируют сопоставимые результаты по эффективности предупреждения ТГВ у пациентов операциями по поводу переломов нижних конечностей и костей таза, получающими АСК** и НМГ [346]. Однако недавний метаанализ показал, что НМГ превосходит АСК** в предотвращении ВТЭО при отсутствии разницы в частоте кровотечений, раневой инфекции и смертности [347].
-
При оперативном и консервативном ведении пациентов с переломами таза, шейки бедренной кости и проксимального отдела бедра рекомендуется продолжение фармакологической профилактики до восстановления ожидаемой двигательной активности больного, но не менее не менее 5 недель после операции [16, 55, 90, 233, 236-240].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1)
4.3. Операции на коленном суставе, за исключением эндопротезирования
-
Пациентам, нуждающимся в артроскопических операциях, не рекомендуется рутинное применение профилактики ВТЭО при отсутствии у них дополнительных факторов риска ВТЭО, а также при продолжительности использования турникета гибкого менее 45 мин и/или оперативного вмешательства менее 90 мин [55, 90].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии. Артроскопические реконструкции структур капсульно-связочного аппарата коленного сустава относят к операциям низкой степени риска ВТЭО. Однако надо помнить, что наличие дополнительных отягощающих факторов изменяет степень риска развития ВТЭО в сторону её повышения [115–118].
-
В случаях выполнения артроскопии с использованием турникета гибкого на 45 мин и более, при продолжительности оперативного вмешательства более 90 мин или высоком риске ВТЭО у пациента (например, ВТЭО и/или ТЭЛА в анамнезе, ожирение с ИМТ ≥40 кг/м2 и др.) рекомендуется рассмотреть назначение НМГ через 6-12 часов после операции, с последующим переходом на ПОАК (дабигатрана этексилат** или ривароксабан**) с продлением курса ТП до 10-14 дней [55, 90].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Пациентам, перенесшим остеотомию или остеосинтез перелома костей, формирующих коленный сустав, при отсутствии активного кровотечения рекомендуется проводить фармакологическую профилактику ВТЭО до восстановления обычной или ожидаемой двигательной активности больного [55, 222, 238-240].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1)
4.4. При иммобилизации нижних конечностей
-
Пациентам с иммобилизацией нижних конечностей рекомендуется начать фармакологическую профилактику ВТЭО сразу после исключения продолжающегося кровотечения: препаратами выбора являются НМГ, при их отсутствии – НФГ (гепарин натрия**), в дальнейшем – с 3-4-х суток в зависимости от состояния пациента – возможен перевод на АВК (варфарин**) при условии адекватного подбора дозы и регулярного контроля МНО [55, 241-257].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1)
Комментарии: Целесообразность и сроки перевода пациента с парентеральных препаратов на АВК (варфарин**) определяет лечащий врач с учетом стационарного/амбулаторного варианта лечения, возможности проведения инъекций НМГ/НФГ (гепарина натрия**) и лабораторного мониторинга МНО при использовании АВК). Правила применения АВК (на примере варфарина**) изложены в Приложении Г8.
4.5. Ортопедические операции на дистальных отделах нижней конечности (лодыжки, голеностопный сустав, стопа)
-
Пациентам, нуждающимся в операциях на дистальных отделах нижней конечности, не рекомендуется рутинное применение профилактики ВТЭО при отсутствии у них дополнительных факторов риска ВТЭО [83, 119–121].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
-
Рекомендуется рассмотреть возможность назначения фармакологической профилактики ВТЭО пациентам, которым после выполнения операции на стопе или голеностопном суставе (например, артродез, остеосинтез реконструкция ахиллова сухожилия) требуется иммобилизация, при продолжительности анестезии больше чем 90 минут, или при наличии у пациента высокого риска развития ВТЭО, связанного с дополнительными отягчающими факторами [83, 119–121].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии. Частота ВТЭО, возникающих после артроскопических операций и открытых хирургических вмешательств на стопе и голеностопном суставе, существенно уступает таковой при хирургическом лечении ряда других областей опорно-двигательной системы. Причем назначение с профилактической целью НМГ после некоторых хирургических вмешательств указанного профиля не оказывает существенного влияния на этот показатель, за исключением хирургии повреждений ахиллова сухожилия [119, 120, 122]. Целесообразно при поступлении пациента принимать решение о методе профилактики ВТЭО, исходя из оценки риска их развития (табл. 5.1) с учетом планируемой тактики лечении заболевания или повреждения [83, 119–121]. Известно, что максимальный риск развития ВТЭО имеет иммобилизация конечности после операций на данном сегменте фиксирующей повязкой, либо аппаратом наружной фиксации, а также проведение восстановительных и реконструктивные операции на пяточном сухожилии.
4.6. Ортопедические операции на верхней конечности
-
Рутинно при операциях на верхней конечности под местной или региональной анестезией профилактика ВТЭО не рекомендуется [123, 124].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
-
В случаях продолжительности общего наркоза или турникета гибкого более 90 минут при вмешательствах на верхней конечности, а также, если операция может существенно затруднить двигательную активность пациента или при наличии эпизодов ВТЭО в анамнезе рекомендуется рассмотреть возможность периоперационной профилактики ВТЭО [125].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: большие и малые операции на плечевом суставе характеризуются низким риском развития ВТЭО [123–125]. Однако, с учетом роста в популяции числа носителей геномно-обусловленных тромбофилий (дефицит антиромбина III, протеина С, S, лейденовская мутация V фактора свёртываемости крови, мутация протромбина G20210А и др.), широкого, часто неконтролируемого использования эстрогенов, старения популяции, роста заболеваемости диабетом и другими метаболическими расстройствами, повышающими риск ВТЭО, фармакологическая тромбопрофилактика может быть целесообразна при лечении пациентов с дополнительными факторами риска развития ВТЭО по поводу переломов плеча и предплечья, а также обширной травмы мягких тканей верхних конечностей. Окончательное решение принимает лечащий врач с учетом объема повреждения, характера предполагаемого вмешательства и дополнительных факторов риска ВТЭО со стороны пациента. Возможно периоперационное назначения этой категории пациентов НМГ по схемам и в дозировках, приведенных в таблице 5.3 на срок 7-10 дней (до выписки из стационара) либо в течение нескольких дней до восстановления обычной/ожидаемой двигательной активности.
4.7. Плановые операции на позвоночнике
-
Рекомендовано рассмотреть возможность назначения фармакологической профилактики ВТЭО НМГ при плановых операциях на позвоночнике, в случаях, когда риск ВТЭО превышает риск кровотечения, с учетом индивидуальных особенностей пациента (табл. 5.1, 5.2) и хирургических факторов (большая длительная операция, операция с комбинированным передне-задним доступом), а также в соответствии с клинической оценкой, проводимой лечащим врачом [92, 126–128].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
-
Пациентам с высоким риском кровотечения рекомендуется до операции применять механическую тромбопрофилактику, а первое введение НМГ отложить до достижения гемостаза (12-24 часов после операции) [92, 126–128].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
-
В случае поступления пациента с ограничением двигательной активности, в том числе по поводу геми- и тетрапареза/-паралича рекомендовано начать фармакологическую профилактику ВТЭО в дооперационном периоде [16, 55].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии. Последнюю дозу НМГ целесообразно вводить не позднее 12-24 часов до плановой операции на позвоночнике в зависимости от клинической оценки состояния пациента и характера планируемой операции.
4.8. Тяжелые травмы (множественные и сочетанные, включая черепно-мозговую, спинного мозга, позвоночника, таза/нижних конечностей)
Все пациенты с тяжелыми травмами относятся к группе высокого риска развития ВТЭО.
-
При поступлении пациента с тяжелой травмой рекомендуется рассмотреть возможность назначения механической профилактики ВТЭО [92, 129].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии. В зависимости от вида полученных травм механическая профилактика может быть противопоказана пациентам с травмой нижних конечностей. Однако при отсутствии других противопоказаний следует применять механическую профилактику в неповрежденной ноге. При высоком риске кровотечения или активном кровотечении следует использовать только механические методы профилактики, в первую очередь ПППК. Возможно также применением электромышечной стимуляции и медицинского компрессионного трикотажа [16].
- У пациентов с тяжелой травмой рекомендуется переоценка и документирование риска развития ВТЭО и кровотечения ежедневно или чаще при изменении их клинического состояния [233, 258-260].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
-
Пациентам с тяжелой травмой рекомендуется назначение фармакологической профилактики ВТЭО как можно скорее, как только риск ВТЭО превысит риск кровотечения [90, 92].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
При наличии у пациента с тяжелой травмой неполного повреждения спинного мозга, спинальной гематомы или внутричерепного кровоизлияния рекомендуется отложить фармакологическую профилактику до достижения удовлетворительного гемостаза (обычно на 1-3 суток) [90, 92].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Препаратами выбора для проведения фармакопрофилактики в дооперационном периоде при лечении тяжелых травм являются НМГ, в случаях, когда применение НМГ невозможно, используют НФГ (гепарин натрия**). Из-за медленного появления и прекращения эффекта и недостаточной изученности применение АВК (варфарин**) с целью профилактики ВТЭО в предоперационном периоде нецелесообразно. При черепно-мозговой травме сроки начала фармакологической профилактики следует обсудить с нейрохирургической бригадой. Обычно у пациентов без внутричерепного кровоизлияния фармакологическая профилактика может быть начата немедленно [92].
-
Пациентам с тяжелой травмой рекомендуется продолжать фармакологическую тромбопрофилактику до восстановления двигательной активности, но не менее 10-14 суток при отсутствии дополнительных факторов риска [92].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Пациентам с острой травмой спинного мозга или с черепно-мозговой травмой рекомендовано продолжать фармакологическую профилактику ВТЭО в течение 3 месяцев после травмы и/или операции или до окончания периода реабилитации в условиях стационара [55, 92, 130, 131].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии. Угроза развития ВТЭО сохраняется длительное время, пока имеются факторы риска. Исследования показали, что не менее половины ВТЭО развивались после выписки больных из стационара, когда двигательная активность пациентов оставалась ограниченной. Для продленной тромбопрофилактики в послеоперационном периоде возможен перевод пациента на пероральные препараты: дабигатрана этексилат**, ривароксабан**, АВК (при условии обеспечения адекватного контроля МНО). В случае прохождения пожилыми пациентами реабилитации в стационаре целесообразно рассмотреть возможность продления продолжительности профилактики сверх минимально рекомендуемой продолжительности: до тех пор, пока активность не вернется к ожидаемому или клинически приемлемому уровню, или до момента выписки из стационара.
4.9. Онкоортопедия
-
Рекомендовано дополнительно оценивать и документировать риск развития ВТЭО у пациентов с учетом основного заболевания и предполагаемого хирургического вмешательства (табл. 5.5) [132, 133].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии. Риск тромбоэмболических осложнений в три раза ниже у больных, перенесших оперативное вмешательство по поводу доброкачественных опухолей костей, чем у пациентов со злокачественными новообразованиями. В сравнении со злокачественными при доброкачественных опухолях и опухолеподобных поражениях костей отмечается также статистически значимое снижение частоты геморрагических осложнений. Средней и низкой степенью риска ВТЭО сопровождаются операции при доброкачественных опухолях костей и проведении плоскостных, краевых, внутриочаговых, сегментарных и околосуставных резекций на длинных и коротких костях сегментов, за исключением бедра и костей таза (табл.5.7) [86, 134–136].
Таблица 5.7. Степени риска ВТЭО при операциях по поводу опухолей и опухолеподобных поражений костей в зависимости от характера оперативного вмешательства
|
Степень риска |
Оперативное вмешательство |
|---|---|
|
Высокая |
|
|
Средняя |
|
|
Низкая |
|
-
Всем больным со злокачественными новообразованиями при проведении хирургического лечения рекомендуется проводить профилактику ВТЭО, формат которой определяется степенью риска ВТЭО и включает медикаментозные и механические способы ТП, при этом ранняя активизация больных целесообразна во всех случаях [132, 133, 231, 261-284].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии. Глубокий флеботромбоз часто сопровождает операции по поводу новообразований костей, особенно на тазовых костях, крупных суставах и сегментах [132, 133, 137–139, 261-284]. Пятая часть пациентов с диагнозом ТГВ – это пациенты с онкологическими заболеваниями после хирургического вмешательства, и риск послеоперационного ТГВ в этих клинических ситуациях в два раза выше по сравнению с больными другой патологией. Риск фатальной тромбоэмболии легочной артерии в три раза выше у пациентов со злокачественными заболеваниями по сравнению с пациентами, перенесшими хирургическое лечение по поводу доброкачественных новообразований [10]. Выбор способа предупреждения и длительности профилактических мер зависит от тяжести онкологического процесса, наличия патологического перелома, анатомической локализации, нозологической единицы, возраста и сопутствующих заболеваний, объема операции, адъювантной химиотерапии, наличия метастазов [16, 73, 133].
-
Онкологическим больным, которым планируется хирургическое лечение, рекомендуется выполнить ультразвуковую допплерографию вен нижних конечностей с максимальным приближением исследования к дате операции [16, 140].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии. Планируя меры профилактики ВТЭО, следует учитывать возможность бессимптомного ТГВ у существенной части онкохирургических больных [16, 133, 140].
-
При невозможности выполнения пациенту операции по поводу патологического перелома бедра в первые сутки, рекомендовано начать медикаментозную профилактику с применением НМГ или НФГ (гепарина натрия**) сразу после постановки диагноза, в случае высокого риска развития или продолжающегося кровотечения проводить профилактику следует немедикаментозными средствами [16, 133].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Рекомендуется продление профилактики ВТЭО не только до восстановления прежней или ожидаемой двигательной активности, но и далее с учетом степени риска тромбоза со стороны пациента [133, 141, 285-296].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии. Медикаментозная профилактика ВТЭО при умеренном риске должна продолжаться до выписки, но не менее 10-14 сут. после операции. У больных с высоким риском ВТЭО целесообразно продление медикаментозной профилактики до 28—35 сут. вне зависимости от срока выписки из стационара. После крупных онкоортопедических/ортопедических операций оправдано проведение профилактики до 35 сут. Больные, переносящие хирургическое лечение новообразований скелета, часто имеют высокий риск тромбоэмболических осложнений, который зависит от объективного статуса пациента, анамнеза, сопутствующих заболеваний, ранее полученного лечения. Известно, что риск развития тромбоза глубоких вен у онкологических больных увеличивается в два раза при наличии метастазов, а химиотерапия увеличивает риск венозной тромбоэмболии примерно в шесть-семь раз у пациентов с опухолями костей по сравнению с пациентами без данной патологии [134, 142–145, 285-296].
-
У онкоортопедических пациентов рекомендовано рассмотреть возможность сокращения длительности использования или отказа от манипуляций, повышающих риск образования тромбов (применение турникета гибкого или жгута кровоостанавливающего, проведение общей анестезии, длительная иммобилизация и пр.) [134, 135, 146, 297-309].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
Комментарии. Отрицательное влияние отдельных факторов риска может снижаться при отказе от некоторых манипуляций, провоцирующих образование тромбов или их модификации на менее тромб/эмболопровокативные. Данная цель может быть достигнута при исключении турникета гибкого или жгута кровоостанавливающего в операциях на нижней конечности или сокращении времени их применения. Значительный позитивный результат дают предпочтение проводниковой анестезии перед общим обезболиванием, что позволяет мобилизовать пациента в раннем послеоперационном периоде, а также отказ по возможности от постоянной иммобилизации и использование функциональных методов лечения, сокращение времени оперативного вмешательства за счет внедрения высоких технологий.
-
Онкологическим пациентам с доброкачественным новообразованием кости и низкой степенью риска развития ВТЭО рекомендуется проведение тромбопрофилактики только механическими способами (эластическая компрессия нижних конечностей, перемежающаяся пневмокомпрессия, миостимуляция мышц голени и т.д.), если иного не требует характер оперативного вмешательства и сопутствующие факторы риска [133].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии. Механическая профилактика у онкологических пациентов, также, как и медикаментозная или комбинированная, строго индивидуальна и осуществляется весь период риска тромбоэмболических осложнений, т.к. помимо характера новообразования зависит от выполняемой операции, продолжительности и типа иммобилизации, сроков восстановления двигательной активности и реабилитации функции конечности или сегмента. При этом у больных с малигнизацией, которая сама по себе является серьезным фактором риска, в период госпитализации проведение фармакопрофилактики является необходимым [15, 33].
4.10. Пациенты, длительно получающие антитромботические средства
Пациенты с заболеваниями и повреждениями ОДА, длительно получающие антикоагулянты и антиагреганты, кроме гепарина, по терапевтическим показаниям, имеют высокий риск развития ВТЭО и, одновременно, на момент госпитализации высокий риск развития геморрагических осложнений.
-
Пациентам, получающим постоянно антитромботические средства, в случаях, когда риск ВЭТО планируемого вмешательства на ОДА превышает риск кровотечения, рекомендуется проведение фармакологической профилактики (НМГ, прямые пероральные антикоагулянты и пр.) [147].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Пациентам, получающим постоянно ацетилсалициловую кислоту** (АСК) и поступающим для плановой операции на ОДА с низким (малые ортопедические вмешательства, когда трансфузий обычно не требуется) и умеренным (большие ортопедические вмешательства, в том числе эндопротезирование суставов, с возможными трансфузиями) риском кровотечения, рекомендуется прием антиагреганта, кроме гепарина, не прерывать [95, 147, 148].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Пациентам, получающим постоянно АСК** и поступающим для плановой операции на ОДА с высоким риском кровотечения (нейрохирургические вмешательства) рекомендуется отменить препарат за 3 дня до операции [95, 147].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
-
Пациентам, поступающим для плановой операции на ОДА и получающим клопидогрел**, тикагрелор** или прасугрел, рекомендуется отменить антиагрегант, кроме гепарина, соответственно за 5, 5 и 7 дней до операции [95, 147, 148].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
-
После операции прием АСК** рекомендуется возобновить сразу по достижении гемостаза, прием клопидогрела**, тикагрелора** или прасугрела через 24-48 часов [147].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
-
Пациентам, постоянно получающим клопидогрел**, тикагрелор** или прасугрел, при необходимости неотложного хирургического вмешательства на ОДА, для экстренного прерывания эффектов антиагрегантов, кроме гепарина, рекомендуется проведение трансфузии тромбоконцентрата – 2 дозы на 7 кг массы тела больного (может быть неэффективен в течение 12 ч после введения тикагрелора**) [95, 211, 310-312]
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
-
Пациентам, поступившим на плановое хирургическое вмешательство и получающим АВК (варфарин**) рекомендуется определить МНО [16]:
- при уровне МНО <1,5 возможно безотлагательное выполнение оперативного вмешательства с началом фармакологической тромбопрофилактики (НМГ, НФГ) в послеоперационном периоде,
- при уровне МНО >2, необходимо отменить АВК минимум за 5 суток до операции и ежедневно мониторировать МНО, когда значение МНО станет <2 рекомендовано вводить НМГ (при отстуствии НФГ (гепарин натрия**) в виде в/в инфузии в лечебных дозах), введение НМГ прервать за 24 часа до операции, НФГ (гепарин натрия**) – за 4-6 часов.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии. После вмешательства необходимо возобновить введение НМГ или НФГ (гепарина натрия**) и с момента достижения полного гемостаза (1-3-и сутки после операции) начать подбирать дозу варфарина** (Приложение Г8). Отменить НМГ или НФГ (гепарина натрия**) можно не ранее чем будут достигнуты стойкие терапевтические значения МНО.
-
Пациентам, постоянно получающим ПОАК, рекомендуется отсрочить плановое оперативное вмешательство с умеренным и высоким риском кровотечения на срок, зависящий от принимаемого препарата и функции почек (табл. 5.8), в большинстве случаев прием ПОАК возобновляют после операции по достижении стойкого гемостаза, но у отдельных категорий пациентов, у которых риски ВТЭО существенно превышают риск развития кровотечения, может быть рассмотрена «терапия моста» с периоперационным применением парентеральных антикоагулянтов [96, 149, 150].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Таблица 5.8 Периоды полувыведения ПОАК и сроки после приема последней дозы, рекомендуемые для выполнения оперативных вмешательств с умеренным и высоким риском кровотечений [96]
где, * - по формуле Кокрофта-Голта
-
Пациентам, постоянно получающим ПОАК, при необходимости неотложного хирургического вмешательства на ОДА в порядке неотложной помощи, рекомендуется выполнение алгоритма, представленного в таблице 5.9 [96, 149, 151].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Таблица 5.9. Тактика при экстренных и срочных хирургических вмешательствах/процедурах у пациентов, получающих ПОАК [96]
|
Шаг 1. Сбор анамнеза
• Уточнение сопутствующей патологии и принимаемых препаратов, определяющих риски кровотечений.
• Антикоагулянт, принимаемый пациентом, доза препарата, время приема последней дозы
|
||
|
Шаг 2. Специфика обследования пациента • Клиренс креатитина (расчет по Кокрофту-Голту). • Коагулограмма (ориентировочное исследование системы гемостаза) (в зависимости от возможностей лаборатории)1. |
||
|
Шаг 3. На основании информации, полученной на этапе 1 и 2, дать ответ на вопрос: «Находится ли пациент в состоянии гипокоагуляции?» • Если есть убедительные доказательства, что пациент не находится в состоянии гипокоагугляции — можно выполнять вмешательство. • Если пациент находится в состоянии гипокоагуляции или отсутствуют убедительные доказательства обратного – смотри шаг 4. |
||
|
Шаг 4. Ответить на вопрос: «Можно ли отложить данную процедуру/вмешательство во времени без негативного влияния на исход лечения пациента?» • Если ответ «да» - рассмотреть возможность выполнения вмешательства после прекращения антикоагулянтного эффекта ПОАК (см. табл. 5.6). • Если ответ «нет» - смотри шаг 5. |
||
|
Шаг 5. Мероприятия, направленные на профилактику/снижение риска периоперационных кровотечений |
||
|
Низкий риск кровотечения |
Умеренный риск кровотечения |
Высокий риск кровотечения |
|
• Временная отмена антикоагулянта. •#Активированный уголь2 30-50 г [96] • Общие мероприятия, направленные на минимизацию кровопотери. |
• Временная отмена антикоагулянта. • #Активированный уголь2- 30-50 г [96] • Общие мероприятия, направленные на минимизацию кровопотери. • Меры, направленные на нейтрализацию антикоагулянтного эффекта3 – либо перед выполнением процедуры/вмешательства, либо только в случае развития тяжелого кровотечения (необходимость нейтрализации антикоагулянтного эффекта перед вмешательством определяется в индивидуальном порядке). |
• Временная отмена антикоагулянта. • #Активированный уголь 2 – 30-50 г [96] • Общие мероприятия, направленные на минимизацию кровопотери. • Перед выполнением процедуры/вмешательства – меры, направленные на нейтрализацию антикоагулянтного эффекта3. |
|
Дозировки препаратов, применяемых для нейтрализации антикоагулянтного эффекта: _________________________________________________________________________________________________________________________ •идаруцизумаб (2 флакона по 2,5 г/50 мл) в виде двух внутривенных последовательных болюсных введений или инфузий длительностью не более 5-10 минут каждая, •факторы свертывания крови II,VII,IX и Х в комбинации [Протромбиновый комплекс]** – начальная доза 50 МЕ/кг, возможно последующее введение дозы 25 МЕ/кг, • #антиингибиторный коагулянтный комплекс** – 50 ЕД/кг (максимальная доза – 200 ЕД/кг в сутки), • рекомбинантный активированный #фактор свертывания крови VII** – 90 мкг/кг. |
||
Примечания: 1- для дабигатрана этексилата** – активированное частичное тромбопластиновое время, экариновое время свертывания, тромбиновое время, тромбиновое время в разведении, для ривароксабана** и апиксабана**)- протромбиновое время, анти-Ха активность плазмы,
2 – если последняя доза препарата принята 2-4 часа назад,
3 – у пациентов, получавших дабигатрана этексилат** – введение идаруцизумаба или #факторов свертывания крови II,VII,IX и Х в комбинации [Протромбиновый комплекс]**, #антиингибиторного коагулянтного комплекса**, рекомбинантного активированного #фактора свертывания крови VII** (в случае недоступности идаруцизумаба); у пациентов, получавших ривароксабан** или апиксабан** – #факторов свертывания крови II,VII,IX и Х в комбинации [Протромбиновый комплекс]**, #антиингибиторного коагулянтного комплекса**, рекомбинантного активированного #фактора свертывания крови VII**. Применять #факторы свертывания крови II,VII,IX и Х в комбинации [Протромбиновый комплекс]**, #антиингибиторный коагулянтный комплекс**, рекомбинантный активированный #фактор свертывания крови VII** рекомендуется с осторожностью, в особенности у пациентов с высоким риском тромбозов, данные по эффективности и безопасности применения у пациентов, получавших ПОАК, ограничены.
5. Лабораторный контроль на фоне фармакологической профилактики
Настоящие рекомендации не подразумевают обязательного лабораторного контроля состояния гемостаза за исключением определения МНО при приеме антагонистов витамина K. Однако, для выбора дозы, определения безопасности и выявления противопоказаний к использованию НМГ, фондапаринукса натрия и ПОАК имеет значение функция почек, которую следует оценивать у всех больных по величине клиренса креатинина или скорости клубочковой фильтрации.
В ряде случаев на фоне проведения фармакологической профилактики целесообразна лабораторная оценка гемостаза с использованием доступных для конкретного лечебного учреждения методов. Лабораторный контроль показан: при экстренных вмешательствах в течение периода эффективного действия антитромботических средств; в случаях нестандартного эффекта антитромботической терапии по данным анамнеза (повышенная или пониженная чувствительность к препарату); при тяжелых и сочетанных нарушения гемостаза (перенесенная массивная кровопотеря, состоявшиеся тромбозы, высокий риск тромботических осложнений, тромбозы на фоне тромбоцитопении и т.д.); при наличии клинических проявлений нарушений гемостаза в виде прогрессирующего тромбоза или кровоточивости.
На фоне введения НФГ (гепарина натрия**) или препаратов НМГ возможно уменьшение содержания тромбоцитов в крови. Иммунная тромбоцитопения обычно возникает через 4–14 суток после начала введения гепарина натрия** (чаще при использовании НФГ), но может развиваться и раньше у больных, недавно получавших препараты группы гепарина. Для своевременного выявления иммунной тромбоцитопении необходимо контролировать содержание тромбоцитов в крови (исследование уровня тромбоцитов в крови):
– при введении профилактических или лечебных доз гепарина натрия** – как минимум через день с 3-х по 14-е сутки лечения или до более ранней отмены препарата;
– если больному вводили гепарин натрия** в предшествующие 3,5 месяца, первое исследование уровня тромбоцитов в крови следует осуществить в ближайшие 24 часа после начала применения гепарина натрия**, а при любом ухудшении состояния в пределах получаса после внутривенного введения НФГ (гепарина натрия**) – немедленно.
Если содержание тромбоцитов в крови уменьшится в 2 и более раза от исходного уровня и/или будет составлять менее 100×109/л, следует прекратить любое введение гепарина натрия** и выполнить УЗАС вен нижних конечностей с целью поиска ТГВ. В период низкого содержания тромбоцитов в крови можно использовать дабигатрана этексилат** или фондапаринукс натрия, ривароксабан**. После восстановления содержания тромбоцитов в крови можно перейти на АВК, начиная их применение с низких доз (для варфарина** не выше 5 мг/сут).
Применение НФГ (гепарина натрия**), НМГ, фондапаринукса натрия, дабигатрана этексилата**, апиксабана** и ривароксабана** в профилактических дозах не требует рутинного коагулогического контроля системы гемостаза.
Лабораторные тесты, отражающие эффект принимаемого препарата:
-
НФГ (гепарин натрия**) — тромбоэластография с гепариназой, АЧТВ, тромбодинамика, исследование уровня тромбоцитов в крови.
-
НМГ — тромбоэластография с гепариназой, анти- Ха-активность, тромбодинамика, исследование уровня тромбоцитов в крови.
-
Фондапаринукс натрия — тромбоэластография с гепариназой, антиХа-активность.
-
Ривароксабан** — протромбин по Квику, МНО.
-
Дабигатрана этексилат** — АЧТВ, ТВ.
-
Антагонисты витамина K — МНО, протромбин по Квику.
-
Антиагреганты, кроме гепарина — исследование индуцированной агрегации тромбоцитов.
Информация
Источники и литература
-
Клинические рекомендации Общероссийской общественной организации "Ассоциация травматологов-ортопедов России" (АТОР)
- 1. Рязанцев Д.И. et al. Анализ риска развития тромбоэмболических осложнений при эндопротезировании суставов у пациентов пожилого возраста в раннем послеоперационном периоде // Вестник ИвГМА. 2016. Vol. 21, № 2. P. 35–39. 2. Копенкин С.С. Профилактика венозных тромбоэмболических осложнений в ортопедической хирургии: новые возможности // Вестник травматологии и ортопедии им. Н. Н. Приорова. 2010. № 1. P. 35–38. 3. Rosenfeld B.A. et al. Neuroendocrine stress hormones do not recreate the postoperative hypercoagulable state // Anesth. Analg. Anesth Analg, 1998. Vol. 86, № 3. P. 640–645. 4. Гайтон А.К., Холл Д.Э. Медицинская физиология. М.:Логосфе / ed. Кобрина В.И.. пер. с англ. 2008. 1296 p. 5. Falck-Ytter Y. et al. Prevention of VTE in orthopedic surgery patients. Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines // Chest. American College of Chest Physicians2012. Vol. 141, № 2 SUPPL. P. e278S-e325S. 6. Freedman K.B. et al. A meta-analysis of thromboembolic prophylaxis following elective total hip arthroplasty // J. Bone Jt. Surg. - Ser. A. Journal of Bone and Joint Surgery Inc., 2000. Vol. 82, № 7. P. 929–938. 7. Migita K. et al. Venous thromboembolism after total joint arthroplasty: Results from a Japanese multicenter cohort study // Arthritis Res. Ther. BioMed Central Ltd., 2014. Vol. 16, № 4. 8. Sarmiento A., Goswami A. Thromboembolic disease prophylaxis in total hip arthroplasty // Clin. Orthop. Relat. Res. Lippincott Williams and Wilkins, 2005. № 436. P. 138–143. 9. Hamilton W.G. et al. Mechanical thromboembolic prophylaxis with risk stratification in total knee arthroplasty. // J. Arthroplasty. Churchill Livingstone Inc., 2015. Vol. 30, № 1. P. 43–45. 10. Geerts W.H. et al. Prevention of venous thromboembolism: American College of Chest Physicians evidence-based clinical practice guidelines (8th edition) // Chest. American College of Chest Physicians, 2008. Vol. 133, № 6 SUPPL. 6. P. 381S-453S. 11. Di Nisio M., van Es N., Büller H.R. Deep vein thrombosis and pulmonary embolism // The Lancet. Lancet Publishing Group, 2016. Vol. 388, № 10063. P. 3060–3073. 12. Kahn S.R. The post-thrombotic syndrome // Hematology. Bulgarian Medical Society of Hematology, 2016. Vol. 2016, № 1. P. 413–418. 13. Ast M.P. et al. Clinical outcomes of patients with non-fatal VTE after total knee arthroplasty // J. Arthroplasty. 2014. Vol. 29, № 1. P. 37–39. 14. Лебедев А.К., Кузнецова О.Ю. Тромбоз глубоких вен нижних конечностей. Клинические рекомендации. // Российский семейный врач. 2015. Vol. 19, № 3. P. 4–16. 15. Хирургические болезни. Учебно-методическое пособие. / ed. Чернядьева С.А. Екатеринбург, 2019. 20 p. 16. Российские клинические рекомендации по профилактике и лечению ВТЭО // Флебология. 2015. Vol. 9, № 4, выпуск 2. P. 4–52. 17. Kitchen L. et al. Emergency department management of suspected calf-vein deep venous thrombosis: A diagnostic algorithm // Western Journal of Emergency Medicine. eScholarship, 2016. Vol. 17, № 4. P. 1–7. 18. Roy P.M. et al. Appropriateness of diagnostic management and outcomes of suspected pulmonary embolism // Ann. Intern. Med. American College of Physicians, 2006. Vol. 144, № 3. P. 157–164. 19. Kitchen L. et al. Emergency Department Management of Suspected Calf-Vein Deep Venous Thrombosis: A Diagnostic Algorithm. // West. J. Emerg. Med. eScholarship, 2016. Vol. 17, № 4. P. 384–390. 20. Bernardi E. et al. Serial 2-point ultrasonography plus D-dimer vs whole-leg color-coded Doppler ultrasonography for diagnosing suspected symptomatic deep vein thrombosis: A randomized controlled trial // JAMA - J. Am. Med. Assoc. JAMA, 2008. Vol. 300, № 14. P. 1653–1659. 21. Michiels J.J. et al. Diagnosis of deep vein thrombosis, and prevention of deep vein thrombosis recurrence and the post-thrombotic syndrome in the primary care medicine setting anno 2014. // World J. Crit. care Med. Baishideng Publishing Group Inc., 2015. Vol. 4, № 1. P. 29–39. 22. Righini M., Robert-Ebadi H. Diagnosis of acute Pulmonary Embolism // Hamostaseologie. Georg Thieme Verlag, 2018. Vol. 38, № 1. P. 11–21. 23. Dronkers C.E.A. et al. Towards a tailored diagnostic standard for future diagnostic studies in pulmonary embolism: communication from the SSC of the ISTH // J. Thromb. Haemost. Blackwell Publishing Ltd, 2017. Vol. 15, № 5. P. 1040–1043. 24. Pollack C. V. et al. Clinical characteristics, management, and outcomes of patients diagnosed with acute pulmonary embolism in the emergency department: Initial report of EMPEROR (multicenter emergency medicine pulmonary embolism in the real world registry) // J. Am. Coll. Cardiol. J Am Coll Cardiol, 2011. Vol. 57, № 6. P. 700–706. 25. Wells P.S. et al. Evaluation of D-dimer in the diagnosis of suspected deep-vein thrombosis // N. Engl. J. Med. N Engl J Med, 2003. Vol. 349, № 13. P. 1227–1235. 26. Modi S. et al. Wells criteria for DVT is a reliable clinical tool to assess the risk of deep venous thrombosis in trauma patients // World J. Emerg. Surg. BioMed Central Ltd., 2016. Vol. 11, № 1. 27. Douma R.A. et al. Validity and clinical utility of the simplified Wells rule for assessing clinical probability for the exclusion of pulmonary embolism // Thromb. Haemost. 2009. Vol. 101, № 1. P. 197–200. 28. Douma R.A. et al. Original Research Performance of 4 Clinical Decision Rules in the Diagnostic Management of Acute Pulmonary Embolism. A prospective cohort study // Ann. Intern. Med. American College of Physicians, 2011. Vol. 154, № 11. P. 709–718. 29. van Es N. et al. The original and simplified Wells rules and age-adjusted D-dimer testing to rule out pulmonary embolism: an individual patient data meta-analysis. // J. Thromb. Haemost. Blackwell Publishing Ltd, 2017. Vol. 15, № 4. P. 678–684. 30. Wells P.S. et al. Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer - PubMed. 2000. Vol. 83, № 3. P. 416–420.
Информация
Список сокращений
Список сокращений
** – лекарственное средство включено в перечень ЖНВЛП 2024 г.
# – назначение лекарственного средства вне зарегистрированных показаний
АВК – антагонисты витамина К (син: антикоагулянты непрямые)
АСК – ацетилсалициловая кислота**
АД – артериальное давление
АЧТВ – активированное частичное тромбопластиновое время
ВТЭО – венозные тромбоэмболические осложнения
КС – коленный сустав
МНО – международное нормализованное отношение
НМГ – низкомолекулярные гепарины (АТХ B01AB Группа гепарина)
НПВП – нестероидные противовоспалительные и противоревматические препараты
НФГ – нефракционированный гепарин (син.: гепарин натрия**)
ОДА – опорно-двигательный аппарат
ПОАК – прямые оральные антикоагулянты (АТХ B01AE Прямые ингибиторы тромбина, B01AF Прямые ингибиторы фактора Xa)
ПППК – последовательная перемежающаяся пневматическая компрессия
РКИ – рандомизированные клинические исследования
ТБС – тазобедренный сустав
ТВ – тромбиновое время
ТГВ – тромбоз глубоких вен
ТП – профилактика ВТЭО
ТПВ – тромбоз поверхностных вен
ТЭЛА – тромбоэмболия легочных артерий
УЗАС – ультразвуковое ангиосканирование (дуплексное сканирование вен сосудов (артерий и вен) нижних конечностей; дуплексное сканирование вен нижних конечностей; дуплексное сканирование сосудов малого таза; дуплексное сканирование нижней полой вены и вен портальной системы)
ЭП – эндопротезирование
Термины и определения
Антиагреганты – собирательное понятие, в контексте данных рекомендаций объединяющее ацетилсалициловую кислоту**, клопидогрел**, прасугрел и тикагрелор** (АТХ B01AC Антиагреганты, кроме гепарина).
Антикоагулянты – собирательное понятие, объединяющее препараты для парентерального введения (гепарин натрия**, бемипарин натрия, далтепарин натрия, надропарин кальция, парнапарин натрия**, эноксапарин натрия**) и препараты для приема внутрь (антикоагулянты непрямые, апиксабан**, дабигатрана этексилат**, ривароксабан**) (АТХ B01A Антитромботические средства).
Венозные тромбоэмболические осложнения (ВТЭО) – собирательное понятие, объединяющее тромбоз подкожных, глубоких вен, а также легочную тромбоэмболию.
Низкомолекулярные гепарины – собирательное понятие, объединяющее препараты для парентерального введения: бемипарин натрия, далтепарин натрия, надропарин кальция, парнапарин натрия**, эноксапарин натрия**, зарегистрированные на территории РФ (АТХ B01AB Группа гепарина).
Прямые оральные антикоагулянты (ПОАК) – собирательное понятие, объединяющее препараты для перорального приема: апиксабан**, дабигатрана этексилат**, ривароксабан** (АТХ B01AE Прямые ингибиторы тромбина, B01AF Прямые ингибиторы фактора Xa).
Тромбоз глубоких вен (ТГВ) – наличие тромба в глубокой вене, который может вызвать ее окклюзию.
Тромбоз поверхностных вен (ТПВ, тромбофлебит) – наличие тромба в поверхностной вене, которое обычно сопровождается клинически определяемым воспалением.
Тромбоэмболия легочных артерий (ТЭЛА, легочная тромбоэмболия, легочная эмболия, тромбоэмболия легочной артерии) – попадание в артерии малого круга кровообращения тромбов - эмболов, которые мигрировали из вен большого круга.
Посттромботическая болезнь (ПТБ) – хроническое заболевание, обусловленное органическим поражением глубоких вен вследствие перенесенного тромбоза. Проявляется нарушением венозного оттока из пораженной конечности.
Ключевые слова
-
тромбоз глубоких вен
-
венозные тромбоэмболические осложнения
-
тромбоэмболия легочных артерий
-
риск венозных тромбоэмболических осложнений
-
профилактика венозных тромбоэмболических осложнении
-
осложнения эндопротезирования суставов
- осложнения после ортопедических операций
Критерии оценки качества медицинской помощи
|
№
|
Критерии качества |
Оценка выполнения |
|---|---|---|
|
1 |
В медицинской документации пациента с травмой или перед плановой ортопедической операцией отражен риск развития ВТЭО |
Да/Нет |
|
2 |
Пациенту с повреждением и/или травмой ОДА при умеренном или высоком риске развития ВТЭО назначена медикаментозная профилактика сразу после исключения кровотечения |
Да/Нет |
|
3 |
При невозможности выполнить операцию в первые сутки после перелома таза, шейки бедренной кости или проксимального отдела бедра назначена медикаментозная профилактика с применением НМГ или НФГ (гепарин натрия**) при отсутствии противопоказаний, после исключения кровотечения. |
Да/Нет |
|
4 |
Пациенту с ограничением двигательной активности по поводу геми- и тетрапареза/-паралича назначена фармакологическая профилактика в дооперационном периоде |
Да/Нет |
|
5 |
Пациенту с умеренным или высоким риском развития ВТЭО при наличии противопоказаний к назначению медикаментозной профилактики назначены механические методы профилактики |
Да/Нет |
|
6 |
Пациенту после эндопротезирования ТБС или КС назначена фармакологическая профилактика ВТЭО |
Да/Нет |
|
7 |
После остеосинтеза перелома костей таза, шейки бедренной кости или проксимального отдела бедра и становления гемостаза назначена фармакологическая профилактика ВТЭО |
Да/Нет |
|
8 |
При развитии ТГВ и/или ТЭЛА пациенту назначено антикоагулянт(при отсутствии противопоказаний) в терапевтической дозе |
Да/Нет |
|
9 |
Пациенту после эндопротезирования ТБС назначена фармакологическая профилактика ВТЭО на 5 недель или до восстановления ожидаемой двигательной активности больного, в зависимости от того, что наступит раньше |
Да/Нет |
|
10 |
Пациенту после эндопротезирования КС назначена фармакологическая профилактика ВТЭО на 2 недели или до восстановления ожидаемой двигательной активности больного, в зависимости от того, что наступит раньше |
Да/Нет |
|
11 |
Пациенту с переломом костей таза, шейки бедренной кости или проксимального отдела бедра назначена фармакологическая профилактика ВТЭО не менее 5 недель после операции |
Да/Нет |
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
-
Божкова Светлана Анатольевна (Санкт-Петербург) – доктор медицинских наук, профессор, заведующая научным отделением профилактики и лечения раневой инфекции и отделением клинической фармакологии, ФГБУ «НМИЦ ТО им. Р.Р. Вредена» Минздрава России; делегат РФ в European Bone and Joint Infection Society (EBJIS), член научного комитета World Association against Infection in Orthopedics and Trauma (WAIOT), член МАКМАХ; конфликт интересов отсутствует.
-
Тихилов Рашид Муртузалиевич (Санкт-Петербург) – член-корреспондент РАН, доктор медицинских наук, профессор, директор ФГБУ «НМИЦ ТО им. Р.Р. Вредена» Минздрава России, главный травматолог–ортопед Комитета по здравоохранению Санкт-Петербурга, вице-президент АТОР, член European Hip Society, член International Hip Society; конфликт интересов отсутствует.
-
Андрияшкин Вячеслав Валентинович (Москва) – доктор медицинских наук, профессор кафедры факультетской хирургии Института хирургии ФГАОУ ВО «РНИМУ им. Н.И.Пирогова»; конфликт интересов отсутствует.
-
Ахтямов Ильдар Фуатович (Казань) – доктор медицинских наук, профессор, заведующий кафедрой травматологии, ортопедии и хирургии экстремальных состояний ФГБОУ ВО «Казанский государственный медицинский университет Минздрава России», член International Society of Orthopaedic Surgery and Traumatology (SICOT) и АТОР; конфликт интересов отсутствует.
-
Белов Михаил Викторович (Ярославль) – кандидат медицинских наук, доцент кафедры травматологии и ортопедии ФГБОУ ВО ЯГМУ МЗ РФ, руководитель отделения травматологи и ортопедии ГАУЗ ЯО «Клиническая больница скорой медицинской помощи им. Н.В. Соловьева», член АТОР; конфликт интересов отсутствует.
-
Дианов Сергей Вячеславович (Астрахань) – заслуженный врач РФ, доктор медицинских наук, профессор, заведующий кафедрой травматологии и ортопедии ФГБОУ ВО «Астраханский государственный медицинский университет Минздрава России», член International Society of Orthopaedic Surgery and Traumatology (SICOT) и АТОР; конфликт интересов отсутствует.
-
Каплунов Олег Анатольевич (Волгоград) – доктор медицинских наук, профессор кафедры травматологии, ортопедии и ВПХ ФГБОУ ВО «Волгоградский государственный медицинский университет Минздрава России», руководитель службы травматологии и ортопедии сети клиник АО ММЦ «Сова»; конфликт интересов отсутствует.
-
Касимова Алина Рашидовна (Санкт-Петербург) – кандидат медицинских наук, доцент, врач-клинический фармаколог отделения клинической фармакологии НМИЦ ТО им. Р.Р. Вредена Минздрава России; доцент кафедры клинической фармакологии и доказательной медицины ПСПбГМУ им. И.П.Павлова Минздрава Росии, конфликт интересов отсутствует.
-
Копенкин Сергей Семенович (Москва) – кандидат медицинских наук, доцент кафедры травматологии, ортопедии и военно-полевой хирургии ФГАОУ ВО «РНИМУ им. Н.И.Пирогова» Минздрава России, член АТОР, конфликт интересов отсутствует.
-
Маланин Дмитрий Александрович (Волгоград) – доктор медицинских наук, профессор, заведующий кафедрой травматологии, ортопедии и ППХ ФГБОУ ВО «Волгоградский государственный медицинский университет» Минздрава России», член АТОР, РАО, European Society of Sports Traumatology, Knee surgery and Arthroscopy (ESSKA), конфликт интересов отсутствует.
-
Муштин Никита Евгеньевич (Санкт-Петербург) – кандидат медицинских наук, доцент кафедры травматологии и ортопедии ПСПбГМУ им. акад. И.П. Павлова, врач травматолог-ортопед травматолого-ортопедического отделения N2 ПСПбГМУ им. акад. И.П. Павлова, член АТОР; конфликт интересов отсутствует.
-
Терещенко Сергей Николаевич (Москва) – доктор медицинских наук, профессор руководитель отдела заболеваний миокарда и сердечной недостаточности, руководитель экспертного центра по амилоидозу сердца, ФГБУ НМИЦ кардиологии им. Академика Е.И. Чазова, председатель правления Общества специалистов по неотложной кардиологии, член правления Российского кардиологического общества, член Европейской рабочей группы по неотложной кардиологии; конфликт интересов отсутствует.
-
Цед Александр Николаевич (Санкт-Петербург) – доктор медицинских наук. доцент, руководитель отделения травматологи и ортопедии №2 ПСПб ГМУ им. акад. И.П. Павлова, член АТОР и АО Травма Россия; конфликт интересов отсутствует.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
-
Врачи-травматологи-ортопеды
-
Врачи-хирурги
-
Врачи-анестезиологи-реаниматологи
-
Врачи-клинические фармакологи
-
Студенты медицинских ВУЗов, ординаторы, аспиранты
Методы, используемые для сбора/выбора доказательств: поиск в электронных базах данных.
Описание методов, используемых для сбора доказательств: доказательной базой для написания настоящих клинических рекомендаций являются материалы, вошедшие в MedLine, PubMed, базу Cohrane, материалы издательства Elsevier и статьи в авторитетных отечественных журналах по травматологии и ортопедии. Глубина поиска составляет 20 лет.
В данных клинических рекомендациях все сведения ранжированы по уровню достоверности (доказательности) в зависимости от количества и качества исследований по данной проблеме. Группа использовала методику оценки уровня убедительности рекомендаций и степени достоверности доказательств согласно Приложению № 2 к "Требованиям к структуре клинических рекомендаций, составу и научной обоснованности включаемой в клинические рекомендации информации", утвержденным приказом Минздрава России от 28.02.2019 г. № 1034.
Таблица П1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
Уровень достоверности |
Тип данных |
|---|---|
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2 |
Отдельные исследования с контролем референсным методом или рандомизированные клинические исследования (РКИ)и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением мета-анализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования любого дизайна |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица П2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
Уровень достоверности |
Тип данных |
|---|---|
|
1 |
Систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2 |
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований с применением мета-анализа |
|
3 |
Нерандомизированные сравнительные исследования, в том числе когортные исследования любого дизайна |
|
4 |
Несравнительные, описание клинического случая или серии случаев, исследование «случай-контроль» |
|
5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица П3. Шкала определения уровней убедительности рекомендаций
|
Категория |
Описание |
|---|---|
|
А |
Однозначная (сильная) рекомендация (все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
В |
Неоднозначная (условная) рекомендация (не все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам не являются согласованными) |
|
С |
Низкая (слабая) рекомендация – отсутствие доказательств надлежащего качества (все исследования имеют низкое методологическое качество, их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Федеральное законодательство в сфере здравоохранения (Основные законодательные акты Российской Федерации)
Данные клинические рекомендации разработаны с учётом следующих нормативно-правовых документов:
1. Конституция Российской Федерации.
2. Декларация прав и свобод человека и гражданина.
3. Федеральный закон от 21 ноября 2011 г. № 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации" (с изменениями и дополнениями).
4. Федеральный закон от 29.11.2010 № 326-ФЗ «Об обязательном медицинском страховании в Российской Федерации» (с изменениями и дополнениями).
5. Федеральный закон от 12.04.2010 № 61-ФЗ (ред. от 26.12.2024) "Об обращении лекарственных средств" (с изм. и доп., вступ. в силу с 01.03.2025).
6. Федеральный закон № 152-ФЗ от 27 июля 2006 г. (ред. От 05.04.2013) «О персональных данных».
7. Приказ Минздрава России от 12 ноября 2012г. № 901н «Об утверждении Порядка оказания медицинской помощи населению по профилю «травматология и ортопедия».
8. Приказ Минздрава России от 10 мая 2017 г. № 203н «Об утверждении критериев оценки качества медицинской помощи».
9. Приказ Минздрава России от 28 сентября 2020 г. № 1029н «Об утверждении перечней медицинских показаний и противопоказаний для санаторно-курортного лечения».
10. Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения утверждён Распоряжением Правительства РФ от 12.10.2019 № 2406-р (редакция от 16.04.2024).
11. Приказ Министерства Здравоохранения и Социального развития Российской Федерации от 17 декабря 2015 г. № 1024н «О классификации и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы».
Приложение Б. Алгоритмы действий врача
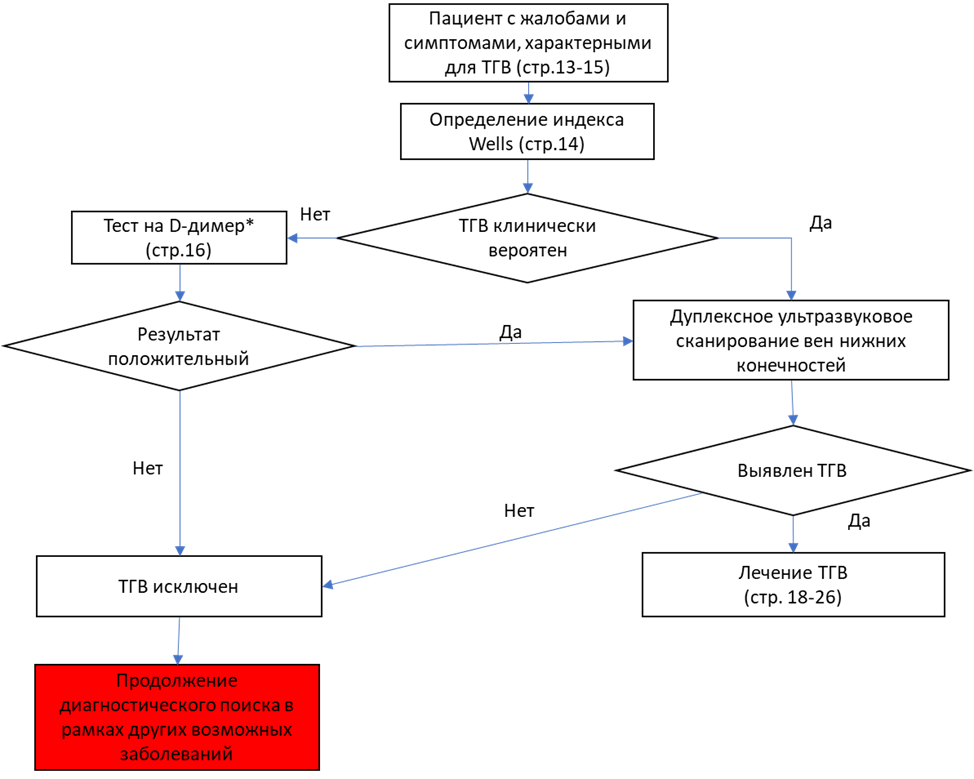
* - У больных с повреждениями опорно-двигательного аппарата изолированное повышение уровня Д-димера не может рассматриваться как патогномоничный признак ВТЭО. Однако нормальный уровень Д-димера позволяет с высокой вероятностью исключить наличие ВТЭО (см. п. 2.3. Лабораторные исследования)
Название алгоритма 1 в клинических рекомендациях «Диагностика, лечение и профилактика венозных тромбоэмболических осложнений в травматологии и ортопедии»:
1. Алгоритм проведения диагностического поиска у пациента с подозрением на развитие тромбоза глубоких вен
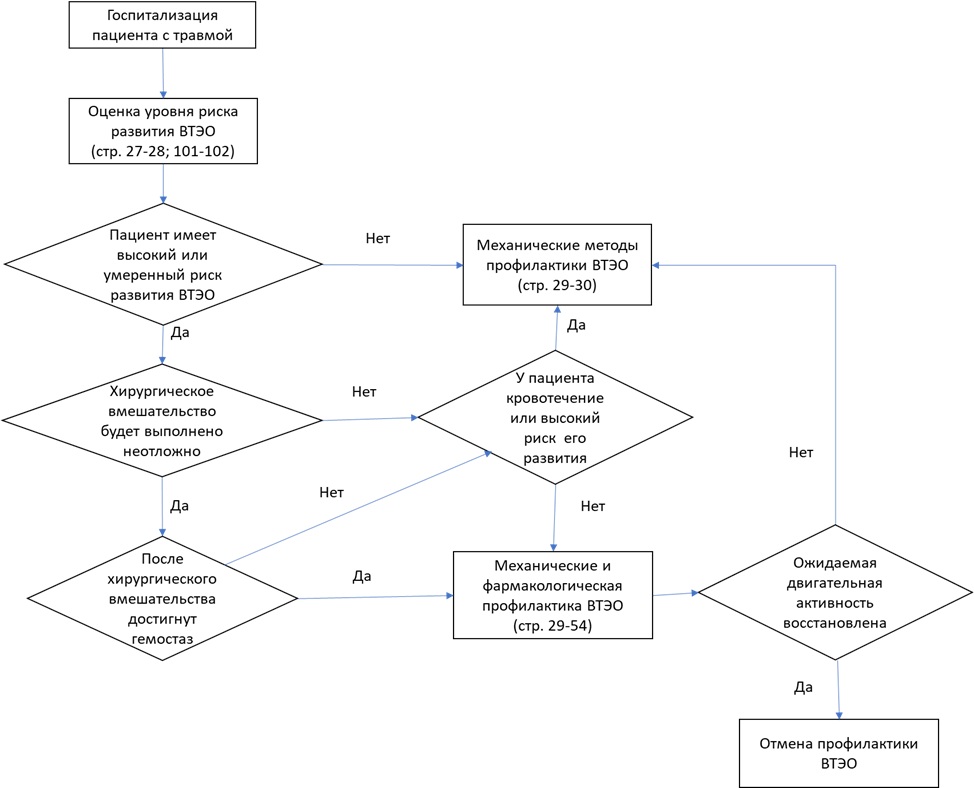
Название алгоритма 2 в клинических рекомендациях «Диагностика, лечение и профилактика венозных тромбоэмболических осложнений в травматологии и ортопедии»:
2. Алгоритм проведения профилактики ВТЭО у пациентов с травмой опорно-двигательного аппарата
Приложение В. Информация для пациента
Информация для пациента, перенесшего большую ортопедическую операцию (эндопротезирование, остеосинтез бедра и т.д.)
Если Вам выполнено эндопротезирование тазобедренного, коленного сустава или другая большая ортопедическая операция, лечащий врач назначит Вам антикоагулянты.
Цель назначения препаратов данной группы – предотвращение развития тромбоза глубоких вен нижних конечностей, которые могут привести к опасному для жизни осложнению – тромбоэмболии легочной артерии. Риск развития тромбоза без применения антикоагулянтов после крупных ортопедических операций очень велик: после эндопротезирования тазобедренного сустава – 40-60%, после эндопротезирования коленного сустава – 60-80%. Для снижения риска развития тромбоза прием антикоагулянтов должен быть продолжен и после выписки из стационара. Вам требуется строго соблюдать рекомендации лечащего врача.
Всегда сообщайте любому медицинскому работнику, к которому Вы обратились, о том, что Вы принимаете антикоагулянты. Большинство стоматологических процедур (кроме удаления зубов) можно получать, не меняя режима лечения. При удалении зуба обычно достаточно воспользоваться тампоном с гемостатическим средством местно (тромбиновая губка). При наличии проблем с артериальным давлением нужен его регулярный контроль и поддержание на уровне не выше 130/80 мм рт. ст.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Оценка вероятности ТГВ нижних конечностей по клиническим данным: шкала Wells
Название на русском языке: Оценка вероятности ТГВ нижних конечностей по клиническим данным: шкала Уэллса (Wells)
Оригинальное название: Wells Criteria for DVT
Источник: Wells PS, Anderson DR, Bormanis J, et al. Value of assessment of pretest probability of deep-vein thrombosis in clinical management. Lancet. 1997 Dec 20-27;350(9094):1795-8. PubMed ID: 9428249
Назначение: клинический инструмент для оценки вероятности ТГВ нижних конечностей до проведения визуализирующих методов исследования (УЗДГ). Применяется в отделениях неотложной помощи, терапевтических и хирургических стационарах, особенно при отёке одной ноги, боли или изменении цвета кожи.
Тип: шкала оценки.
Содержание:
|
Клинический признак |
Количество баллов |
|---|---|
|
Активное злокачественное новообразование (в настоящее время или в предшествующие 6 мес.) |
1 |
|
Парез, паралич или недавняя гипсовая иммобилизации нижней(их) конечности(ей) |
1 |
|
Постельный режим 3-е и более суток или большая операция в течение последних 12 недель |
1 |
|
Болезненность при пальпации по ходу глубоких вен |
1 |
|
Распространённый отёк нижней конечности |
1 |
|
Разница периметра голени за счёт отёка более 3-х см по сравнению со здоровой конечностью (на уровне 10 см ниже tibial tuberosity) |
1 |
|
Расширенные коллатеральные поверхностные вены (не варикоз) |
1 |
|
Документированный ТГВ в анамнезе |
1 |
|
Альтернативный диагноз как минимум столь же вероятен, как и ТГВ |
–2 |
Ключ (интерпретация): система балльной оценки Wells для оценки вероятности ТГВ нижних конечностей: от –2 до 1 — низкая вероятность ТГВ или ТГВ маловероятен; от 2 до 8 — умеренная/высокая вероятность ТГВ или ТГВ вероятен.
Пояснения: критерии оценки возможного ТГВ нижних конечностей предложены по результатам исследования, опубликованного в журнале Lancet в 1997 году. Применение шкалы позволяет улучшить ведение пациентов с подозрением на ТГВ. В частности, она помогает уменьшить количество повторных ультразвуковых исследований.
Приложение Г2. Оценка вероятности ТЭЛА по клиническим данным: шкала Wells
Название на русском языке: Оценка вероятности ТЭЛА по клиническим данным: шкала Уэллса (Wells)
Оригинальное название: нет Wells' Criteria for Pulmonary Embolism
Источник: Wells PS, Anderson DR, Rodger M. Derivation of a simple clinical model to categorize patients probability of pulmonary embolism: increasing the models utility with the SimpliRED D-dimer. Thromb Haemos. 2000;83(03):416-420
Назначение: клинический инструмент для предварительной оценки вероятности ТЭЛА у пациента с одышкой, тахикардией, болью в грудной клетке или синкопальными состояниями.
Тип: шкала оценки.
Содержание:
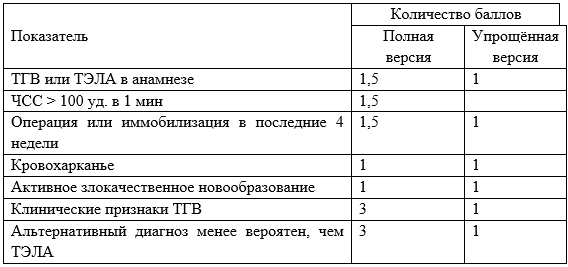
Ключ (интерпретация):
- клиническая вероятность (3 уровня, оригинальная версия шкалы) — сумма баллов: низкая — 0—1, умеренная — 2—6, высокая — ≥7;
- клиническая вероятность (2 уровня, оригинальная версия) — сумма баллов: ТЭЛА маловероятна — 0—4, ТЭЛА вероятна — >4;
- клиническая вероятность (2 уровня, упрощенная версия) — сумма баллов: ТЭЛА маловероятна 0—1, ТЭЛА вероятна — ≥2.
|
Вероятность ТЭЛА по клиническим данным |
||
|---|---|---|
|
Трёхуровневая шкала |
Сумма баллов |
|
|
Вероятность ТЭЛА низкая |
0-1 |
не оценивается |
|
Вероятность ТЭЛА средняя |
2-6 |
не оценивается |
|
Вероятность ТЭЛА высокая |
≥7 |
не оценивается |
|
Двухуровневая шкала |
Сумма баллов |
|
|
ТЭЛА маловероятна |
0-4 |
0-1 |
|
ТЭЛА вероятна |
≥5 |
≥2 |
Пояснения: Шкала Уэллса для оценка вероятности ТЭЛА по клиническим данным позволяет избежать ненужных исследований у пациентов с низким риском и ускорить диагностику у пациентов с высокой вероятностью ТЭЛА.
Приложение Г3. Оценка вероятности ТЭЛА по клиническим данным: модифицированная шкала Geneva
Название на русском языке: Оценка вероятности ТЭЛА по клиническим данным: модифицированная шкала Женева (Geneva)
Оригинальное название: the Geneva prognostic score
Источник: https://pubmed.ncbi.nlm.nih.gov/16461960/, https://pubmed.ncbi.nlm.nih.gov/26178041/
Назначение: Модифицированная шкала Geneva используется для оценки клинической вероятности ТЭЛА. При расчёте учитываются факторы, предрасполагающие к возникновению тромбоза глубоких вен и ТЭЛА, а также симптомы и признаки, характерные для этих состояний.
Тип: шкала оценки.
Содержание:
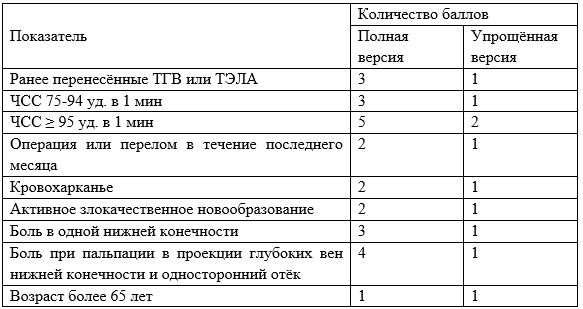
Ключ (интерпретация):
- клиническая вероятность (3 уровня, оригинальная версия) — сумма баллов: низкая — 0—3, умеренная — 4—10, высокая — ≥11
- клиническая вероятность (3 уровня, упрощенная версия) — сумма баллов: низкая — 0—1, умеренная — 2—4, высокая — ≥5 клиническая вероятность (2 уровня, оригинальная версия) — сумма баллов: ТЭЛА маловероятна — 0—5, ТЭЛА вероятна — ≥6
- клиническая вероятность (2 уровня, упрощенная версия) — сумма баллов: ТЭЛА маловероятна — 0—2, ТЭЛА вероятна — ≥3
Пояснения: При использовании трехуровневой классификации по шкале Geneva диагноз ТЭЛА подтверждается приблизительно у 10% больных в категории с низкой вероятностью, у 30% — со средней вероятностью и у 65% — с высокой вероятностью.
Приложение Г4. Индекс PESI (Pulmonary Embolism Severity Index)
Название на русском языке: индекс тяжести тромбоэмболии лёгочной артерии
Оригинальное название: Pulmonary Embolism Severity Index (PESI)
Источник: https://pubmed.ncbi.nlm.nih.gov/37575526/
Назначение: Индекс PESI позволяет определить степень тяжести ТЭЛА и прогнозировать риск смерти в течение 30 суток.
Тип: индекс.
Содержание:
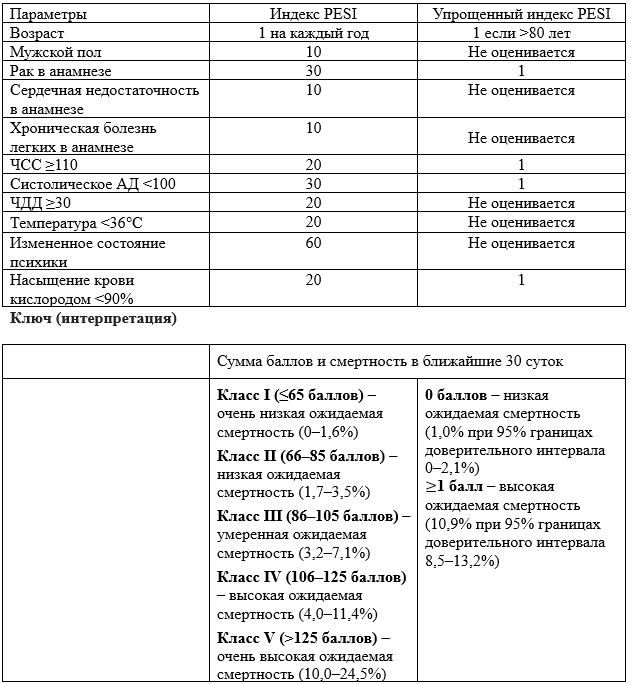
Пояснения: Использование индекса PESI позволяет разделить пациентов на группы риска, от низкого до высокого, что важно для принятия решений о тактике лечения. Упрощённые версии индекса включают меньше параметров, сохраняя при этом высокую прогностическую точность.
Приложение Г5. Шкала Каприни (Caprini) для оценки риска развития ВТЭО у пациентов хирургического профиля [87]
Название на русском языке: шкала Каприни (Caprini) для оценки риска развития ВТЭО у пациентов хирургического профиля
Оригинальное название: Caprini risk score (CRS, Caprini Risk Assessment Model)
Источник: https://pubmed.ncbi.nlm.nih.gov/22315263/
Назначение: шкала Каприни (Caprini) используется для стратификации риска развития венозных тромбоэмболических осложнений у пациентов хирургического профиля.
Тип: шкала оценки.
Содержание:
|
Баллы |
Клинические характеристики |
|---|---|
|
1 |
|
|
2 |
|
|
3 |
|
|
5 |
|
Ключ (интерпретация): результаты представляются в виде оценки суммы полученных баллов. Низкий риск: 0—2 балла; умеренный риск: 3—4 балла; высокий риск: 5—8 баллов; очень высокий риск: 9—10 баллов; чрезвычайно высокий риск: 11 и более баллов.
Приложение Г6. Степень риска развития ВТЭО в зависимости от травм, повреждений и хирургических вмешательств у пациентов травматолого-ортопедического профиля
|
Степень риска развития ВТЭО |
Частота ВТЭО при отсутствии профилактики, % |
Травмы, повреждения, операции |
|---|---|---|
|
Низкая |
Менее 10 |
«Малые»1 операции длительностью не более 60 мин. у пациентов до 40 лет без других факторов риска ВТЭО2 |
|
Средняя |
10-40 |
«Большие» операции (кроме эндопротезирования тазобедренного и коленного суставов) у пациентов 40–60 лет без других факторов риска ВТЭО2 «Малые»1 операции у пациентов старше 60 лет «Малые»1 операции, в т.ч с наложением турникета гибкого у пациентов 40–60 лет с другими факторами риска ВТЭО2 Изолированные переломы голени Повреждения связочного аппарата и сухожилий голени, требующие иммобилизации голеностопного сустава Ожоги поверхностные, площадью более 20% поверхности тела Ожоги глубокие, площадью более 10% поверхности тела Термоингаляционная травма I–II степени Острая инфекция, воспалительные заболевания суставов нижних конечностей, требующие постельного режима |
|
Высокая |
40-80 |
Эндопротезирование тазобедренного, коленного суставов «Большие»3 операции у пациентов старше 60 лет «Большие»3 операции у пациентов 40–60 лет, имеющих другие факторы риска ВТЭО2 Переломы бедра, костей таза Ожоги поверхностные, площадью более 20% поверхности тела Ожоги глубокие, площадью более 10% поверхности тела Осложнения ожоговой болезни Термоингаляционная травма III степени Отморожение II–IV степени Множественная и сочетанная травма Повреждения спинного мозга Травма, повреждение, операция на ОДА у пациентов с онкологическими заболеваниями, получающими химио-, рентгено- или радиотерапию Сепсис |
1 - «малые» операции: коррекция деформаций стопы, эндоскопические операции на суставах нижних конечностей, операции на мягких тканях нижних конечностей с последующей иммобилизацией
2 - см. таблицы 5.1 и 5.2. (стр. 28-29)
3 - «большие» операции: остеотомии и остеосинтез таза, бедра, голени, эндопротезирование тазобедренного, коленного и голеностопного суставов, операции на позвоночнике, ампутация бедра
Приложение Г7. Правила наложения бинтов эластичных медицинских
Бинт растягивают в начале каждого тура и накладывают от уровня плюснефаланговых суставов до верхней трети бедра при разогнутой и супинированной стопе, захватывая половину ширины предыдущего тура и постепенно уменьшая компрессию. Следует стремиться, чтобы давление, оказываемое бинтом, составляло в нижней средней трети голени 14–18 мм рт.ст., на уровне нижней трети бедра – 8–10 мм рт.ст. Для того чтобы больной ощутил нужную степень компрессии, можно использовать аппарат для измерения артериального давления, наложив манжету в надлодыжечной области. Конец бинта закрепляют фиксатором или булавкой, ни в коем случае не допуская «перетяжек», «удавок» при фиксации повязки, которые ухудшают гемодинамику.
Приложение Г8. Правила применения антагонистов витамина К
Подбор дозы АВК на примере варфарина**
Подбор дозы АВК начинают на фоне продолжающегося парентерального введения антикоагулянтов. Эффективную дозу АВК подбирают таким образом, чтобы поддерживать значения МНО в пределах от 2,0 до 3,0. Чтобы поддерживать терапевтический уровень гипокоагуляции во время перехода с парентеральных антикоагулянтов на АВК, необходимо строго соблюдать два условия:
1) длительность одновременного парентерального введения антикоагулянтов (НФГ, препаратов НМГ или фондапаринукса натрия) и приема АВК должна составлять не менее 5 суток;
2) парентеральное введение антикоагулянтов можно прекратить не ранее, чем в двух последовательных анализах, взятых с интервалом примерно в сутки (два последовательных дня), значения МНО будут превышать нижнюю границу терапевтического диапазона (2,0 и выше).
Алгоритм подбора дозы антагонистов витамина К на примере варфарина**
|
1-й и 2-й дни |
2 таблетки (5 мг) однократно вечером после ужина |
|
|---|---|---|
|
3-й день |
Утром определить МНО. |
|
|
|
МНО <1,5 |
Увеличить суточную дозу на ½ таблетки. Определить МНО через 1–2 дня. |
|
|
МНО 1,5-2,0 |
Увеличить суточную дозу на ¼ таблетки. Определить МНО через 1–2 дня. |
|
|
МНО 2,0-3,0 |
Оставить суточную дозу без изменений. Определить МНО через 1–2 дня. |
|
|
МНО 3,0-4,0 |
Уменьшить суточную дозу на ¼ таблетки. Определить МНО через 1–2 дня. |
|
|
МНО >4,0 |
Пропустить 1 прием, далее суточную дозу уменьшить на ½ таблетки. Определить МНО через 1–2 дня. |
|
4-й и 5-й дни |
Утром определить МНО. Действия соответствуют алгоритму 3-го дня. Если подбор дозы занимает более 5-ти дней, дальнейшая кратность определения МНО – 1 раз в два дня с использованием алгоритма 3-го дня. |
|
Далее МНО необходимо определять ежедневно или один раз в несколько дней до получения стабильных терапевтических значений показателя, затем 2–3 раза в неделю на протяжении 1–2 недель. После достижения стабильных терапевтических значений МНО следует определять не реже, чем каждые 4 недели (более частая оценка целесообразна у больных со значительными колебаниями показателя). Чувствительность больных к АВК не одинакова, зависит от множества факторов и может меняться со временем. Поэтому поддерживающая доза колеблется в широких пределах.
Если требуется коррекция (увеличение или уменьшение) дозы препарата, следует повторить цикл более частого определения МНО, пока снова не будут достигнуты стабильные значения показателя. При длительном использовании АВК контроль дозы может осуществляться медицинскими работниками или самим больным (при наличии портативного прибора для определения МНО).
Если у больных с подобранной дозой АВК МНО выходит за границы терапевтического диапазона, необходимо выявить и по возможности устранить возможные причины (неточность определения МНО, интеркуррентные заболевания, выраженные изменения в диете, употребление алкоголя, прием препаратов, влияющих на эффективность варфарина**, недостаточная приверженность лечению). Если при регулярном приеме варфарина** МНО не достигает нижней границы терапевтического диапазона, обычно достаточно увеличить совокупную недельную дозу на 10–20% и чаще контролировать МНО, пока оно не стабилизируется. В отдельных случаях более высокая доза варфарина** может быть дана однократно с последующими более частыми определениями МНО и изменением общей недельной дозы или без него.
В случае повышения уровня МНО выше терапевтического при отсутствии значимого кровотечения рекомендуется снизить или пропустить дозу варфарина**. Чаще определять МНО и возобновить прием варфарина** в меньшей дозе, когда МНО вернется в границы терапевтического диапазона. Если МНО незначительно выше верхней границы терапевтического диапазона, снижение дозы не обязательно.
При развитии клинически значимого кровотечения наиболее быстрый, но кратковременный эффект купирования эффекта варфарина** дает внутривенное введение раствора фитоменадиона, свежезамороженной плазмы, факторов свертывания крови II, VII, IX и X в комбинации [Протромбиновый комплекс]**, рекомбинантного активированного #фактора свертывания крови VII**. Имеющийся в РФ препарат менадиона натрия бисульфит** не является аналогом парентеральной формы фитоменадиона. Менадиона натрия бисульфит** способствует синтезу витамин К-зависимых факторов свертывания de novo за счет влияния на процессы карбоксилирования, поэтому эффект после его приема наступает медленно, и он бесполезен для быстрого устранения эффекта АВК.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.