Диагностика и лечение пациентов с миелодиспластическими синдромами (взрослое население)
 Версия: Клинические протоколы 2024 (Беларусь)
Версия: Клинические протоколы 2024 (Беларусь)
Миелодиспластические синдромы (D46)
Гематология, Онкогематология
Общая информация
Краткое описание
ПОСТАНОВЛЕНИЕ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ
РЕСПУБЛИКИ БЕЛАРУСЬ
5 марта 2024 г. № 45
Об утверждении клинического протокола
На основании абзаца девятого части первой статьи 1 Закона Республики Беларусь от 18 июня 1993 г. № 2435-XII «О здравоохранении», подпункта 8.3 пункта 8, подпункта 9.1 пункта 9 Положения о Министерстве здравоохранения Республики Беларусь, утвержденного постановлением Совета Министров Республики Беларусь от 28 октября 2011 г. № 1446, Министерство здравоохранения Республики Беларусь
ПОСТАНОВЛЯЕТ:
1. Утвердить клинический протокол «Диагностика и лечение пациентов (взрослое население) с миелодиспластическими синдромами» (прилагается).
2. Признать утратившим силу абзац пятый пункта 1 приказа Министерства здравоохранения Республики Беларусь от 31 мая 2012 г. № 662 «Об утверждении клинических протоколов диагностики и лечения отдельных гематологических заболеваний и протоколов медицинской реабилитации пациентов с гемофилией А и В».
3. Настоящее постановление вступает в силу после его официального опубликования.
Министр А.В.Ходжаев
СОГЛАСОВАНО
Государственный пограничный комитет Республики Беларусь
Комитет государственной безопасности Республики Беларусь
Министерство внутренних дел Республики Беларусь
Министерство обороны Республики Беларусь
Министерство по чрезвычайным ситуациям Республики Беларусь
Национальная академия наук Беларуси
Управление делами Президента Республики Беларусь
Брестский областной исполнительный комитет
Витебский областной исполнительный комитет
Гомельский областной исполнительный комитет
Гродненский областной исполнительный комитет
Могилевский областной исполнительный комитет
Минский областной исполнительный комитет
Минский городской исполнительный комитет
УТВЕРЖДЕНО
Постановление
Министерства здравоохранения
Республики Беларусь
05.03.2024 № 45
КЛИНИЧЕСКИЙ ПРОТОКОЛ «Диагностика и лечение пациентов (взрослое население) с миелодиспластическими синдромами»
ГЛАВА 1
ОБЩИЕ ПОЛОЖЕНИЯ
1. Настоящий клинический протокол устанавливает общие требования к объему оказания медицинской помощи пациентам (взрослое население) с миелодиспластическими синдромами (далее – МДС) в амбулаторных и стационарных условиях (шифр по Международной статистической классификации болезней и проблем, связанных со здоровьем, десятого пересмотра – D46 Миелодиспластические синдромы).
2. Требования настоящего клинического протокола являются обязательными для юридических лиц и индивидуальных предпринимателей, осуществляющих медицинскую деятельность в порядке, установленном законодательством о здравоохранении.
3. Для целей настоящего клинического протокола используются основные термины и их определения в значениях, установленных Законом Республики Беларусь «О здравоохранении», Законом Республики Беларусь от 30 ноября 2010 г. № 197-З «О донорстве крови и ее компонентов», а также следующий термин и его определение:
МДС – гетерогенная группа клональных заболеваний системы крови, возникающих вследствие мутации гемопоэтической стволовой клетки и характеризующихся цитопенией, как результат неэффективного гемопоэза, признаками дисмиелопоэза и высоким риском прогрессии/трансформации в острый миелоидный лейкоз (далее – ОМЛ).
4. Первичная медицинская помощь пациентам с МДС оказывается в районных организациях здравоохранения; специализированная медицинская помощь – в районных, областных (городских), республиканских организациях здравоохранения; высокотехнологичная медицинская помощь – в областных (городских) и республиканских организациях здравоохранения.
5. Направление пациентов с МДС для оказания им медицинской помощи в стационарных условиях определяется в порядке, установленном Министерством здравоохранения.
6. Настоящий клинический протокол в части лечения МДС включает основные лекарственные препараты (далее – ЛП), которые представлены в соответствии с международными непатентованными наименованиями, а при их отсутствии – по химическим наименованиям по систематической или заместительной номенклатуре, с указанием лекарственной формы и дозировки.
7. В соответствии с настоящим клиническим протоколом по медицинским показаниям возможно применение ЛП «off-label», назначаемых по решению врачебного консилиума.
8. В каждой конкретной ситуации в интересах пациента решением врачебного консилиума объем диагностики и лечения может быть расширен с использованием иных утвержденных Министерством здравоохранения методов оказания медицинской помощи, не включенных в настоящий клинический протокол.
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ
РЕСПУБЛИКИ БЕЛАРУСЬ
5 марта 2024 г. № 45
Об утверждении клинического протокола
На основании абзаца девятого части первой статьи 1 Закона Республики Беларусь от 18 июня 1993 г. № 2435-XII «О здравоохранении», подпункта 8.3 пункта 8, подпункта 9.1 пункта 9 Положения о Министерстве здравоохранения Республики Беларусь, утвержденного постановлением Совета Министров Республики Беларусь от 28 октября 2011 г. № 1446, Министерство здравоохранения Республики Беларусь
ПОСТАНОВЛЯЕТ:
1. Утвердить клинический протокол «Диагностика и лечение пациентов (взрослое население) с миелодиспластическими синдромами» (прилагается).
2. Признать утратившим силу абзац пятый пункта 1 приказа Министерства здравоохранения Республики Беларусь от 31 мая 2012 г. № 662 «Об утверждении клинических протоколов диагностики и лечения отдельных гематологических заболеваний и протоколов медицинской реабилитации пациентов с гемофилией А и В».
3. Настоящее постановление вступает в силу после его официального опубликования.
Министр А.В.Ходжаев
СОГЛАСОВАНО
Государственный пограничный комитет Республики Беларусь
Комитет государственной безопасности Республики Беларусь
Министерство внутренних дел Республики Беларусь
Министерство обороны Республики Беларусь
Министерство по чрезвычайным ситуациям Республики Беларусь
Национальная академия наук Беларуси
Управление делами Президента Республики Беларусь
Брестский областной исполнительный комитет
Витебский областной исполнительный комитет
Гомельский областной исполнительный комитет
Гродненский областной исполнительный комитет
Могилевский областной исполнительный комитет
Минский областной исполнительный комитет
Минский городской исполнительный комитет
УТВЕРЖДЕНО
Постановление
Министерства здравоохранения
Республики Беларусь
05.03.2024 № 45
КЛИНИЧЕСКИЙ ПРОТОКОЛ «Диагностика и лечение пациентов (взрослое население) с миелодиспластическими синдромами»
ГЛАВА 1
ОБЩИЕ ПОЛОЖЕНИЯ
1. Настоящий клинический протокол устанавливает общие требования к объему оказания медицинской помощи пациентам (взрослое население) с миелодиспластическими синдромами (далее – МДС) в амбулаторных и стационарных условиях (шифр по Международной статистической классификации болезней и проблем, связанных со здоровьем, десятого пересмотра – D46 Миелодиспластические синдромы).
2. Требования настоящего клинического протокола являются обязательными для юридических лиц и индивидуальных предпринимателей, осуществляющих медицинскую деятельность в порядке, установленном законодательством о здравоохранении.
3. Для целей настоящего клинического протокола используются основные термины и их определения в значениях, установленных Законом Республики Беларусь «О здравоохранении», Законом Республики Беларусь от 30 ноября 2010 г. № 197-З «О донорстве крови и ее компонентов», а также следующий термин и его определение:
МДС – гетерогенная группа клональных заболеваний системы крови, возникающих вследствие мутации гемопоэтической стволовой клетки и характеризующихся цитопенией, как результат неэффективного гемопоэза, признаками дисмиелопоэза и высоким риском прогрессии/трансформации в острый миелоидный лейкоз (далее – ОМЛ).
4. Первичная медицинская помощь пациентам с МДС оказывается в районных организациях здравоохранения; специализированная медицинская помощь – в районных, областных (городских), республиканских организациях здравоохранения; высокотехнологичная медицинская помощь – в областных (городских) и республиканских организациях здравоохранения.
5. Направление пациентов с МДС для оказания им медицинской помощи в стационарных условиях определяется в порядке, установленном Министерством здравоохранения.
6. Настоящий клинический протокол в части лечения МДС включает основные лекарственные препараты (далее – ЛП), которые представлены в соответствии с международными непатентованными наименованиями, а при их отсутствии – по химическим наименованиям по систематической или заместительной номенклатуре, с указанием лекарственной формы и дозировки.
7. В соответствии с настоящим клиническим протоколом по медицинским показаниям возможно применение ЛП «off-label», назначаемых по решению врачебного консилиума.
8. В каждой конкретной ситуации в интересах пациента решением врачебного консилиума объем диагностики и лечения может быть расширен с использованием иных утвержденных Министерством здравоохранения методов оказания медицинской помощи, не включенных в настоящий клинический протокол.
Классификация
9. Классификация МДС, принятая Всемирной организацией здравоохранения (далее – ВОЗ) в 2017 г., базируется на цитоморфологических, кариотипических и клинических признаках заболевания и указана в приложении 1.
Диагностика
ГЛАВА 2
КЛАССИФИКАЦИЯ И ДИАГНОСТИКА МДС
10. Диагностические критерии МДС:
10.1. предварительные критерии группы А:
- стабильная цитопения по >1 из следующих клеточных линий:
- эритроидной (уровень гемоглобина (далее – Hb) <110 г/л);
- нейтрофильной (количество нейтрофилов <1,8 х 109 /л);
- мегакариоцитарной (количество тромбоцитов <100 х 109 /л);
- исключение других гематологических и негематологических заболеваний – причин цитопении/дисплазии;
10.2. МДС-ассоциированные критерии группы В:
- дисплазия в >10 % клеток эритроидной, нейтрофильной или мегакариоцитарной клеточных линиях костного мозга (далее – КМ), либо наличие >15 % кольцевых сидеробластов (далее – КС);
- от 5 до 19 % бластных клеток (далее – бласты) в КМ;
- типичные хромосомные аберрации по результатам стандартного цитологического исследования или флюоресцентной гибридизации in situ (+8, -7, 5q-, 20q- и другие);
10.3. вспомогательные критерии группы С (для пациентов, имеющих критерии группы А, но не имеющих критерии группы В):
- аномальный иммунный фенотип эритроидных или миелоидных клеток КМ, указывающий на их клональное происхождение по результатам проточной цитометрии (наличие маркеров CD38, CD13, CD71, CD33);
- молекулярно-генетические признаки наличия клональной клеточной популяции в КМ;
- значительное и стабильное снижение колониеобразующей активности КМ и (или) периферической крови (далее – ПК).
11. Диагноз устанавливается при наличии двух предварительных критериев группы А и не менее чем одного МДС-ассоциированных критериев группы В. Вспомогательные критерии группы С используются при отсутствии критериев группы В и наличии у пациента признаков клональной миелоидной пролиферации.
12. Алгоритм диагностики МДС, указанный в приложении 2, проводится последовательно в организациях здравоохранения различного уровня с соблюдением преемственности на всех этапах.
Лечение
ГЛАВА 4
ЛЕЧЕНИЕ ПАЦИЕНТОВ С МДС
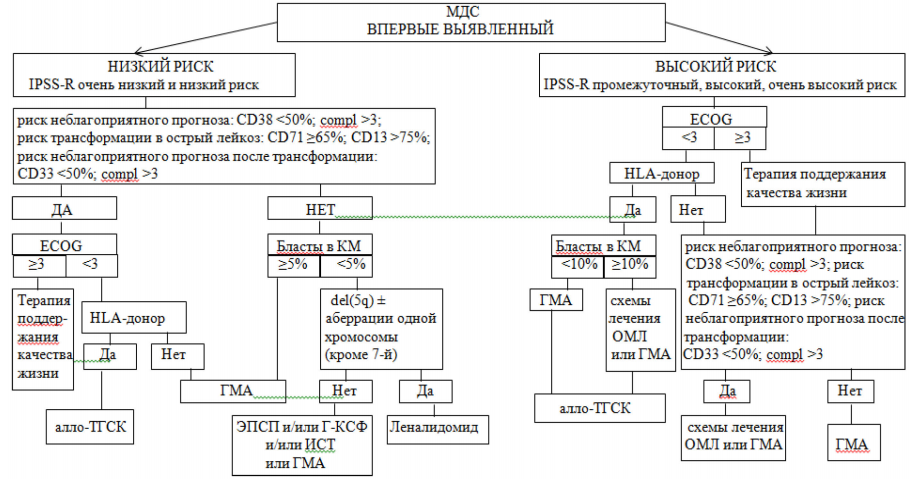
15. Выбор терапии основан на диагнозе и группе риска, указанным в приложении 4, с учетом оценки соматического статуса пациента по шкале ECOG согласно приложению 5.
При ECOG >3 специфическая терапия не показана.
У пациентов с впервые диагностированным МДС высокого риска (IPSS-R промежуточный, высокий, очень высокий риск) при оценке статуса пациента по шкале ECOG >3 показана терапия поддержания качества жизни. При оценке статуса пациента по шкале ECOG <3 при наличии HLA-совместимого донора при уровне бластов в КМ >10 % показана терапия гипометилирующими агентами (далее – ГМА) или терапии по схеме лечения ОМЛ с последующим проведением аллогенной трансплантации гемопоэтических стволовых клеток (далее – алло-ТГСК), а при уровне бластов в КМ <10 % – проведение терапии ГМА с последующим проведением алло-ТГСК.
В случае отсутствия HLA-совместимого донора и невозможности проведения аллоТГСК при выявлении иммунофенотипических и молекулярно-генетических маркеров неблагоприятного прогноза (риск неблагоприятного прогноза: CD38 <50 %; compl >3; риск трансформации в острый лейкоз: CD71 >65 %; CD13 >75 %; риск неблагоприятного прогноза после трансформации: CD33 <50 %; compl >3) показана терапия ГМА или терапия по схеме лечения ОМЛ, при отсутствии маркеров неблагоприятного прогноза – терапия только ГМА.
У пациентов с впервые диагностированным МДС низкого риска (IPSS-R очень низкий и низкий риск) при выявлении иммунофенотипических и молекулярногенетических маркеров неблагоприятного прогноза (риск неблагоприятного прогноза: CD38 <50 %; compl >3; риск трансформации в острый лейкоз: CD71 >65 %; CD13 >75 %; риск неблагоприятного прогноза после трансформации: CD33 <50 %; compl >3) при оценке статуса пациента по шкале ECOG <3 при наличии донора показано выполнение алло-ТГСК, при отсутствии донора – терапия ГМА, а в случае оценки статуса пациента по шкале ECOG >3 – терапия поддержания качества жизни: использование ростовых факторов, переливание эритроцитарных компонентов крови (далее – ЭКК) и (или) тромбоцитарных компонентов крови, хелаторов железа.
У пациентов с впервые диагностированным МДС низкого риска (IPSS-R очень низкий и низкий риск) при отсутствии иммунофенотипических и молекулярногенетических маркеров неблагоприятного прогноза при уровне бластов в КМ >5 % показана терапия ГМА, а в случае уровня бластов в КМ <5 % предусмотрены следующие варианты терапии:
- при наличии делеции изолированной 5q хромосомы ± аберрации одной хромосомы (кроме аберрации 7-й хромосомы) показана терапия леналидомидом;
- при отсутствии делеции изолированной 5q хромосомы ± аберрации одной хромосомы (кроме аберрации 7-й хромосомы) проводится терапия с возможным использованием эритропоэзстимулирующих препаратов (далее – ЭПСП), рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора (далее – Г-КСФ), иммуносупрессивной терапии (далее – ИСТ), ГМА.
16. Терапия поддержания качества жизни проводится всем пациентам, в том числе получающим ИСТ и ГМА:
16.1. переливание ЭКК и переливание тромбоцитарных компонентов крови проводятся согласно Инструкции о порядке медицинского применения крови и (или) ее компонентов в организациях здравоохранения, утвержденной постановлением Министерства здравоохранения Республики Беларусь от 19 мая 2023 г. № 92.
Целевые уровни:
- Hb – 90–100 г/л;
- гематокрит – 30–33 %;
- тромбоциты – 20 х 109 /л;
16.2. применение хелаторов железа.
Медицинскими показаниями к применению хелаторов железа являются:
- переливание более 20 доз ЭКК;
- уровень сывороточного ферритина более 1000 мкг/л;
- наличие дисфункции сердца (аритмия, сердечная недостаточность);
- поражение печени (повышение уровня трансаминаз, гепатомегалия и другие).
В клинической практике используется ЛП деферазирокс, таблетки диспергируемые 250 мг, 500 мг. Назначают внутрь 1 раз/сутки натощак (за 30 мин. до еды), предпочтительно в одно и то же время дня ежедневно. Рекомендуемая начальная суточная доза – 20 мг/кг массы тела.
Для пациентов, получающих переливание ЭКК >14 мл/кг/месяц (>4 переливаний в месяц), начальная суточная доза деферазирокса составляет 30 мг/кг; для пациентов, получающих <7 мл/кг/месяц ЭКК (>2 переливаний в месяц) – 10 мг/кг.
При применении ЛП деферазирокс проводится ежемесячный контроль уровня ферритина в сыворотке крови. Коррекцию дозы ЛП следует проводить постепенно, увеличивая или уменьшая дозу за один раз на 5–10 мг/кг. Направление коррекции дозы ЛП определяется индивидуальной эффективностью лечения и терапевтическими задачами (поддержание или уменьшение содержания ферритина в сыворотке крови);
16.3. эмпирическая антибактериальная терапия показана при развитии фебрильной нейтропении согласно приложениям 6 и 7;
16.4. ЛП, стимулирующие гемопоэз:
16.5. эритропоэтин альфа рекомбинантный, раствор для внутривенного и подкожного введения 40 000 МЕ/1 мл, подкожно 1–2 раза в неделю, при получении ответа (уровень Hb 100–120 г/л) продолжать с коррекцией дозы ЛП с учетом развития нежелательных реакций и клинических данных (лихорадка, головная боль, кашель, тошнота и головокружение, тромбоз и другие);
16.6. Г-КСФ назначается:
- в качестве монотерапии у пациентов с нейтропенией и рецидивирующими или резистентными к антибиотикотерапии инфекциями;
- в качестве монотерапии при ожидаемой длительной нейтропении (абсолютное число нейтрофилов менее 0,5 х 109 /л);
- в качестве сопроводительной терапии при проведении химиотерапии;
- пациентам при отсутствии ответа на монотерапию ЭПСП.
Филграстим, раствор для инъекций (для внутривенного и подкожного введения) 300 мкг/мл (30 млн МЕ/мл), подкожно 1–2 мкг/кг 1–2 раза в неделю, при достижении нейтрофильного ответа (уровень нейтрофилов более 0,5 х 109 /л) продолжать до появления признаков непереносимости или прогрессирования МДС.
При отсутствии ответа в течение 2–3 месяцев ЛП отменяют.
17. ИСТ может быть назначена решением врачебного консилиума с учетом оценки риска и пользы для пациента. В клинической практике могут быть использованы ЛП антитимоцитарного глобулина* (далее – АТГ), циклоспорин А*.
АТГ*, концентрат для приготовления раствора для инфузий 20 мг/мл 5 мл; лиофилизированный порошок для приготовления раствора для инфузий 25 мг, назначается в дозе 40 мг/кг в сутки внутривенно 4 дня.
Циклоспорин А*, капсулы 25 мг, 50 мг, 100 мг, внутрь, в дозе 1–5 мг/кг в сутки в 2 приема с оценкой результата через 6 месяцев. Дозу корригируют в соответствии с концентрацией ЛП в сыворотке крови (не выше 400 мкг/мл), уровнем артериального давления, функциональным состоянием почек.
При снижении на фоне назначения циклоспорина А* скорости клубочковой фильтрации более чем на 25 % от исходного уровня дозу циклоспорина А* уменьшают на 25–50 %.
______________________________
* Назначаются «off-label» по решению врачебного консилиума.
18. ГМА применяют у пациентов различных групп риска, у которых невозможно или нецелесообразно применение более интенсивной терапии. При получении ответа на лечение ГМА (полная ремиссия, частичная ремиссия, стабилизация) терапия должна быть продолжена при сохранении ответа, отменена – при прогрессировании заболевания или выявлении признаков непереносимой токсичности:
18.1. децитабин, лиофилизированный порошок для приготовления раствора для инфузий 50 мг, используется в дозе 20 мг/м2 внутривенно капельно в течение 1 часа 1–5 дней с перерывом в 23 дня (28-дневный терапевтический цикл). Рекомендованное количество терапевтических циклов – не менее 4;
18.2. азацитидин, лиофилизированный порошок для приготовления суспензии для подкожного введения 100 мг, лиофилизат для приготовления раствора для инъекций 100 мг – подкожно в дозе 75 мг/м2 1–7 дней с перерывом в 21 день (28-дневный терапевтический цикл). Рекомендованное количество терапевтических циклов – не менее 6.
19. Лечение МДС по схемам лечения ОМЛ проводится в соответствии с клиническим протоколом «Диагностика и лечение пациентов старше 18 лет с вновь диагностированным острым миелоидным лейкозом», утвержденным постановлением Министерства здравоохранения Республики Беларусь от 1 июня 2017 г. № 43. Пациентам группы высокого риска в возрасте менее 60 лет показано лечение по схемам индукции ремиссии ОМЛ.
20. Высокодозная химиотерапия с алло-ТГСК показана всем пациентам с МДС в возрасте менее 60 лет при наличии HLA-идентичного донорa.
21. Иммуномодулирующая терапия ЛП леналидомидом проводится пациентам группы низкого риска при отсутствии маркеров неблагоприятного прогноза при уровне бластов в костном мозге <5 % и при наличии изолированной делеции 5q хромосомы ± аберрации одной хромосомы (кроме 7-й хромосомы).
Леналидомид, капсулы 5 мг, 10 мг, 15 мг, 20 мг, назначается в дозе 10 мг внутрь в 1– 21 дни, каждые 28 дней. Рекомендованное количество терапевтических циклов – не менее 6.
22. Оценка эффективности лечения МДС по IWG 2006 осуществляется в соответствии с приложением 8.
Прогноз
ГЛАВА 3
ПРОГНОЗ ПРИ МДС
13. Для оценки прогноза и определения тактики лечения пациентов с МДС используют интернациональную прогностическую шкалу IPSS-R 2012 г., указанную в приложении 3.
14. При диагностировании у пациента впервые выявленного МДС с аберрациями по >3 иммунофенотипическим маркерам (риск неблагоприятного прогноза: CD38 <50 %; комплексные аберрации (далее – compl) >3; риск трансформации в острый лейкоз: CD71 >65 %; CD13 >75 %; риск неблагоприятного прогноза после трансформации: CD33 <50 %; compl >3) и (или) хотя бы с 1 молекулярно-генетическим маркером (наличие TP53, compl >3) неблагоприятного прогноза следует интерпретировать риск как высокий согласно алгоритму выбора терапии МДС на основе оценки группы риска, указанному в приложении 4.
Профилактика
ГЛАВА 5
МЕДИЦИНСКАЯ ПРОФИЛАКТИКА И МЕДИЦИНСКОЕ НАБЛЮДЕНИЕ ПАЦИЕНТОВ С МДС В АМБУЛАТОРНЫХ УСЛОВИЯХ
23. Медицинская профилактика МДС проводится путем выполнения диагностических мероприятий у пациентов с цитопеническим синдромом (анемический синдром, геморрагический синдром, лейкопения) с целью раннего выявления гематологической патологии и своевременного начала терапии.
24. Медицинское наблюдение направлено на определение гематологического статуса пациента, исключение реактивных цитопений или других клональных заболеваний кроветворной системы в течение периода медицинского наблюдения.
25. Медицинское наблюдение пациентов с МДС в амбулаторно-поликлинических организациях здравоохранения осуществляет врач общей практики (врач-терапевт).
26. Перечень диагностических исследований и кратность медицинского наблюдения врачами-специалистами:
- медицинский осмотр врача общей практики (врача-терапевта) – 2–4 раза в год;
- консультация врача-гематолога (периодичность определяется индивидуально);
- общий анализ крови развернутый (далее – ОАК) – кратность проведения исследований определяется индивидуально, зависит от варианта МДС, клинических проявлений и проводимой терапии;
- биохимический анализ крови (далее – БАК): общий белок, белковые фракции альбумина, глобулины, мочевина, аланинаминотрансфераза (далее – АЛТ), аспарагинаминотрансфераза (далее – АСТ), креатинин, билирубин общий, прямой билирубин, непрямой билирубин, щелочная фосфатаза, лактатдегидрогеназа (далее – ЛДГ), холестерин, триглицериды, глюкоза, С-реактивный белок – перечень обязательных параметров для контроля, кратность проведения исследований определяются индивидуально;
- исследование уровня ферритина в сыворотке крови (на фоне терапии деферазироксом) – ежемесячно, с коррекцией дозы деферазирокса каждые 3–6 месяцев при необходимости;
- исследование крови методом проточной цитофлуориметрии для выявления клона клеток пароксизмальной ночной гемоглобинурии – кратность проведения исследований определяется индивидуально (показано пациентам с количеством бластов КМ <5 %, а также при наличии клинико-лабораторных признаков внутрисосудистого гемолиза при верификации диагноза МДС);
- ультразвуковое исследование (далее – УЗИ) органов брюшной полости (далее – ОБП) – медицинские показания для проведения и кратность исследования определяются индивидуально в процессе лечения для выявления гепатоспленомегалии, лимфаденопатии и патологии других жизненно важных органов;
- УЗИ органов малого таза (далее – ОМТ) – медицинские показания для проведения и кратность исследования определяются индивидуально в процессе лечения для выявления гепатоспленомегалии, лимфаденопатии и патологии других жизненно важных органов;
- рентгенография (далее – Rh-графия) органов грудной клетки (далее – ОГК) – медицинские показания для проведения и кратность исследования определяются индивидуально, для исключения поражения легочной ткани и органов средостения как воспалительного, так и невоспалительного характера;
- компьютерная томография ОГК – медицинские показания для проведения и кратность исследования определяются индивидуально, для исключения поражения легочной ткани и органов средостения как воспалительного, так и невоспалительного характера;
- аспирационная биопсия костного мозга (миелограмма, иммунофенотипирование, цитогенетический анализ, молекулярно-генетический анализ) – медицинские показания для проведения, перечень обязательных параметров и кратность исследования определяются индивидуально.
Информация
Источники и литература
-
Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2024
-
www.minzdrav.gov.by
- www.minzdrav.gov.by -
Информация
Приложение 1
к клиническому протоколу
«Диагностика и лечение пациентов (взрослое население) с миелодиспластическими синдромами» Классификация МДС по ВОЗ 2017 г.
|
№ п/п
|
Вариант
|
Дисплазия, количество ростков
|
Цитопения* количество ростков
|
КС, %
|
Бласты в КМ и ПК, %
|
Особенности кариотипа
|
|
1
|
МДС с линейной дисплазией**
|
1
|
1-2
|
<15 (<5)***
|
КМ <5, ПК <1, палочки Ауэра – нет
|
Любой, кроме 5q
|
|
2
|
МДС с мультилинейной дисплазией
|
2-3
|
1-3
|
<15 (<5)***
|
КМ <5, ПК <1, палочки Ауэра – нет
|
Любой, кроме 5q
|
|
МДС с КС
|
||||||
|
3
|
МДС-КС и линейной дисплазией
|
1
|
1-2
|
>15 (>5)***
|
КМ <5, ПК <1, палочки Ауэра – нет
|
Любой, кроме 5q
|
|
4
|
МДС-КС и мультилинейной дисплазией
|
2-3
|
1-3
|
>15 (>5)***
|
КМ <5, ПК <1, палочки Ауэра – нет
|
Любой, кроме 5q
|
|
5
|
МДС с изолированной делецией длинного плеча 5 хромосомы
|
1-3
|
1-2
|
Нет или любое количество
|
КМ <5, ПК <1, палочки Ауэра – нет
|
5q- +/–1 добавочная аномалия за исключением – 7/7q-
|
|
МДС с избытком бластов
|
||||||
|
6
|
МДС-ИБ-1
|
1–3
|
1–3
|
Нет или любое количество
|
КМ <10 (5–9), ПК <5 (2–4), палочки Ауэра – нет
|
Любой
|
|
7
|
МДС-ИБ-2
|
1–3
|
1–3
|
Нет или любое количество
|
КМ 10–19, ПК 5– 19, палочки Ауэра –/+
|
Любой
|
|
МДС неклассифицируемый
|
||||||
|
8
|
с 1 % бластов в ПК
|
1-3
|
1-3
|
Нет или любое количество
|
КМ <5, ПК = 1****, палочки Ауэра – нет
|
Любой
|
|
9
|
с линейной дисплазией и панцитопенией
|
1
|
3
|
Нет или любое количество
|
КМ <5, ПК <1, палочки Ауэра – нет
|
Любой
|
|
10
|
на основании цитогенетических изменений
|
0
|
1-3
|
<15*****
|
КМ <5, ПК <1, палочки Ауэра – нет
|
МДС аномалии******
|
______________________________
* Уровень Hb <100 г/л, количество нейтрофилов <1,8 х 109/л, тромбоцитов <100 х 109/л, моноцитов <1,0 х 109/л.
** Дисплазия считается значимой, когда признаки дисплазии выявлены в >10 % клеток эритроидного, гранулоцитарного, мегакариоцитарного ростков.
*** При наличии мутации в гене SF3B1.
**** Если бласты в ПК определены в 2 и более исследованиях.
***** Если КС >15 %, то это МДС с КС и линейной дисплазией.
****** Аномалии кариотипа, наиболее часто встречающиеся при МДС: –5/5q-, –7/7q-, изохромосома 17q/t(17p), –13/13q-, 11q-, 12p–/t(12p), 9q-, idic(X)(q13), t(11;16), t(3;21), t(1;3), t(2;11), inv(3)/t(3;3), t(6;9). Аномалии кариотипа +8, 20q-, –Y без морфологических критериев не являются поводом верифицировать МДС.
Приложение 2
к клиническому протоколу
«Диагностика и лечение пациентов (взрослое население) с миелодиспластическими синдромами» Алгоритм диагностики МДС в организациях здравоохранения различного уровня
* Уровень Hb <100 г/л, количество нейтрофилов <1,8 х 109/л, тромбоцитов <100 х 109/л, моноцитов <1,0 х 109/л.
** Дисплазия считается значимой, когда признаки дисплазии выявлены в >10 % клеток эритроидного, гранулоцитарного, мегакариоцитарного ростков.
*** При наличии мутации в гене SF3B1.
**** Если бласты в ПК определены в 2 и более исследованиях.
***** Если КС >15 %, то это МДС с КС и линейной дисплазией.
****** Аномалии кариотипа, наиболее часто встречающиеся при МДС: –5/5q-, –7/7q-, изохромосома 17q/t(17p), –13/13q-, 11q-, 12p–/t(12p), 9q-, idic(X)(q13), t(11;16), t(3;21), t(1;3), t(2;11), inv(3)/t(3;3), t(6;9). Аномалии кариотипа +8, 20q-, –Y без морфологических критериев не являются поводом верифицировать МДС.
Приложение 2
к клиническому протоколу
«Диагностика и лечение пациентов (взрослое население) с миелодиспластическими синдромами» Алгоритм диагностики МДС в организациях здравоохранения различного уровня
|
№ п/п
|
Этапы
|
Задачи
|
Организация здравоохранения и врачи-специалисты
|
Объем исследований
|
|
1
|
Первичного скрининга
|
Выявление пациентов с цитопеническими синдромами и клиническими проявлениями МДС; обоснование необходимости и направление пациентов, нуждающихся в дополнительном обследовании, на следующий этап
|
Районный, городской (врачи любой специальности амбулаторно-поликлинических и стационарных организаций здравоохранения)
|
Сбор анамнеза (химиотерапия или лучевая терапия в прошлом, случаи МДС/ОМЛ в семье, рецидивирующие инфекционные заболевания или геморрагический синдром). Физикальное обследование. ОАК с подсчетом количества тромбоцитов, лейкоцитарной формулы. БАК: общий белок, мочевина, креатинин, билирубин, щелочная фосфатаза, АСТ, АЛТ, ЛДГ, железо
|
|
2
|
Углубленного клиниколабораторного и инструментального обследования
|
Углубленное клинико-лабораторное и инструментальное обследование и выявление МДС-ассоциированных критериев; обоснование необходимости и направление пациентов на следующий этап
|
Областные, городские (гематологические отделения, кабинеты)
|
ОАК с подсчетом количества тромбоцитов, ретикулоцитов, лейкоцитарной формулы, морфологической оценкой. БАК: исследование уровня ферритина, альбумина, глобулинов; исследование уровня витамина В12; исследование уровня фолиевой кислоты; определение антигена вируса гепатита B (HBsAg) в крови; определение антител классов M и G к вирусному гепатиту C в крови; определение антител к бледной трепонеме (Treponema pallidum) в сыворотке крови; определение антител к вирусу иммунодефицита человека в крови; фиброгастродуоденоскопия; колоноскопия; УЗИ ОБП; УЗИ ОМТ; УЗИ лимфатических узлов; УЗИ щитовидной железы; Rh-графия ОГК; аспирационная биопсия КМ
|
|
3
|
Дифференциальной диагностики и подбора терапии
|
Клинико-лабораторное и инструментальное обследование пациентов с целью дифференциальной диагностики, верификации диагноза; подбор и коррекция индивидуальной программы терапии; медицинское наблюдение пациентов с ранее верифицированным МДС; создание базы и анализ данных пациентов с МДС для изучения проблемы МДС и усовершенствования медицинской помощи
|
Областные, республиканские (гематологические отделения)
|
исследование иммуноглобулинов класса М и G к вирусу Эпштейна-Барр; исследование иммуноглобулинов класса М и G к цитомегаловирусу; исследование уровня витамина В12; исследование уровня фолиевой кислоты; исследование уровня эритропоэтина; аспирационная биопсия КМ; билатеральная трепанобиопсия передних или задних остей подвздошных костей; молекулярно-генетическое исследование ПК или КМ для выявления мутаций генов (SF3B1, ТР53, ASXL1, ETV6, RUNX1, GATA2, DNMT3A, TET2, IDH1/2 и другие)
|
Приложение 3
к клиническому протоколу
«Диагностика и лечение пациентов (взрослое население) с миелодиспластическими синдромами» Интернациональная прогностическая шкала IPSS-R 2012 г.
|
Прогностические факторы
|
Баллы
|
||||||
|
0
|
0,5
|
1
|
1,5
|
2
|
3
|
4
|
|
|
Кариотип
|
очень хороший
|
-
|
хороший
|
-
|
промежуточный
|
плохой
|
очень плохой
|
|
Бласты в костном мозге, %
|
<2
|
-
|
2,1–4,9
|
-
|
5–10
|
>10
|
-
|
|
Hb, г/л
|
>100
|
-
|
80-99
|
<80
|
-
|
-
|
-
|
|
Тромбоциты, х109 /л
|
>100
|
50-99
|
<50
|
-
|
-
|
-
|
-
|
|
Нейтрофилы, х109 /л
|
>0,8
|
<0,8
|
-
|
-
|
-
|
-
|
-
|
|
Вариант кариотипа
|
Данные цитогенетического исследования
|
||||||
|
очень хороший
|
-Y, del(11q)
|
||||||
|
хороший
|
норма, del(5q), del(12p), del(20q), двойные с del(5q)
|
||||||
|
промежуточный
|
del(7q), +8, +19, i(17q), любая другая изолированная или двойная аберрация
|
||||||
|
плохой
|
-7, inv(3)/t(3q)/del(3q); двойные с -7/del(7q), комплексное нарушение кариотипа в виде 3 аберраций
|
||||||
|
очень плохой
|
комплексный кариотип (>3 аберраций)
|
||||||
Приложение 4
к клиническому протоколу
«Диагностика и лечение пациентов (взрослое население) с миелодиспластическими синдромами» Алгоритм выбора терапии МДС на основе оценки группы риска
Приложение 5
к клиническому протоколу
«Диагностика и лечение пациентов (взрослое население) с миелодиспластическими синдромами» Шкала ECOG для оценки соматического статуса пациента
|
№ п/п
|
Баллы
|
Состояние пациента
|
|
1
|
0
|
Пациент полностью активен, способен выполнять все, как и до заболевания
|
|
2
|
1
|
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу)
|
|
3
|
2
|
Пациент лечится в амбулаторных условиях, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно – в вертикальном положении
|
|
4
|
3
|
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования
|
|
5
|
4
|
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели
|
|
6
|
5
|
Смерть
|
Приложение 6
к клиническому протоколу
«Диагностика и лечение пациентов (взрослое население) с миелодиспластическими синдромами» Алгоритм выбора режима эмпирической антибактериальной терапии у пациентов при развитии фебрильной нейтропении

Приложение 7
к клиническому протоколу
«Диагностика и лечение пациентов (взрослое население) с миелодиспластическими синдромами» Оптимальные режимы дозирования отдельных антибиотиков при системном применении у пациентов с фебрильной нейтропенией
|
№ п/п
|
Антибиотик
|
Режим дозирования
|
|
1
|
Меропенем
|
По 2,0 г каждые 8 часов в 100 мл изотонического раствора хлорида натрия внутривенно капельно в виде продленных 3-часовых инфузий
|
|
2
|
Имипенем/циластатин
|
По 1,0 г (по имипенему) каждые 6–8 часов в 100 мл изотонического раствора хлорида натрия внутривенно капельно
|
|
3
|
Дорипенем
|
По 0,5–1,0 г каждые 8 часов внутривенно капельно в виде продленных 4-часовых инфузий
|
|
4
|
Колистиметат натрия (колистин)
|
Загрузочная доза (млн МЕ) = масса тела (кг) / 7,5 (не более 12 млн МЕ), затем через 24 часа поддерживающая доза (млн МЕ) = (клиренс креатинина (мл/мин.)/10) + 2, в 2–3 введения в сутки
|
|
5
|
Пиперациллин/тазобактам
|
По 4,5 г (0,5 по тазобактаму) каждые 8 часов внутривенно капельно в виде продленных 4-часовых инфузий
|
|
6
|
Цефоперазон/сульбактам
|
По 4,0 г (2,0/2,0) каждые 12 часов внутривенно капельно в течение 60 мин.
|
|
7
|
Цефтазидим
|
Загрузочная доза 2,0 г, затем непрерывная внутривенная инфузия 6,0 г в течение 24 часов
|
|
8
|
Цефепим
|
По 2,0 г каждые 8 часов внутривенно капельно в виде продленных 3-часовых инфузий
|
|
9
|
Моксифлоксацин
|
По 400 мг каждые 24 часа внутривенно капельно в течение 60 мин.
|
|
10
|
Амикацин
|
15 мг/кг/сут каждые 24 часа внутривенно капельно в течение 60 мин.
|
|
11
|
Гентамицин
|
7 мг/кг/сут каждые 24 часов внутривенно капельно в течение 60 мин.
|
|
12
|
Клиндамицин
|
0,9 г каждые 8 часов внутривенно капельно
|
|
13
|
Ванкомицин
|
По 2,0 г через каждые 12 часов внутривенно капельно в течение 60 мин.
|
|
14
|
Линезолид
|
По 600 мг каждые 12 часов внутривенно капельно в течение 60–120 мин.
|
|
15
|
Тейкопланин
|
По 400 мг каждые 12 часов внутривенно капельно в течение 30 мин. – первые 3 дня; затем по 400 мг внутривенно капельно каждые 24 часа
|
|
16
|
Даптомицин
|
По 6 мг/кг/сут в одно введение внутривенно капельно в течение 30 мин.
|
|
17
|
Тигециклин
|
Нагрузочная доза 100 мг внутривенно; затем по 50 мг каждые 12 часов внутривенно капельно в течение 30–60 мин.
|
Приложение 8
к клиническому протоколу
«Диагностика и лечение пациентов (взрослое население) с миелодиспластическими синдромами» Оценка эффективности лечения МДС по IWG 2006
|
№ п/п
|
Результат лечения
|
Критерии
|
|
1
|
Полная ремиссия
|
КМ: <5 % бластов с нормальным созреванием всех типов клеточных линий; возможна персистирующая дисплазия; ПК: Hb >110 г/л, тромбоциты >100 х 109 /л, нейтрофилы >1,0 х 109 /л, бласты 0 %
|
|
2
|
Частичная ремиссия
|
Все критерии полной ремиссии соблюдаются за исключением того, что количество бластов в КМ снизилось на 50 % и более от исходного значения, но остается >5 %; клеточность и морфология не актуальны
|
|
3
|
Костно-мозговая ремиссия
|
КМ: <5 % бластов и их количество в процессе терапии снизилось на 50 % и более от исходного значения; ПК: если наблюдается гематологическое улучшение, его следует добавлять к костно-мозговой ремиссии
|
|
4
|
Стабилизация
|
Отсутствие клинических и лабораторных признаков прогрессирования в течение >8 недель
|
|
5
|
Без эффекта (неудача)
|
Летальный исход на фоне терапии или прогрессирование заболевания, характеризующееся углублением цитопении, увеличением процента бластов в КМ, трансформацией в более неблагоприятный вариант МДС (по сравнению с тем, что был до терапии) или острый лейкоз
|
|
6
|
Рецидив после полной или частичной ремиссии
|
Необходимо наличие хотя бы 1 из следующих признаков: процент бластов вернулся к исходному значению до лечения; снижение на 50 % и более от максимального количества гранулоцитов или тромбоцитов; снижение концентрации Hb на 15 г/л и более или присоединение зависимости от переливаний
|
|
7
|
Цитогенетический ответ
|
Полный: исчезновение хромосомных изменений и отсутствие новых Частичный: уменьшение количества клеток с хромосомными нарушениями минимум на 50 %
|
|
8
|
Прогрессирование заболевания
|
Для пациентов с количеством бластов: <5 % – увеличение на 50 % и более, т.е. более 5 %; 5–10 % – увеличение на 50 % и более, т.е. более 10 %; 10–20 % – увеличение на 50 % и более, т.е. более 20 %; 20–30 % – увеличение на 50 % и более, т.е. более 30 %. Наличие любого из следующих признаков: снижение количества гранулоцитов или тромбоцитов как минимум на 50 % от максимального значения; снижение концентрации Hb на 20 г/л и более; зависимость от переливаний
|
|
9
|
Гематологическое улучшение
|
Критерии ответа (ответ должен сохраняться не менее 8 недель)
|
|
10
|
Эритроидный ответ (исходно менее 110 г/л)
|
Повышение Hb на 15 г/л и более. Снижение абсолютного числа единиц переливаемой ЭКК, по крайней мере, на 4 единицы в течение 8 недель, по сравнению с исходным числом переливаемых единиц за предшествующие 8 недель. При оценке интенсивности переливаний ЭКК необходимо учитывать переливания, выполненные при Hb <90 г/л
|
|
11
|
Тромбоцитарный ответ (исходно менее 100 х 109 /л)
|
Абсолютное число тромбоцитов увеличивается >30 х 109 /л, при исходных значениях более 20 х 109 /л. Увеличение с менее 20 х 109 /л до более 20 х 109 /л и минимум на 100 %
|
|
12
|
Нейтрофильный ответ (исходно менее 1,0 х 109 /л)
|
Увеличение на 100 % и увеличение абсолютного числа нейтрофилов до более 0,5 х 109 /л
|
|
13
|
Гематологическое прогрессирование или рецидив
|
Доказательство хотя бы одного из следующих признаков: снижение на 50 % и более от максимального количества гранулоцитов или тромбоцитов; снижение Hb на 15 г/л и более; зависимость от переливаний
|
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.