Диагностика и лечение злокачественных новообразований: Рак поджелудочной железы
 Версия: Клинические протоколы 2006-2019 (Беларусь)
Версия: Клинические протоколы 2006-2019 (Беларусь)
Злокачественное новообразование поджелудочной железы (C25)
Онкология
Общая информация
Краткое описание
ПОСТАНОВЛЕНИЕ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ
РЕСПУБЛИКИ БЕЛАРУСЬ
6 июля 2018 г. № 60
Об утверждении клинического протокола «Алгоритмы диагностики и лечения злокачественных новообразований»
На основании подпункта 8.3 пункта 8 Положения о Министерстве здравоохранения Республики Беларусь, утвержденного постановлением Совета Министров Республики Беларусь от 28 октября 2011 г. № 1446 «О некоторых вопросах Министерства здравоохранения и мерах по реализации Указа Президента Республики Беларусь от 11 августа 2011 г. № 360», Министерство здравоохранения Республики Беларусь
ПОСТАНОВЛЯЕТ:
1. Утвердить прилагаемый клинический протокол «Алгоритмы диагностики и лечения злокачественных новообразований».
2. Начальникам главных управлений по здравоохранению областных исполнительных комитетов, председателю комитета по здравоохранению Минского городского исполнительного комитета, руководителям государственных организаций, подчиненных Министерству здравоохранения Республики Беларусь, обеспечить проведение диагностики, лечение и профилактику заболеваний в соответствии с клиническим протоколом.
3. Настоящее постановление вступает в силу после его официального опубликования.
Министр В.А.Малашко
УТВЕРЖДЕНО
Постановление
Министерства здравоохранения
Республики Беларусь
06.07.2018 № 60
КЛИНИЧЕСКИЙ ПРОТОКОЛ «Алгоритмы диагностики и лечения злокачественных новообразований»
ГЛАВА 15
РАК ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ (С25)
Классификация
ГЛАВА 1
ОБЩИЕ СВЕДЕНИЯ О TNM КЛАССИФИКАЦИИ
Система TNM для классификации злокачественных опухолей была разработана французом Р. Denoix в 1943–1952 гг. В 1953 г. Комитет по номенклатуре опухолей и статистике, организованный UICC, и Международная комиссия по стадированию рака достигли соглашения по классификации анатомической распространенности опухолей на основе системы TNM. В 1954 г. Международный противораковый союз (UICC) создает Комитет по клинической классификации и прикладной статистике, который в 1958 г. публикует первые рекомендации по клинической классификации рака молочной железы и гортани.
В результате многолетней деятельности Комитета в 1968 г. издается первая редакция TNM классификация злокачественных опухолей. По мере разработки классификации для новых локализаций опухолей и уточнения более ранних рекомендаций в 1974, 1978, 1987, 1997, 2002 и 2009 гг. публикуются 2-я, 3-я, 4-я, 5-я, 6-я и 7-я редакции.
Настоящая (8-я) редакция правил классификации и стадирования полностью соответствуют 8-й редакции руководства по стадированию рака и одобрена всеми национальными TNM комитетами.
В данном руководстве используются морфологические формы злокачественных новообразований в соответствии с классификацией МКБ-О-3, адаптированной под МКБ-10 (проставление кодов врачом-патологом в морфологическом заключении обязательно).
UICC признает необходимость постоянства TNM классификации в течение определенного периода времени, необходимого для накопления данных. Поэтому классификация не должна изменяться до тех пор, пока не будут сделаны крупные достижения в диагностике и лечении злокачественных опухолей, требующие пересмотра настоящей классификации.
Общие правила системы TNM.
TNM система для описания анатомической распространенности болезни основывается на оценке 3 компонентов:
Т – распространение первичной опухоли;
N – отсутствие или наличие метастазов в регионарных лимфатических узлах и степень их поражения;
М – отсутствие или наличие отдаленных метастазов.
К этим трем компонентам добавляются цифры, указывающие на распространенность злокачественного процесса:
Т0, Т1, Т2, Т3, Т4; N0, N1, N2, N3; M0, M1.
В действительности система является «стенографическим» описанием распространенности злокачественной опухоли.
Общие правила классификации, применяемые для опухолей всех локализаций, следующие:
Для каждой локализации имеются две классификации:
Клиническая классификация, обозначаемая TNM (или cTNM). Она основывается на результатах обследования до лечения. Эти данные получают при врачебном осмотре, лучевой диагностике, эндоскопии, биопсии, хирургическом диагностическом вмешательстве и других методах обследования.
Патологическая классификация, обозначаемая pTNM. Она основана на данных обследования до лечения, дополненных или измененных в результате хирургического вмешательства и морфологического исследования. Гистологическая оценка первичной опухоли включает резецированную опухоль или биопсию, позволяющую оценить наивысшую Т категорию. Гистологическая оценка регионарных лимфатических узлов включает исследование удаленных узлов в количестве, адекватном для установления отсутствия метастазов в регионарных лимфатических узлах (pN0) и достаточном для оценки наиболее высокой pN категории. Отдаленные метастазы должны быть подтверждены при микроскопическом исследовании (рМ).
После обозначения Т, N, М и/или рТ, pN и рМ категорий они могут группироваться по стадиям. TNM классификация и стадии, установленные однажды, должны оставаться неизменными в медицинских документах. Клиническая стадия служит основой для выбора лечения, тогда как патологическая стадия обеспечивает наиболее точные данные для оценки прогноза и расчета конечных результатов.
При сомнении в правильности оценки Т, N или М категории должно быть выбрано меньшее значение категории, (т.е. меньшее распространение опухоли).
В случае множественных опухолевых очагов в органе должна классифицироваться опухоль с более высокой Т категорией, а в скобках указываться множественность (т) или количество опухолей, например: Т2(т) или Т1(5). При одновременном поражении парных органов каждая опухоль должна классифицироваться отдельно. При опухолях печени, яичников и фаллопиевой трубы множественные очаги поражения являются критерием Т классификации.
Выявление второй опухоли в одном органе в течение 2 месяцев с момента выявления первой нужно расценивать как синхронное поражение.
TNM категории и стадия могут подразделяться или объединяться для клинических и научных целей (например, любые Т, N или М могут быть разбиты на подгруппы). Однако рекомендованные основные обозначения не должны изменяться.
Анатомические области и локализации.
Локализации в этой классификации обозначаются кодовым номером Международной классификации онкологических болезней.
TNM/pTNM классификация.
Используются следующие общие определения:
Т/рТ – первичная опухоль:
TX/рTX – первичная опухоль не может быть оценена;
Т0/рТ0 – нет доказательств первичной опухоли;
Tis/pTis – рак «in situ»;
Т1/рТ1, Т2/рТ2, ТЗ/рТЗ, Т4/рТ4 – размер или местное распространение опухоли в порядке увеличения.
N/pN – регионарные лимфатические узлы:
Nx/pNx – регионарные лимфатические узлы не могут быть оценены;
N0/pN0 – отсутствуют метастазы в регионарных лимфоузлах;
Nl/pNl, N2/pN2, N3/pN3 – возрастающее поражение регионарных лимфатических узлов.
Непосредственное распространение первичной опухоли на лимфатические узлы классифицируется как метастазы в лимфатических узлах. Метастаз в любом лимфоузле, не относящемся к регионарному, расценивается как отдаленный метастаз.
Опухолевый узел в области регионарных лимфатических узлов, не имеющий гистологических признаков лимфоузла, классифицируется как метастаз в регионарном лимфатическом узле, если имеет форму и ровный контур лимфатического узла. Опухолевый узел с неровным контуром классифицируется в рТ категории.
Когда размер является критерием pN классификации, производится измерение метастатического очага, а не всего лимфатического узла.
Случаи с микрометастазами, когда размеры метастазов не превышают 0,2 см, могут обозначаться добавлением «(mi)», например: pNl(mi) или pN2(mi).
М/рМ – отдаленные метастазы:
МХ/рМХ – отдаленные метастазы не могут быть оценены;
М0/рМ0 – нет отдаленных метастазов;
М1/рМ1 – имеются отдаленные метастазы;
Категория М может быть в дальнейшем специфицирована в соответствии со следующими обозначениями (таблица 1.1):
Таблица 1.1
| Легкие | PUL | Костный мозг | MAR |
| Кости | OSS | Плевра | PLE |
| Печень | HEP | Брюшина | PER |
| Головной мозг | BRA | Надпочечники | ADR |
| Лимфоузлы | LYM | Кожа | SKI |
| Другие | ОТН |
Подразделения TNM
Главные категории в классификации могут иметь подразделения, придающие критерию большую специфичность (например; Tla, lb или N2a, 2b).
Сигнальный лимфоузел
Это первый лимфоузел, получающий лимфу из первичной опухоли. Если в нем имеется метастаз, то и другие лимфоузлы могут быть поражены. Если этот лимфоузел не поражен, то и наличие метастазов в других узлах маловероятно. Иногда встречаются более одного сигнальных лимфоузлов.
При оценке сигнального лимфоузла применяются следующие определения:
Главные категории в классификации могут иметь подразделения, придающие критерию большую специфичность (например; Tla, lb или N2a, 2b).
Сигнальный лимфоузел
Это первый лимфоузел, получающий лимфу из первичной опухоли. Если в нем имеется метастаз, то и другие лимфоузлы могут быть поражены. Если этот лимфоузел не поражен, то и наличие метастазов в других узлах маловероятно. Иногда встречаются более одного сигнальных лимфоузлов.
При оценке сигнального лимфоузла применяются следующие определения:
- pNX(sn) – сигнальный узел не может быть оценен; pN0(sn) – нет поражения сигнального узла;
- pN1(sn) – есть поражение сигнального узла.
Отдельные опухолевые клетки
Отдельные опухолевые клетки (ITC) представляют собой единичные опухолевые клетки или маленькие кластеры клеток не более 0,2 мм в наибольшем измерении. ITC обычно не демонстрируют метастатической активности (пролиферацию или реакцию стромы) или инвазии стенок сосудистого или лимфатического синуса. Случаи с ITC в лимфатических узлах или отдаленных органах и тканях должны классифицироваться как N0 или М0 соответственно.
Это же применимо и к случаям, когда наличие опухолевых клеток или их компонентов подтверждается неморфологическими исследованиями, такими как проточная морфометрия или анализ ДНК.
Случаи с ITC должны анализироваться отдельно.
Классификация ITC:
- pN0 – гистологически не выявляются метастазы в регионарных лимфатических узлах, не проводились исследования по выявлению ITC;
- pN0(i-) – гистологически нет метастазов в регионарных лимфатических узлах, негативные морфологические данные по выявлению ITC;
- pN0(i+) – гистологически нет метастазов в регионарных лимфатических узлах, позитивные морфологические данные по выявлению ITC;
- pN0(mol-) – гистологически нет метастазов в регионарных лимфатических узлах, негативные неморфологические данные по выявлению ITC;
- pN0 (mol+) – гистологически нет метастазов в регионарных лимфатических узлах, неморфологическими методами выявляются ITC.
При исследовании ITC в сигнальном лимфоузле к обозначениям выше приведенной классификации в скобках указывается «(sn)», например: pN0(i+) (sn).
Отдельные опухолевые клетки, выявленные в костном мозгу морфологическими методами, классифицируются аналогично схеме для N, например: pM0(i+), а неморфологическими – pM0(mol+).
Гистопатологическая дифференцировка.
Это стадирование позволяет оценить степень агрессивности опухолей некоторых гистологических типов и может влиять на прогноз и выбор лечения.
Для большинства локализаций выделяется 4 степени дифференцировки опухолей:
- G1 – хорошо дифференцированные;
- G2 – умеренно дифференцированные;
- G3 – низко дифференцированные;
- G4 – недифференцированные.
При наличии различных степеней дифференцировки в опухоли указывается наименее благоприятная степень.
Саркомы костей и мягких тканей классифицируется также с использованием градаций «высокая степень» и «низкая степень» дифференцировки.
Для некоторых форм рака (молочной железы, тела матки, печени) рекомендуются специальные системы стадирования по степеням.
Дополнительные дескрипторы.
Для идентификации особых случаев в TNM/pTNM используются символы m, у, r, а.
Хотя они не влияют на группировку по стадиям, но указывают опухоли, которые должны анализироваться отдельно:
- m – используется для обозначения множественных опухолей одной локализации;
- у – в тех случаях, когда классификация приводится в течение или после проведения комбинированного (многокомпонентного) лечения, cTNM или pTNM категория обозначается префиксом «у», например: ycTNM или ypTNM. При оценке распространения опухоли до начала комбинированного лечения символ «у» не исключается;
- r – рецидив опухоли после радикального лечения при классификации обозначается префиксом «r» (rcTNM или rpTNM);
- а – применяется для обозначения классификации опухолей, впервые выявленных при аутопсии.
Необязательные дескрипторы
L – инвазия лимфатических сосудов
Классифицируется как LX, L0 и L1.
V – инвазия вен
Классифицируется как VX, VO, VI (микроскопическая инвазия) и V2 (макроскопическая инвазия). Макроскопическое вовлечение стенки вены при отсутствии опухоли в просвете сосуда классифицируется как V2.
С-фактор
С-фактор или «фактор надежности» отражает достоверность классификации с учетом использованных методов диагностики. Его использование не является обязательным.
Определения С-фактора:
- С1 – данные стандартных диагностических методов (осмотр, пальпация, рентгенологическое исследование, эндоскопическое исследование),
- С2 – данные, полученные при использовании специальных диагностических методов (рентгенологическое исследование в специальных проекциях, томография, компьютерная томография, ультразвуковое исследование, лимфография, ангиография, сцинтиграфия, магнитно-резонансная томография, ПЭТ/КТ, эндоскопия, биопсия, цитологическое исследование);
- С3 – данные хирургического диагностического вмешательства, включая биопсию и цитологическое исследование;
- С4 – данные, полученные после радикальной операции и гистологического исследования удаленного препарата;
- С5 – данные патологоанатомического вскрытия.
Степени С-фактора могут использоваться при описании категорий Т, N и М (например: Т3С2, N2C1, М0С2).
Клиническая классификация TNM соответствует CI, С2 и С3 степеням, тогда как pTNM эквивалентна С4.
Классификация остаточных опухолей (R)
TNM/pTNM классификация описывает анатомическую распространенность опухоли без рассмотрения вопросов лечения. R-классификация описывает статус опухоли после лечения. Она отражает эффект лечения и является прогностическим фактором. При R- классификации оценивается не только первичная опухоль, но и остающиеся отдаленные метастазы.
Эта классификация может применяться после хирургического лечения, лучевой или химиотерапии, а также после комбинированного лечения. После консервативного лечения остаточная опухоль оценивается клиническими методами. После хирургического лечения R-классификация требует тесного сотрудничества хирурга и морфолога.
Случаи с макроскопически определяемой остаточной опухолью (R2) могут подразделяться на R2a (без микроскопического подтверждения) и R2b (микроскопически подтвержденные).
R0 группа может включать пациентов как с М0, так и с Ml. В последнем случае отдаленные метастазы, как и первичная опухоль, должны быть полностью удалены. Трудности с R-классификацией могут возникнуть при удалении опухоли по частям, а не «en blok». В таких случаях уместна категория RX.
Наличие микроскопически определяемой инвазивной опухоли по линии резекции классифицируется как R1, а в случае неинвазивной карциномы – R1 (is).
Группировка по стадиям
Комбинация всех значений дескрипторов TNM позволяет получить 24 категории TNM, описывающие распространенность опухоли. Для табличного представления данных и анализа эти категории объединяются в ограниченное количество групп – стадий. Каждая стадия более или менее однородна по прогнозу и критерию выживаемости относящихся к ней пациентов.
Карцинома «in situ» относится к стадии 0, а опухоли с отдаленными метастазами – к стадии IV (за исключением некоторых локализаций, например, папиллярного и фолликулярного рака щитовидной железы).
Для патологической стадии необходимо морфологическое исследование достаточного количества тканей, позволяющее оценить наибольшее значение Т и N. Если же имеется морфологическое подтверждение отдаленных метастазов, то и классификация (рМ1) и стадия являются патологическими.
Термин «стадия» употребляется только для комбинаций Т, N, М или рТ, pN или рМ категорий. Необходимо избегать выражений типа «Т стадия» или «N стадия»
РАК ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ (С25)
15.2. Гистологическая классификация (ВОЗ 2010).
Таблица 15.2. Гистологическая классификация (ВОЗ 2010)
| 8041/3 | Мелкоклеточная карцинома, БДУ |
| 8042/3 | Овсяноклеточная карцинома |
| 8043/3 | Мелкоклеточная карцинома |
| 8044/3 | Мелкоклеточная карцинома, промежуточноклеточный вариант |
| 8045/3 | Комбинированная мелкоклеточная карцинома (рак) |
| 8046/3 | Немелкоклеточная карцинома |
| 8070/2 | Плоскоклеточная карцинома in situ, БДУ |
| 8070/3 | Плоскоклеточная карцинома, БДУ |
| 8140/3 | Аденокарцинома, БДУ |
| 8141/3 | Скиррозная аденокарцинома |
| 8144/3 | Аденокарцинома, кишечный тип |
| 8145/3 | Карцинома, диффузный тип |
| 8148/2 | Протоковая интраэпителиальная неоплазия III степен/и |
| 8154/3 | Смешанная ацинарно-эндокринная карцинома |
| 8154/3 | Смешанная протоково-эндокринная карцинома |
| 8214/3 | Париетально-клеточная карцинома |
| 8246/3 | Нейроэндокринная карцинома БДУ |
| 8255/3 | Смешанноклеточная аденокарцинома |
| 8260/3 | Паппилярная аденокарцинома, БДУ |
| 8310/3 | Светлоклеточная аденокарцинома, БДУ |
| 8320/3 | Зернистоклеточная карцинома |
| 8430/3 | Мукоэпидермоидная карцинома |
| 8441/3 | Серозная цистоаденокарцинома |
| 8452/3 | Солидная псевдопапиллярная карцинома |
| 8453/2 |
Внутрипротоковая папиллярно-муцинозная карцинома неинвазивная
|
| 8453/3 | инвазивная |
| 8470/3 | Муцинозная цистоаденокарцинома |
| 8480/3 | Муцинозная аденокарцинома |
| 8481/3 | Муцинопродуцирующая аденокарцинома |
| 8490/3 | Перстневидноклеточная карцинома |
| 8500/3 | Протоковая аденокарцинома |
| 8550/3 | Ацинарноклеточная карцинома |
| 8551/3 | Ацинарноклеточная цистоаденокарцинома |
| 8560/3 | Железисто-плоскоклеточная карцинома |
| 8971/3 | Панкреатобластома |
15.3. TNM классификация (8-я редакция, 2017 г.).
15.3.1. Правила классификации.
Классификация применима к ракам экзокринного отдела и нейроэндокринных опухолей поджелудочной железы, включая карцинойды. Должно быть гистологическое или цитологическое подтверждение заболевания.
Процедурами оценки категории Т, N и М является следующее:
Категории T Физикальное обследование, методы визуализации и/или интраоперационное исследование
Категории N Физикальное обследование, методы визуализации и/или интраоперационное исследование
Категории M Физикальное обследование, методы визуализации и/или интраоперационное исследование
15.3.2. Анатомические части.
С.25.0 Головка поджелудочной железы1
С25.1 Тело поджелудочной железы2
С25.2 Хвост поджелудочной железы3
С25.3 Проток поджелудочной железы
С25.4 Панкреатический островок (островок Лангерганса) (эндокринная часть поджелудочной железы)
Внимание:
1. К опухолям головки поджелудочной железы относятся опухоли, возникающие в зоне, расположенной справа от левого края верхней мезентериальной вены. Крючковидный отросток является частью головки.
2. К опухолям тела поджелудочной железы относятся опухоли, возникающие в зоне, ограниченной левым краем верхней мезентериальной вены и левым краем аорты.
3. К опухолям хвоста поджелудочной железы относятся опухоли, возникающие в зоне, ограниченной левым краем аорты и воротами селезенки.
15.3.3. Регионарные лимфатические узлы.
Регионарными узлами являются перипанкреатические узлы, которые можно подразделить на следующие:
Область головки поджелудочной железы
Для опухолей в области головки поджелудочной железы – лимфатические узлы вдоль общего желчного протока, общей печеночной артерии, воротной вены, пилорические, нижнепилорические, подпилорические, проксимальные брыжеечные, чревные, задние и передние панкреатодуоденальные, и вдоль верхней брыжеечной вены и правой боковой стенки верхней брыжеечной артерии.
Область тела и хвоста
Регионарные лимфатические узлы располагаются вдоль общей печеночной артерии, чревного ствола, селезеночной артерии и ворот селезенки, а также забрюшинные лимфатические узлы и по боковой поверхности аорты.
15.3.4. Клиническая классификация TNM.
15.3.4.1. Т – первичная опухоль
TX Первичная опухоль недоступна оценке
Т0 Нет признаков первичной опухоли
Tis Рак in situ
Т1 Опухоль 2 см или меньше в наибольшем измерении
T1a Опухоль 0,5 см или менее в наибольшем измерении
T1b Опухоль больше 0,5 см и менее 1 см в наибольшем измерении
T1c Опухоль больше 1 см, но не более 2 см в наибольшем измерении
Т2 Опухоль больше 2 см, но не более 4 см в наибольшем измерении
Т3 Опухоль больше 4 см в наибольшем измерении
Т4 Опухоль вовлекает в себя чревный ствол, верхнюю брыжеечную или общую печеночную артерию
Внимание: Tis включает также классификацию «PanIN-III».
15.3.4.2. N – регионарные лимфатические узлы.
NX регионарное метастазирование недоступно оценке
N0 нет признаков метастатического поражения регионарных лимфатических узлов
N1 имеется поражение в 1-го или 3-х регионарных лимфатических узлов метастазами
N2 метастазы в 4-х или более регионарных лимфатических узлах
15.3.4.3. М – отдаленные метастазы.
М0 отсутствие отдаленного метастазирования
М1 наличие отдаленного метастазирования
15.3.5. Патологическая классификация pTNM.
Категории pT и pN соответствуют категориям T и N.
pM1 – отдаленный метастаз, подтвержденный микроскопически
Внимание: *pM0 и pMX являются недействующими категориями.
pN0 Гистологическое заключение о состоянии регионарных лимфоузлов должно быть основано на исследовании 12 или более лимфатических узлов. Если в исследованных лимфатических узлах нет метастазов, случай классифицируется как pN0.
15.3.6. Гистопатологическая дифференцировка G.
GX - Степень дифференцировки не может быть оценена
G1 - Высокая степень дифференцировки
G2 - Умеренная степень дифференцировки
G3 - Низкая степень дифференцировки
G4 - Недифференцированный рак
15.3.7. Группирование по стадиям
Таблица 15.3. Группирование по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия IA | T1 | N0 | M0 |
| Стадия IB | T2 | N0 | M0 |
| Стадия IIA | T3 | N0 | M0 |
| Стадия IIB | T1-3 | N1 | M0 |
| Стадия III |
T1-3 T4 |
N2 Любая N |
M0 M0 |
| Стадия IV | Любая Т | Любая N | M1 |
Эпидемиология
15.1. Основные статистические показатели С25
Таблица 15.1
| Показатель | Число | |
| 2011 | 2016 | |
| Число вновь выявленных случаев заболевания | 992 | 1083 |
| Заболеваемость на 100 000 населения (грубый интенсивный показатель) | 10,5 | 11,4 |
|
Диагноз установлен в I стадии заболевания (% к вновь выявленным
случаям)
|
6,6 | 3,9 |
|
Диагноз установлен в II стадии заболевания (% к вновь выявленным
случаям)
|
27,1 | 20,3 |
|
Диагноз установлен в III стадии заболевания (% к вновь выявленным
случаям)
|
24,7 | 19,9 |
|
Диагноз установлен в IV стадии заболевания (% к вновь выявленным
случаям)
|
41,6 | 55,9 |
|
Прожили менее года с момента установления диагноза из числа
заболевших в предыдущем году (одногодичная летальность в %)
|
78,2 | 72,2 |
| Умерло от злокачественных новообразований | 839 | 890 |
| Смертность на 100 000 населения Грубый интенсивный показатель | 8,9 | 9,4 |
| Отношение смертности к заболеваемости в % (интенсивные показатели) | 84,8 | 82,5 |
| Число пациентов, состоящих на учете на конец года | 865 | 1001 |
| Из них состоящих на учете 5 и более лет, % | 29,1 | 24,7 |
Факторы и группы риска
15.4. Прогностические факторы риска рака поджелудочной железы
Таблица 15.4. Прогностические факторы риска рака поджелудочной железы
|
Прогностический фактор
|
Связанные с опухолью
|
Связанные с пациентом |
Связанные с внешнем воздействием
|
| обязательный |
Отдаленные метастазы
|
ЕСOG статус |
Послеоперационная резекция
Остаточная болезнь или
состояние ложе удаленной
опухоли, края отсечения (R0,
R1, R2)
|
| дополнительный |
Метастазы в лимфоузлах;
Повышение С19-9
|
Послеоперационная летальность | Адъювантная терапия |
| ожидаемый | экспрессия hENT1 |
Прогностическая шкала Глазго (С-реактивный белок и альбумин)
Соотношение нейтрофилов и лимфоцитов (NLR)
|
Ответ на неоадьювантную терапию
|
Диагностика
15.5. Диагностические мероприятия
15.5.1. Обязательный объем обследования
План обследования включает изучение жалоб и анамнеза заболевания, общее физикальное обследование, пальцевое исследование прямой кишки, осмотр гинеколога у женщин, стандартные лабораторные тесты (группа крови, резус-фактор, анализ крови на сифилис (реакция микропреципитации), общий анализ крови, общий анализ мочи, биохимическое исследование крови (белок, креатинин, мочевина, билирубин, АсАТ, АлАТ, щелочная фосфатаза, амилаза, глюкоза, электролиты – K, Na, Ca, Cl), коагулограмма – по показаниям); функциональные тесты, состав которых определяется выраженностью сопутствующей патологии (ЭКГ, исследование функции внешнего дыхания, эхокардиография, холтеровское мониторирование, исследование ФВД, УЗИ сосудов (вен нижних конечностей, ультразвуковая допплерография сосудов и т.д.), а также консультация узких специалистов (по показанием с учетом сопутствующей патологии), амилаза панкреатическая крови.
Опухолевый маркер – СА 19-9 определяется при условии нормального уровня билирубина и отсутствии признаков холангита. CA19-9 не является специфичным и имеет ограниченную диагностическую ценность (зависит от размера опухоли, состояния генотипа Levis, повышен при билиарной гипертензии любой этиологии), хотя его исходное исследование может быть полезным для оценки эффективности терапии и при наблюдении.
15.5.2. Инструментальные методы исследования
- УЗИ органов брюшной полости, забрюшинного пространства.
- Компьютерная томографию с ангиоконтрастированием органов брюшной полости и забрюшинного пространства (динамическое трехфазное исследование).
- Фиброгастродуоденоскопия.
- Рентгенография органов Грудной клетки.
По показанием выполняются:
- магнитно-резонансная томография (далее – МРТ);
- магнитно-резонансная холангиопанкреатография (далее – МРХПГ);
- эндоскопическое ультразвуковое исследование (ЭУЗИ);
- компьютерная томография органов Грудной клетки;
- ультразвуковое доплеровское исследование чревного ствола и его ветвей, воротной вены, мезентериальных сосудов;
- УЗИ органов брюшной полости, забрюшинного пространства, малого таза и надключичных зон (при подозрении на метастатическое поражение);
- рентгенологическое исследование желудка и 12-перстной кишки;
- биопсия опухоли (чрескожная тонкоигольная аспирационная биопсия опухоли под КТ, УЗИ контролем; тонкоигольная аспирационная биопсия опухоли под эндоУЗИ-контролем);
- эндоскопическая ретроградная холангиопанкреатикография (далее – ЭРХПГ);
- чрескожная чреспеченочная холангиография (далее – ЧЧХГ);
- фиброколоноскопия;
- ирригоскопия;
- лапароскопия;
- торокоскопия;
- лапароскопическое исследование показано для исключения диссеминации по брюшине. Обязательный элемент – биопсия брюшины с морфологическим исследованием, а также цитологическое исследование промывных вод брюшной полости для выявления диссеминации опухоли по брюшине и/или свободных опухолевых клеток в перитонеальных смывах. Лапароскопия не проводится, если планируется паллиативные хирургические вмешательства;
- пункция патологических образований под контролем УЗИ с последующим морфологическим исследованием;
- стернальная пункция или трепан-биопсия подвздошной кости (при подозрении на метастатическое поражение костного мозга);
-
ФДГ ПЭТ-КТ по показанием.
15.6. Алгоритм предоперационного обследования, стадирования опухолевого процесса и определение лечебной тактики
Таблица 15.5. Алгоритм предоперационного обследования
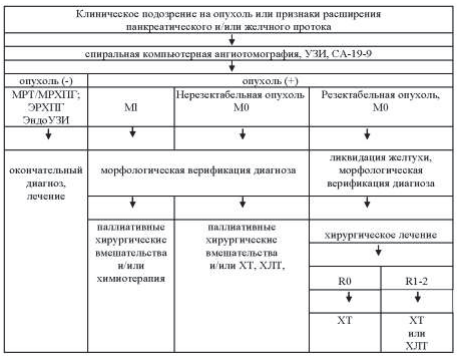
Критерии резектабельности рака ПЖ: наличие прослойки ткани между опухолью и сосудами (верхнебрыжеечная артерия, чревный ствол/общая печеночная артерия), а также свободная зона слияния верхнебрыжеечной и селезеночной вен.
Критерии пограничной резектабельности рака ПЖ: инфильтрация опухолью верхнебрыжеечной артерии на 180° по окружности и менее; инвазия короткого сегмента общей печеночной артерии (обычно в области отхождения желудочно-двенадцатиперстной артерии); окклюзия короткого сегмента верхнебрыжеечной/ портальной вены с удобным для резекции и реконструкции расположением сосудов выше и ниже.
Критерии нерезектабельности рака ПЖ: инфильтрация опухолью верхнебрыжеечной артерии на 180° по окружности и более; инфильтрация опухолью чревного ствола на 180° по окружности и более; окклюзия верхнебрыжеечной/ портальной вены без возможности реконструкции сосудов.
15.7. Наблюдение, сроки и объем обследования
Режим наблюдения:
- 1-й год – 1 раз в 3 мес.
- 2-й год – 1 раз в 6 мес.
В последующем, пожизненно – 1 раз в год.
Объем наблюдения:
- физикальное обследование;
- лабораторное исследование;
- опухолевый маркер СА 19-9;
- инструментальное исследование (ультразвуковое исследование брюшной полости, забрюшинного пространства и малого таза, рентгенологическое исследование легких);
- по показаниям: фиброколоноскопия, ирригоскопия, компьютерная томография, МРТ, сцинтиграфия костей скелета, лапароскопия.
Лечение
15.6.1. Общие принципы лечения
Лечение рака поджелудочной железы (далее – ПЖ) может быть хирургическим, химиотерапевтическим, химиолучевым, комбинированным или симптоматическим. В выборе метода лечения рака ПЖ исходят из данных предоперационной инструментальной оценки наиболее вероятной морфологической сущности опухоли, ее резектабельности, учитывают возраст пациента, их соматический статус, наличие таких осложнений заболевания, как механическая желтуха, нарушение эвакуации из желудка или кишечная непроходимость. Важнейшим фактором является локализация опухоли, предрасполагающая различный объем операции.
Все современные методы хирургического лечения рака ПЖ можно подразделить на радикальные и паллиативные.
Радикальное хирургическое лечение пациентов раком ПЖ основано на применении следующих хирургических операций:
Гастропанкреатодуоденальная (проксимальная, панкреато-дуоденальная) резекция (далее – ГПДР).
Панкреатэктомия (тотальная панкреатикодуоденэктомия).
Дистальная (левосторонняя, корпорокаудальная или субтотальная) резекция поджелудочной железы.
Стандартная ГПДР (Padrazzoli S. et al., 1999) включает пересечение ПЖ в области перешейка приблизительно в 1 см от опухоли, холецистэктомию и пересечение общего желчного протока выше впадения пузырного, пересечение желудка на Границе дистальных его двух третей или двенадцатиперстной кишки ниже привратника на 1,5–2 см. Дистальной Границей резекции является первая петля тощей кишки, что позволяет подвести ее к культе поджелудочной железы без натяжения. В удаляемый комплекс включают следующие Группы лимфатических узлов:
- лимфатические узлы правой стороны гепатодуоденальной связки – верхние и нижние лимфоузлы общего желчного протока и вокруг пузырного протока (N 12b1, 12b2, 12c);
- задние панкреатодуоденальные лимфатические узлы (N 13a, 13b);
- лимфатические узлы правой стороны верхней брыжеечной артерии от ее устья у аорты до уровня нижней панкреатодуоденальной артерии (N 14a,14b);
- передние панкреатодуоденальные лимфатические у злы (N 17a,17b); дополнительно иссекаются лимфоузлы переднее-верхней области общей печеночной артерии (N 8 а).
Пилоросохраняющая панкреатодуоденальная резекция (далее – ППДР). В настоящее время четких показаний к выполнению ППДР нет. Данный вид оперативного вмешательства не стоит выполнять при наличии у пациента сопутствующей язвенной болезни желудка, при распространении опухоли на желудок и на луковицу двенадцатиперстной кишки, при невозможности выполнить адекватный объем лимфодиссекции инфрапилорических лимфатических узлов.
Дистальная резекция поджелудочной железы выполняется при локализации опухоли в ее хвосте и/или теле. Такая локализация встречается у 15–25 % пациентов раком ПЖ. В соответствии с закономерностями локорегионарного распространения рака тела и хвоста ПЖ при нем осуществляется дистальная резекция ПЖ с удалением селезенки. Даже при поражении только хвоста ПЖ резекция должна включать и тело, и хвост. В соответствии с консенсусом, достигнутый Группой широко известных европейских специалистов в области хирургии рака ПЖ (Pedrazzoli S. et al., 1999), стандартная дистальная резекция поджелудочной железы – это резекция дистальных отделов железы, дополненная спленэктомией, при которой поджелудочная железа пересекается справа от верхней брыжеечной или воротной вены с пересечением селезеночной артерии у ее устья, пересечением нижней брыжеечной вены и селезеночной вены непосредственно у конфлюенса воротной вены. Эта операция дополняется удалением лимфатических узлов в соответствии с анатомической классификацией следующих Групп:
- вокруг чревного ствола (N9);
- в воротах селезенки (N10);
- вдоль селезеночной артерии (N11);
-
по нижнему краю тела и хвоста железы (N18).
Тотальная дуоденопанкреатэктомия (далее – ТДПЭ).
Показания для выполнения ТДПЭ:
- диффузное поражение ПЖ раком (6 %);
- мультицентрический рост опухоли (12 %);
- распространение рака головки ПЖ на ее тело (или выявление опухолевых клеток по Границе резекции при срочном интраоперационном морфологическом исследовании после завершения ПДР);
- патологические изменения культи ПЖ и главного панкреатического протока, не позволяющие наложить панкреатикодигестивный анастомоз или выполнить его окклюзию.
Выполнение ТДПЭ включает соответствующие этапы ГПДР и дистальной резекции ПЖ. В типичных случаях весь комплекс выделяется единым блоком. Как и ГПДР, экстирпация ПЖ не обязательно должна сопровождаться резекцией желудка; возможно использование методики операции с сохранением желудка и привратника. В процессе мобилизации ПЖ ключевое значение имеют выделение, изолированная перевязка и пересечение селезеночной артерии вблизи ее устья и селезеночной вен вблизи ее слияния с верхней брыжеечной веной.
Реконструктивный этап менее сложен, чем при ГПДР включает создание лишь двух анастомозов – билиодигестивного и желудочно-кишечного, методика формирования которых соответствует применяемой при ГПДР.
Любые виды хирургических операций выполняются после купирования механической желтухи при цифрах общего билирубина в крови пациентов ниже 100 мкмоль/л.
15.6.2. Паллиативные операции при раке ПЖ
Низкая резектабельность при раке ПЖ делает практически неизбежным применение ряда паллиативных вмешательств, имеющих симптоматический смысл и облегчающий самочувствие и состояние пациентов. Из всего многообразия клинического проявления рака ПЖ паллиативные хирургические вмешательства, как правило, выполняются только при трех наиболее тяжелых осложнениях заболевания: механической желтухе, дуоденальной непроходимости, нестерпимых (некупируемых) болях.
Билиарная декомпрессия при механической желтухе
Показания:
- как первый этап лечения пациентов резектабельным раком ПЖ, осложненным механической желтухой;
- при нерезектабельном раке ПЖ, но при отсутствии внутрипеченочных метастазов, разобщающих сегментарные желчные протоки в обеих долях печени.
При выборе метода желчеотведения необходимо учитывать следующее:
- уровень опухолевой обструкции билиарного дерева.
- распространенность опухолевого поражения и состояние пациента, т.е. планируется ли после билиарной декомпрессии удаление опухоли;
- прогнозируемое время жизни пациента после желчеотведения, если радикальная операция не планируется;
- угроза осложнений и качество технологического исполнения того или иного метода желчеотведения.
-
Интраоперационные методы декомпрессии желчных протоков.
Применяемые в настоящее время билиодигестивные анастомозы:
- холецистоеюноанастомоз;
- холецистогастроанастомоз;
- холецистодуоденоанастомоз;
- холедоходуоденоанастомоз;
- холедохоэнтнроанастомоз;
-
гепатикоэнтероанастомоз.
Анастомозы с желчным пузырем наиболее просты и безопасны. Однако формирование его может быть выполнено только при достаточно высоком (более 1 см от края опухолевой инвазии) уровне впадения пузырного протока в общий желчный.
Анастомозы с общим желчным протоком являются более сложным и рискованным видом желчной декомпрессии при нерезектабельном раке ПЖ.
Гепатикоеюноанастомоз имеет наиболее широкие показания. При этом в соустье с тощей кишкой может участвовать как общий печеночный проток, так и печеночные протоки более мелкого калибра. Анастомоз лучше формировать с мобилизованной по Ру петлей тощей кишки, т. к. практически исключает рецидив желтухи и холангит в позднем периоде. Указанный анастомоз предпочтителен среди пациентов неоперабельным билиопанкреатодуоденальным раком, осложненным механической желтухой, с прогнозируемым временем жизни пациента более 6 месяцев.
Выполнение холецистогастро- и холецистодуоденоанастамоза допустимы лишь в единичных случаях в качестве вынужденного вмешательства: например, при обширном метастазировании опухоли в лимфатические узлы корня брыжейки тонкой кишки, а также при крайне тяжелом состоянии пациентов, когда нужно максимально сократить продолжительность операции.
Наружное дренирование выполняется в виде:
- холецистостомии (может осуществляться как лапароскопическая холецистостомия (ЛХС), так и чрескожная чреспеченочная холецистостомия под контролем УЗИ, КТ);
- гепатикостомии;
- эндоскопическое билиарное дренирование и стентирование;
-
чрескожного чреспеченочного дренирования желчных протоков.
Этот тип оперативного вмешательства крайне неблагоприятен у тяжелых пациентов, так как заведомо обрекает их на существование наружного желчного свища. Однако, иногда эта операция является единственно возможным способом сохранения жизни пациентам.
Для устранения непроходимости двенадцатиперстной кишки используют в основном гастроэнтероанастомоз. Более оправдано применение переднего впередиободочного гастроэнтероанастомозана длинной петле с межкишечным соустьем, что продиктовано опасностью инвазивного роста опухоли или ее метастазирования в брыжейку поперечной ободочной кишки и возможным вовлечением в неопластический процесс созданного соустья.
15.6.3. Химиотерапия
- Кальция фолинат 20 мг/м2 в вену в течение 10 мин., затем 5-фторурацил 425 мг/м2 в вену в течение 10 мин. Препараты вводят в 1-й, 2-й, 3-й, 4-й и 5 дни. 6 курсов. Интервал между курсами 4 недели.
- Гемцитабин 1000 мг/м2 (инфузия в вену в течение 30 минут) 1, 8, 15-й дни 6 курсов. Интервал между курсами 4 недели.
- Гемцитабин 1000 мг/м2 (инфузия 30 минут) раз в неделю в течение 7 недель. После 2-недельного перерыва 3 еженедельных введения, 2-недельный перерыв, 3 еженедельных введения и т.д.
- GEMCAR: гемцитабин 1000 мг/м2 (инфузия в вену в течение 30 минут) 1, 8, 15-й дни + капецитабин 800 мг/м2 внутрь 2 раза в сутки в течение 21 дня. Интервал между курсами 1 неделя.
- Капецитабин 1250 мг/м2 внутрь 2 раза в сутки в течение 14 дней. Интервал между курсами 1 неделя.
- FOLFIRINOX: оксалиплатин 85 мг/м2 в вену в течение 2 часов, затем кальция фолинат 400 мг/м2 в вену в течение 2 часов, через 30 минут иринотекан 180 мг/м2 в вену в течение 90 минут через Y-коннектор, затем 5-фторурацил 400 мг/м2 в вену струйно, затем инфузия 400 мг/м2 в течение 46 часов. Повторные курсы через 2 недели.
15.6.4. Адъювантная химиолучевая терапия
Химиотерапия: 5-фторурацил вводят в/в струйно в дозе 500 мг/м2 в 1–3 дни первой и последней (обычно 1-й и 5-й) недель лучевой терапии.
Дистанционная лучевая терапия проводится РОД 1,8–2 Гр, СОД 45–46 Гр на послеоперационное ложе опухоли, проекцию регионарных лимфатических узлов; хирургические анастомозы. Дополнительно 5–9 Гр на ложе опухоли и хирургические анастомозы по клиническим показаниям. Ложе опухоли и края резекции определяются по данным предоперационной компьютерной томографии, по локализации скрепочного шва, маркировке Границ клипсами во время операции. В случаях выполнения хирургического вмешательства адъювантная химиолучевая терапия проводится через 6–8 недель после операции.
15.6.5. Химиолучевая терапия по радикальной программе
Химиотерапия: 5-фторурацил вводят в/в струйно в дозе 500 мг/м2 в 1–3 дни первой и последней (обычно 1-й и 5-й) недель лучевой терапии.
Дистанционная лучевая терапия проводится РОД 1,8–2 Гр, СОД 45–50,4 Гр на первичный очаг и зоны регионарного метастазирования. СОД может быть увеличена до 54–59,4 Гр с учетом толерантности нормальных тканей и критических органов.
15.6.6. Паллиативная лучевая терапия
Дистанционная лучевая терапия проводится РОД 2,4–5 Гр, СОД 25–36 Гр на первичный очаг. Паллиативная лучевая терапия проводится пожилым пациентам, при наличии болевого синдрома и невозможности проведения лучевой терапии по радикальной программе в связи с сопутствующей патологией.
Предлучевая подготовка
При симуляции и лечении положение пациента «лежа на спине», руки подняты вверх, пероральное контрастирование (барий не используется).
При раке головки поджелудочной железы дистанционная лучевая терапия проводится на область поджелудочно-двенадцатиперстных, надподжелудочных и чревных лимфоузлов, ворот печени, петли двенадцатиперстной кишки, на область первичной опухоли с отступом в пределах 1–3 см.
При раке тела и хвоста поджелудочной железы дистанционная лучевая терапия проводится на область поджелудочно-двенадцатиперстных, воротных, латеральных надподжелудочных лимфоузлов, лимфоузлов ворот селезенки и на область первичной опухоли с отступом в пределах 1–3 см.
Облучение ворот печени и ложа селезенки не требуется.
Лучевая нагрузка на критические органы должна удовлетворять следующим условиям:
Структура. Радикальная лучевая терапия. Адъювантная лучевая терапия Почки (правая и левая). Не более 30 % от общего объема должно получить менее 18 Гр. Если функционирует только одна почка, то не более 10 % объема должно получить менее 18 Гр. Если две функционирующие почки входят в зону облучения, то не более 50 % правой и не более 65 % левой почки должно получить менее 18 Гр. Для IMRT плана средняя доза на обе почки должна быть менее 18 Гр.
Желудок, двенадцатиперстная кишка, кишечник. Максимальная доза не должна превышать 55 Гр и не более 30 % от общего объема органа может быть между 45–55 Гр при проведении лучевой терапии по радикальной программе.
Максимальная доза не должна превышать 55 Гр и не более 10 % от всего объема органа может быть между 50–53,99 Гр. Менее 15 % от всего объема органа должно быть между 45–49,99 Гр при проведении лучевой терапии в адъювантном режиме.
Печень. Средняя доза не должна превышать 30 Гр при проведении лучевой терапии по радикальной программе. Средняя доза не должна превышать 25 Гр при проведении лучевой терапии в адъювантном режиме.
Спинной мозг. Максимальная доза не должна превышать 45 Гр при проведении лучевой терапии по радикальной программе. Максимальная доза не должна превышать 45 Гр при проведении лучевой терапии в адъювантном режиме.
15.6.7. Лечение по стадиям
- Стадия IA-В. Хирургическое лечение. Адъювантная химиотерапия (6 курсов химиотерапии по схеме 5-фторурацил+лековарин; гемцитабин; GEMCAP). Химиолучевая терапия при R1 резекции.
- Стадия IIA-B, III. Хирургическое лечение при резектабельных опухолях. Адъювантная химиотерапия (6 курсов химиотерапии по схеме 5-фторурацил + лековарин; гемцитабин; GEMCAP). Химиолучевая терапия при нерезектабельных, а также в случаях при R1-2 резекции. Паллиативные хирургические вмешательства.
- Стадия IV. Химиотерапия. Паллиативные хирургические вмешательства. Симптоматическая терапия.
- Рецидив рака ПЖ. Химиотерапия. Паллиативные хирургические вмешательства. Химиолучевая терапия.
Информация
Источники и литература
-
Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2006-2019
- Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2006-2019 -
-
www.minzdrav.gov.by
- www.minzdrav.gov.by -
Информация
ГЛАВА 2
ОЦЕНКА ОБЩЕГО СОСТОЯНИЯ ОНКОЛОГИЧЕСКОГО ПАЦИЕНТА
Общее состояние онкологического пациента (Performance status) рекомендовано оценивать по индексу Карновского (0–100 баллов) или шкале ECOG (0–4 балла) (таблицы 2.1, 2.2).
Таблица 2.1. Индекс Карновского
Таблица 2.1. Индекс Карновского
|
Нормальная физическая активность, пациент не нуждается в специальном уходе
|
100 баллов | Состояние нормальное, нет жалоб и симптомов заболевания |
| 90 баллов | Нормальная активность сохранена, но имеются незначительные симптомы заболевания | |
| 80 баллов | Нормальная активность возможна при дополнительных усилиях, при умеренно выраженных симптомах заболевания | |
|
Ограничение нормальной активности при сохранении полной независимости пациента
|
70 баллов | Пациент обслуживает себя самостоятельно, но не способен к нормальной деятельности или работе |
| 60 баллов | Пациент иногда нуждается в помощи, но в основном обслуживает себя сам | |
| 50 баллов | Пациенту часто требуется помощь и медицинское обслуживание | |
|
Пациент не может обслуживать себя самостоятельно, необходим уход или госпитализация
|
40 баллов | Большую часть времени пациент проводит в постели, необходим специальный уход и посторонняя помощь |
| 30 баллов | Пациент прикован к постели, показана госпитализация, хотя терминальное состояние не обязательно | |
| 20 баллов | Сильные проявления болезни, необходима госпитализация и поддерживающая терапия | |
| 10 баллов | Умирающий пациент, быстрое прогрессирование заболевания | |
| 0 баллов | Смерть |
Таблица 2.2. Оценка статуса пациента по шкале ECOG
| Оценка | |
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания (90–100 баллов по шкале Карновского) |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70–80 баллов по шкале Карновского) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно – в вертикальном положении (50–60 баллов по шкале Карновского) |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования (30–40 баллов по шкале Карновского) |
| 4 | Пациент, совершенно не способен к самообслуживанию, прикован к креслу или постели (10–20 баллов по шкале Карновского) |
Приложение
ТАБЛИЦЫ СООТВЕТСТВИЯ «СТАДИЯ-TNM» ДЛЯ РЯДА ЛОКАЛИЗАЦИЙ: ТОНКИЙ КИШЕЧНИК, АМПУЛА ФАТЕРОВА СОСКА, ТИМОМА, МЕЗОТЕЛИОМА ПЛЕВРЫ, КАРЦИНОМА МЕРКЕЛЯ КОЖИ, КОРА НАДПОЧЕЧНИКА
ТОНКИЙ КИШЕЧНИК C17
Таблица 1. Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1, Т2 | N0 | M0 |
| Стадия IIА | Т3 | N0 | M0 |
| Стадия IIB | T4 | N0 | M0 |
| Стадия IIIA | Любая Т | N1 | M0 |
| Стадия IIIB | Любая Т | N2 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
АМПУЛА ФАТЕРОВА СОСКА C24.1
Таблица 2. Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия IA | Т1a | N0 | M0 |
| Стадия IB | Т1b, Т2 | N0 | M0 |
| Стадия IIА | Т3a | N0 | M0 |
| Стадия IIB | Т3b | N0 | M0 |
| Стадия IIIA | Т1a, Т1b, Т2, T3 | N1 | M0 |
| Стадия IIIB | Т4 | Любая N | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
ТИМОМА C37, C38.1-3
Таблица 3. Группировка по стадиям
| Стадия I | T1 | N0 | M0 |
| Стадия II | T2 | N0 | M0 |
| Стадия IIIА | T3 | N0 | M0 |
| Стадия IIIB | T4 | N0 | M0 |
| Стадия IVA | Любая Т |
N1
N0, N1
|
M0
M1A
|
| Стадия IVB | Любая Т | Любая N | M1B |
МЕЗОТЕЛИОМА ПЛЕВРЫ C45.0
Таблица 4. Группировка по стадиям
| Стадия IA | T1 | N0 | M0 |
| Стадия IB | T2, T3 | N0 | M0 |
| Стадия II | T1, T2 | N1 | M0 |
| Стадия IIIА | T3 | N1 | M0 |
| Стадия IIIB | T1, T2, T3, T4 |
N1 Любая N |
M0 |
| Стадия IV | Любая Т | Любая N | M1 |
КАРЦИНОМА МЕРКЕЛЯ C44, C63.2
Таблица 5а. Группировка по стадиям клиническая
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1 | N0 | M0 |
| Стадия IIА | T2, Т3 | N0 | M0 |
| Стадия IIB | Т4 | N0 | M0 |
| Стадия III | Любая Т | N1, N2, N3 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
Таблица 5б. Группировка по стадиям патоморфологическая
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1 | N0 | M0 |
| Стадия IIА | Т2, T3 | N0 | M0 |
| Стадия IIB | Т4 | N0 | M0 |
| Стадия IIIA |
Т0
Т1, Т2, T3, Т4
|
N1b
N1a
|
M0 |
| Стадия IIIB | Любая Т | N1, N2, N3 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
КОРА НАДПОЧЕЧНИКА C74.0
Таблица 6. Группировка по стадиям
| Стадия I | Т1 | N0 | M0 |
| Стадия II | Т2 | N0 | M0 |
| Стадия III |
Т1, T2
Т3, T4
|
N1
N0, N1
|
M0 |
| Стадия IV | Любая Т | Любая N | M1 |
Под редакцией
д-р мед. наук, проф. О.Г.Суконко,
д-р мед. наук, проф., член-корр. НАН Беларуси С.А.Красный
Авторский коллектив:
Антоненкова Нина Н., д.м.н., доц.;
Ануфреенок И.В., к.м.н.;
Артемова Н.А., д.м.н., доц.;
Баранов А.Ю., к.м.н.;
Баранов Е.В., к.м.н.;
Бармотько М.А.;
Грачев Ю.Н., к.м.н.;
Демешко П.Д., д.м.н.;
Демидчик Ю.Е., д.м.н., проф.;
Дзюбан В.П.;
Доломанова Е.В.;
Дубровский А.Ч., к.м.н.;
Евмененко А.А.;
Ермаков Н.Б., к.м.н.;
Жаврид Э.А., д.м.н., проф.;
Жарков В.В, д.м.н., проф.;
Жиляева Е.П.;
Жуковец А.Г., к.м.н.;
Зеленкевич И.А., к.м.н.;
Ильин И.А., к.м.н.;
Караник В.С., к.м.н.;
Карман А.В., к.м.н., доц.;
Киселев П.Г., к.м.н.;
Клименко Д.П.;
Колядич Г.И., к.м.н.;
Кондратович В.А.;
Котов А.А., к.м.н.;
Кохнюк В.Т., д.м.н., проф.;
Красный С.А., д.м.н., проф.;
Крутилина Н.И., д.м.н., проф.;
Курченков А.Н., к.м.н.;
Курчин В.П., д.м.н.;
Левин Л.Ф.;
Леонова Т.А.;
Мавричев А.С., д.м.н., проф.;
Мавричев С.А., к.м.н.;
Малькевич В.Т., д.м.н., доц.;
Маньковская С.В.;
Матылевич О.П., к.м.н.;
Минайло И.И., к.м.н.;
Минич А.А., к.м.н.;
Моисеев П.И., к.м.н.;
Набебина Т.И., к.м.н.;
Науменко Л.В., к.м.н.;
Океанов А.Е., д.м.н., проф.;
Пархоменко Л.Б., к.м.н., доц.;
Петрушенко Ю.И.;
Писаренко А.М.;
Поляков С.Л., к.м.н.;
Портянко А.С., д.м.н., доц.;
Прохорова В.И., д.м.н., проф.;
Ребеко И.В., к.м.н.;
Ревтович М.Ю., к.м.н.;
Ролевич А.И., д.м.н.;
Рындин А.А.;
Рябчевский А.Н.;
Синайко В.В., к.м.н.;
Субоч Е.И., к.м.н.;
Суколинская Е.В., к.м.н.;
Суконко О.Г., д.м.н., проф.;
Суслова В.А., к.м.н.;
Тризна Н.М., к.м.н.;
Фридман М.В., д.м.н.;
Шаповал Е.В., д.м.н.;
Шмак А.И., д.м.н.
Список сокращений:
CTV – клинический объем облучения
GTV – определяемый объем опухоли
ICD – Международная классификация болезней
ITC – отдельные опухолевые клетки
PTV – планируемый объем облучения
UICC – Международный противораковый союз
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
АЧТВ – активированное частичное тромбопластиновое время
ВАТС – видео-ассистированной тораскопии
ВОЗ – Всемирная организация здравоохранения
ВПЧ – вирус папилломы человека
ВЯВ – внутренняя яремная вена;
ГИСО – гастроинтенстинальные стромальные опухоли
ГПДР – гастропанкреатодуоденальная резекция
ГЦР – гепатоцеллюлярный рак
ЖКТ – желудочно-кишечный тракт
ИГХ – иммуногистохимическое исследование
ИОУЗИ – интраоперационное УЗИ
КТ – компьютерная томография
ЛДГ – лактатдегидрогеназа
МНО – международное нормализованное отношение
МРТ – магнитно-резонансная томография
МСКТ – многослойная компьютерная томография
ОГК – органы Грудной клетки
ПВ – протромбиновое время
ПЖ – поджелудочная железа
ПЭТ – позитронно-эмиссионная томография
РЖП – рак желчного пузыря
РОД – разовая облучающая доза
РПК – рак прямой кишки
РПХГ – ретроградная панкреатохолангиография
СОД – суммарная облучающая доза
ТВ – тромбиновое время
ТДПЭ – тотальная дуоденопанкреатэктомия
УЗИ – ультразвуковое исследование
ФВД – функция внешнего дыхания
ФДГ – фтордезоксиглюкоза
ФЭГДС – фиброгастродуоденоскопия
ХЦР – холангиоцеллюлярного рака
ЦНС – центральная нервная система
ЧЧХГ – чрескожная чреспеченочная холангиография
ЧЭИ – чрескожная этаноловая инъекция
ЩФ – щелочная фосфатаза
ЭВВ – эмболизация воротной вены
ЭКГ – электрокардиограмма
ЭУЗИ – эндоскопическое ультразвуковое исследование
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.