Диагностика и лечение злокачественных новообразований: Рак мочевого пузыря
 Версия: Клинические протоколы 2006-2019 (Беларусь)
Версия: Клинические протоколы 2006-2019 (Беларусь)
Злокачественное новообразование пузыря (C67)
Онкология
Общая информация
Краткое описание
ПОСТАНОВЛЕНИЕ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
6 июля 2018 г. № 60
Об утверждении клинического протокола «Алгоритмы диагностики и лечения злокачественных новообразований»
На основании подпункта 8.3 пункта 8 Положения о Министерстве здравоохранения Республики Беларусь, утвержденного постановлением Совета Министров Республики Беларусь от 28 октября 2011 г. № 1446 «О некоторых вопросах Министерства здравоохранения и мерах по реализации Указа Президента Республики Беларусь от 11 августа 2011 г. № 360», Министерство здравоохранения Республики Беларусь
ПОСТАНОВЛЯЕТ:
1. Утвердить прилагаемый клинический протокол «Алгоритмы диагностики и лечения злокачественных новообразований».
2. Начальникам главных управлений по здравоохранению областных исполнительных комитетов, председателю комитета по здравоохранению Минского городского исполнительного комитета, руководителям государственных организаций, подчиненных Министерству здравоохранения Республики Беларусь, обеспечить проведение диагностики, лечение и профилактику заболеваний в соответствии с клиническим протоколом.
3. Настоящее постановление вступает в силу после его официального опубликования.
Министр В.А.Малашко
УТВЕРЖДЕНО
Постановление
Министерства здравоохранения
Республики Беларусь
06.07.2018 № 60
КЛИНИЧЕСКИЙ ПРОТОКОЛ «Алгоритмы диагностики и лечения злокачественных новообразований»
ГЛАВА 34
РАК МОЧЕВОГО ПУЗЫРЯ (C67)
Классификация
ГЛАВА 1
ОБЩИЕ СВЕДЕНИЯ О TNM КЛАССИФИКАЦИИ
Система TNM для классификации злокачественных опухолей была разработана французом Р. Denoix в 1943–1952 гг. В 1953 г. Комитет по номенклатуре опухолей и статистике, организованный UICC, и Международная комиссия по стадированию рака достигли соглашения по классификации анатомической распространенности опухолей на основе системы TNM. В 1954 г. Международный противораковый союз (UICC) создает Комитет по клинической классификации и прикладной статистике, который в 1958 г. публикует первые рекомендации по клинической классификации рака молочной железы и гортани.
В результате многолетней деятельности Комитета в 1968 г. издается первая редакция TNM классификация злокачественных опухолей. По мере разработки классификации для новых локализаций опухолей и уточнения более ранних рекомендаций в 1974, 1978, 1987, 1997, 2002 и 2009 гг. публикуются 2-я, 3-я, 4-я, 5-я, 6-я и 7-я редакции.
Настоящая (8-я) редакция правил классификации и стадирования полностью соответствуют 8-й редакции руководства по стадированию рака и одобрена всеми национальными TNM комитетами.
В данном руководстве используются морфологические формы злокачественных новообразований в соответствии с классификацией МКБ-О-3, адаптированной под МКБ-10 (проставление кодов врачом-патологом в морфологическом заключении обязательно).
UICC признает необходимость постоянства TNM классификации в течение определенного периода времени, необходимого для накопления данных. Поэтому классификация не должна изменяться до тех пор, пока не будут сделаны крупные достижения в диагностике и лечении злокачественных опухолей, требующие пересмотра настоящей классификации.
Общие правила системы TNM.
TNM система для описания анатомической распространенности болезни основывается на оценке 3 компонентов:
Т – распространение первичной опухоли;
N – отсутствие или наличие метастазов в регионарных лимфатических узлах и степень их поражения;
М – отсутствие или наличие отдаленных метастазов.
К этим трем компонентам добавляются цифры, указывающие на распространенность злокачественного процесса:
Т0, Т1, Т2, Т3, Т4; N0, N1, N2, N3; M0, M1.
В действительности система является «стенографическим» описанием распространенности злокачественной опухоли.
Общие правила классификации, применяемые для опухолей всех локализаций, следующие:
Для каждой локализации имеются две классификации:
Клиническая классификация, обозначаемая TNM (или cTNM). Она основывается на результатах обследования до лечения. Эти данные получают при врачебном осмотре, лучевой диагностике, эндоскопии, биопсии, хирургическом диагностическом вмешательстве и других методах обследования.
Патологическая классификация, обозначаемая pTNM. Она основана на данных обследования до лечения, дополненных или измененных в результате хирургического вмешательства и морфологического исследования. Гистологическая оценка первичной опухоли включает резецированную опухоль или биопсию, позволяющую оценить наивысшую Т категорию. Гистологическая оценка регионарных лимфатических узлов включает исследование удаленных узлов в количестве, адекватном для установления отсутствия метастазов в регионарных лимфатических узлах (pN0) и достаточном для оценки наиболее высокой pN категории. Отдаленные метастазы должны быть подтверждены при микроскопическом исследовании (рМ).
После обозначения Т, N, М и/или рТ, pN и рМ категорий они могут группироваться по стадиям. TNM классификация и стадии, установленные однажды, должны оставаться неизменными в медицинских документах. Клиническая стадия служит основой для выбора лечения, тогда как патологическая стадия обеспечивает наиболее точные данные для оценки прогноза и расчета конечных результатов.
При сомнении в правильности оценки Т, N или М категории должно быть выбрано меньшее значение категории, (т.е. меньшее распространение опухоли).
В случае множественных опухолевых очагов в органе должна классифицироваться опухоль с более высокой Т категорией, а в скобках указываться множественность (т) или количество опухолей, например: Т2(т) или Т1(5). При одновременном поражении парных органов каждая опухоль должна классифицироваться отдельно. При опухолях печени, яичников и фаллопиевой трубы множественные очаги поражения являются критерием Т классификации.
Выявление второй опухоли в одном органе в течение 2 месяцев с момента выявления первой нужно расценивать как синхронное поражение.
TNM категории и стадия могут подразделяться или объединяться для клинических и научных целей (например, любые Т, N или М могут быть разбиты на подгруппы). Однако рекомендованные основные обозначения не должны изменяться.
Анатомические области и локализации.
Локализации в этой классификации обозначаются кодовым номером Международной классификации онкологических болезней.
TNM/pTNM классификация.
Используются следующие общие определения:
Т/рТ – первичная опухоль:
TX/рTX – первичная опухоль не может быть оценена;
Т0/рТ0 – нет доказательств первичной опухоли;
Tis/pTis – рак «in situ»;
Т1/рТ1, Т2/рТ2, ТЗ/рТЗ, Т4/рТ4 – размер или местное распространение опухоли в порядке увеличения.
N/pN – регионарные лимфатические узлы:
Nx/pNx – регионарные лимфатические узлы не могут быть оценены;
N0/pN0 – отсутствуют метастазы в регионарных лимфоузлах;
Nl/pNl, N2/pN2, N3/pN3 – возрастающее поражение регионарных лимфатических узлов.
Непосредственное распространение первичной опухоли на лимфатические узлы классифицируется как метастазы в лимфатических узлах. Метастаз в любом лимфоузле, не относящемся к регионарному, расценивается как отдаленный метастаз.
Опухолевый узел в области регионарных лимфатических узлов, не имеющий гистологических признаков лимфоузла, классифицируется как метастаз в регионарном лимфатическом узле, если имеет форму и ровный контур лимфатического узла. Опухолевый узел с неровным контуром классифицируется в рТ категории.
Когда размер является критерием pN классификации, производится измерение метастатического очага, а не всего лимфатического узла.
Случаи с микрометастазами, когда размеры метастазов не превышают 0,2 см, могут обозначаться добавлением «(mi)», например: pNl(mi) или pN2(mi).
М/рМ – отдаленные метастазы:
МХ/рМХ – отдаленные метастазы не могут быть оценены;
М0/рМ0 – нет отдаленных метастазов;
М1/рМ1 – имеются отдаленные метастазы;
Категория М может быть в дальнейшем специфицирована в соответствии со следующими обозначениями (таблица 1.1):
Таблица 1.1
| Легкие | PUL | Костный мозг | MAR |
| Кости | OSS | Плевра | PLE |
| Печень | HEP | Брюшина | PER |
| Головной мозг | BRA | Надпочечники | ADR |
| Лимфоузлы | LYM | Кожа | SKI |
| Другие | ОТН |
Подразделения TNM
Главные категории в классификации могут иметь подразделения, придающие критерию большую специфичность (например; Tla, lb или N2a, 2b).
Сигнальный лимфоузел
Это первый лимфоузел, получающий лимфу из первичной опухоли. Если в нем имеется метастаз, то и другие лимфоузлы могут быть поражены. Если этот лимфоузел не поражен, то и наличие метастазов в других узлах маловероятно. Иногда встречаются более одного сигнальных лимфоузлов.
При оценке сигнального лимфоузла применяются следующие определения:
Главные категории в классификации могут иметь подразделения, придающие критерию большую специфичность (например; Tla, lb или N2a, 2b).
Сигнальный лимфоузел
Это первый лимфоузел, получающий лимфу из первичной опухоли. Если в нем имеется метастаз, то и другие лимфоузлы могут быть поражены. Если этот лимфоузел не поражен, то и наличие метастазов в других узлах маловероятно. Иногда встречаются более одного сигнальных лимфоузлов.
При оценке сигнального лимфоузла применяются следующие определения:
- pNX(sn) – сигнальный узел не может быть оценен; pN0(sn) – нет поражения сигнального узла;
- pN1(sn) – есть поражение сигнального узла.
Отдельные опухолевые клетки
Отдельные опухолевые клетки (ITC) представляют собой единичные опухолевые клетки или маленькие кластеры клеток не более 0,2 мм в наибольшем измерении. ITC обычно не демонстрируют метастатической активности (пролиферацию или реакцию стромы) или инвазии стенок сосудистого или лимфатического синуса. Случаи с ITC в лимфатических узлах или отдаленных органах и тканях должны классифицироваться как N0 или М0 соответственно.
Это же применимо и к случаям, когда наличие опухолевых клеток или их компонентов подтверждается неморфологическими исследованиями, такими как проточная морфометрия или анализ ДНК.
Случаи с ITC должны анализироваться отдельно.
Классификация ITC:
- pN0 – гистологически не выявляются метастазы в регионарных лимфатических узлах, не проводились исследования по выявлению ITC;
- pN0(i-) – гистологически нет метастазов в регионарных лимфатических узлах, негативные морфологические данные по выявлению ITC;
- pN0(i+) – гистологически нет метастазов в регионарных лимфатических узлах, позитивные морфологические данные по выявлению ITC;
- pN0(mol-) – гистологически нет метастазов в регионарных лимфатических узлах, негативные неморфологические данные по выявлению ITC;
- pN0 (mol+) – гистологически нет метастазов в регионарных лимфатических узлах, неморфологическими методами выявляются ITC.
При исследовании ITC в сигнальном лимфоузле к обозначениям выше приведенной классификации в скобках указывается «(sn)», например: pN0(i+) (sn).
Отдельные опухолевые клетки, выявленные в костном мозгу морфологическими методами, классифицируются аналогично схеме для N, например: pM0(i+), а неморфологическими – pM0(mol+).
Гистопатологическая дифференцировка.
Это стадирование позволяет оценить степень агрессивности опухолей некоторых гистологических типов и может влиять на прогноз и выбор лечения.
Для большинства локализаций выделяется 4 степени дифференцировки опухолей:
- G1 – хорошо дифференцированные;
- G2 – умеренно дифференцированные;
- G3 – низко дифференцированные;
- G4 – недифференцированные.
При наличии различных степеней дифференцировки в опухоли указывается наименее благоприятная степень.
Саркомы костей и мягких тканей классифицируется также с использованием градаций «высокая степень» и «низкая степень» дифференцировки.
Для некоторых форм рака (молочной железы, тела матки, печени) рекомендуются специальные системы стадирования по степеням.
Дополнительные дескрипторы.
Для идентификации особых случаев в TNM/pTNM используются символы m, у, r, а.
Хотя они не влияют на группировку по стадиям, но указывают опухоли, которые должны анализироваться отдельно:
- m – используется для обозначения множественных опухолей одной локализации;
- у – в тех случаях, когда классификация приводится в течение или после проведения комбинированного (многокомпонентного) лечения, cTNM или pTNM категория обозначается префиксом «у», например: ycTNM или ypTNM. При оценке распространения опухоли до начала комбинированного лечения символ «у» не исключается;
- r – рецидив опухоли после радикального лечения при классификации обозначается префиксом «r» (rcTNM или rpTNM);
- а – применяется для обозначения классификации опухолей, впервые выявленных при аутопсии.
Необязательные дескрипторы.
L – инвазия лимфатических сосудов
Классифицируется как LX, L0 и L1.
V – инвазия вен
Классифицируется как VX, VO, VI (микроскопическая инвазия) и V2 (макроскопическая инвазия). Макроскопическое вовлечение стенки вены при отсутствии опухоли в просвете сосуда классифицируется как V2.
С-фактор
С-фактор или «фактор надежности» отражает достоверность классификации с учетом использованных методов диагностики. Его использование не является обязательным.
Определения С-фактора:
- С1 – данные стандартных диагностических методов (осмотр, пальпация, рентгенологическое исследование, эндоскопическое исследование),
- С2 – данные, полученные при использовании специальных диагностических методов (рентгенологическое исследование в специальных проекциях, томография, компьютерная томография, ультразвуковое исследование, лимфография, ангиография, сцинтиграфия, магнитно-резонансная томография, ПЭТ/КТ, эндоскопия, биопсия, цитологическое исследование);
- С3 – данные хирургического диагностического вмешательства, включая биопсию и цитологическое исследование;
- С4 – данные, полученные после радикальной операции и гистологического исследования удаленного препарата;
- С5 – данные патологоанатомического вскрытия.
Степени С-фактора могут использоваться при описании категорий Т, N и М (например: Т3С2, N2C1, М0С2).
Клиническая классификация TNM соответствует CI, С2 и С3 степеням, тогда как pTNM эквивалентна С4.
Классификация остаточных опухолей (R)
TNM/pTNM классификация описывает анатомическую распространенность опухоли без рассмотрения вопросов лечения. R-классификация описывает статус опухоли после лечения. Она отражает эффект лечения и является прогностическим фактором. При R- классификации оценивается не только первичная опухоль, но и остающиеся отдаленные метастазы.
Эта классификация может применяться после хирургического лечения, лучевой или химиотерапии, а также после комбинированного лечения. После консервативного лечения остаточная опухоль оценивается клиническими методами. После хирургического лечения R-классификация требует тесного сотрудничества хирурга и морфолога.
Случаи с макроскопически определяемой остаточной опухолью (R2) могут подразделяться на R2a (без микроскопического подтверждения) и R2b (микроскопически подтвержденные).
R0 группа может включать пациентов как с М0, так и с Ml. В последнем случае отдаленные метастазы, как и первичная опухоль, должны быть полностью удалены. Трудности с R-классификацией могут возникнуть при удалении опухоли по частям, а не «en blok». В таких случаях уместна категория RX.
Наличие микроскопически определяемой инвазивной опухоли по линии резекции классифицируется как R1, а в случае неинвазивной карциномы – R1 (is).
Группировка по стадиям.
Комбинация всех значений дескрипторов TNM позволяет получить 24 категории TNM, описывающие распространенность опухоли. Для табличного представления данных и анализа эти категории объединяются в ограниченное количество групп – стадий. Каждая стадия более или менее однородна по прогнозу и критерию выживаемости относящихся к ней пациентов.
Карцинома «in situ» относится к стадии 0, а опухоли с отдаленными метастазами – к стадии IV (за исключением некоторых локализаций, например, папиллярного и фолликулярного рака щитовидной железы).
Для патологической стадии необходимо морфологическое исследование достаточного количества тканей, позволяющее оценить наибольшее значение Т и N. Если же имеется морфологическое подтверждение отдаленных метастазов, то и классификация (рМ1) и стадия являются патологическими.
Термин «стадия» употребляется только для комбинаций Т, N, М или рТ, pN или рМ категорий. Необходимо избегать выражений типа «Т стадия» или «N стадия»
РАК МОЧЕВОГО ПУЗЫРЯ (C67)
34.2. Классификация TNM (Международный противораковый союз, 2016.).
34.2.1. Правила для классификации. Классификация применима для карцином. Папиллома исключается. Должно быть гистологическое или цитологическое подтверждение заболевания
Ниже указаны процедуры для оценки категорий T, N и M:
- категория T – физикальное исследование, визуализация и эндоскопия;
- категория N – физикальное исследование и визуализация;
- категория M – физикальное исследование, визуализация.
34.2.2. Регионарные лимфоузлы. Регионарными лимфатическими узлами являются узлы малого таза, которые в основном располагаются ниже бифуркации общих подвздошных артерий. Сторона поражения не влияет на классификацию N.
34.2.3. Клиническая классификация TNM.
Т – первичная опухоль.
Для определения множественных опухолей к категории Т добавляется индекс m. Для определения сочетания рака in situ с любой категорией Т добавляется аббревиатура is.
TX – недостаточно данных для оценки первичной опухоли.
Т0 – признаки первичной опухоли отсутствуют.
Та – неинвазивная папиллярная карцинома.
Tis – карцинома in situ («плоская опухоль»).
Т1 – опухоль распространяется на субэпителиальную соединительную ткань.
Т2 – опухоль распространяется на мышцы.
Т2а – опухоль распространяется на поверхностную мышцу (внутренняя половина).
Т2b – опухоль распространяется на глубокую мышцу (наружная половина).
Т3 – опухоль распространяется на околопузырные ткани:
Т3а – микроскопически;
Т3b – макроскопически (экстравезикальная масса).
Т4 – опухоль распространяется на следующие структуры: строму предстательной железы, семенные пузырьки, матку, влагалище, стенку таза, брюшную стенку.
T4a – опухоль распространяется на строму предстательной железы, семенные пузырьки, матку или влагалище.
T4b – опухоль распространяется на стенки таза или брюшную стенку.
N – регионарные лимфоузлы.
NX – состояние лимфатических узлов не может быть оценено.
N0 – метастазы в регионарных узлах не определяются.
N1 – метастаз в одном лимфоузле малого таза (гипогастральном, обтураторном, наружном подвздошном или пресакральном)
N2 – метастазы во множественных лимфоузлах малого таза (гипогастральных, обтураторных, наружных подвздошных или пресакральных)
N3 – метастаз(ы) в общем подвздошном лимфоузле(ах)
М – отдаленные метастазы.
М0 – признаки отдаленных метастазов отсутствуют.
М1 – есть отдаленные метастазы.
М1a – нерегионарные лимфоузлы
М1b – другие отдаленные метастазы
34.2.4. Патологическая классификация рTNM.
Категории рТ и pN соответствуют категориям Т и N. Категория pM1 означает наличие микроскопически подтвержденных отдаленных метастазов. Категорий pM0 и pMX не существует.
34.2.5. Резюме (таблица 34.2).
Таблица 34.2
|
Мочевой пузырь
|
|
|
Tа
|
Неинвазивная папиллярная
|
|
Tis
|
Карцинома in situ: «плоская опухоль»
|
|
Т1
|
Субэпителиальная соединительная ткань
|
|
Т2
|
Мышечный слой
|
|
Т2а
|
Внутренняя половина
|
|
Т2b
|
Наружная половина
|
|
Т3
|
Околопузырные ткани
|
|
Т3а
|
Микроскопически
|
|
Т3b
|
Макроскопически
|
|
Т4а
|
Простата, уретра, влагалище
|
|
Т4b
|
Стенки таза, брюшная стенка
|
|
N1
|
Единичный
|
|
N2
|
Множественные
|
|
N3
|
Общие подвздошные
|
|
M1а
|
Нерегионарные лимфоузлы
|
|
M1b
|
Другие отдаленные метастазы
|
34.2.6. Группировка по стадиям (таблица 34.3).
Таблица 34.3. Группировка по стадиям
|
Стадия 0а
|
Ta
|
N0
|
M0
|
|
Стадия 0is
|
Tis
|
N0
|
M0
|
|
Стадия I
|
T1
|
N0
|
M0
|
|
Стадия II
|
T2а, T2b
|
N0
|
M0
|
|
Стадия IIIA
|
Т3a, T3b, Т4а
|
N0
|
M0
|
|
Т1, T2, T3, Т4а
|
N1
|
M0
|
|
|
Стадия IIIB
|
Т1, T2, T3, Т4а
|
N2, N3
|
M0
|
|
Стадия IVA
|
T4b
|
N0
|
M0
|
|
любая T
|
любая N
|
M1a
|
|
|
Стадия IVB
|
любая T
|
любая N
|
M1b
|
34.3. Гистологическая классификация опухолей мочевого пузыря (ВОЗ, 2016).
Уротелиальные опухоли
Инфильтрирующая уротелиальная карцинома [8120/3]
инфильтрирующая уротелиальная карцинома с разнонаправленной (дивергентной) дифференцировкой; гнездный тип, включая крупно-гнездный; микрокистозный; микропапиллярный [8131/3]; лимфоэпителиома-подобный [8082/3]; плазмоцитоидный/перстневидно-клеточный/диффузный; саркоматоидный [8122/3]; гигантоклеточный [8031/3]; плохо дифференцированный [8020/3]; светлоклеточный; богатый липидами.
Неинвазивные уротелиальные опухоли
уротелиальная карцинома in situ [8120/2]; неинвазивная папиллярная уротелиальная карцинома, low grade [8130/2]; неинвазивная папиллярная уротелиальная карцинома, high grade [8130/2]; папиллярная уротелиальная опухоль с низким злокачественным потенциалом [8130/1]; уротелиальная папиллома [8120/0]; инвертированная уротелиальная папиллома [8121/0]; уротелиальная пролиферация с неопределенным злокачественным потенциалом; уротелиальная дисплазия.
Плоскоклеточные опухоли
чистая плоскоклеточная карцинома [8070/3]; веррукозная карцинома [8051/3]; плоскоклеточная папиллома [8052/0].
Железистые опухоли
аденокарцинома, обычная [8140/3]; (кишечная [8144/3], муцинозная [8480/3], смешанная [8140/3]); ворсинчатая аденома [8261/0].
Урахальная карцинома [8010/3]
Нейроэндокринные опухоли
Другие опухоли
Эпидемиология
34.1. Основные статистические показатели (таблица 34.1)
Таблица 34.1. Основные статистические показатели
| Показатель | Число | |
| 2011 | 2016 | |
| Число вновь выявленных случаев заболевания | 1146 | 1242 |
| Заболеваемость на 100 000 населения (грубый интенсивный показатель) | 12,1 | 13,1 |
| Диагноз установлен в I стадии заболевания (% к вновь выявленным случаям) | 57 | 59,6 |
| Диагноз установлен в II стадии заболевания (% к вновь выявленным случаям) | 28,9 | 23,5 |
| Диагноз установлен в III стадии заболевания (% к вновь выявленным случаям) | 8,9 | 8,8 |
| Диагноз установлен в IV стадии заболевания (% к вновь выявленным случаям) | 5,2 | 8,1 |
| Прожили менее года с момента установления диагноза из числа заболевших в предыдущем году (одногодичная летальность в %) | 16,5 | 12,6 |
| Умерло от злокачественных новообразований | 306 | 322 |
| Смертность на 100 000 населения Грубый интенсивный показатель | 3,2 | 3,4 |
| Отношение смертности к заболеваемости в % (интенсивные показатели) | 26,4 | 26 |
| Число пациентов, состоящих на учете на конец года | 7370 | 7902 |
| Из них состоящих на учете 5 и более лет, % | 51,8 | 52 |
Факторы и группы риска
34.2.7. Прогностические факторы прогрессирования в инвазивное заболевание рака мочевого пузыря без мышечной инвазии (Ta, T1, Tis) (таблица 34.4).
Таблица 34.4. Прогностические факторы
|
Прогностические факторы
|
Связанные с опухолью
|
Связанные с пациентом
|
Связанные с окружающей средой
|
|
Важнейшие
|
Гистологическая степень злокачественности, категория T, карцинома in situ, количество опухолей, предыдущие рецидивы
|
Возраст, общее состояние, другие сопутствующие заболевания
|
Объем трансуретральной резекции (внутрипузырная химиотерапия снижает рецидивы, но данные о влиянии на прогрессирование ограничены)
|
|
Дополнительные
|
Размер опухоли, рецидив при контроле через 3 мес.
|
Пол, продолжающееся курение табака
|
|
|
Новые и перспективные
|
p53, NMP22, мутационный статус FGFR3, COX-2 (особенно для верхних мочевых путей), клаудины, статус метилирования ДНК, лимфоваскулярная инвазия, распространенность инвазии (T1microinvasive или T1extensive
invasive)
|
|
|
34.2.8. Прогностические факторы риска метастазов и выживаемости при инвазивном, местно-распространенном раке мочевого пузыря и/или с регионарными метастазами (T2-4N0-1) (таблица 34.5).
Таблица 34.5. Прогностические факторы
|
Прогностические факторы
|
Связанные с опухолью
|
Связанные с пациентом
|
Связанные с окружающей средой
|
|
Важнейшие
|
Категория T, категория N
|
Возраст, общее состояние, уровень ЩФ, другие сопутствующие заболевания
|
Статус хирургических краев резекции
|
|
Дополнительные
|
Степень дифференцировки, гистологический тип, лимфоваскулярная инвазия, сопутствующая CIS, размер опухоли, гидронефроз
|
Гемоглобин, ответ на первичную химиотерапию
|
Объем лимфодиссекции, пропорция (плотность) пораженных лимфатических узлов
|
|
Новые и перспективные
|
p53, p63 p21 (для сохранения мочевого пузыря) белок Rb, Ki67, рецептор EGF, экспрессия E-кадгерина, микрососудистая плотность, механизмы резистентности к лечению (мутации ERCC1, BRCA1 или MMR)
|
Некоторые генеративные однонуклеотидные полиморфизмы
|
|
При подтвержденных метастазах висцеральные метастазы связаны с плохим прогнозом.
Источник: UICC Manual of Clinical Oncology, Ninth Edition (2015). Edited by Brian O’Sullivan, James D. Brierley, Anil K. D’Cruz, Martin F. Fey, Raphael Pollock, Jan B. Vermorken and Shao Hui Huang.
Источник: UICC Manual of Clinical Oncology, Ninth Edition (2015). Edited by Brian O’Sullivan, James D. Brierley, Anil K. D’Cruz, Martin F. Fey, Raphael Pollock, Jan B. Vermorken and Shao Hui Huang.
Диагностика
34.4. Диагностические мероприятия (рисунок 34.1)
34.4.1. Обязательный начальный объем обследования:
- физикальное обследование, пальцевое ректальное исследование;
- общий анализ мочи, общий анализ крови, биохимический анализ крови (белок, креатинин, мочевина);
- амбулаторная цистоскопия или УЗИ мочевого пузыря. Если опухоль визуализируется при неинвазивных исследованиях (УЗИ, КТ) цистоскопию целесообразно выполнять под анестезией на заключительном этапе и совмещать с удалением опухоли (ТУР) при резектабельности последней;
- экскреторная урография с нисходящей цистографией или УЗИ почек;
- посев мочи на флору и чувствительность к антибиотикам;
- уретроцистоскопия под анестезией с биопсией опухоли и подозрительных участков слизистой и/или трансуретральная резекция (ТУР) мочевого пузыря, бимануальная пальпация. При мышечно-инвазивных опухолях резецируется основная масса или часть опухоли с участком мышечной ткани. В случае планирования радикальной цистэктомии выполняется биопсия простатического отдела уретры. Стадия заболевания устанавливается после гистологического исследования на основании данных о глубине инвазии стенки мочевого пузыря (инвазия базальной мембраны и мышечного слоя) с учетом данных бимануального исследования и рентгенологических данных;
- флуоресцентная цистоскопия при наличии соответствующего оборудования;
- перед проведением хирургического лечения дополнительно выполняются посев мочи на флору и чувствительность к антибиотикам, билирубин, глюкоза, электролиты (К, Na, Cl), анализ крови на сифилис (реакция микропреципитации), Группа крови, резус– фактор, ЭКГ.
34.4.2. По показаниям выполняются:
- цитологическое исследование мочи (при подозрении на карциному in situ);
- рентгенография органов Грудной клетки (при подозрении на мышечно-инвазивную опухоль);
- УЗИ органов брюшной полости и забрюшинного пространств (при подозрении на мышечно-инвазивную опухоль);
- КТ либо МРТ брюшной полости и таза с экскреторной КТ-урографией (при установленном диагнозе мышечно-инвазивной опухоли или сопутствующей опухоли верхних мочевых путей);
- уретеропиелоскопия с биопсией (при подозрении на сопутствующую опухоль верхних мочевых путей);
- фиброгастродуоденоскопия перед выполнением радикальной цистэктомии;
- остеосцинтиграфия и рентгенография конкретных областей скелета при подозрении на метастатическое поражение.
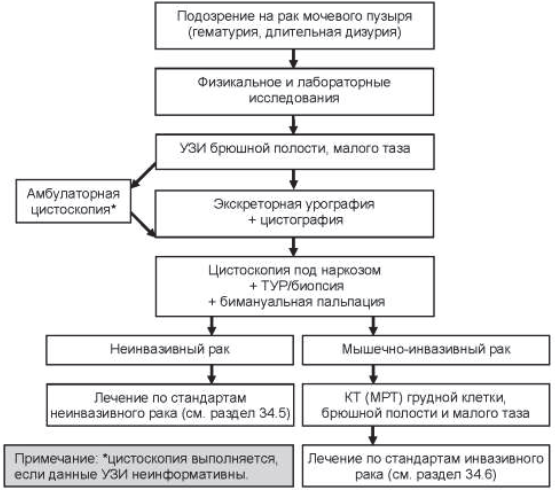
Рисунок 34.1 – Алгоритм диагностики опухолей мочевого пузыря
34.8. Наблюдение за пациентами, страдающих раком мочевого пузыря.
34.8.1. Наблюдение после органо-сохраняющего лечения рака мочевого пузыря без мышечной инвазии (стадии Та, Т1, Tis).
34.8.1.1. Объем наблюдения.
- физикальное обследование, пальцевое ректальное исследование;
- лабораторные исследования, в том числе цитологическое исследование осадка мочи;
- уретроцистоскопия чередуется с УЗИ органов брюшной полости, забрюшинного пространства и малого таза
34.8.1.2. Сроки наблюдения:
- первый год – 1 раз в 3 мес.;
- второй год – 1 раз в 6 мес.;
- в последующем, пожизненно – 1 раз в год.
34.8.2. Наблюдение при мышечно-инвазивном раке мочевого пузыря (стадии Т2-Т4).
34.8.2.1. Объем наблюдения.
- физикальное обследование, пальцевое ректальное исследование;
- лабораторные исследования, в том числе цитологическое исследование осадка мочи;
- УЗИ органов брюшной полости, забрюшинного пространства и малого таза;
- цистоскопия с биопсией (после органосохраняющих операций);
- рентгенография органов Грудной клетки.
По показаниям выполняются:
- рентгеновская компьютерная или магнитная резонансная томография;
- остеосцинтиграфия и рентгенография конкретных областей скелета при подозрении на метастатическое поражение.
34.8.2.2. Сроки наблюдения:
- первый год – 1 раз в 3 мес.;
- второй год – 1 раз в 6 мес.;
- в последующем, пожизненно – 1 раз в год.
34.8.3. Наблюдение после отведения мочи с созданием резервуаров (ортотопическая реконструкция, гетеротопический континентный резервуар).
Кроме методов, указанных в пункте 34.8.2.1, пациенты после отведения мочи с созданием резервуаров нуждаются в мониторинге с целью исключения специфических осложнений отведения мочи:
- биохимический анализ крови (креатинин, мочевина, электролиты);
- общий анализ крови (гемоглобин, лейкоциты);
- кислотно–щелочное состояние крови;
- общий анализ мочи, посев мочи (по показаниям)
Лечение
34.5. Лечение рака мочевого пузыря без мышечной инвазии (стадии Tis, Ta и T1)
34.5.1. Общие принципы лечения
Используется органосохраняющая тактика (преимущественно применяется ТУР мочевого пузыря с или без внутрипузырной терапией).
Адъювантные методы воздействия, из которых наиболее эффективным является внутрипузырное использование вакцины БЦЖ, должны применяться при наличии неблагоприятных факторов: высокой степени злокачественности (high-grade), рецидивных, множественных опухолях, размере опухоли >5 см, нерадикальной операции (в краях отсечения очаги опухолевого роста), наличии карциномы in situ. Разработан ряд прогностических классификаций рака мочевого пузыря без мышечной инвазии. В клинической практике могут использоваться классификация EORTC [Eur. Urol. – 2006, Vol. 49. – P. 466–477] или РНПЦ ОМР им. Н.Н. Александрова [Онкоурология. – 2016. – Т. 12, № 4. – С. 119–130]. Тактика лечения рака мочевого пузыря без мышечной инвазии в зависимости от прогностической Группы отражена в таблице 34.6.
Таблица 34.6. Общие принципы лечения
|
Благоприятный прогноз
первичная одиночная высокодифференцированная (low grade) опухоль <5 см в наибольшем изменении
|
ТУР + однократная инстилляция
имиопрепарата1
|
|
Промежуточный прогноз
Все остальные опухоли
|
ТУР2 ± ФДД3 ± однократная инстилляция химиопрепарата1,4 + внутрипузырная химиотерапия или БЦЖ
|
|
Неблагоприятный прогноз
Часто рецидивирующие (1/год и чаще) или множественные (11 и более) или ≥5 см или high grade; рецидивы реже 1/год и множественные (2–10 опухолей); рак in situ
|
ТУР2 ± ФДД3 ± реТУР5 + БЦЖ6
Цистэктомия7
|
1) В течение 2–6 часов после ТУР при отсутствии подозрения на перфорацию мочевого пузыря или выраженного кровотечения
2) Качество (радикальность) выполнения ТУР играет большую роль в обеспечении благоприятных отдаленных результатов.
3) При наличии необходимого оборудования и фотосенсибилизатора.
4) У пациентов с одиночными небольшими (<3 см) рецидивами реже 1/год, первичными мультифокальными (2–7 опухолей) или крупными (≥3 см) опухолями.
5) реТУР выполняется при опухолях high grade, а также после нерадикальных первичных операций.
6) Рекомендуется проводить с поддерживающими инстилляциями.
7) При диффузном нерезектабельном раке мочевого пузыря без мышечной инвазии, у пациентов с крайне высоким риском прогрессирования (T1 high grade + CIS, мультифокальные или крупные опухоли T1 high grade), особенно при неэффективности БЦЖ.
34.5.2. Хирургическое лечение рака мочевого пузыря без мышечной инвазии.
Проведение органосохраняющих операций возможно с использованием ТУР или открытой резекции мочевого пузыря.
34.5.2.1. Трансуретральная резекция – основной метод хирургического лечения неинвазивных опухолей мочевого пузыря. При этом ТУР одновременно является и диагностической процедурой, так как позволяет установить гистологическую форму, стадию заболевания, а также прогностические факторы (количество опухолей, их размеры, наличие сопутствующих плоских изменений уротелия).
Проведение ТУР предусматривает удаление опухоли в пределах здоровых тканей. Для облегчения патоморфологического стадирования рекомендуется фракционное удаление опухолей мочевого пузыря: сначала удаляется экзофитная часть опухоли, затем основание с участками подлежащего мышечного слоя мочевого пузыря, при возможности отдельно срезаются периферические края резекции, и выполняется биопсия дна резекционной раны. Все фракции удаленного материала сдаются раздельно для морфологического исследования.
При наличии участков измененной слизистой, подозрительных на наличие предопухолевой патологии, выполняется их биопсия.
34.5.2.2. Открытая резекция мочевого пузыря может выполняться при больших четко ограниченных неинвазивных опухолях и невозможности выполнить ТУР.
34.5.3. Морфологическое заключение по препарату после ТУР.
Заключение морфолога должно включать информацию о гистологической степени злокачественности опухоли, глубине инвазии (инвазия базальной мембраны уротелия, ограниченная или распространенная степень этой инвазии, инвазия мышечной ткани детрузора), присутствии карциномы in situ и наличии мышечной ткани детрузора в удаленном препарате. Также необходимо указать присутствие лимфососудистой инвазии или атипичной морфологии опухоли.
34.5.4. Флуоресцентная цистоскопия.
Флуоресцентная цистоскопия в синем свете с использованием в качестве фотосенсибилизатора 5-аминолевулиновой кислоты («Аламин») приводит к увеличению частоты выявления предопухолевых изменений и рака мочевого пузыря, не видимых в обычном белом свете, и увеличению пятилетней безрецидивной выживаемости при выполнении ТУР под контролем флуоресцентной цистоскопии. Таким образом, пациентам с раком мочевого пузыря без мышечной инвазии, особенно в подгруппе с промежуточным и неблагоприятным прогнозом, показана флуоресцентная цистоскопия при наличии соответствующего оборудования и фотосенсибилизатора.
34.5.5. Однократная ранняя инстилляция химиопрепарата после ТУР.
Однократная ранняя (в течение 2–6 часов после ТУР) инстилляция химиопрепарата препятствует имплантации опухолевых клеток после операции и снижает частоту рецидивов у пациентов с благоприятным и, частично, промежуточным риском рецидива. Однократная инстилляция химиопрепарата показана пациентам с частотой рецидивирования реже 1 раза в год или с одиночными папиллярными (предположительно Ta low grade) опухолями <3 см с частотой рецидивирования чаще 1 раза в год.
Для однократной инстилляции используется раствор 50 мг доксорубицина в 50 мл дистиллированной воды, который вводится внутрипузырно на 1 ч в течение первых 2–6 часов после ТУР. Противопоказаниями к внутрипузырной инстилляции является подозрение на перфорацию мочевого пузыря во время ТУР или выраженное кровотечение, требующее перфузии мочевого пузыря.
34.5.6. Ранняя повторная ТУР (реТУР).
В связи с высокой частотой обнаружения остаточной опухоли после выполнения «радикальной» ТУР и вероятностью ошибочного стадирования в результате нераспознания мышечной инвазии предложено выполнять реТУР через 1–8 недель после первичной для выявления остаточной опухоли, коррекции ошибок в определении стадии и отбора пациентов для ранней цистэктомии. Показаниями к реТУР у пациентов, страдающих раком мочевого пузыря без мышечной инвазии, служат нерадикальные первичные операции, низкая степень дифференцировки (high grade) или опухоли с неблагоприятным прогнозом. При наличии высокого риска остаточной опухоли у пациентов с опухолями low grade показано выполнение цистоскопии. РеТУР в таких случаях целесообразно выполнять при наличии визуализируемой опухоли в мочевом пузыре. При отсутствии цистоскопических данных за опухоль реТУР можно избежать.
34.5.7. Внутрипузырная химиотерапия.
Внутрипузырная химио- и иммунотерапия может применяться в сочетании с хирургическим лечением для профилактики рецидивов после операции. В настоящее время для внутрипузырного введения используются доксорубицин, эпирубицин.
Схемы внутрипузырной химиотерапии:
- Доксорубицин 50 мг в 50 мл дистиллированной воды внутрипузырно на 1–2 ч еженедельно в течение 6–8 недель.
- Эпирубицин 50 мг в 50 мл дистиллированной воды внутрипузырно на 1–2 ч еженедельно в течение 6–8 недель.
Далее препараты могут вводиться вводятся в тех же дозах 1 раз в месяц в течение 6– 12 мес.
34.5.8. Внутрипузырная иммунотерапия.
34.5.8.1. Показания к внутрипузырному введению БЦЖ:
В отличие от химиотерапии, иммунотерапия БЦЖ кроме снижения частоты рецидивов может приводить к снижению частоты прогрессирования опухоли. Иммунотерапия БЦЖ показана пациентам с промежуточным или высоким риском рецидива и прогрессирования рака (см таблицу 34.6), а также в случае неэффективности внутрипузырной химиотерапии. Длительная поддерживающая терапия в течение 1–3 лет улучшает результаты лечения пациентов с неблагоприятным прогнозом и показана при низкой степени дифференцировки опухоли и карциноме in situ.
34.5.8.2. Методика внутрипузырной терапии БЦЖ
Внутрипузырное введение вакцины БЦЖ проводят по следующей методике: БЦЖ для внутрипузырного введения (100–120 мг вакцины «Имурон») разводят в 50 мл изотонического раствора хлорида натрия и после атравматичной катетеризации мягким катетером вводят в мочевой пузырь на 1–2 часа. Системное использование антибиотиков или чрезмерное использование любрикантов для смазки катетера при проведении инстилляции не рекомендуется. Лечение БЦЖ начинается не ранее, чем через 2–3 недели после ТУР. Индукционный курс состоит из 6 еженедельных инстилляций. После окончания индукционного курса назначаются поддерживающие инстилляции БЦЖ. При необходимости курс лечения можно повторить.
34.5.8.3. Противопоказания к внутрипузырному введению БЦЖ: ранний период (2–3 недели) после операций на мочевом пузыре (ТУР, резекция мочевого пузыря); иммунодефицитное состояние (первичный иммунодефицит, ВИЧ-инфицирование; противоопухолевая или иммуносупрессивная терапия); активный туберкулез (необходимо исключить при резко положительной кожной реакции на пробу Манту); клинически выраженная инфекция мочевых путей, макроскопическая гематурия или фебрильная инфекция (лечение должно быть отложено до купирования данной патологии); травматичная катетеризация или появление крови после катетеризации мочевого пузыря являются противопоказаниями для инстилляции БЦЖ в данный день; аллергия или тяжелые побочные реакции на предыдущее использование БЦЖ.
34.5.8.4. Осложнения внутрипузырной терапии БЦЖ
При проведении внутрипузырной иммунотерапии БЦЖ могут отмечаться как местные, так и общие реакции:
Легкие (встречаются в 90 % случаев): лихорадка <38,5 и <48 ч, слабый или умеренный цистит <48 ч.
Умеренные (встречаются в 3 % случаев): более длительная или высокая лихорадка, выраженный или более длительный цистит.
Тяжелые (встречаются в 1–2 % случаев): аллергические реакции, инфекции мочеполовых органов (простатит, эпидидимит, орхит, пиелонефрит).
Очень тяжелые (встречаются в до 0,5 % случаев): гепатит, сепсис.
34.5.8.5. Принципы лечения осложнений внутрипузырной терапии БЦЖ
Легкие: специфического лечения не требуется. Для облегчения симптомов могут использоваться нестероидные противовоспалительные препараты. Курс иммунотерапии продолжается.
Умеренные и тяжелые: терапия БЦЖ прерывается до купирования симптомов. Выполняется посев мочи, назначается эмпирическая терапия (ципрофлоксацин 500 мг × 2 р/сутки). При неэффективности эмпирической терапии назначается изониазид 300 мг/сутки до купирования симптомов, но не менее 15 дней. Вопрос о продолжении БЦЖ решается в индивидуальном порядке с учетом прогноза по основанному заболеванию.
Очень тяжелые: требуется интенсивная терапия в условиях стационара: изониазид 300 мг/сутки, рифампицин 600 мг/сутки, преднизолон 40 мг/сутки до купирования сепсиса с последующим снижением дозы. Лечение изониазидом и рифампицином продолжают в тех же дозах в течение 3–6 мес. Дальнейшее проведение терапии БЦЖ противопоказано.
34.5.8.6. Схемы внутрипузырной иммунотерапии с использованием БЦЖ:
Индукционный курс:
- БЦЖ для внутрипузырного использования (100–120 мг вакцины «Имурон» в 50 мл изотонического раствора хлорида натрия), внутрипузырно на 1–2 часа, шесть еженедельных инстилляций через 2–3 недели после ТУР;
- смесь БЦЖ для внутрипузырного использования (100–120 мг вакцины «Имурон») и 6 млн ЕД интерферона-альфа2b в 50 мл изотонического раствора хлорида натрия, внутрипузырно на 2 часа, шесть еженедельных инстилляций через 2–3 недели после ТУР.
Поддерживающая терапия (после завершения индукционного курса):
- БЦЖ внутрипузырно на 1–2 часа, 1 раз в 4 недели до 1 года от начала иммунотерапии;
- по три еженедельных инстилляции БЦЖ внутрипузырно на 2 часа через 3, 6, 12, 18, 24, 30 и 36 мес. от начала иммунотерапии (схема SWOG, рисунок 34.2).
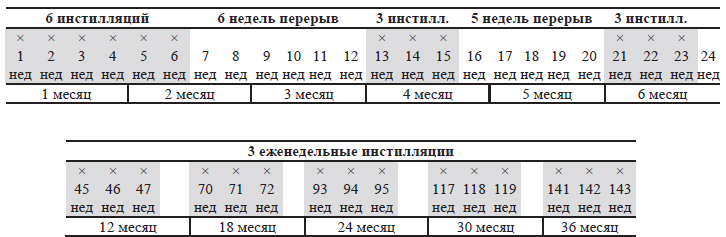
Рисунок 34.2 – Схема БЦЖ-терапии
34.5.8.7. Правила хранения и транспортировки вакцины БЦЖ.
Препарат необходимо хранить при температуре +2–8 Градусов. Транспортировка возможна всеми видами транспорта при температуре +2–8 Градусов в термоконтейнере.
34.6. Лечение мышечно-инвазивного рака мочевого пузыря
34.6.1. Общие принципы лечения
При первичном обращении мышечно-инвазивная опухоль выявляется у 50 % пациентов с раком мочевого пузыря, причем у 20–70 % (в зависимости от стадии и степени злокачественности) из них уже имеются регионарные, а у 10–15 % – отдаленные метастазы.
Стандартным методом лечения мышечно-инвазивного рака мочевого пузыря является неоадъювантная химиотерапия с последующей радикальной цистэктомией. У отдельных пациентов может использоваться органосохраняющая тактика, включающая комбинацию из ТУР/резекции мочевого пузыря, системной химиотерапии и/или лучевой терапии (мультимодальное лечение). Изолированное применение вышеуказанных методов не рекомендуется, однако может использоваться у пожилых ослабленных пациентов с противопоказаниями к комбинированной терапии.
34.6.2. Радикальная цистэктомия
Стандартной операцией при мышечно-инвазивном раке мочевого пузыря является радикальная цистэктомия. Операция включает удаление единым блоком вместе с мочевым пузырем и перивезикальной клетчаткой у мужчин – предстательной железы и семенных пузырьков с прилегающей жировой клетчаткой, проксимальных частей семявыносящих протоков и 1–2 см проксимальной уретры; у женщин – матки с придатками, передней стенки влагалища и уретры.
Во всех случаях выполняется тазовая лимфодиссекция. Лимфодиссекция при мышечно-инвазивном раке мочевого пузыря включает удаление наружных подвздошных, внутренних подвздошных, запирательных, пресакральных, а также общих подвздошных лимфоузлов. Расширение объема лимфодиссекции краниально до бифуркации аорты может способствовать радикальности операции и увеличивать выживаемость пациентов. При лимфодиссекции рекомендуется удаление как минимум 15 лимфатических узлов.
34.6.3. Отведение мочи
Методы отведения мочи после цистэктомии можно условно свести в три Группы: 1) отведение мочи на кожу без создания механизмов, удерживающих мочу (неконтинентные) – уретерокутанеостомия, операция Брикера; 2) отведение мочи на кожу с созданием механизмов, удерживающих мочу (континентный, «сухая стома») – операция Кока, резервуар Индиана (Indiana-pouch), резервуар РНПЦ ОМР им. Н.Н. Александрова; ортотопическая реконструкция мочевого пузыря – илеоцистопластика по Hautmann, илеоцистопластика по Studer.
34.6.3.1. Накожные неконтинентные методы отведения мочи.
Наиболее простой метод отведения мочи после удаления мочевого пузыря – на кожу (уретерокутанеостомия, нефростомия и т. п.). Эти методы используются у ослабленных пациентов с высоким риском операционного вмешательства, при расширении верхних мочевых путей как первый этап при удалении мочевого пузыря для временного отведения мочи перед последующим созданием искусственного мочевого пузыря, а также у неоперабельных пациентов как паллиативная операция. Наиболее удобным в этом отношении является метод отведения мочи в изолированный сегмент тонкой кишки, один конец которой в виде стомы выведен на кожу (операция Брикера). При этом мочеточники анастомозируются с сегментом кишки, а сама кишка является своего рода проводником для мочи (Ileum Conduit). Моча при этом методе отведения выделяется на кожу постоянно. Для сбора мочи при ее отведении по методу Брикера необходимо использование специальных клеящихся мочеприемников.
34.6.3.2. Ортотопическая реконструкция мочевого пузыря.
Оптимальным вариантом отведения мочи является создание искусственного «мочевого пузыря» из тонкой кишки с восстановлением нормального акта мочеиспускания. Показаниями к операции являются: возможность выполнения радикальной цистэктомии; удовлетворительная функция почек (креатинин <150 мкмоль/л); отсутствие метастазов (N0M0); отрицательный результат биопсии простатического отдела уретры. Из методик операции наибольшее распространение получили методики Studer и Hautmann.
34.6.3.3. Гетеротопический катетеризируемый резервуар («сухая стома»).
Выполнение ортотопической реконструкции мочевого пузыря невозможно у пациентов с поражением мочеиспускательного канала. Для данной категории пациентов предложена операция формирования гетеротопического континентного резервуара. Наиболее известной операцией подобного плана является методика формирования резервуара Кокка, предложенная в 1972 году. Может применяться также методика операции, разработанная в 2002 году в РНПЦ ОМР им. Н.Н. Александрова [Онкоурология. – № 1, 2005. – С. 35–41].
34.6.4. Морфологическое заключение по препарату после радикальной цистэктомии
Заключение морфолога должно включать детальную информацию о гистологическом подтипе опухоли, ее глубине инвазии и категории pT, состоянии хирургических краев резекции (включая радиальные, парапростатические, края мочеточника, уретры, влагалища), наличии лимфатической или сосудистой инвазии, присутствии карциномы in situ. Также необходимо указать количество удаленных лимфатических узлов и количество позитивных узлов.
34.6.5. Неоадъювантная и адъювантная полихимиотерапия
Неоадъювантная полихимиотерапия на основе цисплатина увеличивает общую 5-летнюю выживаемость на 5–8 %, поэтому она показана всем пациентам с мышечно-инвазивным переходно-клеточным (либо его вариантами) раком мочевого пузыря с удовлетворительной почечной функцией, отсутствием противопоказаний к цисплатину и отсутствием срочных показаний к цистэктомии. Проводится 3–4 курса химиотерапии по схеме M-VAC или GC. Неоадъювантная химиотерапия на основе карбоплатина не используется.
Пациентам после радикальной цистэктомии с pT3-4 и/или pN+, не получавшим неоадъювантной химиотерапии, показано проведение адъювантной полихимиотерапии на основе цисплатина (3–4 курса M-VAC или GC).
34.6.6. Органосохраняющее мультимодальное лечение
У отдельных пациентов может использоваться мультимодальная органосохраняющая терапия, включающая комбинацию из максимальной ТУР или резекции мочевого пузыря, системной химиотерапии и/или лучевой терапии. Показаниями к данному лечению могут быть небольшие одиночные неосложненные мышечно-инвазивные (cT2-T4a) опухоли без метастазов в лимфоузлах, гидронефроза и сопутствующей карциномы in situ у пациентов с адекватной функцией мочевого пузыря, особенно при выполнении макроскопически полной ТУР мочевого пузыря.
При одиночных опухолях в клинической стадии T2 локализующихся в зонах доступных для открытой резекции с обеспечением достаточных (2 см) краев резекции от видимой опухоли может выполняться открытая резекция мочевого пузыря с предварительным проведением неоадъювантной полихимиотерапии на основе цисплатина. Резекция мочевого пузыря должна быть произведена на всю глубину, включая удаление прилежащей части перивезикального жира, с гистологическим исследованием краев резекционной раны. Операция сочетается с тазовой лимфодиссекцией. Если при гистологическом исследовании в краях резекционной раны выявляются опухолевые клетки (R1), выполняется радикальная цистэктомия. При вовлечении в процесс устья мочеточника после резекции мочевого пузыря и удаления опухоли производится уретеронеоцистоанастомоз.
После ТУР проводится 3–4 курса полихимиотерапии на основе цисплатина (M-VAC, GC) или химиолучевое лечение. Последнее включает дистанционную лучевую терапию в традиционном режиме: РОД 1,8–2 Гр до СОД 40–50 Гр на фоне химиотерапии цисплатином. Цисплатин вводится в дозе 25 мг/м2 внутривенно в течение 60 мин. в 1, 2, 3, 4, 5-й и 36, 37, 38, 39, 40-й дни одновременно с лучевой терапией. Эффект лечения оценивается через 3 недели. При достижении полной или значительной резорбции опухоли химиолучевая терапия продолжается до СОД 60–64 Гр. При неполной резорбции или продолжении роста опухоли выполняется цистэктомия.
34.6.7. Органосохраняющие операции
У отдельных пациентов при отказе или противопоказаниях к радикальной цистэктомии или мультимодальному лечению может использоваться ТУР или открытая резекция мочевого пузыря как единственный метод лечения.
34.6.8. Дистанционная лучевая терапия
При лечении рака мочевого пузыря лучевая терапия может использоваться как самостоятельный метод и как составная часть комбинированного и комплексного лечения (см. мультимодальное лечение). У пациентов при противопоказаниях к радикальной операции, отказе от хирургического лечения, отказе или непереносимости мультимодального лечения проводится дистанционная лучевая терапия по радикальной программе. Для проведения лучевой терапии обязательно гистологическое подтверждение диагноза. Прогностическими факторами успеха лучевой терапии являются размер опухоли, наличие уретерогидронефроза и полнота предыдущей ТУР.
Лучевая терапия по радикальной программе осуществляется с помощью тормозного излучения линейного ускорителя (6–23 МэВ) или гамма-терапии (1,25 МэВ) в традиционном режиме фракционирования дозы (РОД 2 Гр, СОД 60–64 Гр) в течение 6–6,5 недель (ритм облучения – 5 раз в неделю). При возможности облучение сочетают с системным введением химиопрепаратов (цисплатин, 5-фторурацил, гемцитабин).
Лечение состоит из двух фаз. Первая фаза включает облучение всего мочевого пузыря и визуализируемой опухоли с или без регионарных тазовых лимфоузлов до СОД 40–45 Гр с использованием обычного фракционирования. Решение об облучении клинически непораженных регионарных лимфоузлов проводится с учетом состояния пациента. По завершении первой фазы облучение продолжается без перерыва на весь мочевой пузырь или визуализируемую опухоль до СОД 60–64 Гр. При наличии метастатически пораженных лимфоузлов подводится СОД 54–60 Гр на зоны поражения.
Использование лучевой терапии после операций без создания ортотопических резервуаров показано при нерадикальных операциях (R1–R2). В объем облучения включают зоны локализации остаточной опухоли, а также могут включать ложе мочевого пузыря и зону регионарных лимфоузлов с подведением СОД 45–50 Гр, Буст на зоны опухолевого поражения составляет СОД 54–60 Гр.
Показанием для паллиативной лучевой терапии является стадия Т4b, выраженные симптомы со стороны первичного очага (макрогематурия, боли) или метастазов. Обычно используются меньшие СОД (30–40 Гр) с разовой дозой в 2–3 Гр. Плохое общее состояние (индекс Карновского ниже 50 %) и значительное уменьшение емкости мочевого пузыря – противопоказания к паллиативной лучевой терапии.
Противопоказания к лучевой терапии (кроме паллиативной): сморщенный мочевой пузырь (объем менее 100 мл), предшествующее облучение таза, наличие остаточной мочи более 70 мл, камни мочевого пузыря, цистостомический дренаж, обострение цистита и пиелонефрита.
Предлучевая подготовка осуществляется на КТ/МРТ и рентгенсимуляторах в условиях 3D планирования. Предлучевая подготовка предусматривает положение пациента на спине (при необходимости использование фиксирующих устройств); пустой мочевой пузырь; катетеризацию мочевого пузыря катетером Фолея с введением 25–30 мл контрастного вещества в мочевой пузырь и 15 мл в баллон; обязательное контрастирование прямой кишки (при планировании облучения с боковых полей).
Объемы:
Макроскопический объем опухоли: макроскопическая опухоль, визуализируемая при КТ/МРТ/цистоскопии.
Клинический объем мишени таза: макроскопический объем опухоли + весь мочевой пузырь + лимфатические узлы (запирательные, наружные и внутренние подвздошные), проксимальная часть уретры, простата и простатическая часть уретры у мужчин.
Планируемый объем опухоли: клинический объем мишени + на 1,5–2,0 и 2–3 см выше (вероятно, можно уменьшить до 1 и 1,5–2,0 см в случае предварительного использования маркеров и лучевой терапии под визуальным контролем).
Объемы для буста: весь мочевой пузырь или его часть. Клинический объем мишени: макроскопический объем опухоли + 0,5 см. Планируемый объем мишени: клинический объем мишени + 1,5 см. Использование лучевой терапии с модулированной интенсивностью спорно. При ее назначении следует рассмотреть возможность лучевой терапии под визуальным контролем. Стандарт планируемого объема облучения: 90 %-я изодоза включает мочевой пузырь и 1,5–2 см за его пределами.
Ограничение по дозам облучения: 50 Гр на весь мочевой пузырь – 5–10 % отсроченных эффектов 3–4-й степени; 60 Гр на весь мочевой пузырь – 10–40 % отсроченных эффектов 3–4 степени; 60 Гр на более 1/3 пузыря – 5–10 % отсроченных эффектов, при 70 Гр – 20 %; уретра – максимальная доза <70 Гр ассоциирована с риском стриктуры <5 %; толерантная доза на тонкую кишку (5 % отсроченных эффектов 3–4-й степени за 5 лет) – не более 40 Гр.
34.6.9. Паллиативная терапия
При обструкции верхних мочевых путей выполняется нефростомия (предпочтительно пункционная). У отдельных пациентов выполняется отведение мочи в форме уретерокутанеостомии или операции Брикера. При выраженном кровотечении и боли может проводиться паллиативная дистанционная лучевая терапия или цистэктомия.
34.7. Лечение метастатического рака мочевого пузыря
При метастатическом раке мочевого пузыря используется системная химиотерапия. Проведение цисплатин-содержащей полихимиотерапии сопровождается регрессией опухоли у 40–70 % пациентов. Схемы на основе карбоплатина малоэффективны. Стандартными схемами первой линии химиотерапии при распространенном раке мочевого пузыря являются M-VAC и GC. Медиана выживаемости при проведении химиотерапии составляет 12–14 мес.
До 50 % пациентов не могут получать химиотерапию на основе цисплатина из-за противопоказаний (скорость клубочковой фильтрации <60 мл/мин, нарушение слуха 2 степени и более, сердечная недостаточность III степени и более по классификации NYHA или общее состояние по шкале ECOG ≥2). Таким пациентам показаны схемы на основе карбоплатина (GemCarbo). Пациентам с костными метастазами показано введение золедроновой кислоты.
Схемы полихимиотерапии:
GC:
Цисплатин 75 мг/м2 в 1 день
Гемцитабин 1000 мг/м2 в 1, 8, 15 дни
Повторные курсы каждые 28 дней.
M-VAC:
Метотрексат 30 мг/м2 внутривенно струйно в 1-й, 15-й и 22-й дни;
Винбластин 3 мг/м2 внутривенно струйно 2-й, 15-й и 22-й дни;
Доксорубицин 30 мг/м2 внутривенно в течение 20–30 мин во 2-й день;
Цисплатин 70 мг/м2 внутривенная инфузия в течение 60 мин во 2-й день с пре- и постгидратацией.
Химиопрепараты вводятся в 15 и 22 дни только при уровне лейкоцитов >2,5×109 и тромбоцитов >100×1012. Повторные курсы каждые 28 дней.
CMV:
Цисплатин 100 мг/м2 внутривенная инфузия со скоростью не более 1 мг/мин во 2-й день с пред- и постгидратацией.
Метотрексат 30 мг/м2 внутривенно струйно в 1-й и 8-й дни.
Винбластин 4 мг/м2 внутривенно струйно в 1-й и 8-й дни.
Повторные курсы через 3 недели.
GemCarbo:
Гемцитабин 1000 мг/м2 внутривенно в течение 30 мин. в 1-й и 8-й дни
Карбоплатин АUС 4,5 (4,5 × [СКФ + 25]) после окончания введения гемцитабина внутривенно в течение 1 ч. в 1-й день
Повторные курсы через 4 недели.
Информация
Источники и литература
-
Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2006-2019
- Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2006-2019 -
-
www.minzdrav.gov.by
- www.minzdrav.gov.by -
Информация
ГЛАВА 2
ОЦЕНКА ОБЩЕГО СОСТОЯНИЯ ОНКОЛОГИЧЕСКОГО ПАЦИЕНТА
Общее состояние онкологического пациента (Performance status) рекомендовано оценивать по индексу Карновского (0–100 баллов) или шкале ECOG (0–4 балла) (таблицы 2.1, 2.2).
Таблица 2.1. Индекс Карновского
Таблица 2.1. Индекс Карновского
|
Нормальная физическая активность, пациент не нуждается в специальном уходе
|
100 баллов | Состояние нормальное, нет жалоб и симптомов заболевания |
| 90 баллов | Нормальная активность сохранена, но имеются незначительные симптомы заболевания | |
| 80 баллов | Нормальная активность возможна при дополнительных усилиях, при умеренно выраженных симптомах заболевания | |
|
Ограничение нормальной активности при сохранении полной независимости пациента
|
70 баллов | Пациент обслуживает себя самостоятельно, но не способен к нормальной деятельности или работе |
| 60 баллов | Пациент иногда нуждается в помощи, но в основном обслуживает себя сам | |
| 50 баллов | Пациенту часто требуется помощь и медицинское обслуживание | |
|
Пациент не может обслуживать себя самостоятельно, необходим уход или госпитализация
|
40 баллов | Большую часть времени пациент проводит в постели, необходим специальный уход и посторонняя помощь |
| 30 баллов | Пациент прикован к постели, показана госпитализация, хотя терминальное состояние не обязательно | |
| 20 баллов | Сильные проявления болезни, необходима госпитализация и поддерживающая терапия | |
| 10 баллов | Умирающий пациент, быстрое прогрессирование заболевания | |
| 0 баллов | Смерть |
Таблица 2.2. Оценка статуса пациента по шкале ECOG
| Оценка | |
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания (90–100 баллов по шкале Карновского) |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70–80 баллов по шкале Карновского) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно – в вертикальном положении (50–60 баллов по шкале Карновского) |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования (30–40 баллов по шкале Карновского) |
| 4 | Пациент, совершенно не способен к самообслуживанию, прикован к креслу или постели (10–20 баллов по шкале Карновского) |
Приложение
ТАБЛИЦЫ СООТВЕТСТВИЯ «СТАДИЯ-TNM» ДЛЯ РЯДА ЛОКАЛИЗАЦИЙ: ТОНКИЙ КИШЕЧНИК, АМПУЛА ФАТЕРОВА СОСКА, ТИМОМА, МЕЗОТЕЛИОМА ПЛЕВРЫ, КАРЦИНОМА МЕРКЕЛЯ КОЖИ, КОРА НАДПОЧЕЧНИКА
ТОНКИЙ КИШЕЧНИК C17
Таблица 1. Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1, Т2 | N0 | M0 |
| Стадия IIА | Т3 | N0 | M0 |
| Стадия IIB | T4 | N0 | M0 |
| Стадия IIIA | Любая Т | N1 | M0 |
| Стадия IIIB | Любая Т | N2 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
АМПУЛА ФАТЕРОВА СОСКА C24.1
Таблица 2. Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия IA | Т1a | N0 | M0 |
| Стадия IB | Т1b, Т2 | N0 | M0 |
| Стадия IIА | Т3a | N0 | M0 |
| Стадия IIB | Т3b | N0 | M0 |
| Стадия IIIA | Т1a, Т1b, Т2, T3 | N1 | M0 |
| Стадия IIIB | Т4 | Любая N | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
ТИМОМА C37, C38.1-3
Таблица 3. Группировка по стадиям
| Стадия I | T1 | N0 | M0 |
| Стадия II | T2 | N0 | M0 |
| Стадия IIIА | T3 | N0 | M0 |
| Стадия IIIB | T4 | N0 | M0 |
| Стадия IVA | Любая Т |
N1
N0, N1
|
M0
M1A
|
| Стадия IVB | Любая Т | Любая N | M1B |
МЕЗОТЕЛИОМА ПЛЕВРЫ C45.0
Таблица 4. Группировка по стадиям
| Стадия IA | T1 | N0 | M0 |
| Стадия IB | T2, T3 | N0 | M0 |
| Стадия II | T1, T2 | N1 | M0 |
| Стадия IIIА | T3 | N1 | M0 |
| Стадия IIIB | T1, T2, T3, T4 |
N1 Любая N |
M0 |
| Стадия IV | Любая Т | Любая N | M1 |
КАРЦИНОМА МЕРКЕЛЯ C44, C63.2
Таблица 5а. Группировка по стадиям клиническая
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1 | N0 | M0 |
| Стадия IIА | T2, Т3 | N0 | M0 |
| Стадия IIB | Т4 | N0 | M0 |
| Стадия III | Любая Т | N1, N2, N3 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
Таблица 5б. Группировка по стадиям патоморфологическая
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1 | N0 | M0 |
| Стадия IIА | Т2, T3 | N0 | M0 |
| Стадия IIB | Т4 | N0 | M0 |
| Стадия IIIA |
Т0
Т1, Т2, T3, Т4
|
N1b
N1a
|
M0 |
| Стадия IIIB | Любая Т | N1, N2, N3 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
КОРА НАДПОЧЕЧНИКА C74.0
Таблица 6. Группировка по стадиям
| Стадия I | Т1 | N0 | M0 |
| Стадия II | Т2 | N0 | M0 |
| Стадия III |
Т1, T2
Т3, T4
|
N1
N0, N1
|
M0 |
| Стадия IV | Любая Т | Любая N | M1 |
Под редакцией
д-р мед. наук, проф. О.Г.Суконко,
д-р мед. наук, проф., член-корр. НАН Беларуси С.А.Красный
Авторский коллектив:
Антоненкова Нина Н., д.м.н., доц.;
Ануфреенок И.В., к.м.н.;
Артемова Н.А., д.м.н., доц.;
Баранов А.Ю., к.м.н.;
Баранов Е.В., к.м.н.;
Бармотько М.А.;
Грачев Ю.Н., к.м.н.;
Демешко П.Д., д.м.н.;
Демидчик Ю.Е., д.м.н., проф.;
Дзюбан В.П.;
Доломанова Е.В.;
Дубровский А.Ч., к.м.н.;
Евмененко А.А.;
Ермаков Н.Б., к.м.н.;
Жаврид Э.А., д.м.н., проф.;
Жарков В.В, д.м.н., проф.;
Жиляева Е.П.;
Жуковец А.Г., к.м.н.;
Зеленкевич И.А., к.м.н.;
Ильин И.А., к.м.н.;
Караник В.С., к.м.н.;
Карман А.В., к.м.н., доц.;
Киселев П.Г., к.м.н.;
Клименко Д.П.;
Колядич Г.И., к.м.н.;
Кондратович В.А.;
Котов А.А., к.м.н.;
Кохнюк В.Т., д.м.н., проф.;
Красный С.А., д.м.н., проф.;
Крутилина Н.И., д.м.н., проф.;
Курченков А.Н., к.м.н.;
Курчин В.П., д.м.н.;
Левин Л.Ф.;
Леонова Т.А.;
Мавричев А.С., д.м.н., проф.;
Мавричев С.А., к.м.н.;
Малькевич В.Т., д.м.н., доц.;
Маньковская С.В.;
Матылевич О.П., к.м.н.;
Минайло И.И., к.м.н.;
Минич А.А., к.м.н.;
Моисеев П.И., к.м.н.;
Набебина Т.И., к.м.н.;
Науменко Л.В., к.м.н.;
Океанов А.Е., д.м.н., проф.;
Пархоменко Л.Б., к.м.н., доц.;
Петрушенко Ю.И.;
Писаренко А.М.;
Поляков С.Л., к.м.н.;
Портянко А.С., д.м.н., доц.;
Прохорова В.И., д.м.н., проф.;
Ребеко И.В., к.м.н.;
Ревтович М.Ю., к.м.н.;
Ролевич А.И., д.м.н.;
Рындин А.А.;
Рябчевский А.Н.;
Синайко В.В., к.м.н.;
Субоч Е.И., к.м.н.;
Суколинская Е.В., к.м.н.;
Суконко О.Г., д.м.н., проф.;
Суслова В.А., к.м.н.;
Тризна Н.М., к.м.н.;
Фридман М.В., д.м.н.;
Шаповал Е.В., д.м.н.;
Шмак А.И., д.м.н.
Список сокращений:
CTV – клинический объем облучения
GTV – определяемый объем опухоли
ICD – Международная классификация болезней
ITC – отдельные опухолевые клетки
PTV – планируемый объем облучения
UICC – Международный противораковый союз
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
АЧТВ – активированное частичное тромбопластиновое время
ВАТС – видео-ассистированной тораскопии
ВОЗ – Всемирная организация здравоохранения
ВПЧ – вирус папилломы человека
ВЯВ – внутренняя яремная вена;
ГИСО – гастроинтенстинальные стромальные опухоли
ГПДР – гастропанкреатодуоденальная резекция
ГЦР – гепатоцеллюлярный рак
ЖКТ – желудочно-кишечный тракт
ИГХ – иммуногистохимическое исследование
ИОУЗИ – интраоперационное УЗИ
КТ – компьютерная томография
ЛДГ – лактатдегидрогеназа
МНО – международное нормализованное отношение
МРТ – магнитно-резонансная томография
МСКТ – многослойная компьютерная томография
ОГК – органы Грудной клетки
ПВ – протромбиновое время
ПЖ – поджелудочная железа
ПЭТ – позитронно-эмиссионная томография
РЖП – рак желчного пузыря
РОД – разовая облучающая доза
РПК – рак прямой кишки
РПХГ – ретроградная панкреатохолангиография
СОД – суммарная облучающая доза
ТВ – тромбиновое время
ТДПЭ – тотальная дуоденопанкреатэктомия
УЗИ – ультразвуковое исследование
ФВД – функция внешнего дыхания
ФДГ – фтордезоксиглюкоза
ФЭГДС – фиброгастродуоденоскопия
ХЦР – холангиоцеллюлярного рака
ЦНС – центральная нервная система
ЧЧХГ – чрескожная чреспеченочная холангиография
ЧЭИ – чрескожная этаноловая инъекция
ЩФ – щелочная фосфатаза
ЭВВ – эмболизация воротной вены
ЭКГ – электрокардиограмма
ЭУЗИ – эндоскопическое ультразвуковое исследование
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.