Диагностика и лечение злокачественных новообразований: Опухоли яичников, маточных (фаллопиевых) труб, первичная перитонеальная карцинома
 Версия: Клинические протоколы 2006-2019 (Беларусь)
Версия: Клинические протоколы 2006-2019 (Беларусь)
Злокачественное новообразование брюшины неуточненной части (C48.2), Злокачественное новообразование других и неуточненных женских половых органов (C57), Злокачественное новообразование забрюшинного пространства (C48.0), Злокачественное новообразование уточненных частей брюшины (C48.1), Злокачественное новообразование яичника (C56)
Онкология
Общая информация
Краткое описание
ПОСТАНОВЛЕНИЕ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
6 июля 2018 г. № 60
Об утверждении клинического протокола «Алгоритмы диагностики и лечения злокачественных новообразований»
На основании подпункта 8.3 пункта 8 Положения о Министерстве здравоохранения Республики Беларусь, утвержденного постановлением Совета Министров Республики Беларусь от 28 октября 2011 г. № 1446 «О некоторых вопросах Министерства здравоохранения и мерах по реализации Указа Президента Республики Беларусь от 11 августа 2011 г. № 360», Министерство здравоохранения Республики Беларусь
ПОСТАНОВЛЯЕТ:
1. Утвердить прилагаемый клинический протокол «Алгоритмы диагностики и лечения злокачественных новообразований».
2. Начальникам главных управлений по здравоохранению областных исполнительных комитетов, председателю комитета по здравоохранению Минского городского исполнительного комитета, руководителям государственных организаций, подчиненных Министерству здравоохранения Республики Беларусь, обеспечить проведение диагностики, лечение и профилактику заболеваний в соответствии с клиническим протоколом.
3. Настоящее постановление вступает в силу после его официального опубликования.
Министр В.А.Малашко
УТВЕРЖДЕНО
Постановление
Министерства здравоохранения
Республики Беларусь
06.07.2018 № 60
КЛИНИЧЕСКИЙ ПРОТОКОЛ «Алгоритмы диагностики и лечения злокачественных новообразований»
ГЛАВА 27
ОПУХОЛИ ЯИЧНИКОВ, МАТОЧНЫХ (ФАЛЛОПИЕВЫХ) ТРУБ, ПЕРВИЧНАЯ ПЕРИТОНЕАЛЬНАЯ КАРЦИНОМА (ПЕРВИЧНЫЙ ПЕРИТОНЕАЛЬНЫЙ РАК)
Злокачественные опухоли яичников (С56), маточных (фаллопиевых) труб (С57), первичная перитонеальная карцинома (первичный перитонеальный рак).
Классификация
ГЛАВА 1
ОБЩИЕ СВЕДЕНИЯ О TNM КЛАССИФИКАЦИИ
Система TNM для классификации злокачественных опухолей была разработана французом Р. Denoix в 1943–1952 гг. В 1953 г. Комитет по номенклатуре опухолей и статистике, организованный UICC, и Международная комиссия по стадированию рака достигли соглашения по классификации анатомической распространенности опухолей на основе системы TNM. В 1954 г. Международный противораковый союз (UICC) создает Комитет по клинической классификации и прикладной статистике, который в 1958 г. публикует первые рекомендации по клинической классификации рака молочной железы и гортани.
В результате многолетней деятельности Комитета в 1968 г. издается первая редакция TNM классификация злокачественных опухолей. По мере разработки классификации для новых локализаций опухолей и уточнения более ранних рекомендаций в 1974, 1978, 1987, 1997, 2002 и 2009 гг. публикуются 2-я, 3-я, 4-я, 5-я, 6-я и 7-я редакции.
Настоящая (8-я) редакция правил классификации и стадирования полностью соответствуют 8-й редакции руководства по стадированию рака и одобрена всеми национальными TNM комитетами.
В данном руководстве используются морфологические формы злокачественных новообразований в соответствии с классификацией МКБ-О-3, адаптированной под МКБ-10 (проставление кодов врачом-патологом в морфологическом заключении обязательно).
UICC признает необходимость постоянства TNM классификации в течение определенного периода времени, необходимого для накопления данных. Поэтому классификация не должна изменяться до тех пор, пока не будут сделаны крупные достижения в диагностике и лечении злокачественных опухолей, требующие пересмотра настоящей классификации.
Общие правила системы TNM.
TNM система для описания анатомической распространенности болезни основывается на оценке 3 компонентов:
Т – распространение первичной опухоли;
N – отсутствие или наличие метастазов в регионарных лимфатических узлах и степень их поражения;
М – отсутствие или наличие отдаленных метастазов.
К этим трем компонентам добавляются цифры, указывающие на распространенность злокачественного процесса:
Т0, Т1, Т2, Т3, Т4; N0, N1, N2, N3; M0, M1.
В действительности система является «стенографическим» описанием распространенности злокачественной опухоли.
Общие правила классификации, применяемые для опухолей всех локализаций, следующие:
Для каждой локализации имеются две классификации:
Клиническая классификация, обозначаемая TNM (или cTNM). Она основывается на результатах обследования до лечения. Эти данные получают при врачебном осмотре, лучевой диагностике, эндоскопии, биопсии, хирургическом диагностическом вмешательстве и других методах обследования.
Патологическая классификация, обозначаемая pTNM. Она основана на данных обследования до лечения, дополненных или измененных в результате хирургического вмешательства и морфологического исследования. Гистологическая оценка первичной опухоли включает резецированную опухоль или биопсию, позволяющую оценить наивысшую Т категорию. Гистологическая оценка регионарных лимфатических узлов включает исследование удаленных узлов в количестве, адекватном для установления отсутствия метастазов в регионарных лимфатических узлах (pN0) и достаточном для оценки наиболее высокой pN категории. Отдаленные метастазы должны быть подтверждены при микроскопическом исследовании (рМ).
После обозначения Т, N, М и/или рТ, pN и рМ категорий они могут группироваться по стадиям. TNM классификация и стадии, установленные однажды, должны оставаться неизменными в медицинских документах. Клиническая стадия служит основой для выбора лечения, тогда как патологическая стадия обеспечивает наиболее точные данные для оценки прогноза и расчета конечных результатов.
При сомнении в правильности оценки Т, N или М категории должно быть выбрано меньшее значение категории, (т.е. меньшее распространение опухоли).
В случае множественных опухолевых очагов в органе должна классифицироваться опухоль с более высокой Т категорией, а в скобках указываться множественность (т) или количество опухолей, например: Т2(т) или Т1(5). При одновременном поражении парных органов каждая опухоль должна классифицироваться отдельно. При опухолях печени, яичников и фаллопиевой трубы множественные очаги поражения являются критерием Т классификации.
Выявление второй опухоли в одном органе в течение 2 месяцев с момента выявления первой нужно расценивать как синхронное поражение.
TNM категории и стадия могут подразделяться или объединяться для клинических и научных целей (например, любые Т, N или М могут быть разбиты на подгруппы). Однако рекомендованные основные обозначения не должны изменяться.
Анатомические области и локализации.
Локализации в этой классификации обозначаются кодовым номером Международной классификации онкологических болезней.
TNM/pTNM классификация.
Используются следующие общие определения:
Т/рТ – первичная опухоль:
TX/рTX – первичная опухоль не может быть оценена;
Т0/рТ0 – нет доказательств первичной опухоли;
Tis/pTis – рак «in situ»;
Т1/рТ1, Т2/рТ2, ТЗ/рТЗ, Т4/рТ4 – размер или местное распространение опухоли в порядке увеличения.
N/pN – регионарные лимфатические узлы:
Nx/pNx – регионарные лимфатические узлы не могут быть оценены;
N0/pN0 – отсутствуют метастазы в регионарных лимфоузлах;
Nl/pNl, N2/pN2, N3/pN3 – возрастающее поражение регионарных лимфатических узлов.
Непосредственное распространение первичной опухоли на лимфатические узлы классифицируется как метастазы в лимфатических узлах. Метастаз в любом лимфоузле, не относящемся к регионарному, расценивается как отдаленный метастаз.
Опухолевый узел в области регионарных лимфатических узлов, не имеющий гистологических признаков лимфоузла, классифицируется как метастаз в регионарном лимфатическом узле, если имеет форму и ровный контур лимфатического узла. Опухолевый узел с неровным контуром классифицируется в рТ категории.
Когда размер является критерием pN классификации, производится измерение метастатического очага, а не всего лимфатического узла.
Случаи с микрометастазами, когда размеры метастазов не превышают 0,2 см, могут обозначаться добавлением «(mi)», например: pNl(mi) или pN2(mi).
М/рМ – отдаленные метастазы:
МХ/рМХ – отдаленные метастазы не могут быть оценены;
М0/рМ0 – нет отдаленных метастазов;
М1/рМ1 – имеются отдаленные метастазы;
Категория М может быть в дальнейшем специфицирована в соответствии со следующими обозначениями (таблица 1.1):
Таблица 1.1
| Легкие | PUL | Костный мозг | MAR |
| Кости | OSS | Плевра | PLE |
| Печень | HEP | Брюшина | PER |
| Головной мозг | BRA | Надпочечники | ADR |
| Лимфоузлы | LYM | Кожа | SKI |
| Другие | ОТН |
Подразделения TNM
Главные категории в классификации могут иметь подразделения, придающие критерию большую специфичность (например; Tla, lb или N2a, 2b).
Сигнальный лимфоузел
Это первый лимфоузел, получающий лимфу из первичной опухоли. Если в нем имеется метастаз, то и другие лимфоузлы могут быть поражены. Если этот лимфоузел не поражен, то и наличие метастазов в других узлах маловероятно. Иногда встречаются более одного сигнальных лимфоузлов.
При оценке сигнального лимфоузла применяются следующие определения:
Главные категории в классификации могут иметь подразделения, придающие критерию большую специфичность (например; Tla, lb или N2a, 2b).
Сигнальный лимфоузел
Это первый лимфоузел, получающий лимфу из первичной опухоли. Если в нем имеется метастаз, то и другие лимфоузлы могут быть поражены. Если этот лимфоузел не поражен, то и наличие метастазов в других узлах маловероятно. Иногда встречаются более одного сигнальных лимфоузлов.
При оценке сигнального лимфоузла применяются следующие определения:
- pNX(sn) – сигнальный узел не может быть оценен; pN0(sn) – нет поражения сигнального узла;
- pN1(sn) – есть поражение сигнального узла.
Отдельные опухолевые клетки
Отдельные опухолевые клетки (ITC) представляют собой единичные опухолевые клетки или маленькие кластеры клеток не более 0,2 мм в наибольшем измерении. ITC обычно не демонстрируют метастатической активности (пролиферацию или реакцию стромы) или инвазии стенок сосудистого или лимфатического синуса. Случаи с ITC в лимфатических узлах или отдаленных органах и тканях должны классифицироваться как N0 или М0 соответственно.
Это же применимо и к случаям, когда наличие опухолевых клеток или их компонентов подтверждается неморфологическими исследованиями, такими как проточная морфометрия или анализ ДНК.
Случаи с ITC должны анализироваться отдельно.
Классификация ITC:
- pN0 – гистологически не выявляются метастазы в регионарных лимфатических узлах, не проводились исследования по выявлению ITC;
- pN0(i-) – гистологически нет метастазов в регионарных лимфатических узлах, негативные морфологические данные по выявлению ITC;
- pN0(i+) – гистологически нет метастазов в регионарных лимфатических узлах, позитивные морфологические данные по выявлению ITC;
- pN0(mol-) – гистологически нет метастазов в регионарных лимфатических узлах, негативные неморфологические данные по выявлению ITC;
- pN0 (mol+) – гистологически нет метастазов в регионарных лимфатических узлах, неморфологическими методами выявляются ITC.
При исследовании ITC в сигнальном лимфоузле к обозначениям выше приведенной классификации в скобках указывается «(sn)», например: pN0(i+) (sn).
Отдельные опухолевые клетки, выявленные в костном мозгу морфологическими методами, классифицируются аналогично схеме для N, например: pM0(i+), а неморфологическими – pM0(mol+).
Гистопатологическая дифференцировка.
Это стадирование позволяет оценить степень агрессивности опухолей некоторых гистологических типов и может влиять на прогноз и выбор лечения.
Для большинства локализаций выделяется 4 степени дифференцировки опухолей:
- G1 – хорошо дифференцированные;
- G2 – умеренно дифференцированные;
- G3 – низко дифференцированные;
- G4 – недифференцированные.
При наличии различных степеней дифференцировки в опухоли указывается наименее благоприятная степень.
Саркомы костей и мягких тканей классифицируется также с использованием градаций «высокая степень» и «низкая степень» дифференцировки.
Для некоторых форм рака (молочной железы, тела матки, печени) рекомендуются специальные системы стадирования по степеням.
Дополнительные дескрипторы.
Для идентификации особых случаев в TNM/pTNM используются символы m, у, r, а.
Хотя они не влияют на группировку по стадиям, но указывают опухоли, которые должны анализироваться отдельно:
- m – используется для обозначения множественных опухолей одной локализации;
- у – в тех случаях, когда классификация приводится в течение или после проведения комбинированного (многокомпонентного) лечения, cTNM или pTNM категория обозначается префиксом «у», например: ycTNM или ypTNM. При оценке распространения опухоли до начала комбинированного лечения символ «у» не исключается;
- r – рецидив опухоли после радикального лечения при классификации обозначается префиксом «r» (rcTNM или rpTNM);
- а – применяется для обозначения классификации опухолей, впервые выявленных при аутопсии.
Необязательные дескрипторы.
L – инвазия лимфатических сосудов.
Классифицируется как LX, L0 и L1.
V – инвазия вен.
Классифицируется как VX, VO, VI (микроскопическая инвазия) и V2 (макроскопическая инвазия). Макроскопическое вовлечение стенки вены при отсутствии опухоли в просвете сосуда классифицируется как V2.
С-фактор
С-фактор или «фактор надежности» отражает достоверность классификации с учетом использованных методов диагностики. Его использование не является обязательным.
Определения С-фактора:
- С1 – данные стандартных диагностических методов (осмотр, пальпация, рентгенологическое исследование, эндоскопическое исследование),
- С2 – данные, полученные при использовании специальных диагностических методов (рентгенологическое исследование в специальных проекциях, томография, компьютерная томография, ультразвуковое исследование, лимфография, ангиография, сцинтиграфия, магнитно-резонансная томография, ПЭТ/КТ, эндоскопия, биопсия, цитологическое исследование);
- С3 – данные хирургического диагностического вмешательства, включая биопсию и цитологическое исследование;
- С4 – данные, полученные после радикальной операции и гистологического исследования удаленного препарата;
- С5 – данные патологоанатомического вскрытия.
Степени С-фактора могут использоваться при описании категорий Т, N и М (например: Т3С2, N2C1, М0С2).
Клиническая классификация TNM соответствует CI, С2 и С3 степеням, тогда как pTNM эквивалентна С4.
Классификация остаточных опухолей (R)
TNM/pTNM классификация описывает анатомическую распространенность опухоли без рассмотрения вопросов лечения. R-классификация описывает статус опухоли после лечения. Она отражает эффект лечения и является прогностическим фактором. При R- классификации оценивается не только первичная опухоль, но и остающиеся отдаленные метастазы.
Эта классификация может применяться после хирургического лечения, лучевой или химиотерапии, а также после комбинированного лечения. После консервативного лечения остаточная опухоль оценивается клиническими методами. После хирургического лечения R-классификация требует тесного сотрудничества хирурга и морфолога.
Случаи с макроскопически определяемой остаточной опухолью (R2) могут подразделяться на R2a (без микроскопического подтверждения) и R2b (микроскопически подтвержденные).
R0 группа может включать пациентов как с М0, так и с Ml. В последнем случае отдаленные метастазы, как и первичная опухоль, должны быть полностью удалены. Трудности с R-классификацией могут возникнуть при удалении опухоли по частям, а не «en blok». В таких случаях уместна категория RX.
Наличие микроскопически определяемой инвазивной опухоли по линии резекции классифицируется как R1, а в случае неинвазивной карциномы – R1 (is).
Группировка по стадиям
Комбинация всех значений дескрипторов TNM позволяет получить 24 категории TNM, описывающие распространенность опухоли. Для табличного представления данных и анализа эти категории объединяются в ограниченное количество групп – стадий. Каждая стадия более или менее однородна по прогнозу и критерию выживаемости относящихся к ней пациентов.
Карцинома «in situ» относится к стадии 0, а опухоли с отдаленными метастазами – к стадии IV (за исключением некоторых локализаций, например, папиллярного и фолликулярного рака щитовидной железы).
Для патологической стадии необходимо морфологическое исследование достаточного количества тканей, позволяющее оценить наибольшее значение Т и N. Если же имеется морфологическое подтверждение отдаленных метастазов, то и классификация (рМ1) и стадия являются патологическими.
Термин «стадия» употребляется только для комбинаций Т, N, М или рТ, pN или рМ категорий. Необходимо избегать выражений типа «Т стадия» или «N стадия»
ОПУХОЛИ ЯИЧНИКОВ, МАТОЧНЫХ (ФАЛЛОПИЕВЫХ) ТРУБ, ПЕРВИЧНАЯ ПЕРИТОНЕАЛЬНАЯ КАРЦИНОМА (ПЕРВИЧНЫЙ ПЕРИТОНЕАЛЬНЫЙ РАК)

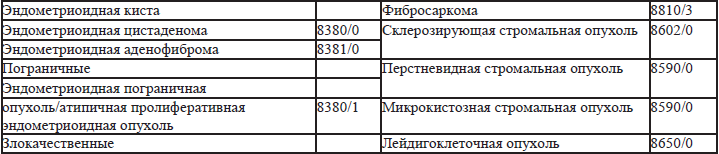
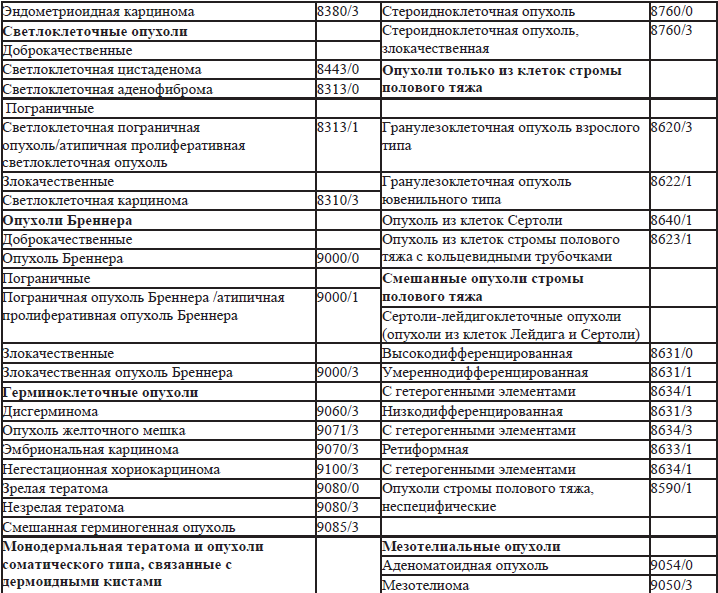
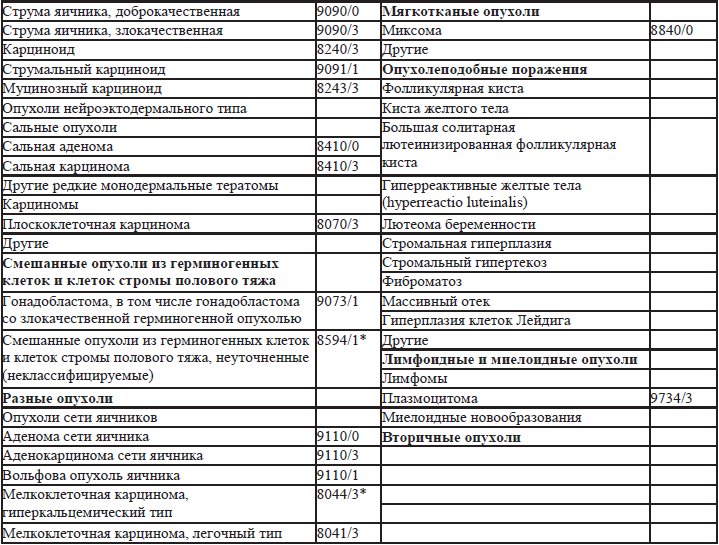

27.2. Классификация ВОЗ опухолей маточных труб (2013) (табл. 27.2)
Таблица 27.2. Классификация ВОЗ опухолей маточных труб
27.1. Классификация ВОЗ опухолей яичников 1, 2, 3(2013).
В 2013 году опубликовано 4-е издание классификации опухолей яичников. В отличие от 3-го издания, термин «поверхностные эпителиально-стромальные опухоли» заменен на «эпителиальные», «аденокарцинома» заменен на «карцинома», серозные карциномы подразделены на low и high-grade (низкой и высокой степени злокачественности). Нет деления муцинозных опухолей на кишечный и цервикальный варианты. Для пограничных опухолей принято двойное обозначение «пограничная опухоль/атипичная пролиферативная опухоль». Введены дополнительные коды: серозно-муцинозные, смешанные эпителиальные, мезенхимальные и редкие опухоли яичников. В самостоятельную Группу выделены мезотелиальные опухоли. Для пограничных опухолей исключено понятие инвазивный имплант и заменено на термин – имплант (табл. 27.1).
Таблица 27.1. Классификация ВОЗ опухолей яичников





27.2. Классификация ВОЗ опухолей маточных труб (2013) (табл. 27.2)
Таблица 27.2. Классификация ВОЗ опухолей маточных труб
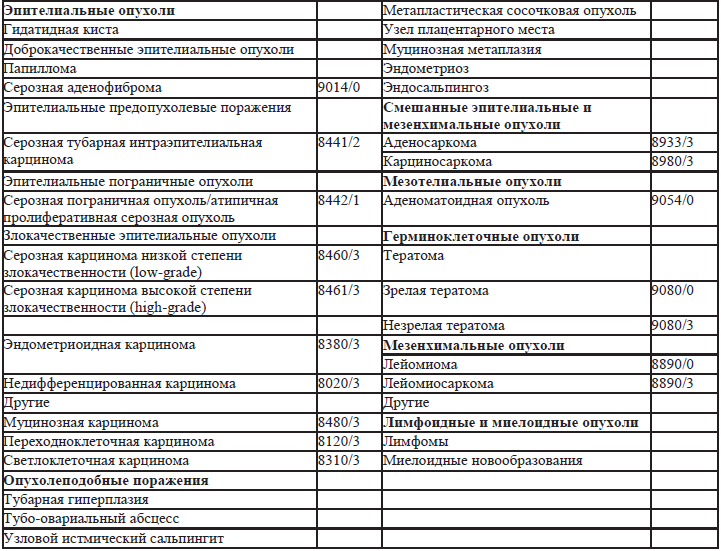
27.3. Классификация ВОЗ опухолей брюшины (2013) (табл. 27.3).
Таблица 27.3. Классификация ВОЗ опухолей брюшины
| Мезотелиальные опухоли |
Экстра-гастроинтестинальная стромальная опухоль желудочно-кишечного тракта
|
8936/3 | |
| Аденоматоидная опухоль | 9054/0 | ||
|
Хорошо дифференцированная сосочковая мезотелиома
|
9050/0 | ||
| Эндометриоидные стромальные опухоли | |||
| Злокачественная мезотелиома | 9050/3 |
Эндометриоидная стромальная саркома низкой степени злокачественности (lowgrade)
|
8931/3 |
| Эпителиальные опухоли Мюллерова типа | |||
|
Серозная пограничная опухоль /атипичная пролиферативная серозная опухоль
|
8442/1 |
Эндометриоидная стромальная саркома высокой степени злокачественности (high-grade)
|
8930/3 |
|
Серозная карцинома низкой степени злокачественности (low-grade)
|
8460/3 | Опухолеподобные поражения | |
|
Серозная карцинома высокой степени злокачественности (high-grade)
|
8461/3 | Мезотелиальная гиперплазия | |
| Другие | Перитонеальная инклюзионная киста | 9055/0 | |
| Гладкомышечные опухоли | Переходноклеточная метаплазия | ||
|
Диссеминированный перитонеальный лейомиоматоз
|
8890/1 | Эндометриоз | |
| Эндосальпингоз | |||
| Опухоли неопределенного происхождения | Гистиоцитарный узел | ||
|
Десмопластическая мелко-круглоклеточная опухоль
|
8806/3 | Эктопия децидуальной ткани | |
| Спленоз | |||
| Разные первичные опухоли | Другое | ||
| Солитарная фиброзная опухоль | 8815/1* | Вторичные опухоли | |
|
Злокачественная солитарная фиброзная опухоль
|
8815/3 | Метастатическая карцинома | |
|
Муцинозная опухоль низкой степени злокачественности, связанная с псевдомиксомой брюшины
|
|||
| Тазовый фиброматоз | 8822/1 | ||
|
Воспалительная миофибробластическая опухоль
|
8825/1 | Метастатическая саркома | |
| Глиоматоз | |||
| Кальцифицирующаяся фиброзная опухоль | 8817/0* |
Примечания:
1 Морфологические коды установлены Международной Классификацией Болезней, рубрика
Онкология (ICD-O) (2000). Потенциал опухоли закодирован как: /0 для доброкачественных опухолей, /1–для пограничных опухолей (пограничные опухоли яичников кодируется как рак яичника C56), /2 для рака in situ и интраэпителиальных неоплазий высокой степени (III степени) и /3 для злокачественных опухолей.
2 Классификация является модификацией предыдущей гистологической классификации опухолей ВОЗ (2002), с учетом современных представлений об опухолях.
3 Проставление кодов врачом-патологом в морфологическом заключении обязательно.
* Новые коды одобрены Комитетом МАИР/ВОЗ для ICD-O в 2012 г.
Правила классификации: классификация применяется для злокачественных опухолей яичников, как эпителиальных, включая пограничные опухоли, так и неэпителиальных. Классификация применяется также для злокачественных опухолей маточных труб, карцином брюшины.
Для оценки T, N, M категорий выполняются следующие мероприятия:
Стадии по FIGO основаны на хирургическом стадировании (TNM стадии базируются на клинической и/или патологической классификации).
27.5.1. Т – первичная опухоль.
Примечание:
27.5.2. N – регионарные лимфатические узлы
27.5.3. М – отдаленные метастазы
27.5.4. рTNM – патогистологическая классификация
27.4. Злокачественные опухоли яичников (С56), маточных (фаллопиевых) труб (С57), первичная перитонеальная карцинома (первичный перитонеальный рак).
27.5. Классификации FIGO и TNM (2016).
Определение категорий TNM соответствуют стадиям по классификации FIGO.
Правила классификации: классификация применяется для злокачественных опухолей яичников, как эпителиальных, включая пограничные опухоли, так и неэпителиальных. Классификация применяется также для злокачественных опухолей маточных труб, карцином брюшины.
Необходима морфологическая верификация диагноза с определением гистотипа опухоли.
Особенности метастазирования обусловили значительные отличия в подходах к стадированию процесса. В отличие от большинства опухолей, при которых данные клинических исследований используются для установления стадии заболевания, рак яичников стадируется в ходе лапаротомии.
Регионарными лимфатическими узлами для рака яичников являются: гипогастральные (обтураторные), общие подвздошные, наружные подвздошные, латеральные сакральные, парааортальные, ретроперитонеальные.
Для оценки T, N, M категорий выполняются следующие мероприятия:
T, N, M – клиническое обследование, данные методов визуализации опухоли, хирургическое вмешательство (лапароскопия/лапаротомия).
Стадии по FIGO основаны на хирургическом стадировании (TNM стадии базируются на клинической и/или патологической классификации).
27.5.1. Т – первичная опухоль.
TNMFIGO
TX Первичная опухоль не может быть оценена
Т0 Первичная опухоль не определяется
Т1 I Опухоль ограничена яичниками (одним или двумя) или маточной трубой (трубами)
Т1а IА Опухоль ограничена одним яичником или стенкой маточной трубы, без прорастания капсулы/поверхности яичника, маточной трубы; нет злокачественных клеток в асцитической жидкости/смывах с брюшины
Т1b IB Опухоль ограничена двумя яичниками/маточными трубами, без прорастания капсулы яичника/поверхности маточной трубы; нет злокачественных клеток в асцитической жидкости или смывах с брюшины
Т1с IC Опухоль ограничена одним или двумя яичниками, или маточными трубами и сопровождается любым из следующих признаков:
T1c1 IC1 Повреждение капсулы опухоли во время операции
T1c2 IC2 Капсула повреждена до операции или опухоль на поверхности яичника/маточной трубы
T1c3 IC3 Наличие злокачественных клеток в асцитической жидкости или смывах с брюшины
Т2 II Опухоль поражает один или оба яичника, или маточную(ые) трубу(ы) с распространением на брюшину малого таза, или первичная перитонеальная карцинома
Т2а IIА Распространение опухоли и/или имплантаты на матке, и/или маточной(ых) трубе(ах), и/или яичнике(ах)
Т2b IIB Распространение на другие ткани таза, включая кишку в пределах таза
Т3 и/или N1 IIIa Опухоль поражает один или оба яичника, или маточные трубы, или первичная перитонеальная карцинома с цитологическим или гистологическим подтверждением распространения по брюшине за пределами таза и/или метастазами в ретроперитонеальных лимфоузлах
N1 IIIA1 Метастазы только в ретроперитонеальных лимфоузлах
N1a IIIA1i Метастазы в лимфатических узлах размерами до 10 мм
N1b IIIA1ii Метастазы в лимфатических узлах размерами более 10 мм
Т3а, N любая IIIА2 Микроскопически установленное поражение брюшины за пределами таза с/без метастазов в забрюшинных лимфатических узлах, включая поражение кишки за пределами таза
Т3b, любая N IIIB Макроскопические метастазы по брюшине за пределами таза 2 см или менее в наибольшем измерении, с/без метастазов в ретроперитонеальных лимфатических узлах
Т3с, любая N IIIC Метастазы по брюшине за пределами таза более 2 см в наибольшем измерении, с/без метастазов в ретроперитонеальных лимфатических узлах (включая распространение опухоли по капсуле печени и селезенки, без вовлечения паренхимы этих органов)
М1 IV Отдаленные метастазы (исключая метастазы по брюшине)
M1a IVA Выпот в плевральной полости (верифицирован цитологически)
M1b IVBв Паренхиматозные метастазы и (или) метастазы в других органах, за пределами брюшной полости (включая метастазы в паховых лимфатических узлах и лимфатических узлах за пределами брюшной полости)
Примечание:
a Поражение капсулы печени относится к Т3/ стадия III
в Метастазы в паренхиме печени – М1/ стадия IV
27.5.2. N – регионарные лимфатические узлы
NX – регионарные лимфатические узлы не могут быть оценены
N0 – нет метастазов в регионарных лимфоузлах
N1IIIA1 – метастазы в регионарных лимфоузлах
N1a IIIA1i – метастазы в лимфатических узлах до 10 мм
N1b IIIA1ii – метастазы в лимфатических узлах более 10 мм
27.5.3. М – отдаленные метастазы
М0 – нет отдаленных метастазов
М1 – отдаленные метастазы (исключая метастазы по брюшине)
M1a – выпот в плевральной полости (верифицирован цитологически)
M1b – метастазы в паренхиме печени и/или селезенке, других органах за пределами брюшной полости (в том числе метастазы в паховых лимфатических узлах и лимфатических узлах за пределами брюшной полости)
27.5.4. рTNM – патогистологическая классификация
Требования к определению категорий рТ, pN соответствуют требованиям к определению категорий Т, N.
pM1 – микроскопически подтвержденные отдаленные метастазы
pN0 – гистологическое исследование регионарных лимфатических узлов включает 10 и более узлов. Если лимфатические узлы не поражены, но число лимфатических узлов менее чем необходимо, следует классифицировать как pN0
Note: pM0и pMX – недействующие категории
27.5.5. Группировка по стадиям (табл. 27.6)
Таблица 27.6. Группировка по стадиям
| Стадия | T | N | M |
| Стадия I | T1 | N0 | M0 |
| Стадия IA | T1a | N0 | M0 |
| Стадия IB | T1b | N0 | M0 |
| Стадия IC | T1c | N0 | M0 |
| Стадия IC1 | T1c1 | N0 | M0 |
| Стадия IC2 | T1c2 | N0 | M0 |
| Стадия IC3 | T1c3 | N0 | M0 |
| Стадия II | T2 | N0 | M0 |
| Стадия IIA | T2a | N0 | M0 |
| Стадия IIB | T2b | N0 | M0 |
| Стадия IIIA1 | T1/T2 | N1 | M0 |
| Стадия IIIA1(i) | T1/T2 | N1a | M0 |
| Стадия IIIA1(ii) | T1/T2 | N1в | M0 |
| Стадия IIIA2 | T3a | N0/N1 | M0 |
| Стадия IIIB | T3b | N0/N1 | M0 |
| Стадия IIIC | T3c | N0/N1 | M0 |
| Стадия IV | Любая Т | N0/N1 | M1 |
| Стадия IVA | Любая Т | N0/N1 | M1a |
| Стадия IVB | Любая Т | N0/N1 | M1в |
Этиология и патогенез
27.4. Злокачественные опухоли яичников (С56), маточных (фаллопиевых) труб (С57), первичная перитонеальная карцинома (первичный перитонеальный рак)
Рак яичников (РЯ) занимает первое место в структуре смертности заболеваний репродуктивной сферы у женщин. Трудности ранней диагностики, быстрый рост опухоли, раннее имплантационное метастазирование по серозным оболочкам малого таза и брюшной полости, неудовлетворительные результаты лечения распространенных форм – все это позволяет считать рак яичников одной из наиболее агрессивных злокачественных опухолей с крайне неблагоприятным прогнозом.
Заболеваемость раком яичников высока в индустриально развитых странах. Даже при высоком уровне медицинской помощи, рак яичников и рак маточных труб в 65–80 % случаев распознается в III–IV стадиях (табл. 27.4, 27.5).
Злокачественные опухоли яичников (С56), маточных (фаллопиевых) труб (С57), первичная перитонеальная карцинома (первичный перитонеальный рак).
27.6. Патогенетические типы рака яичников.
В дополнение к гистологической классификации выделяют патогенетические типы рака яичников (табл. 27.7).
Таблица 27.7. Патогенетические типы рака яичников
| I тип (20 %) | II тип (80 %) |
| Дифференцированные | Низкодифференцированные |
|
Серозный (LGSC), эндометриоидный, светлоклеточный, опухоль Бреннера
|
Серозный(HGSC), эндометриоидный, карциносаркома |
|
Мутации: KRAS, BRAF, PTEN, CTNNB1,ARID1A, PIK3CA, PPP2R1A
|
Мутации: TP53,BRCA-1, BRCA-2, Bcl-2, HLA-G, HER 2 neu, C-kit, дикий тип KRAS, высокий уровень Ki – 67, укороченные теломеры
|
|
Экспрессируют: WT1 calretinin +\-, PAX-8, РЭ, PAX8 +\-, Р53–, Р16–
|
Экспрессируют:p16, CK7, WT-1, PAX-8, РЭ, CA125, Ecadherin |
|
Развиваются поэтапно, течение относительно доброкачественное
|
Агрессивное течение |
Эпидемиология
Основные статистические показатели
| Показатель | Число | |
| 2011 | 2016 | |
| Число вновь выявленных случаев заболевания | 1000 | 983 |
| Заболеваемость на 100 000 населения (грубый интенсивный показатель) | 19,7 | 19,4 |
|
Диагноз установлен в I стадии заболевания (% к вновь выявленным случаям)
|
31,7 | 33,8 |
|
Диагноз установлен в II стадии заболевания (% к вновь выявленным случаям)
|
14,1 | 10,6 |
|
Диагноз установлен в III стадии заболевания (% к вновь выявленным случаям)
|
43,9 | 41,1 |
|
Диагноз установлен в IV стадии заболевания (% к вновь выявленным случаям)
|
10,3 | 14,5 |
|
Прожили менее года с момента установления диагноза из числа заболевших в предыдущем году (одногодичная летальность в %)
|
18,9 | 16,7 |
| Умерло от злокачественных новообразований | 445 | 455 |
| Смертность на 100 000 населения Грубый интенсивный показатель | 8,8 | 9 |
| Отношение смертности к заболеваемости в % (интенсивные показатели) | 44,7 | 46,4 |
| Число пациентов, состоящих на учете на конец года | 6990 | 8201 |
| Из них состоящих на учете 5 и более лет, % | 58 | 60,7 |
Таблица 27.5. Основные статистические показатели С57
| Показатель | Число | |
| 2011 | 2016 | |
| Число вновь выявленных случаев заболевания | 34 | 35 |
| Заболеваемость на 100 000 населения (грубый интенсивный показатель) | 0,7 | 0,7 |
|
Диагноз установлен в I стадии заболевания (% к вновь выявленным случаям)
|
38,7 | 38,2 |
|
Диагноз установлен в II стадии заболевания (% к вновь выявленным случаям)
|
22,6 | 11,8 |
|
Диагноз установлен в III стадии заболевания (% к вновь выявленным случаям)
|
38,7 | 47,1 |
|
Диагноз установлен в IV стадии заболевания (% к вновь выявленным случаям)
|
0 | 2,9 |
|
Прожили менее года с момента установления диагноза из числа заболевших в предыдущем году (одногодичная летальность в %)
|
15,2 | 0 |
| Умерло от злокачественных новообразований | 16 | 3 |
| Смертность на 100 000 населения Грубый интенсивный показатель | 0,3 | 0,1 |
| Отношение смертности к заболеваемости в % (интенсивные показатели) | 42,9 | 14,3 |
| Число пациентов, состоящих на учете на конец года | 339 | 295 |
| Из них состоящих на учете 5 и более лет, % | 73,2 | 55,9 |
Первичная перитонеальная карцинома – злокачественное новообразование, распространяющееся в брюшной полости, поражающее главным образом париетальную и висцеральную брюшину и сальник без, или с минимальным вовлечением яичников. Заболевание характеризуется диффузным вовлечением поверхности брюшины карциномой, гистологически идентичной серозной карциноме яичников.
Первичная перитонеальная карцинома составляет 7–15 % всех случаев от предварительно установленного диагноза диссеминированного рака яичников.
Как правило, заболевание характерно для женщин менопаузального возраста, сопровождается болями в животе, гастроинтестинальными симптомами и асцитом. В 75 % случаев заболевание диагностируется в III стадии, в 25 % в IV стадии.
В структуре злокачественных новообразований яичников 80–90 % составляют эпителиальные опухоли, то есть собственно рак яичников. Для опухолей, не относящихся к эпителиальным, существуют значительные отличия, как в плане тактики лечения, так и в отношении прогноза. Прогноз, как правило, более благоприятен, чем для собственно рака яичников. Классификация, методы диагностики и лечения первичного рака брюшины и маточных труб практически не отличаются от таковых, при раке яичников, поэтому все эти нозологии рассматриваются в данной главе совместно. Однако каждая из представленных локализаций имеет свои патогномоничные особенности.
Факторы и группы риска
27.7. Факторы прогноза рака яичников1 (табл. 27.8)
Таблица 27.8. Факторы прогноза рака яичников
|
Прогностические факторы
|
Связанные с опухолью |
Связанные с организмом
|
Экзогенные факторы |
| Основные |
Морфологический тип опухоли
Степень дифференцировки
Хирургическая стадия
Объем остаточной опухоли
|
Возраст
Сопутствующие заболевания
Объективный статус
|
Максимальный диаметр остаточной опухоли после оптимальной циторедукции
|
| Дополнительные |
Метастазы в лимфатических узлах
Локализация метастазов
Плоидность ДНК
Уровень СА-125
|
Наследственная предрасположенность, ассоциированная с BRCA-1
|
Вид химиотерапии
Снижение уровня СА-125
Ультрарадикальная хирургия
|
| Новые и изучаемые |
Молекулярный профиль опухоли
Клеточная пролиферативная активность
Экспрессия маркера ангиогенеза опухоли P53
Экспрессия гена человеческого калликреина (hK), особенно hKs 6-10-11
|
Интервальная циторедуктивная операция
Неоадьювантная химиотерапия
|
Примечание.
1 UICC Manual of Clinical Oncology, Ninth Edition. Edited by Brian O’Sullivan, James D. Brierley, Anil K. D’Cruz, Martin F. Fey, Raphael Pollock, Jan B. Vermorken and Shao Hui Huang. 2015 UICC. Published 2015 by John Wiley&Sons, Ltd.
Диагностика
Диагностические критерии первичной злокачественной опухоли маточной трубы:
- опухоль исходит из эндосальпинкса;
- гистологические признаки опухоли представлены эпителием слизистой маточной трубы;
- есть признаки озлокачествления эпителия маточной трубы;
- яичники и эндометрий имеют или нормальное строение, или опухолевые изменения, идентичные опухоли трубы;
- патологические кровянистые выделения из влагалища встречаются более чем у 50 % пациенток. Они могут быть ассоциированы с водянистыми выделениями из влагалища, болями в животе, симптомами сдавления и нарушения функции органов брюшной полости;
- дифференциальная диагностика проводится с опухолями яичников и матки и особенно сложна при распространенном опухолевом процессе.
Диагностические специфические макро- и микроскопические критерии, позволяющие отнести опухоль к первичной перитонеальной карциноме:
- оба яичника должны быть нормального строения и размера (до 4 см в наибольшем диаметре) или немного увеличенными за счет доброкачественного процесса;
- опухолевое поражение экстраовариальных участков должно быть намного большим, чем на поверхности любого яичника;
-
микроскопически опухолевый овариальный компонент должен соответствовать одному из требований:
- отсутствует
- ограничен поверхностью яичника без вовлечения коркового вещества
- вовлекает поверхность яичника и строму коркового вещества, но размер опухоли при этом должен быть меньше 5×5 мм
- в морфологической характеристике опухоли должен преобладать серозный тип, подобный или идентичный овариальной серозной карциноме.
27.8. Диагностические мероприятия
27.8.1. Лабораторные исследования:
- группа крови и резус-фактор;
- анализ крови на сифилис (реакция микропреципитации);
- HbSAg, HCV;
- общий анализ крови;
- общий анализ мочи;
- биохимическое исследование крови (общий белок, мочевина, креатинин, билирубин, глюкоза, АсАТ, АлАТ, щелочная фосфатаза, электролиты);
- определение уровня СА-125 в сыворотке крови (его уровень повышен примерно у 50 % пациенток на ранней стадии рака яичников и у 85 % – на поздней);
- при подозрении на рак яичников I–II стадии – определение уровня HE-4 и индекса ROMA (маркер HE-4 показал более высокую специфичность при раннем раке яичников по сравнению с СА-125);
- при подозрении на неэпителиальную опухоль яичников, наряду с СА-125, необходимо определить АФП, бета-хорионический гонадотропин, NSЕ (нейрон-специфическая энолаза), определить ЛДГ в сыворотке крови;
- по уровню раково-эмбрионального антигена (РЭА) в сыворотке крови можно дифференцировать метастатические образования яичников желудочно-кишечного происхождения от первичной опухоли яичников;
- коагулограмма (АЧТВ, ПВ, ТВ, фибриноген) – на этапе предоперационной подготовки.
27.8.2. Инструментальные исследования:
- ЭКГ;
- гинекологическое вагинальное и ректовагинальное исследование;
- раздельное диагностическое выскабливание матки с последующим гистологическим исследованием;
- УЗИ органов брюшной полости и малого таза;
- рентгенологическое исследование органов Грудной клетки;
- обследование органов ЖКТ, с целью исключить метастатический характер поражения яичников (эзофагогастродуоденоскопия, тотальная колоноскопия);
- КТ с болюсным контрастированием органов брюшной полости и таза, при подозрении на распространенный рак;
- КТ органов Грудной клетки при распространенном раке яичников;
- МРТ органов таза, брюшной полости по показаниям;
- выполнение ФДГ ПЭТ/КТ показано в случае, когда данный метод может повлиять на дальнейшую тактику лечения пациенток с распространенным раком яичников.
При наличии асцита, вызывающего компрессию органов брюшной полости, показан лапароцентез и эвакуация асцита с цитологическим исследованием асцитической жидкости.
При наличии плеврита показан торакоцентез с цитологическим исследованием жидкости на наличие опухолевых клеток. Наличие плеврита без морфологической верификации диагноза не дает оснований установить IV стадию заболевания.
При подозрении на метастазы в пальпируемых лимфатических узлах показана их биопсия (тонкоигольная аспирационная, инцизионная, эксцизионная, трепан-биопсия).
27.10. Наблюдение, сроки и объем обследования
27.10.1. Режим наблюдения:
В течение первых двух лет – каждые 3 месяца.
3-й год – каждые 4 месяца.
4-й, 5-й годы – каждые 6 месяцев, далее – ежегодно.
27.10.2. Объем обследования:
- вагинальный и ректовагинальный осмотр;
- определение уровня СА-125 либо маркеры AFP, бета-хорионический гонадотропин, NSЕ;
- по показаниям выполняются УЗИ органов брюшной полости и малого таза (у пациенток, перенесших органосохраняющую операцию УЗИ ОМТ следует выполнять каждые 6 мес.), КТ или МРТ органов брюшной полости и малого таза, или ФДГ ПЭТ/КТ, рентгенологическое исследование органов Грудной клетки;
- осмотр молочных желез ежегодно.
Лечение
27.9. Общие принципы лечения злокачественных опухолей яичников, маточной трубы, первичной перитонеальной карциномы. В дальнейшем, учитывая отсутствие различий в тактике лечения данных трех нозологий, указываться будет только рак яичников.
27.9.1. Эпителиальные опухоли яичников. Рак яичников
Все пациентки, у которых предполагается рак яичников, рак маточной трубы или первичная перитонеальная карцинома, подлежат лапаротомии (лапароскопии), целью которой является точное установление диагноза и распространенности опухолевого процесса, а также максимально возможное удаление опухолевых масс. Следует иметь в виду, что именно размеры наибольшей из остаточных опухолей, после исходной операции, определяют прогноз лечения в целом.
В случаях, когда в ходе ревизии брюшной полости распространенность опухоли соответствует I–II стадии FIGO, проводятся многочисленные (до нескольких десятков) биопсии участков париетальной и висцеральной брюшины; при позитивных результатах стадия заболевания меняется, как и тактика лечения. При очевидном опухолевом поражении, выходящем за пределы малого таза, нет необходимости в биопсии визуально неизмененных участков париетальной и висцеральной брюшины.
27.9.1.1. Лечение первичного рака яичников.
27.9.1.1.1. Хирургическое лечение.
27.9.1.1.1.1. Первичный рак яичников ранней стадии (IA–IIA).
Цель хирургического лечения рака яичников ранней стадии – удалить опухоль и определить стадию заболевания. Стадия заболевания и морфологический тип опухоли являются основными прогностическими факторами раннего рака яичников, что позволяет определить показания к химиотерапии. В результате адекватного хирургического стадирования может быть установлено скрытое распространение опухоли.
27.9.1.1.1.1.1. Процедура хирургического стадирования при раке яичников:
Шаг 1. В тех случаях, когда имеется асцитическая жидкость, как можно большее ее количество должно быть взято для цитологического исследования. При отсутствии асцитической жидкости необходимо получить смывы для цитологического исследования из полости таза, обоих боковых каналов и обеих поддиафрагмальных поверхностей.
Шаг 2. Определить, является ли опухоль злокачественной. Если опухоль злокачественная, выполняется стандартная операция (гистерэктомия с двухсторонней сальпинго-оофорэктомией и удаление большого сальника).
Шаг 3. Тщательно обследуется тазовая брюшина. При наличии образований, подозрительных на метастатические, следует их удалить для срочного гистологического исследования и взять биоптаты из тех образований, которые не могут быть удалены. При подтверждении злокачественного характера опухолевых образований, следует выполнить удаление измененной брюшины таза. В тех случаях, когда отсутствуют видимые глазом опухолевые образования, выполняется забор биоптатов как минимум из брюшины боковых стенок таза, брюшины мочевого пузыря, брюшины ректо-сигмоидного отдела толстой кишки и брюшины Дугласова кармана.
Шаг 4. Обследуются боковые карманы и удаляются все видимые образования. В тех случаях, когда видимых опухолевых образований нет, выполняется биопсия брюшины с каждой стороны в виде полоски ткани1 х 3 см.
Шаг 5. Обследуется сальник и удаляются все участки, имеющие видимые опухолевые образования (включая малый сальник, если он вовлечен в опухолевый процесс). Если видимых опухолевых образований нет, выполняется тотальное (субтотальное) удаление большого сальника.
Шаг 6. Осматриваются и пальпируются обе гемидиафрагмы, поверхность печени и селезенки. При наличии опухолевых образований выполняется их удаление в максимально возможном объеме и биопсия всех тех образований, которые не удалось иссечь. Если видимых образований нет, выполняется биопсия брюшины правой гемидиафрагмы в виде полоски 1 х 2 см (только брюшины, во избежание пневмоторакса).
Шаг 7. Начиная от ректо-сигмоидного отдела, либо от слепой кишки тщательно обследуется вся толстая кишка с удалением/биопсией всех подозрительных образований на поверхности кишки или брыжейки.
В случае наличия муцинозной карциномы и отсутствии остаточной опухоли более 1 см, следует выполнить аппендэктомию.
Если для выполнения циторедукции в полном или оптимальном объеме необходима резекция того или иного участка кишки, ее следует выполнить.
Шаг 8. Начиная с илеоцекального клапана или связки Трейтца, тщательно обследуется вся тонкая кишка и ее брыжейка, с удалением/биопсией всех подозрительных образований.
Если для выполнения циторедукции в полном или оптимальном объеме необходима резекция того или иного участка кишки, ее следует выполнить.
Шаг 9. Если после всех вышеперечисленных процедур не осталось опухолевых образований размерами более 1 см, необходимо выполнить биопсию ретроперитонеальных (тазовых и забрюшинных) лимфатических узлов, если они визуально не изменены, либо забрюшинную и (или) тазовую лимфодиссекцию при наличии макроскопически определяемых опухолевых образований.
27.9.1.1.1.1.2. Органосохраняющие операции при раннем раке яичников (IA, IC стадия)
Консервативная тактика, направленная на сохранение детородной функции (односторонняя аднексэктомия с резекцией второго яичника, оментэктомия), в виде исключения, возможна у молодых пациенток, страдающих раком яичников IA, IC стадии, желающих сохранить фертильность, при высокодифференцированных карциномах, когда реально тщательное диспансерное наблюдение. Органосохраняющие операции должны включать хирургическое стадирование. После рождения ребенка или окончания детородного возраста следует планировать удаление противоположных придатков и матки.
27.9.1.1.1.2. Распространенный рак яичников (IIB-IV стадии)
Потенциально всем пациенткам, страдающим раком яичников IIB-IV стадии, должна быть выполнена циторедуктивная операция. Хирургическое вмешательство при распространенном раке яичников определяет прогноз течения болезни в дальнейшем. Лечение всех пациенток с распространенным раком яичников следует начинать с хирургического вмешательства во всех случаях, когда такое вмешательство возможно. При IV стадии заболевания, наличие опухолевого плеврита не меняет тактику лечения.
Цель операции – циторедукция с максимальным удалением макроскопически видимой опухоли. Одним из основных благоприятных прогностических факторов в данном случае является отсутствие остаточной опухоли. Необходимо стремиться к выполнению полной циторедукции, при этом хирург оценивает распространенность опухоли в малом тазу и брюшной полости. Недопустимо, при возможности удаления всех опухолевых очагов на париетальной брюшине, ограничивать объем операции гистерэктомией с билатеральной сальпинго-оофорэктомией и оментэктомией.
Операция должна включать в себя: тотальную гистерэктомию, билатеральную сальпинго-оофорэктомию, перитонэктомию опухолево-измененной брюшины таза, оментэктомию, при необходимости – перитонэктомию боковых каналов, стриппинг с (без) резекции диафрагмы, резекцию пораженных участков тонкой и толстой кишки, удаление малого сальника, спленэктомию, дистальную панкреатэктомию, резекцию мочевыводящих путей, паховую, тазовую, забрюшинную лимфаденэктомию. При планировании циторедуктивной операции, хирургу необходимо иметь достаточный опыт и навыки выполнения всего объема хирургического вмешательства, в противном случае показано выполнение операции в РНПЦ ОМР им. Н.Н.Александрова.
В тех случаях, когда выявляются нерезектабельные метастазы в печени, метастазы в паренхиме легких, массивное поражение средостения, значительных размеров метастазы в надключичных лимфоузлах, сливной висцеральный канцероматоз, циторедуктивная операция в полном или оптимальном объеме невозможна. В таких случаях оправдано проведение неоадьювантной химиотерапии с последующей промежуточной циторедуктивной операцией.
По размеру резидуальной опухоли хирургические вмешательства делятся на следующие категории:
- Полная циторедукция – остаточная опухоль визуально не определяется.
- Оптимальная циторедукция – размер остаточной опухоли (каждого очага, размер не суммируется) не более 1 см.
- Субоптимальная циторедукция – размер остаточной опухоли равен или более 1 см и менее 2 см.
- Неоптимальная циторедукция – размер остаточной опухоли 2 см и более.
- Эксплоративная лапаротомия – опухоль не удалялась, выполнена только биопсия.
По времени выполнения хирургические вмешательства делятся на следующие категории:
Первичная циторедукция – специальное лечение начато с операции.
Промежуточная (интервальная) циторедукция – лечение начато с химиотерапии, либо на начальном этапе была выполнена эксплоративная лапаротомия, либо циторедукция в неоптимальном или субоптимальном объеме, а затем проводилась химиотерапия. Как правило, промежуточная циторедукция назначается после 3 курсов химиотерапии (2–4 курса). Перед операцией необходимо оценить эффект от терапевтического воздействия (гинекологический осмотр, УЗИ/КТ/МРТ, анализ крови на СА-125). Показания к выполнению промежуточной циторедукции определяются индивидуально, в зависимости от эффекта химиотерапии.
Вторичная циторедукция операция выполняется по поводу рецидива заболевания. Установлено, что вторичная циторедукция себя оправдывает в том случае, если рецидив возник больше чем через 6 месяцев после окончания предыдущего блока лечения.
В протоколе операции необходимо указывать тип циторедукции в зависимости от размеров остаточной опухоли и времени выполнения.
Оптимальное время выполнения циторедуктивной операции относительно химиотерапии пока обсуждается. В большинстве случаев показано выполнение первичной циторедукции с последующей химиотерапией. Неоадьювантная химиотерапия с последующей промежуточной(интервальной) циторедукцией может быть использована в следующих случаях:
а) обусловленных распространенностью опухолевого процесса:
вовлечение верхней брыжеечной артерии, диффузная инфильтрация корня брыжейки тонкой кишки, диффузный или сливной канцероматоз желудка или тонкой кишки, требующий значительного объема резекции, вовлечение проксимальных отделов поджелудочной железы, двенадцатиперстной кишки, сосудов печеночно-12перстной связки или чревного ствола, наличие нерезецируемых висцеральных метастазов (множественные метастазы в легких, лимфоузлах средостения, печени, головном мозге).
Наличие несмещаемых опухолевых масс в малом тазу не является признаком нерезектабельности.
б) обусловленных состоянием пациентки:
при распространенном опухолевом процессе с множественными диссеминатами в брюшной полости, включая IV стадию заболевания, в сочетании с низким объективным статусом (общее состояние пациентки), выраженной потерей веса (альбумин ниже 30 г/л), тяжелыми сопутствующими заболеваниями, препятствующими выполнению длительной и тяжелой операции, ASA>3, возраст старше 75 лет. Сочетание вышеуказанных факторов определяет подгруппу пациенток, у которых риск от агрессивной циторедуктивной операции превышает пользу.
27.9.1.1.2. Химиотерапевтическое лечение.
27.9.1.1.2.1. При раке яичников I стадии принципиальное значение имеет определение Группы риска.
К низкому риску относят рак яичников IA-IB стадии с высокой степенью дифференцировки опухоли (G1).
К промежуточному риску – рак яичников IA-IB стадии с умеренной степенью дифференцировки опухоли (G2).
К высокому риску относится рак яичников IC стадии любой степени дифференцировки, а также IA–IB G3, а также светлоклеточная карцинома.
Для Группы низкого риска после хирургического вмешательства, заключающегося в гистерэктомии с придатками, оментэктомии и хирургического стадирования, рекомендуется наблюдение.
В остальных случаях (группы промежуточного и высокого риска) необходимо проведение адъювантного лечения. После хирургического вмешательства, включающего гистерэктомию с придатками, оментэктомию, а при необходимости и комбинированных операций с целью максимальной циторедукции, обязательно проведение адъювантной химиотерапии (6 курсов).
В случаях, когда при I стадии рака яичников, изначально выполнено неадекватное хирургическое лечение (в общелечебной сети), при котором не было проведено хирургического стадирования, в онкологическом стационаре выполняется повторная операция, включающая в себя все стандартные процедуры при раке яичников (хирургическое рестадирование). Даже если стадия после операции не изменяется, несмотря на это, а также на степень дифференцировки опухоли и ее распространенность, назначается химиотерапия.
27.9.1.1.2.1.1. Схемой выбора в настоящее время считается комбинация карбоплатина и паклитаксела:
- паклитаксел 175 мг/м2 внутривенная 3-часовая инфузия на фоне премедикации в 1-й день;
- карбоплатин из расчета AUC 5–7,5 внутривенно (после введения паклитаксела) в течение 30 мин в 1-й день. Интервал между курсами3 недели, всего 6 курсов.
27.9.1.1.2.1.2. Возможно применение и других комбинаций химиопрепаратов:
- паклитаксел 175 мг/м2 внутривенная 3-часовая инфузия в 1-й день на фоне премедикации,
- цисплатин 75 мг/м2 внутривенная инфузия (после введения паклитаксела) со скоростью не менее 1 мг/мин с пред- и постгидратацией в 1-й день. Интервал между курсами 3 недели, всего 6 курсов.
27.9.1.1.2.1.3. В отсутствие таксанов возможно проведение комбинированной химиотерапии по следующим схемам:
27.9.1.1.2.1.4. Цисплатин 75–100 мг/м2 внутривенная инфузия со скоростью не менее 1 мг/мин с пред- и постгидратацией в 1-й день;
циклофосфамид 750–1000 мг/м2 внутривенно в течение 20–30 мин в 1-й день.
Интервал между курсами 3 недели, всего 6 курсов.
27.9.1.1.2.1.5. Карбоплатин из расчета AUC 5–7 (или 300–360 мг/м2) внутривенно в течение 30 мин в 1-й день;
циклофосфамид 500 мг/м2 внутривенно в течение 20–30 мин в 1-й день. Интервал между курсами 3 недели, всего 6 курсов.
27.9.1.1.2.1.6. Оправданной для ранних стадий (I-IIA) рака яичников считается монотерапия (6 курсов) препаратами платины в больших дозах (например, карбоплатин AUC 5-7).
27.9.1.1.2.2. II–IV стадия
27.9.1.1.2.2.1. При раке яичников II–IV стадии, после хирургического вмешательства проводится стандартная химиотерапия, включающая производные платины и таксаны (как и при I стадии).
27.9.1.1.2.2.2. Лучевая терапия в лечении рака яичников используется редко. Паллиативную локальную лучевую терапию проводят в случаях, если по каким-либо причинам не может быть назначена химиотерапия.
Показания для лучевой терапии:
- размеры наибольшего очага остаточной опухоли в брюшной полости не превышают 2 см;
- по данным обследования подтверждается наличие одиночной рецидивной опухоли.
При наличии метастазов в регионарных и отдаленных (надключичных, подмышечных) лимфоузлах, и отсутствии возможности их удаления и/или неэффективности химиотерапии, вопрос проведения лучевой терапии решается индивидуально консилиумом с участием онколога-хирурга, химиотерапевта, радиолога.
27.9.1.1.2.2.3. Таргетная терапия
Добавление бевацизумаба возможно при прогностически неблагоприятных признаках рака яичников, таких как IV стадия или субоптимальная и неоптимальная циторедукция. Бевацизумаб необходимо назначать в комбинации с паклитакселом или карбоплатином, начиная с первого или второго курса химиотерапии. Затем продолжать его использование после завершения химиотерапии, чтоб общая длительность лечения составила 1 год, в дозе 7,5 или 15 мг / кг в/в, с интервалом в 3 недели, суммарно 18–22 курса (или до прогрессирования, если оно наступит раньше).
27.9.1.2. Лечение рецидивного рака яичников.
Прогноз при рецидивах рака яичников после цисплатин-содержащей химиотерапии зависит от времени возникновения рецидива. В зависимости от сроков возврата болезни, различают следующие типы рака яичников:
платинорефрактерный – прогрессирование заболевания развивается во время 1-й линии химиотерапии с включением препаратов платины;
платинорезистентный – прогрессирование заболевания возникает в срок до 6 месяцев после завершения химиотерапии 1-й линии с включением препаратов платины;
платиночувствительный – рецидив заболевания развивается позднее 6 месяцев после завершения химиотерапии.
27.9.1.2.1. Химиотерапия при рецидивах рака яичников по тем же схемам, что и исходная, оправдана при платиночувствительном раке яичников. Лечение тем эффективнее, чем больше этот интервал.
Повышение уровня СА-125 без клинического и инструментального (УЗИ, КТ, МРТ) подтверждения не является основанием для проведения химиотерапии. В этом случае необходимо исследование маркера в динамике. При наличии клинической и инструментальной верификации рецидива по возможности выполняется вторичная циторедукция, затем назначают химиотерапию.
27.9.1.2.2. В тех случаях, когда прогрессирование опухолевого процесса началось уже в ходе первичного лечения или сразу после его окончания, показано изменение режима химиотерапии. Если на первом этапе не использовались таксаны, показано применение паклитаксела в режиме монотерапии (175 мг/м2с интервалом между курсами 21 день).
27.9.1.2.3. В остальных случаях возможно применение:
27.9.1.2.3.1. Гемцитабин 1000 мг/м2 внутривенно 1 раз в неделю;
27.9.1.2.3.2. Винорельбин 25–30 мг/м2 внутривенно 1 раз в неделю или 60–80 мг/м2 внутрь 1 раз в неделю;
27.9.1.2.3.3. Ифосфамид 1500мг/м2 внутривенно в 1–5-й дни + месна 300 мг/м2 в 1–5 дни;
27.9.1.2.3.4. Тамоксифен по 20 мг внутрь ежедневно.
При развитии платинорезистентности используются режимы химиотерапии II линии:
Монохимиотерапия:
Паклитаксел (еженедельное введение, либо 1 раз в 21 день);
Гемцитабин;
Капецитабин;
Иринотекан;
Ифосфамид;
Мелфалан;
Оксалиплатин;
Винорельбин.
Комбинации цитостатиков:
Треосульфан+иринотекан;
Гемцитабин+оксалиплатин;
Этопозид+ифосфамид.
Выбор режима производится с учетом физического состояния пациента, сопутствующей патологии и функционального состояния жизненно-важных органов и систем. Предпочтение отдается наименее токсичным препаратам, в первую очередь тем, введение или прием которых не требуют госпитализации. При платинорефрактерном рецидиве рака яичников возможно использование бевацизумаба.
27.9.1.2.4. Гипертермическая интраперитонеальная химиотерапия (HIPEC) может быть использована при рецидивном раке яичников, нечувствительном к химиотерапии, при возможности достижения полной или оптимальной циторедукции. Возможность назначения HIPEC определяется мультидисциплинарным консилиумом РНПЦ ОМР.
27.9.1.3. Пограничные опухоли яичников.
Крайне важным является тщательное гистологическое исследование всей удаленной опухоли с выполнением срезов через 1 см.
В тех случаях, когда при размерах опухоли в рамках I стадии желательно сохранение репродуктивной функции, выполняется односторонняя сальпинго-оофорэктомия с клиновидной резекцией контралатерального яичника и оментэктомия. Органосохраняющие операции должны включать хирургическое стадирование. В случаях полного удаления опухоли, у пациенток с локальными формами заболевания и установления диагноза по результатам изучения удаленной опухоли, повторная операция не требуется. Химиотерапия либо лучевая терапия не показаны.
При распространенном процессе (II–III стадии) выполняется хирургическое вмешательство в объеме гистерэктомии с придатками, оментэктомии и циторедуктивные мероприятия, аналогичные тем, что проводятся при раке яичников. Проведение химиотерапии показано в тех случаях, когда в ходе хирургического вмешательства выявлены импланты* опухоли (даже в случае их полного иссечения). Используются те же схемы химиотерапии, что и при лечении рака яичников.
______________________________
* В соответствии с критериями, изложенными в классификации злокачественных новообразований яичников (ВОЗ, 2014 г.), под термином «имплант», при пограничных новообразованиях яичников, следует понимать перитонеальные опухолевые отсевы с признаками инвазивного роста в жировую ткань, с десмопластической реакцией стромы или микропапиллярного строения.
27.9.2. Неэпителиальные опухоли яичников.
Наиболее часто в клинической практике встречаются герминоклеточные опухоли и опухоли стромы полового тяжа (3–7 % всех злокачественных новообразований яичников). В отличие от собственно рака яичников, эти опухоли чаще встречаются в молодом возрасте, нередко поражают только один яичник и более благоприятны в прогностическом плане. С учетом изложенного, особое внимание уделяется срочному гистологическому исследованию в ходе хирургического вмешательства – для определения возможности лечения с сохранением фертильности. Органосохраняющее лечение, при технической возможности (при желании женщины) может выполняться в случаях, когда при срочном морфологическом исследовании установлен диагноз герминогенной опухоли любой стадии либо опухоли стромы полового тяжа I стадии. В этих случаях особое внимание следует уделить состоянию контралатерального яичника с биопсией в случае подозрения на опухолевое поражение, а также состоянию забрюшинных лимфоузлов. При наличии в них метастазов, даже при органосохраняющем лечении, выполняется забрюшинная лимфаденэктомия. Пациенткам, не желающим сохранять фертильность, выполняется хирургическое вмешательство в том же объеме, что и при раке яичников. Особое внимание уделяется стадированию с необходимым количеством биоптатов. Резекция мочевыводящих путей, а также резекции больших участков тонкой или толстой кишки при герминогенных опухолях нецелесообразны.
27.9.2.1. Герминоклеточные опухоли яичников.
Герминогенные опухоли составляют более 75 % опухолей яичников у лиц молодого возраста. Наиболее часто встречаются дермоидные кисты (зрелые тератомы), обычно являющиеся доброкачественными опухолями, составляющими около 20 % всех опухолей яичников.
Злокачественные опухоли представлены дисгерминомой, незрелой тератомой, эмбриональным раком, опухолью желточного мешка (энтодермального синуса). Чаще встречаются у девочек, подростков и молодых женщин. Медиана возраста на момент постановки диагноза составляет 16–20 лет. Дополнительно к объему обследования, выполняемому при собственно раке яичников, необходимо определение бета-хорионического гонадотропина, альфа-фетопротеина и лактатдегидрогеназы. В тех случаях, когда планируется проведение блеоцин-содержащей химиотерапии, целесообразно определение функции внешнего дыхания.
У молодых пациенток повышение уровня АФП при наличии опухоли в малом тазу свидетельствует о наличии герминогенной опухоли. Злокачественные герминогенные опухоли характеризуются хорошим прогнозом, 5-летняя выживаемость после специального лечения составляет более 85 %. При нежелании сохранять фертильность выполняется стандартная операция и хирургическое стадирование, аналогичное стадированию при раке яичников. При желании сохранить фертильность, органосохраняющее вмешательство может быть выполнено вне зависимости от стадии. Наблюдение в послеоперационном периоде осуществляется с обязательным УЗИ контролем. После завершения детородной функции должно быть выполнено хирургическое вмешательство.
В послеоперационном периоде проводится 3–4 цикла химиотерапии по схеме ВЕР в следующих случаях: при всех стадиях эмбрионального рака и опухоли желточного мешка; II–IV стадии дисгерминомы, I стадии Gr 2–3, II–IV стадии незрелой тератомы.
Дисгерминома встречается примерно в 50 % случаев, при дисгерминоме в 10 % случаев встречается двухстороннее поражение яичников, может сочетаться с дисгенезией гонад.
27.9.2.1.1. Лечение герминоклеточных опухолей яичников (таблица 27.9).
Таблица 27.9. Лечение герминоклеточных опухолей яичников1
| Стадия |
Операция (с сохранением репродуктивной функции)
|
Химиотерапия | Наблюдение |
| Дисгерминома | - | Х | |
| IA стадия | Х | Х | |
| IB – IC стадия | Х | Х | |
| IIA – IV стадия | Х | ||
| Незрелая тератома | |||
| IA стадия G1 | Х | - | Х |
| IA стадия G2-G3 | Х | Х | (Х)а |
| IB – IC стадия | Х | Х | (Х) |
| IIA – IV стадия | Х | Х | |
| Опухоль желточного мешка | |||
| IA – IB стадия | Х | Х | Х |
| Другие стадии | Х | Х |
Примечание:
1-Ovarian Cancer Treatment Recommendations. Ledermann J. et al. ESMO Clinical Practice. 2016.
а – при хирургическом стадировании
Х – рекомендуется; (Х) – рекомендуется некоторыми авторами; «-» – отсутствие терапии.
27.9.2.1.2. Пациентки, у которых диагностируется дисгерминома IА стадии либо незрелая тератома G1, после полного хирургического удаления опухоли, могут наблюдаться. Во всех остальных случаях показано проведение 3–4 курсов полихимиотерапии по схеме ВЕР. В отдельных случаях при дисгерминоме IB–III стадии может быть проведено 3 курса химиотерапии по схеме ЕР. Имеются данные в пользу того, что во всех случаях I стадии герминоклеточных опухолей яичников возможно наблюдение с проведением химиотерапии только в случае рецидива, однако такая тактика требует особенно тщательного подхода к стадированию опухолевого процесса и наблюдению за пациентом после хирургического лечения.
В тех случаях, когда у пациенток исходно был повышен уровень бета-хорионического гонадотропина или альфа-фетопротеина, систематическое определение этих маркеров показано как для оценки эффективности химиотерапии, так и для наблюдения в случае достижения полной клинической регрессии.
Пациенткам, у которых не достигнута нормализация опухолевых маркеров, либо выявлено прогрессирование опухолевого процесса в ходе лечения, либо диагностирован рецидив опухоли, проводится химиотерапия второй линии по схемам VIP (цисплатин, ифосфамид, цисплатин), TIP (паклитаксел, цисплатин, ифосфамид), лучевая терапия.
27.9.2.1.3. Схемы химиотерапии
27.9.2.1.3.1. ВЕР:
цисплатин 20 мг/м2 внутривенная инфузия со скоростью не более 1 мг/мин с пред- и постгидратацией в 1–5-й дни;
этопозид 100 мг/м2 внутривенная инфузия в течение 30–60 мин, 1–5-й дни;
блеомицин 30 мг внутривенно в течение 10–15 мин, 2-й, 9-й и 16-й дни.
Очередной курс начинается на 22-й день.
27.9.2.1.3.2. ЕР:
цисплатин 20 мг/м2 внутривенная инфузия со скоростью не более 1 мг/мин с пред- и постгидратацией, 1–5-й дни;
этопозид 100 мг/м2 внутривенная инфузия в течение 30–60 мин, 1–5-й дни.
Очередной курс начинается на 22-й день.
27.9.2.1.3.3. VIP:
этопозид 75 мг/м2 внутривенная инфузия в течение 30–60 мин, 1–5-й дни.
ифосфамид 1,2 г/м2 в течение 60 мин с пред- и постгидратацией, 1–5-й дни. Месна 400 мг/м2 внутривенно струйно за 15 мин до введения ифосфамида, затем по 400 мг/м2 внутривенно струйно каждые 8 часов в 1–5-й дни.
цисплатин 20 мг/м2 внутривенная инфузия со скоростью не более 1 мг/мин с пред- и постгидратацией, 1–5-й дни.
Очередной курс начинается на 22-й день.
27.9.2.1.3.4. TIP:
паклитаксел 250 мг/м2 внутривенная 24-часовая инфузия на фоне премедикации, 1-й день.
ифосфамид 1,2 г/м2 в течение 60 мин с пред- и постгидратацией, 2–6-й дни. Месна 400 мг/м2 внутривенно струйно за 15 мин до введения ифосфамида, затем по 400 мг/м2 внутривенно струйно каждые 8 часов в 2–6-й дни.
цисплатин 20 мг/м2 внутривенная инфузия со скоростью не более 1 мг/мин с пред- и постгидратацией, 2–6-й дни.
Обязательно введение гемопоэтического колониестимулирующего фактора через 24 часа после окончания введения цитостатиков до восстановления кроветворения: кол-во нейтрофилов >1000/мл3.
27.9.2.2. Опухоли стромы полового тяжа и стромальные опухоли яичников
Злокачественные опухоли стромы полового тяжа относятся к редким опухолям, составляющим 7 % злокачественных новообразований яичников. Включают Гранулезоклеточную опухоль (наиболее часто) и опухоль из клеток Сертоли и Лейдига. Среди доброкачественных опухолей в этой Группе наиболее часто встречается фиброма. Клинически их манифестация не имеет отличительных признаков, но некоторые из них являются гормонопродуцирующими и могут вызвать вирилизацию или симптомы избыточной продукции эстрогенов, проявляющиеся гиперплазией эндометрия или постменопаузальным кровотечением.
Эти опухоли наиболее часто выявляются в I стадии, характеризуются индолентным течением и хорошим прогнозом для пациенток. Используется классификация рака яичников.
Пациенткам с IА и IC стадией, желающим сохранить фертильность выполняется органосохраняющее лечение, однако хирургическое стадирование рекомендуется всем пациенткам. При IА и IC стадии лимфаденэктомия не показана. После завершения детородной функции должно быть выполнено хирургическое вмешательство. При низком риске рекомендуется наблюдение. Возможно определение уровня ингибина у пациенток с Гранулезоклеточной опухолью в процессе наблюдения, в случае его повышения в дооперационном периоде.
В тех случаях, когда после хирургического стадирования в ходе лапаротомии (процедура аналогична той, что рекомендуется для собственно рака яичников) устанавливается I стадия стромальной опухоли яичников, решение о тактике лечения принимается индивидуально. Возможно наблюдение, однако при наличии ряда факторов риска:
- разрыв капсулы опухоли,
- низкая степень дифференцировки,
- размер опухоли более 10 см,
- стадия IC,
- может быть проведена лучевая терапия либо цисплатин-содержащая химиотерапия (схемы, аналогичные тем, что применяются при лечении герминогенных опухолей, либо комбинация карбоплатин/паклитаксел). При II–IV стадии, после хирургической циторедукции, рекомендуется лучевая терапия для локализованных опухолей или платиносодержащие схемы химиотерапии (ВЕР или карбоплатин/паклитаксел). В случае рецидивов целесообразны повторные циторедуктивные операции.
27.9.2.2.1. Лечение опухолей стромы полового тяжа (таблица 27.10).
Таблица 27.10. Лечение опухолей стромы полового тяжа1
| Стадия | Операция | Химиотерапия | Наблюдения |
| Гранулезоклеточная опухоль | |||
| IA – IC стадия | Х | - | Х |
| IIA – IV стадия | Х | Х | |
| Опухоль из клеток Сертоли-Лейдига | |||
| IA стадия | Х | - | Х |
|
Все стадии с низкодифференцированными или разнородными элементами
|
Х | Х |
Примечание:
1 – Ovarian Cancer Treatment Recommendations. Ledermann J. еt al. ESMO Clinical Practice. 2016.
Х – рекомендуется; «–» – отсутствие терапии.
Информация
Источники и литература
-
Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2006-2019
- Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2006-2019 -
-
www.minzdrav.gov.by
- www.minzdrav.gov.by -
Информация
ГЛАВА 2
ОЦЕНКА ОБЩЕГО СОСТОЯНИЯ ОНКОЛОГИЧЕСКОГО ПАЦИЕНТА
Общее состояние онкологического пациента (Performance status) рекомендовано оценивать по индексу Карновского (0–100 баллов) или шкале ECOG (0–4 балла) (таблицы 2.1, 2.2).
Таблица 2.1. Индекс Карновского
Таблица 2.1. Индекс Карновского
|
Нормальная физическая активность, пациент не нуждается в специальном уходе
|
100 баллов | Состояние нормальное, нет жалоб и симптомов заболевания |
| 90 баллов | Нормальная активность сохранена, но имеются незначительные симптомы заболевания | |
| 80 баллов | Нормальная активность возможна при дополнительных усилиях, при умеренно выраженных симптомах заболевания | |
|
Ограничение нормальной активности при сохранении полной независимости пациента
|
70 баллов | Пациент обслуживает себя самостоятельно, но не способен к нормальной деятельности или работе |
| 60 баллов | Пациент иногда нуждается в помощи, но в основном обслуживает себя сам | |
| 50 баллов | Пациенту часто требуется помощь и медицинское обслуживание | |
|
Пациент не может обслуживать себя самостоятельно, необходим уход или госпитализация
|
40 баллов | Большую часть времени пациент проводит в постели, необходим специальный уход и посторонняя помощь |
| 30 баллов | Пациент прикован к постели, показана госпитализация, хотя терминальное состояние не обязательно | |
| 20 баллов | Сильные проявления болезни, необходима госпитализация и поддерживающая терапия | |
| 10 баллов | Умирающий пациент, быстрое прогрессирование заболевания | |
| 0 баллов | Смерть |
Таблица 2.2. Оценка статуса пациента по шкале ECOG
| Оценка | |
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания (90–100 баллов по шкале Карновского) |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70–80 баллов по шкале Карновского) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно – в вертикальном положении (50–60 баллов по шкале Карновского) |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования (30–40 баллов по шкале Карновского) |
| 4 | Пациент, совершенно не способен к самообслуживанию, прикован к креслу или постели (10–20 баллов по шкале Карновского) |
Приложение
ТАБЛИЦЫ СООТВЕТСТВИЯ «СТАДИЯ-TNM» ДЛЯ РЯДА ЛОКАЛИЗАЦИЙ: ТОНКИЙ КИШЕЧНИК, АМПУЛА ФАТЕРОВА СОСКА, ТИМОМА, МЕЗОТЕЛИОМА ПЛЕВРЫ, КАРЦИНОМА МЕРКЕЛЯ КОЖИ, КОРА НАДПОЧЕЧНИКА
ТОНКИЙ КИШЕЧНИК C17
Таблица 1. Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1, Т2 | N0 | M0 |
| Стадия IIА | Т3 | N0 | M0 |
| Стадия IIB | T4 | N0 | M0 |
| Стадия IIIA | Любая Т | N1 | M0 |
| Стадия IIIB | Любая Т | N2 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
АМПУЛА ФАТЕРОВА СОСКА C24.1
Таблица 2. Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия IA | Т1a | N0 | M0 |
| Стадия IB | Т1b, Т2 | N0 | M0 |
| Стадия IIА | Т3a | N0 | M0 |
| Стадия IIB | Т3b | N0 | M0 |
| Стадия IIIA | Т1a, Т1b, Т2, T3 | N1 | M0 |
| Стадия IIIB | Т4 | Любая N | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
ТИМОМА C37, C38.1-3
Таблица 3. Группировка по стадиям
| Стадия I | T1 | N0 | M0 |
| Стадия II | T2 | N0 | M0 |
| Стадия IIIА | T3 | N0 | M0 |
| Стадия IIIB | T4 | N0 | M0 |
| Стадия IVA | Любая Т |
N1
N0, N1
|
M0
M1A
|
| Стадия IVB | Любая Т | Любая N | M1B |
МЕЗОТЕЛИОМА ПЛЕВРЫ C45.0
Таблица 4. Группировка по стадиям
| Стадия IA | T1 | N0 | M0 |
| Стадия IB | T2, T3 | N0 | M0 |
| Стадия II | T1, T2 | N1 | M0 |
| Стадия IIIА | T3 | N1 | M0 |
| Стадия IIIB | T1, T2, T3, T4 |
N1 Любая N |
M0 |
| Стадия IV | Любая Т | Любая N | M1 |
КАРЦИНОМА МЕРКЕЛЯ C44, C63.2
Таблица 5а. Группировка по стадиям клиническая
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1 | N0 | M0 |
| Стадия IIА | T2, Т3 | N0 | M0 |
| Стадия IIB | Т4 | N0 | M0 |
| Стадия III | Любая Т | N1, N2, N3 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
Таблица 5б. Группировка по стадиям патоморфологическая
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1 | N0 | M0 |
| Стадия IIА | Т2, T3 | N0 | M0 |
| Стадия IIB | Т4 | N0 | M0 |
| Стадия IIIA |
Т0
Т1, Т2, T3, Т4
|
N1b
N1a
|
M0 |
| Стадия IIIB | Любая Т | N1, N2, N3 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
КОРА НАДПОЧЕЧНИКА C74.0
Таблица 6. Группировка по стадиям
| Стадия I | Т1 | N0 | M0 |
| Стадия II | Т2 | N0 | M0 |
| Стадия III |
Т1, T2
Т3, T4
|
N1
N0, N1
|
M0 |
| Стадия IV | Любая Т | Любая N | M1 |
Под редакцией
д-р мед. наук, проф. О.Г.Суконко,
д-р мед. наук, проф., член-корр. НАН Беларуси С.А.Красный
Авторский коллектив:
Антоненкова Нина Н., д.м.н., доц.;
Ануфреенок И.В., к.м.н.;
Артемова Н.А., д.м.н., доц.;
Баранов А.Ю., к.м.н.;
Баранов Е.В., к.м.н.;
Бармотько М.А.;
Грачев Ю.Н., к.м.н.;
Демешко П.Д., д.м.н.;
Демидчик Ю.Е., д.м.н., проф.;
Дзюбан В.П.;
Доломанова Е.В.;
Дубровский А.Ч., к.м.н.;
Евмененко А.А.;
Ермаков Н.Б., к.м.н.;
Жаврид Э.А., д.м.н., проф.;
Жарков В.В, д.м.н., проф.;
Жиляева Е.П.;
Жуковец А.Г., к.м.н.;
Зеленкевич И.А., к.м.н.;
Ильин И.А., к.м.н.;
Караник В.С., к.м.н.;
Карман А.В., к.м.н., доц.;
Киселев П.Г., к.м.н.;
Клименко Д.П.;
Колядич Г.И., к.м.н.;
Кондратович В.А.;
Котов А.А., к.м.н.;
Кохнюк В.Т., д.м.н., проф.;
Красный С.А., д.м.н., проф.;
Крутилина Н.И., д.м.н., проф.;
Курченков А.Н., к.м.н.;
Курчин В.П., д.м.н.;
Левин Л.Ф.;
Леонова Т.А.;
Мавричев А.С., д.м.н., проф.;
Мавричев С.А., к.м.н.;
Малькевич В.Т., д.м.н., доц.;
Маньковская С.В.;
Матылевич О.П., к.м.н.;
Минайло И.И., к.м.н.;
Минич А.А., к.м.н.;
Моисеев П.И., к.м.н.;
Набебина Т.И., к.м.н.;
Науменко Л.В., к.м.н.;
Океанов А.Е., д.м.н., проф.;
Пархоменко Л.Б., к.м.н., доц.;
Петрушенко Ю.И.;
Писаренко А.М.;
Поляков С.Л., к.м.н.;
Портянко А.С., д.м.н., доц.;
Прохорова В.И., д.м.н., проф.;
Ребеко И.В., к.м.н.;
Ревтович М.Ю., к.м.н.;
Ролевич А.И., д.м.н.;
Рындин А.А.;
Рябчевский А.Н.;
Синайко В.В., к.м.н.;
Субоч Е.И., к.м.н.;
Суколинская Е.В., к.м.н.;
Суконко О.Г., д.м.н., проф.;
Суслова В.А., к.м.н.;
Тризна Н.М., к.м.н.;
Фридман М.В., д.м.н.;
Шаповал Е.В., д.м.н.;
Шмак А.И., д.м.н.
Список сокращений:
CTV – клинический объем облучения
GTV – определяемый объем опухоли
ICD – Международная классификация болезней
ITC – отдельные опухолевые клетки
PTV – планируемый объем облучения
UICC – Международный противораковый союз
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
АЧТВ – активированное частичное тромбопластиновое время
ВАТС – видео-ассистированной тораскопии
ВОЗ – Всемирная организация здравоохранения
ВПЧ – вирус папилломы человека
ВЯВ – внутренняя яремная вена;
ГИСО – гастроинтенстинальные стромальные опухоли
ГПДР – гастропанкреатодуоденальная резекция
ГЦР – гепатоцеллюлярный рак
ЖКТ – желудочно-кишечный тракт
ИГХ – иммуногистохимическое исследование
ИОУЗИ – интраоперационное УЗИ
КТ – компьютерная томография
ЛДГ – лактатдегидрогеназа
МНО – международное нормализованное отношение
МРТ – магнитно-резонансная томография
МСКТ – многослойная компьютерная томография
ОГК – органы Грудной клетки
ПВ – протромбиновое время
ПЖ – поджелудочная железа
ПЭТ – позитронно-эмиссионная томография
РЖП – рак желчного пузыря
РОД – разовая облучающая доза
РПК – рак прямой кишки
РПХГ – ретроградная панкреатохолангиография
СОД – суммарная облучающая доза
ТВ – тромбиновое время
ТДПЭ – тотальная дуоденопанкреатэктомия
УЗИ – ультразвуковое исследование
ФВД – функция внешнего дыхания
ФДГ – фтордезоксиглюкоза
ФЭГДС – фиброгастродуоденоскопия
ХЦР – холангиоцеллюлярного рака
ЦНС – центральная нервная система
ЧЧХГ – чрескожная чреспеченочная холангиография
ЧЭИ – чрескожная этаноловая инъекция
ЩФ – щелочная фосфатаза
ЭВВ – эмболизация воротной вены
ЭКГ – электрокардиограмма
ЭУЗИ – эндоскопическое ультразвуковое исследование
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.