Диагностика и лечение злокачественных новообразований: Опухоли головы и шеи
 Версия: Клинические протоколы 2006-2019 (Беларусь)
Версия: Клинические протоколы 2006-2019 (Беларусь)
Злокачественное новообразование губы (C00), Злокачественное новообразование десны (C03), Злокачественное новообразование дна полости рта (C04), Злокачественное новообразование других и неуточненных больших слюнных желез (C08), Злокачественное новообразование других и неуточненных отделов рта (C06), Злокачественное новообразование других и неуточненных частей языка (C02), Злокачественное новообразование неба (C05), Злокачественное новообразование околоушной слюнной железы (C07)
Онкология
Общая информация
Краткое описание
ПОСТАНОВЛЕНИЕ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ
РЕСПУБЛИКИ БЕЛАРУСЬ
6 июля 2018 г. № 60
Об утверждении клинического протокола «Алгоритмы диагностики и лечения злокачественных новообразований»
На основании подпункта 8.3 пункта 8 Положения о Министерстве здравоохранения Республики Беларусь, утвержденного постановлением Совета Министров Республики Беларусь от 28 октября 2011 г. № 1446 «О некоторых вопросах Министерства здравоохранения и мерах по реализации Указа Президента Республики Беларусь от 11 августа 2011 г. № 360», Министерство здравоохранения Республики Беларусь
ПОСТАНОВЛЯЕТ:
1. Утвердить прилагаемый клинический протокол «Алгоритмы диагностики и лечения злокачественных новообразований».
2. Начальникам главных управлений по здравоохранению областных исполнительных комитетов, председателю комитета по здравоохранению Минского городского исполнительного комитета, руководителям государственных организаций, подчиненных Министерству здравоохранения Республики Беларусь, обеспечить проведение диагностики, лечение и профилактику заболеваний в соответствии с клиническим протоколом.
3. Настоящее постановление вступает в силу после его официального опубликования.
Министр В.А.Малашко
УТВЕРЖДЕНО
Постановление
Министерства здравоохранения
Республики Беларусь
06.07.2018 № 60
КЛИНИЧЕСКИЙ ПРОТОКОЛ «Алгоритмы диагностики и лечения злокачественных новообразований»
ГЛАВА 3
ОПУХОЛИ ГОЛОВЫ И ШЕИ
В группу опухолей головы и шеи входят новообразования различной гистологической структуры следующих локализаций:
- губа и полость рта;
- глотка: ротоглотка (включая р16-отрицательный и р16-положительный рак), носоглотка, гортаноглотка;
- гортань: надсвязочный отдел, средний отдел (область голосовых складок), подсвязочный отдел;
- полость носа и околоносовые пазухи;
- первично неопределяющаяся карцинома с метастазами в шейные лимфоузлы;
- злокачественная меланома верхних отделов желудочно-кишечного тракта и дыхательных путей;
- большие слюнные железы;
-
щитовидная железа.
В этот раздел не входят опухоли ЦНС, новообразования глаза, первичные опухоли лимфатической системы, опухоли нервной и эндокринной систем, которые также могут развиваться в данной анатомической области. Опухоли кожи головы (меланома, рак) рассматриваются в соответствующих разделах.
Из-за разнообразия локализаций опухолей и тканей, из которых они происходят, кардинально различаются биология опухолевого роста, пути метастазирования, границы опухоли, признаки и симптомы заболевания. Одной из общих особенностей клинического течения большинства злокачественных опухолей головы и шеи является высокий риск развития локорегионарных рецидивов (до 80 %) и новых опухолей, которые наблюдаются не менее чем у 20 % пациентов. Через некоторое время после завершения лечения риск развития второй опухоли может даже превышать риск развития рецидива первой. Отдаленные метастазы наиболее часто развиваются на фоне прогрессирования заболевания и обычно локализуются в легких, костях, печени.
Классификация
ГЛАВА 1. ОБЩИЕ СВЕДЕНИЯ О TNM КЛАССИФИКАЦИИ
Система TNM для классификации злокачественных опухолей была разработана французом Р. Denoix в 1943–1952 гг. В 1953 г. Комитет по номенклатуре опухолей и статистике, организованный UICC, и Международная комиссия по стадированию рака достигли соглашения по классификации анатомической распространенности опухолей на основе системы TNM. В 1954 г. Международный противораковый союз (UICC) создает Комитет по клинической классификации и прикладной статистике, который в 1958 г. публикует первые рекомендации по клинической классификации рака молочной железы и гортани.
В результате многолетней деятельности Комитета в 1968 г. издается первая редакция TNM классификация злокачественных опухолей. По мере разработки классификации для новых локализаций опухолей и уточнения более ранних рекомендаций в 1974, 1978, 1987, 1997, 2002 и 2009 гг. публикуются 2-я, 3-я, 4-я, 5-я, 6-я и 7-я редакции.
Настоящая (8-я) редакция правил классификации и стадирования полностью соответствуют 8-й редакции руководства по стадированию рака и одобрена всеми национальными TNM комитетами.
В данном руководстве используются морфологические формы злокачественных новообразований в соответствии с классификацией МКБ-О-3, адаптированной под МКБ-10 (проставление кодов врачом-патологом в морфологическом заключении обязательно).
UICC признает необходимость постоянства TNM классификации в течение определенного периода времени, необходимого для накопления данных. Поэтому классификация не должна изменяться до тех пор, пока не будут сделаны крупные достижения в диагностике и лечении злокачественных опухолей, требующие пересмотра настоящей классификации.
Общие правила системы TNM.
TNM система для описания анатомической распространенности болезни основывается на оценке 3 компонентов:
Т – распространение первичной опухоли;
N – отсутствие или наличие метастазов в регионарных лимфатических узлах и степень их поражения;
М – отсутствие или наличие отдаленных метастазов.
К этим трем компонентам добавляются цифры, указывающие на распространенность злокачественного процесса:
Т0, Т1, Т2, Т3, Т4; N0, N1, N2, N3; M0, M1.
В действительности система является «стенографическим» описанием распространенности злокачественной опухоли.
Общие правила классификации, применяемые для опухолей всех локализаций, следующие:
Для каждой локализации имеются две классификации:
Клиническая классификация, обозначаемая TNM (или cTNM). Она основывается на результатах обследования до лечения. Эти данные получают при врачебном осмотре, лучевой диагностике, эндоскопии, биопсии, хирургическом диагностическом вмешательстве и других методах обследования.
Патологическая классификация, обозначаемая pTNM. Она основана на данных обследования до лечения, дополненных или измененных в результате хирургического вмешательства и морфологического исследования. Гистологическая оценка первичной опухоли включает резецированную опухоль или биопсию, позволяющую оценить наивысшую Т категорию. Гистологическая оценка регионарных лимфатических узлов включает исследование удаленных узлов в количестве, адекватном для установления отсутствия метастазов в регионарных лимфатических узлах (pN0) и достаточном для оценки наиболее высокой pN категории. Отдаленные метастазы должны быть подтверждены при микроскопическом исследовании (рМ).
После обозначения Т, N, М и/или рТ, pN и рМ категорий они могут группироваться по стадиям. TNM классификация и стадии, установленные однажды, должны оставаться неизменными в медицинских документах. Клиническая стадия служит основой для выбора лечения, тогда как патологическая стадия обеспечивает наиболее точные данные для оценки прогноза и расчета конечных результатов.
При сомнении в правильности оценки Т, N или М категории должно быть выбрано меньшее значение категории, (т.е. меньшее распространение опухоли).
В случае множественных опухолевых очагов в органе должна классифицироваться опухоль с более высокой Т категорией, а в скобках указываться множественность (т) или количество опухолей, например: Т2(т) или Т1(5). При одновременном поражении парных органов каждая опухоль должна классифицироваться отдельно. При опухолях печени, яичников и фаллопиевой трубы множественные очаги поражения являются критерием Т классификации.
Выявление второй опухоли в одном органе в течение 2 месяцев с момента выявления первой нужно расценивать как синхронное поражение.
TNM категории и стадия могут подразделяться или объединяться для клинических и научных целей (например, любые Т, N или М могут быть разбиты на подгруппы). Однако рекомендованные основные обозначения не должны изменяться.
Анатомические области и локализации.
Локализации в этой классификации обозначаются кодовым номером Международной классификации онкологических болезней.
TNM/pTNM классификация.
Используются следующие общие определения:
Т/рТ – первичная опухоль:
TX/рTX – первичная опухоль не может быть оценена;
Т0/рТ0 – нет доказательств первичной опухоли;
Tis/pTis – рак «in situ»;
Т1/рТ1, Т2/рТ2, ТЗ/рТЗ, Т4/рТ4 – размер или местное распространение опухоли в порядке увеличения.
N/pN – регионарные лимфатические узлы:
Nx/pNx – регионарные лимфатические узлы не могут быть оценены;
N0/pN0 – отсутствуют метастазы в регионарных лимфоузлах;
Nl/pNl, N2/pN2, N3/pN3 – возрастающее поражение регионарных лимфатических узлов.
Непосредственное распространение первичной опухоли на лимфатические узлы классифицируется как метастазы в лимфатических узлах. Метастаз в любом лимфоузле, не относящемся к регионарному, расценивается как отдаленный метастаз.
Опухолевый узел в области регионарных лимфатических узлов, не имеющий гистологических признаков лимфоузла, классифицируется как метастаз в регионарном лимфатическом узле, если имеет форму и ровный контур лимфатического узла. Опухолевый узел с неровным контуром классифицируется в рТ категории.
Когда размер является критерием pN классификации, производится измерение метастатического очага, а не всего лимфатического узла.
Случаи с микрометастазами, когда размеры метастазов не превышают 0,2 см, могут обозначаться добавлением «(mi)», например: pNl(mi) или pN2(mi).
М/рМ – отдаленные метастазы:
МХ/рМХ – отдаленные метастазы не могут быть оценены;
М0/рМ0 – нет отдаленных метастазов;
М1/рМ1 – имеются отдаленные метастазы;
Категория М может быть в дальнейшем специфицирована в соответствии со следующими обозначениями (таблица 1.1):
Система TNM для классификации злокачественных опухолей была разработана французом Р. Denoix в 1943–1952 гг. В 1953 г. Комитет по номенклатуре опухолей и статистике, организованный UICC, и Международная комиссия по стадированию рака достигли соглашения по классификации анатомической распространенности опухолей на основе системы TNM. В 1954 г. Международный противораковый союз (UICC) создает Комитет по клинической классификации и прикладной статистике, который в 1958 г. публикует первые рекомендации по клинической классификации рака молочной железы и гортани.
В результате многолетней деятельности Комитета в 1968 г. издается первая редакция TNM классификация злокачественных опухолей. По мере разработки классификации для новых локализаций опухолей и уточнения более ранних рекомендаций в 1974, 1978, 1987, 1997, 2002 и 2009 гг. публикуются 2-я, 3-я, 4-я, 5-я, 6-я и 7-я редакции.
Настоящая (8-я) редакция правил классификации и стадирования полностью соответствуют 8-й редакции руководства по стадированию рака и одобрена всеми национальными TNM комитетами.
В данном руководстве используются морфологические формы злокачественных новообразований в соответствии с классификацией МКБ-О-3, адаптированной под МКБ-10 (проставление кодов врачом-патологом в морфологическом заключении обязательно).
UICC признает необходимость постоянства TNM классификации в течение определенного периода времени, необходимого для накопления данных. Поэтому классификация не должна изменяться до тех пор, пока не будут сделаны крупные достижения в диагностике и лечении злокачественных опухолей, требующие пересмотра настоящей классификации.
Общие правила системы TNM.
TNM система для описания анатомической распространенности болезни основывается на оценке 3 компонентов:
Т – распространение первичной опухоли;
N – отсутствие или наличие метастазов в регионарных лимфатических узлах и степень их поражения;
М – отсутствие или наличие отдаленных метастазов.
К этим трем компонентам добавляются цифры, указывающие на распространенность злокачественного процесса:
Т0, Т1, Т2, Т3, Т4; N0, N1, N2, N3; M0, M1.
В действительности система является «стенографическим» описанием распространенности злокачественной опухоли.
Общие правила классификации, применяемые для опухолей всех локализаций, следующие:
Для каждой локализации имеются две классификации:
Клиническая классификация, обозначаемая TNM (или cTNM). Она основывается на результатах обследования до лечения. Эти данные получают при врачебном осмотре, лучевой диагностике, эндоскопии, биопсии, хирургическом диагностическом вмешательстве и других методах обследования.
Патологическая классификация, обозначаемая pTNM. Она основана на данных обследования до лечения, дополненных или измененных в результате хирургического вмешательства и морфологического исследования. Гистологическая оценка первичной опухоли включает резецированную опухоль или биопсию, позволяющую оценить наивысшую Т категорию. Гистологическая оценка регионарных лимфатических узлов включает исследование удаленных узлов в количестве, адекватном для установления отсутствия метастазов в регионарных лимфатических узлах (pN0) и достаточном для оценки наиболее высокой pN категории. Отдаленные метастазы должны быть подтверждены при микроскопическом исследовании (рМ).
После обозначения Т, N, М и/или рТ, pN и рМ категорий они могут группироваться по стадиям. TNM классификация и стадии, установленные однажды, должны оставаться неизменными в медицинских документах. Клиническая стадия служит основой для выбора лечения, тогда как патологическая стадия обеспечивает наиболее точные данные для оценки прогноза и расчета конечных результатов.
При сомнении в правильности оценки Т, N или М категории должно быть выбрано меньшее значение категории, (т.е. меньшее распространение опухоли).
В случае множественных опухолевых очагов в органе должна классифицироваться опухоль с более высокой Т категорией, а в скобках указываться множественность (т) или количество опухолей, например: Т2(т) или Т1(5). При одновременном поражении парных органов каждая опухоль должна классифицироваться отдельно. При опухолях печени, яичников и фаллопиевой трубы множественные очаги поражения являются критерием Т классификации.
Выявление второй опухоли в одном органе в течение 2 месяцев с момента выявления первой нужно расценивать как синхронное поражение.
TNM категории и стадия могут подразделяться или объединяться для клинических и научных целей (например, любые Т, N или М могут быть разбиты на подгруппы). Однако рекомендованные основные обозначения не должны изменяться.
Анатомические области и локализации.
Локализации в этой классификации обозначаются кодовым номером Международной классификации онкологических болезней.
TNM/pTNM классификация.
Используются следующие общие определения:
Т/рТ – первичная опухоль:
TX/рTX – первичная опухоль не может быть оценена;
Т0/рТ0 – нет доказательств первичной опухоли;
Tis/pTis – рак «in situ»;
Т1/рТ1, Т2/рТ2, ТЗ/рТЗ, Т4/рТ4 – размер или местное распространение опухоли в порядке увеличения.
N/pN – регионарные лимфатические узлы:
Nx/pNx – регионарные лимфатические узлы не могут быть оценены;
N0/pN0 – отсутствуют метастазы в регионарных лимфоузлах;
Nl/pNl, N2/pN2, N3/pN3 – возрастающее поражение регионарных лимфатических узлов.
Непосредственное распространение первичной опухоли на лимфатические узлы классифицируется как метастазы в лимфатических узлах. Метастаз в любом лимфоузле, не относящемся к регионарному, расценивается как отдаленный метастаз.
Опухолевый узел в области регионарных лимфатических узлов, не имеющий гистологических признаков лимфоузла, классифицируется как метастаз в регионарном лимфатическом узле, если имеет форму и ровный контур лимфатического узла. Опухолевый узел с неровным контуром классифицируется в рТ категории.
Когда размер является критерием pN классификации, производится измерение метастатического очага, а не всего лимфатического узла.
Случаи с микрометастазами, когда размеры метастазов не превышают 0,2 см, могут обозначаться добавлением «(mi)», например: pNl(mi) или pN2(mi).
М/рМ – отдаленные метастазы:
МХ/рМХ – отдаленные метастазы не могут быть оценены;
М0/рМ0 – нет отдаленных метастазов;
М1/рМ1 – имеются отдаленные метастазы;
Категория М может быть в дальнейшем специфицирована в соответствии со следующими обозначениями (таблица 1.1):
Таблица 1.1
|
Легкие
|
PUL
|
Костный мозг
|
MAR
|
|
Кости
|
OSS
|
Плевра
|
PLE
|
|
Печень
|
HEP
|
Брюшина
|
PER
|
|
Головной мозг
|
BRA
|
Надпочечники
|
ADR
|
|
Лимфоузлы
|
LYM
|
Кожа
|
SKI
|
|
Другие
|
ОТН
|
|
|
Подразделения TNM.
Главные категории в классификации могут иметь подразделения, придающие критерию большую специфичность (например; Tla, lb или N2a, 2b).
Сигнальный лимфоузел.
Это первый лимфоузел, получающий лимфу из первичной опухоли. Если в нем имеется метастаз, то и другие лимфоузлы могут быть поражены. Если этот лимфоузел не поражен, то и наличие метастазов в других узлах маловероятно. Иногда встречаются более одного сигнальных лимфоузлов.
При оценке сигнального лимфоузла применяются следующие определения:
-
pNX(sn) – сигнальный узел не может быть оценен; pN0(sn) – нет поражения сигнального узла;
-
pN1(sn) – есть поражение сигнального узла.
Отдельные опухолевые клетки.
Отдельные опухолевые клетки (ITC) представляют собой единичные опухолевые клетки или маленькие кластеры клеток не более 0,2 мм в наибольшем измерении. ITC обычно не демонстрируют метастатической активности (пролиферацию или реакцию стромы) или инвазии стенок сосудистого или лимфатического синуса. Случаи с ITC в лимфатических узлах или отдаленных органах и тканях должны классифицироваться как N0 или М0 соответственно.
Это же применимо и к случаям, когда наличие опухолевых клеток или их компонентов подтверждается неморфологическими исследованиями, такими как проточная морфометрия или анализ ДНК.
Случаи с ITC должны анализироваться отдельно.
Классификация ITC:
-
pN0 – гистологически не выявляются метастазы в регионарных лимфатических узлах, не проводились исследования по выявлению ITC;
-
pN0(i-) – гистологически нет метастазов в регионарных лимфатических узлах, негативные морфологические данные по выявлению ITC;
-
pN0(i+) – гистологически нет метастазов в регионарных лимфатических узлах, позитивные морфологические данные по выявлению ITC;
-
pN0(mol-) – гистологически нет метастазов в регионарных лимфатических узлах, негативные неморфологические данные по выявлению ITC;
-
pN0 (mol+) – гистологически нет метастазов в регионарных лимфатических узлах, неморфологическими методами выявляются ITC.
При исследовании ITC в сигнальном лимфоузле к обозначениям выше приведенной классификации в скобках указывается «(sn)», например: pN0(i+) (sn).
Отдельные опухолевые клетки, выявленные в костном мозгу морфологическими методами, классифицируются аналогично схеме для N, например: pM0(i+), а неморфологическими – pM0(mol+).
Гистопатологическая дифференцировка.
Это стадирование позволяет оценить степень агрессивности опухолей некоторых гистологических типов и может влиять на прогноз и выбор лечения.
Для большинства локализаций выделяется 4 степени дифференцировки опухолей:
-
G1 – хорошо дифференцированные;
-
G2 – умеренно дифференцированные;
-
G3 – низко дифференцированные;
-
G4 – недифференцированные.
При наличии различных степеней дифференцировки в опухоли указывается наименее благоприятная степень.
Саркомы костей и мягких тканей классифицируется также с использованием градаций «высокая степень» и «низкая степень» дифференцировки.
Для некоторых форм рака (молочной железы, тела матки, печени) рекомендуются специальные системы стадирования по степеням.
Дополнительные дескрипторы.
Для идентификации особых случаев в TNM/pTNM используются символы m, у, r, а.
Хотя они не влияют на группировку по стадиям, но указывают опухоли, которые должны анализироваться отдельно:
-
m – используется для обозначения множественных опухолей одной локализации;
-
у – в тех случаях, когда классификация приводится в течение или после проведения комбинированного (многокомпонентного) лечения, cTNM или pTNM категория обозначается префиксом «у», например: ycTNM или ypTNM. При оценке распространения опухоли до начала комбинированного лечения символ «у» не исключается;
-
r – рецидив опухоли после радикального лечения при классификации обозначается префиксом «r» (rcTNM или rpTNM);
-
а – применяется для обозначения классификации опухолей, впервые выявленных при аутопсии.
Необязательные дескрипторы.
L – инвазия лимфатических сосудов.
Классифицируется как LX, L0 и L1.
V – инвазия вен.
Классифицируется как VX, VO, VI (микроскопическая инвазия) и V2 (макроскопическая инвазия). Макроскопическое вовлечение стенки вены при отсутствии опухоли в просвете сосуда классифицируется как V2.
С-фактор.
С-фактор или «фактор надежности» отражает достоверность классификации с учетом использованных методов диагностики. Его использование не является обязательным.
Определения С-фактора:
-
С1 – данные стандартных диагностических методов (осмотр, пальпация, рентгенологическое исследование, эндоскопическое исследование),
-
С2 – данные, полученные при использовании специальных диагностических методов (рентгенологическое исследование в специальных проекциях, томография, компьютерная томография, ультразвуковое исследование, лимфография, ангиография, сцинтиграфия, магнитно-резонансная томография, ПЭТ/КТ, эндоскопия, биопсия, цитологическое исследование);
-
С3 – данные хирургического диагностического вмешательства, включая биопсию и цитологическое исследование;
-
С4 – данные, полученные после радикальной операции и гистологического исследования удаленного препарата;
-
С5 – данные патологоанатомического вскрытия.
Степени С-фактора могут использоваться при описании категорий Т, N и М (например: Т3С2, N2C1, М0С2).
Клиническая классификация TNM соответствует CI, С2 и С3 степеням, тогда как pTNM эквивалентна С4.
Классификация остаточных опухолей (R).
TNM/pTNM классификация описывает анатомическую распространенность опухоли без рассмотрения вопросов лечения. R-классификация описывает статус опухоли после лечения. Она отражает эффект лечения и является прогностическим фактором. При R- классификации оценивается не только первичная опухоль, но и остающиеся отдаленные метастазы.
Эта классификация может применяться после хирургического лечения, лучевой или химиотерапии, а также после комбинированного лечения. После консервативного лечения остаточная опухоль оценивается клиническими методами. После хирургического лечения R-классификация требует тесного сотрудничества хирурга и морфолога.
Случаи с макроскопически определяемой остаточной опухолью (R2) могут подразделяться на R2a (без микроскопического подтверждения) и R2b (микроскопически подтвержденные).
R0 группа может включать пациентов как с М0, так и с Ml. В последнем случае отдаленные метастазы, как и первичная опухоль, должны быть полностью удалены. Трудности с R-классификацией могут возникнуть при удалении опухоли по частям, а не «en blok». В таких случаях уместна категория RX.
Наличие микроскопически определяемой инвазивной опухоли по линии резекции классифицируется как R1, а в случае неинвазивной карциномы – R1 (is).
Группировка по стадиям.
Комбинация всех значений дескрипторов TNM позволяет получить 24 категории TNM, описывающие распространенность опухоли. Для табличного представления данных и анализа эти категории объединяются в ограниченное количество групп – стадий. Каждая стадия более или менее однородна по прогнозу и критерию выживаемости относящихся к ней пациентов.
Карцинома «in situ» относится к стадии 0, а опухоли с отдаленными метастазами – к стадии IV (за исключением некоторых локализаций, например, папиллярного и фолликулярного рака щитовидной железы).
Для патологической стадии необходимо морфологическое исследование достаточного количества тканей, позволяющее оценить наибольшее значение Т и N. Если же имеется морфологическое подтверждение отдаленных метастазов, то и классификация (рМ1) и стадия являются патологическими.
Термин «стадия» употребляется только для комбинаций Т, N, М или рТ, pN или рМ категорий. Необходимо избегать выражений типа «Т стадия» или «N стадия»
Рак губы и слизистой оболочки ротовой полости (С00, С02-06).
3.2.1. Гистологическая классификация.
Абсолютное большинство злокачественных новообразований слизистой оболочки ротовой полости и губы представлены плоскоклеточным раком (95 %). Характерной его особенностью является склонность к лимфогенному метастазированию в поверхностные и глубокие лимфатические узлы шеи. Самый высокий процент регионарного метастазирования (≈40 %) отмечается при раке языка.
Кроме плоскоклеточного рака на слизистой оболочке полости рта может развиваться меланома, аденокарцинома, аденокистозная карцинома и др. опухоли.
Гистологическая классификация приведена согласно международной классификации онкологических заболеваний, (ВОЗ, 2016); лимфомы и саркомы не включены (таблица 3.5):
Таблица 3.5. Гистологическая классификация
Абсолютное большинство злокачественных новообразований слизистой оболочки ротовой полости и губы представлены плоскоклеточным раком (95 %). Характерной его особенностью является склонность к лимфогенному метастазированию в поверхностные и глубокие лимфатические узлы шеи. Самый высокий процент регионарного метастазирования (≈40 %) отмечается при раке языка.
Кроме плоскоклеточного рака на слизистой оболочке полости рта может развиваться меланома, аденокарцинома, аденокистозная карцинома и др. опухоли.
Гистологическая классификация приведена согласно международной классификации онкологических заболеваний, (ВОЗ, 2016); лимфомы и саркомы не включены (таблица 3.5):
Таблица 3.5. Гистологическая классификация
|
Гистологическая форма новообразования
|
Код ICD-O
|
|
Плоскоклеточный рак классический, неспецифический
|
8070/3
|
|
Плоскоклеточный рак, варианты
Акантолитический
Железисто-плоскоклеточный Базалоидный Папиллярный Веретеноклеточный Веррукозный Лимфоэпителиальный (неносоглоточный) |
8075/3 8560/3 8083/3 8052/3 8074/3 8051/3 8082/ |
|
Нейроэндокринные карциномы
Типичный карциноид (высоко дифференцированная нейроэндокринная карцинома) Атипичный карциноид (умеренно дифференцированная нейроэндокринная карцинома) Мелкоклеточный нейроэндокринный рак (низко дифференцированная нейроэндокринная карцинома) Крупноклеточный нейроэндокринный рак (низко дифференцированная нейроэндокринная карцинома) |
8249/3
|
|
Карциномы малых слюнных желез
Аденокистозный рак Мукоэпидермоидный рак (высоко, умеренно и низко дифференцированный) |
8200/3 8430/3 |
|
Меланома слизистых оболочек
|
8746/3
|
3.2.2. TNM классификация.
3.2.2.1. Анатомические области и части.
Губа (С00):
-
верхняя губа, красная кайма (С00.0);
-
нижняя губа, красная кайма (С00.1);
-
углы рта (комиссуры) (С00.6).
-
Полость рта (С02-C06, С00.3,4).
Слизистая оболочка:
-
слизистая оболочка верхней и нижней губ (С00.3,4);
-
слизистая оболочка щек (С06.0);
-
ретромолярная область (С06.2);
-
щечно-альвеолярные складки (борозды), верхняя и нижняя (преддверие рта) (С06.1).
Верхний альвеолярный отросток и десна (С03.0).
Нижний альвеолярный отросток и десна (С03.1).
Твердое небо (С05.0).
Язык:
-
спинка и боковые края кпереди от желобовидных сосочков (передние две трети) (С02.0,1);
-
нижняя поверхность (С02.2).
Дно полости рта (С04).
3.2.2.2. Клиническая классификация TNM.
Т – первичная опухоль.
TX – недостаточно данных для оценки первичной опухоли.
TO – первичная опухоль не определяется.
Tis – преинвазивная карцинома (carcinoma in situ).
Т1 – опухоль до 2 см в наибольшем измерении и глубиной инвазии опухоли до 5 мм*.
Т2 – опухоль до 2 см в наибольшем измерении и глубиной инвазии опухоли от 5до 10 мм или опухоль от 2 до 4 см и глубиной инвазии опухоли не более 10 мм.
Т3 – опухоль более 4 см в наибольшем измерении или глубиной инвазии опухоли более 10 мм.
Т4а (губа) – опухоль прорастает кортикальную пластинку нижней челюсти, нижнелуночковый нерв, ткани дна полости рта, кожу лица (в т.ч. подбородка или носа).
Т4а (полость рта) – опухоль прорастает кортикальную пластинку нижней челюсти или верхнечелюстную пазуху, кожу лица.
Т4b (губа и полость рта) – опухоль прорастает жевательные мышцы, крыловидные пластинки основной кости или основание черепа, или вовлекает внутреннюю сонную артерию.
Примечание.
* Поверхностной эрозии костной/зубной альвеолы первичной опухолью десны недостаточно для обозначения процесса как Т4а.
N – регионарные лимфатические узлы.
NX – недостаточно данных для оценки состояния регионарных лимфатических узлов.
N0 – отсутствие метастазов в регионарных лимфатических узлах.
N1 – метастаз в одном лимфатическом узле на стороне поражения до 3 см и менее в наибольшем измерении без экстранодального распространения.
N2а – метастаз в одном лимфатическом узле на стороне поражения более чем 3 см, но менее 6 см в наибольшем измерении без экстранодального распространения.
N2b – метастазы в нескольких лимфатических узлах на стороне поражения до 6 см в наибольшем измерении без экстранодального распространения.
N2с – метастазы в лимфатических узлах с обеих сторон или с противоположной стороны не более 6 см в наибольшем измерении без экстранодального распространения.
N3а – метастаз в лимфатическом узле более 6 см в наибольшем измерении без экстранодального распространения.
N3b – метастаз в одном или нескольких лимфатических узлах с клиническим экстранодальным распространением.
Примечания:
Наличие поражения кожи или инвазия в мягкие ткани с глубокой фиксацией к подлежащей мышце или другим структурам, или наличие клинических признаков поражения нерва, классифицируется как клиническое экстранодальное распространение.
Лимфатические узлы, расположенные по средней линии, считаются лимфоузлами на стороне поражения.
М – отдаленные метастазы.
М0 – нет признаков отдаленных метастазов.
М1 – имеются отдаленные метастазы
3.2.2.3. pTNM – патогистологическая классификация.
Требования к определению категорий рТ, рМ соответствуют требованиям к определению категорий Т, М.
pN – региональные лимфоузлы
Гистологическое исследование при селективной шейной диссекции, обычно включает 10 или более лимфоузлов. Гистологическое исследование при радикальной или модифицированной радикальной шейной лимфодиссекции, обычно включает 15 или более лимфоузлов.
pNX – недостаточно данных для оценки состояния регионарных лимфатических узлов
pN0 – отсутствие метастазов в регионарных лимфоузлах
pN1 – метастаз в одном лимфоузле, расположенном на одной стороне поражения, 3 см или менее в наибольшем измерении без экстранодального распространения
pN2a – метастаз в одном лимфоузле, расположенном на одной стороне поражения, менее 3 см в наибольшем измерении с экстранодальным распространением или более 3 см, но не более 6 см в наибольшем измерении без экстранодального распространения
pN2b – метастазы в ипсилатеральных лимфоузлах не более 6 см в наибольшем измерении без экстранодального распространения
pN2c – метастазы в билатеральных и контралатеральных лимфоузлах не более 6 см в наибольшем измерении без экстранодального распространения
pN3a – единичный метастаз более 6 см в наибольшем измерении без экстранодального распространения
pN3b – единичный метастаз более 3 см в наибольшем измерении с экстранодальным распространением или множественные ипсилатеральные, или любые контралатеральные или билатеральные узлы с экстранодальным распространением
При патоморфологическом исследовании необходимо отмечать:
Наличие периневральной инвазии (независимо от размера нерва)
Наличие экстранодального распространения метастазов опухоли (распространение за пределы капсулы узла).
3.2.2.4. Группировка по стадиям (таблица 3.6).
Таблица 3.6. Группировка по стадиям
|
Стадия
|
t
|
n
|
m
|
|
Стадия 0
|
Tis
|
N0
|
М0
|
|
Стадия I
|
Т1
|
N0
|
М0
|
|
Стадия II
|
Т2
|
N0
|
М0
|
|
Стадия III
|
Т3
|
N0
|
М0
|
|
Т1, Т2, Т3
|
N1
|
М0
|
|
|
Стадия IVA
|
Т4а
|
N0, N1
|
М0
|
|
Т1, Т2, Т3, Т4а
|
N2
|
М0
|
|
|
Стадия IVВ
|
Любая Т
|
N3
|
М0
|
|
Т4b
|
Любая N
|
М0
|
|
|
Стадия IVС
|
Любая N
|
Любая N
|
М1
|
Злокачественные опухоли слюнных желез (С07-С08).
3.6.1. Гистологическая классификация.
Наиболее часто встречаются нижеперечисленные морфологические формы злокачественных опухолей слюнных желез (гистологическая классификация приведена согласно международной классификации онкологических заболеваний, 20131; лимфомы и саркомы не включены, таблица 3.9).
Таблица 3.9. Гистологическая классификация
Наиболее часто встречаются нижеперечисленные морфологические формы злокачественных опухолей слюнных желез (гистологическая классификация приведена согласно международной классификации онкологических заболеваний, 20131; лимфомы и саркомы не включены, таблица 3.9).
Таблица 3.9. Гистологическая классификация
|
Гистологическая форма новообразования
|
Код ICD-O
|
|
Ациноклеточный рак (опухоль низкой степени степени злокачественности)
|
8550/3
|
|
Аденокистозный рак (степень злокачественности определяют по количеству солидного
компонента) |
8200/3
|
|
Неспецифическая аденокарцинома (низкой, промежуточной и высокой степени
злокачественности) |
8140/3
|
|
Базальноклеточная аденокарцинома (опухоль низкой степени степени злокачественности)
|
8147/3
|
|
Карцинома в плеоморфной аденоме
|
8941/3
|
|
Мукоэпидермоидный рак (низкой, промежуточной и высокой степени злокачественности
|
8430/3
|
|
Полиморфная аденокарцинома (опухоль низкой степени степени злокачественности)
|
8525/3
|
|
Сосочковая цистаденокарцинома
|
8450/3
|
|
Цистаденокарцинома
|
8440/3
|
|
Рак протоков слюнных желез (опухоль высокой степени степени злокачественности)
|
8500/3
|
|
Онкоцитарная карцинома
|
8290/3
|
|
Муцинозная аденокарцинома
|
8480/3
|
|
Неспецифическая светлоклеточная карцинома
|
8310/3
|
|
Миоэпителиальная карцинома (опухоль низкой или высокой степени степени
злокачественности) |
8982/3
|
|
Плоскоклеточный рак (низкой, промежуточной и высокой степени злокачественности)
|
8070/3
|
|
Крупноклеточный рак (опухоль высокой степени степени злокачественности)
|
8012/3
|
|
Мелкоклеточный рак (опухоль высокой степени степени злокачественности)
|
8041/3
|
|
Карциносаркома (метапластический рак)
|
8980/3
|
|
Лимфоэпителиальный рак
|
8082/3
|
|
Недифференцированный рак
|
8020/3
|
______________________________
1 International Classification of Diseases for Oncology (ICD-O), Third Edition.
3.6.2. TNM классификация.
Классификация применима только для рака больших слюнных желез:
1 International Classification of Diseases for Oncology (ICD-O), Third Edition.
3.6.2. TNM классификация.
Классификация применима только для рака больших слюнных желез:
-
околоушная (С07.9);
-
поднижнечелюстная (С08.0);
-
подъязычная (С08.1).
Карциномы малых слюнных желез верхних отделов желудочно-кишечного тракта и дыхательных путей классифицируются согласно правилам кодирования их анатомической классификации (например, полости рта).
Т – первичная опухоль:
TX – недостаточно данных для оценки первичной опухоли
T0 – первичная опухоль не определяется
T1 – опухоль 2 см или менее в наибольшем измерении без экстрапаренхиматозного распространения*
T2 – опухоль более 2 см, но не более 4 см в наибольшем измерении, без
экстрапаренхиматозного распространения*
T3 – опухоль более 4 см и/или опухоль с экстрапаренхиматозным распространением*
T4a – опухоль распространяется на кожу, нижнюю челюсть, наружный слуховой проход и/или лицевой нерв
T4b – опухоль распространяется на основание черепа, и/или крыловидные пластинки основной кости, и/или охватывает сонную артерию
Примечание.
Экстрапаренхиматозное распространение имеет место в том случае, когда есть клинические или макроскопические данные о вовлеченности мягких тканей или нерва, за исключением перечисленных для T4a и T4b. Только одних микроскопических данных недостаточно для того, чтобы констатировать наличие экстрапаренхиматозного распространения.
N – регионарные лимфоузлы:
N1 – метастаз в одном лимфоузле на стороне поражения, до 3 см в наибольшем измерении, без экстранодального распространения
N2a – метастаз в одном лимфоузле на стороне поражения, более 3 см, но не более 6 см в наибольшем измерении, без экстранодального распространения
N2b – метастазы в нескольких лимфоузлах на стороне поражения, не более 6 см в наибольшем измерении, без экстранодального распространения
N2c – метастазы в лимфоузлах с обеих сторон или с противоположной стороны, не более 6 см в наибольшем измерении, без экстранодального распространения
N3a – метастаз в одном лимфоузле более 6 см в наибольшем измерении, без экстранодального распространения
N3b – метастазы в одном или нескольких лимфоузлах с клиническим экстранодальным распространением*
Примечание.
* Наличие поражения кожи или вовлеченности мягких тканей с глубокой фиксацией к подлежащей мышце или прилежащим структурам, или наличие клинических признаков поражения нерва, классифицируется как клиническое экстранодальное распространение.
M – отдаленные метастазы:
M0 – отдаленные метастазы отсутствуют
M1 – отдаленный метастаз
pTNM патогистологическая классификация:
pT-категории соответствуют клиническим T-категориям.
pN – Регионарные лимфоузлы:
Гистологическое исследование при селективной лимфодиссекции шеи обычно включает 10 или более лимфоузлов. Гистологическое исследование макропрепарата прирадикальной или модифицированной радикальной лимфодиссекции шеи включает 15 или более лимфоузлов.
pNX – недостаточно данных для оценки поражения регионарных лимфоузлов
pN0 – нет признаков метастатического поражения регионарных лимфоузлов
pN1 – метастаз в одном лимфоузле на стороне поражения, 3 см или менее в наибольшем измерении, без экстранодального распространения
pN2a – метастаз в одном лимфоузле на стороне поражения, до 3 см в наибольшемизмерении с экстранодальным распространением или метастаз более 3 см, но не более 6 см в наибольшем измерении, без экстранодального распространения
pN2b – метастазы в нескольких лимфоузлах на стороне поражения, не более 6 см в наибольшем измерении, без экстранодального распространения
pN2c – метастазы в лимфоузлах с обеих сторон или с противоположной стороны, не более 6 см в наибольшем измерении, без экстранодального распространения
pN3a – метастаз в лимфоузле более 6 см в наибольшем измерении, без экстранодального распространения
pN3b – метастаз в одном лимфоузле более 3 см в наибольшем измерении, с экстранодальным распространением или в нескольких лимфоузлах на стороне поражения или в лимфоузлах с противоположной стороны или с обеих сторон, с экстранодальным распространением.
3.6.3. Группировка по стадиям (таблица 3.10).
Таблица 3.10. Группировка по стадиям
|
Стадия
|
Т
|
N
|
М
|
|
Стадия 0
|
Tis
|
N0
|
М0
|
|
Стадия I
|
Т1
|
N0
|
М0
|
|
Стадия II
|
Т2
|
N0
|
М0
|
|
Стадия III
|
Т3
T1, T2, T3 |
N0
N1 |
М0
|
|
Стадия IVA
|
T1, T2, T3
T4a |
N2
N0,N1,N2 |
М0
|
|
Стадия IVВ
|
T4b
Любая T |
Любая N
N3 |
М0
|
|
Стадия IVС
|
Любая T
|
Любая N
|
M1
|
Эпидемиология
3.2. Рак губы и слизистой оболочки ротовой полости (С00, С02-06).
Под термином «рак губы» подразумевают злокачественные опухоли, которые возникают в области слизистой оболочки красной каймы губы (таблица 3.3).
Новообразования, развившиеся на коже рядом с губой или слизистой преддверия рта, в эту группу опухолей не включаются.
Таблица 3.3. Основные статистические показатели С00
|
Показатель
|
Число
|
|
|
2011
|
2016
|
|
|
Число вновь выявленных случаев заболевания
|
173
|
181
|
|
Заболеваемость на 100 000 населения (грубый интенсивный показатель)
|
1,8
|
1,9
|
|
Диагноз установлен в I стадии заболевания (% к вновь выявленным случаям)
|
66,3
|
63,1
|
|
Диагноз установлен в II стадии заболевания (% к вновь выявленным случаям)
|
24,2
|
27,4
|
|
Диагноз установлен в III стадии заболевания (% к вновь выявленным случаям)
|
7,7
|
8,4
|
|
Диагноз установлен в IV стадии заболевания (% к вновь выявленным случаям)
|
1,8
|
1,1
|
|
Прожили менее года с момента установления диагноза из числа заболевших в предыдущем году (одногодичная летальность в %)
|
2,6
|
2,1
|
|
Умерло от злокачественных новообразований
|
22
|
15
|
|
Смертность на 100 000 населения грубый интенсивный показатель
|
0,2
|
0,2
|
|
Отношение смертности к заболеваемости в % (интенсивные показатели)
|
11,1
|
10,5
|
|
Число пациентов, состоящих на учете на конец года
|
3257
|
2084
|
|
Из них состоящих на учете 5 и более лет, %
|
77,8
|
70,1
|
В группу опухолей слизистой оболочки ротовой полости включаются злокачественные новообразования языка (исключая корень языка), дна полости рта, щек, твердого и мягкого слизистой неба, альвеолярного отростка нижней и верхней челюсти (таблица 3.4).
Таблица 3.4. Основные статистические показатели С01–C06
|
Показатель
|
Число
|
|
|
2011
|
2016
|
|
|
Число вновь выявленных случаев заболевания
|
474
|
708
|
|
Заболеваемость на 100 000 населения (грубый интенсивный показатель)
|
5
|
7,5
|
|
Диагноз установлен в I стадии заболевания (% к вновь выявленным случаям)
|
13,6
|
13,6
|
|
Диагноз установлен в II стадии заболевания (% к вновь выявленным случаям)
|
28,8
|
20,5
|
|
Диагноз установлен в III стадии заболевания (% к вновь выявленным случаям)
|
30,3
|
29,5
|
|
Диагноз установлен в IV стадии заболевания (% к вновь выявленным случаям)
|
27,3
|
36,4
|
|
Прожили менее года с момента установления диагноза из числа заболевших в предыдущем году (одногодичная летальность в %)
|
38
|
33,2
|
|
Умерло от злокачественных новообразований
|
294
|
359
|
|
Смертность на 100 000 населения грубый интенсивный показатель
|
3,1
|
3,8
|
|
Отношение смертности к заболеваемости в % (интенсивные показатели)
|
62
|
50,7
|
|
Число пациентов, состоящих на учете на конец года
|
1558
|
2098
|
|
Из них состоящих на учете 5 и более лет, %
|
41
|
35,7
|
Рак губы и рак слизистой ротовой полости в 66–95 % случаев развивается у мужчин. Большинство пациентов представлены лицами 5–7-го десятилетия жизни. Этиологическими факторами рака губы и слизистой оболочки полости рта являются курение, хронические травмы, воспалительные процессы и неблагоприятные метеорологические условия (для рака губы). Более чем в половине случаев рак развивается на фоне клинически определяемых облигатных и факультативных предопухолевых процессов слизистой оболочки и красной каймы губы. Изучается вопрос о роли вируса папилломы человека (ВПЧ) в развитии предраковых заболеваний и рака полости рта, ротоглотки и гортани. ВПЧ-ассоциированные повреждения ротовой полости включают папилломы (ассоциированные с ВПЧ 6 и 11 типов), фокальную гиперплазию эпителия (ВПЧ 13 и 32 типов) и эритроплакию (ВПЧ 16 типа).
Большинство злокачественных опухолей слизистой оболочки ротовой полости локализуется на языке (50–60 %) и слизистой дна полости рта (20–35 %). Крайне редко опухоли развиваются на слизистой твердого неба (1,3 %).
3.6. Злокачественные опухоли слюнных желез (С07-С08).
Опухоли слюнных желез могут развиваться в больших слюнных железах (околоушная, поднижнечелюстная и подъязычная) и малых слюнных железах (слизистая оболочка полости рта, небо, небный язычок, дно полости рта, задняя 1/3 языка, ретромолярная область, глотка, гортань, придаточные пазухи носа).
Злокачественные опухоли слюнных желез в структуре онкологической заболеваемости составляют менее 0,5 % от всех злокачественных новообразований и приблизительно 3–5 % всех злокачественных опухолей головы и шеи.
Возраст большинства пациентов находится в пределах 50–70 лет. Приблизительно 80 % всех новообразований поражает околоушные железы. Опухоли малых слюнных желез наиболее часто развиваются на небе. Частота развития злокачественных опухолей зависит от их локализации. Так, злокачественными опухолями являются приблизительно 20–25 % новообразований околоушных, 35–40 % – поднижнечелюстных, 50 % – опухолей неба, и около 90 % подъязычных слюнных желез.
Таблица 3.8. Основные статистические показатели C07–08
| Показатель | Число | |
| 2011 | 2016 | |
| Число вновь выявленных случаев заболевания | 82 | 120 |
|
Заболеваемость на 100 000 населения (грубый интенсивный
показатель)
|
0,9 | 1,3 |
|
Диагноз установлен в I стадии заболевания (% к вновь выявленным
случаям)
|
16 | 10,5 |
|
Диагноз установлен в II стадии заболевания (% к вновь выявленным
случаям)
|
28 | 30,4 |
|
Диагноз установлен в III стадии заболевания (% к вновь выявленным
случаям)
|
33,3 | 25,2 |
|
Диагноз установлен в IV стадии заболевания (% к вновь выявленным
случаям)
|
22,7 | 33,9 |
|
Прожили менее года с момента установления диагноза из числа
заболевших в предыдущем году (одногодичная летальность в %)
|
27,2 | 23,4 |
| Умерло от злокачественных новообразований | 45 | 53 |
| Смертность на 100 000 населения грубый интенсивный показатель | 0,5 | 0,6 |
|
Отношение смертности к заболеваемости в % (интенсивные
показатели)
|
55,6 | 46,2 |
| Число пациентов, состоящих на учете на конец года | 648 | 721 |
| Из них состоящих на учете 5 и более лет, % | 64,2 | 57,7 |
Факторы и группы риска
Рак губы и слизистой оболочки ротовой полости (С00, С02-06)
3.2.2.5. Прогностические факторы для карцином ротовой полости (таблица 3.7)
Таблица 3.7. Прогностические факторы для карцином ротовой полости
|
Прогностические
факторы |
Связанные с опухолью
|
Связанные с пациентом
|
Прочие
|
|
Существенно важные
|
Категории T и N
Экстракапсулярное распространение Края резекции |
Общее состояние
пациента Зависимость (табак/орех катеху/алкоголь |
Доза лучевой
терапии/химиолучевой терапии |
|
Дополнительные
|
Объем опухоли
Гипоксия |
Возрастные сопутствующие заболевания
|
Общее время лечения/время лечения лучевой терапией.
Интервал от операции до начала послеоперационной лучевой терапии |
|
Новые и перспективные
|
Экспрессия EGFR, мутация TP53 Bcl-2 ERCC1
|
Качество жизни, связанное с глотанием.
Общее качество жизни |
|
Злокачественные опухоли слюнных желез (С07-С08)
3.6.4. Прогностические факторы (таблица 3.11)
Таблица 3.11. Прогностические факторы
|
Прогностические
факторы
|
Связанные с опухолью |
Связанные с
пациентом
|
Прочие |
|
Существенно
важные
|
Гистологическая степень
злокачественности. Размер опухоли.
Местное прорастание опухолью
Периневральная инвазия
|
Возраст |
Края резекции и
остаточный процесс
(R0/R1/R2)
|
| Дополнительные | Метастазы в лимфоузлах | Прозопоплегия, боль |
Адъювантная лучевая
терапия
|
|
Новые и
перспективные
|
Молекулярные маркеры (с-Kit, Ki-67,
HER2, EGFR, VEGF, рецепторы
андрогена)
|
Нейтронная или фотонная
лучевая терапия
|
Гистопатологическая дифференцировка
степень злокачественности (G) карцином:
- GX – степень дифференцировки не может быть установлена.
- G1 – высокая степень дифференцировки.
- G2 – умеренная степень дифференцировки.
- G3 – низкая степень дифференцировки.
- G4 – недифференцированная карцинома.
Для некоторых опухолей слюнных желез, к которым не применима система определения степени злокачественности, используют самостоятельные системы.
Степень злокачественности (G) аденокистозного рака:
- G1 – опухоль преимущественно тубулярного строения, без солидного компонента;
- G2 – опухоль преимущественно криброзного строения, солидный компонент до 30 %;
- G3 – солидный компонент в опухоли более 30 %.
Степень злокачественности мукоэпидермоидного рака:
- Кистозный компонент менее 20 % = 2 балла
- Инвазия нервов = 2 балла
- Некроз = 3 балла
- Митозы 4 на 10 полей зрения при большом увеличении микроскопа = 3 балла
- Анаплазия = 4 балла
Низкая степень злокачественности = 0–4 балла
Промежуточная степень злокачественности = 5–6 баллов
Высокая степень злокачественности = 7–14 баллов.
При патоморфологическом исследовании необходимо отмечать:
- Наличие периневральной инвазии (независимо от размера нерва)
- Наличие экстранодального распространения метастазов опухоли (распространение за пределы капсулы узла).
Диагностика
Рак губы и слизистой оболочки ротовой полости (С00, С02-06)
3.2.3. Диагностические мероприятия:
-
орофарингоскопия и ларингоскопия;
-
бимануальная пальпация губы, языка, щек, тканей дна полости рта, пальцевое исследование миндалин;
-
пальпаторное обследование лимфатических узлов шеи с обеих сторон;
-
УЗИ шеи;
-
рентгенография органов грудной клетки;
-
ортопантомография нижней и верхней челюсти (при подозрении на вовлечение в опухоль костных структур);
-
КТ головы и шеи с контрастированием (Т2-4, N1-3)
-
КТА (выполняется при планировании хирургического вмешательства на шее у пациентов с подозрением на вовлечение в опухолевый процесс крупных магистральных сосудов);
-
морфологическая верификация опухоли с установлением гистологического типа и степени дифференцировки опухоли (инцизионная биопсия);
-
цитологическая верификация опухоли (не исключает гистологической верификации) и регионарных лимфогенных метастазов;
-
эзофагогастроскопия;
-
бронхоскопия (при наличии показаний);
-
ЭКГ;
3.2.4. Лабораторные исследования:
-
группа крови и резус-фактор;
-
анализ крови на сифилис (реакция микропреципитации);
-
общий анализ крови;
-
общий анализ мочи;
-
биохимическое исследование крови (общий белок, креатинин, мочевина, билирубин, щелочная фосфатаза, глюкоза, электролиты – Na, K, Ca, Cl);
-
клиренс креатинина (при планировании химиотерапии);
-
коагулограмма (АЧТВ, ПВ, ТВ, фибриноген) – на этапе предоперационной подготовки;
Рак дна полости рта
3.5.4. Наблюдение, сроки и объем исследования.
Диспансерное наблюдение за излеченными пациентами:
- в течение первых шести месяцев после завершения лечения – ежемесячно;
- в течение последующих шести месяцев (до года) – каждые 1,5–2 месяца;
- в течение второго года – один раз в 3–4 месяца;
- с третьего по пятый годы – один раз каждые 4–6 месяцев;
- после пяти лет – один раз каждые 6–12 месяцев.
Пациенты должны быть информированы о необходимости отказа от курения.
3.5.4.1. Методы обследования:
- локальный контроль (бимануальное пальпаторное обследование губы, языка, щек, тканей дна полости рта, орофарингоскопия) при каждом посещении;
- пальпация регионарных лимфатических узлов при каждом посещении;
- УЗИ шеи 1 раз в 3 мес.;
- рентгенография органов грудной клетки один раз в год;
- эзофагогастроскопия 1 раз в год;
- бронхоскопия, ларингоскопия (при наличии жалоб);
- контроль функции щитовидной железы через 1, 2 и 5 лет (после облучения шеи).
Злокачественные опухоли слюнных желез (С07-С08)
3.6.5. Диагностические мероприятия:
- орофарингоскопия;
- визуальная оценка функции мимической мускулатуры, конфигурации лица;
- пальпаторное обследование больших слюнных желез;
- пальпаторное обследование лимфатических узлов шеи с обеих сторон;
- УЗИ слюнных желез и лимфоузлов шеи;
- цитологическая верификация опухоли (тонкоигольная аспирационная биопсия) или трепан-биопсия опухоли (под УЗ-контролем при кистозных формах опухолей);
- срочное интраоперационное гистологическое исследование;
- ортопантомография нижней челюсти (при подозрении на вовлечение в опухоль костных структур);
- КТ и/или МРТ лицевого черепа и шеи с контрастированием;
- рентгенография органов грудной клетки (при цилиндроме малых или больших слюнных желез показано КТ грудной клетки;
- ЭКГ;
- Эхо-КГ (при планировании химиотерапии).
3.6.5.1. Лабораторные исследования:
- группа крови и резус-фактор;
- анализ крови на сифилис (реакция микропреципитации);
- общий анализ крови;
- общий анализ мочи;
- биохимическое исследование крови (общий белок, креатинин, мочевина, билирубин, щелочная фосфатаза, глюкоза, электролиты – Na, K, Ca, Cl);
- клиренс креатинина (при планировании химиотерапии);
- коагулограмма (АЧТВ, ПВ, ТВ, фибриноген) – на этапе предоперационной подготовки.
3.6.7. Наблюдение, сроки и объем обследования
Диспансерное наблюдение за излеченными пациентами:
- в течение первых шести месяцев после завершения лечения – ежемесячно;
- в течение последующих шести месяцев (до года) – каждые 1,5–2 месяца;
- в течение второго года – один раз в 3–4 месяца;
- с третьего по пятый годы – один раз каждые 4–6 месяцев;
- после пяти лет – один раз каждые 6–12 месяцев.
3.6.7.1. Методы обследования:
- локальный контроль (пальпаторное обследование губы, языка, щек, тканей дна полости рта, орофарингоскопия) при каждом посещении;
- пальпация регионарных лимфатических узлов при каждом посещении;
- УЗИ шеи, околоушной и подчелюстных областей 1 раз в три месяца;
- МРТ лицевого черепа и шеи каждые 4–6 месяцев в течение двух лет рентгенография органов грудной клетки (при цилиндроме малых или больших слюнных желез рекомендуется КТ грудной клетки) один раз в год;
- контроль функции щитовидной железы через 1,2 и 5 лет (после облучения шеи).
Лечение
3.1. Общие принципы лечения
Лечение зависит от факторов, связанных с характеристикой опухоли и общего состояния пациента. Основными целями терапии являются излечение от опухоли, сохранение или восстановление функций органов полости рта, уменьшение осложнений лечения. Для успешного исхода лечения требуется, как правило, мультидисциплинарный подход. Химиотерапевтическое и лучевое лечение должны быть хорошо организованными и контролироваться химиотерапевтами и радиологами, имеющими знания об особенностях лечения и осложнений у данного контингента пациентов.
Способность пациента перенести оптимальную программу лечения является важным фактором принятия решения об ее проведении.
Выбор стратегии лечения в основном осуществляется между хирургическим лечением, лучевой терапией и комбинированными методами.
Хирургический метод допустим лишь при лечении опухолей I стадии, которые можно радикально удалить с хорошим функциональным исходом. В остальных случаях рак I–II стадии лечится лучевым методом и комбинированно. Пациенты с распространенным раком всегда требуют комбинированного лечения. Неотъемлемой частью лечения этих пациентов являются расширенные резекции с выполнением реконструктивно-восстановительных операций. Применение неоадъювантной химиотерапии при ряде локализаций или одновременной химиотерапии и лучевого лечения позволяет увеличить число органосохраняющих вмешательств и перевести часть первично нерезектабельных опухолей в резектабельное состояние.
3.1.1. Принципы лучевого лечения
Требования к исходной информации о пациенте перед началом лечения:
-
четкое клиническое описание опухоли и регионарных лимфатических узлов
-
(локализация, размеры опухоли и каждого клинически пораженного узла, число
-
лимфатических узлов);
-
морфологическая верификация опухолевого процесса;
-
объективное подтверждение клинической информации с помощью УЗИ, КТ, МРТ
-
(при необходимости), ПЭТ (при необходимости).
3.1.1.1. Положение пациента во время облучения
На спине, голова наклоняется (вперед или назад) до той степени, которая обеспечивает максимальное исключение спинного мозга из зоны планируемого объема облучения. Рекомендуется использовать иммобилизирующие системы (маски, вакуумные мешки, фиксаторы головы и др.).
3.1.1.2. Общая предлучевая подготовка
У всех пациентов, подлежащих лучевой терапии, должна быть санирована полость рта. При необходимости удаления зубов в зоне объема облучения заживление раны должно произойти до начала облучения.
3.1.1.3. Определение объемов облучения
Определяемый объем опухоли (GTV) – весь определяемый любыми доступными методами диагностики объем опухолевого поражения, включающий как первичную опухоль, так и пораженные опухолью лимфоузлы и другие анатомические структуры.
Клинический объем облучения (CTV) – включающий GTV + дополнительный объем тканей (зоны высокого риска субклинического распространения опухоли) в 0,8–1 см во всех направлениях, а также уровни непораженных лимфатических узлов с риском субклинического распространения опухоли.
При наличии трахеостомы в объем облучения включается сама трахеостома – у пациентов с опухолями гортаноглотки, всех отделов гортани, при распространении опухоли гортани на подсвязочный отдел; у пациентов с опухолями ротоглотки, инфильтрирующими преднадгортанниковое пространство, а также у пациентов, получающих послеоперационное облучение по поводу наличия опухолевых клеток в краях отсечения ткани.
Планируемый объем облучения (PTV) включает CTV+3–5 мм во всех направлениях в зависимости от применяемых средств иммобилизации и методик лучевого лечения.
3.1.1.4. Тактика лучевого лечения
При лучевом лечении опухолей головы и шеи используют как традиционный режим (РОД 2 Гр, СОД 66–70 Гр), так и нетрадиционные режимы фракционирования дозы излучения: гиперфракционирование (РОД 1.2 Гр/2 фракции в день, СОД 81,6 Гр) или варианты ускоренного режима фракционирования (РОД 1.2 Гр/2 фракции в день на первичную опухоль и зоны регионарного метастазирования (большое поле) до 36 Гр, затем на 4 и 5 неделе – первую фракцию РОД 1.8 Гр на эту же зону до 18 Гр и вторую фракцию в день локально на опухоль (буст) РОД 1.6 Гр до 16 Гр).
Применение расщепленного курса (7–14-дневный интервал) осуществляется после дозы 40 Гр у пожилых, ослабленных пациентов или при наличии некупируемых лучевых реакций 3–4-й степени.
Послеоперационная лучевая терапия проводится при высоком риске развития рецидива заболеваний (наличие двух или более регионарных метастазов, нарушение целостности капсулы лимфоузла, наличие опухолевых клеток в краях отсечения тканей, периневральная и лимфососудистая инвазия).
Применение брахитерапии рекомендуется при опухолях губы и полости рта в изолированном виде или в сочетании с дистанционным облучением зон регионарного метастазирования.
3.1.1.5. Особенности подведения дозы
После подведения к запланированному объему дозы облучения 40–50 Гр лучевая терапия продолжается в дополнительной дозе 30–20 Гр соответственно с уменьшенных полей (буст) с помощью дистанционного облучения или внутритканевой брахитерапии. В начале лечения, а также при уменьшении полей (буст) рекомендуется выполнение контроля позиционирования пациента на лечебном столе линейного ускорителя (киловольтные или мегавольтные изображения).
Общая доза и общее время лечения должны строго соблюдаться. Между завершением дистанционного облучения и проведением контактной лучевой терапии интервал составляет 7–10 дней (если этот интервал является более продолжительным, контактная лучевая терапия не проводится).
Доза облучения спинного мозга не должна превышать 45 Гр за 4,5 недели у пациентов, получающих только лучевую терапию, и 35 Гр за 4,5 недели у пациентов, получающих химиолучевое лечение.
3.1.2. Операции на регионарном лимфаденаппарате
Шейная лимфодиссекция выполняется при наличии метастатического поражения лимфатических узлов, неполной регрессии метастазов после облучения или с профилактической целью (селективная лимфодиссекция).
Если лечение начинается с хирургического вмешательства, шейная лимфодиссекция выполняется одновременно с удалением первичной опухоли. При двустороннем метастатическом поражении лимфатических узлов шейная лимфодиссекция выполняется с обеих сторон поочередно с интервалом 2–3 недели.
Схематически лимфатический дренаж головы и шеи представлен на рисунке 3.1.
К первому уровню относятся лимфатические узлы подбородочного и подчелюстного треугольников.
Ко второму уровню относится верхняя яремная группа лимфатических узлов, лежащих вдоль внутренней яремной вены от нижней челюсти вниз до бифуркации сонных артерий и до задней границы грудино-ключично-сосцевидной мышцы, делится на два подуровня, границей между которыми является добавочный нерв.
К третьему уровню относятся средние яремные лимфатические узлы от каротидного сосудистого пучка до лопаточно-подъязычной мышцы.
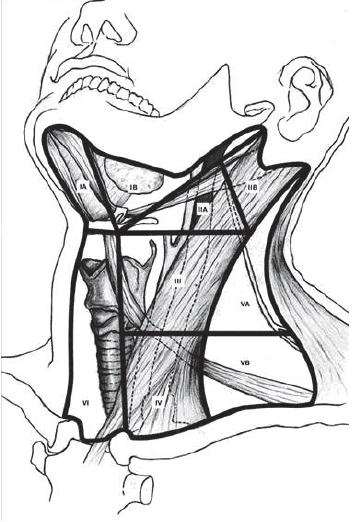
Рисунок 3.1 – Схема лимфатического дренажа головы и шеи
К четвертому уровню относятся нижние яремные лимфатические узлы от лопаточно-подъязычной мышцы вниз до ключицы, включая вирховский лимфатический узел.
К пятому уровню относятся лимфатические узлы бокового треугольника шеи, ограниченного спереди задним краем грудино-ключично-сосцевидной мышцы, сзади – передним краем трапециевидной мышцы и снизу – ключицей. Делится на 2 подуровня, границей между которыми служит условная горизонтальная линия, проведенная на уровне нижней границы переднего выступа перстневидного хряща.
К шестому уровню относятся передние шейные лимфатические узлы, включая пре- и паратрахеальные, предгортанные и околощитовидные узлы, а также лимфоузлы вдоль возвратных нервов.
В зависимости от локализации первичной опухоли лимфооток и метастазирование осуществляется в лимфоузлы соответствующего уровня (таблица 3.1).
Таблица 3.1. Лимфатический дренаж в зависимости от локализации первичной опухоли
|
Уровень лимфооттока
|
Локализация первичной опухоли
|
|
Уровень I
IA
Подподбородочный
IB
Подчелюстной |
Нижняя губа, щека, передние отделы полости рта (включая переднюю треть языка и дно полости рта)
Верхняя и нижняя губа, тело языка, дно рта, кожа лица |
|
Уровень II
II A Группа лимфоузлов, лежащих перед добавочным нервом
II B
Группа лимфоузлов, лежащих перед добавочным нервом |
Полость рта и гортань
Ротоглотка (включая мягкое небо, корень языка и грушевидный синус) |
|
Уровень III
|
Гортань, гортаноглотка, щитовидная железа
|
|
Уровень IV
|
Гортань, гортаноглотка, щитовидная железа, трахея, шейный отдел пищевода
|
|
Уровень V
VA Группа лимфоузлов по ходу нижней половины добавочного нерва и выше уровня нижнего края перстневидного хряща
VB
Поперечные шейные и надключичные лимфоузлы |
Носоглотка, щитовидная железа, околоносовые пазухи, задние отделы кожи волосистой части головы
Верхние отделы дыхательных путей, ЖКТ, молочные железы, отдаленные метастазы опухолей мочеполовой системы и женской половой сферы |
Тип лимфодиссекции в области шеи (радикальная, модифицированная или селективная) определяется в соответствии с дооперационным клиническим стадированием (таблица 3.2).
Таблица 3.2. Типы шейных лимфодиссекций и объем удаляемых тканей
Таблица 3.2. Типы шейных лимфодиссекций и объем удаляемых тканей
|
Тип лимфодиссекции
|
Объем удаляемых тканей
|
|
Полная (тотальная) шейная диссекция
Классическая радикальная шейная диссекция
Модифицированная радикальная шейная диссекция
Тип 1 Тип 2 Тип3 |
Все группы лимфоузлов (1–5 уровни), добавочный нерв, кивательная мышца, внутренняя яремная вена (далее – ВЯВ)
Все группы лимфоузлов (1–6 уровни) с сохранением одной
или более вышеперечисленных структур:
добавочный нерв
добавочный нерв и ВЯВ добавочный нерв, ВЯВ, кивательная мышца |
|
Селективная шейная диссекция
Боковая Заднебоковая Надлопаточно-подъязычная |
Удаление всех групп лимфоузлов:
на уровнях 2–4 на уровнях 2–5 на уровнях 1–3 |
Радикальная шейная лимфодиссекция выполняется при множественных смещаемых метастазах, или одиночных, но ограниченно смещаемых, спаянных с внутренней яремной веной и грудино-ключично-сосцевидной мышцей.
Модифицированные радикальные шейные лимфодиссекции производятся при одиночных, смещаемых, не спаянных с соседними анатомическими структурами шеи метастазами в шейных лимфатических узлах.
Селективные лимфодиссекции могут выполняться у пациентов с клинически не определяемыми шейными метастазами (N0).
N0 – селективная лимфодиссекция шеи в зависимости от локализации первичной опухоли:
- полость рта, по крайней мере, I–III уровни;
- ротоглотка, по крайней мере, I–IV уровни;
- гортань, по крайней мере, II–IV уровни, при необходимости VI уровень;
- гортаноглотка, по крайней мере, II–IV уровни, при необходимости VI уровень.
N1 – селективная шейная диссекция или модифицированная радикальная шейная диссекция.
N2a-b – селективная или модифицированная радикальная шейная диссекция.
N2c – билатеральная модифицированная радикальная (или селективная) шейная диссекция или комбинированная с односторонней селективной шейной диссекцией.
N3а – модифицированная (фасциально-футлярное иссечение) или радикальная шейная диссекция (операция Крайла).
N3b – радикальная шейная диссекция (операция Крайла).
Рак губы и слизистой оболочки ротовой полости (С00, С02-06)
3.2.5. Общие принципы лечения
3.2.5.1. Хирургический метод
Применяются внутриротовые, трансцервикальные и комбинированные хирургические вмешательства. Небольшие опухоли удаляются через рот. При удалении распространенных опухолей выполняют моноблочные комбинированные резекции с интраоперационным контролем радикальности выполненного хирургического вмешательства. При локализации опухоли в задних отделах полости рта возможно удаление опухоли после рассечения нижней челюсти. При этом отдается предпочтение медиальной мандибулотомии.
Хирургическая тактика при вторичном поражении нижней челюсти
Краевая резекция показана в следующих ситуациях:
- достижимо хорошее отделение опухоли от челюсти с трех сторон;
- первичная опухоль близко прилегает к челюсти;
- имеется минимальная эрозия кортикального слоя или альвеолярного отростка.
- имеется минимальная эрозия кортикального слоя или альвеолярного отростка.
Краевая резекция не показана при массивном поражении мягких тканей или инвазии в губчатую часть кости, а также у пациентов, которым ранее проводилась лучевая терапия или атрофичной истонченной челюстью, вследствие резорбции альвеолярного отростка.
Сегментарная резекция выполняется при значительной инвазии опухоли в губчатую часть или инвазии в альвеолы зубов с периневральным распространением. Реконструкция нижней челюсти должна планироваться у всех пациентов, которым выполняется сегментарная резекция, ведущая к выраженным эстетическим и функциональным нарушениям (при общем удовлетворительном состоянии).
3.2.5.2. Лучевое лечение
Результаты лучевого лечения пациентов с опухолями губы и слизистой оболочки полости рта I–II стадии в целом сопоставимы с хирургическим методом. Применяется короткофокусная рентгенотерапия и электронотерапия (только для рака губы), телегамматерапия и сочетанная лучевая терапия.
При проведении сочетанной лучевой терапии между завершением дистанционного облучения и проведением контактной лучевой терапии интервал составляет 7–10 дней. В случае четко отграниченных поверхностных опухолей Т1-Т2 без регионарных метастазов методом выбора является применение брахитерапии.
Распространенные опухоли (Т3-Т4) лечат с использованием лучевой терапии в виде пред-и/или послеоперационного воздействия с целью создания более благоприятных условий для радикального хирургического вмешательства и уменьшения числа рецидивов. В настоящее время наиболее обоснованным является послеоперационная лучевая терапия, позволяющая, не увеличивая числа послеоперационных осложнений, существенно снизить частоту развития местных рецидивов. Тем не менее проведение предоперационной лучевой терапии может быть обосновано при местно-распространенных опухолях на грани резектабельности или несмещаемых метастазах в лимфатических узлах (СОД 46–50 Гр, РОД 2 Гр). Кроме того, предоперационную лучевую терапию можно проводить у соматически ослабленных пациентов с резектабельными опухолями, используя этот период для общеукрепляющего лечения и подготовки к операции.
При облучении регионарного лимфатического коллектора в планируемый объем облучения включаются лимфатические узлы шеи со стороны поражения, а при центральной локализации опухоли – лимфатические узлы шеи с обеих сторон. Облучение регионарных лимфатических узлов проводится параллельно с лучевой терапией первичной опухоли или в рамках послеоперационной лучевой терапии.
Показаниями к проведению послеоперационной лучевой терапии являются:
- опухоли Т3-Т4;
- наличие резидуальной опухоли;
- периневральная/лимфатическая /сосудистая инвазия;
- шейная лимфодиссекция по поводу множественных (более 2-х метастазов и/или их экстракапсулярном распространении).
В качестве основного метода лечения лучевая терапия также применяется при нерезектабельных опухолях или высоком риске хирургического вмешательства.
3.2.5.3. Химиолучевое лечение
Химиолучевое лечение у пациентов с резектабельными опухолями губы и слизистой оболочки полости рта в стандартных ситуациях используется в послеоперационном периоде при морфологическом подтверждении наличия опухоли в крае отсечения (если невозможна реоперация), а также наличии периневральной/лимфатической/сосудистой инвазии, после лимфодиссекции по поводу множественных регионарных метастазов (N2, N3).
Показанием к его применению в предоперационном периоде у пациентов с резектабельными опухолями являются местно-распространенные опухоли или несмещаемые метастазы, возможность радикального удаления которых вызывает сомнение.
При проведении химиолучевого лечения введение цисплатина в 1-й день осуществляется перед проведением сеанса облучения из расчета 100 мг/м2, внутривенная инфузия со скоростью не более 1 мг/мин с пред- и постгидратацией, затем – в 22-й и 43-й дни на фоне проведения лучевой терапии.
3.2.6. Схемы химиотерапии
3.2.6.1. цисплатин 75 мг/м2 внутривенная инфузия со скоростью не более 1 мг/мин с пред- и постгидратацией в 1-й день,
флюороурацил 750–1000 мг/м2 /сут внутривенная 24-часовая инфузия 1–5 дни,
паклитаксел 135 мг/ м2 /сут в 1-й день
интервалы между курсами 3–4 недели.
3.2.6.2. Паклитаксел 175 мг/м2 внутривенно 3-х часовая инфузия в 1-й день с премедикацией, затем карбоплатин (расчет дозы на AUC 6) внутривенно в течение 15–30 мин в 1-й день,
интервалы между курсами 4 недели.
3.2.6.3. Метотрексат 30–40 мг внутрь 1 раз в неделю.
3.2.6.4. При резидуальных опухолях (R2) и местно распространенных рецидивах возможно применение интраоперационно лекарственного средства для локальной химиотерапии на основе цисплатина, мобилизованного на целлюлозном носителе.
3.2.6.5. Возможно использование цетуксимаба при лучевой терапии при наличии противопоказаний к введению платины и в виде моно- или в сочетании с полихимиотерапией в случаях, когда хирургический и лучевой методы лечения не показаны. Назначение цетуксимаба осуществляется мультидисциплинарным консилиумом специалистов онкологического учреждения.
3.3. Рак губы
Лечение проводится с учетом местного распространения опухоли и стадии процесса, функционального и эстетического результата. Используются лучевой, хирургический и комбинированный методы лечения. При этом предпочтительным методом лечения рака губы I–II стадии является лучевой. При распространенных резектабельных опухолях стандартное лечение включает хирургическое удаление опухоли и послеоперационную лучевую терапию. При N0 (по клиническим данным) проводится облучение первого лимфатического барьера, за исключением пациентов с поверхностными и экзофитными формами рака Т1.
3.3.1. Лучевое лечение
До начала проведения лучевой терапия у пациента должна быть санирована полость рта. При раке губы Т1-Т2 без клинически определяемых метастазов используется короткофокусная рентгенотерапия, электронотерапия или брахитерапия (при поверхностных опухолях). При лучевой терапии по радикальной программе к первичному опухолевому очагу подводится СОД 66–70 Гр (РОД 2 Гр). В объем облучаемых тканей включается первичный опухолевый очаг и 1,5-2 см тканей, окружающих опухоль. Клинически не измененные шейные лимфатические узлы I–III уровня облучаются в СОД 50–60 Гр (РОД 2 Гр); при их метастатическом поражении – в СОД 66–70 Гр (РОД 2 Гр).
При раке губы Т3-Т4 может использоваться дистанционная лучевая терапия в СОД 66–70 Гр (РОД 2 Гр) или сочетанная лучевая терапия.
На первом этапе проводится телегамматерапия или электронотерапия в СОД 40–50 Гр (РОД 2 Гр). Облучению подвергаются первичный опухолевый очаг и регионарные лимфатические узлы (I–III уровень). При наличии метастазов облучаются все лимфатические узлы шеи пораженного коллектора и I–III уровень контрлатерального интактного коллектора. Вторым этапом проводится дистанционная или внутритканевая лучевая терапия до СОД экв. 70 Гр на зону первичного очага и пораженных лимфоузлов.
При проведении послеоперационной лучевой терапии на ложе удаленной опухоли подводится СОД 60 (R0) или СОД 66–70 Гр (R1-2), на регионарные лимфатические узлы – СОД 50–60 Гр. Показаниями к проведению послеоперационной лучевой терапии являются опухоли Т3-Т4, наличие неудалимой резидуальной опухоли, периневральная/лимфатическая/сосудистая инвазия, шейная лимфодиссекция по поводу множественных метастазов или их экстракапсулярном распространении.
3.3.2. Хирургический метод
При хирургическом удалении опухоли Т1-2 производится блоковая резекция губы с отступом от клинически определяемых краев новообразования на 1,5–2 см. При возможности интраоперационного гистологического контроля радикальности хирургического вмешательства отступ от краев опухоли может быть уменьшен (в удаляемый блок наряду с опухолью должно быть включено не менее 0,5 см неизмененных тканей, окружающих опухоль). Образовавшийся дефект устраняется непосредственно после удаления опухоли с применением различных вариантов пластического замещения местными тканями. При опухолях Т3–4 используются комбинированные операции с устранением послеоперационного дефекта лоскутами с осевым типом кровообращения.
3.3.3. Лечение по стадиям
3.3.3.1. I–II стадии (Т1-2 N0 M0).
3.3.3.1.1. Дистанционная лучевая терапия в СОД 66-70Гр (РОД 2 Гр) + облучение лимфатических узлов шеи в СОД 50 Гр (РОД 2 Гр).
3.3.3.1.2. Дистанционная лучевая терапия в СОД 40-50Гр (РОД 2 Гр) + брахитерапия до СОД экв. 70 Гр + облучение лимфатических узлов шеи в СОД 50 Гр (РОД 2 Гр)
3.3.3.1.3. Хирургическое удаление опухоли + селективная лимфодиссекция (I–III уровень):
- при наличии опухоли в крае отсечения выполняется повторное хирургическое вмешательство или проводится послеоперационная лучевая терапия в СОД 66–70 Гр (РОД 2 Гр),
- при наличии периневральной/сосудистой/лимфатической инвазии проводится послеоперационная лучевая терапия на ложе удаленной опухоли в СОД 60–66 Гр (РОД 2 Гр).
3.3.3.1.4. Брахитерапия (СОД 66–70 Гр) + облучение лимфатических узлов шеи (СОД 50 Гр).
(При наличии остаточной опухоли после завершения радикального курса лучевой терапии по поводу рака губы оперативное выполняется вмешательство в сроки 3-6 недель после окончания облучения).
3.3.3.2. III–IVA, B стадии (Т3-4N0M0, любая TN1-3M0) резектабельные.
3.3.3.2.1. Хирургическое удаление опухоли + шейная лимфодиссекция без/с послеоперационной лучевой терапии в СОД 60–70Гр (РОД 2 Гр):
- при N0 – одно- или двусторонняя селективная лимфодиссекции;
- при N1, N2a-b, N3 – радикальная шейная лимфодиссекция + контрлатеральная селективная лимфодиссекция;
- при N2c – двусторонняя радикальная шейная лимфодиссекция;
- при Т3-Т4 pN0 – послеоперационная лучевая проводится только на ложе удаленной опухоли;
Послеоперационное химиолучевое лечение может быть проведено при наличии опухоли в крае отсечения, периневральной/сосудистой/лимфатической инвазии, экстранодальном распространении метастазов или множественных метастазах без экстранодального распространения:
- цисплатин 100 мг/м2 внутривенная инфузия в 1-й, 22-й и 43-й дни на фоне проведения лучевой терапии на ложе удаленной опухоли в СОД 70 Гр (РОД 2 Гр) и область регионарных лимфатических узлов в СОД 50–60 Гр.
3.3.3.2.2. Лучевая терапия по радикальной программе (дистанционная лучевая терапия + брахитерапия до СОД экв. 70 Гр или дистанционная лучевая терапия до СОД 70 Гр) или одновременное химиолучевое лечение (пациенты с высоким хирургическим риском):
- при полной регрессии первичной опухоли и неполной регрессии метастазов выполняется радикальная шейная лимфодиссекция + контрлатеральная лимфодиссекция;
- при полной регрессии метастазов (N2, N3) проводится динамическое наблюдение или может быть выполнена радикальная шейная лимфодиссекция;
- при неполной регрессии первичного опухолевого очага выполняется радикальное хирургическое вмешательство через 3-4 недели после окончания облучения ± радикальная шейная лимфодиссекция.
3.3.3.2.3. IV стадия (нерезектабельные).
Проводится лучевое или химиолучевое лечение.
При всех стадиях в рамках радикального лечения проводится облучение лимфатических узлов шеи (IB-IV уровень и VA уровень на стороне поражения лимфоузлов) и/или выполняется шейная лимфодиссекция.
3.4.1. Лучевое лечение
3.4.2. Хирургический метод
3.5.1. Хирургический метод
3.5.2. Лучевое лечение
3.5.3. Лечение рака языка и дна полости рта по стадиям.
3.5.3.1. I–II стадии (Т1-2 N0 M0).
3.5.3.1.2. Хирургическое удаление опухоли + односторонняя или двусторонняя селективная шейная лимфодиссекция (уровень I, II, III и верхняя часть V) или облучение регионарных лимфатических узлов в СОД 50–60 Гр (РОД 2 Гр).
При Т1 и Т2 с наличием периневральной/лимфатической/сосудистой инвазии проводится послеоперационная лучевая терапия на ложе удаленной опухоли в СОД 60–70 Гр (РОД 2 Гр).
3.5.3.2. III стадия (Т3N0M0) резектабельная.
При наличии опухоли в крае отсечения проводится послеоперационная одновременная химиотерапия с цисплатином и лучевая терапия на ложе удаленной опухоли в СОД 70 Гр (РОД 2 Гр) и область регионарных лимфатических узлов в СОД 50– 60 Гр (РОД 2 Гр).
3.5.3.3. III-IVA,B стадии (Т1-3 N1-3 M0) резектабельные.
При наличии опухоли в крае отсечения, периневральной/сосудистой/лимфатической инвазии, экстракапсулярном распространении метастазов или множественных метастазах без экстракапсулярного распространения целесообразна послеоперационная одновременная химиотерапия и лучевая терапия на ложе удаленной опухоли в СОД 70 Гр (РОД 2 Гр) и область регионарных лимфатических узлов в СОД 50–60 Гр.
3.5.3.4. IV стадия (Т4 любая N любая M0) резектабельная.
3.5.3.4.1. Хирургическое удаление опухоли + двусторонняя или односторонняя шейная лимфодиссекция + химиолучевая терапия с цисплатином на ложе удаленной опухоли РОД 2 Гр и область регионарных лимфатических узлов в СОД 50–60 Гр.
3.5.3.4.2. Химиолучевое лечение + хирургическое удаление первичного опухолевого очага + шейная лимфодиссекция:
Одновременное химиолучевое лечение может проводится по схемам:
3.4. Рак языка
При лечении рака языка необходимо принимать во внимание агрессивность опухолей данной локализации и высокой вероятности скрытого лимфогенного, в том числе билатерального метастазирования. Хирургический метод лечения применим лишь для I стадии рака подвижной части языка. Лучевая терапия в качестве единственного метода лечения может использоваться при опухолях Т1-Т2 с минимальной инфильтрацией подлежащих тканей и без распространения на альвеолярный отросток челюсти. Основным методом лечения рака языка является комбинированный. В стандартных ситуациях хирургическое вмешательство выполняется на первом этапе. Послеоперационное облучение начинают сразу после заживления раны.
Проведение предоперационной лучевой терапии (СОД 46–50 Гр, РОД 2 Гр) при резектабельных опухолях не является оптимальной тактикой, но может быть использовано в ряде случаев у пациентов с местно-распространенными опухолями на грани резектабельности или несмещаемыми метастазами в лимфатических узлах, а также у соматически ослабленных пациентов (с одновременным проведением общеукрепляющего лечения и подготовки к операции). В этом случае операция выполняется через 2-3 недели после завершения лучевой терапии.
При всех стадиях в рамках радикального лечения проводится облучение лимфатических узлов шеи (IB-IV уровень и VA уровень на стороне поражения лимфоузлов) и/или выполняется шейная лимфодиссекция.
3.4.1. Лучевое лечение
При лечении рака языка может использоваться дистанционная и сочетанная лучевая терапия. Первичный опухолевый очаг и множественные или большие регионарные метастазы облучаются в СОД 70 Гр (РОД 2 Гр). При проведении послеоперационной лучевой терапии ложе удаленной опухоли облучается в СОД 60–70 Гр (РОД 2 Гр), облучение лимфатических узлов проводится на обеих сторонах шеи в СОД 50–60 Гр (РОД 2 Гр). После удаления регионарных лимфатических узлов с экстракапсулярным распространением метастаза(ов) облучение проводится в СОД 60–70 Гр (РОД 2 Гр).
3.4.2. Хирургический метод
Небольшие опухоли подвижной части языка могут быть удалены внутриротовым доступом. При этом задняя граница резекции должна отстоять от макроскопически определяемой границы опухоли не менее чем на 2 см. Типовой операцией на языке является гемиглоссэктомия. Гемиглоссэктомию выполняют при диаметре опухоли не более 4 см электрохирургическим методом. Местно-распространенные опухоли языка служат показанием к комбинированным или расширенным операциям. Для выполнения комбинированных операций применяются трансоральные доступы с дополнительным рассечением тканей щеки или нижней губы по средней линии и различными видами остеотомий. При распространенном раке языка объем резекции увеличивают за счет частичного удаления корня и противоположной части языка, тканей дна полости рта, сегмента нижней челюсти. Для замещения послеоперационных дефектов выполняются реконструктивно-восстановительные операции с применением перемещенных лоскутов с осевым кровоснабжением или аутотрансплантатов с наложением микрохирургических анатсамозов. Если проводилась предоперационная лучевая терапия, хирургический этап выполняется через 2–3 недели после ее завершения. Тотальная глоссэктомия или пересечение обоих подъязычных нервов требует наложения гастростомы или зондового питания пациента.
При неполной регрессии регионарных метастазов после лучевой терапии необходима радикальная шейная лимфодиссекция.
3.5. Рак дна полости рта
Небольшие опухоли (Т1 и Т2) могут быть излечены путем широкого хирургического иссечения или при помощи лучевой терапии. Хирургический метод может использоваться при ограниченных поверхностных опухолях передних отделов полости рта или при вторичном поражении кости небольшой по размерам опухолью слизистой оболочки. При распространенном опухолевом процессе (Т3-Т4) проводится комбинированное лечение (операция + лучевая терапия). Показания к предоперационной лучевой терапии ограничены (см. рак языка).
Во всех случаях выполняется регионарная лимфодиссекция и/или облучение лимфатических узлов шеи.
3.5.1. Хирургический метод
При иссечении рака дна полости рта Т1 и Т2 необходимо отступить от опухоли не менее 2 см. Местно-распространенные опухоли слизистой оболочки дна полости рта служат показанием к выполнению комбинированных и расширенных операций, включающих широкое иссечение подлежащих мышечных, фасциальных и сосудистых структур, вдоль которых возможен рост опухоли, резекцию нижней челюсти. Радикальность хирургического вмешательства в этих случаях устанавливают путем интраоперационного гистологического исследования. Опухоли слизистой оболочки дна полости рта удаляют в едином блоке с содержимым поднижнечелюстного и подбородочного треугольников.
Наиболее типичными операциями являются резекция тканей дна полости рта с резекцией в едином блоке трети или половины языка; резекция тканей дна полости рта с одномоментной краевой резекцией альвеолярного края нижней челюсти или резекцией внутренней части нижней челюсти, к которой примыкает опухоль; резекция тканей дна полости рта с резекцией сегмента или половины нижней челюсти; аналогичные операции с одномоментным иссечением в едином блоке шейной клетчатки. Замещение послеоперационных дефектов осуществляется с применением перемещенных лоскутов с осевым кровоснабжением (кожно-мышечный или мышечно-фасциальный пекторальный лоскут, в том числе включая фрагмент ребра для восстановления нижней челюсти; торакодорсальный, в состав которого можно включить лопаточную ость) или путем аутотрансплантации сложных тканевых комплексов (кожно-мышечные, мышечно-костные и др.) с использованием микрохирургической техники. Для микрохирургической реконструкции дна полости рта, включая дефекты языка, могут использоваться различные аутотранспланты: свободный радиальный лоскут предплечья, васкулярированный малоберцовый аутотрансплантат.
3.5.2. Лучевое лечение
Общие принципы и дозы лучевой терапии в целом соответствуют аналогичным при лечения рака языка. Двустороннее облучение регионарных лимфатических узлов шеи проводят при центральной локализации опухоли. При наличии метастазов в лимфоузлах шеи на стороне локализации первичной опухоли дополнительно облучаются контрлатеральные лимфатические узлы.
Внутритканевая лучевая терапия в качестве самостоятельного метода может быть применена при лечении небольших хорошо отграниченных опухолей T1, T2 с глубиной инфильтрации до 2,5–3 см (СОД экв. 60–70 Гр). При распространении опухоли на челюсть брахитерапия не является оптимальным методом лечения вследствие высокого риска развития остеорадионекроза. В целом при лучевом лечении рака I–II стадии предпочтение отдается дистанционной и сочетанной лучевой терапии.
3.5.3. Лечение рака языка и дна полости рта по стадиям.
3.5.3.1. I–II стадии (Т1-2 N0 M0).
3.5.3.1.1. Дистанционная (сочетанная лучевая терапия) в СОД экв. 60–70 Гр + облучение регионарных лимфатических узлов в СОД 50-60 Гр (РОД 2 Гр). При наличии резидуальной опухоли выполняется радикальное хирургическое вмешательство.
3.5.3.1.2. Хирургическое удаление опухоли + односторонняя или двусторонняя селективная шейная лимфодиссекция (уровень I, II, III и верхняя часть V) или облучение регионарных лимфатических узлов в СОД 50–60 Гр (РОД 2 Гр).
При Т1 и Т2 с наличием периневральной/лимфатической/сосудистой инвазии проводится послеоперационная лучевая терапия на ложе удаленной опухоли в СОД 60–70 Гр (РОД 2 Гр).
3.5.3.2. III стадия (Т3N0M0) резектабельная.
Хирургическое удаление опухоли + односторонняя или двусторонняя селективная шейная лимфодиссекция (уровень I, II, III и VA) + послеоперационная лучевая терапия на ложе удаленной опухоли в СОД 60–70 Гр (РОД 2 Гр).
При наличии опухоли в крае отсечения проводится послеоперационная одновременная химиотерапия с цисплатином и лучевая терапия на ложе удаленной опухоли в СОД 70 Гр (РОД 2 Гр) и область регионарных лимфатических узлов в СОД 50– 60 Гр (РОД 2 Гр).
3.5.3.3. III-IVA,B стадии (Т1-3 N1-3 M0) резектабельные.
Хирургическое удаление опухоли + двусторонняя или односторонняя шейная лимфодиссекция + послеоперационная лучевая терапия на ложе удаленной опухоли в СОД 60–70 Гр (РОД 2 Гр):
- при N1, N2a-b, N3a-b – радикальная шейная лимфодиссекция + контрлатеральная селективная лимфодиссекция;
- при N2c – двусторонняя радикальная шейная лимфодиссекция.
При наличии опухоли в крае отсечения, периневральной/сосудистой/лимфатической инвазии, экстракапсулярном распространении метастазов или множественных метастазах без экстракапсулярного распространения целесообразна послеоперационная одновременная химиотерапия и лучевая терапия на ложе удаленной опухоли в СОД 70 Гр (РОД 2 Гр) и область регионарных лимфатических узлов в СОД 50–60 Гр.
3.5.3.4. IV стадия (Т4 любая N любая M0) резектабельная.
3.5.3.4.1. Хирургическое удаление опухоли + двусторонняя или односторонняя шейная лимфодиссекция + химиолучевая терапия с цисплатином на ложе удаленной опухоли РОД 2 Гр и область регионарных лимфатических узлов в СОД 50–60 Гр.
Данный вариант предпочтителен при небольших по размеру опухолях Т4, распространяющихся на кость.
3.5.3.4.2. Химиолучевое лечение + хирургическое удаление первичного опухолевого очага + шейная лимфодиссекция:
- шейная лимфодиссекция выполняется при наличии клинически определяемых метастазов в лимфоузлах после завершения химиолучевого лечения;
- при полной регрессии метастазов (N1) осуществляется динамическое наблюдение;
- при полной регрессии метастазов (N2-3) осуществляется динамическое наблюдение или возможно выполнение селективной/радикальной шейной лимфодиссекции.
Одновременное химиолучевое лечение может проводится по схемам:
1 схема: цисплатин 100 мг/м2 внутривенная инфузия со скоростью не более 1 мг/мин
с пред- и постгидратацией в 1-й, 22-й и 43-й дни на фоне проведения лучевой терапии на
первичную опухоль и область регионарных лимфатических узлов в СОД 60–70 Гр
(РОД 2 Гр).
2 схема: цисплатин 100 мг/м2 внутривенная инфузия со скоростью не более 1 мг/мин с пред- и постгидратацией в 1-й и 22-й дни на фоне проведения лучевой терапии в режиме динамического ускоренного гиперфракционирования дозы с сопутствующим бустом (РОД 1.2 Гр/2 фракции в день на первичную опухоль и зоны регионарного метастазирования (большое поле) до 36 Гр, затем на 4 и 5 неделе – первую фракцию РОД 1.8 Гр на эту же зону до 18 Гр (СОД 54 Гр) и вторую фракцию в день локально на опухоль (буст) РОД 1.6 Гр до 16 Гр (СОД 70 Гр)).
3.5.3.5. IV стадия (нерезектабельные).
Лечатся в соответствии с принципами лечения всех нерезектабельных опухолей головы и шеи (лучевая терапия, одновременная лучевая и химиотерапия, химиотерапия).
Злокачественные опухоли слюнных желез (С07-С08)
3.6.6. Общие принципы лечения
Хирургическое удаление опухоли является ведущим компонентом радикального лечения злокачественных новообразований слюнных желез. При I–II стадии низкозлокачественных опухолей (низкозлокачественная мукоэпидермоидная карцинома, ацинозноклеточная карцинома) радикальное хирургическое вмешательство является самостоятельным методом лечения. При опухолях промежуточной и высокой злокачественности (мукоэпидермоидная карцинома, аденокарцинома, аденокистозная карцинома, злокачественная смешанная опухоль, недифференцированная карцинома и плоскоклеточная карцинома) лечение комбинированное. Шейная лимфодиссекция показана лишь при наличии метастазов в лимфатических узлах.
Лучевая терапия применяется в самостоятельном виде исключительно при лечении нерезектабельных опухолей или в случае отказа пациента от операции.
Химиотерапия и химиолучевое лечение могут быть использованы в отдельных группах пациентов с первично нерезектабельными опухолями, локо-регионарными рецидивами, отдаленными метастазами, а также при наличии резидуальной опухоли или прогностически неблагоприятных факторов (промежуточная и низкая степень дифференцировки, метастазы в лимфатических узлах, инвазия в лицевой нерв, периневральная/лимфатическая/сосудистая инвазия).
Неходжскинские лимфомы слюнных желез лечатся в соответствии с разработанными для них стандартами.
3.6.6.1. Хирургическое лечение
Все хирургические вмешательства по поводу злокачественных опухолей слюнных желез выполняются под общей анестезией.
Радикальным хирургическим вмешательством при злокачественных опухолях околоушных слюнных желез является паротидэктомия с/или без сохранения лицевого нерва. Субтотальная резекция околоушной слюнной железы выполняется при клинически доброкачественном течении и отсутствии убедительных данных за злокачественный характер при дооперационной морфологической верификации: опухоль поверхностной доли небольших размеров (T1-Т2), неспаянная с подлежащими тканями, медленно растущая, без вовлечения лицевого нерва и метастазов в лимфоузлах; при низкозлокачественных опухолях околоушной слюнной железы (низкозлокачественная мукоэпидермоидная карцинома, ацинозноклеточная карцинома).В этом случае необходим интраоперационный контроль радикальности хирургического вмешательства. При наличии прогностически неблагоприятных факторов (промежуточная и низкая степень дифференцировки, метастазы в лимфатических узлах, инвазия в лицевой нерв, периневральная/лимфатическая/сосудистая инвазия) показана послеоперационная лучевая терапия.
Опухоли поднижнечелюстной и подъязычной слюнных желез удаляются единым блоком с содержимым поднижнечелюстного треугольника. Местно-распространенные опухоли требуют резекции всех вовлеченных структур (кожа, мышцы, нервы, нижнечелюстная и височная кость).
При клинически негативных лимфатических узлах в ходе выполнения паротидэктомии или удаления поднижнечелюстной слюнной железы обследуется первый лимфатический уровень Увеличенные или подозрительные лимфатические узлы направляются на срочное гистологическое исследование с целью определения необходимости и типа лимфодиссекции. При одиночных метастазах и отсутствии экстранодального распространения предпочтение отдается модифицированным шейным лимфодиссекциям.
Сохранение лицевого нерва.
До операции должно быть четко выяснено функциональное состояние нерва, поскольку частичный или полный паралич может быть обусловлен инвазией опухоли. При нервсохраняющей операции (паротидэктомии или микрохирургической субтотальной резекции околоушной слюнной железы) должно быть выполнено срочное гистологическое исследование краев отсечения опухоли от нерва или собственно пересеченной ветви нерва. Поэтому окончательное решение о сохранении лицевого нерва или его ветвей принимается во время операции. Если опухоль не окружает нерв циркулярно и отсутствует периневральная инвазия, возможно проведение нервсохраняющих операций с последующим курсом лучевой терапии.
3.6.6.2. Лучевая терапия
При первично резектабельных опухолях преимущество имеет послеоперационная лучевая терапия в дозе 60–70 Гр, которая всегда проводится при высокозлокачественных опухолях. Кроме того, показанием к ее проведению является наличие резидуальной опухоли, периневральная или перилимфатическая инвазия, экстракапсулярное распространение опухоли, удаление опухолей глубокой доли околоушной слюнной железы, распространяющихся на парафарингеальное пространство, метастазы в железе или регионарных лимфатических узлах, рецидив опухоли.
После удаления аденокистозной карциномы объем облучения должен включать зоны локализации соседних черепно-мозговых нервов из-за возможного периневрального распространения опухоли.
Превентивное облучение лимфатических узлов шеи на стороне пораженной слюнной железы обязательно при высокозлокачественных опухолях.
При проведении послеоперационной лучевой терапии на ложе удаленной опухоли подводится СОД 60–70 Гр, на регионарные лимфатические узлы СОД 50 Гр.
При лучевом лечении по радикальной программе на первичный опухолевый очаг и метастазы в шейных лимфатических узлах подводится СОД 70 Гр, на неизмененные регионарные лимфатические узлы при высокозлокачественных опухолях СОД 50 Гр.
3.6.6.3. Лечение в зависимости от стадии.
3.6.6.3.1. I–II стадия (низкозлокачественные опухоли).
Хирургическое лечение: паротидэктомия или субтотальная резекция околоушной слюнной железы (по показаниям).
3.6.6.3.2. I–II стадия (средне/высокозлокачественные опухоли):
радикальное хирургическое вмешательство на первичном очаге + послеоперационная дистанционная лучевая терапия на ложе удаленной опухоли в СОД 60–70 Гр (РОД 2 Гр) + облучение регионарных лимфатических узлов на стороне пораженной железы в СОД 50 Гр (РОД 2 Гр);
при аденокистозной карциономе в зону облучения включают ложе удаленной опухоли и ближайшие черепно-мозговые нервы (регионарные интактные лимфатические узлы не облучаются).
3.6.6.3.3. III–IV стадии (резектабельные).
3.6.6.3.3.1. Удаление опухоли (согласно пункту 33.1.) + радикальная шейная лимфодиссекция на стороне опухоли (при N+) + послеоперационная лучевая терапия на ложе удаленной опухоли в СОД 60–70 Гр и область регионарных лимфатических узлов на стороне поражения в СОД 50–60 Гр.
3.6.6.3.3.2. При наличии опухоли в крае отсечения, умеренной и низкой степени дифференцировки, невральной/периневральной инвазии, метастазах с экстракапсулярным распространением, лимфатической/сосудистой инвазии может проводиться одновременная химиотерапия с цисплатином и лучевая терапия на ложе удаленной опухоли в СОД 60–70 Гр (РОД 2 Гр) и область регионарных лимфатических узлов на стороне поражения в СОД 50–60 Гр.
3.6.6.4. Лечение нерезектабельных опухолей:
3.6.6.4.1. Одновременная химиотерапия с цисплатиноми лучевая терапия на ложе удаленной опухоли в СОД 70 Гр (РОД 2 Гр) и область регионарных лимфатических узлов на стороне поражения в СОД 50–60 Гр (при больших метастазах до 70 Гр).
3.6.6.4.2. Дистанционная лучевая терапия на первичный опухолевый очаг в СОД 70 Гр и регионарные лимфатические узлы в СОД 50–60 Гр (при больших метастазах до 70 Гр). При низкозлокачественных опухолях (N0) регионарные лимфатические узлы не облучают.
3.6.6.4.3. Если после завершения лечения опухоль стала резектабельной, возможно выполнение радикального хирургического вмешательства.
3.6.6.5. Схемы химиотерапии:
3.6.6.5.1. Цисплатин 75–100 мг/м2 внутривенная инфузия со скоростью не более 1 мг/мин с пред- и постгидратацией в 1-й день,
флюороурацил 750–1000 мг/м2 /сут внутривенная 24-часовая инфузия 1–4 дни,
интервалы между курсами 3–4 недели.
3.6.6.5.2. Доксорубицин 60 мг/м2 внутривенно в течение 20–30 мин 1-й день,
цисплатин 40 мг/м2 внутривенная инфузия со скоростью не более 1 мг/мин с пред- и постгидратацией в 1-й день,
интервалы между курсами 3–4 недели;
3.6.6.5.3. Паклитаксел 175 мг/м2 внутривенно 3-х часовая инфузия в 1-й день с премедикацией, затем
карбоплатин (расчет дозы на AUC 6) внутривенно в течение 15–30 мин в 1-й день,
интервалы между курсами 3–4 недели.
3.6.6.6. Лечение опухолей после ранее выполненного неполного удаления (диагноз злокачественной опухоли установлен по данным послеоперационного гистологического исследования).
Лечение начинают после пересмотра микропрепаратов, физикального обследования оставшейся части железы, КТ или МРТ и рентгенологического обследования органов грудной полости.
При отсутствии данных о наличии резидуальной опухоли при сроках наблюдения не более 6 недель после хирургического лечения проводится послеоперационная лучевая терапия. При наличии резидуальной опухоли предпочтительно выполнение радикального хирургического вмешательства с последующим проведением послеоперационной лучевой терапии. В случае невозможности выполнения хирургического вмешательства или отказапациента проводится лучевая терапия по радикальной программе или одновременная химиолучевая терапия с цисплатином на ложе удаленной опухоли в СОД 70 Гр (РОД 2 Гр) и область регионарных лимфатических узлов на стороне поражения в СОД 50–60 Гр (при больших метастазах до 70 Гр).
При низкозлокачественных опухолях (N0) регионарные лимфатические узлы не облучают.
3.6.6.7. Лечение рецидивов
При резектабельных местно-регионарных рецидивах проводится комбинированное лечение. У отдельных пациентов может рассматриваться вопрос о хирургическом удалении отдаленных метастазов. При нерезектабельных процессах проводится лучевое, химиолучевое лечение или химиотерапия.
3.6.7. Наблюдение, сроки и объем обследования
Диспансерное наблюдение за излеченными пациентами:
- в течение первых шести месяцев после завершения лечения – ежемесячно;
- в течение последующих шести месяцев (до года) – каждые 1,5–2 месяца;
- в течение второго года – один раз в 3–4 месяца;
- с третьего по пятый годы – один раз каждые 4–6 месяцев;
- после пяти лет – один раз каждые 6–12 месяцев.
3.6.7.1. Методы обследования:
- локальный контроль (пальпаторное обследование губы, языка, щек, тканей дна полости рта, орофарингоскопия) при каждом посещении;
- пальпация регионарных лимфатических узлов при каждом посещении;
- УЗИ шеи, околоушной и подчелюстных областей 1 раз в три месяца;
- МРТ лицевого черепа и шеи каждые 4–6 месяцев в течение двух лет
- рентгенография органов грудной клетки (при цилиндроме малых или больших слюнных желез рекомендуется КТ грудной клетки) один раз в год;
- рентгенография органов грудной клетки (при цилиндроме малых или больших слюнных желез рекомендуется КТ грудной клетки) один раз в год;
- контроль функции щитовидной железы через 1,2 и 5 лет (после облучения шеи).
Информация
Источники и литература
-
Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2006-2019
- Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2006-2019 -
-
www.minzdrav.gov.by
- www.minzdrav.gov.by -
Информация
ГЛАВА 2
ОЦЕНКА ОБЩЕГО СОСТОЯНИЯ ОНКОЛОГИЧЕСКОГО ПАЦИЕНТА
Общее состояние онкологического пациента (Performance status) рекомендовано оценивать по индексу Карновского (0–100 баллов) или шкале ECOG (0–4 балла) (таблицы 2.1, 2.2).
Таблица 2.1. Индекс Карновского
Таблица 2.1. Индекс Карновского
|
Нормальная физическая активность, пациент не нуждается в специальном уходе
|
100 баллов
|
Состояние нормальное, нет жалоб и симптомов заболевания
|
|
90 баллов
|
Нормальная активность сохранена, но имеются незначительные симптомы заболевания
|
|
|
80 баллов
|
Нормальная активность возможна при дополнительных усилиях, при умеренно выраженных симптомах заболевания
|
|
|
Ограничение нормальной активности при сохранении полной независимости пациента
|
70 баллов
|
Пациент обслуживает себя самостоятельно, но не способен к нормальной деятельности или работе
|
|
60 баллов
|
Пациент иногда нуждается в помощи, но в основном обслуживает себя сам
|
|
|
50 баллов
|
Пациенту часто требуется помощь и медицинское обслуживание
|
|
|
Пациент не может обслуживать себя самостоятельно, необходим уход или госпитализация
|
40 баллов
|
Большую часть времени пациент проводит в постели, необходим специальный уход и посторонняя помощь
|
|
30 баллов
|
Пациент прикован к постели, показана госпитализация, хотя терминальное состояние не обязательно
|
|
|
20 баллов
|
Сильные проявления болезни, необходима госпитализация и поддерживающая терапия
|
|
|
10 баллов
|
Умирающий пациент, быстрое прогрессирование заболевания
|
|
|
0 баллов
|
Смерть
|
Таблица 2.2. Оценка статуса пациента по шкале ECOG
|
Оценка
|
|
|
0
|
Пациент полностью активен, способен выполнять все, как и до заболевания (90–100 баллов по шкале Карновского)
|
|
1
|
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70–80 баллов по шкале Карновского)
|
|
2
|
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно – в вертикальном положении (50–60 баллов по шкале Карновского)
|
|
3
|
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования (30–40 баллов по шкале Карновского)
|
|
4
|
Пациент, совершенно не способен к самообслуживанию, прикован к креслу или постели (10–20 баллов по шкале Карновского)
|
Приложение
ТАБЛИЦЫ СООТВЕТСТВИЯ «СТАДИЯ-TNM» ДЛЯ РЯДА ЛОКАЛИЗАЦИЙ: ТОНКИЙ КИШЕЧНИК, АМПУЛА ФАТЕРОВА СОСКА, ТИМОМА, МЕЗОТЕЛИОМА ПЛЕВРЫ, КАРЦИНОМА МЕРКЕЛЯ КОЖИ, КОРА НАДПОЧЕЧНИКА
ТОНКИЙ КИШЕЧНИК C17
Таблица 1. Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1, Т2 | N0 | M0 |
| Стадия IIА | Т3 | N0 | M0 |
| Стадия IIB | T4 | N0 | M0 |
| Стадия IIIA | Любая Т | N1 | M0 |
| Стадия IIIB | Любая Т | N2 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
АМПУЛА ФАТЕРОВА СОСКА C24.1
Таблица 2. Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия IA | Т1a | N0 | M0 |
| Стадия IB | Т1b, Т2 | N0 | M0 |
| Стадия IIА | Т3a | N0 | M0 |
| Стадия IIB | Т3b | N0 | M0 |
| Стадия IIIA | Т1a, Т1b, Т2, T3 | N1 | M0 |
| Стадия IIIB | Т4 | Любая N | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
ТИМОМА C37, C38.1-3
Таблица 3. Группировка по стадиям
| Стадия I | T1 | N0 | M0 |
| Стадия II | T2 | N0 | M0 |
| Стадия IIIА | T3 | N0 | M0 |
| Стадия IIIB | T4 | N0 | M0 |
| Стадия IVA | Любая Т |
N1
N0, N1
|
M0
M1A
|
| Стадия IVB | Любая Т | Любая N | M1B |
МЕЗОТЕЛИОМА ПЛЕВРЫ C45.0
Таблица 4. Группировка по стадиям
| Стадия IA | T1 | N0 | M0 |
| Стадия IB | T2, T3 | N0 | M0 |
| Стадия II | T1, T2 | N1 | M0 |
| Стадия IIIА | T3 | N1 | M0 |
| Стадия IIIB | T1, T2, T3, T4 |
N1 Любая N |
M0 |
| Стадия IV | Любая Т | Любая N | M1 |
КАРЦИНОМА МЕРКЕЛЯ C44, C63.2
Таблица 5а. Группировка по стадиям клиническая
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1 | N0 | M0 |
| Стадия IIА | T2, Т3 | N0 | M0 |
| Стадия IIB | Т4 | N0 | M0 |
| Стадия III | Любая Т | N1, N2, N3 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
Таблица 5б. Группировка по стадиям патоморфологическая
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1 | N0 | M0 |
| Стадия IIА | Т2, T3 | N0 | M0 |
| Стадия IIB | Т4 | N0 | M0 |
| Стадия IIIA |
Т0
Т1, Т2, T3, Т4
|
N1b
N1a
|
M0 |
| Стадия IIIB | Любая Т | N1, N2, N3 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
КОРА НАДПОЧЕЧНИКА C74.0
Таблица 6. Группировка по стадиям
| Стадия I | Т1 | N0 | M0 |
| Стадия II | Т2 | N0 | M0 |
| Стадия III |
Т1, T2
Т3, T4
|
N1
N0, N1
|
M0 |
| Стадия IV | Любая Т | Любая N | M1 |
Под редакцией
д-р мед. наук, проф. О.Г.Суконко,
д-р мед. наук, проф., член-корр. НАН Беларуси С.А.Красный
Авторский коллектив:
Антоненкова Нина Н., д.м.н., доц.;
Ануфреенок И.В., к.м.н.;
Артемова Н.А., д.м.н., доц.;
Баранов А.Ю., к.м.н.;
Баранов Е.В., к.м.н.;
Бармотько М.А.;
Грачев Ю.Н., к.м.н.;
Демешко П.Д., д.м.н.;
Демидчик Ю.Е., д.м.н., проф.;
Дзюбан В.П.;
Доломанова Е.В.;
Дубровский А.Ч., к.м.н.;
Евмененко А.А.;
Ермаков Н.Б., к.м.н.;
Жаврид Э.А., д.м.н., проф.;
Жарков В.В, д.м.н., проф.;
Жиляева Е.П.;
Жуковец А.Г., к.м.н.;
Зеленкевич И.А., к.м.н.;
Ильин И.А., к.м.н.;
Караник В.С., к.м.н.;
Карман А.В., к.м.н., доц.;
Киселев П.Г., к.м.н.;
Клименко Д.П.;
Колядич Г.И., к.м.н.;
Кондратович В.А.;
Котов А.А., к.м.н.;
Кохнюк В.Т., д.м.н., проф.;
Красный С.А., д.м.н., проф.;
Крутилина Н.И., д.м.н., проф.;
Курченков А.Н., к.м.н.;
Курчин В.П., д.м.н.;
Левин Л.Ф.;
Леонова Т.А.;
Мавричев А.С., д.м.н., проф.;
Мавричев С.А., к.м.н.;
Малькевич В.Т., д.м.н., доц.;
Маньковская С.В.;
Матылевич О.П., к.м.н.;
Минайло И.И., к.м.н.;
Минич А.А., к.м.н.;
Моисеев П.И., к.м.н.;
Набебина Т.И., к.м.н.;
Науменко Л.В., к.м.н.;
Океанов А.Е., д.м.н., проф.;
Пархоменко Л.Б., к.м.н., доц.;
Петрушенко Ю.И.;
Писаренко А.М.;
Поляков С.Л., к.м.н.;
Портянко А.С., д.м.н., доц.;
Прохорова В.И., д.м.н., проф.;
Ребеко И.В., к.м.н.;
Ревтович М.Ю., к.м.н.;
Ролевич А.И., д.м.н.;
Рындин А.А.;
Рябчевский А.Н.;
Синайко В.В., к.м.н.;
Субоч Е.И., к.м.н.;
Суколинская Е.В., к.м.н.;
Суконко О.Г., д.м.н., проф.;
Суслова В.А., к.м.н.;
Тризна Н.М., к.м.н.;
Фридман М.В., д.м.н.;
Шаповал Е.В., д.м.н.;
Шмак А.И., д.м.н.
Список сокращений:
CTV – клинический объем облучения
GTV – определяемый объем опухоли
ICD – Международная классификация болезней
ITC – отдельные опухолевые клетки
PTV – планируемый объем облучения
UICC – Международный противораковый союз
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
АЧТВ – активированное частичное тромбопластиновое время
ВАТС – видео-ассистированной тораскопии
ВОЗ – Всемирная организация здравоохранения
ВПЧ – вирус папилломы человека
ВЯВ – внутренняя яремная вена;
ГИСО – гастроинтенстинальные стромальные опухоли
ГПДР – гастропанкреатодуоденальная резекция
ГЦР – гепатоцеллюлярный рак
ЖКТ – желудочно-кишечный тракт
ИГХ – иммуногистохимическое исследование
ИОУЗИ – интраоперационное УЗИ
КТ – компьютерная томография
ЛДГ – лактатдегидрогеназа
МНО – международное нормализованное отношение
МРТ – магнитно-резонансная томография
МСКТ – многослойная компьютерная томография
ОГК – органы Грудной клетки
ПВ – протромбиновое время
ПЖ – поджелудочная железа
ПЭТ – позитронно-эмиссионная томография
РЖП – рак желчного пузыря
РОД – разовая облучающая доза
РПК – рак прямой кишки
РПХГ – ретроградная панкреатохолангиография
СОД – суммарная облучающая доза
ТВ – тромбиновое время
ТДПЭ – тотальная дуоденопанкреатэктомия
УЗИ – ультразвуковое исследование
ФВД – функция внешнего дыхания
ФДГ – фтордезоксиглюкоза
ФЭГДС – фиброгастродуоденоскопия
ХЦР – холангиоцеллюлярного рака
ЦНС – центральная нервная система
ЧЧХГ – чрескожная чреспеченочная холангиография
ЧЭИ – чрескожная этаноловая инъекция
ЩФ – щелочная фосфатаза
ЭВВ – эмболизация воротной вены
ЭКГ – электрокардиограмма
ЭУЗИ – эндоскопическое ультразвуковое исследование
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.