Диагностика и лечение злокачественных новообразований: Новообразования центральной нервной системы
опухоли ЦНС
 Версия: Клинические протоколы 2006-2019 (Беларусь)
Версия: Клинические протоколы 2006-2019 (Беларусь)
Вторичное злокачественное новообразование других локализаций (C79), Доброкачественное новообразование головного мозга и других отделов центральной нервной системы (D33), Доброкачественное новообразование других и неуточненных эндокринных желез (D35), Доброкачественное новообразование мозговых оболочек (D32), Злокачественное новообразование головного мозга (C71), Злокачественное новообразование других эндокринных желез и родственных структур (C75), Злокачественное новообразование мозговых оболочек (C70), Злокачественное новообразование спинного мозга, черепных нервов и других отделов центральной нервной системы (C72), Новообразование неопределенного или неизвестного характера головного мозга и центральной нервной системы (D43), Новообразование неопределенного или неизвестного характера мозговых оболочек (D42), Новообразование неопределенного или неизвестного характера эндокринных желез (D44)
Онкология
Общая информация
Краткое описание
ПОСТАНОВЛЕНИЕ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
6 июля 2018 г. № 60
Об утверждении клинического протокола «Алгоритмы диагностики и лечения злокачественных новообразований»
На основании подпункта 8.3 пункта 8 Положения о Министерстве здравоохранения Республики Беларусь, утвержденного постановлением Совета Министров Республики Беларусь от 28 октября 2011 г. № 1446 «О некоторых вопросах Министерства здравоохранения и мерах по реализации Указа Президента Республики Беларусь от 11 августа 2011 г. № 360», Министерство здравоохранения Республики Беларусь
ПОСТАНОВЛЯЕТ:
1. Утвердить прилагаемый клинический протокол «Алгоритмы диагностики и лечения злокачественных новообразований».
2. Начальникам главных управлений по здравоохранению областных исполнительных комитетов, председателю комитета по здравоохранению Минского городского исполнительного комитета, руководителям государственных организаций, подчиненных Министерству здравоохранения Республики Беларусь, обеспечить проведение диагностики, лечение и профилактику заболеваний в соответствии с клиническим протоколом.
3. Настоящее постановление вступает в силу после его официального опубликования.
Министр В.А.Малашко
УТВЕРЖДЕНО
Постановление
Министерства здравоохранения
Республики Беларусь
06.07.2018 № 60
КЛИНИЧЕСКИЙ ПРОТОКОЛ «Алгоритмы диагностики и лечения злокачественных новообразований»
ГЛАВА 35
НОВООБРАЗОВАНИЯ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ (C70-72, C75, C79, D32, D33, D35, D42-44)
Классификация
ГЛАВА 1
ОБЩИЕ СВЕДЕНИЯ О TNM КЛАССИФИКАЦИИ
Система TNM для классификации злокачественных опухолей была разработана французом Р. Denoix в 1943–1952 гг. В 1953 г. Комитет по номенклатуре опухолей и статистике, организованный UICC, и Международная комиссия по стадированию рака достигли соглашения по классификации анатомической распространенности опухолей на основе системы TNM. В 1954 г. Международный противораковый союз (UICC) создает Комитет по клинической классификации и прикладной статистике, который в 1958 г. публикует первые рекомендации по клинической классификации рака молочной железы и гортани.
В результате многолетней деятельности Комитета в 1968 г. издается первая редакция TNM классификация злокачественных опухолей. По мере разработки классификации для новых локализаций опухолей и уточнения более ранних рекомендаций в 1974, 1978, 1987, 1997, 2002 и 2009 гг. публикуются 2-я, 3-я, 4-я, 5-я, 6-я и 7-я редакции.
Настоящая (8-я) редакция правил классификации и стадирования полностью соответствуют 8-й редакции руководства по стадированию рака и одобрена всеми национальными TNM комитетами.
В данном руководстве используются морфологические формы злокачественных новообразований в соответствии с классификацией МКБ-О-3, адаптированной под МКБ-10 (проставление кодов врачом-патологом в морфологическом заключении обязательно).
UICC признает необходимость постоянства TNM классификации в течение определенного периода времени, необходимого для накопления данных. Поэтому классификация не должна изменяться до тех пор, пока не будут сделаны крупные достижения в диагностике и лечении злокачественных опухолей, требующие пересмотра настоящей классификации.
Общие правила системы TNM.
TNM система для описания анатомической распространенности болезни основывается на оценке 3 компонентов:
Т – распространение первичной опухоли;
N – отсутствие или наличие метастазов в регионарных лимфатических узлах и степень их поражения;
М – отсутствие или наличие отдаленных метастазов.
К этим трем компонентам добавляются цифры, указывающие на распространенность злокачественного процесса:
Т0, Т1, Т2, Т3, Т4; N0, N1, N2, N3; M0, M1.
В действительности система является «стенографическим» описанием распространенности злокачественной опухоли.
Общие правила классификации, применяемые для опухолей всех локализаций, следующие:
Для каждой локализации имеются две классификации:
Клиническая классификация, обозначаемая TNM (или cTNM). Она основывается на результатах обследования до лечения. Эти данные получают при врачебном осмотре, лучевой диагностике, эндоскопии, биопсии, хирургическом диагностическом вмешательстве и других методах обследования.
Патологическая классификация, обозначаемая pTNM. Она основана на данных обследования до лечения, дополненных или измененных в результате хирургического вмешательства и морфологического исследования. Гистологическая оценка первичной опухоли включает резецированную опухоль или биопсию, позволяющую оценить наивысшую Т категорию. Гистологическая оценка регионарных лимфатических узлов включает исследование удаленных узлов в количестве, адекватном для установления отсутствия метастазов в регионарных лимфатических узлах (pN0) и достаточном для оценки наиболее высокой pN категории. Отдаленные метастазы должны быть подтверждены при микроскопическом исследовании (рМ).
После обозначения Т, N, М и/или рТ, pN и рМ категорий они могут группироваться по стадиям. TNM классификация и стадии, установленные однажды, должны оставаться неизменными в медицинских документах. Клиническая стадия служит основой для выбора лечения, тогда как патологическая стадия обеспечивает наиболее точные данные для оценки прогноза и расчета конечных результатов.
При сомнении в правильности оценки Т, N или М категории должно быть выбрано меньшее значение категории, (т.е. меньшее распространение опухоли).
В случае множественных опухолевых очагов в органе должна классифицироваться опухоль с более высокой Т категорией, а в скобках указываться множественность (т) или количество опухолей, например: Т2(т) или Т1(5). При одновременном поражении парных органов каждая опухоль должна классифицироваться отдельно. При опухолях печени, яичников и фаллопиевой трубы множественные очаги поражения являются критерием Т классификации.
Выявление второй опухоли в одном органе в течение 2 месяцев с момента выявления первой нужно расценивать как синхронное поражение.
TNM категории и стадия могут подразделяться или объединяться для клинических и научных целей (например, любые Т, N или М могут быть разбиты на подгруппы). Однако рекомендованные основные обозначения не должны изменяться.
Анатомические области и локализации.
Локализации в этой классификации обозначаются кодовым номером Международной классификации онкологических болезней.
TNM/pTNM классификация.
Используются следующие общие определения:
Т/рТ – первичная опухоль:
TX/рTX – первичная опухоль не может быть оценена;
Т0/рТ0 – нет доказательств первичной опухоли;
Tis/pTis – рак «in situ»;
Т1/рТ1, Т2/рТ2, ТЗ/рТЗ, Т4/рТ4 – размер или местное распространение опухоли в порядке увеличения.
N/pN – регионарные лимфатические узлы:
Nx/pNx – регионарные лимфатические узлы не могут быть оценены;
N0/pN0 – отсутствуют метастазы в регионарных лимфоузлах;
Nl/pNl, N2/pN2, N3/pN3 – возрастающее поражение регионарных лимфатических узлов.
Непосредственное распространение первичной опухоли на лимфатические узлы классифицируется как метастазы в лимфатических узлах. Метастаз в любом лимфоузле, не относящемся к регионарному, расценивается как отдаленный метастаз.
Опухолевый узел в области регионарных лимфатических узлов, не имеющий гистологических признаков лимфоузла, классифицируется как метастаз в регионарном лимфатическом узле, если имеет форму и ровный контур лимфатического узла. Опухолевый узел с неровным контуром классифицируется в рТ категории.
Когда размер является критерием pN классификации, производится измерение метастатического очага, а не всего лимфатического узла.
Случаи с микрометастазами, когда размеры метастазов не превышают 0,2 см, могут обозначаться добавлением «(mi)», например: pNl(mi) или pN2(mi).
М/рМ – отдаленные метастазы:
МХ/рМХ – отдаленные метастазы не могут быть оценены;
М0/рМ0 – нет отдаленных метастазов;
М1/рМ1 – имеются отдаленные метастазы;
Категория М может быть в дальнейшем специфицирована в соответствии со следующими обозначениями (таблица 1.1):
Таблица 1.1
| Легкие | PUL | Костный мозг | MAR |
| Кости | OSS | Плевра | PLE |
| Печень | HEP | Брюшина | PER |
| Головной мозг | BRA | Надпочечники | ADR |
| Лимфоузлы | LYM | Кожа | SKI |
| Другие | ОТН |
Подразделения TNM
Главные категории в классификации могут иметь подразделения, придающие критерию большую специфичность (например; Tla, lb или N2a, 2b).
Сигнальный лимфоузел
Это первый лимфоузел, получающий лимфу из первичной опухоли. Если в нем имеется метастаз, то и другие лимфоузлы могут быть поражены. Если этот лимфоузел не поражен, то и наличие метастазов в других узлах маловероятно. Иногда встречаются более одного сигнальных лимфоузлов.
При оценке сигнального лимфоузла применяются следующие определения:
Главные категории в классификации могут иметь подразделения, придающие критерию большую специфичность (например; Tla, lb или N2a, 2b).
Сигнальный лимфоузел
Это первый лимфоузел, получающий лимфу из первичной опухоли. Если в нем имеется метастаз, то и другие лимфоузлы могут быть поражены. Если этот лимфоузел не поражен, то и наличие метастазов в других узлах маловероятно. Иногда встречаются более одного сигнальных лимфоузлов.
При оценке сигнального лимфоузла применяются следующие определения:
- pNX(sn) – сигнальный узел не может быть оценен; pN0(sn) – нет поражения сигнального узла;
- pN1(sn) – есть поражение сигнального узла.
Отдельные опухолевые клетки
Отдельные опухолевые клетки (ITC) представляют собой единичные опухолевые клетки или маленькие кластеры клеток не более 0,2 мм в наибольшем измерении. ITC обычно не демонстрируют метастатической активности (пролиферацию или реакцию стромы) или инвазии стенок сосудистого или лимфатического синуса. Случаи с ITC в лимфатических узлах или отдаленных органах и тканях должны классифицироваться как N0 или М0 соответственно.
Это же применимо и к случаям, когда наличие опухолевых клеток или их компонентов подтверждается неморфологическими исследованиями, такими как проточная морфометрия или анализ ДНК.
Случаи с ITC должны анализироваться отдельно.
Классификация ITC:
- pN0 – гистологически не выявляются метастазы в регионарных лимфатических узлах, не проводились исследования по выявлению ITC;
- pN0(i-) – гистологически нет метастазов в регионарных лимфатических узлах, негативные морфологические данные по выявлению ITC;
- pN0(i+) – гистологически нет метастазов в регионарных лимфатических узлах, позитивные морфологические данные по выявлению ITC;
- pN0(mol-) – гистологически нет метастазов в регионарных лимфатических узлах, негативные неморфологические данные по выявлению ITC;
- pN0 (mol+) – гистологически нет метастазов в регионарных лимфатических узлах, неморфологическими методами выявляются ITC.
При исследовании ITC в сигнальном лимфоузле к обозначениям выше приведенной классификации в скобках указывается «(sn)», например: pN0(i+) (sn).
Отдельные опухолевые клетки, выявленные в костном мозгу морфологическими методами, классифицируются аналогично схеме для N, например: pM0(i+), а неморфологическими – pM0(mol+).
Гистопатологическая дифференцировка.
Это стадирование позволяет оценить степень агрессивности опухолей некоторых гистологических типов и может влиять на прогноз и выбор лечения.
Для большинства локализаций выделяется 4 степени дифференцировки опухолей:
- G1 – хорошо дифференцированные;
- G2 – умеренно дифференцированные;
- G3 – низко дифференцированные;
- G4 – недифференцированные.
При наличии различных степеней дифференцировки в опухоли указывается наименее благоприятная степень.
Саркомы костей и мягких тканей классифицируется также с использованием градаций «высокая степень» и «низкая степень» дифференцировки.
Для некоторых форм рака (молочной железы, тела матки, печени) рекомендуются специальные системы стадирования по степеням.
Дополнительные дескрипторы.
Для идентификации особых случаев в TNM/pTNM используются символы m, у, r, а.
Хотя они не влияют на группировку по стадиям, но указывают опухоли, которые должны анализироваться отдельно:
- m – используется для обозначения множественных опухолей одной локализации;
- у – в тех случаях, когда классификация приводится в течение или после проведения комбинированного (многокомпонентного) лечения, cTNM или pTNM категория обозначается префиксом «у», например: ycTNM или ypTNM. При оценке распространения опухоли до начала комбинированного лечения символ «у» не исключается;
- r – рецидив опухоли после радикального лечения при классификации обозначается префиксом «r» (rcTNM или rpTNM);
- а – применяется для обозначения классификации опухолей, впервые выявленных при аутопсии.
Необязательные дескрипторы.
L – инвазия лимфатических сосудов
Классифицируется как LX, L0 и L1.
V – инвазия вен
Классифицируется как VX, VO, VI (микроскопическая инвазия) и V2 (макроскопическая инвазия). Макроскопическое вовлечение стенки вены при отсутствии опухоли в просвете сосуда классифицируется как V2.
С-фактор
С-фактор или «фактор надежности» отражает достоверность классификации с учетом использованных методов диагностики. Его использование не является обязательным.
Определения С-фактора:
- С1 – данные стандартных диагностических методов (осмотр, пальпация, рентгенологическое исследование, эндоскопическое исследование),
- С2 – данные, полученные при использовании специальных диагностических методов (рентгенологическое исследование в специальных проекциях, томография, компьютерная томография, ультразвуковое исследование, лимфография, ангиография, сцинтиграфия, магнитно-резонансная томография, ПЭТ/КТ, эндоскопия, биопсия, цитологическое исследование);
- С3 – данные хирургического диагностического вмешательства, включая биопсию и цитологическое исследование;
- С4 – данные, полученные после радикальной операции и гистологического исследования удаленного препарата;
- С5 – данные патологоанатомического вскрытия.
Степени С-фактора могут использоваться при описании категорий Т, N и М (например: Т3С2, N2C1, М0С2).
Клиническая классификация TNM соответствует CI, С2 и С3 степеням, тогда как pTNM эквивалентна С4.
Классификация остаточных опухолей (R)
TNM/pTNM классификация описывает анатомическую распространенность опухоли без рассмотрения вопросов лечения. R-классификация описывает статус опухоли после лечения. Она отражает эффект лечения и является прогностическим фактором. При R- классификации оценивается не только первичная опухоль, но и остающиеся отдаленные метастазы.
Эта классификация может применяться после хирургического лечения, лучевой или химиотерапии, а также после комбинированного лечения. После консервативного лечения остаточная опухоль оценивается клиническими методами. После хирургического лечения R-классификация требует тесного сотрудничества хирурга и морфолога.
Случаи с макроскопически определяемой остаточной опухолью (R2) могут подразделяться на R2a (без микроскопического подтверждения) и R2b (микроскопически подтвержденные).
R0 группа может включать пациентов как с М0, так и с Ml. В последнем случае отдаленные метастазы, как и первичная опухоль, должны быть полностью удалены. Трудности с R-классификацией могут возникнуть при удалении опухоли по частям, а не «en blok». В таких случаях уместна категория RX.
Наличие микроскопически определяемой инвазивной опухоли по линии резекции классифицируется как R1, а в случае неинвазивной карциномы – R1 (is).
Группировка по стадиям.
Комбинация всех значений дескрипторов TNM позволяет получить 24 категории TNM, описывающие распространенность опухоли. Для табличного представления данных и анализа эти категории объединяются в ограниченное количество групп – стадий. Каждая стадия более или менее однородна по прогнозу и критерию выживаемости относящихся к ней пациентов.
Карцинома «in situ» относится к стадии 0, а опухоли с отдаленными метастазами – к стадии IV (за исключением некоторых локализаций, например, папиллярного и фолликулярного рака щитовидной железы).
Для патологической стадии необходимо морфологическое исследование достаточного количества тканей, позволяющее оценить наибольшее значение Т и N. Если же имеется морфологическое подтверждение отдаленных метастазов, то и классификация (рМ1) и стадия являются патологическими.
Термин «стадия» употребляется только для комбинаций Т, N, М или рТ, pN или рМ категорий. Необходимо избегать выражений типа «Т стадия» или «N стадия»
НОВООБРАЗОВАНИЯ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ (C70-72, C75, C79, D32, D33, D35, D42-44)
35.2. Классификация
Ранее для первичных опухолей головного мозга TNM классификация не применялась. В TNM (8-я реакция) предложено два варианта классификации медуллобрастомы и эпиндимомы.
35.2.1. Вариант 1 (Tier 1)
Метастатическая стадия.
Распространение опухоли за пределы ее локализации (например, другие очаги в головном мозгу или позвоночнике, опухолевые клетки в церебро-спинальной жидкости или отдаленные метастазы)
Локализованная стадия.
Имеется локальное опухолевое поражение.
35.2.2. Вариант 2 (Tier 2) основан на распространенности опухоли и наличии метастатического поражения*.
______________________________
* Модифицированная классификация медуллобластом (по Chang)
35.2.2.1. Т – первичная опухоль.
Т1 – опухоль менее 3 см в диаметре и расположена в классической срединной позиции в черве, в крыше IV желудочка или в полушариях мозжечка.
Т2 – опухоль диаметром не менее 3 см, прорастает в одну из соседних структур или частично заполняет IV желудочек.
Т3а – опухоль прорастет в соседние структуры или полностью заполняет IV желудочек, распространяясь по сильвиеву водопроводу, отверстиям Magendie и Luschka с развитием окклюзионной гидроцефалии.
Т3b – опухоль заполняет IV желудочек и инфильтрирует ствол мозга и/или ножки IV желудочка.
Т4 – опухоль распространяется по сильвиеву водопроводу с вовлечением среднего мозга или III желудочка или распространение вплоть до верхних отделов спинного мозга.
35.2.2.2. М – отдаленные метастазы.
М0 – отдаленные метастазы не определяются.
М1 – микроскопические определяемые опухолевые клетки в ликворе.
М2 – большие узлы опухоли обнаруживаются в субарахноидальном пространстве мозжечка или мозга или в III или в боковых желудочках.
М3 – большие метастатические узлы в субарахноидальном пространстве спинного мозга.
М4 – экстраневральные метастазы.
35.3. Определение степени злокачественности (G) опухолей ЦНС основано на выявлении определенных гистологических признаков и ретроспективном анализе клинического течения конкретных гистологических форм новообразований. Каждой нозологической форме соответствует своя степень злокачественности.
К опухолям ЦНС GI относят новообразования с низким пролиферативным потенциалом и с минимальной ядерной атипией, которые могут быть излечены путем хирургического удаления.
Опухоли ЦНС GII характеризуются инфильтративным ростом и низким уровнем пролиферативной активности, однако склонны к рецидивированию. Также некоторые типы опухолей GII (диффузные астроцитомы, олигодендроглиомы и смешанные глиомы) обладают способностью к повышению степени злокачественности (например низко злокачественная диффузная астроцитома с течением времени может трансформироваться в анапластическую астроцитому и глиобластому).
К опухолям ЦНС GIII относятся новообразования с гистологическим признаками злокачественности, включая ядерную атипию и выраженную митотическую активность. В большинстве случаев, пациентам с опухолями GIII необходимо проведение адъювантной лучевой и/или химиотерапии.
К опухолям ЦНС GIV относят цитологически злокачественные новообразования с высоким уровнем митотической активности, очаговыми некрозами и сосудистой (эндотелиальной) пролиферацией. Опухоли ЦНС GIV часто проявляются быстрым прогрессированием заболевания и смертельным исходом. Примерами опухолей ЦНС GIV является глиобластома, большинство эмбриональных опухолей и многие саркомы. Хотя это и не неотъемлемые признаки, тем не менее, широкое распространении инфильтрации на окружающие ткани и склонность к краниоспинальному распространению также характерны для некоторых новообразований ЦНС GIV (медуллобластома).
К опухолям низкой степени злокачественности (Low grade) принадлежат опухоли GI-II, к высокой степени злокачественности (High grade) – GIII-IV.
35.4. Градация астроцитом
Для определения степени злокачественности диффузных астроцитом по ВОЗ рекомендуется трехстепенная система (модификация St. Anne-Mayo), основанная на оценке ряда гистологических критериев (таблица 35.2).
Таблица 35.2. Градация астроцитом
|
Степень злокачественности (G)
|
Определение опухоли | Гистологические критерии |
| II | Диффузная астороцитома | Ядерная атипия |
| III | Анапластическая астроцитома | Ядерная атипия и митозы |
| IV | Глиобластома |
Ядерная атипия и митозы, эндотелиальная пролиферация и/или некрозы
|
35.5. Гистологическая классификация опухолей нервной системы (таблица 35.3).
Таблица 35.3. Гистологическая классификация опухолей нервной системы
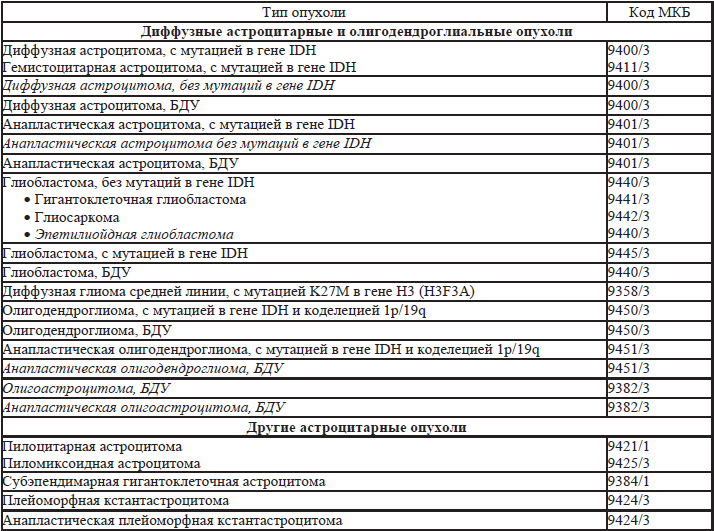
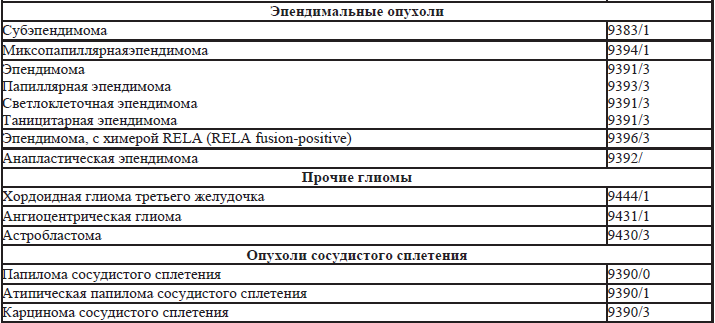
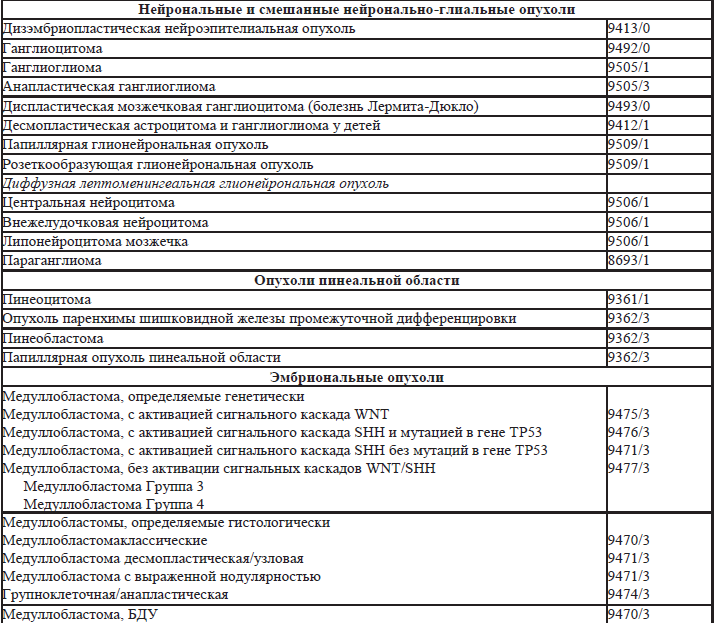
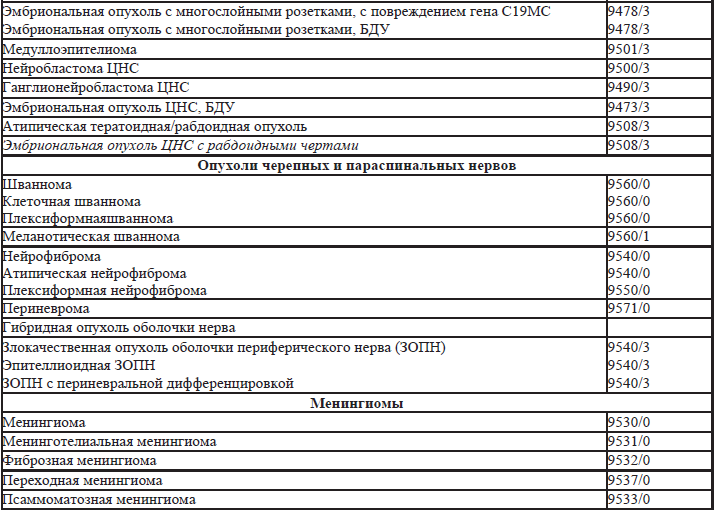



Примечания:
Морфологические коды взяты из международной классификации заболеваний для онкологии (International Classification of Diseases for Oncology) ICD-O. Код /0 применяется для обозначения биологического потенциала доброкачественных опухолей, /1 – для обозначения биологического потенциала опухолей с неопределенным или промежуточным злокачественным потенциалом, код /2 для обозначения карцином in-situ и интраэпителиальных новообразований Grade3, код /3 применяется для злокачественных опухолей.
Эпидемиология
35.1. Основные статистические показатели С70-С72 (таблица 35.1)
Таблица 35.1. Основные статистические показатели
| Показатель | Число | |
| 2011 | 2016 | |
| Число вновь выявленных случаев заболевания | 515 | 616 |
| Заболеваемость на 100 000 населения (грубый интенсивный показатель) | 5,4 | 6,5 |
|
Прожили менее года с момента установления диагноза из числа заболевших в предыдущем году (одногодичная летальность в %)
|
46,4 | 40,5 |
| Умерло от злокачественных новообразований | 340 | 390 |
| Смертность на 100 000 населения Грубый интенсивный показатель | 3,6 | 4,1 |
|
Отношение смертности к заболеваемости в % (интенсивные показатели)
|
66,7 | 63,1 |
| Число пациентов, состоящих на учете на конец года | 2814 | 3251 |
| Из них состоящих на учете 5 и более лет, % | 59 | 59,3 |
Факторы и группы риска
35.6. Прогностические факторы.
У пациентов с первичными опухолями головного мозга основным прогностическим критерием является гистологический диагноз в соответствии с классификацией опухолей. Крайне неблагоприятный прогноз при глиобластоме. Смешанная анапластическая олигоастроцитома и анапластическая астроцитома занимают промежуточное положение. Важными прогностическими критериями являются молекулярно-цитогенетические особенности опухоли. В ряде случаев прогноз заболевания зависит не от степени локачественности, а от локализации опухоли и возможности ее тотального удаления. Кроме того, прогноз заболевания находится в обратной зависимости от возраста пациента и в прямой зависимости от общего клинического состояния пациента (шкала Карновского).
Клиническая картина
Cимптомы, течение
Таблица 35.5. Критерии RANO для оценки эффективности лечения глиальных опухолей
|
Степень регрессии
|
Критерии
|
|
Полная
|
Должны быть соблюдены все условия: полное исчезновение всех накапливающих КВ опухолей, сохраняющееся не менее 4 недель; отсутствие новых поражений; стабильные или уменьшающиеся не накапливающие КВ поражения (на Т2-ВИ/FLAIR); пациент не принимает кортикостероиды (или принимает в физиологической заместительной дозе); клиническая симптоматика стабильна или с улучшением
|
|
Частичная
|
Должны быть соблюдены все условия: уменьшение суммы произведений двух максимальных взаимно перпендикулярных размеров всех измеримых накапливающих КВ опухолей ≥ 50 % по отношению к сканированию до лечения, сохраняющееся не менее 4 недель; нет прогрессирования неизмеримых поражений; отсутствие новых поражений; стабильные или уменьшающиеся не накапливающие КВ поражения (на Т2-ВИ/FLAIR) по отношению к сканированию до лечения на той же или меньшей дозе кортикостероидов; клиническая симптоматика стабильна или с улучшением
|
|
Стабилизация
|
Должны быть соблюдены все условия: не подходит под критерии полной, частичной регрессии или прогрессирования; стабильные или уменьшающиеся не накапливающие КВ поражения (на Т2-ВИ/FLAIR) по отношению к сканированию до лечения на той же или меньшей дозе кортикостероидов
|
|
Прогрессирование
|
Любое из следующих условий: увеличение суммы произведений двух максимальных взаимно перпендикулярных размеров накапливающих КВ опухолей ≥ 25 % по отношению к наименьшей сумме произведений, полученной до начала лечения (если опухоли не уменьшались) или при наилучшей регрессии, на стабильной или увеличивающейся дозе кортикостероидов; значительное увеличение не накапливающего КВ поражения на Т2-ВИ/FLAIR по отношению к сканированию до лечения или наилучшей регрессии, на стабильной или увеличивающейся дозе кортикостероидов, не вызванное сопутствующими заболеваниями и последствиями самого лечения (постоперационные, постлучевые изменения, ишемия, инфекция и др.); любые новые поражения; явное нарастание клинической симптоматики, не обусловленное другими причинами, кроме опухоли, или изменением дозы кортикостероидов; явное прогрессирование неизмеримых поражений
|
Примечание: при множественных накапливающих КВ опухолях рекомендуется включать в измерение от 2 до 5 опухолей наибольшего размера. К неизмеримым поражениям относят те, которые можно измерить лишь в одном направлении, образования с нечеткими Границами или максимальным размером менее 1 см.
35.4.7. При наличии противопоказаний для выполнения МРТ – выполняется КТ головного мозга с контрастным усилением. В этом случае оценку эффективности лечения осуществляют с использованием критериев D. Macdonald (таблица 35.6).
Таблица 35.6. Критерии D. Macdonald для оценки эфективности лечения
|
Степень регрессии
|
Критерии
|
|
Полная
|
Должны быть соблюдены все условия: полное исчезновение всех
накапливающих КВ опухолей, сохраняющееся не менее месяца; пациент не принимает кортикостероиды; неврологическая симптоматика стабильна или с улучшением
|
|
Частичная
|
Должны быть соблюдены все условия: уменьшение произведения двух максимальных взаимно перпендикулярных размеров накапливающей КВ опухоли ≥50 %, сохраняющееся не менее месяца; кортикостероиды в стабильной или снижающейся дозе; неврологическая симптоматика стабильна или с улучшением.
|
|
Стабилизация
|
Не подходит под критерии полной, частичной регрессии или прогрессирования и клинически стабильное состояние
|
|
Прогрессирование
|
Увеличение произведения двух максимальных взаимно перпендикулярных размеров накапливающей КВ опухоли ≥ 25 % или появление новых опухолей, или нарастание неврологических расстройств и кортикостероиды в стабильной или увеличивающейся дозе
|
35.4.8. При прогрессировании или выявлении рецидива опухоли решение о тактике лечения принимается консилиумом в составе врача-нейрохирурга, врача-радиационного онколога и врача-онколога.
Диагностика
35.7. Диагностические мероприятия
35.7.1. Основные методы обследования при наличии клинических признаков опухоли центральной нервной системы:
35.7.1. Основные методы обследования при наличии клинических признаков опухоли центральной нервной системы:
-
сбор анамнеза и общее физикальное обследование;
-
осмотр врача-невролога, врача-нейрохирурга, врача-офтальмолога;
-
оценка функционального статуса по шкале Карновского;
-
спондилография в 2-х проекциях, при необходимости в дополнительных укладках (при опухоли спинного мозга);
-
МРТ головного и спинного мозга;
-
КТ головного или спинного мозга с контрастным усилением (при наличии кардиостимуляторов, ферромагнитных имплантов или технической невозможности выполнения МРТ);
-
рентгенография органов Грудной клетки;
-
УЗИ вен нижних конечностей (по показаниям).
35.7.2. В случае затрудненного дифференциального диагноза (воспалительные и дегенеративные заболевания ЦНС, метастатическое поражение и др.), а также в случаях, когда хирургическое удаление опухоли нецелесообразно или невозможно – выполняется нейронавигационная или стереотаксическая биопсия.
35.7.3. Гистологический диагноз основывается на данных морфологического и иммуногистохимического исследований с установлением гистологического типа и степени злокачественности опухоли.
35.7.4. В связи с введением в классификацию генетически определяемых форм опухолей нервной системы для постановки диагноза и оценки прогноза заболевания необходимым является проведение молекулярного тестирования (схема):
-
мутации в гене IDH для диффузных астроцитарных и олигодендроглиальных опухолей (астроцитомы, олигодендроглиомы, глиобластомы);
-
ко-делеция 1p/19q для олигодендроглиом;
-
мутация K27M в гене H3.3 (H3F3A) для глиом стволовых отделов мозга;
-
повреждение гена C19MC для эмбриональных опухолей с многослойными розетками;
-
химерный ген RELA для эпиндимом;
-
нарушения сигнальных каскадов WNT(Wingless) (мутации в генах CTNNB1 (β-катенин), APC, AXIN1 и AXIN2) и SHH (SonicHedgehog) (мутации в гене PTCH), мутации в гене TP53, амплификация гена MYC, изохромосома17q;
-
метилирование промотора MGMT для определения чувствительности к терапии темозоломидом.
35.7.5. Лабораторные исследования:
-
определение Группы крови, резус-фактора, анализ крови на сифилис (реакция микропреципитации);
-
общий анализ крови;
-
общий анализ мочи;
-
биохимическое исследование крови (общий белок, мочевина, креатинин, билирубин, глюкоза, АлАТ, АсАТ, электролиты – Na, K, Mg, Cl);
-
коагулограмма (по показаниям).
35.7.6. Дополнительные методы обследования:
-
при подозрении на метастатический характер опухоли выполняется КТ органов Грудной клетки и брюшной полости, маммография и другие методы исследования по решению консилиума в составе нейрохирурга и онколога;
-
КТ черепа и головного мозга при вовлечении в опухолевый процесс костей черепа (в дополнение к МРТ);
-
КТА сосудов головного мозга (по показаниям).
-
функциональная МРТ (двигательных зон, речевых зон) и МР-трактография, МРТ-диффузия, МРТ-перфузия, МРТ-спектроскопия (по показаниям).
-
МРТ всего спинного мозга с контрастным усилением (при подозрении на опухоль с риском диссеминации по оболочкам головного и спинного мозга);
-
анализ крови на опухолевые маркеры: АФП, -ХГЧ, ЛДГ (при опухолях пинеальной области);
-
ПЭТ/КТ головного мозга с метионином (по показаниям);
-
Анализ крови на ВИЧ-инфекцию (по показаниям).
35.4. Наблюдение, сроки и объем обследования
Наблюдение осуществляется врачом-онкологом по месту жительства, и наряду с оценкой клинических и неврологических данных включает систематическое выполнение МРТ головного мозга с контрастным усилением.
35.4.1. Для дифференциальной диагностики радионекроза и продолженного роста опухоли после комбинированного лечения целесообразна МРТ спектроскопия.
35.4.2. При глиальных опухолях низкой степени злокачественности (Grade I-II) МРТ в первый год – 1 раз в 6 месяцев в течение первых пяти лет, в дальнейшем – 1 раз в год.
35.4.3. При глиальных опухолях высокой степени злокачественности (Grade III-IV) МРТ–1 раз в 3–4 месяца в течение первых двух лет, в дальнейшем – каждые 4–6 месяцев. Первый контрольный осмотр при глиобластоме выполняется через 1 месяц после завершения лучевой терапии (МРТ-исследование).
35.4.4. При первичной лимфоме МРТ головного мозга выполняется каждые 3–4 месяца в течение первых двух лет, каждые 6 месяца в течение третьего года и далее ежегодно.
35.4.5. При медуллобластоме, эпендимоме, герминативно-клеточных опухолях, пинеобластоме выполняется МРТ головного мозга с контрастированием (каждые 3–4 месяца) и всех отделов спинного мозга (каждые 6 месяцев) в течение первых 2 лет, в течение 3-го и 4-го годов – 1 раз каждые 6 месяцев, далее – 1 раз в год.
35.4.6. Для оценки эффективности лечения глиальных опухолей используют критерии RANO (таблица 35.5).
Наблюдение осуществляется врачом-онкологом по месту жительства, и наряду с оценкой клинических и неврологических данных включает систематическое выполнение МРТ головного мозга с контрастным усилением.
35.4.1. Для дифференциальной диагностики радионекроза и продолженного роста опухоли после комбинированного лечения целесообразна МРТ спектроскопия.
35.4.2. При глиальных опухолях низкой степени злокачественности (Grade I-II) МРТ в первый год – 1 раз в 6 месяцев в течение первых пяти лет, в дальнейшем – 1 раз в год.
35.4.3. При глиальных опухолях высокой степени злокачественности (Grade III-IV) МРТ–1 раз в 3–4 месяца в течение первых двух лет, в дальнейшем – каждые 4–6 месяцев. Первый контрольный осмотр при глиобластоме выполняется через 1 месяц после завершения лучевой терапии (МРТ-исследование).
35.4.4. При первичной лимфоме МРТ головного мозга выполняется каждые 3–4 месяца в течение первых двух лет, каждые 6 месяца в течение третьего года и далее ежегодно.
35.4.5. При медуллобластоме, эпендимоме, герминативно-клеточных опухолях, пинеобластоме выполняется МРТ головного мозга с контрастированием (каждые 3–4 месяца) и всех отделов спинного мозга (каждые 6 месяцев) в течение первых 2 лет, в течение 3-го и 4-го годов – 1 раз каждые 6 месяцев, далее – 1 раз в год.
35.4.6. Для оценки эффективности лечения глиальных опухолей используют критерии RANO (таблица 35.5).
Лечение
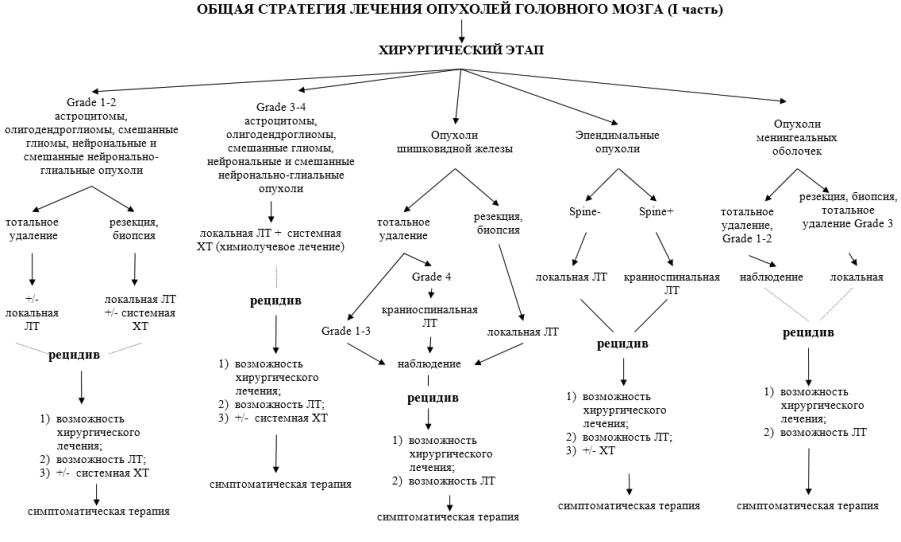
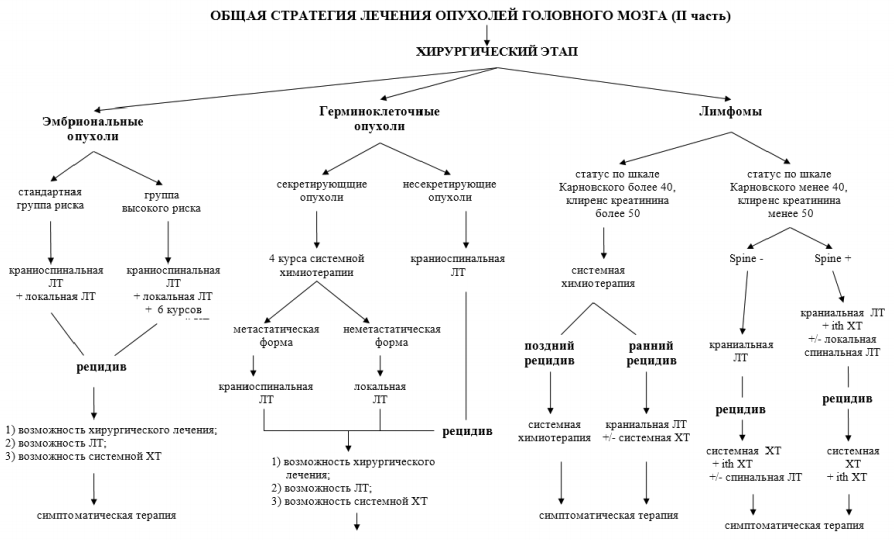
35.8. Общие принципы лечения (рисунки 35.1-35.2).
Лечение пациентов с новообразованиями ЦНС проводится только в специализированных нейрохирургических и онкологических лечебных учреждениях. Стандартными методами лечения опухолей ЦНС в настоящее время являются хирургическое лечение, лучевая терапия, химиотерапия.
Первым этапом лечения является хирургическое вмешательство (лечебное или диагностическое). Дальнейшая лечебная программа строится с учетом гистологической формы и степени злокачественности, распространения процесса, размеров и локализации опухоли.
При выполнении хирургического вмешательства в нейрохирургических отделениях (напр. по экстренным показаниям,) пациенты направляются для дальнейшего лечения в учреждения онкологического профиля с данными общеклинического обследования, описанием хирургического вмешательства, парафиновыми блоками биоптатов, дооперационной и послеоперационной МРТ и/или КТ в формате DICOM на электронных носителях.
35.8.1. Хирургическое лечение
Задачами хирургического этапа лечения являются: обеспечение максимального удаления новообразования с соблюдением принципов анатомической и функциональной доступности, установление точного морфологического диагноза, уменьшение эффекта объемного воздействия опухоли на головной мозг и уменьшение дислокации мозга в полости черепа, нормализация или восстановление ликвороциркуляции.
При полном или частичном удалении злокачественных супратенториальных нейроэпителиальных опухолей головного мозга (морфологически подтвержденных путем срочного гистологического исследования), а также рецидивных опухолей показана интраоперационная локальная химиотерапия с использованием иммобилизованных форм темозоломида и цисплатина.
Противопоказания к хирургическому вмешательству: соматическая патология в стадии декомпенсации; наличие гнойно-воспалительных заболеваний с локализацией гнойных очагов в зоне предстоящих хирургических манипуляций (до излечения).
35.8.2. Предоперационная подготовка:
- назначение кортикостероидных препаратов в дозе от 12 до 16 мг (в пересчете на дексаметазон), однократно, утром в течение 2–3 суток перед хирургическим вмешательством;
- при наличии эпилептических припадков – топирамат в дозе 0,2–0,4г (до 0,5 г) в сутки в два приема, или препараты вальпроевой кислоты в дозе 20–30 мг/кг (до 50 мг/кг) в сутки или карбамазепин в дозе 0,2 г 2–4 раза в сутки, или другие препараты, обеспечивающие купирование припадков, профилактическое назначение противосудорожных препаратов не производится;
- коррекция общесоматических нарушений;
- непосредственно перед операцией производится катетеризация мочевого пузыря, эластическое бинтование нижних конечностей (при наличии варикозной болезни, всем пациентам старше 40 лет).
35.8.3. Объем хирургического вмешательства
35.8.3.1. Нейроэпителиальные опухоли
Полное удаление – новообразование удаляется в пределах видимой здоровой ткани.
Частичное удаление – новообразование удаляется с макроскопически видимой остаточной опухолью.
Биопсия опухоли – удаление участков новообразования для последующего гистологического исследования.
Симптоматические операции – восстановление проходимости ликворных путей и др.
35.8.3.2. Менинготелиальные опухоли
Для формализации степени радикальности операций при менингиомах используется шкала Симпсона:
Тип 1 – макроскопически полное удаление опухоли с иссечением ТМО в месте исходного роста опухоли и резекцией всей пораженной кости;
Тип 2 – макроскопически полное удаление с коагуляцией ТМО в месте исходного роста;
Тип 3 – макроскопически полное удаление без иссечения или коагуляции ТМО в месте исходного роста и(или) без резекции всей пораженной кости;
Тип 4 – частичное удаление опухоли
Тип 5 – биопсия или декомпрессия.
35.8.3.3. Морфологическое исследование. Должна быть обеспечена возможность срочного морфологического исследования. Для срочного морфологического исследования объем биоптата должен быть не менее 1 см3 (за исключением случаев когда выполняется стереотаксическая биопсия). Для дифференциальной диагностики проводятся иммуногистохимические исследования и молекулярно-цитогенетичекий анализ.
35.8.4. Метастатические опухоли головного мозга
Вопрос о хирургическом лечении рассматривается при наличии в головном мозгу от 1 до 3 метастазов (тотальное симультанное или этапное удаление опухоли). При локализации или распространении метастаза(ов) на подкорковые центры и ядра и другие жизненно важные структуры головного мозга, травматизация которых сопряжена с высоким риском фатальных осложнений, хирургическое лечение не показано.
Тактика лечения пациентов с неудалимыми солитарными метастазами, множественными метастазами в головном мозгу, неизлеченной первичной опухолью, наличии экстрацеребральных метастазов определяется консилиумом в составе: врач-нейрохирург, врач-онколог, врач-радиационный онколог.
При метастазе в головном мозгу из невыявленного первичного очага и невозможности его удаления выполняется открытая биопсия/резекция метастаза или стереотаксическая биопсия (предпочтительный вариант, если предполагается нехирургическое лечение). Во время выполнения операции должна быть обеспечена возможность срочного морфологического исследования биопсийного материала.
До выполнения биопсии (при подозрении по данным нейровизуализации на метастатическую природу новообразования в головном мозгу) проводится системное обследование с целью выявления первичного опухолевого очага.
35.8.5. Злокачественные новообразования спинного мозга
При локализации опухоли в поверхностных отделах спинного мозга целесообразно проводить удаление новообразования (полное или частичное).
Вопрос об объеме хирургического вмешательства при интрамедуллярном новообразовании решается индивидуально, определяется особенностями опухолевого роста и состоянием пациента.
После хирургического вмешательства по поводу новообразования головного или спинного мозга для уточнения степени радикальности удаления в обязательном порядке производится контрольное интраскопическое обследование (МРТ и/или КТ). МРТ может быть выполнена не позднее чем через 24 часа после операции, КТ – на 2–10-е сутки после операции.
35.8.6. Специальное лечение в послеоперационном периоде
Вопрос о проведении послеоперационного лечения решается консилиумом в составе: врача-радиационного онколога, врача-онколога, врача-нейрохирурга.
Лучевую терапию начинают на 14–56 сутки после хирургического вмешательства.
Противопоказания к проведению лучевой терапии:
- некупируемая тяжесть состояния пациента;
-
отек головного мозга с клиническими признаками дислокации в полости черепа.
Химиотерапия является компонентом лечения при высокозлокачественных астроцитомах, олигодендроглиомах, смешанных глиомах, нейрональных и смешанных нейронально-глиальных опухолях, эмбриональных опухолях, лимфомах ЦНС, герминоклеточных опухолях ЦНС.
В зависимости от нозологической формы опухоли, распространенности и Группы риска используются различные виды химиотерапии (системная, интратекальная) и различные режимы (до-, на фоне и после лучевой терапии).
35.8.7. Обеспечение лучевой терапии
Лучевое лечение проводится на фоне назначения кортикостероидов (суточная доза определяется индивидуально). Кортикостероиды уменьшают околоопухолевый отек, снижают объемный эффект опухоли и внутричерепное давление. Это дает быстрое облегчение головной боли и смягчает латерализирующие эффекты. Дексаметазон – кортикостероид выбора вследствие своей минимальной минералокортикоидной активности. Начальная доза дексаметазона – 8 мг/день. В последующем ее повышают или снижают до достижения минимальной дозы, необходимой для купирования неврологических симптомов. У большинства пациентов применение кортикостероидов может быть сведено к минимуму по окончании лучевой терапии.
Длительное применение кортикостероидов связано с развитием гипертензии, сахарного диабета, некетотического гиперосмолярного состояния, миопатии, увеличением веса, бессонницы и остеопороза.
Пациентам, у которых в анамнезе были эпизоды судорожного синдрома, назначаются противосудорожные средства: топирамат в дозе 0,2–0,4 г (до 0,5 г) в сутки в два приема, или препараты вальпроевой кислоты в дозе 20–30 мг/кг (до 50 мг/кг) в сутки или карбамазепин в дозе 0,2 г 2–4 раза в сутки, или другие препараты, обеспечивающие купирование припадков, профилактическое назначение противосудорожных препаратов не производится.
Предлучевая подготовка включает:
- МРТ/КТ головного мозга с контрастным усилением;
- осмотр врача-невролога, включая оценку когнитивных функций;
- осмотр врача-окулиста;
- по показаниям МРТ спинного мозга (эмбриональные опухоли, эпендимомы, лимфомы, герминоклеточные опухоли);
- по показаниям исследование спинномозговой жидкости (эмбриональные опухоли, эпендимомы, лимфомы, герминоклеточные опухоли, подозрение на воспалительный процесс и т.д.).
Для первичных опухолей мозга МРТ должна быть получена как с применением контрастного материала, так и без него.
При проведении лучевой терапии предлучевая подготовка осуществляется с использованием рентгеновских симуляторов, обязательным условием является иммобилизация пациента. Расчет физических условий облучения производится на основании данных КТ в положении, при котором будет проводится облучение, компьютерными планирующими 3D-системами.
Облучение осуществляется на линейных ускорителях. Линейный ускоритель должен иметь многопластинчатую диафрагму (коллиматор), систему регистрации портальных изображений (EPID), систему верификации условий облучения для точного позиционирования пациента и локализации мишени в рамках обеспечения IGRT, систему реализации облучения с модулированной интенсивностью дозы (IMRT), а при необходимости проведения стереотаксической радиотерапии/радиохирургии – систему реализации интра- и экстракраниальной стереотаксической лучевой терапии.
Лучевая терапия может проводиться с использованием классического режима фракционирования дозы в РОД 1,8–2 Гр. Также могут применяться режимы гипофракционирования, которые предполагают использование РОД выше 2 Гр. Учитывая, что при использовании режимов гипофракционирования в лучевой терапии опухолей головного мозга и других отделов центральной нервной системы локально подводятся высокие дозы излучения, для максимального исключения окружающих опухоль нормальных тканей и критических органов из объема облучения, особое значение приобретают как предлучевая подготовка пациента с обязательной фиксацией, так и планирование и проведение сеансов лучевой терапии с использованием всех возможностей регистрации и верификации условий облучения современных линейных ускорителей с точным позиционированием пациента и локализацией мишени.
Проведение паллиативного курса лучевой терапии у пациентов с множественным опухолевым поражением центральной нервной системы возможно на гамма-терапевтических установках.
У пациентов с ожидаемой продолжительностью жизни более 3-х лет, получавших лучевую терапию по поводу опухолей головного мозга, может развиться снижение интеллекта.
35.8.8. Методика исследования спинномозговой жидкости (СМЖ)
Необходимо не менее 3 мл спинномозговой жидкости, которая должна быть срочно отправлена для цитологического исследования, но не позже 30 минут после пункции, т.к. клетки в ней очень быстро разрушаются. В полученную жидкость не добавляют фиксатор. В крайнем случае, если нет возможности доставить жидкость сразу же, необходимо добавить фиксатор, например Saccomano carbowax. Этот фиксатор предотвращает дегенерацию клеток, но не позволяет приготовить высушенные на воздухе мазки, по которым оценивают клетки при лимфомах и лейкозах (по Паппенгейму, окрашиваются только высушенные на воздухе мазки).
Цитологу необходимо сообщать, если до получения СМЖ были любые другие терапевтические и диагностические процедуры и дату их проведения, даже о пункции костного мозга для миелограммы. Реактивные клетки могут иметь выраженную атипию, сформировать Группы по типу эпителиальных клеток, что приведет к ложно-положительному ответу. Во время хирургического вмешательства может быть оставлен инородный материал, на который отреагируют клетки СМЖ, или после травмы в СМЖ появятся тканевые фрагменты, включая эпителий назального синуса после травмы основания черепа.
Вследствие низкой клеточности СМЖ используются методы приготовления цитологических мазков, которые способствуют концентрации клеток с сохранением их морфологии. Необходимо использовать метод приготовления мазков на центрифуге «Цитоспин».
Для сохранности клеток необходимо соблюдать следующие условия: скорость центрифугирования 500–900 об/мин, но не выше 1000 об/мин, быстрое ускорение; время центрифугирования – 5 минут, мазки должны быть свежими. Сохранность клеток значительно зависит от их чувствительности к скорости центрифугирования, чрезмерно высокая скорость приводит к уплощению клеток, их разрушению и потере клеточных деталей при микроскопии. Ложно-отрицательные результаты достаточно часты, но шансы положительного ответа зависят от объема исследованной жидкости, скорости центрифугирования и получения жидкости из места рентгенологически выявляемой болезни или «симптомной» точки. Положительный результат можно получить при повторной аспирации СМЖ, даже если первично ответ был отрицательным.
Из СМЖ необходимо делать максимально возможное число препаратов. Для приготовления 1 мазка с помощью цитоспина требуется 0,5–1,0 мл жидкости.
Иммуноцитохимический метод используется для идентификации типа клеток. В частности, при определении типа клеток лимфомы, их дифференциальной диагностике от эпителиальных клеток. Иногда определяют маркеры глиальных и нейроэндокринных опухолей, а также специфических метастатических опухолей (меланома, рак простаты). Но большая осторожность должна присутствовать при оценке реакции на малом числе клеток. Необходимо тщательно соблюдать режим фиксации мазков, разведения и жизнеспособности антител.
35.9. Низкозлокачественные (Grade 1-2) астроцитомы, олиго-дендроглиомы, смешанные глиомы, нейрональные и смешанные нейронально-глиальные опухоли.
Рекомендуемая тактика лечения:
Если удалось выполнить полное удаление опухоли, подтвержденное при динамическом МРТ-исследовании, то у пациентов в возрасте <40 лет, а также в возрасте >40 лет (при отсутствии неблагоприятных прогностических признаков) лучевая терапия может быть отсрочена до тех пор, пока МРТ- или КТ-исследования убедительно не подтвердят наличие рецидива, хирургическое лечение которого невозможно.
У пациентов в возрасте >40 лет при наличии 2-х и более неблагоприятных прогностических признаков (астроцитарный тип опухоли, наибольший размер опухоли >6 см, переход опухоли за среднюю линию, наличие неврологического дефицита) показано проведение послеоперационной лучевой терапии.
Если полное удаление опухоли выполнить не удалось, рекомендуется послеоперационное облучение.
Лучевая терапия должна подводиться с использованием линейного ускорителя ежедневными фракциями по 1,8–2,0 Гр до суммарной дозы 50–54Гр. Поля облучения должны включать только объем первичной опухоли, определенной на МРТ, и не должны охватывать весь головной мозг. ЛТ проводится локальными полями, включающими зону опухоли после контрастного усиления + 2 см от Границы этой зоны (по данным КТ и зоны аномальной плотности на Т-2 взвешенных изображениях МРТ + 1–2 см). При низкозлокачественных астроцитомах лучевая терапия может обеспечить показатель 5- летней выживаемости 50 %, а 10-летней – 20 %. Выживаемость пациентов с низкозлокачественными олигодендроглиомами еще выше.
При рецидиве низкозлокачественной глиомы наряду с возможностью хирургического удаления опухоли и возможностями лучевой терапии рассматривается вопрос о назначении химиотерапии.
35.10. Высокозлокачественные (Grade 3-4) астроцитомы, олигодендроглиомы, смешанные глиомы, нейрональные и смешанные нейронально-глиальные опухоли.
35.10.1. Рекомендуется проведение послеоперационной лучевой терапии локальными полями, независимо от объема хирургического вмешательства. Клинический начальный объем облучения включает в себя остаточную опухоль с контрастным усилением, послеоперационную кисту + 2–3 см (неизмененной ткани мозга с обязательным включением в объем облучения зоны отека). После подведения СОД 46 Гр клинический объем облучения уменьшается и включает в себя остаточную опухоль и послеоперационную кисту + 1–2 см неизмененной ткани мозга. При распространении опухоли до средней линии, в том числе в пределах мозолистого тела, отступ от Границ объема опухоли в контралатеральную часть головного мозга должен составлять 5–7 мм в зависимости от способа иммобилизации пациента. Лучевая терапия на первичный очаг в дозе до 59,4–60 Гр 30–33 фракциями (РОД 1,8–2 Гр) является стандартным методом лечения высокозлокачественных глиом; эта величина дозы несколько выше порога лучевого некроза. Примерно у половины пациентов с анапластическими астроцитомами рентгенографические данные свидетельствуют о наличии ответа на облучение в дозе 60 Гр, при мультиформной глиобластоме – у 25 % пациентов. Полная регрессия и той, и другой опухоли, подтвержденная рентгенографически, бывает редко.
35.10.2. План лучевой терапии составляется с учетом прогностических факторов.
35.10.3. Химиолучевое лечение
У пациентов с исходным статусом ECOG 0-1 балла (шкала Карновского 70–100 %) облучение проводится на фоне приема темозоламида в дозе 75 мг/м2 внутрь ежедневно (включая выходные и праздничные дни) на протяжении всего курса облучения за 1 час до проведения сеанса лучевой терапии. Альтернативной схемой химиолучевой терапии является назначение темозоламида в дозе 75 мг/м2 внутрь ежедневно в первые и последние две недели курса лучевой терапии (исключая выходные и праздничные дни) за 1 час до проведения сеанса облучения. Через 3–4 недели после завершения химиолучевой терапии независимо от ее схемы проводится до 6 курсов химиотерапии: темозоламид 150– 200 мг/м2 внутрь 1–5 день, курсы повторяют каждые 28 дней.
При невозможности проведения локального облучения (обычно при мультифокальном поражении обоих полушарий головного мозга либо опухоли больших размеров, поражающей оба полушария) проводится паллиативная химиолучевая терапия (облучение всего головного мозга в РОД 3 Гр СОД 30 Гр на фоне темозоломида) с возможным назначением через 3–4 недели после ее окончания адъювантной химиотерапии темозоломидом.
35.10.4. У пациентов с исходным статусом ECOG 2 балла (шкала Карновского 50–60 %) тактика лечения определяется в зависимости от возраста, объема опухолевого поражения и общего состояния пациента. У пациентов в возрасте 60 лет при тотальном либо субтотальном удалении опухоли в зависимости от клинической ситуации используется либо химиолучевое лечение (см. п. 35.9.3.), либо лучевая терапия в режиме гипофракционирования в СОД эквивалентной 36–40 Гр с последующим возможным назначением темозоламида в адъювантном режиме. У пациентов в возрасте >60 лет и/или парциальном удалении опухоли либо ее биопсии изначально предпочтительно проведение курса гипофракционированной лучевой терапии в СОД эквивалентной 36–40 Гр с или без последующего назначения темозоломида. При гипофракционированной лучевой терапии используются следующие режимы фракционирования:
РОД 3 Гр на весь головной мозг ежедневно 10 фракций до СОД 30 Гр или РОД 4 Гр на весь головной мозг ежедневно 6 фракций до СОД 24 Гр – при необходимости облучения всего головного мозга;
РОД 5 Гр локально на опухоль и\или ее ложе ежедневно 5 фракций до СОД 25 Гр – при возможности локального облучения опухоли.
Спустя 3–4 недели после окончания лучевой терапии у пациентов в возрасте <65 лет в зависимости от эффекта проведенного ранее лечения рассматривается вопрос о возможности дополнительного локального облучения в РОД 2 Гр до СОД 20 Гр и\или проведении курсов химиотерапии.
35.10.5. При состоянии пациента по шкале Карновского менее 50 % (ECOG >2 баллов) возможность, целесообразность и схема проведения противоопухолевого лечения (если оно будет назначено) определяется индивидуально.
35.10.6. Химиотерапия. Через 3–4 недели после завершения лучевой (химиолучевой) терапии проводится 6 курсов химиотерапии.
35.10.6.1. PCV:
- прокарбазин 60 мг/м2 внутрь 8–21 день;
- ломустин 110 мг/м2 внутрь 1-й день;
- винкристин 1,4 мг/м2 (максимальная доза 2 мг) в/в струйно 8, 29 день;
- курсы повторяют каждые 6–8 недель.
Схема PCV имеет предпочтение при анапластической олигодендроглиоме и анапластической олигоастроцитоме с наличием коделеции 1p/19q.
35.10.6.2. Кармустин: 200 мг/м2 (максимальная кумулятивная доза 1500 мг/м2) в/в в течение 1–2 часов каждые 8 недель.
35.10.6.3. Темозоламид 150–200 мг/м2 внутрь 1–5 день, курсы повторяют каждые 28 дней.
35.10.6.4. Ломустин 110 мг/м2 внутрь 1-й день; каждые 6 недель.
35.11. Эмбриональные опухоли
Медуллобластомы редко бывают у взрослых, развиваются в мозжечке и всегда являются высокозлокачественными новообразованиями. Распространение опухоли по ЦНС происходит по субарахноидальному пространству, внутричерепные метастазы наблюдаются редко, большей частью в области цистерн основания мозга. Послеоперационное стадирование медуллобластомы проводится на основе МРТ/КТ с констрастированием, а также исследование спинного мозга (МРТ с констрастированием в сочетании с цитологическим исследованием спинномозговой жидкости (методика «Цитоспин»)). Для определения тактики лечения устанавливается прогностическая Группа риска (стандартный риск и высокий риск) с учетом остаточной опухоли и распространением процесса (методика оценки TM по Chang и Harisiadis).
Примитивные нейроэктодермальные опухоли (PNET), нейробластома – высокозлокачественные, агрессивные образования, также обычно возникающие у детей. Их прогноз обычно хуже, чем у медуллобластомы.
Вышеперечисленные опухоли относятся к опухолям с высоким риском краниоспинального распространения (Spine +). Высокоэффективным лечением этих опухолей является краниоспинальное облучение (КСО).
35.11.1. Тактика послеоперационного лечения определяется прогностической Группой риска. К стандартной Группе риска относятся эмбриональные опухоли ЦНС, у которых объем остаточной опухоли не превышает 1,5 см3 и нет метастатического поражения.
Лечение пациентов Группы стандартного риска включает послеоперационное краниоспинальное и локальное облучение.
Объем облучения включает весь головной и спинной мозг. Симуляция полей для планирования КСО включает много этапов. Пациенты должны лечиться в положении пронации на специальном фиксирующем устройстве (мешке) с фиксацией лица и головы. Голова и шея должны быть максимально выпрямлены на сколько это возможно. На этапе первичной симуляции рекомендуется промаркировать рентгеноконтрастными метками три референтные точки, расположенные на коже вдоль позвоночника: первая – на уровне Th1 позвонка, вторая – на уровне S2, третья – на середине расстояния между первыми двумя метками. Также рекомендуется установить рентгеноконтрастные метки на коже в латеральных углах глаз. Размер меток не должен превышать 1мм.
Для планирования должны использоваться данные спиральных КТ-исследований: для области головы и шеи используются сканы 3мм толщиной с расстоянием 3 мм между ними, для Грудного, абдоминального и тазового отделов позвоночника – 5 × 5 мм.
Обычно нижняя Граница спинномозгового поля находится на уровне соединения S2/S3 позвонков. Однако, использование МРТ может уточнить положение этой Границы от S1 до верхнего края S4 (использование обычных симуляционных снимков недопустимо).
Для облучения головного мозга используется 2 латеральных поля. Для облучения спинного мозга обычно используется 2 спинномозговых поля – Грудное и люмбальное. Для улучшения дозного распределения возможно применение компенсаторов. Должны быть запланированы и использоваться 2 или более подвижных соединения между полями шириной 1 см каждый в краниальном направлении. Облучение проводится ежедневно с использованием тормозного фотонного излучения с энергией 6 МВ, РИО 100.
После завершения краниоспинального облучения (РОД 1,8 Гр до СОД 36 Гр) проводится лучевая терапия с локальных полей. В объем облучения включается объем опухоли с зоной контрастного усиления либо послеоперационная киста плюс 1–2 см, РОД 1,8 Гр, СОД 19,8 Гр (всего за 11 фракций).
В качестве альтернативной схемы лечения у пациентов стандартной Группы риска возможно использование редуцированных доз при краниоспинальном облучении (РОД 1,8 Гр до СОД 23,4 Гр) с последующим локальным облучением зоны первичной опухоли до 54–55,8 Гр и назначением адъювантной химиотерапии.
35.11.2. Химиотерапия.
Пациентам, относящимся к Группе высокого риска (объем остаточной опухоли >1,5 см или есть метастатическое поражение), проводится химиотерапия (6 курсов), которая начинается через 3–4 недели после окончания облучения.
35.11.2.1. Цисплатин 70 мг/м2 внутривенная инфузия в течение 6 часов с пред- и постгидратацией в 1-й день;
ломустин 75 мг/м2 внутрь в 1-й день;
винкристин 1,5 мг/м2 (максимальная доза 2 мг) в/в струйно в 1-й, 8-й и 15-й дни;
курсы повторяют каждые 42 дня.
35.11.2.2. PCV:
прокарбазин 60 мг/м2 внутрь 8–21 дни;
ломустин 110 мг/м2 внутрь 1-й день;
винкристин 1,4 мг/м2 (максимальная доза 2 мг) в/в струйно 8, 29 дни;
курсы повторяют каждые 6–8 недель.
35.11.2.3. Кармустин: 200 мг/м2 (максимальная кумулятивная доза 1500 мг/м2) в/в в течение 1–2 часов каждые 8 недель.
35.12. Эпендимомы.
Внутричерепные эпендимомы относительно редки, составляя менее 2 % всех опухолей головного мозга. Чаще всего они наблюдаются в задней черепной ямке или в спинном мозгу, хотя могут также возникать в отделе, расположенном над мозжечковым наметом. Гистологически эпендимомы обычно являются высокодифференцированными опухолями, но большая частота их рецидива указывает на их злокачественную природу.
Для определения тактики послеоперационной лучевой терапии необходимо уточнить распространение опухоли по спинномозговому каналу. Проводится МРТ исследование спинного мозга и спинномозговой жидкости методом «Цитоспин».
При поражении спинного мозга (Spine +) проводится краниоспинальное облучение. При отсутствии поражения (Spine –) проводится только локальное облучение. При тотальном удалении супратенториально расположенной опухоли, подтвержденном при МРТ-исследовании, а также отсутствии поражения спинного мозга и опухолевых клеток в спинномозговой жидкости возможно ограничиться динамическим наблюдением за пациентом.
Тактика лечения спинальных эпендимом соответствует тактике лечения внутричерепных эпендимом.
35.13. Менингиомы.
Менингиомы хорошо излечиваются с помощью полной хирургической резекции. Однако часто невозможно полностью резецировать опухоли основания черепа и опухоли, поражающие синусы твердой мозговой оболочки. Для некоторых пациентов с такими опухолями показан курс послеоперационной лучевой терапии. Обычно облучается рентгенографически (по данным МРТ, КТ) определяемая область опухоли с применением трехмерного (далее – 3D) планирования облучения или стереотаксической лучевой терапии (при размерах опухоли не более 3 см).
Показания к послеоперационной лучевой терапии:
- биопсия и частичное удаление доброкачественных менингиом при Grade 1–2 (при тотальном (Simpson 1–2) удалении – динамическое наблюдение);
- анапластические менингиомы (Grade 3) – вне зависимости от объема оперативного вмешательства.
35.14. Опухоли паренхимы шишковидной железы.
К этой Группе относятся пинеоцитома Grade II, пинеобластома Grade IV, опухоль паренхимы шишковидной железы с умеренной дифференцировкой.
Пациенты с тотальным удалением пинеоцитомы Grade II могут подлежать динамическому наблюдению, пациентам с частичным удалением опухоли проводится локальная лучевая терапия.
При пинеобластомах после выполнения хирургического лечения в максимально возможных объемах показано краниоспинальное облучение.
35.15. Краниофрингиомы.
При тотальном удалении краниофарингиомы проводится динамическое наблюдение за пациентом. Локальная лучевая терапия проводится после частичного удаления опухоли либо биопсии или опорожнения опухолевой кисты.
35.16. Лимфомы.
Тактика лечения первичных неходжкинских лимфом ЦНС определяется исходным статусом по шкале Карновского (более или менее 40 %), клиренсом креатинина (более или менее 50). У пациентов в возрасте более 60 лет химиотерапия при первичной лимфоме ЦНС является предпочтительным методом лечения, поскольку лучевая терапия (или химиолучевая терапия) усиливает непосредственные и отдаленные нейротоксические эффекты.
35.16.1. При исходно низком статусе по шкале Карновского (менее 40 %) и клиренсом креатинина менее 50 мл/мин) пациентам показана краниальная лучевая терапия (СОД 36 Гр) с возможным локальным облучением остаточной опухоли до 45–46 Гр. При выявлении клеток лимфомы в спинномозговой жидкости проводятся еженедельное интратекальное введение метотрексата в дозе 15 мг (не менее 6 введений). При выявлении патологических очагов по данным МРТ (с контрастным усилением) рассматривается вопрос о возможности локального спинального облучения.
35.16.2. При статусе по шкале Карновского более 40 % и клиренсе креатинина более 50 мл/мин – проводится химиотерапия. При клинической эффективности режимов химиотерапии (полная резорбция опухоли) показания к дальнейшему лечению определяются индивидуально, последующая лучевая терапия не проводится, либо проводится краниальное облучение в РОД 1,8 Гр до СОД 23,4 Гр.
35.16.3. Базовым лекарственным средством является метотрексат в высоких дозах.
Ранее считалось, что максимальный противоопухолевый эффект достигается при длительной многочасовой инфузии. В настоящее время установлено, что при введении препарата в дозе ≥ 3 г/м2 в течение двух-трех часов всегда создается цитотоксическая концентрация его в спинномозговой жидкости, в то время как введение 8 г/м2 в течение 34 часов не гарантирует создания такой концентрации.
При первичных лимфомах ЦНС оптимальный режим химиотерапии пока не установлен. Лечение проводится по протоколу R-MTX-AraC или протоколу R-MPV-AraC.
35.16.3.1. Протокол R-MTX-AraC включает проведение 4–6 курсов химиотерапии с интервалами 2–3 недели:
- ритуксимаб 375 мг/м2 внутривенно 1-й день;
- метотрексат 3,5 г/м2 внутривенно в течение 2 ч 1-й день;
- лейковорин 30 мг/м24 раза в сутки внутривенно через 24 ч после начала введения метотрексата, 6 введений;
- цитарабин 2 г/м2 каждые 12 часов внутривенно 2–3-й дни (4 введения).
35.16.3.2. Протокол R-MPV-AraC включает проведение 4-х блоков R-MPV, очередной курс начинается на 28-й день от начала предыдущего. При частичной регрессии опухоли и хорошей переносимости лечения количество курсов может быть увеличено до шести. Через 14 дней после последнего блока R-MPV проводится блок AraC.
Блок R-MPV
- ритуксимаб 375 мг/м2 внутривенно 1-й день;
- метотрексат 3,5 г/м2 внутривенно в течение 2 ч 1-й и 15-й дни;
- лейковорин 30 мг/м24 раза в сутки внутривенно через 24 ч после начала введения метотрексата, 6 введений;
- винкристин 1,5 мг/м2внутривенно в 1-й и 15-й дни;
- прокарбазин 100 мг/м2внутрь с1-го по 7-й дни
Блок AraC (проводится через 14 дней после последнего блока R-MPV)
- Цитарабин 3 г/м2 внутривенно 1–2-й дни.
При введении метотрексата помимо гипергидратации (инфузионная терапия 2 л/м2 в/в, прегидратация 6–8 ч) проводится ощелачивание мочи под контролем рН, который должен быть на уровне >7,4 в течение всего периода введения и выведения препарата. Через 24 ч от начала введения метотрексата начинается введение антидота – кальция фолината в дозе 30 мг/м2каждые 6 часов – 6 введений. Доза кальция фолината корригируется в зависимости от скорости выведения метотрексата рисунок 35.3. За 30 минут до начала каждого введения цитарабина внутривенно струйно вводится пиридоксина гидрохлорид 150 мг/м2; в дни введения цитарабина обязательно назначаются глазные капли с кортикостероидами (6 раз в день) и физиологическим раствором в виде глазных капель (6 раз в день), которые чередуются с каплями с кортикостероидами.
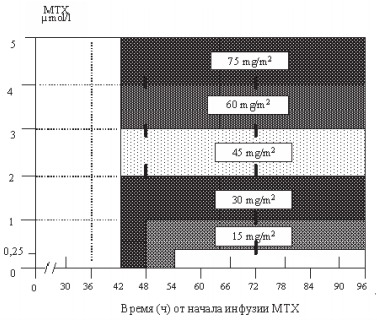
Рисунок 35.3 – Схема назначения антидота – кальция фолината в зависимости от уровня МTX в сыворотке крови
При достижении в результате химиотерапии полной регрессии мультидисциплинарным консилиумом определяется целесообразность проведения консолидирующей высокодозной химиотерапии и облучения всего головного мозга.
35.17. Герминоклеточные опухоли ЦНС
Тактика послеоперационного лечения герминоклеточных опухолей ЦНС определяется уровнем секреции α-фетопротеина или β-хорионического гонадотропина, которые могут определяться как в сыворотке крови, так и в спинномозговой жидкости. В зависимости от уровня данных показателей все пациенты с герминоклеточными новообразованиями ЦНС разделяются на 2 Группы: с секретирующими опухолями и несекретирующими.
35.17.1. При секретирующих новообразованиях в послеоперационном периоде лечение начинают с 4 курсов PEI системной химиотерапии на фоне гидратационной терапии (1,5–2 л/м2):
РЕI: цисплатин 20 мг/м2/день внутривенная инфузия со скоростью не более 1 мг/мин с пред- и постгидратацией в 1–5 дни;
- этопозид 100 мг/м2 внутривенно в течение 1 ч в 1–3 дни;
- ифосфамид 1500 мг/м2/день внутривенно в течение 1 ч в 1–5 дни;
- месна 400 мг/м2 внутривенно струйно до введения ифосфамида, на 4 и 8 ч после начала введения ифосфамида.
При статусе по шкале Карновского менее 50 %, доза ифосфамида редуцируется до 1000 мг/м2/день.
Через 3 недели после химиотерапии пациентам проводится лучевая терапия. Объем лучевой терапии зависит от исходного распространения опухоли. При метастатическом поражении (диссеминированные формы) пациенты получают краниоспинальное облучение. При отсутствии метастатического поражения проводится только локальное облучение первичного распространения опухоли в СОД 45 Гр, РОД 1,8 Гр (всего 25 фракций).
35.17.2. При несекретирующих опухолях в послеоперационном периоде проводится только краниоспинальное облучение.
35.2. Особенности облучения отдельных нозологических форм и локализаций
При первичных опухолях головного мозга и ствола головного мозга в случае невозможности выполнения хирургического вмешательства допускается проведение лучевой терапии без гистологической верификации диагноза (по решению консилиума в составе врача-нейрохирурга, врача-радиационного онколога и онколога после консилиума врачей рентгенологов).
35.2.1. Опухоли ствола головного мозга
Чаще всего (в порядке убывания) опухоли ствола головного мозга представлены астроцитарными опухолями различной степени дифференцировки и эпендимомами. Радикальное хирургическое вмешательство для этой Группы опухолей в настоящее время не выполнимо. Лучевая терапия увеличивает продолжительность жизни и улучшает неврологический статус. Объем облучения включает опухоль + 2 см от Границ объема опухоли. Для хорошо ограниченных опухолей отступ может быть меньше. Классический режим предусматривает применение РОД 1,8 Гр, СОД 54 Гр.
35.2.2. Метастатические опухоли мозга
У пациентов с метастазами в головном мозгу проводится хирургическое, лучевое, комбинированное и комплексное лечение.
Стереотаксическое облучение может проводиться при:
- наличии метастазов (до 10 очагов) с максимальным диаметром до 3 см (при проведении радиохирургии) или до 5 см (при проведении фракционированной стереотаксической лучевой терапии) без проявлений масс-эффекта и гидроцефалии с признаками внутричерепной гипертензии;
- после хирургического лечения крупного метастаза и наличии до 10 оставшихся после операции метастатических очагов, пригодных для проведения ридиохирургического лечения;
- наличии интракраниальных рецидивов после облучения всего головного мозга, хирургического лечения или стереотаксической радиотерапии.
35.2.2.1. Лечение одиночных метастазов в головном мозгу (<3):
35.2.2.1.1. хирургическое удаление удаление метастаза ± облучение всего головного мозга или локальное облучение ложа удаленного метастаза;
35.2.2.1.2. стереотаксическая лучевая терапия или радиохирургия ± облучение всего головного мозга;
35.2.2.1.3. хирургическое удаление угрожающего жизни метастаза в головном мозгу с последующим проведением стереотаксической радиотерапии/ радиохирургии оставшихся метастазов ± облучение всего головного мозга;
35.2.2.1.4. облучение всего головного мозга (при технической невозможности хирургического удаления и проведения радиохирургии) или симптоматическое лечение (при неудалимых метастазах, неконтролируемых экстрацеребральных метастазах, индексе Карновского <70).
35.2.2.2. Лечение множественных метастазов в головном мозгу (>3):
35.2.2.2.1. облучение всего головного мозга или радиохирургическое лечение ± облучение всего головного мозга;
35.2.2.2.2. хирургическое удаление угрожающего жизни метастаза в головном мозгу с последующим проведением стереотаксической радиотерапии / радиохирургии оставшихся метастазов или облучение всего головного мозга (при отсутствии или контролируемых экстракраниальных метастазах, индексе Карновского >70);
35.2.2.2.3. симптоматическое лечение (при неконтролируемых экстрацеребральных метастазах, индексе Карновского < 70) или облучение всего головного мозга (у отдельных категорий пациентов).
У симптоматических пациентов с метастазами в головном мозгу медиана выживаемости составляет около 1 месяца без лечения и 3–6 месяца при лучевой терапии всего головного мозга, при этом нет значительных различий в применении следующих режимов фракционирования облучения (20 Гр за 5 фракций, 24 Гр за 6 фракций, 30 Гр за 10 фракций, 40 Гр за 20 фракций). Более длительный режим применяется у пациентов с незначительными признаками системного процесса или при отсутствии таковых, а также после резекции одиночного метастаза в головном мозгу, поскольку у этих пациентов имеется возможность длительной выживаемости или даже излеченности. Использование режимов облучения крупными фракциями связано с увеличением риска неврологических осложнений. Послеоперационную лучевую терапию начинают на 14–30 сутки после хирургического вмешательства.
Послеоперационное облучение всего головного мозга может не применяться у некоторых категорий пациентов, таких как лица преклонного возраста или с высокой степенью радиорезистентности первичных опухолей (например, рак почки), потому что эти пациенты подвержены токсическим эффектам краниального облучения, не получая от него потенциальных преимуществ.
При самостоятельном лучевом лечении метастазов в головном мозгу может использоваться дистанционная лучевая терапия и радиохирургия.
Дистанционная лучевая терапия может проводиться с использованием различных режимов фракционирования дозы до суммарной очаговой дозы, эквивалентной 36–40 Гр:
РОД 2 Гр 1раз в день 5раз в неделю 18–20 фракций, СОД 36–40Гр
РОД 3 Гр 1 раз в день 5 раз в неделю 10 фракций, СОД 30 Гр
РОД 4 Гр 1 раз в день 5 раз в неделю 6 фракций, СОД 24 Гр.
Вторым этапом возможно проведение локального облучения резидуальных метастатических очагов до суммарной очаговой дозы, эквивалентной 60 Гр за весь курс лучевого лечения. Облучение может проводиться либо локальными полями в условиях 3D планирования, либо при наличии соответствующего радиотерапевтического оборудования с использованием стереотаксической радиохирургиии.
При продолженном росте метастазов в головном мозгу вопрос о тактике специального лечения (хирургическое, лучевое, химиотерапевтическое) решается консилиумом в составе врача-нейрохирурга, врача-радиационного онколога и врача-онколога индивидуально для каждого пациента.
35.3. Схемы лучевой терапии основных форм опухолей ЦНС (таблица 35.4).
Таблица 35.4. Схемы лучевой терапии основных форм опухолей ЦНС
|
Гистологический тип опухоли
|
GTV, CTV
|
РОД, СОД (Гр)
|
|
Grade III–IV астроцитомы,
олигодендроглиомы,
смешанные глиомы,
нейрональные и смешанные
нейроглиальные опухоли
|
GTV
на КТ: опухоль с зоной контрастного усиления
и/или послеоперационная киста;
на МРТ: опухоль с гиперденсивной зоной на Т2
взвешенных снимках (локальные поля).
CTV=GTV+2 см – при полном удалении
опухоли, +3 см при частичном удалении
опухоли, включая зону перифокального отека
(расширенные поля)
CTV=GTV+1 см при полном удалении опухоли,
+2 см при частичном удалении опухоли
(локальные поля)
|
РОД 2; СОД 46 или РОД
1,8; СОД 50,4
РОД 2; СОД 14 или РОД
1,8; СОД 9 (До СОД 59,4–
60 Гр за весь курс лечения)
|
|
Grade I–II астроцитомы,
олигодендроглиомы,
смешанные глиомы,
нейрональные и смешанные
нейроглиальные опухоли
|
GTV=Объем опухоли с зоной контрастного
усиления и/или послеоперационная киста
CTV=GTV+1 см при полном удалении опухоли,
+2 см при частичном удалении опухоли
|
РОД 1,8;
СОД 50,4–54
|
|
Grade I–II
Менингиома
|
GTV=Объем опухоли с зоной контрастного
усиления
CTV=GTV+ 2 см
|
РОД 1,8
СОД 54
|
|
Grade III
Менингиома
|
GTV=Объем опухоли с зоной контрастного
усиления и/или послеоперационная киста
CTV=GTV+2 см (до СОД 45–46 Гр), далее +
1 см (до СОД 59,4–60Гр) при тотальном
удалении и + 3 см (до СОД 45–46 Гр), далее +
2 см (до СОД 59,4–60 Гр) при частичном
удалении
|
РОД 1,8–2
СОД 59,4–60
|
|
Эмбриональные опухоли,
эпендимомы (spine +),
пинеобластома Grade IV
|
Краниоспинальное облучение (КСО)
CTV=Объем всего головного и спинного мозга
(нижняя Граница спинно-мозгового поля
находится на уровне SIII)
Локальное облучение
GTV=Объем опухоли с зоной контрастного
усиления либо послеоперационная киста
CTV=GTV+1–2 см (отступ для опухолей
основания черепа должен составлять 1 см;
отступ для опухолей спинномозгового канала-
1,5–2 см)
|
РОД 1,8; СОД 36
РОД 1,8–2; СОД 18–19,8
(до 54–55,8 для головного
мозга за весь курс лучевой
терапии) и СОД 9 (до СОД
45 для спинного мозга за
весь курс лучевой терапии)
|
|
Эпендимома (spine –)
|
GTV=Объем опухоли с зоной контрастного
усиления и/или послеоперационная киста
CTV=GTV 1–2 см
|
РОД 1,8–2; СОД 54–59,4
|
|
Опухоли ствола головного
мозга
|
GTV=Объем опухоли с зоной контрастного
усиления
CTV=GTV+2 см
|
РОД 1,8; СОД 54
|
|
Опухоли гипофиза
|
GTV=Объем опухоли с зоной контрастного
усиления
CTV=GTV+0,5 см (при планировании с
использованием КТ и МРТ) либо +1 см (при
планировании с использованием только КТ)
|
РОД 1,8;
СОД 50,4–54
|
|
Опухоли спинного мозга
|
GTV=Объем опухоли с зоной контрастного
усиления
CTV=GTV+2–3 см
|
РОД 1,8–2;
СОД 45–50,4
|
|
Первичные лимфомы ЦНС
|
CTV=Объем всего головного мозга
(краниальное облучение)
GTV=Объем опухоли с зоной контрастного
усиления
CTV= GTV+1–2 см (локальное облучение)
|
РОД 1,8–2;
СОД 36- 45
РОД 1,8 СОД 9 (до СОД 45
за весь курс лучевой
терапии)
|
|
Герминоклеточные опухоли
локальные поля (независимо от
наличия или отсутствия
диссеминации)
|
При диссеминации по спинномозговой
жидкости (ДСМЖ):
CTV=Объем всего головного и спинного мозга
(начальные поля)
При отсутствии ДСМЖ:
CTV = желудочковая система (начальные поля)
GTV=Объем опухоли с зоной контрастного
усиления (локальные поля)
CTV=GTV+2 см
|
РОД 1,8; СОД 36
РОД 1,8; СОД 36
РОД 1,8; СОД 23,4 (до 59,4
для головного мозга за весь
курс лучевой терапии) и
СОД 9 (до СОД 45 для
спинного мозга за весь курс
лучевой терапии)
|
|
Опухоли паренхимы
шишковидной железы (Grade IIIII),
опухоли селлярной области
|
GTV=Объем опухоли с зоной контрастного
усиления
CTV=GTV+2 см
|
РОД 2; СОД 54 или
РОД 1,8; СОД 59,4
|
|
Метастатические опухоли
головного мозга (при наличии
метастатического поражения
других органов вопрос о
специальном лечении решается
индивидуально)
|
CTV=Объем всего головного мозга
При остаточном солитарном очаге возможно
дополнительное локальное облучение:
CTV= объем опухоли + 1 см
|
РОД 4; СОД 20–24 или РОД
3; СОД 30
до СОД 50–60
|
Примечание:
GTV – видимый (определяемый при КТ и/или МРТ) объем опухоли;
CTV – клинический объем облучения. Включает GTV + объем возможного субклинического распространения опухоли
PTV – планируемый объем облучения. Формируется путем добавления к CTV дополнительного объема с учетом погрешности при укладке пациента и планировании лучевого лечения. Обычно PTV=CTV+0,5 см
Информация
Источники и литература
-
Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2006-2019
- Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2006-2019 -
-
www.minzdrav.gov.by
- www.minzdrav.gov.by -
Информация
ГЛАВА 2
ОЦЕНКА ОБЩЕГО СОСТОЯНИЯ ОНКОЛОГИЧЕСКОГО ПАЦИЕНТА
Общее состояние онкологического пациента (Performance status) рекомендовано оценивать по индексу Карновского (0–100 баллов) или шкале ECOG (0–4 балла) (таблицы 2.1, 2.2).
Таблица 2.1. Индекс Карновского
Таблица 2.1. Индекс Карновского
|
Нормальная физическая активность, пациент не нуждается в специальном уходе
|
100 баллов | Состояние нормальное, нет жалоб и симптомов заболевания |
| 90 баллов | Нормальная активность сохранена, но имеются незначительные симптомы заболевания | |
| 80 баллов | Нормальная активность возможна при дополнительных усилиях, при умеренно выраженных симптомах заболевания | |
|
Ограничение нормальной активности при сохранении полной независимости пациента
|
70 баллов | Пациент обслуживает себя самостоятельно, но не способен к нормальной деятельности или работе |
| 60 баллов | Пациент иногда нуждается в помощи, но в основном обслуживает себя сам | |
| 50 баллов | Пациенту часто требуется помощь и медицинское обслуживание | |
|
Пациент не может обслуживать себя самостоятельно, необходим уход или госпитализация
|
40 баллов | Большую часть времени пациент проводит в постели, необходим специальный уход и посторонняя помощь |
| 30 баллов | Пациент прикован к постели, показана госпитализация, хотя терминальное состояние не обязательно | |
| 20 баллов | Сильные проявления болезни, необходима госпитализация и поддерживающая терапия | |
| 10 баллов | Умирающий пациент, быстрое прогрессирование заболевания | |
| 0 баллов | Смерть |
Таблица 2.2. Оценка статуса пациента по шкале ECOG
| Оценка | |
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания (90–100 баллов по шкале Карновского) |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70–80 баллов по шкале Карновского) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно – в вертикальном положении (50–60 баллов по шкале Карновского) |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования (30–40 баллов по шкале Карновского) |
| 4 | Пациент, совершенно не способен к самообслуживанию, прикован к креслу или постели (10–20 баллов по шкале Карновского) |
Приложение
ТАБЛИЦЫ СООТВЕТСТВИЯ «СТАДИЯ-TNM» ДЛЯ РЯДА ЛОКАЛИЗАЦИЙ: ТОНКИЙ КИШЕЧНИК, АМПУЛА ФАТЕРОВА СОСКА, ТИМОМА, МЕЗОТЕЛИОМА ПЛЕВРЫ, КАРЦИНОМА МЕРКЕЛЯ КОЖИ, КОРА НАДПОЧЕЧНИКА
ТОНКИЙ КИШЕЧНИК C17
Таблица 1. Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1, Т2 | N0 | M0 |
| Стадия IIА | Т3 | N0 | M0 |
| Стадия IIB | T4 | N0 | M0 |
| Стадия IIIA | Любая Т | N1 | M0 |
| Стадия IIIB | Любая Т | N2 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
АМПУЛА ФАТЕРОВА СОСКА C24.1
Таблица 2. Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия IA | Т1a | N0 | M0 |
| Стадия IB | Т1b, Т2 | N0 | M0 |
| Стадия IIА | Т3a | N0 | M0 |
| Стадия IIB | Т3b | N0 | M0 |
| Стадия IIIA | Т1a, Т1b, Т2, T3 | N1 | M0 |
| Стадия IIIB | Т4 | Любая N | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
ТИМОМА C37, C38.1-3
Таблица 3. Группировка по стадиям
| Стадия I | T1 | N0 | M0 |
| Стадия II | T2 | N0 | M0 |
| Стадия IIIА | T3 | N0 | M0 |
| Стадия IIIB | T4 | N0 | M0 |
| Стадия IVA | Любая Т |
N1
N0, N1
|
M0
M1A
|
| Стадия IVB | Любая Т | Любая N | M1B |
МЕЗОТЕЛИОМА ПЛЕВРЫ C45.0
Таблица 4. Группировка по стадиям
| Стадия IA | T1 | N0 | M0 |
| Стадия IB | T2, T3 | N0 | M0 |
| Стадия II | T1, T2 | N1 | M0 |
| Стадия IIIА | T3 | N1 | M0 |
| Стадия IIIB | T1, T2, T3, T4 |
N1 Любая N |
M0 |
| Стадия IV | Любая Т | Любая N | M1 |
КАРЦИНОМА МЕРКЕЛЯ C44, C63.2
Таблица 5а. Группировка по стадиям клиническая
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1 | N0 | M0 |
| Стадия IIА | T2, Т3 | N0 | M0 |
| Стадия IIB | Т4 | N0 | M0 |
| Стадия III | Любая Т | N1, N2, N3 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
Таблица 5б. Группировка по стадиям патоморфологическая
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1 | N0 | M0 |
| Стадия IIА | Т2, T3 | N0 | M0 |
| Стадия IIB | Т4 | N0 | M0 |
| Стадия IIIA |
Т0
Т1, Т2, T3, Т4
|
N1b
N1a
|
M0 |
| Стадия IIIB | Любая Т | N1, N2, N3 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
КОРА НАДПОЧЕЧНИКА C74.0
Таблица 6. Группировка по стадиям
| Стадия I | Т1 | N0 | M0 |
| Стадия II | Т2 | N0 | M0 |
| Стадия III |
Т1, T2
Т3, T4
|
N1
N0, N1
|
M0 |
| Стадия IV | Любая Т | Любая N | M1 |
Под редакцией
д-р мед. наук, проф. О.Г.Суконко,
д-р мед. наук, проф., член-корр. НАН Беларуси С.А.Красный
Авторский коллектив:
Антоненкова Нина Н., д.м.н., доц.;
Ануфреенок И.В., к.м.н.;
Артемова Н.А., д.м.н., доц.;
Баранов А.Ю., к.м.н.;
Баранов Е.В., к.м.н.;
Бармотько М.А.;
Грачев Ю.Н., к.м.н.;
Демешко П.Д., д.м.н.;
Демидчик Ю.Е., д.м.н., проф.;
Дзюбан В.П.;
Доломанова Е.В.;
Дубровский А.Ч., к.м.н.;
Евмененко А.А.;
Ермаков Н.Б., к.м.н.;
Жаврид Э.А., д.м.н., проф.;
Жарков В.В, д.м.н., проф.;
Жиляева Е.П.;
Жуковец А.Г., к.м.н.;
Зеленкевич И.А., к.м.н.;
Ильин И.А., к.м.н.;
Караник В.С., к.м.н.;
Карман А.В., к.м.н., доц.;
Киселев П.Г., к.м.н.;
Клименко Д.П.;
Колядич Г.И., к.м.н.;
Кондратович В.А.;
Котов А.А., к.м.н.;
Кохнюк В.Т., д.м.н., проф.;
Красный С.А., д.м.н., проф.;
Крутилина Н.И., д.м.н., проф.;
Курченков А.Н., к.м.н.;
Курчин В.П., д.м.н.;
Левин Л.Ф.;
Леонова Т.А.;
Мавричев А.С., д.м.н., проф.;
Мавричев С.А., к.м.н.;
Малькевич В.Т., д.м.н., доц.;
Маньковская С.В.;
Матылевич О.П., к.м.н.;
Минайло И.И., к.м.н.;
Минич А.А., к.м.н.;
Моисеев П.И., к.м.н.;
Набебина Т.И., к.м.н.;
Науменко Л.В., к.м.н.;
Океанов А.Е., д.м.н., проф.;
Пархоменко Л.Б., к.м.н., доц.;
Петрушенко Ю.И.;
Писаренко А.М.;
Поляков С.Л., к.м.н.;
Портянко А.С., д.м.н., доц.;
Прохорова В.И., д.м.н., проф.;
Ребеко И.В., к.м.н.;
Ревтович М.Ю., к.м.н.;
Ролевич А.И., д.м.н.;
Рындин А.А.;
Рябчевский А.Н.;
Синайко В.В., к.м.н.;
Субоч Е.И., к.м.н.;
Суколинская Е.В., к.м.н.;
Суконко О.Г., д.м.н., проф.;
Суслова В.А., к.м.н.;
Тризна Н.М., к.м.н.;
Фридман М.В., д.м.н.;
Шаповал Е.В., д.м.н.;
Шмак А.И., д.м.н.
Список сокращений:
CTV – клинический объем облучения
GTV – определяемый объем опухоли
ICD – Международная классификация болезней
ITC – отдельные опухолевые клетки
PTV – планируемый объем облучения
UICC – Международный противораковый союз
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
АЧТВ – активированное частичное тромбопластиновое время
ВАТС – видео-ассистированной тораскопии
ВОЗ – Всемирная организация здравоохранения
ВПЧ – вирус папилломы человека
ВЯВ – внутренняя яремная вена;
ГИСО – гастроинтенстинальные стромальные опухоли
ГПДР – гастропанкреатодуоденальная резекция
ГЦР – гепатоцеллюлярный рак
ЖКТ – желудочно-кишечный тракт
ИГХ – иммуногистохимическое исследование
ИОУЗИ – интраоперационное УЗИ
КТ – компьютерная томография
ЛДГ – лактатдегидрогеназа
МНО – международное нормализованное отношение
МРТ – магнитно-резонансная томография
МСКТ – многослойная компьютерная томография
ОГК – органы Грудной клетки
ПВ – протромбиновое время
ПЖ – поджелудочная железа
ПЭТ – позитронно-эмиссионная томография
РЖП – рак желчного пузыря
РОД – разовая облучающая доза
РПК – рак прямой кишки
РПХГ – ретроградная панкреатохолангиография
СОД – суммарная облучающая доза
ТВ – тромбиновое время
ТДПЭ – тотальная дуоденопанкреатэктомия
УЗИ – ультразвуковое исследование
ФВД – функция внешнего дыхания
ФДГ – фтордезоксиглюкоза
ФЭГДС – фиброгастродуоденоскопия
ХЦР – холангиоцеллюлярного рака
ЦНС – центральная нервная система
ЧЧХГ – чрескожная чреспеченочная холангиография
ЧЭИ – чрескожная этаноловая инъекция
ЩФ – щелочная фосфатаза
ЭВВ – эмболизация воротной вены
ЭКГ – электрокардиограмма
ЭУЗИ – эндоскопическое ультразвуковое исследование
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.