Диагностика и лечение злокачественных новообразований: Неходжкинские лимфомы
 Версия: Клинические протоколы 2006-2019 (Беларусь)
Версия: Клинические протоколы 2006-2019 (Беларусь)
Диффузная неходжкинская лимфома (C83), Другие и неуточненные типы неходжкинской лимфомы (C85), Периферические и кожные t-клеточные лимфомы (C84), Фолликулярная [нодулярная] неходжкинская лимфома (C82)
Онкология
Общая информация
Краткое описание
ПОСТАНОВЛЕНИЕ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ
РЕСПУБЛИКИ БЕЛАРУСЬ
6 июля 2018 г. № 60
Об утверждении клинического протокола «Алгоритмы диагностики и лечения злокачественных новообразований»
На основании подпункта 8.3 пункта 8 Положения о Министерстве здравоохранения Республики Беларусь, утвержденного постановлением Совета Министров Республики Беларусь от 28 октября 2011 г. № 1446 «О некоторых вопросах Министерства здравоохранения и мерах по реализации Указа Президента Республики Беларусь от 11 августа 2011 г. № 360», Министерство здравоохранения Республики Беларусь
ПОСТАНОВЛЯЕТ:
1. Утвердить прилагаемый клинический протокол «Алгоритмы диагностики и лечения злокачественных новообразований».
2. Начальникам главных управлений по здравоохранению областных исполнительных комитетов, председателю комитета по здравоохранению Минского городского исполнительного комитета, руководителям государственных организаций, подчиненных Министерству здравоохранения Республики Беларусь, обеспечить проведение диагностики, лечение и профилактику заболеваний в соответствии с клиническим протоколом.
3. Настоящее постановление вступает в силу после его официального опубликования.
Министр В.А.Малашко
УТВЕРЖДЕНО
Постановление
Министерства здравоохранения
Республики Беларусь
06.07.2018 № 60
КЛИНИЧЕСКИЙ ПРОТОКОЛ «Алгоритмы диагностики и лечения злокачественных новообразований»
ГЛАВА 40
НЕХОДЖКИНСКИЕ ЛИМФОМЫ (С82-С85)
Классификация
ГЛАВА 1
ОБЩИЕ СВЕДЕНИЯ О TNM КЛАССИФИКАЦИИ
Система TNM для классификации злокачественных опухолей была разработана французом Р. Denoix в 1943–1952 гг. В 1953 г. Комитет по номенклатуре опухолей и статистике, организованный UICC, и Международная комиссия по стадированию рака достигли соглашения по классификации анатомической распространенности опухолей на основе системы TNM. В 1954 г. Международный противораковый союз (UICC) создает Комитет по клинической классификации и прикладной статистике, который в 1958 г. публикует первые рекомендации по клинической классификации рака молочной железы и гортани.
В результате многолетней деятельности Комитета в 1968 г. издается первая редакция TNM классификация злокачественных опухолей. По мере разработки классификации для новых локализаций опухолей и уточнения более ранних рекомендаций в 1974, 1978, 1987, 1997, 2002 и 2009 гг. публикуются 2-я, 3-я, 4-я, 5-я, 6-я и 7-я редакции.
Настоящая (8-я) редакция правил классификации и стадирования полностью соответствуют 8-й редакции руководства по стадированию рака и одобрена всеми национальными TNM комитетами.
В данном руководстве используются морфологические формы злокачественных новообразований в соответствии с классификацией МКБ-О-3, адаптированной под МКБ-10 (проставление кодов врачом-патологом в морфологическом заключении обязательно).
UICC признает необходимость постоянства TNM классификации в течение определенного периода времени, необходимого для накопления данных. Поэтому классификация не должна изменяться до тех пор, пока не будут сделаны крупные достижения в диагностике и лечении злокачественных опухолей, требующие пересмотра настоящей классификации.
Общие правила системы TNM.
TNM система для описания анатомической распространенности болезни основывается на оценке 3 компонентов:
Т – распространение первичной опухоли;
N – отсутствие или наличие метастазов в регионарных лимфатических узлах и степень их поражения;
М – отсутствие или наличие отдаленных метастазов.
К этим трем компонентам добавляются цифры, указывающие на распространенность злокачественного процесса:
Т0, Т1, Т2, Т3, Т4; N0, N1, N2, N3; M0, M1.
В действительности система является «стенографическим» описанием распространенности злокачественной опухоли.
Общие правила классификации, применяемые для опухолей всех локализаций, следующие:
Для каждой локализации имеются две классификации:
Клиническая классификация, обозначаемая TNM (или cTNM). Она основывается на результатах обследования до лечения. Эти данные получают при врачебном осмотре, лучевой диагностике, эндоскопии, биопсии, хирургическом диагностическом вмешательстве и других методах обследования.
Патологическая классификация, обозначаемая pTNM. Она основана на данных обследования до лечения, дополненных или измененных в результате хирургического вмешательства и морфологического исследования. Гистологическая оценка первичной опухоли включает резецированную опухоль или биопсию, позволяющую оценить наивысшую Т категорию. Гистологическая оценка регионарных лимфатических узлов включает исследование удаленных узлов в количестве, адекватном для установления отсутствия метастазов в регионарных лимфатических узлах (pN0) и достаточном для оценки наиболее высокой pN категории. Отдаленные метастазы должны быть подтверждены при микроскопическом исследовании (рМ).
После обозначения Т, N, М и/или рТ, pN и рМ категорий они могут группироваться по стадиям. TNM классификация и стадии, установленные однажды, должны оставаться неизменными в медицинских документах. Клиническая стадия служит основой для выбора лечения, тогда как патологическая стадия обеспечивает наиболее точные данные для оценки прогноза и расчета конечных результатов.
При сомнении в правильности оценки Т, N или М категории должно быть выбрано меньшее значение категории, (т.е. меньшее распространение опухоли).
В случае множественных опухолевых очагов в органе должна классифицироваться опухоль с более высокой Т категорией, а в скобках указываться множественность (т) или количество опухолей, например: Т2(т) или Т1(5). При одновременном поражении парных органов каждая опухоль должна классифицироваться отдельно. При опухолях печени, яичников и фаллопиевой трубы множественные очаги поражения являются критерием Т классификации.
Выявление второй опухоли в одном органе в течение 2 месяцев с момента выявления первой нужно расценивать как синхронное поражение.
TNM категории и стадия могут подразделяться или объединяться для клинических и научных целей (например, любые Т, N или М могут быть разбиты на подгруппы). Однако рекомендованные основные обозначения не должны изменяться.
Анатомические области и локализации.
Локализации в этой классификации обозначаются кодовым номером Международной классификации онкологических болезней.
TNM/pTNM классификация.
Используются следующие общие определения:
Т/рТ – первичная опухоль:
TX/рTX – первичная опухоль не может быть оценена;
Т0/рТ0 – нет доказательств первичной опухоли;
Tis/pTis – рак «in situ»;
Т1/рТ1, Т2/рТ2, ТЗ/рТЗ, Т4/рТ4 – размер или местное распространение опухоли в порядке увеличения.
N/pN – регионарные лимфатические узлы:
Nx/pNx – регионарные лимфатические узлы не могут быть оценены;
N0/pN0 – отсутствуют метастазы в регионарных лимфоузлах;
Nl/pNl, N2/pN2, N3/pN3 – возрастающее поражение регионарных лимфатических узлов.
Непосредственное распространение первичной опухоли на лимфатические узлы классифицируется как метастазы в лимфатических узлах. Метастаз в любом лимфоузле, не относящемся к регионарному, расценивается как отдаленный метастаз.
Опухолевый узел в области регионарных лимфатических узлов, не имеющий гистологических признаков лимфоузла, классифицируется как метастаз в регионарном лимфатическом узле, если имеет форму и ровный контур лимфатического узла. Опухолевый узел с неровным контуром классифицируется в рТ категории.
Когда размер является критерием pN классификации, производится измерение метастатического очага, а не всего лимфатического узла.
Случаи с микрометастазами, когда размеры метастазов не превышают 0,2 см, могут обозначаться добавлением «(mi)», например: pNl(mi) или pN2(mi).
М/рМ – отдаленные метастазы:
МХ/рМХ – отдаленные метастазы не могут быть оценены;
М0/рМ0 – нет отдаленных метастазов;
М1/рМ1 – имеются отдаленные метастазы;
Категория М может быть в дальнейшем специфицирована в соответствии со следующими обозначениями (таблица 1.1):
Таблица 1.1
| Легкие | PUL | Костный мозг | MAR |
| Кости | OSS | Плевра | PLE |
| Печень | HEP | Брюшина | PER |
| Головной мозг | BRA | Надпочечники | ADR |
| Лимфоузлы | LYM | Кожа | SKI |
| Другие | ОТН |
Подразделения TNM
Главные категории в классификации могут иметь подразделения, придающие критерию большую специфичность (например; Tla, lb или N2a, 2b).
Сигнальный лимфоузел
Это первый лимфоузел, получающий лимфу из первичной опухоли. Если в нем имеется метастаз, то и другие лимфоузлы могут быть поражены. Если этот лимфоузел не поражен, то и наличие метастазов в других узлах маловероятно. Иногда встречаются более одного сигнальных лимфоузлов.
При оценке сигнального лимфоузла применяются следующие определения:
Главные категории в классификации могут иметь подразделения, придающие критерию большую специфичность (например; Tla, lb или N2a, 2b).
Сигнальный лимфоузел
Это первый лимфоузел, получающий лимфу из первичной опухоли. Если в нем имеется метастаз, то и другие лимфоузлы могут быть поражены. Если этот лимфоузел не поражен, то и наличие метастазов в других узлах маловероятно. Иногда встречаются более одного сигнальных лимфоузлов.
При оценке сигнального лимфоузла применяются следующие определения:
- pNX(sn) – сигнальный узел не может быть оценен; pN0(sn) – нет поражения сигнального узла;
- pN1(sn) – есть поражение сигнального узла.
Отдельные опухолевые клетки
Отдельные опухолевые клетки (ITC) представляют собой единичные опухолевые клетки или маленькие кластеры клеток не более 0,2 мм в наибольшем измерении. ITC обычно не демонстрируют метастатической активности (пролиферацию или реакцию стромы) или инвазии стенок сосудистого или лимфатического синуса. Случаи с ITC в лимфатических узлах или отдаленных органах и тканях должны классифицироваться как N0 или М0 соответственно.
Это же применимо и к случаям, когда наличие опухолевых клеток или их компонентов подтверждается неморфологическими исследованиями, такими как проточная морфометрия или анализ ДНК.
Случаи с ITC должны анализироваться отдельно.
Классификация ITC:
- pN0 – гистологически не выявляются метастазы в регионарных лимфатических узлах, не проводились исследования по выявлению ITC;
- pN0(i-) – гистологически нет метастазов в регионарных лимфатических узлах, негативные морфологические данные по выявлению ITC;
- pN0(i+) – гистологически нет метастазов в регионарных лимфатических узлах, позитивные морфологические данные по выявлению ITC;
- pN0(mol-) – гистологически нет метастазов в регионарных лимфатических узлах, негативные неморфологические данные по выявлению ITC;
- pN0 (mol+) – гистологически нет метастазов в регионарных лимфатических узлах, неморфологическими методами выявляются ITC.
При исследовании ITC в сигнальном лимфоузле к обозначениям выше приведенной классификации в скобках указывается «(sn)», например: pN0(i+) (sn).
Отдельные опухолевые клетки, выявленные в костном мозгу морфологическими методами, классифицируются аналогично схеме для N, например: pM0(i+), а неморфологическими – pM0(mol+).
Гистопатологическая дифференцировка.
Это стадирование позволяет оценить степень агрессивности опухолей некоторых гистологических типов и может влиять на прогноз и выбор лечения.
Для большинства локализаций выделяется 4 степени дифференцировки опухолей:
- G1 – хорошо дифференцированные;
- G2 – умеренно дифференцированные;
- G3 – низко дифференцированные;
- G4 – недифференцированные.
При наличии различных степеней дифференцировки в опухоли указывается наименее благоприятная степень.
Саркомы костей и мягких тканей классифицируется также с использованием градаций «высокая степень» и «низкая степень» дифференцировки.
Для некоторых форм рака (молочной железы, тела матки, печени) рекомендуются специальные системы стадирования по степеням.
Дополнительные дескрипторы.
Для идентификации особых случаев в TNM/pTNM используются символы m, у, r, а.
Хотя они не влияют на группировку по стадиям, но указывают опухоли, которые должны анализироваться отдельно:
- m – используется для обозначения множественных опухолей одной локализации;
- у – в тех случаях, когда классификация приводится в течение или после проведения комбинированного (многокомпонентного) лечения, cTNM или pTNM категория обозначается префиксом «у», например: ycTNM или ypTNM. При оценке распространения опухоли до начала комбинированного лечения символ «у» не исключается;
- r – рецидив опухоли после радикального лечения при классификации обозначается префиксом «r» (rcTNM или rpTNM);
- а – применяется для обозначения классификации опухолей, впервые выявленных при аутопсии.
Необязательные дескрипторы.
L – инвазия лимфатических сосудов.
Классифицируется как LX, L0 и L1.
V – инвазия вен.
Классифицируется как VX, VO, VI (микроскопическая инвазия) и V2 (макроскопическая инвазия). Макроскопическое вовлечение стенки вены при отсутствии опухоли в просвете сосуда классифицируется как V2.
С-фактор.
С-фактор или «фактор надежности» отражает достоверность классификации с учетом использованных методов диагностики. Его использование не является обязательным.
Определения С-фактора:
- С1 – данные стандартных диагностических методов (осмотр, пальпация, рентгенологическое исследование, эндоскопическое исследование),
- С2 – данные, полученные при использовании специальных диагностических методов (рентгенологическое исследование в специальных проекциях, томография, компьютерная томография, ультразвуковое исследование, лимфография, ангиография, сцинтиграфия, магнитно-резонансная томография, ПЭТ/КТ, эндоскопия, биопсия, цитологическое исследование);
- С3 – данные хирургического диагностического вмешательства, включая биопсию и цитологическое исследование;
- С4 – данные, полученные после радикальной операции и гистологического исследования удаленного препарата;
- С5 – данные патологоанатомического вскрытия.
Степени С-фактора могут использоваться при описании категорий Т, N и М (например: Т3С2, N2C1, М0С2).
Клиническая классификация TNM соответствует CI, С2 и С3 степеням, тогда как pTNM эквивалентна С4.
Классификация остаточных опухолей (R).
TNM/pTNM классификация описывает анатомическую распространенность опухоли без рассмотрения вопросов лечения. R-классификация описывает статус опухоли после лечения. Она отражает эффект лечения и является прогностическим фактором. При R- классификации оценивается не только первичная опухоль, но и остающиеся отдаленные метастазы.
Эта классификация может применяться после хирургического лечения, лучевой или химиотерапии, а также после комбинированного лечения. После консервативного лечения остаточная опухоль оценивается клиническими методами. После хирургического лечения R-классификация требует тесного сотрудничества хирурга и морфолога.
Случаи с макроскопически определяемой остаточной опухолью (R2) могут подразделяться на R2a (без микроскопического подтверждения) и R2b (микроскопически подтвержденные).
R0 группа может включать пациентов как с М0, так и с Ml. В последнем случае отдаленные метастазы, как и первичная опухоль, должны быть полностью удалены. Трудности с R-классификацией могут возникнуть при удалении опухоли по частям, а не «en blok». В таких случаях уместна категория RX.
Наличие микроскопически определяемой инвазивной опухоли по линии резекции классифицируется как R1, а в случае неинвазивной карциномы – R1 (is).
Группировка по стадиям.
Комбинация всех значений дескрипторов TNM позволяет получить 24 категории TNM, описывающие распространенность опухоли. Для табличного представления данных и анализа эти категории объединяются в ограниченное количество групп – стадий. Каждая стадия более или менее однородна по прогнозу и критерию выживаемости относящихся к ней пациентов.
Карцинома «in situ» относится к стадии 0, а опухоли с отдаленными метастазами – к стадии IV (за исключением некоторых локализаций, например, папиллярного и фолликулярного рака щитовидной железы).
Для патологической стадии необходимо морфологическое исследование достаточного количества тканей, позволяющее оценить наибольшее значение Т и N. Если же имеется морфологическое подтверждение отдаленных метастазов, то и классификация (рМ1) и стадия являются патологическими.
Термин «стадия» употребляется только для комбинаций Т, N, М или рТ, pN или рМ категорий. Необходимо избегать выражений типа «Т стадия» или «N стадия»
НЕХОДЖКИНСКИЕ ЛИМФОМЫ (С82-С85)
40.2. Гистологическая классификация
Диагноз заболевания устанавливается на основании морфологического исследования опухолевой ткани. Для гистологической диагностики рекомендуется проводить эксцизионную биопсию лимфоузла. На исследование берется самый ранний из появившихся лимфатических узлов, который удаляется полностью. При удалении узел не должен быть поврежден механически. Нежелательно для гистологического исследования использовать паховые лимфатические узлы, если имеются вовлеченные в процесс другие Группы лимфатических узлов. Пункционная биопсия для верификации диагноза у первичных пациентов недостаточна. Однако у пациентов, требующих немедленного лечения, допустимо на первом этапе руководствоваться результатами цитологического исследования.
Проводится гистологическое исследование и иммунофенотипирование опухоли, а также молекулярно-генетическое исследование. Иммунофенотипирование опухоли может проводиться с помощью проточной цитометрии или иммуногистохимических методов. Преимуществом проточной цитометрии является возможность быстрого получения результата и оценка большого числа антигенов, недостаток метода – отсутствие корреляции с гистоархитектурой и клеточными характеристиками опухоли.
Преимуществом иммуногистохимического исследования является возможность оценки экспрессии антигенов с учетом морфологических признаков, также иммуногистохимическое исследование позволяет работать с фиксированной и архивной тканью (из парафиновых блоков).
Для иммуногистохимического исследования (на срезах из парафиновых блоков) рекомендуется следующий набор антител: CD1a, CD2, CD3, CD4, CD5, CD7, CD8, CD10, CD15, CD20, CD21, CD23, CD30, CD43, CD45, CD56, CD68, CD79A, CD138, CD246 (ALK), bcl-2, bcl-6, PAX5, EMA, cyclinD1, TdT, Ki 67, MPO, EBV, Fascin, granzymeB, Ig легких и тяжелых цепей.
Целью иммунофенотипирования является определение линейной принадлежности опухоли (В- или Т-клеточной) и наличие клональной рестрикции легких цепей В-клеточного рецептора (каппа или лямбда), а также уровня нарушения клеточной дифференцировки и сродства опухолевой ткани определенной анатомической зоне нормального лимфатического узла. Этот метод исследования рассматривается как наиболее высокоинформативный компонент комплексной диагностики НХЛ.
В настоящее время в клинической практике для характеристики вариантов НХЛ используется классификация ВОЗ 2016 года.
Назначение проведения иммуногистохимического исследования и количество используемых маркеров в каждой конкретной ситуации определяет морфолог и только на основании данных световой микроскопии микропрепаратов, окрашенных гематоксилином и эозином, с учетом результатов клинико-лабораторных исследований. В каждом конкретном случае нет необходимости использовать полный набор иммуногистохимических маркеров. Назначение молекулярно-генетического исследования также проводится морфологом, который интерпретирует полученные данные с результатами морфологии и иммунофенотипа и дает последующее заключение. Молекулярно-генетическое исследование выполняется только высококвалифицированными специалистами и может проводиться только в условиях лабораторий, оснащенных специальным оборудованием. Иммунофенотипирование методом проточной циторометрии проводится с использованием периферической крови, костного мозга, нативного лимфатического узла и др. биологического материала в комплексной дифференциальной диагностики. Выбор маркеров в каждой конкретной ситуации определяет врач лабораторной диагностики с учетом результатов клинико-лабораторных исследований.
Адаптированная классификация неходжкинских лимфом согласно рекомендациям ВОЗ 2016 года (таблица 40.2).
Таблица 40.2. Адаптированная классификация неходжкинских лимфом
|
В-клеточные лимфомы
|
Т-клеточные и NK-клеточные лимфомы
|
|
Лимфомы из предшественников В-клеток:
В-лимфобластная лимфома/лейкоз9811/3
|
Лимфомы из предшественников Т-клеток:
Т-лимфобластная лимфома/лейкоз9837/3
|
|
Лимфомы из зрелых В-клеток:
Хронический лимфоцитарный лейкоз/лимфома из малых лимфоцитов9823/3
Моноклональный В-клеточный лимфоцитоз9823/1
В-клеточный пролимфоцитарный лейкоз9833/3
Лимфома из клеток маргинальной зоны селезенки9689/3
Волосатоклеточный лейкоз9940/3
Лимфоплазмоцитарная лимфома9671/3
Макроглобулинемия Вальденстрема9761/3
Болезнь μ-тяжелых цепей9762/3
Болезнь γ-тяжелых цепей9762/3
Болезнь -тяжелых цепей9762/3
Плазмоклеточная миелома9732/3
Солитарная плазмоцитома кости9731/3
Внекостная плазмоцитома9734/3
Экстранодальная лимфома из клеток маргинальной зоны, ассоциированная с лимфоидной тканью слизистой оболочки (MALT-лимфома)9699/3
Лимфома из клеток маргинальной зоны лимфатического
узла9699/3
Лимфома из клеток маргинальной зоны
лимфатического узла детского возраста9699/3
Фолликулярная лимфома9690/3
Фолликулярное новообразование in situ9695/1
Фолликулярная лимфома, grade 1 9695/3
Фолликулярная лимфома, grade 2 9691/3
Фолликулярная лимфома, grade39698/3
Фолликулярная лимфома дуоденального типа9690/3
Фолликулярная лимфома с транслокацией 1р369690/3
В-крупноклеточная лимфома с перестройкой гена IRF49698/3
Педиатрического типа фолликулярная лимфома (у взрослых)9690/3
Первичная кожная центрофолликулярная лимфома 9597/3
Лимфома из клеток мантийной зоны9673/3
Неоплазия из клеток мантийной зоны in situ9673/1
Диффузная В-крупноклеточная лимфома (ДВККЛ), неуточненная9680/3
Вариант из В-клеток зародышевого центра9680/3
Вариант из активированных В-клеток9680/3
В-крупноклеточная лимфома, богатая Т- клетками/гистиоцитами9688/3
Первичная ДВККЛ центральной нервной системы9680/3
Первичная ДВККЛ кожи нижних конечностей (legtype)9680/3
EBV-позитивная ДВККЛ, неуточненная 9680/3
ДВККЛ, ассоциированная с хроническим воспалением9680/3
Лимфоматоидный Гранулематоз, grade 1-2 9766/1
Лимфоматоидный Гранулематоз, grade3 9766/3
Первичная медиастинальная В-крупноклеточная лимфома (тимуса)9679/3
Интраваскулярная В-крупноклеточная лимфома9712/3
ALK-позитивная В-крупноклеточная лимфома9737/3
Плазмобластная лимфома9735/3
Первичная экссудативная лимфома9678/3
HHV8-позитивная ДВККЛ, неуточненная9738/3
Лимфома Беркитта9687/3
В-клеточная лимфома высокой степени злокачественности, с перестройкой генов MYC и BCL2 и/или BCL6 (double/triplehit)9680/3
В-клеточная лимфома высокой степени злокачественности, неуточненная9680/3
В-клеточная лимфома, неклассифицируемая, с признаками, промежуточными между ДВККЛ и классической лимфомой Ходжкина9596/3
|
Лимфомы из зрелых Т и NK-клеток: Т-
клеточный пролимфоцитарный лейкоз9834/3
Т-клеточный лейкоз из крупных зернистых лимфоцитов9831/3
Хроническое лимфопролиферативное заболевание из NK-клеток9831/3
Агрессивный лейкоз из NK-клеток9948/3
Системная EBV-позитивная Т-клеточная лимфома детства9724/3
Оспоподобное лимфопролиферативное заболевание9725/1
Т-клеточная лимфома взрослых9827/3
Экстранодальная NK/Т-клеточная лимфома, назальный тип9719/3
Т-клеточная лимфома ассоциированная с энтеропатией9717/3
Мономорфная эпителиотропная интестинальная Т-клеточная лимфома9717/3
Индолентное Т-клеточное лимфопролиферативное заболевание желудочно-кишечного тракта9702/1
Гепатоспленическая Т-клеточная лимфома9716/3
Подкожная панникулоподобная Т-клеточная лимфома9708/3
Грибовидный микоз9700/3
Синдром Сезари9701/3
Первичные кожные CD30-позитивные Т-
клеточные лимфопролиферативные
заболевания9718/3
Лимфоматоидный папулез9718/3
Первичная кожная анапластическая крупноклеточная лимфома9718/3
Первичная кожная gamma-deltaT-клеточная лимфома9726/3
Первичная кожная агрессивная
эпидермотропическая CD8-позитивная цитотоксическая T-клеточная лимфома9709/3
Первичная кожная акральная CD8-позитиваная T-
клеточная лимфома9709/3
Первичная кожная CD4-позитивная мелко/среднеклеточное T-клеточное
лимфопролиферативное заболевание9709/1
Периферическая Т-клеточная лимфома, неспецифическая9702/3
Ангиоиммунобластная Т-клеточная лимфома9705/3
Фолликулярная Т-клеточная лимфома9702/3
Нодальная периферическая Т-клеточная лимфома9702/3
Анапластическая крупноклеточная лимфома,
ALK-позитивная9714/3
Анапластическая крупноклеточная лимфома,
ALK-негативная9715/3
Имплант-ассоциированная анапластическая крупноклеточная лимфома молочной железы9715/3
|
Таблица 40.3. Иммунофенотипирование и генетическое исследование для дифференциальной диагностики лимфом из малых (зрелых) В-лимфоцитов
|
Экспрессия пан-В-клеточных антигенов (CD20, CD79A, PAX5)
|
|||||
|
Минимальный набор антител: CD5, CD10, CD23, BCL2, cyclinD1, BCL6, (CD11с+CD25, CD103)
|
|||||
|
Экспрессия антигенов CD11с+, CD25, CD103 и определение клональности1
|
|||||
|
Определение клональных перестроек генов клеточных рецепторов Т-лимфоцитов (TCRB/TCRG) и генов тяжелых цепей иммуноглобулинов (IGHV)2
|
|||||
|
CD5+
|
CD23+
|
cyclin D1–
|
(t(11;14)–)хронический лимфоцитарный лейкоз/ лимфома из малых лимфоцитов
|
делеция 17p
делеция 11q
делеция 13q
|
|
|
CD23–
|
cyclin D1+
|
(t(11;14)+) лимфома из клеток мантийной зоны
|
реаранжировки
BCL1 (CCND1)/IgH
мутации гена IGHV3
экспрессия SOX113
|
||
|
|
cyclin D1–
|
(t(11;14)–)хронический лимфоцитарный лейкоз/ лимфома из малых лимфоцитов
|
делеция11q
делеция 17p
делеция 13q
|
||
|
|
cyclin D1–
SOX11+
|
t(11;14)–) лимфома из клеток мантийной зоны4
|
экспрессия SOX11
реаранжировки CCND2
|
||
|
CD5–
|
CD10+
|
BCL6+
BCL2+
|
(t(14;18)+) фолликулярная лимфома5
|
реаранжировка IgH/BCL2
|
|
|
|
фолликулярная лимфома с транслокацией 1р36
|
делеция 1р36
|
|||
|
BCL6+
BCL2–
|
(t(14;18)–) педиатрического типа фолликулярная лимфома
|
реаранжировка IgH/BCL2–
|
|||
|
CD103+
CD25+
CD11с+
|
волосатоклеточный лейкоз
|
мутации гена BRAF/
мутации гена MAP2K1
|
|||
|
CD10–
|
CD103–
цитопл. Ig–
|
морфология (узлы из клеток маргинальной зоны, плазмоцитоидность)
клинические признаки (спленомегалия, поражение костного мозга, парапротеинемия)
|
лимфома из клеток
маргинальной зоны6
|
||
|
псевдофолликулярный тип строения
клинические признаки (поражение костного мозга)
|
CD5 – хронический
лимфоцитарный лейкоз
|
|
|||
|
CD103–
цитопл. Ig+
|
морфология (узлы из клеток маргинальной зоны, плазмоцитоидность)
клинические признаки (спленомегалия,
поражение костного мозга, парапротеинемия)
|
лимфо-
плазмоцитарная
лимфома
лимфома из
клеток
маргинальной
зоны
|
мутация
L265P гена
MYD88+
мутации гена
CXCR4
мутация
L265P гена
MYD88–7
|
||
|
Примечания:
1 –определение экспрессии антигенов CD11с+, CD25, CD103, моноклональной пролиферации лимфоцитов с фенотипом CD19+, CD5+, CD23+,CD79+,CD20+ и рестрикции легких цепей иммуноглобулинов проводится методом проточной цитометрии, материалом для которой служит кровь, костный мозг, ткань лимфоузла (гомогенизат); дифференциальным критерием В-ХЛЛ является моноклональный В- клеточный лимфоцитоз >5000 в 1 мкл крови;
2 – определение клональности является дополнительным диагностическим критерием, выявляемым методом ПЦР в образцах опухолевой ткани;
3 –наличие мутаций гена IGHV и отсутствие экспрессии белка SOX11 ассоциированы с индолентным течением заболевания;
4 –лимфома из клеток мантийной зоны в редких случаях может иметь профиль (cyclin D1–, t(11;14)–), диагноз устанавливается только после консультации с экспертами;
5 –профиль (BCL2+, t(14;18)+) отмечается только в 85 % фолликулярных лимфом;
6 – необходимым является определение антител к HBV/HCV
7 – мутация L265P гена MYD88 выявляется в 21 % лимфом из клеток маргинальной зоны
|
|||||
Таблица 40.4. Иммунофенотипирование и генетическое исследование для дифференциальной диагностики лимфом из средних В-лимфоцитов
|
Экспрессия пан-В-клеточных антигенов (CD20, CD79A, PAX5)
|
|||||
|
Рекомендуемый набор антител: CD5, CD10, BCL2, BCL6, cyclinD1, IRF4/MUM1, Ki67
|
|||||
|
Экспрессия В-клеточных антигенов и определение клональности1
|
|||||
|
Определение клональных перестроек генов клеточных рецепторов Т-лимфоцитов (TCRB/TCRG) и генов тяжелых цепей иммуноглобулинов (IGHV)2
|
|||||
|
CD5+
|
cyclin D1+
|
|
бластоидная лимфома из клеток мантийной зоны
|
||
|
cyclin D1–
|
BCL6+/–
IRF4/MUM1+/–
|
CD5+ диффузная В-крупноклеточная лимфома,
неуточненная
|
|||
|
хронический лимфоцитарный лейкоз с увеличенным
количеством пролимфоцитов
|
|||||
|
BCL6–
IRF4/MUM1–
|
лимфома из клеток мантийной зоны
|
||||
|
CD5–
|
CD10+
|
BCL6+
BCL2–
Ki67-95 %
|
реаранжировки
MYC+
BCL2–
BCL6–
|
лимфома Беркитта
|
мутации гена TCF3
мутации гена ID3
антитела к HBV
|
|
BCL6+
BCL2+
|
реаранжировки
MYC+
BCL2+
|
В-клеточная лимфома высокой степени злокачественности с перестройками MYC и BCL2 и/или BCL6
|
double-hit
|
||
|
реаранжировки
MYC+
BCL2+
BCL6+
|
triple-hit
|
||||
|
CD10–
|
BCL6+
BCL2–
IRF4/MUM1–
Ki67>90 %
|
реаранжировки
MYC+
BCL2–
BCL6–
|
лимфома Беркитта?
|
мутации гена
TCF3
мутации гена
ID3
|
|
|
BCL6+/–
BCL2+
IRF4/MUM1+/–
Ki67 60–90 %
|
реаранжировки
MYC+
BCL2+
|
В-клеточная лимфома высокой степени злокачественности с перестройками MYC и BCL2 и/или BCL6
|
double-hit
|
||
|
реаранжировки
MYC+
BCL2+
BCL6+
|
triple-hit
|
||||
|
Примечание:
1 – определение моноклональной пролиферации и фенотипа лимфоцитов, рестрикции легких цепей иммуноглобулинов проводится методом проточной цитометрии, материалом для которой служит кровь, костный мозг, ткань лимфоузла (гомогенизат);
2 – определение клональности является дополнительным диагностическим критерием, выявляемым методом ПЦР в образцах опухолевой ткани.
|
|||||
Таблица 40.5. Иммунофенотипирование и генетическое исследование для дифференциальной диагностики лимфом из крупных В-лимфоцитов
|
Экспрессия пан-В-клеточных антигенов (CD79A, CD20+/–, PAX5+/–)
|
||||
|
Рекомендуемый набор антител: CD5, CD10, BCL6,IRF4/MUM1, cyclin D1, ALK, CD30, CD15, CD138, Ig
|
||||
|
Экспрессия В-клеточных антигенов и определение клональности1
|
||||
|
Определение клональных перестроек генов клеточных рецепторов Т-лимфоцитов (TCRB/TCRG) и генов тяжелых цепей иммуноглобулинов (IGHV)2
|
||||
|
CD5+
|
cyclin D1+
|
плеоморфная лимфома из клеток мантийной зоны
|
||
|
cyclin D1–
|
CD5+ диффузная В-крупноклеточная лимфома, неуточненная
|
|||
|
CD5–
|
CD10+
|
IRF4/MUM1+
|
В-крупноклеточная лимфома с перестройкой IRF4
|
реаранжировка IRF4
|
|
BCL6+
IRF4/MUM1–
|
диффузная В-крупноклеточная лимфома, неуточненная, из В- клеток зародышевого центра
|
|||
|
CD10–
|
BCL6+
IRF4/MUM1–
|
диффузная В-крупноклеточная лимфома, неуточненная, из В- клеток зародышевого центра
|
||
|
BCL6+/–
IRF4/MUM1+
|
диффузная В-крупноклеточная лимфома, неуточненная, тип из активированных В-клеток
|
|||
|
Примечание:
1 –моноклональная пролиферация и фенотип лимфоцитов, рестрикция легких цепей иммуноглобулинов определяются методом проточной цитометрии, материалом для которой служит кровь, костный мозг, ткань лимфоузла (гомогенизат);
2 – определение клональности является дополнительным диагностическим критерием, выявляемым методом ПЦР в образцах опухолевой ткани.
|
||||
Таблица 40.6. Иммунофенотипирование и генетическое исследование для дифференциальной диагностики лимфом из активированных В-лимфоцитов
|
Экспрессия пан-В-клеточных антигенов (CD79A, CD20+/–, PAX5+/–)
|
|||||
|
Рекомендуемый набор антител: CD20, PAX5, CD138, Ig легких и тяжелых цепей, ALK, CD30, CD15, EBV
|
|||||
|
Экспрессия В-клеточных антигенов и определение клональности1
|
|||||
|
Определение клональных перестроек генов клеточных рецепторов Т-лимфоцитов (TCRB/TCRG) и генов тяжелых цепей иммуноглобулинов (IGHV)2
|
|||||
|
CD20+
(PAX5+)
|
EBER–
|
CD30–
|
В-крупноклеточная лимфома, богатая Т-лимфоцитами/ гистиоцитами (может быть BCL6+, IRF4/MUM1–)
|
||
|
диффузная В-крупноклеточная не из В-клеток зародышевого центра
|
|||||
|
CD30+
|
первичная медиастинальная В-крупноклеточная лимфома (может быть BCL6+, IRF4/MUM1–)
|
||||
|
морфология,
промежуточная с лимфомой Ходжкина
|
CD15–
|
первичная медиастинальная В- крупноклеточная лимфома
|
|||
|
CD15+
|
В-клеточная лимфома, неклассифицируемая, с признаками, промежуточными между диффузной В-крупноклеточной лимфомой и классической лимфомой Ходжкина
|
||||
|
EBER+
|
пожилой возраст или иммунодефицитное состояние
|
EBV-позитивная диффузная В-крупноклеточная лимфома
|
|||
|
экстранодальная локализация,
ангиоцентрическое строение, обилие
Т-лимфоцитов
|
лимфоматоидный Гранулематоз
|
||||
|
хроническое воспаление
|
диффузная В-крупноклеточная лимфома, ассоциированная с хроническим воспалением
|
||||
|
EBER–
HHV8+
|
HHV8-позитивная В-крупноклеточная лимфома, неуточненная3(IgM lambda+)
|
||||
|
CD20–
(PAX5–)
IRF4/
MUM1+
|
CD138+/–
|
EBV+/–
HHV8–
|
плазмобластная лимфома
|
реаранжировки MYC
|
|
|
EBV+/–
HHV8+
|
первичная экссудативная лимфома (CD30+)
|
||||
|
EBV–
ALK+
|
ALK-позитивная В-крупноклеточная лимфома (EMA+ ; IgA lambda +)
|
||||
|
ALK–
EBV–
HHV8–
|
анапластическая/плазмобластная миелома/плазмоцитома (IgG/Akappa+/lambda+)
|
||||
|
Примечание:
1 – моноклональная пролиферация лимфоцитов и рестрикция легких цепей иммуноглобулинов определяется методом проточной цитометрии, материалом для которой служит кровь, костный мозг, ткань лимфоузла (гомогенизат);
2 – определение клональности является дополнительным диагностическим критерием, выявляемым методом ПЦР в образцах опухолевой ткани;
3 –необходимым является определение антител к HBV/HCV и количественное определение ДНК EBV
|
|||||
Таблица 40.7. Иммунофенотипирование и генетическое исследование для дифференциальной диагностики В-клеточных лимфом кожной локализации
|
Экспрессия пан-В-клеточных антигенов (CD79A, CD20, PAX5)
|
|||
|
Рекомендуемый набор антител: CD10, BCL2, BCL6, IRF4/MUM1, маркеры ФДК1 (CD21/23)
|
|||
|
Экспрессия В-клеточных антигенов и определение клональности2
|
|||
|
Определение клональных перестроек генов клеточных рецепторов Т-лимфоцитов (TCRB/TCRG) и генов тяжелых цепей иммуноглобулинов (IGHV)3
|
|||
|
CD10+
|
Первичная кожная фолликулярная лимфома
|
||
|
CD10–
|
BCL2–
|
BCL6+
IRF4/MUM1–
(ФДК+/–)
мелкие/средние/крупные клетки
|
первичная кожная центрофолликулярная лимфома (диффузное строение)
|
|
BCL6–
IRF4/MUM1+/–
(ФДК+)
мелкие/средние клетки
|
первичная кожная В-клеточная лимфома из клеток маргинальной зоны
|
||
|
BCL2+
|
BCL6+/–
IRF4/MUM1+
(ФДК–)
крупные круглые клетки
|
первичная кожная В-клеточная диффузная крупноклеточная лимфома нижних конечностей (legtype)
|
|
|
BCL6–
IRF4/MUM1+/–
(ФДК+)
мелкие/средние клетки
|
первичная кожная В-клеточная лимфома из клеток маргинальной зоны
|
||
|
BCL6+
IRF4/MUM1–
(ФДК+, фолликулярное строение)
мелкие/средние/крупные клетки
|
первичная кожная центрофолликулярная лимфома
|
||
|
Примечание:
1 –ФДК – фолликулярные дендритические клетки;
2 – определение моноклональной пролиферации и фенотипа лимфоцитов, рестрикции
легких цепей иммуноглобулинов выполняется методом проточной цитометрии, материалом для которой служит кровь, костный мозг, ткань лимфоузла (гомогенизат);
3 – определение клональности является дополнительным диагностическим критерием, выявляемым методом ПЦР в образцах опухолевой ткани
|
|||
Таблица 40.8. Иммунофенотипирование и генетическое исследование для дифференциальной диагностики Т-клеточных лимфом с анапластической морфологией
|
Экспрессия пан-Т-клеточных антигенов (CD2, CD3, CD5, CD7) при отсутствии экспрессия пан-В-клеточных антигенов (CD79A, CD20)
|
||||
|
Рекомендуемый набор антител: CD30, CD15, PAX5, ALK, EBV-EBER, маркеры ПЦГ1 (perforin, granzymeB, TIA1), IRF4/MUM1
|
||||
|
Экспрессия Т-клеточных антигенов2
|
||||
|
Определение клональных перестроек генов клеточных рецепторов Т-лимфоцитов (TCRB/TCRG) и генов тяжелых цепей иммуноглобулинов (IGHV)3
|
||||
|
CD30+
|
ALK+
|
анапластическая крупноклеточная лимфома, ALK +
|
||
|
ALK–
|
PAX5+
|
диффузная В-крупноклеточная лимфома
(аберрантная экспрессия T-клеточных антигенов)
|
||
|
CD15+
|
классическая лимфома Ходжкина (EBER+/–)
|
|||
|
PAX5–
|
Первичные кожные CD30-позитивные T-клеточные лимфопролиферативные заболевания:
Полиморфное регрессирующее заболевание=лимфоматоидный папулез
Мономорфное прогрессирующее заболевание=первичная кожная
крупноклеточная анапластическая лимфома
Крупноклеточная трансформация Грибовидного микоза
Некожные: анапластическая крупноклеточная лимфома, ALK–
Интестинальная: Т-клеточная лимфома, ассоциированная с энтеропатией (эозинофилия: клинические данные о целиакии);
(CD25+)2 Т-клеточная лимфома/лейкоз взрослых, анапластический крупноклеточный подтип (HTLV1+)1
|
|||
|
CD30–
|
Периферическая Т-клеточная лимфома, неспецифическая
|
|||
|
Примечания:
1 – ПЦГ–протеиныцитотоксическихгранул (perforin, granzyme B, TIA1), коммерческидоступные–granzyme B (DAKO);
2 – определение моноклональной пролиферации и фенотипа лимфоцитов выполняется методом проточной цитометрии, материалом для которой служит кровь, костный мозг, ткань лимфоузла (гомогенизат);
3–определение клональности является дополнительным диагностическим критерием,
выявляемым методом ПЦР в образцах опухолевой ткани.
|
||||
Таблица 40.9. Иммунофенотипирование и генетическое исследование для дифференциальной диагностики Т-клеточных лимфом кожной локализации с неанапластической морфологией
|
Экспрессия пан-Т-клеточных антигенов (CD2, CD3, CD5, CD7) при отсутствии экспрессия пан-В-клеточных антигенов (CD79A, CD20)
|
|||||
|
Рекомендуемый набор антител: CD2, CD5, CD7, CD4, CD8, CD15, CD30, CD56, PAX5, ALK, маркеры ПЦГ1 (perforin, granzymeB, TIA1),CD123, EBV-EBER
|
|||||
|
Экспрессия Т-клеточных и В-клеточныхантигенов2
|
|||||
|
Определение клональных перестроек генов клеточных рецепторов Т-лимфоцитов (TCRB/TCRG) и генов тяжелых цепей иммуноглобулинов (IGHV)3
|
|||||
|
CD30+
|
Первичные кожные CD30-позитивные T-клеточные лимфопролиферативные заболевания
|
||||
|
CD30–
|
Эпидермотропные
|
CD4+
|
(CD2+,CD5+,CD7–,CD8–,ПЦГ–) грибовидный микоз4, синдром Сезари; (HTLV1+)Т-клеточная лимфома/лейкоз взрослых
|
||
|
CD4–
|
CD8+
|
(CD2–,CD5–,CD7+/–,CD56–,ПЦГ+) первичная кожная агрессивная эпидермотропная цитотоксическая CD8-позитивная Т-клеточная лимфома
|
|||
|
CD8–
|
(CD2+ ,CD5–,CD7+/–,CD56+/–,ПЦГ+) кожная γ/δ Т-клеточная лимфома (часто, поражение кожи и подкожной клетчатки)
|
||||
|
Кожа и подкожная
клетчатка
|
CD4+
|
CD56+
|
1) (CD2+,CD7+ ,CD56+) миелоидная саркома
2) (CD3–,CD5–,CD123+,CD68+) бластная плазмоцитоидная опухоль из дендритических клеток |
||
|
CD56–
|
1) Т-клеточная лимфома из клеток мелкого/среднего размера
2) периферическая Т-клеточная лимфома, неспецифическая (крупные/средние клетки)
|
||||
|
CD4–
|
CD8+
|
(CD2+,CD5–,CD7+,CD56–, ПЦГ +) панникулитоподобная Т- клеточная лимфома подкожной жировой клетчатки
|
|||
|
(CD2+,CD5–,CD7+/–,CD56+/–, ПЦГ+) кожная γ/δ Т-клеточная лимфома
|
|||||
|
CD8–
|
периферическая Т-клеточная лимфома, неспецифическая
|
||||
|
EBV+
|
(CD2+,CD7–,CD56+ ПЦГ +) экстранодальная Т/NK-клеточная лимфома, назальный тип
|
||||
|
EBV–
|
(CD2+ CD5–CD7+/–,CD56+/ – ПЦГ+) кожная γ/δ Т-клеточная лимфома
|
||||
|
Примечания:
1 – ПЦГ–протеины цитотоксических Гранул (perforin, granzymeB, TIA1), коммерчески доступные – granzymeB (DAKO);
2 –определение моноклональной пролиферации лимфоцитов с характерным фенотипом (включая определение экспрессии антигенов CD123) выполняется методом проточной цитометрии, материалом для которой служит кровь, костный мозг, ткань лимфоузла (гомогенизат);
3 –определение клональности является дополнительным диагностическим критерием, выявляемым методом ПЦР в образцах опухолевой ткани.
4 – небольшое число случаев Грибовидного микоза может иметь фенотип (CD30+,CD4– и CD8+/–)
|
|||||
Таблица 40.10. Иммунофенотипирование и генетическое исследование для дифференциальной диагностики экстранодальных некожных лимфом с неанапластической морфологией
|
Рекомендуемый набор антител: CD2, CD5, CD7, CD4, CD8, CD15, CD30, CD56, PAX5, ALK, маркеры ПЦГ1(perforin, granzymeB, TIA1), EBV-EBER
|
|||
|
Экспрессия Т-клеточных антигенов2
|
|||
|
Определение клональных перестроек генов клеточных рецепторов Т-лимфоцитов (TCRB/TCRG) и генов тяжелых цепей иммуноглобулинов (IGHV)3
|
|||
|
CD5-,CD4-,CD8-,CD30-,CD56+,ПЦГ
|
Экстранодальная Т/NK-клеточная лимфома, назальный
тип/Т-клеточная лимфома, средняя линия лица, верхние
дыхательные пути, яички, ЖКТ)
|
(EBER+)
|
|
|
CD30+
|
ALK+
|
ALK+ крупноклеточная анапластическая лимфома,
вариант с мелкими клетками или обилием гистиоцитов
|
(EBER–)
|
|
ALK–
|
Т-клеточная лимфома, ассоциированная с энтеропатией
(интестинальная с поражением других органов брюшной
полости и вне брюшной полости; клинические данные о
целиакии (CD 5–, CD7–, CD4–, CD8–/+, CD56–/+,
granzymeB+)
другие локализации, целиакия отсутствует –
неспецифическая периферическая Т-клеточная лимфома
|
||
|
CD30–
|
(CD5–, CD7–, CD4–, CD8–,
CD56+, granzyme B–)
|
гепатоспленическая Т-клеточная лимфома (поражение
печени, селезенки, синусов костного мозга и
иммуносупрессия)
|
|
|
Другие локализации
|
периферическая Т-клеточная лимфома, неспецифическая
|
||
|
Примечания:
1 –ПЦГ – протеины цитотоксических Гранул (perforin, granzymeB, TIA1), коммерчески доступные – granzymeB (DAKO);
2 – определение моноклональной пролиферации и фенотипа лимфоцитов выполняется методом проточной цитометрии, материалом для которой служит кровь, костный мозг, ткань лимфоузла (гомогенизат);
3 – определение клональности является дополнительным диагностическим критерием, выявляемым методом ПЦР в образцах опухолевой ткани.
|
|||
Таблица 40.11. Иммунофенотипирование и генетическое исследование для дифференциальной диагностики Т-клеточных лимфом нодальной (узловой) локализации с неанапластической морфологией
|
Рекомендуемый набор антител: CD2, CD5, CD7, CD4, CD8, CD15, CD30, CD56, ALK, CD 25 маркеры ФДК1(CD21/23)
|
||
|
Экспрессия Т-клеточных антигенов2
|
||
|
Определение клональных перестроек генов клеточных рецепторов Т-лимфоцитов (TCRB/TCRG) и генов тяжелых цепей иммуноглобулинов (IGHV)3
|
||
|
CD30 +
ALK +
|
ALK+ крупноклеточная анапластическая лимфома, вариант с мелкими клетками или обилием
гистиоцитов
|
|
|
CD30 +/-
ALK –
|
CD10+
BCL6+
CD4+/-
|
Ангиоиммунобластная Т-клеточная лимфома – пролиферация посткапиллярных
венул и ФДК+
Периферическая Т-клеточная лимфома, нодальная ФДК+
|
|
CD10 –
BCL6 –
|
(CD2+, CD5+, CD7-, CD 25+, CD56-)1 Т-клеточная лимфома/лейкоз взрослых
(HTLV1+)
|
|
|
периферическая Т-клеточная лимфома, неспецифическая (HTLV1–)
|
||
|
Примечания:
1 –ФДК – фолликулярные дендритические клетки;
2 –определение моноклональной пролиферации лимфоцитов с характерным фенотипом (включая определение экспрессии антигенов CD25) выполняется методом проточной цитометрии, материалом для которой служит кровь, костный мозг, ткань лимфоузла (гомогенизат);
3 –определение клональности является дополнительным диагностическим критерием, выявляемым методом ПЦР в образцах опухолевой ткани.
|
||
40.3. Классификация по стадиям (TNM-классификация, 8-е издание) (таблица 40.12).
Таблица 40.12. Классификация по стадиям
|
Стадия I
|
Поражение одной лимфатической зоны или лимфатической структуры (I).
Локализованное поражение одного экстралимфатического органа (IE)
|
|
Стадия II
|
Поражение двух и более лимфатических зон по одну сторону диафрагмы (II).
Локализованное поражение одного экстралимфатического органа и его регионарных лимфатических узлов с или без поражения других лимфатических зон по ту же сторону диафрагмы (IIE)
|
|
Стадия II (bulky)
|
Размер пораженного лимфатического узла по длинной оси > 6 см при фолликулярной и >10 см при диффузной крупноклеточной лимфоме или торакально-медиастинальный индекс >1/3
|
|
Стадия III
|
Поражение лимфатических узлов по обе стороны диафрагмы (III), которое может сочетаться с поражением селезенки (IIIS)
|
|
Стадия IV
|
Диссеминированное (многофокусное) поражение одного или нескольких экстралимфатических органов с или без поражения лимфатических узлов. Изолированное поражение экстралимфатического органа с поражением(нерегионарных)лимфатических узлов по ту же или с обеих сторон диафрагмы.
Любое поражение печени, костного мозга, легкого (кроме прямого распространения из ЛУ) или спинномозгового ликвора всегда расценивается как IV стадия |
При стадировании неходжкинских лимфом в отличие от лимфомы Ходжкина категории А и Б не используются.
На прогноз заболевания оказывает влияние также и целый ряд клинических характеристик, которые определяются международным прогностическим индексом (далее – МПИ).
Международный прогностический индекс (IPI) для всех пациентов (каждый показатель оценивается в 1 балл) (таблица 40.13):
Таблица 40.13. Международный прогностический индекс (IPI) для всех пациентов
|
Показатель
|
Оценка IPI
|
|
Возраст – 60 лет и старше
Уровень ЛДГ в сыворотке крови – любое значение выше нормы
Статус ECOG – 2–4 балла
Стадия – III–IV
Экстранодальное поражение – более одного
|
Низкий промежуточный – 2
Высокий промежуточный – 3
Высокий – 4 или 5
|
Таблица 40.14. Возраст-ассоциированный международный прогностический индекс (aaIPI) для пациентов моложе 60 лет
|
Показатель
|
Оценка aaIPI
|
|
Стадия – III–IV
Уровень ЛДГ в сыворотке крови – любое значение выше нормы
Статус ECOG – 2–4 балла
|
Низкий – 0
Низкий промежуточный – 1
Высокий промежуточный – 2
Высокий – 3
|
Эпидемиология
40.1. Основные статистические показатели С82-С85 (таблица 40.1)
Таблица 40.1. Основные статистические показатели
|
Показатель
|
Число
|
|
|
2011
|
2016
|
|
|
Число вновь выявленных случаев заболевания
|
652
|
784
|
|
Заболеваемость на 100 000 населения (грубый интенсивный показатель)
|
6,9
|
8,3
|
|
Диагноз установлен в I стадии заболевания (% к вновь выявленным случаям)
|
14,7
|
16
|
|
Диагноз установлен в II стадии заболевания (% к вновь выявленным случаям)
|
36,8
|
26,6
|
|
Диагноз установлен в III стадии заболевания (% к вновь выявленным случаям)
|
25,7
|
25,3
|
|
Диагноз установлен в IV стадии заболевания (% к вновь выявленным случаям)
|
22,8
|
32,1
|
|
Прожили менее года с момента установления диагноза из числа заболевших в предыдущем году (одногодичная летальность в %)
|
32,6
|
29,9
|
|
Умерло от злокачественных новообразований
|
320
|
345
|
|
Смертность на 100 000 населения Грубый интенсивный показатель
|
3,4
|
3,6
|
|
Отношение смертности к заболеваемости в % (интенсивные показатели)
|
49,3
|
43,4
|
|
Число пациентов, состоящих на учете на конец года
|
3533
|
4427
|
|
Из них состоящих на учете 5 и более лет, %
|
53,6
|
54,4
|
Диагностика
40.4. Диагностические мероприятия
Детальный сбор анамнеза с особым вниманием к наличию симптомов интоксикации и темпу роста лимфатических узлов.
Тщательное пальпаторное обследование всех Групп периферических лимфатических узлов (подчелюстных, шейно-надключичных, подключичных, подмышечных, подвздошных, паховых, бедренных, локтевых, затылочных, кубитальных, брахиальных, подколенных), печени, селезенки.
Осмотр ЛОР-врача (состояние небных миндалин и носоглотки) + фибролярингоскопия.
УЗИ: всех Групп периферических лимфатических узлов, включая шейные, над- и подключичные, подмышечные, паховые, бедренные;
брюшной полости и таза с исследованием печени, селезенки, парааортальных, подвздошных, мезентериальных лимфатических узлов.
Компьютерная томография шеи, органов Грудной клетки, брюшной полости и таза с болюсным внутривенным контрастным усилением.
ПЭТ/КТ с фтордезоксиглюкозой (ФДГ) и/или МРТ с диффузионно-взвешенным исследованием (МРТ-ДВИ) шеи, Грудной клетки, брюшной полости и таза. ПЭТ/КТ не используется при лимфомах низкой степени злокачественности (мелкоклеточная лимфоцитарная лимфома, лимфома из клеток маргинальной зоны, Грибовидный микоз, лимфома из клеток мантийной зоны) без трансформации в высокозлокачественную форму.
При использовании МРТ-ДВИ степень злокачественности лимфомы не имеет значения. МРТ-ДВИ должна проводиться на сканере с напряженностью магнитного поля не менее 1,5 Тл, оборудованном встроенной катушкой для всего тела или набором поверхностных катушек для сканирования всего тела. Минимальный набор импульсных последовательностей: Т1 – взвешенных изображений и STIR (ShortInversionTimeInversionRecovery) в коронарной плоскости, ДВИ и быстрые Т2-ВИ (или Т1-ВИ) в трансверсальной плоскости.
Группа крови и резус-фактор.
Общий анализ крови, включая содержание эритроцитов, гемоглобина, тромбоцитов, лейкоцитарную формулу, СОЭ.
Биохимическое исследование крови: креатинин, мочевина, билирубин, общий белок, альбумин, АСТ, АЛТ, ЛДГ, щелочная фосфатаза, K, Na, Ca, мочевая кислота (при агрессивном типе лимфом).
Биопсия костного мозга (трепанобиопсия крыла подвздошной кости) для морфологического исследования и аспират костного мозга для проточной цитометрии.
Анализ крови на ВИЧ, гепатит В и С (при планировании лечения с ритуксимабом).
Прямая проба Кумбса при планировании лечения с флударабином.
ЭКГ и фракция выброса левого желудочка.
У женщин детородного возраста – тест на беременность.
При некоторых особых клинических вариантах НХЛ требуется проведение специфических дополнительных методов обследования.
При поражении оболочек спинного и головного мозга:
осмотр невролога;
люмбальная пункция с определением клеточности ликвора, цитологическое (цитоспин) и биохимическое исследование; исследование ликворапроточной цитометрией.
КТ или МРТ головного и/или уровня поражения спинного мозга.
При первичном поражении одного из отделов желудочно-кишечного тракта дополнительно должны быть обследованы все его отделы.
При поражении яичка:
УЗИ второго яичка;
люмбальная пункция (цитоспин, проточная цитометрия).
Следует отметить, что риск поражения центральной нервной системы увеличивается при массивном поражении средостения, яичек, придаточных пазух, лейкемической трансформации костного мозга, лимфоме из клеток мантии, лимфобластной лимфоме и лимфоме Беркитта. В этих случаях всегда следует обсуждать вопрос о диагностической люмбальной пункции с одновременным введением метотрексата, цитарабина и дексаметазона.
Дополнительному исследованию должны быть подвергнуты органы, со стороны которых пациент испытывает дискомфорт.
Так как химиотерапия и лучевая терапия потенциально могут привести к необратимой стерильности пациента, необходимо обсуждение вопроса о возможной криоконсервации спермы/яйцеклеток и хирургической транспозиции яичников из зоны планируемого облучения.
С женщинами детородного возраста следует обсуждать вопрос о необходимости защиты от беременности, а также о методах возможной гормональной защиты яичников при проведении химиотерапии.
Лечение
40.5. Лечение НХЛ
Выбор тактики лечения пациентов определяется на основании уточнения специфического типа лимфомы с учетом при необходимости клеточного подварианта опухоли, локализации очагов поражения.
Основным методом лечения НХЛ является химиотерапия, применяемая в виде комбинаций различных цитостатических препаратов. Лечение чаще всего проводится короткими курсами с интервалами 2–3 недели. Для определения чувствительности опухоли к каждому конкретному виду химиотерапии необходимо провести не менее двух циклов лечения. При отсутствии эффекта после двух циклов обоснован переход на другой режим химиотерапии. Изменение режима химиотерапии требуется и в ситуации, если после значительного уменьшения размеров лимфатических узлов после очередного курса лечения происходит их увеличение в интервале между курсами, что должно рассматриваться как резистентность опухоли к использовавшейся комбинации цитостатиков. При неэффективности стандартных режимов химиотерапии всегда следует обсуждать вопрос о возможности проведения высокодозной химиотерапии с трансплантацией стволовых гемопоэтических клеток.
40.6. Профилактика осложнений при химиотерапии НХЛ
40.6.1. Профилактика лизис синдрома
Синдром лизиса опухоли развивается в течение 12–72 часов после начала химиотерапии. Лабораторные маркеры, подтверждающие наличие синдрома лизиса опухоли до манифестации клинических проявлений: повышение в сыворотке крови концентрации мочевой кислоты, калия или фосфора более чем на 25 % от исходного уровня, или снижение концентрации кальция на 25 %.При агрессивных лимфомах с наличием большой опухолевой массы обязательно должны быть приняты меры для профилактики синдрома лизиса опухоли: за 2–3 дня до начала химиотерапии пациенты должны начать прием аллопуринола внутрь в дозе 300 мг/сутки на фоне гипергидратации, длительность приема аллопуринола – 10–14 дней. Такая же профилактика лизис синдрома должна проводиться всем пациентам с агрессивными лимфомами и с нарушенной функцией почек.
40.6.2. Профилактика нейтропении.
Первичным пациентам с агрессивными лимфомами в возрасте >60 лет или в любом возрасте при неблагоприятном Международном Прогностическом Индексе (МПИ) в ходе химиотерапии проводится следующая профилактика нейтропении: филграстим 300 мкг подкожно на 8-й и 12-й дни от начала курса химиотерапии.
Пациентам с хронической обструктивной болезнью легких филграстим 300 мкг подкожно, ежедневно, в течение 7–10 дней, начиная на 4-е сутки после окончания курса химиотерапии. Как альтернатива – однократная инъекция пэгфилграстима на 4-е сутки после окончания химиотерапии.
40.6.3. Профилактика пневмоцистной инфекции.
Профилактика пневмоцистной инфекции (ко-тримоксазол 480 мг внутрь ежедневно) показана при использовании:
- флударабина,
- высоких доз циклофосфамида,
- высоких дох кортикостероидов в течение 5 и более дней курса химиотерапии
- бортезомиба,
- бендамустина.
Профилактика пневмоцистной инфекции показана также всем ВИЧ- инфицированным пациентам.
У всех пациентов профилактика начинается с момента начала химиотерапии и продолжается в течение 3–6 месяцев после ее завершения.
Применение эритропоэтинов не показано. Доказано, что выживаемость пациентов с неходжкинскими лимфомами, у которых использовались эритропоэтины, существенно снижается. При анемиях показаны гемотрансфузии.
40.7. Оценка лечебного эффекта
Оценка лечебного эффекта на любом из этапов лечения должна проводиться теми же методами, которые были применены до начала лечения или при перед переходом на новую линию терапии.
40.7.1. Оценка эффекта терапии по данным ПЭТ/КТ
Оценку эффекта производят с использованием критериев Deauville. Эта пятибалльная шкала учитывает различия в накоплении радиоактивного фтора в различных участках тела: 1 – нет накопления в ранее определяемых зонах поражения, 2 – накопление в ранее определяемой зоне поражения < чем накопление в просвете дуги аорты, 3 – накопление в ранее определяемой зоне поражения > чем накопление в просвете дуги аорты, но < чем накопление в печени, 4 – накопление в ранее определяемой зоне поражения > чем накопление в печени, 5 – существенное увеличение накопления в ранее определяемых зонах поражения или появление ранее неопределяемых очагов гиперметаболизма.
Критерии Deauville 1–2 – полная регрессия.
Критерии Deauville 3 – возможна полная регрессия.
Критерии Deauville 4–5 – активный опухолевый процесс, показана биопсия для исключения ложноположительного результата ПЭТ.
После завершения всей программы лечения ПЭТ/КТ выполняется через 6 недель (при только химиотерапии) и через 2–3 месяца (после химиолучевой терапии).
40.7.2. Оценка эффекта терапии по данным МРТ-ДВИ
Оценку эффекта производят с учетом размеров остаточных образований и интенсивности их сигнала на картах измеряемого коэффициента диффузии (ИКД). Полная регрессия: лимфатические узлы должны уменьшиться до нормальных размеров либо интенсивность сигнала остаточных образований на картах ИКД должна быть выше параспинальных мышц.
40.7.3. Оценка эффекта терапии по данным КТ
Полная регрессия:
- полное исчезновение всех ранее выявляемых клинически и рентгенологически проявлений заболевания и нормализация всех биохимических отклонений, включая ЛДГ;
- все лимфоузлы должны регрессировать до нормального размера (<1,5 см в наибольшем поперечном измерении для лимфоузлов размером более 1,5 см до начала лечения); пораженные лимфоузлы размером 1,1–1,5 см в наибольшем поперечном измерении должны уменьшиться до <1 см или более чем на 75 % от суммы измерений пораженных узлов;
- селезенка, увеличенная до начала лечения, должна уменьшиться до нормальных размеров;
-
пораженный до начала лечения костный мозг должен быть интактным.
Неподтвержденная полная регрессия:
- остаточные лимфоузлы размером более 1,5 см, которые уменьшились в размерах в процессе лечения более чем на 75 %;
- неопределенное состояние костного мозга (увеличение количества и размеров агрегатов без цитологическй или архитектурной атипии).
Частичная регрессия:
- уменьшение более чем на 50 % суммы наибольших размеров, по крайней мере, 6 опухолевых очагов; если очаг один, то его наибольший поперечный диаметр должен уменьшиться, по крайней мере, на 50 %;
- не должно быть новых очагов, ни один из старых очагов не должен увеличиться в размерах;
- размеры печени и селезенки должны уменьшиться до нормальных;
- размеры узлов в печени и селезенке должны уменьшиться более чем на 50 %;
- оценка состояние костного мозга не имеет значения, поскольку это является неизмеримым проявлением болезни;
Стабилизация болезни:
- меньше чем частичная регрессия (см. выше) при отсутствии данных за прогрессирование заболевания (см. ниже).
Прогрессирование заболевания:
- появление нового очага поражения или увеличение более чем на 50 % ранее определяемого очага поражения;
- увеличение более чем на 50 % наибольшего диаметра любого ранее определяемого очага поражения размером более 1 см в поперечном измерении.
40.8. Фолликулярная лимфома
Тактика лечения определяется подтипом лимфомы и распространенностью процесса. Различают 4 подтипа фолликулярной лимфомы:
- типичная фолликулярная лимфома,
- фолликулярная лимфома с транслокацией 1р36,
- В-крупноклеточная лимфома с IRF4 транслокацией,
- педиатрического типа фолликулярная лимфома у взрослых.
40.8.1. Типичная фолликулярная лимфома
Тактика лечения зависит от степени злокачественности опухоли и распространенности процесса.
Степень злокачественности типичной фолликулярной лимфомы определяется подсчетом числа бластов в 10 полях зрения при большом увеличении микроскопа (объектив ×40).
Grade 1. 0–5 центробластов в поле зрения.
Grade 2. 6–15 центробластов в поле зрения.
Grade 3. более 15 центробластов в поле зрения:
3а. имеются центроциты;
3b. нет центроцитов, имеются поля центробластов.
Фолликулярная лимфома Grade 3b рассматривается как агрессивная лимфома и лечится по протоколу диффузной В-крупноклеточной лимфомы.
Алгоритм лечения первичных пациентов представлен на рисунке 40.1.
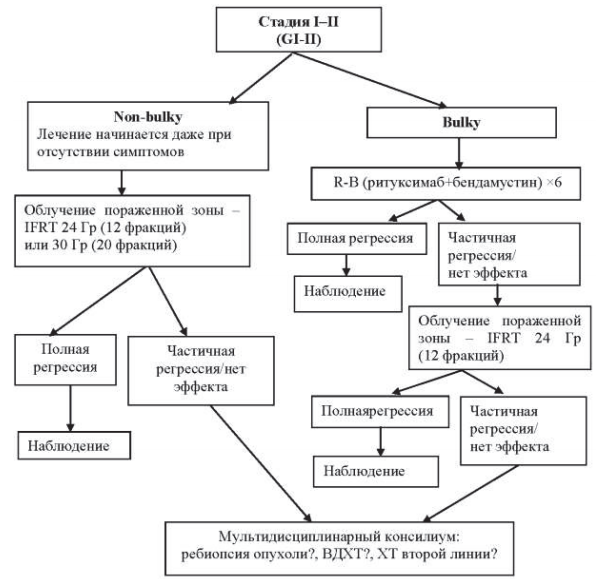
Рисунок 40.1 – Алгоритм лечения типичной фолликулярной лимфомы I–II ст.
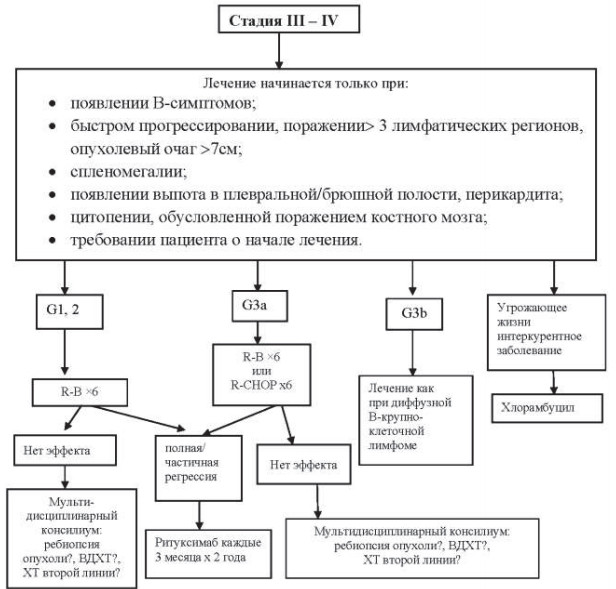
Рисунок 40.2–Алгоритм лечения типичной фолликулярной лимфомы III–IV ст.
40.8.1.1. Стадия I–II (Grade I–II).
Для пациентов с I–II стадиями заболевания и небольшими размерами пораженных лимфатических узлов потенциально излечивающей может быть лучевая терапия – облучение пораженной зоны. Режим облучения: разовая доза 2 Гр 5 раз в неделю, суммарная доза – 24 Гр или разовая доза 1,5 Гр 5 раз в неделю, суммарная доза – 30 Гр.
При хорошей переносимости лучевой терапии и отсутствии отдаленных побочных эффектов при последующих возвратах болезни в виде появлении новых локальных очагов поражения вновь проводится лучевая, а не лекарственная терапия.
При наличии большого объема опухоли (размер отдельных лимфатических узлов более 6 см) лечение начинают с иммунохимиотерапии, используя режимы, применяемые при распространенных формах заболевания. Если не удается достигнуть полной регрессии после 4–6 курсов химиотерапии, то проводится облучение зон поражений в суммарной очаговой дозе 36 Гр (5 раз в неделю за 20 фракций).
40.8.1.2. Стадия III–IV (Grade I и Grade II).
Для большей части пациентов с такой распространенностью процесса излечивающей терапии в настоящее время не существует. Поскольку естественное течение болезни характеризуется спонтанными регрессиями до 25 % случаев, химиотерапию следует начинать только при появлении В-симптомов; быстром прогрессировании опухолевого процесса (в течение трех месяцев), поражении >3 лимфатических регионов,
выраженной лимфаденопатии, спленомегалии; компрессии жизненно важных органов; появлении выпота в плевральной/брюшной полости, перикардита; цитопении, обусловленной поражением костного мозга; требовании пациента о начале противоопухолевого лечения.
выраженной лимфаденопатии, спленомегалии; компрессии жизненно важных органов; появлении выпота в плевральной/брюшной полости, перикардита; цитопении, обусловленной поражением костного мозга; требовании пациента о начале противоопухолевого лечения.
В 4-х рандомизированных исследованиях показано, что раннее начало лечения у асимптоматических пациентов не приводит к повышению выживаемости.
Если целью терапии являются полная ремиссия или длительная безрецидивная выживаемость терапией выбора служит режим ритуксимаб в комбинации с бендамустином. Может использоваться также комбинация R-CVР. При наличии интеркуррентного заболевания, угрожающего жизни пациента, терапией выбора служит монотерапия хлорамбуцилом, ритуксимабом или их сочетанием.
Если целью терапии являются полная ремиссия или длительная безрецидивная выживаемость терапией выбора служит режим ритуксимаб в комбинации с бендамустином. Может использоваться также комбинация R-CVР. При наличии интеркуррентного заболевания, угрожающего жизни пациента, терапией выбора служит монотерапия хлорамбуцилом, ритуксимабом или их сочетанием.
Пациентам, у которых после первой линии лечения комбинацией R-B достигнута полная или частичная регрессия, проводится поддерживающее лечение ритуксимабом каждые три месяца в течение двух лет.
У значительной части пациентов в ходе течения опухолевой болезни происходит трансформация лимфомы в агрессивную форму. Признаками трансформации являются: повышение уровня ЛДГ в сыворотке крови, появление В-симптомов, разнонаправленная динамика размеров, появление экстранодальных опухолевых очагов. В таких ситуациях опухоль становится ПЭТ-авидной. Биопсия должна производиться из очагов с максимальным показателем SUV.
40.8.1.3. Рецидив заболевания.
При появлении рецидива для исключения вторичной трансформации в агрессивную лимфому показано выполнение ПЭТ-КТ и повторных биопсий. Если возврат болезни наступил в сроки более 2-х лет после окончания лечения, то при лечении рецидива используются режимы химиотерапии, примененные ранее в первой линии лечения.
Выбор терапии второй линии зависит от срока возврата болезни и состояния пациента. Компенсированные пациенты при возврате болезни в течение 24 мес. после окончания лечения обязательно направляются на консультацию в Республиканский центр трансплантации костного мозга для решения вопроса проведения высокодозной химиотерапии с трансплантацией аутологичных стволовых гемопоэтических клеток.
У пациентов не кандидатов для высокодозной химиотерапии при ранних рецидивах (<12–24 мес.), предпочтительно применение схем химиотерапии, не обладающих перекрестной резистентностью (например, CHOP после бендамустина), могут использоваться также режимы, содержащие флударабин или алкилирующие лекарственные средства (CVP, CEPP, DHAP, DAEPOCH, GDP, FC, FM, гемцитабин+винорельбин, гемцитабин+карбоплатин, гемцитабин+оксалиплатин, ICE). Повторное использование ритуксимаба во второй линии рекомендуется в случае длительности первой ремиссии более 6 месяцев. У пациентов с полной или частичной регрессией после проведения химиотерапии поддерживающая терапия ритуксимабом продолжительностью до 2-х лет не обладает выраженными побочными эффектами и, как показал системный мета-анализ, существенно увеличивает время до прогрессирования и показатель общей выживаемости пациентов.
В качестве самостоятельного метода лечения у пациентов фолликулярными
лимфомами с распространенными стадиями болезни может использоваться
гормонотерапия преднизолоном (метилпреднизолоном), который назначается короткими
курсами 7–14 дней в дозе 30–60 мг/м2 внутрь с быстрой отменой в течение 3–4 дней.
Повторяют лечение каждые 3–4 недели.
40.8.2. Фолликулярная лимфома с транслокацией 1р36.
Этот вариант встречается редко, клинически проявляется избирательным поражением паховых лимфатических узлов. Процесс долгое время остается локальным и в связи с этим обычно диагностируется в I–II ст. Стандартная тактика лечения не разработана. Длительные ремиссии наблюдаются после локального облучения и/или химиотерапии в режиме R-B.
40.8.3. Фолликулярная В-крупноклеточная лимфома с IRF4 транслокацией.
Клинически этот вариант лимфомы проявляется поражением Валдейерова кольца у молодых взрослых. Характерной особенностью является быстрое локальное прогрессирование. Опухоль высокочувствительна к лучевой и химиотерапии. Лечение проводится как при агрессивных лимфомах.
40.8.4. Педиатрического типа фолликулярная лимфома у взрослых.
Это вариант лимфомы может встречаться в любом возрасте, но в подавляющем большинстве случаев диагностируется у молодых взрослых мужского пола.
Как правило поражаются лимфатические узлы головы и шеи. Диагноз данного типа лимфомы устанавливается с учетом морфологических характеристик и распространенности опухолевого процесса в пределах только I ст. При большей распространенности, даже при наличии характерных морфологических признаков диагноз фолликулярной лимфомы педиатрического типа не ставится.
Стандартная тактика лечения не разработана. Длительные ремиссии наблюдаются при всех видах лечения: хирургический, лучевой, химиотерапевтический – R-CHOP.
40.9. Диффузные В-крупноклеточные лимфомы.
Среди всех диффузных В-крупноклеточных лимфом почти в 10 % случаев имеется перестройка гена MYC в опухоли в сочетании с перестройкой гена Bcl2 (double-hit) и гена Bcl6 (triple-hit). У таких пациентов химиотерапия в режиме R-CHOP неэффективна, должны использоваться режимы химиотерапии, применяемые для лечения лимфомы Беркитта. Всем пациентам моложе 70 лет, у которых при морфологическом исследовании ставится диагноз диффузной В-крупноклеточной лимфомы, необходимо определять состояние генов MYC, Bcl2, Bcl6.
40.9.1. B-крупноклеточная лимфома неспецифическая.
При планировании лечения следует исходить из положения, что пациенты с этим
вариантом НХЛ, независимо от стадии заболевания, являются потенциально излечимыми.
Лечение их всегда начинается с химиотерапии с использованием схемы R-CHOP. Лечебная стратегия должна строиться в соответствии с возрастом пациента, показателями МПИ, возраст-ассоциированного МПИ, а также возможностью проведения дозо-интенсифицированных программ. При наличии большой опухолевой массы должны быть приняты меры для профилактики синдрома лизиса опухоли (см. раздел профилактика лизис синдрома). Следует избегать редукции доз препаратов для профилактики гематологической токсичности.
Профилактика поражения центральной нервной системы (ЦНС):
Профилактика поражения ЦНС показана при поражении яичка, double-hit и triple-hit лимфоме. Для других пациентов профилактика поражения ЦНС проводится только в Группе пациентов высокого риска (таблица 40.15).
Таблица 40.15. Факторы риска
|
Признак
(каждый признак оценивается в один балл)
|
Группа риска
(сумма баллов)
|
|
возраст >60 лет
|
Низкий риск – 0–1 балл
Промежуточный риск – 2–3 балла
Высокий риск – 4–6 баллов
|
|
уровень ЛДГ в сыворотке крови >ВГН
|
|
|
ECOG>1
|
|
|
III–IV стадия
|
|
|
>1 экстранодального очага поражения
|
|
|
Поражение почек или надпочечников
|
Профилактика поражения ЦНС осуществляется внутривенным введением метотрексата в дозе 3,5 г/м2. Метотрексат вводится на 13–15-й дни от начала 2-,4- и 6-го курсов химиотерапии.
При поражении яичка метотрексат вводится после завершения всех 6 курсов R-CHOP, каждые 14–28 дней, 2–3 введения.
Алгоритмы лечения пациентов в зависимости от распространенности опухолевого процесса и факторов риска представлены на рисунках 40.3–40.6.
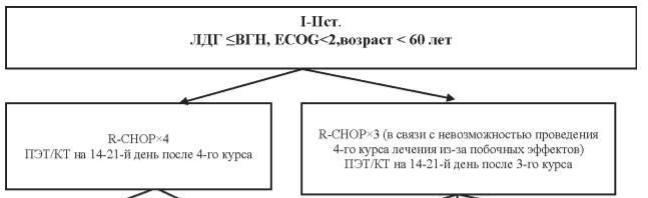
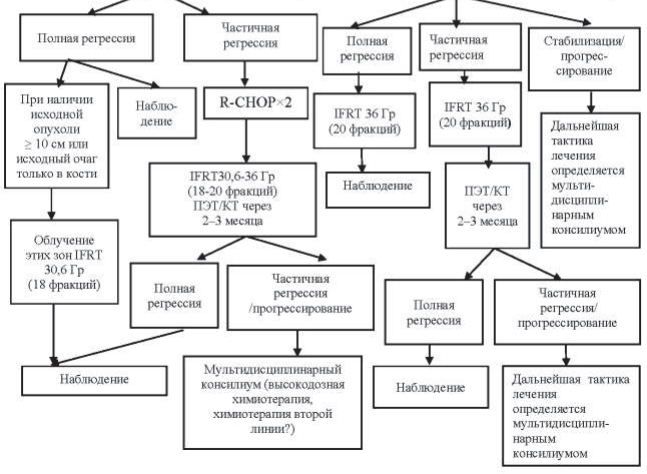
Рисунок 40.3 – Алгоритм лечения первичных пациентов с ДВКЛ I-II ст. Группы низкого риска
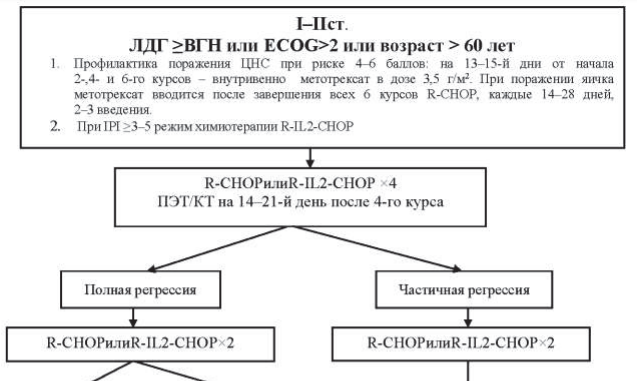
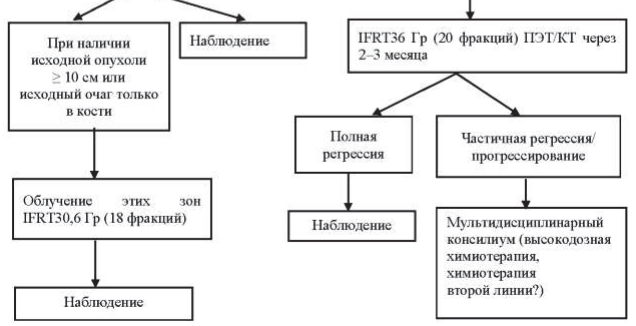
Рисунок 40.4 – Алгоритм лечения первичных пациентов с ДВКЛ I-II ст. Группы высокого риска
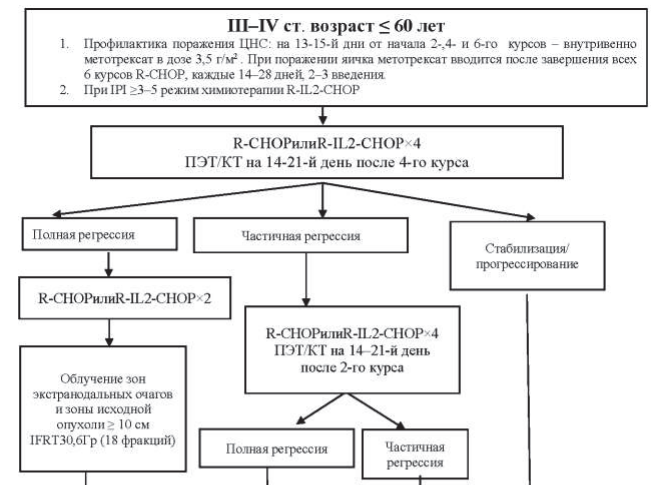
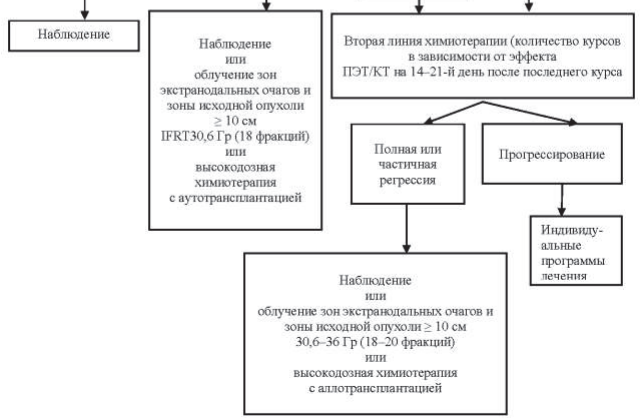
Рисунок 40.5 – Алгоритм лечения первичных пациентов с ДВКЛ III–IV ст. в возрасте <60 лет
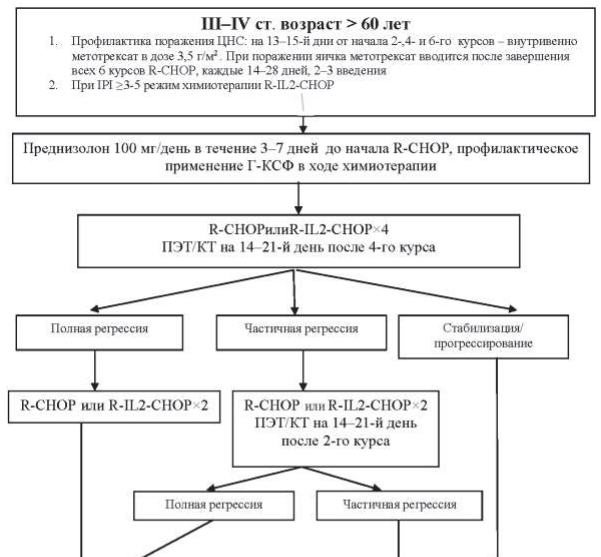
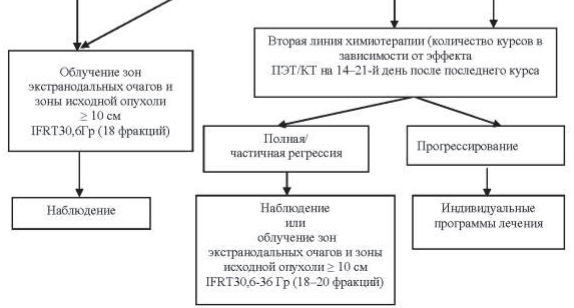
Рисунок 40.6 – Алгоритм лечения первичных пациентов с ДВКЛ III–IV ст. в возрасте >60 лет
Пациентам в возрасте до 60 лет проводится 6–8 курсов химиотерапии R-CHOP. Пациентам старше 60 лет проводится не более 6 курсов R-CHOP, при распространенности процесса в пределах III–IV ст. лечение начинается с гормонотерапии – преднизолон 100 мг/день в течение 3–7 дней до начала R-CHOP. Этим пациентам показано профилактическое применение Г-КСФ в ходе химиотерапии: филграстим 300 мкг подкожно на 8-й и 12-й дни от начала курса химиотерапии.
При оценке эффекта лечения после выполнения всей запланированной программы в случаях, когда по данным ПЭТ/КТ имеется остаточное объемное образование в ранее пораженной зоне и критерий Довиль равен 3 и более, то выполняется МРТ-ДВИ и только после этого мультидисциплинарным консилиумом определяется дальнейшая тактика – биопсия или динамическое наблюдение.
40.9.1.1. Пациенты старше 80 лет:
Терапия по схеме R-CHOP может быть применена только у соматически сохранных пациентов. Как было показано на небольших Группах пациентов, терапия с применением редуцированных доз препаратов может приводить к получению полных ремиссий и длительной выживаемости даже у самых пожилых пациентов.
Некоторые экстранодальные формы диффузной В-крупноклеточной лимфомы требуют специального терапевтического подхода.
40.9.1.2. Терапия первичной лимфомы ЦНС описана в разделе «Новообразования центральной нервной системы».
40.9.1.3. Первичная лимфома с поражением яичек.
Характеризуется высоким риском рецидивов с преимущественным вовлечением экстранодальных зон. Профилактика поражения ЦНС у данной категории пациентов является обязательной. После завершения химиотерапии должно быть проведено облучение мошонки с профилактической целью в дозе 30–36 Гр за 15–20 фракций.
40.9.1.4. Рефрактерные лимфомы и ранние рецидивы (возврат болезни в течение 6 месяцев после окончания лечения).
Если в ходе химиотерапии не удается достигнуть полной ремиссии или наступил ранний рецидив, обязательно обсуждается вопрос о применении высокодозной химиотерапии. В ситуации, когда пациент не подлежит этому методу лечения, проводится лучевая терапия на зоны поражения. Показано проведение химиотерапии 2-й линии (DHAP, ESHAP, MINE, ICE, GEMOX, GDP, CEPP, DA-EPOCH).
40.9.1.5. Поздние рецидивы (возврат болезни в срок более 6 месяцев после окончания лечения).
Рецидив должен быть в любом случае подтвержден гистологически, особенно при возникновении ≥12 месяцев после установления первоначального диагноза. Это необходимо также для подтверждения сохранения экспрессии CD20. С этой целью проведение трепанобиопсии опухоли может считаться достаточным.
Пациентам, которым планируется проведение терапии с целью излечения, следует проводить стадирование рецидива, идентичное для первичных пациентов.
Для соматически сохранных пациентов без выраженных функциональных нарушений в возрасте до 65 лет, получавших в первой линии терапию ритуксимабом и антрациклин-содержащие режимы, показано проведение химиотерапии второй линии (DHAP, ESHAP, MINE, ICE, GEMOX, GDP). При наличии эффекта – рассматривается вопрос о проведении высокодозной химиотерапии с трансплантацией стволовых клеток.
У пациентов, не подходящие для высокодозной химиотерапии, могут быть использованы схемы второй линии (DHAP, ESHAP, MINE, ICE, GEMOX, GDP, CEPP, DA-EPOCH) при необходимости – в сочетании с облучением пораженных зон.
Пациентам этой Группы возможно повторное применение ритуксимаба с любым режимом химиотерапии.
40.9.2. Первичная медиастинальная В-крупноклеточная лимфома.
Является одним из морфологических субвариантов В-крупноклеточной диффузной лимфомы. Локализуется в переднем средостении и исходит из вилочковой железы, а физиологическими представителями клеток лимфомы являются В-клетки тимуса.
Стратегия лечения такая же как и при всех В-крупноклеточных диффузных лимфомах, однако оптимальный режим химиотерапии не определен. Лечащим врачом должно быть оценено общее состояние пациента, наличие сопутствующей патологии, риск побочных эффектов каждого режима химиотерапии и выбрана одна из 3 программ терапии:
6 курсов R-DA-EPOCH (этопозид, винкристин, доксорубицин, циклофосфамид, преднизолон +ритуксимаб). Если после окончания лечения по данным ПЭТ/КТ и МРТ- ДВИ сохраняется в средостении остаточное объемное образование и характер его остается неясным, то производится биопсия и при подтверждении лимфомы – лучевая терапия в СОД 30–36 Гр за 15–20 фракций.
6 курсов R-CHOP (ритуксимаб+винкристин, циклофосфамид, доксорубицин, преднизолон) с последующей лучевой терапией в СОД 30–36 Гр.
4 курса R-CHOP (ритуксимаб+винкристин, циклофосфамид, доксорубицин, преднизолон), затем 3 курса ICЕ (ифосфамид, карбоплатин, этопозид). Если после окончания лечения по данным ПЭТ/КТ и МРТ-ДВИ сохраняется в средостении остаточное объемное образование и характер его остается неясным, то производится биопсия и при подтверждении лимфомы – лучевая терапия в СОД 30–36 Гр за 15–20 фракций.
40.9.3. Интраваскулярная В-крупноклеточная лимфома.
Является также одним из морфологических субвариантов В-крупноклеточной диффузной лимфомы. Встречается крайне редко. Характеризуется агрессивным течением. Все случаи интраваскулярной В-крупноклеточной лимфомы должны рассматриваться как диссеминированный процесс. Поражает кожу, легкие, почки, надпочечники, центральную нервную систему. Лечение не разработано. Оправдано использование тех же схем химиотерапии, что и при других вариантах В-крупноклеточных лимфом.
40.10. Первичная экссудативная лимфома
Проявляется обычно экссудативными выпотами без наличия опухолевых масс (лимфоаденопатии, органного поражения). В подавляющем большинстве случае ассоциирована с ВИЧ инфекцией.
Для лечения используются, как правило, антрациклин-содержащие схемы химиотерапии, в частности, CHOP. В CD20-позитивных случаях оправдано применение схемы R-CHOP. Прогноз крайне неблагоприятный, медиана выживаемости составляет 6 месяцев.
40.11. Мелкоклеточная лимфоцитарная лимфома
Отличается склонностью к ранней диссеминации. В момент диагностики у 61–90 % пациентов имеется поражение костного мозга. Только примерно у 2 % пациентов заболевание диагностируется в ранних стадиях заболевания. По иммунофенотипическим характеристикам и клиническому течению идентична хроническому лимфолейкозу (В-ХЛЛ), что и обусловливает одинаковую лечебную тактику. Часто на фоне этого варианта лимфомы развиваются сопутствующие заболевания, обусловленные имеющимся иммунодефицитом (пневмонии, бронхиты и другие воспалительные процессы).
В соответствии с определением лимфома из малых лимфоцитов характеризуется наличием лимфаденопатии и/или спленомегалии. Лимфомы из малых лимфоцитов имеют иммунофенотип, идентичный хроническому лимфолейкозу. Диагноз должен быть подтвержден морфологическим исследованием лимфоузла или другой пораженной структуры. Диагноз лимфомы из малых лимфоцитов устанавливается только при наличии лимфаденопатии и/или спленомегалии и при количестве В-лимфоцитов в периферической крови < 5×109 /л и наличии клональной рестрикции легких цепей В- клеточного рецептора (по данным проточной цитометрии).
Для лечения пациентов с истинно локализованным процессом используется лучевая терапия. Режим облучения: разовая доза 1,8–2Гр 5 раз в неделю, суммарная доза – 30– 40 Гр.
40.11.1. Лечение пациентов стадии II–IV
Лечению подлежат пациенты при наличии следующих признаков активации болезни: выраженные В-симптомы, цитопения, не являющаяся следствием аутоиммунных нарушений; осложнения, вызванные увеличенными лимфатическими узлами и сплено/гепатомегалией, а также пациенты с аутоиммунными анемией и тромбоцитопенией, плохо поддающимися терапии стероидами.
Возраст, соматическая сохранность и отсутствие тяжелой сопутствующей патологии должны лежать в основе выбора терапии. Для выбора терапии необходимо определение цитогенетических аномалий в опухоли, в особенности делеций хромосомы 17 (del 17p) хромосомы 11 (del 11q) посредством флуоресцентной in situ гибридизации (FISH).
Пациенты носители делеции 17р резистентны к стандартным режимам химиотерапии (монотерапия флударабином или комбинация FC). Введение в практику химиоиммунотерапии (R-FC), также не повлияло на показатель безрецидивной выживаемости, которая остается непродолжительной. Негативное влияние del (11q) на прогноз может, однако, быть преодолено иммунохимиотерапией с применением флударабина, циклофосфамида и ритуксимаба (R-FC).
Используются следующие препараты и/или комбинированные схемы: хлорамбуцил, бендамустин, флударабин, FC, CHOP, DA-EPOCH. К любому из режимов лечения может быть добавлен ритуксимаб.
Вместе с тем, аллогенная трансплантация стволовых клеток является единственным методом излечения пациентов Группы высокого риска с наличием del (17p) или del (11q), а также во всех случаях рефрактерного течения болезни.
Для начальной терапии соматически сохранных пациентов в возрасте <65 лет (физически активны, без серьезной сопутствующей патологии, с сохранной почечной функцией) терапией выбора служат схемы: R-FC, R-F, R-B. При выборе режима химиотерапии необходимо помнить, что при использовании флударабина в связи с высоким риском реактивации цитомегаловирусной инфекции необходимо выявление и количественное определение ДНК цитомегаловируса методом полимеразной цепной реакции (ПЦР) (определять методом количественной ПЦР уровень виремии) до начала лечения и каждые 2–3 недели в ходе лечения. При использовании бендамустина должна проводиться профилактика пневмоцистной инфекции: ко-тримоксазол 480 мг внутрь ежедневно в ходе всего лечения и не менее 3 месяцев после его окончания.
Для начальной терапии пациентов в возрасте >65 лет и для более молодых пациентов с выраженной сопутствующей патологией терапией выбора служат: монотерапия хлорамбуцилом, бендамустином, ритуксимабом или комбинациями хлорамбуцил+ритуксимаб или бендамустин+ритуксимаб
40.11.2. Вторая линия химиотерапии
Первая линия терапии может быть проведена повторно, если рецидив или прогрессирование развились более чем через 12 месяцев от начального лечения. Если рецидив развился в течение 12 месяцев от начального лечения, показана смена режима химиотерапии с включением в программу лечения ритуксимаба. При назначении ритуксимаба врач должен тщательно оценить соотношение польза-риск для конкретного пациента. Поскольку в ходе и после лечения ритуксимабом может развиться реактивация перенесенных ранее вирусных инфекций, то у пациентов с перенесенными ранее тяжелыми вирусными заболеваниями (особенно гепатит В, гепатит С), ритуксимаб не назначается.
40.12. В-клеточная лимфома из лимфоидной ткани, ассоциированной со слизистыми оболочками (MALT-лимфома)
Может встречаться первичное поражение паращитовидной железы, щитовидной железы, орбиты, легочной ткани, молочной железы, кожи.
При локализованных формах проводится локальное лечение – лучевая терапия с включением в поле облучения пораженного органа и регионарных лимфатических узлов или операция. Режим облучения: разовая очаговая доза 1,5 Гр, суммарная – 30 Гр.
Для лечения распространенных стадий используются режимы химиотерапии как при фолликулярной лимфоме.
40.12.1. Экстранодальная В-клеточная лимфома из лимфоидной ткани, ассоциированной со слизистой оболочкой желудка (MALT-лимфома желудка)
Клинически MALT-лимфома желудка проявляется неспецифическими симптомами, приводящими пациента на эндоскопическое исследование. При гастроскопии, как правило, определяется неспецифический гастрит или язвенный дефект слизистой оболочки с нетипичными для простой пептической язвы солидными структурами Производится множественная биопсия слизистой оболочки желудка, двенадцатиперстной кишки, гастроэзофагеального перехода и любых подозрительных участков. Диагноз устанавливается на основании иммуноморфологического исследования гастробиоптата. Ведущую роль в патогенезе в настоящее время отводят Helicobacterpylori инфекции, наличие которой подтверждается в 90 % случаев. Наличие активной Helicobacterpylori инфекции должно быть диагностировано иммуногистохимически или с помощью уреазного дыхательного теста.
Стадирование процесса производится в соответствии с Парижской или Лугано классификацией первичных гастроинтестинальных лимфом (рисунок 40.7)
|
Лугано классификация
|
Парижская классификация
|
||
|
Стадия I E
|
IE1 – опухоль инвазирует в
подслизистый слой
|
T1N0M0
|
опухоль инвазирует в подслизистый слой
|
|
IE2 – опухоль инвазирует в серозную
оболочку без инвазии в соседние
органы
|
T2N0M0
|
опухоль инвазирует в мышечную
оболочку
|
|
|
T3N0M0
|
опухоль инвазирует в серозную оболочку
без инвазии в соседние органы
|
||
|
Стадия II E
|
IIE1 – поражение регионарных
лимфатических узлов
|
T1-3N1M0
|
поражение регионарных лимфатических
узлов
|
|
IIE2 – поражение интраабдоминальных
нерегионарных лимфатических узлов
|
T1-3N2M0
|
поражение интраабдоминальных
нерегионарных лимфатических узлов
|
|
|
Стадия III
|
опухоль инвазирует в соседние органы
|
T4N0M0
|
опухоль инвазирует в соседние органы
|
|
Стадия IV
|
поражение экстраабдоминальных
лимфатических узлов, опухолевое
поражение других органов и тканей
(легкое, плевра, брюшина, миндалины,
печень, селезенка, почки и т.д.
|
T1-4N3M0
|
поражение экстраабдоминальных
лимфатических узлов
|
|
T1-4N1-3M1
|
опухолевое поражение других органов и
тканей (легкое, плевра, брюшина,
миндалины, печень, селезенка, почки и т.д.)
|
||
Рисунок 40.7 – Парижская и Лугано классификация первичных гастроинтестинальных лимфом
Ультразвуковое исследование показано для исключения поражения регионарных лимфоузлов и инфильтрации стенки желудка.
Если доказано наличие H.pylori инфекции, распространенность процесса находится в пределах IE стадии и отсутствует транслокация t (11; 18), то таким пациентам обязательно показана анти H.pylori терапия (рисунок 40.8).
Рисунок 40.8 – Лечебный алгоритм H.pylori позитивной MALT-лимфомы желудка I-IIE1 ст
Наиболее часто используется следующий режим:
- Ингибиторы протонной помпы (Омепразол 20 мг или Пантопразол 40 мг или Лансопразол 30 мг) внутрь два раза в день за 30 мин до еды;
- Амоксициллин 1000 мг внутрь два раза в день за 30 мин до еды;
- Кларитромицин 500 мг внутрь два раза в день за 30 мин до еды;
-
Продолжительность лечения 14 дней.
При непереносимости амоксициллина его заменяют Метронидазолом – по 500 мг внутрь два раза в день во время еды.
Добиться эрадикации удается в 50–80 % случаев, а медиана времени наступления полной регрессии составляет пять месяцев. Опухоли с транслокациями t (11; 18) или t (1; 14) не чувствительны к антибактериальной терапии. При наличии таких транслокаций методом выбора является лучевая терапия.
Эрадикация H. Pylori может способствовать регрессии лимфомы и длительному ремиссии у большинства пациентов. Время до наступления ремиссии может колебаться от нескольких до 12 месяцев. Таким образом, у пациентов, достигших клинической и эндоскопической ремиссии, вместе с эрадикацией H. Pylori, но имеющих резидуальные гистологические признаки лимфомы, имеет смысл выдержать интервал как минимум 12 месяцев перед переходом на другую терапию.
В H. Pylori-негативных случаях, в также при отсутствии эффекта от первичной антибактериальной терапии, в зависимости от стадии заболевания, показано применение лучевой или системной химиотерапии.
Хирургический метод не показал преимуществ в сравнении с более консервативными методами. ВH. Pylori-негативных ситуациях и при персистировании лимфомного клона после эрадикационной антибиотикотерапии высокоэффективна лучевая терапия (РОД 1,5 Гр, СОД 30–40 Гр, 4 недели) на область желудка и регионарных лимфатических узлов.
Для пациентов с распространенным процессом показана системная химиотерапия в сочетании с ритуксимабом.
Алкилирующие препараты (циклофосфан, хлорамбуцил, бендамустин), а также флударабин показали высокую эффективность. Агрессивные антрациклин-содержащие режимы показаны к применению только в случаях болезни с агрессивным течением и большой опухолевой массой.
40.12.2. Диффузная В-клеточная лимфома желудка.
Должна быть лечена в соответствии с рекомендациями, разработанными для первичных диффузных В-клеточных лимфом других локализаций.
В основе наблюдения лежит регулярное эндоскопическое исследование желудка с многократными биопсиями. Первая гастроскопия должна быть проведена через 2–3 месяца после окончания терапии для подтверждения эрадикации H. Pylori; далее для мониторинга гистологической регрессии лимфомы исследование должно повторяться как минимум дважды в год на протяжении первых 2-х лет.
В случаях персистирующей, но стабильной резидуальной болезни или гистологических рецидивах (без наличия отдаленных метастазов и/или эндоскопически отчетливой опухоли) может быть применена тактика «наблюдай и жди».
При других формах первичного экстранодального поражения (паращитовидная железа, щитовидная железа, орбита, легкое, кишечник, молочная железа, кожа и т.д.) тактика лечения определяется распространенностью процесса. В случаях, когда возможно радикальное хирургическое вмешательство, лечение начинается с операции. Если операция выполнена в объеме R0, то дополнительное лечение не требуется. Если радикальное хирургическое вмешательство невыполнимо, то методом выбора является лучевая терапия в СОД 24–30 Гр за 12–20 фракций. При экстранодальном поражении в большинстве случаев в клинический объем облучения (CTV) включается весь пораженный орган (например желудок, слюнная железа, щитовидная железа и т.д.). Для молочной железы, мягких тканей, костей и локализованного облучения кожи после проведения ПХТ возможно включение в CTV части пораженного органа.
При распространенных формах – химиотерапия в тех же режимах, как и при MALT- лимфоме желудка.
40.13. Лимфомы из клеток маргинальной зоны.
40.13.1. Лимфома из клеток маргинальной зоны селезенки.
Это особый тип лейкемически протекающей В-клеточной лимфомы и составляет около 1 % среди всех НХЛ. В клинической картине доминирует спленомегалия. Лимфоаденопатия отступает на второй план. В большинстве случаев имеется поражение костного мозга.
Лечение как и при фолликулярной лимфоме. Если имеется гиперспленизм, показана спленэктомия.
40.13.2. Нодальная лимфома В-клеточная лимфома из клеток маргинальной зоны.
Течение индолентное, не имеет склонности к ранней диссеминации. Лечение – как при фолликулярной лимфоме.
40.14. Мантийно-клеточная лимфома.
Составляет 4–10 % от всех вариантов НХЛ. В подавляющем большинстве случаев лимфома развивается из В-клеток, не имеющих мутаций гена IGHV. При этом возникают как нодальные, так и экстранодальные очаги поражения и процесс, в связи с агрессивным течением, диагностируется, как правило, в распространенных стадиях.
У части пациентов лимфома развивается из В-клеток с мутациями гена IGHV и имеет гиперэкспрессию протеина SOX11. При этом чаще наблюдается индолентное течение процесса, при котором показана выжидательная тактика. Химиотерапия начинается при появлении признаков агрессивного течения (таблица 40.16).
Таблица 40.16. Признаки агрессивного течения
|
Индолентный вариант
|
Агрессивный вариант
|
|
|
Оптимальные режимы лечения мантийно-клеточной лимфомы пока не определены.
При I–II ст. (диагностируется редко) проводится химиолучевое лечение: RCHOP × 4–6 курсов с последующим облучением зоны исходного поражения и смежных областей в РОД 1,8–2 Гр до СОД 40 Гр. При достижении полной регрессии – высокодозная химиотерапия с трансплантацией стволовых аутологичных гемопоэтических клеток, при противопоказаниях к ней – поддерживающая терапия ритуксимабом каждые 3 месяца в течение 2-х лет.
Выбор программы лечения конкретного пациента с распространенностью процесса в пределах III–IV ст. определяется его возрастом и сопутствующей патологией (рисунок 40.9.).
Пациентам в возрасте <65 лет, без выраженной сопутствующей патологии, т.е. кандидатам для высокодозной химиотерапии с трансплантацией аутологичных стволовых клеток, проводятся 4 альтернирующих курса R-CHOP и R-DHAP. Если получена полная или частичная регрессия, то проводятся еще 2 курса и затем высокодозная химиотерапия. В последующем – поддерживающая терапия ритуксимабом каждые 3 месяца в течение 2-х лет.
Пациентам в возрасте >65 лет и более молодым (не кандидатам для высокодозной химиотерапии) с учетом сопутствующей патологии и побочных эффектов химиотерапевтических режимов лечение проводится с использованием схем: R-EPOCH, R-DA-EPOCH, R-СНОР, R-бендамустин, R-бортезомиб.
Для лечения пациентов старше 70 лет с тяжелым общим состоянием проводится только монохимиотерапия.
При возникновении рецидива или прогрессирования болезни после двух линий химиотерапии, одна из которых включала бортезомиб, может быть применен леналидомид. Возможность его назначения определяется мультидисциплинарным консилиумом специалистов онкологического центра.
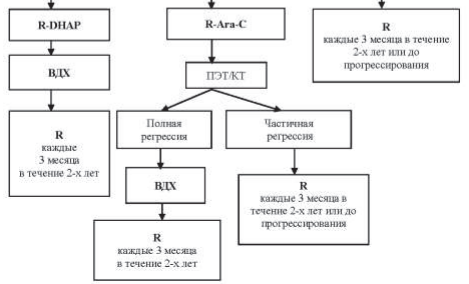
Рисунок 40.9 – Общий план лечения пациентов с мантийно-клеточной лимфомой
40.15. Лимфома Беркитта
Среди всех вариантов НХЛ этот тип опухоли составляет 2 %. Отличается крайне агрессивным течением, наиболее частой локализацией опухоли у заболевших европейцев (спорадический тип) являются абдоминальные лимфатические узлы и толстая кишка с вторичным вовлечением мезентериальных лимфатических узлов, яичников, почек, молочных желез. Поражение костного мозга наблюдается примерно у 20 % пациентов, центральной нервной системы – в 60–70 % случаев.
Лимфома Беркитта – одно из самых быстро пролиферирующих злокачественных новообразований, содержит 100 % делящихся клеток и время удвоения в среднем составляет 25 часов. В связи с этим она относится к «ургентным» онкологическим заболеваниям. Проведение всего объема диагностических мероприятий должно быть выполнено в максимально короткий промежуток времени. Лечение должно быть начато сразу же после установления диагноза.
Стадирование процесса проводится по системе AnnArbor (реже) или по системе StJude/Murphy (чаще).
Таблица 40.17. Стадирование лимфомы Беркитта (Jude/Murphy, 1980)
|
Стадия
|
Проявления
|
|
I
|
Одиночная опухоль (экстранодальная) или одна анатомическая зона (нодальная) за исключением средостения и абдоминальной области
|
|
II
|
Одиночная опухоль (экстранодальная) с региональными лимфатическими узлами.
Две экстранодальные опухоли в сочетании или без вовлечения регионарных лимфатических узлов по одну сторону диафрагмы.
Первичная опухоль желудочно-кишечного тракта в сочетании или без вовлечения мезентериальных лимфатических узлов.
Два или более нодальных очага по одну сторону диафрагмы.
|
|
IIR
|
Полностью резецированные абдоминальные опухоли.
|
|
III
|
Поражение по обе стороны диафрагмы:
а) две экстранодальные опухоли;
б) два и более нодальных очага.
Все первичные внутригрудные опухоли;
Все первичные интраабдоминальные опухоли (медиастинальные, плевральные, тимуса).
Все первичные интраабдоминальные очаги больших размеров.
Все первичные параспинальные или эпидуральные опухоли независимо от наличия других опухолей.
|
|
IIIA
|
Ограниченные брюшной полостью, но нерезектабельные опухоли.
|
|
IIIB
|
Распространенные мультиорганные абдоминальные опухоли.
|
|
IV
|
Любое вышеуказанное проявление болезни с поражением ЦНС или костного мозга.
|
Основным методом лечения лимфомы Беркитта является химиотерапия (модифицированные протоколы: NHL-BFM для зрелых В-клеточных лимфом и CODOXM/ IVAC с добавлением ритуксимаба).
К обязательным компонентам лечения относится профилактика поражения ЦНС. Учитывая неблагоприятный прогноз и склонность к ранней диссеминации, при лечении лимфомы Беркитта используется многокомпонентная химиотерапия с соблюдением принципов лечения острого лимфобластного лейкоза и использования высоких доз метотрексата.
Лечение должно начинаться как можно быстрее с момента установления диагноза.
40.15.1. Лечение по модифицированному протоколу NHL-BFM.
Химиотерапия состоит из блоков, проводимых каждые 3 недели. Успех лечения во многом зависит от соблюдения такого временного интервала. Большинству пациентов требуется проведение первичной профилактики нейтропении: филграстим 5 мкг/кг подкожно, ежедневно, в течение 7 суток, начиная через 24–72 часа после окончания курса химиотерапии. Как альтернатива – однократная инъекция пэгфилграстима после окончания химиотерапии.
Число блоков зависит от Группы риска (таблица 40.18).
Таблица 40.18. Группы риска
|
Группа риска 1
|
-
|
первичная опухоль макроскопически полностью удалена.
|
|
Группа риска 2
|
-
|
первичная опухоль не удалена или удалена не полностью: только
эктраабдоминальное поражение; интраабдоминальная локализация при
показателях ЛДГ, не более 500 до начала ПХТ после инициальной операции.
|
|
Группа риска 3
|
-
|
первичная опухоль не удалена или удалена не полностью, и имеет место хотя бы
один из ниже перечисленных признаков:
а) при абдоминальном поражении увеличение ЛДГ более 500 перед началом ПХТ
после инициальной операции; б) поражение ЦНС; в) поражение костного мозга;
г) мультифокальное поражение костей.
|
Пациенты Группы риска 1 получают два блока химиотерапии А-В. У пациентов Группы риска 2 химиотерапия состоит из 4-х блоков: АА-ВВ-АА-ВВ. Пациенты Группы риска 3 получают шесть блоков: АА-ВВ-АА-ВВ-АА-ВВ (рисунок 40.10).
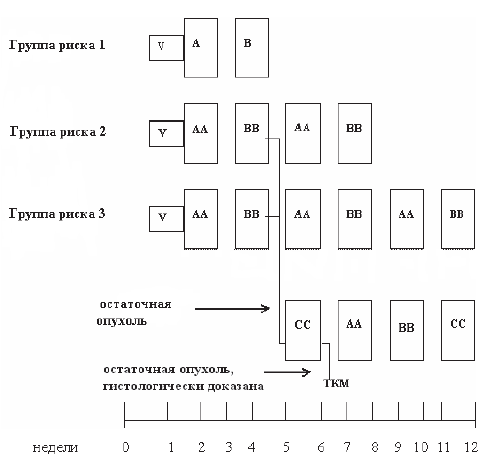
Рисунок 40.10 – Общий план лечения пациентов лимфомой Беркитта в зависимости от Группы риска
При отсутствии эффекта на проводимую терапию (уменьшение опухолевой массы менее чем на 70 % после 2-х блоков химиотерапии, прогрессирование процесса) дальнейшая терапия проводится по схеме: СС-АА-ВВ-СС. При отсутствии эффекта на блок СС обсуждается вопрос о проведении высокодозной химиотерапии с трансплантацией стволовых гемопоэтических клеток.
Перед началом основной химиотерапии всем пациентам с целью предупреждения синдрома лизиса опухоли обязательно проводится циторедуктивная предфаза (V) на фоне гидратации (1,5–2 л/м2), одновременно пациенты получают аллопуринол в дозе 560 мг в первые два дня и затем по 300 мг ежедневно.
Предфаза (V):
Циклофосфамид 200 мг/м2 внутривенно в течение 60 мин 1, 2, 3, 4, 5-й дни.
Дексаметазон 16 мг внутрь 1, 2, 3, 4, 5-й дни.
Дексаметазон (4 мг), метотрексат (15 мг), цитарабин (40 мг) интратекально 1 день.
Основные блоки химиотерапии начинаются сразу же после завершения предфазы. Введение цитостатиков осуществляется на фоне непрерывной гидратации (1,5–2 л/м2). При введении метотрексата помимо гипергидратации (инфузионная терапия 3 л/м2 в/в, прегидратация осуществляется не менее 6 ч) проводится ощелачивание мочи под контролем рН, который должен быть на уровне >7,4 в течение всего периода введения и выведения препарата. Скорость инфузии метотрексата: в течение первых 30 мин вводится 10 % от расчетной дозы препарата, затем в течение 23,5 ч вводится оставшаяся расчетная доза. В первом блоке АА доза метотрексата может быть снижена до 500 мг/м2 у пациентов старше 50 лет или при ограничении функции почек или при наличии у пациентов серозного выпота (асцит, плеврит). После окончания введения метотрексата продолжается гипергидратация еще в течение двух суток. Через 42 ч от начала введения метотрексата начинается введение антидота – кальция фолината каждые 6 ч. Введение кальция фолината продолжается до тех пор, пока концентрация метотрексата в сыворотке крови не станет менее 0,05 мкмоль/л.
Доза кальция фолината корригируется в зависимости от скорости выведения метотрексата (уровень метотрексата в сыворотке крови (рисунок 40.11.). За 30 минут до начала каждого введения цитарабина в дозе 2 г/м2 (блок СС) показано внутривенное введение пиридоксина гидрохлорида в дозе 150 мг/м2, в дни введения цитарабина в указанной выше дозе обязательно назначаются глазные капли с кортикостероидами 6 раз в день, и физиологическим раствором в виде глазных капель, которые чередуются с каплями с кортикостероидами – 6 раз в день.
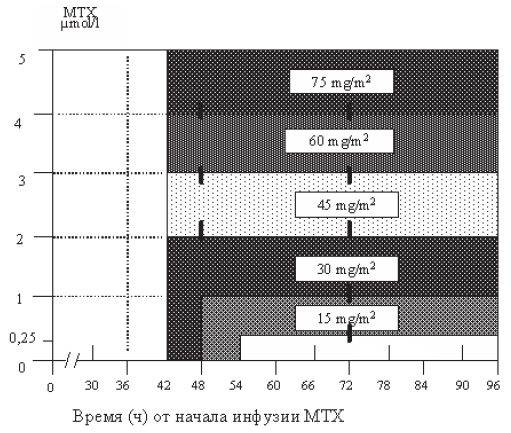
Рисунок 40.11 – Схема назначения антидота – кальция фолината в зависимости от уровня МTX в сыворотке крови
При проведении курсов химиотерапии обязательно назначение сопроводительной терапии: амоксициллин/клавулоновая кислота (по 375 мг 3 раза в день) или амоксициллин (по 500–750 мг 2 раза в день); ко-тримоксазол (по 480 мг 2 раза в день три дня в неделю); флуконазол (150 мг 1 раз в день). Профилактика мукозита осуществляется обработкой полости рта антисептическими растворами. Противовирусные препараты назначаются у всех пациентов с позитивной серологией HerpesSimplex и при неясных инфекционных состояниях. Рекомендуется также назначение внутривенного иммуноглобулина 1 раз в 3 недели в дозе 0,1–0,2 мг/кг. При развитии фебрильной нейтропении лечение проводится в соответствии с алгоритмами лечения данного состояния и результатами клинико-лабораторных исследований.
Блок А:
Ритуксимаб 375 мг/м2 внутривенно 0 день (за день до начала химиотерапии).
Дексаметазон 10 мг/м2/день внутрь (внутривенно) 1, 2, 3, 4, 5 дни.
Этопозид 100 мг/м2 внутривенно в течение 60 мин. 4, 5 дни.
Цитарабин 150 мг/м2 внутривенно в течение 60 мин. каждые 12 часов (всего 4 дозы) 4, 5 дни.
Метотрексат 500 мг/м2 внутривенная 24-часовая инфузия 1-й день.
Кальция фолинат 15 мг/м2 внутривенно струйно на 42, 48 и 54 ч от начала инфузии МTX (с учетом режима выведения, рисунок 16).
Ифосфамид 800 мг/м2внутривенно в течение 60 мин. 1, 2, 3, 4, 5 дни.
Месна 200 мг/м2внутривенно струйно (до введения ифосфамида, на 4 и 8 ч от начала введения ифосфамида).
Метотрексат (15 мг), цитарабин (40 мг), дексаметазон (4 мг) интратекально 1-й день.
Блок В:
Ритуксимаб 375 мг/м2 внутривенно 0 день (за день до начала химиотерапии).
Дексаметазон 10 мг/м2 внутрь (внутривенно) 1,2,3,4,5 дни.
Винкристин 1,5 мг/м2 (max 2 мг) внутривенно струйно 1-й день.
Доксорубицин 25 мг/м2внутривенно в течение 60 мин. 4,5 дни.
Метотрексат 500 мг/м2 внутривенная 24-часовая инфузия 1-й день.
Кальция фолинат 15 мг/м2 внутривенно струйно на 42, 48 и 54 ч от начала инфузии МTX (с учетом режима выведения, рисунок 16).
Циклофосфамид 200 мг/м2внутривенно в течение 60 мин. 1, 2, 3, 4, 5 дни.
Метотрексат (15 мг), цитарабин (40 мг), дексаметазон (10 мг) интратекально 1-й день.
Блок АА:
Ритуксимаб 375 мг/м2 внутривенно 0 день (за день до начала химиотерапии).
Дексаметазон10 мг/м2 внутрь (внутривенно) 1,2,3,4,5 дни.
Винкристин 1,5 мг/м2 (max 2 мг) внутривенно струйно 1-й день.
Этопозид 100 мг/м2 внутривенно в течение 60 мин. 4, 5 дни.
Цитарабин 150 мг/м2 внутривенно в течение 60 мин. каждые 12 часов (всего 4 дозы) 4, 5 дни.
Метотрексат 3000 мг/м2 внутривенная 24-х часовая инфузия 1-й день.
Кальция фолинат 30 мг/м2 внутривенно струйно на 42, 48, 54, 60, 66, 72 ч от начала инфузии МTX (с учетом режима выведения, рисунок 16).
Ифосфамид 800 мг/м2 внутривенно в течение 60 мин. 1, 2, 3, 4, 5 дни.
Месна 200 мг/м2 внутривенно струйно (до введения ифосфамида, на 4 и 8 ч от начала введения ифосфамида).
Метотрексат (7,5 мг), цитарабин (20 мг), дексаметазон (2 мг) интратекально 1, 5 дни.
Блок ВВ:
Ритуксимаб 375 мг/м2 внутривенно 0 день (за день до начала химиотерапии).
Дексаметазон 10 мг/м2 внутрь (внуривенно) 1, 2, 3, 4, 5 дни.
Винкристин 1,5 мг/м2 (max 2 мг) внутривенно струйно 1-й день.
Доксорубицин 25 мг/м2 внутривенно в течение 60 мин. 4, 5 дни.
Метотрексат 3000 мг/м2 внутривенная 24-х часовая инфузия 1-й день.
Кальция фолинат 30 мг/м2 внутривенно струйно на 42, 48, 54, 60, 66, 72 ч от начала инфузии МTX (с учетом режима выведения, рисунок 16).
Циклофосфамид 200 мг/м2 внутривенно в течение 60 мин. 1, 2, 3, 4, 5 дни.
Метотрексат (7,5 мг), цитарабин (20 мг), дексаметазон (2 мг) интратекально 1,5 дни.
Блок CС:
Ритуксимаб 375 мг/м2 внутривенно 0 день (за день до начала химиотерапии).
Дексаметазон 20 мг/м2 внутрь (внутривенно) 1,2,3,4,5 дни.
Винкристин 1,5 мг/м2 (max 2 мг) внутривенно струйно 1-й день.
Цитарабин 2 г/м2 внутривенно в течение 3-х часов каждые 12 часов (всего 4 дозы) 4,5 дни.
Этопозид 150 мг/м2 внутривенно в течение 60 мин. 1,2 дни.
Метотрексат (7,5 мг), цитарабин (20 мг), дексаметазон (2 мг) интратекально 1,5 дни.
40.15.2. Лечение по протоколу R-CODOX-M/R-IVAC.
Программа лечения зависит от Группы риска (низкий или высокий), к которой относится пациент. Низкий риск – у пациента имеются 3 или все показатели: ЛДГ ВГН, статус ECOG – 0–1, стадия I–II, не более одного экстранодального опухолевого поражения (костный мозг, желудочно-кишечный тракт, ЦНС). Высокий риск – у пациента имеются 2 или более показателя: ЛДГ> ВГН, статус ECOG – 2–4, стадия III–IV, более одного экстранодального опухолевого поражения. Интервал между курсами химиотерапии должен быть минимальным. Следующий курс нужно начинать, когда в периферической крови количество нейтрофилов ≥1,0×109 /л и тромбоциты ≥75,0×109/л.
Лечение начинается с предфазы как и по протоколу BFM. Методики всей общей сопроводительной терапии, инфузионной терапии при введении высокодозного метотрексата и сопроводительной терапии при введении цитарабина такие же как в протоколе BFM.
Общий план лечения пациентов и режимы химиотерапии представлены на рисунке 40.12 и в таблицах 40.19, 40.20.
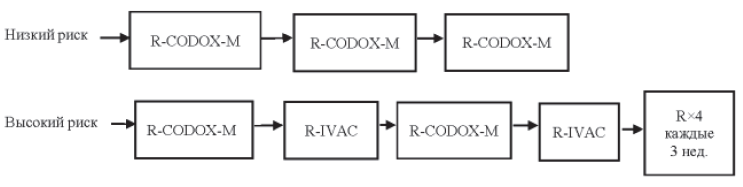
Рисунок 40.12 – Общий план лечения пациентов лимфомой Беркитта по протоколу R-CODOX-M/R-IVAC в зависимости от Группы риска
Таблица 40.19. Режим R-CODOX-M
|
R-CODOX-M, дни
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
|
Ритуксимаб 375 мг/м2
|
х
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Циклофосфамид 800 мг/м2
|
х
|
х
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Доксорубицин 50 мг/м2
|
х
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Винкристин 1,5 мг/м2
|
х
|
|
|
|
|
|
|
|
|
|
|
|
|
|
х
|
|
|
Аллопуринол 300 мг/день
|
х
|
х
|
х
|
х
|
х
|
х
|
х
|
х
|
х
|
х
|
|
|
|
|
|
|
|
Метотрексат× 3000 мг/м2 в течение 2 ч.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
х
|
|
|
Лейковорин 30 мг/м2 4 раза в сутки через 24 ч после
начала введения метотрексата до уровня метотрексата
в сыворотке крови < 0,05 мкмоль/л
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
х
|
|
Метотрексат 12 мг ИТ
|
х
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Цитарабин 50 мг ИТ
|
|
|
х
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пэгфилграстим 6 мг
|
|
|
х
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
При отсутствии пэгфилграстима – филграстим 5 мг/кг/сутки, 3–10-е сутки
|
||||||||||||||||
|
Если до начала лечения было поражение ЦНС, то цитарабин 50 мг вводится ИТ на 3 и 5-й дни на 1-ом курсе
|
||||||||||||||||
|
× У пациентов в возрасте > 65 лет метотрексат вводится в дозе 1000 мг/м2 в течение 2 ч
|
||||||||||||||||
Таблица 40.20. Режим R-IVAC
|
R-IVAC, дни
|
1
|
2
|
3
|
4
|
5
|
6
|
|
Ритуксимаб 375 мг/м2
|
x
|
|
|
|
|
|
|
Цитарабин 2 г/м2 каждые 12 часов 4 введения
|
xx
|
xx
|
|
|
|
|
|
Ифосфамд 1500 мг/м2
|
x
|
x
|
x
|
x
|
x
|
|
|
Месна 360 мг/м2 каждые 3 часа
|
xxx
|
xxx
|
xxx
|
xxx
|
xxx
|
xxx
|
|
Этопозид 60 мг/м2
|
x
|
x
|
x
|
x
|
x
|
|
|
Метотрексат 12 мг ИТ
|
|
|
|
|
x
|
|
|
Пэгфилграстим 6 мг
|
|
|
|
|
|
x
|
|
При отсутствии пэгфилграстима – филграстим 5 мг/кг/сутки, 6–11-е сутки
|
||||||
|
Если до начала лечения было поражение ЦНС, то цитарабин 50 мг вводится ИТ и на 3-й день 1-го курса
|
||||||
40.16. Лимфобластная из В-клеток предшественников лимфома, лимфобластная из Т-клеток предшественников лимфома.
Для лечения этих вариантов лимфом обычно используются единые программы лечения. Пациенты при отсутствии соматических противопоказаний получают терапию в соответствии с модифицированным протоколом лечения NHL-BFM. Стратегия терапии определяется стадией болезни (рисунок 40.13).
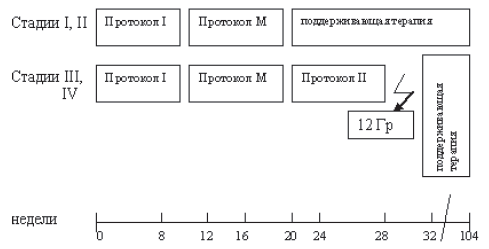
Рисунок 40.13 – Схема лечения лимфобластной из В-клеток предшественников лимфомы, лимфобластной из Т-клеток предшественников лимфомы
У пациентов 1–2-й стадий заболевания лечение включает Протокол I, Протокол М и поддерживающую терапию. При 3–4-й стадии пациенты получают Протокол I, Протокол М, Протокол II, облучение головного мозга и поддерживающую терапию. Интервалы между Протоколом I, Протоколом М и Протоколом II составляют 2 недели. Облучение головного мозга у пациентов 3–4 стадиями (РОД 1,8 Гр СОД 12,6 Гр) начинается сразу же после завершения Протокола II. Поддерживающая химиотерапия начинается через 2 недели после завершения предшествующего этапа лечения и продолжается 1,5 года. При проведении Протокола I у пациентов с большой массой опухоли во избежание синдрома лизиса опухоли начальная доза преднизолона должна составлять 0,2–0,5 мг/кг/день с постепенным повышением дозы в течение 5-ти дней до 60 мг/м2. При применении L-аспарагиназы имеется опасность развития гипергликемии, нарушений со стороны свертывающей системы крови, а также токсических осложнений со стороны поджелудочной железы (амилазный синдром или аспарагиназный панкреатит). Необходим контроль показателей коагулограммы (особенно фибриногена, уровень фибриногена должен превышать 1 г/л) 1–2 раза в неделю, панкреатической амилазы и диастазы мочи, УЗИ/КТ поджелудочной железы (по показаниям). Началу 2-й фазы Протокола I (36 день), Протокола М и Протокола II должны соответствовать следующие гематологические показатели: лейкоциты >2000/мм3, Гранулоциты >1500/мм3, тромбоциты >100 000/мм3.
При проведении курсов химиотерапии обязательно назначение сопроводительной терапии: амоксициллин/клавулоновая кислота (по 375 мг 3 раза в день) или амоксициллин (по 500–750 мг 2 раза в день); ко-тримоксазол (по 480 мг 2 раза в день три дня в неделю, препарат не назначается на протоколе M); флуконазол (150 мг 1 раз в день). Профилактика мукозита осуществляется обработкой полости рта антисептическими растворами. Противовирусные препараты назначаются у всех пациентов с позитивной серологией HerpesSimplex и при неясных инфекционных состояниях. Рекомендуется также назначение внутривенного иммуноглобулина 1 раз в 3 недели в дозе 0,1–0,2 мг/кг. При развитии фебрильной нейтропении лечение проводится в соответствии с алгоритмами лечения данного состояния и результатами клинико-лабораторных исследований.
Протокол I:
Преднизолон по 20 мг/м2 3 раза в день внутрь 1–28 дни (редукция дозы с 29 дня на 50 % каждые 3 дня).
Винкристин 1,5 мг/м2 (max 2 мг) внутривенно струйно 8, 15, 22, 29 дни.
Даунорубицин 30 мг/м2 внутривенно 1-часовая инфузия 8, 15, 22, 29 дни.
L-аспарагиназа 5 000 Ед/м2 внутривенно 1-часовая инфузия 12, 15, 18, 21, 24, 27, 30, 33 дни.
Циклофосфамид 1000 мг/м2 внутривенно 1-часовая инфузия 36, 64 дни.
Месна 200 мг/м2 внутривенно струйно перед введением циклофосфамида на 4-й и 8-й ч в 36, 64 дни.
6-меркаптопурин 60 мг/м2 внутрь 36–63 дни (всего 28 дней).
Цитарабин 75 мг/м2 внутривенно 1-часовая инфузия 38–41 дни (4 введения), 45–48 дни (4 введения), 52–55 дни (4 введения), 59–62 дни (4 введения).
Метотрексат 15 мг интратекально 0,15,29,45,59 дни.
Протокол М (начинается через 2 недели после Протокола I).
6-меркаптопурин 25 мг/м2 внутрь1–57 дни.
Метотрексат 3000 мг/м2 внутривенно 24-часовая инфузия 8,22,36,50 дни.
Кальция фолинат 30 мг/м2 внутривенно струйно на 42, 48, 54, 60, 66, 72 ч от начала инфузии МTX (с учетом режима выведения).
Метотрексат 15 мг интратекально 8,22,36,50 дни.
Протокол II (начинается через 2 недели после Протокола М).
Дексаметазон 10 мг/м2 внутрь за 3 приема 1–21 дни (редукция дозы с 22 дня на 50 % каждые 3 дня).
Винкристин 1,5 мг/м2(max 2 мг) внутривенно струйно8, 15, 22,29 дни.
Доксорубицин 30 мг/м2 внутривенно 1-часовая инфузия 8, 15, 22, 29 дни.
L-аспарагиназа 5 000 Ед/м2 внутривенно 1-часовая инфузия 8, 11, 15, 18 дни.
Циклофосфамид 1000 мг/м2 внутривенно 1-часовая инфузия 36-й день.
Месна 200 мг/м2 внутривенно струйно перед введением циклофосфамида, на 4-й и 8-й ч в 36, 64 дни.
6-меркаптопурин 60 мг/м2 внутрь36–49 дни (всего 14 дней).
Цитарабин 75 мг/м2 внутривенно 1-часовая инфузия 38–41дни (4 введения), 45–48 дни (4 введения).
Метотрексат 15 мг интратекально 38, 45 дни.
Поддерживающая терапия.
Поддерживающая терапия начинается через 2 недели после завершения основных
блоков лечения и продолжается в течение 1,5 лет. Используются: 6-меркаптопурин – 50 мг/м2 ежедневно внутрь за один прием вечером; метотрексат – еженедельно 20 мг/м2 внутрь.
Коррекция доз обоих препаратов осуществляется в зависимости от показателей уровня лейкоцитов и лимфоцитов (таблица 40.21).
Таблица 40.21. Дозы препаратов в зависимости от показателей уровня лейкоцитов и лимфоцитов
|
Количество лейкоцитов/мкл
|
Доза 6-меркаптопурина и метотрексата
|
|
Менее 1000
|
0%
|
|
От 1000 до 2000
|
50%
|
|
От 2000 до 3000
|
100%
|
|
Более 3000
|
150%
|
|
Лимфоциты менее 300/мкл
|
50%
|
При отсутствии эффекта на проводимую терапию (уменьшение опухолевой массы менее чем на 70 % на 33-й день протокольного лечения или прогрессирование опухоли) дальнейшая терапия проводится по альтернирующим блокам протокола Группы высокого риска (рисунок 40.14). При поражении костного мозга выполняются диагностические миелограммы на 15-й, 33-й и 71-й дни протокольного лечения. На протокол Группы высокого риска переводятся также пациенты с наличием на 71-й день протокольного лечения (перед началом проведения Протокола М) остаточной опухоли, содержащей жизнеспособные клетки по данным морфологического исследования.

Рисунок 40.14 – Схема терапии Группы высокого риска
При проведении курсов химиотерапии обязательно назначение сопроводительной терапии: амоксициллин/клавулоновая кислота (по 375 мг 3 раза в день) или амоксициллин (по 500–750 мг 2 раза в день); ко-тримоксазол (по 480 мг 2 раза в день три дня в неделю); флуконазол (150 мг 1 раз в день). Профилактика мукозита осуществляется обработкой полости рта антисептическими растворами. Противовирусные препараты назначаются у всех пациентов с позитивной серологией HerpesSimplex и при неясных инфекционных состояниях. Рекомендуется также назначение внутривенного иммуноглобулина 1 раз в 3 недели в дозе 0,1–0,2 мг/кг. При развитии фебрильной нейтропении лечение проводится в соответствии с алгоритмами лечения данного состояния и результатами клинико-лабораторных исследований.
Блок 1:
Дексаметазон 20 мг/м2 внутрь за 3 приема 1, 2, 3, 4, 5 дни.
6-меркаптопурин 100 мг/м2 внутрь 1, 2,3, 4, 5 дни.
Винкристин 1,5 мг/м2 (max 2 мг) внутривенно струйно 1,6 дни.
Цитарабин 2 г/м2 внутривенно 3-часовая инфузия каждые 12 часов (2 дозы) 5-й день.
Метотрексат 5000 мг/м2 внутривенная 24-х часовая инфузия 1-й день.
Кальция фолинат 30 мг/м2 внутривенно струйно на 42, 48, 54, 60, 66, 72 ч от начала инфузии метотрексата (рисунок 16).
L-аспарагиназа 25 000 Ед/м2 внутримышечно 6-й день.
Метотрексат 15 мг, цитарабин 40 мг, дексаметазон 4 мг интратекально 1-й день.
Блок 2:
Дексаметазон 20 мг/м2 внутрь за 3 приема 1, 2, 3, 4, 5 дни.
6-меркаптопурин 100 мг/м2 внутрь 1, 2, 3, 4, 5 дни.
Винкристин 1,5 мг/м2 (max 2 мг) внутривенно струйно 1-й день.
Даунорубицин 50 мг/м2 внутривенно 1-часовая инфузия 5-й день.
Метотрексат 5000 мг/м2 внутривенная 24-часовая инфузия 1-й день.
Кальция фолинат 30 мг/м2 внутривенно на 42, 48, 54, 60, 66, 72 ч от начала инфузии метотрексата (с учетом режима выведения, рисунок 16).
Ифосфамид 400 мг\м2 внутривенно 1-часовая инфузия 1, 2, 3, 4, 5 дни.
Месна 100 мг/м2 внутривенно струйно (до введения ифосфамида, на 4 и 8 ч от начала введения ифосфамида).
L-аспарагиназа 25 000 Ед/м2 внутримышечно 6-й день.
Метотрексат 15 мг, цитарабин 40 мг, дексаметазон 4 мг интратекально 1-й день.
Блок 3:
Дексаметазон 20 мг/м2 внутрь за 3 приема 1, 2, 3, 4, 5 дни.
Цитарабин 2 г/м2 внутривенно 3-часовая инфузия каждые 12 часов (4 введения) 1, 2 дни.
Этопозид 150 мг/м2 внутривенно 1-часовая инфузия 3, 4, 5 дни.
L-аспарагиназа 25 000 Ед/м2 внутримышечно 6-й день.
Метотрексат 15 мг, цитарабин 40 мг, дексаметазон 4 мг интратекально 5-й день.
За 30 минут до начала каждого введения цитарабина внутривенно, струйно вводится пиридоксина гидрохлорид 150 мг/м2, также в дни введения цитарабин обязательно назначаются глазные капли с кортикостероидами 6 раз в день.
После 9-ти блоков химиотерапии проводится облучение головного мозга (РОД 1,8 Гр СОД 12,6 Гр), через 2 недели после завершения облучения начинается поддерживающая химиотерапия (6-меркаптопурин+метотрексат в течение 1,5 лет).
При наличии остаточной опухоли после 3-х блоков обсуждается вопрос о применении высокодозной химиотерапии.
40.17. Ангиоиммунобластная Т-клеточная лимфома.
Течение заболевания – агрессивное. При прогрессировании наступает трансформация в высокозлокачественные варианты лимфом, в том числе и В-клеточного типа.
В начале заболевания для лечения может использоваться гормонотерапия преднизолоном 30–40 мг в сутки или реже 1 мг/кг в сутки в течение 7–10 дней. При прогрессировании болезни и трансформации болезни в НХЛ высокой степени злокачественности для лечения используются схемы СНОР или DHAP.
Вопрос о проведении высокодозной химиотерапии с трансплантацией аутологичных стволовых клеток и проведении лучевой терапии решается индивидуально.
Т-клеточная лимфома взрослых.
Т-клеточная лимфома взрослых.
Стандартных режимов лечения не существует. Предпочтительно участие в клинических исследованиях. Лечение пациентов начинают с химиотерапии по схемам СНОР или DA-EPOCH 6–8 курсов. Лучевая терапия после завершения химиотерапии проводится только на зоны с неполной регрессией опухоли и на очаги с исходно большой опухолевой массой в СОД 36–40 Гр за 18–20 фракций.
У всех пациентов независимо от стадии, при достижении полной ремиссии, необходимо обсуждать вопрос о проведении высокодозной терапии с аллотрансплантацией гемопоэтических стволовых клеток.
40.18. ALK-позитивная В-крупноклеточная лимфома, анапластическая крупноклеточная лимфома ALK-позитивная, анапластическая крупноклеточная лимфома ALK-негативная, периферическая Т-клеточная лимфома.
Стандартными методами лечения является химиотерапия по схеме CHOP, CHOEP, DA-EPOCH. Если опухоль экспрессирует CD20 антиген к лечению должен быть добавлен ритуксимаб.
При I и II стадиях у пациентов Группы низкого и промежуточного низкого риска (aaIPI <1) после проведения 4–6 курсов химиотерапии проводится облучение пораженных зон в режиме обычного фракционирования в дозе 30–40 Гр за 15–20 фракций.
При I и II стадия пациентам Группы высокого и промежуточного высокого риска (aaIPI ≥2) и при III–IV стадиях заболевания проводится 6–8 курсов химиотерапии. Вопрос о проведении высокодозной химиотерапии с трансплантацией аутологичных стволовых клеток и проведении лучевой терапии решается индивидуально.
40.19. Первичная кожная анапластическая крупноклеточная лимфома.
По крайней мере, у четверти пациентов наблюдается спонтанная регрессия опухоли.
Хирургическое лечение и лучевая терапия используются при одиночных поражениях. При множественных поражениях кожи – лечение как при синдроме Сезари.
40.20. Первичная кожная центрофолликулярная лимфома.
Хирургическое лечение и лучевая терапия используются при одиночных поражениях. При множественных поражениях кожи используется внутриопухолевое введение стероидов, монотерапия ритуксимабом, хлорамбуцил ± ритуксимаб, режим CVP± ритуксимаб. При экстракожном распространении болезни – лечение как при фолликулярной лимфоме.
40.21. Первичная кожная гамма-дельта Т-клеточная лимфома.
Прогноз крайне неблагоприятный. Стандартных схем лечения не существует. Используются различные режимы полихимиотерапии и локальное облучение.
40.22. Первичная кожная CD4-позитивная мелко/среднеклеточная Т-клеточная лимфома.
При одиночных поражениях кожи используется хирургические или лучевые методы лечения. При множественных поражениях – химиотерапия по схеме CHOP. Прогноз в большинстве случаев благоприятный.
40.23. Первичная кожная CD8-позитивная агрессивная эпидермотропическая цитотоксическая Т-клеточная лимфома.
Стандартных схем лечения не существует. При одиночных поражениях используется лучевая терапия, при множественных опухолевых очагах – различные схемы химиотерапии. Прогноз неблагоприятный.
40.24. Т-клеточная лимфома энтеропатического типа.
Заболевание проявляется клинически изъязвлениями тонкой кишки. При этом часто имеются множественные перфорации.
Лечение проводится как экстранодальная В-клеточная лимфома из лимфоидной ткани, ассоциированной со слизистыми оболочками (MALT-лимфома).
40.25. Гепатоспленическая Т-клеточная лимфома.
Гепатоспленическая Т-клеточная лимфома встречается преимущественно у молодых мужчин. Клиническое течение крайне агрессивное, имеются В-симптомы, гепатоспленомегалия, нейтропения, тромбоцитопения.
Терапевтическая стратегия не разработана. Обосновано применение схемы СНОР.
40.26. Экстранодальная NK/T-клеточная лимфома, назальный тип.
При данном заболевании помимо поражения придаточных пазух носа могут поражаться кожа, желудочно-кишечный тракт, почки, верхние дыхательные пути, редко орбита.
Факторы риска для NK/T-клеточной лимфомы:
- Возраст >60 лет
- В-симптомы
- ECOG> 2
- Уровень ЛДГ >N
- Поражение регионарных лимфоузлов
- Инвазия опухоли в кости или кожу
- Высокий Ki-67 (>30 %)
- Концентрация вируса Эпштейна-Барр> 6,1х107 копий/мл
При I стадии заболевания с назальным поражением без наличия факторов риска показано проведение лучевой терапии на зоны опухолевого поражения в СОД не менее 50 Гр.
При I стадии заболевания с назальным поражением и наличием факторов риска, а также II стадии в зависимости от состояния пациента и сопутствующей патологии лечение проводится по одной из следующих схем:
- лучевая терапия (РОД 1,8–2 Гр, СОД 40–50 Гр) с радиосенсибилизацией цисплатином в дозе 30 мг/м2 в неделю. Через 3–5 недель после окончания облучения 3 курса химиотерапии по схеме VIPD;
- 3 курса химиотерапии по схеме VIPD, затем лучевая терапия (РОД 1,8–2 Гр, СОД 40–50 Гр);
- 2 курса химиотерапии по схеме SMILE, затем лучевая терапия (РОД 1,8–2 Гр, СОД 40–50 Гр).
В ходе лечения выявляется и количественно определяется ДНК вируса Эпштейна-Барр методом полимеразной цепной реакции (ПЦР). При обнаружении вирусной ДНК в количестве 6,1х107 копий/мл и более существует высокая вероятность резистентности опухоли к проводимому лечению.
При III–IV стадиях заболевания проводится химиотерапия по схеме VIPD, DeVIC, SMILE.
40.27. Подкожная панникулоподобная Т-клеточная лимфома.
Составляет менее 1 % от всех НХЛ. Характеризуется узловой инфильтрацией подкожной клетчатки. Лимфаденопатия не характерна. Локализуется преимущественно в области конечностей и туловища. У некоторых пациентов может наблюдаться гемофогоцитарный синдром (панцитопения, лихорадка, гепатоспленомегалия). Характеризуется следующими иммунофенотипическими маркерами: CD2+/-; CD3+/-; CD4+; CD5+/-; CD7-/+; CD8-/+; CD16-; CD30-; CD56-; CD57-; CD25+/-; TCRαβ+/-; TCRƴδ-/+.
Течение агрессивное, стандартные методы лечения не разработаны. Для лечения используется системная полихимиотерапия с использованием алкилирующих препаратов, кортикостероидов, флударабина.
40.28. Режимы химиотерапии, используемые для лечения НХЛ
40.28.1. СНОР:
- Винкристин 1,4 мг/м2 (максимально 2 мг) внутривенно струйно, 1-й день.
- Циклофосфамид 750 мг/м2 внутривенно в течение 60 минут, 1-й день.
- Доксорубицин 50 мг/м2 внутривенно в течение 60 минут, 1-й день.
- Преднизолон 60 мг/м2 внутрь, 1, 2, 3, 4 и 5-й дни.
Интервал между курсами 3 недели, то есть начало следующего курса на 22-й день от начала предыдущего.
40.28.2. R – СНОР:
- Ритуксимаб 375 мг/м2внутривенно (первые 50 мг в течение часа, в дальнейшем скорость инфузии можно увеличивать на 50 мг/ч каждые 30 мин, доводя до максимальной скорости 400 мг/ч) в 1-й день.
- Винкристин 1,4 мг/м2(максимально 2 мг) внутривенно струйно, 1-й день.
- Циклофосфамид 750 мг/м2внутривенно в течение 60 минут, 1-й день.
- Доксорубицин 50 мг/м2 внутривенно в течение 60 минут, 1-й день.
- Преднизолон 60 мг/м2 в 1-й день внутривенно до введения ритуксимаба, во 2, 3, 4 и 5-й дни внутрь.
Интервал между курсами 3 недели, то есть начало следующего курса на 22-й день от начала предыдущего.
40.28.3. FC:
- Флударабин 25 мг/м2 внутривенно в течение 30 минут, 1, 2, 3-й дни.
- Циклофосфамид 250 мг/м2 внутривенно в течение 20–30 мин в 1, 2, 3-й дни.
Интервал между курсами 4 недели, то есть начало следующего курса на 28-й день от начала предыдущего.
40.28.4. R-FC:
- Ритуксимаб 375 мг/м2 внутривенно (первые 50 мг в течение часа, в дальнейшем скорость инфузии можно увеличивать на 50 мг/ч каждые 30 мин, доводя до максимальной скорости 400 мг/ч) в 1-й день.
- Флударабин 25 мг/м2 внутривенно в течение 30 минут, 1, 2, 3-й дни.
- Циклофосфамид 250 мг/м2 внутривенно в течение 20–30 минут в 1, 2, 3-й дни.
Интервал между курсами 4 недели, то есть начало следующего курса на 28-й день от начала предыдущего.
40.28.5. FM:
- Флударабин 25 мг/м2 внутривенно в течение 30 минут, 1, 2, 3-й дни.
- Митоксантрон 10 мг/м2 внутривенно в течение 60 минут, 1-й день.
Интервал между курсами 3 недели, то есть начало следующего курса на 22-й день от начала предыдущего.
40.28.6. R-FM:
- Ритуксимаб 375 мг/м2 внутривенно (первые 50 мг в течение часа, в дальнейшем скорость инфузии можно увеличивать на 50 мг/ч каждые 30 мин, доводя до максимальной скорости 400 мг/ч) в 1-й день.
- Флударабин 25 мг/м2 внутривенно в течение 30 минут, 1, 2, 3-й дни.
- Митоксантрон 10 мг/м2 внутривенно в течение 60 минут, 1-й день.
Интервал между курсами 3 недели, то есть начало следующего курса на 22-й день от начала предыдущего.
40.28.7. CVР:
- Циклофосфамид 750 мг/м2 внутривенно в течение 60 минут, 1-й день.
- Винкристин 1,4 мг/м2 (максимально 2 мг) внутривенно струйно, 1-й день.
- Преднизолон 60 мг/м2 внутрь, 1, 2, 3, 4 и 5-й дни.
Интервал между курсами 3 недели, то есть начало следующего курса на 22-й день от начала предыдущего.
40.28.8. R-CVР:
- Ритуксимаб 375 мг/м2 внутривенно (первые 50 мг в течение часа, в дальнейшем скорость инфузии можно увеличивать на 50 мг/ч каждые 30 мин, доводя до максимальной скорости 400 мг/ч) в 1-й день.
- Циклофосфамид 750 мг/м2 внутривенно в течение 60 минут, 1-й день.
- Винкристин 1,4 мг/м2 (максимально 2 мг) внутривенно струйно, 1-й день.
- Преднизолон 60 мг/м2 в 1-й день внутривенно до введения ритуксимаба, во 2, 3, 4 и 5-й дни внутрь.
Интервал между курсами 3 недели, то есть начало следующего курса на 22-й день от начала предыдущего.
40.28.9. FCM:
- Флударабин 25 мг/м2 внутривенно в течение 30 минут, 1, 2, 3-й дни.
- Циклофосфамид 200 мг/м2 внутривенно в течение 20–30 мин в 1, 2, 3-й дни.
- Митоксантрон 8 мг/м2 внутривенно в течение 60 минут, 1-й день.
Интервал между курсами 4 недели, то есть начало следующего курса на 28-й день от начала предыдущего.
40.28.10. R-FCM:
- Ритуксимаб 375 мг/м2 внутривенно (первые 50 мг в течение часа, в дальнейшем скорость инфузии можно увеличивать на 50 мг/ч каждые 30 мин, доводя до максимальной скорости 400 мг/ч) в 1-й день.
- Флударабин 25 мг/м2 внутривенно в течение 30 минут, 1, 2, 3-й дни.
- Циклофосфамид 200 мг/м2 внутривенно в течение 20–30 мин в 1, 2, 3-й дни.
- Митоксантрон 8 мг/м2 внутривенно в течение 60 минут, 1-й день.
Интервал между курсами 4 недели, то есть начало следующего курса на 28-й день от начала предыдущего.
40.28.11. Ритуксимаб монотерапия:
Ритуксимаб 375 мг/м2внутривенно (первые 50 мг в течение часа, в дальнейшем скорость инфузии можно увеличивать на 50 мг/ч каждые 30 мин, доводя до максимальной скорости 400 мг/ч) 1 раз в неделю, 4 введения.
При отсутствии прогрессирования в течение 6 месяцев после 4-го последнего введение ритуксимаба 375 мг/м2внутривенно 1 раз в 3 месяца, всего 8 введений в течение 2-х лет.
40.28.12. Ритуксимаб поддерживающая терапия у пациентов с полной или частичной регрессией опухоли после индукционной химиотерапии/химиоиммунотерапии по поводу рецидива фолликулярной лимфомы.
Ритуксимаб 375 мг/м2внутривенно (первые 50 мг в течение часа, в дальнейшем скорость инфузии можно увеличивать на 50 мг/ч каждые 30 мин, доводя до максимальной скорости 400 мг/ч) 1 раз в 3 месяца, всего 8 введений.
Начало лечения через 6 месяцев после последнего курса индукционной терапии при отсутствии признаков прогрессирования заболевания.
40.28.13. Хлорамбуцил 6 мг/м2 (суточная доза 10 мг) ежедневно внутрь или 5 дней в неделю до суммарной дозы 400–500 мг.
или
Хлорамбуцил16 мг/м2 (25–30 мг в сутки) 5 дней ежедневно внутрь с повторением таких 5-дневных курсов ежемесячно в течение 1–2 лет.
40.28.14. DHAP:
- Дексаметазон 40 мг внутривенно или внутрь 1, 2, 3, 4-й дни.
- Цисплатин 100 мг/м2 внутривенно в 1-й день 24-часовая инфузия с пред- и постгидратацией.
- Цитарабин по 2000 мг/м2 внутривенно во 2-й день 3-часовая инфузия с интервалом 12 часов (2 введения, суммарная доза 4000 мг/м2) с постгидратацией.
Интервал между курсами 21–28 дней.
40.28.15. ESHAP:
- Этопозид 40 мг/м2 внутривенная 60-минутная инфузия 1, 2, 3, 4-й дни.
- Метилпреднизолон 500 мг внутривенно 15-минутная инфузия в 1, 2, 3, 4, 5-й дни.
- Цисплатин 25 мг/м2/день, 1, 2, 3, 4-й дни, 24-часовая инфузия с пред- и постгидратацией.
- Цитарабин 2000 мг/м2 внутривенная 3-часовая инфузия, начинается непосредственно после окончания инфузии цисплатина, 5-й день с постгидратацией.
Интервал между курсами 21–28 дней.
40.28.16. MINE:
- Месна 400 мг/м2/день внутривенно струйно часы 0, 4, 8, день 1, 2, 3-й.
- Ифосфамид 1330 мг/м2 внутривенно в течение 60 минут, 1, 2, 3-й дни с пред- и постгидратацией.
- Митоксантрон 8 мг/м2 внутривенно в течение 30 минут, день 1-й.
- Этопозид 65 мг/м2 внутривенно 60-минутная инфузия 1, 2, 3-й дни.
Интервал между курсами 21–28 дней.
40.28.17. ICE:
- Этопозид 100 мг/м2внутривенно 60-минутная инфузия, 1, 2, 3-й дни.
- Ифосфамид 5 г/м2 и Месна 5 г/м2 смесь в одном флаконе, внутривенная 24-часовая инфузия 2-й день с пред- и постгидратацией.
- Карбоплатин AUC 5 внутривенно в течение 30 минут 2-й день.
- Гранулоцитарный колониестимулирующий фактор с 5 по 12-й дни.
Интервал между курсами 14 дней.
40.28.18. GEMOX:
- Гемцитабин 1000 мг/м2 внутривенная 30-минутная инфузия 1-й день
- Оксалиплатин 100 мг/м2 внутривенная 2-часовая инфузия, 1-й день
Интервал между курсами 14–21день.
40.28.19. GDP:
- Гемцитабин 1000 мг/м2 внутривенная 30-минутная инфузия, 1-й и 8-й дни
- Цисплатин 75 мг/м2 внутривенная инфузия со скоростью не более 1 мг/мин с пред- и постгидратацией, 1-й день
- Дексаметазон 40 мг внутривенно или внутрь, 1, 2, 3, 4-й дни.
Интервал между курсами 21 день.
40.28.20. CEPP:
- Циклофосфамид 600 мг/м2 внутривенно в течение 20–30 мин, 1-й и 8-й дни.
- Этопозид 70 мг/м2 внутривенно в течение 30–60 мин, 1, 2, 3-й дни.
- Прокарбазин 60 мг/м2 внутрь, дни 1–10-й.
- Преднизолон 60 мг/м2 внутрь, дни 1–10-й.
Интервал между курсами 28 дней.
40.28.21. DA-EPOCH (Dose-adjustedEPOCH):
- Этопозид 50 мг/м2/сутки в/в 96 часовая инфузия, 1, 2, 3, 4-й дни
- Винкристин 0,4 мг/м2/сутки внутривенная 96-часовая инфузия, 1, 2, 3, 4-й дни
- Доксорубицин 10 мг/м2/сутки внутривенно 96-часовая инфузия, 1, 2, 3, 4-й дни
- Циклофосфамид 750 мг/м2внутривенно в течение 20–30 мин, 5-й день после завершения непрерывной инфузии.
- Преднизолон 60 мг/м2 внутрь, 1–5-й дни.
- Гранулоцитарный колониестимулирующий фактор начиная с 6 дня до восстановления абсолютного числа нейтрофилов боле 5х109/л.
Интервал между курсами 21 день.
40.28.22. Флударабин 25 мг/м2внутривенно, 30-минутная инфузия, 1, 2, 3, 4, 5-й дни.
Интервал между курсами 28 дней.
40.28.23. R-F:
- Ритуксимаб 375 мг/м2 внутривенно (первые 50 мг в течение часа, в дальнейшем скорость инфузии можно увеличивать на 50 мг/ч каждые 30 мин, доводя до максимальной скорости 400 мг/ч) в 1-й день.
- Флударабин 25 мг/м2внутривенно, 30-минутная инфузия, 1, 2, 3, 4, 5-й дни.
Интервал между курсами 28 дней.
40.28.24. Циклофосфамид 50–200 мг внутрь ежедневно. Дни 1–14-й. Промежуток между курсами 14 дней, т.е. начало следующего курса на 28 день от начала предыдущего.
40.28.25. EPOCH:
- Этопозид 50 мг/м2/сутки внутривенно 96-часовая инфузия, 1, 2, 3, 4-й дни
- Винкристин 0,4 мг/м2/сутки внутривенно 96-часовая инфузия, 1, 2, 3, 4-й дни
- Доксорубицин 10 мг/м2/сутки внутривенно 96-часовая инфузия, 1, 2, 3, 4-й дни
- Циклофосфамид 750 мг/м2 внутривенно в течение 20–30 минут, 5-й день после завершения непрерывной инфузии.
- Преднизолон 60 мг/м2 внутрь, 1, 2, 3, 4-й дни.
- Гранулоцитарный колониестимулирующий фактор начиная с 5 дня до восстановления абсолютного числа нейтрофилов боле 10 х109/л с 5 по 12 дни.
Интервал между курсами 21 день.
Каждая суточная доза цитостатиков для длительной инфузии разводится в одном флаконе. Во время инфузии флакон должен быть защищен от света.
Для профилактики пневмоцистной пневмонии пациенты должны получать ко-тримоксазол 3 раза в неделю (понедельник, среда, пятница) по 480 мг 2 раза в день.
40.28.26. СNОР:
- Винкристин 1,4 мг/м2 (максимально 2 мг) внутривенно струйно, 1-й день.
- Циклофосфамид 750 мг/м2 внутривенно в течение 60 минут, 1-й день.
- Митоксантрон 20 мг/м2 внутривенно в течение 60 минут, 1-й день.
- Преднизолон 60 мг/м2 внутрь, 1, 2, 3, 4 и 5-й дни.
Интервал между курсами 3 недели, то есть начало следующего курса на 22-й день от начала предыдущего.
40.28.27. VIPD:
- этопозид 150 мг/м2, 90-минутная внутривенная инфузия в 1, 2 и 3-й дни;
- ифосфамид 1200 мг/м2 1-часовая внутривенная инфузия в 1, 2 и 3-й дни;
- месна 400 мг/м2 внутривенно струйно за 15 мин до введения ифосфамида, затем по 400 мг/м2 внутривенно струйно каждые 8 часов в 1, 2, 3-й дни.
- Цисплатин 30 мг/м2 внутривенная инфузия со скоростью не более 1 мг/мин с пред- и постгидратацией, 1, 2 и 3-й дни.
- Дексаметазон 40 мг/сутки внутрь или внутривенно, 1, 2, 3 и 4-й дни.
Интервал между курсами 3 недели.
40.28.28. Гемцитабин 1000 мг/м2 внутривенная 30-минутная инфузия 1 раз в неделю в течение 7 недель.
После 2-недельного перерыва 3 еженедельных введения, 2-недельный перерыв, 3 еженедельных введения и т.д.
40.28.29. Интерферон-альфа 5–10 млн МЕ/м2 подкожно или внутримышечно 3 раза в неделю.
Лечение продолжается до прогрессирования болезни или полной регрессии.
40.28.30. Метотрексат 50мг/м2 внутримышечно, внутривенно, 1 раз в неделю.
Лечение продолжается до прогрессирования болезни или полной регрессии.
40.28.31. R-B:
- Ритуксимаб 375 мг/м2 внутривенно (первые 50 мг в течение часа, в дальнейшем скорость инфузии можно увеличивать на 50 мг/ч каждые 30 минут, доводя до максимальной скорости 400 мг/ч) в 1-й день,
- Бендамустин 90 мг/м2, внутривенно 1-й и 2-й дни.
Интервал между курсами 3–4 недели.
40.28.32. Гемцитабин+ винорельбин:
- Гемцитабин 1000 мг/м2, внутривенно, 1-й и 8-й дни.
- Винорельбин 25–30 мг/м2, внутривенно, 1-й и 8-й дни.
Повторные курсы – каждые 3 недели (на 21-й день от начала предыдущего).
40.28.33. Гемцитабин+карбоплатин:
- Гемцитабин 1000 мг/м2, внутривенно, 1-й и 8-й дни.
- Карбоплатин AUC 6, внутривенно, 1-й день.
Повторные курсы – каждые 3 недели (на 21-й день от начала предыдущего).
40.28.34. R-бортезомиб:
- Ритуксимаб 375 мг/м2 внутривенно (первые 50 мг в течение часа, в дальнейшем скорость инфузии можно увеличивать на 50 мг/ч каждые 30 мин, доводя до максимальной скорости 400 мг/ч) в 1-й, 8-й и 15-й дни,
- Бортезомиб 1,6 мг/м2, внутривенно, в 1-й, 8-й и 15-й дни.
Повторные курсы – каждые 4 недели (на 28-й день от начала предыдущего).
40.28.35. R-maxi-CHOP:
- Ритуксимаб 375 мг/м2 внутривенно в 1-й день;
- Циклофосфамид 1200 мг/м2 внутривенно в 1-й день;
- Доксорубицин 75 мг/м2 внутривенно в 1-й день;
- Винкристин 1.4 мг/м2 внутривенно;
- Преднизолон 100 мг внутрь с 1-го по 5-й день;
- Аллопуринол 300 мг внутрь 1 раз в день (цикл 1,2).
Повторные курсы – каждые 3 недели (на 21-й день от начала предыдущего).
40.28.36. R-Ara-C:
- Ритуксимаб 375 мг/м2 внутривенно в 1-ый день;
- Цитарабин 3000 мг/м2 внутривенно в течение 3-х часов в 1-ый день каждые 12 часов (2 введения);
- Цитарабин 3000 мг/м2 внутривенно в течение 3-х часов во 2-й день каждые 12 часов (2 введения);
- Аллопуринол 300 мг внутрь 1 раз в день (цикл 1,2);
- Ко-тримаксазол 480 мг один раз в день в течение 21 дня;
- Ацикловир 400 мг внутрь 2 раза в день в течение 21 дня;
- Итраконазол 200 мг внутрь 2 раза в день в течение 14 дней;
- Г-КСФ 300 мкг подкожно, начиная с 7-го дня, пока АЧН не будет 1×109/л.
Повторные курсы – каждые 3 недели (на 21-й день от начала предыдущего).
40.28.37. DeVIC:
- Дексаметазон 40 мг внутривенно 1 раз в день в 1–3-й дни;
- Этопозид 67 мг/ м2 внутривенно в течение 2-х часов 1 раз в день в 1–3-й дни;
- Ифосфамид 1000 мг/ м2 в течение 3-х часов 1 раз в день в 1–3-й дни
- Карбоплатин 200 мг/ м2 внутривенно в течение 30 минут в 1-й день
- Поддерживающая терапия: Филграстим начинается при уровне лейкоцитов <2×109 /л или АЧН <1×109 /л и прекращается при уровне лейкоцитов >5×109 /л
Повторные курсы – на 21-й день от начала предыдущего.
40.28.38. SMILE:
За 12 часов до метотрексата начинается гидратация
- Метотрексат 2 г/м2 внутривенно в течение 6 часов в 1-й день
- Кальция фолинат 15 мг/ м2 внутривенно каждые 6 часов, начиная через 12часов после окончания введения метотрексата, пока концентрация метотрексата не будет <0,1 мкмоль/л;
- Этопозид 100 мг/м2 внутривенно в течение 1 часа во 2–4-й дни;
- Дексаметазон 40 мг внутривенно во 2–4-й дни;
- Ифосфамид 1500 мг/ м2 внутривенно во 2–4-й дни (+Месна);
- Аспарагиназа 6000 Е/ м2 внутривенно дни 8-й, 10-й, 12-й, 14-й, 16-й, 18-й, 20-й
- Филграстим начиная с 6 дня цикла пока уровень лейкоцитов не будет >5×109/л.
Повторные курсы – каждые 4 недели (на 28-й день от начала предыдущего).
40.28.39. Леналидомид.
Начальная доза составляет 25 мг внутрь 1 раз/сутки в 1–21-й дни повторных 28-дневных циклов.
40.29. Наблюдение, сроки и объем обследования.
Контрольные осмотры проводятся каждые 3 мес. на протяжении первых 2-х лет, каждые 6 мес. в течение последующих 3-х лет и затем 1 раз в год. Развернутый анализ периферической крови и определение уровня ЛДГ проводится на 3-й, 6-й, 12-й, и 24-м мес. наблюдения, а затем при появлении подозрительных симптомов. Оценку функции щитовидной железы проводят пациентам, получившим лучевую терапию на область шеи на 1-м, 2-м и 5-м годах наблюдения. После проведения лучевой терапии на область Грудной клетки в пременопаузальном возрасте, особенно в возрасте до 25 лет, женщин следует подвергать скринингу для исключения индуцированного рака молочной железы. Сначала по клиническим данным, а после 40–50 лет с помощью маммографии.
Информация
Источники и литература
-
Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2006-2019
- Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2006-2019 -
-
www.minzdrav.gov.by
- www.minzdrav.gov.by -
Информация
ГЛАВА 2
ОЦЕНКА ОБЩЕГО СОСТОЯНИЯ ОНКОЛОГИЧЕСКОГО ПАЦИЕНТА
Общее состояние онкологического пациента (Performance status) рекомендовано оценивать по индексу Карновского (0–100 баллов) или шкале ECOG (0–4 балла) (таблицы 2.1, 2.2).
Таблица 2.1. Индекс Карновского
Таблица 2.1. Индекс Карновского
|
Нормальная физическая активность, пациент не нуждается в специальном уходе
|
100 баллов | Состояние нормальное, нет жалоб и симптомов заболевания |
| 90 баллов | Нормальная активность сохранена, но имеются незначительные симптомы заболевания | |
| 80 баллов | Нормальная активность возможна при дополнительных усилиях, при умеренно выраженных симптомах заболевания | |
|
Ограничение нормальной активности при сохранении полной независимости пациента
|
70 баллов | Пациент обслуживает себя самостоятельно, но не способен к нормальной деятельности или работе |
| 60 баллов | Пациент иногда нуждается в помощи, но в основном обслуживает себя сам | |
| 50 баллов | Пациенту часто требуется помощь и медицинское обслуживание | |
|
Пациент не может обслуживать себя самостоятельно, необходим уход или госпитализация
|
40 баллов | Большую часть времени пациент проводит в постели, необходим специальный уход и посторонняя помощь |
| 30 баллов | Пациент прикован к постели, показана госпитализация, хотя терминальное состояние не обязательно | |
| 20 баллов | Сильные проявления болезни, необходима госпитализация и поддерживающая терапия | |
| 10 баллов | Умирающий пациент, быстрое прогрессирование заболевания | |
| 0 баллов | Смерть |
Таблица 2.2. Оценка статуса пациента по шкале ECOG
| Оценка | |
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания (90–100 баллов по шкале Карновского) |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70–80 баллов по шкале Карновского) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно – в вертикальном положении (50–60 баллов по шкале Карновского) |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования (30–40 баллов по шкале Карновского) |
| 4 | Пациент, совершенно не способен к самообслуживанию, прикован к креслу или постели (10–20 баллов по шкале Карновского) |
Приложение
ТАБЛИЦЫ СООТВЕТСТВИЯ «СТАДИЯ-TNM» ДЛЯ РЯДА ЛОКАЛИЗАЦИЙ: ТОНКИЙ КИШЕЧНИК, АМПУЛА ФАТЕРОВА СОСКА, ТИМОМА, МЕЗОТЕЛИОМА ПЛЕВРЫ, КАРЦИНОМА МЕРКЕЛЯ КОЖИ, КОРА НАДПОЧЕЧНИКА
ТОНКИЙ КИШЕЧНИК C17
Таблица 1. Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1, Т2 | N0 | M0 |
| Стадия IIА | Т3 | N0 | M0 |
| Стадия IIB | T4 | N0 | M0 |
| Стадия IIIA | Любая Т | N1 | M0 |
| Стадия IIIB | Любая Т | N2 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
АМПУЛА ФАТЕРОВА СОСКА C24.1
Таблица 2. Группировка по стадиям
| Стадия 0 | Tis | N0 | M0 |
| Стадия IA | Т1a | N0 | M0 |
| Стадия IB | Т1b, Т2 | N0 | M0 |
| Стадия IIА | Т3a | N0 | M0 |
| Стадия IIB | Т3b | N0 | M0 |
| Стадия IIIA | Т1a, Т1b, Т2, T3 | N1 | M0 |
| Стадия IIIB | Т4 | Любая N | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
ТИМОМА C37, C38.1-3
Таблица 3. Группировка по стадиям
| Стадия I | T1 | N0 | M0 |
| Стадия II | T2 | N0 | M0 |
| Стадия IIIА | T3 | N0 | M0 |
| Стадия IIIB | T4 | N0 | M0 |
| Стадия IVA | Любая Т |
N1
N0, N1
|
M0
M1A
|
| Стадия IVB | Любая Т | Любая N | M1B |
МЕЗОТЕЛИОМА ПЛЕВРЫ C45.0
Таблица 4. Группировка по стадиям
| Стадия IA | T1 | N0 | M0 |
| Стадия IB | T2, T3 | N0 | M0 |
| Стадия II | T1, T2 | N1 | M0 |
| Стадия IIIА | T3 | N1 | M0 |
| Стадия IIIB | T1, T2, T3, T4 |
N1 Любая N |
M0 |
| Стадия IV | Любая Т | Любая N | M1 |
КАРЦИНОМА МЕРКЕЛЯ C44, C63.2
Таблица 5а. Группировка по стадиям клиническая
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1 | N0 | M0 |
| Стадия IIА | T2, Т3 | N0 | M0 |
| Стадия IIB | Т4 | N0 | M0 |
| Стадия III | Любая Т | N1, N2, N3 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
Таблица 5б. Группировка по стадиям патоморфологическая
| Стадия 0 | Tis | N0 | M0 |
| Стадия I | Т1 | N0 | M0 |
| Стадия IIА | Т2, T3 | N0 | M0 |
| Стадия IIB | Т4 | N0 | M0 |
| Стадия IIIA |
Т0
Т1, Т2, T3, Т4
|
N1b
N1a
|
M0 |
| Стадия IIIB | Любая Т | N1, N2, N3 | M0 |
| Стадия IV | Любая Т | Любая N | M1 |
КОРА НАДПОЧЕЧНИКА C74.0
Таблица 6. Группировка по стадиям
| Стадия I | Т1 | N0 | M0 |
| Стадия II | Т2 | N0 | M0 |
| Стадия III |
Т1, T2
Т3, T4
|
N1
N0, N1
|
M0 |
| Стадия IV | Любая Т | Любая N | M1 |
Под редакцией
д-р мед. наук, проф. О.Г.Суконко,
д-р мед. наук, проф., член-корр. НАН Беларуси С.А.Красный
Авторский коллектив:
Антоненкова Нина Н., д.м.н., доц.;
Ануфреенок И.В., к.м.н.;
Артемова Н.А., д.м.н., доц.;
Баранов А.Ю., к.м.н.;
Баранов Е.В., к.м.н.;
Бармотько М.А.;
Грачев Ю.Н., к.м.н.;
Демешко П.Д., д.м.н.;
Демидчик Ю.Е., д.м.н., проф.;
Дзюбан В.П.;
Доломанова Е.В.;
Дубровский А.Ч., к.м.н.;
Евмененко А.А.;
Ермаков Н.Б., к.м.н.;
Жаврид Э.А., д.м.н., проф.;
Жарков В.В, д.м.н., проф.;
Жиляева Е.П.;
Жуковец А.Г., к.м.н.;
Зеленкевич И.А., к.м.н.;
Ильин И.А., к.м.н.;
Караник В.С., к.м.н.;
Карман А.В., к.м.н., доц.;
Киселев П.Г., к.м.н.;
Клименко Д.П.;
Колядич Г.И., к.м.н.;
Кондратович В.А.;
Котов А.А., к.м.н.;
Кохнюк В.Т., д.м.н., проф.;
Красный С.А., д.м.н., проф.;
Крутилина Н.И., д.м.н., проф.;
Курченков А.Н., к.м.н.;
Курчин В.П., д.м.н.;
Левин Л.Ф.;
Леонова Т.А.;
Мавричев А.С., д.м.н., проф.;
Мавричев С.А., к.м.н.;
Малькевич В.Т., д.м.н., доц.;
Маньковская С.В.;
Матылевич О.П., к.м.н.;
Минайло И.И., к.м.н.;
Минич А.А., к.м.н.;
Моисеев П.И., к.м.н.;
Набебина Т.И., к.м.н.;
Науменко Л.В., к.м.н.;
Океанов А.Е., д.м.н., проф.;
Пархоменко Л.Б., к.м.н., доц.;
Петрушенко Ю.И.;
Писаренко А.М.;
Поляков С.Л., к.м.н.;
Портянко А.С., д.м.н., доц.;
Прохорова В.И., д.м.н., проф.;
Ребеко И.В., к.м.н.;
Ревтович М.Ю., к.м.н.;
Ролевич А.И., д.м.н.;
Рындин А.А.;
Рябчевский А.Н.;
Синайко В.В., к.м.н.;
Субоч Е.И., к.м.н.;
Суколинская Е.В., к.м.н.;
Суконко О.Г., д.м.н., проф.;
Суслова В.А., к.м.н.;
Тризна Н.М., к.м.н.;
Фридман М.В., д.м.н.;
Шаповал Е.В., д.м.н.;
Шмак А.И., д.м.н.
Список сокращений:
CTV – клинический объем облучения
GTV – определяемый объем опухоли
ICD – Международная классификация болезней
ITC – отдельные опухолевые клетки
PTV – планируемый объем облучения
UICC – Международный противораковый союз
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
АЧТВ – активированное частичное тромбопластиновое время
ВАТС – видео-ассистированной тораскопии
ВОЗ – Всемирная организация здравоохранения
ВПЧ – вирус папилломы человека
ВЯВ – внутренняя яремная вена;
ГИСО – гастроинтенстинальные стромальные опухоли
ГПДР – гастропанкреатодуоденальная резекция
ГЦР – гепатоцеллюлярный рак
ЖКТ – желудочно-кишечный тракт
ИГХ – иммуногистохимическое исследование
ИОУЗИ – интраоперационное УЗИ
КТ – компьютерная томография
ЛДГ – лактатдегидрогеназа
МНО – международное нормализованное отношение
МРТ – магнитно-резонансная томография
МСКТ – многослойная компьютерная томография
ОГК – органы Грудной клетки
ПВ – протромбиновое время
ПЖ – поджелудочная железа
ПЭТ – позитронно-эмиссионная томография
РЖП – рак желчного пузыря
РОД – разовая облучающая доза
РПК – рак прямой кишки
РПХГ – ретроградная панкреатохолангиография
СОД – суммарная облучающая доза
ТВ – тромбиновое время
ТДПЭ – тотальная дуоденопанкреатэктомия
УЗИ – ультразвуковое исследование
ФВД – функция внешнего дыхания
ФДГ – фтордезоксиглюкоза
ФЭГДС – фиброгастродуоденоскопия
ХЦР – холангиоцеллюлярного рака
ЦНС – центральная нервная система
ЧЧХГ – чрескожная чреспеченочная холангиография
ЧЭИ – чрескожная этаноловая инъекция
ЩФ – щелочная фосфатаза
ЭВВ – эмболизация воротной вены
ЭКГ – электрокардиограмма
ЭУЗИ – эндоскопическое ультразвуковое исследование
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.