Диагностика и лечение детей с гематологическими и редкими заболеваниями
Диагностика и лечение детей с онкологическими и гематологическими заболеваниями
 Версия: Клинические протоколы 2022 (Беларусь)
Версия: Клинические протоколы 2022 (Беларусь)
Витамин-b12-дефицитная анемия (D51), Гистиоцитоз из клеток лангерганса, не классифицированный в других рубриках (D76.0), Другие аутоиммунные гемолитические анемии (D59.1), Другие сфинголипидозы (E75.2), Другие уточненные апластические анемии (D61.8), Идиопатическая тромбоцитопеническая пурпура (D69.3), Конституциональная апластическая анемия (D61.0), Наследственный сфероцитоз (D58.0)
Гематология детская, Педиатрия
Общая информация
Краткое описание
ПОСТАНОВЛЕНИЕ
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ
РЕСПУБЛИКИ БЕЛАРУСЬ
5 декабря 2022 г. № 113
Об утверждении клинического протокола
На основании абзаца девятого части первой статьи 1 Закона Республики Беларусь от 18 июня 1993 г. № 2435-XII «О здравоохранении», подпункта 8.3 пункта 8 и подпункта 9.1 пункта 9 Положения о Министерстве здравоохранения Республики Беларусь, утвержденного постановлением Совета Министров Республики Беларусь от 28 октября 2011 г. № 1446, Министерство здравоохранения Республики Беларусь
ПОСТАНОВЛЯЕТ:
1. Утвердить клинический протокол «Диагностика и лечение детей с онкологическими и гематологическими заболеваниями» (прилагается).
2. Признать утратившим силу приказ Министерства здравоохранения Республики Беларусь от 13 января 2012 г. № 38 «Об утверждении некоторых клинических протоколов и признании утратившим силу отдельного структурного элемента приказа Министерства здравоохранения Республики Беларусь от 27 сентября 2005 г. № 549».
3. Настоящее постановление вступает в силу после его официального опубликования.
Министр Д.Л.Пиневич
СОГЛАСОВАНО
Государственный пограничный комитет Республики Беларусь
Комитет государственной безопасности Республики Беларусь
Министерство внутренних дел Республики Беларусь
Министерство обороны Республики Беларусь
Министерство по чрезвычайным ситуациям Республики Беларусь
Национальная академия наук Беларуси
Управление делами Президента Республики Беларусь
Брестский областной исполнительный комитет
Витебский областной исполнительный комитет
Гомельский областной исполнительный комитет
Гродненский областной исполнительный комитет
Минский городской исполнительный комитет
Минский областной исполнительный комитет
Могилевский областной исполнительный комитет
УТВЕРЖДЕНО
Постановление
Республики Беларусь
05.12.2022 № 113
КЛИНИЧЕСКИЙ ПРОТОКОЛ
«Диагностика и лечение детей с онкологическими и гематологическими заболеваниями»
ГЛАВА 1 ОБЩИЕ ПОЛОЖЕНИЯ
1. Настоящий клинический протокол устанавливает общие требования к объемам медицинской помощи, оказываемой с целью диагностики и лечения в стационарных и амбулаторных условиях пациентам в возрасте 0–18 лет с онкологическими и гематологическими заболеваниями (далее, если не указано иное, - дети) и пациентам в возрасте 18–30 лет с некоторыми онкологическими заболеваниями: в возрасте 18–29 лет с впервые выявленным острым лимфобластным лейкозом (далее – ОЛЛ); в возрасте 18–21 год с впервые выявленными опухолями костей (остеогенная саркома, саркома Юинга), лимфомами (Ходжкина и неходжкинскими (далее – НХЛ)), острым миелобластным лейкозом (далее – ОМЛ), герминоклеточными опухолями; в возрасте 22–30 лет с герминогенными опухолями яичка (группа неблагоприятного прогноза, рецидив заболевания) (далее, если не указано иное, – молодые взрослые).
2. Требования настоящего клинического протокола являются обязательными для юридических лиц и индивидуальных предпринимателей, осуществляющих медицинскую деятельность в порядке, установленном законодательством о здравоохранении.
3. Для целей настоящего клинического протокола используются основные термины и их определения в значениях, установленных Законом Республики Беларусь «О здравоохранении», Законом Республики Беларусь от 19 ноября 1993 г. № 2570-XII «О правах ребенка», а также следующие термины и определения:
- изолированный костномозговой рецидив – костный мозг (далее – КМ) содержит >25 % лимфобластов при отсутствии экстрамедуллярных очагов;
- комбинированный костномозговой рецидив – КМ содержит >25 % лимфобластов и имеется не менее одного экстрамедуллярного очага ОЛЛ;
- миелодиспластический синдром (далее – МДС) с кольцевыми сидеробластами (далее – КС) и линейной (однолинейной) дисплазией – вариант МДС, для которого характерна анемия, чаще нормо- или макроцитарного характера. Диагностически значимым является обнаружение КС в КМ в 15 % и более клеток красного ряда, вне зависимости от наличия мутации гена SF3B1, а при ее наличии диагностически значимым является обнаружение 5 % и более КС, без увеличения процента бластных клеток в периферической крови (<1 %) и КМ (<5 %), без абсолютного моноцитоза в периферической крови, при этом дисплазия выявляется в клетках красного ряда более чем в 10 %, в гранулоцитарном и мегакариоцитарном ростках – менее чем в 10 %;
- МДС с КС и мультилинейной дисплазией – вариант МДС, для которого характерна цитопения любой степени выраженности. Диагностически значимым является обнаружение КС в КМ в 15 % и более клеток красного ряда, вне зависимости от наличия мутации гена SF3B1, а при ее наличии диагностически значимым является обнаружение 5 % и более КС, без увеличения процента бластных клеток в периферической крови (<1 %) и КМ (<5 %), без абсолютного моноцитоза в периферической крови, при этом дисплазия выявляется в клетках эритроидного, гранулоцитарного и (или) мегакариоцитарного ростков более чем в 10 %;
- синдром лизиса опухоли (далее – СЛО) – комплекс метаболических расстройств в результате массивного распада опухолевых клеток и высвобождения в плазму и периферические ткани внутриклеточного содержимого и метаболитов;
- тестикулярный рецидив – одно- или двухстороннее безболезненное увеличение яичек с инфильтрацией лейкемическими клетками, подтвержденное биопсией.
4. Госпитализация детей с онкологическими и гематологическими заболеваниями осуществляется в порядке, установленном Министерством здравоохранения.
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ
РЕСПУБЛИКИ БЕЛАРУСЬ
5 декабря 2022 г. № 113
Об утверждении клинического протокола
На основании абзаца девятого части первой статьи 1 Закона Республики Беларусь от 18 июня 1993 г. № 2435-XII «О здравоохранении», подпункта 8.3 пункта 8 и подпункта 9.1 пункта 9 Положения о Министерстве здравоохранения Республики Беларусь, утвержденного постановлением Совета Министров Республики Беларусь от 28 октября 2011 г. № 1446, Министерство здравоохранения Республики Беларусь
ПОСТАНОВЛЯЕТ:
1. Утвердить клинический протокол «Диагностика и лечение детей с онкологическими и гематологическими заболеваниями» (прилагается).
2. Признать утратившим силу приказ Министерства здравоохранения Республики Беларусь от 13 января 2012 г. № 38 «Об утверждении некоторых клинических протоколов и признании утратившим силу отдельного структурного элемента приказа Министерства здравоохранения Республики Беларусь от 27 сентября 2005 г. № 549».
3. Настоящее постановление вступает в силу после его официального опубликования.
Министр Д.Л.Пиневич
СОГЛАСОВАНО
Государственный пограничный комитет Республики Беларусь
Комитет государственной безопасности Республики Беларусь
Министерство внутренних дел Республики Беларусь
Министерство обороны Республики Беларусь
Министерство по чрезвычайным ситуациям Республики Беларусь
Национальная академия наук Беларуси
Управление делами Президента Республики Беларусь
Брестский областной исполнительный комитет
Витебский областной исполнительный комитет
Гомельский областной исполнительный комитет
Гродненский областной исполнительный комитет
Минский городской исполнительный комитет
Минский областной исполнительный комитет
Могилевский областной исполнительный комитет
УТВЕРЖДЕНО
Постановление
Республики Беларусь
05.12.2022 № 113
КЛИНИЧЕСКИЙ ПРОТОКОЛ
«Диагностика и лечение детей с онкологическими и гематологическими заболеваниями»
ГЛАВА 1 ОБЩИЕ ПОЛОЖЕНИЯ
1. Настоящий клинический протокол устанавливает общие требования к объемам медицинской помощи, оказываемой с целью диагностики и лечения в стационарных и амбулаторных условиях пациентам в возрасте 0–18 лет с онкологическими и гематологическими заболеваниями (далее, если не указано иное, - дети) и пациентам в возрасте 18–30 лет с некоторыми онкологическими заболеваниями: в возрасте 18–29 лет с впервые выявленным острым лимфобластным лейкозом (далее – ОЛЛ); в возрасте 18–21 год с впервые выявленными опухолями костей (остеогенная саркома, саркома Юинга), лимфомами (Ходжкина и неходжкинскими (далее – НХЛ)), острым миелобластным лейкозом (далее – ОМЛ), герминоклеточными опухолями; в возрасте 22–30 лет с герминогенными опухолями яичка (группа неблагоприятного прогноза, рецидив заболевания) (далее, если не указано иное, – молодые взрослые).
2. Требования настоящего клинического протокола являются обязательными для юридических лиц и индивидуальных предпринимателей, осуществляющих медицинскую деятельность в порядке, установленном законодательством о здравоохранении.
3. Для целей настоящего клинического протокола используются основные термины и их определения в значениях, установленных Законом Республики Беларусь «О здравоохранении», Законом Республики Беларусь от 19 ноября 1993 г. № 2570-XII «О правах ребенка», а также следующие термины и определения:
- изолированный костномозговой рецидив – костный мозг (далее – КМ) содержит >25 % лимфобластов при отсутствии экстрамедуллярных очагов;
- комбинированный костномозговой рецидив – КМ содержит >25 % лимфобластов и имеется не менее одного экстрамедуллярного очага ОЛЛ;
- миелодиспластический синдром (далее – МДС) с кольцевыми сидеробластами (далее – КС) и линейной (однолинейной) дисплазией – вариант МДС, для которого характерна анемия, чаще нормо- или макроцитарного характера. Диагностически значимым является обнаружение КС в КМ в 15 % и более клеток красного ряда, вне зависимости от наличия мутации гена SF3B1, а при ее наличии диагностически значимым является обнаружение 5 % и более КС, без увеличения процента бластных клеток в периферической крови (<1 %) и КМ (<5 %), без абсолютного моноцитоза в периферической крови, при этом дисплазия выявляется в клетках красного ряда более чем в 10 %, в гранулоцитарном и мегакариоцитарном ростках – менее чем в 10 %;
- МДС с КС и мультилинейной дисплазией – вариант МДС, для которого характерна цитопения любой степени выраженности. Диагностически значимым является обнаружение КС в КМ в 15 % и более клеток красного ряда, вне зависимости от наличия мутации гена SF3B1, а при ее наличии диагностически значимым является обнаружение 5 % и более КС, без увеличения процента бластных клеток в периферической крови (<1 %) и КМ (<5 %), без абсолютного моноцитоза в периферической крови, при этом дисплазия выявляется в клетках эритроидного, гранулоцитарного и (или) мегакариоцитарного ростков более чем в 10 %;
- синдром лизиса опухоли (далее – СЛО) – комплекс метаболических расстройств в результате массивного распада опухолевых клеток и высвобождения в плазму и периферические ткани внутриклеточного содержимого и метаболитов;
- тестикулярный рецидив – одно- или двухстороннее безболезненное увеличение яичек с инфильтрацией лейкемическими клетками, подтвержденное биопсией.
4. Госпитализация детей с онкологическими и гематологическими заболеваниями осуществляется в порядке, установленном Министерством здравоохранения.
Классификация
ГЛАВА 2 КЛАССИФИКАЦИЯ ЗНО
5. В настоящем клиническом протоколе для классификации злокачественных новообразований (далее – ЗНО) используется система TNM (Т – лат. tumor – опухоль, N – лат. nodus – узел, М – лат. metastasis – метастазы) и морфологические формы ЗНО в соответствии с Международной классификацией онкологических болезней третьего пересмотра (далее – МКБ-О-3), адаптированной под Международную статистическую классификацию болезней и проблем, связанных со здоровьем, десятого пересмотра (далее – МКБ-10).
TNM – клиническая классификация, используемая для описания анатомической распространенности болезни, которая основывается на результатах обследования до лечения и оценке всех трех компонентов.
рTNM – патологическая классификация, основанная на данных обследования до лечения, дополненных или измененных в результате хирургического вмешательства и морфологического исследования.
Т/рТ – распространение первичной опухоли:
Тх/рТх – первичная опухоль не может быть оценена;
Т0/рТ0 – нет доказательств первичной опухоли;
Tis/р Tis – рак «in situ»;
Т1/рТ1, Т2/рТ2, Т3/рТ3, Т4/рТ4 – размер и местное распространение опухоли в порядке увеличения.
N/pN – отсутствие или наличие метастазов в регионарных лимфатических узлах (далее – ЛУ) и степень их поражения:
Nx/р Nx – регионарные ЛУ не могут быть оценены;
N0/р Nx0 – отсутствуют метастазы в регионарных ЛУ;
N1/pN1, N2/pN2, N3/pN3 – возрастающее поражение ЛУ.
Непосредственное распространение первичной опухоли на ЛУ классифицируются как метастазы в ЛУ. Метастаз в любом ЛУ, не относящемся к регионарному, расценивается как отдаленный метастаз.
М/рМ – отсутствие или наличие отдаленных метастазов:
Мх/рМх – отдаленные метастазы не могут быть оценены;
М0/рМ0 – нет отдаленных метастазов;
М1/рМ1 – имеются отдаленные метастазы.
6. Гистопатологическая дифференцировка позволяет оценить степень агрессивности опухолей некоторых гистологических типов и может влиять на прогноз и выбор лечения:
G1 – хорошо дифференцированные опухоли;
G2 – умеренно дифференцированные опухоли;
G3 – низкодифференцированные опухоли;
G4 – недифференцированные опухоли.
7. Группировка по стадиям предусматривает комбинацию всех значений дескрипторов и позволяет получить полное описание распространенности опухоли. Для табличного представления данных и анализа эти категории объединяются в ограниченное количество групп – стадий. Каждая стадия более или менее однородна по прогнозу и критерию выживаемости относящихся к ней пациентов. Для патологической стадии необходимо морфологическое исследование достаточного количества тканей, позволяющее оценить наибольшее значение Т и N. Термин «стадия» употребляется только для комбинаций Т, N, M или рТ, pN, pM категорий.
8. В соответствии с рекомендациями Всемирной организации здравоохранения (далее – ВОЗ) разработана Международная классификация ЗНО у детей, обновленная в 2005 г. (International Classification of Childhood Cancer-3 (далее – ICCC-3)), базирующаяся на гистологическом типе новообразования, основанном на локализации первичной опухоли. ICCC-3 включает в себя все ЗНО, а также незлокачественные интракраниальные и интраспинальные опухоли.
9. Диагностические группы ICCC-3:
I. Лейкозы, миелопролиферативные и миелодиспластические заболевания.
II. Лимфомы и ретикулоэндотелиальные новообразования.
III. Центральная нервная система (далее – ЦНС) и различные внутричерепные и интраспинальные новообразования.
IV. Нейробластома и другие опухоли периферических нервных клеток.
V. Ретинобластома.
VI. Опухоли почек.
VII. Опухоли печени.
VIII. Злокачественные опухоли костей.
IX. Мягкотканные и другие внекостные саркомы.
X. Опухоли зародышевых клеток, трофобластические опухоли и новообразования гонад.
XI. Другие ЗНО эпителия и злокачественные меланомы.
XII. Другие и неуточненные ЗНО.
Диагностика
20. Первичный диагостический комплекс: для всех нозологических форм заболеваний в состав первичного диагностического комплекса будут входить следующие обязательные обследования:
20.1. клиническое обследование ребенка (далее – блок А):
анамнез: социальный (семейный), жизни, аллергологический, фармакологический, трансфузионный, прививочный, перенесенных заболеваний и оперативных вмешательств;
антропометрия – при поступлении;
медицинкий осмотр, измерение МТ, температуры тела, оценка диуреза, стула, частоты сердечных сокращений, частоты дыханий, измерение артериального давления (далее – АД);
медицинский осмотр врача – детского невролога;
20.2. лабораторное исследование (далее – блок Б):
ОАК – эритроциты, гемоглобин, гематокрит, тромбоциты, лейкоциты и лейкоцитарная формула, скорость оседания эритроцитов (далее – СОЭ);
общий анализ мочи (далее – ОАМ);
БИК – общий билирубин, глюкоза, мочевина, креатинин, общий белок, альбумин, АлАТ, АсАТ, СРБ, электролиты (калий, натрий, кальций, магний), лактатдегидрогеназа (далее – ЛДГ);
коагулограмма – активированное частичное тромбиновое время (далее – АЧТВ), активность протромбинового комплекса (по Квику), протромбиновое время (далее – ПВ), тромбиновое время (далее – ТВ), международное нормализованное отношение (далее – МНО), фибриноген;
определение групп крови по системам АВ0 и резус-принадлежности;
определение антител к вирусу иммунодефицита человека (далее – ВИЧ) в крови;
анализ крови на сифилис (реакция микропреципитации);
определение антигенов и антител к вирусу гепатита В, С (HbsAg, a/HCV);
20.3. функционально-инструментальное исследование (далее – блок В):
электрокардиограмма (далее – ЭКГ);
УЗИ органов брюшной полости (далее – ОБП);
эхокардиография (далее – Эхо-КГ).
Специфические методы диагностики, необходимые для каждой конкретной нозологической формы заболевания, перечислены в описаниях, характеризующих данную нозологическую форму.
20.1. клиническое обследование ребенка (далее – блок А):
анамнез: социальный (семейный), жизни, аллергологический, фармакологический, трансфузионный, прививочный, перенесенных заболеваний и оперативных вмешательств;
антропометрия – при поступлении;
медицинкий осмотр, измерение МТ, температуры тела, оценка диуреза, стула, частоты сердечных сокращений, частоты дыханий, измерение артериального давления (далее – АД);
медицинский осмотр врача – детского невролога;
20.2. лабораторное исследование (далее – блок Б):
ОАК – эритроциты, гемоглобин, гематокрит, тромбоциты, лейкоциты и лейкоцитарная формула, скорость оседания эритроцитов (далее – СОЭ);
общий анализ мочи (далее – ОАМ);
БИК – общий билирубин, глюкоза, мочевина, креатинин, общий белок, альбумин, АлАТ, АсАТ, СРБ, электролиты (калий, натрий, кальций, магний), лактатдегидрогеназа (далее – ЛДГ);
коагулограмма – активированное частичное тромбиновое время (далее – АЧТВ), активность протромбинового комплекса (по Квику), протромбиновое время (далее – ПВ), тромбиновое время (далее – ТВ), международное нормализованное отношение (далее – МНО), фибриноген;
определение групп крови по системам АВ0 и резус-принадлежности;
определение антител к вирусу иммунодефицита человека (далее – ВИЧ) в крови;
анализ крови на сифилис (реакция микропреципитации);
определение антигенов и антител к вирусу гепатита В, С (HbsAg, a/HCV);
20.3. функционально-инструментальное исследование (далее – блок В):
электрокардиограмма (далее – ЭКГ);
УЗИ органов брюшной полости (далее – ОБП);
эхокардиография (далее – Эхо-КГ).
Специфические методы диагностики, необходимые для каждой конкретной нозологической формы заболевания, перечислены в описаниях, характеризующих данную нозологическую форму.
Лечение
ГЛАВА 3 СОПРОВОДИТЕЛЬНАЯ ТЕРАПИЯ ЗНО
10. Сопроводительная терапия является комплексом дополнительных медицинских мероприятий, проводимых при лечении (химиотерапия, лучевая терапия (далее – ЛТ), хирургическое лечение) ЗНО. К задачам, стоящим перед сопроводительной терапией, относятся:
защита органов и тканей от токсического воздействия противоопухолевых лекарственных средств (далее – ЛС) и их метаболитов;
поддержание гомеостаза и основного обмена;
обеспечение функционирования всех жизненно важных систем организма, медицинская профилактика инфекций;
коррекция осложнений основного заболевания и осложнений, вызванных химиотерапией.
11. В настоящем клиническом протоколе необходимо строгое соблюдение принципов инфузионной терапии, которые зависят от применяемой химиотерапии. Пациентам со ЗНО в первые дни (недели) терапии обязательно рекомендуется проведение терапевтических мероприятий, направленных на медицинскую профилактику СЛО. Степень риска развития СЛО зависит от инициальной массы опухоли, состояния пациента на момент начала химиотерапии и индивидуальных особенностей метаболизма. К важнейшим мерам медицинской профилактики СЛО относятся адекватная гидратация, защелачивание мочи, предупреждение и коррекция гиперурикемии, а также борьба с электролитными нарушениями. Стандартной нагрузкой является гидратация 3000 мл/м2, а у детей массой тела (далее – МТ) менее 10 кг – 200 мл/кг жидкости в сутки. Базисный раствор для инфузии состоит из раствора глюкозы 5 % и раствора хлорида натрия 0,9 % в соотношении 1:1. Инициальная инфузия – без калия. Однако в дальнейшем должна проводиться коррекция электролитов в соответствии с данными биохимического исследования крови (далее – БИК). Во время инфузионной терапии необходимо обеспечивать диурез на уровне 100–250 мл/м2/час. Учитывая более низкую растворимость мочевой кислоты в кислой среде, необходимо обеспечить поддержание нейтрального или слабощелочного рН мочи. Для этого к постоянной инфузии (или 100–200 ммоль/м2/сут параллельной инфузии) добавляется 60 ммоль бикарбоната натрия на литр инфузии (60 мл раствора бикарбоната натрия 7,5 % либо 100–120 мл раствора бикарбоната натрия 4 %). Регулирование необходимого объема бикарбоната натрия осуществляется соответственно уровню pH мочи. При инфузионной терапии необходимо контролировать количество выделенной мочи:
количество выделенной мочи = количество введенной жидкости – потери с дыханием.
Для этого проводится контрольное взвешивание 1–2 раза в сутки. При недостаточном мочевыведении вводится фуросемид, раствор для внутривенного и внутримышечного введения 10 мг/мл, ампула 2 мл, из расчета 1–10 мг/кг в сутки внутривенно капельно или струйно.
14. Эмпирическая антимикробная терапия фебрильной нейтропении (в зависимости от наличия факторов риска пациенты делятся на 2 группы риска развития тяжелых инфекций в установленном Министерством здравоохранения порядке: пациенты группы высокого риска (далее – HRG) должны быть госпитализированы в стационар для проведения эмпирической антимикробной терапии; пациенты с низким уровнем риска (группа низкого риска) могут быть кандидатами для пероральной эмпирической терапии, в том числе, в амбулаторных условиях):
14.1. общие принципы терапии:
14.1.1. назначение антибактериальной терапии по возможности проводится в течение 60 минут после манифестации фебрильной нейтропении (отсроченное назначение антибактериальной терапии сопровождается ухудшением исходов и увеличением длительности госпитализации);
14.1.2. при выборе эмпирической антибактериальной терапии рассматриваются следующие аспекты:
группа риска;
аллергологический и фармакологический анамнезы;
наличие дисфункции органов;
применение химиотерапии у данного пациента;
предшествующая антибактериальная терапия;
колонизация резистентными бактериями (если возможно проводить микробиологический скрининг в организации здравоохранения) (например, метил-резистентный золотистый стафилококк (далее – MRSA), ванкомицин-резистентный энтерококк, бактерии, производящие бета-лактамазы расширенного спектра действия (далее – ESBL), в том числе, карбапенемаза-продуцирующие штаммы Klebsiella pneumoniae);
14.1.3. эмпирическая антибактериальная терапия должна быть эффективной против широкого спектра потенциальных возбудителей. Для пациентов с установленной локализацией инфекции, которые перестали лихорадить на стартовой терапии, антибактериальная терапия может быть изменена с отменой ЛС широкого спектра и назначением подходящих для данной инфекции ЛС с узким спектром активности;
14.1.4. стартовую терапию фебрильной нейтропении пациентам группы низкого риска рекомендуется проводить b-лактамным антибиотиком широкого спектра (например, амоксициллин/клавуланат, цефепим);
14.1.5. стартовую терапию фебрильной нейтропении пациентам HRG рекомендуется проводить b-лактамным антибиотиком широкого спектра с антипсевдомонадной активностью: цефалоспорин (например, цефепим), карбапенем (например, меропенем) или пиперациллин/тазобактам. Выявление колонизации резистентными бактериями предполагает назначение антибиотика (комбинации ЛС), к которым данные бактерии проявляют чувствительность.
Медицинскими показаниями для эмпирической терапии ЛС, активными в отношении грамположительных микроорганизмов, являются:
гипотензия; документированная пневмония;
подозрение на инфекцию области установки центрального венозного катетера;
инфекция кожи и мягких тканей;
документированная колонизация MRSA;
выделение грамположительного микроорганизма из гемокультуры; мукозит III–IV степени;
инфекции, вызванные пенициллин-резистентными стрептококками в анамнезе; проведенная интенсивная химиотерапия, ассоциированная с высоким риском
развития инфекции, вызванной грамположительными микроорганизмами;
14.1.6. рекомендуемые ЛС для фебрильной нейтропении:
амоксициллин/клавуланат внутрь (таблетка: 250 мг/125 мг, 500 мг/125 мг, 875 мг/125 мг; порошок для приготовления суспензии (готовая суспензия – 5 мл): 125 мг/31,25 мг, 250 мг/62,5 мг, 200 мг/28,5 мг, 400 мг/57 мг):
для детей с МТ >40 кг – 250–500 мг 2–3 раза в день или 875 мг 2 раза в день, внутрь. Максимальная доза для пациентов старше 18 лет 1750 мг/сутки в пересчете на амоксициллин;
для детей с МТ <40 кг: 25–45 мг/кг/сутки в пересчете на амоксициллин, дозы приведены в приложении 1.
Для лечения детей в возрасте до 6 лет или с МТ менее 25 кг предпочтительно использовать суспензию амоксициллина/клавуланата. Для лечения детей от 6 до 12 лет оптимальной лекарственной формой являются таблетки 625 мг, принимаемые 2 раза в день. Клинические данные о применении лекарственных форм ЛС амоксициллин/клавуланат с соотношением активных компонентов 4:1 в дозах выше 40 мг/10 мг/кг/сутки для лечения детей в возрасте до 2 лет отсутствуют;
амоксициллин/клавуланат внутривенно (порошок для приготовления раствора для внутривенного введения 500 мг/100 мг, 1000 мг/200 мг):
для детей старше 12 лет с МТ более 40 кг раствор для инфузий вводят из расчета 1000 мг/200 мг через каждые 8 часов;
дети с МТ менее 40 кг, младше 3 месяцев с МТ менее 4 кг раствор для инфузий вводят из расчета 25 мг/5 мг/кг через каждые 12 часов;
детям старше 3 месяцев раствор для инфузий вводят из расчета 25 мг/5 мг/кг через каждые 8 часов.
Пациентам с нарушением функции почек дозу амоксициллина/клавуланата для приема внутрь и для внутривенного введения корректируют согласно инструкции по медицинскому применению (листку вкладышу);
цефепим (порошок для приготовления раствора для внутривенного и внутримышечного введения 1000 мг или 500 мг во флаконах) – для детей старше 2 месяцев раствор для инфузий вводят внутривенно капельно путем инфузии 50 мг/кг 3 раза в день через каждые 8 часов (не более 6 г/сут). Доза цефепима для пациентов с нарушением функции почек корректируется согласно инструкции по медицинскому применению (листку вкладышу);
меропенем (порошок для приготовления раствора для внутривенного введения 1000 мг или 500 мг во флаконах) – для детей старше 3 месяцев раствор для инфузий вводят внутривенно капельно путем инфузии:
40 мг/кг 3 раза в день через каждые 8 часов (не более 6 г/сут). При инфекциях, вызванных микроорганизмами с потенциально повышенными значениями минимальной ингибирующей концентрации (далее – МИК) с целью оптимизации фармакокинетических и (или) фармакодинамических параметров следует рассмотреть возможность продленной инфузии в течение 3–4 часов. Доза меропенема для пациентов с нарушением функции почек корректируется согласно инструкции по медицинскому применению (листку вкладышу);
пиперациллин/тазобактам (порошок для приготовления раствора для внутривенного введения 2000 мг + 250 мг или 4000 мг + 500 мг во флаконах):
для детей старше 2 лет:
с МТ <50 кг раствор для инфузий вводят внутривенно капельно путем инфузии 80 мг/кг по пиперациллину 4 раза в день через каждые 6 часов;
с МТ >50 кг раствор для инфузий вводят внутривенно капельно путем инфузии 4000 мг пиперациллина 4 раза в день через каждые 6 часов (максимальная суточная доза по пиперациллину составляет 16 г). Этот режим направлен на оптимизацию уровня ЛС для микроорганизмов, которые могут иметь повышенные МИК. Доза пиперациллин/тазобактама для пациентов с нарушением функции почек корректируется согласно инструкции по медицинскому применению (листку вкладышу).
Если предполагается применение карбапенемов, следует предпочесть меропенем ввиду риска развития судорог при применении имипенема/циластатина. Эртапенем не рекомендуется в качестве эмпирической терапии ввиду заведомо отсутствующей активности в отношении P.aeruginosa и A.baumannii. Дорипенем* не рекомендуется детям младше 18 лет ввиду отсутствия данных о его эффективности и безопасности у данной категории пациентов.
Дополнительные антимикробные ЛС могут быть добавлены к стартовой терапии на основании клинических проявлений, предполагаемой резистентности к антимикробным ЛС или для терапии осложнений. Так, при наличии симптомов со стороны брюшной полости, таких как боль в животе или кровь в стуле, к стартовой терапии следует добавить метронидазол (раствор для инфузий 500 мг/100 мл) – детям старше 12 лет и молодым взрослым при анаэробных инфекциях раствор для инфузий вводят внутривенно капельно путем инфузии 500 мг 3 раза в день через каждые 8 часов со скоростью 5 мл/мин. Максимальная суточная доза метронидазола – 4000 мг. Для пациентов с выраженными нарушениями функции почек (клиренс креатинина менее 30 мл/мин) и (или) печени суточная доза метронидазола до 1000 мг (кратность приема 2 раза); если стартовая терапия не перекрывает анаэробный спектр (комбинация карбапенема с метронидазолом нерациональна, так как карбапенемы перекрывают спектр анаэробной активности метронидазола).
При подозрении на инфекцию, вызванную MRSA, к терапии следует добавить ванкомицин (порошок для приготовления раствора для внутривенного введения 1000 мг или 500 мг во флаконах) – раствор для инфузий вводят внутривенно капельно путем инфузии:
для молодых взрослых 500 мг 4 раза в день через каждые 6 часов или 1000 мг 2 раза в день через каждые 12 часов. ЛС вводят в виде медленной внутривенной инфузии со скоростью не более 10 мг/мин в течение 60 минут или более. Максимальная суточная доза составляет 2000 мг;
для новорожденных до 7 дней жизни начальная доза составляет 15 мг/кг, затем 10 мг/кг 2 раза в день через каждые 12 часов;
детям до 1 месяца необходимо вводить по 10 мг/кг МТ 3 раза в день через каждые 8 часов;
для детей от 1 месяца и старше рекомендуемая доза составляет 40 мг/кг МТ в сутки, разделенная на индивидуальные введения через каждые 6 часов. Инфузия проводится в течение 60 мин или более. Максимальная однократная доза для ребенка составляет 15 мг/кг МТ, максимальная суточная доза составляет 60 мг/кг МТ. Для пациентов с почечной недостаточностью необходимо индивидуально подбирать дозу. Начальная доза должна составлять 15 мг/кг МТ, далее интервал между дозированием определяется в соответствии с клиренсом креатинина.
Ванкомицин или тейкопланин не рекомендуется рутинно включать в стартовую эмпирическую терапию фебрильной нейтропении. Их следует назначать для дополнительного перекрытия грамположительных микроорганизмов;
14.2. колонизация ESBL-продуцирующими бактериями (выявление носительства цефепим-резистентных энтеробактерий (выделение из любого локуса в течение предшествовавших 90 суток) на фоне фебрильной нейтропении, обусловливает необходимость проведения стартовой эмпирической терапии у данных пациентов карбапенемом (предпочтительно меропенемом). При выявлении карбапенем-резистентных штаммов терапия проводится другим ЛС или комбинацией ЛС в соответствии с их антибиотикочувствительностью. Как правило, альтернативными ЛС для терапии инфекций, вызванных карбапенем-резистентными штаммами, могут служить амикацин, колистин, фторхинолоны (левофлоксацин*) (для пациентов старше 18 лет или off lable, если сохранена чувствительность только к левофлоксацину*), фосфомицин (при инфекциях мочевыводящих путей), цефтазидим/авибактам* (для пациентов старше 18 лет или off lable, если сохранена чувствительность только к цефтазидим/авибактаму*), а также комбинация карбапенемов (эртапенем и дорипенем*); в редких случаях при жизнеугрожающих инфекциях и резистентности ко всем другим антибиотикам – тигециклин*):
амикацин (порошок для приготовления раствора для внутривенного и внутримышечного введения 1000 мг во флаконах): раствор для инфузий вводят внутривенно капельно путем инфузии за 60–120 мин 15–20 мг/кг/сутки 2–3 раза в день, не более 1,5 г; длительность терапии не более 7 дней);
колистин (порошок для приготовления раствора для внутривенного введения и ингаляций 2 000 000 МЕ колистиметата натрия во флаконах): раствор для инфузий вводят внутривенно капельно путем инфузии за 30–60 минут:
дети с МТ <40 кг 75000–150000 МЕ/кг/сутки 3 раза в день через каждые 8 часов;
дети с МТ >40 кг – режим дозирования соответствует режиму дозирования у молодых взрослых, рекомендуемая поддерживающая суточная доза 9 000 000 ME 2–3 раза в день через каждые 12–8 часов соответственно. Для пациентов в критическом состоянии нагрузочная доза должна составлять 9 000 000 ME (максимальная поддерживающая доза – до 12 млн МЕ/сутки).
В случае выявления у детей со ЗНО возбудителя с минимальной подавляющей концентрацией более 0,75 мг/л применяется режим непрерывного круглосуточного внутривенного введения с постоянной скоростью суточной дозы 75000–100000 МЕ/кг под контролем концентрации колистиметата и колистина в крови, а также при непрерывном мониторировании функции почек (определение уровня мочевины, креатинина и клиренса по эндогенному креатинину (далее – КЭК) ежедневно).
Также возможно введение колистина ингаляционно:
молодым взрослым и детям от 2 лет назначают в дозе 1000000–2000000 ME 2–3 раза в день (до 6000000 ME в сутки);
детям до 2 лет колистат назначают в дозе 500000–1000000 ME 2 раза в день (до 2 000 000 ME в сутки);
левофлоксацин* у детей (таблетки, покрытые пленочной оболочкой, по 250 мг и 500 мг, раствор для инфузий 500 мг/100 мл во флаконах) принимают внутрь при нормальной или умеренно сниженной функцией почек (клиренс креатинина >50 мл/мин):
дети в возрасте <5 лет 10 мг/кг/сутки 1–2 раза в день через каждые 24 часа или 12 часов соответственно;
дети в возрасте старше 5 лет 20 мг/кг/сутки 1–2 раза в день через каждые 24 часа или 12 часов соответственно;
раствор для инфузий вводят внутривенно капельно путем инфузии за 60–90 минут: дети в возрасте 6 месяцев – 5 лет – 8–10 мг/кг/доза (не более 250 мг) 2 раза в день через каждые 12 часов;
дети в возрасте >5 лет – 10 мг/кг/доза 1 раз в день, не более 750 мг/сутки.
Дозу левофлоксацина* для пациентов с нарушением функции почек корректируют согласно инструкции по медицинскому применению (листку вкладышу). При нарушении функции печени не требуется коррекция режима дозирования, поскольку левофлоксацин* метаболизируется в печени в незначительной степени и экскретируется в основном почками;
фосфомицин (порошок для приготовления раствора для приема внутрь 3000 мг в пакетах): содержимое пакета растворяют в 150–200 мл воды и принимают раствор внутрь непосредственно после приготовления дети старше 12 лет в суточной дозе 3000 мг;
цефтазидим/авибактам* у детей (порошок для приготовления концентрата для приготовления раствора для инфузий 2000 мг/500 мг во флаконах): раствор для инфузий вводят внутривенно капельно путем инфузии в течении 2 часов пациентам с клиренсом креатинина >50 мл/мин 2000 мг цефтазидима* и 500 мг авибактама* в 100 мл раствора декстрозы 5 % 3 раза в день через каждые 8 часов. Максимальная доза 6000 мг/сутки цефтазидима* и 1500 мг/сутки авибактама*. Максимальная разовая доза 2000 мг цефтазидима* и 500 мг авибактама*.
Применение цефтазидима/авибактама* у детей с рассчитанным клиренсом креатинина >50 мл/мин/1,73 м2:
дети 3–6 месяцев: 40 мг/кг/10 мг/кг каждые 8 часов путем инфузии в течение 2 часов;
дети от 6 месяцев до 18 лет: 50 мг/кг/12,5 мг/кг каждые 8 часов путем инфузии в течение 2 часов. Максимальная разовая доза 2000 мг и 500 мг авибактама.
При проведении гемодиализа ЛС следует вводить после окончания сеанса; эртапенем (лиофизат для приготовления раствора для внутривенного и внутримышечного введения 1000 мг во флаконах): вводится внутримышечно (на растворе лидокаина 1–2 %) или раствор для инфузий вводят внутривенно капельно путем инфузии в течение 30 минут:
дети от 3 месяцев до 12 лет: 15 мг/кг в сутки 2 раза в день через каждые 12 часов, но не более 1 г в день;
дети старше 12 лет: 1000 мг 1 раз в день;
дорипенем* (порошок для приготовления раствора для инфузий 500 мг во флаконах): раствор для инфузий вводят внутривенно капельно путем инфузии у пациентов старше 18 лет в дозе 500 мг 3 раза в день через каждые 8 часов. Дозу дорипенема* для пациентов с нарушением функции почек корректируют согласно инструкции по медицинскому применению (листку вкладышу);
тигециклин* (лиофизат для приготовления раствора для внутривенных инфузий 50 мг во флаконах): раствор для инфузий вводят внутривенно капельно путем инфузии в течение 30–60 мин:
пациенты старше 18 лет начальная доза составляет 100 мг, далее 50 мг 2 раза в день через каждые 12 часов.
Пациентам с тяжелой печеночной недостаточностью (класс С по шкале Чайлд-Пью) после введения начальной дозы тигециклина* 100 мг в последующем его назначают по 25 мг 2 раза в день через каждые 12 часов.
Пациенты с легкими и среднетяжелыми нарушениями функции печени (классы А и В по шкале Чайлд-Пью), пациенты с почечной недостаточностью и пациенты, находящиеся на гемодиализе, не требуют коррекции дозы тигециклина*.
Применение тигециклина* у детей: раствор для инфузий вводят внутривенно капельно путем инфузии в течение 30–60 мин:
дети от 8 лет до 11 лет – 1,2 мг/кг 2 раза в день (через каждые 12 часов) (максимальная разовая доза 50 мг);
дети от 12 до 17 лет – 50 мг 2 раза в день (через каждые 12 часов);
14.3. посев крови на стерильность для верификации инфекции кровотока: медицинским показанием для исследования крови на стерильность является подозрение на инфекцию кровотока. Кроме того, крайне важно выполнять посевы крови у пациентов с установленным или подозреваемым сепсисом, менингитом, остеомиелитом, артритом, эндокардитом, перитонитом, пневмонией и лихорадкой неуточненной этиологии (особенно при фебрильной нейтропении).
При подозрении на инфекцию кровотока или общем тяжелом состоянии пациента первые посевы крови необходимо производить до начала антибактерильной терапии независимо от наличия или отсутствия лихорадки. Лихорадка при заборе крови на бактериологическое исследование не является ни чувствительным, ни специфичным признаком наличия бактериемии. Необязательны посевы крови у лихорадящего пациента с очевидными причинами лихорадки (респираторная вирусная инфекция, трансфузионная реакция, ранний послеоперационный период). Обязательны посевы крови у лихорадящего пациента в нейтропении.
Обнаружение микроорганизма во флаконе с кровью, взятой из центрального венозного катетера, на два и более часа ранее, чем во флаконе с кровью, взятой из отдельной пункции периферической вены, является доказательством катетер-ассоциированной инфекции кровотока (далее – КАИК) (при одновременном посеве из центрального венозного катетера и периферической вены).
Наиболее часто фунгемию вызывают дрожжевые грибы рода Candida. Длительность выделения дрожжевых грибов (при наличии фунгемии) с момента забора крови на бактериологическое исследование – 2–7 дней. Отрицательный ответ регистрируется не ранее, чем через 14 дней (с учетом длительности выделения и ростовых свойств плесневых грибов). Выделение из крови плесневых грибов, кроме рода Fusarium, свидетельствует о контаминации материала и требует повторного исследования;
14.4. медицинские показания для удаления центрального венозного катетера:
КАИК, вызванная Candida spp., Mycobacteria spp., S.aureus, P.aeruginosa, Acinetobakter, E.coli;
сохраняющаяся положительная гемокультура через 72 часа после старта антибактериальной терапии вне зависимости от возбудителя (коагулазанегативные стафилококки, энтерококки, стрептококки группы viridans, Corynebacterium spp., Bacillus spp.) в отсутствии других установленных источников инфекции;
ухудшение состояния пациента, вследствие предполагаемой КАИК, несмотря на 48–72 часа адекватной антибактериальной терапии;
осложненная КАИК (септический тромбоз, эндокардит, возможная диссеминация – остеомиелит);
распространенный целлюлит вокруг места стояния центрального венозного катетера (больше 2 см у детей и молодых взрослых) или по ходу подкожного тоннеля имплантируемого катетера;
рецидивирующая КАИК после завершения курса антибактериальной терапии;
14.5. изменение стартовой терапии. После начала стартовой антимикробной терапии следует проводить медицинское наблюдение за состоянием пациентов. Не следует изменять эмпирическую антибактериальную терапию только на основании персистирующей лихорадки. Изменение режима терапии может быть произведено по медицинским показаниям:
изменение клинического статуса или витальных параметров (ментальный статус, стабильность гемодинамики, наличие дыхательной недостаточности);
выделение микроорганизма из крови;
клинически или микробиологически документированная инфекция; развитие признаков локализованной инфекции;
стойкая лихорадка в течение более четырех дней;
рецидив лихорадки после первоначального ответа на терапию в виде афебрильного периода;
14.6. антибактериальная терапия, основанная на уровне прокальцитонина (далее – РСТ). Определение РСТ рекомендовано с учетом возможностей каждой конкретной организации здравоохранения. РСТ является предиктором бактериемии. РСТ может помочь в принятии решения об отмене антибактериальной терапии, поскольку коррелирует с репликацией бактерий. Существуют другие потенциальные причины повышенного уровня РСТ:
кардиоторакальные и абдоминальные оперативные вмешательства;
кардиогенный шок;
механическая травма;
тяжелые ожоги;
полиорганная недостаточность;
тепловой удар;
панкреатит;
хроническая почечная недостаточность;
медуллярный рак щитовидной железы;
немелкоклеточный рак легкого;
терапия моноклональными и поликлональными ЛС.
В зависимости от длительности клинических проявлений инфекционного процесса принимается решение об определении уровня РСТ:
если длительность не превышает 12 часов, назначается эмпирическая антибактериальная терапия по медицинским показаниям с контролем уровня РСТ через 12–24 часа;
если длительность более 12 часов, определение уровня РСТ производится незамедлительно.
При уровне РСТ:
<0,1 – бактериальную инфекцию можно считать исключенной, антибактериальная терапия не целесообразна;
0,1–0,24 – бактериальная инфекция маловероятна, антибактериальная терапия не показана, за исключением локализованных инфекций. Локализованные инфекции включают в себя документированные инфекции, имеющие установленную локализацию и согласно текущим рекомендациям требующие длительной терапии и (или) хирургической санации: перитонит, медиастинит, менингит, остеомиелит, эндокардит, перипротезная инфекция, другие;
0,25–0,49 – вероятна локализованная бактериальная инфекция. Проводится эмпирическая антибактериальная терапия согласно данным скрининга;
0,5–0,99 – вероятна инфекция кровотока. Эмпирическая антибактериальная терапия проводится согласно данным скрининга.
Проводится повторное клиническое и лабораторно-инструментальное обследование, в том числе, посев крови на стерильность;
1,0–9,9 – вероятен сепсис. Проводится эскалационная антибактериальная терапия, ЛС группы карбапенемов в комбинации с гликопептидами (или согласно данным скрининга). Консультация врача-анестезиолога-реаниматолога детского проводится по медицинским показаниям;
>10 – вероятен септический шок. Проводится деэскалационная антибактериальная терапия ЛС группы карбапенемов в комбинации с гликопептидами и (или) колистином (или согласно данным скрининга). Необходима консультация врача-анестезиолога-реаниматолога детского, следует рассмотреть необходимость перевода в отделение анестезиологии и реаниматологии, проводится мониторинг витальных функций.
У пациентов с инициальным уровнем РСТ более 0,25, а также у всех пациентов с сохраняющимися признаками инфекции, вне зависимости от инициального уровня РСТ проводится повторное определение уровня РСТ через 48 часов.
Тактика оценки РСТ в динамике через 48 часов:
значение показателя менее 0,1 предполагает отмену антибактериальной терапии;
значение показателя 0,1–0,24 или снижение >80 % от максимально определяемого у пациента предполагают отмену антибактериальной терапии, за исключением локализованных инфекций;
снижение показателя <80 % от максимально определяемого у пациента предполагает продолжение выбранной антибактериальной терапии;
рост или стабилизация показателя на прежнем уровне предполагает проведение дополнительных клинико-лабораторно-инструментальных обследований, коррекцию антибактериальной терапии согласно полученным результатам. При отсутствии новых данных – эмпирическое расширение спектра антибактериальной терапии.
Определение РСТ в динамике через 48 часов проводится до указанных выше результатов, позволяющих отменить антибактериальную терапию;
14.7. критерии отмены антибактериальной терапии: отсутствие лихорадки не менее 48 часов; отсутствие признаков локализованной инфекции;
стабильное клиническое состояние (нет дисфункции органов); длительность внутривенной антибактериальной терапии не менее 72 часов;
абсолютное число нейтрофилов (далее – АЧН) >500 для пациентов с ОМЛ, индукция и рецидивы ОЛЛ, реципиенты ТГСК;
нормализация до 0,1–0,24 или снижение уровня РСТ >80 % от максимального значения за инфекционный эпизод (при наличии возможности определения уровня РСТ в данной организации здравоохранения).
16. Нутритивный скрининг и мониторинг:
всем пациентам, получающим лечение в стационаре по поводу онкогематологического заболевания, при поступлении в стационар и далее от 1 до 4 раз в месяц (в зависимости от конкретной клинической ситуации и особенностей проводимого лечения) рекомендуется проводить нутритивный скрининг с целью выявления белково-энергетической недостаточности (далее – БЭН), либо риска ее развития.
Нутритивный скрининг заключается в первичной, а затем регулярной оценке нутритивного статуса и риска развития БЭН, в том числе скрытой, у каждого пациента, с момента поступления в стационар.
Первичный нутритивный скрининг проводится с помощью оценки антропометрических показателей, либо с использованием стандартных шкал и утилит (оценка физического развития по программе ВОЗ Антро и ВОЗ Антро Плюс, инструкция Министерства здравоохранения Республики Беларусь от 10 апреля 2009 г. № 18-1208 «Центильные характеристики антропометрических и лабораторных показателей у детей в современный период») для проведения нутритивного скрининга. Основными антропометрическими параметрами для оценки нутритивного статуса являются: МТ, рост, индекс МТ (далее – ИМТ), окружность плеча нерабочей руки, толщина кожно-жировой складки над трицепсом, вычисление окружности мышц плеча. Оценка нутритивного статуса изложена согласно приложению 5.
Пациентам с онкогематологическими заболеваниями и выявленными нутритивными нарушениями при скрининге с помощью специальных шкал, либо в результате антропометрии рекомендуется более детальное обследование нутритивного статуса: анализ фактического питания, оценка тканевого состава тела, оценка лабораторных показателей, а также детальный физикальный медицинский осмотр на предмет выявления нутритивно-метаболических нарушений.
Всем пациентам с БЭН или высоким риском ее развития (независимо от нутритивного статуса) рекомендуется проведение нутритивной поддержки (далее – НП). Первой формой НП должно являться диетологическое консультирование с последующей коррекцией основного рациона и возможным назначением дополнительно лечебных питательных смесей. При выборе формы, метода, вида и объема НП необходимо руководствоваться принципом индивидуального подхода – сообразно клинической ситуации и логике.
Расчет энергии основного обмена производится методом непрямой калориметрии, при невозможности проведения непрямой калориметрии энергия основного обмена рассчитывается по формуле Schofield (ккал/в день):
мальчики:
0–3 года: (0,167 х МТ в кг) + (15,174 х рост в см) – 617,6; 3–10 лет: (19,59 х МТ в кг) + (1,303 х рост в см) + 414,9; 10–18 лет: (16,25 х МТ в кг) + (1,372 х рост в см) + 515,5;
девочки:
0–3 года: (16,252 х МТ в кг) + (10,232 х рост в см) – 413,5; 3–10 лет: (16,969 х МТ в кг) + (1,618 х рост в см) + 371,2; 10–18 лет: (8,365 х МТ в кг) + (4,65 х рост в см) + 200.
Для расчета действительного расхода энергии (далее – ДРЭ) используются конверсионные коэффициенты. В период адаптации для расчета ДРЭ выбирается один ведущий конверсионный коэффициент. В зависимости от текущей ситуации (тяжесть состояния, режим пребывания, температурный фактор, процент дефицита МТ) конверсионный коэффициент выбирается индивидуально в диапазоне 1,1–1,5.
ДРЭ = ЭОО х КК,
где ЭОО – энергия основного обмена;
КК – конверсионный коэффициент.
У детей с хронической БЭН и длительным дефицитом поступления нутриентов, реальная потребность в нутриентах может оказаться ниже расчетной по стандартным формулам (с учетом коэффициентов) поэтому вопрос о снижении поступления нутриентов может решаться индивидуально и будет отличаться от расчетных величин.
Энтеральное питание является приоритетным при выборе метода НП: оно является наиболее физиологичным, обеспечивая внутрипросветную трофику слизистой оболочки ЖКТ препятствует микробной транслокации из просвета кишечника в кровь, является экономически более выгодным, чем парентеральное питание. Выбор метода энтерального питания определяется сохранностью глотательной функции, а также функциональным состоянием ЖКТ: отсутствие аппетита, нежелание принимать пищу и смеси для энтерального питания, нарушение глотательной функции. Невозможность восполнения потребности в нутриентах внутрь и энергии является медицинским показанием для проведения энтерального питания через назогастральный питательный зонд. Наличие патологических состояний, при которых пациент не должен принимать пищу естественным путем (острый панкреатит, стеноз выходного отдела желудка, высокие проксимальные свищи) – в этих случаях показана реализация энтерального питания через назоеюнальный зонд. При необходимости проведения зондового питания продолжительностью более 6 недель, а также при невозможности адекватной алиментации другими методами энтерального питания, при отсутствии медицинских противопоказаний показано выполнение гастростомии.
В случае, когда на начальных этапах НП выявляется необходимость длительного проведения энтерального питания и прогнозируется риск развития нутритивной недостаточности (в том числе при проведении химиолучевого лечения), либо при наличии у ребенка тяжелой хронической БЭН с высоким риском ее усугубления в дальнейшем, возможно превентивное наложение гастростомы, минуя этап зондового питания. Преимущественным и, желательно, единственным питательным субстратом, вводимым в гастростому должны являться специализированные питательные смеси.
Выбор режима введения энтерального питания определяется конкретной клинической ситуацией, состоянием ЖКТ. В зависимости от клинического состояния используется болюсный или капельный (непрерывное или сеансовое введение) режим введения питательной смеси. Начинать энтеральное питание истощенным пациентам рекомендуется с изокалорической полимерной смеси с последующим переходом на гиперкалорийную (под контролем переносимости ЖКТ). При наличии явлений мальабсорбции следует рассмотреть вопрос о назначении полуэлементной или олигомерной смеси.
Всем пациентам, которым невозможно обеспечить расчетную нутритивную потребность энтеральным путем, рекомендуется назначение парентерального питания. Потребность в парентеральном введении аминокислот рассчитывается индивидуально и зависит от возраста пациента, клинического статуса, количества поступающего белка энтеральным путем.
Парентеральное поступление липидов должно быть ограничено до максимума 4 г/кг/сутки у доношенных и недоношенных детей и 3 г/кг/сутки у детей старше 10 лет. Введение липидов нужно начинать с меньших доз, за 3–4 дня наращивая объем до расчетных значений. В процессе парентерального питания необходим постоянный мониторинг уровня триглицеридов в плазме крови и уменьшение введения липидов при необходимости. Уровень триглицеридов не должен превышать 250 мг/дл (2,8 ммоль/л) для новорожденных и 400 мг/дл (4,5 ммоль/л) для детей старше 10 лет. Потребность в парентеральном введении глюкозы рассчитывается индивидуально и зависит от возраста пациента, клинического статуса, количества поступающих углеводов энтеральным путем. Введение глюкозы нужно начинать с меньших объемов, за 3–4 дня наращивая объем до расчетных значений под контролем уровня гликемии.
Частичное парентеральное питание проводят 10–40 % декстрозой из расчета 0,5 г/кг в час, растворами аминокислот из расчета 0,12–0,25 г/кг в сутки (по азоту).
Всем пациентам, получающим НП, рекомендуется нутритивный мониторинг, который может включать антропометрию, анализ тканевого состава тела, лабораторные показатели (БИК, копрологическое исследование).
При организации и проведении лечебного питания при БЭН руководствуются утвержденными клиническими протоколами.
19. ЛС, назначаемые off label, ЛС, включенные в перечень орфанных (редких) заболеваний и ЛС, согласно приказу Министерства здравоохранения Республики Беларусь от 2 сентября 2022 г. № 1153 «Об орфанных (редких) заболеваниях и лекарственных препаратах» и ЛС, приобретаемые за счет собственных средств пациента или его законных представителей, средств юридических лиц и иных источников, не запрещенных законодательством для лечения детей с онкологическими и гематологичекими заболеваниями приведены в приложении 7;
при назначении ЛС off label проводится врачебный консилиум о необходимости назначения данного ЛС, обязательно оформляется письменное согласие пациента (законного представителя пациента) на использование данного ЛС;
протонная терапия, сцинтиграфия с МИБГ меченным I123 и I131 МИБГ терапия, доказавшие свою эффективность, включены в международные протоколы лечения. Рассмотрение вопроса о необходимости направления граждан Республики Беларусь за пределы республики для получения медицинской помощи осуществляется комиссией по направлению граждан Республики Беларусь за пределы республики для получения медицинской помощи при Министерстве здравоохранения в порядке, установленном Советом Министров Республики Беларусь.
21. Алгоритм расчета доз:
за основу берется терапевтическая доза 1 м2 поверхности тела;
в зависимости от возраста пациента доза рассчитывается по схеме: дети младше 6 месяцев – 2/3 от расчетной дозы; дети в возрасте 6 и более месяцев, но менее 12 месяцев – 3/4 расчетной дозы; дети в возрасте 12 месяцев и старше – полная терапевтическая доза.
ГЛАВА 5
ДИАГНОСТИКА И ЛЕЧЕНИЕ ГЕМАТОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ
44. Шифр по МКБ-10 – D69.3 Идиопатическая тромбоцитопеническая пурпура (далее – ИТП) (диагностируется только в том случае, если количество тромбоцитов неоднократно ниже 100 х 109/л при наличии нормальных параметров лейкоцитов и эритроцитов и исключения других не иммунных причин тромбоцитопении):
44.1. классификация:
впервые выявленная – длительность заболевания не более 3 месяцев с момента установления диагноза;
персистирующая (затяжная) форма – сохранение симптомов заболевания в течение 3–12 месяцев от установления диагноза бесспонтанной ремиссии или потери ремиссии, достигнутой под влиянием медикаментозного лечения;
хроническая форма – заболевание, длящееся более 12 месяцев;
рецидивирующее течение – при эпизодах тромбоцитопении с интервалами более 3 месяцев;
тяжелая форма – тяжесть геморрагического синдрома требует срочного терапевтического вмешательства, направленного на повышение числа тромбоцитов, а также в том случае, если прогрессирование геморрагического синдрома на фоне проводимого лечения требует применения альтернативной терапии или повышения дозы применяемого ЛС;
рефрактерная форма – устанавливается при неэффективной спленэктомии или развитии рецидива с необходимостью медикаментозного лечения вследствие риска тяжелого кровотечения;
острая, затяжная или хроническая ИТП без ответа на один или более видов медикаментозной терапии – формы заболевания у пациентов, которым не проведена спленэктомия;
44.2. степени геморрагического синдрома:
0 степень – отсутствие геморрагического синдрома;
I степень – незначительная кровоточивость, менее 100 петехий и (или) менее 5 мелких синяков (менее 3 см в диаметре); отсутствие кровоточивости слизистых;
II степень – незначительная кровоточивость, более 100 петехий и (или) более 5 мелких синяков (более 3 см в диаметре); отсутствие кровоточивости слизистых;
III степень – умеренная кровоточивость, наличие кровоточивости слизистых (носовое, требующее тампонады, мелена, гематемезис, гематурия, гематохезия, межмышечные гематомы, вагинальное кровотечение), «опасный» стиль жизни;
IV степень – жизнеугрожающие кровотечения, потенциально приводящие к стойким нарушениям функций тех или иных органов и систем;
44.3. дифференциальная диагностика: псевдотромбоцитопения; врожденные тромбоцитопении; хронические инфекции (ВИЧ, инфекции, обусловленные вирусами гепатита, герпеса, ЦМВ, ВЭБ и др.); первичные иммунодефициты; аутоиммунные заболевания (системные заболевания соединительной ткани, антифосфолипидный синдром; апластические анемии (врожденные и приобретенные); лимфопролиферативные заболевания; острые лейкозы; МДС; тромботическая тромбоцитопеническая пурпура;
44.4. медицинские показания для госпитализации:
пациенты с уровнем тромбоцитов <20 х 109/л без геморрагического синдрома или при уровне тромбоцитов <30 х 109/л и наличии геморрагического синдрома, или проживающие удаленно от организации здравоохранения, невозможности обеспечить ежедневное медицинское наблюдение врача-специалиста до достижения гемостатического уровня тромбоцитов;
уточнение диагноза;
угроза ЦНС-кровотечения;
44.5. обязательные диагностические мероприятия при установлении диагноза:
блок А; блок Б;
определение уровня IgG, IgM, IgA в сыворотке крови;
44.6 дополнительные диагностические мероприятия при установлении диагноза:
определение размера (диаметра) тромбоцитов;
УЗИ ОБП, ОМТ;
вирусологическое исследование крови (герпесгруппа, микоплазма);
определение субпопуляции лимфоцитов методом проточной цитофлуориметрии;
исследование крови на маркеры аутоиммунных заболеваний;
определение концентрации гормонов в сыворотке крови: ТТГ, Т3, Т4, ФСГ, ЛГ, тестостерона, кортизола;
проба Кумбса (определение антиэритроцитарных антител);
44.7. обязательные диагностические мероприятия при рецидивирующем и хроническом течении ИТП:
блок А; блок Б;
цитологическое исследование препарата КМ;
гистологическое исследование препарата КМ;
иммунологическое исследование крови (определение субпопуляции лимфоцитов методом проточной цитофлуориметрии);
44.8. дополнительные диагностические мероприятия при рецидивирующем и хроническом течении ИТП:
вирусологическое исследование крови (герпесгруппа, микоплазма);
исследование крови на маркеры аутоиммунных заболеваний;
определение концентрации гормонов в сыворотке крови: ТТГ, Т3, Т4, ФСГ, ЛГ, тестостерона, кортизола;
проба Кумбса (определение антиэритроцитарных антител);
УЗИ ОБП, ОМТ;
44.9. общие принципы терапии:
цель терапии – достижение безопасного, предупреждающего или купирующего геморрагический синдром уровня тромбоцитов (50 х 109/л), а не коррекция числа тромбоцитов до нормальных показателей;
терапия пациентов с ИТП должна быть основана на индивидуальном подходе с учетом не только уровня тромбоцитов, но и выраженности геморрагического синдрома, сопутствующих заболеваний, образа жизни пациента, доступности амбулаторной и стационарной медицинской помощи, опыта персонала в оказании помощи пациенту с ИТП по месту жительства, отдаленности проживания, осложнениями от ранее проводимого лечения, грамотности в отношении здоровья, психосоциальных факторов;
организация лечебно-профилактических мероприятий, направленных на санацию очагов хронической инфекции, своевременную терапию интеркуррентных заболеваний, лечение сопутствующей патологии;
пациентам с уровнем тромбоцитов более 50 х 109/л, но менее 150 х 109/л противопоказаны потенциально травмоопасные и контактные виды спорта;
пациентам за 2–3 недели перед спленэктомией показана вакцинация пневмококковой вакциной, менингококковой и антигемофильной вакцинами, с ревакцинацией согласно инструкции по медицинскому применению (листку вкладышу). При невозможности вакцинации, после операции всем пациентам назначают бензатинбензилпенициллин по схеме в течение 5 лет, далее по медицинским показаниям;
44.10. обязательные лечебные мероприятия при впервые выявленной ИТП:
при отсутствии геморрагического синдрома и уровне тромбоцитов 30–50 х 109/л: охранительный режим; санация очагов инфекции; этамзилат 10–15 мг/кг в сутки;
при геморрагическом синдроме II–III степени или 0–I степени и уровне тромбоцитов <30 х 109/л пациентам назначается терапия первой линии:
ЛС иммуноглобулина для внутривенного введения (далее – ВВИГ) в течение 2–5 дней, курсовая доза – 2 г/кг;
преднизолон – 4 мг/кг/сут внутрь в 3–4 приема, 4 дня или преднизолон – 2 мг/кг/сут внутрь, 14–21 день с постепенной отменой или метилпреднизолон внутривенно в виде пульс – терапии 30 мг/кг в сутки 3 дня (без или с последующей поддержкой);
44.11. обязательные лечебные мероприятия при персистирующей и хронической ИТП:
при отсутствии геморрагического синдрома лечения не требуется. Исключение: подготовка к оперативным вмешательствам, травмы и другие клинические ситуации, когда повышается риск кровотечения;
при наличии геморрагического синдрома назначаются короткие курсы ГКС: метилпреднизолон – 30 мг/кг/сут, внутривенно капельно 3 дня или дексаметазон – 24 мг/м2, внутривенно капельно 4 дня;
при неэффективности ГКС назначаются агонисты тромбопоэтиновых рецепторов: ромиплостим – 1 мкг/кг, подкожно, еженедельную дозу ромиплостима повышают с шагом 1 мкг/кг до тех пор, пока количество тромбоцитов не достигнет более 50 х 109/л;
или эльтромбопаг: 3–6 лет – 25 мг внутрь 1 раз в сутки, 6–17 лет – 50 мг внутрь 1 раз в сутки;
при неэффективности агонистов тромбопоэтиновых рецепторов – ритуксимаб* – 375 мг/м2, внутривенно капельно, 4 введения с интервалом 7 дней;
44.12. дополнительные лечебные мероприятия при персистирующей и хронической ИТП:
интерферон* альфа – 2b – 3 млн/м2/сут, подкожно, 3 раза в неделю;
даназол – 10 мг/кг/сут внутрь, длительно;
азатиоприн – 1–3 мг/кг/сут внутрь, длительно;
микофенолата мофетил – 250–1000 мг 2 раза в день, внутрь;
циклофосфамид – 1–2 мг/кг/сут, внутрь, длительно;
циклоспорин – 4–12 мг/кг/день, внутрь, длительно;
44.13. обязательные лечебные мероприятия при жизнеугрожающих кровотечениях:
комбинация ВВИГ (1 г/кг внутривенно капельно) и ГКС внутривенно капельно и трансфузии тромбоцитов (при внутричерепном кровоизлиянии);
при отсутствии значительного ответа на терапию назначаются агонисты тромбопоэтиновых рецепторов внутривенно;
при неэффективности – экстренная спленэктомия.
45. Шифр по МКБ-10 – D59.1 Другие аутоиммунные гемолитические анемии (далее – АИГА):
45.1. классификация:
по группам: первичные (идиопатические) и вторичные (при лимфопролиферативных новообразованиях, системной красной волчанке, ревматоидным артрите, неспецифическом язвенным колите, врожденных иммунодефицитах, раке толстой кишки, легких, желудка и яичников, некоторых инфекциях);
по типу антител: с неполными тепловыми агглютининами; с полными холодовыми агглютининами; с тепловыми гемолизинами; с двухфазными холодовыми гемолизинами Доната–Ландштейнера (крайне редкая и, как правило, вторичная форма при сифилисе и вирусных инфекциях);
по типу гемолиза: внутриклеточный; внутрисосудистый; смешанный;
45.2. дифференциальная диагностика: В12 дефицитная анемия; врожденные гемолитические анемии; ПНГ; тромботическая тромбоцитопеническая пурпура; гемолитико-уремический синдром; болезнь Вильсона; несовместимые гемотрансфузии; системная красная волчанка; первичные иммунодефициты; неспецифический язвенный колит.
Пациентам за 2–3 недели перед спленэктомией показана вакцинация пневмококковой вакциной, менингококковой и антигемофильной вакцинами с ревакцинацией согласно инструкции по медицинскому применению (листку вкладышу). При невозможности вакцинации после операции всем пациентам назначают бензатинбензилпенициллин по схеме в течение 5 лет, а дальше по медицинским показаниям;
45.3. обязательные диагностические мероприятия при установлении диагноза:
блок А, блок Б (ОАК с морфологическим исследованием эритроцитов, определением индекса ретикулоцитов; БИК с определением концентрации билирубина, непрямого билирубина, гаптоглобина (для пациентов старше 18 мес.), свободного гемоглобина плазмы, ЛДГ, мочевины, креатинина, активности аминотрансфераз (АлАТ, АсАТ);
проба Кумбса (определение антиэритроцитарных антител);
определение титра тепловых и холодовых антиэрироцитарных антител;
45.4. обязательные диагностические мероприятия при медицинском наблюдении за пациентами до нормализации показателей лабораторных исследований:
ОАК с определением индекса ретикулоцитов не реже 1 раза в неделю;
БИК не реже 1 раза в 10 дней;
проба Кумбса (определение антиэритроцитарных антител) не реже 1 раза в 2 недели;
определение титра тепловых и холодовых антиэрироцитарных антител не реже 1 раза в 2 недели;
ОАМ с определением уробилиногена, гемоглобина, гемосидерина не реже 1 раза в 10 дней;
45.5. дополнительные диагностические мероприятия при установлении диагноза:
цитологическое исследование препарата КМ;
иммунологическое исследование крови (определение субпопуляции лимфоцитов методом проточной цитофлуориметрии);
исследование уровня иммуноглобулинов классов A, M, G в сыворотке крови;
исследование уровня витамина В12, фолиевой кислоты в сыворотке крови;
исследование показателей обмена железа;
исследование на волчаночный антикоагулянт;
исследование крови на маркеры аутоиммунных заболеваний;
серологические исследования на M.pneumoniae и ВЭБ (только у пациентов с холодовыми агглютининами);
УЗИ ОБП;
45.6. обязательные лечебные мероприятия при АИГА с тепловыми или не идентифицированными агглютининами:
терапия первой линии:
ГКС из расчета 2 мг/кг/сутки по преднизолону внутривенно капельно (при уровне Hb >60–70 г/л);
ВВИГ в курсовой дозе 2–5 г/кг в течение 2–5 дней внутривенно капельно (при уровне Hb <60–70 г/л);
пульс терапия метилпреднизолоном 30 мг/кг/сутки внутривенно капельно 3 дня с последующим приемом ГКС из расчета 2 мг/кг/сутки по преднизолону или дексаметазон 0,5–1 мг/кг/сутки внутривенно капельно. После достижения уровня Hb >100 г/л доза снижается в течение 2–4 недель до поддерживающей. Полная отмена ГКС при стойкой ремиссии;
терапия второй линии:
ритуксимаб* – 375 мг/м2/сутки внутривенно капельно1 раз в неделю 4 недели;
спленэктомия;
гемотрансфузии по жизненным показаниям: отмытые эритроциты по индивидуальному подбору;
45.7. обязательные лечебные мероприятия при АИГА с холодовыми антителами:
лечение основного заболевания;
плазмаферез;
ВВИГ в курсовой дозе 2–5 мг/кг внутривенно капельно в течение 2–5 дней;
ритуксимаб* – 375 мг/м2/сутки внутривенно капельно 1 раз в неделю 4 недели;
45.8. дополнительные лечебные мероприятия:
плазмаферез;
азатиоприн – 1–3 мг/кг/сутки внутрь;
микофенолата мофетил – 250–1000 мг 2 раза в день внутрь;
циклофосфамид – 1–2 мг/кг/сутки внутрь;
циклоспорин – 4–12 мг/кг/день внутрь;
винкристин – 1 мг/м2 внутривенно струйно 1 раз в неделю.
46. Шифр по МКБ-10 – D69.3 Идиопатическая тромбоцитопеническая пурпура (синдром Эванса-Фишера):
46.1. классификация:
симптоматическая форма (при хроническом гепатите, системной красной волчанке, хроническом лимфолейкозе, лимфомах, ревматоидном артрите, туберкулезе и других);
идиопатическая форма (не удается установить связь с другим патологическим процессом, диагноз исключения);
46.2. дифференциальный диагноз: аутоиммунные заболевания (системная красная волчанка, аутоиммунный гепатит, ревматоидный артрит и др.); синдром приобретенного иммунодефицита; первичный иммунодефицит (АЛПС, ОВИН, GATA2 дефицит, дефицит CTLA-4, LRBA, KRAS, STAT3 CD27, синдром активированной PI3KD, Х-сцепленный иммунодефицит с дефектом транспорта магния и др.); лимфома Ходжкина; целиакия; ПНГ; тромботическая тромбоцитопеническая пурпура.
Пациентам за 2–3 недели перед спленэктомией показана вакцинация пневмококковой вакциной, менингококковой и антигемофильной вакцинами, с ревакцинацией согласно инструкции по медицинскому применению (листку вкладышу). При невозможности вакцинации, после операции всем пациентам назначают бензатинбензилпенициллин по схеме в течение 5 лет, а дальше по медицинским показаниям;
46.3. обязательными диагностическими мероприятиями при установлении диагноза являются:
блок А, блок Б (ОАК с морфологическим исследованием эритроцитов, определением индекса ретикулоцитов; БИК с определением концентрации билирубина, непрямого билирубина, гаптоглобина (для пациентов старше 18 мес.), свободного гемоглобина плазмы, ЛДГ, мочевины, креатинина, активности АлАТ, АсАТ;
проба Кумбса (определение антиэритроцитарных антител);
46.4. дополнительными диагностическими мероприятиями при установлении диагноза являются:
цитологическое исследование препарата КМ;
иммунологическое исследование крови (определение субпопуляции лимфоцитов методом проточной цитофлуориметрии);
исследование уровня иммуноглобулинов классов A, M, G в сыворотке крови;
исследование уровня витамина В12, фолиевой кислоты в сыворотке крови;
исследование показателей обмена железа;
исследование на волчаночный антикоагулянт;
исследование крови на маркеры аутоиммунных заболеваний;
серологические исследования на M.pneumoniae, герпес группа и ВЭБ;
УЗИ ОБП;
46.5. обязательные лечебные мероприятия:
терапия первой линии:
дексаметазон 0,5–1 мг/кг/сутки внутривенно капельно в течение суток или пульстерапия метилпреднизолоном 30 мг/кг/сут внутривенно капельно 3 дня, затем 20 мг/кг/сутки 4 дня, затем 10, 5, 2, 1 мг/кг/нед. Полная отмена ГКС при стойкой ремиссии;
ВВИГ 1 г/кг/сутки внутривенно капельно в течение 2 дней;
гемотрансфузии по жизненным показаниям: отмытые эритроциты по индивидуальному подбору;
терапия второй линии:
ритуксимаб* – 375 мг/м2 в сутки внутривенно капельно 1 раз в неделю 4 недели;
микофенолата мофетил – 650 мг/м2 2 раза в день внутрь;
сочетанная терапия микофенолата мофетил + ритуксимаб*;
циклоспорин;
спленэктомия;
46.6. дополнительные лечебные мероприятия:
плазмаферез;
агонисты тромбопоэтиновых рецепторов: ромиплостин – 5 мкг/кг подкожно 1 раз в неделю до достижения уровня тромбоцитов более 100 х 109/л, затем суточную дозу ЛС постепенно снижают на 1 мкг/кг еженедельно до полной отмены;
или эльтромбопаг: дети 3–6 лет – 25 мг 1 раз в сутки внутрь, дети 6–17 лет и молодые взрослые – 50 мг 1 раз в сутки внутрь;
азатиоприн – 1–3 мг/кг/сутки внутрь;
циклофосфамид – 1–2 мг/кг/сутки внутрь;
винкристин – 1 мг/м2 внутривенно струйно 1 раз в неделю;
ТГСК.
47. Шифр по МКБ-10 – D58.0 Наследственный сфероцитоз:
47.1. классификация:
по характеру течения: кризовое течение; хронический гемолиз;
по степени тяжести:
минимальная (бессимптомная форма) – гемоглобин >120 г/л, ретикулоциты <30‰, билирубин <17 мкмоль/л;
легкая форма – гемоглобин 100–120 г/л, ретикулоциты >60‰, билирубин 17–34 мкмоль/л;
среднетяжелая форма – гемоглобин 100–120 г/л, ретикулоциты 30–60 %, билирубин 17–34 мкмоль/л;
тяжелая форма – гемоглобин 60–80 г/л, ретикулоциты >100‰, билирубин >50 мкмоль/л;
47.2. дифференциальная диагностика: другие врожденные гемолитические анемии, обусловленные нарушением структуры и функции белков мембраны эритроцитов (врожденный эллиптоз, врожденный пиропойколоцитоз, врожденный овалоцитоз); гемолитические анемии, обусловленные дефицитом эритроцитарных энзимов (дефицит глюкозо-6-фосфатдегиидрогеназы, дефицит пируваткиназы); АИГА; транзиторная эритробластопения (при арегенераторном кризе).
Пациентам за 2–3 недели перед спленэктомией показана вакцинация пневмококковой вакциной, менингококковой и антигемофильной вакцинами, с ревакцинацией согласно инструкции по медицинскому применению (листку вкладышу). При невозможности вакцинации, после операции всем пациентам назначают бензатинбензилпенициллин по схеме в течение 5 лет, а дальше по медицинским показаниям.
Пациентам с признаками перегрузки железа показана хелаторная терапия, она начинается после 10–15 трансфузий эритроцитов при уровне ферритина в сыворотке крови не менее 1000 мкг/л. Деферазирокс (начальная доза для лекарственной формы таблетка диспергируемая – 20 мг/кг/сутки внутрь ежедневно, далее с шагом 5 мг/кг/сутки повышается до максимальной дозы 40 мг/кг/сутки или понижается в зависимости от концентрации ферритина сыворотки крови; начальная доза для лекарственной формы таблетка, покрытая пленочной оболочкой – 14 мг/кг/сутки внутрь ежедневно, далее с шагом 3,5 мг/кг/сутки в зависимости от ферритина сыворотки крови доза повышается или понижается; максимальная доза 28 мг/кг/сутки). Отмена хелаторной терапии при достижении ферритина сыворотке 600 мкг/л;
47.3. обязательные диагностические мероприятия при установлении диагноза:
блок А, блок Б (ОАК с подсчетом ретикулоцитов и морфологической оценкой эритроцитов (средний диаметр эритроцитов, индекс сферичности (норма >3,5), индекс овалоцитоза; БИК с определением общего билирубина и его фракций, ЛДГ, АсАТ, АлАТ, ЩФ, холестерина, железа, ферритина, гаптоглобина);
исследование осмотической резистентности эритроцитов до и после инкубации;
тест с флюоресцентным красителем эозин-5-малеимид;
УЗИ ОБП;
47.4. обязательные лечебные мероприятия:
ЛС фолиевой кислоты – 1–5 мг/сутки внутрь 1 месяц, каждые 6 месяцев;
урсодезоксихолевая кислота – 20–40 мг/кг сутки внутрь, 1 месяц, при необходимости курс повторяется;
заместительная терапия эритроцитами при уровне Hb <70 г/л;
медицинские показания к спленэктомии:
тяжелая форма в возрасте не ранее 3 лет;
среднетяжелая форма в возрасте 6–12 лет;
легкая форма – при наличии камней в желчном пузыре при одномоментном выполнении спленэктомии и холецистэктомии в любом возрасте старше 6 лет.
48. Шифр по МКБ-10 – D51 Витамин-В12-дефицитная анемия:
48.1. дифференциальный диагноз: атрофический гастрит, целиакия, цирроз, гемолитическая анемия, гипертиреоз, гипотиреоз, миелопролиферативные заболевания, синдром Золлингера–Эллисона, иммунная тромбоцитопения, рак желудка;
48.2. обязательные диагностические мероприятия при установлении диагноза:
блок А;
ОАК с подсчетом ретикулоцитов и морфологической оценкой эритроцитов;
БИК (общий билирубин и его фракции, ЛДГ, АСТ, АЛТ, ЩФ, холестерин, железо, ферритин, гаптоглобин);
исследование уровня витамина В12 в сыворотке крови;
48.3. дополнительные диагностические мероприятия при установлении диагноза:
цитологическое исследование препарата КМ;
УЗИ ОБП, ЭГДС;
48.4. обязательные лечебные мероприятия:
диетотерапия;
лечение сопутствующих заболеваний;
цианкобаламин – 5 мкг/кг/сут внутримышечно детям в возрасте до 1 года; 200 мкг/сут внутримышечно детям в возрасте 1–3 года; 400 мкг/сут внутримышечно детям в возрасте 4–10 лет; 500 мг/сут внутримышечно детям в возрасте старше 10 лет. Цианкобаламин вводится ежедневно в течение 5–10 дней до получения ретикулоцитарного криза, затем через день до нормализации гематологических показателей;
ПТ цианкобала;
мином: еженедельное введение ЛС в суточной дозе соответственно возрасту в течение 2 месяцев, затем последующие 6 месяцев – 2 раза в месяц. При невозможности устранить причину развития анемии противорецидивные курсы лечения цианкобаламином проводятся ежегодно в суточной дозе соответственно возрасту: на один курс 10–15 инъекций или в режиме постоянного введения 1 раз в месяц;
48.5. дополнительные лечебные мероприятия:
заместительная терапия эритроцитами при уровне Hb <50 г/л или по жизненным показаниям.
49. Шифр по МКБ-10 – D61.0 Конституциональная апластическая анемия (анемия Даймонда-Блекфена (далее – АДБ):
49.1. классификация АДБ:
трансфузионно зависимая (пациент получает регулярные заместительные трансфузии эритроцитов);
полная медикаментозная ремиссия (достигнут ПГО на терапию ГКС);
медикаментозная субкомпенсация (достигнут частичный гематологический ответ на терапию ГКС);
спонтанная ремиссия;
«неклассическая» АДБ: выявлена типичная для заболевания мутация, но в клинической картине представлены не все обязательные диагностические критерии, или пациенты с множественными пороками развития и типичными мутациями АДБ, но без гематологических проявлений;
49.2. основные диагностические критерии:
нормохромная, часто макроцитарная анемия, развивающаяся на первом году жизни;
ретикулоцитопения;
нормоклеточный КМ с избирательным дефицитом предшественников эритроцитов;
нормальное или слегка пониженное количество лейкоцитов;
нормальное или слегка повышенное количество тромбоцитов;
дополнительные диагностические критерии:
выявление генетических мутаций;
семейный анамнез;
повышенная активность аденозиндезаминазы эритроцитов (еАДА);
врожденные аномалии;
повышение уровня HbF;
нет доказательств другого синдрома наследственной недостаточности КМ;
49.3. дифференциальный диагноз: транзиторная эритробластопения, анемия Фанкони, В12 дефицитная анемия, приобретенная апластическая анемия (далее – ПАА), МДС, синдром Пирсона, поздняя гипорегенераторная анемия вследствие изоиммунизации матери и плода;
49.4. обязательные диагностические мероприятия при установлении диагноза:
блок А; блок Б (ОАК с морфологической оценкой эритроцитов);
исследование уровня еАДА;
исследование уровня HbF;
цитологическое исследование препарата КМ;
молекулярно-генетическое исследование препарата КМ для выявления специфических генетических мутаций (секвенирование по Сэнгеру или высокопроизводительное секвенирование);
49.5. дополнительные диагностические мероприятия (по медицинским показаниям):
исследование уровня эритропоэтина;
клоногенный тест;
вирусологическое исследование на парвовирус В19 (кровь, КМ);
исследование уровня В12 и фолиевой кислоты в сыворотке крови;
гистологическое исследование препарата КМ;
УЗИ ОБП;
49.6. критерии гематологического ответа:
полный – Hb >100 г/л, нормальное число ретикулоцитов;
частичный – Hb 85–100 г/л, наличие ретикулоцитов;
отсутствие ответа – Hb <85 г/л, ретикулоцитопения.
Пациентам с признаками перегрузки железа показана хелаторная терапия, она начинается после 10–15 трансфузий эритроцитов при уровне ферритина в сыворотке крови не менее 1000 мкг/л. Деферазирокс (начальная доза для лекарственной формы таблетка диспергируемая – 20 мг/кг/сутки внутрь ежедневно, далее с шагом 5 мг/кг/сутки повышается до максимальной дозы 40 мг/кг/сутки или понижается в зависимости от концентрации ферритина сыворотки крови; начальная доза для лекарственной формы таблетка, покрытая пленочной оболочкой – 14 мг/кг/сутки внутрь ежедневно, далее с шагом 3,5 мг/кг/сутки в зависимости от ферритина сыворотки крови доза повышается или понижается; максимальная доза 28 мг/кг/сутки). Отмена хелаторной терапии при достижении ферритина сыворотке 600 мкг/л;
49.7. обязательными лечебными мероприятиями являются:
ГКС через 2 недели после трансфузии эритроцитов. Стартовая доза преднизолона – 2 мг/кг/сутки внутрь в течение 2–4 нед., при отсутствии ответа отмена в течение 3 дней; при наличии ответа (стабилизация Hb >90 г/л, ретикулоцитоз) постепенное снижение дозы ГКС по 0,5 мг/кг/сутки каждые 2 недели, при достижении дозы 1 мг/кг/сутки темп снижения дозы замедлить – каждые 4 недели, возможен переход на альтернирующий режим приема ЛС. Скорость снижения дозы в этом случае – каждые 8 недель. Максимальная допустимая поддерживающая доза преднизолона <0,5 мг/кг/сутки. На все время приема пациентом ГКС в дозах более 0,5 мг/кг/сутки с целью медицинской профилактики осложнений показан прием в возрастной дозе ЛС: ингибиторы протонной помпы (ежедневно), ЛС калия (ежедневно), ЛС кальция (ежедневно), витамин Д, котримоксазол (сульфаметоксазол + триметоприм) в дозе 5 мг/кг по триметоприму три последовательных дня в неделю.
Содержание Hb после трансфузии эритроцитов должно составлять 115–120 г/л.
50. Шифр по МКБ-10 – D61.0 Конституциональная апластическая анемия (анемия Фанкони):
50.1. дифференциальный диагноз: врожденный дискератоз; АДБ; синдром Швахмана-Даймонда; синдром VACTERL; синдром CHARGE; синдром TAR;
50.2. медицинские показания для обязательного обследования с целью исключения анемии Фанкони:
- апластическая анемия;
- пациенты с классическими аномалиями развития, дефектами позвонков, атрезией ануса, гипоплазией лучевой кости, наличием двух признаков из следующих: большое количество пятен цвета «кофе с молоком» на коже, микроцефалия, микрофтальмия, низкий рост;
- сквамозно-клеточная карцинома пищевода, органов головы и шеи или женских половых органов в раннем детском возрасте;
- пациенты с лейкозом и необычной реакцией на химиотерапию;
50.3. обязательные диагностические мероприятия при установлении диагноза:
- блок А; блок Б;
- тест на ломкость хромосом с ДЭБ или с митомицином С (далее – ММС);
- клоногенный тест;
- цитологическое исследование препарата КМ;
- цитогенетическое исследование препарата КМ методом FISH;
- цитогенетическое исследование препарата КМ методом G-бэндинг;
- гистологическое исследование препарата КМ;
- молекулярно-генетическое исследование препарата КМ для выявления специфических генетических мутаций (секвенирование по Сэнгеру или высокопроизводительное секвенирование);
50.4. дополнительные диагностические мероприятия (по медицинским показаниям):
- УЗИ ОБП, ОМТ, Эхо-КГ;
- вирусологическое исследование крови;
- исследование уровня витамина В12 и фолиевой кислоты в сыворотке крови;
- выявление хромосомных аберраций в культивируемых с ДЭБ или ММС фибробластах кожи;
50.5. цель терапии: обеспечить нормальный рост и развитие ребенка, сохранить трудоспособность в подростковом и взрослом возрасте, обеспечить хорошее качество жизни пациента;
пациентам с признаками перегрузки железа показана хелаторная терапия, она начинается после 10–15 трансфузий эритроцитов при уровне ферритина в сыворотке крови не менее 1000 мкг/л. Деферазирокс (начальная доза для лекарственной формы таблетка диспергируемая – 20 мг/кг/сутки внутрь ежедневно, далее с шагом 5 мг/кг/сутки повышается до максимальной дозы 40 мг/кг/сутки или понижается в зависимости от концентрации ферритина сыворотки крови; начальная доза для лекарственной формы таблетка, покрытая пленочной оболочкой – 14 мг/кг/сутки внутрь ежедневно, далее с шагом 3,5 мг/кг/сутки в зависимости от ферритина сыворотки крови доза повышается или понижается; максимальная доза 28 мг/кг/сутки). Отмена хелаторной терапии при достижении ферритина сыворотке 600 мкг/л;
50.6. обязательные лечебные мероприятия:
- ТГСК;
- при невозможности выполнения ТГСК, а также уровне Hb <80 г/л, тромбоцитов <30 х 109/л, нейтрофилов <1,0 х 109/л и при наличии очагов гемопоэза в КМ назначаются андрогены (даназол 10 мг/кг/сутки внутрь). При отсутствии эффекта в течение 3–4 месяцев ЛС отменяется. При достижении гематологического ответа – снижение дозы каждые 3–4 месяца до поддерживающей дозы;
50.7. дополнительные (по медицинским показаниям) лечебные мероприятия:
- заместительная терапия эритроцитами, тромбоцитами;
- рекомбинантный КСФ – 5–10 мг/кг подкожно;
- эритропоэтиин – 150–300 МЕ/кг 3 раза в неделю, подкожно или 600 МЕ/кг 1 раз в неделю, внутривенно.
51. Шифр по МКБ-10 – D76.0 Гистиоцитоз из клеток Лангерганса (далее – ГКЛ), не классифицированный в других рубриках:
51.1. классификация:
- локализованные формы ГКЛ: унифокальное поражение костей, мягких тканей, другие;
- группа 1 – мультисистемный ГКЛ: пациенты с поражением двух или более органов и (или) систем органов с поражением или без поражения органов риска (система гемопоэза, печень, селезенка);
- группа 2 – моносистемный ГКЛ: пациенты с мультифокальным поражением костей и пациенты с изолированными очагами с риском поражения ЦНС;
51.2. обязательные диагностические мероприятия при установлении диагноза:
- блок А; блок Б;
- гистологичекое, морфологическое и цитологическое исследование препарата ткани опухоли;
- ИГХ препарата опухоли (s100, CD1a);
- анализ мочи по Зимницкому;
- цитологическое и гистологическое исследование препарата КМ у пациентов с мультисистемным поражением;
- рентгенография ОГК в двух проекциях, зон инициального поражения, скелетограмма;
51.3. обязательные диагностические мероприятия перед курсом химиотерапии:
- блок А;
- ОАК;
- БИК (уровень глюкозы, общий белок, билирубин, мочевина, креатинин, калий, натрий, магний, общий кальций, хлориды, неорганический фосфор, сывороточное железо, СРБ, определение активности ЛДГ, ЩФ, АсАТ, АлАТ, ГГТП);
- рентгенография зон инициального поражения;
51.4. дополнительные диагностические мероприятия (по медицинским показаниям):
- исследование уровня гормонов щитовидной железы (ТТГ, анти ТПО, Т4 своб.) в крови;
- исследование уровня креатинина в моче;
- УЗИ периферических ЛУ, ОБП, ОМТ, Эхо-КГ;
- КТ головного мозга и лицевого черепа, ОГК;
- МРТ позвоночника, головного мозга;
- консультация врача-стоматолога детского, врача – челюстно-лицевого хирурга, врача-офтальмолога, врача-оториноларинголога; врача – детского эндокринолога, врача – детского невролога;
51.5. оценка эффективности терапии:
по активности заболевания:
без признаков активности (далее – БПА) – исчезновение всех очагов или симптомов;
наличие признаков активности: регрессия очагов или симптомов, нет новых очагов (улучшение); персистирование очагов или симптомов, новые очаги не появляются (стабилизация); прогрессирование имеющихся очагов или симптомов и (или) появление новых очагов (прогрессирование). При изолированном поражении кости прогрессирование определяется как появление новых очагов в костях или появление очагов в других органах;
по варианту ответа:
хороший – БПА, улучшение;
промежуточный – стабилизация; появление новых очагов в одном месте и исчезновение в другом;
плохой – прогрессирование;
51.6. локализованные формы – медицинское наблюдение;
51.7. обязательные лечебные мероприятия для группы 1:
инициальный курс 1: винбластин – 6 мг/м2, внутривенно струйно, в 1-й день 1, 2, 3, 4, 5, 6 недели; преднизолон – 40 мг/м2, внутрь ежедневно 4 недели с постепенной отменой в течении 2 недель;
пациенты без поражения органов риска и хорошим или промежуточным ответом на 6 неделе лечения и пациенты с поражением органов риска и хорошим ответом получают инициальный курс 2: винбластин – 6 мг/м2, внутривенно струйно в 1-й день 8, 9, 10, 11, 12, 13 недели; преднизолон – 40 мг/м2, внутрь 1–3 дни 8, 9, 10, 11, 12, 13 недели;
пациенты БПА после инициального курса 1 и пациенты без поражения органов риска, достигшие хорошего ответа после инициального курса 2, получают ПТ. Объем и длительность ПТ определяются решением врачебного консилиума и зависят от клинической ситуации;
51.8. обязательные лечебные мероприятия для группы 2:
- инициальный курс 1 описан в подпункте 51.7 настоящего пункта;
- пациенты с улучшением и промежуточным ответом после инициального курса 1 получают инициальный курс 2, который описан в подпункте 51.7 настоящего пункта;
- пациенты БПА после инициального курса 1 и пациенты БПА и улучшением после инициального курса 2 получают ПТ. Объем и длительность ПТ определяются решением врачебного консилиума и зависят от клинической ситуации;
51.9. медицинские показания к инициальному курсу терапии второй линии:
- пациенты с прогрессированием заболевания в органах, не относящихся к органам риска, после первых 6 недель лечения;
- пациенты с промежуточным ответом или прогрессированием по органам, не относящимся к органам риска, с улучшением по органам риска после первых 13 недель лечения;
- пациенты с прогрессированием заболевания в органах, не относящихся к органам риска, в любой момент во время ПТ;
- пациенты с сохранением активности заболевания после завершения терапии;
- пациенты с реактивацией заболевания в органах, не относящихся к органам риска, в любой момент после завершения терапии;
51.10. инициальный курс терапии второй линии:
- преднизолон – 40 мг/м2, внутрь ежедневно 2 недели с последующим снижением дозы в течении 6 недель; цитарабин – 100 мг/м2, внутривенно струйно или подкожно в течение 4 дней на 1, 4, 7, 10, 13, 16, 19, 22 неделе;
- винкристин – 1,5 мг/м2, внутривенно струйно на 1 день 1, 4, 7, 10, 13, 16, 19, 22 недели;
- пациенты, у которых после окончания инициального курса терапии второй линии отмечается ответ БПА или улучшение, получают ПТ. Объем и длительность ПТ определяются решением врачебного консилиума и зависят от клинической ситуации;
- при химиорефрактерности проводится высокодозная ПХТ с ТГСК.
52. Шифр по МКБ-10 – D61.8 ПАА:
52.1. классификация по степени тяжести: сверхтяжелая, тяжелая и нетяжелая.
Критерии определения степени тяжести ПАА (должны быть выполнены не менее двух из трех представленных критериев):
сверхтяжелая ПАА – ретикулоциты <20 х 109/л (ручной подсчет) или с коррекцией по гематокриту менее 1‰, тромбоциты <20 х 109/л, гранулоциты <0,2 х 109/л (200 клеток/мкл);
тяжелая ПАА – ретикулоциты <20 х 109/л (ручной подсчет) или с коррекцией по гематокриту менее 1‰, тромбоциты <20 х 109/л, гранулоциты >0,2 х 109/л (200 клеток/мкл), но <0,5 х 109/л (500 клеток/мкл);
нетяжелая ПАА – все остальные случаи ПАА;
52.2. обязательные диагностические мероприятия при установлении диагноза:
блок А, блок Б, блок В;
проба Кумбса (определение антиэритроцитарных антител);
исследование уровня эритропоэтина крови;
исследование крови на маркеры аутоиммунных заболеваний, показателей клеточного иммунитета с подсчетом абсолютного количества Т- и В-лимфоцитов, уровня комплемента;
миелограмма из 2 точек с определением содержания (в процентах) CD34+ клеток (стволовых клеток) в КМ;
цитологическое, цитогенетическое и молекулярно-генетическое исследование препарата КМ;
гистологическое исследование препарата КМ (билатеральное) с оценкой процента жировой ткани, гемафагоцитоза, гемосидероза;
тест на ломкость хромосом, нестабильность хромосом с ДЭБ;
исследование на ген FANCA;
исследование крови методом проточной цитофлуориметрии для выявления клона клеток ПНГ;
HLA-типирование (серологическое и молекулярное);
рентгенография кисти для определения костного возраста;
52.3. обязательные диагностические мероприятия при лечении:
ОАК – 1 раз в неделю (до достижения трансфузионной независимости) затем 1 раз в месяц до 2 лет; +28, +64, +112, +180, +360, +720 дни после ИСТ; +30, +60, +100, +180 и +360 дни после ТГСК;
определение группы крови по системе АВ0 и резус-принадлежности – +28, +64, +112, +180, +360, +720 дни после ИСТ; +30, +60, +100, +180 и +360 дни после ТГСК (до достижения 100 % химеризма);
исследование показателей клеточного иммунитета с подсчетом абсолютного количества Т- и В-лимфоцитов, уровня комплемента – +28, +64, +112, +180, +360, +720 дни после ИСТ; перед проведением ТГСК, +30, +60, +100, +180 и +360 дни после ТГСК;
миелограмма из 2 точек с определением содержания (в процентах) CD34+клеток (стволовых клеток) в КМ – +28, +64, +112, +180, +360, +720 дни после ИСТ; +30, +60, +100, +180 и +360 дни после ТГСК;
исследование показателей гемостаза (АЧТВ, ПТВ, фибриноген, ПДФ, D-димеры, волчаночный антикоагулянт – +28, +64, +112, +180, +360, +720 дни после ИСТ; перед проведением ТГСК, +30, +60, +100, +180 и +360 дни после ТГСК;
определение уровня циклоспорина А в сыворотке крови – 2 раза в неделю до достижения стабильного терапевтического уровня (150–200 нг/мл), 1 раз в месяц до начала постепенной отмены ЛС;
52.4. дополнительные диагностические мероприятия (по медицинским показаниям):
- КТ придаточных пазух носа, ОГК;
- вирусологическое исследование крови;
- исследование уровня гормонов в крови;
- исследование уровня креатинина в моче;
- УЗИ щитовидной железы;
52.5. общие принципы лечения:
лечение ПАА необходимо начинать незамедлительно. Цель терапии – максимально быстрое восстановление нормального кроветворения. Объем терапии определяется степенью тяжести ПАА. При нетяжелой форме заболевания проводится монотерапия циклоспорином А. При тяжелой и сверхтяжелой ПАА показано выполнение ТГСК от совместимого (HLA-идентичного) родственного или неродственного донора. При отсутствии совместимого донора или наличии медицинских противопоказаний для проведения ТГСК пациентам с ПАА показано проведение ИСТ с использованием антитимоцитарного глобулина и циклоспорина А;
52.6. варианты ответа на ИСТ:
нет гематологического ответа – при обследовании пациента в регламентированные сроки имеются признаки заболевания и сохраняется зависимость от трансфузий тромбоцитов и (или) эритроцитов;
частичный гематологический ответ – при обследовании пациента в регламентированные сроки имеются признаки заболевания, отсутствует зависимость от трансфузий тромбоцитов и эритроцитов;
ПГО – при обследовании пациента в регламентированные сроки отсутствуют признаки заболевания, имеется восстановление всех гематологических показателей хотя бы до нижней границы нормы, а также полная трансфузионная независимость;
возврат болезни или рецидив – после снижения или отмены циклоспорина А регистрируется стойкое снижение гематологических показателей ниже возрастной нормы, при возврате на прежнюю дозу циклоспорина А не происходит нормализации гематологических показателей, появляется зависимость от трансфузий компонентов крови, при этом отсутствуют признаки острого лейкоза или другого клонального заболевания;
клональное заболевание – по данным морфологического, молекулярно-генетического, цитогенетического исследования имеются признаки вторичной опухоли или вторичного МДС;
52.7. обязательные лечебные мероприятия у пациентов с нетяжелой ПАА:
монотерапия циклоспорином А – стартовая доза 4–5 мг/кг в сутки в 2 приема, внутрь. В дальнейшем доза циклоспорина А подбирается индивидуально таким образом, чтобы его концентрация в цельной крови, измеренная до утреннего приема ЛС составляла 150–200 нг/мл. У детей целесообразно применять циклоспорин А в суспензии. Или сочетать прием циклоспорина А в капсулах и в форме суспензии (одного производителя);
при достижении частичного гематологического ответа к 112 дню от начала монотерапии циклоспорином А пациент продолжает лечение в данном режиме дозирования;
при достижения полного гематологического ответа прием циклоспорина А в полной дозе продолжается не менее года, затем начинается постепенное снижение дозы ЛС не более, чем на 10 % в месяц;
минимальная длительность монотерапии циклоспорином А составляет 24 месяца;
52.8. обязательные лечебные мероприятия у пациентов с тяжелой и сверхтяжелой ПАА:
52.8.1. проведение аллоТГСК в терапии первой линии при наличии полностью совместимого донора гемопоэтических стволовых клеток и при отсутствии медицинских противопоказаний. Предпочтение отдается родственной аллоТГСК;
иммуноглобулин – 0,2 г/кг, внутривенно капельно, на «минус» 8, «минус» 1 дни в режиме кондиционирования, далее еженедельная заместительная терапия внутривенным иммуноглобулином в дозе 0,1–0,2 г/кг до иммунологического восстановления;
режим кондиционирования при аллогенной родственной HLA – идентичной ТГСК: флударабин*, разовая доза – 30 мг/м2, внутривенно капельно, суммарная доза – 150 мг/м2, дни введения -9, -8, -7, -6, -5; циклофосфамид, разовая доза – 25 мг/кг, внутривенно капельно, суммарная доза – 100 мг/кг, дни введения -5, -4, -3, -2; кроличий антитимоцитарный глобулин, разовая доза – 3,75 мг/кг, внутривенно капельно, суммарная доза – 11,25 мг/кг, дни введения -3, -2, -1;
в день 0 выполняется инфузия гемопоэтических стволовых клеток согласно общепринятой методике;
режим кондиционирования при аллогенной неродственной HLA – идентично ТГСК: флударабин*, разовая доза – 30 мг/м2, внутривенно капельно, суммарная доза – 150 мг/м2, дни введения -6, -5, -4, -3, -2; циклофосфамид, разовая доза – 50 мг/кг, внутривенно капельно, суммарная доза – 200 мг/кг, дни введения -5, -4, -3, -2; кроличий антитимоцитарный глобулин, разовая доза – 3,75 мг/кг, внутривенно капельно, суммарная доза – 11,25 мг/кг, дни введения -3, -2, -1; тотальное лимфоидное облучение, разовая доза 1–2 Гр, суммарная доза 2–4 Гр, дни облучения -8, -7 или -2, -1;
при наличии HLA-антител у реципиента назначается ритуксимаб* в дозе 200 мг/м2, внутривенно капельно, на день 0;
в день 0 выполняется инфузия гемопоэтических стволовых клеток согласно общепринятой методике;
52.8.2. пациентам, которые не имеют полностью совместимого донора ГСК, или, которые имеют медицинские противопоказания к аллоТГСК, показано проведение ИСТ:
антитимоцитарный (лошадиный) иммуноглобулин – 40 мг/кг, внутривенно капельно в течение 8–10 часов, 4 введения, суммарная доза – 160 мг/кг; метилпреднизолон 1 мг/кг, 10 дней;
алгоритм назначения метилпреднизолона: в дни введения АТГ метилпреднизолон вводится внутривенно в виде постоянной инфузии или в три приема; введение начинается за 1 час до введения АТГ, затем ЛС принимается внутрь до 10 дней, при отсутствии проявлений сывороточной болезни дозу метилпреднизолона начинают постепенно снижать до ее полной отмены к 14 дню;
циклоспорин А назначается в первый день введения АТГ в стартовой дозе 4–5 мг/кг, внутрь в 2 приема. В особых случаях (рвота, диарея с потерей жидкости, другие) допускается назначение циклоспорина А внутривенно в виде постоянной инфузии. В дальнейшем доза циклоспорина А подбирается индивидуально таким образом, чтобы его концентрация в цельной крови, измеренная до утреннего приема ЛС составляла 150–200 нг/мл. При отсутствии частичного гематологического ответа к 180 дню от начала ИСТ, потере полного гематологического ответа, возврате болезни, развитии клонального заболевания дальнейшая терапия определяется врачебным консилиумом.
ГЛАВА 6
ДИАГНОСТИКА И ЛЕЧЕНИЕ РЕДКИХ ЗАБОЛЕВАНИЙ
53. Шифр по МКБ-10 – Е75.2 Другие сфинголипидозы (болезнь Гоше (далее – БГ):
53.1. классификация:
БГ 1 тип (ненейронопатический вариант);
БГ 2 тип (острый нейронопатический вариант);
БГ 3 тип (подострый нейронопатический вариант).
БГ 3 типа в зависимости от клинических проявлений классифицируется на:
IIIа – умеренно выраженная гепатоспленомегалия, прогрессирующие неврологические симптомы (подострая миоклоническая эпилепсия);
IIIb – выраженная гепатоспленомегалия, окуломоторная апраксия, медленно прогрессирующие неврологические симптомы;
IIIc – поражение клапанов сердца с их кальцификацией, помутнением роговицы, окуломоторная апраксия, отставание в умственном развитии у гомозигот с мутацией D409H.
Каждому пациенту, имеющему клинические проявления БГ 1 тип, БГ 3 тип, должна быть назначена ферментозаместительная терапия. Доза ЛС должна подбираться индивидуально в соответствии с клиническими и лабораторными показателями;
53.2. критерии оценки эффективности лечения:
- восстановление подвижности, работоспособности;
- устранение болевого синдрома в течение первых 2 лет терапии;
- предотвращение костных кризов (сильные костные боли);
- предотвращение развития остеонекрозов и субхондральных коллапсов;
- увеличение показателей минеральной плотности кости;
- достижение нормальных показателей роста согласно популяционным стандартам в течение 3 лет терапии;
- достижение нормального возраста наступления пубертата;
- нормализация показателей крови в течение 3 лет терапии (стабилизация уровня Hb выше 110 г/л), отсутствие зависимости от гемотрансфузий, поддержание стабильного количества тромбоцитов без риска развития кровотечения;
- уменьшение гепатоспленомегалии;
- улучшение состояния экстраабдоминальных органов (сердце, глаза, легкие);
53.3. обязательные диагностические мероприятия при установлении диагноза:
- блок А, блок Б (БИК: К, Са, Mg, Na, Cl, общий белок, общий билирубин, ЛДГ, ЩФ, АлАТ, АлАТ, амилаза, сывороточное железо, ферритин, трансферрин, процент насыщения трансферрина железом, IgG, IgM, IgA);
- исследование уровня витамина Д, витамина В12, фолиевой кислоты;
- медико-генетическое консультирование в государственном учреждении «Республиканский научно-практический центр «Мать и дитя» Министерства здравоохранения Республики Беларусь: определение активности -глюкозидазы, определение активности хитотриозидазы, молекулярно-генетическое исследование;
- КТ ОГК, КТ или МРТ головного мозга;
- УЗИ ОБП с расчетом объема селезенки (в см3);
- УЗИ периферических ЛУ;
- Эхо-КГ, ЭКГ;
- МРТ ОБП с расчетом объема печени и селезенки (см3);
- рентгенография или МРТ бедренных костей с захватом коленных и тазобедренных суставов, в режиме Т1, Т2; МРТ поясничного отдела позвоночника;
- исследование минеральной плотности костной ткани;
- медицинский осмотр врача-офтальмолога, врача-оториноларинголога, врача-травматолога-ортопеда, врача – детского эндокринолога, врача – детского невролога, для пациентов с БГ 3 тип – врача-психотерапевта;
53.4. дополнительные диагностические мероприятия при установлении диагноза:
ЭЭГ;
цитологическое исследование препарата КМ;
серологическое исследование крови на ЦМВ, герпес-группу, ВЭБ, микоплазму, хламидию;
исследование мутаций в гене гемахроматоза;
ЭГДС – при подозрении на синдром портальной гипертензии;
53.5. обязательные лечебные мероприятия:
ферментозаместительная терапия (каждые 2 недели): имиглюцераза внутривенно капельно в течение 1–2 часов, для лечения пациентов с БГ 1 и 3 тип; велаглюцераза альфа внутривенно капельно в течение 1 часа, для лечения пациентов старше 4 лет с БГ 1 тип;
стартовая терапия ЛС имиглюцераза и велаглюцераза альфа при БГ 1 тип:
50–60 ЕД/кг внутривенно капельно каждые 2 недели (при тяжелом поражении костей скелета, костных кризах, патологических переломах, очагах литической деструкции, асептическом некрозе головок бедренных костей, или тяжелой гепатомегалии и спленомегалии и панцитопении; легочной гипертензии, поражении легких и других тяжелых осложнениях;
30–40 ЕД/кг внутривенно капельно каждые 2 недели (при среднетяжелой гепатоспленомегалии, панцитопении и менее выраженном поражении костной ткани);
20 ЕД/кг каждые 2 недели (при наличии гепатоспленомегалии с проявлениями гиперспленизма, без значительного поражения костей скелета);
стартовая терапия при БГ 3 тип – 60 ЕД/кг внутривенно капельно каждые 2 недели;
коррекция дозы осуществляется по решению республиканского врачебного консилиума на основании критериев оценки эффективности лечения каждые 12–24 месяца на фоне проведения ферментозаместительной терапии.
ПТ: 15–60 ЕД/кг внутривенно капельно каждые 2 недели;
при БГ 2 тип ферментозаместительная терапия неэффективна, так как рекомбинантная глюкоцереброзидаза не проникает через гематоэнцефалический барьер;
53.6. дополнительные лечебные мероприятия:
субстратредуцирующая терапия применяется для лечения пациентов с БГ 1 тип, которые являются медленными, промежуточными, или быстрыми метаболизаторами по изоферменту CYP2D, ЛС элиглустат тартрат*:
84 мг 2 раза в сутки внутрь пожизненно (пациенты, являющиеся быстрыми и промежуточными метаболизаторами по изоферменту CYP2D6);
84 мг 1 раз в сутки внутрь пожизненно (пациенты, являющиеся медленными метаболизаторами по изоферменту CYP2D6);
фармакологическая терапия шаперонами: амброксол в возрастных дозировках применяется внутрь, длительно, по решению врачебного консилиума для лечения пациентов с БГ 3 тип при наличии миоклонической эпилепсии.
______________________________
* ЛС, применяемые off label у детей и (или) незарегистрированные в Республике Беларусь.
** ЛС, включенные в перечень орфанных (редких) заболеваний и ЛС, согласно приказу Министерства здравоохранения Республики Беларусь от 2 сентября 2022 г. № 1153.
*** За счет собственных средств пациента или его законных представителей, средств юридических лиц и иных источников, не запрещенных законодательством.
Медицинская реабилитация
18. Медицинская реабилитация, медицинские показания и противопоказания к применению методов медицинской реабилитации:
всем пациентам с ЗНО на всех этапах терапии заболевания, а также после завершения лечения рекомендуется медицинская реабилитация. При организации и проведении медицинской реабилитации руководствуются утвержденными Министерством здравоохранения клиническими протоколами.
Медицинским показанием для проведения медицинской реабилитации является необходимость проведения комплекса медицинских услуг, направленных на восстановление нормальной жизнедеятельности организма пациента, нарушенной в результате заболевания.
Медицинская реабилитация проводится в стационарных условиях и в отделении дневного пребывания. Этап ранней медицинской реабилитации может проводится в остром периоде и раннем восстановительном периоде заболевания согласно медицинским показаниям, противопоказаниям.
Медицинская реабилитация пациентов носит комплексный характер, охватывая не только медицинские, но и социально-психологические аспекты адаптации пациента к нормальной жизни. Такая реабилитация требует, кроме медицинской помощи, обязательного участия психологов.
Диагностику характера и степени нарушения функций органов и систем организма, приводящих к ограничению его жизнедеятельности, уровень реабилитационного потенциала осуществляет врач-реабилитолог (лечащий врач) перед началом курса медицинской реабилитации.
Программы медицинской реабилитации разрабатываются индивидуально в зависимости от выявленных осложнений лекарственного лечения, сопутствующей патологии, социальных и психологических проблем. При проведении медицинской реабилитации применяются методы лечебной физкультуры, эрготерапии, массажа, физиотерапии, рефлексотерапии, голосо-речевой терапии, диетотерапии, ЛС.
По окончании курса медицинской реабилитации оценивается эффективность проведенной медицинской реабилитации по изменению степени выраженности функциональных нарушений, а также по изменению характера и степени выраженности ограничений жизнедеятельности.
Фармакотерапию назначают в соответствии с настоящим клиническим протоколом, с учетом всех индивидуальных особенностей пациента, тяжести заболевания, наличия сопутствующей патологии клинико-фармакологической характеристики ЛС. При этом необходимо учитывать аллергологический фармакологический анамнез согласно приложению 6.
Профилактика
12. Медицинская профилактика рвоты проводится с применением антагонистов серотониновых 5-НТ3-рецепторов за 30–60 минут до начала химиотерапии и далее – по медицинским показаниям. Критерием эффективности противорвотной терапии является полное отсутствие (полный контроль) тошноты и рвоты в течении острого и отстроченного периода.
Антагонисты серотониновых 5-НТ3-рецепторов:
ондансетрон 0,45 мг/кг в сутки в 3 приема внутривенно струйно или внутрь (таблетки 4 мг, 8 мг – кратность приема 2 раза в сутки);
гранисетрон 0,04 мг/кг в сутки (но не более 3 мг) внутривенно струйно медленно однократно. Применяется у детей старше 2 лет. Детям старше 12 лет 1 мг внутрь (таблетки 1 мг – кратность и длительность приема устанавливается индивидуально). Молодым взрослым внутрь разовая доза – 1 мг (таблетки 1 мг – кратность и длительность приема устанавливается индивидуально), внутривенно капельно разовая доза – 3 мг, внутривенно струйно (медленно, не менее 30 секунд) разовая доза – 1 мг. Максимальная доза 9 мг/сутки;
трописетрон 0,2 мг/кг в сутки (максимальная суточная доза 5 мг) внутривенно струйно или внутрь (капсулы 5 мг – 1 раз в сутки). Применяется у детей старше 2 лет.
Кратность и длительность применения данных ЛС устанавливается индивидуально.
13. Трансфузии крови и ее компонентов проводят: лечащий либо дежурный врач, врач-трансфузиолог, во время операции – врач-анестезиолог-реаниматолог детский или врач-детский хирург, не участвующие в операции или проведении обезболивания. В исключительных случаях во время операции трансфузию крови и ее компонентов может проводить врач-специалист другого профиля, включенный приказом руководителя в список лиц, допущенных к проведению гемотрансфузий в данной организации здравоохранения.
Во всех случаях, исключая пневмонию и дыхательную недостаточность, трансфузию эритроцитов необходимо проводить при содержании гемоглобина ниже 70 г/л и гематокрите менее 0,3 или при наличии клинических симптомов анемического синдрома (сонливость, тахикардия, одышка) из расчета дозы эритроцитов – 10–15 мл/кг. При развитии инфекции трансфузия эритроцитов проводится при снижении уровня гемоглобина ниже 100 г/л. Для новорожденных и детей до 1 года трансфузия эритроцитов проводится в соответствии с возрастными нормами содержания гемоглобина. Доза эритроцитов в этом случае рассчитывается индивидуально и зависит от исходного уровня гемоглобина.
Трансфузия тромбоцитов при отсутствии осложнений программного лечения проводится при снижении уровня тромбоцитов ниже 10–20 х 109/л. Количество переливаемых тромбоцитов составляет 1 доза на 10 кг МТ (4–6 доз на 1,5 м2 площади поверхности тела), при этом в 1 дозе должно содержаться 0,5–0,7 х 1011 тромбоцитов. При необходимости выполнения инвазивных манипуляций трансфузия тромбоцитов проводится в случае, если уровень тромбоцитов менее 50 х 109/л. Используются тромбоциты, полученные от одного донора путем тромбоцитафереза на специальных сепараторах. Использование для пациентов с онкологическими и гематологическими заболеваниями тромбоцитов, полученных от многих доноров, является недопустимым, так риск осложнений резко возрастает.
Трансфузия гранулоцитов показана при соблюдении всех ниже перечисленных условий:
нейтропении менее 0,5 х 109/л у пациентов при ЗНО (шифр по МКБ-10 – С00–С80), в том числе лимфоидной, кроветворной и родственных им тканей (шифр по МКБ-10 – С81–С97), апластических анемиях (шифр по МКБ-10 – D61), после трансплантации гемопоэтических стволовых клеток (далее – ТГСК) (другие пересаженные органы и ткани (КМ, кишечник, поджелудочная железа; шифр по МКБ-10 – Z94.8);
наличии тяжелого инфекционного осложнения невирусной природы с рефрактерностью к антибактериальной и антимикотической терапии в течение не менее 48 часов;
прогнозируемой длительности нейтропении более 5–10 дней;
неэффективной стимуляции гемопоэза гранулоцитарно-колоние стимулирующими факторами.
Гранулоциты перед переливанием необходимо подвергнуть предварительному облучению в дозе 25–30 Гр.
Трансфузия свежезамороженной плазмы проводится при нарушении гемостаза из расчета 10 мл/кг.
Все компоненты крови для потенциальных реципиентов ТГСК, пациентов с апластической анемией, пациентов в посттрансплантационном периоде должны быть патогенредуцированны, лейкодеплецированы и облучены в дозе 25 Гр.
Трансфузия альбумина производится при гипоальбуминемии ниже 30 г/л. Доза рассчитывается индивидуально, с учетом концентрации используемого раствора. В педиатрической практике альбумин 10 % назначается в дозе 3 мл/кг МТ. У детей дозу ЛС устанавливают индивидуально, с учетом медицинского показания, клинического состояния и МТ пациента. Для коррекции тяжелой гипоальбуминемии (сепсис, глубокие нарушения белковосинтетической функции печени) доза альбумина рассчитывается по формуле
альбумин 10 %, мл = (40 – Х) х МТ/2;
альбумин 20 %, мл = (40 – Х) х МТ/4,
где Х – содержание альбумина в крови г/л, МТ – масса тела, кг. ЛС можно применять у пациентов, находящихся на гемодиализе.
Медицинскими показаниями для эмпирической терапии эхинокандинами являются: низкий КЭК;
экстракорпоральная детоксикация; признаки КАИК;
полное парентеральное питание;
колонизация желудочно-кишечного тракта (далее – ЖКТ) дрожжевыми грибами; мукозит III–IV степени;
наличие признаков гепатолиенального кандидоза;
очаговые изменения в легких, по данным визуализирующих методов исследования при негативном результате определения галактоманнана (антигена грибов) в крови и (или) в бронхо-альвеолярном лаваже (учитывая возможность определения галактоманнана в организации здравоохранения).
Альтернативным средством для эмпирической терапии является амфотерицин В (липидная форма).
При наличии очаговых изменений в легких, по данным визуализирующих методов исследования, рекомендовано рассмотреть целесообразность определения галактоманнана (антигена грибов) в крови и (или) в бронхо-альвеолярном лаваже.
При позитивном результате определения галактоманнана проводится упреждающая терапия вориконазолом.
Дозы противогрибковых ЛС для терапии грибковых инфекций у иммунокомпрометированных пациентов приведены в приложении 3.
При эффективности эмпирическая противогрибковая терапия продолжается до нормализации состояния пациента. При неэффективности – должна быть отменена через 5–7 дней. В обоих случаях диагностический поиск необходимо продолжить для установления причины лихорадки или подтверждения диагноза.
Упреждающая терапия направлена на лечение вероятной грибковой инфекции. Подразумевает назначение ЛС, обладающего чувствительностью потенциального возбудителя заболевания.
Выбор ЛС для терапии в зависимости от этиологии заболевания указан согласно приложению 4.
ЛС выбора для терапии инвазивного аспергиллеза являются: вориконазол и изавуконазол* у детей (в форме лиофилизата для приготовления раствора для инфузий 200 мг. Нагрузочная доза составляет 200 мг 3 раза в день в течение 2 дней, затем 200 мг один раз в день внутривенно). При лечении грибковой инфекции азолами рекомендовано проведение терапевтического лекарственного мониторинга (далее – ТЛМ), если это возможно в конкретной организации здравоохранения (применение изавуконазола* не требует ТЛМ). Альтернативными ЛС для терапии инвазивного аспергиллеза являются: посаконазол, амфотерицин В (липидная форма), изавуконазол*.
ЛС выбора для терапии мукормикоза является амфотерицин В (липидная форма). Альтернативными ЛС являются: посаконазол, изавуконазол*. При терапии мукормикоза приоритетом является хирургическая санация пораженных тканей.
ЛС выбора для терапии инвазивного кандидоза и кандидемии являются эхинокандины. Альтернативные ЛС – флуконазол, амфотерицин В (липидная форма). При фунгемии, вызванной дрожжевыми грибами, необходимо удаление и (или) замена всех искусственных устройств (сосудистых катетеров, зондов, дренажей и т.д.). При инвазивном кандидозе или кандидемии приемлемо назначение эхинокандинов на 10 дней с последующим переходом на терапию флуконазолом в лечебной дозе в случае клинически стабильного состояния пациента.
ЛС выбора для терапии фузариоза являются: посаконазол, амфотерицин В (липидная форма). Альтернативными ЛС являются: вориконазол, изавуконазол*.
При эффективности упреждающая противогрибковая терапия продолжается до исчезновения очагов и (или) признаков инфекции. Далее на период нейтропении проводится вторичная медицинская профилактика. При неэффективности (ухудшение по данным визуализирующих методов исследования, клинически) – должна быть отменена не позже, чем через 14 дней. Диагностический поиск необходимо продолжить для установления диагноза и этиологического фактора.
Целенаправленная противогрибковая терапия назначается при доказанной грибковой инфекции. Учитывается вид выделенных возбудителей, определяется чувствительность к противогрибковым ЛС. Терапия проводится ЛС, к которому чувствителен in vitro выделенный гриб, в лечебной дозе.
Комбинированная противогрибковая терапия рекомендована в случаях доказанной аспергиллезной инфекции, вызванной штаммами, резистентными к одной или нескольким группам противогрибковых ЛС, а также в случаях инфекции, вызванной грибами рода Fusarium.
Целенаправленная терапия продолжается до исчезновения патологических очагов грибковой инфекции;
15.5. контроль противогрибковой терапии: ежедневный контроль общего состояния пациента;
контроль лабораторных показателей – общий анализ крови (далее – ОАК) не менее 1 раза в неделю, БИК (калий, магний, общий белок, мочевина, креатинин, аланинаминотрансфераза (далее – АлАТ), аспартатаминотрансфераза (далее – АсАТ), общий билирубин, С-реактивный белок (далее – СРБ) не менее 2 раз в неделю;
при терапии амфотерицином В (рекомендовано назначение липидных форм из-за меньшей нефротоксичности) производится контроль скорости клубочковой фильтрации (далее – СКФ) почек или КЭК не менее 2 раз в неделю. Если клиренс креатинина прогрессивно снижается на фоне терапии амфотерицином В, рекомендовано рассмотреть вопрос о смене группы противогрибкового ЛС;
контроль динамики изменений уровня сывороточного галактоманана (при наличие возможности в организации здравоохранения) при условии его позитивности в начале заболевания (до назначения противогрибковой терапии) с целью оценки ответа на проводимое лечение;
контроль КТ пораженного органа проводится при стабилизации или улучшении клинического состояния по необходимости (не ранее, чем через 7 дней от предыдущего исследования). Для мониторинга ответа на терапию рекомендовано выполнение КТ пораженного органа не чаще 1 раза в 1–2 недели. Увеличение очага в объеме на фоне выхода из нейтропении (АЧН >500/мкл) не свидетельствует об отрицательной динамике грибковой инфекции. В данном случае необходим контроль КТ еще через 7 дней. При прогрессивном ухудшении клинического состояния пациента контроль КТ может быть выполнен в любые сроки.
Плановый контроль КТ (после исчезновения патологических очагов грибковой инфекции) не проводится.
В оценке динамики грибкового патологического процесса данные визуализирующих методов исследования (КТ, МРТ,УЗИ) имеют приоритет над серологическими методами.
нейтропении менее 0,5 х 109/л у пациентов при ЗНО (шифр по МКБ-10 – С00–С80), в том числе лимфоидной, кроветворной и родственных им тканей (шифр по МКБ-10 – С81–С97), апластических анемиях (шифр по МКБ-10 – D61), после трансплантации гемопоэтических стволовых клеток (далее – ТГСК) (другие пересаженные органы и ткани (КМ, кишечник, поджелудочная железа; шифр по МКБ-10 – Z94.8);
наличии тяжелого инфекционного осложнения невирусной природы с рефрактерностью к антибактериальной и антимикотической терапии в течение не менее 48 часов;
прогнозируемой длительности нейтропении более 5–10 дней;
неэффективной стимуляции гемопоэза гранулоцитарно-колоние стимулирующими факторами.
Гранулоциты перед переливанием необходимо подвергнуть предварительному облучению в дозе 25–30 Гр.
Трансфузия свежезамороженной плазмы проводится при нарушении гемостаза из расчета 10 мл/кг.
Все компоненты крови для потенциальных реципиентов ТГСК, пациентов с апластической анемией, пациентов в посттрансплантационном периоде должны быть патогенредуцированны, лейкодеплецированы и облучены в дозе 25 Гр.
Трансфузия альбумина производится при гипоальбуминемии ниже 30 г/л. Доза рассчитывается индивидуально, с учетом концентрации используемого раствора. В педиатрической практике альбумин 10 % назначается в дозе 3 мл/кг МТ. У детей дозу ЛС устанавливают индивидуально, с учетом медицинского показания, клинического состояния и МТ пациента. Для коррекции тяжелой гипоальбуминемии (сепсис, глубокие нарушения белковосинтетической функции печени) доза альбумина рассчитывается по формуле
альбумин 10 %, мл = (40 – Х) х МТ/2;
альбумин 20 %, мл = (40 – Х) х МТ/4,
где Х – содержание альбумина в крови г/л, МТ – масса тела, кг. ЛС можно применять у пациентов, находящихся на гемодиализе.
15. Медицинская профилактика и терапия инвазивных грибковых инфекций (далее – ИГИ):
15.1. международные критерии доказанности ИГИ у иммунокомпрометированных пациентов включают в себя возможные, вероятные и доказанные ИГИ:
возможная ИГИ – пациент относится к группе риска, имеет факторы риска и клинические признаки инфекции, но все микробиологически исследования отрицательные или не проводились;
вероятная ИГИ – пациент относится к группе риска и имеет факторы риска (АЧН <500/мкл более 10 дней, терапия глюкокортикостероидами (далее – ГКС), Т-клеточными иммуносупрессантами, антибактериальными ЛС широкого спектра действия), а также у пациента есть клинические признаки инфекции и присутствие грибковых элементов при микроскопии и (или) высев культуры из потенциально стерильного локуса или позитивные серологические исследования (например, положительный галактоманнановый тест на аспергиллез);
доказанная ИГИ – пациент имеет клинические признаки ИГИ, а также микроскопически выявлены грибковые структуры и (или) получен рост культуры грибов из стерильного локуса.
Проведение первичной лекарственной противогрибковой медицинской профилактики рекомендовано только у пациентов групп риска развития ИГИ:
HRG(>10 %) включает пациентов с ОМЛ, рецидивами острых лейкозов и реципиентов аллогенной ТГСК (далее – аллоТГСК);
группа низкого риска (<5 %) включает пациентов с ОЛЛ, НХЛ и реципиентов аутологичной ТГСК (далее – аутоТГСК);
группа спорадически возникающих ИГИ включает пациентов детского возраста с солидными опухолями (в том числе опухолями мозга) и лимфомами Ходжкина.
Вторичная медицинская профилактика ИГИ проводится после перенесенной вероятной или доказанной грибковой инфекции и направлена на предотвращение рецидива инфекционного заболевания. Проводится вторичная медицинская профилактика ЛС, действующим на гриб, вызвавший заболевание первично. ЛС назначается в профилактической дозе на период нейтропении АЧН <500/мкл или иммуносупрессивной терапии (далее – ИСТ).
15.1. международные критерии доказанности ИГИ у иммунокомпрометированных пациентов включают в себя возможные, вероятные и доказанные ИГИ:
возможная ИГИ – пациент относится к группе риска, имеет факторы риска и клинические признаки инфекции, но все микробиологически исследования отрицательные или не проводились;
вероятная ИГИ – пациент относится к группе риска и имеет факторы риска (АЧН <500/мкл более 10 дней, терапия глюкокортикостероидами (далее – ГКС), Т-клеточными иммуносупрессантами, антибактериальными ЛС широкого спектра действия), а также у пациента есть клинические признаки инфекции и присутствие грибковых элементов при микроскопии и (или) высев культуры из потенциально стерильного локуса или позитивные серологические исследования (например, положительный галактоманнановый тест на аспергиллез);
доказанная ИГИ – пациент имеет клинические признаки ИГИ, а также микроскопически выявлены грибковые структуры и (или) получен рост культуры грибов из стерильного локуса.
Проведение первичной лекарственной противогрибковой медицинской профилактики рекомендовано только у пациентов групп риска развития ИГИ:
HRG(>10 %) включает пациентов с ОМЛ, рецидивами острых лейкозов и реципиентов аллогенной ТГСК (далее – аллоТГСК);
группа низкого риска (<5 %) включает пациентов с ОЛЛ, НХЛ и реципиентов аутологичной ТГСК (далее – аутоТГСК);
группа спорадически возникающих ИГИ включает пациентов детского возраста с солидными опухолями (в том числе опухолями мозга) и лимфомами Ходжкина.
Вторичная медицинская профилактика ИГИ проводится после перенесенной вероятной или доказанной грибковой инфекции и направлена на предотвращение рецидива инфекционного заболевания. Проводится вторичная медицинская профилактика ЛС, действующим на гриб, вызвавший заболевание первично. ЛС назначается в профилактической дозе на период нейтропении АЧН <500/мкл или иммуносупрессивной терапии (далее – ИСТ).
Противогрибковые стратегии включают в себя медицинскую профилактику, эмпирическую, упреждающую противогрибковую терапию и этиотропное лечение установленной ИГИ;
15.2. первичная лекарственная медицинская профилактика инфекций, вызываемых дрожжевыми грибами, проводится согласно определенным Министерством здравоохранения медицинским показаниям;
15.3. первичная лекарственная медицинская профилактика инфекций, вызываемых плесневыми грибами:
первичная медицинская профилактика инфекций, вызываемых плесневыми грибами, проводится у следующих пациентов:
реципиентов аллоТГСК;
с ОМЛ и проходящих терапию согласно протоколам лечения ОМЛ (кроме острых промиелоцитарных лейкозов (далее – ОПЛ);
с рецидивами острых лейкозов, нейробластомы; с резистентными лейкозами;
с хронической гранулематозной болезнью.
Рекомендации по первичной лекарственной медицинской профилактике инфекций, вызываемых плесневыми грибами приведены в приложении 2.
При развитии у реципиентов ТГСК реакции трансплантат против хозяина (далее – РТПХ) >2 степени – флуконазол отменяется, а инициируется медицинская профилактика инфекций, вызываемых плесневыми грибами.
При наличии аллергических реакций или индивидуальной лекарственной непереносимости противогрибковых ЛС, медицинская профилактика проводится ЛС, не имеющим перекрестной реактивности, с учетом возрастных ограничений.
При появлении признаков ИГИ (вероятная, возможная, доказанная) противогрибковая медицинская профилактика отменяется и назначается лечение;
15.4. противогрибковая терапия:
если лихорадка возникла и сохраняется более 4 суток на фоне антибактериальной терапии рекомендовано:
ежедневный тщательный медицинский осмотр пациента;
забор крови на бактериологическое исследование для верификации фунгемии; бактериологические посевы из всех предполагаемых локусов инфекции.
Проведение обследования (в том числе визуализирующие методы исследования – компьютерная томография (далее – КТ), магнитно-резонансная томография (далее – МРТ), ультразвуковое исследование (далее – УЗИ) на предмет новых очагов инфекции или прогрессирования инфекции в уже установленных; посевы и (или) биопсия и (или) дренирование прогрессирующих очагов инфекции, бактериологическое и вирусологическое исследование крови; пересмотр антибактериальной терапии на предмет адекватности спектра и режима дозирования; рассмотрение необходимости эмпирической противогрибковой терапии.
Эмпирическая противогрибковая терапия рекомендована при возможной грибковой инфекции. Если пациент относится к HRG и получает медицинскую профилактику грибковых инфекций – рекомендуется менять способ введения противогрибкового ЛС приема внутрь на внутривенный, по возможности измерять остаточную сывороточную концентрацию (при медицинской профилактике азолами) и, только убедившись в ее неэффективности, менять группу противогрибковых ЛС с назначением в лечебной дозе. В случае подозрения на инвазивную дрожжевую инфекцию рекомендовано с эмпирической целью назначать эхинокандины (микафингин, анидулафунгин, каспофунгин). В остальных случаях – амфотерицин В (предпочтительна липидная форма из-за меньшей нефротоксичности).
15.2. первичная лекарственная медицинская профилактика инфекций, вызываемых дрожжевыми грибами, проводится согласно определенным Министерством здравоохранения медицинским показаниям;
15.3. первичная лекарственная медицинская профилактика инфекций, вызываемых плесневыми грибами:
первичная медицинская профилактика инфекций, вызываемых плесневыми грибами, проводится у следующих пациентов:
реципиентов аллоТГСК;
с ОМЛ и проходящих терапию согласно протоколам лечения ОМЛ (кроме острых промиелоцитарных лейкозов (далее – ОПЛ);
с рецидивами острых лейкозов, нейробластомы; с резистентными лейкозами;
с хронической гранулематозной болезнью.
Рекомендации по первичной лекарственной медицинской профилактике инфекций, вызываемых плесневыми грибами приведены в приложении 2.
При развитии у реципиентов ТГСК реакции трансплантат против хозяина (далее – РТПХ) >2 степени – флуконазол отменяется, а инициируется медицинская профилактика инфекций, вызываемых плесневыми грибами.
При наличии аллергических реакций или индивидуальной лекарственной непереносимости противогрибковых ЛС, медицинская профилактика проводится ЛС, не имеющим перекрестной реактивности, с учетом возрастных ограничений.
При появлении признаков ИГИ (вероятная, возможная, доказанная) противогрибковая медицинская профилактика отменяется и назначается лечение;
15.4. противогрибковая терапия:
если лихорадка возникла и сохраняется более 4 суток на фоне антибактериальной терапии рекомендовано:
ежедневный тщательный медицинский осмотр пациента;
забор крови на бактериологическое исследование для верификации фунгемии; бактериологические посевы из всех предполагаемых локусов инфекции.
Проведение обследования (в том числе визуализирующие методы исследования – компьютерная томография (далее – КТ), магнитно-резонансная томография (далее – МРТ), ультразвуковое исследование (далее – УЗИ) на предмет новых очагов инфекции или прогрессирования инфекции в уже установленных; посевы и (или) биопсия и (или) дренирование прогрессирующих очагов инфекции, бактериологическое и вирусологическое исследование крови; пересмотр антибактериальной терапии на предмет адекватности спектра и режима дозирования; рассмотрение необходимости эмпирической противогрибковой терапии.
Эмпирическая противогрибковая терапия рекомендована при возможной грибковой инфекции. Если пациент относится к HRG и получает медицинскую профилактику грибковых инфекций – рекомендуется менять способ введения противогрибкового ЛС приема внутрь на внутривенный, по возможности измерять остаточную сывороточную концентрацию (при медицинской профилактике азолами) и, только убедившись в ее неэффективности, менять группу противогрибковых ЛС с назначением в лечебной дозе. В случае подозрения на инвазивную дрожжевую инфекцию рекомендовано с эмпирической целью назначать эхинокандины (микафингин, анидулафунгин, каспофунгин). В остальных случаях – амфотерицин В (предпочтительна липидная форма из-за меньшей нефротоксичности).
Медицинскими показаниями для эмпирической терапии эхинокандинами являются: низкий КЭК;
экстракорпоральная детоксикация; признаки КАИК;
полное парентеральное питание;
колонизация желудочно-кишечного тракта (далее – ЖКТ) дрожжевыми грибами; мукозит III–IV степени;
наличие признаков гепатолиенального кандидоза;
очаговые изменения в легких, по данным визуализирующих методов исследования при негативном результате определения галактоманнана (антигена грибов) в крови и (или) в бронхо-альвеолярном лаваже (учитывая возможность определения галактоманнана в организации здравоохранения).
Альтернативным средством для эмпирической терапии является амфотерицин В (липидная форма).
При наличии очаговых изменений в легких, по данным визуализирующих методов исследования, рекомендовано рассмотреть целесообразность определения галактоманнана (антигена грибов) в крови и (или) в бронхо-альвеолярном лаваже.
При позитивном результате определения галактоманнана проводится упреждающая терапия вориконазолом.
Дозы противогрибковых ЛС для терапии грибковых инфекций у иммунокомпрометированных пациентов приведены в приложении 3.
При эффективности эмпирическая противогрибковая терапия продолжается до нормализации состояния пациента. При неэффективности – должна быть отменена через 5–7 дней. В обоих случаях диагностический поиск необходимо продолжить для установления причины лихорадки или подтверждения диагноза.
Упреждающая терапия направлена на лечение вероятной грибковой инфекции. Подразумевает назначение ЛС, обладающего чувствительностью потенциального возбудителя заболевания.
Выбор ЛС для терапии в зависимости от этиологии заболевания указан согласно приложению 4.
ЛС выбора для терапии инвазивного аспергиллеза являются: вориконазол и изавуконазол* у детей (в форме лиофилизата для приготовления раствора для инфузий 200 мг. Нагрузочная доза составляет 200 мг 3 раза в день в течение 2 дней, затем 200 мг один раз в день внутривенно). При лечении грибковой инфекции азолами рекомендовано проведение терапевтического лекарственного мониторинга (далее – ТЛМ), если это возможно в конкретной организации здравоохранения (применение изавуконазола* не требует ТЛМ). Альтернативными ЛС для терапии инвазивного аспергиллеза являются: посаконазол, амфотерицин В (липидная форма), изавуконазол*.
ЛС выбора для терапии мукормикоза является амфотерицин В (липидная форма). Альтернативными ЛС являются: посаконазол, изавуконазол*. При терапии мукормикоза приоритетом является хирургическая санация пораженных тканей.
ЛС выбора для терапии инвазивного кандидоза и кандидемии являются эхинокандины. Альтернативные ЛС – флуконазол, амфотерицин В (липидная форма). При фунгемии, вызванной дрожжевыми грибами, необходимо удаление и (или) замена всех искусственных устройств (сосудистых катетеров, зондов, дренажей и т.д.). При инвазивном кандидозе или кандидемии приемлемо назначение эхинокандинов на 10 дней с последующим переходом на терапию флуконазолом в лечебной дозе в случае клинически стабильного состояния пациента.
ЛС выбора для терапии фузариоза являются: посаконазол, амфотерицин В (липидная форма). Альтернативными ЛС являются: вориконазол, изавуконазол*.
При эффективности упреждающая противогрибковая терапия продолжается до исчезновения очагов и (или) признаков инфекции. Далее на период нейтропении проводится вторичная медицинская профилактика. При неэффективности (ухудшение по данным визуализирующих методов исследования, клинически) – должна быть отменена не позже, чем через 14 дней. Диагностический поиск необходимо продолжить для установления диагноза и этиологического фактора.
Целенаправленная противогрибковая терапия назначается при доказанной грибковой инфекции. Учитывается вид выделенных возбудителей, определяется чувствительность к противогрибковым ЛС. Терапия проводится ЛС, к которому чувствителен in vitro выделенный гриб, в лечебной дозе.
Комбинированная противогрибковая терапия рекомендована в случаях доказанной аспергиллезной инфекции, вызванной штаммами, резистентными к одной или нескольким группам противогрибковых ЛС, а также в случаях инфекции, вызванной грибами рода Fusarium.
Целенаправленная терапия продолжается до исчезновения патологических очагов грибковой инфекции;
15.5. контроль противогрибковой терапии: ежедневный контроль общего состояния пациента;
контроль лабораторных показателей – общий анализ крови (далее – ОАК) не менее 1 раза в неделю, БИК (калий, магний, общий белок, мочевина, креатинин, аланинаминотрансфераза (далее – АлАТ), аспартатаминотрансфераза (далее – АсАТ), общий билирубин, С-реактивный белок (далее – СРБ) не менее 2 раз в неделю;
при терапии амфотерицином В (рекомендовано назначение липидных форм из-за меньшей нефротоксичности) производится контроль скорости клубочковой фильтрации (далее – СКФ) почек или КЭК не менее 2 раз в неделю. Если клиренс креатинина прогрессивно снижается на фоне терапии амфотерицином В, рекомендовано рассмотреть вопрос о смене группы противогрибкового ЛС;
контроль динамики изменений уровня сывороточного галактоманана (при наличие возможности в организации здравоохранения) при условии его позитивности в начале заболевания (до назначения противогрибковой терапии) с целью оценки ответа на проводимое лечение;
контроль КТ пораженного органа проводится при стабилизации или улучшении клинического состояния по необходимости (не ранее, чем через 7 дней от предыдущего исследования). Для мониторинга ответа на терапию рекомендовано выполнение КТ пораженного органа не чаще 1 раза в 1–2 недели. Увеличение очага в объеме на фоне выхода из нейтропении (АЧН >500/мкл) не свидетельствует об отрицательной динамике грибковой инфекции. В данном случае необходим контроль КТ еще через 7 дней. При прогрессивном ухудшении клинического состояния пациента контроль КТ может быть выполнен в любые сроки.
Плановый контроль КТ (после исчезновения патологических очагов грибковой инфекции) не проводится.
В оценке динамики грибкового патологического процесса данные визуализирующих методов исследования (КТ, МРТ,УЗИ) имеют приоритет над серологическими методами.
17. Медицинские профилактические мероприятия:
всем пациентам с установленным диагнозом ЗНО на фоне проведения полихимиотерапии (далее – ПХТ) рекомендовно проведение профилактических мероприятий:
медицинская профилактика инфекции Pneumocystis carinii – ко-тримоксазол (сульфаметоксазол + триметоприм) (таблетки 400 мг + 80 мг) внутрь 5 мг/кг в расчете на триметоприм 2 раза в день через каждые 12 часов 2–3 дня в неделю;
дезинфекция кожи – ежедневное мытье под душем или обтирание водным раствором хлоргексидина, обработка мацераций и повреждений раствором бриллиантовой зелени;
ежедневная дезинфекция места пребывания пациента с помощью дезрастворов, бактерицидных ламп, при наличии агранулоцитоза – ежедневная смена постельного и нательного белья;
всем пациентам с установленным диагнозом ЗНО на фоне проведения полихимиотерапии (далее – ПХТ) рекомендовно проведение профилактических мероприятий:
медицинская профилактика инфекции Pneumocystis carinii – ко-тримоксазол (сульфаметоксазол + триметоприм) (таблетки 400 мг + 80 мг) внутрь 5 мг/кг в расчете на триметоприм 2 раза в день через каждые 12 часов 2–3 дня в неделю;
дезинфекция кожи – ежедневное мытье под душем или обтирание водным раствором хлоргексидина, обработка мацераций и повреждений раствором бриллиантовой зелени;
ежедневная дезинфекция места пребывания пациента с помощью дезрастворов, бактерицидных ламп, при наличии агранулоцитоза – ежедневная смена постельного и нательного белья;
личная гигиена родителей и посетителей, мытье рук персонала при входе в палату к пациенту;
Информация
Источники и литература
-
Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2022
- Постановления и приказы Министерства здравоохранения Республики Беларусь об утверждении клинических протоколов 2022 -
-
www.minzdrav.gov.by
- www.minzdrav.gov.by -
Информация
Приложение 1
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Антибактериальные ЛС
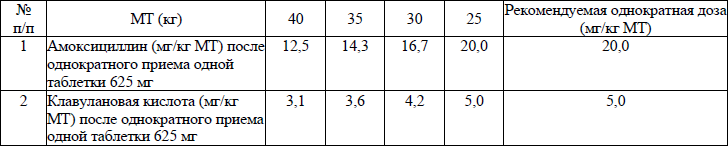
Антибактериальные ЛС

Приложение 2
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Рекомендации по первичной лекарственной медицинской профилактике инфекций, вызываемых плесневыми грибами
Приложение 3
Дозы противогрибковых ЛС для терапии грибковых инфекций у иммунокомпрометированных пациентов
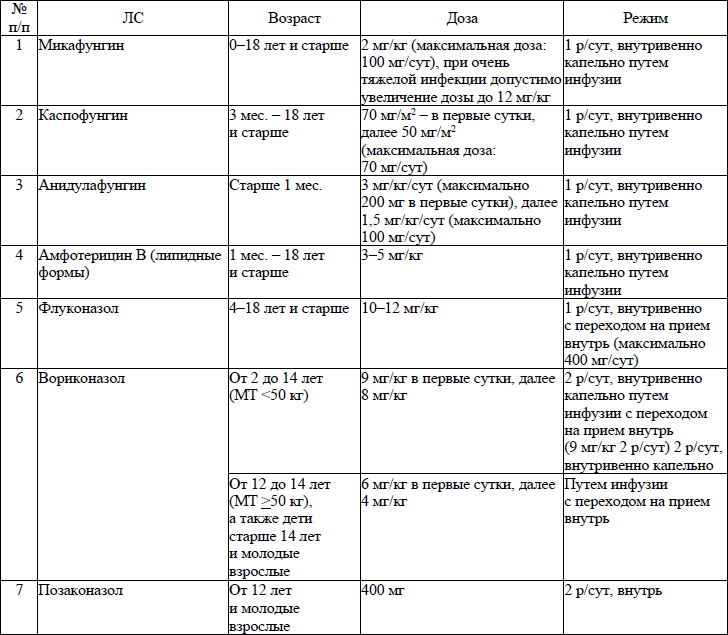
Выбор ЛС для терапии в зависимости от этиологии заболевания
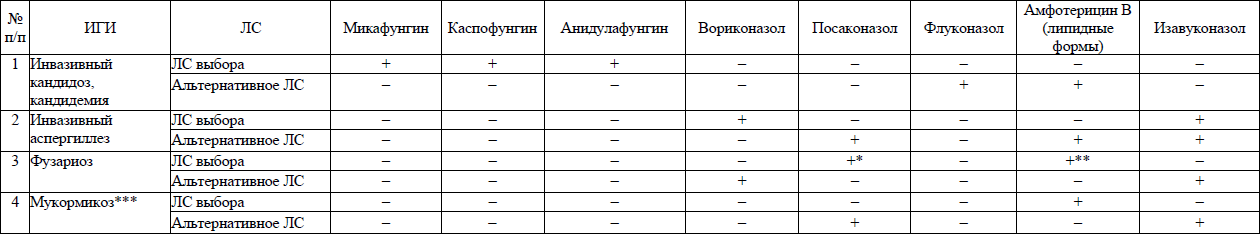
* Инициальная терапия только парентеральной формой, допустим переход на прием внутрь в качестве ступенчатой терапии.
** В терапии первой линии возможно применение комбинации вориконазола с амфотерицинов В (липидные формы).
*** При терапии мукормикоза необходимо рассмотреть возможность хирургической санации пораженных тканей.
Классификация БЭН с учетом данных антропометрии
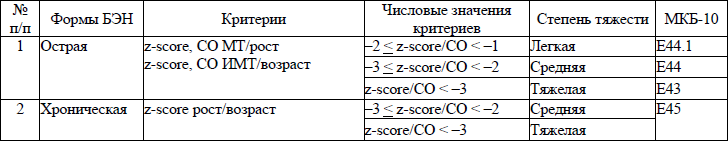
Противоопухолевые ЛС
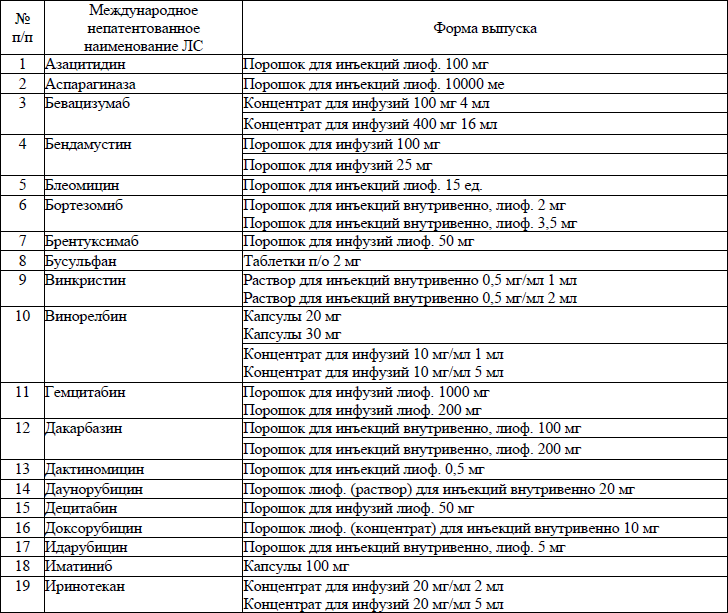

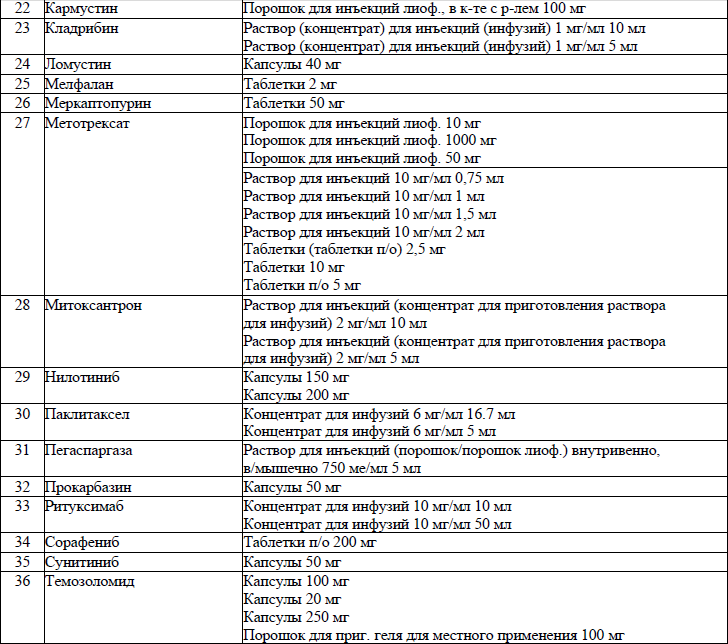
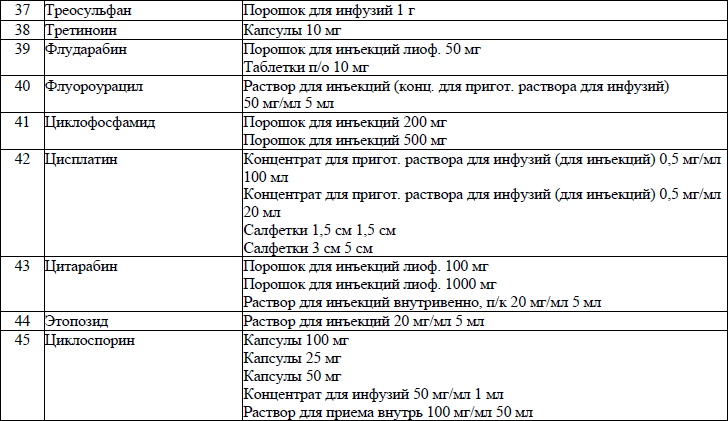
Приложение 7
ЛС, назначаемые off label и орфанные ЛС, назначаемые для лечения детей с онкологическими и гематологичекими заболеваниями
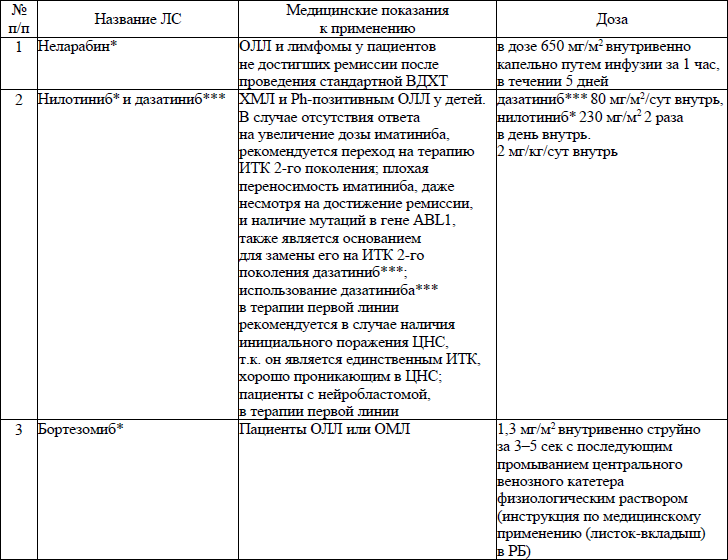
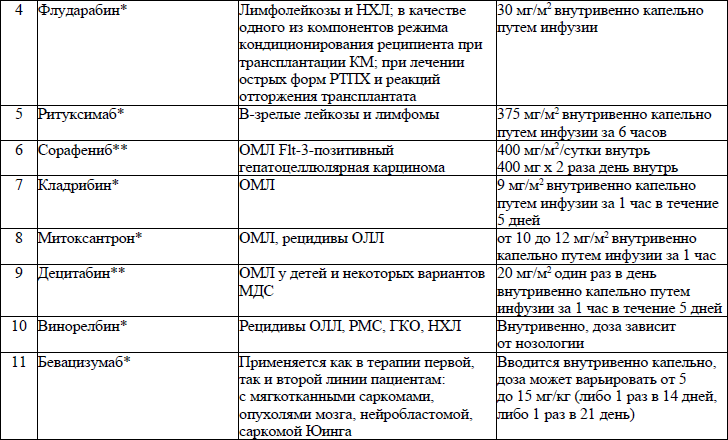
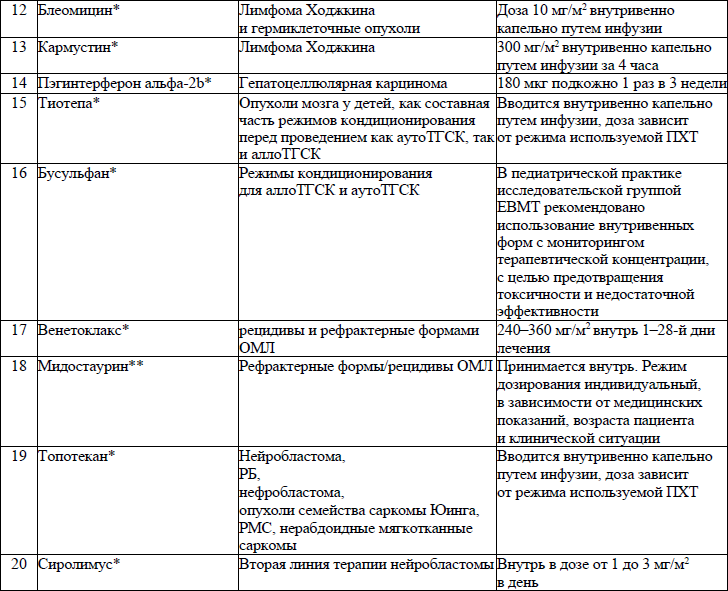

* ЛС, применяемые off label у детей и (или) незарегистрированные в Республике Беларусь.
** ЛС, включенные в перечень орфанных (редких) заболеваний и ЛС, согласно приказа Министерства здравоохранения Республики Беларусь от 2 сентября 2022 г. № 1153.
*** За счет собственных средств пациента или его законных представителей, средств юридических лиц и иных источников, не запрещенных законодательством.
Приложение 8



Приложение 3
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Дозы противогрибковых ЛС для терапии грибковых инфекций у иммунокомпрометированных пациентов

Приложение 4
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Выбор ЛС для терапии в зависимости от этиологии заболевания

______________________________
* Инициальная терапия только парентеральной формой, допустим переход на прием внутрь в качестве ступенчатой терапии.
** В терапии первой линии возможно применение комбинации вориконазола с амфотерицинов В (липидные формы).
*** При терапии мукормикоза необходимо рассмотреть возможность хирургической санации пораженных тканей.
Приложение 5
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Классификация БЭН с учетом данных антропометрии

Приложение 6
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Противоопухолевые ЛС




Приложение 7
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
ЛС, назначаемые off label и орфанные ЛС, назначаемые для лечения детей с онкологическими и гематологичекими заболеваниями




______________________________
* ЛС, применяемые off label у детей и (или) незарегистрированные в Республике Беларусь.
** ЛС, включенные в перечень орфанных (редких) заболеваний и ЛС, согласно приказа Министерства здравоохранения Республики Беларусь от 2 сентября 2022 г. № 1153.
*** За счет собственных средств пациента или его законных представителей, средств юридических лиц и иных источников, не запрещенных законодательством.
Приложение 8
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Морфологическая классификация ОЛЛ
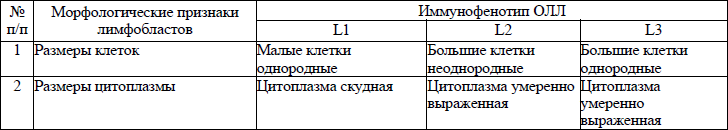
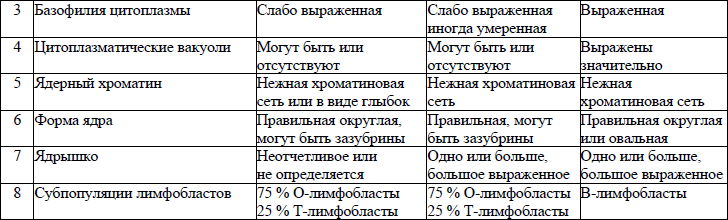
Приложение 9
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Классификация ОЛЛ
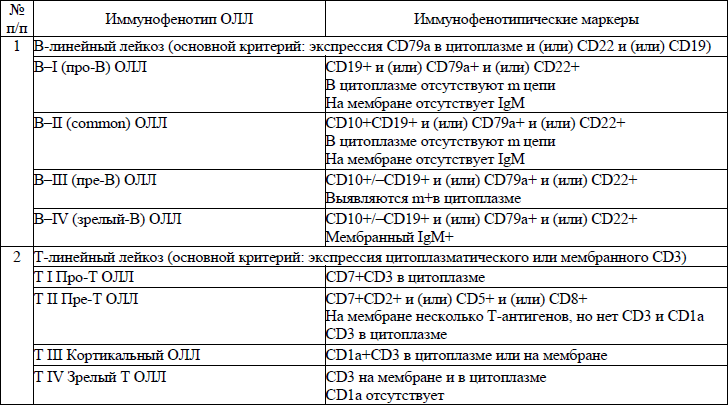
Приложение 10
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
ФАБ классификация ОМЛ

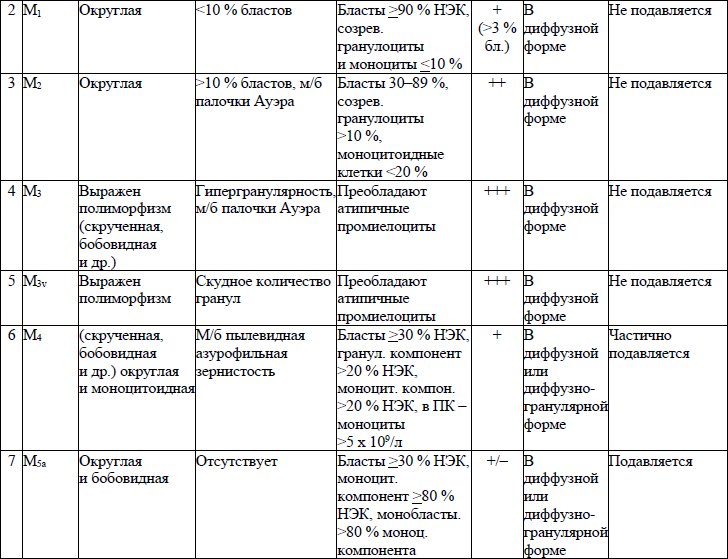
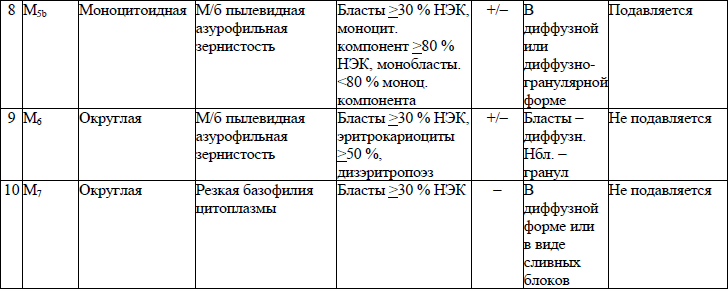
Приложение 11
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Иммунологические маркеры, характерные для разных морфоцитохимических вариантов ОМЛ
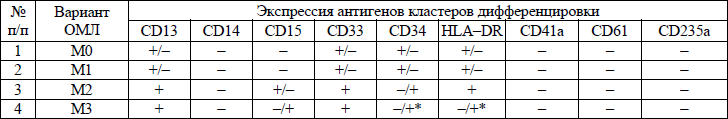
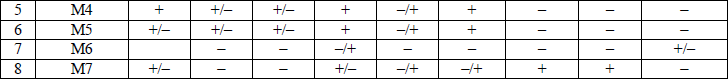
Приложение 12
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Классификация ОПЛ
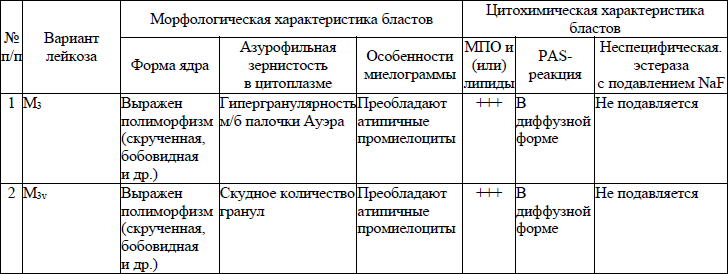
Приложение 13
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Варианты ответа на лечение иматинибом
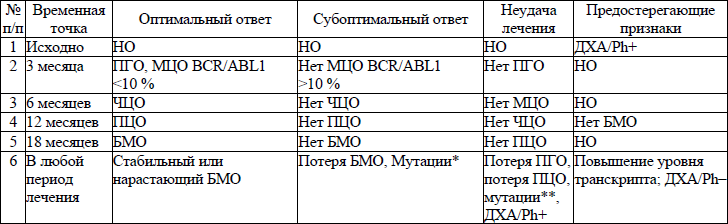
______________________________
* Мутации киназного домена BCR/ABL1 с сохранением чувствительности к иматинибу.
** Мутации киназного домена BCR/ABL1, придающие низкую чувствительность к иматинибу.
Примечание. НО – не определяется.
Приложение 14
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Сравнительная характеристика МДС у молодых взрослых и детей
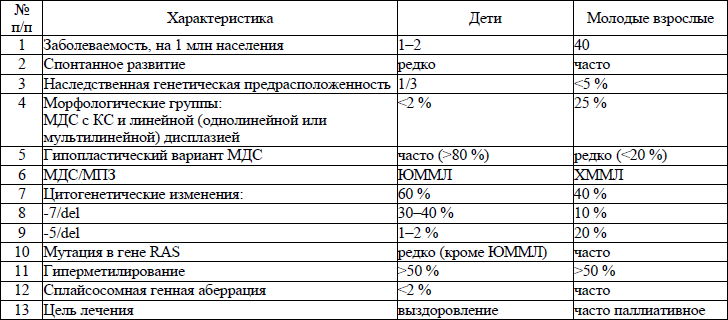

Приложение 15
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Критерии оценки ответа на терапию у пациентов с нейробластомой
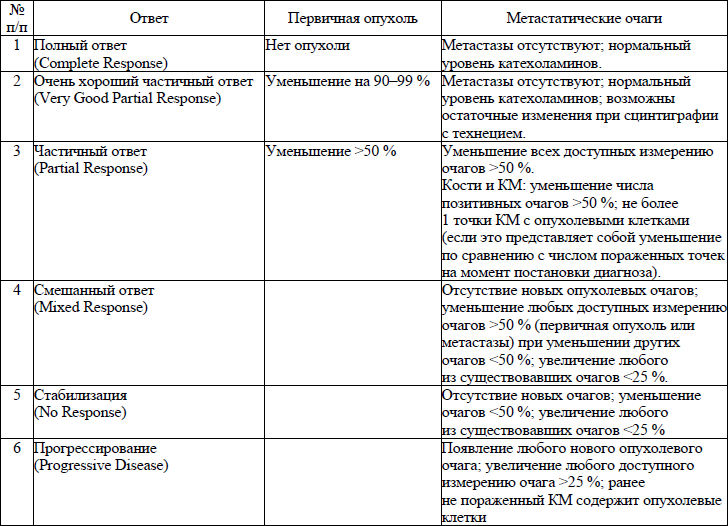
Критерии проведения локальной терапии интраокулярной РБ
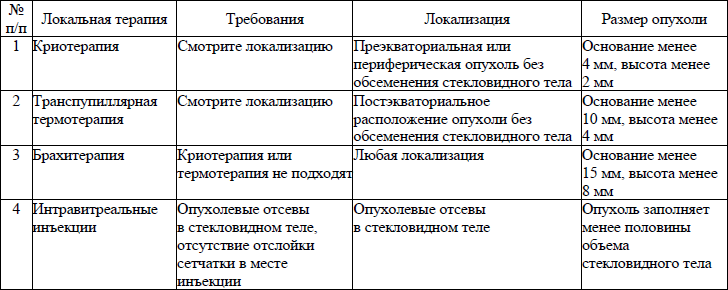

Приложение 16
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Критерии проведения локальной терапии интраокулярной РБ

Приложение 17
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Степени злокачественности остеосаркомы
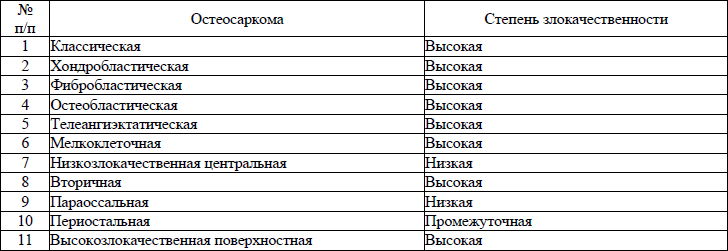
Группировка по стадиям опухолей семейства саркомы Юинга костной ткани
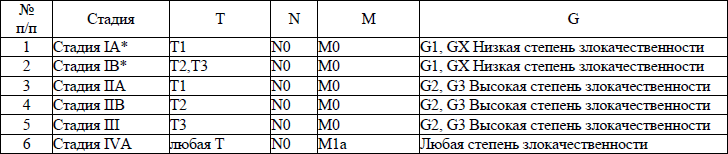
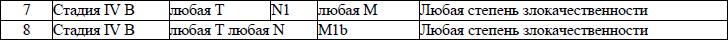
* Первая стадия (IA и IB) не применима для опухолей семейства саркомы Юинга, вследствие того, что опухоли семейства саркомы Юинга всегда классифицируются как новообразования высокой степени злокачественности (G3).

Приложение 18
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Группировка по стадиям опухолей семейства саркомы Юинга костной ткани

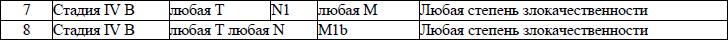
______________________________
* Первая стадия (IA и IB) не применима для опухолей семейства саркомы Юинга, вследствие того, что опухоли семейства саркомы Юинга всегда классифицируются как новообразования высокой степени злокачественности (G3).
Приложение 19
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Группировка по стадиям экстраоссальных опухолей семейства саркомы Юинга
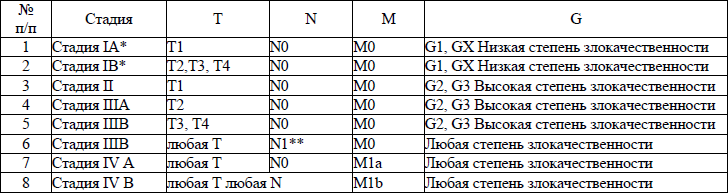
* Первая стадия (IA и IB) не применима для опухолей семейства саркомы Юинга, вследствие того, что опухоли семейства саркомы Юинга всегда классифицируются как новообразования высокой степени злокачественности (G3).
**Пораженные опухолью у пациента ЛУ (N1 статус) классифицируют в IVВ стадию распространения опухолевого процесса при опухолях семейства саркомы Юинга костной ткани, однако при мягкотканной локализации новообразования статус любая T N1 M0 классифицируется как IIIВ стадия.
Приложение 20

______________________________
* Первая стадия (IA и IB) не применима для опухолей семейства саркомы Юинга, вследствие того, что опухоли семейства саркомы Юинга всегда классифицируются как новообразования высокой степени злокачественности (G3).
**Пораженные опухолью у пациента ЛУ (N1 статус) классифицируют в IVВ стадию распространения опухолевого процесса при опухолях семейства саркомы Юинга костной ткани, однако при мягкотканной локализации новообразования статус любая T N1 M0 классифицируется как IIIВ стадия.
Приложение 20
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Группировка по стадиям РМС
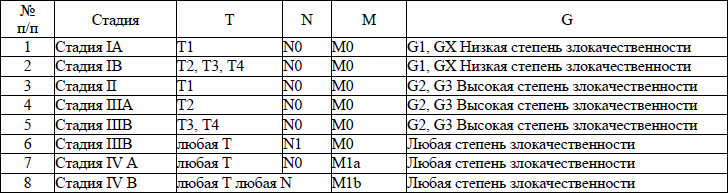
Группировка по стадиям сарком мягких тканей*
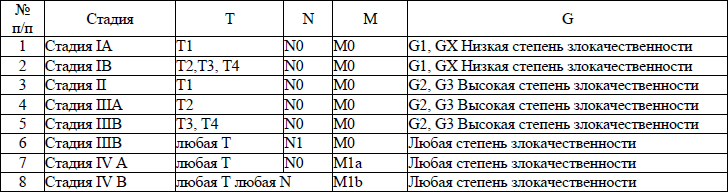
* Для сарком мягких тканей головы и шеи стадия не устанавливается.
Приложение 22

Приложение 21
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Группировка по стадиям сарком мягких тканей*

______________________________
* Для сарком мягких тканей головы и шеи стадия не устанавливается.
Приложение 22
к клиническому протоколу «Диагностика
и лечение детей с онкологическими
и гематологическими заболеваниями»
Классификация герминогенноклеточных опухолей яичника по TNM и FIGO
(The International Federation of Gynecology and Obstetrics)
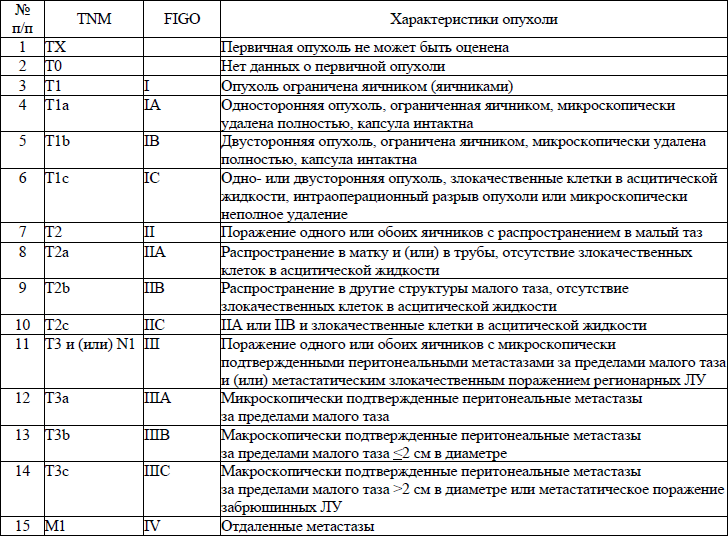

Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.