Диагностика и интенсивная терапия острого респираторного дистресс-синдрома во время беременности
 Версия: Клинические протоколы КР 2017-2020 (Кыргызстан)
Версия: Клинические протоколы КР 2017-2020 (Кыргызстан)
Общая информация
Краткое описание
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ КЫРГЫЗСКОЙ РЕСПУБЛИКИ
КЫРГЫЗСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КЫРГЫЗСКИЙ
ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ ИНСТИТУТ ПЕРЕПОДГОТОВКИ И ПОВЫШЕНИЯ КВАЛИФИКАЦИИ
ДИАГНОСТИКА И ИНТЕНСИВНАЯ ТЕРАПИЯ ОСТРОГО РЕСПИРАТОРНОГО ДИСТРЕСССИНДРОМА ВО ВРЕМЯ БЕРЕМЕННОСТИ
КЛИНИЧЕСКИЙ ПРОТОКОЛ
Национальный клинический протокол для родовспомогательных отделений/стационаров I – III уровней организаций здравоохранения утвержден Приказом МЗ КР №584 от 28.06.2017 г.
Клиническая проблема
Острый респираторный дистресс-синдром во время беременности.
Этапы оказания помощи
Все уровни организаций здравоохранения Кыргызской Республики.
Целевая группа
Акушер-гинекологи, анестезиологи-реаниматологи, организаторы здравоохранения, студенты медицинских высших учебных заведений.
Целевая группа пользователей
Женщины, нуждающиеся в интенсивной терапии при респираторном дистресс-синдроме во время беременности, родов и послеродовом периоде
Дата создания
2017 год
Планируемая дата обновления
Проведение следующего пересмотра планируется в январе 2020 г. либо при появлении новых ключевых доказательств. Все поправки к клиническим протоколам будут опубликованы в периодической печати. Любые комментарии и пожелания по содержанию клинического протокола приветствуются.
ВВЕДЕНИЕ
Нормальное течение беременности, состояние плода и новорожденного в значительной степени определяются состоянием дыхательной системы матери. Во время беременности респираторная система испытывает воздействие механических и метаболических факторов. При физиологическом течении беременности возникает ряд приспособительных изменений функций внешнего дыхания, направленных на обеспечение необходимого уровня газообмена: увеличение вентиляции с ее регионарным перераспределением по зонам легких, поэтапное перераспределение легочного кровотока, увеличение вентиляционно-перфузионных отношений и их более равномерное распределение по зонам легких во второй половине беременности. ОРДС является одним из основных осложнений при различных жизнеугрожающих состояниях в акушерстве: гипертензивные нарушения, послеродовый сепсис, акушерские кровотечения, септический и геморрагический шок, эмболия околоплодными водами, аспирационный синдром, пневмония и т.д. (* Мусуралиев М.С. ОРДС – взрослых в акушерской практике /Центрально-Азиатский мед. журнал, 2011,№1, Том ХVII, Прилож. 1, с 89.). По последним данным доказательной медицины (TheNationalHeart, LungandBloodInstituteARDSClinicalTrialsNetwork) частота возникновения ОРДС достигает 79 на 100 000 населения в год. Летальность пациентов при ОРДС составляет в среднем около 35-45 % и зависит от причин возникновения синдрома, тяжести его течения и наличия полиорганной недостаточности. Заболевания органов дыхания – одна из важнейших проблем современной медицины. Развитие беременности на фоне этих заболеваний резко увеличивают нагрузку на дыхательную систему.
Цель разработки данного протокола:
повышение качества медицинской помощи и улучшение исхода у женщин с ОРДС во время беременности, родов и послеродовом периоде.
Ожидаемые результаты от внедрения рекомендаций данного документа:
• Уточнение критериев диагностики ОРДС у женщин во время беременности, родов и послеродовом периоде
• Улучшение знаний и навыков (респираторная поддержка) по ведению ОРДС у женщин во время беременности, родов и послеродовом периоде
• Снижение материнской смертности от ОРДС
• Внедрение командного подхода и алгоритма действий при ОРДС у женщин во время беременности, родов и послеродовом периоде.
Основные группы пользователей:
акушеры-гинекологи, анестезиологи-реаниматологи, врачи общей практики; руководители сферы здравоохранения и разработчики стратегий в области здравоохранения; студенты медицинских высших и средних учебных учреждений; сотрудники ФОМС.
Для кого предназначено руководство:
для ведения женщин, нуждающихся в интенсивной терапии при ОРДС во время беременности, родов и послеродовом периоде.
Описание процесса поиска и оценки существующих клинических руководств и других доказательств:
поиск клинических руководств, а также результатов мета-анализов, систематических обзоров рандомизированных клинических исследований и т.д. проводился в Кохрейновской Библиотеке, в базе медицинских данных “Медлайн” (Medline) и других национальных и крупнейших международных электронных базах доказательных руководств в сети Интернет.
Декларация конфликта интересов:
перед началом работы по созданию данного клинического протокола все члены рабочей группы дали согласие сообщить в письменной форме о наличии финансовых взаимоотношений с фармацевтическими компаниями. Никто из членов авторского коллектива не имел коммерческой заинтересованности или другого конфликта интересов с фармацевтическими компаниями или другими организациями, производящими продукцию для диагностики, лечения и профилактики ОРДС.
Классификация
КЛАССИФИКАЦИЯ УРОВНЕЙ ДОКАЗАТЕЛЬСТВ


СИСТЕМА ОЦЕНКИ УБЕДИТЕЛЬНОСТИ РЕКОМЕНДАЦИЙ ПО СИСТЕМЕ GRADE (НАСТОЯТЕЛЬНОСТЬ РЕКОМЕНДАЦИЙ)
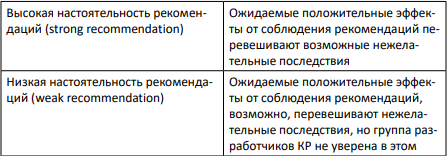
Внедрение рекомендаций
потребует изменения существующей практики ведения больных с ОРДС во время беременности, родов и послеродовом периоде, т.к. были уточнены ряд параметров респираторной терапии при ведении вышеуказанной категории пациенток.
КЛИНИЧЕСКАЯ КЛАССИФИКАЦИЯ
Сегодня нет отдельной, специально для беременных клинической классификации ОРДС, т.к. современная тактика проведения ранней терапии синдрома позволяет предупредить развитие классической клинической симптоматики ОРДС. (13)
СТАДИИ ОРДС (ГИСТОЛОГИЧЕСКИ, ПАТОФИЗИОЛОГИЧЕСКИ):
1. фаза экссудации
2. фаза пролиферации
3. фаза фиброза.
По степени тяжести:

Этиология и патогенез
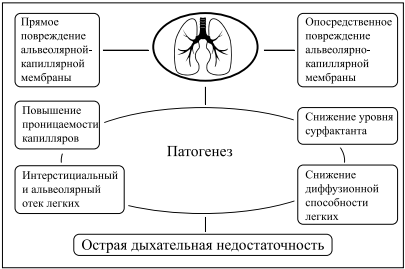
ПАТОГЕНЕЗ ОРДС
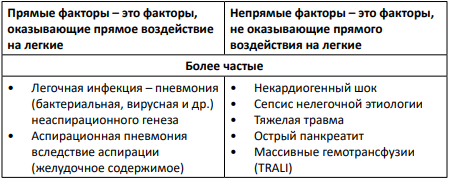
Факторы и группы риска
ФАКТОРЫ РИСКА РАЗВИТИЯ ОРДС (2)

Таблица 1
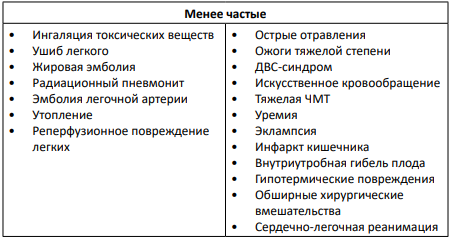
ФАКТОРЫ, УХУДШАЮЩИЕ ТЕЧЕНИЕ ОРДС:
1. Патология грудной стенки, в том числе повышенное давление в средостении и плевральных полостях.
2. Интраабдоминальная гипертензия (8).
3. Избыточная масса тела (6).
1. ПАТОЛОГИЯ ГРУДНОЙ СТЕНКИ
Патология грудной стенки является одним из непосредственных факторов, ухудшающих течение ОРДС, т.к. приводит к сдавлению альвеол извне (отрицательному транспульмональному давлению на выдохе), ограничивает эффект от применения положительного давления конца выдоха (РЕЕР) и маневров рекрутирования альвеол.
Причины увеличения жесткости грудной стенки:
• отек клетчатки средостения и мышц грудной стенки
• ригидность ребер и межреберных мышц
• ожирение
• увеличение внутрибрюшного давления.
2. СИНДРОМ ИНТРААБДОМИНАЛЬНОЙ ГИПЕРТЕНЗИИ (8)
При развитии синдрома интраабдоминальной гипертензии увеличивается жесткость грудной стенки, что приводит к коллапсу альвеол.
Причины интраабдоминальной гипертензии:
• панкреатит
• перитонит
• ишемия ветвей брюшной аорты
• кишечная непроходимость.
3. МАССА ТЕЛА
Чем выше индекс массы тела, тем выше давление на альвеолу снаружи (ниже транспульмональное давление) и тем больше подвержены коллапсу альвеолы, расположенные в дорсальных и нижнебазальных отделах легких. Индекс массы тела следует учитывать при настройке РЕЕР.
Клиническая картина
Cимптомы, течение
ТЕРМИНОЛОГИЯ
ОРДС - это острое, диффузное, воспалительное поражение легких, ведущее к повышению проницаемости сосудов легких, повышению массы легких и уменьшению аэрации легочной ткани. (11)
ОРДС, как правило, развивается вторично.
Основные клинико-физиологические звенья ОРДС (Американо-Европейская согласительная конференция, 2012 г.):
• гипoксемия и двусторонние инфильтраты на рентгенограмме или компьютерной томографии органов грудной клетки
• увеличение венозного шунтирования
• рост физиологического мертвого пространства
• снижение податливости легочной ткани.
Критерии диагностики ОРДС:
1. Наличие факторов риска – прямые и/или непрямые (таблица 1).
2. Острое начало – в течение недели после клинического начала или развитие новых респираторных симптомом.
3. Двусторонняя инфильтрация легких > 20% на фронтальной рентгенограмме грудной клетки (5,6).
Диагностика
ОБСЛЕДОВАНИЕ БОЛЬНЫХ С ОРДС
1. Общеклиническое исследование:
1) Общий анализ крови
• лейкоцитоз или лейкопения
• анемия
• тромбоцитопения, отражающая системную воспалительную реакцию или повреждение эндотелия.
2) Общий анализ мочи.
3) Биохимическое исследование крови: белковый обмен, электролиты, мочевина, креатинин, билирубин – возможно выявление недостаточности функции печени (цитолитиз, холестаз) или почек (повышение креатинина, мочевины). Это связано с тем, что ОРДС часто является проявлением ПОН.
2. Газовый анализ крови:
1) На ранних этапах ОРДС присутствует гипокапния (РаСО2 < 35 мм рт. ст. и респираторный алкалоз (рН > 7,45), которая связана с высокой минутной вентиляцией.
2) При прогрессировании заболевания наблюдаются:
• повышение альвеолярного мертвого пространства
• повышение РаСО2
• развитие «усталости» дыхательных мышц.
В результате вышеизложенного:
• происходит нарастание РаСО2
• алкалоз сменяется ацидозом.
3. Гемостазиограмма крови (в зависимости от патологии, которая привела к ОРДС, сам ОРДС не влияет на коагуляцию крови).
4. Бактериологическое исследование мокроты.
5. Рентгенологическое исследование органов грудной клетки: имеет меньшую диагностическую ценность по сравнению с компьютерной томографией. Тяжелый ОРДС предполагает затемнение минимум 3-4 полей.
На рентгенограмме:
• картина «матового стекла» и диффузных мультифокальных инфильтратов довольно высокой плотности с хорошо очерченными воздушными бронхограммами, то есть развитие обширного поражения паренхимы легких
• может визуализироваться небольшой плевральный выпот.
Трудности возникают при дифференциации рентгенографической картины ОРДС с кардиогенным отеком легких. В пользу ОРДС свидетельствуют:
• более периферическое расположение инфильтративных теней
• нормальные размеры сердечной тени
• отсутствие или небольшое количество линий Керли типа В (короткие, параллельные, располагающиеся на периферии легких).
6. Компьютерная томография (магнитно-резонансная томография по возможности) позволяет получить данные, которые не могут быть получены при обычной рентгенографии. В частности, получить дополнительную информацию о степени и протяженности поражения паренхимы легких, а также выявить наличие баротравмы или локализованной инфекции. Ранние КТ-исследования структуры легких показали, что локализация легочных инфильтратов носит пятнистый, негомогенный характер, причем существует вентрально - дорсальный градиент легочной плотности:
• нормальная аэрация легочной ткани в вентральных (так называемых независимых) отделах
• картина «матового стекла» в промежуточных зонах
• плотные очаги консолидации в дорсальных (зависимых) отделах, возникновение которых обусловлено зависимым от силы тяжести распределением отека легких и, в большей степени, развитием “компрессионных ателектазов” зависимых зон вследствие их сдавления вышележащими отечными легкими.
7. Консультации хирурга, уролога, ЛОР-врача, фтизиатра (по показаниям)
8. Бронхоальвеолярный лаваж. В первые дни заболевания характерно высокое содержание нейтрофилов – более 60% (в норме менее 5%), которое по мере обратного развития заболевания уступает место альвеолярным макрофагам.
9. ЭхоКГ. Для исключения гидростатического отека при отсутствии факторов риска при ОРДС.
Таким образом, лабораторные признаки для ОРДС малоспецифичны, т.к. ОРДС часто сопутствует системной воспалительной реакции организма на инфекцию и/или другие факторы, большинство лабораторных признаков связаны с основным заболеванием, за исключением кислотно-щелочного состояния (4,5).
ДИАГНОСТИЧЕСКИЕ КРИТЕРИИ ОРДС
Критерии диагностики ОРДС основываются на результатах согласительной конференции в Берлине, 2012 г. (11)
КРИТЕРИИ ОРДС


АЛГОРИТМ ДИАГНОСТИКИ ОРДС (2)
1. Определить факторы риска развития ОРДС. Для этого необходимо:
• проанализировать данные анамнеза
• выделить ведущий повреждающий фактор (прямой или непрямой)
• определить время от момента начала действия повреждающего фактора.
2. Исключить другие причины развития ОДН:
3. Проанализировать характер изменений на рентгенограмме:
• диффузные
• очаговые
• сливные.
4. Компьютерная томография легких. При доступности метода и транспортабельности пациента оценить повреждение (гомогенное или негомогенное), участки консолидации и «матового стекла» для оценки ведущего патогенетического механизма и потенциала рекрутабельности альвеол.
5. Оценить соотношение парциального давления кислорода в артериальной крови к инспираторной фракции кислорода (PaO2 /FiO2 ).
6. Оценить состояние статической податливости респираторной системы, измерив давление инспираторной паузы (плато) Pplat по формуле:
Cstat = Vt/(Pplat-PEEP), где
Cstat – статическая податливость респираторной системы
Vt – дыхательный объем
PEEP – положительное давление в конце выдоха.
7. Измерить внутрибрюшное давление: после катетеризации мочевого пузыря ввести в него 25 мл теплого стерильного физиологического раствора, измерить в нем давление, принимая за ноль среднеподмышечную линию при положении пациента на спине в конце выдоха, при отсутствии мышечного напряжения передней брюшной стенки. Устойчивое повышение давления в мочевом пузыре свыше 12 мм. рт. ст. и более, которое регистрируется как минимум при 3-х стандартных измерениях с интервалом в 4 – 6ч свидетельствует об интраабдоминальной гипертензии, которая приводит к дополнительному коллабированию альвеол.
8. Рассчитать индекс массы тела: по формуле ИМТ=вес (в кг) / рост в метрах, возведенный в квадрат.
9. Оценить степень повреждения легких по шкале повреждения легких (LIS).
Осложнения
ОСЛОЖНЕНИЯ:
1. Брадикардия
2. Артериальная гипотензия: повышение внутригрудного давления → повышение постнагрузки правых отделов сердца → снижение ударного объема правого желудочка → снижение сердечного выброса и фракции выброса
3. Баротравма
У пациентов с критериями высокой рекрутабельности альвеол, отсутствием противопоказаний к настройке РЕЕР при невозможности применения расширенного мониторинга респираторной физиологии, эффективен следующий эмпирический протокол сочетания маневров рекрутирования альвеол и деэскалационного варианта настройки РЕЕР:
• установить такую FiO2 , чтобы SpO2 была равна 88-90%
• провести маневр рекрутирования альвеол одним из известных способов, наблюдать за гемодинамикой и SpO2
• после маневра перевести пациента на ИВЛ с дыхательным объемом 4 - 8 мл/кг ИМТ, PEEP 20 мбар
постепенно увеличивать РЕЕР на 1 – 2 мбар до повышения SpO2 . Когда SpO2 перестает повышаться увеличивая РЕЕР начинайте уменьшать PEEP на 1 мбар до снижения SpO2 , запомнить величину PEEP, при которой произошло уменьшение SpO2 . Провести повторный маневр рекрутирования альвеол.
НАСТРОЙКА ВРЕМЕННЫХ ПАРАМЕТРОВ ДЫХАТЕЛЬНОГО ЦИКЛА
Настройка временных параметров дыхательного цикла, т.е. инспираторного времени, соотношения вдоха к выдоху, инспираторной паузы (13):
• Рутинное применение инверсного соотношения вдоха к выдоху (более 1:1,2) нерекомендовано
• Возможно использование инвертированного соотношения вдоха к выдоху как метода резерва
• Для предотвращения инверсного соотношения вдоха к выдоху следует установить время вдоха (Tinsp) (обычно, в пределах 0,8-1,3 секунды) за счет установки параметра времени вдоха или регулировки скорости потока – чем больше скорость потока, тем короче вдох
• Диапазон регулировки скорости потока 30-80 л/мин
• Инспираторное время должно быть примерно равным постоянной времени респираторной системы, то есть произведению сопротивления дыхательных путей и податливости респираторной системы.
ЭТАПЫ ОТЛУЧЕНИЯ ОТ ИВЛ
НАСТРОЙКА РЕЖИМА ПОДДЕРЖКИ ДАВЛЕНИЕМ
1. При переходе от управляемого режима к режиму поддержки давлением оставьте текущий уровень РЕЕР и FiO2 , чувствительность инспираторного триггера, установите уровень поддержки давления (PS) на 2 мбар выше давления плато (в режимах с управляемым объемом SIMV – Volume Control, SPN – PS) и или инспираторного давления (в режимах с управляемым давлением SIMP – Pressure Control, BIPAP).
2. При начале респираторной поддержки с режима PS установите уровень давления поддержки на 12-15 см вод.ст выше уровня РЕЕР, следите за величиной дыхательного объема (4 – 8 мл/кг ИМТ) и ЧД (не более 35/мин).
3. Настройте величину PS на основании ЧД пациента и величину дыхательного объема до достижения целевого значения (4 – 8 мл/кг ИМТ), частоты дыхания (не более 35/мин) и газового состава артериальной крови.
4. Настройте величину РЕЕР.
5. В случае сохраняющегося дыхательного дискомфорта у пациента (десинхронизация с респиратором на вдохе и выдохе, чувство затруднения при дыхании и так далее) отрегулируйте чувствительность инспираторного и экспираторного триггеров.
6. В случае если режим PS неэффективен (ЧД более 35/мин, Vt менее 6 мл/кг ИМТ, f/Vt более 105, PaCO2 менее 30 мм рт.ст., дыхательный дискомфорт, «борьба с респиратором»): вернитесь к предшествующим установкам принудительной вентиляции и попробуйте повторить алгоритм.
7. Процедура снижения поддержки давлением (не уменьшайте давление поддержки в вечернее и ночное время) проводится в случае улучшения биомеханических свойств респираторной системы – увеличения податливости, снижения сопротивления дыхательных путей, а также готовности нервно-мышечного аппарата:
б) если снижение привело к снижению ДО, увеличению ЧД более 35/ мин, увеличению соотношения f/Vt более 105, вернитесь к предшествующим установкам. На следующее утро начните вновь процедуру снижения поддержки давлением с последнего эффективного значения и уменьшайте PS на 2 мбар каждые 1-3 часа.
в) в случае если уровень давления поддержки снижен до PS = 4 мбар (при респираторной поддержке через трахеостомическую трубку) или PS = 6-8 мбар(при респираторной поддержке через эндотрахеальную трубку) в течение 2 часов, следует перейти к тесту спонтанного дыхания (14).
При достижении адекватного ДО, ЧД, целевых показателей газообмена и сохранении дискомфорта пациента следует:
1. Увеличить скорость нарастания давления (уменьшить время достижения заданного давления поддержки).
2. Если у пациента увеличено сопротивление дыхательных путей (например, вследствие хронической обструктивной болезни легких) или мощные короткие попытки вдоха, увеличить процент потока выдоха с автоматически установленного (как правило, 25 - 45%).
ВЕНТИЛЯЦИЯ ЛЕГКИХ В ПОЛОЖЕНИИ ЛЕЖА НА ЖИВОТЕ («ПРОН-ПОЗИЦИИ»)
Коллабирование альвеол, отек и ателектазирование участков легких происходит преимущественно в нижележащих (при текущем положении тела) отделах. В наибольшей степени этот эффект выражен в положении лежа на спине – коллабирование альвеол происходит под воздействием давления отечной легочной ткани, давления со стороны органов брюшной полости и органов средостения (13,12).
Вентиляция в положении на животе приводит к:
• рекрутированию альвеол;
• расправлению ателектазов без создания повышенного давления в дыхательных путях.
Применение прон-позиции приводит к:
• улучшению оксигенации,
• уменьшению летальности у пациентов, но только в случае использования в ранние сроки тяжелого ОРДС при длительности не менее 16 часов в сутки.
Показания к применению прон-позиции:
• тяжелый ОРДС (PaO2 /FiO2 менее 150 мм рт.ст. с FiO2 более 60% и РЕЕР более 5 мбар)
• высокий риск отрицательного влияния РЕЕР на гемодинамику и/или противопоказания к настройке РЕЕР (например: недренированный пневмоторакс)
• морбидное ожирение (необходимо, чтобы живот не оказывал давления на диафрагму,например, за счет подкладывания под грудь и таз пациента валиков).
Эффективность:
• уменьшается шунтирование в легких
• увеличивается объем легочных отделов
• улучшаются оксигенация и биомеханические свойства грудной стенки.
Длительность применения прон-позиции для достижения эффекта:
• не менее 16 часов в сутки.
Методология прон-позиции: пациента следует положить на живот, предварительно положив валики под грудную клетку и таз с таким расчетом, чтобы живот не оказывал избыточного давления на диафрагму, а также не создавалось условий для развития пролежней лица.
Меры, которые следует предпринять перед переводом больного в положение на животе:
• прекратить введение пищи в назогастральный зонд
• более часто аспирировать трахею
• изменить параметры ИВЛ
• увеличить FiO2
Осложнения:
• отек лица (проходит обычно через 2 ч после возвращения в положение на спине)
• транзиторные расстройства гемодинамики (артериальная гипотензия)
• кратковременное усиление гипоксемии вследствие быстрого массивного отхождения мокроты в положении на животе
• спонтанная экстубация (крайне редко)
• нарушение энтерального питания, рвота
• повышение внутричерепного давления
• повышение внутриглазного давления, изъязвление роговицы
• перегибы и дислокации интубационных трубок и венозных катетеров
• невозможность выполнения сердечно-легочной реанимации в случае остановки кровообращения.
Относительные противопоказания:
• гемодинамическая нестабильность и /или аритмии
• травмы лица или вентральной области тела
• повышение внутричерепного давления
• наличие абдоминального и/или торакального дренажа
• терапия, замещающая функцию почек
• беременность (после родоразрешения можно проводить вентиляцию легких в положении лежа на животе).
Абсолютные противопоказания:
• повреждение позвоночника
Критерии прекращения применения прон-позиции:
• увеличение PaO2 /FiO2 более 200 мм рт.ст. при PEEP менее 10 мбар, сохраняющиеся в течение не менее 4 часов после последнего сеанса прон-позиции
УСЛОВИЯ ДЛЯ ПРЕКАЩЕНИЯ РЕСПИРАТОРНОЙ ПОДДЕРЖКИ (В УСЛОВИЯХ РЕГРЕССА ОРДС)
Перед началом отлучения от ИВЛ необходима оценка общего состояния пациента (10).
Основные моменты:
• Отсутствие неврологических признаков отека головного мозга и патологических ритмов дыхания
• Прекращение действия миорелаксантов и других препаратов, угнетающих дыхание
• Стабильность гемодинамики и отсутствие жизнеопасных нарушений ритма при скорости введения дофамина (добутамина), мезатона в любых дозировках
• Отсутствие признаков сердечной недостаточности
• Отсутствие гиповолемии и выраженных нарушений метаболизма
• Отсутствие нарушений кислотно-основного состояния
• PvO2 >35 мм рт. ст.
• Отсутствие выраженных проявлений ДВС-синдрома
• Полноценная нутритивная поддержка пациента перед и во время процесса «отлучения» от респиратора, компенсированные электролитные расстройства
• Температура менее 38°С.
Следующим этапом является оценка респираторной системы:
• PaO2 /FiO2 более 300 мм рт.ст.
• Уменьшение инфильтрации на рентгенограмме (и/или КТ) грудной клетки
• Увеличивающаяся в динамике статическая податливость
• Сопротивление дыхательных путей менее 10 мбар/л/с
• Индекс Тобина (f/Vt) менее 105(отношение частоты вентиляции к ДО в литрах)
• Жизненная емкость легких более 15 мл/кг
• Восстановление кашлевого рефлекса и кашлевого толчка.
НЕРЕСПИРАТОРНЫЕ МЕТОДЫ ТЕРАПИИ ОРДС
1. Раннее энтеральное питание
2. Инфузионная терапия: рекомендована целенаправленная терапия, основанная на показателях гемодинамики и, при возможности, внесосудистой воды легких, с поддержанием отрицательного гидробаланса на протяжении 2-3 сут с момента развития ОРДС
3. Контроль интраабдоминальной гипертензии: использование комплекса мер, направленных на профилактику и лечение дисфункции желудочно-кишечного тракта, своевременное выявления патологических факторов, способствующих росту внутрибрюшного давления:
• адекватная хирургическая санация гнойно-воспалительных очагов брюшной полости
• ультразвуковой контроль брюшной полости, малого таза, забрюшинной клетчатки
• раннее начало энтерального питания
• хирургическое лечение компартмент-синдрома (в том числе, лапаростомия)
• синхронизация пациента с респиратором, нейро-мышечная блокада (10)
Для синхронизации с респиратором пациентам с ОРДС целесообразно применять седативные препараты и средства для наркоза.
4. Сурфактанты – гетерогенная группа лекарственных средств. Препараты различаются по составу фосфолипидов, белков сурфактанта и способу получения. Эффект более выражен при первичном повреждении легких – пневмонии и аспирации желудочного содержимого. Однако ингаляции сурфактанта или его инстилляция не влияют на длительность проведения респираторной поддержки и летальность. Введение сурфактанта в бронхиальное дерево может приводить к обструкции бронхов, дерекрутированию альвеол, ухудшая оксигенацию и увеличивая риск неблагоприятного исхода. Поэтому данный метод не может быть рекомендован для повседневной клинической практики (20).
5. Гемодиафильтрация: применение продленной высокообъёмной вено-венозной гемофильтрации (замещение более 6 л/ч) может приводить к улучшению оксигенации, уменьшению внелегочной воды легких, снижению продолжительности ИВЛ и уменьшению летальности (14).
6. Кортикостероиды: использование малых доз метилпреднизолона (0,5-2,5 мг/кг/сут), начиная с первых 36 часов от начала ОРДС в течение 7-10 суток, приводит к улучшению оксигенации, уменьшению длительности ИВЛ (15).
КОНТРОЛЬ ЭФФЕКТИВНОСТИ ПРОВОДИМОЙ ТЕРАПИИ:
1. Клинические симптомы болезни
2. Температурная реакция
3. Динамика изменений в системе гемокоагуляции
4. Лабораторные признаки воспаления
5. Состояния центрального и периферического кровообращения
6. Степень коррекции изменений газообмена и биомеханики дыхания
7. Показатели летальности.
АКУШЕРСКАЯ ТАКТИКА
Одной из наиболее распространенных причин ОРДС при беременности является грипп. Во время беременности грипп несет значительно более высокий риск заболеваемости и смертности, чем среди населения в целом, и поэтому требует особого внимания, включая быструю диагностику и лечение, а также профилактику.
КЛИНИЧЕСКИЕ СИМПТОМЫ И СИНДРОМЫ ГРИППА
Грипп – это острое инфекционное заболевание. Продолжительность инкубационного периода может составлять несколько часов – 7 дней, а в среднем – 2 – 3 дня. Заболевание начинается остро, сопровождается резким повышением температуры тела до 38°C и выше и выраженными симптомами интоксикации (озноб, головная боль, ломота в суставах, боль в мышцах и при движении глазных яблок). В последующем развиваются катарально-респираторные симптомы (сухость слизистых верхних дыхательных путей, першение в горле, саднение или боли за грудиной, сухой кашель, одышка). В большинстве случаев грипп протекает доброкачественно, в течение 2 – 5 дней, а исход благоприятный. Но течение гриппа может быть и тяжелым, когда поражение нижних дыхательных путей сопровождается дыхательной недостаточностью, отеком легких, сосудистым коллапсом, отеком мозга, геморрагическим синдромом и присоединением вторичных бактериальных осложнений. В Международной классификации болезней, травм и причин смерти 10 пересмотра (МКБ-10, 1992 г.) нозологические формы гриппа входят в группу «Болезней органов дыхания», подгруппа J10-J18 «Грипп и пневмония».
Важными факторами риска тяжелого/осложненного течения гриппа (в том числе и среди беременных) являются:
• сопутствующие хронические заболевания легких и сердечно-сосудистой системы, в том числе гипертензия;
• наличие эндокринных нарушений (сахарный диабет);
• наличие метаболических (в первую очередь ожирение) нарушений;
• позднее начало противовирусной терапии (более 48 часов от начала заболевания);
• курение;
• иммуннодефицитные состояния (пересаженные органы или СПИД).
В случае возникновения заболевания во время беременности пациентки подвержены большему риску развития осложнений в силу гормональных и физиологических изменений, происходящих в организме в период беременности. Так по данным анализа 241 случая госпитализации беременных с гриппом АH1N1, в 2009г. в Великобритании, установлено, что:
1. Беременные женщины, больные гриппом, требовали госпитализации в 4 раза чаще, чем небеременные; 2. Наиболее тяжело протекал грипп у пациенток в третьем триместре беременности;
3. Более 8% госпитализированных беременных (преимущественно в третьем триместре заболевания) требовали проведения интенсивной терапии;
4. Преждевременные роды у беременных с гриппом наблюдались в 3 раза чаще;
5. Перинатальная смертность была в 5 раз выше;
6. Группой высокого риска по тяжести течения заболевания и развитию осложнений являлись и женщины в послеродовом периоде, до 2-х недель после родов (41, 42).
Кроме того, были установлены факторы риска госпитализации беременных с гриппом в отделение интенсивной терапии:
1. Высокая температура тела > 38°C;
2. Одышка (ЧДД > 30/мин) и нарушения дыхания (с большой вероятностью указывают на возможность летального исхода);
3. Необходимость в кислородной поддержке (SpO2 < 80% с большой вероятностью указывает на возможность летального исхода);
4. Развитие пневмонии (с большой вероятностью указывает на возможность развития осложнений в период госпитализации);
5. Тахикардия (чем выше частота сердечных сокращений, тем больше оснований для проведения интенсивной терапии);
6. Нарушение сознания (42).
Наряду с вышеизложенным, важно помнить о наличии грипп-подобного заболевании (ГПЗ), для которого также характерны лихорадка > 38°C, кашель или боль в горле. Однако для гриппа, наряду с вышеизложенными симптомами, характерны еще такие, как быстрая утомляемость, головная боль, мышечные боли и сезонность. Но провести дифференциальную диагностику может только медицинский специалист в организациях здравоохранения, поэтому следует рекомендовать всем беременным при появлении самых первых признаков болезни, как можно раньше обращаться за помощью, особенно если был контакт с больным человеком.
ПАТОЛОГИЯ БЕРЕМЕННОСИ И ПАТОЛОГИЯ ПЛОДА
Клиническая картина гриппа у беременных может существенно варьировать, а грозные осложнения сочетаться с развитием патологии беременности, что в конечном итоге усугубляет состояние как будущей матери, так и плода. Одним из наиболее частых осложнений гриппа во время беременности является синдром потери плода (самопроизвольные аборты, внутриутробная гибель плода, преждевременные роды). Причинами этого являются непосредственно эмбриотоксическое действие вируса и высокой температуры, а также нарушение маточно-плацентарного кровообращения на фоне интоксикации и гипертермии.
Первый триместр беременности
В это время беспокойство, как медицинского работника, так и беременной, в основном, связано с влиянием высокой температуры тела на развитие плода, поскольку гипертермия в течение первого триместра связана с дефектами нервной трубки и, возможно, с другими врожденными дефектами и с самопроизвольным выкидышем.
Важно:
1. С целью снижения температуры тела назначить парацетамол;
2. Обсудить с беременной назначение противогриппозной терапии, принимая во внимание возможные осложнения как гриппа, так и самой терапии.
Второй и третий триместр беременности
В это время беспокойство, в значительной степени, связано с тяжестью заболевания у матери, а также с потенциальными последствиями высокой температуры у матери на развитие в/у плода.
Важно:
1. Настоятельно рекомендовать лечение противогриппозными препаратами, что позволит уменьшить тяжесть заболевания у матери;
2. Контролировать лихорадку, снизить температуру тела путем приема парацетамола;
3. Проводить оценку/переоценку состояния матери и плода на каждом приеме (52).
Во время родов
В это время беспокойство, в значительной степени, связано с тяжестью заболевания у матери и с риском передачи вируса ребенку после родов.
Важно:
1. Настоятельно рекомендовать лечение противогриппозными препаратами, что позволит уменьшить тяжесть заболевания у матери и риск передачи вируса ребенку;
2. Контролировать лихорадку, снизить температуру тела путем приема парацетамола;
3. Не настаивать на ношение роженицей маски во время родов, но все другие, кто присутствует в родильной комнате во время родов, должны соблюдать рекомендации по инфекционному контролю и профилактике вирусной инфекции;
4. Ведение родов: не следует применять методы, ускоряющие роды (ранняя амниотомия, родостимуляция), без стандартных акушерских показаний.
Послеродовый период
В это время беспокойство, в значительной степени, связано с риском передачи вируса ребенку.
Важно минимизировать риск заражения от матери к ребенку:
1. Не разлучать мать и ребенка;
2. Начать лечение матери (мать считается неконтагиозной уже после 72 часов лечения противогриппозными препаратами);
3. Поощрять грудное вскармливание, лишь предупредив, что мать должна носить хирургическую маску;
4. Мать и ребенок могут спать в одной комнате (по крайней мере, в больнице), но в отдельных кроватях, которые расположены на расстоянии не менее 1 метра друг от друга;
5. Мать может осуществлять уход за ребенком, надев хирургическую маску;
6. Важно научить мать соблюдать этикет кашля (при кашле прикрывать рот и нос салфеткой, которую следует сразу выкинуть, отказаться от носовых платков, тщательно мыть руки с мылом и водой, прежде чем подойти к ребенку). Эти меры должны соблюдаться всеми членами семьи, что позволит минимизировать передачу вируса при гриппе и грипп-подобном заболевании.
ПРИНЦИПЫ И СХЕМЫ ЛЕЧЕНИЯ
Беременные с тяжелыми формами гриппа и при тяжелых пневмониях должны помещаться в отделениях реанимации и интенсивной терапии, желательно профильного стационара. Наблюдение и лечение таких беременных осуществляют совместно врачи-терапевты (пульмонологи), инфекционисты, анестезиологиреаниматологи и акушер-гинекологи (50).
ПРОТИВОВИРУСНАЯ ТЕРАПИЯ
В связи с тем что беременные женщины являются группой повышенного риска по развитию угрожающих жизни состояний, в качестве этиотропной терапии, им показано назначение противовирусных препаратов. До начала лечения, если это возможно, с целью идентификации возбудителя, следует взять мазок слизи из носа для проведения экспресс-теста на грипп.
В соответствии с рекомендациями ВОЗ лечение беременных следует начинать как можно раньше, в течение первых 48 часов заболевания, не дожидаясь результатов лабораторный тестов.
Лечение беременных с тяжелым или прогрессирующим течением заболевания целесообразно начинать и в более поздние сроки.
При назначении противовирусных препаратов кормящим женщинам, решение вопроса о продолжении грудного вскармливания зависит от тяжести состояния больной.
Выделяют две основные группы противогриппозных препаратов с доказанной клинической эффективностью:
1. Блокаторы М2-каналов (амантадин, римантадин) – не рекомендовано у беременных с гриппом в связи с большим числом штаммов, резистентных к данной группе препаратов, а главное, с их способностью проникать через плаценту и оказывать эмбриотоксический эффект.
2. Ингибиторы вирусной нейраминидазы (занамивир, озельтамивир).
ДОЗЫ ЭТИОТРОПНЫХ ПРЕПАРАТОВ ПРИ ЛЕЧЕНИИ ГРИППА В ПЕРИОД БЕРЕМЕННОСТИ И В ПОСЛЕРОДОВОМ ПЕРИОДЕ
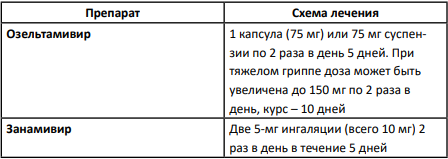
При назначении противовирусной терапии следует получить письменное информированное согласие пациентки на лечение!!!
ОСОБЫЕ УКАЗАНИЯ ПО ПРОТИВОВИРУСНОЙ ТЕРАПИИ
1. Лечение должно быть начато как можно раньше: в течение 48 часов от начала заболевания, что в большей степени обеспечивает выздоровление.
2. Для назначения противовирусной терапии не следует ожидать лабораторного подтверждения гриппа, т.к. это задержит начало терапии, а отрицательный экспресс-тест на грипп не опровергает ДЗ «Грипп».
3. Противовирусные препараты беременным с тяжелым или прогрессирующим течением заболевания необходимо назначать и в более поздние сроки.
ЖАРОПОНИЖАЮЩИЕ ПРЕПАРАТЫ
Препаратом первого выбора является парацетамол, однако, возможно назначение и некоторых нестероидных противовоспалительных препаратов (НПВП):
• Парацетамол: 500-1000 мг до 4 раз/сутки (не более 4000мг/сутки)
• Ибупрофен: 200-400 мг 3-4 раз/сутки (не более 1200мг); противопоказан в III триместре беременности
АНТИБАКТЕРИАЛЬНАЯ ТЕРАПИЯ
Важным аспектом лечения пневмонии у больных с осложненными формами гриппа является выбор антибиотиков.
При постановке ДЗ «ПНЕВМОНИЯ», антибактериальная терапия должна быть назначена в течение ближайших четырех часов!!! Этот показатель относится к числу индикаторов, по которым оценивают качество оказываемой в ОЗ помощи.
1. При вторичной вирусно-бактериальной пневмонии (наиболее вероятные возбудители: Streptococcus pneumonia, Staphilococcus aureus, Haemophilus influenza) предпочтительно использовать следующие схемы антибиотикотерапии:
• Цефалоспорин III поколения + Макролид
• Защищенный Аминопенициллин + Макролид
2. При третичной бактериальной пневмонии (наиболее вероятные возбудители: метициллинрезистеные штаммы Staphylococcus aureus, Haemophilus influenza, грамм (-) микроорганизмы) обоснованно назначение следующих препаратов (в различных комбинациях):
• Цефалоспорин IV поколения + Макролид
• Карбапенемы
• Ванкомицин или Линезолид – препараты выбора из-за лучшего проникновения в легочную ткань.
• Ко-амоксиклав не противопоказан при беременности. ВАЖНО!!! Ко-амоксиклав противопоказан при преждевременном разрыве плодных оболочек, сопровождающихся пневмонией, из-за повышенного риска некротического энтероколита.

РОДОРАЗРЕШЕНИЕ
Во всех случаях вопрос о времени и методе родоразрешения должен решаться индивидуально консилиумом врачей.

Следует помнить, что досрочное прерывание беременности и родоразрешение в разгар заболевания сопряжено с большим числом таких осложнений, как:
• утяжеление основного заболевания и вызванных им осложнений,
• развитие и/или прогрессирование дыхательной недостаточности,
• возникновение акушерских кровотечений,
• интранатальная гибель плода,
• послеродовые гнойно-септические осложнения (52).
Наряду с вышеизложенным, при невозможности устранения гипоксии на фоне ИВЛ или при прогрессировании дыхательной недостаточности, развития альвеолярного отека легких, а также при рефрактерном септическом шоке, по жизненным показаниям, в интересах матери, показано досрочное родоразрешение путем операции кесарево сечение с проведением всех мероприятий по профилактике коагулопатического и гипотонического кровотечений.
Кроме того, следует помнить, что показаниями к операции кесарево сечение у беременных с пневмонией могут быть любые абсолютные акушерские показания (кровотечение, неудовлетворительное состояние в/у плода, обструктивные роды и др.)
При необходимости оперативного родоразрешения в качестве анестезиологического пособия следует считать предпочтительными методы регионарной анестезии на фоне обязательного применения методов респираторной поддержки (52). Однако если заболевание сопровождается выраженной полиорганной недостаточностью, необходима тотальная внутривенная анестезия с ИВЛ.
В случае необходимости проведения преждевременных родов за 24 часа до родов необходимо провести общепринятую профилактику СДР плода.
В случае развития спонтанной родовой деятельности на фоне гриппа и пневмонии роды предпочтительно вести через естественные родовые пути под мониторным контролем состояния матери и плода. Проводить тщательное обезболивание, дезинтоксикационную, антибактериальную терапию, респираторную поддержку.
Во II периоде родов, если существует опасность развития дыхательной и сердечно-сосудистой недостаточности, необходимо исключить потуги путем проведения оперативного влагалищного родоразрешения – по необходимости вакуум-экстракция или акушерские щипцы.
Всем пациенткам, независимо от срока беременности, показана профилактика кровотечения и продолжение лечения гриппа и пневмонии, начатое до родов (выкидыша).
Лечение
ПРИНЦИПЫ И ЦЕЛИ ИНТЕНСИВНОЙ ТЕРАПИИ
1. Ликвидация заболевания, вызвавшего развитие ОРДС (проведение оперативного вмешательства, хирургическая санация очага инфекции, лечение шока и т.п.)
2. Коррекция и поддержание адекватного газообмена (использование различных вариантов респираторной поддержки)
3. Улучшение легочного кровотока, стабилизации АД
4. Поддержание сердечного выброса (добутрекс, при отсутствии – дофамин, допамин, адреналин)
5. Устранение отека легких (РЕЕР-терапия, отрицательный баланс жидкости, кортикостероиды)
6. Коррекция синдрома эндогенной интоксикации (ультрагемофильтрация)
7. Коррекция разных стадий и фаз острого ДВС-синдрома
8. Профилактика постгипоксических кровотечений из желудочно-кишечного тракта (антациды)
9. Рациональная антибактериальная терапия
10. Седация, анальгезия и миорелаксация (атарактики, анестетики, наркотические анальгетики, миорелаксанты) (10)
11.Профилактика тромботических осложнений (при отсутствии противопоказаний, гепарин).
РЕСПИРАТОРНАЯ ПОДДЕРЖКА

1. Задачи респираторной поддержки:
1) Обеспечить адекватный газовый состав артериальной крови
2) Уменьшить работу дыхания и потребление кислорода дыхательными мышцами
3) Предотвращение волюмотравмы – минимизация перерастяжения альвеол
4) Предотвращение ателектатического повреждения – циклического открытия и закрытия альвеол
5) Предотвращение органной лёгочной воспалительной реакции – биотравмы (3)
6) Предотвращение баротравмы.
2. Основные положения респираторной поддержки:
1) Дыхательный объем (ДО, Vt) не более 4 - 8мл/кг идеальной массы тела («протективная» ИВЛ) (B) с давлением плато ниже 30 см. вод. ст. (22). ДО снижается с 6 мл/кг прогнозируемого веса тела до минимального (4 мл/кг), если давление плато превышает 30 см.вод. ст.
2) ЧД и МОВ (MVE) – минимально необходимые, для поддержания РаСО2 на уровне 35-45 мм рт.ст.(C), но допустима пермиссивная (допустимая) гиперкапния
3) Фракция кислорода в дыхательной смеси (FiO2 ) – минимально необходимая для поддержания достаточного уровня оксигенации артериальной крови (C)
4) Выбор РЕЕР – минимально достаточный для обеспечения максимального рекрутирования альвеол и минимального перераздувания альвеол и угнетения гемодинамики («протективная» ИВЛ) (A)
5) Скорость пикового инспираторного потока – от 30 до 80 л/мин (D)
6) Профиль инспираторного потока – нисходящий (рампообразный)(D) Одним из основных звеньев интенсивной терапии ОРДС является своевременно начатая и адекватно проводимая респираторная поддержка
7) Соотношение вдох/выдох (I/E)– неинвертированное (менее 1:1,2)(C)
8) Применение вентиляции в положении лежа на животе («прон-позиции») пациентам с тяжелым ОРДС, морбидным ожирением и пациентам, которым противопоказано применение протокола настройки РЕЕР (А)
9) Синхронизация больного с респиратором – использование седативной терапии и при тяжелом течении ОРДС непродолжительной (обычно, менее 48 часов) миоплегии, а не гипервентиляции (PaCO2 <35 мм рт.ст) (C). При тяжелом ОРДС допустима пермиссивная (допустимая) гиперкапния. Поддержание рН > 7,15.
10)Поддержание поднятого положения головного конца на уровне 30 - 45 градусов, для снижения риска аспирации и предотвращения развития вентилятор-ассоциированной пневмонии (ВАП) (В)
11)Большинству пациентов с ОРДС показана интубация трахеи и проведение инвазивной ИВЛ. Проведение неинвазивной вентиляции при помощи маски (НВЛ) при ОРДС показано определенным группам пациентов после тщательного рассмотрения преимуществ и рисков применения данного метода (В)
12)При выборе режима респираторной поддержки следует отдать предпочтении вспомогательным режимам вентиляции, в которых нет полностью аппаратных вдохов (D)
13)Соблюдение протокола отлучения пациента от аппарата ИВЛ – ежедневно необходимо оценивать критерии прекращения ИВЛ (C) (9).
3. Алгоритм параметров респираторной поддержки:
1) 1. Определите идеальную массу тела (ИМТ) для расчета дыхательного объема по формуле (для женщин): ИМТ (кг) = 45,5 + 0,91 × (Рост [cм] – 152,4) или ИМТ= 0,91 × рост (см) – 93,0, где:
• 45,5 – постоянная константа;
• 0,91 – постоянная константа;
• 152,2 – постоянная константа;
• 93,0 – постоянная константа.
2) Выберите режим вентиляции с заданным объемом;
3) Установите ДО (Vt) 8 мл/кг ИМТ, РЕЕР 5 см вод.ст., FiO2 40-100% для достижения SpO2 88-95%;
4) Установите ЧД (RR) для обеспечения минимально необходимого минутного объема дыхания (MVE) для достижения целевого значения PaCO2 (но не более 35/минуту для предотвращения высокого аутоРЕЕР);
5) Отрегулируйте скорость инспираторного потока (Flow) (обычный предел 40-80 л/мин) или инспираторное время (Tinsp) (обычный предел 0,8-1,3 сек) для предотвращения инверсного соотношения вдоха к выдоху (более 1 : 1,2);
6) Уменьшайте ДО (Vt) на 1 мл/кг каждые 2 часа до достижения Vt < или = 6 мл/кг ИМТ;
7) Настройте РЕЕР в соответствии с рекомендациями раздела «Настройка РЕЕР» (при наличии показаний и отсутствии противопоказаний) и/или примените маневр рекрутирования альвеол (перед настройкой РЕЕР);
8) У пациентов с потенциально высокой рекрутабельностью альвеол и относительно низким риском угнетения гемодинамики можно использовать маневры рекрутирования альвеол до применения протокола настройки РЕЕР;
9) При наличии противопоказаний к настройке РЕЕР, а также тяжелом ОРДС, можно использовать положение лежа на животе (прон-позицию);
10) По возможности, перейдите на вспомогательный режим вентиляции (в большинстве ситуаций – режим PSV) (4).
Настройка РЕЕР - метод открытия коллабированных альвеол (а следовательно, улучшения артериальной оксигенации) и предотвращения их коллапса (4)
Основной механизм гипоксемии при ОРДС - внутрилегочный шунт справа налево. Если в норме величина шунта составляет 3-5% от сердечного выброса, то у больных с ОРДС он может превышать 25%. Шунт формируется в результате перфузии затопленных экссудатом и спавшихся (ателектазированных) альвеол. Нормальной компенсаторной реакцией на альвеолярную гипоксию является гипоксическая легочная вазоконстрикция, но при ОРДС данная реакция недостаточна или отсутствует. Гипоксемия, в основе которой лежит шунт, не восприимчива к оксигенотерапии, даже с очень высокой фракцией О2 во вдыхаемой смеси (FiO2 ). В подобной ситуации для улучшения оксигенации в качестве основного метода используется создание положительного дополнительного давления в дыхательных путях. Это позволяет восстановить вентиляцию в невентилируемых легочных регионах и уменьшить шунт.
При выборе величины РЕЕР следует учитывать:
• потенциальную рекрутабельность альвеол;
• факторы, способствующие коллапсу альвеол извне (давление органов средостения, внутрибрюшное давление, внесосудистую воду легких, индекс массы тела).
Для оценки потенциальной рекрутабельности легких перед началом настройки РЕЕР следует ориентироваться на следующее:
• механизм повреждения легких (прямой или непрямой);
• срок от начала развития ОРДС;
• компьютерную томографию легких;
• статическую петлю «давление-объем»;
• измерение объема легких в конце выдоха (EELV) методом разведения азота или при помощи оценки статической петли «давление-объем» при разных уровнях РЕЕР;
• измерение внесосудистой воды легких (например, мониторинг PiCCO);
• оценку транспульмонального давления при помощи мониторинга пищеводного давления (9).
Основой оценки рекрутабельности альвеол является механизм повреждения и время от начала развития ОРДС:
• Пациенты с непрямым повреждением легких в ранней стадии ОРДС (1-7 дни) чаще всего имеют хороший потенциал для рекрутирования альвеол.
• При непрямом повреждении легких величина оптимального РЕЕР выше, чем при прямом повреждении.
Основным дополнительным методом оценки рекрутабельности альвеол является компьютерная томография (КТ) легких(15), которую следует выполнять всем пациентам с критериями ОРДС (при доступности метода и транспортабельности пациента). При преобладании гомогенного повреждения по типу «матового стекла» по данным КТ потенциал рекрутирования чаще высокий. Диагностика гомогенного повреждения альвеол возможна без компьютерной томографии – увеличение давление плато выше 25 мбар или снижение податливости респираторной системы менее 30 мл/мбар, наличие выраженной точки перегиба на статической петле «давление-объем» (более 10 мбар). Также критериями рекрутабельности альвеол являются повышенное внутрибрюшное давление (более 15 мм рт.ст.) и индекс массы тела более 27 кг/м2 .
Дополнительными критериями рекрутабельности являются:
• увеличение объема легких более чем на 500 мл при построении статической петли «давление-объем» с удержанием заданного давления (около 40 см вод.ст.) в течение 10-40 секунд
• увеличение EELV при увеличении РЕЕР выше ожидаемого прироста объема
• индекс внесосудистой воды легких менее 10 мл/кг
• нормальная податливость грудной стенки
• высокое давление в пищеводе (отрицательное транспульмональное давление на выдохе).
Пациентам с высокой рекрутабельностью (например, непрямое повреждение легких, ранняя стадия ОРДС) эффективен деэскалационный эмпирический метод настройки РЕЕР: от высокого (16-20 см вод.ст.) к более низкому с учётом гемодинамических показателей. У этих пациентов отрицательные гемодинамические эффекты обычно проявляются при РЕЕР выше 16 см вод.ст. Величина эффективного и относительно безопасного РЕЕР у пациентов с высокой рекрутабельностью составляет 12-16 мбар (14).
При внутрибрюшной гипертензии (давление в мочевом пузыре более12 мм рт.ст.) величина РЕЕР должна быть не ниже 10 мбар.
При индексе массы тела выше 30 кг/м2 величина РЕЕР должна быть не ниже 10-12 мбар. При сочетании высокой рекрутабельности и ожирения величина РЕЕР может составлять до 24 мбар.
Для пациентов с высоким потенциалом рекрутирования простым и достаточно точным методом настройки РЕЕР является таблица FiO2 /PEEP. В соответствии с ней установите соотношение между инспираторной фракцией кислорода (FiO2 ) и РЕЕР для достижения целевых значений PaO2 , используйте минимально достаточную комбинацию (9).
ТАБЛИЦА КОМБИНАЦИИ FIO2 /PEEP В СООТВЕТСТВИИ С РЕКРУТАБЕЛЬНОСТЬЮ АЛЬВЕОЛ:
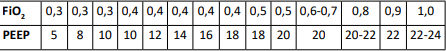
Низкий потенциал рекрутирования характерен для:
• прямого повреждения легких
• локального или негомогенного повреждения легочной ткани (ателектазы, пневмония) по данным КТ легких
• гомогенного повреждения по данным компьютерной томографии легких с преобладанием затемнений по типу «консолидации» с симптомом воздушной бронхограммы (бактериальная пневмония, вирусная пневмония)
• ОРДС в стадии фибропролиферации и фиброза (15).
Дополнительными критериями неэффективности и потенциальной опасности применения РЕЕР являются:
• отсутствие нижней точки перегиба на статической петле «давление-объем» или ее значение менее 10 мбар
• отсутствие увеличения EELV при увеличении РЕЕР выше ожидаемого прироста объема
• индекс внесосудистой воды легких более 10 мл/кг
• невысокое давление в пищеводе на выдохе (транспульмональное давление на выдохе больше нуля)
• сниженная податливость грудной стенки.
При низком потенциале рекрутирования (например, прямом повреждении легких - пневмонии, ушибе легких) пациентам достаточно эмпирического пошагового применения минимального установочного РЕЕР в режиме 5-8-10 мбар.
Противопоказания к применению PEEP при ОРДС относительны, так как в большинстве польза от применения PEEP превышает вред (12).
Абсолютные противопоказания:
• Недренированный пневмоторакс
• Буллезная эмфизема
• Бронхоплевральный свищ,
• Рефрактерная артериальная гипотензия или снижение АД при применении PEEP на 20 мм рт. ст. и более
• Жизнеугрожающие аритмии.
КРИТЕРИИ ПОЛОЖИТЕЛЬНОГО ЭФФЕКТА ОТ ПРИМЕНЕНИЯ PEEP:
1. Изменение аускультативной картины легких: равномерное проведение дыхательных шумов, появление дыхания над дорсальными отделами легких, исчезновение феномена инспираторного открытия легких, слышимого как задержка дыхательных шумов, исчезновение крепитирующих или влажных хрипов
2. Увеличение PaO2 /FiO2 или увеличение SpO2 (если нет возможности определить РаО2 )
3. Уменьшение PaCO2
4. Уменьшение площади и интенсивности инфильтративных теней на рентгенограмме
5. Увеличение статической податливости респираторной системы
6. Увеличение EELV выше ожидаемого.
Маневры рекрутирования альвеол - это кратковременное повышение давления и объема в респираторной системе для открытия коллабированных альвеол (14).
Показания:
• Начальная стадия вентиляции легких (концепция «открытых легких» - временное повышение давления в дыхательных путях для открытия альвеол (рекрутмент) и установление оптимального РЕЕР для сохранения легких открытыми с помощью РЕЕР)
• после инвазивных манипуляций (санации трахеобронхиального дерева, реинтубации трахеи, трахеостомии, бронхоскопии)
• при развитии ателектаза легкого.
ОСНОВНЫЕ МЕТОДЫ РЕКРУТИРОВАНИЯ АЛЬВЕОЛ
1. Длительное раздувание/удержание постоянного давления в дыхательных путях (как правило, 40 мбар, в течение 40 сек).
2. Кратковременное (до 2 минут) одновременное увеличение РЕЕР до 20 мбар иинспираторного давления до 40-50 мбар. (в режиме вентиляции с управляемым давлением).
3. Пошаговое (по 5 мбар каждые 2 минуты) одновременное увеличение РЕЕР (с 20 до 40 мбар) и Pinsp (с 40 до 60 мбар).
4. Вздохи (периодическая доставка увеличенного дыхательного объема).
5. Медленный умеренный маневр (создание инспираторной паузы на 7 секунд дважды в минуту в течение 15 минут при РЕЕР=15 мбар) (12).
Профилактика
ОБЩИЕ ПОДХОДЫ К ПРОФИЛАКТИКЕ
ИНДИВИДУАЛЬНЫЕ МЕРЫ ПРОФИЛАКТИКИ
1. «Этикет кашля» – во время кашля и/или чихания прикрывать нос и рот салфеткой, которую следует сразу выкинуть в мусор!
2. Частое мытье рук с мылом и водой, особенно после того, как пациентка покашляла или чихнула.
3. Избегать касания руками глаз, носа, рта.
4. Избегать близкого контакта с больными людьми, объятий, рукопожатий, поцелуев.
5. Ограничивать контакты с другими людьми, если Вы больны.
СПЕЦИФИЧЕСКАЯ ПРОФИЛАКТИКА
Беременные женщины, которые независимо от беременности попадают в группу риска по сезонному гриппу, должны быть провакцинированы перед началом эпидемии независимо от срока беременности. Безопасность инактивированной вакцины против гриппа была доказана при вакцинации беременных на разных сроках гестации (48). При введении в течение 7 лет 2291 дозы инактивированной вакцины против гриппа беременным пациенткам не наблюдалось никакого существенного увеличения неблагоприятных реакций среди матерей или младенцев.
Исследование показало, что вакцинация беременных против гриппа привела к уменьшению частоты развития респираторных заболеваний с лихорадкой на 29% среди грудных детей и на 36% среди матерей.
Предназначение рекомендаций ВОЗ по сезонному гриппу – защитить уязвимые группы высокого риска от тяжелых форм заболевания (36). В 2012 г. под эгидой ВОЗ был опубликован документ с изложением позиции в отношении вакцинации против гриппа, в котором беременные женщины определены в качестве приоритетной группы для стран, планирующих внедрение или расширение программ вакцинации против сезонного гриппа. Вакцинация беременных женщин призвана предохранить от гриппа не только мать, но и младенца, поскольку лицензированной вакцины для детей в возрасте до 6 месяцев не имеется (37). Вакцинация беременных против гриппа безопасна и доказала свою эффективность на практике, обеспечив профилактику лабораторно подтвержденных случаев гриппа у 35−70% матерей и 28−61% младенцев в возрасте до 6 месяцев (36).
СРОКИ ПРОВЕДЕНИЯ ВАКЦИНАЦИИ ВО ВРЕМЯ БЕРЕМЕННОСТИ
Согласно рекомендациям ВОЗ, вакцинация может проводиться на любом сроке беременности для формирования иммунной защиты матери и ее будущего ребенка. В основе этой рекомендации лежат два соображения: вакцинация на ранних сроках беременности полезна для женщины, а иммунизация во II и III триместрах беременности максимально увеличивает защиту новорожденного (39). Оптимальное время проведения вакцинации беременных против гриппа – непосредственно перед началом эпидемического сезона, чтобы обеспечить защиту от инфекции во время сезонного подъема заболеваемости. Достаточно однократного инъекционного введения вакцины.
Выводы:
1. Беременные женщины и женщины после родов подвергаются более высокому риску тяжелого течения гриппа и его осложнений, чем женщины, которые не беременны.
2. Вакцинация против гриппа рекомендуется всем беременным женщинам, независимо от сроков беременности, а также женщинам, планирующим беременность до и во время сезона гриппа. Кроме того, материнское антитело продолжает защищать новорожденного в первые несколько месяцев жизни.
3. Можно использовать любую лицензированную, рекомендуемую и подходящую по возрасту вакцину против гриппа.
Основная информация о гриппе, которая должна быть предоставлена беременным женщинам медицинским работником, оказывающем дородовое наблюдение:
• Беременные женщины и их дети подвергаются повышенному риску тяжелого гриппа и осложнений.
• Вакцинация против гриппа во время беременности должна быть обычной – безопасность и преимущества вакцинации против гриппа во время беременности хорошо известны.
• Беременным женщинам и недавно родившим женщинам следует обратиться за помощью на ранних стадиях развития гриппоподобных симптомов: как можно раньше начатое лечение противогриппозными препаратами может предотвратить серьезные осложнения.
• Беременным женщинам и недавно родившим женщинам следует соблюдать и практиковать хороший респираторный этикет и гигиену рук и держать себя и своих детей подальше от других больных, особенно больных кашлем.
Информация
Источники и литература
-
Клинические протоколы Министерства здравоохранения Кыргызской Республики
- Клинические протоколы Министерства здравоохранения Кыргызской Республики - 1. Rubenfeld GD Cadwell EPeabody Eetal Incidence and outcomes of acute lung injury. N Engl J Med, 2005;353:1685-1693. 2. Ware LB, Matthay MA. The Acute respiratory distress syndrome.NEnglJMed 2000; 342: 1301-1308. 3. Кассиль В.Л., Выжигина М. А., Лескин Г. С.. Искусственная и вспомогательная вентиляция легких. Санкт–Петербург, Медицина, 2004, 480с. 4. Острый респираторный дистресс-синдром. Практическое руководство. Под ред. Б.Р. Гельфанда, В.Л. Кассиля. Москва, Литература, 2007, 232с. 5. Atabai K, Matthay MA et al. The pulmonary physician in critical care: Acute lung injury and acute respiratorydistress syndrome: definitions and epidemiology. Thorax 2002; 57: 452-458. 6. Власенко А. В., А. М. Голубев, В. В. Мороз, В. Н. Яковлев, В. Г. Алексеев, Н. Н. Булатов, А. М. Смелая. Патогенез и дифференциальная диагностика острого респираторного дистресс - синдрома, обусловленного прямыми и непрямыми этиологическими факторами. Общая реаниматология 2011;VII (3): 5-13. 7. Michard F, Fernandez-Mondejar E, Kirov MY, Malbrain M, Tagami T. A new and simple definition for acute lunginjury.Crit Care Med 2012; 3: 1004-1006. 8. Mutoh T et al. Volume infusion produces abdominal distension, lung compression and chest wall stiffening inpigs. J ApplPhysiol 1992; 72(2):575-82. 9. Malbrain et al. Incidence and prognosis of intraabdominal hypertension in mixed population of critically illpatients: a multiple-center epidemiological study. Crit Care Med 2005; 33: 315-323. 10. Malbrain et al. Prevalence of IAH in critically ill patients: a multicentre epidemiological study. Intensive CareMed 2004; 30(5): 822-9. 11. Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, Caldwell E, Fan E, Camporota L, Slutsky AS. Acuterespiratory distress syndrome: the Berlin definition. JAMA 2012; 307(23): 2526-33. 12. Murray JF, Matthay MA, Luce JM et al. An expanded definition of the adult respiratory distress syndrome.AmRevRespirDis 1988;138:720-3;erratum 1989;139:1065. 13. Власенко А. В., А. М. Голубев, В. В. Мороз, В. Н. Яковлев, В. Г. Алексеев, Дифференцированное лечение острого респираторного дистресс - синдрома. Общая реаниматология 2011;VII (4): 5-14. 14. ChatburnR. L. Fundamentals of mechanical ventilation. Cleveland Ohio, Mandu Press Ltd, 2003. 15. Грицан А.И., Газенкампф А.А., Довбыш Н.Ю. Анализ применения вентиляции легких, контролируемой по объему и по давлению, у больных с ишемическим инсультом. Вестник анестезиологии и реаниматологии 2012; №6: 33-40. 16. Antonelli M etal. Predictors of failure of a noninvasive positive pressure ventilation in patients with acutehyperemic respiratory failure: a multicenter study. Intensive Care Med 2001; 27(11): 1718-1728. 17. Antonelli M et al. A multiple-center survey on the use in clinical practice of noninvasive ventilation as a first-lineintervention for acute respiratory distress syndrome.Crit Care Med 2007; 35(1):18-25. 18.Demoule A et al. Benefits and risks of success or failure of noninvasive ventilation. Intensive Care Med 2006;32 (11): 1756-1765. 19. Confalonieri M et al. NIV for treating acute respiratory failure in AIDS patients with pneumocystis cariniipneumonia. Intensive Care Med 2002; 28: 1233-1238. 20. Squadrone V et al. Early CPAP prevents evolution of acute lung injury in patients with hematologic malignancy.Intensive Care Med 2010; 36(10): 1666-1674. 21.Gristina G et al. Noninvasive ventilation for acute respiratory failure in patients with hematologic malignancies:a 5-year multicenter observational survey. Cait Care Med 2011; 39(10): 2232-2239. 22. The Acute Respiratory Distress Syndrome Network. Ventilation with lower tidal volumes as compared withtraditional tidal volumes for acute lung injury and acute respiratory distress syndrome. N Engl J Med 2000; 342:1301-1308. 23. www.ardsnet.org/system/files/6mlcardsmall_2008update_final_JULY2008.pdf. 24.Gattinoni L et al. Lung recruitment in patients with ARDS.N Engl J Med 2006; 354: 1775-1786. 25. Храпов К.Н. Респираторная поддержка при тяжелой пневмонии. Диссертация на соискание ст. доктора медицинских наук, Санкт-Петербург, 2011. 26. Ярошецкий А.И., Проценко Д.Н., Ларин Е.С., Гельфанд Б.Р. Роль оценки статической петли «давление-объем» в дифференциальной диагностике и оптимизации параметров респираторной поддержки при паренхиматозной дыхательной недостаточности. Анестезиология и реаниматология, 2014, №2, с,21-26. 27. Власенко А. В., Мороз В. В., Яковлев В. Н., Алексеев В. Г., Булатов Н.Н. Выбор способа оптимизации ПДКВ у больных с острым респираторным дистресс - синдромом, развившемся вследствие воздействия прямых и непрямых повреждающих факторов. Общая реаниматология 2012; VIII (1): 13-21. 28.Goodman et al. ARDS due to pulmonary and extrapulmonary causes: CT, clinical and functional correlations:Radiology 1999;213:545-552. 29.Gattinoni L et al. ARDS caused by pulmonary and extrapulmonary disease: different syndromes. AmJRespirCritCareMed 1998; 158: 3-11. 30. Ярошецкий А.И., Проценко Д.Н., Ларин Е.С., Гельфанд Б.Р.. Роль оценки статической петли «давление-объем» в дифференциальной диагностике и оптимизации параметров респираторной поддержки при паренхиматозной дыхательной недостаточности. Анестезиология и реаниматология, 2014,№2, с.21-26. 31. Райбужис Е.Н., Сметкин А.А., Гайдуков К.М., Киров М.Ю. Внутрибрюшная гипертензия и абдоминальный компартмент-синдром: современные представления о диагностике и лечении. Вестник анестезиологии и реаниматологии 2010; 7(4): 14-21. 32. Ярошецкий А.И., Проценко Д.Н., Резепов Н.А., Гельфанд Б.Р.. Настройка положительного давления конца выдоха при паренхиматозной ОДН: статическая петля «давление-объем» или транспульмональное давление? Анестезиология и реаниматология 33.Jonson Betal PV curves and compliance in ALI: evidence of recruitment above LIP. Am J Respir Crit Care Med 1999; 159: 1172-8. 34.Dellamonica J et al. PEEP-induced changes in lung volume in ARDS. Twomethodstoestimate alveola recruitment. Intensive Care Med 2011; 37: 1595-1604. 35.Нахамчен Л.Г. «Функция внешнего дыхания во время беременности у здоровых женщин и с неспецифическими заболеваниями органов дыхания» - Бюллетень Сибирского отд. АМН. - 2001- выпуск 8 – стр. 64-69. 36. «Как обеспечить вакцинацию беременных женщин против гриппа» - Вводное пособие для руководителей здравоохранения и менеджеров национальных программ иммунизации - Всемирная организация здравоохранения, 2016 г. 37.Neuzil KM, Reed GW, Mitchel EF, Simonsen L, Griffin MR. Impact of influenza on acute cardiopulmonary hospitalizations in pregnant women. Am J Epidemiol. 1998; 148:1094–102. 38. World Health Organization. Vaccines against influenza WHO position paper – November 2012.Wkly Epidemiol Rec. 2012; 87:461–76. 39. Madhi SA, Cutland CL, Kuwanda L, Weinberg A, Hugo A, Jones S, et al. Influenza vaccination of pregnant women and protection of their infants. The New England journal of medicine Рекомендации Европейского регионального бюро ВОЗ по вакцинации против гриппа в зимний сезон, Сентябрь 2016 г. – Всемирная организация здравоохранения, 2016 г. 40. Van Kerkhove M.D., Vandemaele K.A., Shinde V., Jaramillo Gutierrez G., Koukounari Aatall Risk factors for severe outcomes following 2009 influenza A (H1N1) infection: a global pooled analysis. PLoS Med. 2011 July; 8(7): e100105. 41. Lim Boon H., Mahmood Tahir A. Influenza A H1N1 2009 (Swine Flu) and Pregnancy. 2010. United Kingdom Obstetric Surveillance System (UKOSS). 42. Киселев О. И. Сологуб Т. В. «Грипп у беременных», Клиническое руководство. – Москва 2015г. – 103с. 43. Colette Kanellopoulos-Langevin, Stéphane M Caucheteux, Philippe Verbeke, David M Ojcius. Tolerance of the fetus by the maternal immune system: role of inflammatory mediators at the fetomaternal interface. Reprod Biol Endocrinol. 2003; 1: 121. 44.Jain S1, Kamimoto L, Bramley AM, Schmitz AM, Benoit SR, Louie J and al. Hospitalized patients with 2009 H1N1 influenza in the United States, April-June 2009. N Engl J Med. 2009 Nov 12;361(20):1935-44. 45. The ANZIC Influenza Investigators. Critical Care Services and 2009 H1N1 Influenza in Australia and New Zealand. N Engl J Med 2009; 361:1925-1934. 46. P. Shears, C. Sluman, D. Harvey. Sever bacterial sepsis associated with influenza: antimicrobial management in adults – clinical guideline, v2. 2012. 47. Englund J. A. Maternal immunization with inactivated influenza vaccine: rationale and experience // Vaccine. 2003; 21: 3460–3464. 48. CDC. Prevention and control of influenza: recommendations of the Advisory Committee on Immunization Practices (ACIP) // MMWR. 2004; 53 (№ RR-6). 49.Информационно-методическое письмо «Грипп и вызванная им пневмония у беременных: этиотропная и респираторная терапия, акушерская тактика, профилактика», - Москва, Министерство Здравоохранения Российской Федерации, 28 декабря 2016г. 50. Мусуралиев М.С. ОРДС – взрослых в акушерской практике/Центрально-Азиатский мед. журнал, 2011, №1, Том ХУ11, Прилож. 1, с 89. 51. Грипп и вызванная им пневмония у беременных: этиотропная и респираторная терапия, акушерская тактика, профилактика – информационно-методическое письмо, Министерство здравоохранения Российской Федерации – 28.12.2016г. 52. Influenza and pregnancy - guidance for clinicians fact sheet; http://www. health.nsw.gov.au/Infectious/factsheets/Pages/Influenza-pregnancy-info-forclinicians.aspx. 53.Doyle TJ, Goodin K, Hamilton JJ. Maternal and neonatal outcomes among pregnant women with 2009 pandemic influenza A(H1N1) illness in Florida, 2009-2010: a population-based cohort study. 54. Tamma PD et al. Expert Reviews in Respiratory Medicine, 2010: 4(3). 55. McNeil et al. Am J Obstets Gynecol 2011: 204. 56.Haberg et al. NEJM 2013; 368:333-40. 57. The New England journal of medicine Рекомендации Европейского регионального бюро ВОЗ по вакцинации против гриппа в зимний сезон Сентябрь 2016 г. – Всемирная организация здравоохранения, 2016 г. 58. Van Kerkhove M.D., Vandemaele K.A., Shinde V., Jaramillo Gutierrez G ., Koukounari Aatall. Risk factors for severe outcomes following 2009 influenza A (H1N1) infection: a global pooled analysis. PLoS Med. 2011 July; 8(7): e100105. 59. Lim Boon H., Mahmood Tahir A. Influenza A H1N1 2009 (Swine Flu) and Pregnancy. 2010. United Kingdom Obstetric Surveillance System (UKOSS). 60. Киселев О. И. Сологуб Т. В. «Грипп у беременных», Клиническое руководство. – Москва 2015г. – 103с. 61. Colette Kanellopoulos-Langevin, Stéphane M Caucheteux, Philippe Verbeke, David M Ojcius. Tolerance of the fetus by the maternal immune system: role of inflammatory mediators at the fetomaternal interface. Reprod Biol Endocrinol. 2003; 1: 121. 62.Jain S1, Kamimoto L, Bramley AM, Schmitz AM, Benoit SR, Louie J and al. Hospitalized patients with 2009 H1N1 influenza in the United States, April-June 2009. N Engl J Med. 2009 Nov 12;361(20):1935-44. 63. The ANZIC Influenza Investigators. Critical Care Services and 2009 H1N1 Influenza in Australia and New Zealand. N Engl J Med 2009; 361:1925-1934. 64. P. Shears, C. Sluman, D. Harvey. Sever bacterial sepsis associated with influenza: antimicrobial management in adults – clinical guideline, v2. 2012. 65. Englund J. A. Maternal immunization with inactivated influenza vaccine: rationale and experience // Vaccine. 2003; 21: 3460–3464. 66. CDC. Prevention and control of influenza: recommendations of the Advisory Committee on Immunization Practices (ACIP) // MMWR. 2004; 53 (№ RR-6). 67.Информационно-методическое письмо «Грипп и вызванная им пневмония у беременных: этиотропная и респираторная терапия, акушерская тактика, профилактика», - Москва, Министерство Здравоохранения Российской Федерации, 28 декабря 2016г. 68. Мусуралиев М.С. ОРДС – взрослых в акушерской практике/Центрально-Азиатский мед. журнал, 2011, №1, Том ХУ11, Прилож. 1, с 89. 69. Грипп и вызванная им пневмония у беременных: этиотропная и респираторная терапия, акушерская тактика, профилактика – информационно-методическое письмо, Министерство здравоохранения Российской Федерации – 28.12.2016г. 70. Influenza and pregnancy - guidance for clinicians fact sheet; http://www. health.nsw.gov.au/Infectious/factsheets/Pages/Influenza-pregnancy-info-forclinicians.aspx. 71.Doyle TJ, Goodin K, Hamilton JJ. Maternal and neonatal outcomes among pregnant women with 2009 pandemic influenza A(H1N1) illness in Florida, 2009-2010: a population-based cohort study. 72. Tamma PD et al. Expert Reviews in Respiratory Medicine, 2010: 4(3). 73. McNeil et al. Am J Obstets Gynecol 2011: 204. 74.Haberg et al. NEJM 2013; 368:333-40.
Информация
Рабочая группа по разработке протокола:
Мамбеталиева Д.С. – руководитель рабочей группы, зав. отделением анестезиологии и реанимации, Перинатальный центр г. Бишкек, ассистент кафедры реанимации и анестезиологии КГМИПиПК. Стакеева Ч.А. – зав. отделом сексуального и репродуктивного здоровья КГМИПиПК, к.м.н. Кийизбаева Л.Э. – зав. отделением анестезиологии и реанимации, родильный стационар Чуйской областной объединенной больницы. Барыктабасова Б.К. – консультант Министерства здравоохранения по вопросам доказательной медицины и методологии разработки клинических руководств и протоколов, к.м.н.
Внешний эксперт:
Миндаугас Шерпутис – доцент кафедры анестезиологии и реанимации медицинского факультета Вильнюсского университета, специалист-консультант анестезиологии и реаниматологии Министерства здравоохранения Литовской Республики, заведующий отделением реанимации и интенсивной терапии больницы Вильнюсского университета Santaros klinikos. Стелиан Ходороджа - доцент кафедры акушерства и гинекологии, Государственный университет медицины и фармации «Николае Тестемицану», международный эксперт ВОЗ. Чу Руфь – врач акушер-гинеколог, Институт научных технологий и языков, международный консультант.
Внутренний эксперт:
Бошкоев Ж.Б. – анестезиолог-реаниматолог, д.м.н., проф. Мусуралиев М.С. – зав. кафедрой акушерства и гинекологии, КГМА, д.м.н., проф.
Адрес для переписки с рабочей группой:
Кыргызская Республика,
г. Бишкек, ул. Тоголок Молдо, 1,
720040.
Тел. +996 (312) 66-27-98,
+996 (312) 62-18-29.
Выражается глубокая признательность Фонду ООН в области народонаселения (ЮНФПА) в Кыргызской Республике за оказанное техническое и методическое содействие при разработке и внедрении протокола.
СПИСОК СОКРАЩЕНИЙ



СЛОВАРЬ ТЕРМИНОВ
Альвеолы – пузырьковидное образование в легком, оплетенное сетью капилляров. Через стенки альвеол (в легких человека их св. 700 млн) происходит газообмен
Аспирационная пневмония - воспаление лёгких, возникающее при вдыхании или пассивном попадании в лёгкие различных веществ в массивном объёме, чаще всего в практике – рвотных масс. Воспаление возникает через специфические свойства субстанций, вызывающих сильные воспалительные реакции.
Бронхиолы – конечные мельчайшие разветвления бронхов в легочных дольках, не содержащие хряща и переходящие в альвеолярные ходы легких.
Висцеральный листок плевры – листок плевры, прилегающий к легким.
Воздухоносные пути – система полостей и трубок, включающая носовую полость, гортань, трахею и заканчивающаяся терминальными бронхиолами.
Гипоксемия – снижение содержания кислорода в артериальной крови.
Инфильтрация – аномальное просачивание вещества (инфильтрата - infiltrate) внутрь клетки, ткани или органа.
Газообмен – совокупность процессов, обеспечивающих поступление в организм кислорода и удаление углекислого газа (внешнее дыхание).
Гипоксия – недостаточная насыщенность крови кислородом.
Диафрагма – сухожильно-мышечная перегородка, отделяющая грудную от брюшной полости; участвует в дыхательных движениях: при вдохе опускается, при выдохе поднимается.
Дыхание – окисление органических веществ с освобождением энергии, необходимой для их жизнедеятельности (тканевое дыхание).
Дыхательные мышцы – мышцы, обеспечивающие акты вдоха и выдоха (диафрагма, внешние межреберные, внутренние межреберные мышцы и др.)
Дыхательный объем – объем воздуха, который поступает легкие при спокойном и здоровом вдохе (около 500 мл).
Жизненная емкость легких – количество воздуха, которое можно выдохнуть после максимального вдоха. ЖЕЛ включает дыхательный объем, резервный объем вдоха (дополнительный воздух) и резервный объем выдоха (резервный воздух). В среднем ЖЕЛ человека 3500 мл.
Мертвое пространство – объем воздуха дыхательных путей, в котором не происходят процессы газообмена.
Минутный объем – произведение дыхательного объема на число дыхательных движений в минуту. У взрослого человека в среднем 6-8 литров в минуту, при физической нагрузке до 250 литров в минуту.
Остаточный объем – воздух, который остается в легких после максимального выдоха.
Париетальный листок плевры – листок плевры, прилегающий к стенке полости грудной клетки.
Парциальное давление – давление газа, которое приходится на его долю от общего давления смеси газов. Оно пропорционально содержанию каждого газа в смеси.
Плевра – серозная оболочка, плотно покрывающая легкие и выстилающая изнутри грудную полость.
Плевральная полость – полость между двумя листками плевры, герметично замкнутая, заполненная плевральной жидкостью.
Реперфузия – восстановление кровяного тока к органам или тканям, которые ранее были лишены кровоснабжения.
Пневмоторакс – скопление воздуха или газов в полости плевры. Самопроизвольный (спонтанный) пневмоторакс возникает при разрыве легочных альвеол (туберкулез, эмфизема легких); травматический пневмоторакс – при повреждении грудной клетки.
Сурфактант – вещество, выстилающее внутреннюю поверхность альвеол, имеющее низкое поверхностное натяжение, обеспечивающее расширение альвеол при вдохе и противодействующее спаданию их при выдохе. Сурфактант обладает бактерицидными свойствами.
ФОЕ – функциональная остаточная емкость: представляет собой объем газа, который остается в легких после спокойного выдоха.
Частота дыхания – число циклов дыхательных движений в минуту.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.