Детский церебральный паралич
ДЦП
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Детский церебральный паралич (G80)
Неврология, Неврология детская
Общая информация
Краткое описание
Одобрено
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «15» декабря 2023 года
Протокол №199
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
ЦЕРЕБРАЛЬНЫЙ ПАРАЛИЧ
Церебральный паралич (ЦП) – термин ЦП описывает группу нарушений развития движений и положений тела, вызывающих ограничения активности, которые вызваны непрогрессируюшим поражением развивающегося мозга плода или младенца. Двигательные расстройства часто сопровождаются дефектами чувствительности, когнитивных, коммуникативных функций, восприятия и/или поведенческими, и/или судорожными нарушениями.
ВВОДНАЯ ЧАСТЬ
Код(ы) МКБ-10:
Дата разработки/пересмотра протокола: 2017 год (пересмотр 2023 год)
Категория пациентов: дети.
Сокращения, используемые в протоколе:
Шкала уровня доказательности:
Церебральный паралич (ЦП) – термин ЦП описывает группу нарушений развития движений и положений тела, вызывающих ограничения активности, которые вызваны непрогрессируюшим поражением развивающегося мозга плода или младенца. Двигательные расстройства часто сопровождаются дефектами чувствительности, когнитивных, коммуникативных функций, восприятия и/или поведенческими, и/или судорожными нарушениями.
ВВОДНАЯ ЧАСТЬ
Код(ы) МКБ-10:
|
Код
|
Название |
| G80.0 | Спастический церебральный паралич, квадриплегия |
| G80.1 | Спастический церебральный паралич, диплегия |
|
G80.2
|
Спастический церебральный паралич, гемиплегия |
| G80.3 | Дискинетический церебральный паралич |
|
G80.4
|
Атаксический церебральный паралич |
| G80.8 | Другой вид церебрального паралича |
| G80.9 | Церебральный паралич неуточненный |
Дата разработки/пересмотра протокола: 2017 год (пересмотр 2023 год)
Пользователи протокола: врачи общей практики, педиатры, детские неврологи, неонатологи, врачи физической медицины и реабилитации (ФМР), детские нейрохирурги.
Категория пациентов: дети.
Сокращения, используемые в протоколе:
|
РКИ
|
Рандомизированные клинические исследования
|
|
GMFCS
|
Классификации больших моторных функций |
|
GMFM
|
Балльная шкала измерения больших моторных функций |
|
ЗВУР
|
Задержка внутриутробного развития плода |
|
ЦП
|
Церебральный паралич |
|
GMA
|
Общая оценка движений |
|
ФМР
|
Физическая медицина и реабилитация |
|
MACS
|
Система классификации мануальной способностей |
|
КТ
|
Компьютерная томография |
|
МРТ
|
Магнитно-резонансная томография |
|
ЭЭГ
|
Электроэнцефалография |
|
СМА
|
Спинальная мышечная атрофия |
|
MLPA
|
Мультиплексная амплификация зонда,зависимая от лигирования |
|
КФК
|
Кератинфосфокиназа |
|
ИРТ
|
Иглорефлексотерапия |
|
ЛФК
|
Лечебная физическая культура |
|
АСТ
|
Аспартатаминотрансфераза |
|
АЛТ
|
Аланинаминотрансфераза |
|
ЭНМГ
|
Электронейромиография |
|
ЛДГ
|
Лактатдегидрогеназа |
|
УЗИ
|
Ультразвуковое исследование |
|
ЭКГ
|
Электрокардиография |
|
ЭхоКГ
|
Эхокардиография |
| ЦП | Церебральный паралич |
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
Классификация
Классификация [3,4]:
Рекомендуемая к использованию в клинической практике классификация основывается на типе двигательных нарушений.
спастическая;
дискинетическая;
атактическая формы.
Спастическая форма наиболее часто встречающаяся форма (80% от количества наблюдаемых с ЦП). Термин двусторонний спастический паралич используется при описании таких часто вызывающих путаницу определений как диплегия, тетраплегия, двойная гемиплегия и квадриплегия, имеющих разное значение в разных странах. Рекомендуемый возраст для классификации церебрального паралича на подтипы не моложе 4-5 лет [4].
GMFCS (Gross Motor Function Classification System) Система классификации больших моторных функций – важный инструмент классификации и прогноза будущих двигательных функций [5] (приложение 1).
Система классификации больших моторных функций – важный инструмент классификации и прогноза будущих двигательных функций [5] (приложение 1).
GMFM (Gross Motor Function Measure) - балльная шкала измерения больших моторных функций (приложение 1). Используется для определения инвалидности.
Шкала Ашфорта (Ashworth) – степень выраженности спастичности (приложение 1)
Barthel Activities of Daily Living Index (Индекс активности повседневной жизнедеятельности Бартела) модифицированный – оценка навыков самообслуживания и степени независимости (приложение 1)
WeeFim (Functional independence measure, FIM) – модифицированная оценка функциональной независимости (приложение 1)
MACS (The Manual Ability Classification System) – шкала функционирования верхних конечностей (приложение 1)
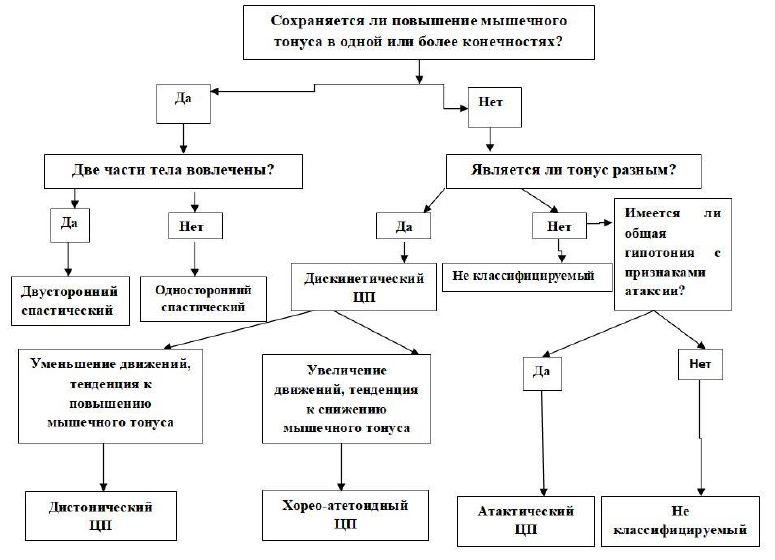
Классификация подтипов церебрального паралича, рекомендуемая Наблюдательным комитетом за церебральным параличом в Европе (Surveillance of Cerebral Palsy in Europe, 2000).
GMA - анализ общих движений (метод Прехтла), используется с прогностической целью двигательных нарушении.
GMFCS (Gross Motor Function Classification System) Система классификации больших моторных функций – важный инструмент классификации и прогноза будущих двигательных функций [5] (приложение 1).
Неврологическая оценка по шкале Хамерсмит (HINE) (приложение 1)
Система классификации больших моторных функций – важный инструмент классификации и прогноза будущих двигательных функций [5] (приложение 1).
GMFM (Gross Motor Function Measure) - балльная шкала измерения больших моторных функций (приложение 1). Используется для определения инвалидности.
Шкала Ашфорта (Ashworth) – степень выраженности спастичности (приложение 1)
Barthel Activities of Daily Living Index (Индекс активности повседневной жизнедеятельности Бартела) модифицированный – оценка навыков самообслуживания и степени независимости (приложение 1)
WeeFim (Functional independence measure, FIM) – модифицированная оценка функциональной независимости (приложение 1)
MACS (The Manual Ability Classification System) – шкала функционирования верхних конечностей (приложение 1)
Классификация подтипов церебрального паралича, рекомендуемая Наблюдательным комитетом за церебральным параличом в Европе (Surveillance of Cerebral Palsy in Europe, 2000).

Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ [5,6]
Диагностические критерии:
Жалобы: основной жалобой является задержка развития двигательных функций (не держит голову, не сидит, не переворачивается, не стоит (в соответственный временной промежуток).
Анамнез: Факторы риска – события или обстоятельства, увеличивающие риск возникновения травмы или пороков развития, приводящие к церебральному параличу.
Важно! Присутствие факторов риска не всегда означает, что ребенок разовьет церебральный паралич. Это означает, что шансы возникновения ЦП выше, чем, если бы они отсутствовали. С другой стороны, отсутствие факторов риска не гарантирует, что у ребенка не разовьётся церебральный паралич. Важно не создавать излишней тревоги или усиленного наблюдения за детьми, имеющие указанные факторы риска, если они нормально развиваются. Знание факторов риска может помочь в предотвращении, эффективном лечении и управлении рисками.
Факторы риска:
Факторы риска:
низкий вес при рождении (48,4 на 1000 рожденных с весом менее 1500 г в сравнении с 1.1 на 1000 у детей с весом более 2500 г);
многоплодная беременность повышает риск в 4 раза [5];
ЗВУР и переношенность при одноплодной беременности и при многоплодной после 32 недель[6].
Причины ЦП от 20 недель гестации и неонатальном периоде (анамнестические данные)
|
Факторы предрасположенности
|
Острые и подострые факторы | Постнатальные факторы |
|
Недоношенность
|
Гипоксия-ишемия | Хроническая гипоксия |
|
ЗВУР
|
Инфекции | Лекарственные препараты |
|
Сосудистые заболевания во время беременности
|
Воспаление | Питание |
| Дефицит гормонов | Разделение матери и ребенка | |
| Дефицит факторов роста | Социально-экономический уровень | |
| Токсины | ||
| Стресс |
Методы оценки риска развития церебрального паралича у детей до 2 лет.
Оценка общих движений:
бедный репертуар до 50 недель;
отсутствие фиджети к 48-56 неделе.
Шкала Хаммерсмит:
Оптимальные баллы:
3 месяца-67 баллов;
6 месяцев – 70 баллов;
>9 месяцев – 73 баллов.
необычные движения или другие аномальные движения, включающие асимметрию или скудность движения;
аномальный тонус, включающий гипотонию, спастичность или дистонию (флюктуирующий/изменяющийся тонус);
аномальное моторное развитие, включающий поздний контроль головы, фиксацию взора, симметричность аксиального тонуса;
проблемы кормления.
После 2 лет детям проводиться неврологический осмотр, так же как у взрослых.

Если замечены вышеперечисленные признаки необходимо направить ребенка для срочной диагностики на церебральный паралич.
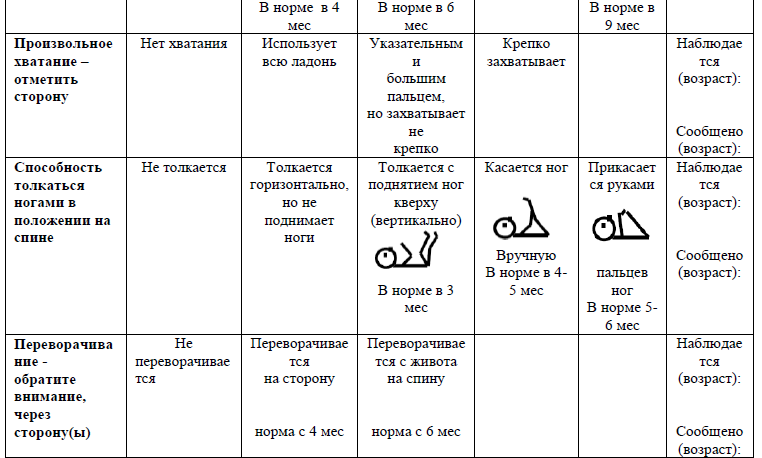
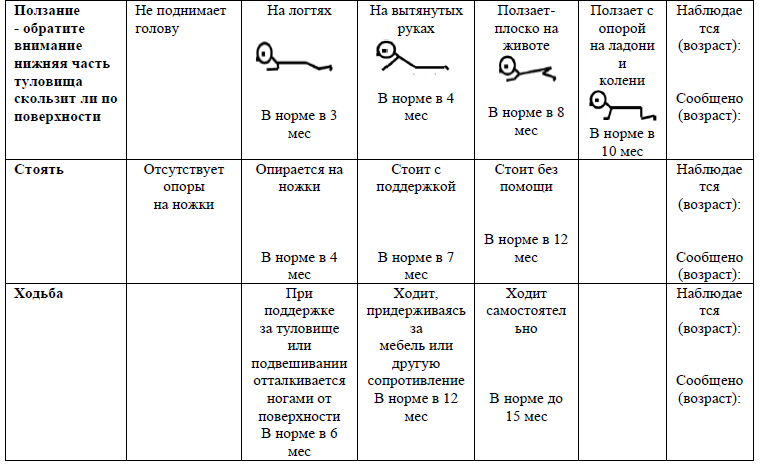
Наиболее распространенными отсроченными моторными навыками у детей с церебральным параличом являются:
не сидящие в 8 месяцев (с коррекцией гестационного возраста);
не ходящие в 18 месяцев (с коррекцией для гестационного возраста);
ранняя асимметрия функции руки (предпочтение руки) до 1 года (с коррекцией для гестационного возраста).
После 2 лет детям проводиться неврологический осмотр, так же как у взрослых.

Физикальное обследование:
повышение мышечного тонуса в одной или более конечностях;
клонус;
патологический симптом Бабинского;
расширение рефлексогенных зон;
повышение сухожильных рефлексов.
Лабораторные исследования: не информативны.
Инструментальные исследования:
краниальное УЗИ – первый скрининговый метод.
Необходим открытый родничок.
КТ головы – низкая чувствительность к корковым повреждениям, высокая радионагрузка. Метод выбора для визуализации - кальцинатов, не требует седации, быстро выполняется.
МРТ - «золотой стандарт» с высокой разрешающей способностью. При отсутствии изменении на МРТ необходимо продолжить диагностический поиск других заболевании ассоциированных с двигательными расстройствами. Провести метаболические и генетические исследования.
ЭЭГ исследования проводятся только в случае наличия судорог и результаты соответствуют виду судорог.
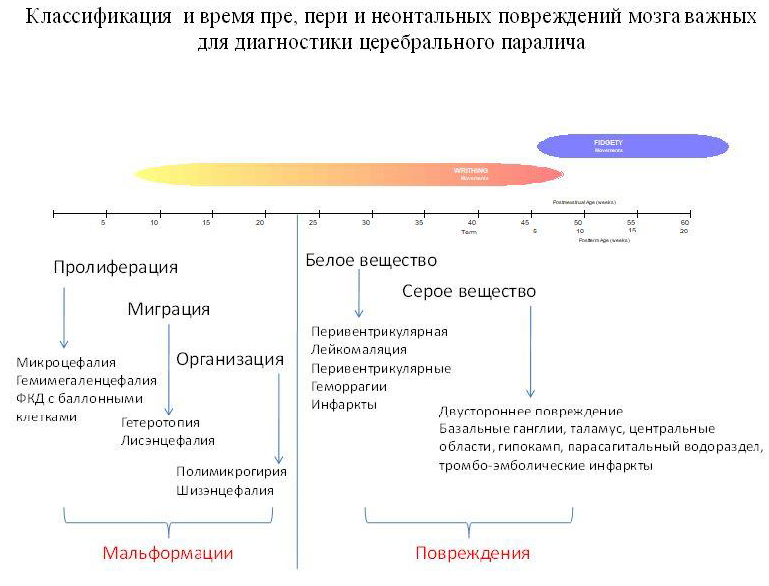
Форма ЦП и нейрорадиологическим находкам в зависимости от периода воздействия повреждающего фактора
| Время повреждения (24-35 недель гестации) | Время повреждения (40 недель гестации) |
| Спастическая диплегия | Тетраплегия, дискинезия |
| Диффузное повреждение белого вещества с внурипаренхиматозными геморрагиями и перивенктрикулярными полостями, вследствие особенностей строения сосудистой системы ( нет коллатералей) | Диффузное поражение базальных ганглиев, таламуса, корково-подкорковые повреждения водопровода |
Показания для консультации специалистов:
консультация офтальмолога – глазное дно и проверка остроты зрения в случае подозрения на снижение зрения;
консультация оториноларинголога, сурдолога (проведение сурдологических исследований) – проверка слуха в случае подозрения на снижение слуха;
консультация травматолога/ортопеда – при развитии вторичных мышечно-скелетных аномалий для решения вопроса ортопедической коррекции;
консультация нейрохирурга – при развитии мышечно-скелетных аномалий для решения вопроса нейрохирургической коррекции;
консультация врача физической медицины и реабилитации (ФМР) – определение степени нарушения биосоциальных функций, реабилитационного потенциала, объема (программы)реабилитации согласно протоколов реабилитации;
консультация диетолога – при наличии нарушений питания (дефицит или профицит массы тела);
консультация педиатра – при сопутствующей соматической патологии для своевременной коррекции;
консультация генетика – для исключения генетической патологии;
консультация логопеда, дефектолога, психолога;
консультация ортезиста.
консультацию эрготерапевта
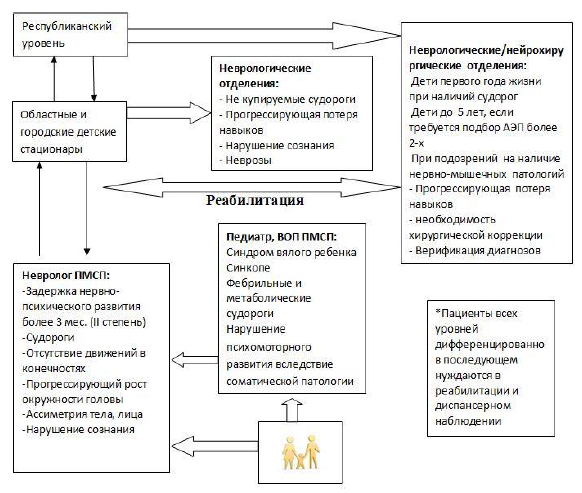
Диагностический алгоритм: (схема)
Алгоритм диагностики и ухода за пациентами с церебральным параличом
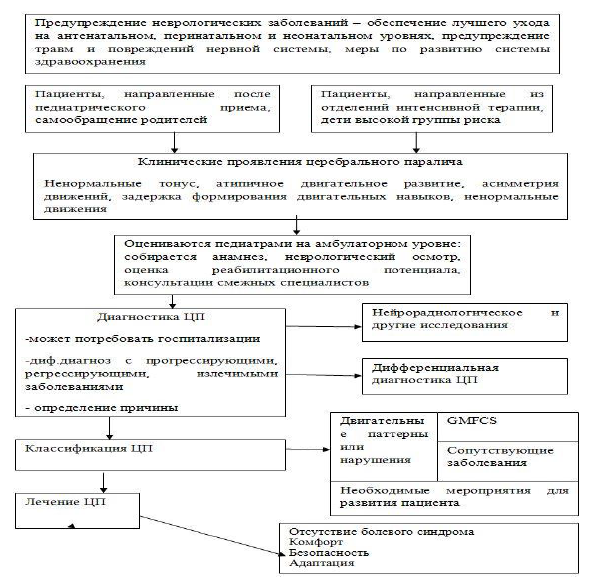
Алгоритм для по постановки диагноза (схема)
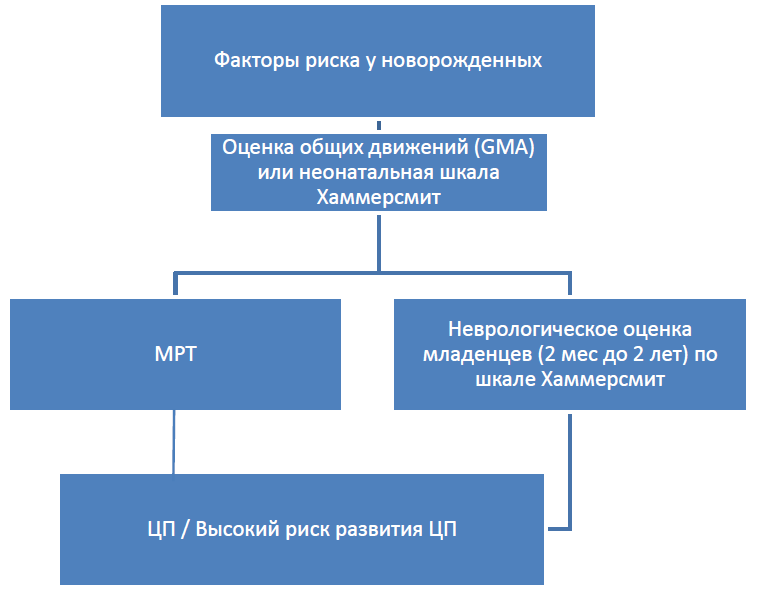
При отсутствии изменений на МРТ следует рассмотреть вопрос проведения генетического анализа
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований [7]:
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Нервно-мышечные заболевания, Генетическими синдромами, метаболическими нарушениями, нейродегенеративными заболеваниями (лейкодистрофии), Наследственная спастическая параплегия, дистония, хореоатетоз, атаксия. | Клинические признаки повышения мышечного тонуса, парезы, гипотония туловища, снижение определенного двигательного контроля (разгибание стоп), различные нарушения мелкой моторики, признаки дисморфии, кожные симптомы. | Сыворотка крови на КФК, АСТ, АЛТ, ЛДГ ЭНМГ УЗИ мышц МРТ мышц ЭКГ/ЭхоКГ Люмбальная пункция Исследования слуха Офтальмологические исследования Биопсия мышц (световая и электронная микроскопия, метаболические анализы) Генетические анализы Уточнить генетические анализы (болезнь Дюшена, СМА, MLPA) |
Прогрессирующий характер течения; заболевания Ранние трофические изменения мыщц; Миалгии; Индукция мышечных нарушений после движения;
Фасцикуляции Чувствительные нарушения; Дыхательные расстройства; Вовлечение сердечно-сосудистой системы; Ранние контрактуры, сколиозы; Вовлечение мимической мускулатуры, Изменение уровня КФК; Стигмы дизэмбиогенеза;
|
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ [8]
От 0 до 2 лет – каждый осмотр должен проводиться в соответствии с принципами индивидуального ухода, а постнатальные услуги должны планироваться на местном уровне для достижения наиболее эффективного обслуживания женщин и младенцев. К методам ранней реабилитации детей раннего возраста 0 – 3 месяца относятся:
возраст адекватный уход за ребенком;
минимизация флуктуаций/изменений кровообращения в головном мозге и оксигенации у недоношенных новорожденных;
минимизация использования постнатальных стероидов и других препаратов;
нейропротективные подходы после неонатальной энцефалопатии, такие как терапевтическая гипотермия с мониторингом состояния мозга (амплитудно-интегрированная ЭЭГ);
поддержание зрительного и сенсорного контакта между матерью и ребенком, проведение процедур массажа и ЛФК совместно с матерью или только ею (ранние вмешательства у детей до 2 месяцев (массаж, ИРТ, ЛФК, грудничковое плавание), проводимые инструктором, не показали доказательной эффективности;
адекватное питание ребенка, обеспечивающее нормальное развитие, согласно шкалам развития.
Принципы раннего вмешательства детям неонатального возраста c риском развития двигательных нарушении в отделении интенсивной терапии новорожденных:
Принципы раннего вмешательства детям неонатального возраста c риском развития двигательных нарушении в отделении интенсивной терапии новорожденных:
обеспечение близости и взаимодействия между родителями и младенцем;
обеспечить круглосуточный доступ родителей к новорождённому;
ранний и продолжительный контакт «кожа к коже» с родителями (метод кенгуру), также применять данных подход при болезненных процедурах;
уход, ориентированный на семью – вовлечение членов семьи в уход за ребенком в отделении интенсивной терапии;
поддержка родителей в наблюдении и интерпретации поведения своего ребенка;
обеспечение обучения родителей для улучшения качества взаимодействия между родителями и младенцем;
совместное принятие решений;
обеспечение психологической помощи родителям.
Обеспечение оптимального сенсорного окружения:
обеспечить отсутствие раздражающих внешних стимулов: снижение окружающего шума, одноместная семейная палата, сведение к минимуму боли и стресса во время процедур;
использование позитивных сенсорных стимуляции: человеческий голос, чтение новорождённому во время болезненных процедур;
обеспечение протективных и стимуляционных компонентов: пеленание для снижения стресса и способствования саморегуляции, правильное позиционирование, использование медленных и нежных движении во время процедур.
Мониторинг эффективности манипуляций данного этапа показывает использование общей оценки движения (GMA) во время обычных неонатальных контрольных оценок для детей от 0 до 3 месяцев, которые подвергаются повышенному риску развития церебрального паралича.
Обеспечение качественного сна: отсрочка плановых процедур во время сна, соответствующий расписание для активностей по уходу.
Мониторинг эффективности манипуляций данного этапа показывает использование общей оценки движения (GMA) во время обычных неонатальных контрольных оценок для детей от 0 до 3 месяцев, которые подвергаются повышенному риску развития церебрального паралича.
От 3 месяцев до 2 лет.
Обеспечить расширенную клиническую и последующую программу развития, проводимую многопрофильной командой для детей до 2 лет (с поправкой на гестационный возраст).
Ограниченная двигательная терапия основана на принципе принудительного использования плохо двигающейся конечности.
Онтогенетическая терапия включает: ограниченную двигательную терапию, взаимодействие родителей и детей, сенсомоторный контакт, визуальный, эмоциональный контакт.
Ограниченная двигательная терапия основана на принципе принудительного использования плохо двигающейся конечности.
Формирование движения посредством управляемого повторения во время данной терапии создает опыт успешного движения, необходимого для развития более эффективных действий.
Повышенная и более качественная сенсорная обратная связь при движении также имеет решающее значение для улучшения способности мозга производить новые движения.
Предоставление такого вида обучения является сложным для детей с ЦП, которые имеют ограниченный доступ к тактильному вмешательству к их пораженным конечностям.
Поэтому дозированная стимуляция возраст специфической двигательной активности являются важным компонентом обучения новым двигательным навыкам и саморегуляции.
Формирование движения в данном возрасте должно быть активной задачей, ведущей к успешному результату.
Пациенты с низким реабилитационным потенциалом, а также пациенты с судорогами вне ремиссии получают реабилитационное лечение в амбулаторном порядке.
Мониторинг эффективности раннего вмешательства проводиться с использованием шкалы неврологического осмотра Хаммерсмита.
Пациенты с низким реабилитационным потенциалом, а также пациенты с судорогами вне ремиссии получают реабилитационное лечение в амбулаторном порядке.
Методы и принципы раннего вмешательства детям до 2 лет с риском развития двигательных нарушений.
1. Раннее вмешательство младенцам с низким или умеренным риском развития двигательных нарушении (младенцы которые были клинический больны в неонатальном возрасте, но без значительных повреждении мозга). Обеспечить поддержку в развитии младенца при помощи программ раннего вмешательства:
Программа оценки поведения младенцев и вмешательства - состоит из оказания ребенку и его семье вмешательства в домашних условиях, начиная непосредственно перед выпиской из больницы и до скорректированного возраста 6 месяцев. Целью данной программы является поддержка функций развития, включая саморегуляцию младенца, и сосредоточение внимания на улучшении реакции родителей на взаимодействие с младенцем.
Игрушки, способствующие уходу.
2. Раннее вмешательство младенцам с очень высоким риском развития двигательных нарушении, заключается в обеспечении поддержки в развитии младенца при помощи программ раннего вмешательства:
Игрушки, обеспечивающие уход – раннее вмешательство на дому с использованием мехатронных игрушек.
CIMT (терапия постоянно-индуцированными движениями) – это метод, предназначенный для увеличения амплитуды и двигательной активности паретичных конечностей.
GAME (Цели - Движения – обогащение двигательного репертуара) –двигательное обучение, методика раннего вмешательства по обогащению окружающей среды. Является эффективной для улучшения двигательных навыков у младенцев с высоким риском развития ЦП.
SSP (программа маленьких шагов) – программа «маленький шаг» - это индивидуальное, целенаправленное и интенсивное вмешательство, которое фокусируется на использовании рук, мобильности и общении.
Реабилитация детей старше 2- лет проводиться согласно протоколам реабилитации, описанным в стандарте реабилитации.
Немедикаментозное лечение:
гипоаллергенная диета богатая пищевыми волокнами, согласно стандарта реабилитации; физическая медицина и реабилитация (физиотерапия, кинезотерапия);
оккупационная терапия;
эрготерапия;
логопедические массажи;
речевая терапия;
психологическая коррекция;
ортезирование (ортезы, корсеты и др);
коррекция поведенческих нарушений – поведенческая терапия.
Схемы основных применяемых средств указаны в таблицах.
Перечень основных лекарственных средств (имеющих 100% вероятность применения) [9]:
Дальнейшее ведение согласно протоколам медицинской реабилитации: Согласно стандартам оказания реабилитационной помощи.
Индикаторы эффективности лечения:
Медикаментозная терапия:
Медикаментозная терапия назначается в качестве симптоматического лечения при выраженной спастичности мыщц (группа миорелаксантов), а также для облегчения проведения методов реабилитации. Группа миорелаксантов назначается курсом (тригексофенидил) у детей первого года жизни, а также у детей до 18-ти лет, при выраженной спастичности у детей старше года для облегчения ухода и обеспечения адекватности реабилитационных процедур рассматривается вопрос проведения лечения баклофеном (через помпу).
При наличии приступов дистонических атак с целью миорелаксации применяется группа бензодиазепинов.
Снотворные средства используются для обеспечения физиологического ритма сон – бодрствование.
Схемы основных применяемых средств указаны в таблицах.
Перечень основных лекарственных средств (имеющих 100% вероятность применения) [9]:
|
Лекарственная группа
|
Международное непатентованное название | Способ применения | Уровень доказательности |
| Мышечные релаксанты | Баклофен |
Через рот: Начальная доза 0,5 мг/кг 3 раза в день; еженедельно увеличение дозы по 0,5 мг/кг Поддерживающая доза: 2-5 мг/кг 3-4 раза в день |
С |
| Толперизон | Детям: в возрасте от 6 до 14 лет: ежедневно 2-4 мг/кг массы тела, в три приёма. Препарат следует принимать после еды, запивая стаканом воды. | С | |
| Тригексофенидил | Начальная доза: 0,5 мг еженедельно поднимать по 0,5 мг Поддерживающая доза: 10-20(60) мг/день | С | |
| Левадопа/карбидопа | Стартовая доза 1-2 мг/кг/сут с повышением дозы на 1 мг/кг/сут каждые 3-5 дней | С |
Перечень дополнительных лекарственных средств (менее 100% вероятности применения):
|
Лекарственная группа
|
Международное непатентованное название | Способ применения | Уровень доказательности |
| Бензодиазепины | Диазепам |
Через рот Начальная доза:0,25 мг/кг/день Поддерживающая:До 1 мг/кг/день в 2-3 приема в день. Суточная доза составляет 5-10 мг.
Длительность непрерывного курса лечения не должна превышать 1 месяца. Перед повторным курсом лечения перерыв должен быть не менее 3 недель.
|
В |
| Мышечные релаксанты | Тизанидин | Начальная доза: 1 мг/день Поддерживающая : 0,3-0,5 мг/кг/день, макс. 36 мг/день | С |
| Баклофен для интратекального применения* | У детей рекомендуемая начальная тестовая доза — 25 мкг. Тестовая доза должна вводиться в течение как минимум 1 мин методом барботажа (смешивание со спинно-мозговой жидкостью). Для тестирования дозы предназначен раствор с низкой концентрацией препарата (0,05 мг/мл). При отсутствии положительного результата тестовая доза может быть повышена ступенчато на 25 мкг каждые 24 ч до достижения эффекта, сохраняющегося около 4–8 ч | В | |
| Противосудорожные препараты | Топирамат | 0,5-1 мг/кг титрование по 1 мг/кг сут разделенные на 2 приема каждые 1-2 недели Поддерживающая доза 5-10 мг/кг/сут | В |
| Вальпроевая кислота | 10 мг/кг/сут разделенные на два приема. Титрование по 10 мг/кг/сут каждые 5- 7 дней. Поддерживающая доза 20-40 мг/кг/сут ( макс. 60 мг/кг/сут) | В | |
| Левитирацетам | Начальная доза 10 мг/кг/сут разделенная на 2 приема, титрование по 10 мг/кг/сут каждые 7 дней Поддерживающая 40-60 мг/кг/сут | В | |
| Карбамазепин | Начальная доза 10 мг/кг, сут с последующей титрацией до 30 мг/кг сут | В |
Хирургическое вмешательство: нет.
Дальнейшее ведение согласно протоколам медицинской реабилитации: Согласно стандартам оказания реабилитационной помощи.
Индикаторы эффективности лечения:
стимуляция и повышение двигательной активности;
отсутствие боли;
развитие двигательных и речевых навыков (держать голову, сидеть, ходить, говорить);
развитие мелкой моторики и навыков самообслуживания;
независимость, автономия движений;
процент улучшения по GMFM;
снижение спастичности по шкале Ашфорта(Ashworth);
процент улучшения навыков самообслуживания по индексу Бартела, WeeFim;
улучшение функционирования верхних конечностей по MACS.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ [7-11]:
Стационарное лечение пациентам проводится при необходимости установки диагноза, так как обязательным методом является проведение нейрорадиологических исследований (МРТ), которое до 4-х лет детям проводят с седацией, кроме того при необходимости проведения дифференциальной диагностики с нервно-мышечными заболеваниями (проведение МРТ мышц, биопсии мышц, ряда генетических анализов), а также проведение хирургической коррекции может потребоваться анестезиологическое пособие.
Карта наблюдения пациента, маршрутизация пациента:
Немедикаментозное лечение:
при нарушениях питания: гипоаллергенная диета, определение дефицита массы тела [9]
Подбор диеты:
при аспирациях: уточнить наличие пневмонии, нарушений глотания Подобрать позу для кормления, снижение саливации (см. в разделе медикаментозное лечение введение ботулинистического токсина А в слюнные железы);
при гастроэзофагеальном рефлюксе: контроль болевого синдрома, позы при кормлении, увеличение тонуса мышц. Подбор гипоаллергенной диеты с пищевыми волокнами, при наличии эзофагита или гастрита (прием омепразола) возможно через желудочный зонд или гастростому;
при не эффективности лечения гастроэзофагеального рефлюкса – лапароскопическая фундопластика;
Перечень дополнительных лекарственных средств (менее 100% вероятности применения):
при не купировании боли или повышенной чувствительности – применение габапентина;
ЛФК с элементами массажа (лечебная гимнастика, лечение положением);
физиотерапия.
Медикаментозное лечение [9-11]:
Медикаментозная терапия назначается в качестве симптоматического лечения при выраженной спастичности мыщц (группа миорелаксантов), а также для облегчения проведения методов реабилитации. Группа миорелаксантов назначается курсом (тригексофенидил) у детей первого года жизни, а также у детей до 18-ти лет, при выраженной спастичности у детей старше года для облегчения ухода и обеспечения адекватности реабилитационных процедур рассматривается вопрос проведения лечения баклофеном (через помпу).
При наличии приступов дистонических атак с целью миорелаксации применяется группа бензодиазепинов.
Снотворные средства используются для обеспечения физиологического ритма сон - бодрстование.
Использование тетрабеназина при трудно курируемых дистонических атаках в палатах интенсивной терапии.
Схемы основных применяемых средств указаны в таблицах, использование схемы лечения или монотерапии зависит от тяжести клинических проявлений и ведущего симптомокомплекса, подбирается индивидуально из представленного ниже перечня.
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
|
Лекарственная группа
|
Международное непатентованное название | Способ применения | Уровень доказательности |
| Мышечные релаксанты | Баклофен | Через рот: Начальная доза 0,5 мг/кг 3 раза в день; еженедельно увеличение дозы по 0,5 мг/кг Поддерживающая доза: 2-5 мг/кг 3-4 раза в день | С |
| Толперизон | Детям: в возрасте от 6 до 14 лет: ежедневно 2-4 мг/кг массы тела, в три приёма. Препарат следует принимать после еды, запивая стаканом воды. | С | |
| Тригексофенидил | Начальная доза: 0,5 мг еженедельно поднимать по 0,5 мг Поддерживающая доза: 10-20(60) мг/день | С | |
| Левадопа /карбидопа | Стартовая доза 1-2 мг/кг/сут с повышением дозы на 1 мг/кг/сут каждые 3-5 дней | С | |
| Бензодиазепины | Диазепам |
Через рот Начальная доза:0,25 мг/кг/день Поддерживающая:До 1 мг/кг/день в 2-3 приема в день. Суточная доза составляет 5-10 мг. Длительность непрерывного курса лечения не должна превышать 1 месяца. Перед повторным курсом лечения перерыв должен быть не менее 3 недель. |
В |
| Ботулинистический токсин А |
Внутримышечно доза 0,5 -16,0 Ед/кг
Содержимое флакона растворяют в 1.0 мл 0.9 % раствора натрия хлорида для инъекций, получая раствор, содержащий 500 ЕД в мл.
Определение мышц-мишеней проводится специально подготовленным врачом-инжектором, совместно с членами мультидисциплинарной команды.
|
В |
|
Лекарственная группа
|
Международное непатентованное название | Способ применения | Уровень доказательности |
|
Бензодиазепины
|
Диазепам | Через рот Начальная доза:0,25 мг/кг/день Поддерживающая: до 1 мг/кг/день в 2-3 приема в день. Суточная доза составляет 5-10 мг. Длительность непрерывного курса лечения не должна превышать 1 месяца. Перед повторным курсом лечения перерыв должен быть не менее 3 недель. | В |
| Мышечные релаксанты | Баклофен* | У детей рекомендуемая начальная тестовая доза — 25 мкг. Тестовая доза должна вводиться в течение как минимум 1 мин методом барботажа (смешивание со спинно-мозговой жидкостью). Для тестирования дозы предназначен раствор с низкой концентрацией препарата (0,05 мг/мл). При отсутствии положительного результата тестовая доза может быть повышена ступенчато на 25 мкг каждые 24 ч до достижения эффекта, сохраняющегося около 4–8 ч | В |
| Тизанидин | Начальная доза: 1 мг/день Поддерживающая : 0,3-0,5 мг/кг/день, макс. 36 мг/день | С | |
| Противосудорожные | Вигабатрин* | Начальная доза 50 мг/кг/день Поддерживающая 150 мг/кг/день на 3 приема | С |
| Вальпроевая кислота | 0,5-1 мг/кг титрование по 1 мг/кг сут разделенные на 2 приема каждые 1-2 недели Поддерживающая доза 5-10 мг/кг/сут | С | |
| Топирамат | 10 мг/кг/сут разделенные на два приема. Титрование по 10 мг/кг/сут каждые 5- 7 дней. Поддерживающая доза 20-40 мг/кг/сут ( макс. 60 мг/кг/сут) | С | |
| Леветирацетам | Начальная доза 10 мг/кг/сут разделенная на 2 приема, титрование по 10 мг/кг/сут каждые 7 дней Поддерживающая 40-60 мг/кг/сут | С | |
| Карбамазепин | Начальная доза 10 мг/кг, сут с последующей титрацией до 30 мг/кг сут | С | |
|
Ингибитор протонного насоса
|
Омепразол | 1-16 лет: от 5 до 10 кг: 5 мг через рот 1 раз в день 10-20 кг: 10 мг 1 раз в день 20 кг и больше: 20 мг в день 1 раз в день в течении 4 недель 16-18 лет: 20 мг через рот 1 раз в день в течении 4 недель | С |
Хирургическое вмешательство: см. Приложение 2.
Дальнейшее ведение: согласно стандартам оказания реабилитационной помощи.
Индикаторы эффективности лечения:
стимуляция и повышение двигательной активности;
отсутствие боли;
безопасность; адаптация (независимость, автономия движений);
процент улучшения по GMFM;
снижение спастичности по шкале Ашфорта(Ashworth);
процент улучшения навыков самообслуживания по индексу Бартела, WeeFim;
улучшение функционирования верхних конечностей по MACS.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ**:
Показания для плановой госпитализации:
наличие спастичности у детей первых двух лет жизни, с задержкой становления основных двигательных актов;
гипотония мышц, потеря приобретенных навыков, асимметрия мышечного тонуса, движений, атаксия;
фокальная дистония и хореоатетоза.
Показания для экстренной госпитализации:
дистонические атаки;
присоединение судорог, особенно статусного течения.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- 1) Rosenbaum Petal: Dev. Med.ChildNeurol (suppl) 2007;109:8-14 2) AACPDM The definition and classification of cerebral palsy. Developmental Medicine and Child Neurology, 2007, 49(s109):1-44 3) Cans et al., Recommendations from the SCPE collaborative group for defining and classifying cerebral palsy. Developmental Medicine and Child Neurology Supplement, 2007, 109:35-38 4) Palissano RJ et al Content validity of the expanded and revised Gross Motor Function Classification System. Developmental Medicine and Child Neurology Supplement,2008, 50(10):744-750 5) Scholtes VA et al Clinical assessment of spasticity in children with cerebral palsy: a critical review of available instruments. Developmental Medicine and Child Neurology Supplement,2006, 48(1):64-73 6) Krageloh-Mann et al, Horber V. the role of magnetic resonance imaging in elucidationg the pathogenesis of cerebral palsy: a systematic review. Developmental medicine and child neurology, 2007, 49(20:144-151 7) Neurokids child neurology workbook, diagnosis and therapy , mind maps, edited by Florian Heinen, W.Kohlhammer GmbH, Stuttgard, 2017, 192 p. 8) http://www.lifeexpectancy.org/articles/NewGrowthCharts.shtml 9) Heinen F et al. The updated European Consensus 2009 0n use of Botulinum toxin for children with cerebral palsy. European Journal of Pediatric Neurology, 2010, 14(1):45-66 10) Handbook on clinical neurology . Vol 111(3rd series) Pediatric Neurology Part1, O. Dulac, M.Lassonde and H.B.Sarnat, Editors, 2013,Elsevier p.163-167 11) Principals and Practice of Child neurology in infancy edited by Colin Kennedy, 2012, p.304
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков протокола с указанием квалификационных данных:
1) Джаксыбаева Алтыншаш Хайруллаевна – доктор медицинских наук, профессор, НАО «Медицинский Университет Астана» заведующая кафедрой неврологии, главный внештатный детский невролог Министерства здравоохранения Республики Казахстан.
2) Лепесова Маржан Махмутовна – доктор медицинских наук, профессор, НУО «Казахско-Российский медицинский университет» заведующая кафедрой неврологии.
3) Текебаева Латина Айжановна – кандидат медицинских наук, ТОО «Институт детской неврологии» директор.
3) Текебаева Латина Айжановна – кандидат медицинских наук, ТОО «Институт детской неврологии» директор.
4) Жаилганов Азамат Абикенович – КГП на ПХВ «Городская детская клиническая больница №2» Управление общественного здравоохранения города Алматы, врач-нейрохирург.
5) Касенова Гульнур Нурлановна – КГП на ПХВ «Городская детская клиническая больница №2» Управление общественного здравоохранения города Алматы, врач-невролог.
Указание на отсутствие конфликта интересов: нет.
Рецензент: Булекбаева Шолпан Адильжановна – доктор медицинских наук, профессор НАО «Национальный центр детской реабилитации», советник Председателя Правления, главный внештатный специалист по физической медицине и детской реабилитации Министерства здравоохранения Республики Казахстан.
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Международные критерии по оценке функционального состояния детей с ЦП
У детей с ЦП для оценки БСФ используются следующие шкалы и тесты:
1. Индекс активности повседневной жизни Бартела (Barthel Activities of Daily Living (ADL) Index)
Разница: Балльная оценка независимости:

«GMFCS»Возраст с 4 до 6 лет
«GMFCS» Возраст с 6 до 12 лет

«GMFCS» Возраст от 12 до 18 лет
6) Шакенов Мейрам Джамбулович – кандидат медицинских наук, НАО «Национальный центр детской реабилитации» детский невролог, реабилитолог.
7) Макалкина Лариса Геннадьевна – кандидат медицинских наук, НАО «Медицинский университет Астана» доцент кафедры клинической фармакологии, главный внештатный клинический фармаколог Министерства здравоохранения Республики Казахстан.
Указание на отсутствие конфликта интересов: нет.
Рецензент: Булекбаева Шолпан Адильжановна – доктор медицинских наук, профессор НАО «Национальный центр детской реабилитации», советник Председателя Правления, главный внештатный специалист по физической медицине и детской реабилитации Министерства здравоохранения Республики Казахстан.
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Приложение 1
Международные критерии по оценке функционального состояния детей с ЦП
У детей с ЦП для оценки БСФ используются следующие шкалы и тесты:
Индекс Бартела (Barthel) модифицированный – до 4-х лет;
Шкала функциональной независимости модифицированная WeeFim – старше 4-х лет;
Система классификации больших моторных функций (GMFCS);
Шкала измерения больших моторных функций(GMFM) – балльная оценка моторных функций;
Шкала функционирования верхних конечностей MACS;
Шкала Ашфорта (Ashworth);
Неврологический осмотр по Хаммерсмит.
1. Индекс активности повседневной жизни Бартела (Barthel Activities of Daily Living (ADL) Index)
Оценка навыков самообслуживания и бытовой адаптации (модифицированная шкала Бартела)
|
Навыки
|
Характеристика | Баллы | При поступлении | При выписке |
| Умение умываться и пользоваться полотенцем | Не может | 0 | ||
| С помощью | 5 | |||
| Испол.одну руку: правую, левую (подчер.) | 10 | |||
| Самостоятельно | 15 | |||
| Умение чистить зубы | Не может | 0 | ||
| С помощью | 5 | |||
| Самостоятельно | 10 | |||
| Умение расчесывать волосы | Не может | 0 | ||
| С помощью | 5 | |||
| Самостоятельно | 10 | |||
| Умение заправлять постель | Не может | 0 | ||
| С помощью | 5 | |||
| Самостоятельно | 10 | |||
| Навыки раздевания | Не может | 0 | ||
| С помощью | 5 | |||
| Испол.одну руку: правую, левую (подчер.) | 10 | |||
| Самостоятельно | 15 | |||
| Навыки одевания | Не может | 0 | ||
| С помощью | 5 | |||
| Испол.одну руку: правую, левую (подчер.) | 10 | |||
| Самостоятельно обеими руками | 15 | |||
| Умение застегивать пуговицы | Не может | 0 | ||
| С помощью | 5 | |||
| Испол.одну руку: правую, левую (подчер.) | 10 | |||
| Самостоятельно двумя руками | 15 | |||
| Умение пользоваться «молнией» | Не может | 0 | ||
| С помощью | 5 | |||
| Испол.одну руку: правую, левую (подчер.) | 10 | |||
| Самостоятельно | 15 | |||
| Умение обуваться | Не может | 0 | ||
| С помощью | 5 | |||
| Испол.одну руку: правую, левую (подчер.) | 10 | |||
| Самостоятельно | 15 | |||
| Умение шнуровать ботинок | Не может | 0 | ||
| С помощью | 5 | |||
| Самостоятельно | 10 | |||
| Умение пользоваться липучкой на обуви | Не может | 0 | ||
| С помощью | 5 | |||
| Самостоятельно | 10 | |||
|
Умение принимать пищу: а) умение держать кружку и пить б) Умение держать ложку, подносить ко рту |
Не может | 0 | ||
| С помощью | 5 | |||
| Самостоятельно | 10 | |||
|
а) Умение пользоваться унитазом б) Просится на горшок |
Не может | 0 | ||
| С помощью | 5 | |||
| Самостоятельно | 10 | |||
|
Навыки захвата
|
Не может | 0 | ||
| С помощью | 5 | |||
| Самостоятельно | 10 | |||
| Умение включать и выключать освещение | Не может | 0 | ||
| С помощью | 5 | |||
| Самостоятельно | 10 | |||
| Умение включать и выключат водопроводный кран | Не может | 0 | ||
| С помощью | 5 | |||
| Самостоятельно | 10 | |||
| Владение трудовыми навыками: (ножницами, клеем, пластилином, иглой) | Не может | 0 | ||
| С помощью | 5 | |||
| Испол.одну руку :правую, левую (подчеркнуть) | 10 | |||
| Самостоятельно | 15 | |||
| Умение приводить свое рабочее место и игрушки в порядок | Не может | 0 | ||
| С помощью | 5 | |||
| Испол.одну руку :правую, левую (подчеркнуть) | 10 | |||
| Самостоятельно | 15 | |||
| Владение навыками ИЗО | Не может | 0 | ||
| С помощью | 5 | |||
| Самостоятельно | 10 | |||
| Умение складывать личные вещи | Не может | 0 | ||
| С помощью | 5 | |||
| Самостоятельно | 10 |
Норма:
с 1 года до 3 лет – 200 баллов;
с 1 года до 3 лет – 200 баллов;
от 3-х до 4-х лет - 220 баллов;
1. Полная зависимость: 0 -60 баллов(с 1года до 3 лет от 0 до 50 баллов).
2. Умеренная зависимость: 61-125 баллов (с 1 года до 3 лет от 51 баллов до 115 баллов). 3. Легкая зависимость: 126- 220 баллов: (от 1 года до 3 лет 116 баллов до 200 баллов). Навыки самообслуживания улучшились на %.
2. Шкала функциональной независимости
Шкала функциональной независимости рассматривает 6 основных областей деятельности: «уход за собой», «контроль сфинктеров», «перемещение», «передвижение», «коммуникацию», «социальную адаптацию». В каждой из этих областей по 7-балльной шкале оцениваются несколько видов специфической деятельности. Всего пунктов оценки 18.
Двигательные функции оцениваются по суммарному баллу, полученному по пунктам 1 - 13 из категорий «Самообслуживание», «Контроль функций тазовых органов», «Перемещение», «Подвижность».
|
№
|
Наименование | При поступлении | При выписке |
| Самообслуживание | |||
| 1. | Прием пищи (поднесение пищи ко рту, пользование столовыми приборами, жевание, глотание) | ||
| 2. | Личная гигиена (причесывание, чистка зубов, умывание лица и рук, бритье, макияж) | ||
| 3. | Принятие ванны или душа (мытье и вытирание тела, за исключением области спины) | ||
| 4. | Одевание выше пояса (в том числе надевание протезов или ортезов) | ||
| 5. | Одевание ниже пояса (в том числе надевание протезов или ортезов) | ||
| 6. | Туалет (в том числе пользование туалетной бумагой) | ||
| Контроль тазовых функций | |||
| 7. | Функции мочевого пузыря (контроль мочеиспускания, использование приспособлений - катетера и проч.) | ||
| 8. | Функции прямой кишки (контроль акта дефекации, использование специальных приспособлений — калоприемника и прочее) | ||
| Перемещение | |||
| 9. | Подъем с кровати, приседание на стул или инвалидное кресло и вставание с них | ||
| 10. | Способность присаживаться и вставать с унитаза | ||
| 11. | Способность пользоваться ванной или душевой кабиной | ||
| Подвижность | |||
| 12. | Самостоятельная ходьба или передвижение с помощью инвалидного кресла. | ||
| 13. | Самостоятельный подъем по лестнице | ||
|
Суммарные баллы Процент эффективности |
|||
|
Наименование
|
При поступлении | При выписке | |
| Общение | |||
| 1. | Восприятие внешней информации (понимание обращенной устной и/или письменной речи) | ||
| 2. | Изложение собственных мыслей и желаний (устно и/или письменно) | ||
| Социальная активность | |||
| 3. | Социальная интеграция (взаимодействие с окружающими, в том числе членами семьи, медперсоналом и т.д.) | ||
| 4. | Способность к принятию решений (умение решать проблемы, связанные с личными, социальными, финансами и проч. потребностями) | ||
| 5. | Память (узнаванию окружающих, способность к запоминанию и воспроизведению информации, обучению) | ||
| Суммарный балл | |||
| Процент эффективности | |||
Общий суммарный балл:
При поступлении:
При выписке:
Разница: Балльная оценка независимости:
7 баллов - полная независимость в выполнении соответствующей функции (все действия выполняются самостоятельно, в общепринятой манере и с разумными затратами времени);
6 баллов - ограниченная независимость (больной выполняет все действия самостоятельно, но медленнее, чем обычно, либо нуждается в постороннем совете);
5 баллов - минимальная зависимость (при выполнении действий требуется наблюдение персонала либо помощь при надевании протеза или ортеза);
4 баллов - незначительная зависимость (при выполнении действий нуждается в посторонней помощи, однако более 75% задания выполняет самостоятельно);
3 баллов - умеренная зависимость (самостоятельно выполняет 50—75% необходимых для исполнения задания действий);
2 баллов - значительная зависимость (самостоятельно выполняет 25—50% действий); 1 баллов - полная зависимость от окружающих (самостоятельно может выполнить менее 25% необходимых действий).
«GMFCS» Возраст с 2 до 4 лет
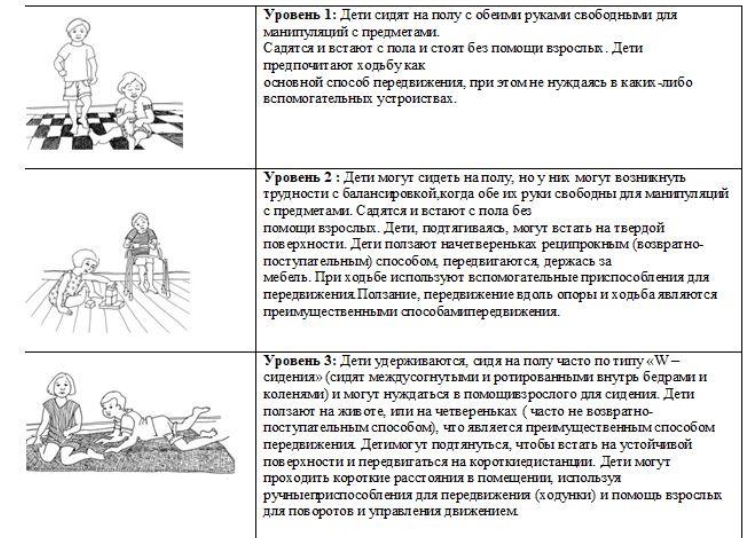
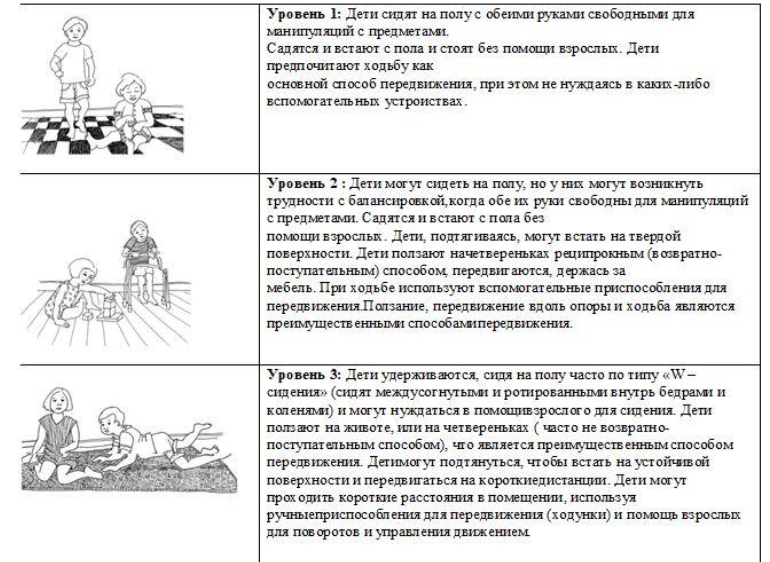
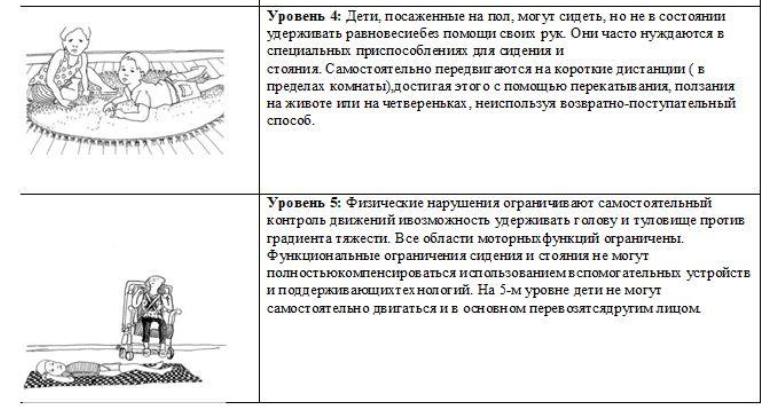
3. Система классификации больших моторных функций (GMFCS)
Gross Motor Function Classification System – GMFCS
У детей с церебральным параличом используются следующие международные критерии, оценивающие двигательные способности ребенка по шкалам GMFCS , и функцию рук по шкале MACS.
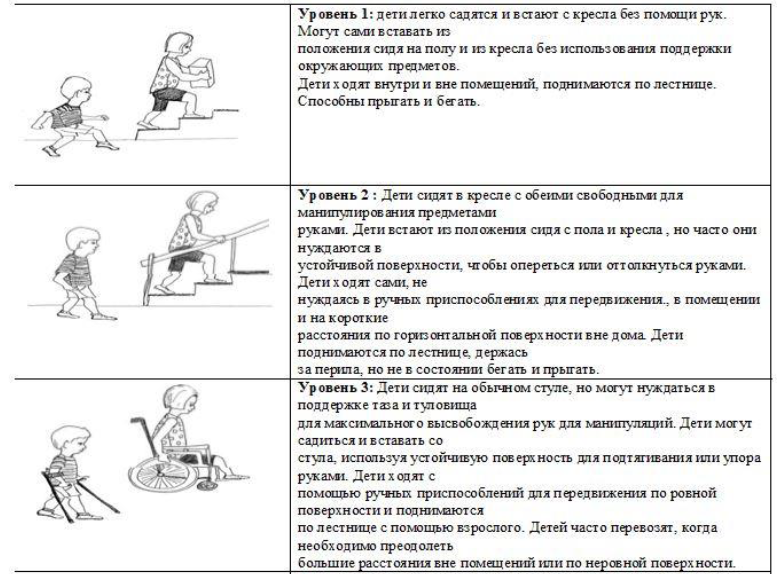
Шкала больших моторных функций (GMFCS)- это определение двигательных способностей у ребенка с ЦП с учетом возрастного периода. По своим двигательным возможностям она делится на 5 уровней:
1 уровень: соответствуют дети, которые могут ходить без ограничений, но не справляются с более сложными моторными заданиями.
2 уровень: дети, которые могут самостоятельно ходить с легким ограничением и справляются с более простыми моторными заданиями.
3 уровень: дети, которые могут передвигаться с дополнительной опорой удовлетворительно, делают несколько самостоятельных шагов.
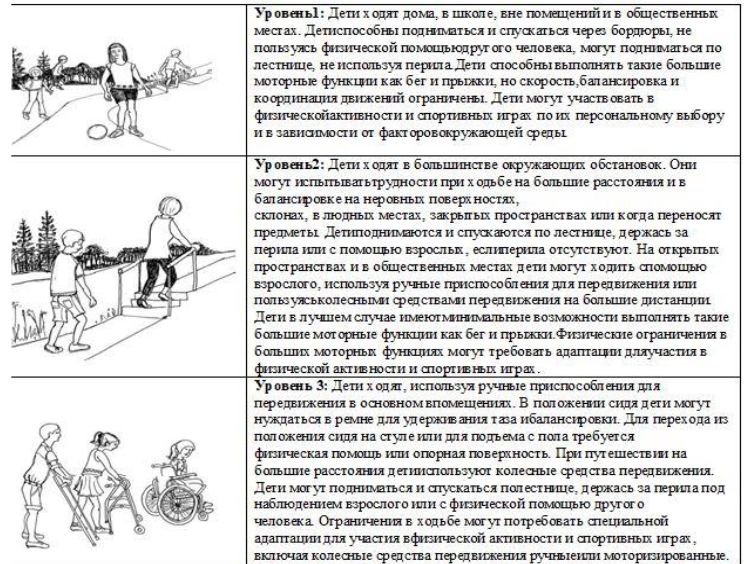
4 уровень: дети, которые могут передвигаться с дополнительной опорой с трудом, но требуют постоянной поддержки одного сопровождающего.
5 уровень: соответствуют дети с очень ограниченными возможностями самостоятельного передвижения даже со вспомогательным оборудованием и слабым контролем положения туловища и головы.
Различия между уровнями 4 и 5 – дети и подростки с 5 уровнем имеют серьезные ограничения контроля положения головы и туловища и требуют как обширной физической помощи другого лица, так и технологической поддержки. Самостоятельное передвижение достигается, только если ребенок или подросток научиться управлять инвалидным креслом.
Различия между уровнями 1 и 2 – по сравнению с детьми и подростками 1 уровня дети и подростки 2 уровня имеют ограничения в ходьбе на длинные дистанции и в балансировке или им может понадобиться использование ручных приспособлений для передвижения, когда они впервые обучаются ходьбе; могут использоваться колесные средства передвижения при путешествии на длинные дистанции на открытом воздухе или в общественные места; требуется использование перил при подъеме и спуске по лестнице; они ограниченны в способности бегать и прыгать
Различия между уровнями 2 и 3 – дети подростки со 2 уровнем способны ходить без ручных приспособлений для передвижения после 4-х летнего возраста (хотя они и могут выбирать их использование время от времени). Дети и подростки с 3 уровнем нуждаются в ручных приспособлениях для передвижения в помещениях и используют колесные средства передвижения на улице и в общественных местах.
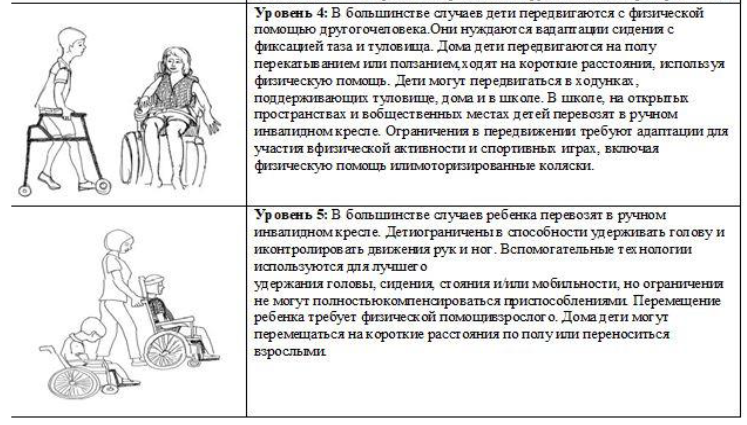
Различия между уровнями 3 и 4 – дети и подростки с 3 уровнем сидят самостоятельно и требуют незначительной внешней поддержки при сидении, они более независимы при перемещении стоя, могут ходить, используя ручные приспособления для передвижения. Дети и подростки с 4 уровнем в положении сидя обычно нуждаются в поддержке, но в самостоятельном передвижении ограничены. Дети и подростки с 4 уровнем чаще всего транспортируются в ручном инвалидном кресле или с использованием коляски с электроприводом.
Различия между уровнями 2 и 3 – дети подростки со 2 уровнем способны ходить без ручных приспособлений для передвижения после 4-х летнего возраста (хотя они и могут выбирать их использование время от времени). Дети и подростки с 3 уровнем нуждаются в ручных приспособлениях для передвижения в помещениях и используют колесные средства передвижения на улице и в общественных местах.
Различия между уровнями 3 и 4 – дети и подростки с 3 уровнем сидят самостоятельно и требуют незначительной внешней поддержки при сидении, они более независимы при перемещении стоя, могут ходить, используя ручные приспособления для передвижения. Дети и подростки с 4 уровнем в положении сидя обычно нуждаются в поддержке, но в самостоятельном передвижении ограничены. Дети и подростки с 4 уровнем чаще всего транспортируются в ручном инвалидном кресле или с использованием коляски с электроприводом.
Различия между уровнями 4 и 5 – дети и подростки с 5 уровнем имеют серьезные ограничения контроля положения головы и туловища и требуют как обширной физической помощи другого лица, так и технологической поддержки. Самостоятельное передвижение достигается, только если ребенок или подросток научиться управлять инвалидным креслом.
Для каждого уровня представлены отдельные описания в нескольких возрастных группах.
«GMFCS» Возраст с 1 года до 2 лет


«GMFCS» Возраст с 1 года до 2 лет


«GMFCS» Возраст с 2 до 4 лет


«GMFCS»Возраст с 4 до 6 лет


«GMFCS» Возраст с 6 до 12 лет


«GMFCS» Возраст от 12 до 18 лет


4. Шкала измерения больших моторных функций GMFM
(Gross Motor Function Measure)
Тест моторных функций GMFM – это стандартизированный оценочный тест двигательных навыков ребенка, соответствующих определенному этапу моторного развития и позволяющий объективно оценить уровень развития ребенка при детском церебральном параличе.
Тестирование по шкале проводится дважды: при поступлении, при выписке. В результате первого тестирования оценивается этап двигательного развития на момент осмотра. При повторном тестировании, мы получаем объективную оценку улучшения его двигательных возможностей с учетом перехода на следующий этап.
Каждый пункт имеет определенный этап двигательного развития:
Шкала состоит из 5 пунктов А, В, С, Д, Е, включающих 88 параметров:
1 пункт А включает 17 параметров;
2 пункт В – 33 параметра;
3 пункт С – 13 параметра;
4 пункт Д – 12 параметра;
5 пункт Е – 27 параметра.
Каждый пункт имеет определенный этап двигательного развития:
пункт А: держать голову, переворачиваться;
пункт В: сидеть;
пункт С: стоять на четвереньках, ползать, стоять на коленях;
пункт Д: стоять;
пункт Е: ходить, бегать, прыгать.
Полученный результат оценивается в процентах:
Каждый параметр оценивается по бальной системе от 0 до 3 баллов:
нет никакой реакции;
1-пытается, но нет движения;
2- выполняет часть движения;
3-выполняет полностью;
н/т – не тестировался.
Закончив тестирование выбранного пункта, необходимо суммировать отмеченные баллы и поделить их на определенный знаменатель, указанный для каждого пункта и умножить на 100%.
Полученный результат оценивается в процентах:
сумма пункта А делится на 51;
сумма пункта В делится на 60;
сумма пункта С делится на 42;
сумма пункта Д делится на 39;
сумма пункта Е делится на 72.
Расчет коэффициента: Суммарный коэффициент=(%А+%Б+%В+%Г+%Д)/5
5. Шкала функционирования верхних конечностей MACS
(The Manual Ability Classification System - MACS)
Шкала MACS является классификатором функционирования верхних конечностей у детей с ДЦП и имеет 5 уровней:
1 уровень: Захватывает объекты успешно и с легкостью. В основном проблемы в манипуляции объектами проявляются в незначительном ограничении скорости и неаккуратности. Тем не менее имеющиеся незначительные ограничения не влияют на степень самостоятельности в повседневной активности.
2 уровень: Захватывает большинство предметов с незначительным ограничением качества и/ или скорости. Определенные виды манипуляций недоступны или вызывают определенную долю затруднений; пациент может использовать альтернативные пути выполнения манипуляций, но возможный объем моторики рук не влияет на степень независимости в повседневной активности.
3 уровень: Удерживает объект с трудом, нуждается в помощи со стороны, чтобы подготовиться к захватыванию объекта. Манипуляции замедленны, качество действия и возможное количество повторений ограничено. Не может осуществлять некоторые виды манипуляций без должной адаптации окружающей среды.
4 уровень: Может захватывать ограниченное число объектов простых для манипуляций в адаптированной среде. Они выполняют лишь часть действий, и нуждаются в постоянной помощи.
5 уровень: Не захватывает объекты и имеет тяжелое стойкое ограничение даже в простых движениях. Нуждается в тотальной помощи со стороны.
Описание уровня функционирования верхних конечностей необходимо для определения возможностей выполнения навыков самообслуживания и входит в структуру диагноза церебрального паралича согласно международным стандартам.
6. Шкала Ашфорта (Ashworth)
(модифицированная шкала спастичности Ашфорта)
Большое значение имеет объективная оценка выраженности спастичности. Для оценки степени спастичности используется модифицированная шкала Ашфорта.
Имя Дата рождения
|
Степень
|
Изменения мышечного тонуса | До | После |
| 0 | Нет повышения мышечного тонуса | ||
| 1 | Легкое повышение мышечного тонуса, минимальное напряжение в конце амплитуды движения при сгибании и разгибании пораженной конечности. | ||
| 2 | Легкое повышение мышечного тонуса, которое проявляется при захватывании предметов и сопровождается минимальными сопротивлением (менее половины объема движения) | ||
| 3 | Более отчетливое повышение мышечного тонуса в большей части объема движения, но пассивные движения не затруднены | ||
| 4 | Значительное повышение мышечного тонуса –значительное затруднение пассивных движении | ||
| 5 | Ригидное сгибательное или разгибательное положение конечности |
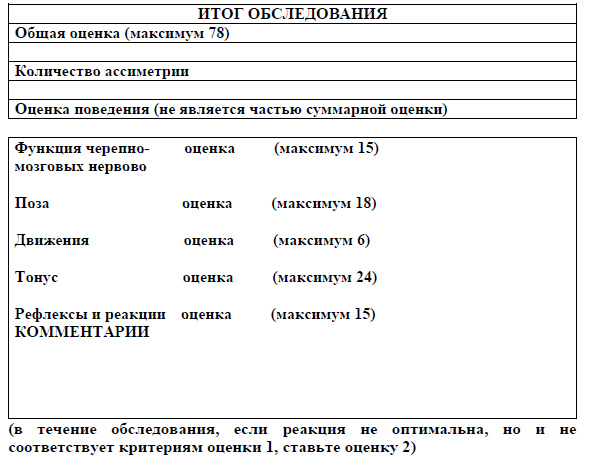
НЕВРОЛОГИЧЕСКОЕ ОБСЛЕДОВАНИЕ ДЕТЕЙ ХАММЕРСМИТ
(v 08.02.19)
Имя Дата рождения
Гестационный возраст Дата обследования
Хронологический возраст Окружность головы

НЕВРОЛОГИЧЕСКОЕ ОБСЛЕДОВАНИЕ
ОЦЕНКА ЧЕРЕПНО-МОЗГОВЫХ НЕРВОВ
| Оценка 3 | 2 | Оценка 1 | Оценка 0 | Оценка | Ассиметрия / комментарии | |
| Выражение лица (в покое и во время плача или в ответ на раздражитель) |
Улыбается или
реагирует на раздражитель
закрыванием глаз и гримасами
|
Закрывает глаза, но
не плотно,
обедненная мимика
лица
|
Лицо лишено
выражения, не реагирует на
раздражители
|
|||
| Движения глаз |
Нормальные
скоординированные движения
глаз
|
Непостоянное
отклонение глаз
или атипичные движения
|
Постоянное
отклонение глаз или
атипичные движения
|
|||
| Зрительная реакция Проверить способность следить за черным / белым объектом | Следит за целью по полной дуге | Следит за целью по неполной или асимметричной дуге | Не следит за объектом | |||
| Слуховая реакция Проверить реакцию на звук погремушки |
Реагирует на раздражитель с
обеих сторон
|
Реакция на раздражитель
сомнительная или есть
асимметрия ответа
|
Нет ответа | |||
| Сосание / глотание Наблюдать, как ребенок сосет грудь или бутылочку. Для более старших детей, спросить о кормлении, связанный с ним кашель, чрезмерное слюноотделение |
Хорошее сосание и
глотание
|
Плохое сосание и
глотание
|
Нет сосательного
рефлекса, не глотает
|
ОЦЕНКА ПОЗЫ (отметить любую асимметрию)
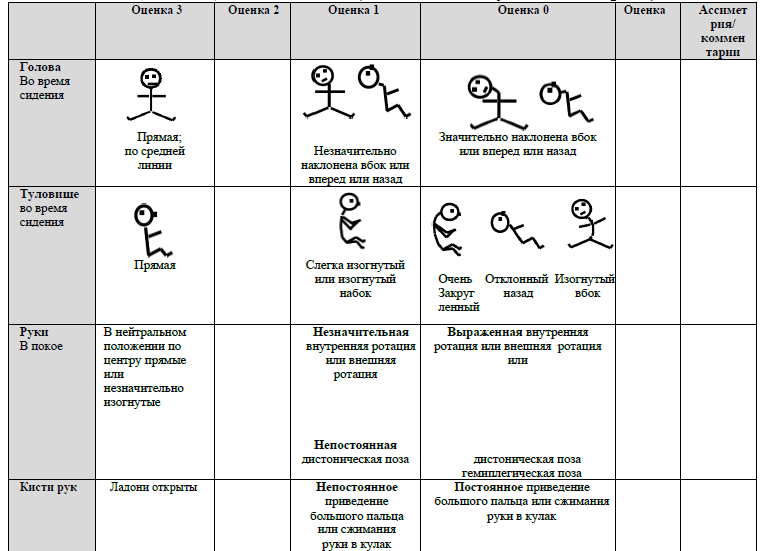
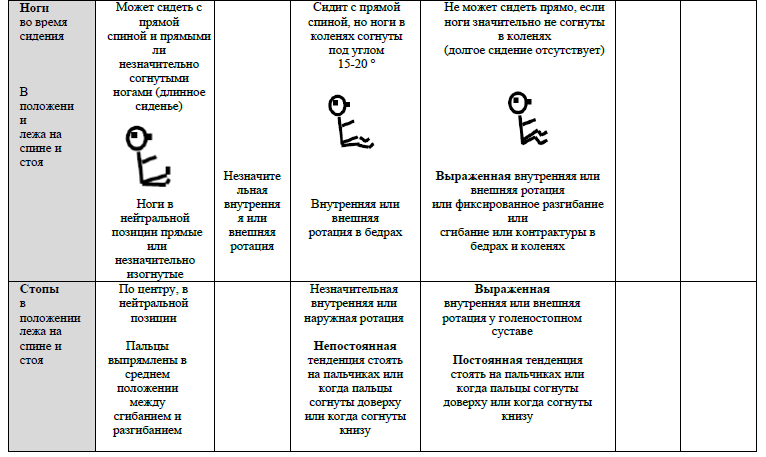
ОЦЕНКА ДВИЖЕНИЙ
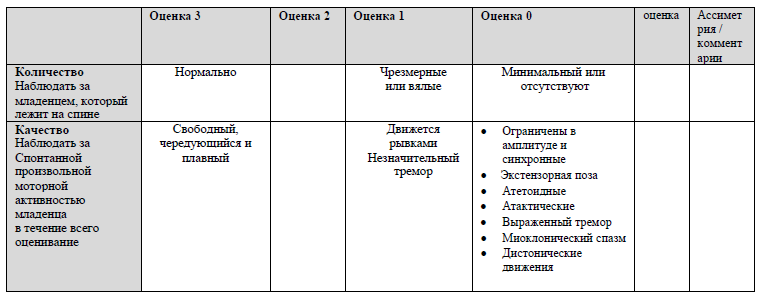
ОЦЕНКА ТОНУСА
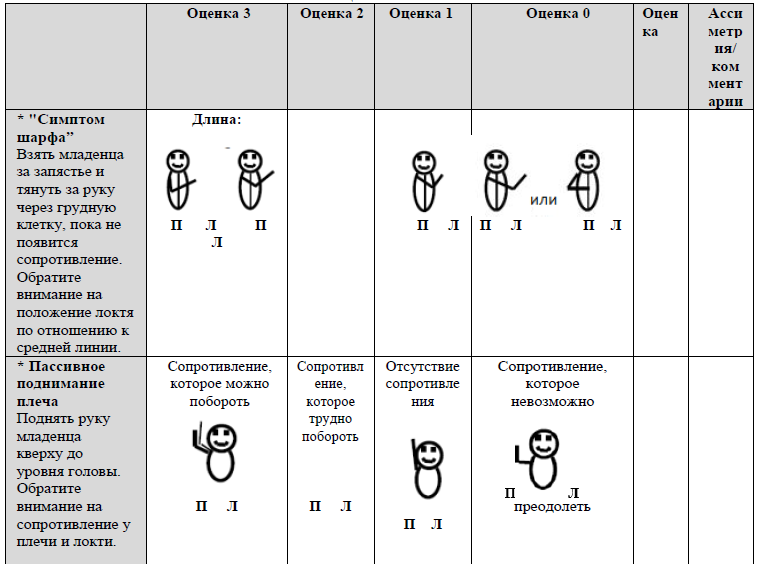
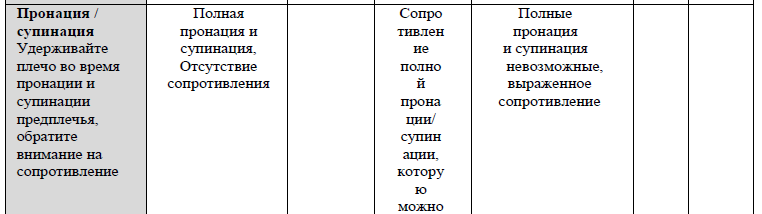
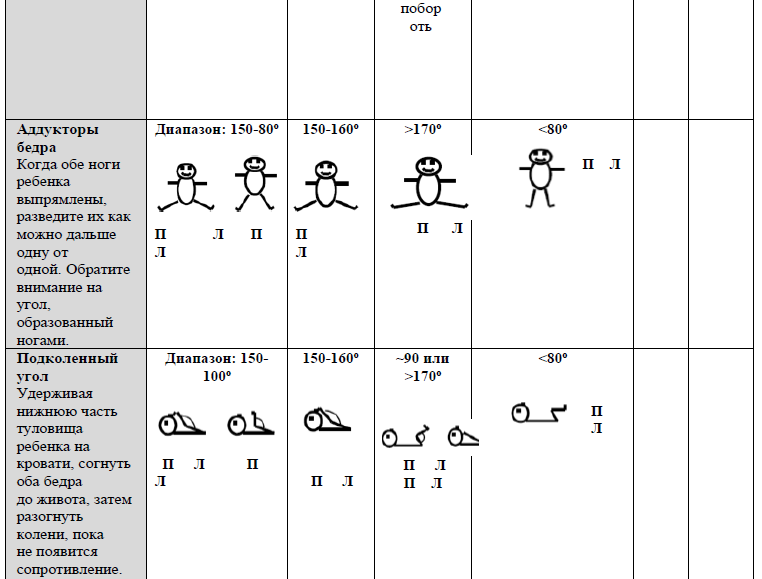
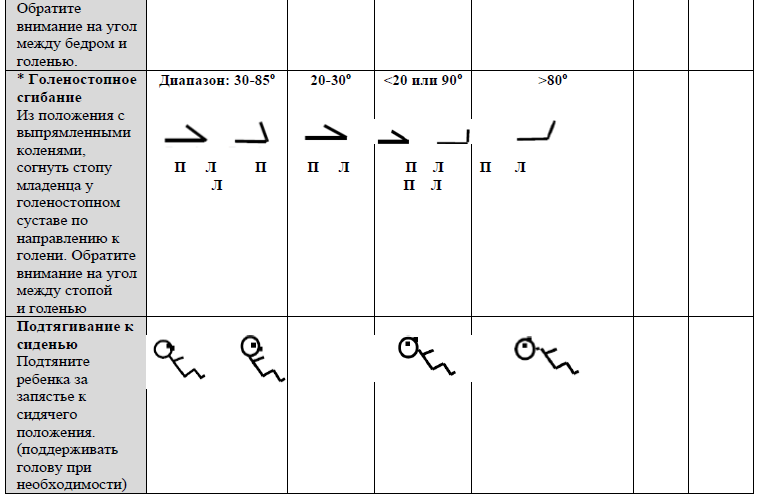
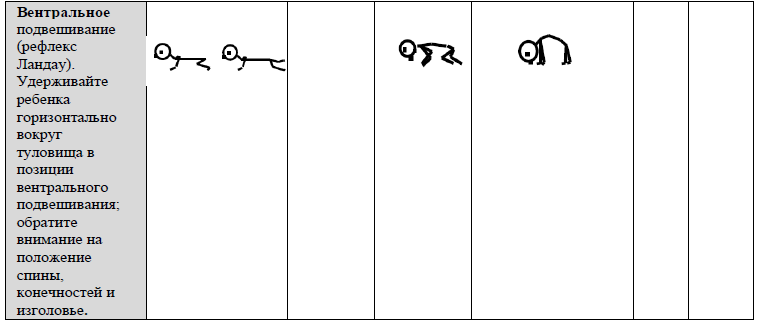
РЕФЛЕКСЫ И РЕАКЦИИ
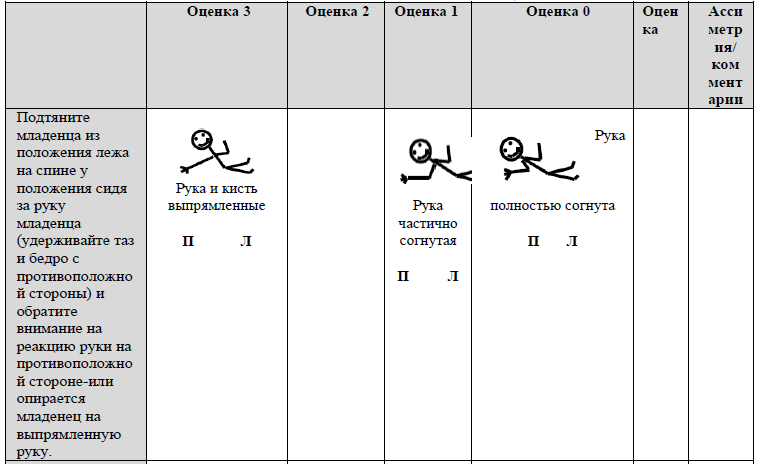
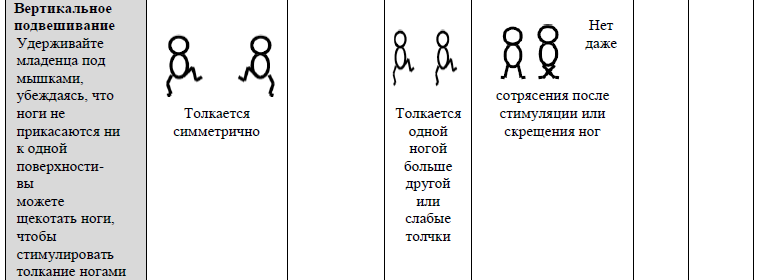
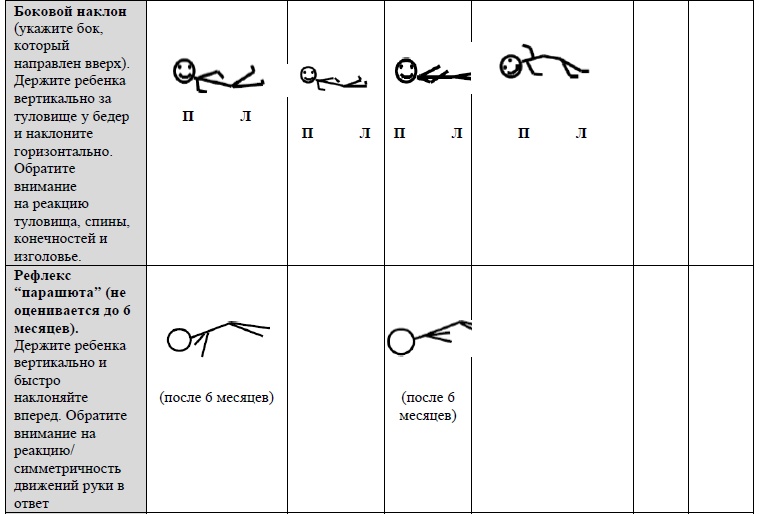

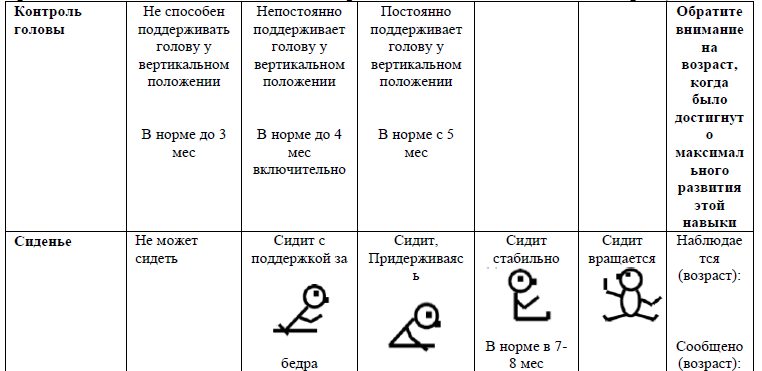
2 СЕКЦИЯ. ЭТАПЫ МОТОРНОГО РАЗВИТИЯ (не выставляется оценка в рамках основного оценивания; обратить внимание на асимметрии)
3 СЕКЦИЯ. ПОВЕДЕНИЕ МЛАДЕНЦА (оценка в рамках основного оценивания не выставляется)
| 1 | 2 | 3 | 4 | 5 | 6 | Комментарии | |
|
Состояние
сознания
|
Невозможно
разбудить
|
Младенец вялый,
сонный
|
Спит, но
Легко
просыпается
|
Не спит, но не
обнаруживает заинтересованности
|
Теряет
заинтересованность
|
Поддерживает заинтересованность | |
|
Эмоциональное
состояние
|
Раздражающее,
невозможно
успокаивать
|
Раздражающее;
можно успокоить
|
Становится
раздражительным
при контакте
|
Спокойное, без
эмоций
|
Счастливое и
улыбающееся
|
||
|
Социальная
ориентация
|
Избегает
взаимодействия,
замкнутый
|
Неуверенный,
нерешительно
взаимодействует
|
Взаимодействует с
окружающими
|
Дружеское |
Официальная версия на сайте: www.hammersmith-neuro-exam.com.
Hammersmith Infant Neurological Examination (Неврологическое обследование младенцев Хаммерсмит) - является одним из мировых стандартов неврологической оценки. Неврологическое обследование младенцев Хаммерсмит - практическое, быстрое и легкое в исполнении. Оно разработано для осмотра недоношенных детей и младенцев в возрасте от 3 до 24 месяцев. Ориганальный вариант оценки, находится на официальном сайте www.hammersmith-neuro-exam.com. Результаты обследования позволяют оценить риск развития детского церебрального паралича (ДЦП) и прогнозировать формирование самостоятельного сидения и ходьбы у детей с ДЦП. Первая версия этого обследования была разработана доктором Лили Дубовица (Lilly Dubowitz) и ее мужем, профессором лондонского университета Виктором Дубовица (Victor Dubowitz) в 1981 году. В 1998 году доктор Эудженио Меркури (Eugenio Mercuri) обновил и усовершенствовал методику проведения оценки. Обследование стандартизировано на больших когортах детей как без особенностей развития, так и с неврологической патологией. Оно рекомендуется для применения в клинической практике и в научных исследованиях. Неврологическое обследование состоит из 26 пунктов, которые разделены на 5 категорий и оценивают функции черепно-мозговых нервов, позы тела, движений, тонуса, рефлексов и реакций.
Каждый пункт оценивается по четырехбалльной шкале с обязательным указанием асимметрий, наблюдающихся при выполнении обследования. Отдельно оцениваются этапы моторного развития ребенка с указанием возраста, когда был достигнут определенного уровня развития двигательных навыков, таких как контроль головы, хватания, сидения, ползания, переворачивания, стояния и походки.
Последняя секция включает оценку поведения, а именно состояния сознания младенца, его эмоционального состояния и социальной ориентации. Результаты обследования легко заполнить в стандартизированных бланках, что упрощает процесс документирования осмотра и сравнения с предыдущими данными.
Нейрохирургическое лечение
Основными критериями отбора пациентов для операции, с наиболее эффективным ее исходом, являются дети в возрасте от 2 лет; а также пациенты у которых будет отмечаться положительная динамика в функциональном отношении после операции. Решение вопроса об использовании того или иного метода лечения должно осуществляться мультидисциплинарной группой специалистов, включающая нейрохирурга, невролога, нейрофизиолога, ортопеда, физиотерапевта, с учетом неврологического статуса ребенка, данных дополнительных методов исследования, с учетом эффективности ранее проводимого восстановительного лечения [1,2].
Нейрохирургические вмешательства делятся на две большие группы. Первая, это нейромодуляционные: в нее входят имплантация систем для электростимуляции структур головного и спинного мозга и установка баклофеновой помпы. Вторая, это деструктивные виды, которые включают в себя: SDR (Селективная дорзальная ризотомия); Селективная нейротомия; Паллидотомия; DREZ-операция (от анг. Dorsal Root Entry Zone разрушение зоны входа задних корешков) [2]
Приложение 2
Нейрохирургическое лечение
Основными критериями отбора пациентов для операции, с наиболее эффективным ее исходом, являются дети в возрасте от 2 лет; а также пациенты у которых будет отмечаться положительная динамика в функциональном отношении после операции. Решение вопроса об использовании того или иного метода лечения должно осуществляться мультидисциплинарной группой специалистов, включающая нейрохирурга, невролога, нейрофизиолога, ортопеда, физиотерапевта, с учетом неврологического статуса ребенка, данных дополнительных методов исследования, с учетом эффективности ранее проводимого восстановительного лечения [1,2].
Нейрохирургические вмешательства делятся на две большие группы. Первая, это нейромодуляционные: в нее входят имплантация систем для электростимуляции структур головного и спинного мозга и установка баклофеновой помпы. Вторая, это деструктивные виды, которые включают в себя: SDR (Селективная дорзальная ризотомия); Селективная нейротомия; Паллидотомия; DREZ-операция (от анг. Dorsal Root Entry Zone разрушение зоны входа задних корешков) [2]
Общие показания для нейрохирургического лечения:
1) Неэффективность или краткосрочная эффективность, предшествующей консервативной и реабилитационной терапии.
2) Отсутствие, кратковременность или слабый эффект от введения лекарственных препаратов.
3) Статус пациентов, затрудняющий реабилитационное лечение и/или уход за больным,
4) Угроза формирования фиксированных контрактур и деформаций опорно- двигательного аппарата вследствие патологического мышечного тонуса и патологических поз [1,2,3,5].
Общие противопоказания для нейрохирургического лечения:
1) Тяжелые сопутствующие заболевания, инфекционный процесс,
2) Грубые деформации опорно-двигательного аппарата, делающие невозможным выполнение операции и дальнейшее успешное реабилитационное лечение.
3) Пациенты, у которых не будет отмечаться положительная динамика в функциональном отношении после проведенной операции (в перспективе),
4) Отсутствие мотивации пациента и его близких родственников
5) Высокий анестезиологический риск [1,2,3].
Отбор пациентов:
Селективная дорзальная ризотомия (SDR) (УД – А) [6]
Показаниями к операции являются:
- спастический парез нижних и верхних конечностей при ДЦП;
- спастический синдром нижних конечностей при различных состояниях (травма и заболевания спинного мозга, последствия заболеваний и операций на спинном мозге).
Отбор пациентов:
- Дети старше 2-х лет;
- Диагноз спастическая диплегия или тетрапарез;
- История недоношенности, если рожден в срок, то должны иметься типичные признаки спастический диплегии;
- Пациенты, у которых будет отмечаться положительная динамика в функциональном отношении после SDR;
- Незначительные ортопедические деформации;
- Паллиативная операция с целью облегчения ухода за пациентами.
- Пациент или его родители (опекуны) способный заниматься реабилитацией после операции SDR.
Условия и требования:
- Отделение нейрохирургии;
- Операции выполняются врачами нейрохирургами обладающие техникой микрохирургии;
- Врач нейрофизиолог
- Современная, оборудованная операционная;
- Нейрохирургический микроскоп;
- С-дуга;
- Ультразвуковая навигация (опционно, при выборе метода оперативного вмешательства);
- Интраоперационный нейромониторинг;
- Высокоскоростной трепан с осциллирующими пилами, или костный нож для проведения ламинотомии
- Резорбируемые пластины для фиксации дужек позвонков [1,2,3,5,7]
Этапы оперативного вмешательства:
Существуют три метода проведения оперативного вмешательства Селективной дорзальной ризотомии. [1]
1. Метод по Пикоку, расширенный метод с ламинотомией 5-6 дужек позвонков.
2. Метода по Парку или Single level approach
3. Метод по Синду или KIDR (key-hall intralaminar dorsal rhizotomy)
Анестезиологическое пособие: Операция селективная дорзальная ризотомия проводится под общим эндотрахеальным наркозом. Необходима установка мочевого катетера, который будет находится на протяжении нескольких дней после операции. Положение больного на животе в позе обратного Тренделенбурга, головной конец должен располагаться ниже уровня спины, для предотвращения интраоперационной потери ликвора. Под грудной и тазовый отделы должны укладываться валики для снижения легочной и абдоминальной компрессии, что способствует повышению венозного давления. Миорелаксанты используются только на начальном этапе анестезии, необходим для интубации трахеи и укладки пациента. Миорелаксанты длительного действия наряду с наркотиками и аналгетиками должны быть исключены из анестезиологического пособия в связи с их отрицательным влиянием на нейрональную активность, что может блокировать мышечный ответ при стимуляции. В анестезии используются комбинации ингаляционного севофлюрана (или 50-70% диоксида азота) и внутривенное введение суфентанила (или ремифентанил). Для взрослых пациентов можно сочетать препараты профол с севофлюраном, но стоит отметить, что профол может снижать активность записываемого интраоперационного ЭМГ.
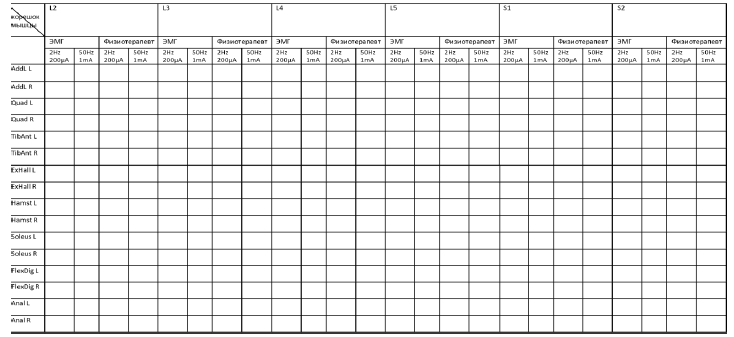
Ход операции: На этапе предоперационной подготовки, после интубации пациента для проведения интраоперационного нейрофизиологического мониторинга вставляются игольчатые электроды в мышцы иннервируемые корешками с уровня L2-S4. В положении на спине: Игольчатые электроды устанавливаются в m. Adductors of hips, m. Quadriceps, m.Tibialis anterior, m. Extensor hallicus longus, затем, после поворота пациента на живот, устанавливаются электроды в следующие зоны: m. Hamstrings m. Soleus/m. Gastrocnemius medianus, m. Flexor Digitorum longus, m. Sphincter ani externus.
Метод Пикока: С помощью эмиссионно- оптического преобразователя (ЭОП) определяют уровень L1-S1. Над остистыми отростками L1-S1 производится разрез. После бескровного скелетирования остистых отростков и дужек L1-S1 позвонков по белой линии, производится ламинотомия, дужек соответствующих позвонков. Ламинотомию желательно проводить осцилирующими (вертикальными) пилами или костным ножом. После изъятия дужек, подкожная эпидуральная клетчатка коагулируется и опускается в эпидуральной пространство ниже, вдоль дурального мешка и сверху укладывается гемостатический материал (типа гемостатической ваты, сетки или пены). Твердая мозговая оболочка (ТМО) вскрывается по средней линии на всем протяжении и подшивается к мышцам, таким образом, чтобы визуализировались фораменальные отверстия.
Интраоперационным ЭНМГ дифференцируют моторные и сенсорные корешки нервов L2-S1. S2 корешок не иссекается в связи с высоким риском возникновения нарушений тазовых органов. Корешки с L2 по S1 с обеих сторон разделяются на двигательные и чувствительные (дорзальные/сенсорные и вентральные/двигательные), и двигательные корешки погружаются по специальные ватнички. Далее моторные корешки не подвергаются инвазии. Затем проводится сепарация каждых чувствительных корешков, выделенных ранее. Для выявления степени поражения, стимулируется импульсами по отдельности. С помощью стимуляционного интраоперационного ЭНМГ биполярным зондом подаются одиночные постоянные импульсы интенсивностью от 0,1 до 1 мА и частотой 2 Гц. Полученные рефлекторные реакции от стимулируемой мышцы фиксируются в таблицу. После дифференцировки для определения патологической степени сенсорного корешка интенсивность стимуляции увеличивается от 1 мА и выше, а частота 50Гц. Полученные электрофизиологические и двигательные ответы от миотом оцениваются по 5-бальной шкале (таблица 1), и в соответствии этой шкалы принимается решение об иссечении корешка (от 25-75%), для получения необходимого клинического эффекта [1,2,3].
Таблица 1. Шкала оценки электрофизиологического ответа по данным интраоперационного нейрофизиологического мониторинга:
Анестезиологическое пособие: Операция селективная дорзальная ризотомия проводится под общим эндотрахеальным наркозом. Необходима установка мочевого катетера, который будет находится на протяжении нескольких дней после операции. Положение больного на животе в позе обратного Тренделенбурга, головной конец должен располагаться ниже уровня спины, для предотвращения интраоперационной потери ликвора. Под грудной и тазовый отделы должны укладываться валики для снижения легочной и абдоминальной компрессии, что способствует повышению венозного давления. Миорелаксанты используются только на начальном этапе анестезии, необходим для интубации трахеи и укладки пациента. Миорелаксанты длительного действия наряду с наркотиками и аналгетиками должны быть исключены из анестезиологического пособия в связи с их отрицательным влиянием на нейрональную активность, что может блокировать мышечный ответ при стимуляции. В анестезии используются комбинации ингаляционного севофлюрана (или 50-70% диоксида азота) и внутривенное введение суфентанила (или ремифентанил). Для взрослых пациентов можно сочетать препараты профол с севофлюраном, но стоит отметить, что профол может снижать активность записываемого интраоперационного ЭМГ.
Ход операции: На этапе предоперационной подготовки, после интубации пациента для проведения интраоперационного нейрофизиологического мониторинга вставляются игольчатые электроды в мышцы иннервируемые корешками с уровня L2-S4. В положении на спине: Игольчатые электроды устанавливаются в m. Adductors of hips, m. Quadriceps, m.Tibialis anterior, m. Extensor hallicus longus, затем, после поворота пациента на живот, устанавливаются электроды в следующие зоны: m. Hamstrings m. Soleus/m. Gastrocnemius medianus, m. Flexor Digitorum longus, m. Sphincter ani externus.
Метод Пикока: С помощью эмиссионно- оптического преобразователя (ЭОП) определяют уровень L1-S1. Над остистыми отростками L1-S1 производится разрез. После бескровного скелетирования остистых отростков и дужек L1-S1 позвонков по белой линии, производится ламинотомия, дужек соответствующих позвонков. Ламинотомию желательно проводить осцилирующими (вертикальными) пилами или костным ножом. После изъятия дужек, подкожная эпидуральная клетчатка коагулируется и опускается в эпидуральной пространство ниже, вдоль дурального мешка и сверху укладывается гемостатический материал (типа гемостатической ваты, сетки или пены). Твердая мозговая оболочка (ТМО) вскрывается по средней линии на всем протяжении и подшивается к мышцам, таким образом, чтобы визуализировались фораменальные отверстия.
Интраоперационным ЭНМГ дифференцируют моторные и сенсорные корешки нервов L2-S1. S2 корешок не иссекается в связи с высоким риском возникновения нарушений тазовых органов. Корешки с L2 по S1 с обеих сторон разделяются на двигательные и чувствительные (дорзальные/сенсорные и вентральные/двигательные), и двигательные корешки погружаются по специальные ватнички. Далее моторные корешки не подвергаются инвазии. Затем проводится сепарация каждых чувствительных корешков, выделенных ранее. Для выявления степени поражения, стимулируется импульсами по отдельности. С помощью стимуляционного интраоперационного ЭНМГ биполярным зондом подаются одиночные постоянные импульсы интенсивностью от 0,1 до 1 мА и частотой 2 Гц. Полученные рефлекторные реакции от стимулируемой мышцы фиксируются в таблицу. После дифференцировки для определения патологической степени сенсорного корешка интенсивность стимуляции увеличивается от 1 мА и выше, а частота 50Гц. Полученные электрофизиологические и двигательные ответы от миотом оцениваются по 5-бальной шкале (таблица 1), и в соответствии этой шкалы принимается решение об иссечении корешка (от 25-75%), для получения необходимого клинического эффекта [1,2,3].
Интраоперационно, врачом нейрофизиологом заполняется таблица (таблица 2). Также обязательным требованием является нахождение врача невролога-нейрофизиолога при стимуляции волокон для определения мышечного ответа мануально. Все манипуляции проводятся с применением микроскопа или бинокулярной лупы. После завершения ризотомии, плотно ушивается ТМО, дужки позвонков устанавливаются на место и фиксируются резорбируемыми пластинами (при наличии), с целью предотвращения или снижения риска послеоперационных отсроченных деформаций позвоночного столба [1,2,3,5], так же для начала ранней послеоперационной реабилитации.
Таблица 1. Шкала оценки электрофизиологического ответа по данным интраоперационного нейрофизиологического мониторинга:
|
Градация
|
ЭНМГ ответ |
| 0 | нерегулярные или единичные разряды при последовательной импульсной стимуляции |
| 1 | Регулярные разряды мышц, иннервирующие одноимённым сегментом с ипсилатеральной стороны |
| 2 | Регулярные разряды мышц, иннервирующие одноимённым сегментом и рядом расположенный сегмент |
| 3 | Регулярные разряды от сегмента иннервирующую мышцу и мышц иннервируемые дистальными сегментами |
| 4 | Регулярные разряды с контрлатеральных с или без регулярных разрядов с ипсилатеральной мышцы |
Таблица 2.
Результаты после SDR [1-3,7,8,9].
- Снижение патологического мышечного тонуса;
- Улучшается походка, лучше сидят (>70%);
- Изменяются сухожильные рефлексы, угасают клонусы, происходит значительное увеличение объема пассивных и активных движений
- Возможность обслуживать себя;
- Уменьшение боли и их кратковременность;
- Сокращается период выздоровления;
- Можно раньше начать реабилитацию;
- Продолжительный эффект (>10 лет);
- Улучшается когнитивная функция (возможно);
- Снижается риск спинальной деформации.
- Снижение спастики по шкале Эшворда (*%).
Возможные послеоперационные осложнения: [1-5,7,8]
Наблюдаются примерно у 15% пациентов и преимущественно являются преходящими.
1. Дерматомы с потерей чувствительности в нижних конечностях и повышенная чувствительность стоп.
2. Может измениться функционирование кишечника и мочевого пузыря, причем у детей с нормальной деятельностью мочевого пузыря может возникнуть необходимость в периодической катетеризации для его опорожнения (2%).
Таблица 3. Группы мышц и нервы иннервирующие нижние конечности
Таблица 2. Группы мышц и нервы иннервирующие верхние конечности
Результаты после селективной невротомии
3. SDR не в состоянии ликвидировать спастику полностью. Операция не гарантирует то, что в будущем у ребенка не возникнет необходимость в проведении ортопедических хирургических вмешательств.
4. В <1% существует риск занесения операционной инфекции.
5. Риск возникновения ликворной подушки и ликвореи.

Селективная невротомия
Цель селективной невротомии заключается в восстановлении баланса тонуса между агонистами и антагонистами мышечной группы для снижения ее спастики. Снижение спастичности заключается в пересечении афферентных и эфферентных волокон на уровне в непосредственной близости к иннервируемой мышце. Группы мышц и нервы, иннервирующие те или иные мышцы указаны в таблице 3 и 4. [1,11]
Таблица 3. Группы мышц и нервы иннервирующие нижние конечности
|
Область
|
Клиническая картина | Задействованные мышцы | Иннервирующий нерв |
|
Тазобедренный сустав
|
Согнутое бедро
|
m. psoas, iliacus, rectus femoris. |
Ветвь от поясничного сплетения.
Бедренный нерв
|
|
Бедро
|
Отведенное бедро
|
Группа аддукторов (mm. Longus, brevis, magnus), gracilis, obturator externus, pectineus
|
Запирательный нерв
|
| Колено |
Вытянутое колено
Согнутое колено
|
Группа четырехглавой мышцы (mm. rectusfemoris, vastusintermedius, vastusmedialis, vastuslateralis)
Задняя группа мышц бедра (mm. Bicepsfemoris, semitendinosus, semimembranosus)
|
Бедренный нерв Седалищный нерв |
|
Голеностопный сустав
|
Эквиноварус |
Эквинус (mm. gastrocnemius, soleus, popliteal)
Варус (mm. Tibialis posterior)
|
Большеберцовый нерв
|
| Пальцы |
«Когтистая» лапа.
Деформация большого пальца стопы (симптом Хитчхикерса)
|
m. Flexor digitorum longus et brevis, flexor halluces longus. m. Extensor halluces longus |
Большеберцовый нерв
Подошвенный нерв |
Таблица 2. Группы мышц и нервы иннервирующие верхние конечности
|
Область
|
Клиническая картина | Задействованные мышцы | Иннервирующий нерв |
| Плечо |
Приведенное и внутрь ротированное плечо
|
mm. Pectoralis major et teres major |
Латеральный и медиальный грудной нервы,
Нижний подлопаточный нерв
|
| Локоть |
Конечность согнута в локтевом суставе
|
Coracobrachialis, biceps, brachialis |
Кожномышечный нерв
|
| Предплечье |
Пронированное предплечье
|
Pronator quadratus et teres | Срединный нерв |
| Запястье |
Согнутое запястье
|
Flexor carpi radialis, palmaris longus, flexor carpi ulnaris
|
Срединный нерв
Локтевой нерв
|
|
Большой палец
|
Согнутый в ладони
|
Flexor pollicis longus, adductor et opponents pollicis |
Срединный нерв
Локтевой нерв
|
| Пальцы |
Сжатый Кулак
Деформация пальцев кисти по типу «лебединной» шеи
|
Flexor digitorum superfacialis, flexor digitprum profundus Первый и второй mm. Lumbricales et Palmar interossei Третий и четвертый mm. Lumbricales et Palmar interossei |
Срединный нерв
Срединный нерв
Локтевой нерв
|
Показания к операции:
1. Фокальные спастические синдромы в случаях резистентности к ботулинотерапии.
2. Фокальные формы вторичной мышечной дистонии в случаях рези-стентности к ботулинотерапии [11].
3. Невротомии на нижних конечностях обычно выполняются при эквинусной деформации стопы (невротомия большеберцового нерва).
4. При изолированном перекресте нижних конечностей (невротомия запирательного нерва).
5. Невротомии на верхних конечностях выполняются при миогенных контрактурах локтевого сустава (невротомия мышечно-кожного нерва).
6. При сгибательных контрактурах лучезапястного сустава (невротомия срединного и локтевого нервов).
Условия и требования:
1. Отделение нейрохирургии;
2. Врач невролог-нейрофизиолог
3. Операции выполняются врачами нейрохирургами обладающие техникой микрохирургии;
4. Современная, оборудованная операционная;
5. Нейрохирургический микроскоп;
6. Интраоперационный нейромониторинг;
Селективная невротомия — это метод, основанный на выделении необходимого нерва (в зависимости от топического расположения), разделение его на чувствительную и двигательные ветви, которые верифицируются с помощью интраоперационного нейромониторирования. После чего двигательную часть нерва разделяют на волокна (3-4 фасцикулы). Под контролем интраоперационной электростимуляции пересекается до 75% фасцикул. Отрезанные фасцикулы отделяются и пересекаются в непосредственной близости к патологически иннервируемой мышце на протяжении не менее 5 мм и должны быть хорошо прокоагулированы биполярным коагулятором, для профилактики реиннервации. После пересечения мышечных фасцикул проводится повторная электростимуляция нервного ствола. Если при стимуляции сохраняются патологические высокоамплитудные мышечные ответы, производится дополнительное пересечение мышечных ветвей [1,10,11,12].
Результаты после селективной невротомии
Достигается устойчивый клинический эффект в виде снижения мышечного тонуса и регресса миогенных контрактур [12].
Возможные послеоперационные осложнения:
1. В <1% существует риск занесения операционной инфекции.
2. Риск реинервации нерва.
Показания к ITB:
Интратекальная терапия баклофеном (ITB).
УД – «А» [26,27]
Пролонгированная интратекальная терапия баклофеном проводится с помощью специального программируемого устройства. Обязательным условием применения метода является эффективность баклофенового скрининг-теста и возможности имплантации корпуса помпы.
Показания к ITB:
1. спастические пара- и тетрапарезы,
2. вторичная мышечная дистония,
3. гиперкинетическая форма ДЦП.
Баклофен является производным основного тормозного медиатора ЦНС гамма-аминомасляной кислоты (ГАМК). Препарат действует на уровне мотонейронов спинного мозга, вызывая усиление торможения мотонейронов и угнетение миотатических рефлексов. Результатом применения баклофена является снижение тяжести спастического синдрома, дистонии и гиперкинезов. Таблетированная форма баклофена имеет низкую биодоступность. Соотношение его концентрации в крови к концентрации в спинномозговой жидкости составляет не более 10/1. В связи с низкой доступностью перорального баклофена и большим количеством побочных эффектов были разработаны прямые способы доставки препарата в спинномозговую жидкость при помощи имплантируемых помп. [1,22]
ITB противопоказано у больных с прогрессирующими деформациями позвоночного столба и фармакорезистентными формами эпилепсии.
Баклофен является производным основного тормозного медиатора ЦНС гамма-аминомасляной кислоты (ГАМК). Препарат действует на уровне мотонейронов спинного мозга, вызывая усиление торможения мотонейронов и угнетение миотатических рефлексов. Результатом применения баклофена является снижение тяжести спастического синдрома, дистонии и гиперкинезов. Таблетированная форма баклофена имеет низкую биодоступность. Соотношение его концентрации в крови к концентрации в спинномозговой жидкости составляет не более 10/1. В связи с низкой доступностью перорального баклофена и большим количеством побочных эффектов были разработаны прямые способы доставки препарата в спинномозговую жидкость при помощи имплантируемых помп. [1,22]
Баклофеновый скрининг-тест должен проводиться в стационаре в нейрохирургическом отделении, в присутствии невролога и реаниматолога. Вес пациента должен быть не менее Используется для оценки чувствительности пациента к интратекальной терапии баклофеном. Для скрининг-теста используются специальные ампулы по 1 мл, содержащие 50 мкг баклофена. Проводится люмбальная пункция, вводится тестовая доза препарата в спинномозговую жидкость. Начальная доза для детей - 25 мкг (0,5 мл), для взрослых - 50 мкг (1,0 мл). При отсутствии эффекта при первом введении, тест повторяют через 24 часа с увеличенной дозой. Максимальная дозировка - 100 мкг (2,0 мл). Тест считается положительным при снижении мышечного тонуса на 1 балл и более по шкале Эшворт [1,22]. При отсутствии изменений тонуса пациент исключается из кандидатов для имплантации баклофеновой помпы.
Методика операции.
Операция проводится под общей анестезией. Положение больного - лежа на боку. Разрез кожи проводится в проекции остистых отростков L3- L5. Пункция субарахноидального пространства осуществляется из косого парамедианного доступа: под углом 30 градусов к апоневрозу и по направлению к средней линии. После получения ликвора через иглу производится имплантация интратекального катетера. Продвижение катетера контролируется рентгенологически. При нижнем спастическом парапарезе уровень имплантации соответствует среднегрудному отделу позвоночника (Th6-Th7). При спастическом тетрапарезе катетер имплантируется на шейный уровень не выше С3 позвонка [1,4]. После верификации положения катетера вокруг места вкола иглы в апоневроз накладывается кисетный шов. Игла и мандрен извлекаются. После этого затягивается кисетный шов вокруг катетера, и он фиксируется к апоневрозу при помощи якоря. Производится разрез в подреберной области (обычно слева) и формируется карман для помпы в подапоневротическом пространстве. Помпа должна быть размещена таким образом, чтобы сверху не касаться края реберной дуги, снизу - подвздошной кости, медиально – не пересекать среднюю линию.
Перед имплантацией из помпы извлекается физиологический раствор и резервуар заполняется баклофеном (20 или 40 мл в зависимости от объема помпы). Далее к помпе присоединяется помповый сегмент катетера. Его необходимо заполнить физиологическим раствором через порт катетера для профилактики появления воздушных пузырей в системе. Помповый сегмент катетера проводится на спину при помощи проводника и соединяется со спинальным сегментом. Помпа укладывается в карман и фиксируется швами к апоневрозу. Петли катетера укладываются под помпу [1,4,20,21,22]. Помпа активируется после имплантации. Стартовая скорость интратекальной инфузии зависит от результата скрининг-теста. В том случае, если при тесте был получен выраженный клинический эффект, стартовая скорость равна дозе баклофена, введенном при тесте. В том случае, если динамика тонуса при тесте была небольшая, устанавливается скорость в 1,5 раза больше тестовой (опция). Период титрации дозы баклофена после операции занимает около 2 месяцев. В течение этого срока подбирается оптимальная скорость и режим инфузии баклофена. Чаще всего используется простой режим инфузии, когда препарат подается в течение суток с постоянной скоростью. Если у пациента отмечаются колебания мышечного тонуса в течение дня, особенно у больных с ночными двигательными автоматизмами, применяется гибкий режим инфузии. Он позволяет изменять скорость инфузии баклофена в течение суток. Перезаправка помпы должна проводиться в отделении нейрохирургии, врачом нейрохирургом или невропатологом отделения. Особенностью хронической интратекальной терапии является необходимость периодических заправок помпы баклофеном. Частота заправок помпы зависит от параметров интратекальной инфузии. В среднем эта процедура требуется 4-5 раз в год. Процедура, проводится в условиях процедурного кабинета или перевязочной. Для заправки помпы требуется интратекальный баклофен и одноразовый заправочный набор (refill kit). Максимальный временной промежуток между заправками не должен превышать 80 дней. Для заправки обязательно используется одноразовый заправочный набор, который включает в себя заправочный шприц, иглы, соединительный шланг и бактериальный фильтр.
Использование заправочного набора позволяет минимизировать риск инфекционных осложнений. При заправке пунктируется порт на передней поверхности помпы и эвакуируются остатки препарата. Новый препарат вводится в резервуар помпы через бактериальный фильтр. После заправки проводится перепрограммирование помпы, и, если это необходимо, корректируются параметры интратекальной инфузии. После перепрограммирования помпа автоматически определяет дату очередной заправки. К моменту очередной заправки объем препарата в помпе достигает критического значения (обычно программируется равным 1,5-2 мл). Если не произвести заправку в срок, помпа начнет подавать сигнал тревоги, однако препарат будет еще в течение нескольких дней поступать в организм за счет резервного объема. Если резерв препарата будет истощен, интратекальная инфузия препарата прекратится. Это приведет к повреждению помпы и развитию у пациента синдрома отмены.
Использование заправочного набора позволяет минимизировать риск инфекционных осложнений. При заправке пунктируется порт на передней поверхности помпы и эвакуируются остатки препарата. Новый препарат вводится в резервуар помпы через бактериальный фильтр. После заправки проводится перепрограммирование помпы, и, если это необходимо, корректируются параметры интратекальной инфузии. После перепрограммирования помпа автоматически определяет дату очередной заправки. К моменту очередной заправки объем препарата в помпе достигает критического значения (обычно программируется равным 1,5-2 мл). Если не произвести заправку в срок, помпа начнет подавать сигнал тревоги, однако препарат будет еще в течение нескольких дней поступать в организм за счет резервного объема. Если резерв препарата будет истощен, интратекальная инфузия препарата прекратится. Это приведет к повреждению помпы и развитию у пациента синдрома отмены.
Осложнения интратекальной терапии.
Осложнения интратекальной терапии могут быть связаны как с нарушением подачи препарата в спинномозговую жидкость, так и с реакцией организма на имплант. [23] Нарушения подачи баклофена могут приводить как к передозировке лекарства, так и к его недостаточному поступлению. Внезапное прекращение интратекальной терапии баклофеном представляет собой угрожающее жизни состояние. В связи с этим пропускать очередную заправку помпы недопустимо. Заправка помпы может осуществляться в любых клиниках, где имеется обученный персонал и специальный программатор. В случае появления первых признаков осложнений интратекальной терапии больной должен быть немедленно доставлен в стационар.
Причины:
Симптомы отмены интратекального баклофена:
Высокая температура, изменение психологического состояния, усиление спастичности и мышечной ригидности, что, в редких случаях, переходит в рабдомиолиз, полиорганную недостаточность и смерть. Состояние может походить на автономную дисрефлексию, сепсис, злокачественную гипертермию, злокачественный нейролептический синдром.
Причины:
1) обструкция или выпадение катетера;
2) отсоединение системы;
3) ошибки заправки;
4) ошибки программирования;
5) повреждение помпы, истощение ресурса батареи помпы.
Лечение:
1) Перевод в отделение реанимации.
2) Начало мероприятий по поддержанию витальных функций (если необходимо).
3) Связаться со специалистом по баклофеновой терапии, даже если симптомы имеют легкую степень.
4) При невозможности связаться со специалистом:
- Использовать высокую дозу перорального или энтерального баклофена согласно инструкции по применению препарата.
- Внутривенное введение бензодиазепинов путем непрерывной или болюсной инфузии, титруя дозу до момента достижения желаемого терапевтического эффекта.
- Начать мероприятия для восстановления инфузии баклофена - провести диагностику системы.
- Сообщить лечащему врачу и в компанию-производитель устройства.
Синдром передозировки интратекального баклофена.
Симптомы:
Вялость, предобморочное состояние, головокружение, сонливость, дыхательная недостаточность, пароксизмы, прогрессирование гипотонии в ростральном направлении, потеря сознания, переходящая в кому.
Причины:
- повышение температуры тела - увеличение скорости инфузии баклофена;
- колебание атмосферного давления (полет на самолете, применение барокамеры);
- ошибки заправки;
- ошибки программирования;
- неисправность помпы.
Диагностика системы для интратекальной терапии и проводится исключительно обученным врачом.
Лечение:
1) Перевод в отделение реанимации.
2) Начало мероприятий по поддержанию витальных функций (если необходимо).
3) Опустошить резервуар помпы. При длительности опустошения более 2 дней- заполнить резервуар физиологическим раствором.
4) Прием физостигмина. Для взрослых: 0,5-1,0 мг в/м или в/в при медленной контролируемой скорости введения не более 1 мг/мин. Если желаемый ответ не получен, можно повторять каждые 10-30 минут. Для детей: 0,02 мг/кг внутримышечно или внутривенно, не более 0,5 мг/мин. Можно повторять каждые 5-10 минут (максимум до 2 мг).
5) Произвести забор 30-40 мл ликвора посредством люмбальной пункции или через порт прямого доступа к катетеру (игла 24) для снижения концентрации баклофена.
6) Сообщить лечащему врачу и в компанию-производитель устройства.
Диагностика системы для интратекальной терапии и проводится исключительно обученным врачом.
Для диагностики помпы необходимо провести сканирование, проверить концентрацию препарата, скорость интратекальной инфузии, дату перезаправки и срок службы батареи помпы. С целью диагностики системы необходимо сделать рентгенографию компонентом помпы. При рентгенологическом исследовании можно визуализировать смещение, перекрут или отсоединение катетера. В том случае, если при рентгенологическом исследовании не обнаружено проблем, связанных с катетером, необходимо проверить проходимость катетера [25]. С этой целью необходимо пунктировать порт катетера и аспирировать ликвор. В случае, если ликвор не получен, речь идет об обструкции катетера. Если катетер проходим, то проблема может быть связана с работой помпы. С целью диагностики помпы производят рентгеновские снимки помпы в прямой проекции с временным интервалом в 1 час. В том случае, если не регистрируется поворот рентгенологических меток ротора помпы (для помп с роторным механизмом), диагностируется ее дисфункция. До тех пор, пока работоспособность системы не будет восстановлена, больной переводится на таблетированный баклофен. После выполнения ревизии и восстановления функции помпы, постепенно наращивается скорость интратекальной инфузии, а таблетированный препарат отменяется. ITB в течение нескольких месяцев приводит к стойкому снижению спастичности в верхних и нижних конечностях. Помимо снижения мышечного тонуса в конечностях, ITB также имеет существенное влияние на тонус туловищной мускулатуры. Вместе с этим улучшаются локомоторные функции больных [26].
Микрохирургическая DREZ-томия или деструкция места вхождения дорзальных корешков в спинной мозг.
Техника оперативного вмешательства была названа микрохирургическая DREZ-томия, так как используется микрохирургическая техника с использованием микрохирургического биполярного коагуляционного пинцета для деструкции проводящих путей. Метод направлен на селективное разрушение мелких миелиновых волокон (ноцицептивные волокна), а также широкие миелиновые миотатические волокна расположенные латерально и центрально (первичные сенсорные афферентные волокна). Анестезиологическое пособие и укладка пациента проводится аналогично операции селективная дорзальная ризотомия. Доступ маркируется под контролем ЭОП, ламинотомия или гемиламинэктомия (по показаниям) производится на уровне предполагаемой DREZ-томии. В шейном отделе с уровня С4-С7. В поясничном отделе ламинотомия или гемиламинэктомия (по показаниям) проводится на уровне Т10-L2. В основе DREZ-томии лежит микрохирургическое разрушение волокон: при болях до 3-х мм, при спастике до 5 мм, с углом вхождения 35 градусов в шейном отделе и 45 градусов в пояснично-крестцовом отделе спинного мозга, в зависимости от расположения дорзальных рогов [1].
Цель стимуляции топографическое определение уровня, предстоящей DREZ-томии. В шейном отделе он соответствует уровню С4-С8. Для стимуляции требуется биполярный зонд, игольчатые электроды, установленные на мышцы m. Deloid, m. Biceps brachii, m. Extensor carpi radialis longus, m. Abductor digiti minimi, m.Abductor policis brevis. Параметры стимуляции дорзальных колон начинаются при интенсивности от 0,2 до 1 мА, с частотой 2 Гц и длительностью импульса прямоугольной волны 0,1 мс. При стимуляции сегмента С4 появляется ответ на аппарате ИВЛ в виде проявления дополнительного спонтанного дыхания на фоне полной анестезии и мануально сокращения диафрагмы (на краю реберной дуги) из-за раздражения диафрагмального нерва.
В поясничном отделе стимуляция регистрируется от мышц m. Adductors of hips, m. Quadriceps, m.Tibialis anterior, m. Extensor hallicus longus, m. Hamstrings m. Soleus/m. Gastrocnemius medianus, m. Flexor Digitorum longus, m. Sphincter ani externus.
Хроническая электростимуляция спинного мозга (SCS)
Показания для применения хронической электростимуляции спинного мозга (SCS) - нижний спастический парапарез с умеренным уровнем спастичности (не более 3 баллов), без признаков вторичной мышечной дистонии и гиперкинетического синдрома[17].
При SCS электрическое воздействие происходит в области вхождения задних корешков спинного мозга на уровне поясничного утолщения. Развитие функционального блока проведения на мембране миотатических волокон может лежать в основе снижения спастичности [18].
Операция проводится в положении больного лежа на животе. Пункция эпидурального пространства выполняется на поясничном уровне под рентгенологическим контролем. Электрод (электроды) имплантируется в проекции поясничного утолщения спинного мозга. При интраоперационной стимуляции необходимо получить мышечные ответы от икроножных мышц, передней и задней группы мышц бедра, приводящих мышц, мышц поясницы. Электроды фиксируется к апоневрозу и через временные коннекторы выводятся наружу. В тестовом периоде оценивается степень влияния электростимуляции на тяжесть спастического синдрома. При положительном результате тестовой электростимуляции проводится имплантация подкожного генератора электрических импульсов. Имплантация генератора импульсов проводится в подвздошную или ягодичную область. Для предотвращения смещения генератор импульсов фиксируется при помощи швов к окружающим тканям. [17] Пациенту подбирается индивидуальная программа нейростимуляции. Длительность сеансов электростимуляции составляет обычно 10-15 минут с кратностью 3-6 раз в сутки. В некоторых случаях применяется постоянный режим стимуляции. Лимитирующим критерием длительности нейростимуляции служит появление признаков избыточной стимуляции: мышечная слабость, ощущение тяжести в ногах, императивные позывы на мочеиспускание и дефекацию. Оптимальным эффектом считается снижение спастичности до 1-1,5 баллов по Ashworth, регресс миогенных контрактур при отсутствии признаков избыточной стимуляции. [17,18,19] При тяжелых спастических парапарезах и тетрапарезах эффективность SCS может быть недостаточной [17].
Операция проводится в положении больного лежа на животе. Пункция эпидурального пространства выполняется на поясничном уровне под рентгенологическим контролем. Электрод (электроды) имплантируется в проекции поясничного утолщения спинного мозга. При интраоперационной стимуляции необходимо получить мышечные ответы от икроножных мышц, передней и задней группы мышц бедра, приводящих мышц, мышц поясницы. Электроды фиксируется к апоневрозу и через временные коннекторы выводятся наружу. В тестовом периоде оценивается степень влияния электростимуляции на тяжесть спастического синдрома. При положительном результате тестовой электростимуляции проводится имплантация подкожного генератора электрических импульсов. Имплантация генератора импульсов проводится в подвздошную или ягодичную область. Для предотвращения смещения генератор импульсов фиксируется при помощи швов к окружающим тканям. [17] Пациенту подбирается индивидуальная программа нейростимуляции. Длительность сеансов электростимуляции составляет обычно 10-15 минут с кратностью 3-6 раз в сутки. В некоторых случаях применяется постоянный режим стимуляции. Лимитирующим критерием длительности нейростимуляции служит появление признаков избыточной стимуляции: мышечная слабость, ощущение тяжести в ногах, императивные позывы на мочеиспускание и дефекацию. Оптимальным эффектом считается снижение спастичности до 1-1,5 баллов по Ashworth, регресс миогенных контрактур при отсутствии признаков избыточной стимуляции. [17,18,19] При тяжелых спастических парапарезах и тетрапарезах эффективность SCS может быть недостаточной [17].
Операции на глубоких структурах головного мозга.
Деструктивные операции на подкорковых структурах головного мозга могут быть рассмотрены при гиперкинетической форме ЦП и/или вторичной мышечной дистонии, при отрицательном баклофеновом скрининг-тесте. Принцип операций заключается в разрушении определенных подкорковых структур, что приводит к прерыванию патологической активности, участвующей в формировании гиперкинезов и дистонии. В случае преобладания в клинической картине гиперкинетического синдрома оперативное вмешательство производится на ядрах таламуса (вентральное промежуточное - Vim, заднее вентро-оральное -Vop). При преобладании дистонии - на внутреннем сегменте бледного шара (GPi).
Хроническая электростимуляция глубоких структур мозга (DBS) применяется в ряде случаев при вторичной дистонии и гиперкинетической форме ЦП. Эффективность этой методики не превышает 50%. Показания к DBS у больных с ЦП возникают при отсутствии ответа на баклофеновый скрининг-тест или при других противопоказаниях для проведения ITB (опция). Мишенями для электростимуляции служат те же структуры, которые используются для деструкции. Поскольку для достижения клинического эффекта не требуется разрушения нервных структур, DBS имеет меньший риск стойких осложнений, чем деструкция соответствующих ядер и допускает возможность проведения двусторонних операций.
Для DBS используются автономные имплантируемые устройства с внутренним источником энергии. Имплантация электродов производится с применением рамного стереотаксиса (стандарт). Для интраоперационной верификации структуры, в которую имплантируется электрод, используется методика микроэлектродной регистрации (рекомендация). Подкожный генератор импульсов имплантируется подкожно в подключичную, либо в подвздошную область. Параметры нейростимуляции подбираются индивидуально. Пациент может изменять программу стимуляции в пределах, установленных врачом при помощи специального програматора. При недостаточной эффективности нейростимуляции может быть принято решение о применении других хирургических методик, в том числе и деструктивных.
Возможно применение комбинированных деструкций, однако риск побочных эффектов и хирургических осложнений при этом выше [13,14]. При операциях на подкорковых структурах используется методика рамного стереотаксиса. Стереотаксические расчеты проводится с использованием специальных компьютерных станций планирования на основе магнитно-резонансных томограмм пациента, либо совмещения данных МРТ и КТ. Для выполнения деструкции используется радиочастотная коагуляция.
Применявшиеся ранее методики криодеструкции (замораживание), хемодеструкции (введение этилового спирта) в настоящее время не используются.
Клинический эффект после операции развивается в течение нескольких дней после операции и достигает своего пика приблизительно через 4-6месяцев. Деструктивные операции на головном мозге не приводят к полному регрессу
гиперкинетического синдрома и тем самым могут облегчить состояние больных и ухо за ними. Эффективность операции составляет около 40-50% [15,16].
Применение двухсторонних деструкций одной структуры имеет высокий риск развития псевдобульбарного синдрома, речевых и психических расстройств.
Хроническая электростимуляция глубоких структур мозга (DBS) применяется в ряде случаев при вторичной дистонии и гиперкинетической форме ЦП. Эффективность этой методики не превышает 50%. Показания к DBS у больных с ЦП возникают при отсутствии ответа на баклофеновый скрининг-тест или при других противопоказаниях для проведения ITB (опция). Мишенями для электростимуляции служат те же структуры, которые используются для деструкции. Поскольку для достижения клинического эффекта не требуется разрушения нервных структур, DBS имеет меньший риск стойких осложнений, чем деструкция соответствующих ядер и допускает возможность проведения двусторонних операций.
Для DBS используются автономные имплантируемые устройства с внутренним источником энергии. Имплантация электродов производится с применением рамного стереотаксиса (стандарт). Для интраоперационной верификации структуры, в которую имплантируется электрод, используется методика микроэлектродной регистрации (рекомендация). Подкожный генератор импульсов имплантируется подкожно в подключичную, либо в подвздошную область. Параметры нейростимуляции подбираются индивидуально. Пациент может изменять программу стимуляции в пределах, установленных врачом при помощи специального програматора. При недостаточной эффективности нейростимуляции может быть принято решение о применении других хирургических методик, в том числе и деструктивных.
Список литературы.
1) Marc Sindou, George Georgoulis, Patrick Mertens«Neurosurgeryfor Spasticity»A Practical Guide for TreatingChildren and Adults ISBN 978-3-7091-1770-5 ISBN 978-3-7091-1771-2 (eBook)DOI 10.1007/978-3-7091-1771-2 Springer Wien Heidelberg New York Dordrecht London 2014. стр162
2) Neurosurgical operative atlas. Pediatric neurosurgery / [edited by] James Tait Goodrich, 2008.ISBN 978-1-58890-510-9 chapter 27, стр 157
3) Principles and practice of pediatric neurosurgery / [edited by]A. Lelan d Albright, Ian F. Pollack, P. David Adelson . – Third edition. Chapter 76. Страница 994
4) Sebastian Grunt, Jules Becher, Long-term outcome and adverse effects of selective dorsal rhizotomy in children with cerebral palsy: a systematic review, Dev Med Child Neurol 2011; 53: 490-498
5) Li Z, Zhu J, Liu X. Deformity of lumbar spine after selective dorsal rhizotomy for spastic cerebral palsy. Microsurgery 2008; 28: 10-2
6) McLaughlin J, Bjornson K, Temkin N, et al. Selective dorsal rhizotomy: metaanalysis of three randomized controlled trials. Dev Med Child Neurol 2002; 44: 17-25.
7) Eva Nordmark, Annika Josenby, Long-term outcomes five years after selective dorsal rhizotomy. BMC Pediatrics 2008, 8: 54-65
8) Mittal S, Farmer JP, Al-Atassi B, et al. Functional performance following selective posterior rhizotomy: long-term results determined using a validated evaluative measure. J Neurosurg 2002; 97: 510-8
9) Rosenbaum PL, Walter SD, Hanna SE, et al. Prognosis for gross motor function in cerebral palsy: creation of motor development curves. JAMA 2002; 18:1357-63
10) Philippe Decq, Masahiro Shin, Surgery in the Peripheral Nerves for Lower Limb Spasticity, Operative Techniques in Neurosurgery 2004 Volume 7, Issue 3, Pages 136-146
11) Miller, Freeman. «Cerebral palsy» ISBN 0-387-20437-7 2005 section 3
12) Декопов A.B., Шабалов B.A., Томский A.A., Хить М.А., Салова Е.М., Микрохирургическая селективная невротомия в лечении фокальных спастических синдромов различной этиологии; Вопросы нейрохирургии им. Бурденко № 2, 2013, том 77, 65-71
13) Humberto Trejos, Rolando Araya; Stereotactic Surgery for Cerebral Palsy Department of Neurosurgery, National Children's Hospital, National Rehabilitation Center, Costa Rica, Stereotact Funct Neurosurg 1990;54:130-135
14) Antonio A.F. De Salles, MD, PhD; Role of stereotaxis in the treatment of CP, Division of Neurosurgery, University of California Los Angeles School of Medicine, Journal of child neurology, 1996, 11, (Suppl 1), 43-50
15) Broggi G., Angelini L., Bono R.; Long term results of stereotactic thalamotomy for cerebral palsy., Neurosurgery, 1983 Feb;12(2):195-202.
16) Kim J., Chang W.; Treatment of secondary dystonia with a combined stereotactic procedure: long-term surgical outcomes. Acta Neurochir (Wien), 2011 Dec;153(12):2319-27; discussion 2328. Epub 2011 Sep 11.
17) Dekopov A.V. • Shabalov V.A. • Tomsky A.A. • Hit M.V. • Salova E.M., Chronic Spinal Cord Stimulation in the Treatment of Cerebral and Spinal Spasticity, Stereotact Funct Neurosurg 2015;93:133-139 (статья)
18) Siegfried J, Treatment of spasticity by dorsal cord stimulation, Int. Rehabil. Med., 1980; 2:31-34.
19) Pinter M., Epidural electrical stimulation of posterior structures of the human lumbosacral cord: control of spasticity, Spinal cord, 2000; 38(9):524-531
20) Steinbok P., O’Donnell M. Baclofen infusion for spastic cerebral palsy. Clin Neurosurg 2000; 47:440-57.
21) Walker RH, Danisi FO, Intrathecal baclofen for dystonia: benefits and complications during six years of experience. Mov Disord. 2000 Nov;15(6):1242- 7
22) Albright A, Continuous intrathecal baclofen infusion for spasticity of cerebral origin, JAMA 1993, 270: 2475-2477.
23) Murphy, NA, Irwin MCN, Hoff C. In-trathecal baclofen therapy in children with cerebral palsy: Efficacy and com-plications. ArchPhysMedRehabil2002; 83:1721-1725.
24) Coffey RJ, Edgar TS, Francisco GE, Gra-ziani V, Meythaler JM, Ridgely PM, Sadiq SA, Turner MS. Abrupt withdrawal from intrathecal baclofen: Recognition and management of a potentially life-threat-ening syndrome. Arch Phys Med Rehabil 2002; 83:735-741
25) Flckiger B, Knecht H, Grossmann S, Felleiter P. Device-related complications of long-term intrathecal drug therapy via implanted pumps. Spinal Cord 2008; 46:639-643.
26) Gilmartin R, Bruce D, Storrs BB, Abbott R, Krach L, Ward J, Bloom K, Intrathecal baclofen for management of spastic cerebral palsy: multicenter trial, J Child Neurol. 2000 Feb; 15(2):71-77.
27) Steven D. Creedon, Marcel P. J. M. Dijkers, and Steven R. Hinderer “Intrathecal Baclofen for Severe Spasticity: A Meta-Analysis” 1997.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.