Гастрит и дуоденит
 Версия: Клинические рекомендации РФ 2024 (Россия)
Версия: Клинические рекомендации РФ 2024 (Россия)
Общая информация
Краткое описание
Разработчик клинической рекомендации:
- Российская Гастроэнтерологическая Ассоциация
- Ассоциация "Эндоскопическое общество "РЭндО"
- Межрегиональная Общественная Организация "Научное сообщество по содействию клиническому изучению микробиома человека"
- Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968 с изменения, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 января 2024 года – с 1 января 2025 года.
Клинические рекомендации
Гастрит и дуоденит
Год утверждения: 2024
Пересмотр не позднее: 2026
Дата размещения: 10.07.2024
Статус: Действует
ID: 708
Определение заболевания или состояния (группы заболеваний или состояний)
Гастрит – воспалительное заболевание слизистой оболочки желудка. Различают острый и хронический гастриты. Хронический гастрит – группа хронических заболеваний, которые характеризуются персистирующим воспалительным инфильтратом и нарушением клеточного обновления с развитием кишечной метаплазии и атрофии в слизистой оболочке желудка.
Хронический дуоденит характеризуется воспалительной инфильтрацией слизистой оболочки двенадцатиперстной кишки, желудочной метаплазией эпителия и нарушениями гистоархитектоники и в виде укорочения ворсинок и углубления крипт.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Гастрит и дуоденит (K29)
К29.0 - Острый геморрагический гастрит
Острый (эрозивный) гастрит с кровотечением
К29.1 - Другие острые гастриты
К29.2 - Алкогольный гастрит
К29.3 - Хронический поверхностный гастрит
К29.4 - Хронический атрофический гастрит
Атрофия слизистой оболочки
К29.5 - Хронический гастрит неуточненный
Хронический гастрит:
· антральный
· фундальный
К29.6 - Другие гастриты
Гастрит гипертрофический гигантский
Гранулематозный гастрит
Болезнь Менетрие
К29.7 - Гастрит неуточненный
К29.8 - Дуоденит
К29.9 - Гастродуоденит неуточненный
K31.8 - Другие уточненные болезни желудка и двенадцатиперстной кишки
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
В докладе Киотского консенсуса для хронического гастрита предложена классификация, в основу которой положен этиологический принцип [7]:
Аутоиммунный гастрит
Инфекционный гастрит
- Гастрит, вызванный Helicobacter pylori
- Бактериальный гастрит (Helicobacter heilmannii, Enterococcus, Mycobacteria, вторичный сифилитический гастрит)
- Флегмона желудка
- Вирусный гастрит (энтеровирус, цитомегаловирус, вирус Эпштейна-Барр)
- Микотический гастрит (микормикоз, кандидоз, гистоплазмоз)
- Паразитарныйгастрит (Cryptosporidium, Strongyloides stercorale)
Гастрит, вызванный внешними причинами
- Гастрит, вызванный лекарствами
- Алкогольный
- Радиационный
- Химический
- Вызванный билиарным рефлюксом
- Вызванный другими определенными внешними причинами
Гастрит, вызванный специальными причинами
- Лимфоцитарный
- Болезнь Менетрие
- Аллергический
- Эозинофильный
Гастрит, обусловленный другими классифицированными заболеваниями
- при саркоидозе
- при васкулите
- при болезни Крона.
Сиднейская классификация хронического гастрита (1990), модифицированная в 1994 году в Хьюстоне, учитывает топографию поражения (тело желудка, антральный отдел) и морфологические изменения слизистой оболочки желудка (степень активности воспаления, выраженность воспаления, выраженность атрофии и метаплазии, наличие и степень колонизации H.pylori). Данные характеристики оцениваются с помощью визуально-аналоговой шкалы, полуколичественно по степени выраженности морфологического признака – норма (отсутствие признака), слабый, умеренный, выраженный. Применение визуально-аналоговой шкалы снизило субъективность оценки при характеристике гистологической картины [15]. Топография и гистологическая характеристика гастрита важны, так как фенотип гастрита определяет риск развития таких заболеваний как язвенная болезнь двенадцатиперстной кишки, язвенная болезнь желудка и рак желудка [2, 4, 6, 7, 9].
Стадия и степень атрофического гастрита и кишечной метаплазии (метапластической атрофии) служат индикаторами риска развития рака желудка [16-18]. Для того чтобы облегчить и по возможности стандартизировать определение прогноза хронического гастрита, в первую очередь, оценку риска развития рака желудка, применяется несколько методик. Прогностическая система OLGA (Operative Link for Gastritis Assessment) использует визуально-аналоговую шкалу Сиднейской классификации. Для определения стадии гастрита соотносят гистологическую выраженность атрофии с ее топографией: стадия 0 означает минимальный риск канцерогенеза, а стадия IV соответственно – максимальный, в 5-6 раз превышающий показатели риска рака желудка в популяции [19, 20]. Российский пересмотр системы OLGA за счет визуализации с помощью пиктограмм значительно упрощает оценку атрофии (метапластической атрофии) слизистой оболочки желудка. Российский пересмотр OLGA-system одобрен III съездом Российского общества патологоанатомов и утвержден Федеральной службой в сфере здравоохранения и социального развития (ФС №2010/220 от 10.06.2010 г.) [21]. Аналогичная по базовым принципам система OLGIM анализирует вместо атрофии кишечную метаплазию [22].
Всё более широко используется эндоскопическая оценка распространённости атрофии слизистой оболочки желудка по Кимура-Такемото [23, 24] либо по модифицированной шкале EGA [25], а также эндоскопическая оценка выраженности кишечной метаплазии по шкале EGGIM [26].
Наличие острых и/или хронических эрозий желудка и двенадцатиперстной кишки следует указывать в эндоскопическом заключении или в клиническом диагнозе как отдельную позицию. Естественное течение и клиническое значение эрозивного гастрита или эрозивного дуоденита зависит от этиологии. Частыми причинами их возникновения служат нестероидные противовоспалительные препараты (НПВП), стресс, употребление алкоголя. Среди более редких причин называют лучевое поражение, вирусную инфекцию (например, цитомегаловирус), прямую травматизацию (например, назогастральный зонд) [7, 27].
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Гастритические изменения представляют собой реакции слизистой оболочки желудка в ответ на различные эндогенные и экзогенные патогенные факторы. К основным изменениям, из которых складывается морфологическая картина хронического гастрита, относятся воспаление, атрофия, нарушение клеточного обновления, в том числе метаплазия и дисплазия.
Бактерия Helicobacter pylori, колонизирующая слизистую оболочку желудка, служит одним из ведущих этиологических факторов гастрита. Установление этиологического значения H.pylori сделало хронический гастрит четко очерченной и клинически значимой нозологической единицей -заболеванием с известной причиной, этапами патогенетического развития, определенным прогнозом и, наконец, определило возможности этиотропного лечения. B.J.Marshall и J.R.Warren, которым впервые удалось выделить культуру ранее неизвестного грамотрицательного микроорганизма из биоптатов желудка человека, уже в первой публикации, открывшей широкомасштабное изучение H.pylori, связали наличие этой бактерии с инфильтрацией полиморфно-ядерными лейкоцитами эпителия и собственной пластинки слизистой оболочки на фоне лимфоплазмоцитарной инфильтрации [1]. Способность H.pylori колонизировать слизистую оболочку желудка и вызывать острый, а затем хронический гастрит, получила подтверждение в опытах по самозаражению, независимо проведенных B.Marshall (1985) и A.Morris (1987). Большое значение для изучения патогенетического значения H.pylori имеют эксперименты на животных: моделями, на которых удается воспроизвести геликобактерный гастрит и некоторые другие H.pylori-ассоциированные заболевания, служат мыши, монгольские песчанки, морские свинки, гнотобионтные поросята и приматы [2]. На модели монгольской песчанки воспроизведена парадигма канцерогенеза в желудке (каскад Корреа): хроническое воспаление, вызванное H. pylori, кишечная метаплазия, атрофия, дисплазия/интраэпителиальная метаплазия и инвазивная аденокарцинома. Разным авторам удавалось воспроизвести гастрит у человека после заражения добровольцев культурой H.pylori [2, 3].
Колонизацию слизистой оболочки и выживание H. pylori в особой среде желудка обеспечивает целый ряд факторов. Уреаза, фермент, гидролизующий мочевину с образованием аммония и углекислого газа, имеет значение для нейтрализации кислоты в окружении микроорганизма. Жгутики позволяют бактерии «целенаправленно» двигаться в слое слизи над эпителием. Другие ферменты бактерии способны вызывать деградацию муцина. Около 10% H. pylori непосредственно контактируют с эпителием. Адгезия H.pylori с эпителиоцитами –сложный процесс, в котором участвует целый ряд поверхностных белков. Например, ВabA (blood group antigen binding adhesion) - адгезин, который связывается с Leb ангигенами группы крови на эпителиоцитах; аллель гена этого адгезина - babA2 – тесно ассоциирована с развитием язвенной болезни и рака желудка в некоторых популяциях [2, 4].
В геноме бактерии выделяют «островок патогенности» cag PAI, маркером которого служит ген cagA – «цитотоксин-ассоциированный ген А». Этот ген обнаруживается у 50-70% штаммов H.pylori. Некоторые белки, которые кодирует cag PAI, служат для построения секреторной системы IV типа бактерии, благодаря которой H.pylori при прикреплении к эпителиоциту желудка вводит внутрь клетки хозяина CagA, пептидогликан, а возможно, и другие собственные молекулы. Белки H.pylori в эпителиоците «запускают» несколько сигнальных путей, результатом чего служат изменение цитоскелета клетки хозяина, нарушение межклеточных контактов, изменение пролиферации и апоптоза, а также провоспалительный эффект. Эпителиоциты желудка отвечают на присутствие H.pylori высвобождением IL-8 и хемокина, экспрессируемого и секретируемого Т-клетками при активации (RANTES), что приводит к активной воспалительной реакции в слизистой оболочке. Около 50% штаммов H.pylori секретируют высокоиммуногенный белок – вакуолизирующий цитотоксин А (VacA), который соответственно вызывает вакуолизацию клеток in vitro, а in vivo его связывают с воспалением и апоптозом [2, 4]. Таким образом, колонизацияH.pylori поддерживает персистенцию воспалительного инфильтрата в слизистой оболочке желудка. H.pylori-индуцированное воспаление приводит к атрофии - необратимой утрате желез желудка с замещением их фиброзной тканью или метаплазированным эпителием. Атрофический гастрит, особенно с поражением тела желудка и гипохлоргидрией, доказанно служит фактором риска аденокарциномы желудка [2, 5, 6, 7, 8, 9].
Патоморфологические данные, а также исследования с применением теста проницаемости сахарозы доказывают, что при гастритах, а также при функциональной диспепсии имеет место синдром повышенной эпителиальной проницаемости, выраженность которого коррелирует с активностью воспалительного процесса в слизистой оболочке желудка. H.pylori вносит вклад в возникновение этот синдрома, оказывая негативное влияние на структурные компоненты плотных контактов эпителиоцитов [10]. Таким образом, синдром повышенной эпителиальной проницаемости участвует в патогенезе гастрита, а медикаментозная терапия, оказывающая цитопротективный эффект, патогенетически обоснована [10].
В основе аутоиммунного гастрита лежат аутоиммунные механизмы, что подтверждается наличием антител против антигенов париетальных клеток и/или против внутреннего фактора, а также сочетанием гастрита с другими аутоиммунными заболеваниями (аутоиммунный тиреоидит, сахарный диабет I типа, витилиго и др.)[11, 12, 13].
Другие особые формы гастрита встречаются реже, характеризуются специальными этиологическими факторами или могут сопровождать другие заболевания. Лимфоцитарный гастрит может быть связан с глютеновой энтеропатией, эозинофильный гастрит протекает в рамках эозинофильного гастроэнтерита, гранулематозный гастрит ассоциируют с болезнью Крона, саркоидозом, васкулитами [7].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Согласно Статистическим материалам «Заболеваемость взрослого населения России в 2019 году», зарегистрировано более 538 тысяч взрослых с установленным впервые в жизни диагнозом «гастрит и дуоденит», и заболеваемость взрослых составила 462,0:100000. Всего в 2019 году по обращаемости взрослого населения зарегистрировано более 700 тысяч случаев с диагнозом «гастрит и дуоденит». Таким образом, диагноз «гастрит» широко применяется в практике здравоохранения. Этот факт, с одной стороны, отражает высокую реальную частоту заболевания, но с другой стороны, служит свидетельством субъективных и объективных трудностей как в интерпретации симптомов диспепсии, так и в доступности необходимых методов диагностики, в первую очередь, видеоэндоскопии высокой четкости с электронной/виртуальной хромоскопией и увеличением и патологоанатомического исследования биоптатов слизистой оболочки желудка.
Высокая частота H.pylori в популяции определяет высокую частоту хронического гастрита. В различных регионах Российской Федерации по данным крупных эпидемиологических исследований 2004-2012 гг. инфекцию H.pylori обнаруживали у 65-92% взрослых [9]. Проведенные в последние годы в Российской Федерации исследования продемонстрировали тенденцию к снижению доли инфицированных лиц в популяции. Распространенность H.pylori по данным дыхательного теста с мочевиной, меченной 13С, у лиц без предшествующей эрадикационной терапии (n=19875) составила 38,8% (41,8% в 2017 г., 36,4% в 2019 г., p < 0.0001) [14].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Под диспепсией понимают такие симптомы, как боль или жжение в эпигастральной области, переполнение в эпигастральной области, чувство раннего насыщения. Хронический гастрит, который характеризуется определенными морфологическими изменениями слизистой оболочки, часто не является причиной возникновения симптомов, в том числе диспептических. Однако у части больных с диспепсией имеющиеся клинические симптомы могут быть обусловлены хроническим Н.pylori-ассоциированным гастритом, что доказывается стойким их исчезновением после эрадикации инфекта. Диспепсию, ассоциированную с Н.pylori и хроническим гастритом, в докладе Киотского консенсуса предложено рассматривать как самостоятельную клиническую форму. Наоборот, персистенция диспептических симптомов, несмотря на успешно проведенную эрадикацию Н.pylori, рассматривается как проявление функционального заболевания – функциональной диспепсии [6, 7, 9].
Гастродуоденальные эрозии, в том числе обусловленные приемом НПВП, нередко протекают малосимптомно и могут манифестировать острым желудочно-кишечным кровотечением [7, 29].
Клиническую картину аутоиммунного гастрита обычно связывают с проявлениями дефицита витамина В12 (макроцитарная анемия, неврологическая симптоматика), железодефицитной анемией и сочетанными аутоиммунными заболеваниями [11-13]. Однако имеются исследования, которые позволяют говорить о наличии гастроэнтерологических симптомов у пациентов с аутоиммунным гастритом. Гастроэнтерологические симптомы зарегистрированы у 60% пациентов с аутоиммунным гастритом, причем представлены они в основном диспептическими симптомами, которые чаще наблюдались у пациентов моложе 55 лет, некурящих и без анемии [29]. В другом исследовании эпигастральная боль установлена в 35% случаев аутоиммунного гастрита, тошнота – в 22%, раннее насыщение – в 10%, тяжесть после еды - в 7,1%. Частыми симптомами оказались изжога (24%) и регургитация (12%) [30]. С помощью pH-импедансометрии при аутоиммунном гастрите показано, что некислые рефлюксы могут быть ассоциированы с наличием симптомов [31].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза заболевания/состояния:
Диагноз гастрита основан на гистологическом выявлении воспаления слизистой оболочки желудка (нейтрофильные лейкоциты в собственной пластинке и интраэпителиально, плотность мононуклеарной воспалительной инфильтрации), а также атрофии и кишечной метаплазии.
Современные методы эндоскопического исследования, в частности, видеоэндоскопия высокой четкости с мультимодальным режимом осмотра и увеличением, предоставляют дополнительные высокоинформативные возможности для диагностики гастрита, дуоденита предраковых изменений слизистой оболочки желудка.
Важнейшим этиологическим фактором гастрита служит инфекция H.pylori, и положительные тесты на H.pylori свидетельствуют о наличии хронического гастрита.
1. Жалобы и анамнез
Возможные жалобы у пациентов с гастритом и интерпретация данных жалоб представлены в подразделе Клиническая картина.
При сборе анамнеза следует уточнить, была ли ранее проведена пациенту ЭГДС с биопсией; имелись ли при этом указания на наличие предраковых состояний и изменений слизистой оболочки желудка (атрофия, кишечная метаплазия, эпителиальная дисплазия). Для оценки прогноза важно уточнить, была ли ранее проведена эрадикационная терапия инфекции H.pylori, с помощью какой схемы лечения, проведен ли контроль эффективности антигеликобактерной терапии.
Для аутоиммунного гастрита важны указания в анамнезе на дефицит витамина В12 и макроцитарную анемию, наличие таких аутоиммунных заболеваний, как аутоиммунный тиреоидит, сахарный диабет I типа, витилиго и др., выявленную при ранее проведенном эндоскопическом и патолого-анатомическом исследовании атрофию слизистой оболочки тела желудка при относительно сохранной слизистой оболочке антрального отдела.
2. Физикальное обследование
При физикальном обследовании, как правило, нет данных, которые были бы характерны для гастрита.
3. Лабораторные диагностические исследования
-
Всем пациентам с гастритом с целью исключения анемии из-за кровотечений при эрозивном поражении гастродуоденальной слизистой оболочки или из-за аутоиммунного гастрита рекомендуется выполнение общего (клинического) анализа крови с определением уровня гемоглобина, гематокрита, объема эритроцита, цветового показателя [30, 32-34].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4)
Комментарии: Клинический анализ крови при хроническом гастрите чаще всего остается без существенных изменений, но может обнаруживаться анемия, как микроцитарная, свидетельствующая о явных, либо скрытых кровотечениях или нарушении всасывания железа, так и макроцитарная вследствие дефицита витамина В12 при аутоиммунном поражении желудка [30, 32-34].
-
Всем пациентам с подозрением на аутоиммунный гастрит с целью подтверждения диагноза рекомендуется проведение анализа крови на антитела к париетальным клеткам и антитела к фактору Касла [11-13, 34, 35, 36].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Мишенью антител к париетальным клеткам служит H+/K+ ATФ-аза (альфа и бета субъединицы протонной помпы). Их выявляют у 85-90% больных с пернициозной анемией. Чувствительность для диагноза аутоиммунного гастрита составляет ~80%, специфичность низкая (обнаруживаются у лиц без аутоиммунного гастрита). Антитела к внутреннему фактору блокируют связывание кобаламина с внутренним фактором. Чувствительность для диагностики аутоиммунного гастрита ~50%, но специфичность достигает 99% [11-13, 34, 35, 36].
-
Всем пациентам с подозрением на наличие при гастрите предраковых изменений желудка (атрофии, кишечной метаплазии) с целью подтверждения диагноза, оценки степени риска развития рака желудка и определения порядка эндоскопического наблюдения рекомендуется проведение анализа крови на пепсиноген I, пепсиноген II и гастрин-17 [37, 38, 7, 39-42].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
Комментарии: Диагноз атрофического гастрита стал более доступным благодаря сывороточным маркерам атрофии слизистой оболочки тела и антрального отдела желудка. Низкий уровень сывороточного пепсиногена I имеет высокую чувствительность и специфичность (84% и 95% соответственно) в диагностике выраженной атрофии слизистой оболочки тела желудка. Для атрофии слизистой оболочки антрального отдела характерны низкие уровни базального и постпрандиального гастрина-17 за счет уменьшения количества G-клеток.
При длительном наблюдении лиц с нормальным сывороточным пепсиногеном, независимо от наличия H.pylori, частота развития рака желудка была незначительной. У лиц с низким уровнем пепсиногена, свидетельствующим об атрофическом гастрите тела желудка, частота развития рака желудка было существенно выше (3,5–6 на 1000 в год). В данной группе заболеваемость раком желудка была больше при отрицательном результате антител к H.pylori, что было связно с выраженной атрофией и метаплазией, препятствующих дальнейшей колонизации H. pylori [39]. В исследовании, проведенном в Российской Федерации, рак желудка был ассоциирован с низким уровнем пепсиногена I (отношение шансов (ОШ) 2,9; 95% доверительный интервал (ДИ)1,3-6,4), низким соотношением пепсиногена I к пепсиногену II (ОШ 3,3; 95% ДИ 1,5-7,3), низким уровнем гастрина-17 (ОШ 1,8; 95% ДИ 0,7-4,8) [40]. Метаанализ 20 исследований, включавших 4241 пациента, показал, что для диагноза атрофического гастрита сочетанная оценка сывороточного пепсиногена, гастрина-17 и антител класса IgGк H.pylori продемонстрировала чувствительность 74,7% (95% ДИ 62,0-84,3) и специфичность 95,6% (95% ДИ 92,6-97,4). Отрицательная предсказательная ценность составила 91% [38]. Метаанализ 31 исследования, включавшего 1520 пациентов с аденокарциномой желудка и 2265 пациентов с атрофическим гастритом, продемонстрировал, что сывороточный пепсиноген служит надежным неинвазивным скрининговым маркером рака желудка и предракового заболевания – атрофического гастрита [38].
4. Инструментальные диагностические исследования
-
Всем пациентам с целью подтверждения диагноза гастрита и дуоденита, выявления и ранжирования предраковых состояний и изменений слизистой оболочки желудка, в первую очередь, распространённости и степени атрофии, кишечной метаплазии и наличия дисплазии, при отсутствии противопоказаний, рекомендуется проведение эзофагогастродуоденоскопии (ЭГДС)[25, 26, 32, 33, 41, 42, 43, 44, 45, 190].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
Комментарии: Для диагностики предраковых изменений желудка при традиционной эндоскопии в белом свете корреляция между эндоскопическими и гистологическими данными неудовлетворительна [41], результаты эндоскопии высокого разрешения более надежны. В многоцентровых проспективных исследованиях специфичность эндоскопии высокого разрешения в белом свете для диагностики кишечной метаплазии составила 98%, чувствительность - 53% и 59%;для диагностики неоплазии специфичность оказалась> 95%, чувствительность - 74% и 29% [26, 44]. В метаанализе, включавшем 10 исследований и 699 пациентов, чувствительность, специфичность и площадь под кривой (AUC) хромоэндоскопии с красителями для диагностики предраковых изменений и раннего рака желудка составили 0,90 (95% ДИ 0,87 - 0,92), 0,82 (95% ДИ 0,79–0,86) и 0,95 соответственно, что превосходит результаты эндоскопии в белом свете [43].
-
Всем пациентам для диагностики предраковых состояний и/или изменений слизистой оболочки желудка рекомендуется выполнение ЭГДС высокого разрешения с мультимодальным режимом визуализации с увеличением или без него, в том числе, для выполнения прицельной биопсии с целью оценки стадии атрофии и кишечной метаплазии и выявления неоплазии [26, 42, 44, 45, 29, 30, 38, 46].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Мультимодальный режим осмотра предполагает использование дополнительных эндоскопических методик, позволяющих улучшить визуализацию (хромоскопия с витальными красителями, цифровые и оптические технологии контрастировали - NBI, BLI, iscan, FICE и другие). Систематический обзор показал, что эндоскопическое исследование в режиме NBI (в большинстве исследований с увеличением) для диагностики кишечной метаплазии продемонстрировало чувствительность и специфичность 86% и 77%, а для диагностики дисплазии - 90% и 83% [44]. На основании воспроизводимых признаков эндоскопии в режиме NBI была предложена упрощенная классификация изменений слизистой оболочки, точность диагностики кишечной метаплазии составила 84%, дисплазии - 95%. Отмечено, что представленные результаты зависят от профессиональной подготовки и лучше у опытных эндоскопистов [45]. В проспективном многоцентровом исследовании с применением данной классификации чувствительность и специфичность для диагностики кишечной метаплазии составили 87% и 97%, для диагностики дисплазии - и 92% и 99% [26].
-
Всем пациентам, у которых впервые проводится диагностическая ЭГДС, для адекватного стадирования предраковых состояний слизистой оболочки желудка у пациентов с подозрением на наличие атрофических, метапластических и неопластических изменений рекомендуется проведение биопсии (с последующим патолого-анатомическим исследованием биопсийного материала желудка, в том числе с применением гистохимических и иммуногистохимических методов), как для диагностики инфекции H. pylori. так и для идентификации стадий атрофического гастрита [47-52, 53, 54].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
-
Выполнение биопсии желудка с последующим патолого-анатомическим исследованием биоспсийного материала желудка рекомендуется из двух отделов (по два биоптата из тела и антрального отдела по малой и большой кривизне). Биоптаты из тела и антрального отдела желудка необходимо четко маркировать и помещать в отдельные контейнеры. Дополнительная биопсия должна быть взята из каждого видимого патологического участка слизистой оболочки желудка. Если для оценки тяжести атрофического гастрита планируется использование систем OLGA или OLGIM, возможно дополнительное взятие биопсии из угла желудка [47-52].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Диагноз «гастрит» традиционно рассматривается как диагноз морфологический. В соответствии с требованиями Модифицированной Сиднейской системы для правильной интерпретации состояния слизистой оболочки желудка необходимо минимум пять биоптатов. Определены места для получения биопсийного материала: 2 из антрального отдела на расстоянии 3 см от привратника по большой и малой кривизне, 2 из тела желудка посередине большой кривизны и на 4 см проксимальнее угла по малой кривизне, 1 - из угла желудка [15]. В настоящее время хромоэндоскопия обеспечивает прецизионное взятие биопсии, что в сочетании с биопсией из фиксированных точек обеспечивает лучшую диагностику предраковых изменений. Биопсия из угла желудка позволяет более точно определять предраковые изменения, особенно в тех случаях, когда хромоэндоскопия и другие методы эндоскопии с расширенными возможностями недоступны. Биопсия из угла желудка позволяет более точно оценить стадии в соответствии с OLGA и OLGIM, которые коррелируют с риском развития рака желудка [41, 50, 51, 52].
5. Иные диагностические исследования
5.1. Первичная диагностика инфекции H.pylori
-
Всем пациентам c подозрением на гастрит для первичной диагностики H.pylori рекомендуется назначать референсные методы диагностики инфекции H. pylori - дыхательный тест с мочевиной, меченной 13С (13С-уреазный дыхательный тест на Helicobacter pylori), и моноклональное определение антигена H.pylori в кале лабораторным способом [55, 56].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 1).
Комментарии: Наиболее оптимальными тестами первичной диагностики инфекции H. pylori служат неинвазивные (не требующие проведения эзофагогастродуоденоскопии) 13С-дыхательный уреазный тест и моноклональное определение антигена H.pylori в кале. Согласно Кокрейновскому обзору и мета-анализу, чувствительность 13С-дыхательного теста составляет 94% (95% ДИ: 0,89 - 0,97), а определение антигена H. pylori в кале – 83% (95% ДИ: 0,73 - 0,90) при специфичности в 90% [55].
-
Пациентам, которые имеют показания для проведения эзофагогастродуоденоскопии, в качестве метода первичной диагностики могут быть рекомендованы быстрый уреазный тест с выполнением биопсии антрального отдела желудка и тела желудка [57-60] или определение ДНК хеликобактер пилори (Helicobacter pylori) в биоптатах слизистой желудка методом ПЦР [61-63].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 2).
Комментарии: При проведении ЭГДС методом первичной диагностики Н.pylori может быть быстрый уреазный тест. При использовании эндоскопических методов диагностики Н.pylori берут, как минимум, 2 биоптата из тела желудка и 1 биоптат из антрального отдела [57-60]. Чувствительность БУТ от 85% до 95%, специфичность от 95% до 100% [61]. Для диагностики H.pylori методом ПЦР может быть использован биоптат, ранее размещенный в среду быстрого уреазного теста [62, 63].
Комментарии: Необходимо учитывать, что лечение ингибиторами протонного насоса (ИПН) может привести к ложноотрицательным результатам большинства диагностических тестов [6, 9, 64, 65]. Рекомендуется отменить ИПН не менее чем за 2 недели до проведения диагностических мероприятий [6, 9]. Антибактериальные препараты системного действия) и препараты висмута следует отменить не менее чем за 4 недели до диагностических тестов [6].
-
Некоторым пациентам, в том числе в случае снижения степени колонизации бактерией слизистой оболочки желудка, например, после недавнего приема антисекреторных или антибактериальных лекарственных средств, при язвенном кровотечении, атрофическом гастрите может быть рекомендовано серологические исследование антител класса IgG к H. pylori (определение антител к хеликобактер пилори (Helicobacter pylori) в крови) в качестве первичной диагностики инфекции [55, 66].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 3).
5.2. Диагностика H.pylori после курса эрадикационной терапии
-
Всем пациентам для диагностики эффективности проведенной эрадикационной терапии рекомендуется дыхательный тест с мочевиной, меченной 13С (13С-уреазный дыхательный тест на Helicobacter pylori) [55, 56], или определения антигена H. pylori в кале лабораторным способом [55, 67] не ранее, чем через 4 недели после окончания курса антигеликобактерной терапии либо после окончания лечения антисекреторными средствами (ИПН) или висмутом трикалия дицитрата** [55, 56].
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 1).
-
Для диагностики эффективности проведенной эрадикационной терапии cерологические методы определения антител к H. pylori не рекомендуются, так как к этой ситуации не применимы [55, 6].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 3).
-
При отсутствии референсных методов диагностики целесообразно комбинировать доступные диагностические тесты или (в случае применения методов непосредственного обнаружения бактерии в биоптате слизистой оболочки желудка – бактериологического, морфологического, быстрого уреазного теста) исследовать хотя бы два биоптата из тела желудка и один биоптат из антрального отдела [57-60, 9].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 3).
Комментарии: Для контроля эрадикации, который проводят минимум через 4 недели после окончания эрадикационной терапии, лучше всего применять дыхательный тест с мочевиной, меченной 13С, или определение антигена Н.pylori в кале [55]. Во избежание ложноотрицательных результатов прием ИПП необходимо прекратить за 2 недели до предполагаемого контрольного исследования, прием любых антибактериальных препаратов или висмута трикалия дицитрата** за 4 недели до планируемого контрольного исследования [6].
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Медикаментозное лечение
1.1. Эрадикационная терапия инфекции H. рylori
-
Всем пациентам с хроническим гастритом с положительными результатами тестирования на инфекцию H. рylori в качестве этиологического лечения рекомендуется проведение эрадикационной терапии [3, 68-73, 7].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
-
Всем пациентам с атрофическим гастритом с положительными результатами тестирования на инфекцию H.pylori для предотвращения прогрессирования атрофии рекомендуется проведение эрадикационной терапии [74-76, 6, 7].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2).
Комментарии: H.pylori служит этиологическим фактором хронического гастрита .Эрадикационная терапия инфекции позволяет излечить неатрофический гастрит, что сопровождается хорошо изученными гистологическими изменениями: в ранние сроки исчезает инфильтрация эпителия и собственной пластинки слизистой оболочки полиморфно-ядерными лейкоцитами; инфильтрация лимфоцитами и плазматическими клетками снижается в достаточно ранние сроки, но не исчезает полностью более года после эрадикации; лимфоидные фолликулы также сохраняются более года после этиологического лечения, хотя число их и сокращается [68-73]. По итогам нескольких метаанализов установлено, что в результате эрадикационной терапии H.pylori происходит регрессия или, как минимум, стабилизация атрофии слизистой оболочки в теле и антральном отделе желудка, при этом возможно добиться только стабилизации, но не обратного развития кишечной метаплазии [74-76].
-
Всем пациентам гастритом с положительными результатами тестирования на инфекцию H.рylori и показаниями для проведения эрадикационной терапии в качестве эрадикационной терапии первой линии, обеспечивающий высокий процент эрадикации инфекции, рекомендуется назначить по выбору:
- стандартную тройную терапию, включающую ИПН (в стандартной дозе 2 раза в сутки), кларитромицин** (500 мг 2 раза в сутки) и #амоксициллин** (1000 мг 2 раза в сутки внутрь), усиленную висмута трикалия дицитратом** (120 мг 4 раза в день или 240 мг 2 раза в день) на 14 дней [77, 78]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
или
- классическую четырехкомпонентную терапия с висмутом трикалия дицитратом** (120 мг 4 раза в сутки) в сочетании с ИПН (в стандартной дозе 2 раза в сутки), #тетрациклином (500 мг 4 раза в сутки внутрь) и метронидазолом** (500 мг 3 раза в сутки) на 14 дней [79-81]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
или
- квадротерапию без препаратов висмута, которая включает стандартную тройную терапию (ИПН в стандартной дозе 2 раза в сутки), #амоксициллин** (в дозе 1000 мг 2 раза в сутки внутрь), кларитромицин** (500 мг 2 раза в сутки), усиленную метронидазолом** (500 мг 3 раза в сутки) на 14 дней [81, 191].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2).
Комментарии: Эмпирический выбор схемы эрадикационной терапии первой линии без определения чувствительности H.pylori к антибактериальным препаратам системного действия опирается на терапию с максимальной доказанной эффективностью. Добавление висмута трикалия дицитрата** к стандаратной тройной терапии убедительно увеличивает достижение излечения инфекции выше 90% по данным «Европейского регистра лечения H.pylori» [78]. Согласно метаанализу S.W.Ko et al. усиление препаратом висмута стандартной тройной терапии увеличивает эффективность с отношением шансов 2,81 (95% ДИ 2,03-3,89), в том числе при доказанной резистентности H.pylori к кларитромицину** [77]. В «Рекомендациях Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции H. pylori у взрослых» редакции 2018 г. включение в схему эрадикационной терапиии H.pylori висмута трикалия дицитрата** названо мерой, повышающей эффективность эрадикационной терапии [82]. Стандартная тройная терапия, усиленная препаратом висмута, в рутинной клинической практике по российским данным превосходит эффективность 90% [83-86]. Добавление препарата висмута к другим схемам эрадикационной терапии, в том числе с левофлоксацином**, также продемонстрировало высокую эффективность [79-81]. Классическая четырехкомпонентная терапия на основе висмута трикалия дицитрата** продолжает демонстрировать эффективность эрадикации более 90% и по данным европейского регистра [78] и по данным метаанализов [80,81]. Квадротерапия без препарата висмута или сочетанная терапия (по-английски «concomitant»), включающая ИПН и сочетание амоксициллина**, кларитромицина** и метронидазола**, по данным метаанализа не уступает в эффективности классической квадротерапии [81]. По сути сочетанная терапия является стандартной тройной схемой, усиленной метронидазолом** [82].
-
Пациентам с положительными результатами тестирования на инфекцию H.рylori и показаниями для проведения эрадикационной терапии в качестве эрадикационной терапии первой линии рекомендуется назначение стандартной тройной терапии в регионах, где подтверждена ее эффективность, на 14 дней [87].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Согласно данным европейского регистра стандартная тройная терапия в течение 7 дней приводит к успешной эрадикации в 82,7%; 10 дней 84,2%; 14 дней - 86.2% [79]. Кокрейновский метаанализ 45 рандомизированных контролируемых исследований в параллельных группах показывает повышение процента эрадикации H.pylori в результате тройной терапии при удлинении продолжительности лечения с 7 до 14 дней (72,9% против 81,9%), а относительный риск (ОР) персистенции H. pylori составляет 0,66 (95% ДИ 0,60 – 0,74), ЧБНЛ - 11 (95% ДИ 9 - 14). Значимый эффект наблюдали при сочетании ИПН с кларитромицином** и амоксициллином** (34 исследования, ОР 0,65, 95% ДИ 0,57 – 0,75; ЧБНЛ 12, 95% ДИ 9 - 16). Значимое повышение успеха эрадикации H.pylori сопровождает удлинение тройной терапии с 7 до 10 дней (24 исследования, 75,7% против 79,9%; ОР 0,80, 95% ДИ 0,72 – 0,89; ЧБНЛ 21, 95% ДИ 15 - 38) и с 10 до 14 дней (12 исследований, 78,5%; 78,5% против 84,4%; ОР 0,72, 95% ДИ 0,58 – 0,90; ЧБНЛ 17, 95% ДИ 11 - 46); особенно для сочетания ИПН с кларитромицином** и амоксициллином** при увеличении продолжительности с 7 до 10 дней (17 исследований, ОР 0,80, 95% ДИ 0,70 – 0,91) и с 10 до 14 дней (10 исследований, ОР 0,69, 95% ДИ 0,52 – 0,91) [87]. В «Рекомендациях Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции H. pylori у взрослых» редакции 2018 г. увеличение продолжительности эрадикационной терапии H.pylori до 14 дней названо мерой, повышающей эффективность эрадикационной терапии [82]. Консенсус Маастрихт VI EHMSG устанавливает для всех режимов эрадикации продолжительность лечения 14 дней [6].
-
Пациентам c гастритом с положительными результатами тестирования на инфекцию H.рylori и показаниями для проведения эрадикационной терапии в качестве меры повышения эффективности антигеликобактерного лечения возможно назначение удвоенной дозы ингибитора протонного насоса [88].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Метаанализ продемонстрировал увеличение процента эрадикации H.pylori при назначении высокой дозы ИПН [88]. В «Рекомендациях Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции H. pylori у взрослых» редакции 2018 г. предпочтение было отдано более современным ИПН - рабепразолу и эзомепразолу** [82]. У рабепразола установлены особые характеристики (собственный антигеликобактерный эффект, стимуляция секреции муцинов в слизистой оболочке желудка), которые могут обеспечивать дополнительные преимущества при эрадикациии H. pylori [82]. В Маастрихтском консенсусе IV преференции для этих ИПН не акцентированы [6]. Например, попытка показать с помощью метаанализа увеличение эффективности лечения в зависимости от дозы рабепразола и эзомепразола** не получила подтверждения (85,3% успешной терапии с «высокими» дозами и 84,2% с «обычными» дозами ИПН, ОШ 1,09 (95% ДИ 0,86-1,37), P = 0,47) [89]. Возможно, такой результат служит следствием включения в метаанализ исследований с низкой суточной дозой рабепразола (10 мг 2 раза в сутки), принятой в некоторых азиатских странах [89]. Высокая результативность рабепразола и эзомепразола** для эрадикации H.pylori мало зависит от фенотипически детерминированных вариантов печеночного метаболизма. Метаанализ 16 рандомизированных контролируемых исследований (n=3680) продемонстрировал снижение эффективности тройной терапии с омепразолом** и лансопразолом в стандартных дозах у быстрых метаболизаторов ИПН, при этом эффективность тройной терапии с рабепразолом и эзомепразолом** в стандартных дозах не зависела от генетического полиморфизма CYP2C19 и не снижалась у быстрых метаболизаторов ИПН [90].
-
Пациентам с гастритом с положительными результатами тестирования на инфекцию H.рylori и показаниями для проведения эрадикационной терапии в качестве меры повышения эффективности антигеликобактерного лечения возможно назначение калий-конкурентного ингибитора протонного насоса (вонопразана) [91, 92].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2).
Комментарии: Метаанализ Y.S.Jung et al. продемонстрировал увеличение процента эрадикации H.pylori при назначении тройной терапии с вонопразаном по сравнению с тройной терапией с «классическими» ИПН [91]. Метаанализ S.Shinozaki et al. при сравнении эффективности различных схем эрадикационной терапии второй линии также показал преимущество эрадикационной терапии с вонопразаном [92].
-
Пациентам с гастритом с положительными результатами тестирования на инфекцию H.рylori и показаниями для проведения эрадикационной терапии в качестве меры повышения эффективности антигеликобактерного лечения и лучшей его переносимости возможно добавление в схемы эрадикации ребамипида [93-95].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1)
Комментарии: 3 мета-анализа, включавших 6, 11 и 6 рандомизированных контролируемых исследований, подтвердил повышение частоты эрадикации при включении в ее схемы ребамипида в дозе 100 мг 3 раза в сутки и лучшей переносимости проводимого лечения [93-95].
-
Пациентам с гастритом с положительными результатами тестирования на инфекцию H.рylori и показаниями для проведения эрадикационной терапии при ee назначении рекомендуется обеспечить приверженность к назначенному лечению (комплаенс) [96, 97].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Комплаенс следует рассматривать как ключевой фактор успеха эрадикационной терапии H.pylori. В контролируемом исследовании было показано, что при приеме более 60% назначенных препаратов эрадикация инфекции составила 96%, при приеме менее 60% (низкий комплаенс) - 69% [96]. В широкомасштабном рандомизированном контролируемом исследовании процент эрадикации снизился при низком комплаенсе (принято менее 80% назначенных препаратов) на 34%, причем у некомплаентных пациентов персистенция H.pylori наблюдалась в 59% случаев [97]. В рекомендациях Всемирной организации гастроэнтерологии по H.pylori как соблюдение качественной практики представлены меры по повышению приверженности пациентов эрадикационной терапии. Пациентов следует обязательно информировать о том, что успешная эрадикация зависит от соблюдения режима лечения. Следует уделить время тому, чтобы проконсультировать пациента, объяснить, как принимать комплексную лекарственную терапию и оценить возможные побочные эффекты антибиотикотерапии. Следует специально отметить необходимость завершения лечения и приема предписанной суммарной дозы лекарственных средств. Подчеривается, что письменная или графическая информация о порядке приема комплексной эрадикационой терапии может способствовать комплаенсу [https://www.worldgastroenterology.org/UserFiles/file/guidelines/helicobacter-pylori-russian-2021.pdf]. Для лечения язвенной болезни в РФ зарегистрирован комбинированный препарат, который содержит набор капсул и таблеток стандартной тройной терапии: каждый стрип (контурная безъячейковая упаковка),, включающий 2 капсулы омепразола 20 мг, 2 таблетки кларитромицина 500 мг, 4 капсулы амоксициллина 500 мг, рассчитан на 1 один день с четким указанием утреннего и вечернего приема. Готовый набор лекарственных средств для эрадикационной терапии обеспечивает правильность дозы и стабильность частоты приема и повышает комплаенс пациента, что служит основанием для полученной в отечественном исследовании эрадикации инфекции при язвенной болезни свыше 90% [98].
-
Пациентам с гастритом с положительными результатами тестирования на инфекцию H.рylori и показаниями для проведения эрадикационной терапии возможно назначение штаммоспецифичных пробиотиков (АТХ A07F: Противодиарейные микроорганизмы), доказавших свою эффективность, для снижения частоты нежелательных явлений, в том числе антибиотик-ассоциированной диареи [99-110].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Доказанную эффективность при проведении эрадикационной терапии H. pylori имеют определенные одноштаммовые и мультиштаммовые пробиотики [99-106]. Предполагается, что благодаря назначению пробиотиков снижается частота нежелательных явлений, что приводит к возможному повышению комплаенса, и, как следствие, увеличению эффективности эрадикации [6].
В метаанализе 42 РКИ, было показано, что риск развития антибиотик-ассоциированной диареи у принимающих пробиотики пациентов оказался достоверно ниже по сравнению с пациентами, которые не принимали таковые (ОР=0,35; 95% ДИ: 0,27-0,47, p<0.00001) или во время антибактериального лечения получали плацебо (ОР=0,69; 95% ДИ: 0,60-0,80, p<0,00001) [107]. В метаанализе 7 РКИ, посвященных применению пробиотиков совместно с антибактериальными препаратами системного действия исключительно при проведении эрадикации H. pylori отмечалось достоверное снижение риска развития антибиотик-ассоциированной диареи на 45% (ОР = 0,55; 95% ДИ: 0,41-0,73, р<0,0001) [107].
Согласно данным метаанализа 31 РКИ прием пробиотиков при проведении антибактериальной терапии также снижает риск развития C. difficile-ассоциированной диареи на 60% (ОР=0,40; 95% ДИ: 0,30-0,52) по сравнению с плацебо или при отсутствии пробиотической поддержки [108].
В рандомизированном исследовании было продемонстрировано, что включение в трехкомпонентную схему эрадикации пробиотика Сахаромицеты буларди - Saccharomyces boulardii (S.boulardii) CNCM I-745 в дозе 750 мг в день на весь период лечения, достоверно снижало число побочных эффектов на фоне проводимой терапии, по сравнению с группой контроля (5,3±3,0 против 9,0±3,1, P = 0.028) [109]. Эффективность эрадикации H. pylori в группе пациентов, принимавших S. boulardii CNCM I-745 в дозе 500 мг в день, достоверно превосходила таковую у пациентов группы контроля (86,0% и 74,7% соответственно; р = 0,02). По сравнению с контрольной группой, у пациентов основной группы достоверно реже наблюдались нежелательные побочные эффекты эрадикации (17,0% против 55,7%; p <0,001), в том числе и развитие антибиотик-ассоциированной диареи (2,0% против 46,4%; P = 0,02), а также отмечалась более высокая приверженность к лечению (95,0% исследуемых лиц экспериментальной группы закончили полный курс терапии в отличии от 91,2% группы контроля, р <0,001) [110]. Мета-анализ 18 исследований (n=3592) показал, что при добавлении S.boulardii к эрадикационной терапии риск общего числа нежелательных явлений (диспепсии, нарушения стула) был на 53% ниже, чем без S.boulardii (ОР= 0,47, 95% ДИ: 0,36-0,61), частота развития диареи - на 67% ниже (ОР= 0,37, 95% ДИ: 0,23-0,57), а достижение успешной эрадикации - выше (ОР= 1,09, 95% ДИ: 1,05-1,13) [100].
По результатам проведенного метаанализа отмечается эффективность содержащих Lactobacillus acidophilus LA-5 и Bifidobacterium animalis subsp. lactis BB-12 пробиотиков (преимущественно в составе функциональных пищевых продуктов) в снижении общего числа нежелательных явлений (ОР 0,31, 95% ДИ 0,20-0,47), профилактики антибиотик-ассоциированной диареи (ОР 0,38, 95% ДИ 0,20-0,72) и улучшении исходов эрадикации H.pylori (ОР 1,16, 95% ДИ 1,05-1,28)[101].
-
Пациентам с гастритом с положительными результатами тестирования на инфекцию H.рylori и показаниями для проведения эрадикационной терапии при ее проведении возможно назначение метабиотиков (в составе биологически активной добавки к пище) для повышения ее эффективности и снижения частоты нежелательных явлений [111].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3).
Комментарии: К метабиотикам (постбиотикам) относятся нежизнеспособные бактерии или их компоненты, а также продукты микробного метаболизма, которые обладают активностью в отношении организма человека [112, 113]. Эффективность метабиотиков в эрадикации инфекции H.pylori была продемонстрирована в многоцентровом рандомизированном клиническом исследовании с участием 90 взрослых пациентов с гастритом и/или язвенной болезнью. Было показано достоверное улучшение исходов стандартной тройной эрадикационной терапии при включении в схему лечения метабиотика, содержащего инактивированные Lactobacillus reuteri DSM 17648 в дозе 1×1010 КОЕ 2 раза в день (p=0,024). Согласно результатам 13С-уреазного дыхательного теста, успешная эрадикация была достигнута у 86,7% принимающих метабиотик и у 66,67% пациентов группы контроля, которым проводилось лечение только компонентами тройной схемы лечения. У пациентов, получавших метабиотик, реже наблюдались такие побочные эффекты лечения, как тошнота (60% против 86,67%, р=0,033), диарея (36,6% против 50%, р=0,035), запор (20% против 33,3%, р=0,026) и нарушение вкуса (43,3% против 60%, р=0,047), однако чаще отмечалось вздутие живота (40% против 13,3%, р<0,001) [111].
-
Пациентам с положительными результатами тестирования на инфекцию H. рylori после неудачи стандартной тройной терапии, стандартной тройной терапии, усиленной висмута трикалия дицитратом**, сочетанной терапии рекомендуется в качестве терапии второй линии классическая четырехкомпонентная терапия с висмутом трикалия дицитратом**- висмут трикалия дицитрат** (120 мг 4 раза в сутки) в сочетании с ИПН (в стандартной дозе 2 раза в сутки), #тетрациклином (500 мг 4 раза в сутки внутрь) и метронидазолом** (500 мг 3 раза в сутки) на 14 дней [114, 115, 192].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 1)
Комментарии: Систематический обзор с сетевым метаанализом продемонстрировал высокую эффективность квадротерапии с препаратом висмута в качестве терапии второй линии [114]. Согласно метаанализу Z.Han et al. висмутсодержащие схемы повышают процент эрадикации при наличии резистентности к кларитромицину** на 40%, к метронидазолу** на 26%, при двойной резистентности на 59%, что делает их выбор оправданным в качестве терапии второй линии [115].
-
Пациентам с положительными результатами тестирования на инфекцию H. рylori после неудачи классической четырехкомпонентной терапии с висмутом трикалия дицитратом** в качестве второй линии рекомендуется тройная схема лечения с #левофлоксацином** (ИПН в стандартной дозе 2 раза в сутки, #левофлоксацин** 500 мг 2 раза в сутки внутрь и #амоксициллин** 1000 мг 2 раза в сутки внутрь) или квадротерапия с #левофлоксацином** (ИПН в стандартной дозе 2 раза в сутки, #левофлоксацин** 500 мг 2 раза в сутки внутрь и #амоксициллин** 1000 мг 2 раза в сутки внутрь, висмута трикалия дицитратом** 120 мг 4 раза в день) на 14 дней[114, 116-118].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Тройная терапия с #левофлоксацином (ИПН, #левофлоксацин** и #амоксициллин**) или квадротерапия с #левофлоксацином** (ИПН, #левофлоксацин**, #амоксициллин**, препарат висмута) после неудачи предшествующих курсов эрадикационной терапии изучены в контролируемых исследованиях и систематических обзорах [114, 116-118].
Алгоритм диагностики и лечения инфекции H.pylori представлен на рисунке 1 (Приложение Б).
1.2. Медикаментозная терапия при эрозивном гастрите и дуодените
-
Пациентам с эрозивным гастритом и дуоденитом, в том числе на фоне приема нестероидных противовоспалительных и противоревматических препарартов, с целью достижения заживления эрозий рекомендуется проведение антисекреторной терапии ингибиторами протонного насоса течение 4-6 недель [119-123] и/или ребамипидом в течение 4-8 недель [124, 125].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Базисная антисекреторная терапия с применением ИПН (назначение #омепразола** внутрь в суточной дозе 20 мг [122], #лансопразола внутрь 30 мг, #пантопразола внутрь 40 мг, #рабепразола внутрь 20 мг, #эзомепразола** внутрь 20 мг на 2-4 недели, при необходимости на более длительный срок, служит основным методом лечения гастродуоденальных эрозий, в том числе индуцированных нестероидными противовоспалительными и противоревматическими препаратами [119-123, 193, 194]. Эффективность ребамипида для заживления эрозивного гастрита доказана в клинических исследованиях в том числе рандомизированных [124, 125].
1.3. Цитопротективная медикаментозная терапия
-
Пациентам с хроническим гастритом, в том числе атрофическим, с целью потенцирования защитных свойств слизистой оболочки возможно рекомендовать терапию висмута трикалия дицитратом**[126, 127, 82] или ребамипидом в течение 4-8 недель [128-132, 82,133, 134].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: Цитопротективный эффект висмута трикалия дицитрата** обусловлен связыванием йонами висмута свободных радикалов и усилением эндогенного синтеза простагландинов [126], в когортном исследовании продемонстрировано снижение уровня повреждения ДНК генеративной зоны слизистой оболочки желудка пациентов после успешной эрадикации H.pylori на фоне четырехнедельной терапии висмута трикалия дицитратом**[127]. Ребамипид оказывает защитный эффект на слизистую оболочку желудочно-кишечного тракта за счет регуляции уровня простагландинов, восстановления физиологичекой продукции слизи и плотных контактов, а также ингибирования продуктов окислительного стресса, провоспалительных цитокинов и хемокинов, что в комплексе ведет к устранению синдрома повышеннной пронцаемости слизистых оболочек [10, 133, 134]. В рандомизированных контролируемых исследованиях ребамипид привел к уменьшению воспаления, а в одном исследовании даже к уменьшению кишечной метаплазии и дисплазии низкой степени, способствовал профилактике рака желудка у пациентов высокого риска [128-132].
1.4. Медикаментозная терапия при симптомах диспепсии
-
Всем пациентам, впервые обратившихся к врачу с жалобами на боль и жжение в эпигастральной области, чувство переполнения в эпигастрии, ранне насыщение, то есть пациентам с необследованной диспепсией с положительными результатами тестирования на инфекцию H. рylori с целью устранения симптомов диспепсии и установления диагноза функциональной диспепсии рекомендуется проведение эрадикационной терапии H. рylori [135].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Согласно систематическому обзору по оценке эффективности эрадикационной терапии H.pylori в лечении функциональной диспепсии при анализе 29 клинических исследований с числом пациентов 6781 доказано, что эрадикационная терапия достоверно эффективнее для прекращения (число больных, которых необходимо лечить (ЧБНЛ) 14 (95% ДИ 11 - 21)) или уменьшения (ЧБНЛ 9 (95% ДИ 7 - 17)) диспептических жалоб. Таким образом, было показано, что положительный эффект антигеликобактерной терапии у больных функциональной диспепсией статистически значимый, хотя и незначительный [135]. Доклад Киотского консенсуса по геликобактерному гастриту узаконил термин «H.pylori-ассоциированная диспепсия», такой вариант диспепсии рассматривается как отдельная единица («distinct entity») [7]. У H.pylori-инфицированных пациентов с диспепсией симптомы могут быть вызваны геликобактерным гастритом в случае, если успешная эрадикация сопровождается устойчивой ремиссией. Если диспепсия сохраняется после этиологического лечения бактериального гастрита, следует поставить диагноз функциональной диспепсии [7].
-
Пациентам с хроническим гастритом и симптомами диспепсии (особенно такими, как боль и жжение в эпигастрии), в том числе в сочетании с функциональной диспепсией, в качестве симптоматического лечения рекомендуется проведение терапии ингибиторами протонного насоса [136, 137, 138, 139, 140].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1).
Комментарии: Гиперчувствительность к кислоте, снижение клиренса двенадцатиперстной кишки и изменение перистальтики желудка, индуцированное кислым рефлюксом из двенадцатиперстной кишки, служат обоснованием назначения кислотосупрессивной терапии при функциональной диспепсии, особенно при синдроме эпигастральной боли [139, 140]. Метаанализ 8 РКИ с участием 2216 пациентов с ФД показал, что ИПН были более эффективными, чем плацебо для улучшения симптомов, причем улучшение симптомов наблюдалось у 36,0% в группе ИПН и 30,0% в группе плацебо (относительный риск (ОР) 1,41; 95% ДИ 1,07–1,87). Число пациентов, которых необходимо лечить (NNT), составило 9 (95% ДИ, 6–24). ИПН оказались эффективным с точки зрения облегчения симптомов (ОР 1,44; 95% ДИ 1,03–2,01) и полного купирования симптомом (ОР 1,26; 95% ДИ 1,07–1,49) [139].
-
Пациентам с хроническим гастритом и симптомами диспепсии (особенно такими, как переполнение в эпигастрии и раннее насыщение), в том числе в сочетании с функциональной диспепсией, в качестве симптоматического лечения рекомендуется проведение терапии препаратами, обладающими прокинетическим эффектом [138, 141-145].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Акотиамид является обратимым ингибитором ацетилхолинэстеразы и антагонистом пресинаптических мускариновых рецепторов. Прокинетический эффект обеспечивается за счет усиления высвобождения ацетилхолина из пресинаптических окончаний и снижения его расщепления ацетилхолиэстеразой [146]. Эффективность акотиамида в сравнении с плацебо для уменьшения симптомов диспепсии была продемонстрирована в клинических исследованиях [146, 147] и метаанализах [141, 142], в том числе специально посвященном сравнению акотиамида и плацебо (6 РКИ, включавших 2429 пациентов с ФД) [142]. Препарат не вызывает удлинения интервала QT и экстрапирамидные расстройства, его безопасность сравнима с плацебо, что подтверждено исследованием с приемом акотиамида более 50 недель [146] метаанализами [141, 142]. Акотиамид не влияет на результаты дыхательного теста с мочевиной, меченной 13С, у H.pylori-позитивных пациентов с функциональной диспепсией [148].
Итоприд по механизму действия одновременно является антагонистом дофаминовых рецепторов и блокатором ацетилхолинэстеразы. Препарат активирует освобождение ацетилхолина и препятствует его деградации [149]. Результаты крупного РКИ свидетельствовали о том, что через 8 недель лечения клинические симптомы диспепсии полностью исчезли или значительно уменьшилась их выраженность у 57, 59 и 64% больных, получавших итоприд (соответственно в дозах 50, 100 и 200 мг 3 раза в сутки), что достоверно превышало эффект плацебо (41%) [149]. Эффективность итоприда подтверждена и в других исследованиях, проведенных в том числе в России [150, 151]. Метаанализ 9 РКИ, включавших 2620 больных с ФД, свидетельствовал о достоверно более высокой эффективности итоприда в отношении улучшения общего состояния, уменьшения тяжести в эпигастральной области после еды и раннего насыщения. Частота возникновения побочных эффектов была одинаковой в группах итоприда и плацебо [144].
Тримебутин - средство, действующее на энкефалинергическую систему желудочно-кишечного тракта, и таким образом, нормализующее его моторику, в РКИ продемонстрировал высокую эффективность для купирования таких симптомов диспепсии, как тяжесть после еды, быстрое насыщение, абдоминальная боль у пациентов с ФД, а также у пациентов с ФД в сочетании с синдромом раздраженного кишечника [152, 153]. Способность тримебутина купировать симптомы диспепсии подтверждена в масштабных проспективных неинтервенционных исследованиях, проведенных в РФ, общее число участников которых составило 4533 человека [154, 155]. По данным сетевого метаанализа, посвященного оценке препаратов с прокинетическим действием при функциональной диспепсии, тримебутин продемонстрировал сопоставимую с метоклопрамидом** и домперидоном эффективность по показателю поверхности под кумулятивной кривой распределения (surfaceunderthecumulativerankingcurve – SUCRA) [143]. При этом безопасность тримебутина по данным метаанализов не отличалась от плацебо [143, 156].
Домперидон, по механизму действия являющийся антагонистом дофаминовых рецепторов, в метаанализе продемонстрировал эффективность в уменьшении симптомов диспепсии (ОР 7,0 (95% CI 3,6-16) [145]. Однако такие нежелательные явления, как увеличение интервала Q–T и связанный с этим риск возникновения нарушений ритма сердца (особенно при одновременном приеме препаратов, метаболизирующихся, как и домперидон, с помощью системы CYP3A4), привели к ограничению показаний к назначению домперидона при диспепсии и продолжительности лечения [157, 158]. В этой связи интерес представляет комбинированный препарат – Домперидон+Омепразол (фиксированная комбинация омепразола 20 мг и домперидона модифицированного высвобождения 30 мг). Клиническая эффективность обеспечивается потенцированием действия препаратов разных фармакологических групп, высоким комплаенсом (однократный прием в течение суток) [159]. Домперидон с модифицированным освобождением в составе препарата Домперидон+Омепразол позволяет принимать препарат один раз в день вместо трехразового прием. При этом отсутствуют пиковые значения концентраций домперидона, возможные при использовании его обычных лекарственных форм, что снижает вероятность проявления нежелательных дозозависимых явлений. Концентрация домперидона в плазме крови на фоне применения фиксированной комбинации омепразола 20 мг с домперидоном модифицированного высвобождения 30 мг не выходит за пределы однократной дозы 10 мг, что позволяет назначать препарат для курсового лечения симптомов диспепсии [157-159].
-
Пациентам с хроническим гастритом и симптомами диспепсии для купирования этих симптомов рекомендуется лечение #ребамипидом (100 мг 3 раза в сутки в течение 2-4 недель, при необходимости 8 недель) как в монотерапии, так и в составе комплексного лечения [160].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1).
Комментарии: Согласно метаанализу 17 РКИ ребамипид достоверно уменьшает симптомы диспепсии не только при функциональной диспепсии, но и при гастрите, индуцированным НПВП [160].
2. Эндоскопическое лечение
-
Пациентам с хроническим гастритом при обнаружении эндоскопически видимых новообразований с дисплазией низкой или высокой степени, а также ракового поражения показано определение стадии процесса и соответствующее лечение, в том числе, эндоскопическая резекция новообразования единым блоком [161, 162, 46, 42].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Дисплазия эпителия представляет собой гистологически однозначный неопластический эпителий (клеточный атипизм, нарушение гистоархитектоники) без достоверных признаков инвазии и служит предпоследней стадией канцерогенеза желудка[163, 164]. При наблюдении за пациентами с дисплазией высокой степени в течение 4-48 месяцев доля пациентов с развитием рака или метахронным раком составила 60-85%; при наблюдении за пациентами с дисплазией низкой степени в течение 10-48 месяцев развитие рака наблюдалось в 0-23% случаев [162]. Метаанализ показывает, что при проведении биопсии при дисплазии низкой степени после патологоанатомического исследования диагноз дисплазии высокой степени устанавливают в 25% случаев, диагноз рака – в 7% [161]. Таким образом, при выявлении патологического участка эпителиальной дисплазии взятие биоптатов малоэффективно для точного диагноза и эндоскопическое лечение служит тактикой выбора.
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
-
Пациентам с хроническим гастритом в стадии ремиссии рекомендуется санаторно-курортное лечение [165].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: На санаторно-курортное лечение не направляют пациентов с противопоказаниями к курортному лечению, а также к проведению любых бальнеологических процедур (например, пациенты с болезнью Менетрие, с полипозом желудка и новообразованиями желудка). Следует обязательно учитывать возраст и наличие сопутствующих заболеваний, что определяет выбор климатического региона. Ведущими методами санаторно-курортного этапа реабилитации служат немедикаментозные: естественные природные факторы (климат, минеральная вода, лечебная грязь), искусственно моделированные природные факторы, кинезотерапия (разнообразные формы и средства ЛФК, медицинский массаж), психотерапия, диетотерапия, фитотерапия и другие. Реабилитация пациентов на санаторном этапе происходит в соответствии с режимами – щадящим, тонизирующим и тренирующим, которые выбираются в зависимости от времени пребывания в санатории, характера заболевания и адаптационных возможностей организма. Больным хроническим гастритом со сниженной секреторной функцией желудка назначают питьевые средне- и высокоминерализованные хлоридно-натриевые, гидрокарбонатные натриевые водами (курорты Бобруйск, Горячий Ключ, Ессентуки, Нальчик, Старая Русса, Усть-Качка и др.). С целью стимуляции секреции желудочного сока и соляной кислоты минеральную воду назначают за 15-20 минут до еды, 3 раза в день. Больным хроническим гастритом с повышенной секреторной функцией желудка назначают питьевые слабо- и среднеминерализованные углекислые гидрокарбонатные натриевые, натриево-кальциевые, сульфатные кальциево-магниево-натриевыми воды (Боржоми, Березовские минеральные воды, Дарасун, Железноводск, Ижевские минеральные воды и др.). Минеральную воду назначают за 1-1,5 часа до еды, 3 раза в день[165].
Госпитализация
Организация оказания медицинской помощи
Большинство пациентов с гастритом подлежат наблюдению и лечению в амбулаторных условиях.
Показаниями к плановой госпитализации пациентов с гастритом и дуоденитом служат необходимость проведения дифференциального диагноза при редких формах гастрита (эозинофильный, гранулематозный и др.), выраженная анемия при аутоиммунном гастрите, выраженная клиническая картина заболевания при эрозивном гастрите, необходимость проведения эрадикационной терапии H.pylori под непосредственным врачебным контролем, необходимость выполнения эндоскопической резекции аденомы и раннего рака желудка.
Продолжительность стационарного лечения пациентов с обострением гастрита должна составлять 16 дней.
Показанием к экстренной госпитализации является наличие признаков острого желудочно-кишечного кровотечения у пациента с подозрением на эрозивный гастрит и/или дуоденит.
Установление клинического диагноза и прогноза пациента, улучшение клинической картины, завершение курса эрадикационной терапии H.pylori, выполнение эндоскопической резекции аденомы и раннего рака желудка, купирование желудочно-кишечного кровотечения, улучшение показателей клинического анализа крови служат основанием для выписки из стационара.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
-
Всем лицам с наличием инфекции H.pylori при отсутствии противопоказаний рекомендуется проведение эрадикационной терапии с целью профилактики рака желудка [166, 167, 168, 169, 170, 6, 7, 8, 46, 42, 82].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1)
Комментарии: Эрадикация инфекции H.pylori признана основным методом профилактики рака желудка, эффективность которого доказана в ряде популяционных исследований и в метаанализах [166-170]. В метаанализе 7 РКИ, включавшем 8323 человека, эрадикация H.pylori снизила заболеваемость раком желудка по сравнению с лицами, которые не получали эрадикационную терапию, с показателем относительного риска0,54 (95% ДИ 0,40 – 0,72;NNT=72), а также смертность от рака желудка с показателем относительного риска 0,61 (95% CI 0,40 – 0,92;NNT=135) [167].
-
Всем пациентам, которые перенесли эндоскопическую резекцию аденомы/раннего рака желудка, рекомендуется эрадикационная терапия H.pylori для профилактики метахронного рака желудка [167, 171-173, 6, 7, 8, 46, 42, 82, 174].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
Комментарии: Снижение частоты метахронного рака желудка у пациентов после эрадикации H.pylori по сравнению с группой с персистенцией инфекции доказано в РКИ и метаанализах [167, 171-173]. Так, в метаанализе 3 исследований, включавшем 1841 пациента с эндоскопической резекцией эпителиальной дисплазии/неоплазии, эрадикационная терапия снизила заболеваемость раком желудка с показателем относительного риска 0,49(95% ДИ 0,34 – 0,70, NNT=21) [167].
-
Пациентам с выявленной дисплазией слизистой оболочки желудка в отсутствие видимого при стандартной эндоскопии в белом свете отграниченного новообразования рекомендуется незамедлительно выполнить повторную эзофагогостродуоденоскопию высокого разрешения с хромоэндоскопией (виртуальной или с использованием красителей) и увеличением. В случае, если при проведении повторного исследования вновь не удается выявить отграниченное новообразование, рекомендуется выполнить биопсию желудка для определения стадии гастрита (если это не сделано ранее) и контрольную эзофагогастродуоденоскопию не позднее, чем через 6 месяцев (при дисплазии высокой степени), и не позднее, чем через 12 месяцев (при дисплазии низкой степени) [175-182, 46, 42].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Пациентам со слабой и умеренной степенью атрофии слизистой оболочки, ограниченной только антральным отделом желудка, после успешной эрадикационной терапии H.pylori эндоскопическое наблюдение не рекомендуется [175-182, 46, 42].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
-
Пациентам с кишечной метаплазией, ограниченной одной анатомической областью, в большинстве случаев не рекомендуется наблюдение, особенно если высококачественное эндоскопическое исследование с биопсией позволило исключить выраженные стадии атрофического гастрита. Однако при наличии у таких пациентов отягощенного по раку желудка семейного анамнеза, неполной кишечной метаплазии, персистенции инфекции H.pylori им рекомендуется эндоскопическое наблюдение с хромоэндоскопией и прицельной биопсией 1 раз в 3 года[175-184, 46, 42].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
-
Пациентам с выраженным атрофическим гастритом (выраженная атрофия и/или кишечная метаплазия и в теле, и в антральном отделе желудка — OLGA/OLGIM III/IV) рекомендуется высококачественное эндоскопическое наблюдение – эзофагогастродуоденоскопию каждые 3 года. Пациентам с выраженным атрофическим гастритом с отягощенным наследственным анамнезом по раку желудка рекомендуется эзофагогастродуоденоскопия 1 раз в 1—2 года[175-184, 46, 42]. Согласно приказу Министерства здравоохранения РФ от 29 марта 2019 г. № 173н “Об утверждении порядка проведения диспансерного наблюдения за взрослыми” диспансерное наблюдение при хроническом атрофическом фундальном и мультифокальном гастрите предусматривает прием (осмотр, консультация) врача-гастроэнтеролога 1 раз в год, прием (осмотр, консультация) врача-онколога по медицинским показаниям c контролируемым показателем стабилизации морфологических изменений по данным ЭГДС с биопсией.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: Для определения интервалов эндоскопического наблюдения предложена стратификация пациентов на основании выраженности предраковых изменений желудка и наличия дополнительных факторов риска рака желудка. Очевидно, что лица с выраженной атрофией и кишечной метаплазией слизистой оболочки желудка продолжают нуждаться в эндоскопическом наблюдении даже несмотря на ликвидацию инфекции H.pylori в результате успешной ее терапии [6, 7, 8, 46, 42, 174].Популяционное исследование (405172 человека, за период 1979-2011) показало, что у лиц, которые проходили эндоскопическое исследование с биопсией в связи с неонкологическими показаниями, в течение 20 лет рак желудка развивается в одном случае из 256 с нормальной слизистой оболочкой желудка, в 1 из 85 с гастритом, в 1 из 50 с атрофическим гастритом, в 1 из 39 с кишечной метаплазией и в 1 случае из 19 с дисплазией [175]. В когортном исследовании при наблюдении 1755 пациентов с диспепсией в среднем в течение 55 месяцев неоплазия была выявлена исключительно у лиц с иcходными стадиями OLGAIII-IV. Риск неоплазии отсутствовал у пациентов со стадией OLGA 0, I и II (95% ДИ 0 – 0,4), составил 36,5 на 1000 человеко-лет при стадии III (95% ДИ 13,7 – 97,4) и 63,1 на 1000 человеко-лет при стадии IV (95% ДИ 20,3 – 195,6) [176].Стадии OLGAIII/IVиOLGIMI – IVоказались независимыми факторами риска рака желудка, причем даже незначительно выраженная кишечная метаплазия существенно повышала риск рака желудка [177, 178]. Данные исследования показывают, что наличие кишечной метаплазии (как маркера выраженного гастрита) может иметь даже большее значение, чем степень атрофии без кишечной метаплазии, поскольку риск рака желудка был выше с OLGIM I / II, чем с OLGA III / IV. Неполная кишечная метаплазия - прогностически неблагоприятный фактор развития рака желудка по сравнению с полной кишечной метаплазией, ее следует рассматривать как дополнительное условие определения сроков наблюдения пациентов с гастритом [180-182].Дополнительным фактором риска рака желудка служит наличие близких родственников, страдающих раком желудка [183, 184].
-
Пациентам с аутоиммунным гастритом рекомендуется эндоскопическое наблюдение 1 раз в 1-2 года [46, 42].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Аутоиммунный гастрит является предраковым заболеванием, что оправдывает эндоскопическое наблюдение. Так, относительный риск рака желудка при пернициозной анемии составил 6,8 (95% ДИ 2,6–18,1). Недостатком этого метаанализа служит включение любых пациентов с низким уровнем витамина B12, причиной которого служит не только аутоиммунный гастрит [185]. Через 3 года после первичного скринингового обследования у 56 пациентов были выполнены контрольные ЭГДС, в ходе которых было выявлено 2 пациента с аденокарциномой желудка, ни одного пациента с дисплазией высокой степени и 49 пациентов с кишечной метаплазией [186]. В другом исследовании в течение 6-7 лет не было выявлено случаев рака желудка [187]. Рекомендуемый интервала наблюдения не разработан в рандомизированных контролируемых исследованиях. Учитывая кроме риска аденокарциномы желудка риск развития нейроэндокринной опухоли желудка, сочетание с другими заболеваниями, ассоциированными с повышенным риском новообразований желудочно-кишечного тракта, мы рекомендуем эндоскопический контроль 1 раз в 3 года.
Алгоритм ведения пациентов с хроническим гастритом с порядком диспансерного наблюдения представлен на рисунке 2 (Приложение Б).
Информация
Источники и литература
-
Клинические рекомендации Российской гастроэнтерологической ассоциации
- 1. Marshall B.J., Warren J.R. Unidentified curved bacilli in the stomach of patients with gastritis and peptic ulceration. Lancet. 1984; 1(8390):1311-1315. doi: 10.1016/s0140-6736(84)91816-6. 2. Kusters J.G., van Vliet A.H., Kuipers E.J. Pathogenesis of Helicobacter pylori infection. ClinMicrobiolRev. 2006; 19(3):449-490. doi:10.1128/CMR.00054-05. 3. Graham D.Y., Opekun A.R., Osato M.S., El-Zimaity H.M., Lee C.K., Yamaokaet Y. et al. Challenge model for Helicobacter pylori infection in human volunteers. Gut. 2004; 53(9): 1235-1243. doi: 10.1136/gut.2003.037499. 4. Ansari S., Yamaoka Y. Helicobacter pylori Virulence Factors Exploiting Gastric Colonization and its Pathogenicity. Toxins (Basel). 2019; 11(11):677. doi: 10.3390/toxins11110677. 5. El-Omar E.M., Carrington M., Chow W.H., McColl K.E., Bream J.H., Young H.A., Herrera J., Lissowska J., Yuan C.C., Rothman N., Lanyon G., Martin M., Fraumeni J.F. Jr., Rabkin C.S. Interleukin-1 polymorphisms associated with increased risk of gastric cancer.Nature. 2000; 404(6776):398-402. doi: 10.1038/35006081. 6. Malfertheiner P., Megraud F., Rokkas T., Gisbert J.P., Liou J.M., Schulz C., et al.; European Helicobacter and Microbiota Study group. Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report. Gut. 2022:gutjnl-2022-327745. doi: 10.1136/gutjnl-2022-327745. 7. Sugano K., Tack J., Kuipers E.J., Graham D.Y., El-Omar E.M., Miura S. et al. Kyoto global consensus report on Helicobacter pylorigastritis Gut 2015;64:1353–1367. doi: 10.1136/gutjnl-2015-309252. 8. Ивашкин В.Т., Маев И.В., Каприн А.Д., Агапов М.Ю., Андреев Д.Н., Водолеев А.С., и соавт. Раннее выявление онкологических заболеваний органов пищеварения (методическое руководство Российской гастроэнтерологической ассоциации и Ассоциации онкологов России для врачей первичного звена здравоохранения). Рос журн гастроэнтерол гепатол колопроктол. 2019;29(5):53–74. doi:10.22416/1382-4376-2019-29-5-53-74. Ivashkin V.T., Mayev I.V., Kaprin A.D., Agapov M.Yu., Andreev D.N., Vodoleev A.S., et al. Early Detection of Oncological Diseases of the Digestive System (Guidelines of the Russian Gastroenterological Association and the Russian Association of Oncologists for Primary Care Physicians). Rus J Gastroenterol Hepatol Coloproctol. 2019;29(5):53-74. (In Russ.) https://doi.org/10.22416/1382-4376-2019-29-5-53-74 9. Ивашкин В.Т., Лапина Т.Л., Маев И.В., Драпкина О.М., Козлов Р.С., Шептулин А.А., и соавт. Клинические рекомендации Российской гастроэнтерологической ассоциации, Научного сообщества по содействию клиническому изучению микробиома человека, Российского общества профилактики неинфекционных заболеваний, Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии по диагностике и лечению H. pylori у взрослых. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2022;32(6):72-93. https://doi.org/10.22416/1382-4376-2022-32-6-72-93 Ivashkin V.T., Lapina T.L., Maev I.V., Drapkina O.M., Kozlov R.S., Sheptulin A.A., et al Clinical Practice Guidelines of Russian Gastroenterological Association, Scientific Society for the Clinical Study of Human Microbiome, Russian Society for the Prevention of Non-Communicable Diseases, Interregional Association for Clinical Microbiology and Antimicrobial Chemotherapy for H. pylori Diagnostics and Treatment in Adults. Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2022;32(6):72-93. https://doi.org/10.22416/1382-4376-2022-32-6-72-93 10. Симаненков В.И., Маев И.В., Ткачева О.Н, Алексеенко С.А., Андреев Д.Н., Бордин Д.С. и соавт. Синдром повышенной эпителиальной проницаемости в клинической практике. Мультидисциплинарный национальный консенсус. Кардиоваскулярная терапия и профилактика. 2021;20(1):2758. doi:10.15829/1728-8800-2021-2758. Simanenkov V.I., Maev I.V., Tkacheva O.N., Alekseenko S.A., Andreev D.N., Bordin D.S., et al. Syndrome of increased epithelial permeability in clinical practice. Multidisciplinary national Consensus. Cardiovascular Therapy and Prevention. 2021;20(1):2758. (In Russ.) https://doi.org/10.15829/1728-8800-2021-2758
Информация
Список сокращений
ДИ – доверительный интервал
ИПН– ингибиторы протонного насоса
Н.рylori – Helicobacter pylori
НПВП – нестероидные противовоспалительные и противоревматические препараты
ОР – относительный риск
ОШ – отношение шансов
ЭГДС –эзофагогастродуоденоскопия
ФД – функциональная диспепсия
Термины и определения
Гастрит – воспалительное заболевание слизистой оболочки желудка.
Хронический гастрит – группа хронических заболеваний, которые характеризуются персистирующим воспалительным инфильтратом и нарушением клеточного обновления с развитием кишечной метаплазии и атрофии в слизистой оболочке желудка.
Helicobacter pylori (H.pylori) – спиралевидная грамотрицательная бактерия, которая обладает способностью колонизировать слизистую оболочку желудка и вызывает ее воспаление.
Эрадикация – лечение, направленное на уничтожение инфекции Helicobacter pylori (H.pylori)
Схема эрадикации 1-й линии - схема эрадикации инфекции H pylori, которая назначается в первую очередь.
Схема эрадикации 2-й линии - схема эрадикации, которая назначается при неэффективности схемы 1-й линии.
Аутоиммунный гастрит – орган-специфическое аутоиммунное заболевание, которое характеризуется наличием антител к париетальным клеткам желудка и/или внутреннему фактору.
Хронический дуоденит - группа хронических заболеваний, которая характеризуется воспалительной инфильтрацией слизистой оболочки двенадцатиперстной кишки, желудочной метаплазией эпителия и нарушениями гистоархитектоники и в виде укорочения ворсинок и углубления крипт.
Критерии оценки качества медицинской помощи
|
№ |
Критерии качества |
Оценка выполнения |
|---|---|---|
|
1. |
Проведена ЭГДС, причем для диагностики предраковых изменений и раннего рака желудка – видеоЭГДС высокого разрешения с виртуальной хромондоскопией |
Да/Нет |
|
2. |
Взята биопсия по показаниям при проведении диагностической ЭГДС |
Да/Нет |
|
3. |
Проведено тестирование на наличие инфекции с помощью 13С- уреазного дыхательного теста на Helicobacter pylori или определения антигена H.pylori в кале, а при проведении ЭГДС - с помощью быстрого уреазного теста с целью определения показаний к этиотропной эрадикационной терапии |
Да/Нет |
|
4. |
Проведена эрадикационная терапия при положительном результате тестирования на инфекцию H. рylori в качестве этиологического лечения |
Да/Нет |
|
5. |
Проведена эрадикационная терапия при положительном результате тестирования на инфекцию H. рylori пациентам с атрофическим гастритом для предотвращения прогрессирования атрофии |
Да/Нет |
|
6. |
Проведена эндоскопическая резекция единым блоком при обнаружении эндокопически видимых патологических участков дисплазии низкой или высокой степени, а также раннего рака. |
Да/Нет |
|
7. |
Проведена эрадикация инфекции H.pylori пациенту после эндоскопической резекции аденомы/раннего рака желудка для профилактики метахронного рака желудка. |
Да/Нет |
|
8. |
Проведено эндоскопическое наблюдение - ЭГДС1 раз в 3 года пациентам с кишечной метаплазией, ограниченной одной анатомической областью, при наличии у таких пациентов отягощенного по раку желудка семейного анамнеза, неполной кишечной метаплазии, персистенции инфекции H.pylori. |
Да/Нет |
|
9. |
Проведена высококачественная ЭГДС каждые 3 года пациентам с выраженным атрофическим гастритом (выраженная атрофия и/или кишечная метаплазия и в теле, и в антральном отделе желудка — OLGA/OLGIM III/IV), и эндоскопическое наблюдение 1 раз в 1—2 года пациентам с выраженным атрофическим гастритом с отягощенным наследственным анамнезом по раку желудка. |
Да/Нет |
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Абдулхаков Рустам Аббасович - доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Абдулхаков Сайяр Рустамович – кандидат медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Алексеева Ольга Поликарповна- доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Алексеенко Сергей Алексеевич - доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Андреев Дмитрий Николаевич, кандидат медицинских наук, доцент, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Барановский Андрей Юрьевич - доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Бордин Дмитрий Станиславович– доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Дехнич Наталья Николаевна – кандидат медицинских наук, член Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии. Конфликт интересов отсутствует.
Зольникова Оксана Юрьевна - доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Ивашкин Владимир Трофимович – доктор медицинских наук, профессор, академик РАН, дважды лауреат премии Правительства РФ в области науки и техники в 2007 г., в области образования – в 2013 г., заслуженный врач РФ, заслуженный деятель науки РФ, Президент Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Кляритская Ирина Львовна - доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Козлов Роман Сергеевич – доктор медицинских наук, профессор, член-корреспондент РАН, президент Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии. Конфликт интересов отсутствует.
Коган Евгения Алтаровна - доктор медицинских наук, профессор, лауреат премии Правительства РФ в области науки и техники в 2007 г., член Российского общества патологоанатомов. Конфликт интересов отсутствует.
Кононов Алексей Владимирович - доктор медицинских наук, профессор, член Российского общества патологоанатомов. Конфликт интересов отсутствует.
Королев Михаил Павлович – доктор медицинских наук, профессор, председатель Российского эндоскопического общества, член Российского общества хирургов. Конфликт интересов отсутствует
Корочанская Наталья Всеволодовна - доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Куваев Роман Олегович – кандидат медицинских наук, член Российского эндоскопического общества. Конфликт интересов отсутствует
Лапина Татьяна Львовна – кандидат медицинских наук, доцент, лауреат премии Правительства РФ в области науки и техники в 2007 г., член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Ливзан Мария Анатольевна - доктор медицинских наук, профессор, член-корреспондент РАН, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Маев Игорь Вениаминович, доктор медицинских наук, профессор, академик РАН, лауреат премии Правительства РФ в области науки и техники в 2006 г., заслуженный врач РФ, заслуженный деятель науки РФ, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Маммаев Сулейман Нураттинович - доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Осипенко Марина Федоровна - доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Павлов Павел Владимирович - кандидат медицинских наук, член Российского эндоскопического общества. Конфликт интересов отсутствует.
Пирогов Сергей Сергеевич -доктор медицинских наук, член Российского эндоскопического общества. Конфликт интересов отсутствует.
Полуэктова Елена Александровна - доктор медицинских наук, член Научного сообщества по содействию клиническому изучению микробиома человека, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Сарсенбаева Айман Силкановна - доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Симаненков Владимир Ильич– доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Тертычный Александр Семенович - доктор медицинских наук, профессор, член Российского общества патологоанатомов. Конфликт интересов отсутствует.
Ткачев Александр Васильевич - доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Трухманов Александр Сергеевич – доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Ульянин Анатолий Игоревич - член Научного сообщества по содействию клиническому изучению микробиома человека, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Успенский Юрий Павлович - доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Федоров Евгений Дмитриевич - доктор медицинских наук, профессор, заместитель председателя Российского эндоскопического общества. Конфликт интересов отсутствует.
Хлынов Игорь Борисович – доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Цуканов Владислав Владимирович – доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Шептулин Аркадий Александрович - доктор медицинских наук, профессор, член Российской гастроэнтерологической ассоциации. Конфликт интересов отсутствует.
Приложение А2. Методология разработки клинических рекомендаций
Предлагаемые рекомендации имеют своей целью довести до практических врачей современные представления об этиологии и патогенезе гастрита и дуоденита, познакомить с применяющимся в настоящее время алгоритмом диагностики и лечения.
Целевая аудитория данных клинических рекомендаций:
1. Врачи-гастроэнтерологи
2. Врачи общей практики (семейные врачи)
3. Врачи-терапевты
4. Врачи-эндоскописты
5. Врачи-онкологи
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Уровни достоверности доказательств с указанием использованной классификации уровней достоверности доказательств (УДД)
|
УДД |
Расшифровка |
|---|---|
|
1. |
Систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2. |
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3. |
Нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4. |
Несравнительные исследования, описание клинического случая или серии случаев, исследование «случай-контроль» |
|
5. |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение эксперта |
Таблица 3. Уровни убедительности рекомендаций (УУР) с указанием использованной классификации уровней убедительности рекомендаций
|
УУР |
Расшифровка |
|---|---|
|
А |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
В |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
С |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
-
Приказ Министерства здравоохранения и социального развития Российской Федерации от 02.06.2010 № 415н “Об утверждении Порядка оказания медицинской помощи населению при заболеваниях гастроэнтерологического профиля”
-
Приказ Министерства здравоохранения Российской Федерации от 10 мая 2017 г. № 203н "Об утверждении критериев оценки качества медицинской помощи».
-
Приказ Министерства здравоохранения РФ от 14 февраля 2023 г. N 49н "Об утверждении стандарта медицинской помощи взрослым при гастрите и дуодените (диагностика и лечение)"
-
Приказ Министерства здравоохранения Российской Федерации от 15.03.2022 № 168н "Об утверждении порядка проведения диспансерного наблюдения за взрослыми"
Классификация атрофического гастрита по Кимура-Такемото [23, 24]. Рисунок воспроизведен из [188] в соответствии с Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0).
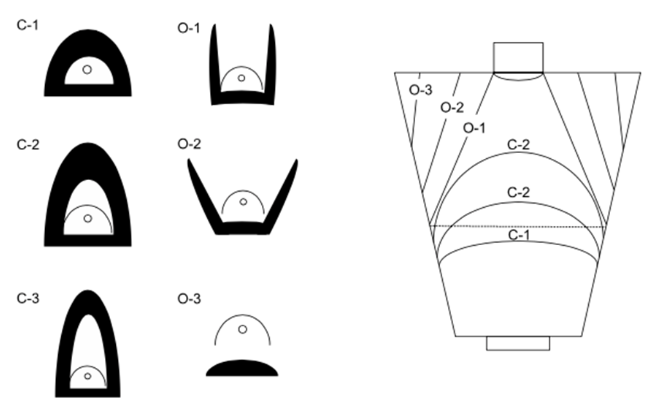
Гастрит закрытого типа (closed type: C-1, C-2, C-3): граница атрофии распространяется по малой кривизне тела желудка, не достигая кардии.
Гастрит открытого типа (ореn type: О-1, О-2, О-3, Ор): граница атрофии, достигнув кардии, распространяется по передней и задней стенкам тела желудка.
С-1 – атрофия ограничена антральным отделом
С-2 – атрофия распространяется выше угла желудка, но ограничена небольшой областью малой кривизны тела желудка
С-3 – атрофия занимает большую часть малой кривизны тела желудка, но не достигает кардии
О-1 – атрофия распространяется на тело желудка, достигая кардии; граница атрофии располагается между малой кривизной и передней стенкой
О-2 – граница атрофии проходит по передней стенке тела желудка
О-3 – атрофия занимает почти весь желудок; граница проходит между передней стенкой и большой кривизной
Ор - атрофический пангастрит
Эндоскопическая картина, соответствующая классификации атрофического гастрита по Кимура-Такемото [23, 24]. Граница атрофии слизистой оболочки (F-линия) обозначена прерывистой линией. A: C1; B: C2; C: C3; D: O1; E: O2; F: O3. Рисунок воспроизведен из [189] в соответствии с Creative Commons Attribution Non Commercial (CC BY-NC 4.0) license.
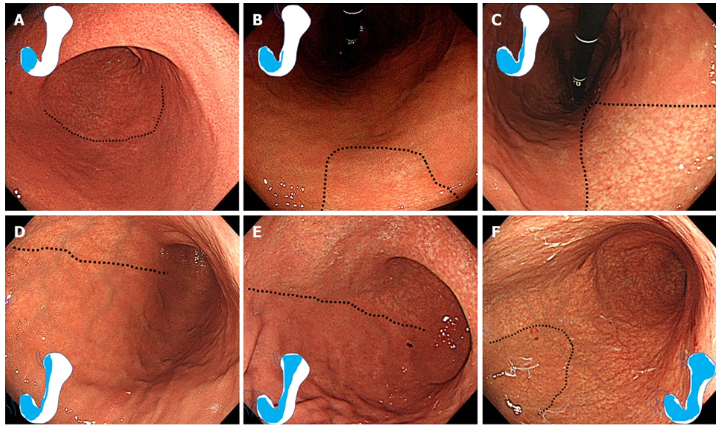
Эндоскопическая Киотская характеристика гастрита [189]
|
Локализация |
Эндоскопические признаки |
H.pylori+ |
H.pylori- |
После эрадикации H.pylori |
|---|---|---|---|---|
|
Все отделы желудка |
Атрофия |
часто |
никогда |
часто ~ никогда |
|
Диффузная эритема |
часто |
никогда |
никогда |
|
|
Фовеолярно-гиперпластические полипы |
часто |
никогда |
часто ~ никогда |
|
|
«Географическая» эритема |
никогда |
никогда |
часто |
|
|
Ксантома |
часто |
никогда |
часто |
|
|
Гематин |
|
часто |
часто |
|
|
Красные полосы |
|
часто |
часто |
|
|
Кишечная метаплазия |
часто |
никогда |
часто ~ |
|
|
Отек слизистой оболочки |
часто |
никогда |
никогда |
|
|
Очаговая эритема |
часто |
часто |
часто |
|
|
Плоские эрозии |
часто |
часто |
часто |
|
|
Тело желудка |
Увеличенные /извитые складки |
часто |
никогда |
никогда |
|
Вязкий секрет |
часто |
никогда |
никогда |
|
|
Тело и свод желудка |
Полипы фундальных желез |
никогда |
часто |
часто |
|
Точечная эритема |
часто |
никогда |
иногда~ никогда |
|
|
Множественные белые и плоско-приподнятые участки |
иногда |
часто |
часто |
|
|
Малая кривизна, нижняя 1/3 - угол |
Регулярное распределение коллекторных венул |
никогда |
часто |
Никогда~ иногда |
|
Антральный отдел |
Зернистость слизистой оболочки |
часто |
никогда |
Иногда ~ никогда |
|
Приподнятые эрозии |
иногда |
часто |
часто |
Приложение Б. Алгоритмы действий врача
Рисунок 1. Алгоритм диагностики и лечения инфекции H. pylori у взрослых
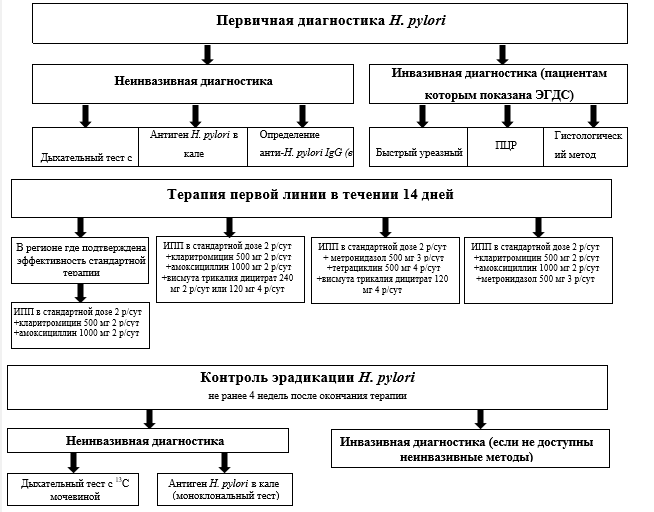
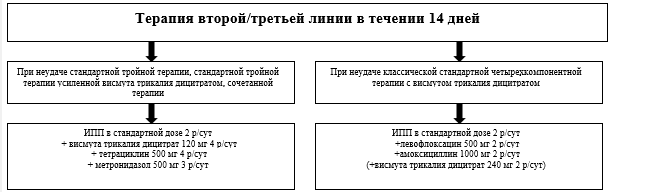
Рисунок 2. Алгоритм ведения пациентов с хроническим гастритом с порядком диспансерного наблюдения


Приложение В. Информация для пациента
Основным фактором, вызывающим гастрит, в настоящее время признан микроорганизм, называемый пилорическим геликобактером. Поэтому каждый пациент, у которого выявлен гастрит, должен быть обследован на наличие данной инфекции. При ее подтверждении необходимо проведение лечения, направленного на уничтожение данных бактерий (эрадикация) с последующим контролем через 4-6 недель. При неэффективности проведенного лечения следует провести повторный курс терапии с другой схемой назначения лекарственных средств. Важно соблюдать приверженность к лечению и строго контролировать прием лекарственных препаратов. Эрадикационная терапия, приводящая к уничтожению пилорического геликобактера, сейчас считается основной мерой, направленной на оздоровление слизистой оболочки желудка, и профилактику рака желудка. Наличие рака желудка у близких родственников (родители, бабушки и дедушки) служит дополнительным основанием для проведения лечения против пилорического геликобактера.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.