Врожденная и перинатальная цитомегаловирусная инфекция
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Общая информация
Краткое описание
Одобрен
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
ВРОЖДЕННАЯ И ПЕРИНАТАЛЬНАЯ ЦИТОМЕГАЛОВИРУСНАЯ ИНФЕКЦИЯ
ЦМВ инфекция – вирусное инфекционное заболевание, относящееся к семейству ДНК содержащих герпесвирусных инфекций, характеризующееся полиморфной клинической симптоматикой и специфичными гистопатологическими проявлениями в виде инфицированных клеток с обилием цитоплазмы и внутриядерными и цитоплазматическими включениями.
Врожденная ЦМВ инфекция – возникает вследствие заражения плода во внутриутробном периоде, преимущественно до 20 недель беременности, от инфицированной матери с явным или субклиническим течением инфекции трансплацентарным путем. Проявления инфекции зависят от срока беременности, когда произошло заражение, дозы возбудителя и могут иметь следующие исходы: самопроизвольный аборт, задержка внутриутробного развития, преждевременные роды, мертворождение, формирование врожденных пороков развития, и после рождения- симптоматическая или бессимптомная формы неонатальной ЦМВИ.
Перинатальная ЦМВ инфекция приобретается через родовые пути матери при контакте с инфицированными выделениями из шейки матки.
Постнатальная ЦМВ инфекция передается через грудное молоко, трансфузию препаратов крови после рождения.
ВВОДНАЯ ЧАСТЬ
Код(ы) МКБ-10:

Дата разработки/пересмотра протокола: 2022 год.
Категория пациентов: новорожденные, недоношенные дети.
Шкала уровня доказательности:
|
Рейтинг качества
|
Определение | Пример методологии | Уровень доказательства |
| Высокий |
Продолжение дальнейших исследований
вряд ли изменит результаты предыдущих исследований
|
Рандомизированные или дважды модернизированные обсервационные исследования | А |
| Умеренный |
Дальнейшие исследования, вероятно, окажут важное влияние на уверенность в
оценке эффекта и
могут изменить оценку
|
Рандомизированные исследования пониженным рейтингом или модернизированные обсервационные исследования | Б |
| Низкий |
Дальнейшие исследования окажут
важное влияние на уверенность в оценке эффекта и вероятно изменят ее.
|
Рандомизированные исследования с удвоенным понижением рейтинга и
обсервационные исследования.
|
С |
| Очень низкий |
Любая оценка эффекта
очень неопределенно
|
Рандомизированные с тройным понижением рейтинга
или обсервационное исследование с пониженным рейтингом или серия случаев/доклад случаев
|
Д |
|
Сила рекомендации
|
Определение | Класс рекомендации |
|
Сильная
рекомендация для использования (или не использования) в качестве
вмешательства
|
Наиболее информированные пациенты выбрали бы рекомендуемое лечение и клиницисты могут структурировать свои взаимодействия с пациентами соответственно | 1 |
| Слабая рекомендация для использования (или не использования) в качестве вмешательства |
Выбор пациентов будет варьировать в зависимости от их ценностей и предпочтений.
Клиницисты должны обеспечить уход, соответствующий ценностям и предпочтениям пациентов
|
2 |
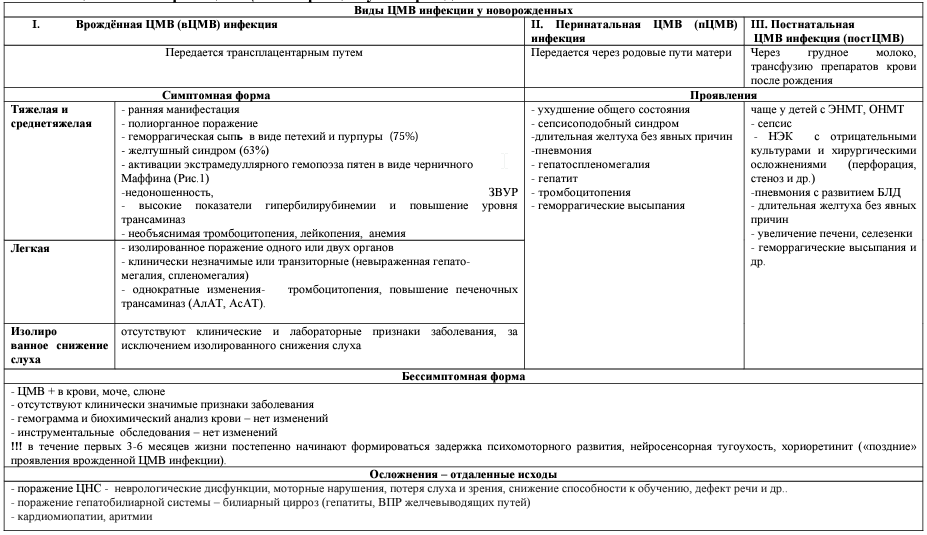
Классификация
Классификация [1, 3-5]:
Таблица 1. Классификация ЦМВ инфекции у новорожденных.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ.
Диагностические критерии.
Жалобы и анамнез:
- о врожденной ЦМВ инфекции могут свидетельствовать указания на перенесенные матерью во время данной беременности мононуклеозоподобных состояний, вирусных инфекций, а также сероконверсия (иммунологический ответ без клинических признаков);
- перинатальная ЦМВ инфекция подтверждается положительными результатами ПЦР ДНК ЦМВ из цервикального канала
- постнатальная ЦМВ инфекция подтверждается положительными результатами ПЦР ДНК ЦМВИ из грудного молока матери, а также при трансфузии препаратов крови у новорожденного.
Проявления вЦМВ инфекции:
- ухудшение общего состояния;
- длительная желтуха без явных причин;
- увеличение печени, селезенки;
- задержка внутриутробного развития;
- геморрагические высыпания и т.д.
Симптомная форма вЦМВ инфекции
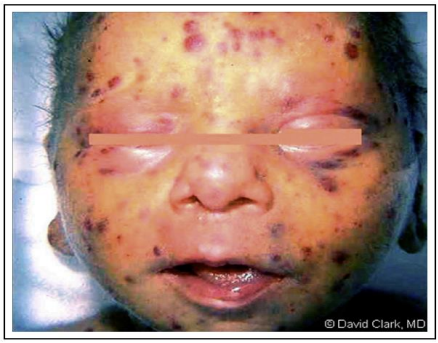
1. Тяжелая степень тяжести проявляется ранней манифестацией в виде тяжелого острого инфекционного заболевания с развитием полиорганной патологии и с высоким риском летального исхода. Клиническая картина характеризуется наличием геморрагической сыпи в виде петехий и пурпуры (75%), желтухой (63%), недоношенностью и пятен в виде черничного Маффина (Рис.1) как следствие активации экстрамедуллярного гемопоэза. Приблизительно, 1/3 этих новорожденных являются недоношенными и 1/3 имеют ЗВУР.
2. Среднетяжелая степень тяжести характеризуется наличием клинических симптомов и без угрожающих жизни осложнений, таких как задержка внутриутробного развития, хореоретинит, микроцефалия (48%) без или с внутричерепными кальцификатами. Кальцификаты могут визуализироваться везде, но чаще располагаются в перивентрикулярной области головного мозга. Нейровизуальная картина поражения ЦНС включает и вентрикуломегалию, атрофию коры головного мозга, а также заболевания, обусловленные недостаточной миграцией нейробластов из первичной нервной трубки, такие как лиссенцефалия, пахигирия и демиелинизация (10% - 15%).
3. Легкая степень тяжести проявляется изолированным поражением одного или двух органов, клинически незначимыми или транзиторными (невыраженная гепатомегалия, спленомегалия) проявлениями, или однократным изменением количества тромбоцитов, однократным повышением печеночных трансаминаз (АЛаТ, АСаТ).
Лабораторные исследования:
Таблица 2. Диагностические тесты [1-2,6-9].
|
Тест
|
Комментарий |
| ПЦР мочи на ЦМВ в первые 21 дни жизни | Сбор мочи в специальный контейнер |
| Мазок слюны методом ПЦР на ЦМВ в первые 21 день жизни [9, 11, 46]. |
Необходимо проводить по крайней мере через час после кормления грудным молоком.
Нет ограничений для детей, находящихся на искусственном вскармливании.
|
| ПЦР на ЦМВ цельной крови или плазмы в первые 21 день жизни |
Используются пробирки ЭДТА для сбора крови на исследования.
ПЦР на ЦМВ цельной крови или плазмы чаще бывают отрицательными.
Исследование слюны и мочи на ЦМВ являются предпочтительными тестами.
|
| ПЦР на ЦМВ по карте Гатри (Пятна сухой крови) | Можно использовать для ретроспективной диагностики, но отрицательный результат не исключает полностью вЦМВ, так как чувствительность варьирует: 34-80% . |
| Динамика материнской крови |
Может продемонстрировать время заражения по:
-сероконверсии при наличии двух последовательных проб, например во время беременности или при сравнении анте, пери- или постнатальной крови.
-авидности IgG к ЦМВ – низкая авидность признак присоединения «свежей» инфекции.
|
При вЦМВ инфекции в лабораторных анализах ребенка выявляются:
- длительная желтуха, обусловленная гипербилирубинемией, связанной с нарушением функции печени и, как следствие, ― повышение уровня трансаминаз;
- гипербилирубинемия с высоким уровнем прямого билирубина;
- необъяснимая тромбоцитопения, особенно при лейкопении или анемии.
При вЦМВИ с изолированным снижением слуха отсутствуют клинические и лабораторные признаки заболевания, за исключением изолированного снижения слуха.
NB! У детей, не прошедших аудиологический скрининг, необходимо проводить дифференциальный диагноз между вЦМВ инфекцией и другими причинами тугоухости.
- Диагноз вЦМВ инфекции у ребенка устанавливается путем обнаружения ДНК ЦМВ методом ПЦР в биологических жидкостях организма в первые 3 недели жизни. Если ЦМВ обнаруживается через 3 недели после рождения, то остается неясной, была ли ЦМВ инфекция врожденной (антенатальная инфекция) или приобретенной (постнатальная инфекция), в связи с чем этот результат не подтверждает время инфицирования ЦМВ.
Бессимптомная форма вЦМВ, пЦМВ и постЦМВ инфекции характеризуется обнаружением цитомегаловируса в биологических жидкостях (кровь, моча слюна) и отсутствием клинически значимых признаков заболевания, изменений в гемограмме, биохимическом анализе крови и при инструментальном обследовании. У детей до 10-20% случаев с бессимптомной формой вЦМВИ в течение первых 3-6 месяцев жизни постепенно начинают формироваться задержка психомоторного развития, нейросенсорная тугоухость, хориоретинит («поздние» проявления врожденной ЦМВИ). Дети с данной формой ЦМВ инфекции требуют динамического наблюдения на амбулаторном этапе до школьного возраста, так как около 40% нарушений слуха формируются в постнеонатальном периоде у детей с нормальным результатом слухового теста в неонатальном периоде [1-2,10-12].
Осложнения. У новорожденных с поражением ЦНС в отдаленном периоде практически всегда имеются проблемы развития, обусловленные неврологическими дисфункциями, моторными нарушениями, потерей слуха, зрения, снижением способности к обучению, дефектом речи и т.д. Тугоухость и потеря слуха являются самыми распространёнными осложнениями вЦМВ (60% при симптомной и 10-20 % при бессимптомной вЦМВ инфекции), в связи с чем новорожденные с проблемами слуха, выявленными во время скрининга, должны быть обследованы на ЦМВ инфекцию.
Перинатальная ЦМВ инфекция [1-2, 5, 3-15]:
У новорожденных, инфицированных ЦМВ во время рождения могут развиться сепсисоподобный синдром, пневмония, гепатоспленомегалия, гепатит (что может вызвать печеночную недостаточность), тромбоцитопения и атипичный лимфоцитоз.
Постнатальная ЦМВ инфекция [14-27]:
У новорожденных, инфицированных ЦМВ после рождения, особенно у недоношенных детей с ЭНМТ и ОНМТ развиваются сепсис и НЭК с отрицательными культурами, пневмония с развитием БЛД, гепатоспленомегалия, гепатит (что может вызвать печеночную недостаточность и билиарный цирроз печени в последующем), тромбоцитопения и изменения со стороны лейкоцитарной формулы.
У инфицированных ЦМВ женщин вирус выделяется и обнаруживается в грудном молоке методом ПЦР в 70% случаев. Вероятность постнатального инфицирования новорожденного при грудном вскармливании составляет 39–59% и возрастает при вирусной нагрузке более 7×103 копий/мл. После инфицирования через молоко дети выделяют вирус через 3 нед – 3 мес. Описывается вклад ЦМВ-инфекции в развитие некротизирующего энтероколита [12,13] и хирургических осложнений, таких как перфорация стенки кишки, формирование стеноза кишки в исходе воспалительного процесса.
- Моча и слюна являются предпочтительными образцами для исследования из-за большей чувствительности, но кровь (включая «каплю сухой крови» новорожденного) также можно использовать в дополнение к моче или слюне, но не вместо них. Отрицательная ПЦР крови не исключает ЦМВ инфекцию. Этот анализ полезен только в случае положительного результата.
- Определение IgM к ЦМВ не рекомендуется, так как этот метод не столь чувствителен и специфичен, как ПЦР – выделение ДНК ЦМВ. Определение IgG к ЦМВ менее достоверен для детей младше 1 года, потому что он может отражать материнские антитела из-за плацентарного переноса. Моча и слюна должны быть собраны в первую очередь и кровь не является их заменой.
- Образцы слюны следует брать по крайней мере через час после того, как ребенок в последний раз был на грудном вскармливании или после того, как его накормили сцеженным грудным молоком, поскольку может быть обнаружен материнский вирус, присутствующий в грудном молоке. По этой причине могут быть ложноположительные результаты при проведении исследования слюны на ЦМВ [9-12], должны быть впоследствии подтверждены вторым тестом. Для детей, находящихся на искусственном вскармливании, ограничений по времени нет.
- Недоношенные дети имеют более высокую заболеваемость вЦМВ, пЦМВ и постЦМВ инфекцией. Обследования недоношенных детей с гестационным сроком <28 недель при рождении могут помочь в дифференциации врожденной и постнатальной инфекции. Это может быть очень полезным для ведения этих детей, особенно уязвимых к симптоматической постнатальной инфекции. Необходимы дальнейшие исследования, чтобы выяснить эти спорные вопросы. ПЦР анализ пятен сухой крови новорожденных, выполненный в первые дни после рождения, может быть ретроспективно исследован с целью диагностики вЦМВ инфекции после 21 дня жизни. По результатам метаанализа, чувствительность этого метода составляет около 84%, но сильно варьирует в зависимости от используемых других лабораторных методов и тестируемой популяции, поэтому отрицательный ПЦР анализ пятна сухой крови не может быть использован для окончательного исключения диагноза вЦМВ.
Инструментальные исследования (смотрите таблицу 3):
- Нейровизуализация:
- внутричерепная вентрикуломегалия (при отсутствии других причин);
- не исключаются перивентрикулярные кисты, субэпендимальные псевдокисты, герминолитические кисты, аномалии белого вещества, атрофия коры, нарушения миграции, гипоплазия мозжечка, лентикулостриарная васкулопатия.
- Осмотр зрения:
- при обнаружении врожденной катаракты следует рассмотреть вероятность наличия вЦМВ инфекции.
- При аудиологическом скрининге:
- При скрининге слуха новорожденного – если выявляется сомнительный результат, то необходимо более тщательное обследование.
Таблица 3. Возможные клинические и лабораторно-инструментальные данные ЦМВ инфекции у новорожденных [1, 11,15].
|
Лабораторные исследования
|
Ожидаемые результаты |
| Общий анализ крови | Часто наблюдается тромбоцитопения менее 100 х 109/л |
| Тесты на функцию печени (ТСП) | АлАТ более 80 Ед/л, гипербилирубинемия, увеличение значений в первые недели жизни |
| Радиологические методы исследования | |
|
Нейросонография
МРТ
|
Всем новорожденным с ЦМВ следует проводить нейровизуализацию.
На МРТ у детей с ЦМВ может быть выявлена дополнительная патология, не обнаруженная при нейросонографии.
Спектр аномалий ЦНС широк:
- перивентрикулярные кальцификаты;
- увеличение желудочков;
- изменения белого вещества;
- кисты;
- дефекты миграции нейробластов;
- гипоплазия мозжечка.
|
| Консультация узких специалистов | |
| Осмотр офтальмолога |
- Хориоретинит.
- Атрофия зрительного нерва.
- Катаракта.
|
| Оценка слуха +/- оценка вестибулярной функции. | Тщательная оценка слуховой реакции ствола головного мозга (предпочтительно на всех четырех частотах по крайней мере на 1 и 4 кГц), даже при наличии четких ответов на скрининге слуха новорожденного, поскольку скрининг может пропустить легкую сенсорную тугоухость. |
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований
|
Диагноз
|
Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| Tоксоплазмоз |
- Контакт с домашними питомцами.
- Употребление сырых или плохо приготовленных мясных продуктов, плохо промытых овощей и фруктов.
- Обнаружение при НСГ внутричерепных кальцификатов (диффузных).
- Гидроцефалия.
- Хориоретинит.
- ЗВУР.
|
- ПЦР
- ИФА
- Серологические тесты
- Гистологические и цитологические исследования
|
Лабораторным методом |
|
Врожденная
краснуха
|
- Пятна черничного маффина (Рис.1)
- Катаракта
- Глаукома
- ВПС
- Патология со стороны костной ткани
|
- ПЦР
- ИФА
|
Лабораторным методом |
| Врожденная инфекция, вызванная вирусом простого герпеса |
- В анамнезе у матери признаки генитального герпеса
- Высыпания на коже
- Конъюнктивит или кератоконъюнктивит
- Повышение печеночных трансаминаз
|
- ПЦР
- тесты на функции печени
|
Лабораторным методом |
| Врожденный вирусный гепатит |
Родители относятся к группе высокого риска.
- Используют в/в ЛС.
- Без определенного места жительства.
- Отсутствуют результаты скрининга.
|
- ПЦР
- ИФА
|
Лабораторным методом |
| Врожденный сифилис |
- Родители относятся к группе высокого риска
- Макуло- папуло- везикуло-буллезная сыпь на ладонях и подошвах.
- Петехии
- Заложенность носа
- Патология костей на рентген снимке
- Гепатоспленомегалия
- Желтуха
- Пневмония
- Лейкоцитоз, анемия, тромбоцитопения
- Лимфоаденопатия
|
- Скрининг на сифилис
- ПЦР
|
Лабораторным методом |
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ.
- при вЦМВ инфекции – после выписки из стационара специфическое лечение продолжают валганцикловиром в разовой дозе 16 мг/кг 2 раза в сутки, общая длительность курса до 6 мес;
- при вЦМВ инфекции с изолированным снижением слуха рутинно протививовирусная терапия не проводится. При необходимости для предупреждения отдаленных последствий, связанных с потерей слуха решается консилиумом врачей и назначается валганцикловир длительностью 6 недель в разовой дозе 16 мг/кг 2 раза в сутки;
- при ЦМВ инфекции новорожденных с изолированным поражением ЦНС, специфическое лечение валганцикловиром, направленное на снижение вирусной нагрузки продолжается в разовой дозе 16 мг/кг 2 раза в сутки до 6-8 недель.
Критерии для проведения лечения валганцикловиром в амбулаторных условиях при поражении ЦНС [1-2, 28-37]:
- Врожденное ЦМВ-заболевание с одним или несколькими из следующих нарушений центральной нервной системы:
- микроцефалия;
- гидроцефалия или увеличение желудочков;
- перивентрикулярная кальцификация;
- корковая гипоплазия или повреждение белого вещества.
- Ретинальный хориоидит
- Гестационный возраст >32 недель при рождении.
- Масса тела на момент лечения >1800 гр.
NB! Подписанное информированное согласие родителей или законных опекунов.
- мониторинг виремии - вирусная нагрузка ЦМВ в крови как минимум на 1 и 2 log во время лечения (а также смотри раздел 6).
- контроль ОАК с определением уровня нейтрофилов (нейтропения развивается в 20 % случаях). Пауза в лечении, если количество нейтрофилов <0,5 до >0,75
- тесты функции печени и почек (АлАТ, АсАТ, общий билирубин, фракции билирубина, мочевина, креатинин).
На фоне противовирусной терапии имеет место положительная динамика: улучшение мышечного тонуса, уверенно начинает держать голову, сидеть с опорой на руки, появляется хорошая опора на ноги, динамика в психо-речевом развитии в виде появления игровой мотивации, социальной и речевой
Немедикаментозное лечение:
- лечебно-охранительный режим;
- энтеральное кормление материнским молоком (грудное вскармливание, при его невозможности – кормление сцеженным материнским молоком любым альтернативным методом).
- зависит от клинических проявлений, вида поражения и степени поражения органа (ЦНС, слух, зрение). Лечебный и коррекционный массаж, электрофорез, ЛФК.
Медикаментозное лечение
|
Лекарственная группа
|
Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
|
Противовирусное средство
|
Валганцикловир |
Разовая доза
16 мг/кг 2 раза в сутки
|
Качество А, Сила – 2 |
Перечень дополнительных лекарственных средств (менее 100% вероятности применения): нет.
Хирургическое вмешательство: нет.
Дальнейшее ведение:
- Новорожденные с перенесённой вЦМВ инфекцией наблюдаются [33-42]::
у врача-офтальмолога на 1 месяце жизни, далее ежегодно до 18 лет.
у врача невролога - ежегодно до 7 лет.
у врача инфекциониста – до 2х лет.
Мониторинг и последующее наблюдение в зависимости от статуса лечения [1-2, 27-42].
| Бессимптомная форма и легкой степени тяжести вЦМВ инфекции (специфическое лечение не проводилось) | Тяжелая и среднетяжелая степени тяжести симптомной формы вЦМВ инфекции (специфическое лечение проводилось) |
| Мониторинг проведенной специфической терапии | |
| При бессимптомной форме и легкой степени тяжести вЦМВ инфекции специфическое лечение не проводится, поэтому нет необходимости проводить мониторинг терапии |
ОАК,* тесты функции печени (ТФП)† и мочевина и электролиты – их проведение рекомендуется еженедельно в течение первых 4 недель и затем не реже одного раза в месяц до завершения курса лечения (ганцикловир/валганцикловир)‡
(Качество B, Сила 2).
Контроль веса и коррекция дозы препарата в связи с изменением веса ребенка.
Вирусная нагрузка на исходном уровне (Качество C, Сила 2).
Рассмотреть определение вирусной нагрузки 1-2 раза в месяц во время противовирусной терапии (нет консенсуса; качество D, сила 2)*.
Рассмотреть возможность терапевтического лекарственного мониторинга, если:
- увеличение вирусной нагрузки >1,0 log10 во время лечения;
- подозревается токсичность проводимой медикаментозной терапии;
- существует повышенный риск развития токсичности: например, у недоношенных с ГВ<36 недель, при нарушении функции почек (Качество D, Сила 2).
|
| Последующее наблюдение | |
| Аудиологическое обследование каждые 3–6 мес в первый год, затем каждые 6 месяцев до 3 лет и каждые 12 месяцев до 6 лет (Качество C, Сила 1). Оценка вестибулярной системы/лечение также может быть показана. | Аудиологическая оценка каждые 3–6 месяцев в течение первого года, затем каждые 6 месяцев до достижения 3-летнего возраста и каждые 12 месяцев до 6-летнего возраста (Качество C, Сила 1). |
| Осмотр на базе детской инфекционной клиники (или педиатрической клиники после консультации со специалистом) по крайней мере до 1 года, а в идеале 2-х лет жизни. (Качество D, Сила 1) | Осмотр на базе детской инфекционной клиники (или в педиатрической клинике после консультации с специалистом) как можно раньше в первый месяц жизни, затем ежегодный осмотр до достижения не менее 2 лет (специалист или поликлиника с участием детского врача по инфекционным заболеваниям в зависимости от местных возможностей). (Качество D, Сила 1). |
| Мониторинг за развитием. (Качество D, Сила 1) | Европейские рекомендации предлагают мониторировать развитие с помощью оценки развития нервной системы в возрасте 1 года в службе развития ребенка (Качество D, Сила 1). Предполагается, что увеличение возраста (до 1-2 лет) для оценки развития нервной системы может быть более продуктивным. |
| Рекомендуется проводить офтальмологическую оценку в начале заболевания и ежегодно до возраста 5 лет у лиц с клиническими проявлениями при рождении. ** (Качество D, Сила 2) | Рекомендуется проводить офтальмологическую оценку в начале заболевания и ежегодно до возраста 5 лет (Качество D, Сила 2). |
Рассмотрите проведение теста устойчивости ЦМВ (секвенирование) при необъяснимом повышении/всплеска виремии.
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе.
- Клинические и лабораторные критерии оценки эффективности лечения и валганцикловиром в амбулаторных условиях [1-2, 27-42]:
| Клинические показатели эффективности лечения |
|
1. Гепатобилиарная система:
- нет гепатоспленомегалии
- нет желтушного синдрома
- нормальные показатели АлАТ, АсАТ, билирубина
2. ЦНС:
- нет судорожного синдрома
- улучшение мышечного тонуса
- отсутствие патологического прироста окружности головы
- улучшение психо-моторного развития
-улучшение психо-речевого развития: появления игровой мотивации, социальной и речевой активности
- улучшения психо-эмоционального развития: появление ответного гуления, интерес к игрушкам.
- улучшение слуха - отсутствие ухудшения зрения 3. Общие симптомы - купирование отечного синдрома
- прибавка в весе
- исчезновение сыпи
|
| Лабораторные показатели эффективности лечения |
|
Высокая эффективность терапии -снижение вирусной нагрузки на 2log10 и более (в 100 и более раз); умеренная эффективность - снижение более, чем на 1 и менее 2log10 (менее 100 и более 10 раз); низкая эффективность - снижение менее, чем на 1log10 (менее, чем в 10 раз). !!!!
Свидетельством неактивной ЦМВИ является уровень вирусной нагрузки в слюне ниже 3,9 log и в моче ниже 3,1log копий ДНК/мл.
Биохимический анализ крови: нормальный уровень АлАТ, АсАТ, билирубина, креатинина, мочевины
Общий анализ крови: нормализация количества нейтрофилов
|
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ:
- Этиотропная терапия вЦМВ инфекции проводится противовирусными препаратами, которые до настоящего времени относятся к группе «off-label» - ганцикловир, валганцикловир. Препараты имеют серьезные побочные действия, а также в экспериментах выявлен их канцерогенный эффект и токсическое воздействие на гонады [70,73,74,61,69]. В связи с высокой токсичностью, выше указанные препараты применяются по жизненным показаниям при тяжелом или средне-тяжелом течении вЦМВ инфекции. Необходимо перед проведением лечения получить информированное согласие родителей [1-2, 28-35].
- Ганцикловир ингибирует ДНК-полимеразу ЦМВ и репликацию вируса. Ганцикловир применяют при жизнеугрожающем течении болезни у новорожденных и высоком риске инвалидизации (поражения ЦНС, легких, миокарда, печени, глаза). Препарат может угнетать кроветворение, и способствовать развитию тяжелой нейтропении, тромбоцитопении. Нейтропения является наиболее важным и частым побочным эффектом, может потребовать уменьшения или прекращения терапии. Это обычно обратимо при снижении дозы или кратковременной отмене терапии и чаще всего возникает в первые 6 недель лечения. Он более распространен при внутривенной терапии (65% против 21% - при пероральном). Обратите внимание, что нейтропения также возникает при врожденной ЦМВ инфекции без лечения. Повреждение печени чаще встречается после четвертого месяца, но обычно легкое и обратимое после прекращения терапии. Также может возникать почечная недостаточность, однако это бывает редко при прекращении терапии. Исследования на животных показывают обратимое повреждение яичек, а также возможные канцерогенные эффекты. Эти эффекты не были показаны в исследованиях на людях, но долгосрочные данные недоступны [15, 28-33].
- Валганцикловир (предшественник ганцикловира) является менее токсичным по сравнению с ганцикловиром. В Европейских странах ганцикловир и валганцикловир применяются в неонатальной практике для лечения вЦМВ, пЦМВ инфекции как препараты, имеющие доказательную базу.
- Лечение вЦМВ инфекции ганцикловиром и валганцикловиром проводится новорожденным со сроком гестации > 32 недель и массой тела при рождении > 1800 гр. с симптомной формой тяжелой и среднетяжелой степени в первые 30 дней жизни.
- В некоторых исследованиях имеются данные о том, что сочетанное применение противовирусного препарата и антицитомегаловирусного иммуноглобулина у детей с вЦМВ инфекцией имеет положительный эффект. Антицитомегаловирусный иммуноглобулин человека, 1 мл которого содержит 100 МЕ нейтрализующей активности, может назначаться одновременно с противовирусными препаратами внутривенно в дозе 1 мл/кг массы тела каждые 48 часов до достижения клинико-лабораторного улучшения. Возможность использования в комплексной терапии врожденной ЦМВИ поливалентных иммуноглобулинов обусловлена наличием в нем антител к ЦМВ (15-20 МЕ/мл), а также антител разных классов к ряду других микроорганизмов, но их эффективность при активной ЦМВ инфекции существенно ниже антицитомегаловирусного иммуноглобулина человека.
- По данным исследований, развивающийся мозг особенно чувствителен к ЦМВ-инфекции из-за незрелого состояния иммунной системы. В то же время, ЦМВ способен вызывать депрессию практически всех звеньев иммунитета и резко угнетать продукцию интерферонов (ИНФ), в первую очередь ИНФ-α. Внутренняя система ИНФ обеспечивает первую линию защиты от вирусных инфекций, включая системные ЦМВ-инфекции, и может задерживать репликацию вируса, позволяя активировать системные адаптивные иммунные ответы. В этом плане не противопоказано применение препаратов ИНФ-α 2в новорожденным с ЦМВ инфекцией, особенно недоношенным детям со сроком гестации <32 недель и массой тела при рождении < 1800 гр.
- При бессимптомной форме вЦМВ инфекции и симптомной форме легкой степени тяжести специфическая противовирусная терапия не назначается. Возможно проведение патогенетической терапии.
- Перинатальная и постнатальная ЦМВ инфекция обычно не вызывает значительных проблем у доношенных детей, однако у глубоконедоношенных детей (гестационный возраст менее 32 нед и масса тела при рождении менее 1500 гр.) инфекция может протекать тяжело с выраженными клиническими проявлениями, при которых специфическое лечение назначается после обсуждения на мультидисциплинарном консилиуме врачей. Пероральный валганцикловир является терапией первой линии, а внутривенный ганцикловир следует использовать только в том случае, если пероральные препараты не переносятся или если имеется тяжелое заболевание и абсорбция в кишечнике сомнительна.
- Ганцикловир назначается в разовой дозе 6 мг/кг 2 раза в сутки путем внутривенной инфузии (длительность применения желательно не более 21 дня) с последующим переходом на валганцикловир в разовой дозе 16 мг/кг 2 раза в сутки перорально. На валганцикловир можно переходить, когда ребенок начинает получает примерно 50% энтерального питания. Продолжительность курса составляет 6 мес.
- При отсутствии клинического эффекта от терапии валганцикловиром необходимо переходить на лечение ганцикловиром. Рекомендуемая общая продолжительность введения ганцикловира не более 6 недель.
Действия врача в ниже следующих состояниях при лечении ганцикловиром [1-2, 28-35]:
Нейтропения
<0,5x10/л – прекратить прием ганцикловира до восстановления >0,75x10/л. Затем препарат возобновляется на нормальном уровне. Повторите исследование количества лейкоцитов через 3 дня и 7 дней, и если уровень падает ниже 0,75 в течение 1 недели, уменьшите дозу препарата на 50% и продолжайте.
Рассмотрите возможность использования гранулоцитарного колониестимулирующего фактора в случаях стойкой нейтропении.
Тромбоцитопения <50x10 9 /л - Отменить ганцикловир до восстановления >50x10 9 /л и возобновить дозу на прежнем уровне. Если тромбоциты были менее 10 x 10 9/л при постановке диагноза, приостановите дозу, если уровень упадет на 50%. Повторно проверьте ОАК через 3 и 7 дней.
Острый гепатит. Это может быть связано с самим заболеванием или с терапией ганцикловиром. Решения о продолжении лечения должны приниматься на мультидисциплинарном консилиуме врачей. Следует прекратить, если уровень АЛТ повышается в 10 раз по сравнению с исходным уровнем, и возобновляется только тогда, когда уровень АлАТ снижается до < 5 раз по сравнению с исходным уровнем.
Острое почечное повреждение. Если есть признаки ухудшения функции почек (олигурия или повышение уровня креатинина в сыворотке), может потребоваться снижение дозы ганцикловира, поскольку он выводится почками. Следует проводить терапевтический мониторинг лекарств и корректировать дозу в соответствии с уровнями (необходимо проконсультироваться клиническим фармакологом).
Отсутствие ответа на лечение. Вирусная нагрузка ЦМВ в крови обычно снижается как минимум на 1 и 2 log во время лечения. Если при лечении ганцикловиром не наблюдается снижения вирусной нагрузки или сохраняется тяжелая симптоматика, следует проводить терапевтический лекарственный мониторинг, поскольку может потребоваться коррекция дозы препарата или поиск альтернативного лечения. В этом случае следует обсудить ситуацию как с консультантом-вирусологом (инфекционистом), так и клиническим фармакологом. При отсутствии эффекта ганцикловира можно в виде дополнительной терапии использовать ЦМВ-специфический иммуноглобулин.
Ведение перинатальной и постнатальной ЦМВ инфекции у глубоконедоношенных детей [1-2, 28-42].
У недоношенных 22-24 недель гестации, пЦМВ инфекция встречается в 65% случаев. При этом грудное молоко является обычным источником ЦМВ инфекции. В то время как ограниченное количество ЦМВ обнаруживается в молозиве, ДНК ЦМВ обнаруживается в грудном молоке матери с пиковыми концентрациями на 4-8 неделе лактации, после чего концентрация быстро падает. Не рекомендуется пастеризовать грудное молоко для этой группы новорожденных, учитывая общепризнанные преимущества не пастеризованного молока.
Целью лечения данной группы детей является подавление активной виремии и предотвращение деструктивного поражения органов-мишеней. Этим детям при достижении массы тела более 1800гр. назначается валганцикловир из расчета 16 мг/кг два раза в день при условии, если ребенок усваивает >50% от общего объема энтерального питания.
- Патогенетическая терапия. Объем и характер патогенетической терапии зависят от наличия ведущих синдромов. При признаках внутренней гидроцефалии и стойкой внутричерепной гипертензии необходима консультация врача-нейрохирурга. При хориоретините показаны осмотр и наблюдение врача-офтальмолога.
- Симптоматическое лечение. При этом назначаются лекарственные препараты в зависимости от клинических проявлений (антигеморрагическая, гемостатическая, противосудорожная, седативная, кардиотоническая и др.).
Карта наблюдения пациента, маршрутизация пациента (схемы, алгоритмы):
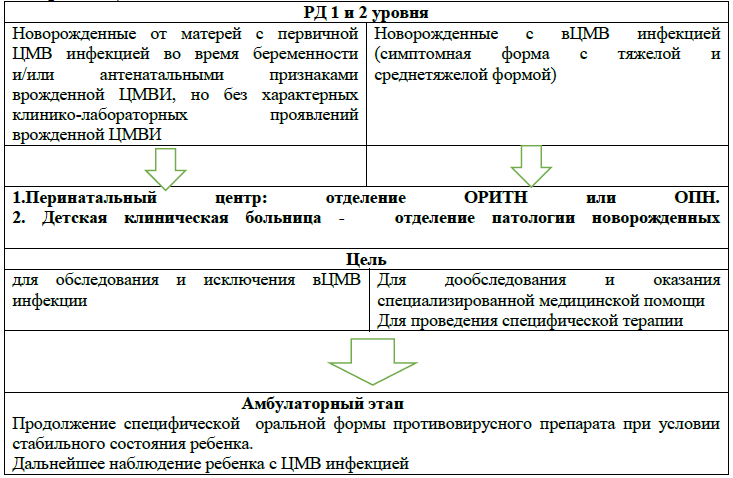
- лечебно-охранительный режим;
- соблюдение теплового режима;
- контакт «кожа к коже», материнский уход, метод «Кенгуру» с соблюдением всех правил гигиены;
- энтеральное кормление материнским молоком (грудное вскармливание, при его невозможности – кормление сцеженным материнским молоком любым альтернативным методом).
Медикаментозное лечение:
Рекомендации по выбору лечения детей с вЦМВ инфекцией (положительный результат ПЦР-мазка слюны) [1-2, 4, 14-15, 28-42]:
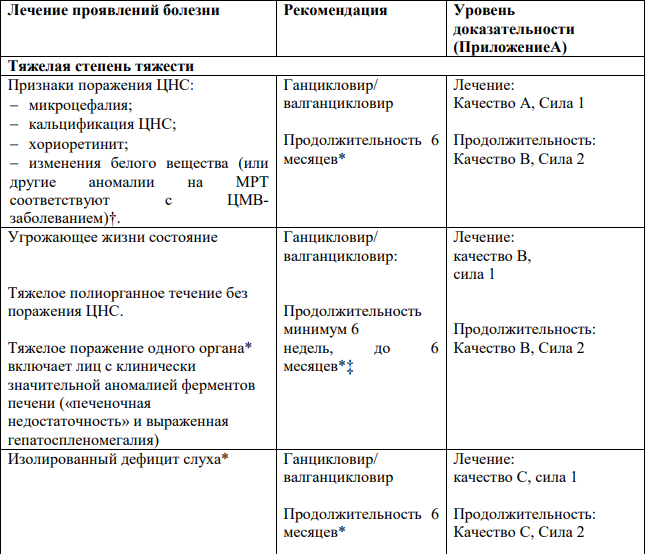
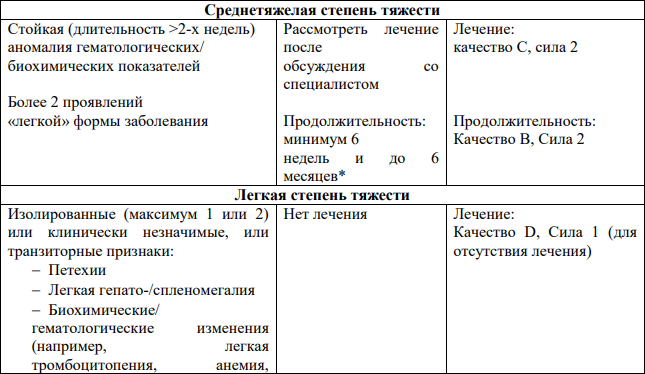

* Ограниченные доказательства без полного консенсуса: см. Европейские рекомендации для дальнейшего описания.
† Было решено, что в случае изолированных неспецифических результатов МРТ, которые не согласуются с заболеванием вЦМВ инфекции, лечение необязательное.
‡ Было высказано предположение (без единого мнения), что лечение может продолжаться в этой группе до тех пор, пока не исчезнут основные клинические проявления заболевания (например, гепатит), поскольку польза от 6-месячного лечения неясна.
* Ни одно исследование не касается этой конкретной группы, хотя они были включены в критерии приемлемости для лечения в обоих опубликованных РКИ по лечению.
|
Лекарственная группа
|
Лекарственные средства | Способ применения | Уровень доказательности |
| Противовирусное средство | Ганцикловир | Внутривенно 6 мг/кг в сутки 2 раза в день | Качество А, Сила – 2 |
| Противовирусное средство | Валганцикловир |
16 мг /кг в сутки/
2 раза в день
|
Качество А, Сила – 2 |
Перечень дополнительных лекарственных средств (менее 100% вероятности применения): нет.
Хирургическое вмешательство: нет.
Дальнейшее ведение: После выписки из родовспомогательных учреждений (перинатальные центры), дети с симптомной формой ЦМВИ находятся под наблюдением участкового врача по месту жительства и состоят на диспансерном учете у узких специалистов в зависимости от органной патологии (невропатолог, сурдолог, офтальмолог, пульмонолог и др.). Тактика лечения ребенка на амбулаторном уровне согласуется с врачом-инфекционистом. Специфическое лечение при необходимости решается на мультидисциплинарном консилиуме в условиях поликлиники. Мониторинг эффективности продолжающегося специфического лечения на амбулаторном уровне проводится участковым врачом совместно с врачом инфекционистом.
Глубоконедоношенные дети с ЦМВ инфекцией, выписанные из перинатальных центров с рекомендациями продолжения специфической терапии на амбулаторном уровне дополнительно наблюдаются в кабинетах катамнеза по месту жительства, где также может проводиться мониторинг эффективности специфической терапии врачами -неонатологами, педиатрами совместно с врачом инфекционистом при необходимости.
Индикаторы эффективности лечения [1-2, 28-42]:
- Клинические и лабораторные критерии оценки эффективности лечения ганцикловиром и валганцикловиром:
| Клинические показатели эффективности лечения |
|
1. Гепатобилиарная система:
- уменьшение гепатоспленомегалии
- купирование желтушного синдрома
- нормализация показателей АлАТ, АсАТ, билирубина
2. Со стороны ЖКТ:
- купирование признаков энтероколита 3. ЦНС:
- купирование судорожного синдрома
- улучшение мышечного тонуса
- оживление врожденных рефлексов
- отсутствие патологического прироста окружности головы
- улучшение психомоторного развития в дальнейшем
4. Дыхательная система:
- купирование симптомов дыхательной недостаточности
- разрешение воспалительного процесса в легких
5. Общие симптомы
- купирование отечного синдрома
- прибавка в весе
- исчезновение сыпи
|
| Лабораторные показатели эффективности лечения |
|
Высокая эффективность терапии -снижение вирусной нагрузки на 2log10 и более (в 100 и более раз); умеренная эффективность - снижение более, чем на 1 и менее 2log10 (менее 100 и более 10 раз); низкая эффективность - снижение менее, чем на 1log10 (менее, чем в 10 раз). !!!!
Свидетельством неактивной ЦМВИ является уровень вирусной нагрузки в слюне ниже 3,9 log и в моче ниже 3,1log копий ДНК/мл.
Биохимический анализ крови: нормальный уровень АлАТ, АсАТ, билирубина, креатинина, мочевины
Общий анализ крови: нормализация количества нейтрофилов
|
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ:
Показания для плановой госпитализации: нет.
Показания для экстренной госпитализации:
- Признаки поражения жизненно важных органов и систем в стадии суб-, и декомпенсации.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023 - 1. NHSGGC Guidelines. Cytomegalovirus (CMV) - congenital infection. https://www.clinicalguidelines.scot.nhs.uk/nhsggc-guidelines/nhsggc-guidelines/neonatology/cytomegalovirus-cmv-congenital-infection/ 2. Clinical Guideline: Diagnosis and Management of Congenital Cytomegalovirus. East of England cCMV guideline. F Walston, K McDevitt, S Walter, S Luck, T Holland Brown. , 2022. https://www.eoeneonatalpccsicnetwork.nhs.uk/wp-content/uploads/2022/02/cCMV-EoE-guideline.pdf. 3. Jaan A, Rajnik M. TORCH Complex. StatPearls Publishing. 2023. https://www.ncbi.nlm.nih.gov/books/NBK560528/ Brenda L. Tesini. Congenital and Perinatal Cytomegalovirus Infection (CMV). 2022. https://www.msdmanuals.com/professional/pediatrics/infections-in-neonates/congenital-and-perinatal-cytomegalovirus-infection-cmv. 4. F Walston, K McDevitt, S Walter, S Luck, T Holland Brown. Clinical Guideline: Diagnosis and Management of Congenital Cytomegalovirus. East of England cCMV guideline. 2022. https://www.eoeneonatalpccsicnetwork.nhs.uk/wp-content/uploads/2022/02/cCMV-EoE-guideline.pdf. 5. I.E. Suleimenova, N.C. Bozhbanbaeva, M.E. Atke, S.N. Urazova. On the classification of cytomegalovirus infection in newborn children. Scientific and practical journal. 2023. N. 2 (55). Р. 88-89 6. Concetta Marsico, David W. Kimberlin. Congenital Cytomegalovirus infection: advances and challenges in diagnosis, prevention and treatment. Italian Journal of Pediatrics (2017) 43:38 DOI 10.1186/s13052-017-0358-8. 7. Marianne Leruez-Ville, Ina Foulon, Robert Pass, Yves Ville. Cytomegalovirus infection during pregnancy: state of the science. American Journal of Obstetrics & Gynecology 2020. Р. 1-20. https://files.medelement.com/uploads/materials/13eb24509f2627881690f9f28a7e97ea.pdf. 8. Laura Puhakka. CONGENITAL CYTOMEGALOVIRUS INFECTION IN FINLAND. 2019. ACADEMIC DISSERTATION. Р.108. https://helda.helsinki.fi/server/api/core/bitstreams/e3f0a6c5-fc89-4868-a60b-192f57f1f8ba/content. 9. Daniel Blázquez-Gamero, Marie-Luce Delforge, Ina Foulon, Suzanne Luck, Susanne Modrow, Marianne Leruez-Ville.Congenital Cytomegalovirus Infection. Front. Pediatrician: sec. neonatology. Volume 8 – 2020 | https://doi.org/10.3389/fped.2020.00013 10. Monika L. Dietrich, John S. Schieffelin. Congenital Cytomegalovirus Infection. Ochsner Journal 19:123–130, 2019. DOI: 10.31486/toj.18.0095 11. Marsico C., Kimberlin D.W. Congenital Cytomegalovirus infection: Advances and 38 challenges in diagnosis, prevention and treatment // Ital. J. Pediatr. Italian Journal of Pediatrics, 2017, Vol 3, № P –8. 12. J. Drew Prosser, Thomas W. Holmes, Mohammad Seyyedi, Daniel I. Choo. Congenital cytomegalovirus (CMV) for the pediatric otolaryngologist. International Journal of Pediatric Otorhinolaryngology. Volume 148, 2021. https://doi.org/10.1016/j.ijporl.2021.110809. 13. Carmona AS, Kakkar F, Gantt S. Perinatal Cytomegalovirus Infection. Curr Treat Options Pediatr. 2022;8(4):395-411. doi: 10.1007/s40746-022-00261-y. 14. Вайнштейн Н.П., Британишская Е.А., Митина Ю.Ю., Матвеева Т.В. Саркисян Е.А. Роль цитомегаловирусной инфекции в поражении желудочно-кишечного тракта у новорожденных и детей раннего возраста. Неонатология: новости, обучение. 2018, Т.6, №4, стр 70-85 15. Clinical Guideline: Diagnosis and Management of Congenital Cytomegalovirus. East of England cCMV guideline. F Walston, K McDevitt, S Walter, S Luck, T Holland Brown. 2022. https://www.eoeneonatalpccsicnetwork.nhs.uk/wp-content/uploads/2022/02/cCMV-EoE-guideline.pdf. 16. Plotogea M, Isam AJ, Frincu F, Zgura A, Bacinschi X, Sandru F, Duta S, Petca RC, Edu A. An Overview of Cytomegalovirus Infection in Pregnancy. Diagnostics. 2022. 12(10):2429. doi: 10.3390/diagnostics12102429. 17. Chiopris G, Veronese P, Cusenza F, Procaccianti M, Perrone S, Daccò V, Colombo C, Esposito S. Congenital Cytomegalovirus Infection. Update on Diagnosis and Treatment. Microorganisms. 2020.1;8(10):1516. doi: 10.3390/microorganisms8101516. 18. Bardanzellu F, Fanos V, Reali A. Human Breast Milk-acquired Cytomegalovirus Infection: Certainties, Doubts and Perspectives. Curr Pediatr Rev. 2019;15(1):30-41. doi: 10.2174/1573396315666181126105812. 19. Hu, X., Hu, W., Sun, X. et al. Transmission of cytomegalovirus via breast milk in low birth weight and premature infants: a systematic review and meta-analysis. BMC Pediatr. 2021 . https://doi.org/10.1186/s12887-021-02984-7 20. Schleiss MR. Breast Milk–Acquired Cytomegalovirus in Premature Infants: Uncertain Consequences and Unsolved Biological Questions. JAMA Pediatr. 2020;174(2):121–123. doi:10.1001/jamapediatrics.2019.4538. 21. Hye Won Park , Myung Hyun Cho, Sun Hwan Bae, Ran Lee, Kyo Sun Kim. Incidence of Postnatal CMV Infection among Breastfed Preterm Infants: a Systematic Review and Meta-analysis. J Korean Med Sci. 2021.36(12):e 84. https://doi.org/10.3346/jkms.2021.36.e84. 22. Kohn LA, Horowitz H, Butte MJ, et al. Prevention of Cytomegalovirus (CMV) Transmission via Maternal Breast Milk to an Infant with Severe Combined Immunodeficiency (SCID) using Kimie: New Compact Breast Milk Pasteurizer. J Pediatr Neonatal. 2021; 3(3): 1-4. https://www.scivisionpub.com/pdfs/prevention-of-cytomegalovirus-cmv-transmission-via-maternal-breast-milk-to-an-infant-with-severe-combined-immunodeficiency-scid-us-1889.pdf. 23. Kadambari S, Whittaker E, Lyall H. Postnatally acquired cytomegalovirus infection in extremely premature infants: how best to manage? Arch Dis Child Fetal Neonatal Ed. 2020.105(3):334-339. doi: 10.1136/archdischild-2019-317650. 24. Koji Takemoto, Makoto Oshiro, Yoshiaki Sato, Hikaru Yamamoto, Masatoki Ito, Seiji Hayashi, Eiko Kato, Yuichi Kato, Masahiro Hayakawa.Outcomes in symptomatic preterm infants with postnatal cytomegalovirus infection. Nagoya J. Med. Sci. 83. 311–319, 2021. doi:10.18999/nagjms.83.2.311. 25. Rütten, H., Rissmann, A., Brett, B. et al. Congenital cytomegalovirus infection in Central Germany: an underestimated risk. Arch Gynecol Obstet, 231–240 (2017). https://doi.org/10.1007/s00404-017-4435-4. 26. Hernandez-Alvarado, N., Shanley, R., Schleiss, M.R., Ericksen, J., Wassenaar, J., Webo, L., Bodin, K., Parsons, K., Osterholm, E.A. Clinical, Virologic and Immunologic Correlates of Breast Milk Acquired Cytomegalovirus (CMV) Infections in Very Low Birth Weight (VLBW) Infants in a Newborn Intensive Care Unit (NICU) Setting. Viruses 2021, 13, 1897. https://doi.org/10.3390/v13101897. 27. Shah T, Luck S, Sharland M, et al. Fifteen-minute consultation: diagnosis and management of congenital CMV. Archives of Disease in Childhood - Education and Practice 2016;101:232-235. 28. Ichiro Morioka, Yasumasa Kakei, Takashi Omori. et al. Efficacy and safety of valganciclovir in patients with symptomatic congenital cytomegalovirus disease: Study Protocol Clinical Trial (SPIRIT Compliant), 2022, doi: 10.1097/MD.0000000000019765. 29. Ortiz-Gracia A, Ríos M, Tobías E, et al. Assessment of mitochondrial toxicity in newborns and infants with congenital cytomegalovirus infection treated with valganciclovir. Arch Dis Child 2022;107:686–691. https://adc.bmj.com/content/archdischild/107/7/686.full.pdf. 30. NEONATAL MEDICATION GUIDELINE. Valganciclovir. Women and Newborn Health Service 2020. https://www.kemh.health.wa.gov.au/~/media/HSPs/NMHS/Hospitals/WNHS/Documents/Clinical-guidelines/Neonatal-MPs/Valganciclovir.pdf?thn=0. 31. Queensland Clinical Guidelines: Neonatal monograph Ganciclovir. https://www.health.qld.gov.au/__data/assets/pdf_file/0007/1201003/nmq-ganciclovir.pdf. 32. N. Akter, M. M. Rahman, S. Akhter, K. Fatema, S. M. B. Billah, Predictors of Recurrence after a First Unprovoked Seizure in Childhood: A Prospective Study , European Journal of Clinical Medicine: Vol. 2 No. 3 (2021). https://www.ej-clinicmed.org/index.php/clinicmed/article/view/122. 33. MCN for Neonatology West of Scotland Neonatal Guideline. Cytomegalovirus (CMV) - Congenital infection. 2022. https://www.perinatalnetwork.scot/wp-content/uploads/2022/12/CMV-Cytomegalovirus_WoS.pdf. 34. Piché-Renaud PP, Chiasson CO, Autmizguine J, Ovetchkine P, Lachance C, Théorêt Y, Martin B. Treatment of Congenital Cytomegalovirus and Ganciclovir Therapeutic Drug Monitoring in Twin Preterm Infants. J Pediatr Pharmacol Ther. 2023;28(1):93-101. doi: 10.5863/1551-6776-28.1.93. 35. Michelle Barton, A. Michael Forrester, Jane McDonald; Canadian Paediatric Society Infectious Diseases and Immunization Committee. Paediatr Child Health 2020 25(6):395. https://cps.ca/en/documents/position/update-on-congenital-cytomegalovirus-infection-prenatal-prevention-newborn-diagnosis-and-management 36. Ronchi, A., Zeray, F., Lee, L.E. et al. Evaluation of clinically asymptomatic high risk infants with congenital cytomegalovirus infection. J Perinatol 40, 89–96 (2020). https://doi.org/10.1038/s41372-019-0501-z. 37. PIER guideline for the management of Congenital CMV. The majority of units do not test all extremely preterm infants. 2019. https://www.piernetwork.org/congenital-cmv. 38. Turriziani Colonna A. et al. Long-Term Clinical, Audiological, Visual, Neurocognitive and Behavioral Outcome in Children With Symptomatic and Asymptomatic Congenital Cytomegalovirus Infection Treated With Valganciclovir // Front. Med. 2020 Vol 7, № July. 39. Rawlinson W.D. et al. Congenital cytomegalovirus infection in pregnancy and the 36 neonate: consensus recommendations for prevention, diagnosis, and therapy // Lancet Infect Dis 2017 Vol 7. P 773–778. 40 Luck S.E. et al. Congenital cytomegalovirus a European expert consensus statement on diagnosis and management // Pediatr Infect Dis J 2017 Vol 36, № 2 P 205–1213. Coats D.K. et al. Ophthalmologic Findings in Children With Congenital Cytomegalovirus Infection // J AAPOS 2000 Vol , № 2 P 0–116. 41. Liu P.H. et al. Congenital cytomegalovirus infection and the risk of hearing loss in childhood: A PRISMA-compliant meta-analysis // Medicine (Baltimore). 2021. Vol. 100, № 36 P e27057. 42. Lanzieri T.M. et al. Hearing loss in children with asymptomatic congenital cytomegalovirus infection // Pediatrics 2007 Vol 39, № 3.
Информация
Сокращения, используемые в протоколе:
Список разработчиков протокола с указанием квалификационных данных:
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Рисунок 1. Сыпь в виде черничного пирога при вЦМВ.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.