Врожденная анемия вследствие кровопотери у плода и другие врожденные анемии новорожденных
 Версия: Клинические рекомендации РФ 2024 (Россия)
Версия: Клинические рекомендации РФ 2024 (Россия)
Общая информация
Краткое описание
Разработчик клинической рекомендации:
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968 с изменения, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 января 2024 года – с 1 января 2025 года.
Год утверждения: 2024
Дата размещения: 22.07.2024
ID: 660
Определение заболевания или состояния (группы заболеваний или состояний)
Анемия – гематологический синдром, характеризующийся снижением концентрации гемоглобина и/или гематокрита более, чем на 2 стандартных отклонения от средних значений гемоглобина и/или гематокрита для данного постнатального возраста [1,2].
Постгеморрагическая анемия – гематологический синдром, характеризующийся снижением концентрации гемоглобина и/или гематокрита более, чем на 2 стандартных отклонения от средних значений гемоглобина и/или гематокрита для данного постнатального возраста вследствие кровопотери [1,2].
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
P61.3 Врожденная анемия вследствие кровопотери у плода.
Р61.4 Другие врожденные анемии, не классифицированные в других рубриках.
Впоследствии при уточнении причины врожденной анемии кодирование заболевания трансформируется в соответствующий код выявленной нозологии.
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Врожденные постгеморрагические анемии новорожденных классифицируются [15]:
- по времени возникновения: антенатальные, интранатальные (во время родов), постнатальные (сразу после рождения);
- по темпам развития: острая и хроническая.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Патологическая анемия у новорождённых бывает результатом одной или более из 3 главных причин: кровопотери (пренатальной, внутренней или наружной), повышенной деструкции эритроцитов (гемолиз) или следствием неадекватной продукции эритроцитов (врождённый дефицит или вторичное подавление эритропоэза [3].
Потеря крови у плода может происходить в пренатальном и интранатальном периоде. Трансплацентарная кровопотеря может быть как острой, так и хронической [4,5].
1. Кровопотеря.
Потеря крови у плода может происходить в пренатальном и интранатальном периоде. Трансплацентарная кровопотеря может быть как острой, так и хронической [4,5].
Основные причины кровопотери.
1.1. Пренатальные кровопотери:
-
Трансплацентарная (фето-материнская трансфузия);
-
Интраплацентарная;
-
Ретроплацентарная;
-
Фето-фетальная (монозиготные, монохориальные близнецы).
1.2. Интранатальные:
-
Патология и повреждение пуповины (разрыв нормальной пуповины, разрыв варикоза или аневризмы пуповины, гематома пуповины, разрыв аномальных сосудов, не защищенных Вартоновым студнем, предлежание сосудов);
-
Патология плаценты (отслойка плаценты, предлежание плаценты, многодольчатая плацента с хрупкими сосудами к основной плаценте, повреждение плаценты при кесаревом сечении, травма сосудов при амниоцентезе, хорионангиома плаценты);
-
Геморрагический синдром у матери, обусловленный тромбоцитопенией или дефицитом факторов свертывания.
1.3. Внутриутробные или интранатальные кровотечения плода:
-
Наружные кровопотери (желудочно-кишечные кровотечения);
-
Внутренние кровотечения (внутричерепные, внутрижелудочковые, субапоневротические, субарахноидальные, субдуральные, внутрибрюшные (разрыв печени, селезенки, субкапсулярные гематомы паренхиматозных органов), забрюшинные (кровоизлияния в надпочечник), легочное кровотечение).
Факторами риска анемии являются переднее расположение плаценты, преждевременные роды и экстренное кесарево сечение [6]. У 10% всех детей, рожденных при предлежании плаценты, отмечается тяжелая анемия [7,8], которая наряду с преждевременными родами является основным фактором риска перинатальной смерти [9,10].
2. Гемолитические анемии [5,11]:
2.1. Врожденные дефекты эритроцитов:
а. Мембранопатии:
-
наследственный сфероцитоз;
Заболевание вызвано мутацией в одном или нескольких генов, кодирующих белки цитоскелета мембраны эритроцитов и трансмембранные белки: α-спектрин (SPTA1), β спектрин (SPTB), анкирин-1(ANK1), анионный транспортный белок полосы 3 (SLC4A1) и белок полосы 4.2 (EPB42). У 75% семей наследственный сфероцитоз наследуется по аутосомно-доминантному типу. В оставшихся случаях, обычно семейный анамнез отсутствует либо из-за аутосомно-рецессивного наследования заболевания, либо из-за наличия аутосомно-доминантной мутации de novo. Аутосомно-рецессивный наследственный сфероцитоз может быть вызван би-аллельными мутациями в любом из пяти генов, тогда как аутосомно-доминантный сфероцитоз наблюдается только при мутациях генов SPTB, ANK1 и SLC4A1 [11].
-
наследственный эллиптоцитоз (вызван аутосомно-доминантными мутациями генов, кодирующих α- или β-спектрин (SPTA1, SPTB) или белок полосы 4.1 (EPB41))
-
наследственный стоматоцитоз;
-
наследственный ксероцитоз;
-
инфантильный пикноцитоз;
-
пиропойкилоцитоз (вызван аутосомно-доминантными мутациями генов, кодирующих α- или β-спектрин (SPTA1, SPTB) или белок полосы 4.1 (EPB41));
-
овалоцитоз Юго-Восточной Азии (заболевание является результатом гомозиготности по мутациям гена SLC4A1);
б. Гемоглобинопатии:
-
a-талассемия:
- делеция одного гена a-глобина (бессимптомное носительство);
- делеция двух генов a-глобина (признак a-талассемии);
- делеция трех генов a-глобина (гемоглобин Нb4 и гемоглобина Барта);
- делеция четырех генов a-глобина (чаще всего, антенатальная гибель или смерть вскоре после рождения).
-
gb - талассемия;
-
egdb - талассемия;
-
b - талассемия;
-
Нестабильные варианты гемоглобина ((Hb Кöln, Hb F Poole, Hb Hasharon и др.).
в. Энзимопатии:
-
Дефицит пируваткиназы (ПК);
Дефицит ПK передается по аутосомно-рецессивному типу наследования и обусловлен би-аллельными мутациями в гене PKLR, который кодирует фермент ПK.
-
Дефицит глюкозо-6-фосфатдегидрогеназы (мутации в гене G6PD);
-
Другие редкие дефициты ферментов: глюкозофосфатизомераза, гексокиназа, пиримидин-5-нуклеотидаза, фосфофруктокиназа, фосфоглицераткиназа, триозофосфатизомераза).
2.2. Приобретенные дефекты эритроцитов:
а. иммунные:
-
Аутоиммунная гемолитическая анемия у матери;
-
Гемолитическая болезнь плода и новорожденного (Rh, АВ0, минорные антигены);
б. неиммунные:
-
Инфекция (цитомегаловирус, токсоплазма, простой герпес, краснуха, малярия, сифилис, бактериальный сепсис, в т.ч. E.coli);
-
Микроагиопатическая гемолитическая анемия в сочетании или без диссеминированного внутрисосудистого свертывания (ДВС): диссеминированная герпетическая инфекция, инфекция, вызванная Коксаки В, Грам-отрицательная септицемия, тромбоз почечных вен, тромботическая тромбоцитопеническая пурпура (ТТП), атипичный гемолитико-уремический синдром, врожденные гемангиомы;
-
Дефицит витамина Е;
-
Болезни обмена (галактоземия, остеопетроз).
3. Недостаточная продукция эритроцитов [3,5,11]:
3.1. Врожденная:
-
Анемия Даймонда-Блекфана;
-
Врожденный дискератоз;
-
Анемия Фанкони;
-
Синдром Аазе;
-
Синдром Пирсона;
-
Сидеробластная анемия;
-
Врожденные дизэритропоэтические анемии.
3.2. Приобретенные
-
Вирусные инфекции (вирусный гепатит, ВИЧ, цитомегаловирус, парвовирус В 19, краснуха, сифилис)
-
Малярия
-
Анемия недоношенных.
Бóльшая часть представленных нозологий проявляются врожденной анемией.
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Анемия новорожденного вследствие кровопотери (потеря - более 30 мл крови) происходит в одном случае из 400 беременностей, а тяжелая (более 100 мл) - 1/2000 беременностей.
В 30% монохориальной беременности происходит фето-фетальная трансфузия с развитием анемии у одного плода из двойни [9], и в 15% случаев развивается трансфузия с разницей уровня гемоглобина между близнецами более 50 г/л [12].
Заболеваемость детей анемией Даймонда-Блекфена в России составляет 0,63 ± 0,034 случая на 100 тыс. живорожденных младенцев с одинаковым соотношением полов (1 : 1), Среднегодовой показатель распространенности анемии Даймонда-Блекфена в России составил 5,75 ± 0,87 случая на 100 тыс. новорожденных детей, рожденных живыми. Распространенность анемии Даймонда-Блекфана в мире оценивается как 5-7 случаев на 1 млн. живорожденных младенцев [11,13].
Наследственный сфероцитоз является наиболее распространенным из мембранопатий эритроцитов, вызывающий симптоматическую анемию от 1 на 2000 до 1 на 5000 случаев живорожденных младенцев у родителей североевропейского происхождения [11].
Распространенность наследственного эллиптоцитоза оценивается как от 1 на 2000 до 1 на 4000 популяции, но эти цифры значительно варьируют в различных странах мира. Например, наследственный эллиптоцитоз более распространен в областях, эндемичных по малярии, особенно среди людей африканского и среднеземноморского происхождения [11].
Дефицит глюкозо-6-фосфатдегидрогеназы (Г6-ФДГ) имеют около 400 млн человек в мире, в основном в странах Средиземноморья, Африки и Китая. В подавляющем большинстве болеют мальчики, девочки являются носителями этого заболевания. Однако с частотой 1 на 5 млн чел. могут болеть и девочки [3]. В противоположность дефициту Г6-ФДГ, дефицит пируваткиназы (ПK) встречается довольно редко; по оценкам, заболеваемость составляет 1 на 20 000 среди европеоидов[11].
Альфа-талассемия является одним из самых часто встречающихся наследственных заболеваний, распространенность носителей которого по всему миру составляет приблизительно 5%. Наиболее значимая форма этого заболевания поражает семьи преимущественно Юго-Восточного азиатского происхождения, где распространенность носителей достигает 40%, хотя она также часто встречается в некоторых частях Индии и Средиземноморья (Греция, Турция, Кипр и Сардиния)[11].
Распространенность анемий, обусловленных врожденными инфекциями, зависят от их распространенности. Например, перинатально приобретенный сифилис остается серьезной проблемой во многих странах, затрагивая, по оценкам, 713 600–1 575 000 беременностей во всем мире [11]. Эпидемиология врожденной цитомегаловирусной инфекции представлена в клинических рекомендациях «Врожденная цитомегаловирусная инфекция»[14].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические симптомы анемии неспецифичны: при осмотре обращают на себя внимание вялость, плохое сосание, «мраморность», бледность кожных покровов и слизистых в сочетании с различными нарушениями других органов и систем в зависимости от причины анемии; тахи-/брадипноэ, апноэ, потребность в оксигенотерапии, снижение эффективности проводимой респираторной терапии, приводящее в том числе к усилению параметров искусственной вентиляции легких (ИВЛ); сонливость или изменения неврологического состояния; тахикардия > 180 уд/мин, при аускультации сердца может отмечаться приглушение тонов и систолический шум.
При хронической кровопотере отмечается бледность кожных покровов, выраженность которой зависит от тяжести анемии, однако состояние ребенка может быть компенсированным в связи с нормоволемией. В периоде новорожденности подобную анемию наблюдают часто при хронических фето-материнских трансфузиях [4].
При быстрой и массивной кровопотере в интранатальном периоде у ребенка или сразу после рождения может развиться клиника гиповолемического шока. Гиповолемический шок характеризуется резким снижением объема циркулирующей крови (ОЦК), сердечного выброса и тканевой перфузии. Шок проявляется выраженными расстройствами кровообращения, при которых отмечается спазм периферических сосудов, малый сердечный выброс; снижается пульсовое артериальное и венозное давление, отмечается тахикардия, тахипноэ с участием вспомогательной мускулатуры (втяжение межреберных промежутков, западение нижней трети грудины, напряжение мышц передней брюшной стенки, раздувание крыльев носа), симптомы острого респираторного дистресс синдрома, угнетение центральной нервной системы. При развитии данной симптоматики новорожденному ребенку требуется экстренная помощь, ввиду высокой степени риска летального исхода, либо тяжелого поражения центральной нервной системы, связанного как с гипоксическими, так и циркуляторными нарушениями в головном мозге на фоне анемии и гиповолемии.
В периоде новорожденности дефицит Г6-ФД эритроцитов проявляется в основном выраженной непрямой гипербилирубинемией, может проявляться гемолитической анемией 1 степени с тяжелой непрямой гипербилирубинемией. Хотя большинство пораженных новорожденных – мальчики, иногда с помощью скрининга неонатальной желтухи выявляются девочки-носители, так как у этих детей иногда также развивается тяжелая неонатальная желтуха. Пик клинических проявлений приходится на 2-3 дни жизни. Хотя причина гипербилирубинемии у детей с дефицитом Г6-ФД иногда отражает ускоренное разрушение эритроцитов, чаще явного разрушения эритроцитов нет. В большинстве случаев в клинической картине преобладает больше желтуха, нежели анемия. В случае если плод имеет дефицит Г6-ФД эритроцитов, а мать во время беременности принимает медикаменты или продукты, вызывающие сильный окислительный процесс, то гемолиз может развиться уже внутриутробно. Степень страдания плода дозозависима, чем больше приняла мать, тем более выражен гемолиз. Также может проявляться у новорожденных в возрасте нескольких недель внезапным и глубоким снижением уровня Hb вследствие острого окислительного гемолиза, часто в сочетании с инфекцией (или лекарствами/химическими веществами). Анемия в семейном анамнезе обычно отсутствует, но могут иметь место семейные случаи неонатальной желтухи [3,11].
Примерно четверть больных с дефицитом пируваткиназы (ПК) эритроцитов страдают внутриутробно или сразу с рождения, что проявляется глубокой анемией (до анемической водянки плода), внутриутробной задержкой роста, тяжелой гемолитической анемией с первых дней жизни. После рождения все новорожденные с дефицитом ПК эритроцитов с первых часов имеют тяжелую желтуху (непрямую гипербилирубинемию) и тяжелую анемию. В единичных случаях у новорожденных может развиться тяжелое поражение печени с прогрессией до печеночно-клеточной недостаточности [3].
Инфантильный пикноцитоз более распространен у недоношенных новорожденных, и если заболевание возникает у близнецов, то обычно поражаются оба. Внезапное начало тяжелой анемии в возрасте 2-4 недель, обычно с падением уровня Hb на 40–50 г/л в течение нескольких дней; часто требуется трансфузия (обычно только 1-2 трансфузии); затем она постепенно разрешается к возрасту 2-3 месяцев [11].
Анемия Даймонда–Блекфена — врожденная парциальная красноклеточная аплазия, наиболее часто презентирует в первые три месяца жизни. Анемия Фанкони, наоборот, крайне редко презентирует в периоде новорожденности и раннем возрасте, и помимо анемии у детей отмечается тромбоцитопения и лейкопения (таблица 1.).
Таблица 1. Клинико-лабораторные проявление врожденных синдромов костномозговой недостаточности в раннем возрасте. (FA, анемия Фанкони; CD, врожденный дискератоз; DBA, анемия Даймонда-Блекфена; SDS, синдром Швахмана-Даймонда; HH, Хойерал-Хрейдарссон синдром; RS, Реверц синдром) [3].
|
|
FA |
CD |
DBA |
SDS |
|---|---|---|---|---|
|
Общий анализ крови |
очень редко цитопения |
очень редко цитопения |
анемия (éMCV, N MCH) |
ê нейтрофилов |
|
Общие |
НМТ при рождении, пороки развития |
НМТ при рождении, задержка внутриутробного развития (HH и RS) |
НМТ при рождении |
|
|
Кожа |
пятна «кофе с молоком», гиперпигментация |
диспластичные ногти |
|
|
|
Скелет |
отсутствие или гипоплазия больших пальцев или лучевой кости, уплощенное основание большого пальца, синдактилия, деформация Спренгеля, аномалия Клиппел-Фейл, спина бифида, аномалия ребер, аплазия копчика, порок позвонков |
|
Широкая или короткая шея, деформация Спренгеля, аномалия Клиппел-Фейл, отсутствие лучевой артерии, уплощенное основание большого пальца, трехфаланговый, удвоенный, расщепленный, гипоплазированный или отсутствующий большой палец |
Метафизарные дизостозы, эпифизарная дисплазия, аномалия ребер |
|
Голова / шея |
Микроцефалия, треугольное «птичье» лицо, маленькие глаза |
Микроцефалия, ретинопатия (RS) |
Микроцефалия, гипертелоризм, широкая уплощенная переносица, микроотия, расщепления губы / неба, микрогнатия, низкий рост волос на лбу, врожденная глаукома или катаракта |
Потеря слуха |
|
ЦНС |
|
Гипоплазия мозжечка (HH), интракраниальные кальцинаты (RS) |
|
Порок развития Киари тип 1, эктопия миндалины мозжечка, гипотония |
|
Сердце |
ВПС |
|
ДМПП, ДМЖП, коарктация аорты |
ДМПП, ДМЖП, открытый аортальный проток |
|
ЖКТ |
Атрезия ануса, трахеопищеводная фистула, атрезия пищевода или 12-перстной кишки |
Стеноз пищевода |
|
Экзокринная дисфункция поджелудочной железы, гепатомегалия с повышением трансаминаз, незавершенный поворот, паховая грыжа, порок развития ануса |
|
Почки |
Аномалии развития |
|
Аномалии развития |
|
|
Мочеполовая система |
Мальчики – гипоспадия, микропенис, неопущенные / отсутствующие яички; Девочки – двурогая матка, недоразвитие яичников, гермофрадитизм, гидронефроз, гидроуретер |
Гипогонадизм; Мальчики – стеноз уретры |
гипогонадизм |
Агенезия матки, шейки матки, верхней части влагалища |
Большинство новорожденных с синдромом Пирсона имеют низкую массу тела при рождении, метаболический лактат-ацидоз и недостаточность экзокринной функции поджелудочной железы; также часто наблюдаются функциональные нарушения со стороны печени и почек [11].
Чуть больше половины всех новорожденных с врожденным сифилисом будут иметь гемолитическую анемию с отрицательной пробой Кумбса, которая может персистировать в течение недель после лечения. И хотя летальные исходы редки, тяжелые случаи могут проявляться водянкой плода. Врожденный токсоплазмоз также может проявляться тяжелой гемолитической анемией новорожденных и/или водянкой плода. Несмотря на распространенность малярии среди беременных женщин, врожденная анемия встречается очень редко, даже в странах эндемичных по малярии, и исключительно редко в неэндемичных странах, возможно, благодаря защищающим IgG антителам у матери. Врожденная малярия проявляется анемией, желтухой, гепатоспленомегалией и неспецифическими признаками, такими как отказ от еды, вялость и лихорадка. Обычно первые признаки малярии появляются на 10–28 после рождения, хотя зарегистрированы случаи манифестации в течение нескольких часов после рождения или к возрасту 8 недель. Парвовирус B19 является причиной 6–7% случаев неиммунной водянки плода, а также является наиболее распространенной причиной этого состояния. Обычно у пораженного плода или новорожденного наблюдается выраженная ретикулоцитопения (часто <10 ×109/л), а в тяжелых случаях также развивается тромбоцитопения. Помимо парвовируса B19, анемию в результате сниженной продукции эритроцитов могут вызывать такие инфекции как цитомегаловирус (ЦМВ), токсоплазмоз, врожденный сифилис, краснуха и простой герпес, хотя в этих случаях обычно наблюдается легкая анемия и ретикулоцитопения [11].
Тяжесть α-талассемии зависит от количества затронутых генов α-глобина. Когда оба родителя являются носителями α0 талассемии, их потомство может быть гомозиготным по α0 и не унаследовать ни одного нормального гена α-глобина; делеция всех четырех генов α-глобина приводит к большой α-талассемии, имеющей наиболее тяжелые проявления и практически всегда манифестирующей внутриутробно тяжелой анемией во втором триместре и водянкой плода со средней концентрацией Hb 64 г/л. Поскольку основным гемоглобином, продуцирующимся у пораженных плодов, является гемоглобин Барта (тетрамеры γ-цепей глобина плода, γ4), это состояние называют синдромом водянки плода с гемоглобином Барта, чтобы отличать его от водянки плода с тяжелой анемией, вызванной другими причинами. Основные клинические признаки это синдрома включают в себя сильную бледность с желтухой, сердечную недостаточность, гидроторакс и гидроперикард, асцит, гепатоспленомегалию и респираторный дистресс [11].
У большинства новорожденных с наследственным сфероцитозом будет наблюдаться желтуха, хотя обычно не тяжелая и легко поддающаяся фототерапии. Однако, у новорожденных с наследственным сфероцитозом, имеющих также признак синдрома Жильбера – распространенный полиморфизм в промоторной области гена уридин-дифосфат–глюкуронозилтрансферазы (UGT1A1), часто развивается тяжелая желтуха, и может потребоваться обменное переливание крови для предотвращения развития ядерной желтухи. Уровень Hb при наследственном сфероцитозе обычно нормальный при рождении, но у приблизительно одной трети новорожденных в неонатальном периоде развивается выраженная анемия. Как правило, анемия умеренная (70–100 г/л). Аутосомно-рецессивные формы наследственного сфероцитоза обычно очень тяжелые и проявляются водянкой плода или тяжелой неонатальной гемолитической анемией. При овалоцитозе Юго-Восточной Азии типична желтуха, отмечается легкая анемия или ее отсутствие. При наследственном пиропойкилоцитозе обычно отмечается выраженная персистирующая трансфузионно-зависимая гемолитическая анемия в неонатальном периоде. Гипергидратированный наследственный стоматоцитоз может проявляться водянкой плода. Клинические проявления наследственного эллиптоцитоза и связанных с ним синдромов сложны в том смысле, что различают по меньшей мере три различных типа этого заболевания, и любой из них может манифестировать в неонатальном периоде. Наиболее частым проявлением, особенно у новорожденных африканского происхождения, является распространенный наследственный эллиптоцитоз аутосомно-доминантного типа, который редко дает какие-либо клинические симптомы, кроме наличия эллиптоцитов в мазке крови. Поэтому заболевание в неонатальном периоде обнаруживается случайно, и диагноз ставится на основании мазка крови, взятого по какой-то другой причине, например, для скрининга на наличие инфекции. Новорожденные, являющиеся гомозиготными или сложными гетерозиготными носителями мутаций, приводящих к наследственному эллиптоцитозу, имеют тяжелую, трансфузионно-зависимую анемию, которая проявляется во внутриутробном периоде или в первые несколько дней после рождения. Наследственный эллиптоцитоз с инфантильным пойкилоцитозом является второй по тяжести формой эллиптоцитоза в неонатальном периоде. Обычно, у таких новорожденных наблюдается умеренно тяжелая гемолитическая анемия с выраженным пойкилоцитозом, а также эллиптоцитами. Иногда развивается достаточно тяжелая желтуха, требующая обменного переливания крови [11].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза анемии вследствие кровопотери у плода
Диагноз постгеморрагической анемии может быть подтвержден, если выявлены лабораторные диагностические признаки анемии в сочетании с фактом наличия кровопотери [16].
Основными критериями диагностики анемии:
Снижение количества эритроцитов, концентрации гемоглобина и/или уровня гематокрита более, чем на 2 стандартных отклонения от средних значений эритроцитов, гемоглобина и/или гематокрита для данного постнатального возраста [1].
Значения гемоглобина и гематокрита в зависимости от постнатального возраста ребенка представлены в таблице 2 [17].
Таблица 2. Значения гемоглобина, гематокрита и эритроцитов венозной крови у новорожденных [16–18] (модифицирована из Dallman P.R. et.al, 1977, Girelli G.et al., 2015).
|
Возраст |
Гемоглобин (Hb), г/л |
Гематокрит (Hct) % |
Эритроциты (RBC) 1012/л |
|||
|---|---|---|---|---|---|---|
|
|
Среднее |
−2 SD |
Среднее |
−2 SD |
Среднее |
−2 SD |
|
Пуповина |
165 |
135 |
51 |
42 |
4.7 |
3.9 |
|
1–3 день |
185 |
145 |
56 |
45 |
5.3 |
4.0 |
|
1 неделя |
175 |
135 |
54 |
42 |
5.1 |
3.9 |
|
2 недели |
165 |
125 |
51 |
39 |
4.9 |
3.6 |
|
1 месяц |
140 |
100 |
43 |
31 |
4.2 |
3.0 |
Вспомогательные диагностические критерии анемии новорожденных
Показатели среднего объема эритроцитов (MCV), среднего содержания и средней концентрации гемоглобина в эритроците (MCH, MCHС) [18].
Таблица 3. Показатели среднего объема эритроцитов (MCV), среднего содержания и средней концентрации гемоглобина в эритроците (MCH, MCHС) у новорожденных (венозная кровь) [18](модифицирована из Dallman P.R. et.al, 1977, Girelli G.et al., 2015).
|
Возраст |
MCV, фл |
MCH, пг |
MCHC, г/дл |
|||
|---|---|---|---|---|---|---|
|
|
Среднее |
−2 SD |
Среднее |
−2 SD |
Среднее |
−2 SD |
|
Пуповина |
108 |
98 |
34 |
31 |
33 |
30 |
|
1–3 день |
108 |
95 |
34 |
31 |
33 |
29 |
|
1 неделя |
107 |
88 |
34 |
28 |
33 |
28 |
|
2 недели |
105 |
86 |
34 |
28 |
33 |
28 |
|
1 месяц |
104 |
85 |
34 |
28 |
33 |
29 |
Хроническая постгеморрагическая анемия является микроцитарной, гипохромной, нормо- или умеренно гиперрегенераторной. При острой кровопотере (например, в родах) гематокрит, гемоглобин, количество эритроцитов, ретикулоцитов в первые часы могут оставаться в пределах нормы, так как потеря форменных элементов и плазмы происходит параллельно, и, следовательно, концентрация в единице объема эритроцитов остается такой же, как и до кровопотери. Острая постгеморрагическая анемия является нормоцитарной, нормохромной, гиперрегенераторной анемией.
Основными диагностическими критериями мембранопатий и энзимопатий эритроцитов являются семейный анамнез и характерная форма эритроцитов в мазке крови (таблица 4).
Таблица 4. Характерная морфология эритроцитов при мембранопатиях и энзимопатиях.
|
Ретикулоциты |
Билирубин |
Проба Кумбса |
Морфология эритроцитов |
Диагноз |
|---|---|---|---|---|
|
Норма или |
|
отриц |
сфероцитоз |
Врожденный сфероцитоз |
|
Норма или |
|
отриц |
эллиптоциты |
Врожденных эллиптоцитоз |
|
Норма или |
|
отриц |
Гипохромные микроциты |
a- или g- талассемия |
|
|
|
отриц |
Шиповидные пикноциты |
Дефицит пируват киназы |
|
Норма или |
Норма или |
отриц |
Шизоциты или обломки эритроцитов |
ДВС-синдром, другие микроангиопатические процессы |
|
|
|
отриц |
«откусанные» эритроциты (эритроциты с отщепленной частью мембраны) тельца Гейнца |
Дефицит глюкозо-6-фосфат дегидрогеназы |
1. Жалобы и анамнез
-
Рекомендуется изучить анамнез матери и семейный анамнез для выявления факторов риска развития врожденной анемии [1,7,11,18].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии: К материнским факторам риска развития постгеморрагической анемии относятся:
-
внутриматочные вмешательства во время беременности;
-
гематома пуповины или плаценты;
-
предлежание, врастание плаценты;
-
наличие у матери анемии различной степени тяжести перед и во время беременности;
-
многоплодная монохориальная беременность;
-
наличие острой̆ инфекции у матери или обострение хронической;
-
стремительные роды;
-
оперативные роды;
-
отслойка плаценты.
Для диагностического поиска других врожденных анемий целесообразно изучить семейный анамнез с уточнением наличия анемий или желтух у родственников.
Для выявления возможных инфекционных причин анемии уточнить течение беременности, наличие хронических инфекционных заболеваний у матери, путешествие в эндемичные страны, прием препаратов и веществ, способных вызвать гемолиз у плода при дефиците Г6-ФД.
2. Физикальное обследование
-
Новорожденному ребенку с подозрением на врожденную анемию рекомендуется проведение визуального терапевтического осмотра [1,11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5)
Комментарии: См. раздел «Клиническая картина». При врожденных анемиях, вследствие недостаточности продукции эритроцитов следует обратить внимание на наличие пороков развития и стигм дизэмбриогенеза (таблица 1).
3. Лабораторные диагностические исследования
-
Новорожденному ребенку с подозрением на врожденную анемию рекомендуется проведение общего (клинического) анализа крови с исследованием уровня эритроцитов, гемоглобина, оценку гематокрита и исследование уровня ретикулоцитов в крови для определения дальнейшей тактики лечения [18–29].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии: Для достоверного определения уровня гемоглобина и оценки гематокрита наиболее оптимально использовать венозные показатели, поскольку при отечном синдроме показатели капиллярной крови могут быть занижены.
-
Новорожденному ребенку с врожденной анемией при подозрении на врожденные дефекты эритроцитов рекомендуется просмотр мазка крови для анализа аномалий морфологии эритроцитов, тромбоцитов и лейкоцитов для подтверждения диагноза [11,21,24,25,27,28].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии: см. таблицу 4.
-
Новорожденному ребенку с врожденной анемией для исключения иммунного характера гемолитической анемии рекомендуется проведение прямого антиглобулинового теста (прямая проба Кумбса) [3,11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
-
Новорожденному ребенку с анемией, сопровождающейся развитием иктеричности кожного покрова, рекомендуется исследование уровня общего билирубина в крови, исследование уровня свободного и связанного билирубина в крови для подтверждения неиммунного гемолиза и определения дальнейшей тактики гипербилирубинемии [3,11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
-
Для оценки нарушений газообмена, признаков тканевой гипоксии, метаболических нарушений и определения дальнейшей тактики симптоматической терапии у новорожденного ребенка с признаками врожденной анемии, сопровождающиеся дыхательными и/или гемодинамическими нарушениями, рекомендуется исследование кислотно-основного состояния (КОС) и газов крови и уровня лактата [22,30–36].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии: определение лактата крови зависит от возможностей лаборатории медицинской организации (МО).
-
Для исключения коагулопатий и определения дальнейшей тактики гемостатической терапии у новорожденного ребенка с врожденной анемией в сочетании с геморрагическим синдромом рекомендуется исследование коагулограммы (ориентировочное исследование системы гемостаза) [18,37–40].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии: исследование коагулограммы зависит от возможностей лаборатории МО. В качестве дополнительных методов исследования гемостаза при возможностях конкретной МО может быть использованы тромбоэластография и/или тромбоэластометрия.
-
При ухудшении состояния во время и после гемотрансфузии новорожденному рекомендуется исследование кислотно-основного состояния и уровней калия и кальция в крови для выявления трансфузионных реакций и осложнений гемотрансфузии [41,42].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии: Гиперкалиемия является следствием гемолиза эритроцитов. При выявлении гиперкалиемии (6,5-7,0 ммоль/л) трансфузию следует прекратить. Гипокальциемия, метаболический ацидоз или алкалоз, как правило, связаны с цитратной интоксикацией и требуют своевременной коррекции [42].
-
После проведения гемотрансфузии у новорожденного рекомендуется проведение общего (клинического) анализа крови и мочи не ранее, чем через 2 часа и не позже 24 часов после гемотрансфузии для оценки эффективности и выявления осложнений [43].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии: Оценка эффективности гемотрансфузии проводится по достижению целевых значений гематокрита и/или гемоглобина.
-
Новорожденному ребенку с анемией при подозрении на вирусную или бактериальную этиологию анемии рекомендуется определение ДНК токсоплазмы (Toxoplasma gondii) методом ПЦР в периферической и пуповинной крови, определение ДНК цитомегаловируса (Cytomegalovirus) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК парвовируса B19 (Parvovirus B19) методом ПЦР в периферической и пуповинной крови, количественное исследование, определение ДНК простого герпеса 1 и 2 типов (Herpes simplex virus types 1, 2) методом ПЦР в крови, количественное исследование, определение РНК вируса краснухи (Rubella virus) методом ПЦР в периферической и пуповинной крови, количественное исследование, молекулярно-биологическое исследование крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1), микробиологическое (культуральное) исследование крови на стерильность для выявления этиологии анемии и тактики дальнейшей терапии [11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
-
Новорожденному ребенку с врожденной анемией неясной этиологии при подозрении на наследственную гемолитическую или апластическую анемию рекомендуется комплекс исследований при анемическом синдроме неустановленной этиологии или комплекс исследований для диагностики гемолитической анемии [11,29].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Комментарии: Комплексы могут включать в себя молекулярно-генетические исследования поломок различных генов, отвечающие за развитие гемолитических и апластических анемий.
4. Инструментальные диагностические исследования
-
Для исключения кровоизлияний во внутренние органы новорожденному с признаками анемии рекомендуется проведение ультразвуковых исследований: нейросонографии (НСГ), ультразвукового исследования (УЗИ) брюшной полости (комплексное), почек и надпочечников [44–51].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
-
Для определения дальнейшей тактики лечения новорожденному ребенку с врожденной анемией в сочетании с гиповолемическим шоком рекомендуется проведение эхокардиографии (ЭхоКГ) [45,52–54].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 3).
5. Иные диагностические исследования
-
При подозрении на фето-материнскую трансфузию рекомендуется исследование в крови матери уровня фетального гемоглобина в первые 2 часа жизни [55–57].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 4).
Комментарии: при возможности лабораторной диагностики в конкретной МО. К диагностическим методам фето-материнской трансфузии относятся: определение фетальных эритроцитов в крови матери с помощью теста Клейхауэра-Бетке или методом проточной цитофлуометрии [58]. Тест Клейхауэра-Бетке недостаточно чувствителен и обладает низким уровнем воспроизводимости или точности (коэффициент вариации 50-100%). Расчет процентного соотношения фетальных и материнских клеток используется для оценки фето-материнской трансфузии [55]: Процент фетальных клеток = количество фетальных клеток х 100 / общее количество эритроцитов. При тесте Клейхауэра-Бетке определяется наличие фетальной крови в материнской с порогом 5 мл. Если в мазке крови матери 1% эритроцитов фетальные – кровопотеря плода составляет около 50 мл. При несовместимости по АВО системе между матерью и плодом фетальный гемоглобин плода (HbF), попавший в кровоток матери, может быстро лизироваться антителами матери. В случае персистенции у матери фетального гемоглобина или при других материнских гемоглобинопатиях, приводящих к повышенному уровню HbF, тест Клейхауэра-Бетке будет ложно положительным, и для количественной оценки фето-материнской трансфузии используется метод проточной цитометрии. Определение количества фетальных эритроцитов в крови матери с помощью проточной цитометрии является наиболее быстрым и чувствительным методом. Чувствительность достигает 100% [59].
-
Новорожденному ребенку с подозрением на врожденные дефекты эритроцитов или врожденную недостаточность продукции эритроцитов рекомендуется прием (осмотр, консультация) врача-гематолога первичный для определения дальнейшей тактики обследования и лечения [3,11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
-
Во время гемотрансфузии и как минимум в течение 2 часов после новорожденному рекомендуется проведение мониторирования частоты сердечных сокращений, артериального давления, частоты дыхания, степени насыщения гемоглобина кислородом, диуреза, цвета мочи, температура тела для возможности выявления трансфузионных реакций и осложнений гемотрансфузии [60].
Уровень убедительности рекомендаций C (уровень достоверности доказательств - 5).
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Консервативное лечение
Этиотропная и патогенетическая терапия
-
Новорожденному с уровнем гемоглобина менее 120 г/л в первые 24 часа жизни для коррекции анемии рекомендуется гемотрансфузия лейкоредуцированных эритроцитсодержащих компонентов крови (ЭСК) [61–66].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
Комментарии: При анемии, сопровождающейся развитием гиповолемического шока вследствие острой кровопотери сразу после родов возможно использование O (I) Rh (-) D-отрицательного лейкоредуцированного ЭСК [67].
Объем трансфузируемого лейкоредуцированного эритроцитсодержащего компонента крови, как правило, составляет 10-20 мл/кг [38,61].
Рекомендуемая длительность трансфузии не более 4 часов [61,62,68,69].
Возможные риски и осложнения гемотрансфузии [70]:
- Переливание неверного компонента ЭСК (по группе крови, резусу и т.д.);
- Острая / отсроченная трансфузионная реакция;
- Передача бактериальных и вирусных инфекций;
- Трансфузионно-ассоциированное осложнение «трансплантат против хозяина» – редкое, но часто смертельное состояние, которое предотвращается гамма-облучением продуктов крови;
- Иммунный и неиммунный гемолиз;
- Метаболические нарушения (гиперкалиемия, гипокальциемия) и нарушение кислотно-основного состояния крови;
- Острое повреждение легких, связанное с переливанием компонентов крови («TRALI») с развитием респираторных нарушений;
- TANEC – трансфузия ассоциированный некротизирующий энтероколит – энтероколит, развившийся в течение 48-72 ч после проведенной гемотрансфузии ЭСК крови;
- Посттрансфузионная тромбоцитопеническая пурпура, при которой количество тромбоцитов катастрофически падает через 5-9 дней после переливания;
- Аллергические реакции;
- Перегрузка объемом;
- Перегрузка железом;
- Апноэ;
- Нарушения сердечного ритма;
- Судороги;
- Эмболия (воздух / тромб);
- Гемодинамические нарушения;
- Инфекция;
- Нестабильность температуры тела;
- Тромбоцитопения;
- Внутрижелудочковое кровоизлияние.
-
Для коррекции анемии у новорожденного с показателем Hb менее 80 г/л в сочетании с гиповолемическим шоком (потерей ОЦК 20% и более) объем гемотрансфузии может превышать 20 мл/кг и расчет лейкоредуцированного трансфузируемого ЭСК рекомендуется проводить по формуле [18]:
целевой Ht –Ht больного
Объем крови (мл)= ––––––––––––––––––––––– × объем крови новорожденного
Ht эр.компонента
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Комментарии: Объем крови новорожденного: 80 мл/кг – доношенные, 100 мл/кг- недоношенные, Ht целевой не менее 0,35.
Во избежание осложнений массивной гемотрансфузии общий объём ЭСК не должен превышать 60% ОЦК.
Трансфузию следует прекратить при появлении следующих побочных реакций [61]:
- тахикардия, брадикардия или аритмия;
- тахипноэ;
- увеличение систолического артериального давления (АД) более, чем на 15 мм.рт.ст., если только это не является желательным эффектом;
- повышение температуры выше 38оС и/или повышение температуры ≥ 1о С;
- цианоз;
- кожная сыпь, крапивница, гиперемия;
- гематурия/ гемоглобинурия;
-
Новорожденному с симптомами анемии и/или снижением уровня гемоглобина до значений, требующих коррекции, для достижения целевого уровня гемоглобина рекомендуется гемотрансфузия лейкоредуцированных эритроцитсодержащих компонентов (ЭСК) крови с учетом потребности в проведении респираторной терапии [63,64,71–74].
Уровень убедительности рекомендаций A (уровень достоверности доказательств-1).
Комментарии: Показания для заместительной гемотрансфузии лейкоредуцированных эритроцитсодержащих компонентов крови у новорожденных представлены в таблице 5 [74].
Таблица 5. Концентрации гемоглобина (г/л), при которых рекомендована трансфузия ЭСК крови у новорожденных детей, в зависимости от их респираторного статуса и постнатального возраста (модифицирована из Whyte R., Kirpalani H., 2011 ) [74].
|
Возраст (дни) |
Тип пробы крови |
Новорожденные, нуждающиеся в респираторной поддержке★ Hb г/л (Ht%) |
Новорожденные без респираторной поддержки Hb г/л (Ht%) |
|---|---|---|---|
|
2-7 |
капиллярный венозный |
≤ 115 (35%) ≤ 104 |
≤ 100 (30%) ≤ 90 |
|
8-14 |
капиллярный венозный |
≤ 100 (30%) ≤ 90 |
≤ 85 (25%) ≤ 77 |
|
≥ 15 |
капиллярный венозный |
≤ 85 (25%) ≤ 77 |
≤ 75 (23%) ≤ 68 |
êвключает все виды респираторной терапии и поддержки адекватного самостоятельного дыхания, включая масочную или диффузную подачу кислорода
Рекомендованные уровни гемоглобина в качестве критериев проведения трансфузии не могут применяться в случае крупных хирургических вмешательств, сепсиса, шока, кровотечения или симптомов, присущих анемии (тахикардия, тахипноэ) [18,75].
Решение о проведении плановой трансфузии целесообразно принимать с учетом оценки пользы над риском при сопутствующих заболеваниях и состояниях (например, прогрессирующая ретинопатия, перегрузка объемом, течение некротизирующего энтероколита, острое почечное повреждение и т.п..).
Симптоматическая терапия
Симптоматическая терапия включает в себя инфузионную терапию кристаллоидными растворами для поддержания нормоволемии, гемостатическую терапию при наличии проявлений активного геморрагического синдрома, респираторную и кардиотоническую терапию при наличии показаний.
-
При тяжелой анемии вследствие кровопотери у новорожденного для экстренной коррекции гиповолемии до трансфузии ЭСК рекомендуется введение растворов электролитов (код АТХ В05ХА) - натрия хлорида** 0,9% раствора в дозе 20 мл/кг [18,76,77].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
-
Новорожденному с непрямой гипербилирубинемией вследствие гемолиза рекомендуется проведение фототерапии кожи для снижения уровня билирубина и профилактики развития ядерной желтухи [78].
Уровень убедительности рекомендаций В (уровень достоверности доказательств - 2).
Комментарии: Уровень непрямого билирубина, требующий проведения фототерапии, зависит от гестационного и постнатального возраста (см. Приложение А3.2).
-
Новорожденному с непрямой гипербилирубинемией вследствие гемолиза при неэффективности фототерапии кожи и/или повышения уровня непрямого билирубина, требующего операции заменного переливания, рекомендуется проведение операции заменного переливания для снижения уровня билирубина и профилактики развития ядерной желтухи [3,11,79].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 4).
Комментарии: Уровень непрямого билирубина, требующий проведения операции заменного переливания, зависит от гестационного и постнатального возраста (см. Приложение А3.2).
2. Хирургическое лечение
Хирургическое лечение зависит от топики и степени тяжести кровотечений.
3. Иное лечение
Лечебно-охранительный режим подразумевает создание оптимальных условий выхаживания новорожденных.
- В зависимости от тяжести состояния новорожденный, которому требуется проведение гемотрансфузии, должен быть переведен в отделение реанимации и интенсивной терапии новорожденных, палату интенсивной терапии (ПИТ) или в отделение патологии новорожденных и недоношенных детей;
- Ребенку показано пребывание в условиях поддержания термонейтральной среды, ограничение сенсорной стимуляции (защита от света, шума, прикосновений), контроль температуры тела;
- Ребенку показано адекватное энтеральное и, при необходимости, парентеральное питание. Преимущество в энтеральном вскармливании отдается материнскому молоку. При недостаточной лактации или противопоказаний к грудному вскармливанию со стороны матери вскармливание новорожденного проводится сухой адаптированной молочной смесью для вскармливания детей с рождения или сухой/готовой специальной молочной смесью для вскармливания недоношенных и маловесных детей.
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Проводится профильными специалистами (врач-невролог, врач-офтальмолог, врач-хирург и др.) в зависимости от сопутствующей патологии и осложнений.
Прогноз
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Прогноз заболевания при анемии вследствие кровопотери у плода при отсутствии сопутствующих заболеваний, как правило, благоприятный. При тяжелой анемии при рождении вследствие кровопотери возможен летальный исход, развитие полиорганной недостаточности (в частности, острое повреждение почек), поражение ЦНС вследствие гемической гипоксии. Прогноз также зависит от сопутствующих заболеваний, локализации кровоизлияний.
Исход анемий вследствие вирусных инфекций с развитием водянки плода, а также других врожденных анемий, различен, вплоть до летального исхода.
Госпитализация
Организация оказания медицинской помощи
Гемотрансфузия новорожденным проводится только в стационарных условиях. При выявлении у ребенка врожденных дефектов эритроцитов или врожденной недостаточности продукции эритроцитов, пациент должен быть переведен в профильный гематологический стационар. При антенатальном выявлении тяжелой анемии плода, в т.ч. в сочетании с водянкой плода, при принятии решения вопроса о проведении внутриутробных переливаний крови плоду беременная женщина переводится в стационар III уровня с наличием специалистов, владеющих данным методом лечения.
Показания к выписке пациента из медицинской организации:
1) Стабильное удовлетворительное состояние ребенка;
2) Стабилизация лабораторных показателей с уровнем гемоглобина, не требующим трансфузии ЭСК;
3) Отсутствие противопоказаний к выписке.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
-
Для профилактики анемии у новорожденного рекомендуется отсроченное пережатие и пересечение пуповины спустя 60-120 сек при отсутствии необходимости в немедленном оказании помощи матери или ребенку [80–82].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Альтернативой отсроченному пережатию может являться сцеживание пуповины. Рутинное применение сцеживания пуповины не рекомендуется глубоко недоношенным детям в связи с отсутствием достаточных доказательств его безопасности у глубоко недоношенных новорожденных [80].
-
При антенатально выявленной тяжелой анемии у плода рекомендуется проведение внутриутробного переливания крови плоду отмытыми эритроцитами для повышения уровня гемоглобина у плода и улучшения неонатальных исходов [11,83].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Критерии тяжелой анемии плода и техника проведения представлены в клинических рекомендациях «Резус-иммунизация. Гемолитическая болезнь плода». Процедура внутриутробного переливания крови плоду проводится в МО III уровня, при наличии в ней специалистов, владеющих данным методом.
Диспансерное наблюдение
Диспансерное наблюдение профильными специалистами в зависимости от топики кровоизлияний.
-
Детям с анемиями вследствие врожденных дефектов эритроцитов или врожденной недостаточности продукции эритроцитов рекомендуется диспансерный прием (осмотр, консультация) врача-гематолога [3].
Уровень убедительности рекомендаций С (уровень достоверности доказательств - 5).
Информация
Источники и литература
-
Клинические рекомендации Российского общества неонатологов
- 1. Colombatti R., Sainati L., Trevisanuto D. Seminars in Fetal & Neonatal Medicine Anemia and transfusion in the neonate // Semin. Fetal Neonatal Med. Elsevier Ltd, 2016. Vol. 21, № 1. P. 2–9. 2. Fanaroff AA M.R. Neonatal-perinatal medicine. Disorders of fetus and infant. 7th ed. / ed. St.Louis M. 2002. 1182–254 p. 3. Неонатология: национальное руководство: в 2 т./ под ред. Н.Н. Володина, Д.Н. Дегтярева. 2nd-е изд, п ed. Москва: ГЭОТАР-Медиа, 2023. 768 p. 4. Widness J.A. Pathophysiology , Diagnosis , and Prevention of Neonatal Anemia // Neo Rev. 2000. Vol. 1, № 4. P. 61. 5. Lanzkowsky P. Anemia During the Neonatal Period // Lanzkowsky’s Manual of Pediatric Hematology and Oncology. Elsevier Inc., 2016. 51–68 p. 6. Jang D.G. et al. Risk Factors of Neonatal Anemia in Placenta Previa // Int J Med Sci. 2011. Vol. 8, № 7. P. 554–557. 7. Lokeshwar M.R., Singhal T., Shah N. Anemia in the Newborn // Indian J. Pediatr. 2003. Vol. 70, № 11. P. 893–902. 8. Bizzarro M.J., Colson E., Ehrenkranz R.A. Differential diagnosis and management of anemia in the newborn // Pediatr Clin North Am. 2004. Vol. 51. P. 1087–1107. 9. Christensen R.D. RBC transfusions in the NICU: guidelines, alternatives, outcomes. // Program and abstracts of the National Association of Neonatal Nurses 24th Annual Educational Conference; 2008. 10. Steiner L.A., Gallagher P.G. Erythrocyte Disorders in the Perinatal Period // Semin Perinatol. 2007. Vol. 31. P. 254–261. 11. Робертс И., Бейн Б. Дж. . Неонатальная гематология: практическое руководство / ed. пер. с англ. под ред Е.Н. Балашовой. Москва: ГЭОТАР-Медиа, 2024. 248 p. 12. Stockman, J.A. , Pochedly C. Developmental and neonatal hematology / ed. Raven Pres. New York: Raven Pres, 1988. 336 p. 13. Чернов В. М. , Овсянникова Г. С., Юдина Н. Б. [и др.]. Медико-частотные характеристики анемии Даймонда-Блекфена у детей в Российской Федерации // Вопросы гематологии/онкологии и иммунопатологии в педиатрии. 2019. Vol. 18, № 3. P. 22–28. 14. Балашова Е.Н., Васильев В.В., Вайнштейн Н.П., Дегтярева М.В., Зубков В.В., Иванова А.А., Игнатко И.В., Карпова А.Л., Лобзин Ю.В., Малютина Л.В., Овсянников Д.Ю., Панкратьева Л.Л., Савенкова М.С., Сенкевич О.А., Шахгильдян В.И., Шабалов Н.П., Ионов О.В., Д . Врожденная цитомегаловирусная инфекция (клинические рекомендации) // Неонатология: новости, мнения, обучение. 2023. Vol. 11, № 4. P. 68–87. 15. Pearson A. Posthemorrhagic Anemia in the Newborn // Pediatr. Rev. Aug. 1982. Vol. 4, № 2. P. 40–43. 16. Dallman P.R. Anemia of prematurity // Annu. Rev. Med. 1981. Vol. 32. P. 143–160. 17. Salsbury D.C. Anemia of Prematurity // Neonatal Netw. 2001. Vol. 20, № 5. P. 13–20. 18. Girelli G. et al. Recommendations for transfusion therapy in neonatology // Blood Transfus. 2015. Vol. 13, № 3. P. 484–497. 19. Jopling J. et al. Reference ranges for hematocrit and blood hemoglobin concentration during the neonatal period: Data from a multihospital health care system // Pediatrics. 2009. Vol. 123, № 2. 20. Shalev H. et al. A novel epsilon gamma delta beta thalassemia presenting with pregnancy complications and severe neonatal anemia // Eur. J. Haematol. 2013. Vol. 90, № 2. P. 127–133. 21. Verhovsek M, Shah NR, Wilcox I et al. Severe fetal and neonatal hemolytic anemia due to a 198 kb deletion removing the complete β-globin gene cluster // Pediatr Blood Cancer. 2012. Vol. 59, № 5. P. 941–944. 22. Solomonia N., Playforth K., Reynolds E. Fetal-Maternal Hemorrhage: A Case and Literature Review // Am. J. Perinatol. Reports. 2012. Vol. 02, № 01. P. 007–014. 23. Tao E. et al. Severe neonatal anemia affected by massive fetomaternal hemorrhage: a single-center retrospective observational study // J. Matern. Neonatal Med. Taylor & Francis, 2020. Vol. 12, № nov. P. 1–7. 24. Corebima B.I.R.V. et al. A 6-Day-Old Male Infant with Severe Hyperbilirubinemia Diagnosed with Hereditary Spherocytosis at a Tertiary Hospital in East Java, Indonesia: A Diagnostic and Management Challenge in a Developing Country // Am. J. Case Rep. 2022. Vol. 23. P. 1–7. 25. Sánchez Villalobos M. et al. Case Report: α-Spectrin Mutation Associated with αLELY Polymorphism Responsible for Hereditary Pyropoikilocytosis // Hematol. Rep. 2022. Vol. 14, № 4. P. 300–304. 26. Fotzi I. et al. Case Report: Clinical and Hematological Characteristics of εγδβ Thalassemia in an Italian Patient // Front. Pediatr. 2022. Vol. 10, № March. P. 1–6. 27. Drouilly M. et al. Infantile pyknocytosis, a neonatal hemolytic anemia with Heinz bodies: A cohort study // Pediatr. Blood Cancer. 2024. № May. P. 1–9. 28. Laosombat V. et al. Neonatal anemia associated with Southeast Asian Ovalocytosis // Int. J. Hematol. 2005. Vol. 82, № 3. P. 201–205. 29. Smetanina N.S. et al. Clinical and genomic heterogeneity of Diamond Blackfan anemia in the Russian Federation // Pediatr. Blood Cancer. 2015. Vol. 62, № 9. P. 1597–1600. 30. Nadeem M., Clarke A., Dempsey E.M. Day 1 serum lactate values in preterm infants less than 32 weeks gestation // Eur. J. Pediatr. 2010. Vol. 169, № 6. P. 667–670. 31. Izraeli S. et al. Lactic acid as a predictor for erythrocyte transfusion in healthy preterm infants with anemia of prematurity // J. Pediatr. 1993. Vol. 122, № 4. P. 629–631. 32. Ross MP, Christensen RD, Rothstein G, Koenig JM, Simmons MA, Noble NA K.R. A randomized trial to develop criteria for administering erythrocyte transfusions to anemic preterm infants 1 to 3 months of age. // J Perinatol. 1989. Vol. Sep;9, № 3. P. 246–253. 33. Kanmaz H.G. et al. Effects of red cell transfusion on cardiac output and perfusion index in preterm infants // Early Hum. Dev. Elsevier Ltd, 2013. Vol. 89, № 9. P. 683–686. 34. Dallman M.D. et al. Changes in transfusion practice over time in the PICU // Pediatr. Crit. Care Med. 2013. Vol. 14, № 9. P. 843–850. 35. Takahashi D. et al. Effect of transfusion on the venous blood lactate level in very low-birthweight infants // Pediatr Int. 2009. Vol. 51, № 3. P. 321–325. 36. Raye J.R., Gutberlet R.L., Stahlman M. Symptomatic posthemorrhagic anemia in the newborn. // Pediatr. Clin. North Am. Elsevier Masson SAS, 1970. Vol. 17, № 2. P. 401–413. 37. Motta M, Del Vecchio A C.G. Fresh Frozen Plasma Administration in the Neonatal Intensive Care Unit: Evidence-Based Guidelines. // Clin. Perinatol. Elsevier Inc, 2015. Vol. 42, № 3. P. 639–650. 38. New H. V. et al. Guidelines on transfusion for fetuses, neonates and older children // Br. J. Haematol. 2016. Vol. 175, № 5. P. 784–828. 39. Christensen R.D. et al. Reference intervals for common coagulation tests of preterm infants (CME) // Transfusion. 2014. Vol. 54, № 3. P. 627–632. 40. Delaney M. et al. Bleeding emergencies in neonatal and paediatric patients: improving the quality of care using simulation // Transfus. Med. 2018. Vol. 28, № 6. P. 405–412. 41. Diab Y.A., Wong E.C.C., Luban N.L.C. Massive transfusion in children and neonates // Br. J. Haematol. 2013. Vol. 161, № 1. P. 15–26. 42. Sihler K.C., Napolitano L.M. Complications of massive transfusion // Chest. The American College of Chest Physicians, 2010. Vol. 137, № 1. P. 209–220. 43. MacDonald M.G., Ramasethu J. R.-B.K. Atlas of procedures in neonatology. 5th ed. Lippincott Williams & Wilkins, Wolter Kluwer, 2013. 429 p. 44. Mozzini C. et al. Ultrasound as First Line Step in Anaemia Diagnostics // Mediterr J Hematol. Infect Dis. 2019. Vol. 11, № 1. P. 1–10. 45. Singh Y. et al. International evidence-based guidelines on Point of Care Ultrasound ( POCUS ) for critically ill neonates and children issued by the POCUS Working Group of the European Society of Paediatric and Neonatal Intensive Care ( ESPNIC ) // Crit Care. Critical Care, 2020. Vol. 24, № 1. P. 1–16. 46. Kluckow M E.N. Low superior vena cava flow and intraventricular haemorrhage in preterm infants. // Arch Dis Child Fetal Neonatal Ed. 2000. Vol. 82, № 3. P. 188–194. 47. Papile L.A. et al. Incidence and evolution of subependymal and intraventricular hemorrhage: A study of infants with birth weights less than 1,500 gm // J. Pediatr. 1978. Vol. 92, № 4. P. 529–534. 48. Hintz S.R. et al. Interobserver Reliability and Accuracy of Cranial Ultrasound Scanning Interpretation in Premature Infants // J. Pediatr. 2007. Vol. 150, № 6. 49. Toti M.S. et al. Adrenal hemorrhage in newborn: How, when and why- from case report to literature review // Ital. J. Pediatr. Italian Journal of Pediatrics, 2019. Vol. 45, № 1. P. 1–8. 50. Azarow K. et al. Multidisciplinary evaluation of the distended abdomen in critically ill infants and children: The role of bedside sonography // Pediatr. Surg. Int. 1998. Vol. 13, № 5–6. P. 355–359. 51. Vergani P. et al. Fetus-placenta-newborn: Clinical significance of fetal intracranial hemorrhage // Am. J. Obstet. Gynecol. 1996. Vol. 175, № 3 PART I. P. 536–543. 52. Singh Y. Echocardiographic evaluation of hemodynamics in neonates and children // Front. Pediatr. 2017. Vol. 5, № September. P. 1–14. 53. Miletin J. et al. Comparison of Two Techniques of Superior Vena Cava Flow Measurement in Preterm Infants With Birth Weight <1,250 g in the Transitional Period—Prospective Observational Cohort Study // Front. Pediatr. 2021. Vol. 9, № April. P. 1–9.
Информация
Список сокращений
Hb – гемоглобин
HbF - фетальный гемоглобин
Hct, Ht – гематокрит
IgG – иммуноглобулины класса G
MCH - среднее содержание гемоглобина в эритроците
MCHC – средняя концентрация гемоглобина в эритроците
MCV - средний объем эритроцитов
RBC – эритроциты
SD – стандартное отклонение
АД – артериальное давление
ВПС – врожденный порок сердца
Г6-ФДГ - глюкозо-6-фосфатдегидрогеназа
ДВС – диссеминированное внутрисосудистое свертывание
ДМЖП – дефект межжелудочковой перегородки
ДМПП – дефект межпредсердной перегородки
ЖКТ – желудочно-кишечный тракт
ИВЛ – искусственная вентиляция легких
КОС – кислотно-основное состояние
МО – медицинская организация
НМТ – низкая масса тела
НСГ – нейросонография
ОПНиНД – отделение патологии новорожденных
ОРИТН – отделение реанимации и интенсивной терапии новорожденных
ОЦК - объем циркулирующей крови
ПИТ – палата интенсивной терапии
ПК - пируваткиназа
ПЦР – полимеразная цепная реакция
ТТП – тромботическая тромбоцитопеническая пурпура
УЗИ – ультразвуковое исследование
ЦМВ – цитомегаловирус
ЦНС – центральная нервная система
ЧД – частота дыхания
ЧСС – частота сердечных сокращений
ЭСК - эритроцитсодержащие компоненты
ЭхоКГ - эхокардиография
Термины и определения
Анемия – гематологический синдром, характеризующийся снижением концентрации гемоглобина и/или гематокрита более, чем на 2 стандартных отклонения от средних значений гемоглобина и/или гематокрита для данного постнатального возраста.
Постгеморрагическая анемия – гематологический синдром, характеризующийся снижением концентрации гемоглобина и/или гематокрита более, чем на 2 стандартных отклонения от средних значений гемоглобина и/или гематокрита для данного постнатального возраста вследствие кровопотери.
Критерии оценки качества медицинской помощи
|
№ |
Критерии качества |
Оценка выполнения (да/нет) |
|---|---|---|
|
1. |
Выполнен визуальный терапевтический осмотр |
Да/нет |
|
2. |
Выполнен общий (клинический) анализ крови после рождения с исследованием уровня эритроцитов, гемоглобина, оценку гематокрита и исследование уровня ретикулоцитов в крови |
Да/нет |
|
3. |
Выполнен просмотр мазка крови для анализа аномалий морфологии эритроцитов, тромбоцитов и лейкоцитов при подозрении на врожденные дефекты эритроцитов |
Да/нет |
|
4. |
Выполнено проведение прямого антиглобулинового теста (прямая проба Кумбса) |
Да/нет |
|
5. |
Выполнено исследование кислотно-основного состояния, газов крови и лактата крови при наличии дыхательных и гемодинамических нарушений |
Да/нет |
|
6. |
Выполнена коагулограмма (ориентировочное исследование гемостаза) при наличии геморрагического синдрома |
Да/нет |
|
7. |
Выполнена нейросонография |
Да/нет |
|
8. |
Выполнено УЗИ брюшной полости (комплексное), почек и надпочечников |
Да/нет |
|
9. |
Выполнена эхокардиография при наличии гиповолемического шока |
Да/нет |
|
10. |
Выполнена гемотрансфузия при уровне гемоглобина ниже 120 г/л в первые 24 часа |
Да/нет |
|
11. |
Выполнена гемотрансфузия новорожденному с симптомами анемии и/или снижением уровня гемоглобина до значений, требующих коррекции |
Да/нет |
|
12. |
Выполнено введение 0,9% раствора натрия хлорида**(код АТХ В05ХА) для экстренной коррекции гиповолемии до трансфузии ЭСК при тяжелой анемии |
Да/нет |
|
13. |
Выполнен мониторинг ЧСС, АД, ЧД, степени насыщения гемоглобина кислородом, диуреза, цвета мочи, температура тела во время и в течение 2 часов после гемотрансфузии |
Да/нет |
|
14. |
Выполнено исследование кислотно-основного состояния и уровней калия и кальция в крови во время и после гемотрансфузии при ухудшении состояния |
Да/нет |
|
15. |
Выполнено исследование общего (клинического) анализа крови и мочи не ранее, чем через 2 часа и не позже 24 часов после гемотрансфузии |
Да/нет |
|
16. |
Выполнено отсроченное пережатие пуповины и пересечение пуповины спустя 60-120 сек при отсутствии необходимости в немедленном оказании помощи матери или ребенку |
Да/нет |
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
-
Балашова Екатерина Николаевна – кандидат медицинских наук, ведущий научный сотрудник ОРИТ имени проф. А.Г. Антонова института неонатологии и педиатрии ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России¸ доцент кафедры неонатологии, член Совета Российского общества неонатологов
-
Володин Николай Николаевич, акад. РАН, профессор, д.м.н.; президент Ассоциация специалистов в области перинатальной медицины, оказания помощи беременной женщине и плоду, новорожденному и ребенку в возрасте до 3-х лет (АСПМ+)
-
Дегтярев Дмитрий Николаевич - доктор медицинских наук, профессор заместитель директора по научной работе ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, заведующий кафедрой неонатологии педиатрического факультета ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» МЗ РФ (Сеченовский Университет), член Совета Российского общества неонатологов
-
Зубков Виктор Васильевич - доктор медицинских наук, директор института неонатологии и педиатрии, заведующий кафедрой неонатологии ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России, профессор кафедры неонатологии Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» МЗ РФ (Сеченовский Университет), член Совета Российского общества неонатологов
-
Ионов Олег Вадимович - доктор медицинских наук, заведующий ОРИТ имени проф. А.Г. Антонова института неонатологии и педиатрии ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России, профессор кафедры неонатологии Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» МЗ РФ (Сеченовский Университет), Председатель Российского общества неонатологов
-
Карпова Анна Львовна - кандидат медицинских наук, заведующая неонатологическим стационаром ГБУЗ "Городская клиническая больница №67 им. Л.А. Ворохобова Департамента Здравоохранения города Москвы", доцент кафедры неонатологии имени профессора В.В. Гаврюшова ФГБОУ ДПО «РМАНПО» Минздрава России, ассистент кафедры поликлинической терапии, клинической лабораторной диагностики и медицинской биохимии ИПДО ФГБОУ ВО "Ярославский государственный медицинский университет" МЗ РФ, член Совета Российского общества неонатологов.
-
Киртбая Анна Ревазиевна - доктор медицинских наук, заведующая по клинической работе ОРИТ имени проф. А.Г. Антонова института неонатологии и педиатрии ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России, профессор кафедры неонатологии Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), член Российского общества неонатологов
-
Сапун Ольга Ильинична - заведующая ОРИТН №2 ДККБ г. Краснодар, главный внештатный неонатолог МЗ Краснодарского края, член Совета Российского общества неонатологов
-
Сенькевич Ольга Александровна - доктор медицинских наук, профессор, заведующая кафедрой педиатрии, неонатологии и перинатологии с курсом неотложной медицины Института непрерывного профессионального образования и аккредитации ФГБОУ ВО «Дальневосточный государственный медицинский университет» МЗ РФ, член Совета Российского общества неонатологов
-
Сметанина Наталья Сергеевна - доктор медицинских наук, профессор, заместитель директора Института гематологии, иммунологии и клеточных технологий ФГБУ «НМИЦ детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева» Минздрава России, член Национального гематологического общества, член Российского общества детских онкологов и гематологов
-
Рындин Андрей Юрьевич – кандидат медицинских наук, старший научный сотрудник ОРИТ имени проф. А.Г. Антонова института неонатологии и педиатрии ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России¸ доцент кафедры неонатологии Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), член Совета Российского общества неонатологов
-
Нароган Марина Викторовна- доктор медицинских наук, профессор кафедры неонатологии Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), член Совета Российского общества неонатологов
-
Шарафутдинова Дияна Рашидовна– кандидат медицинских наук, врач анестезиолог-реаниматолог ОРИТ имени проф. А.Г. Антонова института неонатологии и педиатрии ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России¸ ассистент кафедры неонатологии Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), член Совета Российского общества неонатологов
Конфликт интересов отсутствует
Приложение А2. Методология разработки клинических рекомендаций
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для сбора/селекции доказательств: доказательной базой для рекомендаций являлись публикации, вошедшие в Кохрановскую библиотеку, базы данных PubMed, EMBASE и MEDLINE, Scopus, Web of Science, e-library, clinicaltrial.gov, электронные библиотеки, клинические рекомендации, размещенные на ресурсах The National Institute for Health and Care Excellence, The European Association of Perinatal Medicine, The European Society for Pediatric Research, The European Foundation for the Care of Newborn Infants, The European Society for Neonatology. Глубина поиска составляла 43 года.
Методы, использованные для оценки качества и силы доказательств:
· консенсус экспертов;
· оценка значимости в соответствии с рейтинговой схемой.
Шкалы оценки уровней достоверности доказательств (УДД) (Таблица 1,2) для методов диагностики, профилактики, лечения и реабилитации (диагностических, профилактических, лечебных, реабилитационных вмешательств) с расшифровкой и шкала оценки уровней убедительности рекомендаций (УУР) (Таблица 3) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
Методы, использованные для анализа доказательств:
· обзоры опубликованных метаанализов;
· систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств.
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучалась для того, чтобы убедиться в её валидности. Методологическое изучение базировалось на вопросах, которые сфокусированы на тех особенностях дизайна исследований, которые оказывают существенное влияние на валидность результатов и выводов.
Для минимизации потенциальных ошибок субъективного характера каждое исследование оценивалось независимо, по меньшей мере, двумя членами рабочей группы. Какие-либо различия в оценках обсуждались всей группой в полном составе. При невозможности достижения консенсуса привлекался независимый эксперт.
Экономический анализ:
Анализ стоимости не проводился, и публикации по фармакоэкономике не анализировались
Метод валидизации рекомендаций:
· внешняя экспертная оценка;
·внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, прежде всего, то, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей первичного звена и участковых педиатров в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций, как рабочего инструмента повседневной практики.
Предварительная версия была также направлена рецензенту, не имеющему медицинского образования, для получения комментариев, с точки зрения перспектив пациентов.
Комментарии, полученные от экспертов, тщательно систематизировались, и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультация и экспертная оценка:
Последние изменения в настоящих рекомендациях представлены для дискуссии в предварительной версии. Обновленная версия для широкого обсуждения была размещена на сайте Российского общества неонатологов (РОН) www.neonatology.pro, www.raspm.ru, https://portalcr.minzdrav.gov.ru/ для того, чтобы все заинтересованные лица имели возможность принять участие в обсуждении и совершенствовании рекомендаций.
Проект рекомендаций рецензирован независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Целевая аудитория данных клинических рекомендаций:
1. врачи-неонатологи
2. врачи-анестезиологи-реаниматологи
3. врачи-педиатры
4. врачи-акушеры-гинекологи
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1 |
Систематический обзор РКИ с применением мета-анализа |
|
2 |
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
|
3 |
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
|
5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций(УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР |
Расшифровка |
|---|---|
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием, но не чаще 1 раза в 6 месяцев. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Приложение А3.1 Связанные документы
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
1. Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» от 21.11.2011 № 323 Ф3.
2. МЗ РФ, Приказ от 10 мая 2017 г. N 203н «Об утверждении критериев оценки качества медицинской помощи».
3. Международная классификация болезней, травм и состояний, влияющих на здоровье, 10-го пересмотра (МКБ-10) (Всемирная организация здравоохранения) версия 2019.
4. Номенклатура медицинских услуг (Министерство здравоохранения и социального развития Российской Федерации) 2020.
5. Приказ Министерства здравоохранения Российской Федерации от 28.10.2020 № 1170н "Об утверждении порядка оказания медицинской помощи населению по профилю "трансфузиология"
(Зарегистрирован 27.11.2020 № 61123)
6. Постановление Правительства РФ от 22 июня 2019 г. № 797 "Об утверждении Правил заготовки, хранения, транспортировки и клинического использования донорской крови и ее компонентов и о признании утратившими силу некоторых актов Правительства Российской Федерации”
7. Методическое письмо Минздрава России № 15-4/И/2-2570 от 04.03.2020 «Реанимация и стабилизация состояния новорожденных детей в родильном зале». Под ред. Байбариной Е.Н. М.: Министерство здравоохранения РФ; 2020.
8. Перечень жизненно необходимых и важнейших лекарственных препаратов на 2020 г. (Распоряжение Правительства РФ от 12 октября 2019 г. N 2406-р).
Приложение А3.2 Показания для проведения фототерапии и заменного переливания крови у новорожденных
Показания к проведению фототерапии у новорожденных детей разного гестационного возраста [3,84].
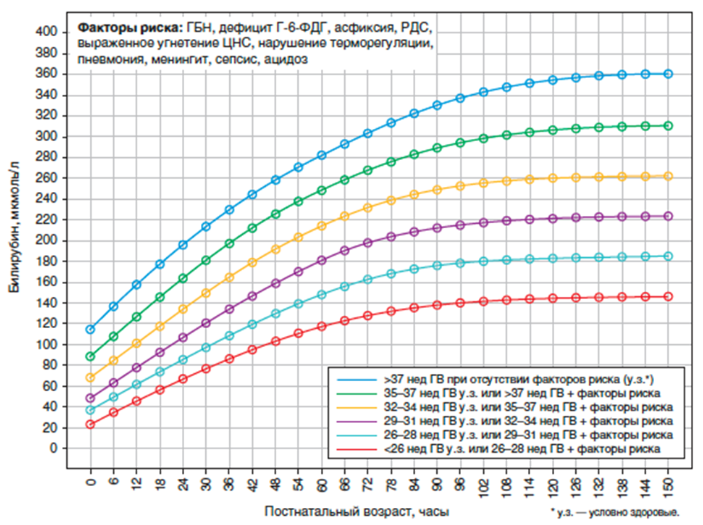
Показания к проведению заменного переливания крови у новорожденных детей разного гестационного возраста [3,84].
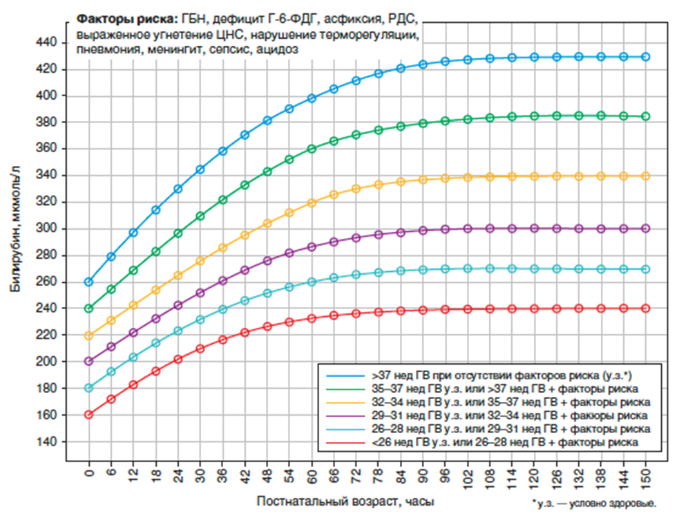
Приложение Б. Алгоритмы действий врача
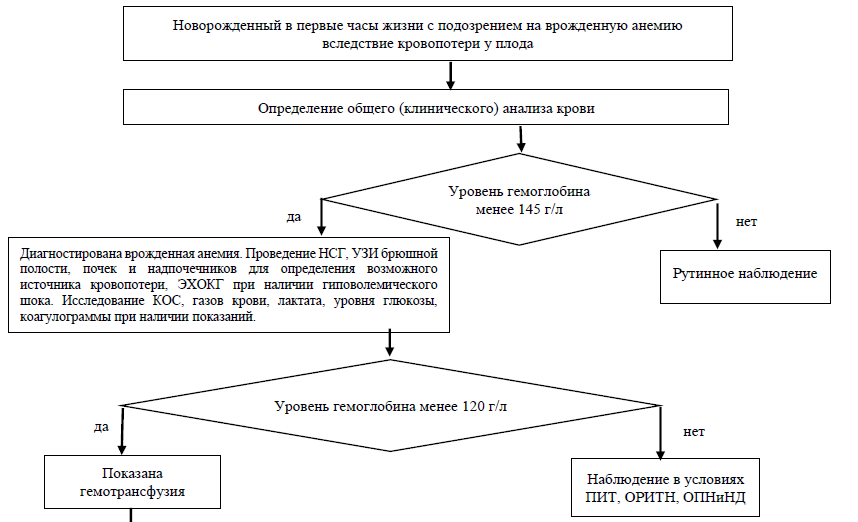
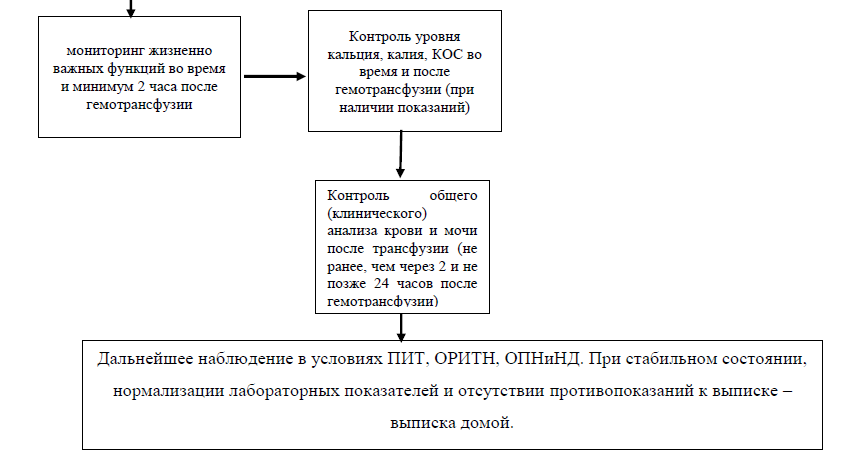
Приложение В. Информация для пациента
Анемия может встречаться у новорожденных детей. Анемия характеризуется значительным уменьшением количества гемоглобина в крови ребёнка, а также количества красных кровяных телец – эритроцитов. У новорожденных детей анемия в первые сутки жизни может возникать вследствие внутриутробного обмена кровью между матерью и ребенком, между плодами при многоплодных беременностях, при кровотечении в результате предлежания плаценты, повреждениях, отслойке плаценты. В таких случаях у новорожденного отмечается снижение уровня гемоглобина и развивается, так называемая, врожденная анемия вследствие кровопотери у плода. Также причиной анемии могут быть наружные и внутренние кровотечения у ребенка, развившиеся еще внутриутробно или во время родов, нарушение синтеза гемоглобина, наследственные нарушения мембран эритроцитов, наследственные гемолитические анемии, врожденные анемии вследствие недостаточной продукции эритроцитов, течение внутриутробных вирусных или бактериальных инфекций, приводящих к развитию анемии. По темпам развития анемия может быть острая и хроническая. В результате анемии у ребёнка развивается общая гипоксия, т.е. недостаточное поступление кислорода к органам и тканям, в том числе к головному мозгу, что может привести к серьёзным последствиям для здоровья малыша. Анемия у детей имеет следующие признаки: бледный кожный покров и слизистые оболочки, одышка, тахикардия. Новорожденные с анемией могут потребовать лечения и наблюдения в условиях отделения реанимации и интенсивной терапии новорожденных, проведения интенсивной терапии. Для диагностики анемии и определения причин проводят развёрнутое исследование крови ребенка, инструментальные методы обследования. Основным лечением тяжелой анемии является переливание компонентов крови (эритроцитов). Для профилактики анемии у новорожденного сразу после рождения проводят отсроченное пережатие или «сцеживание» пуповины. Также необходима организация правильного кормления новорожденных, налаживания режима дня и приема препаратов. Наиболее легкоусвояемое железо содержится в грудном молоке, оно и является лучшей профилактикой анемии у детей, при необходимости назначаются препараты железа (по согласованию с доктором). Очень важно сохранять позитивный настрой и поддерживать грудное вскармливание – эти два фактора являются залогом успеха. После выписки ребенка необходимо контролировать уровень гемоглобина с учетом рекомендаций врача.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.