Внеорганные забрюшинные опухоли
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Злокачественное новообразование забрюшинного пространства и брюшины (C48)
Онкология
Общая информация
Краткое описание
Одобрено
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «14» декабря 2023 года
Протокол №198
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
ВНЕОРГАННЫЕ ЗАБРЮШИННЫЕ ОПУХОЛИ
Код(ы)МКБ-10:
Дата разработки протокола: 2017год/пересмотр 2023 год.
Сокращения, используемые в протоколе:
Категория пациентов: взрослые.
Шкала уровня доказательности:
ВВОДНАЯЧАСТЬ
Код(ы)МКБ-10:
|
Код
|
Название |
| C 48 | Внеорганные забрюшинные опухоли |
| C48.0 | Забрюшинного пространства |
| C48.1 | Уточненных частей брюшины |
|
C48.2
|
Брюшины неуточненной части |
| C48.8 | Поражение забрюшинного пространства и брюшины, выходящее за пределы одной и более вышеуказанных локализаций |
Дата разработки протокола: 2017год/пересмотр 2023 год.
Сокращения, используемые в протоколе:
|
в/в
|
Внутривенно |
| п/к | Подкожно |
| peros | Перорально |
| Гр | Грей |
|
родКТ
|
Компьютерная томография |
| МРТ | магнитно-резонансная томография |
| НЭО | Нейроэндокринные опухоли |
| ОАК | Общий анализ крови |
| ОАМ | Общий анализ мочи |
| ПЭТ | позитронно-эмиссионная томография |
|
РОД
|
Разовая очаговая доза |
| РЭА | Раково-эмбриональный антиген |
| СОД | Суммарная очаговая доза |
| ВЗО | внеорганные забрюшинные опухоли |
| ЗНО | злокачественные новообразования |
|
ТАХЭ
|
трансартериальная химиоэмболизация |
| УЗДГ | Ультразвуковая допплерография |
| УЗИ | Ультразвуковоеисследование |
| ФЭГДС | Фиброэзофагогастродуоденоскопия |
|
TNM
|
Tumor
Nodulus Metastasis
международная классификация стадий злокачественных новообразований
|
Пользователи протокола: врачи-онкологи, химиотерапевты, хирурги, врачи общей практики.
Категория пациентов: взрослые.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с не высоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С |
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+).
Результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++или+), результаты которых не могут быть непосредственно распространены на соответствующую популяцию.
|
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов. |
Классификация
Классификация [9]
TNM И СТАДИРОВАНИЕ
Определение pT
Первичная опухоль (pT): забрюшинное пространство
pTх: первичная опухоль не может быть определена;
pT0: нет признаков первичной опухоли;
pT1: опухоль 5 см и менее в наибольшем измерении;
pT2: опухоль более 5 см, но менее 10 см в наибольшем измерении;
pT3: опухоль более 10 см, но не более 15 см в наибольшем измерении;
Региональные лимфатические узлы (pN)
М – отдаленные метастазы
I. Опухоли мезодермального происхождения
pT4: опухоль более 15 см в наибольшем измерении.
Региональные лимфатические узлы (pN)
pNx: региональные лимфатические узлы не могут быть определены;
pN0: нет метастазов в региональных лимфатических узлах;
pN1: метастазы в региональных лимфатических узлах.
М – отдаленные метастазы
|
Мх
|
недостаточно данных для определения отдаленных метастазов |
| М0 | нет отдаленных метастазов |
| М1 | есть отдаленные метастазы |
Таблица 1. Группировка по стадиям сарком забрюшинного пространства.Стадия
|
Стадия
|
T | N | M | G | Степень злокачественности |
| IA | T1 | N0 | M0 | G1,Gx | Low‑grade |
| IB | T2 | N0 | M0 | G1,Gx | Low‑grade |
| T3 | N0 | M0 | G1,Gx | Low‑grade | |
| T4 | N0 | M0 | G1,Gx | Low‑grade | |
| II | T1 | N0 | M0 | G2,G3 | High‑grade |
| IIIA | T2 | N0 | M0 | G2,G3 | High‑grade |
| IIIB | T3 | N0 | M0 | G2,G3 | High‑grade |
| T4 | N0 | M0 | G2,G3 | High‑grade | |
| ЛюбаяT | N11 | M0 | Любая G | Любой grade | |
| IV | ЛюбаяT | Любое N | M1 | Любая G | Любой grade |
Гистологическая классификация внеорганных забрюшинных опухолей.
Наибольшее распространение получила классификация Ассегmann (1954), который называет разделение опухолей данной локализации условным и в основу его кладет гистогенетический принцип:
I. Опухоли мезодермального происхождения
| Опухоли из жировой ткани: |
• Доброкачественные липомы;
• Злокачественные липосаркомы.
|
| Опухоли из гладких мышц |
• Доброкачественные лейомиома;
• Злокачественные лейомиосаркома
|
| Опухоли из соединительной ткани |
• Доброкачественные фиброма;
• Злокачественные фибросаркома
|
|
Опухоли из поперечных
полосатых мышц
|
• Доброкачественные: рабдомиома;
• Злокачественные: рабдомиосаркома.
|
| Опухоли из кровеносных сосудов |
• гемангиома и ангиосаркома;
• гемангиоперицитома –доброкачественная и злокачественная
|
|
Опухоли из лимфатических
сосудов
|
• доброкачественная лимфангиома;
• злокачественная лимфангиосаркома
|
|
Опухоли из первичной
мезенхимы
|
• доброкачественная миксома;
• злокачественные миксосаркомы
|
|
Опухоли
недифференцированные, неясного происхождения
|
• ксантогранулемы |
II. Опухоли нейрогенного происхождения:
| Опухоли из закладок нервных влагалищ |
• нейрофиброма, без капсулы;
• инкапсулированная нейролеммома;
• злокачественная нейролеммома (злокачественная шваннома).
|
|
Опухоли из тканей
симпатической нервной системы
|
• ганглионеврома;
• симпатобластома;
• нейробластома.
|
| Опухоли из гетеротопных тканей коры надпочечников и хромаффинных тканей |
• рак из клеток надпочечника;
• злокачественная нейромаффинная парагангиома;
• парагангиома;
• активная феохромоцитома.
|
III. Опухоли из эмбриональных остатков почки
|
• Злокачественные и доброкачественные тератомы.
|
| • Хордомы. |
IV. Злокачественные опухоли метастатического характера.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ
Диагностические критерии:
Жалобы и анамнез
Наличие пальпируемого опухолевого образования в животе;
Боли в животе – от тупых, ноющих незначительных болей до сильных, приступообразных;
Желудочный дискомфорт –потеря аппетита, отрыжка, иногда рвота, чувство тяжести в верхней половине живота;
кишечные расстройства –запоры, поносы, чередование запоров с поносами, урчание и вздутие живота;
Нарушение общего состояния больного – общее недомогание, повышенная утомляемость, слабость, похудание, лихорадка, бледность кожных покровов;
Наличие пальпируемой опухоли.
Физикальное обследование:
Данные объективного исследования:
осмотр: бледность кожных покровов, ассиметрия живота;
Лабораторные исследования:
пальпация живота: пальпаторное обнаружение опухоли, зависит от стадии заболевания, анатомической формы роста, напряжения брюшной стенки;
перкуссия живота: притупление над опухолью.
Лабораторные исследования:
Основные исследования:
общий анализ крови –характерны гипохромная анемия, повышение СОЭ, лейкоцитоз;
анализ кала на скрытую кровь – положительная реакция при прорастании опухолью толстой кишки;
коагулограмма – наблюдаются признаки гиперкоагуляции (не всегда).
Дополнительные исследования: нет.
Инструментальные исследования
Основные исследования:
КТ с контрастированием органов брюшной полости, забрюшинного пространства с целью уточнения распространенности опухолевого процесса
МРТ органов малого таза (при локализации или распространении опухоли в малом тазу) - с целью уточнения распространенности опухолевого процесса.
Компьютерная томография органов грудной клетки –для выявления метастазов в легких.
Дополнительные исследования:
УЗИ органов брюшной полости и забрюшинного пространства
ПЭТ-КТ/МРТ–один из наиболее чувствительных и информативных методов для оценки степени распространенности опухолевого процесса малого таза, брюшной полости, забрюшинного пространства, грудной клетки, головного мозга, мягких тканей, костей, выявления «маленьких» опухолей, рецидивов, метастазов.
пункционная биопсия — забор ткани с помощью широкой иглы; процедура проводится под навигационным контролем (УЗИ, КТ, МРТ);
инцизионная биопсия — удаление или забор части новообразования или образца ткани; может быть выполнена, когда пункционная биопсия небезопасна или ее результаты не ясны.
Колоноскопия (для определения степени распространенности процесса).
ФЭГДС (для определения степени распространенности процесса).
Показания для консультации узких специалистов:
Консультация узких специалистов – по показаниям (при сопутствующей патологии).
Консультация эндокринолога при эндокринной патологии (показание и противопоказание к проведению спец. лечения).
Консультация невропатолога, при наличии сопутствующей неврологической патологии (показание и противопоказание к проведению спец. лечения).
Консультация кардиолога, при серлечно-сосудистой патологии (показания и противопоказание к проведению спец. лечения).
Консультация сосудистого хирурга, при патологии сосудистой системы (показание и противопоказание к проведению спец. лечения).
Консультация инфекциониста, при гепатите В, С (показание и противопоказание к проведению спец. лечения).
Диагностический алгоритм:
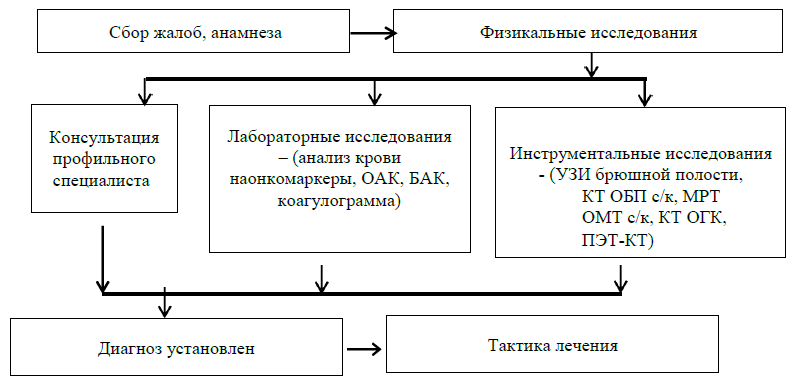
Дифференциальный диагноз
Дифференциальный диагноз
|
Диагноз
|
Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| кисты почек и яичников |
Киста почки - патологическое состояние, при котором происходит аномальное разрастание полого образования.
Размеры полосного образования могут быть мелкие от 1см, до больших -10см в диаметре, быть единичными или
множественными.
Киста яичника – это заполненное жидкостью выпячивание, образующееся на поверхности одного или обоих яичников женщин в большинстве случаев из фолликула. Анатомически киста выглядит как тонкостенная полость в виде мешочка.
Размеры этого образования колеблются от нескольких до15-20 сантиметров в диаметре.
В 90% случаев киста является функциональной, или фолликулярной.
|
УЗИ ОБП и ЗП, МРТ ОБП и ЗП, КТ, ОБП и ЗП,
лапароскопия.
|
наличие внутритканевой кисты |
|
Аневризма
аорты и ее ветвей
|
Аневризма аорты – патологическое локальное расширение участка магистральной артерии, обусловленное слабостью ее стенок. В зависимости от локализации аневризма аорты может проявляться болью в грудной клетке или животе, наличием пульсирующего опухолевидного образования, симптомами компрессии соседних органов: одышкой, кашлем, дисфонией, дисфагией, отечностью и цианозом лица и шеи. | КТ-аортография грудной/брюшной аорты). |
выявление
аневризматического сосуда
|
| Гематомы | Забрюшинные гематомы - образуются чаще всего при переломах костей таза (46,9%), забрюшинно расположенных органов (31,6%), повреждениях позвоночника (21,5%). Как правило, забрюшинные кровоизлияния встречаются при наиболее тяжелых видах травмы у больных с сочетанными повреждениями. | УЗИ ОБП и ЗП, МРТ ОБП и ЗП, КТ ОБП и ЗП. |
Наличие предшествующей травмы и
объемного
забрюшинного образования
|
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ
План лечения ВЗО обсуждается мультидисциплинарной группой на базе специализированных центров и должен учитывать:
• распространенность опухолевого процесса (клиническая стадия течения заболевания);
• объективное состояние пациента;
• прогноз основного заболевания;
• сопутствующую патологию;
• пожелания пациента.
В амбулаторном режиме проводится иммунотерапия ВЗО под контролем врача онколога или химиотерапевта кабинета амбулаторной химиотерапии онкодиспансера. Амбулаторному лечению подлежат пациенты с соматически сохранным качеством жизни по классификационной системе ECOG I-II балла.
Немедикаментозное лечение:
режим больного при проведении консервативного лечения (иммунотерапии) – общий;
диета стол - №15.
Медикаментозное лечение
Амбулаторная противоопухолевая терапия по решению МДГ проводится в кабинете амбулаторной химиотерапии онкологического центра (далее – КАХ) при режимах лечения, не требующих постоянного врачебного контроля.
Показанием для лечения в условиях КАХ является уровень функционального состояния пациента по шкале ECOG 0-1 балл.
Перечень основных лекарственных средств (имеющих 100% вероятность применения)
|
Лекарственная группа
|
Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
|
Ингибитор BCR-ABL тирозинкиназы
|
Иматиниб |
Дозировка и кратность согласно режимам
химиотерапии, в/в
|
А |
|
Противоопухолевое средство, ингибитор протеинтирозинкиназы
|
Сунитиниб |
Дозировка и кратность согласно режимам
химиотерапии перорально
|
А |
| Противоопухолевый препарат, селективный и обратимый ингибитор внутриклеточной тирозинкиназы | Лапатиниб |
Дозировка и кратность согласно режимам
химиотерапии перорально
|
А |
| Противоопухолевое средство, ингибитор протеинтирозинкиназы. | Дазатиниб |
Дозировка и кратность согласно режимам
химиотерапии перорально
|
А |
|
Моноклональные антитела
|
Деносумаб |
Дозировка и кратность согласно режимам
химиотерапии подкожно
|
А |
Перечень дополнительных лекарственных средств (имеющих менее 100% вероятность применения) – нет.
Хирургическое вмешательство: нет.
Дальнейшее ведение:
Режим наблюдения:
• первый год – 1 раз в 3 мес.;
• второй год – 1 раз в 6 мес.;
• в последующем, пожизненно – 1 раз в год.
Объем обследования:
• физикальное;
• лабораторное – ОАК, БАК, ОАМ, коагулограмма.
Основные исследование:
КТ с контрастированием/ органов брюшной полости, забрюшинного пространства;
МРТ органов малого таза (при локализации / распространении опухоли в малом тазу);
КТ ОГК.
Дополнительные исследование:
ПЭТ-КТ/МРТ (по показаниям 1 раз в 6 месяцев);
УЗИ органов брюшной полости и забрюшинного пространства.
Индикаторы эффективности лечения:
полный эффект – исчезновение всех очагов поражения на срок не менее 4-х недель;
частичный эффект – большее или равное 50% уменьшение всех или отдельных опухолей при отсутствии прогрессирования других очагов;
стабилизация – (без изменений) уменьшение менее чем на 50% или увеличение менее чем на 25% при отсутствии новых очагов поражения;
прогрессирование – увеличение размеров одной или более опухолей более 25% либо появление новых очагов поражения.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ
Тактика лечения:
Тактика лечения:
ликвидация опухолевого очага и метастазов;
достижение полной или частичной регрессии, стабилизации опухолевого процесса.
По стадиям лечения:
Стадия Ia (Т1bN0, NXM0, низкая степень злокачественности): хирургическое удаление опухоли.
Стадия Ib (Т2bN0, NXM0, низкая степень злокачественности): хирургическое удаление опухоли + послеоперационная лучевая терапия на область резидуальной опухоли в СОД 60–70Гр, РОД 2 Гр (при R1,R2).
Стадии II–III (Т1b–Т2bN0, N1M0, высокая степень злокачественности): хирургическое удаление опухоли (при N+ выполняется лимфодиссекция) + послеоперационная лучевая терапия (СОД40–50Гр, РОД2Гр) + 3–4курса
адъювантной химиотерапии (при чувствительных гистологических типах опухоли).
Широкое иссечение опухоли в пределах здоровых тканей с учетом принципов футлярности и зональности является стандартом хирургического вмешательства.
При R1, R2 суммарная очаговая доза лучевой терапии на область резидуальной опухоли должна быть увеличена до60–70Гр (без превышения толерантных доз на здоровые органы и ткани).
При сомнении в резектабельности или нерезектабельной опухоли проводится курс лучевой терапии в СОД 40–50Гр в режиме классического фракционирования и/или 2–3 курса химиотерапии (предпочтительнее в условиях общей или регионарной гипертермии).
При сохранении нерезектабельности опухоли проводится лучевая терапия
до СОД 60–70 Гр за весь курс лечения ± 3–4 курса химиотерапии (схема лечения определяется исходя из оценки эффективности неоадъювантной химиотерапии по данным компьютерной томографии или ультразвукового исследования).
Стадия IV(любая Т и NM1,любая степень злокачественности):
паллиативное лечение по индивидуальным программам с включением химиотерапии и/или лучевой терапии, в том числе в модифицированных условиях (общая и регионарная гипертермия);
хирургические вмешательства для уменьшения опухолевой массы и ликвидации симптомов опухолевой компрессии.
NB! при резектабельной опухоли и наличии одиночных и единичных метастазов в отдаленных органах – циторедуктивная операция с одномоментным или отсроченным удалением метастазов.
Абляция, эмболизация используются также для минимизации симптомов, связанных с наличием опухоли (боль, кровотечение, компрессия нервных структур и т. д.).
Трансартериальная химиоэмболизация (ТАХЭ)
◊ ТАХЭ включает доставку эмболических агентов в печеночные артерии, снабжающие опухоль печени, с целью стаза сосудов.
◊ ТАХЭ можно рассматривать для лечения метастазов саркомы печени у пациентов с нерезектабельным заболеванием печени или у пациентов с заболеванием, которое не поддается традиционной терапии.
Было показано, что местное абляционное лечение улучшает общую выживаемость у пациентов с олигометастатическим заболеванием.
Критерии резектабельности метастазов в печени – отсутствие нерезектабельных экстрапеченочных метастазов, функциональная переносимость и отсутствие сопутствующих заболеваний в стадии суб–и декомпенсации, возможность удаления всех метастазов с клиренсом не менее 0,1 см без опухолевого роста и поражение менее 70% или 6 сегментов печени.
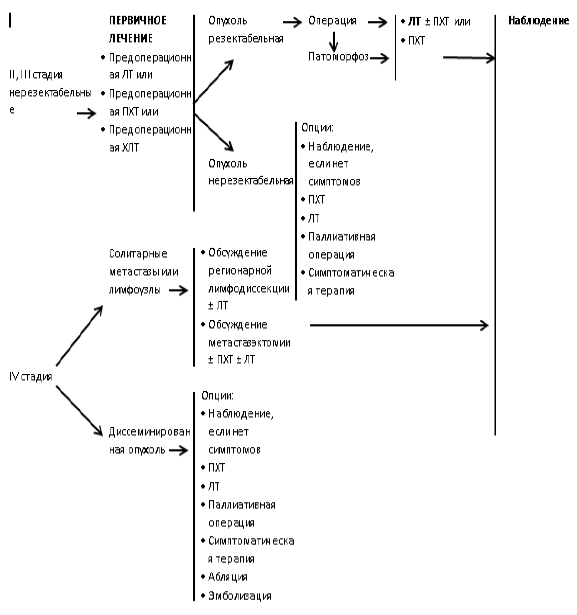
Карта наблюдения пациента, маршрутизация пациента
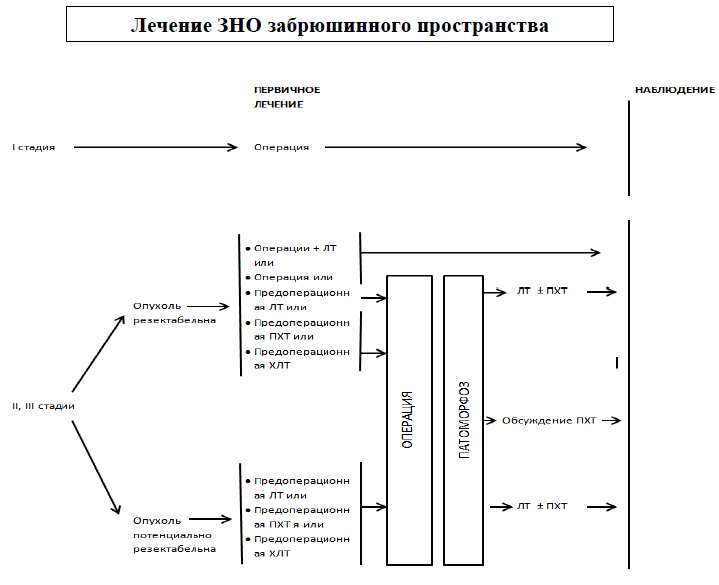
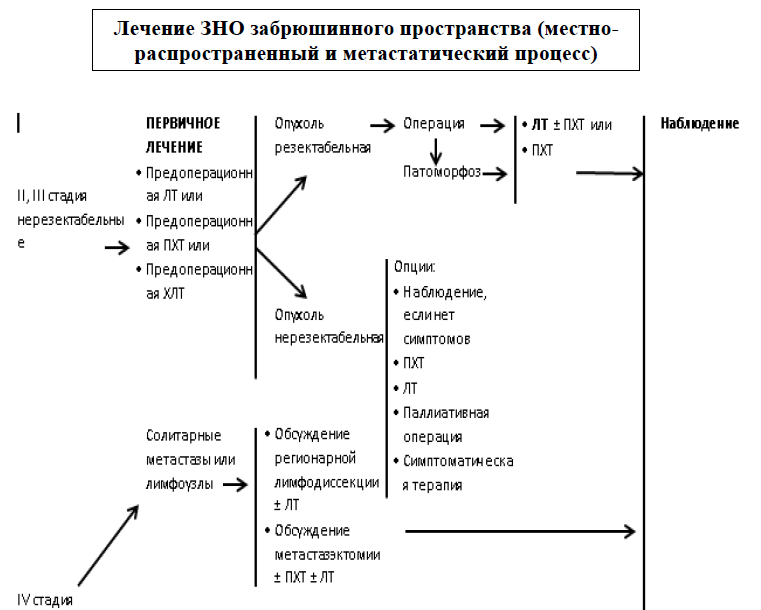

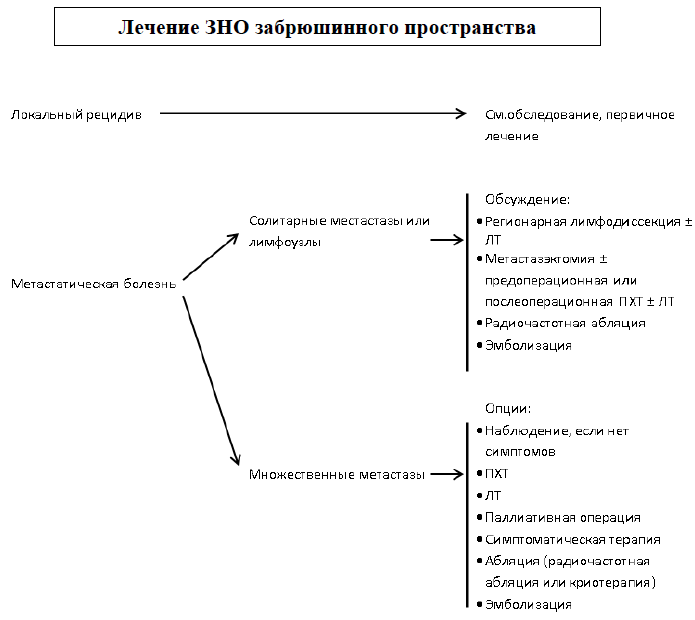
Медикаментозное лечение:
Химиотерапия нейроэндокринных опухолей:
Режимы химиотерапии сарком, монотерапия:
Карта наблюдения пациента, маршрутизация пациента





Немедикаментозное лечение
Режим – больного при проведении консервативного лечения – общий. В ранний послеоперационный период – постельный или полупостельный (в зависимости от объема операции и сопутствующей патологии). В послеоперационном периоде – палатный.
Диета – Стол №1 после хирургического лечения, затем переход на Стол №2.
Лучевая терапия:
Послеоперационная лучевая терапия показана при степени местного распространения соответствующей St Ib – St IV.
Проводится послеоперационная лучевая терапия на область резидуальной опухоли в СОД 60–70Гр, РОД2Гр (при R1, R2).
При сомнении в резектабельности или нерезектабельной опухоли проводится курс лучевой терапии в СОД40–50Гр в режиме классического фракционирования.
Лучевая терапия проводится в конвенциальном (стандартном) или конформном режиме облучения в статическом многопольном режиме РОД 2-2,5-3,0 Гр до СОД 40-60Гр на зону врастания опухоли. При проведении лучевой терапии возможно применение препаратов, защищающих организм от лучевого повреждения.
Облучение проводят на гамма-терапевтических аппаратах или линейных ускорителях.
Медикаментозное лечение:
Химиотерапия нейроэндокринных опухолей:
Химиотерапия назначается при невозможности хирургического лечения, после циторедуктивных операций.
Функционирующие НЭО G1-G3: аналоги соматостатина (симптоматическая терапия):
Октреотид 0,1 мгп/к, 3 раза в сутки в течение короткого периода времени (примерно 2 недели) с целью оценки его эффективности и общей переносимости затем октреотид ЛАР20 мг внутримышечно 1 раз в 28 дней.
Если в течение 3 месяцев обеспечивается адекватный контроль клинических проявлений и биологических маркеров заболевания–октреотид ЛАР 10 мг, внутримышечно1 раз/28 дней.
Если в течение 3 месяцев обеспечивается только частичный контроль клинических проявлений и биологических маркеров заболевания – октреотид ЛАР 30 мг внутримышечно каждые 4 недели.
Распространенные нейроэндокринные опухоли толстой кишки или с неизвестной локализацией первичной опухоли – октреотид ЛАР 30 мг внутримышечно 1 раз/28 дней до прогрессирования.
Нефункционирующие НЭО:
Ki67<2-10%, G1/G2:
Аналоги соматостатина;
α-ИФН;
Эверолимус 10мг внутрь ежедневнодо прогрессирования;
Эверолимус10мг внутрь ежедневно в комбинации с Октреотид ЛАР 1раз / 28дней, до прогрессирования Ki 67 3-20%, G1/G2:
Фторурацил + Эверолимус;
Темозоломид + Капецитабин;
аналоги соматостатина. Ki67>20%, G3:
карбоплатин / цисплатин + этопозид;
темозоломид + бевацизумаб;
аналоги соматостатина.
Практические рекомендации по лекарственному лечению гастроинтестинальных стромальных опухолей (GIST)
Лечение нерезектабельных опухолей при рецидиве или метастатической болезни.
Терапия второй линии:
Терапия первой линии:
При нерезектабельных опухолях, рецидиве или метастатической болезни основной метод лечения – таргетная терапия иматинибом 400 мг в сутки. При выявлении мутации в 9-м экзоне гена KIT рекомендован иматиниб 800 мг в сутки (достоверно увеличивает время до прогрессирования без статистически значимого улучшения общей выживаемости [2]). При прогрессировании на фоне приема Иматиниба в дозе 400 мг в сутки показана эскалация дозы до 800 мг в сутки. При исходно нерезектабельных опухолях у больных с эффектом в результате терапии целесообразна оценка возможности радикального хирургического лечения через 6 – 12 месяцев после начала терапии.
Терапия второй линии:
При прогрессировании заболевания на фоне приема Иматиниба (после эскалации дозы с 400 до 800 мг), непереносимости Иматиниба либо первичной резистентности показана терапия сунитинибом: 50мг в сутки, 4 недели с двухнедельным перерывом. При выраженных побочных эффектах допустимо снижение дозы до37,5 мг в сутки.
Саркомы забрюшинного пространства
Распространенный опухолевый процесс – стадия III–IV:
Химиотерапия является основным методом лечения диссеминированного процесса при саркомах. Наиболее часто используются доксорубицин, ифосфамид, дакарбазин. Стандартом химиотерапии диссеминированных сарком первой линии является комбинированный режим доксорубицин + ифосфамид. Для пациентов старше 65лет методом выбора является монотерапия антрациклинами. При общем хорошем состоянии комбинированная химиотерапия предпочтительнее, когда ожидается выраженный эффект со стороны опухоли. При поверхностных ангиосаркомах альтернативой является назначение таксанов, показавших высокую противоопухолевую активность при данном гистологическом типе. Паклитаксел показал высокую эффективность в терапии местнораспространенных ангиосарком, в частности ассоциированных с синдромом Стюарта-Тривса.
В качестве >2 линии в лечении липосарком, лейомиосарком, синовиальной и экстраоссальной формы саркомы Юинга может быть использован Трабектедин. Также во вторую и более линии для большинства гистологических подтипов, за исключением липосарком и GIST, может быть использован Пазопаниб. Для липосарком возможно использование Эрибулина. Гемцитабин показал наличие противоопухолевой активности в качестве единственного противоопухолевого агента и при лейомиосаркоме. Дакарбазин, назначенный в качестве второй линии химиотерапии, также обладает некоторой противоопухолевой активностью (вероятно, более всего в лечении лейомиосаркомы). Пазопаниб используется в качестве второй и более линий для лечения большинства гистологических подтипов, однако для химиорезистентных гистотипов (альвеолярная саркома, светлоклеточная саркома, солитарная фиброзная опухоль / гемангиоэндотелиома) должен применяться в первую линию лечения.
Наблюдение у больных, закончившим этап комбинированного лечения, динамическое наблюдение проводится каждые 3 месяца в течение первых 2 лет, далее раз в 6 месяцев до 5лет.
Режимы химиотерапии сарком, монотерапия:
доксорубицин30 мг/м2, в/в, с1-го по 3-й день;
доксорубицин 60–75 мг/м2, в/в,1 раз в 3 недели;
ифосфамид 1,6–2,5 г/м2/сут, в течение 5 дней с уропротектором Месной из расчета 20% + 100% от дозы Ифосфамида одновременно с ним.
Гемцитабин 1200 мг/м2 за ≥ 120 мин в 1-й и 8-й дни каждые 21 день с фиксированной скоростью инфузии (только для лейомиосарком матки при невозможности использовать режим GemTax);
Трабектидин1,5мг/м2 в/в в виде 24-часовой инфузии 1раз в 21день в качестве второй линии в лечении липосарком, лейомиосарком, синовиальных сарком и экстрооссальной формы семейства Юинга;
Пазопаниб 800мг per os ежедневно в качестве второй линии в лечении СМТ за исключением липосарком и GIST, контроль эффективности после 2 месяцев приема.
Полихимиотерапия:
AI:
- доксорубицин 75 мг/м2, в виде72-часовой инфузии;
- ифосфамид 2,5 гр/м2,в/в в виде 3-часовой инфузии, в1-й–4-й дни;
- месна 500мг/м2, в1-йдень вместе с ифосфамидом, далее1500 мг/м2 в виде 24-часовой инфузии в течение 4 дней;
- филграстим п/к в 5-й–15-й дни или до восстановления уровня нейтрофилов. Интервал 3 недели.
MAID:
- месна ОД 8000 мг/м2 в виде 96-часовой инфузии (2000 мг/м2/сутки, 4 дня);
- доксорубицин 60мг/м2 в виде 72-часовой инфузии в/в;
- ифосфамид 6000мг/м2 в виде 72-часовой инфузии и липо 2000 мг/м2 в/в в виде 4-часовой инфузии в 1-й –3-й дни;
- дакарбазин 900 мг/м2 в виде 72-часовой инфузии, растворенный вместе с доксорубицином;
Интервал 3–4 недели.
ADIC:
- доксорубицин 90мг/м2 в виде 96-часовой инфузии в/в;
- дакарбазин 900мг/м2 в виде 96-часовой инфузии, растворенный вместе с Доксорубицином.
Интервал 3–4 недели.
Режимы химиотерапии при рабдомиосаркоме:
VAI:
- винкристин ОД 2 мг в 1-йдень;
- доксорубицин 75 мг/м2 в виде 72-часовой инфузии;
- ифосфамид 2,5 гр/м2 в/в в виде 3-часовой инфузии в 1-й–4-й дни;
- месна 500 мг/м2 в 1-й день вместе с ифосфамидом, далее –1500мг/м2 в виде 24-часовой инфузии в течение 4 дней;
- филграстим п/к в 5-й–15-й дни или до восстановления уровня нейтрофилов. Интервал – 3недели.
VAC:
- винкристин 2мг/м2, в 1-й и 8-й дни в/в, интервал – 5 недель;
- дактиномицин* 0,5мг/м2, в1-й, 2-й, 3-й, 4-й,5-й дни (повторять каждые 3 месяца, до5 курсов);
- циклофосфамид 300 мг/м2, ежедневно в течение 7 дней каждые 6недель.
VAdriaC:
- винкристин 1,5мг/м2, в1-й,8-й,15-й дни в течение первых 2 курсов, далее только в 1-й день;
- доксорубицин 60 мг/м2, в виде 48-часовой инфузии;
- циклофосфамид 600 мг/м2, в течение 2 дней. Интервал – 3недели.
И далее:
- ифосфамид 1800 м/м2 + месна в течение 5 дней;
- этопозид 100мг/м2 в 1-й– 5-й дни. Интервал– 3недели.
Таргетные препараты:
- иматиниб по 400 мг в день внутрь постоянно для лечения агрессивного фиброматоза.
Перечень основных лекарственных средств (имеющих 100% вероятность применения)
Саркомы с высоким уровнем мутационной нагрузки (TMB-H (≥10 mutations/megabase) Tumors) – иммунотерапия:
- Пембролизумаб 200 мг каждые 3 недели или 400 мг каждые 6 недель - длительность лечения определяется мультидисциплинарной группой.
- Ниволумаб + ипилимумаб*: ниволумаб 240 мг в/в кап каждые 2 недели, ипилимумаб* 1 мг/кг в/в кап каждые 6 недель (ипилимумаб* не более 4х введений).*
*- показания к иммунотерапии при лечении сарком не зарегистрированы в РК.
Перечень основных лекарственных средств (имеющих 100% вероятность применения)
|
Лекарственная группа
|
Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
|
Противоопухолевые антибиотики – антрациклины
|
Доксорубицин | 75 мг/м2 , в/в 1-4 дни | А |
|
Алкилирующие агенты – хлорэтиламины
|
Ифосфамид | 2,5 гр/м2 , в/в 1-4 дни | А |
|
Антиметоболиты – аналоги цитидина.
|
Гемцитабин | 90 мг/ м2, в/в 1 и 8 дни | А |
|
Алкалоиды растительного происхождения и другие препараты естественного происхождения микротрубочковые ингибиторы
|
Трабектидин | 1,5 мг/ м2, в/в раз в 3 недели | А |
| Антидот акролеина |
Месна
|
100-120% дозы ифосфамида в/в | А |
|
Алкилирующие агенты- триазины
|
Дакарбазин | 750 мг/м2 суммарно в/в, непрерывная инфузия 72 ч | А |
|
Алкилирующие агенты – хлорэтиламины
|
Циклофосфамид | 300 мг/ м2 , в/в 1 день | А |
|
Ингибиторы топоизомеразы 11
|
Этопозид | 100 мг/м2, в/в 1-3 дни | А |
|
Алкалоид барвинка
|
Винкристин | 1,5 мг/м2, в/в 1 день | В |
|
Аналог соматостатина
|
Октреотид | 0,1 мг п/к, 3 раза в сутки, 2 недели | В |
|
Иммунодепрессант, ингибитор передачи пролиферативного сигнала
|
Эверолимус | 10 мг внутрь ежедневно до прогрессирования | А |
|
Антиметаболит
|
Фторурацил | 400 мг/ м2 в/в; 2400 мг/м2 в/в | А |
|
Алкилирующее соединение
|
Темозоломид | 150 мг/ м2 внутрь | А |
| Алкилирующие агенты – комплексные соединения платины | Карбоплатин | AUC 5 в/в 1 день | В |
| Цисплатин | 75 мг/ м2 в/в 1 день | В | |
| Моноклональные антитела к факторам роста и их рецепторам |
Бевацизумаб
|
5-7,5 мг/кг в/в раз в 3 недели | А |
|
Микротрубочковые ингибиторы – таксаны
|
Паклитаксел | 80 мг/ м2 в/в 1 день | А |
| Антагонисты пиримидина – фторпиримидины | Капецитабин | 2500 мг/ м2 внутрь 1-14 дни | А |
| Ингибитор протеинкиназ | Пазопаниб | 800 мг 1 раз в день внутрь | А |
Перечень дополнительных лекарственных средств (имеющих менее 100% вероятность применения)
|
Лекарственная группа
|
Международное непатентованное наименование ЛС | Способ применения | Уровень доказательности |
|
Ингибитор BCR-ABL тирозинкиназы
|
Иматиниб | 400 мг внутрь ежедневно | А |
| Противоопухолевое средство, ингибитор протеинтирозинкиназы |
Сунитиниб
|
37,5 мг внутрь ежеденевно | А |
| Противоопухолевый препарат, селективный и обратимый ингибитор внутриклеточной тирозинкиназы |
Лапатиниб
|
1250 мг внутрь ежедневно | А |
| Противоопухолевое средство, ингибитор протеинтирозинкиназы |
Дазатиниб
|
100 мг внутрь | А |
|
Моноклональные антитела
|
Деносумаб | 120 мг каждые 4 недели п/к | В |
| Иммуноонкологический препарат, ингибитор PD-1, гуманизированное моноклональное антитело |
Пембролизумаб
|
200 мг каждые 3 недели или 400 мг каждые 6 недель | А |
| Иммуноонкологический препарат, гуманизированное моноклональное антитело |
Ниволюмаб*
|
ниволумаб 240 мг в/в каждые 2 недели | А |
| Иммуноонкологический препарат, гуманизированное моноклональное антитело |
Ипилимумаб*
|
1 мг/кг в/в каждые 6 недель (не более 4х введений) | В |
| Противоопухолевое средство галихондриновой группы, ингибитор динамики микротрубочек нетаксанового ряда |
Эрибулин
|
1.4 мг/м2 в 1-й и 8-й дни каждого 21-дневного цикла | А |
|
Противоопухолевые антибиотики актиномицины
|
Дактиномицин* | 0,5 мг/ м2, в/в 1-5 дни | В |
| КСФ | Эпоэтинальфа |
40 тысяч МЕ, 3 раза в неделю, по показаниям в течение 1 месяца, подкожно, внутривенно
|
С |
| КСФ |
Дарбопоэтин альфа
|
2,25 мкг/м2 1 раз в 7 дней в течение 9 недель, подкожно
|
С |
| КСФ | Филграстим |
30 млн ЕД,
ежедневно по показаниям,
подкожно
|
С |
Хирургическое вмешательство:
Основным методом лечения внеорганных забрюшинных опухолей является хирургический.
Цель: радикальное, либо циторедуктивное удаление опухоли.
Название вмешательства: тотальное или субтотальное удаление опухоли.
Показания к вмешательству: наличие внеорганного забрюшинного образования.
Противопоказания к вмешательству: тяжелая сопутствующая патология в стадии декомпенсации.
Методика проведения: полное или частичное удаление образования в пределах анатомической области.
Режим наблюдения:
Объем обследования:
Дальнейшее ведение
Наблюдение:
Режим наблюдения:
первый год – 1раз в3 мес.;
второй год – 1 раз в 6 мес.;
в последующем, пожизненно – 1 раз в год.
Объем обследования:
• физикальное;
• лабораторное – ОАК, БАК, ОАМ, коагулограмма;
Основные:
Другие методы исследования (ФЭГДС, ФКС и т.д.) и консультации специалистов (гинеколог, уролог и др.) по показаниям.
Индикаторы эффективности лечения:
Основные:
КТ с контрастированием/ органов брюшной полости, забрюшинного пространства;
МРТ органов малого таза (при локализации/распространении опухоли в малом тазу);
КТ ОГК
Дополнительные:
ПЭТ-КТ/МРТ (1 раз в 6 месяцев по показаниям).
УЗИ органов брюшной полости и забрюшинного пространства
Другие методы исследования (ФЭГДС, ФКС и т.д.) и консультации специалистов (гинеколог, уролог и др.) по показаниям.
Индикаторы эффективности лечения:
Удовлетворительное состояние при условии отсутствия осложнений и заживления послеоперационной раны;
данные, свидетельствующие об отсутствии признаков прогрессирования процесса, полученные клиническими и/или визуализирующими методами исследования, а также повышение качества жизни больного.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ
Показания для плановой госпитализации:
подозрение или верифицированное внеорганное забрюшинное образование, II клиническая группа.
Показания для экстренной госпитализации:
острая кишечная непроходимость;
внутреннее кровотечение;
болевой синдром.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- 1) Клинические рекомендации ESMO2023 https://www.esmo.org/guidelines 2) NCCN guidelines 2015 http://www.nccn.org/professionals/physician 3) WHO Classification of Tumours of Soft Tissue and Bone 4th Edition, IARS, Lyon, 2013 4) Злокачественные опухоли мягких тканей и меланома кожи: И. А. Гилязутдинов,Р. Ш. Хасанов, И. Р. Сафин, В. Н. Моисеев — Москва, Практическая Медицина,2010 г.-204с. 5) Переводчикова Н.И. Руководство по химиотерапии опухолевых заболеваний 2022г. 6) Цвелодуб С.В., Стилиди И.С. Лейомиосаркома нижней полой вены: обзор литературы. Часть I. Анналы хирургии 2013;1:5–9. 7) Стилиди И.С., Никулин М.П., Давыдов М.М. и др. «Нефросохранные» операции в лечении больных внеорганными забрюшинными опухолям. Анналы хирургии 2014;(3):47–52. 8) Trans-Atlantic RPS Working Group. Management of primary retroperitoneal sarcoma (RPS) in the adult: a consensus approach from the Trans-Atlantic RPS Working Group. Ann Surg Oncol 2015;22:256–63. 9) Palassini E., Ferrari S., Verderio P. et al. Feasibility of preoperative chemotherapy with or without radiation therapy in localized soft tissue sarcomas of limbs and superficial trunk in the Italian Sarcoma Group/Grupo Espanol de Investigacion en Sarcomas randomized clinical 48 trial: three versus five cycles of full-dose epirubicin plus ifosfamide. J Clin Oncol 2015;33:3628–34. 10) WHO Classification of Tumours of Soft Tissue and Bone 7th edition. Lyon: IARS, 2013. 11) Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, Dancey J, Arbuck S, Gwyther S, Mooney M et al: New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2014, 45(2):228-247. 12) WHO Classification of Tumours of Soft Tissue and Bone 4th Edition, IARS, Lyon, 2013 13) Е.Ф. Лушников «Лечебный патоморфоз злокачественных новообразований человека», Обнинск, 2016 14) Стилиди И.С. «Нефросохранные» операции в лечении больных неорганными забрюшинными опухолям / И.С. Стилиди, М.П.Никулин, М.М. Давыдов и др// Анналы хирургии. – 2014, № 3 – С.47-52. 15) P. G. Casali, N. Abecassis, S. Bauer, R. Biagini, S. Bielack, S. Bonvalot, I. Boukovinas, et al. Soft tissue and visceral sarcomas: ESMO–EURACAN Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology, Volume 29, Issue Supplement_4, October 2018, Pages iv51–iv67. 16) Hull MA, Niemierko A, Haynes AB, et al. Post-operative renal function following nephrectomy as part of en bloc resection of retroperitoneal sarcoma (RPS). J Surg Oncol. 2015;112:98–102., 23. 17) Кит О.И., Максимова Н.А., Агаркова Е.И., Ильченко М.Г.. «Применение комплексной ультразвуковой диагностики и динамической реносцинтиграфии у пациентов с опухолевым поражением почки в предоперационном периоде при планировании хирургического лечения». Современные проблемы науки и образования. 2015. № 6. С. 200. 18) Стилиди, И.С. Ангиопластика в хирургическом лечении больных забрюшинными неорганными саркомами / И.С. Стилиди, М.Г.Абгарян, М.П. Никулин и др.// Хирургия. – 2017. –, №5. – С.14-18 26. 19) Стилиди, И.С. Резекция и протезирование бифуркации аорты по поводу забрюшинной гломусной опухоли/ И.С. Стилиди, М.П. М.Г. Абгарян, В.Ю. Бохян и др. // Онкология. Журнал им.П.А.Герцена. – 2017. – №1 – С.53-56. 20) Von Mehren M, Randall RL, Benjamin RS, Boles S, Bui MM, Ganjoo KN, George S, Gonzalez RJ, Heslin MJ, Kane JM, Keedy V, Kim E, Koon H, Mayerson J, McCarter M, McGarry SV, Meyer C, Morris ZS, O'Donnell RJ, Pappo AS, Paz IB, Petersen IA, Pfeifer JD, Riedel RF, Ruo B, Schuetze S, Tap WD, Wayne JD, Bergman MA, Scavone JL. Soft Tissue Sarcoma, Version 2.2018, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2018 May;16(5):536-563 33. 21) Каприн А.Д., Рябов А.Б., Хомяков В.М. и др. Резекция нижней полой вены при местнораспространенных неорганных забрюшинных опухолях. Онкология. Журнал им. П.А. Герцена. 2017;6(1):28-38. 22) Palassini E, Ferrari S, Verderio P et al. Feasibility of preoperative chemo- therapy with or without radiation therapy in localized soft tissue sarcomas of limbs and superficial trunk in the Italian Sarcoma Group/Grupo Espan~ol de Investigacio ́n en Sarcomas randomized clinical trial: three versus five cycles of full-dose epirubicin plus ifosfamide. J Clin Oncol 2015; 33: 3628–3634. 36. 23) Gronchi A, Ferrari S, Quagliuolo V et al. Histotype-tailored neoadjuvant chemotherapy versus standard chemotherapy in patients with high-risk soft-tis- sue sarcomas (ISG-STS 1001): an international, open-label, andomized, controlled, phase 3, andomized trial. Lancet Oncol 2017; 18: 812–822
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков протокола:
1) Джуманов Абай Игликович – докторант PhD, Руководитель Центра абдоминальной онкологии АО «Казахский научно-исследовательский институт онкологии и радиологии» врач онколог-хирург.
2) Курманалиев Аль-Фараби Канатович – химиотерапевт «Центра опухолей костей, мягких тканей и меланом» АО «Казахский научно-исследовательский институт онкологии и радиологии».
3) Туркпенова Иннара Талгатовна – врач-химиотерапевт Центра абдоминальной онкологии АО «Казахский научно – исследовательский институт онкологии и радиологии».
4) Ким Виктор Борисович – доктор медицинских наук, Руководитель Центра общей радиологии, Председатель радиологического совета АО «Казахский научно – исследовательский институт онкологии и радиологии».
5) Кузикеев Марат Анатольевич – доктор медицинских наук, заместитель директора по науке и инновационным технологиям «Многопрофильный медицинский центр» Управление общественного здравоохранения акимата города Астаны.
6) Макаров Валерий Анатольевич – докторант PhD, заведующий хирургическим отделением «Алматинской региональной многопрофильной клиники».
7) Тулегенов Марат Асанбаевич – заместитель руководителя по онкологии ГКП на ПХВ «Областная клиническая больница» Управление здравоохранения Туркестанской области.
8) Рахманбердиева Эльвира Жайдаровна – врач, клинический фармаколог АО «Казахский научно – исследовательский институт онкологии и радиологии».
Указание на отсутствие конфликта интересов: нет.
Рецензенты:
1) Ижанов Ерген Бакчанович – доктор медицинских наук, профессор кафедры онкологии, ассистент кафедры онкологии НАО «Казахский национальный медицинский университет имени С.Д.Асфендиярова».
2) Хожаев Арман Айварович – доктор медицинских наук, профессор кафедры онкологии НАО «Казахский национальный медицинский университет имени С.Д.Асфендиярова».
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его разработки или при наличии новых методов с уровнем доказательности.
Приложение 1
Оценка общего состояния больного с использованием индекса Карновского
|
Нормальная физическая активность, больной не нуждается в специальном уходе
|
100
баллов
|
Состояние нормальное, нет жалоб и симптомов заболевания. |
|
90
баллов
|
Нормальная активность сохранена, но имеются незначительные симптомы заболевания. | |
|
80
баллов
|
Нормальная активность возможна при
дополнительных усилиях, при умеренно выраженных симптомах заболевания.
|
|
|
Ограничение нормальной активности при сохранении полной независимости больного
|
70
баллов
|
Больной обслуживает себя самостоятельно, но неспособен к нормальной деятельности или работе |
|
60
баллов
|
Больной иногда нуждается в помощи, но в основном обслуживает себя сам. | |
|
50
баллов
|
Больному часто требуется помощь и медицинское обслуживание. | |
|
Больной не может обслуживать себя самостоятельно, необходим уход или госпитализация
|
40
баллов
|
Большую часть времени больной проводит в постели, необходим специальный уход и посторонняя помощь.
|
|
30
баллов
|
Больной прикован к постели, показана
госпитализация, хотя терминальное состояние необязательно.
|
|
|
20
баллов
|
Сильные проявления болезни, необходима госпитализация и поддерживающая терапия. | |
|
10
баллов
|
Умирающий больной, быстрое прогрессирование заболевания. | |
|
0 баллов
|
Смерть. |
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.