Бронхолегочная дисплазия
 Версия: Клинические рекомендации РФ 2024 (Россия)
Версия: Клинические рекомендации РФ 2024 (Россия)
Общая информация
Краткое описание
Разработчик клинической рекомендации:
- Ассоциация Здоровье детей
- Ассоциация специалистов в области перинатальной медицины, оказания помощи беременной женщине и плоду, новорожденному и ребенку в возрасте до 3-х лет (АСПМ+)
- Национальная ассоциация детских реабилитологов
- Общероссийская общественная организация «Союз педиатров России»
- Общероссийская общественная организация содействия развитию неонатологов «Российское общество неонатологов» (РОН)
- Российская ассоциация специалистов перинатальной медицины (РАСПМ)
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968 с изменения, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 января 2024 года – с 1 января 2025 года.
Год утверждения: 2024
Статус: Действует
ID: 377
Код по МКБ-10 – Р27.1 – Бронхолегочная дисплазия, возникшая в перинатальном периоде.
Классификация
Таблица 2. Классификация БЛД по тяжести [47].
|
Степень тяжести БЛД |
Диагностические критерии для детей различного гестационного возраста при рождении |
|
|---|---|---|
|
|
Гестационный возраст |
|
|
< 32 нед |
≥ 32 нед2 |
|
|
Время и условия оценки |
||
|
36 нед ПКВ или выписка домой (что наступит раньше) |
От 28 до 56 дней после рождения или при выписке домой (что наступит раньше) |
|
|
Терапия О2 более 21% в течение 28 суток1 |
||
|
Легкая БЛД |
Дыхание комнатным воздухом в 36 нед или при выписке |
Дыхание комнатным воздухом на 56-й день или при выписке |
|
Среднетяжелая БЛД |
Потребность в О2 ˂ 30% в 36 нед или при выписке |
Потребность в О2 ˂ 30% на 56-й день жизни или при выписке |
|
Тяжелая БЛД |
Потребность в кислороде > 30% и/или PPV, NCPAP в 36 нед ПКВ или при выписке |
Потребность в О2 > 30% и/или PPV, NCPAP на 56-й день жизни или при выписке |
1За одни сутки лечения принимают оксигенотерапию продолжительностью не менее 12 час
2В данную классификацию включены дети ГВ ≥ 32 недель, в настоящее время развитие БЛД у младенцев ГВ ≥ 33 недели отмечается крайне редко.
В 2016 г, NICHD (США) предложена новая классификация БЛД, учитывающая новые методы неинвазивной ИВЛ, не включенные в предыдущие определения. Предлагается использовать новые термины: «степень тяжести I,II,III», при этом степень III относится к наиболее тяжелой форме БЛД (табл. 3).
Таблица 3. Предполагаемые уточнения для определения степени тяжести БЛД (в 36 недель ПКВ) [1].
|
Степень тяжести |
Инвазивная IPPV1 |
NCPAP, NIPPV или назальные канюли со скоростью потока > 3 л/мин |
Назальные канюли со скоростью потока от 1 до˂3 л/мин |
Подача кислорода |
Скорость потока через назальные канюли ˂ 1 л/мин |
|---|---|---|---|---|---|
|
I |
- |
21 |
22-29 |
22-29 |
22-70 |
|
II |
21 |
22 - 29 |
>30 |
>30 |
>70 |
|
III |
>21 |
>30 |
- |
- |
- |
|
III (A) |
Ранняя смерть (между 14 днями постнатального возраста и 36 неделями ПКВ), обусловленная стойким паренхиматозным по-ражением легких и дыхательной недостаточностью, не связанная с другими причинами (такими как, некротизирующий энтеро-колит, внутрижелудочковые кровоизлияния, сепсис и т.д.) |
|
|
|
|
1 - исключая новорожденных, которым ИВЛ проводится по поводу первичного заболевания дыхательных путей или заболеваний, связанных с поражением дыхательного центра, нервно-мышечными заболеваниями. Концентрации O2 указана в %.
В клинической работе допустимо использование обеих классификаций (одна дополняет другую).
К осложнениям относят хроническую ДН, легочную гипертензию (ЛГ), системную артериальную гипертензию и другие (табл. 4) [48].
Таблица 4. Осложнения бронхолегочной дисплазии и их диагностические критерии
|
Осложнение |
Определение, диагностические критерии |
|---|---|
|
Хроническая дыхательная недостаточность |
I степени при SpО2 90-94%, II степени при SpО2 75-89%, III при SpО2 ниже 75% |
|
Белково-энергетическая недостаточность |
Масса тела ниже 10 перцентиля по оценочным перцентильным таблицам физического развития Intergrowth-21 |
|
Легочная гипертензия |
При проведении допплер-эхокардиографии систолическое давление в легочной артерии ≥36 мм рт. ст. (старше 3 мес. скорректированного возраста) или выше 1/3 от системного систолического артериального давления, косвенные эхокардиографические признаки легочной гипертензии ИЛИ среднее давление выше 20 мм рт. ст. при катетеризации правых отделов сердца |
|
Легочное сердце |
Гипертрофия, дилатация правых отделов сердца при эхокардиографии |
|
Системная артериальная гипертензия |
Артериальное давление выше 95 перцентиля по перцентильным таблицам артериального давления1 |
1 - Приложение А3.2. Значения систолического, диастолического и среднего артериального давления у недоношенных детей в зависимости от постконцептуального возраста (95-й процентиль, мм рт.ст).
В настоящее время при формулировке диагноза выделение формы заболевания (классическая или новая БЛД) представляется нецелесообразным, так как в практической деятельности точное разделение данных форм затруднительно. В постнеонатальном периоде диагноз БЛД устанавливается до достижения ребенком возраста 2 лет, после этого возраста при формулировке диагноза заболевание указывается как имевшее место в анамнезе.
Этиология и патогенез
Почти 80% младенцев, родившихся на 22–24 неделе беременности, имеют диагноз БЛД [15], тогда как среди рожденных на 28 неделе беременности заболевают БЛД только 20%. Среди младенцев с БЛД 95% имеют ОНМТ при рождении [16]. К другим перинатальным факторам риска относят задержку развития плода, [17] мужской пол, хориоамнионит, расовую или этническую принадлежность [9,12,17], а также курение [18,19].
Экзогенные факторы риска развития БЛД включают в себя использование агрессивной респираторной терапии в раннем неонатальном периоде, инфекционные и другие факторы. Предиктивную значимость в отношении БЛД имеют нахождение на ИВЛ более 3 суток с потребностью в высоких режимах - FiO2>0,5 и PIP >30 мм. вод. ст. [20].
Таблица 1 - Факторы риска развития БЛД [3,28–30].
|
Эндогенные |
Экзогенные |
|
|---|---|---|
|
Немодифицируемые |
Модифицируемые |
|
|
Недоношенность, гестационный возраст < 32 недель Очень низкая и экстремально низкая масса тела при рождении Хориоамнионит у матери Задержка развития легких Недостаточность антиоксидантной системы Задержка внутриутробного развития Генетическая предрасположенность (полиморфизм генов сурфактантов, металлопротеиназ, факторов роста, цитокинов) Белая раса Мужской пол |
Курение матери во время беременности Недостаточность сурфактанта (у детей ОНМТ и ЭНМТ) Респираторный дистресс- синдром новорожденных Функционирующий открытый артериальный проток Надпочечниковая недостаточность Гастроэзофагеальный рефлюкс Легочное кровотечение Синдромы утечки воздуха (интерстициальная эмфизема, пневмоторакс, пневмомедиастинум) |
ИВЛ более 3 суток с FiO2>0,5 и PIP >30 мм вод. ст, NCPAP, другие методы респираторной поддержки новорожденных Врожденная и постнатальная нозокомиальная инфекция (уреаплазма, цитомегаловирус, бактериальная, сепсис), внутриутробная или ИВЛ-ассоцированная пневмония, генерализованный кандидоз Нарушение питания и низкие темпы роста, в т.ч. в связи с повышенными энергозатратами на работу дыхания Дефицит витамина А, меди, цинка, селена, магния Избыток жидкости и отек легких, в т.ч. вследствие неадекватной инфузионной терапии, снижения диуреза, ОАП |
Патоморфологические исследования при БЛД у детей, нуждающихся в респираторной терапии с рождения, особенно в инвазивной ИВЛ, демонстрируют повреждение всех отделов дыхательной системы, в т.ч. бронхиол, альвеол, интерстициальной ткани, сосудов. Страдают также центральные механизмы регуляции дыхания, дыхательная мускулатура и каркас грудной клетки (в том числе вследствие остеопении недоношенных) незрелого младенца [31].
Острая фаза повреждения легкого при БЛД (некроз дыхательного эпителия, воспалительные изменения) постепенно сменяется процессами фиброзирования (облитерирующий бронхиолит, перибронхиальный и интраальвеолярный фиброз) с реактивной гипертрофией железистого эпителия, пролиферацией мышечной ткани бронхов с развитием гиперреактивности бронхов [32]. Все это способствует нарушению воздухообмена в легких в связи с формированием ателектазов, эмфиземы, «воздушных ловушек» - таким образом создается основа для снижения растяжимости легких, увеличения сопротивления дыхательных путей и работы дыхания, дыхательной недостаточности.
Ремоделирование бронхолегочных структур на фоне БЛД создает благоприятную почву для повышенной чувствительности ребенка как к токсинам, ингаляционным аллергенам и ирритантам (пассивное курение, другие загрязнения окружающей среды), так и к респираторным инфекциям, особенно к РСВИ и риновирусу, причем для детей с БЛД характерно тяжелое течение этих инфекций с выраженной бронхиальной обструкцией, приводящей к тяжелой ДН [36].
В патогенезе БЛД, осложненной развитием легочной гипертензии (ЛГ), установлена значимость биологически активных веществ, связанных с воздействием на легочные сосуды. Так, при развитии этого осложнения у пациентов отмечен повышенный уровень эндогенного ингибитора оксида азота – асимметричного диметиларгинина, который расценивается и как ЛГ, и как потенциальная мишень терапии у недоношенных с БЛД, осложненной ЛГ[42,43].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Клиническая картина
Cимптомы, течение
К предикторам развития классической БЛД принято относить вынужденное использование «жестких» параметров вентиляции и высоких концентраций О2 более 6 – 7 дней. При попытках снижения параметров у младенца отмечают нарастание ДН, поскольку уже в этом периоде уменьшается растяжимость легких, снижается количество капилляров, начинает развиваться отек и фиброз легочного интерстиция.
Особенностью клинической картины БЛД на фоне широкого внедрения применения протективных респираторных технологий является позднее, отсроченное начало и постепенное развитие заболевания: после первичного улучшения состояния, часто связанного с введением сурфактанта новорожденному с РДС, на второй-третьей неделе жизни отсутствует положительная динамика, развивается стойкая дыхательная недостаточность с нарастанием кислородозависимости и появлением эпизодов гипоксемии.
В некоторых случаях выраженность ДН постепенно снижается, ребенок может обходиться без вспомогательной вентиляции легких и даже без дотации кислорода (т.н. «светлый» промежуток), но через короткое время признаки ДН появляются вновь и нарастают [50].
Реинтубации являются фактором риска тяжелого течения заболевания [51].
При осмотре пациента на этапе формирования БЛД можно отметить изменения формы грудной клетки – она принимает бочкообразную форму, имеет место одышка смешанного или экспираторного типа с участием вспомогательной мускулатуры, втяжением уступчивых мест грудной клетки и тахипноэ (ЧД = 80 – 100 в мин). Возможны приступы апноэ с развитием брадикардии. Кожа больного ребенка обычно бледная с цианотичным оттенком; при нагрузках цианоз усиливается. При перкуссии грудной клетки отмечают коробочный оттенок перкуторного звука. Перкуссия грудной клетки не проводится детям ОНМТ и ЭНМТ в связи с риском интракраниальных кровоизлияний. Для аускультативной картины БЛД характерны ослабление дыхания и крепитация, отражающие развитие интерстициального отека, и появление свистящих, мелкопузырчатых хрипов независимо от наличия или отсутствия сердечной недостаточности. К проявлениям бронхообструктивного синдрома (БОС) у недоношенных детей с БЛД относятся эпизоды падения сатурации кислорода, клинически сопровождающиеся свистящими хрипами, ослабленным дыханием, затруднением выдоха, ригидностью грудной клетки, падением растяжимости и увеличением резистентности дыхательных путей.
К моменту выписки пациента из неонатального стационара при тяжелых и среднетяжелых формах БЛД сохраняется умеренная одышка и аускультативные признаки стойкого бронхообструктивного синдрома (выражены по-разному, могут усиливаться при беспокойстве ребенка). Обычно дети с этими формами БЛД сохраняют склонность к дискинезиям со стороны ЖКТ (срыгиваниям, рвоте) независимо от характера вскармливания, могут иметь признаки белково-энергетической недостаточности (БЭН), причиной которой при адекватной калорийности и объеме получаемого питания является некорригируемая хроническая гипоксемия.
На протяжении первых 6 – 12 мес жизни даже в отсутствии наслоения острых респираторных заболеваний у детей с БЛД периодически могут отмечаться эпизоды бронхиальной обструкции. Для оценки степени тяжести БЛД и ее осложнений, прогнозирования течения и подбора терапии необходимы лабораторные и инструментальные диагностические исследования.
Диагностика
Критериями установления диагноза БЛД являются [4]:
- недоношенность (подавляющее большинство детей имеют гестационный возраст <32 недель);
- стойкое паренхиматозное поражение легких, подтверждаемое при исследовании газов крови (гипоксемия, гиперкапния) и проведении рентгенографии органов грудной клетки (снижение пневматизации, эмфизема, лентообразные уплотнения);
- потребность в инвазивной/неинвазивной ИВЛ, респираторной поддержке с постоянным положительным давлением в дыхательных путях (CPAP), дотации кислорода через назальные канюли в 28 суток жизни и/или 36 недель ПКВ с концентрацией кислорода (FiO2) более 0,21 в течение более 3 последовательных дней для поддержания уровня насыщения гемоглобина крови кислородом (сатурации) в диапазоне 90-95% (исключая новорожденных, которым ИВЛ проводится по поводу другого заболевания дыхательных путей или других заболеваний, связанных с поражением дыхательного центра, нервно-мышечными заболеваниями).
Физикальное обследование
- Новорожденному с БЛД и с подозрением на развитие БЛД рекомендуется проведение визуального терапевтического осмотра [4].
Для детей с БЛД характерными клиническими признаками являются: тахипноэ (ЧД более 60-70 в минуту), склонность к тахикардии с ЧСС более 160 в минуту, при аускультации - неравномерно жесткое дыхание, признаки бронхообструкции – удлиненный и усиленный выдох, сухие свистящие хрипы.
- Рекомендуется проводить общий (клинический) анализ крови развернутый пациентам с БЛД и с подозрением на развитие БЛД для оценки общего уровня реакций адаптации и сопутствующих нарушений, требующих коррекции [49,56,57].
- Рекомендуется проведение анализа крови биохимического общетерапевтического пациентам с БЛД и с подозрением на развитие БЛД для выявления и оценки степени электролитных нарушений, белково-энергетической недостаточности, остеопении недоношенных, сопутствующих патологических состояний, требующих коррекции (неонатальный холестаз и др.) [60–65].
- Рекомендуется исследование кислотно-основного состояния (КОС) и газов крови пациентам с БЛД и с подозрением на развитие БЛД, находящимся в стационаре, при проведении респираторной терапии, как в периоде формирования БЛД в первый месяц жизни, так и при нарастании ДН на фоне интеркуррентных заболеваний для объективной оценки тяжести ДН для подбора терапии и для контроля эффективности терапии [4,49,66,67].
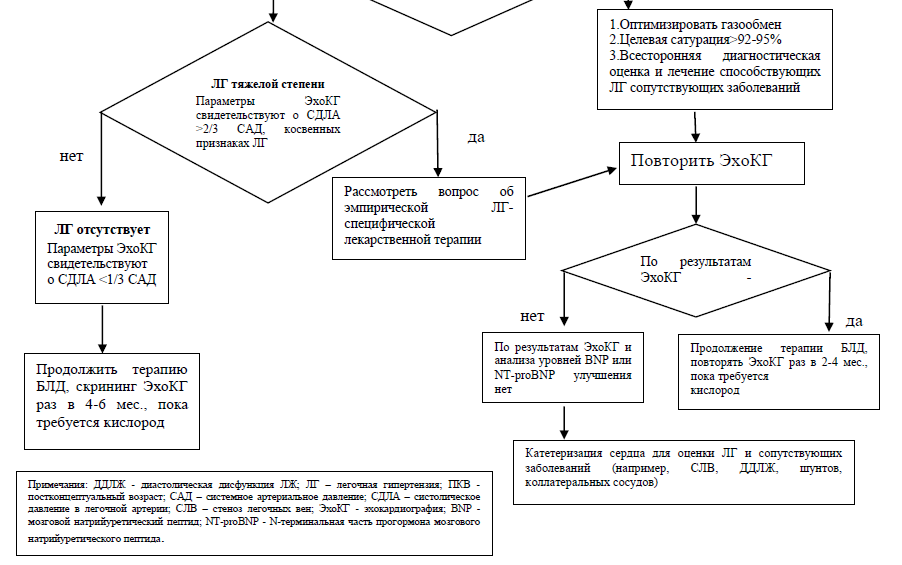
- Рекомендуется селективное исследование уровня N-терминального фрагмента натрийуретического пропептида мозгового (NT-proBNP) в крови пациентам с БЛД для оценки степени тяжести и эффективности терапии легочной гипертензии [68–71].
- Рекомендуется суточное прикроватное мониторование жизненных функций и параметров: степени насыщения гемоглобина кислородом методом пульсоксиметрии, частоты сердечных сокращений (ЧСС), артериального давления (АД) и частоты дыхания (ЧД) всем пациентам с БЛД и с подозрением на БЛД, находящимся в стационаре. После выписки из стационара детям с сохраняющейся кислородозависимостью рекомендовано регулярное измерение степени насыщения гемоглобина кислородом методом пульсоксиметрии в амбулаторных условиях (на дому, при визитах к врачу) [4,48,49,66,72,73].
- Рекомендуется проведение рентгенографии легких пациентам с БЛД или с подозрением на развитие БЛД, находящимся в стационаре с диагностической целью, с целью оценки динамики патологического процесса в легких, исключения синдромов утечки воздуха, пневмонии и других состояний [4,48,49,66,74,75].
- Рекомендуется селективное проведение компьютерной томографии (КТ) легких пациентам с БЛД или с подозрением на развитие БЛД [4,48,49,66,71,72,76,77].
- Рекомендуется селективное проведение электрокардиографии (ЭКГ) пациентам с БЛД и с подозрением на развитие БЛД, находящимся в стационаре, с целью выявления патологии со стороны сердца [48,49], а также при подозрении на развитие легочной гипертензии [78].
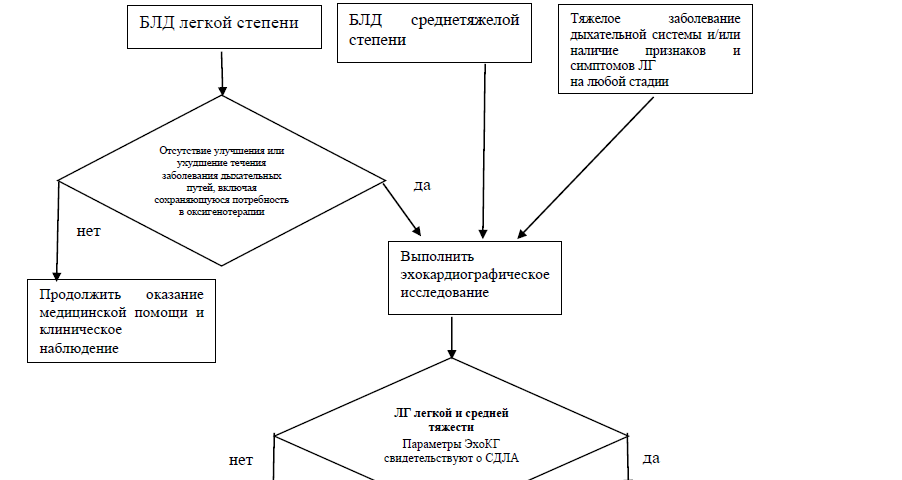
- Рекомендуется проведение эхокардиографии (ЭхоКГ) детям с БЛД или с подозрением на формирование БЛД с целью выявления патологии со стороны сердца, в том числе в качестве скрининговой методики выявления хронической легочной гипертензии [4,48,49,66,78–80].
Таблица 5. Эхокардиографические критерии легочной гипертензии в скорректированном возрасте старше 3 мес. [81].
|
Определение |
Критерии |
|---|---|
|
ЛГ маловероятна |
Vтрикуспидальной регургитации ≤ 2.8 м/с1 СДЛА ≤ 36 мм рт. ст. Отсутствуют дополнительные ЭхоКГ – критерии ЛГ2 |
|
ЛГ возможна |
Vтк регургитации ≤ 2.8 м/с1, СДЛА ≤ 36 мм рт. ст.1, есть дополнительные ЭхоКГ – критерии ЛГ2 |
|
Vтк регургитации ≥ 2.9 м\с1 СДЛА = 37 – 50 мм рт. ст. |
|
|
ЛГ достоверна |
Vтк регургитации > 3.4 m/s, СДЛА > 50 мм рт. ст1 |
Таблица 6. Степени тяжести легочной гипертензии по данным ЭхоКГ [4,83].
|
|
отстутствует |
легкая |
средней тяжести |
тяжелая |
|---|---|---|---|---|
|
СД ПЖ |
<1/3 системного АД по градиенту ТР |
1/3-1/2 системного АД по градиенту ТР |
1/2-2/3 системного АД по градиенту ТР |
>2/3 системнго АД по градиенту ТР |
|
Положение МЖП |
сбалансировано и связано с ЛЖ |
уплощение МЖП в систолу |
плоская МЖП или прогиб кзади в позднюю систолу |
пансистолический прогиб перегородки кзади |
|
Гипертрофия и дилатация ПЖ |
отстутствует |
легкая |
умеренно выражена |
выраженная |
|
Функция ПЖ |
в норме |
может быть в норме |
может быть снижена |
дисфункция |
- У новорожденных с подозрением на развитие БЛД селективно рекомендуется оценка состояния паренхимы по ультразвуковой шкале легких LUS или eLUS (Приложение Г3) для стратификации риска развития среднетяжелой и тяжелой форм БЛД [84–90].
- Рекомендуется селективное проведение бронхофонографии детям с БЛД или с подозрением на развитие БЛД для определения причин и уточнения механизмов обструкции дыхательных путей [95,96].
- Рекомендуется селективное проведение полисомнографии у пациентов с БЛД для диагностики нарушений дыхания во время сна [78,97–101].
Решение о проведении данного исследования принимается в зависимости от возможностей и опыта конкретной медицинской организации (МО).
Лечение
1. Консервативное лечение
1.1. Респираторная терапия /оксигенотерапия
- Детям с БЛД и с подозрением на развитие БЛД рекомендуется проведение респираторной терапии под контролем КОС и газов крови с целью купирования дыхательной недостаточности и ликвидации гипоксемии [102].
Критерии экстубации:
-отсутствие признаков активно текущего инфекционного процесса и неудачных попыток экстубации в течение предыдущих 48 часов.
- Рекомендуется проводить оксигенотерапию пациентам с БЛД и с подозрением на развитие БЛД при невозможности поддержания целевых значений SpO2 91-95%, для купирования гипоксемии [4,48,49,72,74,75,99,100,108].
- Детям с БЛД и с подозрением на развитие БЛД при длительном нахождении на инвазивной ИВЛ рекомендуется адаптация режимов и параметров ИВЛ соответственно патофизиологическим изменениям легочной механики для предотвращения дальнейшего повреждения и обеспечения репарации легочной ткани [4,111,112].
1.2.1 Глюкокортикоиды
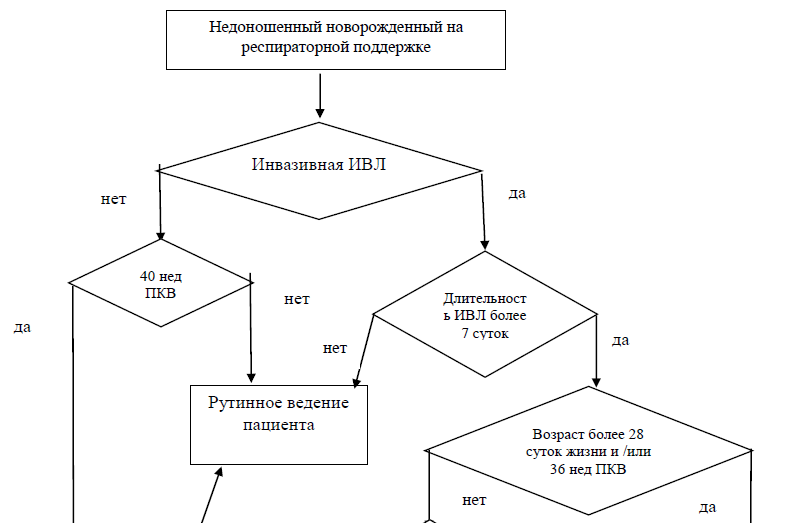
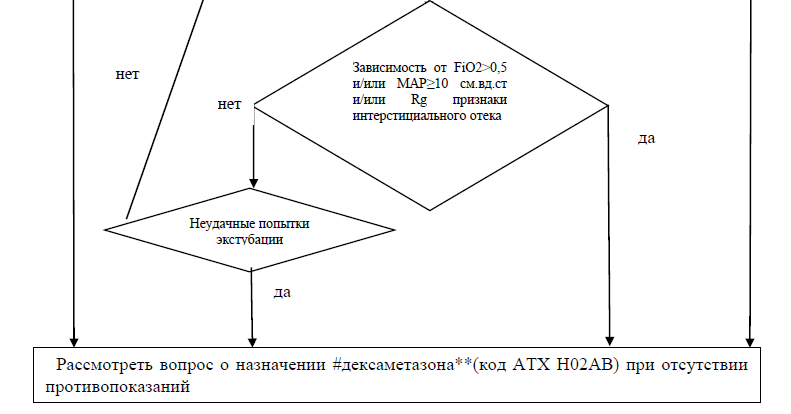
- Рекомендуется селективное назначение глюкокортикоидов (код АТХ H02AB) -#дексаметазон** для улучшения газообмена, снижения потребности в кислороде и уменьшения длительности искусственной вентиляции легких пациентам с целью лечения БЛД [72,113].
В клинической практике трудно разделить между собой лечебное и профилактическое назначение #дексаметазона**(код АТХ H02AB). Ориентируясь на временной критерий установления диагноза, показания к назначению препарата с целью профилактики БЛД освещены отдельно в соответствующем разделе (раздел 5).
Важным фактором при принятии решения о назначении #дексаметазона** (код АТХ H02AB) является баланс риска и пользы. Среди значимых побочных эффектов - неврологические последствия, артериальная гипертензия, метаболические нарушения (гипергликемия), сепсис. Так как БЛД сама по себе является фактором риска неврологического дефицита, назначение #дексаметазона** (код АТХ H02AB) оправдано для пациентов, имеющих риск развития заболевания более 60%, а оптимальным терапевтическим «окном» считается ирнтервал от 2 до 7 недель жизни.
Рекомендуется воздержаться от назначения #дексаметазона** (код АТХ H02AB) в острой фазе течения системных грибковых инфекций, а также в острой фазе течения некротизирующего энероколита. Применять с осторожностью при стойкой гипергликемии, гипертрофической кардиомиопатии, артериальной гипертензии, инфекционных заболеваниях бактериальной природы. При наличии гемодинамичеки значимого функционирующего ОАП следует перед назначением #дексаметазона** (код АТХ H02AB) рассмотреть возможность проведения терапии, направленой на закрытие ОАП [4].
Оценку эффективности применения проводят на 3-и сутки от начала лечения. В случае снижения FiO2, PIP введение продолжают по данной схеме. При отсутствии в течение первых 3 сут эффекта на 4-й день дозу препарата увеличивают до 0,3 мг/кг в сутки на 3 дня (4–6-й день). Далее проводят снижение дозы — 0,15 мг/кг в сутки (7–9-й день), 10–12-й день по 0,1 мг/кг в сутки, 13–14-й день — по 0,05 мг/кг в сутки, 15–16-й день — по 0,02 мг/кг в сутки [4,114].
При необходимости применяются повторные курсы с интервалом в 1-2 недели. Повторный курс #дексаметазона**(код АТХ H02AB) при БЛД менее эффективен по сравнению с профилактическим курсом [113].
- Рекомендуется пациентам с БЛД селективное применение других средств для лечения обструктивных заболеваний дыхательных путей для ингаляционного введения (код АТХ R03B) - глюкокортикоидов #будесонид** (код АТХ R03BA) для купирования бронхообструктивного синдрома, улучшения газообмена, снижения потребности в кислороде [72,110].
Для ингаляционного введения #будесонида**(код АТХ R03BA), применяют компрессионные или мембранные (предпочтительно) ингаляторы – небулайзеры.
- Рекомендовано селективное назначение адренергических средств для ингаляционного введения (код АТХ R03A) - селективных бета 2-адреномиметиков - #сальбутамол** (код АТХ R03AС) или адренергических средств в комбинации с антихолинергическими средствами - #ипратропия бромид + фенотерол** (код АТХ R03AL), или других средств для лечения обструктивных заболеваний дыхательных путей для ингаляционного введения - антихолинергических средств - #ипратропия бромид** (код АТХ R03BB) детям с БЛД и с подозрением на развитие БЛД при необходимости купирования бронхообструктивного синдрома [72,116–119].
- Рекомендуется селективное назначение диуретиков (код АТХ С03) пациентам с БЛД и с подозрением на развитие БЛД для уменьшения интерстициального легочного отека, улучшения растяжимости легких, снижения потребности в кислороде [4,122,123].
Применяют сульфонамиды – #фуросемид**(код АТХ С03СА), разовая доза для парентерального введения – 1 мг/кг, по возможности коротким курсом во избежание нежелательных явлений (нефрокальциноз, электролитные и метаболические нарушения)[4].
- Рекомендуется назначение производных ксантина (код АТХ N06BC) пациентам с БЛД и с подозрением на развитие БЛД – кофеина цитрат (код АТХ N06BC) для лечения первичного апноэ у недоношенных новорожденных, с целью стимуляции дыхательного центра, увеличения минутной вентиляции, снижения порога чувствительности к гиперкапнии и усиления ответа на гиперкапнию [124–126].
3. Иное лечение
3.1. Диетотерапия (нутритивная поддержка)
- Рекомендуется умеренное ограничение дотации жидкости пациентам с БЛД и с подозрением на развитие БЛД для уменьшения задержки жидкости в интерстиции легких [49,127].
- Рекомендуется недоношенным новорожденным с БЛД или подозрением на развитие БЛД в качестве субстрата энтерального питания отдавать предпочтение грудному молоку для обеспечения роста, развития, профилактики инфекционно-воспалительных заболеваний [49,128–132].
- Рекомендуется повышенное белково-энергетическое обеспечение для адекватного роста и развития легочной ткани недоношенным новорожденным с БЛД или с подозрением на развитие БЛД [49,127,133,134].
- Недоношенным детям с БЛД, требующим проведения респираторной терапии и/или оксигенотерапии, рекомендуется избегать гемической гипоксии и поддерживать оптимальный уровень доставки кислорода, при необходимости путем гемотрансфузий эритроцитсодержащих компонентов крови [136].
Комментарии: В настоящее время имеются доказательства того, что системная доставка кислорода улучшается, а потребление кислорода снижается у кислородозависимых младенцев с бронхолегочной дисплазией при поддержании гематокрита выше 0,35-0,40 [136,137]. Из-за повышенных метаболических потребностей у младенцев с БЛД, связанных с низким напряжением кислорода в артериальной крови, важно поддерживать относительно высокую концентрацию гемоглобина в крови. Важно иметь в виду, что ограничение флеботомических потерь является эффективной и безопасной мерой профилактики анемии [138].
- Детям с хронической ЛГ на фоне БЛД рекомендуется длительная оксигенотерапия для уменьшения легочного сосудистого сопротивления и устранения гипоксемии [4,139].
- Детям с хронической ЛГ на фоне БЛД рекомендуется в качестве препаратов в вазодилятирующим эффектом первой линии терапии ЛГ селективное назначение препаратов, применяемых в урологии (код АТХ G04B) - #силденафил, для нормализации СДЛА и устранения гипоксемии [140–143].
- Детям с хронической ЛГ на фоне БЛД рекомендуется в качестве препаратов в вазодилятирующим эффектом второй линии терапии ЛГ селективное назначение антигипертензивных средств для лечения легочной артериальной гипертензии -#бозентан** (код АТХ C02KX) для нормализации СДЛА и купирования гипоксемии [4].
- Рекомендуется в качестве препаратов в вазодилятирующим эффектом третьей линии терапии ЛГ селективное использование ингаляционного оксида азота (iNO) пациентам с ЛГ на фоне БЛД с целью снижения давления в легочной артерии и устранения гипоксемии [4].
Терапия оксидом азота iNO осуществляется двумя способами:
- Детям с тяжелой БЛД, длительно находящимся на инвазивной ИВЛ, в стабильном состоянии рекомендуется выписка из стационара и продолжение ИВЛ на дому (хроническая ИВЛ) для продолжения терапии, снижения рисков госпитального инфицирования, повышения качества жизни [107,145].
Медицинская реабилитация
- Не рекомендовано рутинное применение детям с БЛД гальванических токов, различных видов постоянных или переменных импульсных токов (Воздействие токами ультравысокой частоты при заболеваниях нижних дыхательных путей, Воздействие синусоидальными модулированными токами, Воздействие интерференционными токами, Воздействие токами надтональной частоты) [146].
- Не рекомендовано рутинное применение полихроматического некогерентного поляризованного света видимого и инфракрасного диапазонов (Воздействие поляризованным светом) [146].
- Рекомендовано селективное назначение бальнеотерапии детям с БЛД в период ремиссии, при общем удовлетворительном состоянии с целью улучшения функционального состояния ЦНС и вегетативной нервной системы [147].
- Рекомендовано детям с БЛД при частых обострениях заболевания, особенно при сопутствующих последствиях перинатального поражения ЦНС рассмотреть проведение курса «сухих» иммерсионных ванн (сухая иммерсия) с целью улучшения функционального состояния ЦНС и вегетативной нервной системы [147].
- Рекомендуется детям с БЛД селективное проведение лечебного массажа, гимнастики (кинезотерапия) с целью укрепления дыхательной мускулатуры [146,148]
- Рекомендовано селективное назначение санаторно-курортного лечения детям с БЛД на заключительном этапе реабилитации с целью общеукрепляющего воздействия, укрепления дыхательной мускулатуры [146,147].
- Рекомендовано при возможности, проведение консультации медицинского психолога и дальнейшая психологическая поддержка родителям/законным представителям детей с БЛД, особенно при проведении респираторной поддержки на дому с целью создания благоприятного климата для лечения ребенка [149–151].
Прогноз
При сочетании БЛД с легочной гипертензией риск летального исхода может достигать 40%.
У большинства пациентов наблюдается регресс дыхательных нарушений после 2-х лет; однако сохраняется риск тяжелого течения острых вирусных бронхиолитов (потребность в госпитализации, лечении в условиях отделения реанимации и интенсивной терапии, с использованием респираторной терапии, ИВЛ), рецидивов бронхиальной обструкции; повышен риск развития бронхиальной астмы [72,192,201].
Основным последствием БЛД в возрасте старше 2 лет жизни при сохранении кислородозависимости, потребности в респираторной терапии, ИВЛ является облитерирующий бронхиолит. Другие возможные последствия включают в себя бронхоэктазы, бронхиальную астму, эмфизему, локальный пневмосклероз, у взрослых – раннее развитие хронической обструктивной болезни легких. Дети с БЛД имеют повышенный риск развития бронхиальной астмы. К группе риска относятся дети с отягощенным семейным (атопические заболевания) и личным аллергоанамнезом (сопутствующие атопический дерматит, аллергический ринит), эозинофилией в общем анализе крови, рецидивами бронхиальной обструкции, особенно в возрасте старше 2 лет, протекающей без лихорадки, от воздействия аэроаллергенов, с хорошим эффектом от применения ингаляционных бронхолитиков и глюкокортикоидов. Для подтверждения диагноза бронхиальной астмы проводится аллергологическое обследование с определением специфических IgE к ингаляционным аллергенам. Терапия астмы проводится по общим принципам. После 5 лет при персистирующих симптомах дыхательной недостаточности, бронхиальной обструкции рекомендуется исследование функции внешнего дыхания с проведением пробы с бронхолитиком, КТ легких (при подозрении на развитие облитерирующего бронхиолита) [4,31,97].
Госпитализация
Показанием для госпитализации в медицинскую организацию является ухудшение состояния ребенка с БЛД, находящегося в домашних условиях (в т.ч. при сопутствующем инфекционном процессе); необходимость стационарного лечения в связи с нарастанием ДН.
Показания к выписке пациента из медицинской организации:
Показания для организации паллиативной помощи (в т.ч. на дому) при тяжелой БЛД:
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
1. Профилактика развития БЛД у недоношенных детей
- Рекомендуется недоношенным новорожденным с высоким риском развития БЛД проводить оксигенотерапию в родильном зале под контролем пульсоксиметрии, с титрованием дополнительного кислорода для достижения показателей SpO2 в рекомендуемом диапазоне значений: к 1 мин-60-65%; 3 мин-70-75%; 5 мин-80-85%; 10 мин и далее – 85-95% для предотвращения оксидативного повреждения легких [97,152–157].
Комментарии: Стратегии профилактики БЛД с помощью вмешательств в родильном зале имеют большой потенциал для влияния на отдаленные результаты [154]. В настоящее время общая рекомендация, основанная на индивидуальном анализе восьми РКИ, состоит в том, чтобы начать непрерывный мониторинг SpO2 сразу после рождения и титровать дополнительный кислород для достижения показателей SpO2> 80% к 5 минутам жизни [157]. Новорожденным ГВ более 28 недель следует начинать проведение респираторной терапии с воздуха, новорожденным ГВ менее 28 недель – с 30% кислорода.
- Рекомендуется при проведении респираторной терапии и/или оксигенотерапии у недоношенных новорожденных с высоким риском развития БЛД вне родильного зала поддержание целевого насыщения гемоглобина кислородом (сатурации) в пределах 91-95% для предотвращения гипоксемии и гипероксии [49,97,98].
- Недоношенным новорожденным с высоким риском развития БЛД при наличии дыхательных нарушений рекомендуется по возможности избегать инвазивной ИВЛ путем применения стартовой неинвазивной респираторной терапии СРАР и других неинвазивных стратегий (NIPPV) для предотвращения повреждения легких [52,53,158–162].
- Недоношенным новорожденным с РДС и высоким риском развития БЛД при проведении инвазивной традиционной ИВЛ рекомендуется контроль и поддержание дыхательного объема (в раннем неонатальном периоде -4-6 мл/кг, на второй-третьей неделе жизни- 5,5-6,5 мл/кг) для предотвращения волюмо- и баротравмы легких [4,5,31,134,163–166].
- Рекомендуется селективное назначение легочных сурфактантов (код АТХ R07AA) недоношенным новорожденным с высоким риском развития БЛД для лечения и профилактики респираторного дистресс-синдрома и предотвращения повреждения легких [49,134,168].
- Для лечения и профилактики РДС у недоношенных новорожденных с высоким риском развития БЛД, находящихся на неинвазивной респираторной терапии, при проведении сурфактантной терапии рекомендуется предпочтительное использование малоинвазивных методик введения препарата группы легочные сурфактанты (код АТХ R07AA) [134,172–176].
- При проведении инвазивной традиционной ИВЛ у недоношенных новорожденных с РДС в раннем неонатальном периоде рекомендуется использование короткого времени вдоха (0,3-0,33с), частоты циклов респиратора, близкой к физиологической частоте дыхания новорожденного (50-60 в минуту) и постоянного ПДКВ не менее 4-6 см водн. ст. для снижения вентиллятор-ассоциированного повреждения легких [103–105,177].
Комментарий: протективные респираторные стратегии, которые используются в остром периоде течения РДС у недоношенных новорожденных, ориентированы на сурфактант-дефицитную модель легкого. В условиях низкого комплайнса и нормальной резистентности, время, необходимое для полного заполнения/опорожнения легких, достаточно мало (константа времени короткая). Таким образом, наиболее бережной вентиляцией может считаться вентиляция малым дыхательным объемом 4-6 мл/кг, высокой частотой циклов респиратора 50-60 в минуту, с коротким временем вдоха 0,3-0,33с, ПДКВ 4-6 см вод. ст для поддержания функциональной остаточной емкости легких.
- Рекомендуется ранняя селективная экстубация недоношенных новорожденных, находящихся на инвазивной ИВЛ, и продолжение респираторной терапии неинвазивными методами NIPPV/СРАР для снижения риска развития и степени тяжести БЛД [125,178,179].
- Недоношенным новорожденным с высоким риском развития БЛД ГВ < 32 недель, находящимся на неинвазивной ИВЛ, а также на инвазивной ИВЛ перед планирующейся экстубацией, рекомендуется раннее назначение производных ксантина (код АТХ N06BC) - кофеина цитрат в первые 72 часа жизни с целью стимуляции дыхательного центра, лечения первичного апноэ, увеличения минутной вентияции, снижения порога чувствительности к гиперкапнии и усиления ответа на гиперкапнию [124–126,180–182].
- Рекомендуется селективное назначение кортикостероидов системного действия – глюкокортикоидов - #дексаметазон**)(код АТХ H02AB) для улучшения газообмена, снижения потребности в кислороде и уменьшения длительности вентиляции недоношенным детям старше 7 суток жизни, находящимся на инвазивной ИВЛ и имеющим высокий риск развития БЛД [4,114,189,190].
- Всем детям с БЛД на первом году жизни и детям с БЛД на втором году жизни, в случаях, если требовалось лечение по поводу БЛД в течение последних 6 месяцев рекомендуется назначение специфического иммуноглобулина - паливизумаб** (код АТХ J06BB) для профилактики РСВИ [31,48,191–194].
- Пациентам с БЛД для профилактики респираторных инфекций, влияющих на течение БЛД, рекомендуется вакцинация от пневмококковой инфекции, от гемофильной инфекции, от гриппа [107,191,199,200].
_____________________
1 Приказ Министерства здравоохранения Российской Федерации от 06.12.2021 № 1122н "Об утверждении национального календаря профилактических прививок, календаря профилактических прививок по эпидемическим показаниям и порядка проведения профилактических прививок"
В состав мультидисциплинарной команды обычно входят: врач-неонатолог, врач-педиатр/врач общей практики (семейный врач), врач-пульмонолог, врач-анестезиолог-реаниматолог, врач-детский кардиолог, врач-гастроэнтеролог, врач-диетолог, специалист по медицинской реабилитации (врач по медицинской реабилитации/врач физической и реабилитационной медицины/врач по лечебной физкультуре/врач-физиотерапевта или др.), врач-сурдолог-оториноларинголог, врач-офтальмолог, а также врачи других специальностей пациентам с БЛД, имеющим нарушения функций соответствующих органов и систем, медицинская сестра, медицинский психолог, социальный работник, врач по паллиативной медицинской помощи,. и др. в зависимости от клинической необходимости [107].
- Детям с БЛД для динамического наблюдения, назначения своевременного лечения, исключения бронхиальной астмы рекомендуется диспансерное наблюдение врача – пульмонолога [4,66].
- Не рекомендуется рутинное проведение в динамике рентгенографии легких/рентгенографии легких цифровой и/или компьютерной томографии органов грудной полости пациентам с БЛД и пациентам с БЛД в анамнезе: проведение исследований необходимо только пациентам с тяжелым течением БЛД, выраженными респираторными симптомами и/или требующими регулярных госпитализаций вследствие респираторных проблем [66].
- Рекомендовано проведение исследования функции внешнего дыхания (Исследование неспровоцированных дыхательных объемов и потоков, Исследование дыхательных объемов с применением лекарственных препаратов – детям с 5 лет) в динамике, в т.ч., в долгосрочной перспективе детям с БЛД в анамнезе с целью контроля легочной функции и своевременной диагностики заболеваний, сформировавшихся в исходе БЛД [66].
Информация
Источники и литература
-
Клинические рекомендации Союза педиатров России
- Higgins R.D. et al. Bronchopulmonary Dysplasia: Executive Summary of a Workshop // J. Pediatr. 2018. Vol. 197. P. 300–308. Wang S.H., Tsao P.N. Phenotypes of bronchopulmonary dysplasia // International Journal of Molecular Sciences. MDPI AG, 2020. Vol. 21, № 17. P. 1–20. Thébaud B. et al. Bronchopulmonary dysplasia // Nature Reviews Disease Primers. Nature Publishing Group, 2019. Vol. 5, № 1. Ашерова И. К., Бабак О. А., Богданова А. В. [и др.]. Бронхолегочная Дисплазия. Москва: (РУДН), Российский университет дружбы народов, 2020. 176с p. Jobe A.H. Animal models, learning lessons to prevent and treat neonatal chronic lung disease // Front. Med. 2015. Vol. 2, № AUG. P. 1–13. Husain A.N., Siddiqui N.H., Stocker J.T. Pathology of arrested acinar development in postsurfactant bronchopulmonary dysplasia // Hum. Pathol. 1998. Vol. 29, № 7. P. 710–717. Coalson J.J. Pathology of new bronchopulmonary dysplasia // Semin. Neonatol. 2003. Vol. 8, № 1. P. 73–81. Ambalavanan N. et al. Predictors of death or bronchopulmonary dysplasia in preterm infants with respiratory failure // J. Perinatol. 2008. Vol. 28, № 6. P. 420–426. Lemons J.A. et al. Very Low Birth Weight Outcomes of the National Institute of Child Health and Human Development Neonatal Research Network, January 1995 Through December 1996 // Pediatrics. 2001. Vol. 107, № 1. P. e1–e1. Marshall D.D. et al. Risk factors for chronic lung disease in the surfactant era: A North Carolina population-based study of very low birth weight infants // Pediatrics. 1999. Vol. 104, № 6. P. 1345–1350. Oh W. et al. Association between fluid intake and weight loss during the first ten days of life and risk of bronchopulmonary dysplasia in extremely low birth weight infants // J. Pediatr. 2005. Vol. 147, № 6. P. 786–790. Rojas M.A. et al. Changing trends in the epidemiology and pathogenesis of neonatal chronic lung disease // J. Pediatr. 1995. Vol. 126, № 4. P. 605–610. Stoll B.J. et al. Trends in care practices, morbidity, and mortality of extremely preterm Neonates, 1993-2012 // JAMA - J. Am. Med. Assoc. 2015. Vol. 314, № 10. P. 1039–1051. Young T.E. et al. Population-based Study of Chronic Lung Disease in Very Low Birth Weight Infants in North Carolina in 1994 With Comparisons With 1984 // Pediatrics. 1999. Vol. 104, № 2. P. e17–e17. Younge N. et al. Survival and Neurodevelopmental Outcomes among Periviable Infants // N. Engl. J. Med. 2017. Vol. 376, № 7. P. 617–628. Walsh M.C. et al. Impact of a physiologic definition on bronchopulmonary dysplasia rates // Pediatrics. 2004. Vol. 114, № 5. P. 1305–1311. Bose C. et al. Fetal growth restriction and chronic lung disease among infants born before the 28th week of gestation // Pediatrics. 2009. Vol. 124, № 3. P. e450–e45. McEvoy C.T., Spindel E.R. Pulmonary Effects of Maternal Smoking on the Fetus and Child: Effects on Lung Development, Respiratory Morbidities, and Life Long Lung Health // Paediatr. Respir. Rev. Elsevier Ltd, 2017. Vol. 21. P. 27–33. Morrow L.A. et al. Antenatal determinants of bronchopulmonary dysplasia and late respiratory disease in preterm infants // Am. J. Respir. Crit. Care Med. 2017. Vol. 196, № 3. P. 364–374. Ryan S.W., Nycyk J., Shaw B.N.J. Prediction of chronic neonatal lung disease on day 4 of life // Eur. J. Pediatr. 1996. Vol. 155, № 8. P. 668–671. Lavoie P.M., Pham C., Jang K.L. Heritability of bronchopulmonary dysplasia, defined according to the consensus statement of the national institutes of health // Pediatrics. 2008. Vol. 122, № 3. P. 479–485. Parker R.A., Lindstrom D.P., Cotton R.B. Evidence from twin study implies possible genetic susceptibility to bronchopulmonary dysplasia // Semin. Perinatol. 1996. Vol. 20, № 3. P. 206–209. Bhandari V. et al. Genetics of bronchopulmonary dysplasia: When things do not match up, it is only the beginning // J. Pediatr. 2019. Vol. 208. P. 298–299. Lal C.V., Bhandari V., Ambalavanan N. Genomics, microbiomics, proteomics, and metabolomics in bronchopulmonary dysplasia // Semin. Perinatol. Elsevier Inc., 2018. Vol. 42, № 7. P. 425–431. Parad R.B. et al. Role of Genetic Susceptibility in the Development of Bronchopulmonary Dysplasia // J. Pediatr. Elsevier Inc., 2018. Vol. 203. P. 234-241.e2. Torgerson D.G. et al. Ancestry and genetic associations with bronchopulmonary dysplasia in preterm infants // Am. J. Physiol. - Lung Cell. Mol. Physiol. 2018. Vol. 315, № 5. P. L858–L869. Yu K.H. et al. The genetic predisposition to bronchopulmonary dysplasia // Curr. Opin. Pediatr. 2016. Vol. 28, № 3. P. 318–323. Bonadies L. et al. Present and future of bronchopulmonary dysplasia // J. Clin. Med. 2020. Vol. 9, № 5. P. 1–26. Kim S.H. et al. Effect of antenatal azithromycin for Ureaplasma spp. on neonatal outcome at ≤30 weeks’ gestational age // Pediatr. Int. 2019. Vol. 61, № 1. P. 58–62. Dassios T. et al. Duration of mechanical ventilation and prediction of bronchopulmonary dysplasia and home oxygen in extremely preterm infants // Acta Paediatr. Int. J. Paediatr. 2021. Vol. 110, № 7. P. 2052–2058. Овсянников Дмитрий Юрьевич, Кравчук Дарья Андреевна Н.Д.Ю. Клиническая патофизиология органов дыхания недоношенных детей // Неонатология: новости, мнения, обучение. 2018. Vol. 3, № 21. P. 74–98. Kalikkot Thekkeveedu R., Guaman M.C., Shivanna B. Bronchopulmonary dysplasia: A review of pathogenesis and pathophysiology // Respir. Med. 2017. Vol. 132, № August. P. 170–177. Jobe A.H. Mechanisms of Lung Injury and Bronchopulmonary Dysplasia // Am. J. Perinatol. 2016. Vol. 33, № 11. P. 1076–1078. Thibeault D.W. et al. Lung Elastic Tissue Maturation and Perturbations During the Evolution of Chronic Lung Disease // Pediatrics. 2000. Vol. 106, № 6. P. 1452–1459. Berkelhamer S.K., Mestan K.K., Steinhorn R. An update on the diagnosis and management of bronchopulmonary dysplasia (BPD)-associated pulmonary hypertension // Semin. Perinatol. Elsevier Inc., 2018. Vol. 42, № 7. P. 432–443. Chaw P.S. et al. Respiratory syncytial virus-associated acute lower respiratory infections in children with bronchopulmonary dysplasia: Systematic review and meta-analysis // J. Infect. Dis. 2021. Vol. 222, № Suppl 7. P. S620–S627. Lal C.V., Ambalavanan N. Genetic predisposition to bronchopulmonary dysplasia // Semin. Perinatol. Elsevier, 2015. Vol. 39, № 8. P. 584–591. Hamvas A. et al. Exome sequencing identifies gene variants and networks associated with extreme respiratory outcomes following preterm birth // BMC Genet. BMC Genetics, 2018. Vol. 19, № 1. P. 1–10. Gao J. et al. CD74, a novel predictor for bronchopulmonary dysplasia in preterm infants // Medicine (Baltimore). 2020. Vol. 99, № 48. P. e23477. Leong M. Genetic approaches to bronchopulmonary dysplasia // Neoreviews. 2019. Vol. 20, № 5. P. e272–e279. Бондарь В.А. , Давыдова И.В. , Басаргина М.А. , Фисенко А.П. , Пушков А.А. , Жани И.С. , Борисов И.В. С.К.В. Роль Генетических Предикторов В Доклинической Диагностике Бронхолегочной Дисплазии // Кремлевская Медицина. Клинический Вестник. 2022. Vol. 1. P. 5–9. Trittmann J.K. et al. Arginase and α-smooth muscle actin induction after hyperoxic exposure in a mouse model of bronchopulmonary dysplasia. // Clin Exp Pharmacol Physiol. 2018. Vol. 45, № 6. P. 556–562. Abed N.T. et al. Relation of asymmetric dimethylarginine with pulmonary morbidities in neonatal respiratory distress syndrome // J. Neonatal. Perinatal. Med. 2021. Vol. 14, № 4. P. 511–517. Nuytten A. et al. Postnatal Corticosteroids Policy for Very Preterm Infants and Bronchopulmonary Dysplasia // Neonatology. 2020. Vol. 117, № 3. P. 308–315. McEvoy C.T. et al. Bronchopulmonary dysplasia: NHLBI Workshop on the primary prevention of chronic lung diseases // Ann. Am. Thorac. Soc. 2014. Vol. 11, № SUPPL. 3. Stoll B.J. et al. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network // Pediatrics. 2010. Vol. 126, № 3. P. 443–456. Jobe A., Bancalari E. Bronchopulmonary Dysplasia // Am. J. Respir. Crit. Care Med. 2001. Vol. 163. P. 1723–1729. Баранов A.A. et al. Ведение детей с бронхолегочной дисплазией // Педиатрическая фармакология. 2016. Vol. 13, № 4. P. 319–333. Sweet D.G. et al. European Consensus Guidelines on the Management of Respiratory Distress Syndrome - 2019 Update // Neonatology. 2019. Vol. 115, № 4. P. 432–450. Voynow J. “New” bronchopulmonary dysplasia and chronic lung disease // Paediatr. Respir. Rev. 2017. Vol. 24. P. 17–18.
Информация
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
-
Алексеева Анна Александровна – к.м.н., заведующая отделением анестезиологии-реанимации и интенсивной терапии с операционным блоком и кабинетом переливания крови ФГАУ «НМИЦ здоровья детей» Минздрава россии
-
Балашова Екатерина Николаевна, к.м.н., ведущий научный сотрудник ОРИТ имени проф. А.Г. Антонова Института неонатологии и педиатрии ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России¸ доцент кафедры неонатологии, член Совета Российского общества неонатологов
-
Баранов Александр Александрович, акад. РАН, профессор, д.м.н.; почетный президент Союза педиатров России, советник руководителя НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им.Б.В.Петровского», профессор кафедры педиатрии и детской ревматологии ФГАОУ «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), главный внештатный специалист педиатр Минздрава России
-
Басаргина Милана Александровна, к.м.н., научный сотрудник лаборатории неонатологии и проблем здоровья раннего детского возраста, заведующая отделением патологии новорожденных детей ФГАУ "НМИЦ здоровья детей" Минздрава России.
-
Батышева Татьяна Тимофеевна, д.м.н., профессор, главный внештатный детский специалист по медицинской реабилитации МЗ РФ, главный внештатный детский специалист по неврологии ДЗМ, директор ГБУЗ Научно-практический Центр Детской психоневрологии ДЗМ, заведующая кафедрой неврологии, физической и реабилитационной медицины детского возраста МИ ФНМО РУДН, заслуженный врач РФ
-
Беляева Ирина Анатольевна, д.м.н., руководитель отдела преконцепционной, антенатальной и неонатальной медицины НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им.Б.В.Петровского», профессор кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, член Союза педиатров России, Почетный профессор Российской ассоциации специалистов перинатальной медицины
-
Богдан Игорь Ярославович, к.м.н., ведущий научный сотрудник ФГБУГБУЗ Научно-практический Центр Детской психоневрологии ДЗМ
-
Бойцова Евгения Викторовна, д.м.н., профессор кафедры пропедевтики детских болезней с курсом общего ухода за детьми ФГБОУ ВО СПбГПМУ Минздрава России, заведующая лабораторией детской пульмонологии НИИ пульмонологии ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. академика И.П. Павлова» Минздрава России, главный пульмонолог Ленинградской области.
-
Бомбардирова Елена Петровна, д.м.н., главный научный сотрудник отдела преконцепционной, антенатальной и неонатальной медицины НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им.Б.В.Петровского», врач-неонатолог
-
Буров Артем Александрович, к.м.н., заведующий отделением анестезиологии-реанимации и интенсивной терапии новорожденных Отдела неонатальной и детской хирургии Института неонатологии и педиатрии ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России¸ член Совета Российского общества неонатологов
-
Быкова Ольга Владимировна, д.м.н., заведующий научно-исследовательским отделом ГБУЗ Научно-практический Центр детской психоневрологии ДЗМ, профессор кафедры неврологии, физической и реабилитационной медицины детского возраста ФНМО МИ РУДН
-
Вашакмадзе Нато Джумберовна, д.м.н., руководитель отдела орфанных болезней и профилактики инвалидизирующих заболеваний НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им.Б.В.Петровского» профессор кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России
-
Вишнёва Елена Александровна, д.м.н., профессор РАН, заместитель руководителя НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им.Б.В.Петровского» по научной работе, профессор кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, член Союза педиатров России
-
Володин Николай Николаевич, акад. РАН, профессор, д.м.н.; президент Российской ассоциации специалистов перинатальной медицины, президент Ассоциация специалистов в области перинатальной медицины, оказания помощи беременной женщине и плоду, новорожденному и ребенку в возрасте до 3-х лет (АСПМ+)
-
Гребенников Владимир Алексеевич, профессор, д.м.н., член Российской ассоциации специалистов перинатальной медицины, Российский национальный исследовательский медицинский университет им. Н.И. Пирогова, Москва
-
Давыдова Ирина Владимирован, д.м.н., заведующая кафедрой педиатрии и общественного здоровья института подготовки медицинских кадров, главный научный сотрудник лаборатории неонатологии и проблем здоровья раннего детского возраста, ФГАУ «НМИЦ здоровья детей» Минздрава России, член Ассоциации Здоровье Детей.
-
Жесткова Мария Александровна, к.м.н., доцент кафедры педиатрии Медицинского института ФГАОУ ВО "Российский университет дружбы народов".
-
Иванов Дмитрий Олегович, профессор, д.м.н., ректор ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России, Главный неонатолог Минздрава России, член Правления Российской ассоциации специалистов перинатальной медицины, член Союза педиатров России, Европейской ассоциации перинатальной медицины
-
Ионов Олег Вадимович, д.м.н., заведующий ОРИТ имени проф. А.Г. Антонова Института неонатологии и педиатрии ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России, профессор кафедры неонатологии Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» МЗ РФ (Сеченовский Университет), Председатель Российского общества неонатологов
-
Ионушене Светлана Владимировна, к.м.н., ассистент кафедры педиатрии ИГМАПО филиал ФГБУ ДПО РМАНПО МЗ РФ, врач-анестезиолог-реаниматолог ОГАУЗ Иркутский городской перинатальный центр, главный внештатный неонатолог Минздрава Росси по СФО, член Российского общества неонатологов.
-
Карпова Анна Львовна, к.м.н., заместитель главного врача по неонатологии ГБУЗ г.Москвы ГКБ №67 им. Л.А. Ворохобова ДЗМ, ассистент кафедры поликлинической терапии, клинической лабораторной диагностики и медицинской биохимии ИПДО ФГБОУ ВО ЯГМУ Минздрава России, Ярославль, Российская Федерация, член Совета Российского общества неонатологов.
-
Киртбая Анна Ревазиевна, д.м.н., заведующая по клинической работе ОРИТ имени проф. А.Г. Антонова Института неонатологии и педиатрии ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России, профессор кафедры неонатологии Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), член Российского общества неонатологов
-
Климов Юрий Андреевич, к.м.н., ведущий преподаватель НЦДП ДЗМ, доцент кафедры физической реабилитационной медицины, психологии, неврологии детского возраста РУДН
-
Кустова Ольга Владимировна, врач-рентгенолог ФГАУ «НМИЦ здоровья детей» Минздрава России
-
Лёнюшкина Анна Алексеевна, к.м.н., заведующая ОРИТ № 2 Института неонатологии и педиатрии ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России, член Совета Российского общества неонатологов
-
Мебелова Инесса Исааковна, заместитель главного врача по неонатологии ГБУЗ Республики Карелия "Республиканский перинатальный центр", главный внештатный неонатолог Министерства здравоохранения Республики Карелия.
-
Мостовой Алексей Валерьевич, к.м.н., руководитель службы анестезиологии и реанимации отделения реанимации и интенсивной терапии для новорожденных №1 ГБУЗ г.Москвы ГКБ №67 им. Л.А. Ворохобова ДЗМ, ассистент кафедры поликлинической терапии, клинической лабораторной диагностики и медицинской биохимии ИПДО ФГБОУ ВО ЯГМУ Минздрава России, Ярославль, Российская Федерация член Совета Российского общества неонатологов
-
Намазова-Баранова Лейла Сеймуровна, акад. РАН, профессор, д.м.н., президент Союза педиатров России; паст-президент EPA/UNEPSA; руководитель НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им.Б.В.Петровского», заведующая кафедрой факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, главный внештатный детский специалист по профилактической медицине Минздрава России
-
Овсянников Дмитрий Юрьевич, д.м.н., профессор, заведующий кафедрой педиатрии медицинского факультета РУДН, педиатр, пульмонолог, иммунолог-аллерголог, член Российской ассоциации специалистов перинатальной медицины.
-
Павлинова Елена Борисовна, д.м.н., проректор по учебной работе, доцент, заведующая кафедрой госпитальной педиатрии ФГБОУ ВО ОмГМУ Минздрава России.
-
Петрова Наталья Александровна, к.м.н., доцент кафедры детских болезней Института медицинского образования Центра Алмазова, заведующая НИЛ физиологии и патологии новорожденных ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России.
-
Платонова Мария Михайловна, к.м.н., старший научный сотрудник НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им.Б.В.Петровского»
-
Романенко Владислав Александрович, д.м.н., профессор кафедры педиатрии и неонатологии Института дополнительного профессионального образования ФГБОУ ВО «Южно-Уральский государственный медицинский университет» Министерства здравоохранения Российской Федерации, заслуженный врач России, председатель Челябинского регионального отделения Российского общества неонатологов.
-
Рудакова Алеся Анатольевна, старший научный сотрудник, врач анестезиолог-реаниматолог ОРИТ имени проф. А.Г. Антонова, врач ультразвуковой диагностики отдела ультразвуковой диагностики в неонатологии и педиатрии Института неонатологии и педиатрии ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России
-
Рындин Андрей Юрьевич, к.м.н., старший научный сотрудник ОРИТ имени проф. А.Г. Антонова Института неонатологии и педиатрии ФГБУ «НМИЦ АГП имени В.И. Кулакова» Минздрава России¸ доцент кафедры неонатологии Клинического института детского здоровья им. Н.Ф. Филатова ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), член Совета Российского общества неонатологов.
-
Савостьянов Кирилл Викторович, д.б.н., начальник Медико-генетического центра, заведующий лабораторией медицинской геномики, профессор кафедры педиатрии и общественного здоровья Института подготовки медицинских кадров ФГАУ "НМИЦ здоровья детей" Минздрава России, член Ассоциации Здоровье Детей.
-
Сапун Ольга Ильинична, заведующая ОРИТН №2 ДККБ г. Краснодар, главный внештатный неонатолог МЗ Краснодарского края, член Совета Российского общества неонатологов
-
Сахарова Елена Станиславовна, д.м.н., профессор кафедры госпитальной педиатрии №2 педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России.
-
Селимзянова Лилия Робертовна, к.м.н., ведущий научный сотрудник НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им.Б.В.Петровского», доцент кафедры педиатрии и детской ревматологии ФГАОУ «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет), доцент кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, член Союза педиатров России
-
Тихонов Сергей Владимирович, к.б.н., ученый секретарь ГБУЗ «НПЦ ДП ДЗМ», доцент кафедры неврологии, физической и реабилитационной медицины детского возраста ФНМО МИ Российский университет дружбы народов
-
Турти Татьяна Владимировна, д.м.н., главный научный сотрудник отдела преконцепционной, антенатальной и неонатальной медицины НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им.Б.В.Петровского», профессор кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, Член Союза педиатров России
-
Федосеенко Марина Владиславовна, к.м.н., заведующая отделом разработки научных подходов к иммунизации пациентов с отклонениями в состоянии здоровья и хроническими болезнями, ведущий научный сотрудник, врач-педиатр НИИ педиатрии и охраны здоровья детей НКЦ №2 ФГБНУ «РНЦХ им.Б.В.Петровского», доцент кафедры факультетской педиатрии педиатрического факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России, член Союза педиатров России
-
Фисенко Андрей Петрович, профессор, д.м.н., Заслуженный врач РФ, действительный государственный советник РФ II класса; директор ФГАУ «НМИЦ здоровья детей» Минздрава России, председатель Ассоциации Здоровье детей
-
Чубарова Антонина Игоревна, профессор, д.м.н., член Российской ассоциации специалистов перинатальной медицины, Российский национальный исследовательский медицинский университет им. Н.И. Пирогова.
-
Яцык Галина Викторовна, профессор, д.м.н., член Ассоциации Здоровье детей, ФГАУ "НМИЦ здоровья детей" Минздрава России
Приложение А2. Методология разработки клинических рекомендаций
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для сбора/селекции доказательств: доказательной базой для рекомендаций являлись публикации, вошедшие в Кохрановскую библиотеку, базы данных PubMed, EMBASE и MEDLINE, Scopus, Web of Science, e-library, clinicaltrial.gov, электронные библиотеки, клинические рекомендации, размещенные на ресурсах The National Institute for Health and Care Excellence, The European Association of Perinatal Medicine, The European Society for Pediatric Research, The European Foundation for the Care of Newborn Infants, The European Society for Neonatology. Глубина поиска составляла 34 года.
Методы, использованные для оценки качества и силы доказательств:
· консенсус экспертов;
· оценка значимости в соответствии с рейтинговой схемой.
Шкалы оценки уровней достоверности доказательств (УДД) (Таблица 1,2) для методов диагностики, профилактики, лечения и реабилитации (диагностических, профилактических, лечебных, реабилитационных вмешательств) с расшифровкой и шкала оценки уровней убедительности рекомендаций (УУР) (Таблица 3) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств).
Методы, использованные для анализа доказательств:
· обзоры опубликованных метаанализов;
· систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств.
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучалась для того, чтобы убедиться в ее валидности. Методологическое изучение базировалось на вопросах, которые сфокусированы на тех особенностях дизайна исследований, которые оказывают существенное влияние на валидность результатов и выводов.
Для минимизации потенциальных ошибок субъективного характера каждое исследование оценивалось независимо, по меньшей мере, двумя членами рабочей группы. Какие-либо различия в оценках обсуждались всей группой в полном составе. При невозможности достижения консенсуса привлекался независимый эксперт.
Экономический анализ:
Анализ стоимости не проводился, и публикации по фармакоэкономике не анализировались
Метод валидизации рекомендаций:
· внешняя экспертная оценка;
· внутренняя экспертная оценка.
Описание метода валидизации рекомендаций:
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых попросили прокомментировать, прежде всего, то, насколько интерпретация доказательств, лежащих в основе рекомендаций, доступна для понимания.
Получены комментарии со стороны врачей первичного звена и участковых педиатров в отношении доходчивости изложения рекомендаций и их оценки важности рекомендаций, как рабочего инструмента повседневной практики.
Предварительная версия была также направлена рецензенту, не имеющему медицинского образования, для получения комментариев, с точки зрения перспектив пациентов.
Комментарии, полученные от экспертов, тщательно систематизировались, и обсуждались председателем и членами рабочей группы. Каждый пункт обсуждался, и вносимые в результате этого изменения в рекомендации регистрировались. Если же изменения не вносились, то регистрировались причины отказа от внесения изменений.
Консультация и экспертная оценка:
Последние изменения в настоящих рекомендациях представлены для дискуссии в предварительной версии. Обновленная версия для широкого обсуждения была размещена на сайте Российского общества неонатологов (РОН) www.neonatology.pro,·Российской ассоциации специалистов перинатальной медицины (РАСПМ) www.raspm.ru и Союза педиатров России www.pediatr-russia.ru для того, чтобы все заинтересованные лица имели возможность принять участие в обсуждении и совершенствовании рекомендаций.
Проект рекомендаций рецензирован независимыми экспертами, которых попросили прокомментировать, прежде всего, доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Целевая аудитория данных клинических рекомендаций:
-
Врачи-педиатры, врачи-неонатологи;
-
Врачи-реаниматологи;
-
Врачи-пульмонологи;
-
Врачи общей практики (семейные врачи);
-
Студенты медицинских ВУЗов;
-
Обучающиеся в ординатуре и интернатуре.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1 |
Систематический обзор РКИ с применением мета-анализа |
|
2 |
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
|
3 |
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
|
5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР |
Расшифровка |
|---|---|
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утвержденным КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Приложение А3.1 Связанные документы
-
Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» от 21.11.2011 № 323 Ф3.
-
МЗ РФ, Приказ от 10 мая 2017 г. N 203н «Об утверждении критериев оценки качества медицинской помощи».
-
Международная классификация болезней, травм и состояний, влияющих на здоровье, 10-го пересмотра (МКБ-10) (Всемирная организация здравоохранения) версия 2019.
-
Номенклатура медицинских услуг (приказ Минздрава России от 13 октября 2017 г. N 804н).
-
Порядок оказания медицинской помощи по профилю «Неонатология» (Приказ Министерства здравоохранения РФ от 15 ноября 2012 г. N 921н).
-
Перечень жизненно необходимых и важнейших лекарственных препаратов на 2023 г. (Распоряжение Правительства РФ от 12 октября 2019 г. N 2406-р).
-
Порядок оказания медицинской помощи: Приказ Министерства здравоохранения и социального развития РФ от 16 апреля 2012 г. N 366н "Об утверждении Порядка оказания педиатрической помощи"
-
Приказ Минздрава России от 20.12.2012 N 1204н «Об утверждении стандарта специализированной медицинской помощи детям при хронических болезнях органов дыхания, развившихся в перинатальном периоде (этап реабилитации после выписки из неонатологического стационара)»
-
Приказ Министерства здравоохранения Российской Федерации от 06.12.2021 № 1122н "Об утверждении национального календаря профилактических прививок, календаря профилактических прививок по эпидемическим показаниям и порядка проведения профилактических прививок"
-
Федеральный закон "О внесении изменений в Федеральный закон "Об основах охраны здоровья граждан в Российской Федерации" по вопросам оказания паллиативной медицинской помощи" от 06.03.2019 № 18-ФЗ.
-
Приказ Минздрава России № 345н, Минтруда России от 31.05.2019 № 372н «Об утверждении положения об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья».
-
Приказ Минздрава России № 348н от 31 мая 2019 года «Об утверждении перечня медицинских изделий, предназначенных для поддержания органов и систем организма человека, предоставляемых для использования на дому».
-
Приказ Минздрава России № 505н от 10 июля 2019 года «Об утверждении Порядка передачи от медицинской организации пациенту (его законному представителю) медицинских изделий, предназначенных для поддержания функций органов и систем организма человека, для использования на дому при оказании паллиативной медицинской помощи».
-
Приказ МЗ РФ и Министерства труда и социальной защиты РФ от 31 мая 2019 №345н/372н «Об утверждении Положения об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья».
Приложение А3.2 Артериальное давление (мм.рт.ст.) у доношенных и недоношенных новорожденных детей после 14 суток жизни [202–204]
|
Возраст после зачатия |
50 перцентиль |
95 перцентиль |
99 перцентиль |
|---|---|---|---|
|
42 недели |
|||
|
САД |
85 |
98 |
102 |
|
ДАД |
50 |
65 |
70 |
|
СрАД |
62 |
76 |
81 |
|
40 недель |
|||
|
САД |
80 |
95 |
100 |
|
ДАД |
50 |
65 |
81 |
|
СрАД |
60 |
75 |
80 |
|
38 недель |
|||
|
САД |
77 |
92 |
97 |
|
ДАД |
50 |
65 |
70 |
|
СрАД |
59 |
74 |
79 |
|
36 недель |
|||
|
САД |
72 |
87 |
92 |
|
ДАД |
50 |
65 |
70 |
|
СрАД |
57 |
72 |
71 |
|
34 недели |
|||
|
САД |
70 |
85 |
90 |
|
ДАД |
40 |
55 |
60 |
|
СрАД |
50 |
65 |
70 |
|
32 недели |
|||
|
САД |
68 |
83 |
88 |
|
ДАД |
40 |
55 |
60 |
|
СрАД |
48 |
62 |
69 |
|
30 недель |
|||
|
САД |
65 |
80 |
85 |
|
ДАД |
40 |
55 |
60 |
|
СрАД |
48 |
65 |
68 |
|
28 недель |
|||
|
САД |
60 |
75 |
80 |
|
ДАД |
38 |
50 |
54 |
|
СрАД |
45 |
58 |
63 |
|
26 недель |
|||
|
САД |
55 |
72 |
77 |
|
ДАД |
30 |
50 |
56 |
|
СрАД |
38 |
57 |
63 |
САД ― систолическое артериальное давление; ДАД ― диастолическое артериальное давление, срАД – среднее артериальное давление.
Приложение А3.3 Оценка степени дыхательной недостаточности [4].
|
Степень ДН |
PaO2, мм рт. ст. |
SpO2, % |
|---|---|---|
|
Норма |
≥ 80 |
≥ 95 |
|
I |
60 – 79 |
90– 94 |
|
II |
40 – 59 |
75 – 89 |
|
III |
< 40 |
< 75 |
PaO2 - парциальное давление кислорода в артериальной крови, SaO2 - Сатурация кислородом артериальной крови, ДН – дыхательная недостаточность
Приложение А3.4 Рентгенологическая картина, легочная механика и респираторные стратегии при РДС и БЛД [111].
|
Параметры |
РДС |
БЛД |
|---|---|---|
|
Рентгенологическая картина |
Гомогенное снижение воздушности легочной ткани |
Чередование участков легочной ткани с повышенной (эмфизема) и сниженной воздушностью (мигрирующие ателектазы) |
|
Легочная механика |
Низкий комплайнс Нормальная резистентность дыхательных путей |
Нормальный или умеренно сниженный комплайнс Высокая резистентность дыхательных путей |
|
Направленность респираторных стратегий |
Предотвращение волюмотравмы: использование минимального ДО, высокой (физиологической) частоты и короткого времени вдоха |
Оптимизация газообмена; уменьшение риска ателектазирования и формирования «воздушных ловушек», уменьшение работы дыхания, обеспечение роста и развития |
|
Продолжительность ИВЛ |
Минимально возможная продолжительность ИВЛ Как можно наиболее быстрая экстубация |
Продолжительность ИВЛ с постепенным отлучением от респиратора |
|
Патофизиологически обоснованные параметры ИВЛ |
ДО – 4-6 мл/кг Тinsp – 0,25-0,4 сек ЧД – 40-60 в мин |
ДО – 8-12 мл/кг Тinsp >0,6 сек ЧД – 17-20 в мин |
Примечания: ДО – дыхательный объем, Тinsp – время вдоха, ЧД – частота дыхания, Тinsp – время вдоха
Приложение А3.5 Критерии клинической стабильности пациента с тяжелой БЛД для перевода его из ОРИТ домой или в общее стационарное отделение для проведения длительной ИВЛ [145].
|
Для проведения ИВЛ на дому |
Для проведения ИВЛ в общем стационарном или в паллиативном отделении |
|---|---|
|
Клинические |
|
|
Положительная динамика кривой роста и веса |
Нет необходимости в постоянном уходе медперсонала |
|
Выдерживает периоды игр |
Нет инвазивного мониторинга |
|
Нет лихорадки или инфекции |
Нет необходимости во внутривенном введении вазопрессоров или вазодилататоров |
|
Физиологические |
|
|
Стабильные воздухопроводящие пути ≥ 1 месяца после наложения трахеостомы |
≥ 1 недели после операции трахеостомии |
|
PaO2 ≥60 мм рт. ст. при FiO2 ≤0,4 |
SpO2 >92% при FiO2 ≤0,4 |
|
PaCO2 <50 мм рт. ст. (паренхиматозное легочное заболевание) или <45 mmHg (патология грудной стенки или нервно-мышечное заболевание) |
Газы крови в пределах возрастной нормы |
|
Нет необходимости в частых изменениях настроек вентилятора |
Стабильные настройки вентилятора ≥1 недели |
Приложение Б. Алгоритмы действий врача
Приложение Б1. Алгоритм действий врача при назначении системной терапии глюкокортикоидами - #дексаметазон**(код АТХ H02AB).
Приложение В. Информация для пациента
Бронхолегочная дисплазия (БЛД) – это заболевание легких, формирующееся в течение первого месяца жизни у недоношенных детей, получающих респираторную поддержку (ИВЛ, СРАР), вследствие недоразвития дыхательной системы. Диагноз БЛД устанавливается детям, нуждающимся в дополнительном кислороде при самостоятельном или аппаратном дыхании, в возрасте 28 дней и /или 36 недель после зачатия и старше.
БЛД проявляется симптомами дыхательной недостаточности (частое дыхание, одышка, втяжения уступчивых мест грудной клетки), обструкции (сужения) бронхов (свистящее дыхание, хрипы в легких). Осложнениями БЛД являются недостаточность питания, потребность в дополнительной оксигенотерапии, которая может продолжаться после выписки из стационара, повышение давления в малом круге кроообращения (легочная гипертензия).
Исход БЛД зависит от тяжести течения заболевания и определяется к 2-м годам жизни ребенка. В большинстве случаев симптомы постепенно ослабевают по мере роста ребенка и развития его легочной ткани. К неблагоприятным, редко встречающимся последствиям БЛД относятся облитерирующий бронхиолит, бронхиальная астма.
Детям с БЛД показана профилактика ОРИ, в некоторых случаях ингаляционная терапия глюкокортикоидами и бронхолитическая терапия. Очень важно исключение пассивного курения, в том числе электронных сигарет. Когда такие дети вырастут, им тоже нельзя будет курить, работать во вредных производствах, связанных с ингаляионными воздействиями (шахты, химическая, металлургическая промышленнность и т.п.), так как БЛД является фактором риска развития хронической обструктивной болезни легких в молодом возрасте.
Предотвращение тяжелых бронхиолитов путем сезонной пассивной иммунизации против РСВИ определяет благоприятный исход заболевания и улучшает качество жизни детей с БЛД.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Рентгенологическая шкала оценки бронхолегочной дисплазии (А. Greenough и соавт.1999, модифицировано).
Название на русском языке: Рентгенологическая шкала оценки бронхолегочной дисплазии
Оригинальное название: Simple chest radiograph scoring system
Источник: Greenough A, Kavvadia V, Johnson AH, Calvert S, Peacock J, Karani J. A simple chest radiograph score to predict chronic lung disease in prematurely born infants. Br J Radiol. 1999 Jun;72(858):530-3[62]
Тип: шкала оценки
Назначение:
Содержание (шаблон)
|
Баллы Симптомы |
0 |
1 |
2 |
3 |
4 |
|---|---|---|---|---|---|
|
Вздутие1 |
<14 |
14-16 |
>16 |
- |
- |
|
Фиброз/интерстициальные изменения2 |
Нет |
1 зона |
2 зоны |
3 зоны |
4 зоны |
|
Кистозные элементы3 |
Нет |
Маленькие |
Множественные/большие |
|
|
Примечание. 1- число задних отрезков ребер выше диафрагмы билатерально, 2- фокальные области линейной или узловой плотности в пределах зоны (1/2 легкого с каждой стороны); 3- прозрачные интрапарехиматозные поражения с четким контуром
Ключ (интерпретация) и пояснения: высокое значение баллов по данной шкале (≥3) позволяет прогнозировать сохранение кислородозависимости в возрасте недоношенного ребенка 36 недель ПКВ (чувствительность 69%, специфичность 85%, положительная прогностическая значимость 73%).
Приложение Г2. Рентгенографическая шкала тяжести БЛД по данным КТ.
Название на русском языке: Рентгенографическая шкала тяжести БЛД по данным КТ
Оригинальное название: Рентгенографическая шкала тяжести БЛД по данным КТ
Источник (официальный сайт разработчиков, публикация с валидацией): Давыдова И.В., Аникин А.В., Кустова О.В., Сиденко А.В., Басаргина Е.Ю., Павлюкова Е.В., Пожарищенская В.К.Бронхолегочная дисплазия в постсурфактантную эру: результаты объективной оценки течения заболевания. Вопросы современной педиатрии. 2015. Т. 14. № 4. С. 514-518 [205].
Тип: шкала оценки
Назначение: оценка тяжести БЛД по данным КТ
Содержание (шаблон), ключ (интерпретация), пояснения:
|
Признаки
|
Баллы |
||
|---|---|---|---|
|
|
1 |
2 |
3 |
|
Степень пневматизации лёгочной ткани |
умеренное повышение |
повышение, неравномерность |
резкое повышение, неравномерность, буллы |
|
Архитектоника лёгочного рисунка по долям лёгких |
обеднён, не деформирован |
обеднён, умеренно деформирован, интерстиций подчёркнут |
резко обеднён на периферии, деформирован |
|
Перибронхиальные изменения лёгочной ткани |
незначительные |
умеренные, просветы бронхов сужены |
выраженные, просветы деформированы, бронхоэктазы |
|
Распространённость пневмофиброза |
отсутствует |
не выраженный, единичные спайки |
грубый с признаками объёмного уменьшения поражённых сегментов, множественные транспульмональные тяжи |
|
Сердечно – сосудистые изменения: лёгочная гипертензия, кардиомегалии |
отсутствуют |
умеренная лёгочная гипертензия, может быть кардиомегалия |
выраженная кардиомегалия или гипертрофия правого желудочка, лёгочная гипертензия |
|
Результат оценки степени тяжести БЛД |
лёгкое 0 – 5 баллов |
среднетяжёлое 6 – 10 баллов |
тяжёлое 11 – 15 баллов |
Приложение Г3. Технологии оценки ультразвуковых характеристик легких новорожденных по шкалам LUS и eLUS.
Шкала LUS
Название на русском языке: ультразвуковая шкала легких
Оригинальное название: Lung ultrasonography score
Источник: Brat R. et al. Lung ultrasonography score to evaluate oxygenation and surfactant need in neonates treated with continuous positive airway pressure //JAMA pediatrics. – 2015. – Т. 169. – №. 8. – С. doi:10.1001/jamapediatrics.2015.1797 [93]
Тип: шкала оценки
Назначение: оценка риска развития тяжелой и среднетяжелой форм БЛД
Содержание (шаблон): Рисунок 1. Метод оценки ультразвуковых характеристик паренхимы легких по шкале LUS [93].
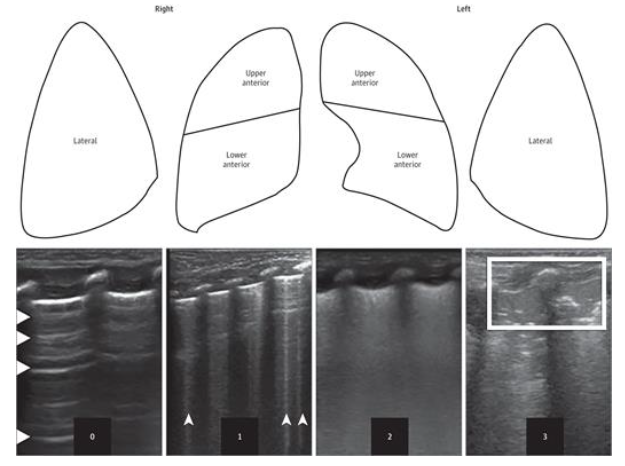
Ключ (интерпретация), пояснения:
Продольное и поперечное сканирование грудной полости проводится высокочастотным линейным датчиком.
Каждое легкое условно делится на переднюю верхнюю , переднюю нижнюю и боковую поверхности. Всего - 6 зон (рисунок 1),
Для каждой из указанных зон исследования проводится оценка ультразвуковой картины легкого в баллах от 0 до 3.
0 баллов – только А-линии (нормальная аэрация легкого)
1 балл – наличие А-линий и не менее 3х В-линий (интерстициальный паттерн)
2 балла – наличие сливающихся В-линий без консолидаций или консолидации ограниченные субплевральным пространством (альвеолярный паттерн)
3 балла – наличие распространенных консолидаций
Суммарная оценка по шкале LUS может составить 0-18 баллов
Оценка состояния паренхимы легких при помощи ультразвука на 7 и 14 сутки жизни обладает высокой предиктивной ценностью в отношении развития среднетяжелой и тяжелой форм БЛД при оценке по шкале LUS в 8 и более баллов
Шкала eLUS
Название на русском языке: ультразвуковая шкала легких (расширенная версия)
Оригинальное название: extended version Lung ultrasonography score
Источник: Loi B. et al. Lung ultrasound to monitor extremely preterm infants and predict bronchopulmonary dysplasia. A multicenter longitudinal cohort study //American Journal of Respiratory and Critical Care Medicine. – 2021. – Т. 203. – №. 11. – С. 1398-1409.PubMed: 33352083 [89].
Тип: шкала оценки
Назначение: оценка риска развития тяжелой и среднетяжелой форм БЛД
Оценка состояния паренхимы легки при помощи ультразвука на 7 и 14 сутки жизни обладает высокой предиктивной ценностью в отношении развития среднетяжелой и тяжелой форм БЛД жизни при оценке по шкале eLUS - 14 и более баллов.
Содержание (шаблон): Рисунок 2. Метод оценки ультразвуковых характеристик паренхимы легких по шкале eLUS [89].
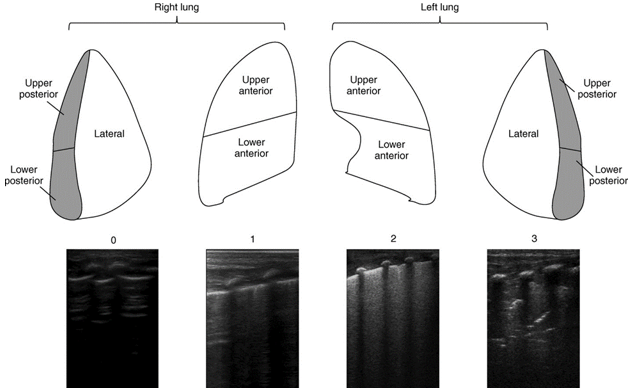
Ключ (интерпретация), пояснения:
Продольное и поперечное сканирование грудной полости проводится высокочастотным линейным датчиком.
Каждое легкое условно делится для шкалы eLUS на переднюю верхнюю , переднюю нижнюю, боковую, заднюю верхнюю и заднюю нижнюю поверхности. Всего 10 зон (рисунок 2).
Для каждой из указанных зон исследования проводится оценка ультразвуковой картины легкого в баллах от 0 до 3.
0 баллов – только А-линии (нормальная аэрация легкого)
1 балл – наличие А-линий и не менее 3х В-линий (интерстициальный паттерн)
2 балла – наличие сливающихся В-линий без консолидаций или консолидации ограниченные субплевральным пространством (альвеолярный паттерн)
3 балла – наличие распространенных консолидаций
Суммарная оценка по шкале eLUS 0-30 баллов.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.