Бронхиальная астма у взрослых
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Общая информация
Краткое описание
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Код(ы) МКБ-10
|
Код
|
Название |
|
J45
|
Астма |
|
J45.0
|
Астма с преобладанием аллергического компонента |
|
J45.1
|
Неаллергическая астма |
|
J45.8
|
Смешанная астма |
|
J45.9
|
Астма неуточненная |
|
J46
|
Астматический статус |
Дата разработки и пересмотра протокола: 2019 (пересмотр 2023 год)
Категория пациентов: взрослые.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов |
Классификация
Классификация БА по степени тяжести
Таблица 2. Классификация впервые выявленной БА по степени тяжести.
|
Характеристики*
|
Интермиттирующая БА | Легкая персистирующая БА | Персистирующая БА средней тяжести | Тяжелая персистирующая БА |
| Дневные симптомы | Реже 1 раза в неделю | Чаще 1 раза в неделю, но реже 1 раза в день |
Ежедневные симптомы;
Ежедневное использование КДБА
|
Ежедневные симптомы;
Ограничение физической активности;
|
| Ночные симптомы | Не чаще 2-х раз в месяц | Не чаще 2-х раз в месяц | Ночные симптомы чаще 1 раза в неделю; | Частые ночные симптомы; |
| Обострения | Обострения короткие |
Обострения могут снижать физическую активность и нарушать сон
|
Обострения могут приводить к ограничению физической активности и нарушению сна
|
Частые обострения |
|
Функциональные
показатели
|
ОФВ1 или ПСВ ≥ 80% от должного; | ОФВ1 или ПСВ ≥ 80% от должного; | ОФВ1 или ПСВ 60—80% от должного; | ОФВ1 или ПСВ ≤60% от должного; |
| Суточная лабильность ПСВ |
Суточная лабильность ПСВ или
ОФВ1 < 20%.
|
Суточная лабильность ПСВ или ОФВ1
20—30%.
|
Суточная лабильность ПСВ или
ОФВ1 > 30%.
|
Суточная лабильность ПСВ или
ОФВ1 > 30%.
|
Тяжесть БА у пациентов, получающих лечение, оценивается ретроспективно, исходя из необходимого для контроля симптомов и обострений объема терапии (Табл. 3).
Таблица 3. Классификация БА по степени тяжести у пациентов, уже получающих базисное лечение (для пациентов, принимающих ингаляционные или системные кортикостероиды)
|
Степень тяжести
|
Определение (ступень терапии) | Получаемое лечение |
| Легкая БА | Астма, которая хорошо контролируется терапией ступени 1 и 2 | Низкие дозы ИГКС-ДДБА по потребности или низкие дозы ИГКС или АЛТР |
| БА средней степени тяжести | Астма, которая хорошо контролируется терапией ступени 3 | Низкие дозы ИГКС/ДДБА |
| Тяжелая БА* | Астма, требующая терапии ступени 4 и 5, для того чтобы сохранить контроль, или БА, которая остается неконтролируемой, несмотря на эту терапию (ступень 5). | Средние или высокие дозы ИГКС/ДДБА, тиотропия бромид**, или фиксированная комбинация ИГКС/ДДБА/ДДАХ, таргетная терапия и/или СГКС |
Оценку можно проводить после 3-4 месяцев комплексной терапии, направленной на контроль заболевания, и, по возможности, после попытки снизить интенсивность терапии для определения ее минимального уровня, эффективного у данного пациента. Поскольку течение БА крайне вариабельно, степень тяжести заболевания может меняться на протяжении месяцев и лет.
| *Диагноз тяжелой БА считается обоснованным после 3-4 месяцев полноценного лечения, соответствующего 4-5 ступеням, при адекватной технике ингаляции, соблюдении рекомендаций врача (должной приверженности лечению), устранении подтвержденных триггеров (домашних, наружных, профессиональных и т.п.), компенсации сопутствующих заболеваний, способных утяжелить течение БА1 |
Таблица 4. Уровни контроля БА
| А. Контроль симптомов астмы | Уровень контроля | |||
|
За последние 4 недели у пациента отмечались:
|
Хорошо контролируемая
|
Частично контролируемая
|
Неконтролируемая
|
|
| Дневные симптомы чаще, чем 2 раза в неделю |
ДА☐
НЕТ☐
|
Ничего из перечисленного |
1-2 из
перечисленного
|
3-4 из
перечисленного
|
| Ночные пробуждения из- за БА |
ДА☐
НЕТ☐
|
|||
|
Потребность в препарате для купирования симптомов чаще, чем 2 раза в неделю
|
ДА☐
НЕТ☐
|
|||
| Любое ограничение активности из-за БА |
ДА☐
НЕТ☐
|
|||
| В. Факторы риска для неблагоприятных исходов: | ||||
|
Оценивать факторы риска с момента постановки диагноза и периодически, особенно у пациентов с обострениями.
Функция легких не учитывается при оценке контроля симптомов (но снижение ОФВ1 учитывается как фактор риска обострений).
Измерять функцию легких в начале терапии, через 3-6 месяцев лечения препаратами длительного контроля с целью определения лучшего персонального ОФВ1 пациента, и периодически для оценки риска.
|
||||
|
Потенциально модифицируемые независимые факторы риска обострений БА:
Плохой контроль симптомов астмы
Чрезмерное использование монотерапии КДБА (≥1 ингалятора 200 доз в месяц)
Неадекватная терапия ИГКС: не назначались ИГКС; плохая
приверженность; неправильная техника ингаляции
Низкий ОФВ1, особенно <60% должного
Существенные психологические/социально-экономические проблемы
Контакт с триггерами: курение, аллергены
Коморбидные состояния: ожирение, риносинуситы, подтвержденная
пищевая аллергия
Эозинофилия мокроты или крови
Беременность
Другие важные независимые факторы риска обострений:
Интубация или лечение в отделении интенсивной терапии по поводу БА
≥ 1 тяжелого обострения за последние 12 месяцев
|
Наличие одного или более из этих факторов повышает риск обострений*,
**даже если симптомы хорошо контролируются
|
|||
|
Факторы риска для развития фиксированной обструкции дыхательных путей
Отсутствие или недостаточная ИГКС терапия
Экспозиция с: табачным дымом, вредными химическими, профессиональными агентами
Низкий исходный ОФВ1, хроническая гиперсекреция слизи, эозинофилия мокроты или крови
|
||||
|
Факторы риска для развития нежелательных побочных эффектов лекарств
Системные: частое применение системных ГКС; длительное применение высоких доз или применение сильнодействующих ИГКС; также применение Р450- ингибиторов
Локальные: высокие дозы или сильнодействующие ИГКС, плохая техника ингаляции
|
||||
|
*При любом обострении необходимо рассмотрение поддерживающей терапии с целью оценки ее адекватности
**По определению, неделя с обострением – это неделя неконтролируемой БА
|
||||
Фенотипы БА [1-6]:
• Аллергическая БА - часто начинается в детстве, связана с наличием других аллергических заболеваний (атопический дерматит, аллергический ринит, пищевая аллергия) у пациента или родственников. Для этого фенотипа характерно эозинофильное воспаление дыхательных путей. Пациенты с фенотипом аллергической БА обычно хорошо отвечают на терапию ингаляционными глюкокортикостероидами (ИГКС). • Неаллергическая БА: Часть пациентов имеют астму, не связанную с аллергией. Клеточный профиль воспаления дыхательных путей может быть эозинофильным, нейтрофильным, смешанным или малогранулоцитарным. Пациенты с неаллергической астмой часто демонстрируют меньший ответ на терапию ИГКС.
Обострения БА представляют собой эпизоды нарастающей одышки, кашля, свистящих хрипов, или заложенности в грудной клетке, требующие изменений обычного режима терапии. Для обострения БА характерно снижение ПСВ и ОФВ1.
Таблица 5. Степени тяжести обострений БА
| Умеренно тяжелое (средней степени тяжести) обострение астмы |
Один из следующих критериев:
- Усиление симптомов
- ПСВ 50-75% от лучшего или расчетного результата
- Повышение частоты использования препаратов скорой помощи ≥50% или дополнительное их применение в форме небулайзера
- Ночные пробуждения, обусловленные возникновением симптомов бронхиальной астмы и требующие применения препаратов скорой помощи
|
| Тяжелое обострение астмы |
Один из следующих критериев:
- ПСВ 33-50% от лучших значений
- Частота дыхания ≥25 в мин
- Пульс ≥ 110 в мин
- Невозможность произнести фразу на одном выдохе
|
| Жизнеугрожающая астма |
Один из следующих критериев:
- ПСВ < 33% от лучших значений
- Цианоз, SрO2 < 92%
- PaO2 < 60 мм рт.ст. Нормокапния (РаСО2 35-45 мм рт.ст.)
- Слабые дыхательные усилия, "немое" легкое
- Брадикардия, Гипотензия
- Утомление, Оглушение, Кома
|
|
Астма, близкая к
фатальной
|
- Гиперкапния (РаСО2 > 45 мм рт.ст.) и/или
- Потребность в проведении механической вентиляции легких
|
Астматический статус определяется как не купирующийся приступ бронхиальной астмы длительностью 6 часов и более с развитием резистентности к симпатомиметическим препаратам, нарушением дренажной функции бронхов и возникновением гипоксемии и гиперкапнии [4,50] В современных классификациях термин «астматический статус» соответствует критериям и эквивалентен понятиям «жизнеугрожающая БА» и «БА, близкая к фатальной» [26].
Диагностика
Диагностические критерии
Жалобы и анамнез (УД А)
Основными критериями диагностики БА являются [1]:
Пикфлоуметрия – определение пиковой скорости выдоха (ПСВ). Регистрируется лучший показатель после 3 попыток выполнения форсированного маневра с паузой, не превышающей 2 сек после вдоха. Маневр выполняется сидя или стоя. Прирост ПСВ после ингаляции бронхолитика на 60 л/мин (или на величину ≥20%ПСВ, измеренной до ингаляции бронхолитика) либо изменение ПСВ в течение суток более чем на 10% указывают на наличие БА.
Таблица 6. Методы оценки воспаления дыхательных путей: [12, 26]
|
Тест
|
Норма | Валидность | |
|
Чувствительность
|
Специфичность | ||
| Метахолиновая ПК20 | >8 мг/мл | Высокая | Умеренная |
| Физическая нагрузка |
Падение ОФВ1
>10% от исходн. значений
|
Умеренная | Высокая |
| FENО | <25 ppb | Высокая# | Средняя |
| Эозинофилы крови* | <4% | Высокая# | Средняя |
| Эозинофилы в мокроте | <2% | Высокая# | Средняя |
|
Вариабельность ПСВ
(% от максимума)
|
<8**
<20%***
|
Низкая | Средняя |
Эозинофильный катионный белок (ЕСР), триптаза, обнаружение сенсибилизированных лимфоцитов, базофилов – дополнительные методы подтверждения наличия аллергического процесса.
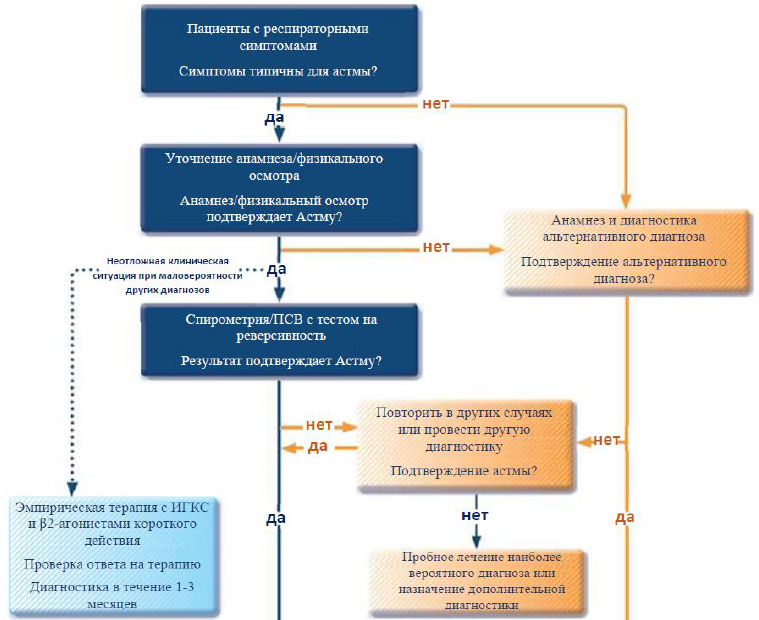

Таблица 7. Диагностические критерии для постановки впервые выявленной БА [1, 18]
| Анамнез заболевания | |
| Критерии | Данные, подтверждающие диагноз |
|
Свистящее дыхание
Одышка
Кашель
Чувство скованности в груди
|
Имеется 2 и более симптомов
Отмечается изменение симптомов с течением времени, а также вариабельность по интенсивности
Симптомы часто ухудшаются в ночное время или при нагрузках
Симптомы чаще провоцируются физнагрузкой, смехом, аллергенами, холодным воздухом, вирусной инфекцией
|
| Наличие подтвержденной обструкции | |
| Документальное подтверждение нарушения скорости выдоха | На фоне снижения ОФВ1 наблюдается снижение ОФВ1/ФЖЕЛ относительно нижней границы нормы |
| Положительная проба с бронхолитиком | Прирост ОФВ1>12% и >200 мл (достовернее ОВФ1>15% и 400 мл). До теста не использовать КДБА≥4ч, ДДБА двухкратного применения 24 ч, ДДБА однократного приема 36 ч |
| Вариабельность показателей ПСВ, измеряемого 2 раза в день в течение 2 недель | Среднесуточная вариабельность ПСВ>10% |
| Улучшение функции легких после 4-х недель противовоспалительной терапии | Прирост ОФВ1> 12% или >200 мл или ПСВ>20% по сравнению с исходным уровнем |
| Положительный тест с физической нагрузкой | Снижение ОФВ1>10% и >200 мл от исходного уровня |
| Положительный бронхопровокационный тест | Снижение показателя ОФВ1 на 20% при стандартных дозах метахолина |
| Вариабельность показателей спирографии между приемами | Колебания ОФВ1>12% или >200 мл между приемами, необходимо исключить случаи респираторной инфекции |
Таблица 8. Диагностические критерии, подтверждающие БА на фоне получаемого лечения [1, 18]
|
Критерии
|
Данные, подтверждающие диагноз |
| Вариабельность респираторных симптомов и наличие обструкции | Подтверждение диагноза БА. Оценка уровня контроля и пересмотр базисной терапии |
| Вариабельность респираторных симптомов, но без наличия обструкции |
Повторить спирографию после отмены бронходилататора (4 ч КДБА, 24 ч для двухкратного применения ГКС-ДДБА, 36 ч для ГКС-ДДБА один раз в сутки) или во время приступа.
Если ОФВ1>70% от ожидаемого: проведите бронхопровокационный тест. Если результат отрицательный, рассмотрите переход на ступень ниже базисной терапии и пересмотреть через 2-4 недели
Если ОФВ1<70% от ожидаемого: перейти на следующую ступень терапии с контролем через 3 месяца (повторить спирографию и оценить симптомы)
|
| Наличие респираторных симптомов, нормальная функция легких и отсутствие обструкции |
Провести спирографию с бронхолитиком, также после отмены бронходилататора. Если показатели в норме, рассмотреть альтернативный диагноз.
Рассмотреть переход на ступень ниже
Если симптомы возобновились и снижается функция легких: астма подтверждается. Перейти на следующую ступень до предыдущей наименьшей эффективной дозы
Если нет изменений в симптомах или функции легких на самых низких дозах базисной терапии: отменить базисную терапию и наблюдать за пациентов в течение последующих 12 месяцев
|
| Постоянная нехватка воздуха и постоянная обструкция |
Рассмотреть переход на следующую ступень сроком на 3 месяца, затем повторно оценить функцию легких и симптомы
Если нет ответа на терапию, возобновить предыдущее лечение и направить пациента на дообследование. Рассмотреть вероятность астма-ХОБЛ оверлап синдрома
|
У пациентов с БА могут иметь место другие заболевания, являющиеся причинами бронхиальной обструкции, что усложняет интерпретацию проведенных исследований. Особенно часто могут сочетаться БА и хроническая обструктивная болезнь легких (ХОБЛ).
Дифференциальный диагноз
Дифференциальная диагностика БА у взрослых
Отсутствие бронхиальной обструкции:
Наличие бронхиальной обструкции:
Таблица 9. Дифференциальный диагноз при уточнении диагноза БА:
|
Диагноз
|
Обоснование для дифференциальной диагностики | Методы обследования | Критерии исключения альтернативного диагноза |
|
ХОБЛ, Asthma-COPD overlap
|
Сходность симптоматики, частые обострения, неполный эффект от терапии, возраст пациента старше 40 лет, курение в анамнезе, признаки бронхита и гиперинфляции на рентгенограмме и КТ | Спирометрия с пробой с бронхолитиком, мониторинг пикфлоуметрии, анализ мокроты, специфическая аллергодиагност ика in vitro / in vivo |
Начало заболевания ранее 20 лет, отсутствие анамнеза длительного курения или воздействия патогенных частиц. Симптомы ухудшаются ночью или утром, связаны с контактом с аллергенами или неспецифическими раздражителями
Симптомы варьируют в течение суток или недель
Семейный или личный отягощенный аллергоанамнез. Установленный ранее диагноз Астмы.
ФВД может быть нормальной в межприступном периоде или сильно варьировать с течением времени
Наличие сенсибилизации к различным аллергенам, влияние которых анамнестически связано с астмой.
Эозинофилия мокроты.
|
| Поражения ВДП (синдром хронического кашля при поражении ВДП, дисфункция голосовых связок, инородные тела, полипоз и т.п.) |
Инспираторная одышка или чувство нехватки воздуха, превалирование кашля над обструктивными изменениями, характерный
анамнез
|
Риноскопия, ларингоскопия, бронхоскопия, рентген и/или КТ придаточных пазух носа, грудной клетки, консультация ЛОР-врача | Отсутствие поражения ВДП характерное для данных заболеваний, заключение ЛОР- врача, исключающее данные патологии. |
| Гастроэзофагеальный рефлюкс |
Наличие гастроэзофагеальной симптоматики, анамнеза язвенной болезни желудка, эрозивного гастрита и т.п.
Отсутствие эффекта от бронхолитической терапии.
|
ФГДС, суточное мониторирование рН | Нормальные или почти нормальные показатели ФГДС, отрицательные пробы на НР. Отсутствие эффекта от антирефлюксной терапии. |
|
Аллергический
бронхолегочный аспергиллез
|
Частые обострения, недостаточный эффект от терапии,
присоединение кровохарканья
|
Аллергодиагностика in vitro, анализ мокроты, бронхоскопия с анализом смывов, рентгенография легких |
Отсутствие высоких титров общего IgE и специфических IgE и IgE к Aspergillus spp.
Отсутствие признаков грибковой контаминации в мокроте и смывах.
Отсутствие эффекта от противогрибковой терапии.
|
| Бронхоэктазы | Частые обострения, большое количество мокроты, особенно слизисто-гнойной, прогрессирующее течение, недостаточный эффект от терапии | Рентгенография и КТ легких, бронхоскопия, анализы мокроты |
Отсутствие характерных признаков бронхоэктазов при имидж-диагностике, бронхоскопии, диффузное поражение нижних дыхательных путей.
Эозинофильный характер воспаления.
|
|
Интерстициальны е поражения легких
(фиброзирующие заболевания, поражения легких при ревматологически х патологиях и т.п.)
|
Прогрессирующее течение, превалирование симптомов дыхательной недостаточности, полиорганное поражение, высокие показатели СОЭ и ревмопроб, отсутствие эффекта от терапии |
ОАК,
Ревмопробы: СРБ, ревмофактор, АСЛО. рентгенография и КТ легких,
бронхоскопия, анализы мокроты,
биопсия легких, консультация ревматолога
|
Отрицательные данные обследования, заключение ревматолога, исключающее
данные патологии.
|
| Туберкулез легких, различные формы | Длительный кашель, кровохарканье, нарастающее истощение пациента, перенесенный ТВС в анамнезе, контакт с больными туберкулезом, характерный социальный статус пациента, очаговые изменений на ФГ, отсутствие эффекта от терапии. |
Рентгенография и КТ легких,
диаскин тест, мокрота на БК, консультация фтизиатра
|
Отрицательные данные обследования на туберкулез легких, заключение фтизиатра, исключающее туберкулез легких. |
| Опухоли легких (центральные и периферические) | Пожилой возраст пациента, длительный кашель, кровохарканье, нарастающее истощение пациента, высокие показатели СОЭ, отсутствие эффекта от терапии |
ОАК,
рентгенография и КТ легких, бронхоскопия, анализы мокроты,
биопсия, консультация онколога
|
Отрицательные данные обследования на новообразования легких, заключение онколога, исключающее опухоль легких |
|
Побочные действия
лекарственных средств
|
Зависимость астматической симптоматики, ее совпадение с приемом различных групп препаратов (ингибиторы АПФ, бета-блокаторы и т.п.) | Консультация кардиолога, пробное лечение с элиминацией провоцирующих факторов. | Отсутствие изменений в астматической симптоматике после отмены данных групп препаратов. |
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ [1-3, 11, 25-36]
Медикаментозное лечение:
Рисунок 2. Ступенчатая терапия БА для контроля симптомов и минимизации будущих рисков [1]
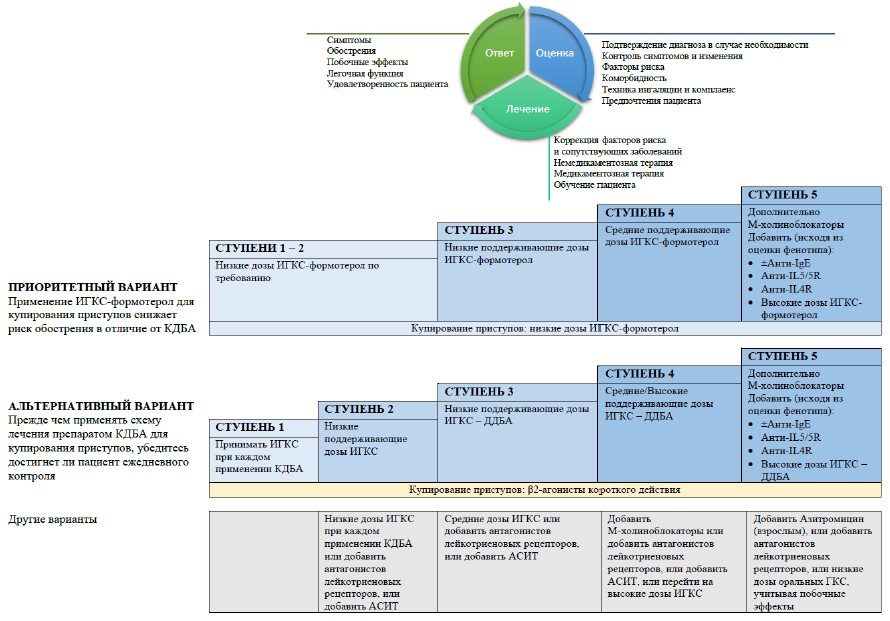
СТУПЕНЬ 5 (тяжелая, неконтролируемая БА на фоне терапии ступени 4, но с сохраняющимися ежедневными симптомами и частыми обострениями).
Требуется добавление дополнительных препаратов – тиотропия в виде мягкого туманного ингалятора (mist soft inhaler) и/или пероральных ГКС в минимальных эффективных дозировках (пациент должен быть информирован о риске развития нежелательных эффектов). При среднетяжелой или тяжелой астме с аллергическим генезом, не контролируемой комбинацией других препаратов (включая высокие дозы ИГКС или пероральные ГКС), целесообразно применение дополнительной терапии (таргетной, биологической).
Критерии применения
Критерии применения
Предикторы хорошего ответа на анти IgE терапию:
Критерии применения Тезепелумаба
Предикторы ответа на ТСЛП-терапию:
Лечение БА в сочетании с АР: нелеченный АР способен ухудшать течение БА (УД А), своевременное лечение АР способно снижать частоту и выраженность обострений БА, особенно при персистирующем, круглогодичном АР с сенсибилизацией к бытовым аллергенам, сопутствующим полипозом носа [33, 44]. Используются топические назальные глюкокортикостероиды и другие препараты. [20, 26].
Применение витамина Д: недостаток витамина Д может привести к нарушению легочной функции, учащению обострений и снижению эффекта ИГКС [43]. Применение витамина Д способствует улучшению контроля астмы и снижению риска обострений.
Рисунок 3. Алгоритм лечения обострения БА на амбулаторном этапе
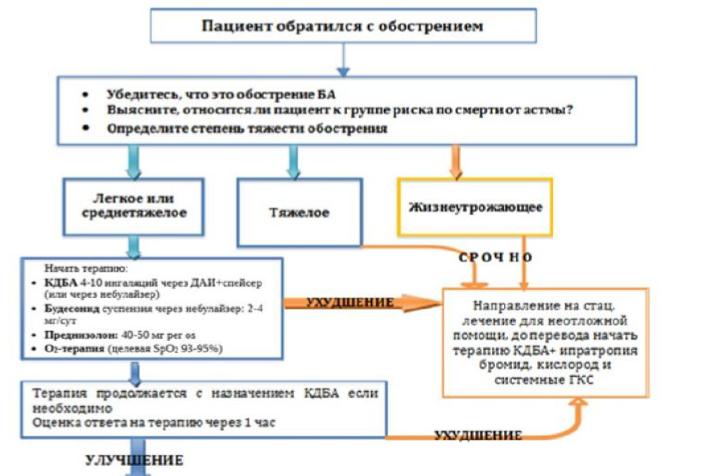

Целями лечения являются как можно более быстрое устранение бронхиальной обструкции и гипоксемии и предотвращение дальнейших рецидивов.
Параллельно с началом терапии проводится оценка тяжести обострения БА (таблица 5). На амбулаторном этапе возможно добиться купирования симптомов умеренно тяжелого (средней степени тяжести) обострение астмы. Обострение астмы тяжелой степени, жизнеугрожающей и астмы близкой к фатальной требует экстренной госпитализации.
Таблица 10. Перечень основных лекарственных средств (имеющих 100% вероятность применения):
|
Фармакотерапевтическая группа
|
Международное непатентованное наименование ЛС | Способ применения | УД |
| Ингаляционные глюкокортикоиды (иГКС) | будесонид | Суспензия для ингаляций, Дозированная (для небулайзера) 0.250, 0.500 мг | А |
| будесонид | ДАИ 200 мкг | А | |
| флутиказон | ДАИ, 50, 125, 250 мкг | А | |
| циклезонид | ДАИ, 80, 160 мкг | А | |
| беклометазон | ДАИ, 100, 250 мкг | А | |
| иГКС в комбинации с формотеролом |
формотерол/
будесонид
|
ДАИ, 4.5/80, 4.5/160, 6/200 мкг | А |
|
формотерол/
будесонид
|
ДПИ (порошок для ингаляций дозированный)
4.5/80, 4.5/160, 9/320 мкг
|
А | |
|
Антагонисты лейкотриеновых
рецепторов
|
монтелукаст | Таблетки 4, 5, 10 мг | А |
| Глюкокортикоиды | преднизолон | Таблетки, 5 мг | А |
| метилпреднизолон | Таблетки, 4, 16 мг | А | |
| преднизолон | Ампулы, 30 мг/мл | А | |
| дексаметазон | Ампулы, 4 мг/мл | А |
Таблица 11. Перечень дополнительных лекарственных средств (менее 100% вероятности применения):
|
Лекарственная группа
|
Международное непатентованное наименование ЛС | Способ применения | УД |
| Глюкокортикоиды | Метилпреднизолон |
Порошок для
приготовления инъекций, 250 мг
|
В |
| Селективные бета-2 -адреномиметики | Сальбутамол | ДАИ, 100 мкг | А |
| Сальбутамол | Раствор для ингаляций (через небулайзер, 5 мг/мл) | А | |
| КДБА в сочетании с антихолинергическими средствами |
Фенотерол/
ипратропий
|
ДАИ, 50/21 мкг | А |
|
Фенотерол/
ипратропий
|
Раствор для небулайзера, 25/12.5 мг/мл | А | |
| Длительно действующие В2-агонисты в комбинации иГКС |
Сальметерол/
Флутиказон
|
ДАИ, 25/50, 25/125, 25/250 мкг | А |
|
Сальметерол/
Флутиказон
|
ДПИ (порошок для ингаляций дозированный)
50/100, 50/250, 50/500 мкг
|
А | |
|
Вилантерол/
Флутиказон
|
ДПИ (порошок для ингаляций дозированный)
22/92, 22/184 мкг
|
А | |
|
Формотерол/
беклометазон
|
ДПИ (порошок для ингаляций дозированный)
6/100 мкг
|
А | |
| Антихолинергические средства | Тиотропия бромид | Раствор для ингаляций в 2.5 мкг/доза | А |
| Порошок для ингаляций, 18 мкг/доза | В | ||
|
Адрено- и
допаминомиметики
|
Эпинефрин | Ампулы, 0.18% | А |
| Назальные кортикостероиды | Мометазон | Назальный спрей, 50 мкг | В |
| Беклометазон | Назальный спрей, 50 мкг | В | |
| Флутиказон |
Назальный спрей, 27.5, 50
Мкг
|
В | |
|
Моноклональные антитела,
связывающие свободный IgE
|
Омализумаб |
Порошок для
приготовления инъекций, 150 мг
|
В |
| Моноклональные антитела к рецептору интерлейкина 5 | Бенрализумаб | раствор для подкожного введения, 30 мг/1 мл | В |
| Моноклональные антитела к IL-4Рα | Дупилумаб* | Раствор для подкожного введения 150 мг/мл, 175 мг/мл | В |
| Моноклональные антитела к тимусному стромальному лимфопоэтину | Тезепелумаб* | Раствор для подкожного введения, 210 мг, 110 мг/1 мл | В |
Хирургическое вмешательство: нет.
Дальнейшее ведение:
Таблица 12. Возможные варианты уменьшения объема терапии (ступень вниз):
|
Ступень
|
Обьем терапии | Варианты снижения терапии | УД |
| Ступень 5 |
Высокие дозы ИГКС/ДДБА и оральных кортикостероидов
Высокие дозы ИГКС/ДДБА и др.препараты
|
Продолжить высокие дозы ИГКС/ДДБА и уменьшать до отмены оральные кортикостероиды (ОКС)
Альтернирующая схема лечения ОКС
Заменить ОКС на высокие дозы ИГКС
Консультация специалиста (пульмонолог, аллерголог)
|
D
D
D
D
|
| Ступень 4 |
Средние и высокие дозы ИГКС/ДДБА
Высокая доза ИГКС плюс второй контролирующий препарат
|
Продолжение комбинации ИГКС/ДДБА снизить дозу ИГКС на 50% (прекращение ДДБА может привести к ухудшению)
Уменьшить дозу ИГКС на 50% и продолжение приема второго контролирующего препарата
|
B
B |
| Ступень 3 |
Низкие дозы ИГКС/ДДБА
Средние или высокие дозы ИГКС
|
Уменьшите ИГКС/ДДБА до одного раза в день
Уменьшение дозы ИГКС на 50%
|
D
A |
| Ступень 2 |
Низкие дозы ИГКС
Низкие дозы ИГКС или АЛР
|
Перевод на однократный прием ИГКС (будесонид, циклесонид, мометазон)
• Добавление АЛР со снижением дозы ИГКС
• Рассмотрите возможность прекращения контролирующего лечения у пациентов, в случае отсутствия симптомов в течение 6–12 месяцев отсутствие факторов риска (табл. 3)
• Полное прекращение применения ИГКС у взрослых не рекомендуется, в связи с высоким риском обострения
|
A
B D A |
Лечение (стационар)
Карта наблюдения пациента, маршрутизация пациента.
Пациенты с жизнеугрожающим обострением БА нуждаются в госпитализации непосредственно в ОРИТ, основные показания: слабые респираторные усилия, «немое легкое», цианоз, брадикардия или гипотензия, спутанность сознания или кома. При стабилизации состояния пациент переводится в профильное отделение.
Гипоаллергенная элиминационная диета.
Кислородотерапия:
Основные мероприятия по лечению обострений включают (в порядке их назначения и в зависимости от тяжести обострений) повторные ингаляции бронхолитиков быстрого действия, раннее применение системных ГКС, добавление или увеличение доз ИГКС, кислородотерапию.
Целями лечения являются как можно более быстрое устранение бронхиальной обструкции и гипоксемии и предотвращение дальнейших рецидивов.
Ингаляционные ГКС
Системные глюкокортикостероиды
Внутривенный аминофиллин и теофиллин не должны использоваться при лечении обострений астмы ввиду их низкой эффективности и профиля безопасности, а также большей эффективности и относительной безопасности КДБА. [1, 26]. Применение внутривенного аминофиллина связано с тяжелыми и потенциально фатальными побочными реакциями, особенно у пациентов, уже получавших теофиллин с замедленным высвобождением. У взрослых с тяжелыми обострениями астмы дополнительное лечение аминофиллином не улучшает результаты по сравнению с КДБА.
Магния сульфат.
Гелий-кислородная терапия
Антилейкотриеновые препараты (АЛР).
Антибиотики (не рекомендуются)
Неинвазивная вентиляция легких.
Искусственная вентиляция легких (ИВЛ).
Хирургическое вмешательство: нет.
Рекомендации по выписке пациентов из стационара:
Необходимо установить, какие факторы вызвали обострение и принять меры по избеганию воздействия с ними. Следует пересмотреть объем контролирующей терапии и обеспечить пациента письменным руководством. Пациента и членов его семьи необходимо информировать об обращении к врачу первичного звена или специалисту по лечению БА в течение 24 ч после выписки с целью обеспечения терапии до достижения контроля заболевания.
Индикаторы эффективности лечения:
Госпитализация
Показания для госпитализации в дневной стационар (СЗП):
Показания для экстренной госпитализации:
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- 1. Global strategy for asthma management and prevention, updated 2023 (доступно https://ginasthma.org/) 2. GINA Difficult to treat & severe asthma in adolescent and adult patients/ Diagnosis and Management. updated 2023 доступно https://ginasthma.org/) 3. British guideline on the management of asthma - a national clinical guideline. Revised edition published July 2019. (доступно с https://www.sign.ac.uk/media/1773/sign158-updated.pdf) 4. Чучалин А.Г. и соавт. Федеральные клинические рекомендации по бронхиальной астме. – Москва, 2021. – 114 с. (доступно с https://www.spulmo.ru/upload/kr_bronhastma_2019.pdf) 5. Ненашева Н.М. Клинические фенотипы атопической бронхиальной астмы: диагностика и лечение. Palmarium Academic Publishing, 2012, 319 p. 6. Kaur R, Chupp G. Phenotypes and endotypes of adult asthma: Moving toward precision medicine. J Allergy Clin Immunol. 2019 Jul;144(1):1-12. doi: 10.1016/j.jaci.2019.05.031. PMID: 31277742. 7. Boonpiyathad T, Sözener ZC, Satitsuksanoa P, Akdis CA. Immunologic mechanisms in asthma. Semin Immunol. 2019 Dec;46:101333. doi: 10.1016/j.smim.2019.101333. Epub 2019 Nov 6. PMID: 31703832. 8. Miller RL, Grayson MH, Strothman K. Advances in asthma: New understandings of asthma's natural history, risk factors, underlying mechanisms, and clinical management. J Allergy Clin Immunol. 2021 Dec;148(6):1430-1441. doi: 10.1016/j.jaci.2021.10.001. Epub 2021 Oct 14. PMID: 34655640. 9. Wenzel SE. Asthma phenotypes: the evolution from clinical to molecular approaches. Nat Med 2012;18:716-25 10. Jia CE, Zhang HP, Lv Y, Liang R, Jiang YQ, Powell H, Fu JJ, Wang L, Gibson PG, Wang G. The Asthma Control Test and Asthma Control Questionnaire for assessing asthma control: Systematic review and meta-analysis. J Allergy Clin Immunol. 2013 Mar;131(3):695-703. doi: 12.1016/j.jaci.2012.08.023. Epub 2012 Oct 8. PMID: 23058645. 11. Авдеев С.Н., Айсанов З.Р., Белевский А.С., Емельянов А.В., Курбачева О.М., Лещенко И.В., Ненашева Н.М., Фассахов Р.С. Пути улучшения диагностики и лечения больных бронхиальной астмой врачами первичного звена. Пульмонология. 2019;29(4):457-467. https://doi.org/10.18093/0869-0189-2019-29-4-457-467 12. Методические рекомендации по использованию метода спирометрии. Российское респираторное общество. Утверждены Минздравом России в 2016 г.- М., - 2016 – 36 с.: 6-7. 13. Kerkhof M, Tran TN, van den Berge M, Brusselle GG, Gopalan G, Jones RCM, Kocks JWH, Menzies-Gow A, Nuevo J, Pavord ID, Rastogi S, Price DB. Association between blood eosinophil count and risk of readmission for patients with asthma: Historical cohort study. PLoS One. 2018 Jul 25;13(7):e0201143, 14. Price DB, Rigazio A, Campbell JD, Bleecker ER, Corrigan CJ, Thomas M, Wenzel SE, Wilson AM, Small MB, Gopalan G, Ashton VL, Burden A, Hillyer EV, Kerkhof M, Pavord ID. Blood eosinophil count and prospective annual asthma disease burden: a UK cohort study. Lancet Respir Med. 2015 Nov;3(11):849-58, 15. Albers FC, Licskai C, Chanez P, Bratton DJ, Bradford ES, Yancey SW, Kwon N, Quirce S. Baseline blood eosinophil count as a predictor of treatment response to the licensed dose of mepolizumab in severe eosinophilic asthma. Respir Med. 2019 Nov;159:105806 16. Rath N, Raje N, Rosenwasser L. Immunoglobulin E as a Biomarker in Asthma. Immunol Allergy Clin North Am. 2018 Nov;38(4):587-597 17. Rivero-Yeverino D. Espirometría: conceptos básicos [Spirometry: basic concepts]. Rev Alerg Mex. 2019 Jan-Mar;66(1):76-84. Spanish. doi: 10.29262/ram.v66i1.536. PMID: 31013409. 18. Stanojevic S, Kaminsky DA, Miller MR, Thompson B, Aliverti A, Barjaktarevic I, Cooper BG, Culver B, Derom E, Hall GL, Hallstrand TS, Leuppi JD, MacIntyre N, McCormack M, Rosenfeld M, Swenson ER. ERS/ATS technical standard on interpretive strategies for routine lung function tests. Eur Respir J. 2022 Jul 13;60(1):2101499. doi: 10.1183/13993003.01499-2021. PMID: 34949706. 19. Tan W.C., Vollmer W.M., Lamprecht B., et al. Worldwide patterns of bronchodilator responsiveness: results from the Burden of Obstructive Lung Disease study. Thorax 2012; 67: 718-26. 20. Аллергический ринит. Клинический протокол. Одобрено ОКК МЗСР РК. 15.09.2017, протокол №27 (доступно с https://diseases.medelement.com/disease/аллергический-ринит-2017/15377) 21. Cates CJ, Rowe BH. Vaccines for preventing influenza in people with asthma. Cochrane Database Syst Rev 2013;2:CD000364. 22. Talbot TR, Hartert TV, Mitchel E, Halasa NB, Arbogast PG, Poehling KA, Schaffner W, et al. Asthma as a risk factor for invasive pneumococcal disease. N Engl J 23. Schleich F.N., Manise M., Sele J., Henket M., Seidel L., Louis R. Distribution of sputum cellular phenotype in a large asthma cohort: predicting factors for eosinophilic vs neutrophilic inflammation. BMC Pulm Med. 2013 Feb 26; 13: 11. Doi: 10.1186/1471-2466-13-11. 24. Bousquet J, Schunemann HJ, Samolinski B, Demoly P, Baena-Cagnani CE, Bachert C, Bonini S, et al. Allergic Rhinitis and its Impact on Asthma (ARIA): achievements in 10 years and future needs. J Allergy Clin Immunol 2012;130:1049-62. 25. Нурпеисов Т.Т., Газалиева М.А., Нурпеисов Тем., Хан В.В. Дневник самоконтроля пациента с астмой. – ОАИИР, Алматы, 2018. – 23 с. 26. Клинические рекомендации «Бронхиальная астма» Российское респираторное общество, Российская ассоциация аллергологов и клинических иммунологов, Союз педиатров России. Одобрено Научно-практическим Советом Минздрава РФ в 2021.- М., - 2021 – 114 с. 27. Nair P, Wenzel S, Rabe KF, et al. Oral corticosteroid-sparing effect of benralizumab in severe asthma [supplementary appendix]. N Engl J Med. 2017. http://dx.doi.org/10.1056/NEJMoa1703501. Accessed May 22, 2017. 28. J Mark FitzGerald. Predictors of enhanced response with benralizumab for patients with severe asthma: pooled analysis of the SIROCCO and CALIMA studies. Lancet Respir Med 2018; 6:51-54. 29. Stephenson L. Monoclonal Antibody Therapy for Asthma. – Clin Pulm Med 2017; 24:250-257. 30. Ortega HG, Yancey SW, Mayer B, et al. Severe eosinophilic asthma treated with mepolizumab stratified by baseline eosinophil thresholds: a secondary analysis of the DREAM and MENSA studies // Lancet Respir Med. 2016;4(7):549556. 31. Тяжелая бронхиальная астма-2018. Согласительный доклад объединенной группы экспертов Ассоциации русскоговорящих специалистов в области респираторной медицины, Российского респираторного общества, Российской ассоциации аллергологов и клинических иммунологов Практическая пульмонология | 2018 | № 3. 32. Sheikh A, Alves B, Dhami S. Pneumococcal vaccine for asthma. Cochrane Database Syst Rev 2002:CD002165 33. Tan BK, Chandra RK, Pollak J, Kato A, Conley DB, Peters AT, Grammer LC, et al. Incidence and associated premorbid diagnoses of patients with chronic rhinosinusitis. J Allergy Clin Immunol 2013;131:1350-60. 34. Cassim R, Russell MA, Lodge CJ, Lowe AJ, Koplin JJ, Dharmage SC. The role of circulating 25 hydroxyvitamin D in asthma: a systematic review. Allergy 2015;70:339-54. 35. O’Byrne P.M., FitzGerald M., Bateman E.D., et al. Inhaled combined budesonide formoterol as needed in mild asthma [article and supplementary appendix]. N Engl J Med. 2018; 378: 1865-1876. https://dx.doi.org/doi10.1056/NEJMoa1715274. Accessed May 16, 2018. 36. Bateman E.D., Reddel H.K., O’Byrne P.M., et al. As-needed budesonide-formoterol versus maintenance budesonide in mild asthma [article and supplementary appendix]. N Engl J Med. 2018; 378: 1877-1887. 37. Авдеев С.Н., Айсанов З.Р., Архипов В.В., Белевский А.С., Визель А.А., Демко И.В., Емельянов А.В., Ильина Н.И., Курбачева О.М., Лещенко И.В., Ненашева Н.М., Овчаренко С.И., Фассахов Р.С. от лица экспертной группы. Принципы выбора терапии для больных легкой бронхиальной астмой. Согласованные рекомендации РААКИ и РРО. Практическая пульмонология.2017; 1: 44-54 38. Patel M., Pilcher J., Pritchard A., et al. Efficacy and safety of maintenance and reliever combination budesonide/formoterol inhaler in patients with asthma at risk of severe exacerbations: a randomised controlled trial. Lancet Respir Med 2013; 1: 32-42. 39. Normansell R., Walker S., Milan S.J., Walters E.H., Nair P. Omalizumab for asthma in adults and children. Cochrane Database Syst Rev 2014;1: CD003559. 40. Castro M., Zangrilli J., Wechsler M.E. et al. Reslizumab for inadequately controlledasthma with elevatedblood eosinophil counts: results from multicenter, parallel, double-blind, randomized, placebo-controlled, phase 3 trials. Lancet Respir Med 2015; 3: 355-66. 41. FitzGerald J.M., Bleecker E.R., Nair P. et al. Benralizumab, an anti-interleukin-5 receptor α monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomized, double-blind, placebo-controlled phase 3 trial. Lancet 2016; 388: 2128–41. 42. Bleecker E.R, FitzGerald J.M., Chanez P. et al. Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting β2-agonists (SIROCCO): a randomized, multi-centre, placebo-controlled phase 3 trial. Lancet 2016; 388: 2115–27. 43. Jolliffe DA, Greenberg L, Hooper RL, Griffiths CJ, Camargo CA Jr, Kerley CP, Jensen ME, Mauger D, Stelmach I, Urashima M, Martineau AR. Vitamin D supplementation to prevent asthma exacerbations: a systematic review and meta-analysis of individual participant data. Lancet Respir Med. 2017 Nov;5(11):881-890. doi: 10.1016/S2213-2600(17)30306-5. Epub 2017 Oct 3. Erratum in: Lancet Respir Med. 2018 Jun;6(6):e27. PMID: 28986128; PMCID: PMC5693329. 44. European Medicinal Agency, https://www.ema.europa.eu/en/documents/product-information/tezspire-epar-product-information_en.pdf,Tezepelumab SMPC. 45. Menzies-Gow A., Corre J., Bourdin A, et al. Efficacy and safety of tezepelumab in adults and adolescents with severe, uncontrolled asthma: results from the phase 3 NAVIGATOR study. L 46. AAAAI poster. February 2021. 46. Corren J., Parnes J. R., Wang L. et al. Tezepelumab in Adults with Uncontrolled Asthma [published correction appears in N Engl J Med. 2019;380(21):2082]. N Engl J Med. 2017;377(10):936 47. ov. Extension Study to Evaluate the Safety and Tolerability of Tezepelumab in Adults and Adolescents With Severe, Uncontrolled Asthma (DESTINATION) [Online]. Available at: https://clinicaltrials.gov/ct2/show/NCT03706079. Accessed: February 2021. 48. Menzies-Gow A, Corren J, Bel EH, et al. Corticosteroid tapering with benralizumab treatment for eosinophilic asthma: PONENTE Trial. ERJ Open Res. 2019; 5: 00009-2019. https://doi.org/10.1183/23120541.00009-2019. Accessed December 22, 2020. 49. Andrew Menzies-Gow, Mark Gurnell, Liam G Heaney, Jonathan Corren, Elisabeth H Bel et al, Oral corticosteroid elimination via a personalised reduction algorithm in adults with severe, eosinophilic asthma treated with benralizumab (PONENTE): a multicentre, open-label, single-arm study, The Lancet Respiratory Medicine, Volume 10, Issue 1, 2022, Pages 47-58, ISSN 2213-2600, https://doi.org/10.1016/S2213-2600(21)00352-0. 50. Астматический статус. Клинический протокол. Одобрено ОКК МЗСР РК. 23.06.2016, протокол №5 (доступно с https://diseases.medelement.com/disease/астматичский-статус/14794). 51 . Castro M., Corren J., Pavord I.D. et al. Dupilumab efficacy and safety in moderate-to-severe uncontrolled asthma. N. Engl. J. Med. 2018; 378 (26): 2486–2496. DOI: 10.1056/NEJMoa1804092. 52. Rabe K.F., Nair P., Brusselle G. et al. Efficacy and safety of dupilumab in glucocorticoid-dependent severe asthma. N. Engl. J. Med. 2018; 378 (26): 2475–2485. DOI: 10.1056/NEJMoa1804093. 53. Zayed Y., Kheiri B., Banifadel M. et al. Dupilumab safety and efficacy in uncontrolled asthma: a systematic review and meta-analysis of randomized clinical trials. J. Asthma. 2018; 56 (10): 1110–1119. DOI: 10.1080/02770903.2018.1520865
Информация
Сокращения, используемые в протоколе
|
ECP
|
Эозинофильный катионный белок |
|
FENO
|
фракция оксида азота в выдыхаемом воздухе |
|
GINA
|
Глобальная стратегия менеджмента и профилактики астмы (Global Initiative for Asthma) |
|
IgE
|
иммуноглобулин Е |
|
SpO2
|
насыщение гемоглобина кислородом (сатурация кислорода) |
|
АЛР
|
антилейкотриеновые препараты |
|
АПФ
|
Ангиотензинпревращающий фермент |
|
АСИТ
|
аллерген-специфическая иммунологическая терапия |
|
АР
|
аллергический ринит |
|
БА
|
бронхиальная астма |
|
БК
|
бациллы Коха (микобактерии туберкулеза) |
|
ГКС
|
глюкокортикостероиды |
|
ДАИ
|
дозированный аэрозольный ингалятор (pMDI) |
|
ДДБА
|
длительно действующие бета-2-агонисты |
|
ДПИ
|
дозированный порошковый ингалятор |
|
ИГКС
|
ингаляционный глюкокортикостероид |
|
ИЛ-5
|
Интерлейкин 5 |
|
ИЛ-5R
|
Рецептор к интерлейкину 5 |
|
ИЛ-4
|
Интерлейкин 4 |
|
ИЛ-13
|
Интерлейкин 13 |
|
КДБА
|
бета-2-агонисты короткого действия |
|
НН
|
недостаточность надпочечников |
|
КТ
|
компьютерная томография |
|
ОАК
|
общий анализ крови |
|
ОРИТ
|
отделение реанимации и интенсивной терапии |
|
ОФВ1
|
объем форсированного выдоха за 1 секунду |
|
ПМСП
|
первичная медико-санитарная помощь |
|
ПСВ
|
пиковая скорость выдоха |
|
РаО2
|
парциальное напряжение кислорода |
|
РаСО2
|
парциальное напряжение углекислого газа |
|
СЗП
|
стационар-замещающая помощь |
|
СНМП
|
скорая и неотложная медицинская помощь |
|
СГКС
|
Системный глюкокортикостероид |
|
ТСЛП/
TSLP
|
тимусный стромальный лимфопоэтин |
|
УД
|
уровень доказательства |
|
ФВД
|
функция внешнего дыхания |
|
ФГ
|
флюорография |
|
ФГДС
|
фиброгастродуоденоскопия |
|
ФЖЕЛ
|
форсированная жизненная емкость легких |
|
ХОБЛ
|
хроническая обструктивная болезнь легких |
|
ЧДД
|
частота дыхательных движений |
|
ЧСС
|
частота сердечных сокращений |
Список разработчиков протокола с указание квалификационных данных:
Указание на отсутствие конфликта интересов: нет.
Список рецензентов:
Условия пересмотра протокола: пересмотр протокола через 5 лет после его разработки или при наличии новых методов с уровнем доказательности.
ТЕСТ ПО КОНТРОЛЮ НАД АСТМОЙ (АСТ)
| Вопросы | Баллы | ||||
| 1. Как часто за последние 4 недели астма мешала Вам выполнять обычный объем работы в учебном заведении, на работе или дома? | |||||
|
все время
|
очень часто | иногда | редко | никогда | |
| 1 | 2 | 3 | 4 | 5 | |
| 2. Как часто за последние 4 недели Вы отмечали у себя затрудненное дыхание? | |||||
|
чаще, чем раз в день
|
1 раз в день | от 3 до 6 раз в неделю | 1 или два раза в неделю | ни разу | |
| 1 | 2 | 3 | 4 | 5 | |
| 3. Как часто за последние 4 недели Вы просыпались ночью или раньше, чем обычно, из-за симптомов астмы (свистящего дыхания, кашля, затрудненного дыхания, чувства стеснения или боли в груди)? | |||||
|
4 ночи в неделю или чаще
|
2 - 3 ночи в неделю | 1 раз в неделю | 1 или 2 раза | ни разу | |
| 1 | 2 | 3 | 4 | 5 | |
| 4. Как часто за последние 4 недели Вы использовали быстродействующий ингалятор (например, Сальбутамол, Фенотерол/ипратропия бромид, Ипратропия бромид) или небулайзер (аэрозольный аппарат) с лекарством (например, Фенотерол, Фенотерол/ипратропия бромид, Сальбутамол небулы) | |||||
|
3 раза в день или чаще
|
1 или 2 раза в день | 2 или 3 раза в неделю | 1 раз в неделю или реже | ни разу | |
| 1 | 2 | 3 | 4 | 5 | |
| 5. Как бы Вы оценили, насколько Вам удавалось контролировать астму за последние 4 недели? | |||||
| совсем не удавалось контролировать | плохо удавалось контролировать | в некоторой степени удавалось контролировать | хорошо удавалось контролировать | полностью удавалось контролировать | |
| 1 | 2 | 3 | 4 | 5 | |
| Итого | |||||
Ключ (интерпретация): шкала ACT включает в себя 5 пунктов для самостоятельного заполнения пациентом, каждому пункту присваивается значение от 1 до 5 баллов, которые затем суммируются (общее значение шкалы - 5 - 25 баллов). Сумма 25 баллов означает полный контроль; сумма 20 - 24 балла означает, что астма контролируется хорошо; сумма 19 баллов и меньше свидетельствует о неконтролируемой астме.
Пояснения (результаты):
- 25 баллов - Вы ПОЛНОСТЬЮ КОНТРОЛИРОВАЛИ астму за последние 4 недели. У Вас не было симптомов астмы и связанных с ней ограничений. Проконсультируйтесь с врачом, если ситуация изменится.
- от 20 до 24 баллов - за последние 4 недели Вы ХОРОШО КОНТРОЛИРОВАЛИ астму, но не ПОЛНОСТЬЮ. Ваш врач поможет Вам добиться ПОЛНОГО КОНТРОЛЯ
- менее 20 баллов - за последние 4 недели Вам НЕ удавалось КОНТРОЛИРОВАТЬ астму. Ваш врач может посоветовать Вам, какие меры нужно применять, чтобы добиться улучшения контроля над Вашим заболеванием.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.