Асфиксия при рождении
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Асфиксия при родах (P21), Гипоксическая ишемическая энцефалопатия новорожденного (P91.6), Ишемия мозга (P91.0), Неуточненная асфиксия при рождении (P21.9), Средняя и умеренная асфиксия при рождении (P21.1), Тяжелая асфиксия при рождении (P21.0)
Неонатология
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «17» марта 2023 года
Протокол №180
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
АСФИКСИЯ ПРИ РОЖДЕНИИ
BBOДНАЯ ЧАСТЬ
Код (-ы) по МКБ-11:
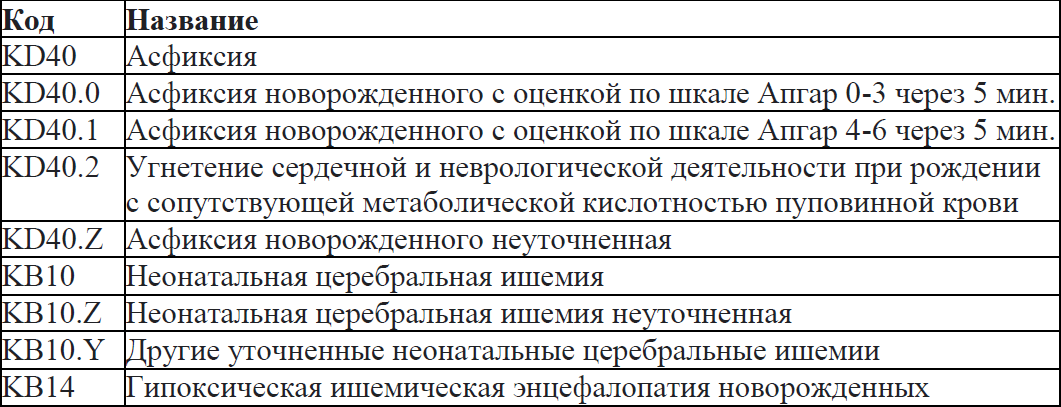
Дата разработки/пересмотра: 2014 год (пересмотр 2023 год).
Сокращения, используемые в протоколе:
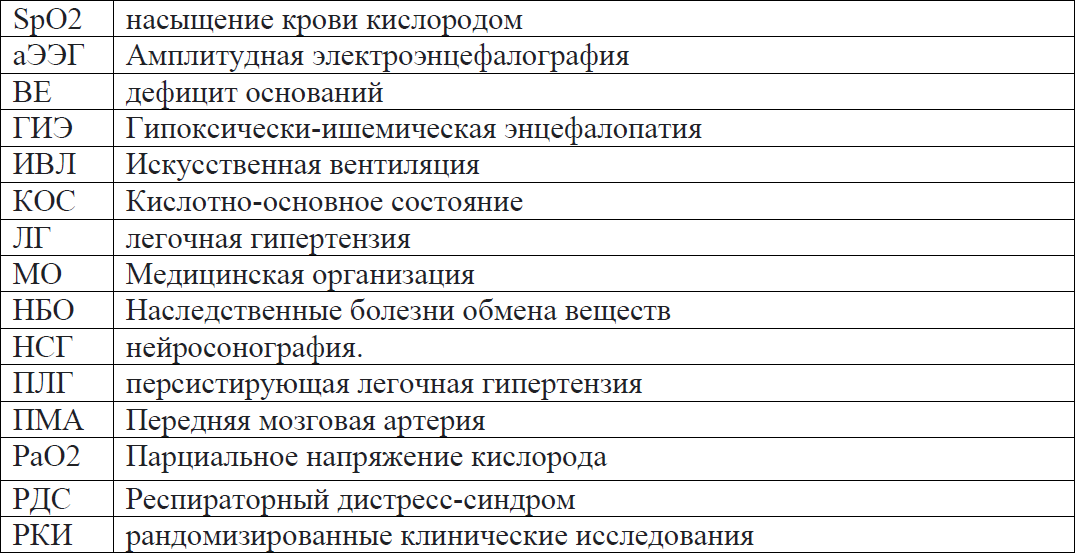

Пользователи протокола: неонатологи, педиатры, анестезиологи-реаниматологи, акушер-гинекологи, акушерки родильных домов, неонатальные медицинские сестры.
Категория пациентов: новорожденные дети.
Определение:
Асфиксия – это нарушение газового обмена в организме ребенка во время родов, приводящее к тяжелому ацидозу и недостаточной оксигенации органов, и как следствие, вызывающее временные или постоянные нарушения их функций [15].
Классификация
Классификация:
Для постановки диагноза «Тяжелая асфиксия при рождении» предлагается использовать совокупность признаков: признаки внутриутробного или интранатального страдания плода; низкая оценка по шкале Апгар (<5 баллов на 5-й минуте); рН <7,0 или дефицит оснований (ВЕ) – >16 ммоль/л в пуповинной крови; полиорганная недостаточность в раннем неонатальном периоде; неврологические нарушения с момента рождения [5, 8, 9].
Средняя или умеренная асфиксия при рождении - нормальное дыхание в течение 1-й минуты после рождения не установилось, но частота сердцебиений 100 ударов/мин или более, незначительный мышечный тонус, незначительный ответ на раздражение, оценка по шкале Апгар 4-7 баллов через 1 минуту после рождения.
Классификация гипоксической энцефалопатии по Н.В. Sarnat и M.S. Sarnat
I степень (легкая) ГИЭ – сознание сохранено, повышенная возбудимость, гиперрефлексия, мидриаз, отсутствие судорог, тахикардия, регресс симптоматики к концу первых суток.
II степень (среднетяжелая) ГИЭ – угнетение сознания до летаргического, гиперрефлексия, миоз, брадикардия, судороги, гипотония, снижение безусловных рефлексов (Моро, сосательный),
III степень (тяжелая) ГИЭ – нарушение сознания до степени ступора, кома; миоз с плохой фотореакцией, снижение сухожильных рефлексов, гипотония, отсутствие безусловных рефлексов, потребность в респираторной поддержке.
дней с продолжающимися судорогами коррелирует с последующей неврологической дисфункцией.
Признаком тяжелой асфиксии является полиорганная недостаточность:
- Тяжелое угнетение дыхательной и сердечной деятельности: снижение сократимости миокарда, тяжелая гипотензия, пассивное расширение полостей сердца и трикуспидальная регургитация; пациенты могут иметь тяжелую легочную гипертензию, требующую проведения ИВЛ.
- Почечная недостаточность, олигурия и, в восстановительном периоде – полиурия, что приводит к значительному водно-электролитному дисбалансу.
- Повреждения со стороны кишечника: вялая перистальтика кишечника и замедленное опорожнение желудка. В редких случаях развивается некротизирующий энтероколит.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ.
Диагностические критерии
Антенатальные факторы риска:
- сахарный диабет у матери;
- ожирение у матери;
- преэклампсия;
- эклампсия;
- хроническая гипертензия (гипертоническая болезнь матери);
- резус-иммунизация матери (ультразвуковые признаки анемии или водянки плода);
- мертворождения или рождение предыдущих детей в состоянии тяжелой асфиксии;
- клинические признаки инфекционного заболевания у матери непосредственно перед или во время родов (хорионамнионит, повышенная температура перед или непосредственно в родах);
- подозрение на врожденную инфекцию плода;
- кровотечение во II или III триместрах беременности;
- многоводие;
- маловодие;
- многоплодная беременность;
- несоответствие предполагаемой массы тела плода гестационному возрасту;
- наркотическая или алкогольная зависимость матери;
- применение матерью лекарственных препаратов, способных угнетать дыхание и сердечную деятельность новорожденного (таких, как препараты лития, магнезии, адреноблокаторы);
- наличие пороков развития плода, выявленных при антенатальной диагностике;
- аномальные показатели кардиотокографии или допплерометрии перед родами или во время родов;
- угнетение двигательной активности плода перед родами;
- отсутствие данных о пренатальном наблюдении;
- длительный безводный период (более 18 часов).
Интранатальные факторы риска:
- преждевременные роды (срок менее 37 недель);
- запоздалые роды (срок более 42 недель);
- острая гипоксия плода в родах;
- разрыв матки;
- эмболия околоплодными водами;
- коллапс/шок у роженицы (любой этиологии) во время родоразрешения;
- отслойка плаценты;
- предлежание плаценты;
- врастание плаценты;
- выпадение петель пуповины;
- патологическое положение плода;
- применение общего обезболивания во время родоразрешения;
- аномалии родовой деятельности;
- наличие мекония в околоплодных водах;
- нарушение ритма сердца плода;
- дистоция плечиков;
- инструментальные роды (акушерские щипцы, вакуум-экстракция).
Лабораторные исследования:
Для определения интранатальной асфиксии рождения [1-3, 5, 8, 9,15].
- Обязательные критерии: для подтверждения тяжести перенесенной гипоксии в течение первых 30 минут после рождения у новорожденного проводится забор крови из пережатой артерии пуповины для определения ее газового состава. КОС-метаболический ацидоз - pH <7.0 и Ве <–16 ммоль/л; ранние неврологические осложнения; церебральный паралич; исключение другой патологии (травма, патология свёртывающей системы крови, инфекция, генетические заболевания). Дефицит оснований и уровень лактата в крови является прогностическим критерием. Уровень лактата меньше 5 ммоль/л и/или дефицит оснований менее 10 ммоль/л не приводят к неврологическим осложнениям. Повышение лактата более 9 ммоль/л прогностически связано с умеренной или тяжёлой энцефалопатией (УД-2А).
NB! Исследование КОС, газов крови и лактата проводится из пуповинной, капиллярной или венозной крови и входит в критерии группы «А» для определения показаний к проведению терапевтической гипотермии. Определение лактата крови зависит от возможностей лаборатории медицинской организации.
- Клинический анализ крови, развернутый с дифференциальным подсчетом лейкоцитов, прокальцитонин и СРБ для исключения или подтверждения наличия у новорожденного тяжелой бактериальной инфекции (сепсис, пневмония) (УД-3 С).
NB! У ребенка вследствие перенесенной асфиксии могут отмечаться изменения в клиническом анализе крови требующие коррекции (анемия, тромбоцитопения.)
- Концентрация глюкозы в сыворотке крови (глюкоза основной энергетический субстрат, необходимый для постнатальной адаптации, питания мозга; гипогликемия может привести к апноэ, судорогам).
- Функция почек: определение креатинина сыворотки крови, клиренса креатинина, и остаточного азота.
- Магнитно-резонансная спектроскопия выявляет изменения концентрации лактата, холина, креатина и глутамина и таким образом обеспечивает биохимический анализ церебральной ткани. Повышение концентрации лактата являются признаками поздних неврологических осложнениями. Соотношение лактат/холин, равное 1, является показателем более чем 95%-й вероятности неблагоприятного неврологического исхода, тогда как отсутствие лактата предсказывает нормальный исход.
Инструментальные исследования при асфиксии новорожденных:
- Проведение суточного прикроватного мониторирования жизненных функций и параметров (ЧСС, ЧД, температура тела, пульсоксиметрия, мониторинг артериального давления) - с первых часов жизни (УД-2В).
Во время проведения терапевтической гипотермии рекомендуется.
- установка ЭКГ датчиков для мониторирования нарушений ритма сердца.
- предуктальная и постдуктальная сатурация для выявления стойкого фетального кровообращения;
- нейросонография для исключения/подтверждения внутримозгового кровотечения и/или отека мозга и другой патологии ЦНС; допплерография средней мозговой и передней мозговой артерий в первые 48 часов после рождения (УД-1А);
- Магнитно-резонансная томография (УД-3В)-в возрасте 14-21 суток магнитно-резонансная томография (МРТ) головного мозга; при подозрении на субдуральные кровоизлияния целесообразно провести компьютерную томографию / магниторезонансную терапию головного мозга до начала лечебной гипотермии для исключения субдуральных гематом;
NB! Проведение данных методов нейровизуализации зависят от возможностей конкретной МО.
- Амплитудно-интегрированной ЭЭГ - в первые 6 часов жизни регистрируется постоянный фоновый паттерн с нормальным вольтажем, может свидетельствовать о благоприятном неврологическом исходе. Если аЭЭГ представлена паттерном вспышка – угнетение, паттерном с низким вольтажем, присутствуют вспышки эпилептической активности в первые 24–48 часов жизни, что связано с высоким риском смерти или серьёзных неврологических отклонений (УД-3А).
NB! аЭЭГ входит в критерии группы «С». Показанием для проведения аЭЭГ являются наличие критериев групп А и В.
- Транскраниальная церебральная оксиметрия отражает региональное насыщение кислородом головного мозга. Метод обеспечивает круглосуточное и непрерывное мониторное наблюдение за состоянием региональной сатурации мозга кислородом.
- Электроэнцефалография- ЭЭГ-мониторинг, метод длительной регистрации электрической активности головного мозга. Данный метод позволяет оценить функциональные нарушения в работе головного мозга и выявить причины пароксизмальных состояний, обусловленных нарушениями работы мозга у детей, перенесшие интранатальную асфиксию с последующим развитием церебральных нарушений. Во время проведения процедуры определяли динамику картины ЭЭГ до гипотермии, на фоне и после гипотермии. Динамика изменения мозговой активности новорожденного наглядно представляется при длительном мониторировании ЭЭГ (УД-5С).
- Скрининга слуха - аудиологический скрининг новорожденных (аудиоскрининг) — это стандартизированная процедура исследования слуха, задача которого максимально быстрое и достоверное выявление детей с нарушениями работы слухового анализатора у детей, перенесшие асфиксию при рождении. Является обязательным методом для всех новорожденных в нашей стране.
- Скрининг зрения – целью скрининга зрения у новорожденных и детей раннего возраста является выявление отклонений, которые могут привести к серьезным нарушениям зрения или постоянной потере зрения, у детей перенесших гипоксию при рождении. У недоношенных новорожденных детей высокий риск развития ретинопатии недоношенных и скрининг проводится всем недоношенным новорожденным.
Показания для консультации узких специалистов:
• пульмонолог – при наличии патологии со стороны дыхательной системы;
• невролог, нейрохирург - при наличии сопутствующей патологии со стороны ЦНС;
• кардиолог - при персистирующей легочной гипертензии, кардиоваскулярных расстройствах;
• офтальмолог – при наличии сопутствующей ретинопатии недоношенных.
Дифференциальный диагноз
Дифференциальный диагноз:
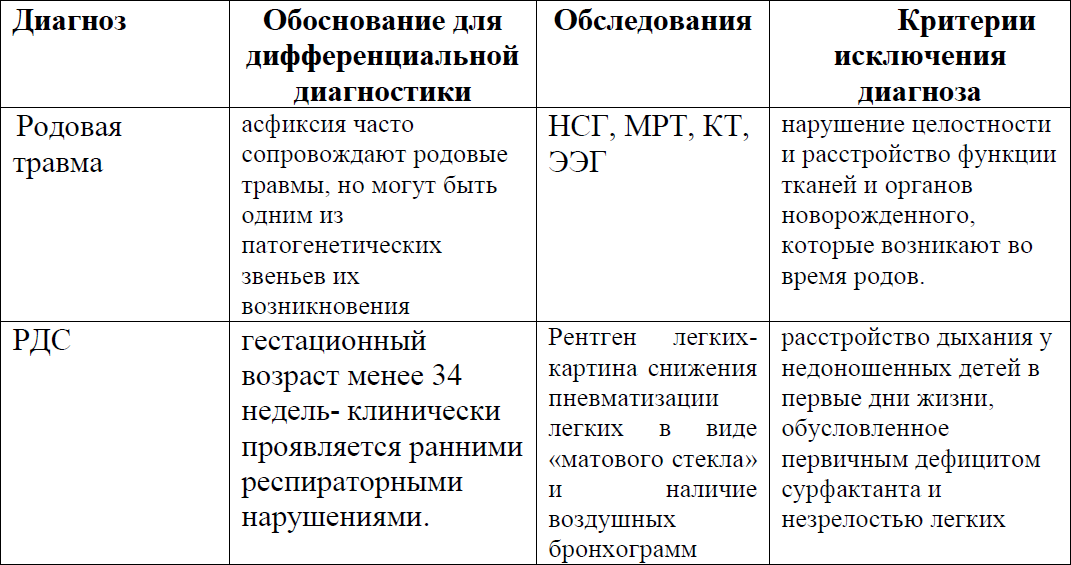
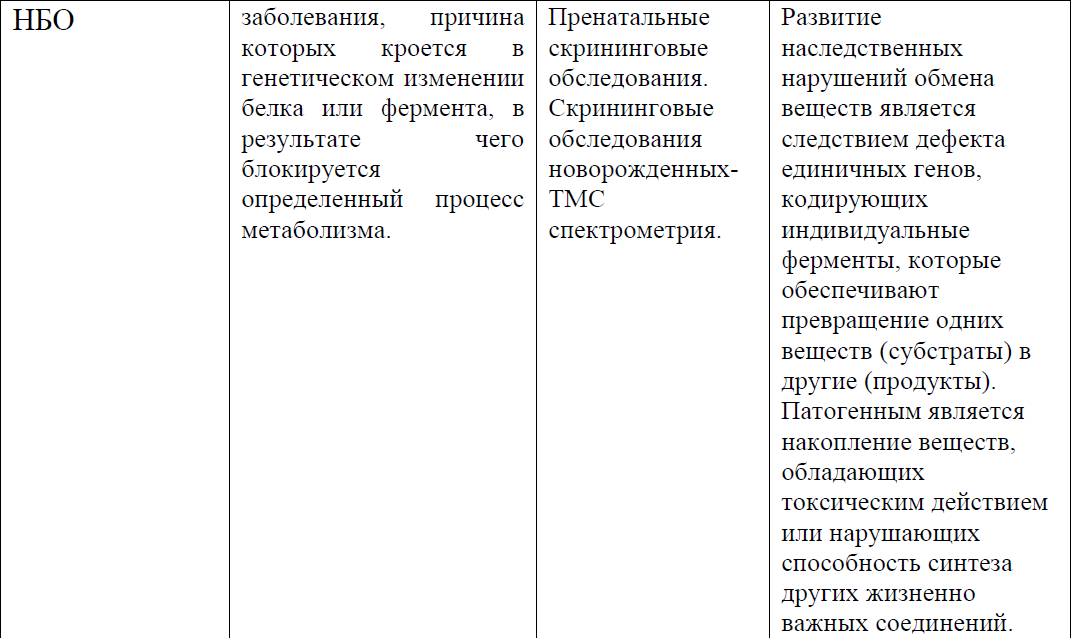



Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ: нет.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ: Снижение частоты тяжелых осложнений у новорожденного со стороны центральной нервной системы, после перенесенной асфиксии и гипоксии в родах.
У новорожденных детей, получающих кислород, целевой диапазон SatO2 рекомендуется поддерживать в пределах 90-95%. (УД-2В). Обычно SatO2 в пределах от 90 до 95% гарантирует уровень РаО2 больше 45 и меньше 100 мм.рт.ст.
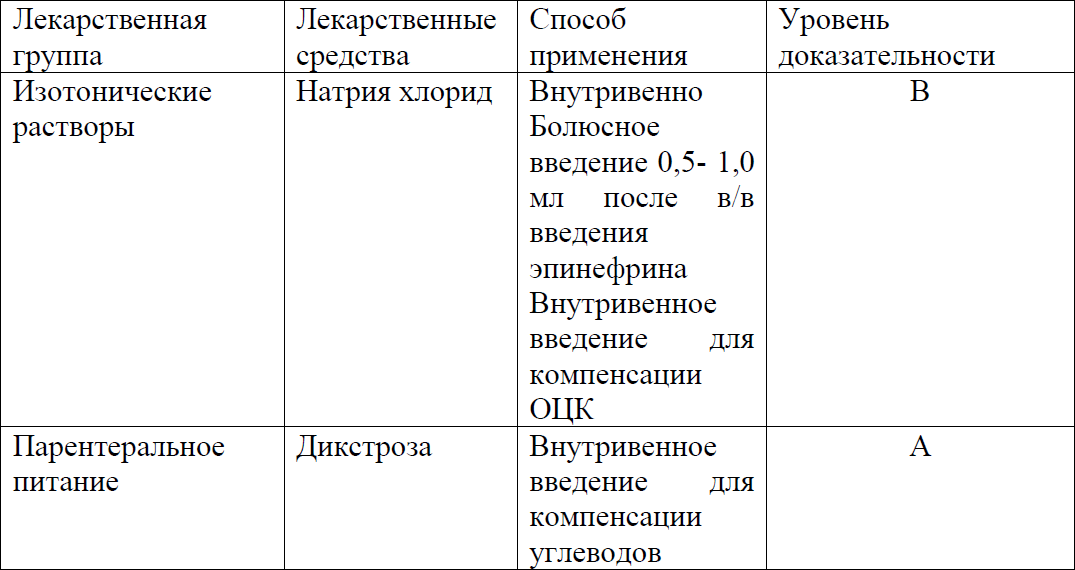
Для адекватной перфузии головного мозга необходимо поддерживать среднее АД выше 35–40 мм рт. ст. Гипотензия связана с дисфункцией миокарда, синдромом капиллярной утечки и гиповолемией. Таким образом, основными целями гемодинамической поддержки являются адекватная волемическая нагрузка физиологическим раствором натрия хлорида 0,9%.
Инфузионная терапия должна быть индивидуальной и подбираться на основании: тяжести и течения ГИЭ; контроль концентрации электролитов и глюкозы (протокол «Парентеральное питание»).
Карта наблюдения пациента маршрутизация пациента:
Критерии группы «А»:
- Оценка по шкале Апгар ≤ 5 на 10 минуте или
- Сохраняющаяся потребность в ИВЛ на 10 минуте жизни или
- В первом анализе крови, взятом в течение первых 60 минут жизни, (пуповинной, капиллярной или венозной) рН <7.0 или
- В первом анализе крови, взятом в течение 60 минут жизни (пуповинной, капиллярной или венозной), дефицит оснований (ВЕ) ≥16 моль/л.
Критерии группы «В»:
- Клинически выраженные судороги (тонические, клонические, смешанные) или
- Мышечная гипотония и гипорефлексия
- Выраженный гипертонус и гипорефлексия
- Нарушения зрачкового рефлекса (сужен и не реагирует на затемнение, расширен и не реагирует на свет, слабая реакция зрачка на изменение освещения).
Критерии группы «С» основываются на результатах аЭЭГ:
- Верхний край зубцов кривой более 10мкВ, нижний край зубцов кривой менее 5 мкВ. Кривая может прерываться пиками или сериями пиков более 25мкВ или
- Верхний край зубцов менее 10мкВ, кривая прерывается и периодически выглядит изолинией и/или прерывается сериями пиков менее 10 мкВ или
- Сплошные серии пиков с вольтажом более 25 мкВ или
- Изолиния с вольтажом менее 5 мкв.
Немедикаментозное лечение:
- Единственным методом немедикаментозного лечения, относительно широко используемым у детей, перенесших среднетяжелую и тяжелую асфиксию в родах, является контролируемая лечебная гипотермия. Гипотермия должна быть начата в течение первых 6 ч, но проведено несколько исследований доказывающих, что при начале гипотермии в течении первых 3 ч эффективность выше. Для начала гипотермии используют критерии National Institute of Child Health and Human Development (NICHD body cooling criteria).
- Лечебную гипотермию следует проводить, только если выявлен хотя бы один критерий из группы А плюс хотя бы один критерий из группы В плюс хотя бы один критерий из группы С. Патологический каскад, запускающийся после перенесённой асфиксии, является основной целью нейропротективной терапии. Первые 6 ч жизни ребёнка, рождённого в асфиксии, являются терапевтическим окном для стабилизации жизненно важных функций организма, на протяжении которых лечебные мероприятия наиболее эффективны в отношении уменьшения апоптоза клеток головного мозга.
Противопоказания к общей гипотермии:
- Врождённые пороки развития, требующие экстренного/срочного хирургического лечения; внутричерепные кровоизлияния; масса тела ребёнка при рождении менее 1 800 г; гестационный возраст менее 35 недель.
NB! При отсутствии возможности оценить критерии группы С, процедура терапевтической гипотермии должна начинаться по результатам оценки критериев первых двух групп (А и В). [1,2,3, 5,6,7, 8, 9,15].
- Если родился ребенок с массой тела более 1800 г по завершении 35-й недели гестации и потребовал проведения первичной реанимации в родильном зале, то такого пациента следует последовательно оценить по группам критериев А, В и с целью выявления показаний для лечебной гипотермии.
NB! При подозрении на субдуральные кровоизлияния целесообразно провести МРТ головного мозга до начала лечебной гипотермии для исключения наличия субдуральных гематом. Инфекционные состояния не являются противопоказанием для лечебной гипотермии. В истории развития новорожденного следует указать критерии, на основании которых начата лечебная гипотермия.
Механизмы и свойства гипотермии:
- Снижение церебрального метаболизма (~6–8 % на 1 °С); снижение продукции возбуждающих нейротрансмиттеров; уменьшение отёка мозга и снижение внутричерепного давления; стабилизация гематоэнцефалического барьера; снижение продукции свободных кислородных радикалов и пероксидации липидов; восстановление нормальных межклеточных сигнальных механизмов; антиконвульсантные свойства.
Целью лечебной общей гипотермии является: поддержание ректальной температуры в диапазоне 33,5 ± 0,5 °С в течение 72 ч путём искусственного охлаждения через наружные покровы тела при помощи специального аппарата для проведения терапевтической гипотермии. Через 72 ч от начала гипотермии начинается согревание. Согревание должно быть медленным, со скоростью 0,4–0,5 °С/ч, иначе это может привести к гемодинамическим нарушениям и провоцированию судорог. Заполняется чек-лист каждый час.
Новорожденному с ГИЭ вследствие перенесенной асфиксии при рождении, требующей проведения процедуры терапевтической гипотермии общей, при планируемой транспортировке ребенка до приезда транспортной реанимационной бригады рекомендуется проводить пассивную терапевтическую гипотермию общую (УД-3В). [1,2,3, 5, 8, 9,15].
Новорожденному с ГИЭ вследствие перенесенной асфиксии при рождении, требующей проведения процедуры терапевтической гипотермии общей, при отсутствии аппарата терапевтической гипотермии или невозможности транспортировки ребенка рекомендуется проведение пассивной терапевтической гипотермии общей или терапевтической гипотермии общей с использованием охлаждающих термоэлементов в течение 72 часов [4-6, 8, 9-15] (УД-3В).
NB! Противопоказания и показания для экстренного прерывания пассивной терапевтической гипотермии и терапевтической гипотермии с использованием охлаждающих термоэлементов такие же, как и при аппаратной терапевтической гипотермии.
Методика проведения пассивной терапевтической гипотермии и терапевтической гипотермии с использованием охлаждающих термоэлементов:
- Ребенок должен находиться в отключенной открытой реанимационной системе или в отключенном инкубаторе;
- Кожные покровы ребенка остаются открытыми, подгузник подкладывается, но не застегивается;
- Температура окружающей среды 18º-24 º(С). Оптимальным является создание условия для пребывания пациента в одноместной палате;
- Четкая фиксация начальной температуры и времени достижения целевой температуры;
- Целевая ректальная температура 33º±0,5º(С);
- При снижении или повышении температуры необходима проверка положения ректального датчика;
- При снижении температуры до 33,0º(С) с целью предотвращения переохлаждения может возникнуть необходимость в дополнительном обогреве, чтобы удержать целевую температуру тела ребенка;
- Для мониторинга ректальной температуры оптимальным является использование полифункциональных мониторов.
Показания к преждевременному прекращению процедуры:
- невозможность достичь целевой ректальной температуры при снижении температуры охлаждающего костюма до минимальной; стойкая брадикардия <80 уд. /мин; кровотечения; отказ родителей от процедуры.
К системным неблагоприятным эффектам гипотермии у новорождённых относятся: увеличение интервала Q-T, синусная брадикардия; снижение контрактильности и сердечного выброса; гипотензия; тромбоцитопения; коагулопатия, гипокоагуляция; повышение вязкости крови; лёгочная гипертензия; гипогликемия; повышенный риск инфекций. Общая гипотермия способна замедлить утилизацию и ухудшить выделение лекарств из организма через почки, например, противосудорожных препаратов (бензодиазепины), продлевая период их полураспада. Общая гипотермия не влияет на фенобарбитал. Гипотермия уменьшает выведение антибактериальных средств, поэтому необходимо увеличивать интервал используемых доз.
Медикаментозное лечение:
Обеспечение адекватной системной перфузии; коррекция метаболических нарушений, коррекция белков, жиров и углеводов.
- Инфузионная терапия, нутритивная поддержка. Расчет суточной потребности жидкости, белков, жиров, углеводов проводится согласно протокола «Парентеральное питание новорожденных» и следующим принципам: − стартовый объем 60 мл/кг/сут − учитывая возможную задержку жидкости на фоне перенесенной асфиксии;
- Энтеральное кормление при проведении гипотермии не противопоказано и может назначаться по обычным показаниям – донорское материнское молоко.
- Антибактериальная терапия. После стабилизации новорожденного и начала проведения терапевтической гипотермии не является показанием к назначению антибактериальных препаратов; в случае, если антибактериальные препараты показаны, назначается эмпирическая комбинированная терапия пенициллинами в сочетании с аминогликозидами.
Перечень основных лекарственных средств (имеющих 100% вероятность применения) [1,5-7,9,11-15, 23-24]:
Перечень дополнительных лекарственных средств (менее 100% вероятности применения): нет.
Профилактические мероприятия:
- Снижение факторов риска у женщин в антенатальном и интранатальном периодах.
- Оборудование всем необходимым родильных палат.
- Сердечно-легочная реанимация новорожденных в родильном зале (рекомендации Европейского совета по реанимации, 2020).
- Обеспечение адекватного внешнего дыхания.
- Отсроченное пережатие пуповины.
- Оценка состояния новорожденного в родильной палате.
- Тренинги медицинского персонала.
Хирургическое вмешательство: нет.
Дальнейшее ведение:
- После выписки из родовспомогательной организации ребенок должен находиться на динамическом наблюдении в кабинете катамнеза – врач педиатр, реабилитолог, невролог совместно с врачом общей практики.
- Проводится анализ развития ребёнка в последующие 18 месяцев жизни, который включает осмотр невролога и педиатра один раз в 3 месяца, выявление сопутствующих заболеваний.
- Основной задачей кабинета катамнестического наблюдения за детьми с перинатальной патологией является снижение инвалидизации, контроль за реабилитацией и абилитацией недоношенных детей и интеграция их в общество, а также проведение мероприятий для правильного и гармоничного развития.
- Учитывают анамнез и оценку по шкале тяжести ГИЭ (по H. B. Sarnat и M. S. Sarnat, наличие судорог в первый час жизни и далее в динамике, длительность ИВЛ, длительность применения инфузионной терапии, продолжительность госпитализации в ОРИТН). До 18 месяцев жизни проводится комплексная оценка состояния здоровья детей. Оценивают основные антропометрические показатели (рост, вес, окружность груди, головы). С развитием ребенка отслеживают динамическое развитие и неврологический статус, когда начал держать голову, когда сел, начал ползать, ходить.
- При оценке нервно-психического развития используют шкалы развития младенца Bayley-III (Bayley Scales of Infant Development), которые признаны «золотым стандартом» для оценки развития ребёнка. Тестирование проводится в возрасте до 18 месяцев. Тест состоит из 5 шкал, которые позволяют оценить когнитивное, речевое, моторное развитие, а также социально-эмоциональные навыки и адаптивное поведение детей в возрасте от 16 дней до 42 месяцев. Когнитивная шкала направлена на изучение сенсомоторного развития ребёнка, стратегии исследования новых объектов, манипуляции предметами. Речевая шкала оценивает импрессивную и экспрессивную речь, моторная шкала –мелкую и крупную моторику, шкала адаптивного поведения – способность ребёнка адаптироваться к окружающему миру. Шкала социально-эмоциональных навыков выявляет соответствие ребёнка основным нормам социально эмоционального развития. Продолжают обследование. НСГ, МРТ, ЭЭГ. Контроль питания и оценка физического развития по таблицам.
Индикаторы эффективности и безопасности методов диагностики и лечения, описанных в протоколе:
- отсутствие осложнений реанимации;
- снижение младенческой смертности;
- снижение повреждения центральной нервной системы, приводящей к инвалидности детей.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ:
Показания для плановой госпитализации - нет
Показания для экстренной госпитализации в родовспомогательное учреждение 3 уровня регионализации [1-3, 5, 8, 9,15].
NB! Транспортировка ребенка в медицинскую организацию более высокого функционального уровня для проведения аппаратной гипотермии. Проведение терапевтической гипотермии не является противопоказанием для транспортировки новорожденного ребенка. Противопоказания для транспортировки определяются по общепринятым критериям или критериям, установленным локальными протоколами.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- 1) „Neonatal Life Support. 2020 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations”. 2) “2020 American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care, Part 5: Neonatal Resuscitation”. Circulation. 2020;142(suppl 2): S524–S550. DOI: 10.1161/CIR.0000000000000902. 3) Wassink G. et al. The mechanisms and treatment of asphyxial encephalopathy // Front. Neurosci. 2014. Vol. 8, № 8 FEB. P. 1–11. 4) Laptook A.R. Birth Asphyxia and Hypoxic-Ischemic Brain Injury in the Preterm Infant // Clin. Perinatol. Elsevier Inc, 2016. Vol. 43, № 3. P. 529–545. 5) Wyllie J., Perlman J. M., Kattwinkel J. e t al. Part 7: Neonatal resu scit ation: 2015 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations // Resuscitation. 2015. Vol. 95. P. e169–e201 6) Acharya A. et al. Clinico-Biochemical Correlation in Birth Asphyxia and Its Effects on Outcome // Cureus. 2020. Vol. 12, № 11. 7) Odo K.E. et al. Comparison of plasma electrolytes of perinatally asphyxiated and normal term babies // J. Neonatal. Perinatal. Med. 2020. Vol. 12, № 4. P. 385–389. 8) Van Wincoop M. et al. Effect of therapeutic hypothermia on renal and myocardial function in asphyxiated (near) term neonates: A systematic review and meta-analysis // PLoS One. 2021. Vol. 16, № 2 February. P. 1–19. 9) Буров А.А., Горев В.В., Горелик К.Д. и др. Клинические рекомендации по проведению терапевтической гипотермии у новорожденных // Клинические рекомендации. Неонатология / ed. . Н.Н. Володина, Д.Н.Дегтярева Д.С.К. Москва: ГЭОТАР-Медиа, 2019. P. 193–227. 10) Machie M. et al. MRI Score Ability to Detect Abnormalities in Mild Hypoxic-Ischemic Encephalopathy // Pediatr. Neurol. Elsevier Inc., 2021. Vol. 116. P. 32–38. 11) Chang P.D. et al. Predictive values of location and volumetric MRI injury patterns for neurodevelopmental outcomes in hypoxic-ischemic encephalopathy neonates // Brain Sci. 2020. Vol. 10, № 12. P. 1–9. 12) Takenouchi T. et al. Therapeutic hypothermia for neonatal encephalopathy: JSPNM & MHLW Japan Working Group Practice Guidelines. Consensus Statement from the Working Group on Therapeutic Hypothermia for Neonatal Encephalopathy, Ministry of Health, Labor and Welfare (MHLW), Jap // Brain Dev. The Japanese Society of Child Neurology, 2012. Vol. 34, № 2. P. 165–170. 13) Rao LM, Hussain SA, Zaki T, Cho A, Chanlaw T, Garg M S.R. A comparison of levetiracetam and phenobarbital for the treatment of neonatal seizures associated with hypoxic-ischemic encephalopathy. // Epilepsy Behav. 2018. Vol. 88. P. 212–217. 14) Hsu J. et al. Visual outcomes in children with neonatal hypoxic ischemic encephalopathy treated with therapeutic hypothermia // J. Perinatol. Springer US, 2021. Vol. 41, № 9. P. 42 2379–2380. 15) Gleason C.A., Devaskar S.U. Avery’s Diseases of the Newborn. 9th ed. Saunders, 2012. 1520 p 16) Wyckoff MH, Aziz K, Escobedo MB, et al. Part 13: Neonatal resuscitation: 2015 American Heart Association guidelines update for cardiopulmonary resuscitation and emergency cardiovascular care (reprint). Pediatrics. 2015;136(suppl 2): 196–218 17) Heathcote A.C., Jones J., Clarke P. Timing and documentation of key events in neonatal resuscitation // Eur. J. Pediatr. 2018. Vol. 177, N 7. P. 1053–1056. 18) Patel A., Khatib M.N., Kurhe K. et al. Impact of neonatal resuscitation trainings on neonatal and perinatal mortality: a systematic review and meta-analysis // BMJ Paediatr. Open. 2017. Vol. 1. Article ID e000183. DOI: 10.1136/bmjpo-2017-000183. 19). Odd D., Heep A., Luyt K. et al. Hypoxic-ischemic brain injury: planned delivery before intrapartum events // J. Neonatal Perinatal Med. 2017. Vol. 10, N 4. P. 347–353. 20). Wyllie J., Perlman J.M., Kattwinkel J., Wyckoff M.H., Aziz K., Guinsburg R., Kim H.S., Liley H.G., Mildenhall L., Simon W.M., Szyld E., Tamura M., Velaphi S.:Neonatal Resuscitation Chapter Collaborators. Part 7: Neonatal resuscitation: 2015 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations. Resuscitation. 2015; 95: e169-201. 21). Moral Y., Robertson N.J., Goni-de-Cerio F., et al. Neonatal hypoxiaischemia: cellular and molecular brain damage and therapeutic modulation of neurogenesis. Rev Neurol. 2019; 68 (1): 23–36. 22). Heathcote A.C., Jones J., Clarke P. Timing and documentation of key events in neonatal resuscitation. Eur J Pediatr. 2018; 177 (7): 1053–6. 23). Perez M., Robbins M.E., Revhaug C., et al.Oxygen radical disease in the newborn, revisited: oxidative stress and disease in the newborn period. Free Radic Biol Med. 2019; (5): S0891-5849(18)32520-6. DOI: 10.1016/j. freeradbiomed.2019.03.035. 24). Guidelines for Perinatal Care. 7th ed. – Elk Grove Village (IL): AAP; Washington, DC: American College of Obstetricians and Gynecologists, 2012. 25). Jacobs S.E., Berg M., Hunt R. et al. Cooling for newborns with hypoxic ischaemic encephalopathy // Cochrane Database Syst. Rev. – 2013 Jan 31. – Vol. 1:CD003311. doi: 10.1002/14651858.CD003311.pub3. 26). Приказ Министра здравоохранения Республики Казахстан от 9 сентября 2010 года № 704. Зарегистрирован в Министерстве юстиции Республики Казахстан 15 сентября 2010 года № 6490. 27). «Парентеральное питание новорожденных». Республиканский центр развития здравоохранения РЦРЗ (Республиканский центр развития здравоохранения МЗ РК). Клинические протоколы МЗ РК – 2015
Информация
Шкала уровня доказательности:
Таблица 1 - Уровни доказательности


Рейтинговая схема оценки силы рекомендаций представлена в таблице 2


ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ВНЕДРЕНИЯ ПРОТОКОЛА
Список разработчиков протокола с указанием квалификационных данных:
1) Жубанышева Карлыгаш Биржановна – завевающая кафедрой неонатологии НУО «Казахстанско-Российский Медицинский университет», неонатолог-реаниматолог, высшая категория, профессор, Президент ассоциации неонатологов и специалистов детской медицины, г.Алматы.
2) Абентаева Ботагоз Абубакировна – UMC КФ «Центр материнства и детства», кандидат медицинских наук, врач неонатолог – реаниматолог, старший ординатор отделения реанимации новорожденных «Центр материнства и детства», г.Астана.
3) Качурина Дилара Радиковна – доктор медицинских наук, профессор кафедры неонатологии Казахстанско-Российского медицинского университета, г. Алматы.
4) Божбанбаева Нишангуль Сейтбековна – заведующая кафедрой неонатологии НАО КазНМУ им. Асфендиярова, доктора медицинских наук, профессор, г.Алматы.
5) Ахмадьяр Нуржамал Садыровна – завежующая кафедрой клиническая фармакология, доктора медицинских наук, профессор НАО Медицинский университет «Астана», г.Астана.
Указание на отсутствие конфликта интересов: нет.
Рецензенты: Кизатова Сауле Танзиловна. профессор кафедры педиатрии с неонатологией НАО Медицинский университет Караганда, г. Караганда.
Условия пересмотра протокола: пересмотр протокола через 5 лет и/или при появлении новых методов диагностики и/или лечения с более высоким уровнем доказательности.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.