Анемия при злокачественных новообразованиях
 Версия: Клинические рекомендации РФ 2024 (Россия)
Версия: Клинические рекомендации РФ 2024 (Россия)
Анемия при новообразованиях (C00-D48+) (D63.0*)
Онкогематология, Онкология
Общая информация
Краткое описание
Разработчик клинической рекомендации
- Национальное гематологическое общество
- Общероссийская общественная организация «Российское общество клинической онкологии»
- Ассоциация онкологов России
- Российское общество онкогематологов
Одобрено Научно-практическим Советом Минздрава РФ
В соответствии с Правилами поэтапного перехода медицинских организаций к оказанию медицинской помощи на основе клинических рекомендаций, разработанных и утвержденных в соответствии с частями 3, 4, 6 –9 и 11 статьи 37 Федерального закона «Об основах охраны здоровья граждан в Российской Федерации», утвержденных постановлением Правительства Российской Федерации от 19.11.2021 № 1968 с изменения, клинические рекомендации применяются следующим образом:
– размещенные в Рубрикаторе после 1 января 2024 года – с 1 января 2025 года.
– размещенные в Рубрикаторе после 1 января 2024 года – с 1 января 2025 года.
Анемия при злокачественных новообразованиях
Год утверждения (частота пересмотра): 2024
Возрастная категория: Взрослые
Пересмотр не позднее: 2026
ID: 624
Определение заболевания или состояния (группы заболеваний или состояний)
Анемия при злокачественных новообразованиях (АЗН) определяется как снижение концентрации Hb и/или количества эритроцитов ниже нормальных значений, в том числе, обусловленное опухолевым процессом и/или его лечением.
Последствия анемии могут включать нарушение ответа на лечение рака и снижение общей выживаемости (ОВ), даже если прямая причинно-следственная связь не установлена [1,2], а также снижение качества жизни пациентов вследствие различной степени нарушения толерантности к нагрузке и связанных с анемией симптомов.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
D63.0 – Анемия при новообразованиях
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Для дифференциальной диагностики анемий используется ряд классификаций, основанных на различных классификационных признаках, в том числе: морфологические особенности эритроцитов (в частности – показатели MCV, MCH и MCHC); способность костного мозга к воспроизводству эритроцитов (определяется на основе относительного и абсолютного количества ретикулоцитов), степень снижения концентрации гемоглобина и другие [9]
По среднему объему эритроцитов (MCV) и среднему содержанию/концентрации гемоглобина в эритроцитах (MCH, MCHC) анемии разделяются на:
- Микроцитарные и гипохромные анемии (MCV <80 fl, MCH <27 пг, MCHC <300 г/л);
- Нормоцитарные и нормохромные анемии (MCV 80-100 fl, MCH 27 – 34 пг, MCHC 300 -380 г/л);
- Макроцитарные и гиперхромные анемии (MCV >100 fl, MCH >34 пг, MCHC >380 г/л).
По способности костного мозга к воспроизводству эритроцитов выделяют:
- Гипорегенераторные анемии (Ret отн. <0,5 %, Ret абс. <20 х 109/л);
- Норморегенераторные анемии (Ret отн. 0.5–2,0 %, Ret абс. 20 - 100 х 109/л);
- Гиперрегенераторные анемии (Ret отн. >2 %, Ret абс. > 100 х 109/л).
Типичные морфологические признаки и характеристики регенерации наиболее распространенных вариантов анемий представлены в таблице № 1 и 2.
Таблица 1. Морфологическая классификация анемий (на основе показателей MCV и MCH/MCHC)
|
Микроцитарные,
гипохромные анемии
|
Нормоцитарные,
нормохромные анемии
|
Макроцитарные,
гиперхромные анемии
|
|---|---|---|
| ЖДА | АХЗ | В12-дефицитная анемия |
| Талассемия | Анемия при ХБП | Фолиеводефицитная анемия |
|
Наследственная
сидеробластная анемия
|
Апластическая анемия | Гемолитические анемии |
| Свинцовая интоксикация |
Анемии при ЗНО и
опухолевых заболеваниях
системы крови
|
Состояние после
спленэктомии
|
|
Лекарственные и
токсические анемии
|
Анемии на фоне терапии
метотрексатом,
гидроксимочевиной
|
Таблица 2. Классификация анемий на основе регенераторной способности
| Гипорегенераторные | Норморегенераторные | Гиперрегенераторные |
|---|---|---|
| Апластическая анемия | АХЗ |
Постгеморрагическая анемия
(острая кровопотеря)
|
|
Парциальная
красноклеточная аплазия
|
Дефицитные анемии |
Приобретенные
гемолитические анемии:
- АИГА
- неиммунные
гемолитические анемии
|
| Анемии при ЗНО | Анемии при ХБП |
Наследственные
гемолитические анемии
|
| Тяжелые дефицитные анемии |
Анемия при
опухолевых заболеваниях
системы крови
|
По степени тяжести анемии согласно критериям ВОЗ выделяют [10]:
- Анемию легкой степени: концентрация гемоглобина 100–119 г/л у женщин и 100–129 г/л у мужчин;
- Анемию средней степени: концентрация гемоглобина 80–99 г/л у обоих полов;
- Анемию тяжелой степени: концентрация гемоглобина <80 г/л у обоих полов.
Для оценки степени токсичности лекарственных препаратов (в том числе цитостатического воздействия) используется шкала CTCAE, представленная в приложении Г2.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
К причинам анемии, обусловленной ЗНО, относятся [3–5]:
- Хроническое воспаление за счет воздействия провоспалительных опухолевых цитокинов на гемопоэз и процесс обмена железа
- Миелосупрессия и деструкция эритроцитов в результате цитостатического воздействия противоопухолевой терапии (лекарственной терапии, лучевой терапии)
- Супрессия процесса кроветворения и дифференцировки клеток-предшественников эритроцитов в костном мозге опухолевым процессом или противоопухолевым лечением
- Нарушение процессов синтеза эритропоэтина, а также снижение чувствительности к эритропоэтину эритродных клеток-предшественников
- Инфильтрация костного мозга опухолевыми клетками с сокращением плацдарма кроветворения
Дополнительными причинами, приводящими к развитию или усугубляющими течение анемии у пациентов с ЗНО могут являться:
- Острые и хронические кровотечения
- Железодефицитные состояния
- В12-дефицитные (в том числе, обусловленные антителами к внутреннему фактору Касла) и фолиеводефицитные состояния
- Нарушение функции почек со снижением продукции эритропоэтина
- Гемолиз (повышенное разрушение эритроидных клеток) вследствие аутоиммунных реакций, микроангиопатии и других причин
Таким образом, патогенез анемии у пациентов со злокачественными новообразованиями достаточно сложен и связан как с прямыми, так и с опосредованными эффектами опухолевого процесса на организм, а также с возможным в ряде случаев угнетающим действием противоопухолевого лечения на клетки эритроидного ростка кроветворения [4].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Анемия и дефицит железа (ДЖ) - частые осложнения у пациентов с злокачественными новообразованиями, особенно, получающих противоопухолевые препараты) [6]. Согласно результатам European Cancer Anemia Survey (ECAS), у 15000 проанализированных пациентов со злокачественными новообразованиями на этапе постановки диагноза частота регистрации анемии составила 39,3%, а проведение специализированной терапии увеличило частоту регистрации анемии у этих пациентов до 67,0% [7,8].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Основными клиническими симптомами анемии могут быть бледность кожных покровов и слизистых оболочек, учащенное сердцебиение (тахикардия), одышка (тахипное), астения, шум в ушах, головная боль.
Часто анемия связана с повышенной утомляемостью, нарушением физических функций и снижением качества жизни [11–13].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу (по критериям шкал оценки уровня достоверности доказательств и уровня убедительности рекомендаций) по причине отсутствия посвященных им клинических исследований. Несмотря на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Диагноз анемии при ЗНО может быть заподозрен на основании анамнестических данных, результатов физикального обследования; устанавливается на основании результатов лабораторных исследований.
Основным диагностическим критерием анемии является стойкое снижение концентрации гемоглобина менее 120 г/л у женщин и менее 130 г/л и мужчин [10].
1. Жалобы и анамнез
- Всем пациентам с подозрением на анемию злокачественных новообразований и всем пациентам с установленным диагнозом анемии злокачественных новообразований на каждом врачебном приеме рекомендуется сбор анамнеза и сбор жалоб для оценки состояния пациента, а также для выявления возможных альтернативных причин анемии [4].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии: при сборе жалоб и анамнеза у больных с анемией необходимо оценить возможность наличия других причин анемии, и в частности:
- острое или хроническое кровотечение;
- гемолиз (аутоимунный, микроангиопатический);
- интеркуррентные заболевания (например, инфекционно-воспалительные заболевания, болезни почек и др.);
- дефицит железа, фолиевой кислоты, витамина В12;
- наследственная анемия (в том числе гемоглобинопатии).
2. Физикальное обследование
- Всем пациентам с подозрением на анемию злокачественных новообразований и всем пациентам с установленным диагнозом анемии злокачественных новообразований на каждом врачебном приеме рекомендуется визуальное исследование, пальпация, перкуссия при заболеваниях органов кроветворения и крови [4].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии: Общий физикальный осмотр подразумевает оценку общего состояния пациента по шкале оценки общего состояния пациента, разработанная Восточной Кооперативной Группой Исследования Рака – ECOG (Приложение Г1), наличие симптомов гипоксии, степень компенсации анемического синдрома.
При физикальном осмотре оценивают:
- цвет кожных покровов и видимых слизистых (бледность, желтушность);
- изменения со стороны сердечно-сосудистой системы (тахикардия, глухость тонов, сердечные шумы);
- изменения со стороны дыхательной системы (тахипноэ);
- выраженность астении, толерантность к физической нагрузке.
У пациентов с АЗН большинство жалоб и клинических симптомов являются неспецифическими и, как правило, сочетаются с жалобами и клиническими проявлениями основного заболевания (опухолевого процесса), а также побочными нежелательными явлениями проводимой специализированной терапии (лекарственной терапии, лучевой терапии).
Следует учесть, что присоединение инфекции, гипертермии, боли могут привести к декомпенсации анемического синдрома. Признаками декомпенсации могут быть затрудненное, быстрое дыхание с межреберным, подреберным и надгрудинным втяжением (респираторный дистресс); усиленное использование мышц живота для дыхания; раздувание крыльев носа; форсированный ("стонущий") выдох (респираторный дистресс); изменение психического состояния; ослабление периферического пульса; застойная сердечная недостаточность (гепатомегалия, отеки).
3. Лабораторные диагностические исследования
- Всем пациентам с подозрением на анемию злокачественных новообразований и всем пациентам с установленным диагнозом анемии злокачественных новообразований рекомендуется проведение лабораторных и инструментальных исследований с целью выявления анемии, определения ее типа, уточнения степени анемии и выявления ведущих этиологических факторов [4]. Диагностику анемии и выявление ее причин необходимо проводить до проведения гемотрансфузии (если нет экстренных показаний) или назначения эритропоэзстимулирующих препаратов (ЭСП; В03ХА: Другие антианемические препараты) и препаратов железа [4,14].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Пациентам с клиническими симптомами АЗН рекомендуется выполнение общего (клинического) анализа крови развернутого с определением уровня общего гемоглобина в крови, количества эритроцитов и ретикулоцитов, гематокрита (Hct), среднего объёма эритроцита (MCV), среднего содержания гемоглобина в эритроците (MCH), средней концентрации гемоглобина в эритроците (MCHC) [15].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: учитывая, что большинство симптомов анемии неспецифические, наиболее доступным, объективным и основополагающим методом диагностики анемии является лабораторное определение концентрации гемоглобина в крови. АЗН, как правило, носит гипорегенераторный, нормоцитарный, нормохромный характер.
- Пациентам с клиническими и лабораторными проявлениями АЗН рекомендуется исследование показателей обмена железа, включающее исследование уровня железа сыворотки крови, исследование уровня ферритина в крови, исследование уровня трансферрина сыворотки крови, исследование железосвязывающей способности сыворотки, исследование насыщения трансферрина железом, исследование уровня C-реактивного белка в сыворотке крови с целью определения вида анемии и дифференциальной диагностики с железодефицитной анемией [15–17].
Уровень убедительности рекомендаций С (уровень достоверности доказательств –5)
Комментарии: железодефицитная анемия в типичном варианте имеет характеристику норморегенераторной (в случае продолжающейся кровопотери - гиперрегенераторной) микроцитарной, гипохромной анемии, отличительной лабораторной особенностью которой является снижение концентрации сывороточного ферритина <30 нг/мл [17,18]В случае сопутствующего воспалительного процесса (обусловленного опухолью или иного генеза) и повышения концентрации СРБ >5 нг/мл критериями абсолютного дефицита железа является концентрация сывороточного ферритина <100 нг/мл в сочетании со снижением показателя НТЖ <20 % [19].Значение сывороточного ферритина >100 нг/мл в сочетании с НТЖ <20 % расценивают как функциональный (перераспределительный) дефицит железа – состояние, характеризующиеся секвестрацией железа в клетках-экспортерах (энтероцитах, гепатоцитах, макрофагах) и снижением транспорта железа к клеткам-потребителям, что приводит к развитию железодефицитного эритропоэза в условиях достаточных тканевых запасов железа [19]. В сложных клинических ситуациях помимо определения концентрации ферритина и расчета параметра НТЖ необходимо исследование концентрации трансферрина и общей железосвязывающей способности (ОЖСС). Для абсолютного дефицита железа характерно повышение концентрации сывороточного трансферрина и ОЖСС, для воспалительных изменений – нормальная или сниженная концентрация трансферрина, нормальное значение ОЖСC [20]
- Пациентам, у которых по клиническим и лабораторным проявлениям можно заподозрить В12-дефицитную или фолиеводефицитную анемию, рекомендуется определение уровня витамина В12 (цианокобаламина) в крови и исследование уровня фолиевой кислоты в сыворотке крови [4,21,22].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: В12 и фолиеводефицитная анемии характеризуются макроцитозом и гиперхромией эритроцитов, нормальным или сниженным количеством ретикулоцитов, картиной мегалобластного эритропоэза в костном мозге, снижением количества тромбоцитов и лейкоцитов (вплоть до глубокой панцитопении), гиперсегментацией ядер нейтрофилов, а также лабораторными признаками гемолиза. Для В12-дефицитной анемии характерно поражение нервной системы [23,24]
- Пациентам, у которых по клиническим и лабораторным проявлениям можно заподозрить гемолитическую анемию, рекомендуется проведение тестов на гемолиз (исследование уровня общего билирубина в крови, исследование уровня свободного (неконъюгированного) и связанного билирубина в крови, определение активности лактатдегидрогеназы в крови; исследование уровня гаптоглобина крови, прямой антиглобулиновый тест (прямая проба Кумбса) [25].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: общими лабораторными характеристиками гемолитических анемий является ретикулоцитоз (относительный и абсолютный), повышение концентрации билирубина за счет непрямой фракции, повышение концентрации ЛДГ, снижение концентрации гаптоглобина сыворотки. В случае аутоиммунного гемолиза регистрируется положительная прямая проба Кумбса. В костном мозге при гемолитических анемиях определяется расширение эритроидного ростка гемопоэза [26]
- Пациентам, у которых по клиническим и лабораторным проявлениям можно заподозрить скрытое желудочно-кишечное кровотечение, рекомендуется исследование кала на скрытую кровь [15].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Пациентам, у которых по клиническим и лабораторным проявлениям можно заподозрить нарушение почечной функции, рекомендуется исследование уровня креатинина в крови и/или функции нефронов по клиренсу креатинина (проба Реберга) [27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Пациентам, у которых по клиническим и лабораторным проявлениям можно заподозрить миелодиспластический синдром или нарушение выработки эритропоэтина почками, рекомендуется исследование уровня эритропоэтина крови [27].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: миелодиспластический синдром - группа клональных заболеваний системы крови, характеризующаяся развитием цитопении, картиной дисплазии в костном мозге и высоким риском трансформации в острый лейкоз. Заподозрить миелодиспластический синдром позволяет наличие рефрактерной анемии (при исключении анемии других этиологий) в сочетании с тромбоцитопенией и/или лейкопенией. Для анемии при миелодисплатическом синдроме характерен нормо- (при отдельных формах – макроцитоз) эритроцитов, нормальное или сниженное количество ретикулоцитов. При исследовании параметров метаболизма железа регистрируется картина тканевой перегрузки: повышение концентрации ферритина >300 нг/мл, повышение НТЖ >45%, снижение концентрации сывороточного трансферрина и показателя ОЖСС [28].
4. Инструментальные диагностические исследования
- Пациентам с установленным диагнозом ЖДА, протекающей на фоне злокачественного новообразования рекомендуется проведение эндоскопических исследований верхних и нижних отделов желудочно-кишечного тракта (эзофагогастродуоденоскопия, колоноскопия) с целью исключения кровотечения и принятия мер по его остановке [4,15].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
- Пациентам с установленным диагнозом ЖДА, протекающей на фоне злокачественного новообразования рекомендуется проведение инструментальных исследований с целью поиска источника кровопотери. В зависимости от объема и локализации опухолевого поражения выполняется [4,15]:
- рентгенография легких и прицельная рентгенография органов грудной клетки;
- обзорная рентгенография органов брюшной полости;
- компьютерная томография органов грудной полости;
- компьютерная томография органов брюшной полости;
- компьютерная томография органов малого таза;
- ультразвуковое исследование органов грудной клетки;
- ультразвуковое исследование органов брюшной полости (комплексное), ультразвуковое исследование органов малого таза (комплексное), ультразвуковое исследование мягких тканей (одна анатомическая зона), ультразвуковое исследование почек, других зон (по показаниям);
- эзофагогастродуоденоскопия;
- колоноскопия;
- бронхоскопия;
- ларингоскопия;
- фарингоскопия.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарий: диагностику анемии и выявление ее причин необходимо проводить до проведения гемотрансфузии (если нет экстренных показаний к гемотрансфузии) или назначения эритропоэзстимулирующих препаратов (ЭСП; В03ХА: Другие антианемические препараты) и препаратов железа.
5. Иные диагностические исследования
- Пациентам с подозрением на анемию, вызванную нарушением костномозгового кроветворения, или метастазами в костный мозг, или иными причинами, отличными от основного злокачественного заболевания, рекомендуется исследование костного мозга [29].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии: может выполняться аспирация костного мозга (Получение цитологического препарата костного мозга путем пункции) для цитологического исследования мазка костного мозга (миелограмма) и/или трепанобиопсия (Получение гистологического препарата костного мозга) для патолого-анатомического исследования биопсийного (операционного материала костного мозга) – по показаниям.
- Всем пациентам с АЗН рекомендуется проведение исследований группы крови и резус фактора [30].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии: проводятся определение основных групп по системе AB0, определение антигена D системы Резус (резус-фактор), определение фенотипа по антигенам C, c, E, e, Cw, K, k и определение антиэритроцитарных антител, иные исследования по показаниям.
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
1. Консервативное лечение
Гемотрансфузия эритроцитарной массы
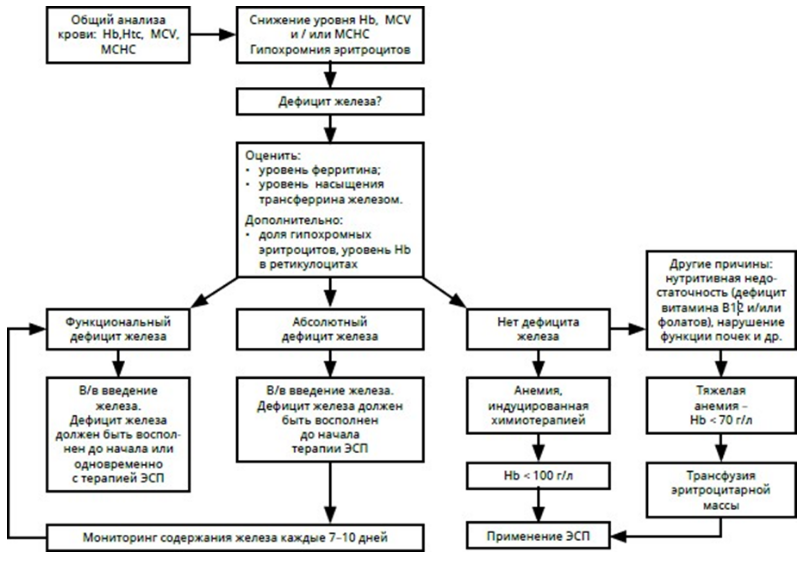
- Пациентам с концентрацией гемоглобина ниже 70 г/л и/или с клиническими проявлениями анемической гипоксии (в том числе при более высоком содержании гемоглобина) рекомендовано проведение гемотрансфузии эритроцитсодержащих компонентов донорской крови (эритроцитная масса, эритроцитная масса с удаленным лейкотромбоцитным слоем, эритроцитная масса, лейкоредуцированная, эритроцитная масса, полученная методом афереза, и др) [14,31].
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии: гемотрансфузии назначаются исходя из клинических показаний, и содержание гемоглобина является одним из ориентиров. Так, трансфузии эритроцитсодержащих компонентов донорской крови могут быть показаны при более легкой степени анемии с содержанием гемоглобина 100 – 80 г/л, если предстоит обширное хирургическое пособие, если анемия приводит к гипоксическим симптомам и т.д.
Эритроцитсодержащие компоненты донорской крови – это компоненты донорской крови, полученные после центрифугирования цельной донорской крови путем удаления максимального количества плазмы и, в ряде случаев, лейкотромбоцитного слоя, и содержащие вследствие этого преимущественно эритроциты (эритроцитная масса, эритроцитная взвесь и т. д.).
Заместительные трансфузии эритроцитсодержащих компонентов донорской крови являются традиционным методом коррекции сниженного Hb и жизнеугрожающих ситуаций, связанных с острой кровопотерей (обширные операции). Однако для лечения анемии, связанной с опухолевым процессом (распад опухоли, интоксикация) и противоопухолевым лечением, гемотрансфузии не являются однозначно безопасным и эффективным методом. Так, гемотрансфузии могут сопровождаться гемолитическими реакциями, в том числе фатальными (частота — 1: 1000), трансфузионными поражениями лёгких (частота — 1: 5000), бактериальной контаминацией, в том числе фатальным сепсисом (частота — 1 : 10000), передачей вирусов гепатита В (частота — 1 : 30000), гепатита С и вируса иммунодефицита человека (частота — 1 : 1000000) [33, 34]. Кроме того, многие потенциально опасные вирусные инфекции в настоящее время у доноров не тестируются. Наряду с вышесказанным, иммунодепрессия, вызванная гемотрансфузией, приводит к повышению риска тромбозов, инфекционных осложнений и снижением безрецидивной и общей выживаемости при ряде опухолевых заболеваний (колоректальный рак, рак мочевого пузыря) [32,33]Повышение концентрации Hb после гемотрансфузий является кратковременным, и для поддержания его нормального значения их необходимо повторять. В связи с этим ВОЗ рекомендует максимально регламентировать заместительные гемотрансфузии у онкологических больных и использовать альтернативные методики коррекции Hb.
Согласно приказу Министерства Здравоохранения Российской Федерации от 03.06.2013 г. № 348Н, гемотрансфузии при снижении концентрации Hb <70–80 г / л показаны только в случае острых постгеморрагических анемий при одномоментном снижении гематокрита до ≤ 25 %. При хронических анемиях главной задачей является устранение причины, вызвавшей анемию, и гемотрансфузии назначаются только для коррекцииклинически значимых симптомов, обусловленных гипоксией вследствие снижения Hb и не поддающихся патогенетической терапии. Таким образом, концентрация Hb изолированно не может служить абсолютным критерием необходимости гемотрансфузий, поэтому решение всегда должно быть результатом клинического суждения лечащего врача, и основываться в первую очередь на объективных признаках гипоксии с учетом сопутствующих факторов риска (кровотечения, интеркуррентные инфекции, предстоящая химио/лучевая терапия и др.). При частых гемотрансфузиях пациентам предпочтительно назначать облученную, обедненную лейкоцитами эритроцитную массу. Было показано, что лейкоредукция достоверно уменьшает риск фибрильных негемолитических трансфузионных реакций, а также передачу возбудителей инфекционных заболеваний [34,35]. Облучение эритроцитной массы предотвращает развитие трансфузионно-ассоциированной реакции трансплантант- против-хозяина у иммунокомпромитированных пациентов [34,36].
Лекарственная терапия с целью коррекции АЗН
- Пациентам с симптомной анемией или уровнем гемоглобина менее 100 г/л рекомендовано проведение лекарственной терапии эритропоэзстимулирующими препаратами (ЭСП В03ХА: Другие антианемические препараты) в монорежиме или в комбинации с препаратами железа [13,15,29,37,38]
Уровень убедительности рекомендаций С (уровень достоверности доказательств 5).
Комментарии: применение ЭСП (В03ХА: Другие антианемические препараты) может быть показано при симптомной анемии, Hb <100 г/л и всем пациентам с анемией тяжелой степени. В случае отсутствия эффекта (увеличение Hb менее, чем на 10 г / л при исходном уровне Hb <100 г / л) лечение ЭСП (В03ХА: Другие антианемические препараты) должно быть прекращено через 8 недель. Использование ЭСП (В03ХА: Другие антианемические препараты) позволяет повысить продукцию эритроцитов костным мозгом и увеличить содержание Hb без переливания донорских эритроцитов. Результаты контролируемых исследований показали, что применение ЭСП (В03ХА: Другие антианемические препараты) при АЗН, а также при анемии, вызванной ХТ, повышает концентрацию Hb в 60–70 % случаев и сопровождается существенным снижением потребности в заместительных гемотрансфузиях (относительный риск 0,64; 95 % ДИ 0,6–0,68). У пациентов с солидными опухолями и пациентов, получающих платиносодержащую ХТ, применение ЭСП (В03ХА: Другие антианемические препараты) более эффективно, чем при других типах опухолей и других видах ХТ. В ряде исследований продемонстрировано улучшение качества жизни при применении ЭСП (В03ХА: Другие антианемические препараты). Однако, в других исследованиях различия в показателях качества жизни признаны незначимыми.
Применение ЭСП (В03ХА: Другие антианемические препараты) повышает вероятность венозных тромбоэмболических осложнений (ВТЭО), относительный риск которых увеличивается на 67 % по сравнению с плацебо (ОР 1,67; 95 % ДИ: 1,35–2,06) [39]. Однако назначение эритропоэтинов не требует дополнительной профилактики ВТЭО. Влияние ЭСП (В03ХА: Другие антианемические препараты) на выживаемость онкологических пациентов изучается, однако результаты исследований неоднозначны. Данные трёх мета-анализов показали негативное влияние ЭСП (В03ХА: Другие антианемические препараты) на общую выживаемость, а результаты двух других мета-анализов подобного влияния не выявили. Однако во всех мета-анализах не было выявлено значимого негативного влияния ЭСП (В03ХА: Другие антианемические препараты) у пациентов, получающих ХТ. В связи с этим большинство экспертов считает нецелесообразным применение ЭСП (В03ХА: Другие антианемические препараты) у пациентов, не получающих ХТ или ХЛТ.
Противопоказания к применению ЭСП (В03ХА: Другие антианемические препараты):
- известная гиперчувствительность к ЭСП (В03ХА: Другие антианемические препараты) или их компонентам;
- неконтролируемая АГ;
- высокий риск тромбоэмболических осложнений (тромбоз в анамнезе, обширное хирургическое вмешательство, длительная иммобилизация или ограничение активности, лечение леналидомидом** в комбинации с доксорубицином** и глюкокортикоидами; данные о роли профилактического использования антикоагулянтов отсутствуют).
Рекомендуемые дозы ЭСП (В03ХА: Другие антианемические препараты) и принципы их коррекции у взрослых онкологических больных, получающих ХТ, представлены в табл. 1 (см. приложение А3).
- Пациентам с доказанным абсолютным дефицитом железа рекомендуется назначение лекарственных препаратов железа в соответствии с протоколами лечения ЖДА [13,19,40].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: у ряда пациентов на фоне интенсификации эритропоэза в результате терапии ЭСП (В03ХА: Другие антианемические препараты) развивается абсолютный дефицит железа, что обусловливает необходимость контроля параметров метаболизма железа у пациентов с АЗН как исходно, так и в динамике.
Выбор предпочтительной лекарственной формы (пероральной или парентеральной) и дозы препарата железа зависит от ряда факторов: степени тяжести анемии, наличия сопутствующего воспаления (в частности, на фоне опухолевого процесса), наличия продолжающейся кровопотери, а также индивидуальной переносимости различных форм препаратов железа.
В случае анемии легкой или умеренной степени тяжести, при отсутствии продолжающегося кровотечения и нормальных показателях СРБ целесообразно проводить коррекцию железодефицита препаратами железа в лекарственной форме для перорального применения в дозе 60-120 мг элементарного железа в сутки каждый день, либо в режиме приема через день. Длительность терапии определяется тяжестью исходного железодефицита и может варьировать от 1 до 3 месяцев (в некоторых случаях – больше) – до регресса лабораторной картины ЖДА (ферритин 40-60 нг/мл при СРБ <5 нг/мл).
При тяжелой анемии, продолжающемся кровотечении (которое невозможно купировать хирургическими и/или консервативными методами), а также при повышении СРБ >5 нг/мл (на фоне опухолевого процесса) целесообразно проводить лечение парентеральными препаратами трехвалентного железа.
При наличии инфекционных осложнений применение как пероральных, так и внутривенных препаратов железа откладывается до купирования инфекционного процесса.
В связи с возможным взаимодействием железа и некоторых противоопухолевых препаратов (антрациклины и родственные соединения, препараты платины) необходимо воздерживаться от введения препаратов железа в дни введения противоопухолевых препаратов. Рекомендуемые дозы и режим парентерального введения препаратов железа представлены в табл. 2 (см. приложение А3).
- Пациентам с развитием аутоиммунной гемолитической анемии на фоне ЗН рекомендуется проведение терапии в соответствии с протоколами лечения аутоиммунных гемолитических анемий [41,42].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: в ряде случаев, развитие аутоиммунного гемолиза, например при лимфопролиферативных заболеваниях, является показанием к проведению специфической химиотерапии.
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Специфических методов реабилитации и санаторно-курортного лечения для больных с АЗН не разработано. Реабилитация пациентов с АЗН должна носить комплексный характер, охватывая социально-реабилитационную, нейропсихологическую и клинико-психологическую адаптацию. Объем медицинской реабилитации разрабатывается индивидуально для каждого пациента врачом по медицинской реабилитации, медицинским психологом при участии врача-онколога и врача-гематолога. Кроме этого, программа реабилитации должна учитывать социальные и психологические проблемы пациента и включать (по показаниям) социальных работников и психологов. Реабилитация при возникновении осложнений в течение заболевания и лечения проводится в рамках соответствующих нозологий.
Госпитализация
Организация оказания медицинской помощи
Медицинская помощь, за исключением медицинской помощи в рамках клинической апробации, в соответствии с Федеральным законом от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», организуется и оказывается:
1) в соответствии с положением об организации оказания медицинской помощи по видам медицинской помощи, которое утверждается уполномоченным Федеральным органом исполнительной власти;
2) в соответствии с порядком оказания помощи по профилю «онкология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями;
3) в соответствии с порядком оказания помощи по профилю «гематология», обязательным для исполнения на территории Российской Федерации всеми медицинскими организациями для кодов МКБ-10: С81—С96, D45—D47, D50—D76, Е75.2, Е80.0, Е80.2, Е83.0, Е83.1, Е85.8, М31.1;
4) на основе настоящих клинических рекомендаций;
5) с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
Первичная специализированная медико-санитарная помощь оказывается врачом-онкологом или врачом-гематологом и иными врачами-специалистами в центре амбулаторной гематологической/онкологической помощи либо в первичном гематологическом/ онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы).
При подозрении или выявлении у пациента онкологического заболевания врачи-терапевты, врачи-терапевты участковые, врачи общей практики (семейные врачи), врачи-специалисты, средние медицинские работники в установленном порядке направляют пациента на консультацию в центр амбулаторной гематологической/онкологической помощи либо в первичный гематологический/онкологический кабинет, поликлиническое отделение онкологического диспансера (онкологической больницы) для оказания ему первичной специализированной медико-санитарной помощи.
Консультация в центре амбулаторной онкологической помощи либо в первичном онкологическом кабинете, поликлиническом отделении онкологического диспансера (онкологической больницы) должна быть проведена не позднее 5 рабочих дней с даты выдачи направления на консультацию. Врач-онколог центра амбулаторной онкологической помощи (в случае отсутствия центра амбулаторной онкологической помощи врач-онколог первичного онкологического кабинета или поликлинического отделения онкологического диспансера (онкологической больницы), или врач-гематолог амбулаторного или стационарного звена гематологической помощи организует взятие биопсийного (операционного) материала, а также организует выполнение иных диагностических исследований, необходимых для установления диагноза, включая распространенность онкологического процесса и стадию заболевания.
В случае невозможности взятия в медицинской организации, в составе которой организован центр амбулаторной гематологической/онкологической помощи (первичный онкологический кабинет, биопсийного (операционного) материала, проведения иных диагностических исследований пациент направляется лечащим врачом в онкологический диспансер (онкологическую больницу) или в медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими/гематологическими заболеваниями.
Срок выполнения патологоанатомических исследований, необходимых для гистологической верификации злокачественных новообразований не должен превышать 15 рабочих дней с даты поступления биопсийного (операционного) материала в патологоанатомическое бюро (отделение).
Сроки проведения диагностических инструментальных и лабораторных исследований в случае подозрения на онкологическое заболевание не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
Диагноз онкологического заболевания устанавливается врачом-онкологом, а при злокачественных новообразованиях лимфоидной, кроветворной и родственных им тканей, входящих в рубрики МКБ-10 С81-С96 и D45—D47, D50—D76, также врачом-гематологом.
Врач-онколог центра амбулаторной онкологической помощи (первичного онкологического кабинета) направляет пациента в онкологический диспансер (онкологическую больницу) или иную медицинскую организацию, оказывающую медицинскую помощь пациентам с онкологическими заболеваниями, в том числе подведомственную федеральному органу исполнительной власти (далее – федеральная медицинская организация), для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания), определения тактики лечения, а также в случае наличия медицинских показаний для оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
При онкологических заболеваниях, входящих в рубрики С37, C38, C40–C41, C45–C49, С58, D39, C62, C69–C70, С72, C74 МКБ-10, а также соответствующих кодам международной классификации болезней – онкология (МКБ-О), 3 издания 8936, 906-909, 8247/3, 8013/3, 8240/3, 8244/3, 8246/3, 8249/3 врач-онколог онкологического диспансера (онкологической больницы) или иной медицинской организации, оказывающей медицинскую помощь пациентам с онкологическими заболеваниями, для определения лечебной тактики организует проведение консультации или консилиума врачей, в том числе с применением телемедицинских технологий, в федеральных государственных бюджетных учреждениях, подведомственных Министерству здравоохранения Российской Федерации, оказывающих медицинскую помощь (далее в целях настоящего Порядка – национальные медицинские исследовательские центры).
В сложных клинических случаях для уточнения диагноза (в случае невозможности установления диагноза, включая распространенность онкологического процесса и стадию заболевания) в целях проведения оценки, интерпретации и описания результатов врач-онколог организует направление:
- цифровых изображений, полученных по результатам патоморфологических исследований, в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр) путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
- цифровых изображений, полученных по результатам лучевых методов исследований, в дистанционный консультативный центр лучевой диагностики, путем информационного взаимодействия, в том числе с применением телемедицинских технологий при дистанционном взаимодействии медицинских работников между собой;
- биопсийного (операционного) материала для повторного проведения патоморфологических, иммуногистохимических, и молекулярно-генетических исследований: в патолого-анатомическое бюро (отделение) четвертой группы (референс-центр), а также в молекулярно-генетические лаборатории для проведения молекулярно-генетических исследований.
Тактика лечения устанавливается консилиумом врачей, включающим врачей-онкологов, врача-радиотерапевта, врача-нейрохирурга (при опухолях нервной системы) медицинской организации, в составе которой имеются отделения хирургических методов лечения злокачественных новообразований, противоопухолевой лекарственной терапии, радиотерапии (далее – онкологический консилиум), в том числе онкологическим консилиумом, проведенным с применением телемедицинских технологий, с привлечением при необходимости других врачей-специалистов, или врачом-гематологом, с проведением при необходимости консилиума и привлечения при необходимости других врачей-специалистов. Решение консилиума врачей оформляется протоколом, подписывается участниками консилиума врачей и вносится в медицинскую документацию пациента.
Диспансерное наблюдение врача-онколога или врача-гематолога за пациентом с выявленным онкологическим или гематологическим заболеванием устанавливается и осуществляется в соответствии с порядком диспансерного наблюдения за взрослыми с онкологическими или гематологическими заболеваниями.
С целью учета информация о впервые выявленном случае онкологического или гематологического заболевания направляется в течение 3 рабочих дней врачом-онкологом или врачом-гематологом медицинской организации, в которой установлен соответствующий диагноз, в онкологический диспансер или организацию субъекта Российской Федерации, исполняющую функцию регистрации пациентов с впервые выявленном злокачественным новообразованием, в том числе с применением единой государственной информационной системы в сфере здравоохранения.
Специализированная, в том числе высокотехнологичная, медицинская помощь в медицинских организациях, оказывающих медицинскую помощь взрослому населению при онкологических заболеваниях, оказывается по медицинским показаниям, предусмотренным положением об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Специализированная, за исключением высокотехнологичной, медицинская помощь в медицинских организациях, подведомственных федеральным органам исполнительной власти, оказывается по медицинским показаниям, предусмотренным пунктом 5 порядка направления пациентов в медицинские организации и иные организации, подведомственные федеральным органам исполнительной власти, для оказания специализированной (за исключением высокотехнологичной) медицинской помощи, предусмотренного в приложении к положению об организации оказания специализированной, в том числе высокотехнологичной, медицинской помощи.
Сроки ожидания оказания специализированной (за исключением высокотехнологичной) медицинской помощи не должны превышать сроков, установленных в программе государственных гарантий бесплатного оказания гражданам медицинской помощи, утверждаемой Правительством Российской Федерации.
При наличии у пациента с онкологическим заболеванием медицинских показаний для проведения медицинской реабилитации врач-онколог организует ее проведение в соответствии с порядком организации медицинской реабилитации взрослых.
При наличии у пациента с онкологическим заболеванием медицинских показаний к санаторно-курортному лечению врач-онколог организует его в соответствии порядком организации санаторно-курортного лечения.
Паллиативная медицинская помощь пациенту с онкологическими заболеваниями оказывается в соответствии с положением об организации оказания паллиативной медицинской помощи, включая порядок взаимодействия медицинских организаций, организаций социального обслуживания и общественных объединений, иных некоммерческих организаций, осуществляющих свою деятельность в сфере охраны здоровья.
При подозрении и (или) выявлении у пациента онкологического заболевания в ходе оказания ему скорой медицинской помощи его переводят или направляют в медицинские организации, оказывающие медицинскую помощь пациентам с онкологическими заболеваниями, для определения тактики ведения и необходимости применения дополнительно других методов специализированного противоопухолевого лечения.
Показаниями для госпитализации в медицинскую организацию в экстренной или неотложной форме являются:
1) наличие осложнений онкологического/гематологического заболевания, требующих оказания ему специализированной медицинской помощи в экстренной и неотложной форме;
2) наличие осложнений лечения (хирургическое вмешательство, ЛТ, лекарственная терапия и т.д.) онкологического/гематологического заболевания.
Показаниями для госпитализации в медицинскую организацию в плановой форме являются:
1) необходимость выполнения сложных интервенционных диагностических медицинских вмешательств, требующих последующего наблюдения в условиях круглосуточного или дневного стационара;
2) наличие показаний к специализированному противоопухолевому лечению (хирургическое вмешательство, ЛТ, в том числе контактная, ДЛТ и другие виды ЛТ, лекарственная терапия и др.), требующему наблюдения в условиях круглосуточного или дневного стационара.
Показаниями к выписке пациента из медицинской организации являются:
1) завершение курса лечения или одного из этапов оказания специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара при условии отсутствия осложнений лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
2) отказ пациента или его законного представителя от специализированной, в том числе высокотехнологичной, медицинской помощи в условиях круглосуточного или дневного стационара, установленной консилиумом медицинской организации, оказывающей онкологическую помощь при условии отсутствия осложнений основного заболевания и/или лечения, требующих медикаментозной коррекции и/или медицинских вмешательств в стационарных условиях;
3) в случаях несоблюдения пациентом предписаний или правил внутреннего распорядка лечебно-профилактического учреждения, если это не угрожает жизни пациента и здоровью окружающих
4) необходимость перевода пациента в другую медицинскую организацию по соответствующему профилю оказания медицинской помощи.
Заключение о целесообразности перевода пациента в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра пациента врачами-специалистами медицинской организации, в которую планируется перевод.на основе настоящих клинических рекомендаций с учетом стандартов медицинской помощи, утвержденных уполномоченным Федеральным органом исполнительной власти.
В связи с тем, что АЗН является осложнением самого онкологического заболевания или проводимого лечения онкологического заболевания, ее коррекция проводится в рамках лечения основного заболевания.
Показания для госпитализации в медицинскую организацию:
1) гемоглобин крови ниже 70 г/л;
2) гематокрит ниже 30%;
3) клинические признаки анемической гипоксии (в том числе, при гемоглобине выше 70 г/л и уровне гематокрита выше 30%)
Показания к выписке пациента из медицинской организации:
1) разрешение анемии;
2) разрешение симптомов анемической гипоксии.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Специфических методов профилактики и диспансерного наблюдения для больных с АЗН не разработано. Для своевременного выявления АЗН необходим регулярный контроль клинического анализа крови в период терапии и диспансерное наблюдение по основному заболеванию (злокачественному новообразованию).
Информация
Источники и литература
-
Клинические рекомендации Российского общества онкогематологов
- Клинические рекомендации Российского общества онкогематологов - 1. Caro J.J. et al. Anemia as an independent prognostic factor for survival in patients with cancer: A systematic, quantitative review // Cancer. 2001. Vol. 91, № 12. 2. Hudis C.A. et al. rHuEPO and Treatment Outcomes: the Clinical Experience // Oncologist. 2004. Vol. 9, № S5. 3. Dicato M. Anemia in Cancer: Some Pathophysiological Aspects // Oncologist. 2003. Vol. 8, № S1. 4. Gilreath J.A., Stenehjem D.D., Rodgers G.M. Diagnosis and treatment of cancer-related anemia // American Journal of Hematology. 2014. Vol. 89, № 2. 5. Кулибаба Т.Г., Пчелин И.Ю., Слепых Л.А. Особенности анемического синдрома у онкологических пациентов // Juvenis Scientia. 2018. Vol. 9. P. 10–16. 6. Ludwig H. et al. The European Cancer Anaemia Survey (ECAS): A large, multinational, prospective survey defining the prevalence, incidence, and treatment of anaemia in cancer patients // Eur J Cancer. 2004. Vol. 40, № 15. 7. Ludwig Prof. H. et al. Prevalence of iron deficiency across different tumors and its association with poor performance status, disease status and anemia // Annals of Oncology. 2013. Vol. 24, № 7. 8. Delarue R. et al. Iron Parameters and Relation To Prognosis In Elderly Patients With Aggressive Lymphoma Receiving First Line Immunochemotherapy: An Analysis Of The Lysa LNH 03-6B Study // Blood. 2013. Vol. 122, № 21. 9. Jansen V. Diagnosis of anemia—A synoptic overview and practical approach // Transfusion and Apheresis Science. 2019. Vol. 58, № 4. 10. Who, Chan M. Haemoglobin concentrations for the diagnosis of anaemia and assessment of severity // Geneva, Switzerland: World Health Organization. 2011. 11. Cella D, Kallich J, McDermott A, Xu X. The longitudinal relationship of hemoglobin, fatigue and quality of life in anemic cancer patients: results from five randomized clinical trials // Ann Oncol. 2004. Vol. 15. P. 979–986. 12. Crawford J. et al. Relationship between changes in hemoglobin level and quality of life during chemotherapy in anemic cancer patients receiving epoetin alfa therapy // Cancer. 2002. Vol. 95, № 4. 13. Demetri G.D. Anaemia and its functional consequences in cancer patients: Current challenges in management and prospects for improving therapy // Br J Cancer. 2001. Vol. 84, № SUPPL. 1. 14. Shah N., Andrews J., Goodnough L.T. Transfusions for anemia in adult and pediatric patients with malignancies // Blood Rev. 2015. Vol. 29, № 5.15. Pasricha S. R. et al. Iron deficiency // The Lancet. 2021. Vol. 397, № 10270. P. 233–248. 16. Bermejo F., García-López S. A guide to diagnosis of iron deficiency and iron deficiency anemia in digestive diseases // World J Gastroenterol. 2009. Vol. 15, № 37. P. 4638. 17. Fertrin K.Y. Diagnosis and management of iron deficiency in chronic inflammatory conditions (CIC): Is too little iron making your patient sick? // Hematology (United States). 2020. Vol. 20, № 1. 18. Aapro M. et al. Prevalence and management of cancer-related anaemia, iron deficiency and the specific role of I.V. iron // Annals of Oncology. 2012. Vol. 23, № 8. 19. Aapro M. et al. Management of anaemia and iron deficiency in patients with cancer: ESMO Clinical Practice Guidelines // Annals of Oncology. 2018. Vol. 29. 20. Bouri S., Martin J. Investigation of iron defi ciency anaemia // Clinical Medicine, Journal of the Royal College of Physicians of London. 2018. Vol. 18, № 3. 21. Esposito G. et al. Pernicious Anemia: The Hematological Presentation of a Multifaceted Disorder Caused by Cobalamin Deficiency // Nutrients. 2022. Vol. 14, № 8. 22. Green R., Datta Mitra A. Megaloblastic Anemias: Nutritional and Other Causes // Medical Clinics of North America. 2017. Vol. 101, № 2. 23. Долгов В.В., Луговская С.А., Морозова В.Т. П.М.Е. Лабораторная диагностика анемий. Москва, Триада. 2009; 147 с. n.d. 24. Buttarello M. Laboratory diagnosis of anemia: are the old and new red cell parameters useful in classification and treatment, how? // International Journal of Laboratory Hematology. 2016. 25. Hill A., Hill Q.A. Autoimmune hemolytic anemia // Hematology (United States). 2018. Vol. 2018, № 1. 26. Phillips J., Henderson A.C. Hemolytic anemia: Evaluation and differential diagnosis // Am Fam Physician. 2018. Vol. 98, № 6. 27. Batchelor E.K. et al. Iron deficiency in chronic kidney disease: Updates on pathophysiology, diagnosis, and treatment // Journal of the American Society of Nephrology. 2020. Vol. 31, № 3. 28. Fenaux P. et al. Myelodysplastic syndromes: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up // Annals of Oncology. 2021. Vol. 32, № 2. 29. Bohlius J. et al. Management of cancer-associated anemia with erythropoiesis-stimulating agents: ASCO/ASH clinical practice guideline update // Blood Advances. 2019. Vol. 3, № 8. 30. Li H.Y., Guo K. Blood Group Testing // Frontiers in Medicine. 2022. Vol. 9.31. Жибурт Е. Б., Танкаева Х. С., Шестаков Е. А. Новые рекомендации по переливанию эритроцитов: что учесть службе трансфузиологии // Справочник заведующего КДЛ. 2020. Vol. 3. P. 40–53. 32. Rühl H., Bein G., Sachs U.J.H. Transfusion-Associated Graft-Versus-Host Disease // Transfusion Medicine Reviews. 2009. Vol. 23, № 1. 33. Abdallah R., Rai H., Panch S.R. Transfusion Reactions and Adverse Events // Clinics in Laboratory Medicine. 2021. Vol. 41, № 4. 34. King K.E. et al. Universal leukoreduction decreases the incidence of febrile nonhemolytic transfusion reactions to RBCs // Transfusion. 2004. Vol. 44, № 1. 35. Dzik W.H. Leukoreduction of blood components // Current Opinion in Hematology. 2002. Vol. 9, № 6. 36. Dwyre D.M., Holland P. V. Transfusion-associated graft-versus-host disease // Vox Sanguinis. 2008. Vol. 95, № 2. 37. Павлов А.Д., Морщакова Е.Ф., Румянцев А.Г. Эритропоэз, эритропоэтин, железо. М.: ГЭОТАР-Медиа. 2011. 304 p. 38. Hedley B.D., Allan A.L., Xenocostas A. The role of erythropoietin and erythropoiesis-stimulating agents in tumor progression // Clinical Cancer Research. 2011. Vol. 17, № 20. 39. Bennett C.L. et al. Venous thromboembolism and mortality associated with recombinant erythropoietin and darbepoetin administration for the treatment of cancer-associated anemia // JAMA. 2008. Vol. 299, № 8. 40. Железодефицитная анемия. Клинические рекомендации, 2021. URL: cr.minzdrav.gov.ru/recommend/669. 41. Jaime-Pérez J.C. et al. Treatment of autoimmune hemolytic anemia: Real world data from a reference center in Mexico // Blood Res. 2019. Vol. 54, № 2. 42. Hill Q.A., Hill A., Berentsen S. Defining autoimmune hemolytic anemia: A systematic review of the terminology used for diagnosis and treatment // Blood Advances. 2019. Vol. 3, № 12.
Информация
Список сокращений
АЗН – анемия при злокачественных новообразованиях
ДЖ – дефицит железа
ЖКТ – желудочно-кишечный тракт
ЭСП – эритропоэзстимулирующие препараты (В03ХА: Другие антианемические препараты)
ФКС – фиброколоноскопия
ФЭГДС –фиброэзофагогастродуоденоскопия
ECOG - англ. The ECOG Scale of Performance Status - шкала оценки общего состояния пациента, разработанная Восточной Кооперативной Группой Исследования Рака
Hb – гемоглобин
Hct – гематокрит
MCV – средний объем эритроцита
MCH – среднее содержание гемоглобина в эритроците
MCHC – средняя концентрация гемоглобина в эритроците
CTCAE – Common Terminology Criteria for Adverse Events
** – жизненно необходимые и важнейшие лекарственные средства
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
Анемия при злокачественных новообразованиях (АЗН) – это снижение концентрации гемоглобина (Hb) и/или количества эритроцитов ниже нормальных значений, в том числе, обусловленное опухолевым процессом и/или его лечением.
Эритропоэзстимулирующие препараты (ЭСП, В03ХА: Другие антианемические препараты) – группа лекарственных средств, стимулирующих процесс образования эритроцитов в костном мозге, которые применяются для лечения анемий.
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Дополнительная информация отсутствует.
Критерии оценки качества медицинской помощи
| № |
Критерии качества
|
Оценка выполнения (да/нет) |
|---|---|---|
| 1. | Выполнен общий (клинический) анализ крови, развернутый с определением гематокрита, ретикулоцитов (при установлении диагноза, контрольных исследованиях) | Да/нет |
| 2. |
Выполнено определение уровня железа в сыворотке крови, исследование уровня ферритина в крови, исследование насыщения трансферрина железом при подозрении на дефицит железа (при установлении диагноза)
|
Да/нет |
| 3. |
Выполнено ультразвуковое исследование при подозрении на развитие внутреннего кровотечения (в зависимости от предполагаемой локализации источника кровотечения)
|
Да/нет |
| 4. |
Выполнено эндоскопическое исследование при подозрении на развитие внутреннего кровотечения (в зависимости от предполагаемой локализации источника кровотечения)
|
Да/нет |
| 5. |
Выполнено рентгенологическое исследование при подозрении на развитие внутреннего кровотечения (в зависимости от предполагаемой локализации источника кровотечения)
|
Да/нет |
| 6. |
Выполнена трансфузии эритроцитсодержащих компонентов крови при гемоглобине крови ниже 70 г/л
анемической гипоксии (при отсутствии противопоказаний)
|
Да/нет |
| 7. |
Выполнена терапии эритропоэзстимулирующими препаратов препаратами при гемоглобине крови ниже 100 г/л или клиническими признаками анемической гипоксии (при отсутствии противопоказаний)
|
Да/нет |
| 8. | Выполнена терапия препаратами железа при железодефицитной анемии | Да/нет |
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
- Орлова Рашида Вахидовна – д.м.н., профессор, заведующий кафедрой онкологии Медицинского факультета Санкт-Петербургского государственного университета, Главный специалист по клинической онкологии СПб ГБУЗ «Городской клинический онкологический диспансер»; член правления Российского общества клинической онкологии (RUSSCO); член Американского общества клинических онкологов (ASCO); член Европейского общества медицинских онкологов (ESMO).
- Гладков Олег Александрович – д.м.н., заслуженный врач РФ, директор ООО «Эвимед», г.Челябинск.
- Кутукова Светлана Игоревна – д.м.н., врач-онколог отделения противоопухолевой лекарственной терапии № 10 СПб ГБУЗ «Городской клинический онкологический диспансер», профессор кафедры стоматологии хирургической и челюстно-лицевой хирургии, доцент кафедры онкологии ФПО ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Министерства здравоохранения Российской Федерации, член Российского общества клинической онкологии (RUSSCO); член Американского общества клинических онкологов (ASCO), член стоматологической ассоциации России (СТАР), член стоматологической ассоциации Санкт-Петербурга (СТАСПб).
- Копп Михаил Валерьевич – д.м.н., профессор, Медицинский университет «Реавиз» член Российского общества клинической онкологии (RUSSCO); член Американского общества клинических онкологов (ASCO); член Европейского общества медицинских онкологов (ESMO).
- Королева Ирина Альбертовна – д.м.н. профессор, Медицинский университет «Реавиз», член Российского общества клинической онкологии (RUSSCO); член Американского общества клинических онкологов (ASCO); член Европейского общества медицинских онкологов (ESMO).
- Поддубная Ирина Владимировна – д.м.н., профессор, академик РАН, заведующий кафедрой онкологии и паллиативного лечения им. акад. А.И.Савицкого ФГБОУ ДПО «Российская Медицинская Академия непрерывного профессионального образования» МЗ РФ
- Пономарев Родион Викторович, к.м.н., руководитель сектора изучения неопухолевых заболеваний системы крови, врач-гематолог отделения гематологии и химиотерапии орфанных заболеваний ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России
- Аль-Ради Любовь Саттаровна – к.м.н., старший научный сотрудник клинико- диагностического отделения гематологии и химиотерапии с дневным стационаром ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России
- Моисеева Татьяна Николаевна – к.м.н., заведующая клинико-диагностического отделения гематологии и химиотерапии с дневным стационаром ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России
Конфликт интересов: отсутствует
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
- Врачи-онкологи 31.08.57
- Врачи-гематологи 31.08.29
- Врачи-терапевты 31.08.49
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
| УДД | Расшифровка |
|---|---|
| 1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа
|
| 2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры
исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа
|
| 3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
| 4 | Несравнительные исследования, описание клинического случая |
| 5 | Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД)для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
| УДД | Расшифровка |
|---|---|
| 1 | Систематический обзор РКИ с применением мета-анализа |
| 2 |
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа
|
| 3 | Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
| 4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль»
|
| 5 | Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
| УУР | Расшифровка |
|---|---|
| A | Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
| B | Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
| C | Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, при наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Таблица 1. Рекомендуемые дозы эритропоэзстимулирующих препаратов и принципы их коррекции у взрослых онкологических пациентов, получающих химиотерапию
| Параметры | Эпоэтин альфа**1 | Эпоэтин бета**1 |
Эпоэтин
тета1
|
Дарбэпоэтин
альфа**1
|
|---|---|---|---|---|
| Начальная доза |
150 МЕ / кг × 3 раза в нед.
#12 000 MЕ × 3 раза в нед [10]
40 000 МЕ ×
1 раз в нед. [10]
|
30 000 МЕ ×
1 раз в нед. [10]
|
20 000 МЕ ×
1 раз в нед. [10]
|
2,25 мкг / кг × 1 раз в нед.
#500 мкг × 1 раз в нед. [10]
|
|
Снижение дозы при достижении целевого уровня гемоглобина2
|
25–50 % дозы | |||
| Остановка в лечении |
При Нb > 130 г / л следует приостановить введение препарата до снижения Hb до уровня < 120 г / л
|
|||
| Отмена препарата | Окончание ХТ или отсутствие эффекта после 8 нед. лечения (сохраняется потребность в гемотрансфузиях) | |||
1 Все эритропоэтины вводятся п / к.
2 Достижение уровня Hb 120 г / л или увеличение уровня Hb более, чем на 20 г / л за 2 нед.
Таблица 2. Рекомендуемые режимы внутривенного введения препаратов железа
| Препарат | Способ введения и дозировка | Тест-доза |
|---|---|---|
| Железа [III] гидроксид сахарозный комплекс** 1 |
• Внутривенно струйно: 200 мг × 3 раза в нед. [10]
• Внутривенно капельно: 7 мг/кг, однократная доза — не более 500 мг железа; минимальное время введения — 3,5 часа [10]
|
Внутривенно медленно (в течение 1–2 мин.) 20 мг — для взрослых и детей весом более 14 кг, для детей весом менее 14 кг — 1,5 мг/кг; ожидание — 15 мин., при отсутствии нежелательных явлений возможно введение полной дозы с рекомендованной скоростью [10]
|
|
Железа
карбоксимальтозат** 1
|
• Внутривенно капельно 20 мг/кг в максимальной однократной дозе до 1000 мг железа; минимальное время введения — 15 мин. [10]
• Суммарная курсовая доза – в соответствии с определенной потребностью в железе
|
Нет |
| Железа [III] гидроксид декстран 1 | Зависит от точного типа декстрана, см. инструкцию по применению. Минимальное время инфузии 240–360 мин. (4–6ч.). |
Внутривенно медленно (в течение 1–2 мин.) 25 мг или 0,5 мл препарата; время ожидания — 15 мин., при отсутствии нежелательных явлений возможно введение полной дозы с рекомендованной скоростью
|
| Железа [III] гидроксид олигоизомальтозат** 1 |
• До 500 мг внутривенно струйно до
3 раз в неделю со скоростью до 250 мг железа/мин. [10]
• Препарат в дозах до 1000 мг вводят строго в течение более 15 мин.
• Препарат в дозах выше 1000 мг вводят
строго в течение более 30 мин.
|
Нет |
1 Препараты железа не должны вводиться в дни введения противоопухолевых препаратов.
Таблица 3. Рекомендуемые режимы введения витаминов
| Препарат | Способ введения и дозировка | Тест-доза |
|---|---|---|
| #Витамин В12**[4] |
Согласно инструкции, режим дозирования устанавливают индивидуально, в зависимости от показаний, клинической ситуации, возраста пациента и применяемой лекарственной формы.
1,0 мг, в/м 1-10 дни, затем ежемесячно
Или
1,0 мг в 1,3, 7,10, 14, 21 дни, далее ежемесячно
|
Нет |
|
#Фолиевая кислота**[4]
|
2 – 5 мг / сут. внутрь | Нет |
Приложение Б. Алгоритмы действий врача
Схема 1. Рекомендуемый алгоритм обследования пациента с анемией при злокачественном новообразовании.
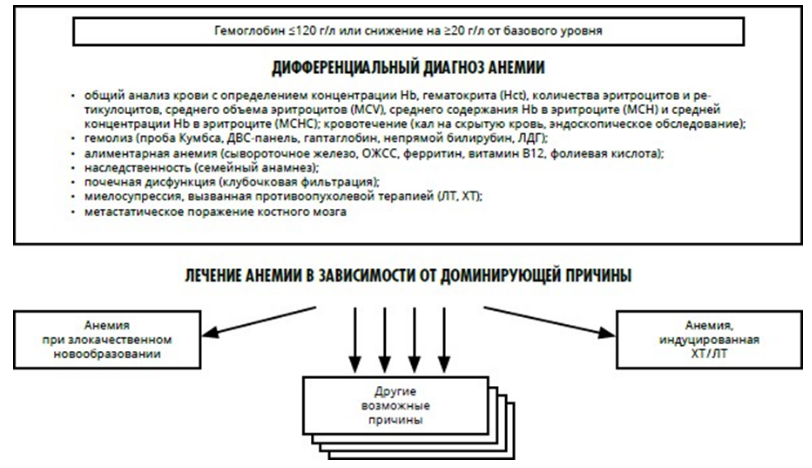

Схема 2. Рекомендуемый алгоритм лечения анемии у пациентов со злокачественными новообразованиями.
Приложение В. Информация для пациента
Анемия является частым симптомом самих злокачественных новообразований, а также частым осложнением противоопухолевого лечения (лекарственной и лучевой терапии). Основная причина анемии при злокачественных новообразованиях – угнетение процессов роста и созревания эритроцитов в костном мозге пациента, но также анемия может быть следствием других причин (кровопотеря, разрушение эритроцитов и др).
Анемия негативно влияет на качество жизни пациента и на эффективность противоопухолевого лечения (за счет невозможности проведения циклов лекарственной и лучевой терапии в оптимальных дозах и в оптимальные сроки – при развитии анемии появляется необходимость уменьшать рассчитанную дозу лекарственного препарата и увеличивать длительность периода между циклами лекарственной и лучевой терапии).
Среди основных симптомов анемии следует выделить бледность кожных покровов и слизистых оболочек, учащенное сердцебиение, одышка при незначительных физических нагрузках и в покое, головокружение, ощущение шума в ушах, чувство слабости, повышенная утомляемость, усиливающиеся при физической̆ нагрузке.
Основным клинико-лабораторным тестом для выявления анемии является клинический анализ крови, в котором оценивают уровень гемоглобина крови и гематокрит.
Коррекция анемии при злокачественном новообразовании может осуществляться путем заместительных гемотрансфузий – переливания эритроцитсодержащих компонентов крови, либо путем применения лекарственных средств: эритропоэзстимулирующих препаратов, препаратов железа и др. Выбор оптимальной тактики лечения определяет лечащий врач.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала EGOG/ВОЗ для оценки общего состояния пациента
Название на русском языке: шкала оценки общего состояния пациента, разработанная Восточной Кооперативной Группой Исследования Рака.
Оригинальное название (если есть): The ECOG Scale of Performance Status.
Источник: Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, Carbone PP: Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982, 5(6):649-655.
Тип: шкала оценки.
Назначение: оценка общего состояния пациента.
| Оценка | Описание |
|---|---|
| 0 | Пациент полностью активен, способен выполнять все, как и до заболевания |
| 1 | Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу) |
| 2 | Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно - в вертикальном положении |
| 3 | Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования |
| 4 | Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели |
| 5 | Смерть |
Пояснения: отсутствуют.
Приложение Г2. Шкала Common Terminology Criteria for Adverse Events (CTCAE) v 5.0
Название на русском языке: шкала токсичности по критериям CTCAE
Оригинальное название (если есть): Common Terminology Criteria for Adverse Events (CTCAE) v 5.0
Источник: Common Terminology Criteria for Adverse Events (CTCAE) v 5.0 Publish Date: November 27, 2017 (http://ctep.cancer.gov).
Тип: шкала оценки.
Назначение: оценка тяжести нежелательного явления
|
Степень тяжести
(grade)
|
Уровень Hb (г / л) | Комментарии |
|---|---|---|
| 1 | <100 г/л | - |
| 2 | 80–100 г/л | - |
| 3 | <80 г/л | Показана гемотрансфузия |
| 4 | Жизнеугрожающее состояние, необходимо срочное медицинское вмешательство | - |
| 5 | Смерть |
- |
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.