Анемии при злокачественных новообразованиях у детей
 Версия: Клинические рекомендации РФ 2025 (Россия)
Версия: Клинические рекомендации РФ 2025 (Россия)
Общая информация
Краткое описание
Российское общество детских онкологов и гематологов
Одобрено Научно-практическим Советом Минздрава России
Клинические рекомендации
Анемии при злокачественных новообразованиях
Пересмотр не позднее: 2027
Возрастная категория: Дети
Определение заболевания или состояния (группы заболеваний или состояний)
Анемия при злокачественных новообразованиях представляет собой один из вариантов анемии хронических заболеваний (АХЗ). В основе ее развития лежит многофакторный процесс, запускаемый взаимодействием между популяцией опухолевых клеток и иммунной системой с образованием ряда цитокинов, ответственных за относительную недостаточность эритропоэза [1].
Последствия анемии могут включать нарушение ответа на лечение онкологических заболеваний и снижение общей выживаемости (ОВ), даже если прямая причинно-следственная связь не установлена [61,62], а также снижение качества жизни пациентов вследствие различной степени нарушения толерантности к нагрузке и связанных с анемией симптомов.
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
D63.0 – Анемия при новообразованиях
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
По степени тяжести анемии, согласно критериям ВОЗ, выделяют [66]:
-
легкая - концентрация Hb выше 90 г/л;
-
средняя - концентрация Hb в пределах 90-70 г/л;
-
тяжелая - концентрация Hb менее 70 г/л.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Патогенез анемии у детей со злокачественными новообразованиями (ЗНО) достаточно сложен и связан как с прямыми, так и с опосредованными эффектами опухолевого процесса на организм. К ним относятся: кровотечения, инфильтрация костного мозга (КМ) опухолевыми клетками, миелотоксические эффекты химиотерапии (ХТ), избыточная продукция провоспалительных цитокинов и связанные с ними нарушения метаболизма железа и эритропоэза. Совокупность указанных патофизиологических реакций, выраженных в той или иной мере, приводит к нарушению процессов пролиферации, дифференцировки и созревания костномозговых эритроидных коммитированных предшественников [2].
В патогенезе анемии злокачественных новообразований (АЗН) можно выделить три основных аспекта: анемия, как проявление паранеопластического процесса; анемия, индуцированная ХТ; анемия, вызванная другими причинами [3].
Паранеопластический процесс характеризуется повышенной продукцией ряда провоспалительных цитокинов, таких как фактор некроза опухоли альфа (TNF-α), интерлeйкины (IL-1, IL-6), интерфероны (IFN-ɣ), которые ответственны за развитие анемии на фоне злокачественного опухолевого процесса [4]. Характерными патофизиологическими чертами АЗН являются:
-
укорочение продолжительности жизни эритроцитов, связанное с опосредованным действием TNF-α и IL-1 [2,5];
-
нарушение метаболизма железа вследствие повышенной продукции гепцидина, который уменьшает всасывание железа в желудочно-кишечном тракте и нарушает его реутилизацию из клеток моноцитарно-макрофагальной системы [5-6];
-
супрессия эритроидных предшественников, вызванная действием IL-1, TNF-α, IFN-ɣ [5,7];
-
снижение продукции эритропоэтина (ЭПО) в почках из-за прямого ингибирующего действия TNF-α и IL-1 [6-7].
Результаты проведенных исследований постулируют дефектный эритропоэз, как главную причину анемии у пациентов с онкологическими заболеваниями [8-9]. У детей с острыми лейкозами результаты исследований демонстрируют сохраненную адекватную продукцию ЭПО степени тяжести анемии [10-14].
Большинство режимов ХТ подавляют пролиферацию клеток предшественников гемопоэза в КМ. Ряд цитостатических препаратов (АТХ Противоопухолевые препараты (L01): цисплатин**, карбоплатин**) непосредственно и избирательно подавляют продукцию ЭПО в почках, снижая чувствительность перитубулярных фибробластов к гипоксии. Некоторые противоопухолевые препараты, блокирующие синтез рибонуклеиновой кислоты (РНК) (АТХ антрациклины и родственные соединения (L01DB), циклофосфамид**, ифосфамид**) или секрецию белка (винкристин**), вызывают угнетение синтеза ЭПО [15-19].
Другими причинами развития анемии у пациентов со ЗНО могут быть:
-
кровотечения (экзогенные кровотечения, внутриопухолевые кровоизлияния);
-
гемолиз (аутоимунный, микроангиопатический);
-
вытеснение нормальных ростков кроветворения в КМ опухолевыми клетками при гемобластозах или метастазах солидных опухолей;
-
дефицит железа, фолатов, витамина В12;
-
нарушение функции почек;
-
интеркуррентные заболевания [20].
Таким образом, патогенез анемии у пациентов со злокачественными новообразованиями достаточно сложен и связан как с прямыми, так и с опосредованными эффектами опухолевого процесса на организм, а также с возможным в ряде случаев угнетающим действием противоопухолевого лечения на клетки эритроидного ростка кроветворения [63].
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Анемия является одной из самых частых проблем во время лечения детей со ЗНО и часто присутствует уже при постановке диагноза. Анемия и дефицит железа (ДЖ) - частые осложнения у пациентов с злокачественными новообразованиями, особенно, получающих противоопухолевые препараты) [64]. Согласно результатам European Cancer Anemia Survey (ECAS), у 15000 проанализированных пациентов со злокачественными новообразованиями на этапе постановки диагноза частота регистрации анемии составила 39,3%, а проведение специализированной терапии увеличило частоту регистрации анемии у этих пациентов до 67,0% [65].
Проведенный в Европе анализ, охвативший 18 крупных детских онкологических центров и включивший данные о 25093 пациентах, показал, что среди детей со ЗН независимо от типа опухоли анемичными являются более 80%, тогда как у детей с острым лейкозом анемия регистрируется в 97% случаев. На фоне интенсивной противоопухолевой терапии распространенность анемии в данной группе пациентов значительно возрастает, при этом тяжесть анемии и соответственно потребность в заместительной гемотрансфузионной терапии увеличиваются с повышением интенсивности ХТ [21]. Таким образом, анемия является одним из типичных проявлений злокачественного неопластического процесса у детей и частым осложнением проводимого им химиотерапевтического лечения.
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Клинические проявления при АЗН обычно неспецифические и зависят от тяжести анемии. Анемический синдром различной степени выраженности (слабость, снижение толерантности к физической нагрузке, тахикардия, одышка, головокружение и/или головная боль). Часто анемия связана с повышенной утомляемостью, нарушением физических функций и снижением качества жизни [67-69].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу (по критериям шкал оценки уровня достоверности доказательств и уровня убедительности рекомендаций) по причине отсутствия посвященных им клинических исследований. Несмотря на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Диагноз анемии при ЗНО может быть заподозрен на основании анамнестических данных, результатов физикального обследования; устанавливается на основании результатов лабораторных исследований.
Основным диагностическим критерием анемии является стойкое снижение концентрации гемоглобина менее 120 г/л у лиц женского пола и менее 130 г/л у лиц мужского пола [85].
1. Жалобы и анамнез
-
Рекомендуется всем пациентам с подозрением на АЗН подробный опрос жалоб, сбор анамнеза заболевания ля оценки состояния пациента, а также для выявления возможных альтернативных причин анемии [63].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: при сборе у пациента жалоб выясняют наличие у него следующих симптомов: сердцебиение, одышка, усиливающиеся при физической нагрузке; головокружение, шум в ушах; слабость, повышенная утомляемость. При сборе у пациента анамнеза выясняют наличие возможных других причин анемии: кровотечения (острые и хронические); гемолиз (аутоиммунный, микроангиопатический); интеркуррентные заболевания (инфекционно-воспалительные, болезни почек); дефицит железа, фолатов, витамина В12 (алиментарный фактор, нарушенная абсорбция, проводимая специфическая терапия).
2. Физикальное обследование
-
Рекомендуется всем пациентам с подозрением на АЗН и всем пациентам с установленным диагнозом АЗН на каждом врачебном приеме провести визуальное исследование, общий физикальный осмотр, пальпацию (периферических лимфатических узлов, мезентериальных лимфатических узлов, селезенки), перкуссию (селезенки, внутригрудных лимфатических узлов, вилочковой железы) при заболеваниях органов кроветворения и крови с целью оценки тяжести состояния и выявления признаков основного заболевания [63].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: общий физикальный осмотр подразумевает оценку общего состояния пациента по шкале оценки общего состояния пациента, разработанная Восточной Кооперативной Группой Исследования Рака – ECOG (Приложение Г1), наличие симптомов гипоксии, степень компенсации анемического синдрома. Общий осмотр подразумевает оценку общего физического состояния, симптомов гемической гипоксии, возможных признаков декомпенсации анемического синдрома. При физикальном обследовании обращают внимание на выявлении следующих признаков: бледность кожных покровов, видимых слизистых (желтушность кожи и слизистых при гемолизе); тахикардия, тахипноэ; приглушенность сердечных тонов, систолический шум на верхушке сердца и над крупными сосудами; вялость.
Следует отметить, что большинство жалоб и симптомов являются неспецифическими признаками анемии, которые накладываются на симптомы основного заболевания, опухолевой интоксикации и побочные эффекты проводимой ХТ.
Кроме того, следует иметь в виду, что дети могут быть более толерантными к анемии, чем взрослые. Это обусловлено отчасти большим сердечно-легочным резервом и отсутствием коронарных заболеваний, а также сравнительно быстрой компенсацией потери кислородтранспортной способности (смещение кислородтранспортной кривой вправо и снижение сродства гемоглобина к кислороду). Таким образом, компенсаторные механизмы хронической анемии у детей обеспечивают толерантность к очень низким концентрациям Hb при наличии небольшого количества симптомов или вообще при их отсутствии, особенно если анемия развивается медленно в течение недель или месяцев.
Однако, многие факторы могут провоцировать декомпенсацию у ребенка с анемией и приводить к гипоксии тканей и органов, которая угрожает жизни.
Причины декомпенсации хронической анемии: повышенная потребность в кислороде вследствие инфекции, боли, лихорадки; дальнейшее снижение снабжения тканей кислородом вследствие острой кровопотери, пневмонии.
Ранние признаки декомпенсации: затрудненное, быстрое дыхание с межреберным, подреберным и надгрудинным втяжением (респираторный дистресс); усиленное использование мышц живота для дыхания; раздувание крыльев носа.
Признаки острой декомпенсации: форсированный ("стонущий") выдох (респираторный дистресс); изменение психического состояния; ослабление периферического пульса; застойная сердечная недостаточность; гепатомегалия; плохая периферическая перфузия (время повторного наполнения капилляров больше 2 сек.).
Ребенок с этими клиническими признаками срочно нуждается в терапии, так как имеется высокий риск смерти из-за недостаточной кислородтранспортной способности.
3. Лабораторные диагностические исследования
-
Рекомендуется всем пациентам с подозрением на АЗН и всем пациентам с установленным диагнозом АЗН проводить лабораторные и инструментальные исследований с целью выявления анемии, определения ее типа, уточнения степени тяжести анемии и выявления ведущих этиологических факторов [63]. Диагностику анемии и выявление ее причин необходимо проводить до проведения гемотрансфузии (если нет экстренных показаний) или назначения эритропоэзстимулирующих препаратов (ЭСП; В03ХА: Другие антианемические препараты) и препаратов железа [27,63].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
-
Рекомендуется всем пациентам с АЗН выполнение общего (клинического) анализа крови развернутого с исследованием уровня общего гемоглобина в крови, количества эритроцитов и ретикулоцитов, гематокрита (Hct), среднего объёма эритроцита (MCV), среднего содержания гемоглобина в эритроците (MCH), средней концентрации гемоглобина в эритроците (MCHC) [70].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: основным диагностическим критерием анемии является снижение концентрации Hb в крови менее 110 г/л. АЗН, как правило, носит гипорегенераторный, нормоцитарный, нормохромный характер [2,22].
-
Рекомендуется всем пациентам с АЗН проведение исследования показателей обмена железа (исследование уровня железа сыворотки крови, исследование уровня ферритина в крови, исследование уровня трансферрина сыворотки крови, исследование железосвязывающей способности сыворотки, исследование насыщения трансферрина железом), исследование уровня C-реактивного белка в сыворотке крови с целью определения вида анемии и дифференциальной диагностики с железодефицитной анемией [24,70-72].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: при обследовании детей со ЗН надо учитывать, что ДЖ может быть абсолютным (снижение СФ менее 100 мкг/л), и функциональным с нарушением мобилизации железа из макрофагов при сохраненном адекватном пуле хранения (снижение коэффициента НТЖ меньше 20%, СФ менее 100 мкг/л) [23]. Повышение концентрации СФ, как правило, выявляемое у детей с ЗН, обусловлено комплексом факторов, среди которых наиболее важное значение имеет выраженный воспалительный процесс, как проявление основного заболевания, инфекционные осложнения, которые часто отмечаются у детей с ЗН.
-
Пациентам, у которых по клиническим и лабораторным проявлениям можно заподозрить гемолитическую анемию, рекомендуется проведение тестов на гемолиз (исследование уровня общего билирубина в крови, исследование уровня свободного (неконъюгированного) и связанного билирубина в крови, определение активности лактатдегидрогеназы в крови; исследование уровня гаптоглобина крови [73-75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: некоторые ЗН могут сопровождаться гемолизом, поражением почек либо кровотечением. Общими лабораторными характеристиками гемолитических анемий является ретикулоцитоз (относительный и абсолютный), повышение концентрации билирубина за счет непрямой фракции, повышение концентрации ЛДГ, снижение концентрации гаптоглобина сыворотки. В костном мозге при гемолитических анемиях определяется расширение эритроидного ростка гемопоэза [74].
-
Рекомендуется всем пациентам с АЗН выполнение прямого антиглобулинового теста (прямой пробы Кумбса) и непрямого антиглобулинового теста (теста Кумбса) для выявления иммунного генеза гемолитической анемии [22,75].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: некоторые ЗН могут сопровождаться аутоиммунным гемолизом. В случае аутоиммунного гемолиза регистрируется положительная прямая проба Кумбса.
-
Пациентам, у которых по клиническим и лабораторным проявлениям можно заподозрить В12-дефицитную или фолиеводефицитную анемию, рекомендуется определение уровня витамина В12 (цианокобаламина) в крови и исследование уровня фолиевой кислоты в сыворотке крови [63,76,77].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: В12 и фолиеводефицитная анемии характеризуются макроцитозом и гиперхромией эритроцитов, нормальным или сниженным количеством ретикулоцитов, картиной мегалобластного эритропоэза в костном мозге, снижением количества тромбоцитов и лейкоцитов (вплоть до глубокой панцитопении), гиперсегментацией ядер нейтрофилов, а также лабораторными признаками гемолиза. Для В12-дефицитной анемии характерно поражение нервной системы [78,79].
-
Пациентам, у которых по клиническим и лабораторным проявлениям можно заподозрить скрытое желудочно-кишечное кровотечение, рекомендуется исследование кала на скрытую кровь [70].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: при кровотечении из верхних отделов (пищевода, желудка и двенадцатиперстной кишки) могут отмечаться следующие его признаки: рвота свежей кровью или «кофейной гущей»; мелена — стул чёрного оттенка дегтеобразной консистенции с резким зловонным запахом. При кровотечении в нижних отделах желудочно-кишечного тракта: примеси ярко-красной крови в кале; кровянистые выделения из заднего прохода; стул по типу «малинового» желе; мелена. Общими признаками, связанными с кровопотерей, служат следующие: нарастающая слабость; головокружение, шум в ушах, появление мелькающих «мушек» перед глазами, дезориентация и обморочные состояния; олигурия — уменьшение объёма выделяемой мочи; жажда. При незначительной степени кровотечения симптомы могут отсутствовать совсем. Иногда пациента беспокоят небольшая слабость, головокружение, ухудшение общего самочувствия, а также признаки основной патологии: боль в животе, диспепсия, изжога, тошнота, болезненность при дефекации и т. п. При сильном кровотечении, особенно из сосудов крупного диаметра, и тяжёлой кровопотере возможна потеря сознания и даже летальный исход.
-
Пациентам, у которых по клиническим и лабораторным проявлениям можно заподозрить миелодиспластический синдром или нарушение выработки эритропоэтина почками, рекомендуется исследование уровня эритропоэтина крови [73].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: миелодиспластический синдром - группа клональных заболеваний системы крови, характеризующаяся развитием цитопении, картиной дисплазии в костном мозге и высоким риском трансформации в острый лейкоз. Заподозрить миелодиспластический синдром позволяет наличие рефрактерной анемии (при исключении анемии других этиологий) в сочетании с тромбоцитопенией и/или лейкопенией. Для анемии при миелодисплатическом синдроме характерен нормо- (при отдельных формах – макроцитоз) эритроцитов, нормальное или сниженное количество ретикулоцитов. При исследовании параметров метаболизма железа регистрируется картина тканевой перегрузки: повышение концентрации ферритина >300 нг/мл, повышение НТЖ >45%, снижение концентрации сывороточного трансферрина и показателя ОЖСС [80].
4. Инструментальные диагностические исследования
-
Пациентам с установленным диагнозом ЖДА, протекающей на фоне злокачественного новообразования, рекомендуется проведение эндоскопических исследований верхних и нижних отделов желудочно-кишечного тракта (эзофагогастродуоденоскопия, колоноскопия) с целью исключения кровотечения и принятия мер по его остановке [63,70,86].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарий: диагностику анемии и выявление ее причин необходимо проводить до проведения гемотрансфузии (если нет экстренных показаний к гемотрансфузии) или назначения эритропоэзстимулирующих препаратов (ЭСП; В03ХА1 и В03ХА2) и препаратов железа.
5. Иные диагностические исследования
-
Пациентам с подозрением на анемию, вызванную нарушением костномозгового кроветворения, или метастазами в костный мозг, или иными причинами, отличными от основного злокачественного заболевания, рекомендуется исследование костного мозга [60].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: может выполняться аспирация костного мозга (Получение цитологического препарата костного мозга путем пункции) для цитологического исследования мазка костного мозга (миелограмма) и/или трепанобиопсия (Получение гистологического препарата костного мозга) для патолого-анатомического исследования биопсийного (операционного материала костного мозга) – по показаниям.
-
Всем пациентам с АЗН рекомендуется определения основных групп по системе АВ0 и определение антигена D системы Резус (резус-фактор) [83].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: проводятся определение основных групп по системе AB0, определение антигена D системы Резус (резус-фактор), определение фенотипа по антигенам C, c, E, e, Cw, K, k и определение антиэритроцитарных антител, иные исследования по показаниям.
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
-
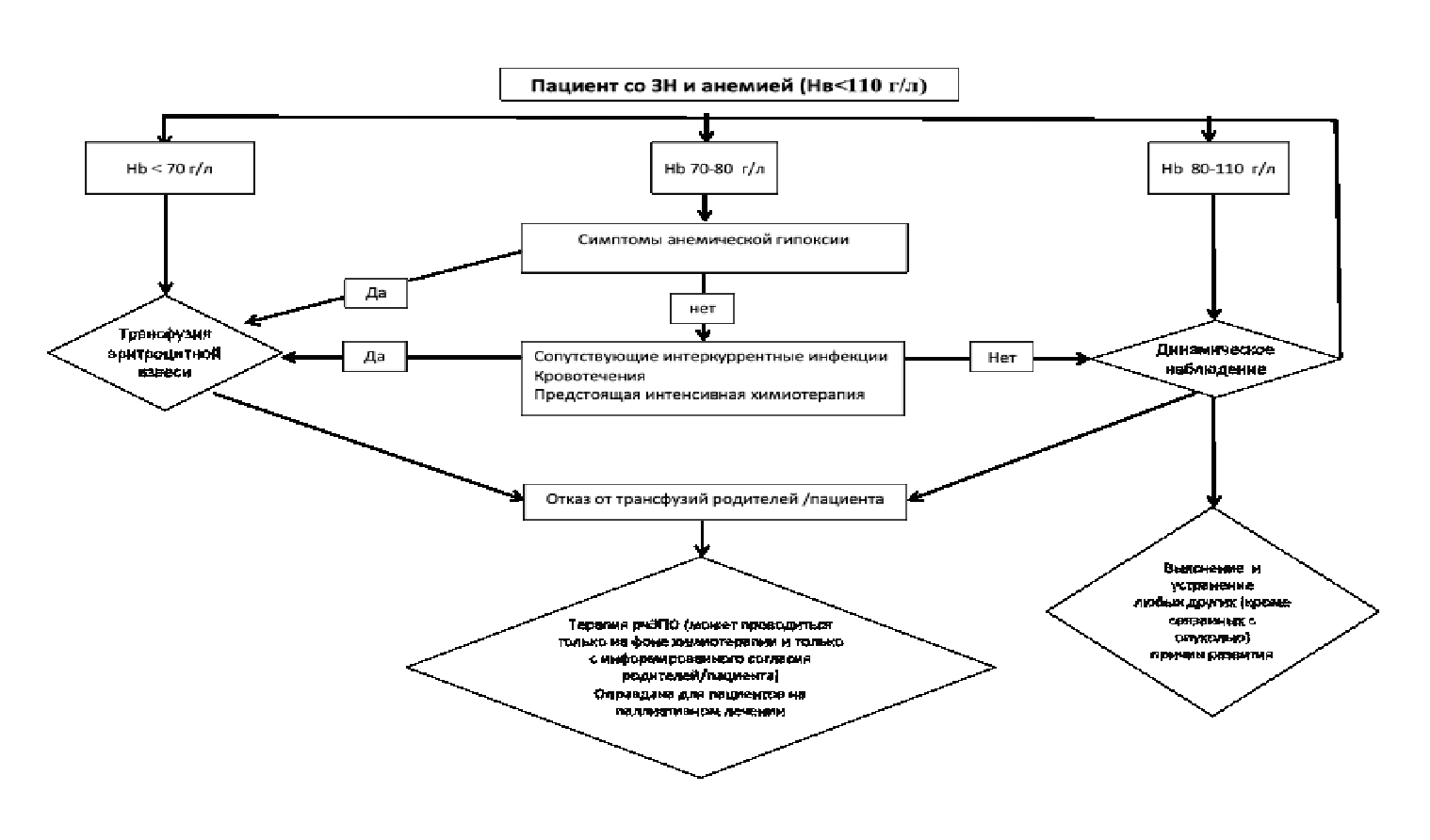
Пациентам с концентрацией гемоглобина ниже 70 г/л и/или с клиническими проявлениями анемической гипоксии (в том числе при более высоком содержании гемоглобина) рекомендовано проведение гемотрансфузии эритроцитсодержащих компонентов донорской крови (эритроцитная взвесь лейкоредуцированная, эритроцитная взвесь, полученная методом афереза, и др.) [24-28,60,63,81].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: гемотрансфузии назначаются исходя из клинических показаний, и содержание гемоглобина является одним из ориентиров. Так, трансфузии эритроцитсодержащих компонентов донорской крови могут быть показаны при более легкой степени анемии с содержанием гемоглобина 80 – 100 г/л, если предстоит обширное хирургическое пособие, если анемия приводит к гипоксическим симптомам и т.д.
Заместительные трансфузии эритроцитсодержащих компонентов донорской крови являются традиционным методом коррекции сниженного Hb и жизнеугрожающих ситуаций, связанных с острой кровопотерей (обширные операции). Однако для лечения анемии, связанной с опухолевым процессом (распад опухоли, интоксикация) и противоопухолевым лечением, гемотрансфузии не являются однозначно безопасным и эффективным методом. Так, гемотрансфузии могут сопровождаться гемолитическими реакциями, в том числе фатальными (частота – 1 : 1000), трансфузионными поражениями лёгких (частота – 1 : 5000), бактериальной контаминацией, в том числе фатальным сепсисом (частота – 1 : 10000), передачей вирусов гепатита В (частота – 1 : 30000), гепатита С и вируса иммунодефицита человека (частота – 1 : 1000000) [31,83]. Кроме того, многие потенциально опасные вирусные инфекции в настоящее время у доноров не тестируются. Наряду с вышесказанным, иммунодепрессия, вызванная гемотрансфузией, приводит к повышению риска тромбозов, инфекционных осложнений и снижением безрецидивной и общей выживаемости при ряде опухолевых заболеваний (колоректальный рак, рак мочевого пузыря) [33,82]. Повышение концентрации Hb после гемотрансфузий является кратковременным, и для поддержания его нормального значения их необходимо повторять. В связи с этим ВОЗ рекомендует максимально регламентировать заместительные гемотрансфузии у онкологических больных и использовать альтернативные методики коррекции Hb.
Гемотрансфузии при снижении концентрации Hb <70–80 г / л показаны только в случае острых постгеморрагических анемий при одномоментном снижении гематокрита до ≤ 25 %. При хронических анемиях главной задачей является устранение причины, вызвавшей анемию, и гемотрансфузии назначаются только для коррекции клинически значимых симптомов, обусловленных гипоксией вследствие снижения Hb и не поддающихся патогенетической терапии. Таким образом, концентрация Hb изолированно не может служить абсолютным критерием необходимости гемотрансфузий, поэтому решение всегда должно быть результатом клинического суждения лечащего врача, и основываться в первую очередь на объективных признаках гипоксии с учетом сопутствующих факторов риска (кровотечения, интеркуррентные инфекции, предстоящая химио/лучевая терапия и др.).
Трансфузии могут не потребоваться для хорошо компенсированных пациентов, восстанавливающихся после ХТ-индуцированной аплазии [24-27]. Однако, в случае предстоящей интенсивной ХТ трансфузии в отсутствии клинических проявлений оправданы [24,28-29].
Все педиатрические онкологические пациенты должны получать облученную, обедненную лейкоцитами эритроцитную взвеси [30]. Было показано, что лейкоредукция достоверно уменьшает риск фибрильных негемолитических трансфузионных реакций, а также передачу инфекционных патогенов, в частности, цитомегаловируса (ЦМВ) [31,32]. Облучение эритроцитной взвеси предотвращает развитие трансфузионно-ассоциированной реакции трансплантант-против-хозяина у иммунокомпромитированных пациентов [33,34].
Общим правилом для принятия решения о необходимости гемотрансфузии в педиатрической практике является ориентация, прежде всего, на клинические показатели, такие как:
-
клинические симптомы и функциональные показатели анемии (прежде всего скорость ее нарастания);
-
наличие или отсутствие сердечно-сосудистых и\или дыхательных симптомов, анемической гипоксии, нарушений со стороны ЦНС;
-
физическое состояние и активность ребенка;
-
отсутствие методов альтернативной терапии.
Концентрация Hb изолированно не может служить абсолютным критерием необходимости гемотрансфузий. Поэтому решение всегда должно быть результатом клинического суждения лечащего врача, и основываться в первую очередь на объективных признаках гипоксии, принимая во внимание сопутствующие факторы риска (кровотечения, интеркуррентные инфекции, предстоящая химио/лучевая терапия и др.) [28,35-36].
Обычная доза трансфузии эритроцитной взвеси составляет 10-15 мл/кг. Трансфузия детям эритроцитной взвеси в объеме 10 мл/кг повышает концентрацию гемоглобина в среднем на 10-20 г/л. В случае неадекватно низкого прироста концентрации гемоглобина должны быть приняты во внимание следующие условия:
-
скрытые кровотечения;
-
повторные заборы крови для лабораторных исследований;
-
лихорадка;
-
гиперспленизм;
-
первичные и вторичные иммунологические причины;
-
механический или другой тип гемолиза [28,37-38].
Недостатками гемотрансфузионной терапии являются непродолжительность достигнутого результата, риск развития ряда острых и отдаленных реакций и осложнений [28,30,39].
-
Пациентам с АЗН при наличии абсолютных или относительных противопоказаний к трансфузиям эритроцитсодержащих компонентов донорской крови рекомендовано проведение лекарственной терапии эритропоэзстимулирующими препаратами (ЭСП, В03ХА1 и В03ХА2) в монорежиме или в комбинации с препаратами железа [24,30,42-51,57-60,63].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 3)
Комментарии: данные рандомизированных исследований свидетельствуют об эффективности и безопасности терапии ЭСП у детей со ЗН [20,42-51]. Несмотря на данные этих исследований, рчЭПО не рекомендован для рутинного использования у детей с ЗН. Это связано в первую очередь с несостоятельностью научно обоснованной доказательной базы в отношении влияния терапии ЭСП на качество жизни и выживаемость детей с онкологическими заболеваниями, а также с возникшими противоречиями в вопросе влияния терапии ЭСП на выживаемость взрослых пациентов с ЗН. Результаты нескольких рандомизированных исследований показали более низкие показатели общей выживаемости среди взрослых пациентов со ЗН, получавших ЭСП, по сравнению с пациентами, получавшими плацебо. Хотя большинство из этих исследований имели методологические проблемы, их результаты послужили поводом для настороженного отношения к использованию ЭСП у онкологических пациентов [52,53]. Кроме того, ряд преклинических исследований свидетельствует о присутствии рецепторов к эритропоэтину (ЭПОр) на некоторых опухолевых клетках, посредством которых ЭСП потенциально могут влиять на процессы пролиферации и апоптоза экспрессирующих ЭПОр опухолевых клеток [54-56]. Большинство последних исследований свидетельствует, что экспрессия на злокачественных клетках рецепторов к ЭПО не приводит к стимулирующему опухолевый рост эффекту и не защищает их от лекарственного апоптоза. Опубликованные за последние несколько лет результаты больших контролируемых исследований, оценивавших влияние терапии ЭСП на показатели выживаемости взрослых пациентов, не поддерживают гипотезу об ЭСП-индуцированной опухолевой прогрессии и/или уменьшении выживаемости [57]. До настоящего времени нет достоверных данных о влиянии терапии ЭСП на выживаемость детей со ЗН. В единичных публикациях, оценивающих выживаемость небольших групп детей с ЗН, получающих терапию ЭСП, не выявлено их негативного влияния [20,58].
Применение рчЭПО у детей с ЗН до настоящего времени носит экспериментальный характер и должно проводиться в рамках крупных контролируемых рандомизированных исследований.
Однако, в отдельных случаях, при относительных противопоказаниях к трансфузиям эритроцитной взвеси (острая печеночная недостаточность, декомпенсация кровообращения, тяжелые расстройства мозгового кровообращения, тромбофилические/тромбоэмболические состояния), в случае редкой группы крови или аллоиммунизации, либо при отказе пациента/родителей от трансфузий по религиозным соображениям коррекция анемии может проводиться применением рчЭПО с препаратами железа. Кроме того, такая терапия оправдана для пациентов на паллиативном лечении. Терапия ЭСП может проводиться только на фоне химиотерапии и только с информированного согласия родителей/законных опекунов или самого пациента в случае достижения им возраста 16 лет [58,59].
Применение рчЭПО для профилактики анемии не проводится [57].
Перед началом ЭПО терапии следует установить и устранить любые другие (кроме связанных с опухолью) причины развития анемии.
РчЭПО терапию следует начинать при Hb < 100 (110) г/л в зависимости от симптомов анемии. МНН: Эпоэтин бета** вводится внутривенно в дозе 600 МЕ/кг один раз в неделю. Допустимо подкожное введение препаратов МНН: Эпоэтин бета** при отсутствии венозных катетеров. В качестве стартовой разовой используется доза 600 МЕ/кг. При отсутствии полного терапевтического ответа через 4 недели применения МНН: Эпоэтин бета** , определяемого как повышение уровня гемоглобина на 20 г/л от исходного при отсутствии трансфузий эритроцитной массы, разовая доза препарата увеличивается на 100 МЕ/кг. Последующее увеличение дозы МНН: Эпоэтин бета** предусматривается каждые 2 недели на 100 МЕ/кг при условии недостаточной скорости прироста уровня гемоглобина (< 5 г/л в неделю), максимально 900 МЕ/кг. Если доза 900 МЕ/кг не дает эффекта, дальнейшая терапия МНН: Эпоэтин бета** нецелесообразна.
При лечении АЗН не следует стремиться к значительному повышению концентрации гемоглобина (выше 110-120 г/л), даже несмотря на отсутствие данных о развитии тромбоэмболических осложнений у детей на фоне рчЭПО терапии. Наиболее важное значение при оценке эффективности проводимой рекомбинантным человеческим эритропоэтином терапии следует уделять не достижению целевого уровня гемоглобина, а поддержанию удовлетворительного качества жизни пациента. Для взрослых онкологических пациентов Американское общество клинических онкологов (ASCO) и Американское общество гематологов (ASH), а также Национальная всеобщая онкологическая сеть (NCCN) основными целями терапии ЭСП считают устранение симптомов анемии и предотвращение трансфузий [60,61].
Если Hb повышается чрезмерно быстро (более чем на 20 г/л в неделю) или если его концентрация ≥ 120 г/л, следует прекратить введение препарата. Введение препарата возобновляется при снижении Hb ˂ 100 (110) г/л в зависимости от симптомов анемии.
Противопоказания к применению ЭСП (В03ХА1, В03ХА2):
-
известная гиперчувствительность к ЭСП или их компонентам;
-
неконтролируемая АГ;
-
высокий риск тромбоэмболических осложнений (тромбоз в анамнезе, обширное хирургическое вмешательство, длительная иммобилизация или ограничение активности, лечение леналидомидом** в комбинации с доксорубицином** и глюкокортикоидами; данные о роли профилактического использования АТХ Антитромботических средств отсутствуют).
Учитывая развитие функционального дефицита железа (ФДЖ) у всех пациентов, получающих терапию ЭСП, универсальным правилом при проведении терапии ЭСП является назначение препаратов железа.
-
Пациентам с доказанным абсолютным дефицитом железа рекомендуется назначение лекарственных препаратов железа в соответствии с протоколами лечения ЖДА [13,19,40].
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 5)
Комментарии: у ряда пациентов на фоне интенсификации эритропоэза в результате терапии ЭСП (В03ХА1 или В03ХА2) развивается абсолютный дефицит железа, что обусловливает необходимость контроля параметров метаболизма железа у пациентов с АЗН как исходно, так и в динамике. Лабораторным критерием абсолютного дефицита железа служит снижение коэффициента НТЖ менее 20%, СФ менее 100 нг/мл.
Выбор предпочтительной лекарственной формы (пероральной или парентеральной) и дозы препарата железа зависит от ряда факторов: степени тяжести анемии, наличия сопутствующего воспаления (в частности, на фоне опухолевого процесса), наличия продолжающейся кровопотери, а также индивидуальной переносимости различных форм препаратов железа.
В случае анемии легкой или умеренной степени тяжести, при отсутствии продолжающегося кровотечения и нормальных показателях СРБ целесообразно проводить коррекцию железодефицита препаратами железа в лекарственной форме для перорального применения, в дозах для детей соответственно клиническим рекомендациям по лечению ЖДА – до регресса лабораторной картины ЖДА (ферритин 40-60 нг/мл при СРБ <5 нг/мл).
При тяжелой анемии, продолжающемся кровотечении (которое невозможно купировать хирургическими и/или консервативными методами), а также при повышении СРБ >5 нг/мл (на фоне опухолевого процесса) целесообразно проводить лечение парентеральными препаратами железа, используемыми у детей в дозах в соответствии с клиническими рекомендациями по лечению ЖДА (МНН железа карбоксимальтозат** или МНН: Железа [III] гидроксид сахарозный комплекс** или Железа [III] гидроксид декстран).
При наличии инфекционных осложнений применение как пероральных, так и внутривенных препаратов железа откладывается до купирования инфекционного процесса.
В связи с возможным взаимодействием железа и некоторых противоопухолевых препаратов (антрациклины и родственные соединения, препараты платины) необходимо воздерживаться от введения препаратов железа в дни введения противоопухолевых препаратов. Рекомендуемые дозы и режим парентерального введения препаратов железа представлены в табл. 2 (см. приложение А3).
-
Пациентам с развитием аутоиммунной гемолитической анемии на фоне ЗНО рекомендуется проведение терапии в соответствии с протоколами лечения аутоиммунных гемолитических анемий [41,42].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: в ряде случаев, развитие аутоиммунного гемолиза, например, при лимфопролиферативных заболеваниях, является показанием к проведению специфической химиотерапии.
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Специфических методов реабилитации и санаторно-курортного лечения для больных с АЗН не разработано. Реабилитация пациентов с АЗН должна проходить в соответствии с индивидуально разработанной программой реабилитационных мероприятий для каждого пациента с учетом иных осложнений онкологического заболевания. Подобная программа разрабатывается врачом физической и реабилитационной медицины, медицинским психологом при участии врача-онколога, врача-гематолога, врача-детского онколога-гематолога на основании Международной классификации функционирования, ограничений жизнедеятельности и здоровья. Кроме этого, программа реабилитации должна учитывать социальные и психологические проблемы пациента и включать (по показаниям) социальных работников и психологов.
Прогноз
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
На клиническом уровне связь между анемией и утомляемостью считается обоснованной. У взрослых доказано прямое влияние уровня Hb на утомляемость и другие параметры качества жизни. У детей, особенно младшего возраста, оценка качества жизни связана с техническими сложностями, так как требует заполнения анкетных опросников самими детьми и их родителями. По данным исследований качества жизни у детей со ЗНО, утомляемость так же идентифицирована детьми и подростками как один из самых тягостных симптомов, которые они испытывают [38]. Кроме того, дети разных возрастов по-разному интерпретируют ощущение утомляемости: так дети 7-12 лет подчеркивают физическую усталость, в то время как подростки 13-18 лет отмечают еще и умственное ощущение усталости [39]. Имеются единичные публикации, показавшие улучшение качества жизни детей с ЗНО, коррелирующее с повышением концентрации Hb на фоне терапии ЭСП.
Несмотря на это, утомляемость редко отмечается в жалобах пациентов и их родителей, что приводит к недооценке этого.
Госпитализация
Организация оказания медицинской помощи
Учитывая, что анемия является типичным осложнением как самого онкологического заболевания, так и проводимого химиотерапевтического лечения, то ее коррекция проводится в рамках лечения основного заболевания.
В случае проведения амбулаторного этапа химиотерапии показаниями к госпитализации будут служить выраженная анемия (Нв ≤ 70 г/л, Ht ≤ 25-30 %), либо наличие симптомов и признаков анемической гипоксии даже при более высоких показателях концентрации Hb.
Показания к выписке пациента из медицинской̆ организации:
1) разрешение анемии (повышение или нормализация уровня гемоглобина на фоне проводимого лечения);
2) разрешение симптомов анемической гипоксии.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Специфических профилактических мероприятий в отношении пациентов с анемией злокачественных новообразований не разработано. Для своевременного выявления АЗН необходим регулярный контроль клинического анализа крови в период терапии и диспансерное наблюдение по основному заболеванию (злокачественному новообразованию).
Информация
Источники и литература
-
Клинические рекомендации Российского общества детских онкологов и гематологов
- 1. Лунякова М.А., Демихов В.Г., Морщакова Е.Ф., Румянцев А.Г. Патогенез и возможности терапии анемии у детей с острым лимфобластным лейкозом. Вопросы гематологии, онкологии и иммунопатологии в педиатрии. 2013; 12(2): 5-16 2. Павлов А.Д., Морщакова Е.Ф., Румянцев А.Г. Эритропоэз, эритропоэтин, железо. М.:ГЭОТАР-Медиа, 2011: 304с 3. Безнощенко А.Г., Лунякова М.А., Морщакова Е.Ф., Павлов А.Д., Дронова С.Н., Кукушкина И.П. Эритропоэтин в лечение анемии у детей и подростков с острым лимфобластным лейкозом. Детская онкология. 2008; 3: 11-15 4. Dicato М. Anemia in cancer: some pathophysiological aspects. Oncologist. 2003; 8:19–21 5. Dicato М., Plawny L., Diederich M. Anemia in cancer. Ann Oncol. 2010; 21(7):167-172. 6. Pallalio G., Law E., Means R.T. Hepcidin inhibits in vitro erythroid colony formation at reduced erythropoietin concentrations. Blood. 2006; 99(7): 2702-2704 7. Wang W., Zhang M.H., Yu Y., et al. Influence of tumor necrosis factor-alpha and interferon-gamma on erythropoietin production and erythropoiesis in cancer patients with anemia. Zhonghua Xue Ye Xue Za Zhi. 2007; 28(10):681-684 8. Corazza F., Beguin Y., Bergmann P., et al. Anemia in children with cancer is associated with decreased erythropoietic activity and not with inadequate erythropoietin production. Blood. 1998; 92(5):1793-1798 9. Kim M.H., Lee J.H., Wu C.W., et al. Defective erythropoiesis in bone marrow is a mechanism of anemia in children with cancer. J Korean Med Sci. 2002; 17:337-340 10. Kivivuori S.M., Viinikka L., Teppo A.M., et al. Serum transferrin receptor and erythropoiesis in children with newly diagnosed acute lymphoblastic leukemia. Leuk Res. 1994; 18(11):823-828 11. Hellebostad M., Marstrander J, Sl?rdahl S.H., et al. Serum immunoreactive erythropoietin in children with acute leukaemia at various stages of disease and the effects of treatment. Eur J Haematol. 1990; 45(2):125 12. Dowd M.D., Morgan E.R., Langman C.B., et al. Serum erythropoietin levels in children with leukemia. Med Pediatr Oncol. 1997; 28(4):259-267 13. Corazza F.V. Physiopathologic aspects of anemia and thrombocytopenia in children with cancers: the roles of erythropoietin and thrombopoietin. Bull Mem Acad R Med Belg. 2008;163(1-2):152-156 14. Лунякова М.А., Безнощенко А.Г., Демихов В.Г. и соавт. Уровни сывороточного эритропоэтина при анемиях у детей с острым лимфобластным лейкозом до начала химиотерапии. Онкогематология 2008; 4: 54-55 15. Bhavnani M., Morris Jones P.H., Testa N.G. Children in long-term remission after treatment for acute lymphoblastic leukaemia show persisting haemopoietic injury in clonal and long-term cultures. Br J Haematol. 1989; 71: 37–41 16. Gardner R.V., Astle C.M., Harrison D.E. Hematopoietic precursor cell exhaustion is a cause of proliferative defect in primitive hematopoietic stem cells (PHSC) after chemotherapy. Exp Hematol. 1997; 25: 495–501 17. Yao M., Bouchet S., Harnois C., at al. Quantitative and qualitative alterations of long-term culture-initiating cells in patients with acute leukaemia in complete remission. Br J Haematol. 1998; 103: 124–128 18. Galotto M., Berisso G., Delfino L., at al. Stromal damage as consequence of high-dose chemo/radiotherapy in bone marrow transplant recipients. Ex P Hematol. 1999; 27 (9): 1460-1466 19. Verfaillie C.M., Catanzarro P.M., Li W.N. Macrophage inflammatory protein 1 alpha, interleukin 3 and diffusible marrow stromal factors maintain human hematopoietic stem cells for at least eight weeks in vitro. J Exp Med. 1994; 179: 643–649 20. Shankar A.G. The role of recombinant erythropoietin in childhood cancer. Oncologist. 2008; 13 (2): 157-166 21. Michon J. Incidence of anemia in pediatric cancer patients in Europe: results of a large, international survey. Med Pediatr Oncol. 2002; 39 (4): 448 - 450. 22. Ruggiero A., Attina G., Haber M., et al. Assessment of chemotherapy-induced anemia in children with cancer. Cent Eur J Med. 2008; 3(3): 341-345 23. Ludwig H., Evstatiev R., Kornek G., at al. Iron metabolism and iron supplementation in cancer patients. Wien Klin Wochenschr. 2015; 127: 907–919 24. Ruggiero A., Riccardi R. Interventions for anemia in pediatric cancer patients. Med Pediatr Oncol. 2002; 39 (4): 451-454 25. Marec-Berard P, Blay JY, Schell M. et al. Risk model predictive of severe anemia requiring RBC transfusion after chemotherapy in pediatric solid tumor patients. J Clin Oncol. 2003; 21: 4235–4238 26. Steiner ME, Zantek ND, Stanworth SJ, et al. Recommendations on RBC Transfusion Support in Children With Hematologic and Oncologic Diagnoses From the Pediatric Critical Care Transfusion and Anemia Expertise Initiative. Pediatr Crit Care Med. 2018;19(Suppl 1): S149-S156 27. Shah N, Andrews J, Goodnough LT. Transfusions for anemia in adult and pediatric patients with malignancies. Blood Reviews. 2015; 29(5): 291-299 28. Румянцев А.Г., Аграненко В.А. Гемотрансфузионная терапия в педиатрии и неонатологии. Руководство для врачей. М.: Макс Пресс, 2002. 644 с. 29. Ruccione K.S., Midambi K., Sposto R. et al. Association of projected transfusional iron burden with treatment intensity in childhood cancer survivors. Pediatr Blood Cancer. 2012; 59: 697–702 30. Feusner J. et al. Supportive Care in Pediatric Oncology: 27 A Practical Evidence-Based Approach. Pediatric Oncology. Springer Berlin Heidelberg; 2015. 31. King K.E., Shirey R.S., Thoman S.K. et al. Universal leukoreduction decreases the incidence of febrile nonhemolytic transfusion reactions to RBCs. Transfusion. 2004; 44: 25–29 32. Dzik W.H. Leukoreduction of blood components. Curr Opin Hematol. 2002; 9: 521–526 33. Ruhl H., Bein G., Sachs U.J. Transfusion-associate graft-versus-host disease. Transfus Med Rev. 2009; 23: 62–71 34. Dwyre D.M., Holland P.V. Transfusion-associated graft-versus-host disease. Vox Sang. 2008; 95: 85–93 35. Buchanan G.R. Blood transfusions in children with cancer and hematologic disorders: why, when, and how? Pediatr Blood Cancer. 2005; 44: 114–116 36. Wong E.C., Perez-Albuerne E., Moscow J.A. et al. Transfusion management strategies: a survey of practicing pediatric hematology/oncology specialists. Pediatr Blood Cancer. 2005; 44: 119–127 37. Blood Transfusion Guideline, 2011. http://www.sanquin.nl/repository/ documenten/en/prod-en-dienst/287294/blood-transfusion-guideline.pdf. 38. Национальный стандарт Российской Федерации. Кровь донорская и ее компоненты: Руководство по применению компонентов донорской крови. 2010. ГОСТ Р 53470-2009 39. Румянцев А.Г., Морщакова Е.Ф., Павлов А.Д. Эритропоэтин: биологические свойства, возрастная регуляция эритропоэза, клиническое применение. М.: ГЭОТАР-МЕД. 2003; 400 c. 40. Hockenberry-Eaton M., Hinds P.S. Fatigue in children and adolescents with cancer: evolution of a program of study. Semin Oncol Nurs. 2000; 16(4): 261 - 272 41. Hinds P.S., Hockenberry-Eaton M., Quargnenti A., et al. Fatigue in 7- to 12-year-old patients with cancer from the staff perspective: an exploratory study. Oncol Nurs Forum. 1999; 26(1): 37-45 42. Razzouk B.I., Hord J.D., Hockenberry M. et al. Double-blind, placebo-controlled study of quality of life, hematologic end points, and safety of weekly epoetin alfa in children with cancer receiving myelosuppressive chemotherapy. J Clin Oncol. 2006; 24(22): 358-359 43. Abdelrazik N., Fouda M. Once weekly recombinant human erythropoietin treatment for cancer-induced anemia in children with acute lymphoblastic leukemia receiving maintenance chemotherapy: a randomized case-controlled study. Haematology. 2007; 12(6): 533-541 44. Buyukpamukcu M., Varan A., Kutluk T. et al. Is epoetin alfa a treatment option for chemotherapy-related anemia in children? Med Pediatr Oncol. 2002; 39(4): 455-458 45. Wagner L.M., Billups C.A., Furman W.L., Rao B.N., et al. Combined use of erythropoietin and granulocyte colony-stimulating factor does not decrease blood transfusion requirements during induction therapy for high-risk neuroblastoma: a randomized controlled trial. J Clin Oncol. 2004; 22(10): 1886-1893 46. Hinds P.S., Hockenberry M., Feusner J., et al. Hemoglobin response and improvements in quality of life in anemic children with cancer receiving myelosuppressive chemotherapy. J Support Oncol. 2005; 3: 10-11 47. Zachariah M., Elshinawy M., Alrawas A., at al. Single Dose Darbepoetin Alfa is Useful in Reducing Red Cell Transfusions in Leukemic Children Receiving Chemotherapy. Pediatr. Hematol. Oncol. 2013; 31:5, 442-447 48. Durmaz O., Demirkaya M., Sevinir B. The Effect of Weekly Dosing on Anemia, Quality of Life, and Long-Term Outcomes in Pediatric Cancer Patients. Pediatr Hematol Oncol. 2011; 28(6): 461–468 49. Hiradfar A.A., Banihosseinian M. The Efficacy of Recombinant Human Erythropoietin in Treatment Chemotherapy Induced Anemia in Children Diagnosed with a Solid Cancer. Iran J Ped Hematol Oncol. 2014; 4(4): 151–159 50. Mорщакова Е.Ф., Безнощенко А.Г., Лунякова М.А., и др. Опыт применения эритропоэтина в детской онкологии и онкогематологии. Вопросы гематологии, онкологии и иммунопатологии в педиатрии. 2008; 7(2): 16-20
Информация
Список сокращений
АЗН – анемии при злокачественных новообразованиях
АХЗ – анемии хронических заболеваний
ДЖ – дефицит железа
ЖС – концентрация железа сыворотки
ЗНО – злокачественные новообразования
КМ – костный мозг
НТЖ – коэффициент насыщения трансферрина железом
ОЖСС – общая железосвязывающая способность сыворотки
РНК – рибонуклеиновая кислота
рчЭПО – рекомбинантный человеческий эритропоэтин
СФ – сывороточный ферритин
ФДЖ – функциональный дефицит железа
ХТ – химиотерапия
ЦНС – центральная нервная система
ЭПО – эритропоэтин
ЭПОр – рецепторы к эритропоэтину
ЭСП – эритропоэзстимулирующие препараты (АТХ: Антианемические препараты (B03) или (В03ХА): Другие антианемические препараты,)
IFN-ɣ – интерферон гамма
IL-1 – интерлeйкин 1
IL-6 – интерлeйкин 6
Hb – гемоглобин
Ht – гематокрит
TNF-α – фактор некроза опухоли альфа
Термины и определения
Анемия при злокачественных новообразованиях (АЗН) – это один из вариантов анемии хронических заболеваний, в основе развития которой лежит многофакторный процесс, запускаемый взаимодействием между популяцией опухолевых клеток и иммунной системой с образованием ряда цитокинов, ответственных за относительную недостаточность эритропоэза.
Эритропоэзстимулирующие препараты (ЭСП, В03ХА: Другие антианемические препараты) – группа лекарственных средств, стимулирующих процесс образования эритроцитов в костном мозге, которые применяются для лечения анемий.
Критерии оценки качества медицинской помощи
|
№ |
Критерии качества |
Оценка выполнения (да/нет) |
|---|---|---|
|
1 |
Выполнен общий (клинический) анализ крови, развернутый с определением гематокрита, ретикулоцитов (при установлении диагноза, контрольных исследованиях) |
Да / нет |
|
2 |
Выполнено определение уровня железа в сыворотке крови, исследование уровня ферритина в крови, исследование насыщения трансферрина железом при подозрении на дефицит железа (при установлении диагноза) |
Да / нет |
|
3 |
Выполнено ультразвуковое исследование при подозрении на развитие внутреннего кровотечения (в зависимости от предполагаемой локализации источника кровотечения) |
Да / нет |
|
4 |
Выполнено эндоскопическое исследование при подозрении на развитие внутреннего кровотечения (в зависимости от предполагаемой локализации источника кровотечения) |
Да / нет |
|
5 |
Проведена трансфузия эритроцитной взвеси при наличии показаний и отсутствии противопоказаний |
Да / нет |
|
6 |
Выполнено рентгенологическое исследование при подозрении на развитие внутреннего кровотечения (в зависимости от предполагаемой локализации источника кровотечения) |
Да / нет |
|
7 |
Проведена терапия АТХ: Антианемическими препаратами (B03) или (В03ХА): Другими антианемическими препаратами (эритропоэзстимулирующими препаратами) у детей со злокачественными новообразованиями при наличии абсолютных или относительных противопоказаний к гемотрансфузиям. |
Да / нет |
|
8 |
Проведена терапия препаратами железа при наличии абсолютного дефицита железа |
Да / нет |
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
-
Румянцев Александр Григорьевич – доктор медицинских наук, профессор, академик РАН, член Российского общества детских онкологов и гематологов; Президент ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России.
-
Сметанина Наталия Сергеевна – доктор медицинских наук, профессор, член Национального гематологического общества, член Российского общества детских онкологов и гематологов, член Европейского общества гематологов, член Международного общества «Биожелезо»; заместитель генерального директора – директор управления по планированию и стратегическому развитию службы детской онкологии и гематологии, заместитель директора Института гематологии, иммунологии и клеточных технологий ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России.
-
Варфоломеева Светлана Рафаэлевна – доктор медицинских наук, профессор, президент Российского общества детских онкологов и гематологов; директор НИИ детской онкологии и гематологии им. акад. Л.А. Дурнова ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, профессор кафедры детской онкологии ФГБОУ ДПО «РМАНПО» Минздрава России.
-
Лунякова Мария Анатольевна – кандидат медицинских наук, член Российского общества детских онкологов и гематологов; главный врач Научно-клинического центра гематологии, онкологии и иммунологии ГБОУ ВПО «Рязанский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России.
-
Трахтман Павел Евгеньевич – доктор медицинских наук, доцент, член Российского общества детских онкологов и гематологов, член Российской ассоциации трансфузиологов; заведующий отделением трансфузиологии, заготовки и процессинга гемопоэтических стволовых клеток ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России.
-
Шифрин Юрий Александрович – кандидат медицинских наук, член Российского общества детских онкологов и гематологов; младший научный сотрудник отдела молекулярной и клинической фармакологии, врач-клинический фармаколог ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России.
-
Абросимов Андрей Борисович – кандидат медицинских наук, заведующий отделением-врач гематолог отделения лечения и реабилитации пациентов иммуногематологического профиля и реципиентов стволовых клеток, старший научный сотрудник лаборатории фармакологии и оценки технологий здравоохранения ФГБУ «НМИЦ ДГОИ им. Дмитрия Рогачева» Минздрава России.
Конфликт интересов: Отсутствует.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
Врачи-гематологи
Врачи-детские онкологи
Врачи-педиатры
Врачи-детские онкологи-гематологи
Студенты медицинских ВУЗов, ординаторы, аспиранты
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД |
Расшифровка |
|---|---|
|
1 |
Систематический обзор РКИ с применением мета-анализа |
|
2 |
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
|
3 |
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
|
5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР |
Расшифровка |
|---|---|
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию – не реже чем один раз в три года, а также при появлении новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
Таблица 1. Рекомендуемые дозы эритропоэзстимулирующих препаратов и принципы их коррекции у взрослых онкологических пациентов, получающих химиотерапию
|
Параметры |
Эпоэтин альфа**1 |
Эпоэтин бета**1 |
Дарбэпоэтин альфа**1 |
|---|---|---|---|
|
Начальная доза |
150 МЕ / кг × 3 раза в нед. [44,63] #40 000 МЕ × 1 раз в нед. [63] |
450 МЕ/кг × 1 раз в нед. [87] |
2,25 мкг / кг × 1 раз в нед. #200 мкг × 1раз в 2 нед. [63] #300 мкг × 1раз в 3 нед. [63] #500 мкг × 1 раз в 3 нед. [63] |
|
Снижение дозы при достижении целевого уровня гемоглобина2 |
25–50% дозы
|
||
|
Остановка в лечении |
При Нb > 130 г / л следует приостановить введение препарата до снижения Hb до уровня < 120 г / л |
||
|
Отмена препарата |
Окончание ХТ или отсутствие эффекта после 8 нед. лечения (сохраняется потребность в гемотрансфузиях) |
||
1Все рчЭПО (АТХ Антианемические препараты (B03) или (В03ХА): Другие антианемические препараты) вводятся п / к.
2Достижение уровня Hb 120 г/л или увеличение уровня Hb более, чем на 20 г/л за 2 нед.
Таблица 2. Рекомендуемые режимы внутривенного введения препаратов железа
|
Препарат |
Способ введения и дозировка |
Тест-доза |
|---|---|---|
|
Железа [III] гидроксид сахарозный комплекс**1 |
|
Внутривенно медленно (в течение 1–2 мин.) 20 мг – для взрослых и детей массой тела более 14 кг, для детей массой тела менее 14 кг – 1,5 мг/кг; ожидание – 15 мин., при отсутствии нежелательных явлений возможно введение полной дозы с рекомендованной скоростью [63] |
|
Железа карбоксимальтозат**1 |
|
Нет |
|
Железа [III] гидроксид декстран1 |
Зависит от точного типа декстрана, см. инструкцию по применению. Минимальное время инфузии 240 – 360 мин. (4 – 6 ч). |
Внутривенно медленно (в течение 1–2 мин.) 25 мг или 0,5 мл препарата; время ожидания – 15 мин., при отсутствии нежелательных явлений возможно введение полной дозы с рекомендованной скоростью |
1Препараты железа не должны вводиться в дни введения противоопухолевых препаратов.
Приложение Б. Алгоритмы действий врача
Приложение В. Информация для пациента
Анемия часто сопровождает течение злокачественных новообразований у детей, являясь следствием угнетения образования эритроцитов в костном мозге под действием опухоли или проводимой химиотерапии.
Анемия является частым симптомом самих злокачественных новообразований, а также частым осложнением противоопухолевого лечения (лекарственной и лучевой терапии). Основная причина анемии при злокачественных новообразованиях – угнетение процессов роста и созревания эритроцитов в костном мозге пациента, но также анемия может быть следствием других причин (кровопотеря, разрушение эритроцитов и др).
Анемия негативно влияет на качество жизни пациента и на эффективность противоопухолевого лечения (за счет невозможности проведения циклов лекарственной и лучевой терапии в оптимальных дозах и в оптимальные сроки – при развитии анемии появляется необходимость уменьшать рассчитанную дозу лекарственного препарата и увеличивать длительность периода между циклами лекарственной и лучевой терапии).
Среди основных симптомов анемии следует выделить бледность кожных покровов и слизистых оболочек, учащенное сердцебиение, одышка при незначительных физических нагрузках и в покое, головокружение, ощущение шума в ушах, чувство слабости, повышенная утомляемость, усиливающиеся при физической̆ нагрузке.
Основным клинико-лабораторным тестом для выявления анемии является клинический анализ крови, в котором оценивают уровень гемоглобина крови и гематокрит.
Коррекция анемии при злокачественном новообразовании может осуществляться путем заместительных гемотрансфузий – переливания эритроцитсодержащих компонентов крови, либо путем применения лекарственных средств АТХ: Антианемические препараты (B03) или (В03ХА): Другие антианемические препараты (эритропоэзстимулирующих препаратов), препаратов железа и др. Выбор оптимальной тактики лечения определяет лечащий врач.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г1. Шкала EGOG/ВОЗ для оценки общего состояния пациента
Название на русском языке: Шкала оценки общего состояния пациента, разработанная Восточной Кооперативной Группой Исследования Рака.
Оригинальное название (если есть): The ECOG Scale of Performance Status.
Источник: Oken MM, Creech RH, Tormey DC, Horton J, Davis TE, McFadden ET, Carbone PP: Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982, 5(6):649-655.
Тип: шкала оценки.
Назначение: клиническая оценка общего состояния пациента.
Содержание (шаблон) и ключ (интерпретация):
|
Оценка |
Описание |
|---|---|
|
0 |
Пациент полностью активен, способен выполнять все, как и до заболевания |
|
1 |
Пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу) |
|
2 |
Пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу. Более 50 % времени бодрствования проводит активно - в вертикальном положении |
|
3 |
Пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели более 50 % времени бодрствования |
|
4 |
Инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели |
|
5 |
Смерть |
Пояснения: отсутствуют.
Приложение Г2. Шкала Common Terminology Criteria for Adverse Events (CTCAE) v 5.0
Название на русском языке: Шкала токсичности по критериям CTCAE.
Оригинальное название (если есть): Common Terminology Criteria for Adverse Events (CTCAE) v 5.0.
Источник: Common Terminology Criteria for Adverse Events (CTCAE) v 5.0 Publish Date: November 27, 2017 (http://ctep.cancer.gov).
Тип: шкала оценки.
Назначение: оценка тяжести нежелательного явления.
Содержание (шаблон) и ключ (интерпретация)
|
Степень тяжести (grade) |
Уровень Hb (г / л) |
Комментарии |
|---|---|---|
|
1 |
<100 г/л |
|
|
2 |
80–100 г/л |
|
|
3 |
<80 г/л |
Показана гемотрансфузия |
|
4 |
Жизнеугрожающее состояние, необходимо срочное медицинское вмешательство |
|
|
5 |
Смерть |
|
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.