Аневризмы грудной и торакоабдоминальной аорты
 Версия: Клинические рекомендации РФ 2025 (Россия)
Версия: Клинические рекомендации РФ 2025 (Россия)
Аневризма аорты неуточненной локализации без упоминания о разрыве (I71.9), Аневризма аорты неуточненной локализации разорванная (I71.8), Аневризма грудной и брюшной аорты без упоминания о разрыве (I71.6), Аневризма грудной и брюшной аорты разорванная (I71.5), Аневризма грудной части аорты без упоминания о разрыве (I71.2), Аневризма грудной части аорты разорванная (I71.1)
Ангиохирургия, Кардиология, Кардиохирургия
Общая информация
Краткое описание
Разработчик клинической рекомендации
Ассоциация сердечно-сосудистых хирургов России,
Общероссийская общественная организация «Российское кардиологическое общество»,
Российское общество ангиологов и сосудистых хирургов,
Общероссийская общественная организация "Российское общество хирургов",
Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению
Общероссийская общественная организация «Российское кардиологическое общество»,
Российское общество ангиологов и сосудистых хирургов,
Общероссийская общественная организация "Российское общество хирургов",
Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению
Одобрено Научно-практическим Советом Минздрава России
ID: 919_1
Клинические рекомендации
Аневризмы грудной и торакоабдоминальной аорты
Год утверждения (частота пересмотра): 2025
Пересмотр не позднее: 2027
ID: 919_1
Возрастная категория: Взрослые
Определение заболевания или состояния (группы заболеваний или состояний)
Истинная аневризма грудной (АГА) и/или торакоабдоминальной аорты (ТААА) определяется как патологическое необратимое расширение аорты более чем на 50% от нормального диаметра (5,0-5,5 см и более). Диаметр аорты зависит от пола, возраста, веса, роста. Нормальным считается диаметр аорты менее 4,0 см. Расширение аорты свыше данного значения, но не достигшего критериев аневризмы, называют пограничным расширением аорты. При этом термин «эктазия» аорты, которым зачастую пользуются радиологи для описания умеренного расширения аорты, не является корректным в данном случае [1]. В отличие от «истинной» аневризмы, «ложная» (псевдоаневризма) представляет собой отграниченное окружающими артерию тканями скопление крови, сформировавшееся вне артериального сосуда в результате разрыва его стенки.
Примеры оформления диагнозов:
Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Аневризма и расслоение аорты (I71):
I71.1 Аневризма грудной части аорты разорванная;
I71.2 Аневризма грудной аорты без упоминания о разрыве;
I71.5 Аневризма грудной и брюшной аорты разорванная;
I71.6 Аневризма грудной и брюшной аорты без упоминания о разрыве;
I71.8 Аневризма аорты неуточненной локализации разорванная
I71.9 Аневризма аорты неуточненной локализации без упоминания о разрыве
Примеры оформления диагнозов:
Основной: Аневризма корня и восходящего отдела аорты. Тяжелая АН
Осложнения: ХСНсФВ, 1 стадии. III ФК (NYHA).
Классификация
Классификация заболевания или состояния (группы заболеваний или состояний)
Классификация аневризм грудной аорты включает в себя следующие понятия:
● Аневризма корня аорты;
● Аневризма восходящей аорты;
● Аневризма дуги аорты;
● Аневризма нисходящей аорты;
● Торакоабдоминальная аневризма;
● Нередко встречаются комбинации зон расширения аорты, например аневризма корня, восходящей части и дуги аорты и т.п.
Среди истинных аневризм можно выделять веретеновидные и мешотчатые. Разными авторами предпринимались попытки классифицировать АГА по этиологическому признаку, однако, прежде всего, в связи с невозможностью выделения одного ведущего этиопатогенетического фактора, мы находим большинство подобных классификаций узконаправленными и имеющими ограниченное применение в научной и клинической практике. Одной из рациональных мы считаем систематизацию, предложенную исследователями Каролинского Института: предлагается аневризмы грудной аорты делить на моногенные (или синдромные, обусловленными генетическими нарушениями – синдромами Марфана, Элерса-Данло, Лойеса-Дитца и т.д.), ассоциированные с ДАК, и несиндромные несемейные, т.е. идиопатические [19]. На рисунке 1 представлен объединенный патогенетический подход, согласно которому аневризмы ВА предлагается делить на группы семейных и несемейных; в свою очередь, в каждой из данных групп выделяют подгруппы синдромных и несиндромных аневризм аорты, ассоциированных с мутациями различных генов, влияющих на структуру стенки аорты. ДАК может выступать в роли как (предположительно) самостоятельного этиологического фактора, так и являться «дополнительным состоянием». Таким образом, приблизительно около 75% пациентов с аневризмами ВА принадлежит к группе несиндромных несемейных, или спорадических аневризм, либо несиндромных несемейных аневризм ВА, ассоциированных с двустворчатым АК [20].
Аневризмы с вовлечением нисходящего отдела грудной и брюшной аорты обозначаются как ТААА. Классификация ТААА по Crawford, позже модифицированная Safi и соавторами [21] (Рисунок 2), не только описывает степень распространения аневризмы, но также позволяет прогнозировать заболеваемость и летальность при лечении аневризмы [22].
Кроме того, существует классификация воспалительных аневризм аорты Svensson L.G. и соавт., разработанная для пациентов с аортитами различной природы (болезнь Такаясу, гигантоклеточный аортит и др.) [23].
● Тип I – в зону расширения аорты полностью вовлечены грудной отдел, а также нисходящий или торакоабдоминальный отделы аорты;
● Тип II – в зону расширения аорты вовлечен восходящий отдел до уровня дуги аорты;
● Тип III – в зону расширения вовлечен торакоабдоминальный отдел аорты;
● Тип IV – аневризма субдиафрагмального отдела аорты.
Рисунок 1. Этиологическая классификация аневризм грудной аорты [20].
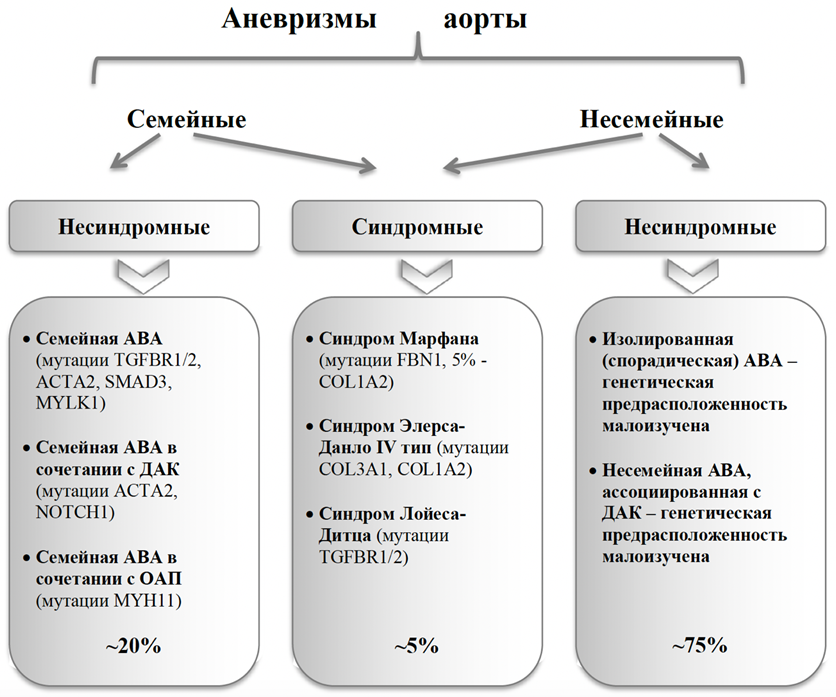
Примечания. АГА – аневризма грудной аорты; ДАК – двустворчатый аортальный клапан; ОАП – открытый артериальный проток; ACTA2 – ген-гладкомышечного актина; COL1A2 – ген коллагена типа 1-2; COL3A1 – ген коллагена типа 3-1; FBN1 – ген фибриллина-1; TGFBR1/2 – ген рецептора трансформирующего ростового фактора- 1/2 типа; MYH11 – ген белка тяжелых цепей миозина-11; MYLK1 – ген киназы легких цепей миозина; NOTCH1 – трансмембранный белок NOTCH1; SMAD3 – внутриклеточные белки семейства SMAD, передающие сигнал от лигандов (TGF) в ядро.
Рисунок 2. Классификация торакоабдоминальных аневризм аорты по Crawford
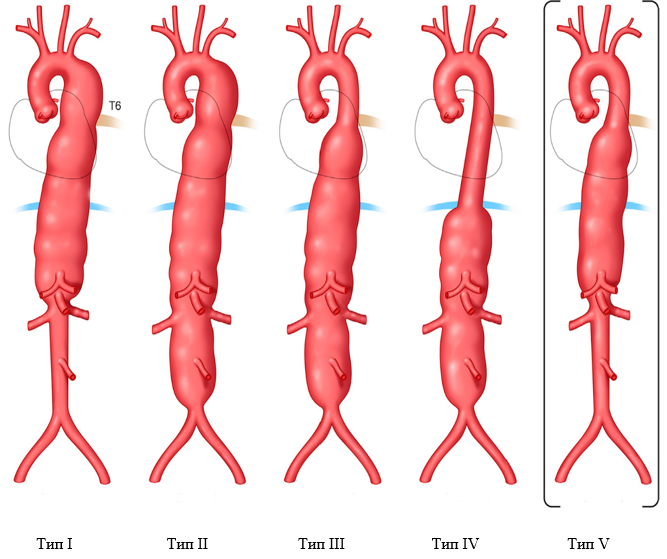
Классификация аневризм торакоабдоминального отдела аорты в соответствии со степенью поражения аорты, которая первоначально была предложена Crawford [24]: степень распространения I – от уровня ниже подключичной артерии до уровня выше чревного ствола или напротив верхней брыжеечной артерии, но выше почечных артерий; степень распространения II – от уровня ниже подключичной артерии, с поражением инфраренального отдела брюшной аорты, вплоть до уровня бифуркации аорты; степень распространения III – от уровня ниже межреберного промежутка Т6 до бифуркации аорты; степень распространения IV – от уровня ниже Т12, сужаясь к месту, аккурат выше бифуркации аорты. Safi и соавторы [21] предложили расширить классификацию добавлением степени распространения V – от уровня ниже Т6, сужаясь к месту, аккурат выше почечных артерий.
Этиология и патогенез
Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
Основными этиологическими факторами АГА и ТААА являются наследственные заболевания, врожденные аортопатии, мультифакториальные дегенеративные заболевания, воспалительные заболевания и инфекционные заболевания. Кроме того, аневризматическое расширение нередко является исходом расслоения грудной или торакоабдоминальной аорты, в том числе в отсутствие значимого расширения аорты как до, так и сразу после развития расслоения. Аневризмы корня и восходящей аорты (ВА) нередко носят наследственный характер и формируются в более молодом возрасте, в то время как аневризмы нисходящего отдела грудной аорты чаще имеют дегенеративную этиологию и характерны для пациентов среднего и пожилого возраста [2,3]. Кроме того, аневризмы корня аорты и ВА также нередко развиваются у пациентов с двустворчатым аортальным клапаном (ДАК), хотя остаются не полностью ясными генетические основы развития ДАК и развитие сопутствующей аортопатии далеко не у всех пациентов [4,5]. Большинство же аневризм корня и ВА относятся к группе несиндромных несемейных (спорадических) аортопатий. Поскольку тактика ведения пациентов с аневризмами корня и ВА может отличаться в зависимости от причины и дополнительных факторов риска осложнений, ассоциированных с аортой, рекомендации по консервативному, транскатетерному, хирургическому и гибридному лечению могут отличаться (см. раздел 3 «Лечение»).
Примерно в 20% случаев АГА и ТААА связаны с генетически обусловленной или наследственной патологией. При этом их также называют наследственными заболеваниями грудной аорты (НЗГА), и некоторые из них сопровождаются мультисистемными симптомами (в этом случае они считаются синдромными НЗГА), а некоторые – изолированной патологией аорты с возможным вовлечением ее ветвей (несиндромные НЗГА) [6]. При НЗГА чаще всего поражаются корень, ВА или оба этих сегмента, но также они могут проявляться поражением дистальной аорты или расслоением аорты. Патогенные варианты множества генов могут приводить к формированию АГА, аневризм артерий головного мозга и АБА [6,7]. Примерно у 20% лиц с АГА или расслоением аорты имеются указания на заболевание грудной аорты в семейном анамнезе (по меньшей мере 1 заболевший родственник первой степени родства). Популяционные исследования продемонстрировали семейный характер АГА и расслоений – в случаях семейной патологии отмечается значимое увеличение риска развития АГА и расслоений аорты по сравнению со спорадическими случаями. В связи с этим среди пациентов с аневризмами корня и ВА, чрезвычайно важен скрининг родственников первой линии родства при помощи методов лучевой диагностики с целью определения нераспознанных, бессимптомных заболеваний грудной аорты.
Хотя существует определенное анатомическое разграничение между АГА и ТААА, это не подразумевает сопоставимость их всех по этиологии или естественному течению. Аневризмы корня и ВА в типичных случаях выявляются у пациентов более молодого возраста по сравнению с аневризмами нисходящего отдела грудной и ТААА (60 лет и 72 года, соответственно) [2]. Даже при учете лишь «спорадических» аневризм (т.е. аневризм при отсутствии признаков синдромной, семейной или подтвержденной генетической этиологии) значимая разница в возрасте пациентов двух групп (64 и 72 года, соответственно) сохраняется [2]. Кроме того, типичные факторы риска атеросклероза (т.е. артериальная гипертензия, сахарный диабет, курение) значительно реже встречаются у пациентов со спорадическими аневризмами корня и ВА по сравнению с больными с аневризмами нисходящего отдела грудной аорты [8]. Также распространенность кальцификации аорты или атером достаточно мала при спорадических аневризмах корня и ВА, но весьма высока при аневризмах нисходящего отдела грудной аорты (8–9% и 80–88% соответственно). В совокупности эти сведения свидетельствуют о том, что аневризмы корня и ВА чаще носят врожденный (и даже наследственный) характер, в то время как аневризмы нисходящего отдела аорты в основном имеют атеросклеротический генез. Хотя иногда их называют атеросклеротическими аневризмами, гораздо чаще аневризмы нисходящего отдела грудной аорты (не обусловленные заболеваниями соединительной ткани) характеризуются как «дегенеративные». Медикаментозные, хирургические и эндоваскулярные методы лечения спорадических и дегенеративных аневризм обсуждаются в разделе 3 «Лечение».
В семьях, члены которых страдают НЗГА, и причинный ген не идентифицирован, ведение в целом здоровых членов семей базируется на клинических характеристиках, применяемых в отношении больных членов семьи. К таким характеристикам относятся локализация аневризмы, диаметры грудной аорты в разных отделах у больных членов семьи, перенесших расслоение аорты типа А по Stanford, а также патология иных сосудов и другие симптомы, накапливающиеся на фоне АГА в семье.
Эти данные свидетельствуют о том, что гетерозиготные патогенные варианты одиночных генов становятся причиной НЗГА в большинстве семей. В семьях с НЗГА следует проводить соответствующие анализы (исследования) у лиц с подтвержденным диагнозом заболевания грудной аорты. При наличии патологии в семейном анамнезе она проявляется в более молодом возрасте (в среднем в 57 лет) [9]. В таких семьях с НЗГА отмечается вариабельная экспрессия генов, ответственных за заболевания грудной аорты, что находит отражение в разном возрасте, начале заболевания, разной частоте расслоения аорты на фоне ее диаметра <5,0 см, разном риске расслоения аорты типа В по Stanford и разной частоте развития дилатации корня аорты, тубулярной восходящей части грудной аорты либо обоих отделов. Кроме того, конкретные патологически измененные гены влияют на риск развития сопутствующих сосудистых заболеваний.
Факторы риска заболевания или состояния (группы заболеваний или состояний)
Большинство случаев АГА относятся к группе несемейных несиндромных (спорадических) аортопатий, ассоциированных с двустворчатым либо трехстворчатым аортальным клапаном. Основными факторами риска патологического расширения ВА являются артериальная гипертензия (АГ), моногенные заболевания соединительной ткани (синдромы Марфана, Элерса-Данло, Тернера, Лойеса-Дитца), гигантоклеточный артериит, атеросклероз; относительно нечастой причиной расширения и расслоения грудной аорты является инфекция (включая сифилитическое и микотическое поражение), а также аутоиммунные процессы.
Факторами риска аневризм корня, ВА, дуги и ТААА, а также расслоений аорты являются патогенные варианты генов, предрасполагающих к заболеваниям грудной аорты [10]. Хотя рекомендации сосредоточены на лицах из группы высокого риска одиночной генной мутации (Таблица 1), генетическое тестирование может оказаться полезным у многих пациентов с заболеваниями грудной аорты. Лишь патогенные или вероятно патогенные варианты могут провоцировать развитие заболеваний, и именно их следует использовать для каскадных генетических тестов, назначаемых всем родственникам из группы риска наследования патологических вариантов.
Таблица 1.
Факторы риска семейных заболеваний грудной аорты
Факторы риска семейных заболеваний грудной аорты
| ● Заболевание грудной аорты и симптомы синдрома Марфана, синдрома Лойеса-Дитца или сосудистого типа синдрома Элерса-Данло |
|---|
| ● Дебют заболевания грудной аорты в возрасте младше 60 лет |
| ● Заболевание грудной аорты или аневризмы периферических или внутричерепных артерий в семейном анамнезе у родственников первой или второй степени родства |
| ● Внезапная смерть неясной этиологии в относительно молодом возрасте среди родственников первой или второй степени родства |
«Традиционные» факторы риска атеросклероза (мужской пол, гиперхолестеринемия, курение, сахарный диабет) реже встречаются при аневризмах корня и ВА, нежели при аневризмах нисходящей грудной аорты.
В настоящее время пристальное внимание уделяется планиметрическим параметрам грудной аорты, рассматривающимся в качестве перспективных факторов риска формирования аневризм и расслоений. К таким признакам относят, кроме максимального диаметра аорты, ее кривизну, степень удлинения, определенные врожденные аномалии («бычья дуга» и т.п.). Установлено, что удлинение нерасширенной тубулярной части ВА (от уровня СТС до устья БЦС) более 90 мм может являться фактором риска расслоения аорты типа А по Stanford [11], а удлинение дуги аорты более 50 мм с высокой долей вероятности предрасполагает к расслоению аорты типа B по Stanford [12,13]. Отхождение БЦС и ЛОСА единым стволом (так называемая “бычья дуга”) и коарктация аорты также ассоциированы с формированием аневризм и расслоений грудной аорты.
Эпидемиология
Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Встречаемость АГА за последние 2 десятилетия значительно возросла и к настоящему времени достигает 5-10 случаев на 100 тыс. населения в год. Данный прирост обусловлен, в основном, совершенствованием диагностики патологии аорты. Заболевание наиболее характерно для пациентов старшей возрастной группы (50-70 лет). Эта патология аорты выявляется у мужчин в 2-4 раза чаще, чем у женщин [13,14]. Выживаемость при естественном течении АГА составляет 20% за 5-летний период от момента установления диагноза. Таким образом, пациенты с АГА находятся в группе высокого риска, что подтверждается данными литературы: только 41% пациентов с АГА доживают до этапа стационарного лечения [15]. Важное значение для прогнозирования выживаемости имеет максимальный диаметр грудной аорты. Известно, что в течение жизни человека диаметр аорты постепенно увеличивается. Так, ежегодное увеличение аневризмы ВА составляет, в среднем, 1 мм, а для аневризмы нисходящей аорты этот показатель соответствует 3 мм. Большие аневризмы аорты склонны к более быстрому росту - позже поправлю, это взаимоисключающие предложения. Согласно данным Chau и соавт., при диаметре аорты 8,0 см скорость ее роста увеличивается в 2 раза и составляет 1,9 мм в год [16]. Анамнез нарушения мозгового кровообращения, курение, атеросклероз периферических артерий достоверно увеличивают скорость роста аневризмы аорты [17]. Установлено, что диаметр ВА в среднем больше у страдающих артериальной гипертензией. Из результатов исследования Kuzmik G.A. и соавт. следует, что риск разрыва аневризмы аорты или развития расслоения растет пропорционально её диаметру. Так, ежегодный риск осложнений со стороны грудной аорты у пациентов с диаметром последней 40-49 мм может достигать 2%, тогда как при диаметре грудной аорты более 6 см частота подобных осложнений, в том числе фатальных, возрастает в 3-4 раза [16,18].
Клиническая картина
Cимптомы, течение
Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Аневризма аорты во многих случаях никак себя не проявляет. Симптоматика может возникать при формировании большого аневризматического мешка, сдавливающего окружающие структуры: кашель, одышка, осиплость голоса (вследствие сдавления возвратного нерва), отек верхних конечностей (в результате сдавления верхней полой или брахиоцефальной вены), болезненное или нарушенное глотание (по причине сдавления пищевода) при больших аневризмах грудной аорты, постоянные или периодические боли или дискомфорт в грудной клетке, ощущение «пульсации» в груди [25].
Диагностика
Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
1. Жалобы и анамнез
- Рекомендуется выполнять сбор жалоб и анамнеза у всех пациентов с подозрением на АГА и ТААА для верификации диагноза [26].
ЕОК/РКО I C (УДД 4, УУР С)
Комментарии. Несмотря на то, что зачастую пациенты с аневризмой грудной аорты и незначительная часть больных с расслоением аорты не имеют клинических проявлений, с поражением аорты потенциально могут быть связаны следующие симптомы:
— острая резкая, ломящая или пульсирующая боль в груди или животе («ощущение разрыва»), с возможной миграцией в спину, шею, ягодицы, пах или ноги и наводить на мысль о расслоении аорты или другом ОАС;
— кашель, одышка или затрудненное / болезненное глотание, осиплость (из-за паралича левого гортанного нерва), дисфагия, гематемезис, отек верхних конечностей, кровохарканье при сдавлении аортой при ее аневризме или расслоении;
— инфаркт миокарда может быть одной из масок острого расслоения ВА;
— редкими проявлениями гигантских АВА являются сдавление различных отделов сердца, легочной артерии, а также правожелудочковая недостаточность
— инсульт, транзиторная ишемическая атака, параплегия или перемежающаяся хромота как результат ишемии головного или спинного мозга при расслоении аорты, или материальной эмболии при выраженном атеросклерозе аорты (например, при «shaggy aorta») [27].
Жалобы, обусловленные аортальной регургитацией (при хронической аортальной регургитации в стадии компенсации клинические проявления могут отсутствовать в течение продолжительного периода времени. При приближении и наступлении декомпенсации наступает постепенное снижение толерантности к физическим нагрузкам, появление одышки при нагрузках (вначале при высокоинтенсивных нагрузках), ощущение «сердцебиений» в груди и «пульсаций» в голове. Нередкими проявлениями хронической аортальной регургитации являются неприятные ощущения, дискомфорт и боли в области сердца и в грудной клетке. Периферические отеки, ортопноэ и отек легких могут наблюдаться как при хронической, так и при острой аортальной регургитации. Острая аортальная регургитация, как правило, характеризуется внезапным появлением выраженной одышки и/или удушья. Ишемия миокарда, нередко развивающаяся при острой аортальной регургитации, может проявляться болевым синдромом в грудной клетке [28,29]. Сведения об имеющейся аневризме и/или расслоении ВА позволяют заподозрить вторичный характер аортальной регургитации[28,30].
- Рекомендуется у пациентов с аневризмами корня и восходящего отдела грудной аорты или расслоением аорты собрать семейный анамнез (случаи заболеваний грудной аорты, двустворчатого аортального клапана, моногенных заболеваний соединительной ткани, внезапной смерти неясного генеза, аневризм периферических и внутричерепных артерий) на протяжении нескольких поколений [31].
ЕОК/РКО I C, АКК и ААC 1 В (УДД 4, УУР С)
Комментарии. Актуальные данные свидетельствуют о том, что у 13–20% пациентов с заболеванием грудной аорты без симптомов синдромов Марфана и Лойеса-Дитца обнаруживаются родственники первой степени родства со схожей патологией [31]. ЗГА в этих семьях обычно наследуются аутосомно-доминантным путем со снижением пенетрантности (особенно у женщин).
2. Физикальное обследование
- Рекомендуется выполнять физикальное обследование всех пациентов с подозрением на АГА и ТААА для установления диагноза [26].
ЕОК/РКО I C (УДД 4, УУР С)
Комментарии. Осмотр пациента с подозрением на аневризму аорты должен включать пальпацию и аускультацию грудной клетки и живота с целью выявления патологических артериальных пульсаций, шумов вследствие турбулентного кровотока, сравнение характеристик пульса и значений АД на руках.
3. Лабораторные диагностические исследования
Базовые лабораторные исследования включают выявление сердечно-сосудистых факторов риска и играют незначительную роль в диагностике заболеваний грудной аорты. Вместе с тем, существует ряд ситуаций, когда выполнение лабораторных исследований принципиально:
- Рекомендуется всем пациентам с АГА и ТААА, госпитализирующимся в стационар для оперативного лечения, исследование кислотно-щелочного состояния крови (рН, ВЕ, рСО2, РО2, Lac - анализ капиллярной/артериальной/венозной проб) с целью оценки тяжести гипоксемии и степени выраженности метаболических нарушений, выполнение коагулограммы (ориентировочного исследования системы гемостаза) (активированное частичное тромбопластиновое время (АЧТВ), определение протромбинового (тромбопластинового) времени в крови (ПТИ), определение концентрации Д-димера в крови, исследование уровня фибриногена в крови, определение активности антитромбина III в крови), определение международного нормализованного отношения (МНО) для прогноза риска периоперационных кровотечений. Определение основных групп по системе AB0, определение антигена D системы резус (резус-фактор), определение фенотипа по антигенам C, c, E, e, Cw, K, k и определение антиэритроцитарных антител, определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови, определение антител к бледной трепонеме (Treponema pallidum) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови для исключения ассоциации с ВИЧ-инфекцией, гепатитом, а также в случае оперативного лечения при необходимости в пери- и/или послеоперационном периоде [32,33].
ЕОК/РКО I C (УУР C, УДД 5)
- Рекомендуется проведение общего (клинического) анализа мочи, общего (клинического) анализа крови (с оценкой уровня гемоглобина и гематокрита, количества эритроцитов, лейкоцитов, тромбоцитов, скорости оседания эритроцитов) и анализа крови биохимического общетерапевтического (исследования уровня калия в крови, уровня натрия в крови, уровня глюкозы в крови, уровня креатинина в крови, исследование уровня общего белка в крови, уровня мочевины в крови, уровня общего билирубина в крови, определение активности аспартатаминотрансферазы и аланинаминотрансферазы в крови, исследование уровня общего трийодтиронина (Т3) в крови, уровня общего тироксина (Т4) сыворотки крови и уровня тиреотропного гормона (ТТГ) в крови, исследование уровня С-реактивного белка в сыворотке крови, уровня холестерина крови, уровня холестерина липопротеидов низкой плотности (ХсЛНП) и триглицеридов (ТГ),) для оценки почечной и печеночной функции, исключения воспаления и с целью выявления факторов риска сопутствующего атеросклероза и, при необходимости, коррекции терапии у всех пациентов с АГА и ТААА в рамках первичного обследования, при поступлении в стационар, а также в случае оперативного лечения при необходимости в пери- и/или послеоперационном периоде [32–34].
ЕОК/РКО I C (УДД 4, УУР С)
- Рекомендуется рассмотреть возможность проведения генетического тестирования для выявления патогенных или вероятно патогенных мутаций у пациентов с аневризмами корня и восходящего отдела грудной аорты или хроническим расслоением грудной аорты и факторами риска НЗГА (таблица 1) [35].
ЕОК I С, АКК и ААC 1 В (УДД 4, УУР С)
Комментарии. Для диагностики требуется исследование 11 генов, которые, согласно подтвержденным сведениям, несут риски высокой пенетрантности заболеваний грудной аорты: FBN1, LOX, COL3A1, TGFBR1, TGFBR2, SMAD3, TGFB2, ACTA2, MYH11, MYLK, PRKG119. В этот список также входят гены, повышающие риск развития ЗГА и (или) обусловливающие системные симптомы, совпадающие с проявлениями синдромов Марфана, Лойеса-Дитца, сосудистого типа синдрома Элерса-Данло. [36]. Пациентам, соответствующим клинико-диагностическим критериям синдрома Марфана, но не страдающим эктопией (т.е. вывихом) хрусталика, желательно провести генетические анализы для исключения альтернативного диагноза (синдром Лойеса-Дитца). Генетические лаборатории классифицируют редкие варианты генов НЗГА следующим образом: патогенные, вероятно патогенные, варианты неизвестного значения, доброкачественные, вероятно доброкачественные. Варианты неизвестного значения не имеют подтвержденной связи с заболеваний грудной аорты и, таким образом, не должны применяться для выявления членов семей из группы риска, а также для принятия клинических решений.
- Рекомендуется рассмотреть возможность проведения у пациентов с подтвержденным патогенным или вероятно патогенным вариантом гена, предрасполагающим к НЗГА, генетического консультирования, при этом клиническое ведение пациента необходимо скорректировать с учетом конкретного гена и варианта гена [37].
EOK I B, АКК и ААC I В (УДД 4, УУР С)
Комментарии. Мутации FBN1, TGFBR1, TGFBR2, SMAD3, TGFB2 выявляют в 6–8% семей с НЗГА, у членов которых отсутствуют симптомы синдромов Марфана и Лойеса-Дитца [35]. Подтверждено, что мутации ACTA2, MYH11, MYLK, LOX, PRKG1 могут вызывать НЗГА в отсутствие выраженных симптомов синдромов Марфана или Лойеса-Дитца [37]. В рамках клинического описания семей с НЗГА с патогенными вариантами недавно открытых генов установлено, что основной ген позволяет прогнозировать не только риск аневризмы и расслоения грудной аорты (АРГА), но и клиническую картину патологии аорты, риск развития расслоения аорты в определенном диапазоне диаметров аорты (см. ранее), а также риск развития и виды дополнительной сосудистой патологии. Например, мутации TGFBR2 предрасполагают к развитию не только АРГА, но и аневризм внутричерепных артерий, аневризм и расслоений иных артерий; мутации ACTA2 ведут к развитию АРГА и окклюзирующей патологии артерий (в том числе ранних инсультов, ишемической болезни сердца).
- Рекомендуется рассмотреть возможность проведения генетического тестирования биологическим родственникам пациентов с известным заболеванием грудной аорты и выявленными у них патогенными или вероятно патогенным вариантам генов НЗГА [37,38].
ЕОК/РКО IC, АКК и ААC 1 В (УДД 4, УУР С)
Комментарии. Каскадный скрининг подразумевает применение расширенных визуализирующих методик для выявления бессимптомного расширения грудной аорты у лиц из группы риска в семьях с наследованием патогенного варианта НЗГА; данный процесс повторяют по мере выявления членов семей с расширением грудной аорты или носителей патогенного варианта [39]. Патогенные варианты в генах НЗГА обеспечивают повышенный риск развития заболевания грудной аорты, поэтому лица с подобными патогенными вариантами подлежат скринингу с проведением визуализации аорты на предмет выявления бессимптомных заболеваний грудной аорты [37,38].
4. Инструментальные диагностические исследования
Визуализирующие методы обследования имеют основополагающее значение для первичной диагностики и продленного наблюдения за пациентами с АГА и ТААА. Выбор адекватного метода обследования или их комбинации основывается на клинических проявлениях, объективном статусе, локализации патологического процесса, возраста пациента и сведений о дополнительных факторах риска ассоциированных с аортой осложнений. Кроме того, выбор метода определяться его наличием в медицинском, а также целесообразно учитывать опыт клиники в диагностике данных заболеваний и возможности выполнения различных визуализирующих исследований Диагностическая эффективность различных методов визуализации аорты представлена в Таблице 2. Выбор метода визуализации может зависеть от особенностей пациента, включая его гемодинамическую стабильность, наличие металлических имплантатов, сердечный ритм (тахикардия, частая экстрасистолия или фибрилляция предсердий), наличие аллергических реакций на йодсодержащие контрастные средства, функцию почек и переносимость процедуры (например, следует учитывать относительно более продолжительное время исследования и ограниченное пространство при проведении МРТ, что иногда требует седации) [40].
Таблица 2.
Диагностическая эффективность различных методов визуализации аорты
Диагностическая эффективность различных методов визуализации аорты
| Показатель | КТА аорты | МРА аорты | ТТ-ЭхоКГ | ЧП-ЭхоКГ | УЗДГ и ДС |
|---|---|---|---|---|---|
| Доступность | +++ | ++ | +++ | ++ | +++ |
| Транспортабельность | - | - | +++ | +++ | +++ |
| Скорость проведения исследования | +++ | + | ++ | ++ | ++ |
| Пространственное разрешение | +++ | ++ | ++ | +++ | ++ |
| Временное разрешение | + | ++ | +++ | +++ | +++ |
| Трехмерный набор данных | +++ | ++ | + | + | + |
| Возможность оценки сосудов ветвей дуги | +++ | +++ | ++ | + | НП |
| Возможность оценки функции клапана и желудочка | + | ++ | +++ | +++ | НП |
| КТА – рентгеновская компьютерно-томографическая ангиография, МРА – магнитно-резонансная ангиография, НП – неприменимо, ЧП-ЭхоКГ – чреспищеводная эхокардиография, ТТ-ЭхоКГ – трансторакальная эхокардиография, УЗДГ и ДС – ультразвуковая допплерография и дуплексное сканирование. «+++» – отличные результаты, «++» – хорошие результаты, «+» – удовлетворительные результаты, «-» – недоступно. | |||||
- Рекомендуется выполнение трансторакальной эхокардиографии (ТТ-Эхо КГ) всем пациентам с АГА и/или ТААА в качестве метода визуализации первой линии при оценке заболеваний грудной аорты [41].
ЕОК\РКО I В (УДД 4, УУР С)
Комментарии. ТТ Эхо-КГ предоставляет важную анатомическую информацию (наличие расширения, или расслоения) о восходящем отделе аорты (ВА). Вместе с тем, дистальная часть ВА и проксимальный отдел дуги аорты (слепое пятно) недоступны для визуализации из-за интерпозиции левого главного бронха. При ТТ ЭХО-КГ могут выявляться осложнения АГА (например, АН, гидроперикард), но ее диагностическая точность в случае ОАС ограничена (чувствительность: 78%–100% для расслоения типа A, 31%–55% – для типа B).
- Рекомендуется у пациентов с впервые выявленным при ультразвуковом либо другом исследовании расширении любого отдела грудной аорты 40 мм и более и/или расслоением любого отдела грудной аорты выполнять КТА, либо МРА грудной и брюшной аорты [42].
ЕОК/РКО I B, АКК и ААC 1 В (УДД 4, УУР C)
- Рекомендуется у пациентов с подтвержденным или предполагаемым заболеванием грудной аорты измерять ее диаметр в различных отделах по воспроизводимым анатомическим ориентирам. Каждое измерение должно выполняться на уровне воображаемой плоскости располагающейся перпендикулярно оси кровотока (аорты), а результаты измерения должны излагаться в четкой и последовательной форме. При асимметричном или овальном контуре поперечного сечения аорты следует отдельно указывать наибольший и наименьший диаметры аорты, а также протяженность расширения [42].
ЕОК/РКО I С, АКК и ААC 1 В (УДД 4, УУР C)
Комментарии. Измерения диаметра аорты следует проводить перпендикулярно оси аорты в определенных точках (Рисунок 3), а также выполнять дополнительные замеры в местах каких-либо аномалий (локальные расширения, изъязвления, гематомы). Крайними точками при измерении диаметра аорты должны быть внешние стороны ее стенки, то есть толщина стенки аорты при измерении ее диаметра должна учитываться. При выраженном утолщении аортальной стенки (5 мм и более), а также в случае наличия интрамуральной гематомы целесообразно отдельно измерять диаметр внутреннего просвета грудной аорты, толщину ее стенки, распространенность утолщения (гематомы), и отражать эти сведения в заключении [42].
- Рекомендуется при проведении ТТ-ЭхоКГ пациентам с с АГА и/или ТААА измерять диаметр аорты от переднего края до переднего края, перпендикулярно оси кровотока, в конце диастолы [32,43,44].
ЕОК/РКО IIa С, АКК и ААC 2аС (УДД 5, УУР С)
Комментарии. Измерение от переднего края до переднего края при ТТ ЭХО-КГ показало хорошую корреляцию с измерениями от внутреннего края до внутреннего края на КТА и МРА. Метод измерения от внутреннего края до внутреннего края при ТТ ЭХО-КГ также показал отличное совпадение измерений, но только в исполнении опытных исследователей.
- Рекомендуется, чтобы у пациентов с подтвержденным или предполагаемым поражением аорты эпизодическая и кумулятивная дозы ионизирующего облучения должны быть настолько низкими, насколько это возможно без потери качества визуализации [45].
ЕОК/РКО I С, АКК и ААC 1 С (УДД 4, УУР С)
Комментарии. Риск развития злокачественного новообразования, ассоциированный с проведением рентгеновской компьютерной томографии, остается спорным вопросом. В целом считается, что этот риск максимален в раннем возрасте, а затем значительно снижается. Внимательная оценка наличия показаний к проведению визуализирующего исследования аорты, оптимизация протокола КТА, использование альтернативных методик, например, МРА, являются действенными подходами для снижения лучевой нагрузки [45].
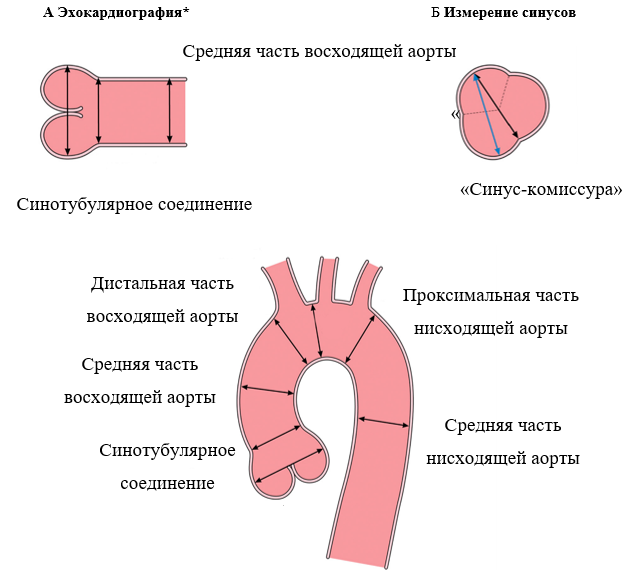
Рисунок 3. Особенности выполнения измерений аорты при эхокардиографии и рентгеновской компьютерно-томографической ангиографии
С МРА и КТА аорты†
(A) Методика измерений «между внешними краями», используемая при эхокардиографии, слева направо: измерение максимального диаметра на уровне корня аорты (синусов Вальсальвы), синотубулярного соединения и тубулярной части восходящей аорты. (Б) Измерения диаметров корня аорты «синус-комиссура» и «синус-синус» в ходе КТА или МРА. (С) Стандартные зоны измерений грудной аорты при анализе КТА или МРА. Источник: Боргер и соавторы [46], авторское право 2018 года; публикуется с согласия Elsevier, Inc. КТА –компьютерно-томографическая ангиография; МРА – магнитно-резонансная ангиография. *Между внешними краями. †Между внутренними стенками.
- Рекомендуется у пациентов с подтвержденным или предполагаемым поражением грудной аорты при выполнении КТА или МРА аорты измерять диаметры на уровне синусов Вальсальвы, синотубулярного соединения и тубулярной части восходящего отдела аорты между ее внешними сторонами с использованием ЭКГ-синхронизированной методики (Таблица 3) [43].
ЕОК/РКО I С, АКК и ААC 1 С (УДД 4, УУР С)
Комментарии. Использование техники ЭКГ-синхронизации при проведении КТА уменьшает артефакты движения корня и восходящего отдела аорты [47], значительно повышая этим точность измерений и достоверность диагностики. При КТА и МРА грудной аорты диаметр корня аорты можно измерять от комиссуры до стенки противоположного синуса или от стенки одного синуса до стенки другого (Рисунок 4) [48]. Измерение от синуса до синуса и между внутренними краями на КТА грудной аорты и МРА грудной аорты продемонстрировало хорошую корреляцию с результатами эхокардиографии при измерении корня и восходящего сегмента аорты [43]. Измерение диаметра протеза аорты (например, имплантированного хирургическим путем синтетического сосудистого протеза либо стент-графта для транскатетерной изоляции патологии грудной аорты) может также включать проведение замеров между внутренними краями, что позволяет определить функциональный просвет и может быть использовано при планировании дополнительных лечебных мероприятий.
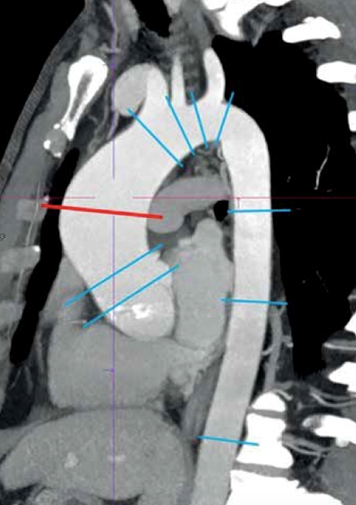
Рисунок 4. Стандартные зоны измерений диаметров грудной аорты (адаптировано из Скрипник А.Ю. и соавт., 2019 [49]).
Таблица 3.
Основные составляющие заключений по результатам визуализации аорты методами КТА и МРА
Основные составляющие заключений по результатам визуализации аорты методами КТА и МРА
|
1. Максимальный диаметр аорты на каждом уровне дилатации, измеренный перпендикулярно оси кровотока. При асимметричном или овальном контуре стенок следует отдельно указывать наибольший диаметр просвета. Должны быть приведены результаты измерений на стандартных уровнях грудной аорты, даже если они находятся в пределах нормы. Необходимо обращать особое внимание и отмечать в заключении наличие у пациента врожденных аномалий: аберрантная левая подключичная артерия (a. Lusoria), дивертикул Коммереля, “бычья дуга” аорты, коарктация аорты, функционирующий открытый артериальный проток, дополнительная левая верхняя полая вена, аномалии аортального клапана (двустворчатый, моностворчатый, четырехстворчатый АК).
|
|
2. Изменения стенки аорты, свидетельствующие об атеросклерозе, диффузном утолщении (например, при аортите) или наличии пристеночного тромба.
|
|
3. Признаки стеноза или окклюзии просвета аорты, включая их локализацию, степень тяжести и протяженность.
|
|
4. Признаки, свидетельствующие об остром аортальном синдроме (например, расслоение, ИМГ, ПАЯ, парааортальная гематома), включая проксимальное и дистальное распространение, подозрение на первичную фенестрацию (если этот участок виден) и развитие осложнений (например, активная экстравазация рентгенконтрастных средств, содержащих йод, разрыв, ограниченный разрыв, разрыв, вызвавший периаортальное кровоизлияние, перикардиальный и плевральный выпоты, медиастинальное кровотечение, сдавление гематомой прилежащих анатомических структур).
|
|
5. Распространение патологического процесса в аорте (острого или хронического) на ее магистральные ветви, признаки повреждения органов-мишеней, а также подозрение на мальперфузию.
|
|
6. Следует провести прямое детальное сравнение с результатами предыдущих исследований, чтобы выявить соответствующие изменения.
|
|
7. Наличие и объем проведенных ранее вмешательств (например, имплантированный сосудистый протез, стент-графт, протез клапана сердца), а также любые признаки осложнений.
|
|
8. Предположение относительно классификации заболевания (например, острый аортальный синдром, истинная или ложная аневризма, стеноз просвета или атеросклеротическое поражение аорты).
|
|
9. Также в заключение должны быть включены соответствующие подробности, которые касаются метода получения изображения (например, факт использования ЭКГсинхронизации и фаза сердечного цикла, в которую получены изображения), а также техники выполнения измерений (например, аксиальное или двойное косое, по внутренним или по внешним краям).
|
КТА – рентгеновская компьютерно-томографическая ангиография; МРА– магнитнорезонансная ангиография
-
Рекомендуется у пациентов с установленным или предполагаемым поражением аорты диаметр корня аорты указывать как максимальное расстояние между максимально взаимно удаленными точками синусов [50].
ЕОК/РКО I C, АКК и ААC I С (УДД 4, УУР С)
- Рекомендуется для более эффективной оценки риска расслоения аорты и летального исхода у пациентов с подтвержденным или предполагаемым поражением аорты указывать не только абсолютные значения диаметров аорты, но и индексированные к росту и площади поверхности тела, а также абсолютные и индексированные значения площади поперечного сечения в зоне максимального расширения [41].
ЕОК/РКО Iia C, АКК и ААC 2А, С (УДД 4, УУР С)
- Рекомендуется выполнение прицельной рентгенографии органов грудной клетки пациентам с подозрением на АГА и ТААА в рамках первичного обследования, при поступлении в стационар, а также в случае оперативного лечения при необходимости в пери- и/или послеоперационном периоде [51].
ЕОК\РКО I С (УДД 5, УУР С)
- Рекомендуется выполнение КТА аорты при отсутствии противопоказаний пациентам с подозрением на АГА и/или ТААА в рамках первичного обследования, при поступлении в стационар, а также в случае оперативного лечения при необходимости в пери- и/или послеоперационном периоде для установления и подтверждения диагноза, а также для диагностики осложнений и сопутствующей патологии [51,52].
ЕОК\РКО I B (УДД 5, УУР С)
Комментарии. При необходимости КТА аорты может быть выполнена без использования рентгенконтрастных средств, содержащих йод позволит обеспечить вполне точную оценку диаметра аневризмы аорты, что может оказаться достаточным для наблюдения за состоянием тех пациентов, для которых проведение МРА аорты противопоказано или представляется невозможным по причине непереносимости. Тем не менее в некоторых случаях при КТА аорты может быть затруднена визуализация контура стенки аорты (например, на уровне корня). Использование внутривенных рентгенконтрастных йодсодержащих препаратов позволяет более четко определить границу между внутренним просветом аорты и ее стенкой, что, как правило, повышает точность диагностики пристеночных изменений. В некоторых случаях следует учитывать потенциальный риск развития аллергии на рентгенконтрастное йодсодержащее средство и его токсическое воздействие на почки. Тем не менее, согласно недавнему согласованному заявлению Американской коллегии радиологов и Американского Национального почечного фонда [53], риск развития острого почечного повреждения после внутривенного введения йодсодержащих рентгенконтрастных средств у пациентов с нарушением функции почек, вероятно, был переоценен.
- Выполнение КТА всей аорты рекомендуется в качестве метода визуализации первой линии у пациентов с подозрением на острый аортальный синдром (разрыв аневризмы), поскольку он широко доступен, точен и позволяет получить информацию о разрыве, расширении и возможных осложнениях [54].
ЕОК\РКО I B (УДД 5, УУР С)
- Рекомендуется выполнение МРА аорты и её ветвей «плановым» пациентам с подозрением на АГА и ТААА при отсутствии противопоказаний в рамках первичного обследования при невозможности выполнения КТА аорты, при поступлении в стационар, а также в случае оперативного лечения при необходимости в пери- и/или послеоперационном периоде для установления и подтверждения диагноза, а также диагностики осложнений и сопутствующей патологии [51,55].
ЕОК\РКО I С (УДД 5, УУР С)
Комментарии. МРА аорты обеспечивает визуализацию всей аорты и ее ветвей, позволяет охарактеризовать изменения стенок на предмет наличия воспаления и ОАС, а также предоставляет необходимую информацию для проведения физиологической оценки функции желудочков и клапанов сердца, количественной оценки скорости кровотока. При МРА не используются ионизирующее излучение и, зачастую, может не вводиться контрастный препарат. Поэтому часто именно МРА аорты является основным методом оценки врожденных аномалий аорты и хорошо подходит для проведения повторных визуализаций у молодых пациентов. Использование ЭКГ-синхронизации уменьшает выраженность артефактов движения корня аорты и наборов 3D-данных, что имеет решающее значение для получения точных и воспроизводимых результатов измерений. К ограничениям методики МРТ относятся ее пространственное разрешение (которое, хотя и является хорошим, но, как правило, все же несколько ниже, чем у КТ), а также появление артефактов на снимках пациентов, в теле которых имеется любой металлический имплант. Кроме того, доступность МРА аорты для визуализации аорты не так широка, как доступность КТА аорты. К другим недостаткам МРТ можно отнести более продолжительное время, требующееся для сбора данных, и ограниченную возможность мониторинга и лечения нестабильных пациентов в момент нахождения в томографе [56]. Поэтому МРА аорты реже используется при подозрении на острую аортальную патологию, особенно если состояние пациента оценивается как нестабильное. Для визуализации аорты доступны различные последовательности МРТ, в том числе МРА аорты, которая включает получение объемной анатомии аорты с такой толщиной среза, которая позволяет реконструировать изображения в нескольких плоскостях. При проведении МРА аорты часто используются внутривенные парамагнитные контрастные средства. В таких случаях у пациентов с сопутствующими заболеваниями почек существует некоторый риск развития контрастиндуцированного нефрогенного системного фиброза, однако этот риск может быть дополнительно снижен путем использования таких парамагнитных контрастных средств, которые относятся к группе II. Дополнительные возможности МРА аорты часто используются для визуализации анатомии аорты в тех ситуациях, когда внутривенное введение контрастного средства не требуется: например, кино-МРТ в последовательности градиентного эха (с артериальной кровью) и спин-эхо-последовательность (с венозной кровью).
- Рекомендуется применять ЧП-ЭхоКГ во время всех «открытых» хирургических операций на восходящем отделе и дуге аорты у пациентов АГА и/или ТААА [57].
ЕОК\РКО I В, ЕАКТХ I, B (УДД 4, УУР C)
Комментарии. Относительная близость пищевода и дуги аорты позволяет получать изображения с высоким разрешением с помощью ЧП-ЭхоКГ. ЧП-ЭхоКГ интраоперационная превосходит ТТ-ЭхоКГ по уровню визуализации грудной аорты и играет важную роль в условиях, когда КТА аорты или МРА аорты может быть недоступна или невозможна, например, в отделении интенсивной терапии или операционной. ЧП-ЭхоКГ является полуинвазивным методом и требует седации, строгого контроля артериального давления, а также исключения заболеваний пищевода. Вследствие интерпозиции правого главного бронха и трахеи короткий сегмент дистального отдела восходящей аорты, как раз перед брахиоцефальным стволом, остается невидимым («слепое пятно»). Интраоперационная ЧП-ЭхоКГ также весьма эффективна для детализированной оценки строения и функции аортального клапана, а также для контроля нисходящего отдела грудной аорты при проведении гибридных вмешательств.
- Рекомендуется использовать ЧП-ЭхоКГ у пациентов с АГА и/или ТААА в качестве альтернативы при нестабильной гемодинамике, невозможности транспортировки пациента, неясных результатах МРА аорты или КТА аорты [57].
ЕОК\РКО Iia B, ЕАКТХ Iia, B (УДД 4, УУР C)
Комментарии. Особенно часто ЧП-ЭхоКГ используется при интраоперационной оценке пациентов с ОАС для определения открытой хирургической и эндоваскулярной тактики, а также для оценки состояния истинного и ложного каналов аорты – как до, так и сразу после выполнения реконструкции [58].
- Пациентам с подозрением на ОАС (разрыв аневризмы) рекомендуется проводить ЧП-ЭхоКГ для определения тактики ведения, оперативного вмешательства и выявления осложнений [54].
ЕОК\РКО I B (УДД 5, УУР С)
- Рекомендуется в семье с диагностированными случаями аневризм корня и (или) ВА или расслоения аорты, если патологическая мутация не выявлена по данным генетических тестов, выполнение скринингового обследования биологических родственников из группы риска при помощи методик визуализации аорты [59].
ЕОК\РКО I B, АКК и ААC I В (УДД 4, УУР С)
Комментарии. Считается, что у пациентов, с характерными анамнезом (например, неоднократные случаи заболеваний грудной аорты в семейном анамнезе или спорадические заболевания грудной аорты с ранним началом в отсутствие факторов риска), несмотря на отсутствие патогенного варианта гена, нельзя исключить НЗГА так как возможно патологические генетические варианты у них присутствующие, еще не известны. В нескольких исследованиях была подтверждена польза скрининга (ТТ-ЭхоКГ) среди родственников (из группы риска) всех пациентов с заболеваниями грудной аорты с положительным семейным анамнезом [59]. При отрицательном результате рекомендуется выполнение повторной ТТ-ЭхоКГ спустя 5 лет у молодых членов семьи или через 10 лет у старших членов семьи.
- Рекомендуется у пациентов с аневризмами корня и (или) ВА или расслоения аорты при отсутствии подтвержденного семейного анамнеза ЗГА или патогенных/вероятно патогенных мутаций выполнение скринингового обследования родственников первой степени родства при помощи визуализации аорты [59].
ЕОК\РКО I C, АКК и ААC I С (УДД 4, УУР С)
Комментарии. Исследования также свидетельствуют в пользу скрининга родственников первой степени родства среди пациентов с заболеваниями грудной аорты, у которых в семейном анамнезе нет указаний на подобные заболевания, хотя данные по этому вопросу более ограничены [59]. При отрицательных результатах скрининга визуализацию аорты можно повторить спустя несколько лет (в зависимости от возраста родственника и размеров аорты). Необходимо понимать, что не существует верхнего возрастного предела, при котором у пациентов могут развиваться заболевания грудной аорты и одновременно можно исключить генетическую этиологию заболевания.
- Рекомендуется всем пациентам с ДАК выполнение визуализации корня и ВА на предмет наличия признаков ее расширения [60].
ЕОК\РКО I B, ЕАКТХ I, В (УДД 5, УРР C)
Комментарии. ДАК встречается в общей популяции в 1-2% случаев. До 50% пациентов с ДАК имеют ассоциированную аортопатию с вовлечением корня и тубулярной части ВА [60]. Рекомендуется скрининг родственников первой линии с помощью ТТ-ЭхоКГ для определения наличия ДАК и/или расширения восходящей аорты. КТ ангиография аорты или МРА аорты могут быть показаны для полной визуализации восходящей аорты и дуги. Может быть полезна ТТ-ЭхоКГ родственников в юном возрасте.
- У пациентов с ДАК и расширением корня или ВА рекомендуется обследование всех родственников первой линии с помощью ТТ-ЭхоКГ для оценки наличия ДАК, расширения корня аорты и восходящей аорты или и того, и другого [61].
ЕОК\РКО I C, АКК и ААC I С (УДД 4, УУР С)
Комментарии. И ДАК, и расширение корня и восходящего отдела аорты могут быть семейными [61], и модели наследования семейных ДАК и аортопатии согласуются с аутосомно-доминантным паттерном с неполным проникновением. В семьях с ДАК и расширением корня и восходящего отдела аорты облигатные носители могут иметь и ДАК, и расширение аорты либо ни то, ни другое [61]. В семьях с ДАК и расширением корня и восходящего отдела аорты скрининг родственников первой степени (родителей, братьев и сестер и детей) с помощью ТТ-ЭхоКГ для оценки наличия ДАК и расширения аорты выявляет пораженных членов семьи. Если у члена семьи обнаруживается ДАК, расширение аорты или и то, и другое, показано каскадное обследование других родственных членов семьи. Поскольку в семьях с ДАК и расширением аорты могут быть члены семьи с расширением корня и восходящего отдела аорты при отсутствии ДАК, при недостаточной оценке восходящего отдела аорты с помощью ТТ-ЭхоКГ для полной оценки размера восходящей аорты следует выполнить КТА грудной аорты или МРА грудной аорты.
- Рекомендуется пожизненное наблюдение за корнем и восходящим отделом аорты с помощью ТТ-ЭхоКГ, КТА грудной аорты или МРА грудной аорты с интервалом, зависящим от диаметра аорты и скорости ее роста у пациентов с ДАК и диаметром корня аорты и/или восходящего отдела аорты более 4,0 см [62].
ЕОК\РКО I C, АКК и ААC I С (УДД 4, УУР С)
Комментарии. В проспективном исследовании у 90 взрослых с ДАК среднее увеличение диаметра восходящей аорты составило 0,47 мм/г (диапазон 0,2–2,3 мм/г) за 4,8 года наблюдения [63]. ТТ-ЭхоКГ может документировать текущие диаметры аорты и позволяет рассчитать темпы ее роста. Среди когорты взрослых пациентов с ДАК (средний возраст – 55±17 лет) без АГА в исходе (т.е. исходный диаметр аорты составлял <4,5 см) у 13% через 14±6 лет после постановки диагноза развилась АГА, а 25-летний риск развития АГА составил 26% [64]. У многих взрослых корень аорты, восходящий отдел аорты или и то, и другое диаметром ≥4,0 см считаются расширенными, и поэтому с течением времени их следует контролировать с помощью обзорной визуализации для выявления прогрессирующего расширения.
5. Иные диагностические исследования
- Рекомендуется выполнять коронарографию (Ангиография коронарных артерий) всем пациентам с АГА и ТААА для выявления гемодинамически значимых стенозов коронарных артерий перед «открытым» хирургическим, эндоваскулярным или гибридным вмешательством в следующих ситуациях: возраст старше 40 лет, анамнез и/или симптомы ИБС, признаки ишемии миокарда, снижение ФВ ЛЖ <50%, один и более факторов риска ИБС и/или постлучевое поражения [28].
ЕОК\РКО I C (УДД 5, УРР С)
Комментарии. Инвазивное определение давлений в полостях сердца, измерение параметров центральной гемодинамики, оценка степени нарушений кровотока на клапанах и функции ЛЖ требуется в случаях недостаточно информативных неинвазивных исследований либо расхождения результатов последних с клиническими данными. Учитывая риск возможных осложнений, рутинное выполнение инвазивной манометрии одномоментно с коронарографией не рекомендуется. В связи с невысокой диагностической ценностью панаортографии в диагностике патологии грудной аорты не рекомендуется её выполнение при возможности выполнения КТА аорты или МРА аорты.
- Рекомендуется рассмотреть возможность выполнения компьютерной томографической ангиографии коронарных артерий с ЭКГ синхронизацией в качестве альтернативы коронарографии у пациентов с планируемым лечением заболеваний на грудной аорте и невысокой вероятностью ИБС с целью выявления гемодинамически значимых стенозов, врожденных коронарных аномалий, а также уточнения анатомических особенностей коронарного русла [28].
ЕОК\РКО Iia C (УДД 5, УРР С)
Комментарии. У молодых пациентов с АГА, которым выполнялась КТА грудной аорты, целесообразна одномоментная оценка анатомии коронарных артерий, наличия кальциноза и признаков стенозирования. У пациентов моложе 40 лет без факторов риска ИБС с планируемым вмешательством на грудной аорте целесообразно визуализировать анатомию коронарного русла при коронарографии.
- Рекомендуется использовать внутрисосудистое ультразвуковое исследование сосудистой стенки у пациентов с АГА и/или ТААА в качестве альтернативы при выполнении эндоваскулярного лечения для дополнительной диагностики, в качестве навигации, для уменьшения объема используемого контрастного средства, при неясных результатах МРА аорты или КТА аорты [57].
ЕОК\РКО I C (УДД 4, УУР C)
Комментарии. Внутрисосудистое ультразвуковое исследование сосудистой стенки при проведении эндоваскулярного лечения сложных патологий грудной и брюшной аорты, позволяет уточнить размер аорты, ее извитость, наличие бляшек, наличие кальцинатов, оценить устья ветвей аорты и дефекты внутрисосудистого наполнения (например, при тромбах и расслоении интимы), а также исследовать зону имплантации эндоваскулярного стент-графта для нисходящего отдела грудной аорты. Также помогает выявить пациентов, для которых эндоваскулярное лечение связано с высоким риском осложнений и/или противопоказано. Кроме того, может быть полезным при расслоении аорты, для оценки анатомии истинного и ложного каналов и тем самым позволяет сделать выбор между эндоваскулярным или открытым хирургическим лечением. Внутрисосудистое ультразвуковое исследование сосудистой стенки может использоваться для навигации во время раскрытия любых стент-графтов эндоваскулярных (для нисходящего отдела грудной аорты, абдоминальных и т.д.) и, во время окончательной оценки, для уменьшения объема, используемого рентгенконтрастного средства, содержащего йод [65].
Лечение
Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Общие положения
Консервативное лечение аневризм грудного отдела аорты направлено на предотвращение увеличения диаметра аневризмы, развития осложнений, таких как разрыв или диссекция, отсрочки хирургического вмешательства, а также на контроль факторов риска, способствующих прогрессированию заболевания, снижение сердечно-сосудистой заболеваемости и смертности.
Немедикаментозная терапия включает модификацию образа жизни, отказ от курения и ограничение физической активности.
Медикаментозная терапия играет ключевую роль в снижении артериального давления и замедлении роста аневризмы при регулярном мониторинге размеров аневризмы с использованием современных методов визуализации, таких как МРА или КТА.
Хирургическое и эндоваскулярные методы лечения применяются в зависимости от размеров и локализации аневризмы, скорости её роста, симптоматики и наличия острых осложнений.
Важным аспектом лечения АГА является мультидисциплинарный подход, который учитывает генетические факторы, сопутствующие заболевания и индивидуальные риски пациента (Приложение А3).
1. Консервативное лечение
- Рекомендуется пациентам с АГА и ТААА избегать интенсивных изометрических нагрузок (занятий тяжелой атлетикой или требующих маневра Вальсальвы), подъема тяжестей и занятий контактными видами спорта [32].
ЕОК\РКО I C, АКК и ААC I С (УДД 5, УУР C)
Комментарии. Маневр Вальсальвы может вызвать резкое повышение САД до >300 мм рт. Ст. Кроме того, показано, что высокоинтенсивные спортивные тренировки являются независимым предиктором роста корня аорты [66].
- При целевом уровне АД пациентам с АГА и ТААА, рекомендуется выполнять 30–60 минут аэробной активности легкой или средней интенсивности не реже 3–4 дней в неделю [32].
ЕОК\РКО Iia C, АКК и ААC Iia С (УДД 5, УУР С)
Комментарии. Имеется консенсусное мнение экспертов, что легкая атлетика и аэробные упражнения низкой интенсивности безопасны и, вероятно, улучшают как физическое, так и психическое здоровье пациентов с АГА. Не существует единого консенсуса относительно безопасности статических и аэробных упражнений среднего уровня. Рекомендации по интенсивности упражнений лучше всего индивидуализировать, основываясь на нескольких факторах, которые включают в себя основную патологию аорты, диаметр аорты и, скорость роста аорты, возраст, семейный анамнез и любые другие признаки высокого риска (например, неконтролируемая гипертония) [32].
- Рекомендуется пациентам с АГА и ТААА отказ от курения с целью снижения риска расслоения аорты, инфаркта миокарда и летального исхода [32,44].
ЕОК\РКО I C, АКК и ААC I С (УДД 5, УУР C)
Комментарии. Курение является фактором риска расширения АГА, а среди лиц с атеросклеротическим заболеванием аорты отказ от курения снижает показатели инфаркта миокарда и смерти [67,68]. Использование электронных сигарет, хотя и является эффективным средством отказа от курения, не было доказано как безопасное при использовании у пациентов с сосудистыми заболеваниями, включая АГА; кроме того, небольшие исследования показали, что ароматизирующие химические вещества в электронных сигаретах могут оказывать неблагоприятное воздействие на функцию эндотелия сосудов [69,70].
- Пациентам с АГА и ТААА и средним систолическим АД (САД) ≥130 мм рт. Ст. или средним диастолическим АД (ДАД) ≥80 мм рт. Ст. рекомендуется назначать антигипертензивные препараты для снижения риска сердечно-сосудистых осложнений, согласно рекомендациям по артериальной гипертензии 2024 года [71,72].
ЕОК\РКО I В, АКК и ААC I В (УДД 5, УУР C)
Комментарии. Ни в одном рандомизированном клиническом исследовании не оценивался оптимальный порог, до которого следует снижать АД у пациентов с АГА для уменьшения риска осложнений со стороны аорты (рост аорты, расслоение аорты или разрыв аорты). Обновленные рекомендации AКК и AАС по артериальной гипертензии предполагают, что все пациенты с клиническими сердечно-сосудистыми заболеваниями должны иметь целевое САД <130 мм рт. Ст. или ДАД <80 мм рт. Ст., или и то, и другое [71]. Фактические данные подтверждают агрессивное снижение АД для уменьшения побочных эффектов, связанных с сосудами, и смертности от всех причин.
- Рекомендуется назначение бета-адреноблокаторов у пациентов с АГА и ТААА для достижения целевых показателей АД при отсутствии противопоказаний и независимо от этиологии аневризмы [71].
ЕОК\РКО Iia C, АКК и ААC Iiа С (УДД 5, УУР C)
Комментарии. Проспективные данные о положительном эффекте бета-адреноблокаторов при АГА в зависимости от причины ограничены, при этом наиболее достоверные доказательные данные получены из когортных исследований пациентов с синдромом Марфана [65]. В небольшом открытом рандомизированном клиническом исследовании профилактического пропранолола** (средняя доза: 212±68 мг/сут) по сравнению с плацебо у подростков и взрослых с синдромом Марфана бета-адреноблокаторы замедляли рост корня аорты и уменьшали аортальные осложнения [73]. В исследовании 155 детей в возрасте <12 лет с синдромом Марфана при многофакторном анализе бета-адреноблокаторы снижали скорость роста корня аорты на 0,16 мм/год [74].
- У пациентов с АГА и ТААА для достижения целевых показателей АД рекомендуется в качестве комбинированной терапии в дополнении к бета-адреноблокаторам назначать блокаторы ангиотензиновых рецепторов (БАР, АТХ: Антагонисты рецепторов ангиотензина II), при отсутствии противопоказаний и независимо от этиологии аневризмы [75].
ЕОК\РКО Iia C, АКК и ААC Iiа С (УДД 1, УУР A)
Комментарии. Метаанализ 1510 рандомизированных пациентов, оценивающий влияние БАР на заболевания грудной аорты, ассоциированное с синдромом Марфана, продемонстрировал более медленный рост корня аорты при использовании БАР (АТХ: Антагонисты рецепторов ангиотензина II) по сравнению с плацебо; при прямом сравнении с терапией бета-адреноблокаторами не было различий в росте аорты; и комбинация бета-адреноблокаторов + БАР (АТХ: Антагонисты рецепторов ангиотензина II) приводила к более медленному росту аорты, чем применение только бета-адреноблокаторов [75].
- Рекомендуется назначение ингибиторов ГМГ-КоА-редуктазы пациентам с АГА и ТААА при наличии атеросклероза по данным визуализации или клинических признаков [76].
ЕОК\РКО Iia C, АКК и ААC Iiа С (УДД 5, УУР С)
Комментарии. Аневризмы аорты атеросклеротического генеза повышают риск инсульта и инфаркта миокарда, поэтому в соответствии с заключением третьей группы экспертов по лечению взрослых в США в рамках Национальной образовательной программы по холестерину (NCEP ATP III) они считаются эквивалентом ишемической болезни сердца с риском развития события >20% в течение 10 лет [77]. В «Руководстве AHA и ACC 2016 года по ведению пациентов с заболеваниями периферических артерий нижних конечностей» [78] дана рекомендация с уровнем доказательности 2a по применению ингибиторов ГМГ-КоА-редуктазы высокой интенсивности для достижения целевого уровня ЛПНП <70 мг/дл у пациентов с некоронарным атеросклеротическим заболеванием. По результатам совместной работы специалистов по лечению заболеваний, связанных с холестерином, при объединении данных 5 (рандомизированных клинических исследований (РКИ) с участием 39 612 пациентов на протяжении 5,1 лет, более интенсивное снижение уровня холестерина у пациентов с атеросклерозом привело к уменьшению основных сердечно-сосудистых событий еще на 15% по сравнению с тем, что было достигнуто при менее интенсивном снижении уровня холестерина[76]. Терапия ингибиторами ГМГ-КоА-редуктазы все еще является разумной при наличии сопутствующего атеросклеротического поражения у пациентов со спорадическими или генетически опосредованными аневризмами.
- Рекомендуется рассмотреть возможность терапии ингибиторами ГМГ-КоА-редуктазы у пациентов с АГА и ТААА без признаков атеросклероза [79].
ЕОК\РКО Iib C, АКК и ААC Iib С (УДД 4, УУР С)
Комментарии. Долгое время выдвигалась гипотеза о том, что плейотропные эффекты ингибиторов ГМГ-КоА-редуктазы могут быть полезными для предотвращения неблагоприятного ремоделирования сосудистой стенки, связанного с АГА, тем самым замедляя рост, независимо от причины и наличия сопутствующего атеросклероза. Исследования на животных показали уменьшение роста аневризмы грудной клетки при терапии ингибиторами ГМГ-КоА-редуктазы, возможно, за счет регуляции активности матриксных металлопротеиназ. Исследование, в котором приняли участие 1348 пациентов с эктазией грудной аорты, в соответствии с анализом склонности продемонстрировало возможную пользу терапии ингибиторами ГМГ-КоА-редуктазы в снижении скорости роста аорты, а также аортальных осложнений [80]. В ретроспективном исследовании, включавшем 2267 пациентов, перенесших ЭВПГА по поводу аневризматической болезни, 1148 (64%) из которых получали ингибиторы ГМГ-КоА-редуктазы до операции, предоперационная терапия ингибиторами ГМГ-КоА-редуктазы была связана со значительно более низкими показателями периоперационных осложнений и 5-летней летальностью [81]. Возможная польза ингибиторов ГМГ-КоА-редуктазы в предотвращении неблагоприятных исходов, связанных с аортой, также была продемонстрирована в небольшом когортном исследовании, а в 2-х небольших исследованиях у пациентов с ДАК и аортопатией предполагается замедление роста аорты [79].
- Рекомендуется пациентам с атеросклеротическим генезом АГА или ТААА и наличием атероматоза аорты или пенетрирующих атеросклеротических язв назначение низких доз ацетилсалициловой кислоты** при отсутствии противопоказаний [51].
ЕОК\РКО Iiа C, АКК и ААC Iia С (УДД 5, УУР С)
Комментарии. В исследовании SPARC (профилактика инсульта: оценка риска среди населения) атеросклероз аорты был взаимосвязан с ишемической болезнью сердца (ОШ – 2,99; 95%-й ДИ – 1,47–6,10; p=0,003)[82]. В свою очередь, при наличии ишемической болезни сердца ацетилсалициловая кислота** уже давно рекомендуется для снижения риска сердечно-сосудистых событий, включая инсульт, смерть, вызванную ишемической болезнью сердца, и инфаркт миокарда [51].
- Пациентам с ОАС (разрывом аневризмы), для достижения целевых уровней АД имеющих противопоказания к назначению бета-адреноблокаторов, рекомендуется назначение недигидропиридиновых кальциевых блокаторов [83,84].
EОК\РКО Iia В (УДД 4, УУР С)
2. Хирургическое лечение аневризм восходящего отдела и корня аорты [85–87]
Желательно, чтобы плановое вмешательство при аневризмах корня и ВА выполнялось, когда риск нежелательных явлений – расслоения, разрыва или внезапной смерти перевешивает риски хирургического вмешательства. Ни в одном проспективном многоцентровом наблюдательном исследовании не оценивалось множество параметров (например, диаметр, длина или площадь аорты, изолированно или с индексацией к росту или площади поверхности тела, напряжению стенки, напряжению сдвига), предложенных для прогнозирования риска нежелательных аортальных событий. С чисто механической точки зрения расслоение или разрыв аорты можно рассматривать как событие, когда существует дисбаланс между нагрузками на стенку аневризмы и внутренней прочностью ее ткани. Вопрос о том, вызвано ли расслоение аорты повышенным напряжением стенки или снижением прочности стенки, или сочетанием того и другого, является областью активных исследований[88]. Максимальный диаметр аорты логично был основным критерием для планового лечения аневризмы, поскольку, согласно закону Лапласа, напряжение стенки увеличивается пропорционально радиусу аорты и обратно пропорционально толщине. Первоначальные исследования естественной динамики изучали риск разрыва или расслоения аорты в зависимости от ее диаметра, и точка отсчета для расслоения определила порог в 5,5 см, длительное время регулировавший клиническую практику. Хотя у значительной части пациентов с расслоением аорты типа А по Stanford диаметр составляет <5,5 см, этот хирургический порог по-прежнему эффективно снижает нежелательные явления [89].
Участниками рабочей группы было принято решение ввести понятия экспертных центров и экспертов по каждой проблеме, что возможно будет значимо влиять на результаты диагностики, открытого хирургического и рентгенхирургического лечения и периоперационного ведения пациентов с тяжелой патологией аорты.
Значение аортальной команды сложно переоценить, и в настоящее время во всех клинических рекомендациях активно обсуждается необходимость наличия таковой для качественного и оптимального способа оказания медицинской помощи пациентам [32,34]. Также, по нашему мнению, наличие специалистов открытого хирургического лечения вместе с эндоваскулярными методами лечения патологии аорты в одной клинике – это необходимое условие для экспертного центра.
Решением ведущих специалистов РФ по патологии аорты принято считать экспертными центрами клиники, имеющие опыт ежегодного открытого хирургического лечения каждой конкретной патологии, которая будет рассматриваться ниже. По открытому хирургическому лечению патологии ВА и дуги – не менее 50 вмешательств на ВА и 20 вмешательств на дуге аорты. По нисходящей грудной и торакоабдоминальной патологии – не менее 15 случаев открытых реконструкций АГА и ТААА в год по каждой группе. Что касается эндоваскулярной хирургии – ведущие специалисты не считают необходимым связывать опыт клиники с экспертностью её, ввиду активного участия приглашенных экспертов для развития эндоваскулярных методик повсеместно.
С учетом опыта и экспертностью центров, возможен более агрессивный подход к показаниям для открытого и эндоваскулярного методов лечения пациентов с аневризмой и расслоением аорты. Предлагаются следующие значения диаметров для вмешательства при бессимптомных аневризмах грудной аорты (Таблица 4):
Таблица 4.
Рекомендуемые пороговые значения размера для вмешательства при бессимптомных аневризмах грудной аорты *
Рекомендуемые пороговые значения размера для вмешательства при бессимптомных аневризмах грудной аорты *
| Этиология | Корень аорты, см | Восходящая аорта, см | Дуга аорты, см |
Нисходящая и
ТАА аорта, см
|
|---|---|---|---|---|
| Дегенеративные 1 |
5,5 (5)
|
5,5 (5) | 5,5 |
НГА – 5,5
ТААА – 6 (5,5)
|
| Двустворчатый аортальный клапан 1 | 5,5 (5) | 5,5 (5) | 5,5 |
НГА – 5,5
ТААА – 6 (5,5)
|
| Генетические синдромы 1,2 | 5 (4,5) | 5 (4,5) | 5(4,5) | 5 (4,5) |
| Семейная аортопатия 1,3 | 4 – 4,5 | 4 – 4,5 | 5,5 |
НГА – 5,5
ТААА – 6 (5,5)
|
| Планирующиеся на кардиохирургическое вмешательство 1 | 5 (4,5) | 5 (4,5) | 5,5 |
НГА – 5,5
ТААА – 6 (5,5)
|
Особенности выбора показаний к хирургическому вмешательству см. в соответствующих разделах рекомендаций
() – пороговые значения для экспертных центров
* Пороговые значения размера для вмешательства должны учитывать размер тела пациента эмпирически или с использованием предложенных формул; также имеет значение истончение стенки аорты, соотношение диаметров восходящей и нисходящей аорты, тип строения корня и восходящего отдела аорты, наличия аортальной недостаточности
1 – Для молодых пациентов, дисплазии соединительной ткани и в экспертных центрах – возможна более агрессивная тактика
2 – В зависимости от верифицированной генетической патологии
3 – Для женщин, ожидающих беременности, порог составляет 4,1-4,5 см.
- Рекомендуется пациентам с аневризмами корня и ВА, у которых имеются симптомы, связанные с аневризмой, выполнять протезирование данного отдела аорты [90].
ЕОК\РКО I C, АКК и ААC I С (УДД 4, УУР С)
Комментарии. Крупные аневризмы по мере их роста могут сдавливать близлежащие структуры, что приводит к болевому синдрому в груди или спине. С другой стороны, боль иногда связана с быстрым ростом аорты. Следовательно, появление таких симптомов вызывает беспокойство по поводу повышенного риска разрыва аневризмы [90], и, следовательно, показано хирургическое вмешательство.
- Рекомендуется выполнять протезирование аорты бессимптомным пациентам с аневризмами корня и/или ВА при максимальном диаметре аорты ≥5,5 см [91].
ЕОК\РКО I B, АКК и ААC I B (УДД 5, УУР С)
Комментарии. Максимальный диаметр аорты ≥5,5 см был главным критерием для планового хирургического лечения аневризм корня аорты или восходящего отдела грудной аорты [26,92] на основании исследований естественного течения аневризм грудной аорты, в которых изучались диаметр на момент неблагоприятного события и периоперационная смертность <5% [26,91]. Уровень смертности при плановом хирургическом вмешательстве на ВА низкий, в то время как риск осложнений, ассоциированных с аортой, является высоким, когда такая операция рекомендована, но не выполняется из-за нарушения пациентом предписанного режима терапии или сопутствующих заболеваний. В отсутствие дополнительных факторов риска применяется одно и то же пороговое значение диаметра аорты 5,5 см независимо от наличия трехстворчатого или двустворчатого АК [93].
- Рекомендуется хирургическое вмешательство на корне и/или ВА в случае пациентов с аневризмой корня и/или ВА диаметром <5,5 см, скорость роста которой, подтвержденная данными КТА, составляет ≥0,3 см/год в течение двух последовательных лет или ≥0,5 см в течение 1 года [44].
ЕОК\РКО I C, АКК и ААC I С (УДД 5, УУР С)
Комментарии. Один метаанализ и ограниченные наблюдательные исследования показали, что рост аневризмы ВА происходит медленнее, чем сообщалось ранее, и эта скорость часто меньше 0,5 мм/год у пациентов с трехстворчатым АК и без генетически обусловленного заболевания аорты [94]. Также этот мета-анализ продемонстрировал, что быстрый рост аневризмы связан с повышенным риском разрыва [95]. Из-за присущей измерениям погрешности, а также вариабельности результатов у разных исследователей было бы трудно последовательно документировать рост от 1 мм до 2 мм в год по данным визуализации в динамике. Расхождения в измерениях могут возникать при сравнении различных методов визуализации или даже при использовании одного и того же метода при сравнении изображений, полученных с контрастным средством и без него. Как правило, темпы роста наиболее точны при оценке с помощью МРА аорты или КТА аорты с ЭКГ-синхронизацией с использованием методов измерения осевой линии [96]. Подтвержденный рост ≥0,5 см в год был и остается показанием к хирургическому вмешательству [26,97]. Более того, рост даже на 0,3 см в год все еще существенно превышает ожидаемые темпы роста аневризм корня и ВА, поэтому если такие темпы роста сохраняются в течение двух лет подряд, также рекомендуется протезирование аорты [44].
- Рекомендуется хирургическое вмешательство на корне и/или ВА в случае асимптомных пациентов с аневризмами корня и/или ВА максимальным диаметром ≥5,0 см при выполнении опытными хирургами в экспертном аортальном центре (см. Таблицу 4) [98,99].
ЕОК\РКО I B, АКК и ААC I B (УДД 4, УУР С)
Комментарии. Риск расслоения или разрыва аорты коррелирует с увеличением диаметра аневризмы [89], как и скорость роста аорты [95]. Таким образом, можно ожидать, что аневризмы размером ≥5,0 см будут иметь больший риск осложнений или быстрого роста, чем аневризмы меньшего размера. Действительно, в отчете Паручури и соавт. [100] при диаметре аорты от 4,0 см до 4,4 см риск расслоения аорты повышался в 89 раз по сравнению с контрольным диаметром аорты ≤3,4 см, а при диаметре аорты ≥4,5 см риск ее разрыва возрастал в 6300 раз. Следовательно, многие опытные хирурги в экспертном аортальном центре предпочитают оперировать пациентов при диаметре ВА от 5,0 см до 5,4 см выборочно [101] при условии, что хирургический риск пациента низок [102], и при этом демонстрируются отличные результаты [103]. Однако в настоящее время проводится проспективное многоцентровое РКИ пациентов с аневризмами восходящего отдела грудной аорты 5,0–5,4 см, где сравниваются результаты ранней плановой операции и продленного наблюдения [104], результаты которого могут подкрепить последующие рекомендации.
- Рекомендуется хирургическое вмешательство на корне и/или ВА пациентам с расширением корня и/или ВА максимальным диаметром ≥4,5 см, которым планируется выполнение пластики или протезирования трехстворчатого АК, при выполнении его опытными хирургами в экспертном аортальном центре (см. Таблицу 4) [99,105].
ЕОК\РКО Iia B, АКК и ААC Iia B (УДД 4, УУР C)
- Рекомендуется хирургическое вмешательство на корне и/или ВА пациентам с аневризмой корня и/или ВА максимальным диаметром ≥5,0 см, которым планируется пластика или протезирование трехстворчатого АК [99,105].
ЕОК\РКО Iia B, АКК и ААC Iia B (УДД 4, УУР С)
- Рекомендуется хирургическое вмешательство на корне и/или ВА пациентам с аневризмой корня и/или ВА максимальным диаметром ≥5,0 см, которым планируется выполнение кардиохирургического вмешательства по показаниям, отличным от пластики или протезирования АК [99,105].
ЕОК\РКО Iia B, АКК и ААC Iia B (УДД 4, УУР C)
Комментарии. Ранее в рекомендациях для пациентов с ДАК, перенесших протезирование или пластику АК в условиях искусственного кровообращения с сопутствующим расширением ВА максимальным диаметром ≥4,5 см, рекомендовалось одновременное протезирование ВА. С другой стороны, у пациентов, перенесших операцию на АК без одномоментного вмешательства на ВА (будь то для двустворчатого или трехстворчатого АК) было показано, что ассоциированные расширения ВА аневризмы прогрессируют медленно и характеризуются низкой частотой аортальных осложнений. Тем не менее, в ряде исследований также демонстрируется безопасность одновременного протезирования ВА при ее диаметре ≥4,5 см в случае выполнения опытными хирургами, работающими в экспертном аортальном центре [99,105]. Тем не менее, до тех пор, пока не появятся достоверные предикторы «аортальных» осложнений, в большинстве случаев пациентам, которым планируется выполнение пластики или протезирования АК при расширении ВА ≥5,0 см из-за более быстрой скорости роста и более высокого риска расслоения аорты, целесообразно рассматриваться одновременную операцию на ВА. Протезирование корня аорты должно планироваться индивидуально в зависимости от типа операции на АК (т.е. пластика АК с сохранением корня или без него в сравнении с протезированием клапана, реконструкция ВА с протезированием АК механическим или биологическим протезом), статуса пациента, его возраста и сопутствующих заболеваний. У пациентов, которым планируется кардиохирургическое вмешательство по показаниям, отличным вмешательства на АК, одновременное профилактическое протезирование ВА при ее диаметрее 5,0 см может быть целесообразным [26].
- Рекомендуется пациентам с синдромом Марфана и расширением корня и/или ВА ≥5,0 см протезирование корня и/или ВА [26,44].
ЕОК\РКО I B, АКК и ААC I B (УДД 5, УУР С)
Комментарии. У пациентов с синдромом Марфана и дилатацией корня аорты плановое протезирование ВА улучшает выживаемость. В знаковом исследовании 1995 г. было отмечено существенное увеличение продолжительности жизни среди пациентов с синдромом Марфана, которым было выполнено плановое протезирование ВА, по сравнению с контрольной группой пациентов, находившихся под наблюдением в предыдущие эпохи [106]. Хотя риск расслоения аорты у пациентов с синдромом Марфана, получающих необходимую медицинскую помощь и соответствующим образом модифицирующих свой образ жизни, относительно невысок, он повышается при расширении ВА >5,0 см [106]. При профилактическом протезировании аорты коррекции подвергается как корень, так и тубулярный отдел. Некоторые клиники выступают за одномоментное проведение реконструкции дуги аорты по типу hemiarch во время планового протезирования корня или тубулярной части ВА, однако убедительные данные в поддержку этого подхода отсутствуют.
- В отношении пациентов с синдромом Марфана, расширением корня и/или восходящего отдела аорты ≥4,5 см и признаками, ассоциированными с повышенным риском расслоения аорты (Таблица 5), резекция с протезированием корня и/или ВА аорты рекомендуется в том случае, если она выполняется опытными хирургами в экспертном центре [26,106,107].
ЕОК\РКО Iia B, АКК и ААC Iia B (УДД 4, УУР С)
Таблица 5.
Факторы повышенного риска осложнений со стороны аорты у пациентов с синдромом Марфана
|
■ Семейный анамнез расслоения аорты
■ Быстрый рост диаметра аорты (≥0,3 см/год)
■ Диффузное расширение корня и восходящего отдела аорты [108]
■ Выраженная извитость позвоночных артерий [109]
|
|---|
Комментарии. В одном исследовании, проводившемся на большой когорте пациентов с синдромом Марфана, около 20% перенесли плановую операцию при диаметре корня аорты <5,0 см [106,107,110]. Предикторы расслоения аорты и других неблагоприятных исходов со стороны аорты у пациентов с синдромом Марфана перечислены в таблице 7. Показаниями для более раннего вмешательства на ВА могут быть быстрый рост аорты (≥0,3 см/год), случаи расслоения аорты в семейном анамнезе, планирование беременности, тяжелая клапанная недостаточность, а также личные предпочтения пациента [44,107,111]. У большинства пациентов с синдромом Марфана темпы роста аорты относительно низки, однако скорость роста увеличивается вместе с размером аорты.
- Для пациентов с синдромом Марфана, у которых отношение максимальной площади поперечного сечения корня и/или ВА (см2) к росту (м) ≥10, протезирование корня и/или ВА рекомендуется в том случае, если она выполняется опытными хирургами в экспертном аортальном центре [93,106].
ЕОК\РКО Iia C, АКК и ААC Iia C (УДД 5, УУР С)
Комментарии. Диаметр аорты может колебаться в зависимости от возраста, пола, роста и размера тела. Частота ассоциированных с аортой осложнений, включая ее расслоение, растет по мере увеличения диаметра аорты, индексированного по росту или площади поверхности тела. Когда максимальная площадь поперечного сечения корня или восходящей части аорты в квадрате (см2), разделенная на рост пациента (м), составляет ≥10 см2/м, целесообразно выполнение профилактического протезирования корня аорты. В исследовании, где этот параметр использовался для принятия решений о проведении профилактических оперативных вмешательств, были продемонстрированы хорошие результаты.
- У пациентов с синдромом Марфана и подпороговым диаметром аорты, которые являются кандидатами для клапаносберегающего протезирования корня и ВА и имеют очень низкий хирургический риск, клапаносберегающее протезирование корня и ВА рекомендуется в том случае, если она выполняется опытными хирургами в экспертном аортальном центре [93,106].
ЕОК\РКО Iib B, АКК и ААC Iib B (УДД 4, УУР С)
Комментарии. Клапаносберегающее протезирование ВА ассоциировано с относительно невысоким хирургическим риском [106,107,110], если она выполняется опытными хирургами в составе специализированного аортального центра. Пациентам с аневризматическим расширением синусов Вальсальвы и тубулярного отдела ВА (в том числе ассоциированным с синдромами Марфана, Лойеса-Дитца, Элерса-Данло) рекомендуется выполнять протезирование корня и ВА с реимплантацией АК (операция David), а при невозможности – операцию Bentall – De Bono. Возможным вариантом является использование клапаносодержащего кондуита из ксеноперикарда. Главным критерием для выбора механического или биологического протеза клапана сердца является возраст пациента. Устойчивой тенденцией последнего времени является расширение использования биологических протезов клапанов сердца в когорте более молодых пациентов. Результаты операции Bentall – De Bono при АВА с сопутствующим трехстворчатым либо бикуспидальным АК значимо не различаются; госпитальная летальность сопоставима с операциями изолированного протезирования АК, а осложнения в отдаленном послеоперационном периоде нечасты. Одним из решений проблемы коррекции АН без использования искусственного клапана является операция Ross. В 1967 г. Donald Ross впервые выполнил аутотрансплантацию пульмонального клапана в аортальную позицию, что позволило по-новому взглянуть на возможности лечения пациентов с патологией корня аорты и АК. Аутографт легочной артерии демонстрирует прекрасные гемодинамические характеристики, функционирует в течение длительного времени, ассоциирован с низким риском тромбоэмболических и инфекционных осложнений. Недостатками операции Ross являются ее техническая сложность, узкие показания к выполнению, сложности с подбором оптимальных кандидатов для хирургического лечения данным методом. Кроме того, при аневризме корня аорты, распространяющейся дистальнее СТС, требуется протезирование измененного отдела аорты, что может быть выполнено с синтетическим либо ксеноперикардиальным протезом. При неизмененных (мягких, нефиброзированных и некальцинированных) створках трехстворчатого АК возможно выполнение клапаносберегающего вмешательства. Оптимальными кандидатами для подобного метода лечения являются больные с АН первого (расширение корня аорты в сочетании с морфологически нормальными створками) и второго (пролапс створок) типов. В 1992 г. T. David и соавт. опубликовали статью, описывающую протезирование корня аорты с сохранением АК методом его реимплантации в протез аорты. Отличительной чертой этого подхода является стабилизация корня аорты на всех уровнях (ФК АК, синусы Вальсальвы, СТС). Годом позже M. Sarsam и M. Yacoub описали клапаносохраняющее протезирование корня аорты с ремоделированием АК. От методики реимплантации T. David ремоделирование корня аорты принципиально отличается отсутствием стабилизации аорты на уровне ФК АК, что потенциально может приводить к рецидиву АН. Существует несколько модификаций протезирования корня аорты с сохранением АК: формирование псевдосинусов методом шовной пликации протеза аорты, использование протеза с синусами, сформированными фабричным способом, комбинация ремоделирования АК и стабилизации корня аорты путем имплантации полоски из тефлона либо опорного кольца. Одним из подвидов клапаносохраняющего протезирования корня аорты является методика Florida sleeve, предложенная P. Hess и соавт. в 2005 г. В отличие от операции David, при варианте Florida sleeve не производится иссечения синусов Вальсальвы – корень аорты имплантируется в протез целиком. Диаметр протеза подбирается таким образом, чтобы возможно было достичь восстановления нормальной запирательной функции АК. При необходимости в протез аорты реимплантируются одна либо обе коронарные артерии. Существует несколько модификаций способа Florida sleeve, и унифицированный и широко применяемый термин «реимплантация корня аорты» обозначает данный метод коррекции. Реимплантация корня аорты в протез демонстрирует стабильно хорошие клинические результаты в ближайшем послеоперационном периоде и может стать альтернативой классической операции David.
- Пороговое значение диаметра корня и ВА для ее профилактического протезирования у пациентов с синдромом Лойеса-Дитца рекомендуется определять согласно конкретному генетическому варианту, диаметру аорты, скоростью роста ее диаметра, экстрааортальными особенностям, с учетом семейного анамнеза, возраста и пола пациента, а также предпочтениям врача и пациента (таблица 6) [39,112].
ЕОК\РКО I C, АКК и ААC I C (УДД 4, УУР С)
Комментарии. Патогенные варианты в TGFBR1, TGFBR2, SMAD3, TGFB2 и TGFB3 приводят к синдрому Лойеса-Дитца или могут вызывать аортопатию с незначительными внешними признаками. Основная часть информации описывает патогенные варианты TGFBR1 и TGFBR2 [113]. Пациенты с вариантами TGFBR1 и TGFBR2 подвержены риску расслоения аорты типа А в более молодом возрасте и при меньшем диаметре корня аорты, чем при синдроме Марфана [113]. В соответствии с более ранними рекомендациями, эта агрессивная аортопатия, особенно выраженная у пациентов с тяжелыми черепно-лицевыми нарушениями, требовала протезирования аорты уже при диаметре корня аорты >4,0 см [113]. Вместе с тем, согласно Рекомендациям ACC/AHA 2010 г. по лечению заболеваний грудной аорты, операция рекомендуется только в тех случаях, когда диаметр аорты составляет от 4,2 см до 4,6 см (в зависимости от метода визуализации) [26]. Варианты синдрома Лойеса-Дитца, связанные с патологией гена SMAD3, могут приводить к расслоению аорты различного диаметра [26,112]. Риск расслоения аорты выше у женщин с патологическими вариантами TGFBR2, у которых отмечаются определенные внеаортальные признаки. Ограниченные данные позволяют предполагать отсутствие более высокого риска расслоения аорты при ее меньшем размере у пациентов с вариантами TGFB2 [114] или TGFB3 [115] . Существует заметная внутрисемейная изменчивость поражения аорты при синдроме Лойеса-Дитца. Общее решение о сроках проведения профилактической операции для предотвращения расслоения аорты типа А при синдроме Лойеса-Дитца должно учитывать конкретный генетический вариант, диаметр и скорость роста аорты, а также возраст, пол, размер тела, семейный анамнез, личные предпочтения пациента и опыт хирурга.
Таблица 6.
Пороговые значения диаметра восходящей аорты для профилактического протезирования корня и восходящей аорты при синдроме Лойеса-Дитца на основе генетического варианта
| КР | УД [ссылки] | Аллель | Наличие признаков высокого риска* | Диаметр аорты (см) | |
|---|---|---|---|---|---|
| 1 | C [116] | TGFBR1 | Нет | ≥4,5 | |
| 1 | C [116] | TGFBR2 | Нет | ≥4,5 | |
| 2b | C [116] | TGFBR1 | Да | ≥4,0 | |
| 2a | C [113,116] | TGFBR2 | Да | ≥4,0 | |
| 2a | C [112,117] | SMAD3 | - | ≥4,5† | |
| 2b | C [114,115,118] | TGFB2‡ | - | ≥4,5† | |
| 2b | C [115,118] | TGFB3 | - | ≥ 5,0† | |
|
* протезирование аорты может быть рекомендовано и при меньшем диаметре аорты в том случае, если синдром Лойеса-Дитца связан с патогенными вариантами генов TGFBR1 и TGFBR2, а также имеются признаки, ассоциированные с более высоким риском расслоения аорты, в том числе некоторые специфические патогенные варианты, женщины с TGFBR2 и небольшим размером тела, наличие тяжелых экстрааортальных симптомов (например, краниосиностоз, расщелина неба, гипертелоризм, расщепленный язычок, выраженная извитость артерий, расширение шрамов и полупрозрачная кожа), семейный анамнез расслоения аорты (особенно в молодом возрасте или при относительно небольшом диаметре аорты), скорость роста аорты >0,3 см/год.
†Семейный анамнез, возраст и скорость роста аорты также определяют пороговые значения хирургического вмешательства.
‡Патогенные варианты в гене TGFB2 отличаются от вариантов в гене TGFBR2.
КР – класс рекомендации; УД – уровень доказательности.
|
|||||
- У пациентов с синдромом Лойеса-Дитца, обусловленным патогенными вариантами TGFBR1, TGFBR2 или SMAD3, рекомендуется рассмотреть протезирование корня, ВА, дуги, нисходящей грудной или брюшной аорты, если диаметр аорты составляет ≥4,5 см (таблица 6) [119].
ЕОК\РКО Iib C, АКК и ААC Iib C (УДД 4, УУР C)
Комментарии. При синдроме Лойеса-Дитца могут возникать аневризмы дистального отдела ВА, дуги аорты, нисходящей грудной и брюшной аорты [110,112,120]. ВА также подлежит протезированию, поскольку после изолированного протезирования корня аорты могут сформироваться более дистально расположенная аневризма и расслоение ВА [110]. Существует мало информации о пороговых значениях диаметра аорты, при которых риск расслоения при синдроме Лойеса-Дитца оправдывает плановое протезирование неизмененной аорты в области дуги, нисходящей грудной или брюшной аорты. Совместное решение должно учитывать патогенный вариант, диаметр аорты, скорость роста аорты, возраст, пол, размер тела, предпочтения пациента, а также предпочтения хирурга и его хирургический опыт.
- У пациентов с сосудистым типом синдрома Элерса-Данло для принятия решения о протезировании аорты при ее расслоении рекомендуется участие бригады экспертного аортального центра и совместного принятия решений [121–123].
ЕОК\РКО Iib C, АКК и ААC Iib C (УДД 4, УУР C)
Комментарии. Протезирование аорты при сосудистом синдроме Элерса-Данло сопряжено с повышенным риском из-за хрупкости сосудов и связанными с этими осложнениями кровотечения. Быстрый рост аневризмы или расслоение аорты является показанием к лечению, но точные пороговые значения диаметра для принятия решения о профилактическом протезировании аорты и ее магистральных ветвей при сосудистом синдроме Элерса-Данлоса отсутствуют [121,122]. Следовательно, решение о протезировании аорты при ее аневризме и расслоении требует участия бригады экспертного аортального центра и совместного принятия решений [121].
- Протезирование корня и/или ВА рекомендуется пациентам с ДАК и диаметром корня аорты и/или восходящей аорты ≥5,5 см [46].
ЕОК\РКО I В, АКК и ААC I В (УДД 5, УУР C)
Комментарии. Пациенты с ДАК без значительного расширения аорты характеризуются низким риском расслоения аорты типа А, в то время как пациенты с ДАК и аневризматическим расширением корня и/или восходящего отдела имеют существенно более высокий риск расслоения аорты. Риск расслоения аорты с увеличением диаметра аорты возрастает, и существуют «точки отсчета» при достижении восходящим отделом аорты диаметров от >5,25 см до 5,75 см [41].
- Протезирование корня и/или ВА у пациентов с ДАК и отношением площади поперечного сечения корня и/или восходящего отдела аорты (см2) к росту (м) ≥10 см2/м рекомендуется, если она выполняется опытными хирургами в экспертном аортальном центре [103].
ЕОК\РКО Iia B, АКК и ААC Iia B (УДД 2, УУР В)
Комментарии. Индексирование максимального диаметра корня восходящего отдела аорты к росту позволяет прогнозировать риск расслоения аорты и, следовательно, определяет пороговые значения хирургического вмешательства [97,103]. Более того, при сравнении отдаленных результатов у пациентов с ДАК и расширением корня или восходящего отдела аорты выживаемость была значительно выше у пациентов с отношением площади поперечного сечения аорты (в см2) к росту (в метрах) ≥10, которым выполнялось плановое профилактическоеая протезирование аорты по сравнению с теми, у кого такая операция не проводилась [103].
- Протезирование корня и/или ВА рекомендуется пациентам с ДАК, диаметром корня и/или ВА от 5,0 см до 5,4 см и дополнительным фактором риска расслоения аорты (таблица 7), если операция выполняется опытными хирургами в экспертном аортальном центре [32,124].
ЕОК\РКО Iia B, АКК и ААC Iia B (УДД 5, УУР С)
Комментарии. Существуют дополнительные факторы риска расслоения аорты, влияющие на пороговые значения диаметра аорты, используемые при принятии решения о хирургическом вмешательстве на аорте у пациентов с ДАК. Семейный анамнез расслоения аорты [125] и быстрый рост аорты ≥0,3 см/год (при аналогичном измерении с использованием той же методики) являются факторами риска расслоения аорты. Сообщалось, что пациенты с ДАК и коарктацией аорты имеют повышенный риск расслоения аорты [124], хотя в недавнем отчете о 499 пациентах с ДАК (средний возраст – 40±16 лет), из которых у 24% также была коарктация аорты, не было различий в нежелательных явлениях со стороны аорты между пациентами с или без коарктации. От 10% до 20% пациентов с ДАК и аортопатией составляют лица с расширением корня аорты («фенотип корня аорты»), и они могут иметь более быстрый рост аорты и повышенный риск аортальных осложнений [62,126]. Поскольку замещение восходящего отдела аорты клапаносодержащим кондуитом либо клапаносберегающее протезирование является более сложным, чем экстравальвулярное протезирование, при оценке рисков и преимуществ при диаметре аорты <5,5 см часто используется совместное принятие решений.
Таблица 7.
Факторы риска связанные с повышенным риском развития расслоения аорты у пациентов с ДАК
| Семейный анамнез расслоения аорты |
|---|
| Скорость роста аорты ≥0,3 см/г |
| Коарктация аорты |
| Аортопатия «корень фенотип» |
- У пациентов с ДАК, которым выполняется пластика или протезирование аортального клапана в условиях искусственного кровообращения и у которых диаметр корня или восходящего отдела аорты превышает 4,5 см, рекомендуется одновременное протезирование корня и/или ВА, если оно выполняется опытными хирургами в экспертном аортальном центре [46].
ЕОК\РКО Iia B, АКК и ААC Iia B (УДД 5, УУР С)
Комментарии. У пациентов с ДАК и показаниями к протезированию или пластике аортального клапана в условиях искусственного кровообращения по поводу стеноза или регургитации в литературе ограничены данные относительно степени расширения аорты, требующей одномоментного протезирования корня и/или восходящего отдела аорты. В случае пациентов с большой ожидаемой продолжительностью жизни, низким хирургическим риском, «корневым» фенотипом расширения ВА и преобладающей АН пользу одновременного профилактического реконструктивного вмешательства на аорте обычно превышает риски осложнений. Наоборот, риски одновременного с вмешательством на АК протезирования корня и/или восходящего отдела аорты могут быть неоправданными в случае пациентов с более высоким хирургическим риском, особенно с аортальным стенозом и умеренным расширением ВА.
- Рекомендуется рассмотреть возможность протезирования корня и/или ВА пациентам с ДАК, диаметром корня и/или ВА 5,0–5,4 см без других факторов риска расслоения аорты (таблица 7) и низким хирургическим риском при выполнении вмешательства опытными хирургами в экспертном аортальном центре [44].
ЕОК\РКО Iib B, АКК и ААC Iib B (УДД 5, УУР С)
Комментарии. Имеются ограниченные данные о риске расслоения аорты у лиц с ДАК и диаметром аневризмы аорты от 5,0 до 5,4 см [99,127]. На сроки хирургического вмешательства могут повлиять характеристики пациента, особенно наличие ДАК и аневризмы аорты от 5,0 до 5,4 см низкого риска, и опыт хирурга [44].
- Рекомендуется рассмотреть возможность протезирования корня и/или ВА у пациентов с несиндромальной семейной аортопатией, диаметром корня и/или ВА 4,0–4,5 см в зависимости от выявленных патогенных мутаций и факторов риска (таблица 8) [44].
ЕОК\РКО Iib B, АКК и ААC Iib B (УДД 5, УУР С)
Комментарии. Патогенные варианты в ACTA2, PRKG1, MYH11, MYLK и LOX создают высокий проникающий риск развития заболеваний грудной аорты, наследуемых аутосомно-доминантным образом [35,128]. При этих НЗГА рекомендуется исходная ТТ-ЭхоКГ или, если восходящий отдел аорты недостаточно хорошо визуализируется при ТТ-ЭхоКГ, МРА аорты или КТА аорты; затем, если состояние стабильное, ежегодно проводится ТТ-ЭхоКГ. Дуга и нисходящая аорта могут расширяться, и в этом случае также выполняется ТТ-ЭхоКГ этих сегментов. Менее частая ТТ-ЭхоКГ может быть рассмотрена, когда аорта в норме, в зависимости от варианта гена, возраста и семейного анамнеза. Терапия бета-адреноблокаторами используется для уменьшения гемодинамической нагрузки на аорту.
Специфические особенности, связанные с каждым геном, включают пациентов с мутациями ACTA2, в основном имеющих расслоение аорты типа A или B, имеющих аневризмы, затрагивающие корень и восходящий отдел аорты, а подмножество патогенных вариантов предрасполагает к окклюзирующим атеросклеротическим поражениям. Скрининг на ишемическую болезнь сердца и цереброваскулярные заболевания проводится у лиц с определенными патогенными вариантами. Пациенты с мутациями ACTA2 могут страдать от расслоения аорты типа А при диаметре аорты <4,5 см, и рассмотрение хирургического вмешательства при диаметре <4,5 см обусловлено наличием дополнительных факторов риска [129]. НЗГА, взаимосвязанное с PRKGl, может проявляться в позднем подростковом возрасте расслоением аорты типа A или B без предшествующего увеличения аорты; у пациентов с мутациями MYH11 в основном наблюдаются расслоение аорты типа A или B (расслоение аорты типа A может наблюдаться при диаметре аорты <5,0 см), аневризмы, затрагивающие корень и восходящий отдел аорты, и они могут иметь заболевание периферических артерий [130]; пациенты с мутациями MYLK в возрасте >40 лет поступают с расслоением аорты типа А с небольшим предыдущим расширением аорты (средний диаметр аорты – 4,25 см) [131]; у пациентов с мутациями LOX могут наблюдаться аневризмы корня аорты, веретенообразное расширение корня и восходящей части аорты, которые могут распространяться на дугу аорты, или расслоение аорты типа А, и у них могут быть легкие системные признаки синдрома Марфана [35,128]. Решение относительно сроков реконструктивного вмешательства на аорте при НЗГА основывается на диаметре аорты, возрасте, семейном анамнезе и наличии или отсутствии дополнительных факторов риска.
Таблица 8.
Хирургические пороги для профилактического протезирования корня и/или восходящей аорты при несиндромном наследуемом заболевании грудной аорты, основанные на аллеле и дополнительных факторах риска расслоения аорты.
| КР* | УД* | Аллель | Факторы риска | Диаметр аорты (см) |
|---|---|---|---|---|
| 2a | Уровень C | ACTA2 | Нет | ≥4,5 |
| 2b | Уровень C | ACTA2 | Да† | ≥4,2 |
| 2b | Уровень C | PRKG1 | Нет | ≥4,2 |
| 2b | Уровень C | PRKG1 | Да† | ≥4,0† |
|
*У пациента наблюдаются факторы риска расслоения аорты (семейный анамнез расслоения аорты типа А с минимальным расширением аорты, скорость роста аорты ≥0,3 см/г) или значимое заболевание клапана, требующее хирургического вмешательства.
†Более раннее вмешательство на аорте может быть рассмотрено у пациентов с расслоением аорты типа А в семейном анамнезе при отсутствии или минимальной дилатации аорты, скорости роста аорты ≥0,3 см/г или по желанию пациента.
КР – класс рекомендации; УД – уровень доказательности.
|
||||
- Рекомендуется выполнение клапаносберегающего протезирования корня и ВА специально отобранным пациентам при условии выполнения в клиниках, имеющих опыт подобных вмешательств в случае, когда есть основания ожидать стойкий положительный результат от операции, для облегчения клинической симптоматики, профилактики осложнений и улучшения прогноза для жизни [28].
ЕОК\РКО I B, ЕАКТХ I В (УДД 4, УУР С)
Комментарии. При неизмененных (мягких, нефиброзированных и некальцинированных) створках трехстворчатого АК возможно выполнение клапаносберегающего вмешательства. Оптимальными кандидатами для подобного метода лечения являются больные с АН первого (расширение корня аорты в сочетании с морфологически нормальными створками) и второго (пролапс створок) типов [132]. Клапаносберегающее протезирование корня и восходящего отдела аорты демонстрирует стабильно хорошие клинические результаты в ближайшем послеоперационном периоде и может стать альтернативой классической операции David [133]. По данным клиник, имеющих большой опыт клапаносберегающих операций на ВА, дополнительные вмешательства на створках АК значимо не ухудшают непосредственные и отдаленные результаты операций. Клапаносберегающее протезирование ВА позволяет снизить риск ассоциированных с протезом АК отдаленных неблагоприятных событий и повысить качество жизни пациентов [133]. Дискутабельным остается клапаносохраняющее протезирование корня аорты при ДАК. В связи с исходной асимметрией створок адекватное восстановление планиметрии и функции АК представляет собой непростую задачу. Тем не менее, в ряде работ показаны хорошие ближайшие и отдаленные результаты клапаносберегающих операций на корне и ВА с сохранением ДАК, при этом свобода от реопераций в отдалённом периоде не отличается от таковой у пациентов с трехстворчатым АК. Следует отметить, что особое внимание нужно обращать на такие факторы риска неуспешной реконструкции корня аорты, как симметричность клапана, достаточная длина створки, наличие кальциноза. При выраженной асимметрии (межкомиссуральный угол менее 140О (по другим данным, менее 160О)), наличие рестрикции створок (высота створки от основания до свободного края <18 мм), кальцинатов створок, при удалении которого требуется использование перикардиального материала для восстановления целостности створки, моностворчатой анатомии АК следует отдать предпочтение протезированию корня и ВА клапаносодержащим кондуитом.
- Рекомендуется лигирование ушка левого предсердия открытым доступом одномоментно с протезированием грудного отдела аорты для профилактики осложнений у пациентов с постоянной, пароксизмальной либо персистирующей формой фибрилляции предсердий и высоким риском нарушения мозгового кровообращения и геморрагических осложнений, связанных с назначением антитромботической терапии [44,134].
ЕОК\РКО Iia B, ЕАКТХ Iia В (УДД 5, УУР С)
- Рекомендуется рассмотреть возможность выполнения РЧА одномоментно с протезированием аорты для профилактики осложнений у пациентов с постоянной, пароксизмальной либо персистирующей формой фибрилляции предсердий, с учетом риска потенциальных осложнений, пользы от отсутствия нарушений ритма сердца, и вероятности рецидива фибрилляции предсердий (размеры левого предсердия, давность фибрилляции предсердий, возраст, факторы риска сердечно-сосудистых заболеваний) [44,134].
ЕОК\РКО Iia B, ЕАКТХ Iia В (УДД 5, УУР С)
Комментарии. При протезировании грудного отдела аорты может обсуждаться одномоментная радиочастотная аблация (РЧА). Кроме РЧА, для снижения риска эмболических осложнений может обсуждаться лигирование ушка левого предсердия открытым доступом одномоментно с протезированием грудного отдела аорты.
- Рекомендуется коронарное шунтирование в условиях искусственного кровообращения пациентам с АГА и/или ТААА в случае протезирования грудной аорты и наличия стеноза(ов) коронарных артерий >70% (при стенозе ствола левой коронарной артерии >50%) для профилактики осложнений и улучшения прогноза для жизни [44,135].
ЕОК\РКО I C, ЕАКТХ I C (УДД 5, УУР С)
- Рекомендуется рассмотреть возможность коронарного шунтирования в условиях искусственного кровообращения пациентам с АГА и/или ТААА в случае протезирования грудной аорты и наличия стеноза(ов) коронарных артерий >50-70% для профилактики осложнений и улучшения прогноза для жизни [44,135].
ЕОК\РКО Iia C, ЕАКТХ Iia C (УДД 5, УУР С)
- Рекомендуется рассмотреть возможность выполнения малоинвазивного вмешательства с использованием мини-доступа у пациентов с АГА и/или ТААА при протезировании грудной аорты для профилактики осложнений и улучшения прогноза для жизни [131–133, 135, 137-144, 146- 150].
ЕОК\РКО Iia C (УДД 4, УУР С)
Комментарии. Выбор доступа при хирургическом лечении патологии восходящего отдела аорты зависит от необходимости выполнения сопутствующих вмешательств. При наличии показаний к одномоментной коррекции патологии атриовентрикулярных клапанов, хирургическому лечению фибрилляции предсердий, коронарному шунтированию в условиях искусственного кровообращения следует отдать предпочтение полному стернотомному доступу. В остальных случаях при вмешательстве на корне, восходящей и проксимальном сегменте дуги аорты необходимо рассмотреть возможность малоинвазивного подхода (верхняя частичная министернотомия, правосторонняя миниторакотомия). Выполнение малоинвазивного доступа дает преимущества в меньшей потребности гемо- и плазмотрансфузии в раннем послеоперационном периоде, сопровождается меньшей частотой инфекционных раневых осложнений, сопровождается более быстрым реабилитационным периодом, однако требует значимого опыта в хирургии аорты. Данный факт говорит о необходимости использования миниинвазивного подхода в экспертных центрах [136–152].
3. Эндоваскулярное (транскатетерное) лечение заболеваний восходящей аорты
- Рекомендуется применение транскатетерных вмешательств на аорте у пациентов с патологией корня и восходящей аорты в рамках научно-исследовательских проектов в научно-исследовательских институтах при наличии аортальной команды, соблюдении всех норм организации клинических испытаний с одобрением этического комитета и наличием добровольного информированного согласия пациента [153,154].
ЕОК\РКО Iia C (УДД 4, УУР С)
Комментарии. Патология аорты, затрагивающая корень и восходящий отдел, традиционно лечится с помощью открытых хирургических технологий. В настоящее время эндопротезирование аорты адаптировано и успешно применяется при лечении патологии нисходящей грудной и брюшной аорты, поэтому экстраполяция применения данной технологии на восходящую аорту представляется естественным эволюционным шагом [155]. Тем не менее, эндопротезирование нисходящего отдела аорты пока не нашло широкого применения в клинической практике, поскольку связано с целым рядом трудностей и ограничений. Наиболее частым принципиальным ограничением пока является отстутствие проксимальной площадки для фиксации стент-графта, которая обеспечит герметизацию и должна располагаться чуть дистальнее синотубулярного соединения. При этом дистальная фиксация должна размещаться до отхождения брахиоцефального ствола [154]. К техническим ограничениям также следует отнести высокую вероятность миграции и нецелевой имплантации стент-графта аортального эндоваскулярного универсального в данной зоне по сравнению с другими сегментами нисходящей грудной и брюшной аорты. Конструкционные особенности современных стент-графтов подразумевают размещение сверхжесткого проводника и частично стент-графта в полости левого желудочка, что существенно увеличивает операционные риски.
Несмотря на вышеуказанные проблемы, накопленный клинический опыт и техническое развитие за последнее десятилетие позволили использовать стент-графты аортальные эндоваскулярные универсальные для лечения патологии аорты типа А по Stanford, включая расслоения, аневризмы, псевдоаневризмы, пенетрирующие язвы и интрамуральные гематомы [154]. Первый случай лечения расслоения типа А, с использованием специального стент-графта (*не зарегистрирован в РФ) в 2000 году [156]. С тех пор другие авторы также регулярно публикуют свой единичный опыт эндопротезирования восходящего отдела аорты. При этом отмечается большое разнообразие показаний, методик и материалов, применяемых при эндопротезировании.
Четкие анатомические критерии отбора пациентов для эндопротезирования восходящей аорты еще не установлены к настоящему времени. При расслоении типа А по Stanford многие авторы рекомендуют расстояние ≥2 см между синотубулярным соединением и проксимальной фенестрацией, более ≥0,5 см между фенестрацией и брахиоцефальным стволом, а также отсутствие тампонады сердца и окклюзии ветвей аорты.
Следует упомянуть, что коронарное шунтирование в условиях искусственного кровообращения у пациентов после эндопротезирования восходящей аорты имеет существенное ограничение. Коронарное шунтирование в условиях искусственного кровообращения и без него у данных пациентов представляется технически невозможным при необходимости формирования проксимального анастомоза с аортой. В подобных клинических ситуациях использование маммаро-коронарного анастомоза будет являться разумной альтернативой.
В заключение важно отметить о постепенном накоплении данных, свидетельствующих о том, что применением транскатетерных вмешательств потенциально может распространяться на восходящий отдел аорты. Клинические преимущества этой технологии могут иметь решающее значение для пациентов с высоким хирургическим риском. Однако отсутствие специализированных стент-графтов для данного сегмента аорты по-прежнему является важным ограничением в распространении эндоваскулярной технологии. В свою очередь, отсутствие долгосрочных результатов пока не позволяет сделать заключение, что стент-графтыспособны выдерживать сложные анатомо-функциональные условия восходящей аорты в течение длительного времени.
4. Лечение аневризм дуги аорты
1. Показания к хирургическому лечению
- Плановое протезирование дуги аорты с реимплантацией брахиоцефальных артерий у пациентов с АГА и/или ТААА рекомендуется проводить в специализированных центрах, выполняющих открытые и эндоваскулярные операции на сердце и сосудах [97,157].
ЕОК\РКО I C, ЕАКТХ I C (УДД 4, УУР С)
- Протезирование дуги аорты с реимплантацией брахиоцефальных артерий рекомендуется в случае пациентов с изолированной аневризмой дуги аорты максимальным диаметром ≥55 мм [32,44].
ЕОК\РКО IIa C, ЕАКТХ IIa C (УДД 2, УУР А)
Комментарии. Протезирование дуги аорты с реимплантацией брахиоцефальных артерий должно рассматриваться у бессимптомных пациентов, имеющих аневризму дуги аорты дегенеративной природы с максимальным диаметром ≥55 мм или у больных с симптомами или признаками локальной компрессии соседних органов. Симптомы, обусловленные аневризмой дуги аорты (охриплость, возникающая в результате растяжения левого возвратного нерва, дисфагия, одышка и боль в груди или в спине, расслоение с мальперфузией) являются показаниями к оперативному вмешательству вне зависимости от размера аорты, за исключением случаев крайне ограниченной продолжительности жизни. Планирование оперативного вмешательства предполагает оценку риска, аналогичную оценке риска аневризмы или других заболеваний корня и ВА (Приложение А3).
- У пациентов с синдромом Марфана с аневризмой дуги аорты, нисходящей части грудной аорты или брюшной аорты диаметром ≥5,0 см (без расслоения) рекомендуется проведение протезирование дуги аорты с реимплантацией брахиоцефальных артерий [158].
ЕОК\РКО IIa B, АКК и ААC IIa B (УДД 3, УУР В)
Комментарии. Несмотря на редкость, сегменты аорты, расположенные дистальнее корня и тубулярной части восходящей аорты, могут расширяться при синдроме Марфана, и чаще это происходит после планового протезирования аорты или после предыдущего расслоения аорты с вовлечением этих сегментов. У пациентов с приемлемым риском операции или с большой ожидаемой продолжительностью жизни хирургическое вмешательство при аневризме с вовлечением дуги, нисходящей грудной или брюшной аорты целесообразно при пороговом диаметре аорты ≥5,0 см и с учетом от возраста пациента, скорости роста аорты, семейного анамнеза и хирургического риска. Расслоение аорты типа В встречается примерно у 10% пациентов с синдромом Марфана, часто при отсутствии значительного расширения нисходящей аорты, и иногда связано с предшествующим плановым протезированием корня аорты [158], предыдущим расслоением аорты в другом месте [99] или беременностью [110].
- У пациентов с аневризмой корня и/или ВА в случае распространения аневризмы корня и/или ВА на проксимальный отдел дуги аорты рекомендуется расширить объем хирургического вмешательства до протезирования аорты с протезированием малой кривизны дуги аорты (процедура «полудуга» - hemiarch) [159].
ЕОК\РКО IIa C, ЕАКТХ IIa C (УДД 4, УУР С)
2. Открытое хирургическое лечение
- У пациентов с аневризмой корня и/или ВА в случае распространения аневризмы дуги аорты на проксимальный отдел нисходящей грудной аорты рекомендуется рассмотреть возможность выполнения протезирования дуги аорты с реимплантацией брахиоцефальных артерий с оставлением «хобота слона» [160].
ЕОК\РКО IIb C, ЕАКТХ IIb C (УДД 5, УУР С)
Комментарии. При хирургическом лечении аневризмы дуги аорты изолированное «открытое» протезирование дуги аорты с реимплантацией брахиоцефальных артерий без использования классической техники «хобота слона» (операция Борста) или «замороженного (фиксированного) хобота слона» на сегодняшний день используется нечасто. Процедура «хобот слона» является методом выбора в случаях, когда реконструкция гибридным устройством по типу «замороженный хобот слона» остается дискутабельной. Классическая операция Борста может применяться при распространенных аневризмах с вовлечением нескольких сегментов грудной аорты, а также при очень маленьком диаметре истинного просвета аорты вследствие риска возникновения синдрома «псевдоарктации».
- В случае планируемой «открытой» хирургической коррекции аневризмы у пациентов с аневризмой дуги аорты рекомендуется проведение операции «хобот слона» (операция Борста) или «замороженный (фиксированный) хобот слона», если аневризматическое расширение распространяется на проксимальный отдел нисходящей грудной аорты [32,161,162].
ЕОК\РКО IIa С (УДД 4, УУР С)
- В ходе «открытой» операции протезирования дуги аорты с реимплантацией брахиоцефальных артерий у пациентов с аневризмой дуги аорты рекомендуется мониторинг АД, измеряемого в обеих лучевых артериях и одной из бедренных артерий [163].
ЕОК\РКО IIa C, ЕАКТХ IIa C (УДД 4, УУР С)
Комментарии. Необходимость временного поочередного пережатия брахиоцефальных артерий в ходе протезирования дуги аорты требует двустороннего инвазивного мониторинга артериального давления в лучевых артериях. Это позволяет контролировать уровень перфузионного давления верхней половины туловища в режиме реального времени в ходе всей операции. Во время согревания пациента после циркуляторного ареста и в течение нескольких часов после прекращения искусственного кровообращения давление в лучевой артерии нередко ниже реального уровня центрального давления в аорте: разница может достигать до 20 мм рт.ст. по среднему артериальному давлению и до 35 мм рт.ст. по систолическому артериальному давлению [163]. Поэтому дополнительный мониторинг давления в бедренной артерии позволяет оценить эффективность дистальной перфузии до и после реконструктивного вмешательства на дуге аорты, а также оценить градиент давления после операции.
- Рекомендуется проведение антеградной церебральной перфузии в период циркуляторного ареста через правую подключичную/подмышечную артерию или брахиоцефальный ствол у пациентов с аневризмой дуги аорты при «открытой» хирургической коррекции аневризмы дуги аорты [164–167].
ЕОК\РКО I C (УДД 4, УУР С)
Комментарии. На сегодняшний день внедрены эффективные и безопасные методы канюляции и антеградной церебральной перфузии. Предпочтительной зоной артериальной канюляции для проведения антеградной церебральной перфузии является правая подключичная/подмышечная артерии или брахиоцефальный ствол [165]. Предпочтение следует отдавать использованию дополнительного протеза кровеносного сосуда синтетического для артериальной канюляции [164] , но выбор следует делать с учетом опыта хирургической бригады и клиники [167]. При этом не рекомендуется проведение перфузии через бедренную артерию в ходе «открытого» протезирования дуги аорты с реимплантацией брахиоцефальных сосудов с использованием техники «хобот слона», так как это может привести к инвагинации протеза аорты и окклюзии ветвей дуги аорты.
- В ходе «открытого» протезирования дуги аорты с реимплантацией брахиоцефальных артерий у пациентов с аневризмой дуги аорты рекомендуется проведение церебральной оксиметрии с помощью церебральной спектроскопии в ближней инфракрасной области (NIRS) [163,168].
ЕОК\РКО I В, ЕАКТХ I B (УДД 5, УУР С)
Комментарии. Церебральная спектроскопия в ближней инфракрасной области (near‐infrared cerebral spectroscopy – NIRS) может быть использована для непрерывного мониторинга баланса поступления и потребления кислорода в поверхностных областях коры головного мозга, т.е. с помощью бифронтальной церебральной оксиметрии [168]. На сегодняшний день NIRS вытеснила из ежедневной практики инвазивную оксиметрию в яремной луковице [168]. Имеются указания на прямую связь между интраоперационной церебральной десатурацией с развитием послеоперационной неврологической симптоматики. Вместе с тем, этот метод имеет свои ограничения. Так, интраоперационные бифронтальные региональные показатели насыщения церебральной оксиметрии (rSO2) не исключают фокальную ишемию головного мозга, которая может возникнуть за пределами поля зрения NIRS. Транскраниальный допплеровский мониторинг представляет собой еще один вариант мониторинга изменений церебральной перфузии, но он более сложен в отношении настройки и применения во время операции на дуге аорты. Совместное применение этих двух методов повышает достоверность и точность оценки адекватности перфузии головного мозга.
- В ходе протезирования дуги аорты по методике «хобот слона» (операция Борста) у пациентов с аневризмой дуги аорты рекомендуется помещать «свободный» сегмент протеза аорты в зону 4 нисходящей грудной аорты с целью формирования адекватной зоны фиксации при последующем «открытом» протезировании грудной или торакоабдоминальной аорты либо при транскатетерном вмешательстве [166].
ЕОК\РКО I C, ЕАКТХ I C (УДД 5, УУР С)
Комментарии. Реконструкция дуги аорты по типу «хобот слона» является целесообразна, когда планируется последующая операция на торакоабдоминальном отделе аорты. Кроме того, «хобот слона» может служить хорошей посадочной зоной для проведения транскатетерного вмешательства на аорте в случае, если «свободный» сегмент сосудистого протеза в нисходящем отделе аорты имеет достаточную длину. С учетом этого следует низвести протез аорты в нисходящую аорту как можно дальше, чтобы она была доступна в зоне 4, что позволит сформировать адекватную зону фиксации при последующем «открытом» протезировании грудной аорты либо при транскатетерном вмешательстве [166]. Дистальный анастомоз сосудистого протеза с аортой может находиться не только в зоне 3, но в зоне 2 для облегчения его формирования, а также для контроля кровотечения и снижения риска травматизации левого возвратного нерва. С целью надежного укрепления линии шва рекомендуется использование двойного обвивного шва либо полоски ткани или фетра [169–172].
- При протезировании дуги аорты с реимплантацией брахиоцефальных артерий рекомендуется проведение расширенного мониторинга температуры тела пациента (носоглоточная, тимпаническая, пузырная ректальная) с целью обеспечения адекватного охлаждения головного мозга и профилактики повреждения центральной нервной системы, защиты внутренних органов, позвоночника, нижних конечностей и спинного мозга [166,168].
ЕОК\РКО I В, ЕАКТХ I B (УДД 5, УУР C)
Комментарии. Во время операции при охлаждении и согревании пациента необходимо учитывать формирующиеся температурные градиенты между различными участками, где измеряется температура тела (носоглотка, барабанная перепонка, мочевой пузырь или прямая кишка) [166,168]. Для обеспечения адекватного охлаждения головного мозга и профилактики повреждения центральной нервной системы, обусловленной церебральной гипертермией в ходе время согревания, рекомендуется контролировать температуру носоглотки и барабанной перепонки. Вместе с тем, температура мочевого пузыря наиболее релевантно отражает степень защиты внутренних органов, позвоночника, нижних конечностей и спинного мозга.
3. Гибридное протезирование дуги аорты (методика «замороженный (фиксированный) хобот слона»)
- Протезирование дуги аорты с реимплантацией брахиоцефальных артерий рекомендуется у пациентов с аневризмами дуги с полным или частичным ее вовлечением в расширение и распространением последнего на проксимальный отдел нисходящей аорты, предпочтительнее с использованием техники «замороженный (фиксированный) хобот слона» или, как минимум, «классический хобот слона» (операция Борста) с целью упрощения лечения данной категории больных на втором этапе хирургического лечения [166,173–178].
ЕОК\РКО IIa В, ЕАКТХ IIa B (УДД 4, УУР С)
Комментарии. Методики «классический хобота слона» (операция Борста) и «замороженный (фиксированный) хобот слона» при лечении больных с аневризмой дуги аорты характеризуются сопоставимой эффективностью и безопасностью в раннем и среднесрочном послеоперационном периодах. Вместе с тем, гибридное протезирование дуги аорты с реимплантацией брахиоцефальных артерий представляется оптимальной альтернативой, призванной упростить лечение данной категории пациентов.
- У пациентов с аневризмой дуги аорты при протезировании дуги аорты с реимплантацией брахиоцефальных артерий рекомендуется применение упреждающей стратегии в отношении потенциальных дистальных аортальных реинтервенций с целью избежания многоэтапного открытого и/или эндоваскулярного вмешательства [172,175,178].
ЕОК\РКО I C, ЕАКТХ I C (УДД 4, УУР С)
Комментарии. При полной изоляции патологически измененных отделов аорты одним или несколькими стент-графтами в будущем, эндоваскулярным для нисходящего отдела грудной аорты как правило, не требуются дополнительные вмешательства на аорте. Пациенты с резидуально измененной аортой за пределами области реконструкции (например, техникой «замороженный хобот слона») остаются в группе риска отрицательного ремоделирования аорты и дистальной аортальной реинтервенции. Необходимо изначально тщательно планировать объем реконструкции аорты, диаметры и длину гибридного устройства при выполнении реконструкции по методу «замороженного хобота слона» с учетом возможного проведения дополнительной эндоваскулярной процедуры, чтобы избежать чрезмерного несоответствия и многокомпонентного вторичного эндоваскулярного вмешательства.
- Гибридное протезирование дуги аорты с реимплантацией брахиоцефальных артерий рекомендуется у пациентов с протяженным аневризматическим поражением дуги аорты, грудного и торакоабдоминального отдела аорты, особенно если ожидается потребность во втором этапе хирургического лечения патологии грудного отдела аорты, подразумевающем «открытое» протезирование или транскатетерную изоляцию аневризмы аорты [166,173,174,179,180].
ЕОК\РКО IIa C, ЕАКТХ IIa C (УДД 4, УУР С)
Комментарии. В случае повторного «открытого» вмешательства на дистальных отделах аорты, учитывая тонкую текстуру ткани стент-графта, необходимо надежно захватывать стенку аорты в шов при формировании проксимального аортального анастомоза. В случае эндоваскулярной реинтервенции ранее имплантированный стент-графт позволяет использовать его в качестве безопасной посадочной зоны для имплантируемых дистальнее стент-графтов
- При протезировании грудного отдела аорты по методике «замороженный (фиксированный) хобот слона» у пациентов с АГА и/или ТААА рекомендуется располагать дистальный аортальный анастомоз в зоне 2 (проксимальнее устья левой подключичной артерии) с целью упрощения его формирования и облегчения контроля кровотечения [174,176,181].
ЕОК\РКО IIa C, ЕАКТХ IIa C (УДД 4, УУР С)
Комментарии. Учитывая герметизирующие свойства стент-графта при эндопротезировании нисходящей грудной аорты, смещение зоны проксимальной шовной фиксации стент-графта из зоны 3 в зону 2 облегчает формирование дистального анастомоза гибридного устройства с аортой, сокращает продолжительность циркуляторного ареста нижней части тела, а также уменьшает риск повреждения левого возвратного нерва [176,181,182]. Кроме того, герметизация линии анастомоза обеспечивает надежный гемостаз и позволяет использовать эту технологию даже у пациентов с хрупкой аортальной стенкой [183]. Комбинация хирургического шва и эндоваскулярной герметизации позволяет надежно исключить из кровотока полость аневризмы аорты без чрезмерного увеличения размера имплантируемого стент-графта [174] .
- В ситуациях отсроченного ишемического повреждения спинного мозга у пациентов с АГА и/или ТААА рекомендуется избирательное использование дренажа спинномозговой жидкости с целью избежания ишемического повреждения спинного мозга [184,185].
ЕОК\РКО I C, ЕАКТХ I C (УДД 4, УУР С)
Комментарии. Гибридное лечение патологии грудной аорты потенциально может поставить скомпрометировать коллатеральную сосудистую сеть и, следовательно, нарушить перфузию спинного мозга. Известными причинами ишемического повреждения спинного мозга являются периоперационная артериальная гипотензия, предыдущие вмешательства по поводу аневризмы брюшной аорты и значимое нарушение кровоснабжения в бассейне левой подключичной артерии [186]. На сегодняшний день недостаточно доказательств для рекомендации использования профилактического мониторинга давления и дренажа спинномозговой жидкости в ходе гибридного лечения аневризмы грудного отдела аорты [184]. Вместе с тем, использование мониторинга давления и дренажа спинномозговой жидкости может рассматриваться на основе индивидуальной оценки риска ишемии спинного мозга [184]. В ситуациях отсроченного ишемического повреждения спинного мозга рекомендуется избирательное использование дренажа [185]. Осуществлять дренаж всегда следует медленно до значений давления спинномозговой жидкости 10-12 мм рт.ст. в отсутствие признаков ишемического повреждения спинного мозга и до 8-10 мм рт. ст. при их наличии. Объем дренирования не должен превышать 40 мл/4 ч [187]. Следует избегать болюсного забора ликвора, при котором возрастает риск (~1%) внутричерепной гипотензии с последующим повреждением головного мозга (субдуральная гематома, внутричерепное кровоизлияние).
4. Эндоваскулярное лечение
- Комбинированное гибридное вмешательство на дуге аорты и транскатетерная изоляция патологии аорты в зоне 0 вторым этапом рекомендуется пациентам с соответствующими анатомическими характеристиками, которым нежелательно выполнять «открытую» хирургическую реконструкцию [188].
ЕОК\РКО IIb B, АКК и ААC IIb B (УДД 4, УУР C)
Комментарии. Открытые хирургические и эндоваскулярные процедуры можно выполнять одновременно или поэтапно в соответствии с необходимостью и/или предпочтениями врача («аортальной» команды) [180,188,189].
- Комбинированное гибридное вмешательство на дуге аорты c транскатетерной изоляцией патологии аорты в зонах 1 и 2 рекомендуется пациентам с соответствующими анатомическими характеристиками [190].
ЕОК\РКО IIa B, АКК и ААC IIa B (УДД 4, УУР С)
- Транскатетерная изоляция патологии дуги аорты не рекомендуется пациентам с аневризмой дуги аорты если длина проксимальной и/или дистальной зоны имплантации менее 25 мм или максимальный диаметр стент-графта более 38 мм [191].
ЕОК\РКО III B, АКК и ААC III B (УДД 4, УУР С)
- Комбинированное гибридное вмешательство на дуге аорты и транскатетерная изоляция не рекомендуется в случае пациентов с заболеваниями соединительной ткани, если проксимальная зона имплантации стент-графта находится в нативной части аорты [191].
ЕОК\РКО III C, АКК и ААC III C (УДД 4, УУР С)
- При гибридном вмешательстве у пациентов с аневризмой дуги аорты рекомендуется сохранять кровоток по всем брахиоцефальным артериям с целью снижения риска ишемических неврологических осложнений со стороны головного и спинного мозга [192].
ЕОК\РКО IIa B, АКК и ААC IIa B (УДД 5, УУР С)
- Пациентам с аневризмой дуги аорты рекомендуется проводить гибридные вмешательства на дуге аорты в клинических центрах, имеющих опыт проведения открытых и эндоваскулярных операций на аорте, и проводящих достаточное их количество [166].
ЕОК\РКО I C, АКК и ААC I C (УДД 5, УУР С)
Комментарии. Рекомендуется выполнять переключение (дебранчинг) магистральных сосудов в области дуги аорты и транскатетерную изоляцию патологии аорты только в клиниказ, имеющих опыт их проведения и выполняющих достаточное количество соответствующих операций, как открытых переключений магистральных артерий дуги аорты, так и транскатетерных. К последним относятся: фенестрации «on-table» с техникой частичного расправления протеза и последующей обратной загрузкой, либо «in situ» c применением специального баллонного катетера с пункционной иглой. Транскатетерная изоляция патологии дуги аорты достаточно широко применяется в качестве второго этапа хирургического лечения расслоения аорты типа А после ранее выполненного открытого протезирования восходящего отдела аорты. Наличие сосудистого протеза в восходящем отделе аорты создает оптимальную проксимальную посадочную зону для стент-графта более чем у 70% пациентов и полностью исключает риск ретроградной диссекции аорты. Альтернативными подходами к лечению патологий дуги аорты являются эндоваскулярные методики, в которых используются методики «дымоход», «перископ» и «сэндвич» (совместно называемые «параллельные стент-графты». Также в качестве параллельного стент-графта может быть использован стент-графт для периферической артерии [160,166,180,189].
5. Редкие заболевания грудной аорты
1. Тромб в дуге аорты
- Пациентам с флотирующими тромбами в дуге аорты рекомендуется протезирование дуги аорты либо пластика аорты заплатой, и/или тромбэндартерэктомия [193].
ЕОК\РКО IIa C, ЕАКТХ IIa C (УДД 4, УУР С)
- Пациентам с обширными неподвижными (пристеночными) тромбами в дуге аорты рекомендуется проведение протезирование аорты или пластики аорты заплатой, и/или тромбэндартерэктомии [193].
ЕОК\РКО IIb C, ЕАКТХ IIb C (УДД 4, УУР С)
Комментарии. Наличие тромба в дуге аорты представляет риск опасного для жизни инсульта и периферической эмболии [193]. Следует учитывать морфологическую форму тромба, различая подвижный (т.е. флотирующий, выпячивающийся в просвет) и неподвижный (пристеночный) тромбы [193]. Пациентам с клиническими проявлениями тромба дуги аорты (например, ишемией вследствие эмболизации: инсультом, ишемией конечностей, висцеральной или почечной ишемией) часто требуется неотложное вмешательство. У бессимптомных пациентов тромб чаще всего обнаруживается случайно при ТТ-ЭхоКГ или КТА аорты, проводимых по другому поводу. Среди пациентов с тромбом в дуге аорты высоко распространены гиперкоагуляционные состояния и гематологические нарушения, в том числе на фоне злокачественных новообразований. Эти состояния необходимо учитывать при разработке индивидуальной стратегии лечения. Перед операцией у пациентов с клиническими проявлениями тромба дуги аорты необходимо исключить другие возможные источники эмболизации. Основным методом лечения тромбоза дуги аорты является протезирование аорты. Возможные варианты лечения включают консервативное (антикоагулянтная и тромболитическая терапия), тромбэндартерэктомию из аорты и/или локальная резекция аорты с протезированием места прикрепления тромба, переключение магистральных артерий дуги аорты и эндоваскулярная реконструкция дуги аорты. В случае выбора консервативного метода лечения для оценки лизиса тромба должна быть рекомендована ТТ-ЭхоКГ и/или КТА аорты.
2. Аберрантная левая подключичная артерия и дивертикул Коммереля
- Пациентам с бессимптомной аневризмой устья подключичной артерии (≥3,0 см) и/или дивертикуле Коммереля (≥5,5 см) рекомендуется протезирование вовлеченного сегмента аорты [194].
ЕОК\РКО IIa C, ЕАКТХ IIa C (УДД 4, УУР С)
- При наличии клинических проявлений пациентам с аберрантной левой подключичной артерией и/или дивертикулом Коммереля рекомендуется проведение протезирования вовлеченного сегмента аорты [8].
ЕОК\РКО I C, ЕАКТХ I C (УДД 4, УУР С)
Комментарии. Встречаемость аберрантной левой подключичной артерии (a. lusoria) и дивертикула Коммереля составляет 0,4–2,3% [194]. Анатомически аберрантная левая подключичная артерия проходит в 80% случаев позади от пищевода, в 15% — между пищеводом и трахеей, и в 5% — кпереди от трахеи [194]. Пациенты с клиническими проявлениями, включающими дисфагию, одышку, кашель, боль в груди, аспирацию или рецидивирующие легочные инфекции, составляют лишь 5% от общего числа. Дивертикул Коммереля сопровождается высоким риском разрыва и тромбоэмболии с летальностью более 50%. Частота расслоений аорты при этом заболевании достигает 50% [195].
Вопрос об определении фактического размера дивертикула Коммереля остается дискутабельным. Наиболее актуальной методикой измерения дивертикула Коммереля является подход, когда оценивается расстояние от стенки, прилегающей к трахее, до противоположной стенки аорты или от верхушки дивертикула до противоположной стенки аорты. Диаметр подключичной артерии измеряют в зонее ее устья.
3. Инфекции
- У пациентов при инфекциях нативной дуги аорты, сосудистого протеза или стент-графта рекомендуется удаление инфицированного сосуда или протезного материала, проведения локальной санации и реконструкции аорты in situ с использованием биологического материала или экстра-анатомическое шунтирование в зависимости от опыта клиники [196–198].
ЕОК\РКО IIa C, ЕАКТХ IIa C (УДД 4, УУР C)
Комментарии. Инфекционное поражение нативной аорты или, чаще, протеза либо стент-графта ассоциировано с высокой частотой осложнений и смертностью. Подобный диагноз должен опираться на клинические данные, результаты лучевой диагностики и лабораторные результаты [197]. Позитронно-эмиссионная томография (ПЭТ) с 18F-фтордезоксиглюкозой или сцинтиграфия в режиме «все тело» для выявления воспалительных очагов, используемые в диагностических целях, позволяют отличить общее воспаление (например, послеоперационное) от инфекционного. Важно исключать инфекцию во всех случаях мешотчатых АГА, так как около 93% микотических аневризм имеют такой вид при КТА аорты [198].
- Только в качестве промежуточного или окончательного этапа лечения у неоперабельных пациентов с инфекциями нативной дуги аорты, протеза или стент-графта рекомендуется рассмотреть возможность проведения транскатетерной изоляции патологии дуги аорты [199].
ЕОК\РКО IIa C, ЕАКТХ IIa C (УДД 4, УУР C)
Комментарии. Транскатетерное вмешательство на грудной аорте может быть эффективно при временном закрытии разорванной инфицированной АГА или опасного для жизни свища, соединяющего аорту с полым органом (например, аорто-пищеводного и аорто-бронхиального). Для пациентов с такой клинической картиной характерны высокая частота осложнений и смертности независимо от последующей стратегии ведения [200]. Транскатетерная изоляция (дуги или нисходящей аорты) может обеспечить более стойкую реконструкцию, если эндопротез предварительно обработать антибактериальными препаратами системного действия, но данных по значимо различающимся клиническим сценариям мало [199].
4. Аортит дуги аорты
- У пациентов с активным гигантоклеточным артериитом (ГКА) или артериитом Такаясу для начальной медикаментозной терапии рекомендуется назначать высокие дозы глюкокортикоидов [201].
ЕОК\РКО I B, ЕАКТХ I B (УДД 2, УУР А)
- У пациентов с активным ГКА или артериитом Такаясу эффективность лечения рекомендуется периодически оценивать клинические проявления, а также проводить мониторинг сывороточных маркеров воспаления (исследование уровня С-реактивного белка в сыворотке крови и скорости оседания эритроцитов), визуализирующие исследования аорты (МРА аорты, КТА аорты или ПЭТ-КТ аорты с 18F-фтордезоксиглюкозой для выявления воспалительных очагов) [201,202].
ЕОК\РКО I C, ЕАКТХ I C (УДД 2, УУР А)
- У пациентов с ГКА или артериитом Такаясу, находящихся в стадии ремиссии, рекомендуется плановая эндоваскулярная операция на аорте или протезирование аорты для лечения осложнений со стороны аорты и ее ветвей [203].
ЕОК\РКО IIa C, ЕАКТХ IIa C (УДД 5, УУР С)
Комментарии. Гигантоклеточный артериит — системный васкулит, характеризующийся очаговым трансмуральным гранулематозным воспалением с появлением гигантских клеток, утолщением интимы и инфильтратами из мононуклеаров, нейтрофилов и эозинофилов [203]. Ключевая характеристика гранулематозного артериита — сегментарное распространение воспалительных инфильтратов, состоящих из Т-клеток и гистиоцитов. Разрыв аорты и/или ее ветвей, по-видимому, представляет собой редкое осложнение, однако истинную распространенность этих случаев трудно оценить, т. к. «немой» ГКА обычно невозможно выявить клинически и/или рентгенологически. ГКА может проявляться внезапным появлением височной головной боли, недомоганием с признаками синдрома системной воспалительной реакции неизвестного происхождения, слабостью плечевого и тазобедренного пояса и потерей массы тела. ГКА ранее был известен как болезнь Хортона и представлял собой сегментарное васкулитное поражение височных артерий. КТА аорты, а также МРА и/или ПЭТ-КТ аорты для выявления воспалительных очагов позволяют выявить дополнительное васкулитное поражение аорты, локализующееся преимущественно в области дуги аорты и НГА, а также частично в брюшном или подвздошном отделах аорты, в том числе проявляющиеся на ранних этапах. Чтобы не пропустить сопутствующий васкулит крупных сосудов, целесообразно провести диагностическую оценку возможного поражения аорты [202]. Лечение глюкокортикостероидами следует приостановить до окончания процедуры, если это оправдано с медицинской точки зрения: через 3–5 дней после начала лечения глюкокортикостероидами сигнал от стенок сосудов в основном исчезает, из-за чего результаты обследования расценивают как отрицательные, несмотря на продолжающееся воспаление [202].
В случае височного артериита немедленное начало лечения оправдано из-за риска дальнейшего васкулитного поражения сосудистой сети, питающей зрительный нерв, с возможностью быстрого развития преимущественно необратимой слепоты. Глюкокортикостероиды являются основой лечения. Терапевтические стратегии, целенаправленно воздействующие на интерлейкин-6 и его специфический рецептор, оказались полезны для индукции и поддержания ремиссии или целевого объема, по используемым значениям исходного давления и единицам измерения (см вод. ст. или мм рт. ст.), а также по максимальному количеству жидкости, которое разрешается дренировать (в час, за 4 часа или в день), чтобы избежать внутричерепного кровотечения или дислокации головного мозга. Другие дополнительные методы снижения риска повреждения спинного мозга включают плановое использование глюкокортикостероидов системного действия, отказ от опиоидных анальгетиков длительного действия и стратегии контроля уровня гемоглобина, которые различны в разных клинических центрах [203]. Часто используемый целевой уровень гемоглобина составляет > 100 г/л, особенно у пациентов с симптомами повреждения спинного мозга. Протоколы неотложной помощи включают повышение системного артериального давления до > 100 мм рт.ст., снижение давления СМЖ (часто до 5 мм рт.ст. или 7 мм рт.ст.), гемотрансфузия до достижения целевого уровня гемоглобина >100 г/л и использование глюкокортикостероидов [201].
Болезнь Такаясу (некротизирующий аортит) обычно проявляется в виде панаортита гранулематозным воспалением и стенозом дуги аорты и ее крупных ветвей. Первоначально воспаление локализуется вокруг vasa vasorum, а также в средней и наружной оболочках сосуда и распространяется на интиму. Быстрое и тяжелое воспаление может привести к утрате гладкомышечных клеток и может привести к развитию синдрома дуги аорты, сегментарного стеноза, окклюзии и аневризмы. При этом заболевании выражены дезинтеграция эластических волокон, реактивный фиброз и увеличение объема основного вещества в интиме. Гистологическим признаком аортита Такаясу является многоочаговый ламинарный некроз средней оболочки сосуда с каймой из макрофагов и редких гигантских клеток. Бессимптомная или скрытая болезнь Такаясу характеризуется плотным фиброзным утолщением наружной оболочки сосуда и выраженным фиброзом средней оболочки с утратой нормальной пластинчатой структуры. Проявления артериита Такаясу редко вызывают подозрение, что в основе лежит иммуноопосредованное воспаление сосудов; скорее эти симптомы похожи на повреждение сосудов после развития стеноза. Поскольку при данном заболевании в основном поражаются супрааортальные ветви дуги аорты, у пациентов часто отмечают отсутствие пульса на верхних конечностях, синдром перемежающейся хромоты верхних конечностей, головокружение или подозрение на церебральную ишемию. Диагностические процедуры включают те же методы, что и алгоритм диагностики ГКА, при этом дуплексное сканирование брахиоцефальных артерий с цветным допплеровским картированием кровотока можно использовать для оценки супрааортальных ветвей, а КТА аорты, МРА аорты и ПЭТ-КТ аорты для выявления воспалительных очагов — для скрининга поражений других частей аорты. Активные поражения могут быть обнаружены в фазе серологического воспаления. Начальная терапия включает использование глюкокортикоидов с целью индукции ремиссии. Неспецифическая иммуносупрессия, целенаправленно воздействующая на вовлеченные подгруппы лимфоцитов, эмпирически доказала свою эффективность. Терапевтические стратегии, целенаправленно воздействующие на фактор некроза опухоли-альфа и интерлейкин-6, дают положительные результаты и могут быть в дальнейшем адаптированы для новых методов лечения. В поздней фазе заболевания, когда возникают стенозы с клиническими проявлениями, ведущие к снижению перфузии в соответствующем сегменте артериального русла, может быть показано протезирование артерий или стентирование. Транслюминальная баллонная ангиопластика ветвей аорты имеет ограниченный эффект из-за воспалительного характера заболевания, так как довольно часто развивается ранний рестеноз [203].
6. Хирургическое лечение аневризм нисходящей грудной и торакоабдоминальной аорты
1. Показания к хирургическому лечению аневризм нисходящей аорты
1. Показания к хирургическому лечению аневризм нисходящей аорты
- У пациентов, имеющих показания для вмешательств на нисходящей грудной аорте при подходящих анатомических условиях транскатетерную изоляцию рекомендуется рассматривать прежде «открытого» хирургического протезирования грудного отдела аорты [204].
ЕОК\РКО I A, АКК и ААС I A (УДД 4, УУР С)
Комментарии. Эндоваскулярное (транскатетерное) вмешательство на нисходящей грудной аорте является более безопасной техникой в сравнении с «открытой» хирургической операцией, характеризуется значительно более низкой частотой осложнений и летальностью, а также более коротким периодом госпитализации [205].
- У пациентов с неосложненными аневризмами нисходящего отдела грудной аорты транскатетерное вмешательство на аорте рекомендуется при диаметре аневризмы ≥5,5 см, «открытое» хирургическое протезирование грудного отдела аорты – при диаметре ≥6,0 см [89].
ЕОК\РКО I B, АКК и ААС I B (УДД 4, УУР С)
Комментарии. При диаметре аорты >6,0 см частота ассоциированных с аортой неблагоприятных событий (разрыв, расслоение) существенно повышается [89].
- У пациентов с неосложненными аневризмами нисходящей грудной аорты и факторами риска разрыва аорты рекомендуется рассмотреть возможность выполнения транскатетерной изоляции аневризмы аорты при диаметре последней <5,5 см [89].
ЕОК\РКО IIb B, АКК и ААС IIb B (УДД 4, УУР С)
Комментарии. Ранее были выявлены признаки высокого риска разрыва, что позволяет при соблюдении этих критериев выполнять резекцию аневризмы грудного отдела аорты с протезированием при меньшем пороговом диаметре. Признаки, включающие быстрый рост диаметра аорты (≥0,5 см/год), симптомные аневризмы, сопутствующие моногенные заболевания соединительной ткани или НЗГА [89], мешковидная аневризма, женский пол [89] и инфицированная аневризма связаны с более высокой склонностью к разрыву [32,206].
- У пациентов с повышенным риском периоперационных осложнений и смертности рекомендуется рассмотреть возможность повышения порогового диаметра аорты, когда принимается решение о хирургическом протезировании либо эндоваскулярной изоляции аневризмы грудного отдела аорты [207].
ЕОК\РКО IIb B, АКК и ААС IIb B (УДД 4, УУР С)
Комментарии. У пациентов, рассматриваемых как кандидаты для «открытого» протезирования грудного отдела аорты или транскатетерного вмешательства на аорте, установлены клинические признаки высокого риска, ассоциированные с неблагоприятными исходами хирургических вмешательств. При резекции аневризмы грудного отдела аорты с протезированием пожилой возраст [208], предоперационная почечная недостаточность 3-й стадии или выше, хроническая обструктивная болезнь легких и значение объема форсированного выдоха за 1 секунду ≤50%, а также инсульт в анамнезе были ассоциированы [208] с повышенным риском смерти и(или) периоперационных осложнений. Коморбидность, заболевания легких, а также сложность процедуры являются предикторами неблагоприятных исходов[209]. Особое внимание к этим факторам риска при рассмотрении любого из методов позволит надлежащим образом учитывать соотношение рисков и пользы при принятии решения о целесообразности и методе вмешательства.
2. Эндоваскулярное лечение аневризм нисходящей аорты
- При проведении планового эндоваскулярного вмешательства на аорте по поводу аневризмы нисходящей грудной аорты, когда перекрытие левой подключичной артерии (ЛПкА) необходимо для достаточной герметизации стент-графта, рекомендуется на дооперационном этапе либо интраоперационно провести одномоментное сонно-подключичное шунтирование или эндоваскулярную реваскуляризацию левой подключичной артерии (интраоперационная фенестрация стент-графта), что снижает частоту осложнений, продолжительности госпитализации и летальности [210].
ЕОК\РКО I B, АКК и ААС I B (УДД 4, УУР С)
- Пациентам с аневризмой нисходящей аорты рекомендуется провести сонно-подключичное шунтирование или эндоваскулярную реваскуляризацию ЛПкА, если перекрытие питающей артерии ставит под угрозу перфузию жизненно важных структур [32].
ЕОК\РКО I B, АКК и ААС I B (УДД 5, УУР С)
Комментарии. Выделяют четыре основных проблемы, связанных с перекрытием ЛПкА: ишемия спинного мозга, острое нарушение мозгового кровообращения, ишемия верхней конечности и вертебробазилярная ишемия. Исследования, а также многочисленные сообщения о самодельных или модифицированных врачами эндопротезах, вероятно, изменят подход к сонно-подключичному шунтированию или эндоваскулярной реваскуляризации ЛПКлА в будущем [22,166,180,185,189,206,211].
- Рекомендовано проводить открытую реконструкцию чревного ствола (ЧС) или стентирование висцеральных артерий (ЧС) при высоком риске ишемии в его бассейне (ЧС) (отсутствие визуализации коллатеральных ветвей ЧС при КТА брюшной аорты или селективной ангиографии ВБА) перед транскатетерным вмешательством на аорте у пациентов с аневризмой нисходящей аорты [208,209].
ЕОК\РКО I B, АКК и ААС I B (УДД 4, УУР С)
Комментарии. Рекомендовано проводить динамическое наблюдение в отношении признаков и симптомов мезентериальной и печеночной ишемии в ранние сроки после перекрытия ЧС [208,209].
- У пациентов с аневризмой нисходящей аорты при применении открытого доступа к бедренным артериям рекомендуется использовать поперечные или косые разрезы в рамках транскатетерных вмешательств на аорте [8].
ЕОК\РКО I B, АКК и ААС I B (УДД 5, УУР С)
Комментарии. Традиционный «открытый» доступ во время транскатетерного вмешательства на аорте включает обнажение общей бедренной артерии на уровне паховой связки. Хирургический доступ, осуществляемый посредством ограниченного поперечного (косого) разреза (под общей или местной анестезией), имеет преимущество из-за прямого контроля артерии и свободного выбора идеального места пункции [8,212].
- При чрескожном доступе у пациентов с аневризмой нисходящей аорты рекомендовано использовать ультразвуковой контроль, чтобы повысить успешность процедуры и снизить частоту серьезных осложнений [8,212].
ЕОК\РКО I B, АКК и ААС I B (УДД 5, УУР С)
- Чрескожный доступ рекомендуется при соответствии пациента определенным анатомическим критериям. (например, касающимся диаметра общей бедренной артерии, отсутствия кальциноза передней стенки артерии) [8,212].
ЕОК\РКО I B, АКК и ААС I B (УДД 5, УУР С)
- Рекомендовано использование синтетических сосудистых протезов или прямой чрескожный подвздошно-аортальный доступ для введения стент-графта, чтобы облегчить доступ у пациентов с небольшими (относительно выбранного размера устройства), извитыми или кальцифицированными подвздошными артериями [8,213].
ЕОК\РКО I B, АКК и ААС I B (УДД 4, УУР С)
Комментарии. Предполагается, что использование синтетических сосудистых протезов, облегчающих доступ при транскатетерных вмешательствах на аорте, в некоторых случаях являются приемлемой альтернативой открытому подвздошному доступу, но данных об их использовании мало, как и сведений о долгосрочном наблюдении [8,212,213].
- Рекомендовано пациентам с разрывом аневризмы нисходящей аорты выполнять транскатетерное вмешательство на аорте вместо «открытого» хирургического протезирования грудной аорты для лечения разрыва нисходящей грудной аорты в тех случаях, когда это анатомически возможно [214].
ЕОК\РКО I B, АКК и ААС I B (УДД 4, УУР С)
Комментарии. Летальность после открытой резекции аневризмы грудного отдела аорты с протезированием разорванной аневризмы нисходящей грудной аорты высока и приближается 100%. В многоцентровом исследовании острой аортальной патологии смертность составила 15% в группе разрыва аорты, и эти данные выгодно отличались от результатов открытого протезирования грудного отдела аорты, согласно которым летальность составила 45%. Обзор базы данных Medicare с 2004 по 2007 гг. показал, что доля пациентов с разрывом аневризмы ниходящей аорты, которым проводились транскатетерные вмешательства, увеличилась с 17% в 2004 г. до 49% в 2007 .у (всего пролечено 1033 пациента) со значительным снижением летальности с 45% при «открытмом» протезировании грудной аорты и до 24 % при эндоваскулярной коррекции (P < 0,001) [214].
3. Показания для открытого хирургического вмешательства на торакоабдоминальной аорте
- У пациентов с неосложненными ТААА дегенеративного генеза протезирование аорты рекомендуется при диаметре аневризмы ≥6,0 см [215].
ЕОК\РКО I B, АКК и ААС I B (УДД 4, УУР С)
Комментарии. При диаметрах ТААА >6,0 см частота аортальных осложнений начинает значимо увеличиваться, а 5-летняя выживаемость снижается. При подобных диаметрах риск неблагоприятных аортальных осложнений колеблется от 9,3% [216] до 19% [215], что в 2–4 раза превышает медиану операционной летальности при открытом протезировании ТААА. У пациентов с некоторыми сопутствующими заболеваниями, значительно увеличивающими риск осложнений при «открытом» протезировании аорты с реконструкцией ветвей ТААА (например, хроническая обструктивная болезнь легких, пожилой возраст, нарушение функции почек или дисфункция левого желудочка, диагностированные до операции), приемлемым можно считать продолжение наблюдения за пациентами с диаметром ТААА >6,0 см либо направление их на транскатетерное вмешательство.
- У пациентов с неосложненной ТААА дегенеративного генеза протезирование аорты с возможной реконструкцией ее ветвей рекомендуется при диаметре аневризмы ≥5,5 см в случае, если ее проводят опытные хирурги из экспертного аортального центра [217].
ЕОК\РКО IIa B, АКК и ААС IIa B (УДД 4, УУР С)
Комментарии. В экспертных аортальных центрах, несмотря на сопутствующие заболевания пациентов, при лечении патологии ТААА можно достичь отличных результатов при тщательной предоперационной подготовке и технически безупречных оперативных приемах. В ходе многофакторного анализа было установлено, что у пациентов с фракцией выброса левого желудочка <40%, которым проводилось протезированием ТААА с реконструкцией ветвей аорты, не отмечались увеличение периоперационной смертности (ОШ=0,28; 95%-й ДИ=0,02–4,14; P=0,58) и частота неблагопритяных исходов в отдаленном послеоперационном периоде (ОШ=0,55; 95%-й ДИ=0,17–1,80; P=0,23) по сравнению с лицами с более высокой фракцией выброса левого желудочка [218]. Подобным образом среди тщательно отобранных 80-летних лиц, кому проводилась открытая аневризмэктомия с протезированием и пластикой ветвей ТААА, операционная смертность оказалась сопоставимой с таковой среди пациентов <80 лет (5,2% и 5,7%; P=0,852) [218].
- У пациентов с неосложненной ТААА дегенеративного генеза при наличии признаков повышенного риска ее разрыва протезирование аорты с возможной реконструкцией ее ветвей рекомендуется при диаметре аневризмы <5,5 см [217].
ЕОК\РКО IIa B, АКК и ААС IIa B (УДД 4, УУР С)
Комментарии. Определенные клинические факторы, связанные с повышенным риском разрыва ТААА, могут побуждать к проведению открытого или транскатетерного вмешательства при диаметре аневризмы ниже стандартных «хирургических» пороговых значений. Если у пациента с неосложненной ТААА, за которым наблюдают при помощи методов визуализации, подтвержден быстрый рост аневризмы (≥0,5 см в год), ему следует протезирование аорты с реконструкцией ветвей независимо от абсолютного диаметра аорты [219]. Симптомы увеличения размеров ТААА и не обусловленные иной патологией являются предвестниками разрыва и также свидетельствуют о необходимости вмешательства. У пациентов с «вторичной» симптоматикой на фоне пенетрирующих атеросклеротических язв (ПАЯ) или мешотчатых аневризм также увеличивается риск разрыва, и их необходимо направить на хирургическое лечение независимо от абсолютного диаметра.
4. Открытое и эндоваскулярное лечение ТААА
На данный момент отсутствуют РКИ, где проводилось бы сравнение непосредственных или отдаленных результатов «открытого» или эндоваскулярного лечения ТААА. Большинство эндоваскулярных вмешательств, проводящихся в настоящее время, осуществляются с применением специальных стент-графтов. В экспертных аортальных центрах были получены отличные результаты протезирования аорты с реконструкцией ее ветвей. В крупнейшей серии, опубликованной на сегодняшний день, операционная летальность среди 3309 пациентов, которым было проведено «открытое» протезирование аорты с реконструкцией ее ветвей при ТААА, периоперационная летальность составила 7,5% даже с учетом того, что более 1000 пациентов, которым операции проводились по поводу аневризм II типа по Сrawford; риск повторных вмешательств на аорте при этом был низким [220]. В других крупных центрах при «открытых» хирургических операциях были получены сопоставимые результаты. В одном центре госпитальная летальность среди 783 пациентов составила 5,6% при низком риске повреждения спинного мозга (2,0%), а послеоперационный гемодиализ потребовался лишь в 5,2% случаев [218]. Еще в одной клинике, где использовался глубокий гипотермический циркуляторный арест, операционная смертность составила 7%, риск повреждения спинного мозга – <4%, а риск послеоперационного гемодиализа – 2% [221].
- Пациентам с ТААА при разрыве аневризмы рекомендуется протезирование аорты [222].
ЕОК\РКО I B, АКК и ААС I B (УДД 4, УУР С)
Комментарии. В случае разрыва ТААА «открытое» протезирование аорты с вмешательством на ее ветвях могут проводить хирурги из экспертных аортальных центров, при этом смертность находится на низком уровне. В рамках серии из 100 последовательно оперированных пациентов с разрывами ТААА были продемонстрированы операционная летальность 14% частота повреждения спинного мозга – 5% [223]. Хотя в выборке исследования было множество случаев сопутствующих заболеваний, но единственным фактором риска, сохранившим значимость после отбора подобного по вероятности, остался «шок» на момент госпитализации. Кроме того, 5-летняя предполагаемая (актуарная) выживаемость составила 47,5%. Центры, имеющие опыт комплексной эндоваскулярной хирургии, могут воспользоваться данной методикой. В национальном регистре, куда вошли 140 случаев разорвавшихся аневризм нисходящего отдела грудной аорты, операционная смертность (10%) была удовлетворительной, однако частота инсультов (14,7%), повреждения спинного мозга (9,6%) и необходимость повторного вмешательства в течение 30 дней (19,7%) оказались весьма высокими. Спустя 17 месяцев (медиана наблюдения) 5-летняя актуарная выживаемость составила 31,9%. Эти результаты оказались сопоставимыми с таковыми в регистре медицинских изделий [222,223]. Хотя комплексная эндоваскулярная хирургия неосложненных ТААА оказалась многообещающей в опытных руках и в отдельных центрах, на фоне разрыва ТААА эндоваскулярным вмешательствам могут мешать нестабильное состояние пациента и потребность в специальных протезах (на производство которых может уходить несколько недель). Кроме того, размер большинства серий наблюдения за случаями эндопротезирования на фоне разрывов ТААА невелик; для определения роли эндоваскулярной хирургии разрывов аорты потребуется оценка результатов более крупных когорт пациентов с более длительным периодом наблюдения.
- Если пациенту с разрывом ТААА требуется оперативное вмешательство, в центрах с приемлемым опытом проведения эндоваскулярных вмешательств и доступными соответствующими видами стент-графтов (браншированные и фенестрированные стент-графты) рекомендуется рассмотреть возможность эндоваскулярной реконструкции аорты при условии стабильной гемодинамики у пациента [216].
ЕОК\РКО IIb C, АКК и ААС IIb C (УДД 4, УУР C)
Комментарии. При эндоваскулярной реконструкции ТААА необходимо последовательно осуществить успешную имплантацию стент-графта, реконструкцию висцеральных артерий и добиться быстрой остановки кровотечения. В связи с этим возможности вмешательств с использованием готовых стент-графтов аортальных эндоваскулярных универсальных у гемодинамически нестабильных пациентов с разрывами аневризм ограничены. Вместе с тем, среди пациентов более высокого риска, у которых выявлены симптомные аневризмы или аневризмы с локальными разрывами, эндоваскулярное вмешательство с использованием либо готового, либо модифицированного (фенестрированного) стент-графта можно провести при условии стабильной гемодинамики и подходящей анатомии. Кельбель и соавт. [224] продемонстрировали госпитальную летальность 15% при лечении симптомных ТААА и 30% в случае разрыва ТААА методом эндопротезирования аорты несколькими стент-графтами аортальными эндоваскулярными универсальными.
- У пациентов с синдромом Марфана, синдромом Лойеса-Дитца или сосудистым типом синдрома Элерса-Данло и неосложненной ТААА при наличии показаний к вмешательству рекомендуется «открытое» хирургическое вмешательство, а не транскатетерное при диаметре аорты 4,5 – 5 см [217].
ЕОК\РКО I C, АКК и ААС I C (УДД 4, УУР С)
Комментарии. У пациентов с подтвержденными заболеваниями соединительной ткани (синдром Марфана, синдром Лойеса-Дитца, сосудистый синдром Элерса-Данло) или подозрением на них рекомендуется «открытое» хирургическое вмешательство. Госпитальная летальность в этом случае ниже, чем в общей популяции при «открытых» вмешательствах на ТААА, равно как и частота тяжелых осложнений (инсульт, повреждение спинного мозга). Следует отметить низкую частоту повторных вмешательств на аорте и отличную отдаленную выживаемость. Напротив, результаты комплексного эндоваскулярного лечения ТААА у пациентов с заболеваниями соединительной ткани недостаточны. В небольшом исследовании среди 17 пациентов, которым было проведено эндопротезирование аорты, не было зарегистрировано смертельных случаев, техническая эффективность оказалась равной 100%, а в рамках среднего периода наблюдения в 34 месяца потребовалось лишь 1 повторное вмешательство [216]. Эндоваскулярное лечение может считаться приемлемым у пациентов при неэффективности предшествующего открытого хирургического вмешательства, а также у пациентов из группы высокого риска. Эндоваскулярное лечение также можно использовать в качестве «переходного» перед «открытой» хирургической коррекцией у пациентов с нестабильной гемодинамикой.
- У пациентов с неосложненной ТААА дегенеративного генеза и подходящими анатомическими условиями в центрах с опытом проведения эндоваскулярных вмешательств и доступом к соответствующим видам стент-графтов (браншированные и фенестрированные) рекомендуется рассмотреть возможность эндоваскулярного лечения с имплантацией стент-графта [32,219].
ЕОК\РКО IIb C, АКК и ААС IIb C (УДД 4, УУР C)
Комментарии. Транскатетерная изоляция ТААА выглядит многообещающим методом лечения в рамках серии исследований медицинских изделий, освобожденных от ограничений, связанных с отсутствием регистрации, которые спонсировались медицинскими работниками в одном или нескольких центрах. При условии проведения опытными хирургами в большинстве случаев достигается технический успех на уровне 92–99,6%, а периоперационная смертность остается на низком уровне. По результатам контрольных визуализирующих исследовваний спустя 1 год функционирование магистральных ветвей аорты также было удовлетворительным (96–98%). Спустя 3 года смертность, обусловленная аортальными осложнениями, составила всего 9%, а общая выживаемость – 57% [219].
5. Методы защиты органов и обеспечение операций
5. Методы защиты органов и обеспечение операций
- При выполнении открытого вмешательства по поводу ТААА у пациентов с высоким риском повреждения спинного мозга рекомендуется провести установку спинномозгового дренажа для снижения частоты транзиторного повреждения спинного мозга, стойкого повреждения спинного мозга или обоих состояний [220,221,223,225,226].
ЕОК\РКО I A, АКК и ААС I A (УДД 2, УУР В)
Комментарии. Хирургия ТААА остается чрезвычайно трудной задачей независимо от ее типа (открытая или эндоваскулярная). Повреждение спинного мозга, сопровождающееся парапарезом или параплегией, может быть транзиторным или стойким; оно чрезвычайно отрицательно влияет на кратко- и долгосрочную выживаемость, а также на качество жизни после вмешательства. Предложено множество методик для уменьшения частоты данного значимого осложнения. Интраоперационная профилактика повреждения спинного мозга может включать глубокий гипотермический циркуляторный арест, шунтирование левых отделов сердца, применение методики сегментарного пережатия аорты (clamp-and-sew). Положительные результаты были получены при использовании каждого из этих подходов. Нейромониторинг статуса спинного мозга интраоперационно и в ближайшем послеоперационном периоде широко не применяется, однако его польза доказана в рамках конкретных учреждений. Использование спинномозгового дренажа остается единственной методикой, которая доказанно снижает частоту развития периоперационного повреждения спинного мозга. В РКИ, где анализировалась частота повреждений спинного мозга у пациентов при хирургическом лечении ТААА высокого риска (степени распространенности аневризмы I и II), использование спинномозгового дренажа сопровождалось значимым снижением частоты повреждений спинного мозга по сравнению с лицами, перенесшими протезирование аорты без дренирования спинномозговой жидкости. За последнее десятилетие появился ряд центров, где выполняют протезирование аорты без дренирования спинномозговой жидкости. Кроме того, дренаж спинальной жидкости может принести пользу при эндоваскулярном лечении с распространенным перекрытием нисходящего отдела грудной аорты, а также при наличии в анамнезе указаний на протезирование инфраренальной брюшной аорты (данные из нерандомизированных исследований).
- При отсроченной дисфункции спинного мозга после «открытого» или эндоваскулярного вмешательства у пациентов с ТААА рекомендуется предпринять своевременные меры для оптимизации перфузии спинного мозга и снижения интратекального давления (таблица 9) [220,221,227–229].
ЕОК\РКО I B, АКК и ААС I B (УДД 2, УУР В)
Комментарий. У пациентов, которым проводится открытое протезирование ТААА с реконструкцией ветвей аорты, на отсроченную параплегию может приходиться почти 60% всех случаев неврологических осложнений со стороны спинного мозга. Несмотря на нормальные результаты неврологического осмотра сразу после вмешательства, отсроченные осложнения могут развиваться в любой момент в течение первых 2-х недель после вмешательства. Зарегистрированная частота отсроченного повреждения спинного мозга составляет около 5%, что почти в 2 раза превышает частоту дефицитов, распознаваемых тотчас после вмешательства. Отсроченный дефицит обычно развивается вследствие гемодинамических нарушений (фибрилляция предсердий, гиповолемия, кровоизлияние, инфекция); в его лечении могут помочь агрессивные меры, направленные на оптимизацию перфузии спинного мозга.
Таблица 9.
Меры по оптимизации перфузии спинного мозга и органов-мишеней
Меры по оптимизации перфузии спинного мозга и органов-мишеней
| Кардиоверсия при тахиаритмиях |
|---|
| Дренаж спинномозговой жидкости |
| Увеличение среднего артериального давления до уровня >100 мм рт.ст. |
| Гемотрансфузии до достижения уровня гемоглобина >100 г/л |
| Восполнение объема циркулирующей крови |
Использование дренажа спинномозговой жидкости позволяет немедленно снизить интратекальное давление и улучшить перфузионное давление в сосудах спинного мозга (этот показатель соответствует среднему артериальному давлению за вычетом давления спинномозговой жидкости) [184]. У значительной доли (57%) пациентов с поздним дефицитом отмечается улучшение неврологической симптоматики, а у 17% дефицит разрешается полностью [230]. Операционная летальность у лиц с персистирующим повреждением спинного мозга фактически в 3 раза выше по сравнению с лицами с восстановившейся функцией (38% и 13% соответственно; P<0,001). Кроме того, 5-летняя выживаемость также значимо падает (с 75% среди лиц с восстановлением функций до 28% у пациентов без такового; P<0,001) [230].
- При проведении «открытого» протезирования ТААА с вмешательством на магистральных ветвях аорты, включая почечные артерии, перфузия почечных и висцеральных артерий кровью или растворами, влияющих на водно-электролитный баланс рекомендуется для обеспечения эффективной защиты от повреждения [32,228,231,232].
ЕОК\РКО I A, АКК и ААС I A (УДД 5, УУР С)
Комментарии. Нарушение функции почек после «открытого» протезирования ТААА с вмешательством на магистральных ветвях аорты, определяют как увеличение уровня креатинина вдвое или потребность в проведении гемодиализа. При развитии этого значимого осложнения страдает непосредственная и отдаленная выживаемость, а частота дыхательной недостаточности, повреждений спинного мозга и сердечно-сосудистых осложнений нарастает. Для определения методов, позволяющих снизить частоту послеоперационного нарушения функции почек, были проведены 2 РКИ со сравнением перфузии холодным раствором, влияющим на водно-электролитный баланс, и перфузатом с нормотермической, а в последующем холодной кровью. По сравнению с доставкой нормотермической крови в почечные артерии напрямую из контура, шунтирующего левые отделы сердца, доставка холодного перфузата с кристаллоидами в почечные артерии в ходе открытой реконструкции ТААА привела к 3-кратному снижению частоты развития послеоперационного нарушения функции почек [228]. В последующем оказалось, что перфузия почечных артерий охлажденной кровью через окклюзионные или перфузионные катетеры обеспечивает уровень защиты, сопоставимый с таковым при перфузии холодными растворами, влияющими на водно-электролитный баланс[227,228]. Результаты второго РКИ позволили хирургам воспользоваться двумя вариантами защиты почек при необходимости реконструкции почечных артерий в ходе «открытого» протезирования ТААА с реконструкцией ее ветвей. Несмотря на полученные данные, отечественные работы показывают удовлетворительные результаты использования нормотермической перфузии висцеральных органов, в том числе с использованием контроля давления в перфузионных катетерах [179,230,231,233,234].
- У пациентов, которым проводят открытую или эндоваскулярную реконструкцию ТААА на фоне ишемии органов-мишеней или значимых стенозов висцеральных либо почечных артерий атеросклеротического генеза, рекомендуется провести дополнительную реваскуляризацию чревного ствола, и/или почечных артерий, и/или пластику верхней брыжеечной артерии [228,235].
ЕОК\РКО I B, АКК и ААС I B (УДД 4, УУР С)
Комментарий. У пациентов со стенозами почечных или висцеральных артерий, а также вторичной обструкцией устьев последних на фоне хронических или острых расслоений может нарушаться перфузия органов-мишеней. Улучшить перфузию чревного ствола, верхней брыжеечной артерии и почечных артерий можно при помощи шунтирования, эндартерэктомии, а также ангиопластикой висцеральных ветвей брюшного отдела аорты комбинированным доступом, открытым и эндоваскулярным доступом. Стратегия реваскуляризации с достижением проходимости целевых сосудов описана на небольших сериях пациентов, которым проводилась открытая реконструкция ТААА с переключением ветвей, а также эндопротезирование ТААА.
- У пациентов с ТААА при изолированном или сочетанном с реконструкцией ветвей протезировании грудной аорты для обеспечения дистальной органной перфузии рекомендуется использование левожелудочкового обхода или вспомогательного искусственного кровообращения в зависимости от опыта клиники [228].
ЕОК\РКО IIa B, ЕАКТХ IIa B (УДД 4, УУР С)
Комментарии. К используемым приемам при протезировании грудной аорты относятся использование левожелудочкового обхода, частичный обход, глубокий гипотермический циркуляторный арест. Простой метод "пережать и шить" может быть нецелесообразным, поскольку при увеличении времени пережатия аорты более 30 минут значительно возрастает риск послеоперационного неврологического дефицита, мезентериальной и почечной ишемии[236]. В противоположность этому, методика левожелудочкового обхода обеспечивает дистальную перфузию аорты (с помощью центрифужного насоса) во время пережатия аорты, когда кровь забирается через канюлю в ушке левого предсердия или, предпочтительнее, левых легочных венах, а возврат крови осуществляется через канюлю, установленную в дистальном отделе аорты или бедренной артерии. Похожей методикой является частичный обход, когда процедура искусственного кровообращения обеспечивается путем канюляции бедренных артерии и вены и обеспечивает перфузию и оксигенацию органов дистальнее аортального зажима [235]. В отличие от левожелудочкового обхода, из-за использования стандартного контура аппарата искусственного кровообращения этот метод требует полной гепаринизации, однако при необходимости позволяет использовать методику циркуляторного ареста.
6. Эндоваскулярное лечение аневризм торакоабдоминальной аорты
- Если рассматривается возможность эндопротезирования (ТААА) с использованием браншированного стент-графта у пациентов с ТААА, рекомендуется провести КТА аорты (всех сегментов), включая подвздошные и бедренные артерии с получением тонких срезов (≤ 0,75 мм), включая КТ шеи с внутривенным болюсным контрастированием (КТА брахиоцефальных артерий) для оценки анатомических характеристик позвоночных артерий [217].
ЕОК\РКО I A, АКК и ААС I A (УДД 4, УУР С)
- Для точного планирования и выполнения эндопротезирования у пациентов с ТААА рекомендуется рутинно использовать программное обеспечение для трехмерной реконструкции аорты по средней линии [217].
ЕОК\РКО I B, АКК и ААС I B (УДД 4, УУР С)
Комментарии. Диаметр аорты и длину целевой проксимальной зоны имплантации стент-графта следует указывать в миллиметрах, чтобы облегчить выбор основного модуля стент-графта и оценку его соответствия проксимальной зоне имплантации. Также следует уточнить другие характеристики проксимальной шейки: угловое искривление, наличие тромбов, геометрическая конфигурация и кальцификация. Для определения размеров и планирования сохранения боковых ветвей следует точно измерить расстояния на основе изображений криволинейных плоскостных реконструкций или многоплоскостных реконструкций с выпрямленной центральной линией потока. Кроме того, необходим анализ извитости и угловых искривлений почечных артерий [237].
- Рекомендуется свести к минимуму время пребывания крупных или окклюзирующих интродьюсеров в бедренных и подвздошных артериях у пациентов с ТААА с целью снижения риска ишемии спинного мозга и ишемии нижних конечностей, которая может привести к развитию послеоперационного компартмент-синдрома и/или рабдомиолиза [8].
ЕОК\РКО I B, АКК и ААС I B (УДД 5, УУР С)
Комментарии. Как и при любой эндоваскулярной процедуре на аорте, оценивается подвздошно-бедренный доступ для определения возможности доставки устройства, для чего в настоящее время требуются интродьюсеры размером от 18F до 24F в зависимости от производителя. В случаях, когда требуется большой интродьюсер, его можно вывести в наружную подвздошную артерию, чтобы обеспечить антеградный кровоток в ипсилатеральную внутреннюю подвздошную артерию. Хирург всегда должен сохранять бдительность для выявления послеоперационной мальперфузии нижних конечностей и/или развития компартмент-синдрома [8].
Стратегии защиты почек при эндоваскулярном лечении ТААА
- Рекомендуется предпроцедурное планирование эндопротезирования у пациентов с ТААА, включающее в себя определение размера и места имплантации стент-графта перед операцией, чтобы свести к минимуму использование контрастного средства во время процедуры. По возможности следует использовать интраоперационное наложение данных КТА аорты на ангиографическую установку (3D Fusion), чтобы свести к минимуму использование контрастного препарата [209,219,237].
ЕОК\РКО I B, АКК и ААС I B (УДД 4, УУР С)
- Рекомендуется использовать неионогенный гипоосмолярный контрастный препарат и свести к минимуму его внутриартериальное введение, особенно у пациентов с высоким риском контраст-индуцированной нефропатии [238,239].
ЕОК\РКО I B, АКК и ААС I B (УДД 1, УУР B)
Комментарии. Контраст-индуцированная нефропатия является третьей ведущей причиной ОПП у госпитализированных пациентов. Несмотря на противоречивые определения, приводимые в литературе, можно предполагать, что частота ОПП колеблется от 5% до 25%. Факторы, повышающие риск контраст-индуцированной нефропатии, включают пожилой возраст, сахарный диабет, существующее заболевание почек и применение контрастного средства в возрастающих дозах [239].
Защита спинного мозга при эндоваскулярном лечении ТААА
- Рекомендуется использовать профилактический дренаж спинномозговой жидкости и повышать перфузионное давление с помощью контролируемой артериальной гипертензии (среднее артериальное давление >90 мм рт.ст.) для защиты спинного мозга от повреждений при транскатетерном вмешательстве на аорте у пациентов с ТААА, которое ассоциировано с высоким риском [240–242].
ЕОК\РКО I A, АКК и ААС I A (УДД 4, УУР С)
Комментарий. К пациентам высокого риска относят лиц с перекрытием большой длины нисходящей аорты, ранее выполненной транскатетерной изоляцией патологии аорты, включая эндопротезирование брюшной аорты, «открытое» протезирование брюшной аорты с реконструкцией ее висцеральных ветвей, больных с нарушением тазового кровотока из-за стеноза или окклюзии общей или внутренней подвздошной артерии, со стенозом или окклюзией позвоночных артерий, а также при запланированном перекрытии ЛПкА и высоком риске осложнений по оценке оперирующего хирурга [243]. Для снижения риска повреждения спинного мозга применяют ряд профилактических стратегий: сохранение кровотока в ЛПкА и гипогастральных артериях , стратегии этапности при перекрытии длинного сегмента аорты [240], профилактический дренаж спинномозговой жидкости, профилактику анемии, пермиссивную гипертензию, терапию глюкокортикостероидами системного действия [240–242], методику «вспышка — подавление», пермиссивную гипотермию и гипероксигенационную терапию [240–242].
7. Иное лечение
Иные методы лечения не предусмотрены.
Медицинская реабилитация
Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
Медицинская реабилитация для данного заболевания не разработана.
Госпитализация
Организация оказания медицинской помощи
Многопрофильные бригады, диспансерное наблюдение и логистика пациентов с заболеваниями грудной аорты
В стандартах оказания помощи при различных заболеваниях, основанных на доказательствах, отмечается, что результаты лечения пациентов критически взаимосвязаны как с количеством госпитализаций в целом, так и с объемом выполняемых в клинике операций на грудной аорте. Эффективность оказания медицинской помощи еще больше повышается при условии сотрудничества специалистов многопрофильных бригад, что способствует выбору наилучшей лечебной тактики для пациентов. Особенно это актуально в трудных случаях, когда имеется угроза развития мультиорганного поражения. Несмотря на отсутствие согласованного определения многопрофильной бригады по вмешательствам на аорте («аортальной» команды), за ее основу можно принять следующее: это специализированная бригада врачей, обладающих исключительно глубокими знаниями в области оценки и лечения заболеваний аорты, при этом помощь такой бригады носит комплексный и междисциплинарный характер [264]. Концепция таких комплексных центров, занимающихся патологией клапанов сердца, была официально закреплена в «Рекомендациях АСС/АНА 2020 г. по ведению пациентов с клапанными пороками сердца» [157]. В этом документе подчеркиваются многочисленные важные компоненты таких центров, начиная от знаний, опыта врачей, их технических навыков для сбора данных, а также научных достижений и уровня образования до оборудования и ресурсов, которыми должно располагать учреждение. Конкретные компоненты многопрофильных «аортальных» бригад могут отличаться от центра к центру, однако можно выделить наиболее общие черты, которые характерны для таких команд: наличие кардиохирургов, сосудистых хирургов и специалистов по эндоваскулярным методам лечения, обладающих большим опытом работы со сложными заболеваниями аорты в клинике, где ежегодно проводится большое количество оперативных вмешательств на аорте, наличие специалистов по визуализации, имеющих опыт работы с заболеваниями аорты, для выполнения и интерпретации КТА аорты, МРА аорты и ТТ-ЭхоКГ, наличие анестезиологов, имеющих опыт лечения острых заболеваний аорты и дренирования спинномозговой жидкости, и специалистов отделения реанимации и интенсивной терапии, также имеющих опыт ведения таких пациентов.
Заболевания грудной аорты, в особенности острые, являются опасными для жизни состояниями и требуют госпитализации пациента в стационар, где доступны все соответствующие диагностические и лечебные мероприятия. Минимальные требования для возможности адекватного ведения этих пациентов включают визуализацию с помощью КТА, ТТ-ЭхоКГ и ангиографии, наличие бригады сердечно-сосудистых хирургов, обладающих опытом применения искусственного кровообращения и циркуляторного ареста, а также возможности эндоваскулярных вмешательств. Кроме того, необходимо отделение интенсивной терапии, позволяющее осуществлять непрерывный мониторинг и коррекцию жизненно-важных функций, а также наличие специалистов, обладающих личным опытом и знаниями в ведении этой категории пациентов.
Перевод пациентов с заболеваниями грудной аорты, особенно с острыми состояниями, из одного медицинского учреждения в другое является опасным периодом для пациента и должен быть тщательно спланирован и эффективно осуществлен. Залогом успешного результата является полноценное врачебное взаимодействие на всех этапах транспортировки пациента.
Ретроспективная оценка пациентов с аневризмой грудной аорты и/или расслоением, особенно тех, у кого диагноз не был установлен своевременно, имеет решающее значение для изучения путей оптимизации диагностического и лечебного алгоритмов будущих пациентов.
- Рекомендуется в целях улучшения результатов лечения и диспансерного наблюдения пациентов с бессимптомным течением распространенного поражения аорты, тех, кому может помочь комплексное любое открытое и эндоваскулярное лечение патологии аорты или имеющих множественные сопутствующие заболевания при рассмотрении возможности хирургического вмешательства направлять в экспертный центр, выполняющий большой объем вмешательств на грудной аорте (определение «экспертный центр» представлено в главе 3), имеющий в штате опытных хирургов в составе многопрофильной «аортальной» бригады [98].
ЕОК\РКО IIa C, АКК и ААC IIa C (УДД 4, УУР С)
Комментарии. В исследовании, в которое вошло 230 736 пациентов программы Medicare, перенесших операцию по поводу аневризмы брюшной аорты в период с 2001 по 2006 г., весь массив оперативных вмешательств (как «открыты», так эндоваскулярных) был разделен на квинтили. При этом скорректированная смертность снизилась по квинтилю вместе с ростом количества оказанных медицинских услуг, особенно в группе пациентов, перенесших открытые операции [265]. Преимущества большого объема операций в клинике для результатов хирургического лечения аналогичны таковым у пациентов с аневризмами грудной аорты. Хьюз и соавт. [98] проанализировали более 13 000 плановых операций на АК, корне и восходящем отделе аорте, выполненных в 741 больнице Северной Америки с 2004 по 2007 гг. Они обнаружили отрицательную связь между объемом оказанных медицинских услуг и скорректированным отношением шансов (ОШ) смертности пациентов (P <0,001), особенно при количестве вмешательств менее 30–40 в год. Обратная зависимость между годовым объемом вмешательств, проводимых в медучреждении, и смертностью была также продемонстрирована в более современной серии случаев, описанной Мори и соавт. [102]. На выборке из 53 000 операций на проксимальном отделе грудной аорты, проведенных в США с 2011 по 2016 гг., было показано, что риск периоперационной смертности значительно снижался, когда годовой объем оперативных вмешательств в медучреждении превышал 20–25 случаев (только 116 клиник в США выполнили более 20 случаев за год); в еще большей степени этот риск снижался, если годовой объем вмешательств составлял более 50 случаев (только 24 клиники в США выполнили более 50 случаев за год). Возможно, наиболее явная корреляция между количеством госпитализаций и уровнем смертности наблюдается среди пациентов с острым расслоением аорты. В ретроспективном анализе историй болезни 232 пациентов с острым расслоением аорты типа А, перенесших срочную операцию в одном из медицинских центров Великобритании, 30-дневная смертность была значительно ниже у тех пациентов, кого оперировал хирург, уже имеющий опыт работы операций на аорте (по сравнению с хирургом, не являющимся специалистом по аорте), и составила 10% против 26%, соответственно (P=0,02). Кроме того, хирурги, специализирующиеся на заболеваниях аорты, значительно чаще выполняли вмешательства на ее корне (43,0% против 17,3%; P=0,001), а продолжительность пережатия аорты во время операции у них была значительно ниже [266]. Наконец, по данным Умана-Пизано и соавт. [267], смертность после вмешательства по поводу расслоения аорты составила 14% против 24% у хирургов с большим и малым объемом выполняемых операций, соответственно. Очевидно, что не всем пациентам с заболеваниями грудной аорты доступна помощь многопрофильных бригад, особенно в условиях развития ОАС. Тем не менее, при плановом протезировании аорты (особенно при пороговых значениях ее диаметра) более низкий уровень периоперационной смертности у опытных «аортальных» хирургов в экспертных центрах с большим объемом ежегодно выполняемых вмешательств может дополнительно обосновать раннее проведение операции. Сходным образом, если протезирование аорты является относительно новыми или технически сложными, то наилучшие результаты, скорее всего, будут получены в центрах с активно оперирующими хирургами, имеющими опыт работы с новыми методиками. Следовательно, в настоящем руководстве присутствует ряд рекомендаций, в которых указано, что некоторые виды «открытых» хирургических или эндоваскулярных методов лечения заболеваний аорты должны выполняться опытными хирургами в экспертных центрах, где организованы многопрофильные «аортальные» бригады.
- Рекомендуется пациентов с ОАС (разрывом аорты), требующих любого срочного вмешательства при возможности направлять в экспертный центр, где выбор тактики лечения будет осуществляться многопрофильной командой специалистов [66,266].
ЕОК\РКО I C, АКК и ААC I C (УДД 4, УУР С)
Комментарии. Андерсен и соавт. [66] сравнили результаты протезирования ВА по поводу острого расслоения аорты типа А. Были сравнены результаты лечения до и после внедрения программы многопрофильной хирургии грудной аорты, и было установлено, что после внедрения многопрофильной бригады периоперационная смертность резко снизилась, и это значительное снижение смертности сохранялось в течение 5 лет наблюдения (P=0,002). Аналогичным образом, в исследовании из Англии [266] сообщалось, что в клиниках, где были внедрены программы по созданию многопрофильных бригад, специализирующихся на лечении заболеваний грудной аорты, было достигнуто значительное снижение смертности по сравнению с больницами без таких программ.
Особенностью хронических заболеваний грудной аорты является необходимость регулярных скрининговых визуализирующих исследований. Диагностические скрининги, в том числе с применением методов лучевой диагностики, возможно проводить в амбулаторных условиях с дальнейшей интерпретацией полученных данных профильными врачами-хирургами.
Скорая специализированная медицинская помощь оказывается пациентам с подозрением на острые заболевания грудной аорты (разрыв и острое расслоение). В остальных случаях пациенты с хроническими заболеваниями грудной аорты сохраняют мобильность и обращаются за плановой медицинской помощью самостоятельно.
Высокотехнологичная медицинская помощь оказывается в условиях стационара врачами сердечно-сосудистыми хирургами, в ряде случаев врачами по рентгенэндоваскулярной диагностике и лечению. Для проведения диагностических исследований привлекаются врачи ультразвуковой диагностики, врачи-рентгенологи, врачи функциональной диагностики.
Показаниями для плановой госпитализации пациентов с заболеваниями грудной аорты в стационар являются:
- хирургическое или эндоваскулярное лечение заболеваний грудной аорты;
- хирургическое или эндоваскулярное лечение состояний и осложнений после открытых и эндоваскулярных вмешательств на грудной аорте.
Не являются показаниями для госпитализации:
- периодические диагностические скрининги заболеваний грудной аорты при технической возможности их выполнения в амбулаторном порядке.
Показаниями для экстренной госпитализации пациентов с заболеванием грудной аорты в стационар являются:
- разрыв, расслоение, ИМГ, ПАЯ грудной аорты или подозрение на эти состояния;
- появление/усиление клинических симптомов ранее диагностированного заболевания грудной аорты.
Критерии выписки из стационара:
- завершенное хирургическое или эндоваскулярное лечение заболевания грудной аорты, состояний или осложнений после открытых и эндоваскулярных вмешательств.
Профилактика
Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
1. Наблюдение при расширении и аневризме грудной и торакоабдоминальной аорты
У пациентов с заболеваниями грудной аорты важна подробная исходная оценка всех сегментов грудной аорты, анатомии и функции АК. Для оценки состояния грудного отдела аорты обычно используются ТТ-ЭхоКГ, КТА грудной аорты и МРА грудной аорты.
- Рекомендуется выполнение ТТ-ЭхоКГ пациентам с расширением грудной аорты в процессе обследования и установления диагноза, а также при последующем наблюдении, в том числе для оценки диаметров грудной аорты, анатомии и функции АК [44,244].
ЕОК\РКО I C, АКК и ААС I C (УДД 5, УУР С)
Комментарии. Проведение детального обследования с помощью ТТ-ЭхоКГ для оценки анатомии и функции АК является важным на начальном этапе наблюдения за пациентами с заболеваниями грудной аорты, которые не имеют показаний к хирургическому вмешательству. ТТ-ЭхоКГ, как правило, обеспечивает получение четких изображений корня и восходящего отдела аорты, является безопасной, воспроизводимой и может использоваться для многолетнего наблюдения. У отдельных пациентов со сложными окнами трансторакальной эхокардиографической визуализации ЧП-ЭхоКГ является альтернативой для оценки анатомии АК и размеров аорты [26,44,245].
- Рекомендуется в процессе установления диагноза и для последующего наблюдения для оценки анатомии и диаметра грудной аорты пациентам с расширенной грудной аортой проведение КТА грудной аорты или МРА грудной аорты [26,55,58,246].
ЕОК\РКО IIa C, АКК и ААС IIa C (УДД 5, УУР С)
Комментарии. Для оценки всех сегментов грудной аорты, включая ветви дуги аорты, в качестве золотого стандарта предложена визуализация поперечного сечения тела человека с помощью КТА грудной аорты или МРА грудной аорты [55,247]. Спиральная КТ сердца с ЭКГ-синхронизацией сводит к минимуму артефакты движения и, таким образом, позволяет точно определить размеры корня, восходящего отдела аорты, морфологические особенности АК и других сердечных структур [55,247].
- Рекомендуется для определения скорости расширения аорты у пациентов с расширенной грудной аортой выполнять визуализацию каждые 6–12 месяцев в динамике (в зависимости от индивидуальной анатомии с помощью ЭхоКГ, КТА грудной аорты или МРА грудной аорты); если размер аорты стабилен, контрольная визуализация рекомендуется каждые 6–24 месяца (в зависимости от диаметра аорты) [26,58,244].
ЕОК\РКО IIa C, АКК и ААС IIa C (УДД 5, УУР С)
Комментарии. Пациенты со стабильными размерами аорты могут длительно наблюдаться с помощью ТТ-ЭхоКГ, КТА грудной аорты или МРА грудной аорты. Частота визуализации в динамике должна быть индивидуальной и зависеть от этиологии аневризмы, диаметра аорты, скорости расширения аорты, близости диаметра аорты пороговому для принятия решения о хирургическом вмешательстве, возраста пациента [18,248]. В целом у пациентов с несиндромными пограничными расширениями грудной аорты скорость расширения аорты относительно низка, поэтому интервал для проведения визуализаций в динамике может быть увеличен.
- Рекомендуется назначение монотерапии низкими дозами Ацетилсалициловой кислоты** (75-100 мг/сут) в течение первых 3 месяцев пациентам с аневризмой корня и/или ВА после клапаносохраняющей операции на корне и/или ВА при отсутствии других показаний к назначению оральных антикоагулянтов (B01A) Антитромботические средства) с целью профилактики тромботических осложнений [135,249].
ЕОК\РКО IIa С (УДД 5, УУР С)
- Пациентам с сосудистым типом синдрома Элерса-Данло рекомендуется регулярное наблюдение за состоянием аорты и периферических артерий с помощью дуплексного сканирования сосудов, КТА или МРА [250,251].
ЕОК\РКО I С (УДД 4, УУР С)
- У пациентов с синдромом Марфана рекомендуется выполнение ТТ- ЭхоКГ:
- ежегодно при диаметре корня аорты <45 мм и в отсутствие дополнительных факторов риска;
- не реже одного раза в 6 месяцев при диаметре корня аорты <45 мм при наличии дополнительных факторов риска;
- не реже одного раза в 6-12 месяцев при диаметре корня аорты ≥45 мм при отсутствии дополнительных факторов риска [32,58,252,253].
ЕОК\РКО I С (УДД 5, УУР С)
- Пациентам с синдромом Марфана, которым ранее ранее не выполнялись хирургические вмешательства на аорте, рекомендуется полная визуализация торакоабдоминальной аорты и периферических артерий с помощью КТА либо МРА, а также УЗИ при первичном обследовании, затем каждые 3-5 лет при стабильном течении заболевания [32,252,254].
ЕОК\РКО I С (УДД 5, УУР С)
- Пациентам с синдромом Лойеса-Дитца рекомендуется выполнение ТТ-ЭхоКГ при первичном осмотре, затем каждые 6-12 месяцев в зависимости от диаметра аорты и скорости ее расширения [32,113,255].
ЕОК\РКО I С (УДД 4, УУР С)
- У пациентов с синдромом Лойеса-Дитца рекомендуется визуализация всей аорты и периферических артерий при первичном осмотре с помощью КТА или МРА и последующее наблюдение с контрольными визуализирующими исследованиями каждые 1-3 года [32,255].
ЕОК\РКО I С (УДД 5, УУР C)
2. Наблюдение за пациентами после транскатетерного (эндоваскулярного) вмешательства на аорте
- Рекомендована КТА грудной аорты пациентам после транскатетерного (эндоваскулярного) вмешательства на аорте в течение первого месяца от момента выполнения процедуры (предпочтительно в рамках стационарного лечения), через 6 и 12 месяцев после транскатетерного вмешательства на аорте, а затем ежегодно в течение всей жизни с возможностью более частого проведения контрольных исследований, если будет выявлено эндоподтекание (эндолик) или другая вызывающая настороженность проблема [256,257].
ЕОК\РКО I В (УДД 4, УУР С)
Комментарии. В случаях, когда при КТА через 1 месяц выявлены морфологические проблемы с эндопротезом (например, «птичий клюв», загибание эндопротеза), эндоподтекание (эндолик) или признаки расширения аневризматического мешка, а также при неосложненном течении у пациентов высокого риска осложнений (например, после вмешательства по поводу ПАЯ или разрыва аорты), рекомендуется провести повторную КТА грудной аорты с визуализацией артерий и контрастированием в отсроченные фазы в течение 3-6 месяцев. В случаях низкого риска прогрессии расширения аорты, например, при уменьшении размера аневризмы аорты и стабильном состоянии более 3 лет, можно использовать КТ органов грудной полости для отслеживания размера аневризматического мешка и стабильности компонентов. Нельзя рекомендовать отмену наблюдения после транскатетерного вмешательства на аорте либо увеличение интервалов между исследованиями до менее одного раза в год, учитывая отсутствие доказательной базы по долгосрочной безопасности, а также наличие данных о росте аневризмы и появлении новых эндоликов, несмотря на ранее проведенную изоляцию аневризмы [256,257].
- Рекомендуется продолжение долгосрочного наблюдения за пациентами после эндоваскулярного вмешательства на грудной аорте и визуализации аорты с помощью КТА каждые 5 лет, если по прошествии 5 лет после оперативного лечения не наблюдалось развития осложнений [22,32,258].
ЕОК\РКО IIa В (УДД 4, УУР С)
- Рекомендуется проведение повторных КТА каждые 6–12 месяцев у пациентов с ростом аневризмы без признаков эндоподтеканий типа I или III [259].
ЕОК\РКО IIa С (УДД 5, УУР С)
- У пациентов низкого риска начиная с 1 года после эндоваскулярного вмешательства на аорте рекомендуется проведение повторных ультразвуковых допплерографий и дуплексного сканирования с контрастным усилением каждые 2 года [44,260].
ЕОК\РКО IIa В (УДД 5, УУР С)
3. Наблюдение после хирургического лечения
- После проведенного клапаносберегающего либо клапаноуносящего протезирования корня и/или восходящего отдела аорты у пациентов с АГА и\или ТААА, либо после протезирования АК и диаметре ВА в любой зоне >4,0 см рекомендуется пожизненное наблюдение и проведение визуализирующих исследований корня и восходящего отдела аорты методами ЭхоКГ, КТА или МРА с интервалами, зависящими от диаметра грудной аорты в разных отделах и темпа его роста, наличия ДАК, а также дополнительных факторов риска осложнений, ассоциированных с аортой [46].
ЕОК\РКО I С, АКК и ААC I С (УДД 4, УУР С)
Комментарии. Пациенты с ДАК, ранее перенесшие изолированное ПАК или пластику АК, остаются подверженными риску расширения и расслоения аорты в будущем. В серии из 1286 пациентов, перенесших изолированное ПАК по поводу ДАК с 1960 по 1995 гг., 15-летняя свобода от «аортальных» осложнений (расслоение аорты, аневризма аорты >5,0 см или операция по поводу аневризмы аорты) составила 89%, но она была ниже у пациентов с документально подтвержденным расширением аорты на исходном этапе по сравнению с пациентами с нормальными диаметрами аорты (85% против 93%; р=0,001) [261]. Пациенты с ДАК, перенесшие изолированное ПАК по поводу аортального стеноза и имеющие только легкую или умеренную дилатацию аорты, в ходе 15-летнего наблюдения характеризуются низким риском осложнений со стороны аорты [62], то время как те, кто перенес ПАК по поводу преобладающей АН, и лица с преобладающим расширением корня аорты («корневой» фенотип расширения ВА) имеют более высокий риск ассоциированных с аортой осложнений. Во время наблюдения за 56 пациентами с ДАК, перенесшими изолированное ПАК по поводу АН и имевших сопутствующее расширение корня аорты (4,0–5,0 см), осложнения со стороны аорты развились у 34% пациентов [62]. Пациенты с ДАК после изолированного ПАК по поводу АН подвержены более высокому риску позднего расслоения аорты по сравнению с больными, оперированными по поводу стеноза бикуспидального АК [262].
- Пациентам, перенесшим «открытую» хирургическую реконструкцию грудной аорты, рекомендуется выполнение КТА грудной аорты в течение первого месяца от момента выполнения процедуры (предпочтительно в рамках стационарного лечения), через 6, 12 и 24 месяца после вмешательства, и далее при стабильном состоянии аорты каждые 5 лет [22,32,263].
ЕОК\РКО I В (УДД 4, УУР С)
Информация
Источники и литература
-
Клинические рекомендации Ассоциации сердечно-сосудистых хирургов России
- Клинические рекомендации Ассоциации сердечно-сосудистых хирургов России - 1. Hiratzka LF, Bakris GL, Beckman JA, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM Guidelines for the Diagnosis and Management of Patients With Thoracic Aortic Disease. J Am Coll Cardiol. 2010;55(14):e27-e129. doi:10.1016/j.jacc.2010.02.015 2. Vapnik JS, Kim JB, Isselbacher EM, et al. Characteristics and Outcomes of Ascending Versus Descending Thoracic Aortic Aneurysms. Am J Cardiol. 2016;117(10):1683-1690. doi:10.1016/j.amjcard.2016.02.048 3. Иртюга О.Б., Гаврилюк Н.Д., Воронкина И.В., Успенский В.Е., Малашичева А.Б., Моисеева О.М. Механизмы формирования аневризмы восходящего отдела аорты различной этиологии. Российский кардиологический журнал. 2013;18(1):14-18. 4. Irtyuga O, Kopanitsa G, Kostareva A, et al. Application of Machine Learning Methods to Analyze Occurrence and Clinical Features of Ascending Aortic Dilatation in Patients with and without Bicuspid Aortic Valve. J Pers Med. 2022;12(5):794. doi:10.3390/jpm12050794 5. Пугина М.Ю., Гареев Д.А., Коржова М.А., et al. Патоморфологические особенности осложнений у пациентов с бикуспидальным аортальным клапаном. Южно-Российский журнал терапевтической практики. 2023;4(3):62-69. 6. Pinard A, Jones GT, Milewicz DM. Genetics of Thoracic and Abdominal Aortic Diseases. Circ Res. 2019;124(4):588-606. doi:10.1161/CIRCRESAHA.118.312436 7. Thakker PD, Braverman AC. Cardiogenetics: genetic testing in the diagnosis and management of patients with aortic disease. Heart. 2021;107(8):619-626. doi:10.1136/heartjnl-2020-317036 8. Upchurch GR, Escobar GA, Azizzadeh A, et al. Society for Vascular Surgery clinical practice guidelines of thoracic endovascular aortic repair for descending thoracic aortic aneurysms. J Vasc Surg. 2021;73(1):55S-83S. doi:10.1016/j.jvs.2020.05.076 9. Albornoz G, Coady MA, Roberts M, et al. Familial Thoracic Aortic Aneurysms and Dissections—Incidence, Modes of Inheritance, and Phenotypic Patterns. Ann Thorac Surg. 2006;82(4):1400-1405. doi:10.1016/j.athoracsur.2006.04.098 10. Иртюга О.Б, Фрейлихман О.А., Кривоносов Д.С., et al. Роль гена NOTCH1 в формировании аневризмы аорты. Российский кардиологический журнал. 2018;23(7):53-59. 11. Krüger T, Oikonomou A, Schibilsky D, et al. Aortic elongation and the risk for dissection: the Tübingen Aortic Pathoanatomy (TAIPAN) project†. European Journal of Cardio-Thoracic Surgery. 2017;51(6):1119-1126. doi:10.1093/ejcts/ezx005 12. Lescan M, Veseli K, Oikonomou A, et al. Aortic Elongation and Stanford B Dissection: The Tübingen Aortic Pathoanatomy (TAIPAN) Project. European Journal of Vascular and Endovascular Surgery. 2017;54(2):164-169. doi:10.1016/j.ejvs.2017.05.017 13. Иртюга О.Б., Воронкина И.В., Смагина Л.В., et al. ЧАСТОТА ВЫЯВЛЕНИЯ АНЕВРИЗМЫ ВОСХОДЯЩЕГО ОТДЕЛА АОРТЫ И МЕХАНИЗМ РАЗВИТИЯ ПО ДАННЫМ РЕГИСТРА ФГБУ ФЦСКЭ ИМ. В.А. АЛМАЗОВА. Бюллетень Федерального Центра сердца, крови и эндокринологии им ВА Алмазова. 2011;5:73-78. 14. Ramanath VS, Oh JK, Sundt TM, Eagle KA. Acute Aortic Syndromes and Thoracic Aortic Aneurysm. Mayo Clin Proc. 2009;84(5):465-481. doi:10.1016/S0025-6196(11)60566-1 15. Knaut AL, Cleveland JC. Aortic emergencies. Emerg Med Clin North Am. 2003;21(4):817-845. doi:10.1016/S0733-8627(03)00063-4 16. Chau KH, Elefteriades JA. Natural History of Thoracic Aortic Aneurysms: Size Matters, Plus Moving Beyond Size. Prog Cardiovasc Dis. 2013;56(1):74-80. doi:10.1016/j.pcad.2013.05.007 17. Bashir M, Fok M, Hammoud I, et al. A Perspective on Natural History and Survival in Nonoperated Thoracic Aortic Aneurysm Patients. AORTA. 2013;1(3):182-189. doi:10.12945/j.aorta.2013.13-043 18. Kuzmik GA, Sang AX, Elefteriades JA. Natural history of thoracic aortic aneurysms. J Vasc Surg. 2012;56(2):565-571. doi:10.1016/j.jvs.2012.04.053 19. Maleki S, Björck HM, Paloschi V, et al. Aneurysm Development in Patients With Bicuspid Aortic Valve (BAV): Possible Connection to Repair Deficiency? AORTA. 2013;1(1):13-22. doi:10.12945/j.aorta.2013.12.011 20. Гаврилюк Н.Д., Успенский В.Е., Малашичева А.Б., et al. Аневризма восходящего отдела аорты: от молекулярно- генетических особенностей патогенеза до выбора метода лечения. Трансляционная медицина. 2016;3(1):6-20. 21. Safi HJ, Winnerkvist A, Miller CC, et al. Effect of extended cross-clamp time during thoracoabdominal aortic aneurysm repair. Ann Thorac Surg. 1998;66(4):1204-1208. doi:10.1016/S0003-4975(98)00781-4 22. Riambau V, Böckler D, Brunkwall J, et al. Editor’s Choice – Management of Descending Thoracic Aorta Diseases. European Journal of Vascular and Endovascular Surgery. 2017;53(1):4-52. doi:10.1016/j.ejvs.2016.06.005 23. Svensson LG, Arafat A, Roselli EE, et al. Inflammatory disease of the aorta: Patterns and classification of giant cell aortitis, Takayasu arteritis, and nonsyndromic aortitis. J Thorac Cardiovasc Surg. 2015;149(2):S170-S175. doi:10.1016/j.jtcvs.2014.08.003 24. Conrad MF, Cambria RP. Contemporary Management of Descending Thoracic and Thoracoabdominal Aortic Aneurysms: Endovascular Versus Open. Circulation. 2008;117(6):841-852. doi:10.1161/CIRCULATIONAHA.107.690958 25. Gao J, Cao H, Hu G, et al. The mechanism and therapy of aortic aneurysms. Signal Transduct Target Ther. 2023;8(1):55. doi:10.1038/s41392-023-01325-7 26. Rogers IS, Massaro JM, Truong QA, et al. Distribution, Determinants, and Normal Reference Values of Thoracic and Abdominal Aortic Diameters by Computed Tomography (from the Framingham Heart Study). Am J Cardiol. 2013;111(10):1510-1516. doi:10.1016/j.amjcard.2013.01.306 27. Pelliccia A, Di Paolo FM, Quattrini FM. Aortic Root Dilatation in Athletic Population. Prog Cardiovasc Dis. 2012;54(5):432-437. doi:10.1016/j.pcad.2012.01.004 28. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43(7):561-632. doi:10.1093/eurheartj/ehab395 29. Stout KK, Verrier ED. Acute Valvular Regurgitation. Circulation. 2009;119(25):3232-3241. doi:10.1161/CIRCULATIONAHA.108.782292 30. Maganti K, Rigolin VH, Sarano ME, Bonow RO. Valvular Heart Disease: Diagnosis and Management. Mayo Clin Proc. 2010;85(5):483-500. doi:10.4065/mcp.2009.0706 31. Coady MA. Familial Patterns of Thoracic Aortic Aneurysms. Archives of Surgery. 1999;134(4):361. doi:10.1001/archsurg.134.4.361 32. Isselbacher EM, Preventza O, Hamilton Black J, et al. 2022 ACC/AHA Guideline for the Diagnosis and Management of Aortic Disease: A Report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022;146(24). doi:10.1161/CIR.0000000000001106 33. Halvorsen S, Mehilli J, Cassese S, et al. 2022 ESC Guidelines on cardiovascular assessment and management of patients undergoing non-cardiac surgery. Eur Heart J. 2022;43(39):3826-3924. doi:10.1093/eurheartj/ehac270 34. Козлов Б.Н., Панфилов Д.С., Сондуев Э.Л., Лукинов В.Л. Предикторы ранних осложнений после протезирования восходящей аорты. Сибирский журнал клинической и экспериментальной медицины. 2022;37(1):108-117. 35. Guo D chuan, Hostetler EM, Fan Y, et al. Heritable Thoracic Aortic Disease Genes in Sporadic Aortic Dissection. J Am Coll Cardiol. 2017;70(21):2728-2730. doi:10.1016/j.jacc.2017.09.1094 36. Regalado ES, Guo D chuan, Prakash S, et al. Aortic Disease Presentation and Outcome Associated With ACTA2 Mutations. Circ Cardiovasc Genet. 2015;8(3):457-464. doi:10.1161/CIRCGENETICS.114.000943 37. Morisaki H, Akutsu K, Ogino H, et al. Mutation of ACTA2 gene as an important cause of familial and nonfamilial nonsyndromatic thoracic aortic aneurysm and/or dissection (TAAD). Hum Mutat. 2009;30(10):1406-1411. doi:10.1002/humu.21081 38. Guo DC, Pannu H, Tran-Fadulu V, et al. Mutations in smooth muscle α-actin (ACTA2) lead to thoracic aortic aneurysms and dissections. Nat Genet. 2007;39(12):1488-1493. doi:10.1038/ng.2007.6 39. Harris SL, Lindsay ME. Role of Clinical Genetic Testing in the Management of Aortopathies. Curr Cardiol Rep. 2021;23(2):10. doi:10.1007/s11886-020-01435-6 40. Beebe HG, Kritpracha B, Serres S, Pigott JP, Price CI, Williams DM. Endograft Planning without Preoperative Arteriography: A Clinical Feasibility Study. Journal of Endovascular Therapy. 2000;7(1):8-15. doi:10.1177/152660280000700102 41. Zafar MA, Li Y, Rizzo JA, et al. Height alone, rather than body surface area, suffices for risk estimation in ascending aortic aneurysm. J Thorac Cardiovasc Surg. 2018;155(5):1938-1950. doi:10.1016/j.jtcvs.2017.10.140 42. Rudarakanchana N, Bicknell CD, Cheshire NJ, et al. Variation in Maximum Diameter Measurements of Descending Thoracic Aortic Aneurysms Using Unformatted Planes versus Images Corrected to Aortic Centerline. European Journal of Vascular and Endovascular Surgery. 2014;47(1):19-26. doi:10.1016/j.ejvs.2013.09.026 43. Rodríguez-Palomares JF, Teixidó-Tura G, Galuppo V, et al. Multimodality Assessment of Ascending Aortic Diameters: Comparison of Different Measurement Methods. Journal of the American Society of Echocardiography. 2016;29(9):819-826.e4. doi:10.1016/j.echo.2016.04.006 44. Mazzolai L, Teixido-Tura G, Lanzi S, et al. 2024 ESC Guidelines for the management of peripheral arterial and aortic diseases. Eur Heart J. 2024;45(36):3538-3700. doi:10.1093/eurheartj/ehae179 45. Zur G, Andraous M, Bercovich E, et al. CT-Ultrasound Fusion for Abdominal Aortic Aneurysm Measurement. American Journal of Roentgenology. 2020;214(2):472-476. doi:10.2214/AJR.19.21670 46. Borger MA, Fedak PWM, Stephens EH, et al. The American Association for Thoracic Surgery consensus guidelines on bicuspid aortic valve–related aortopathy: Executive summary. J Thorac Cardiovasc Surg. 2018;156(2):473-480. doi:10.1016/j.jtcvs.2017.10.161 47. Lu W, Guo W, Liu J, et al. Consistency of Proximal-to-Distal Tapering of Descending Thoracic Aortic Diameter: Quantification Using a Novel Computer Tomography-based Assessment. Ann Vasc Surg. 2019;58:205-210. doi:10.1016/j.avsg.2018.12.072 48. Vriz O, Driussi C, Bettio M, Ferrara F, D’Andrea A, Bossone E. Aortic Root Dimensions and Stiffness in Healthy Subjects. Am J Cardiol. 2013;112(8):1224-1229. doi:10.1016/j.amjcard.2013.05.068 49. Скрипник А.Ю., Фокин В.А., Мирончук Р.Р., et al. Оценка эластических характеристик стенки восходящего отдела аорты при помощи компьютерно-томографической ангиографии в режиме электрокардиографической синхронизации с расширенной постпроцессорной обработкой данных. Российский кардиологический журнал. 2019;12:48-54. 50. Plonek T, Berezowski M, Bochenek M, et al. A comparison of aortic root measurements by echocardiography and computed tomography. J Thorac Cardiovasc Surg. 2019;157(2):479-486. doi:10.1016/j.jtcvs.2018.07.053 51. McEvoy JW, McCarthy CP, Bruno RM, et al. 2024 ESC Guidelines for the management of elevated blood pressure and hypertension. Eur Heart J. 2024;45(38):3912-4018. doi:10.1093/eurheartj/ehae178 52. Davenport MS, Perazella MA, Yee J, et al. Use of Intravenous Iodinated Contrast Media in Patients With Kidney Disease. Kidney Med. 2020;2(1):85-93. doi:10.1016/j.xkme.2020.01.001 53. Davenport MS, Perazella MA, Yee J, et al. Use of Intravenous Iodinated Contrast Media in Patients With Kidney Disease. Kidney Med. 2020;2(1):85-93. doi:10.1016/j.xkme.2020.01.001 54. Bhave NM, Nienaber CA, Clough RE, Eagle KA. Multimodality Imaging of Thoracic Aortic Diseases in Adults. JACC Cardiovasc Imaging. 2018;11(6):902-919. doi:10.1016/j.jcmg.2018.03.009 55. Freeman LA, Young PM, Foley TA, Williamson EE, Bruce CJ, Greason KL. CT and MRI Assessment of the Aortic Root and Ascending Aorta. American Journal of Roentgenology. 2013;200(6):W581-W592. doi:10.2214/AJR.12.9531 56. Moore AG, Eagle KA, Bruckman D, et al. Choice of computed tomography, transesophageal echocardiography, magnetic resonance imaging, and aortography in acute aortic dissection: International Registry of Acute Aortic Dissection (IRAD). Am J Cardiol. 2002;89(10):1235-1238. doi:10.1016/S0002-9149(02)02316-0 57. Koschyk DH, Nienaber CA, Knap M, et al. How to Guide Stent-Graft Implantation in Type B Aortic Dissection? Circulation. 2005;112(9_supplement). doi:10.1161/CIRCULATIONAHA.104.525972 58. Goldstein SA, Evangelista A, Abbara S, et al. Multimodality Imaging of Diseases of the Thoracic Aorta in Adults: From the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Journal of the American Society of Echocardiography. 2015;28(2):119-182. doi:10.1016/j.echo.2014.11.015 59. Robertson EN, van der Linde D, Sherrah AG, et al. Familial non-syndromal thoracic aortic aneurysms and dissections — Incidence and family screening outcomes. Int J Cardiol. 2016;220:43-51. doi:10.1016/j.ijcard.2016.06.086 60. Loeys BL, Dietz HC, Braverman AC, et al. The revised Ghent nosology for the Marfan syndrome. J Med Genet. 2010;47(7):476-485. doi:10.1136/jmg.2009.072785 61. Loscalzo ML, Goh DL, Loeys B, Kent KC, Spevak PJ, Dietz HC. Familial thoracic aortic dilation and bicommissural aortic valve: A prospective analysis of natural history and inheritance. Am J Med Genet A. 2007;143A(17):1960-1967. doi:10.1002/ajmg.a.31872 62. Girdauskas E, Disha K, Rouman M, Espinoza A, Borger MA, Kuntze T. Aortic events after isolated aortic valve replacement for bicuspid aortic valve root phenotype: echocardiographic follow-up study. European Journal of Cardio-Thoracic Surgery. 2015;48(4):e71-e76. doi:10.1093/ejcts/ezv259 63. Avadhani SA, Martin-Doyle W, Shaikh AY, Pape LA. Predictors of Ascending Aortic Dilation in Bicuspid Aortic Valve Disease: A Five-year Prospective Study. Am J Med. 2015;128(6):647-652. doi:10.1016/j.amjmed.2014.12.027 64. Devereux RB, de Simone G, Arnett DK, et al. Normal Limits in Relation to Age, Body Size and Gender of Two-Dimensional Echocardiographic Aortic Root Dimensions in Persons ≥15 Years of Age. Am J Cardiol. 2012;110(8):1189-1194. doi:10.1016/j.amjcard.2012.05.063 65. Illuminati G, Pacilè MA, Ceccanei G, Ruggeri M, La Torre G, Ricco JB. Peroperative Intravascular Ultrasound for Endovascular Aneurysm Repair versus Peroperative Angiography: A Pilot Study in Fit Patients with Favorable Anatomy. Ann Vasc Surg. 2020;64:54-61. doi:10.1016/j.avsg.2019.11.013 66. Ulug P, Powell JT, Warschkow R, von Allmen RS. Editor’s Choice – Sex Specific Differences in the Management of Descending Thoracic Aortic Aneurysms: Systematic Review with Meta-Analysis. European Journal of Vascular and Endovascular Surgery. 2019;58(4):503-511. doi:10.1016/j.ejvs.2019.04.022 67. Dapunt OE, Galla JD, Sadeghi AM, et al. The natural history of thoracic aortic aneurysms. J Thorac Cardiovasc Surg. 1994;107(5):1323-1332; discussion 1332-3. 68. Gu B, Choi JC, Shen YH, et al. Elastin‐Specific Autoimmunity in Smokers With Thoracic Aortic Aneurysm and Dissection is Independent of Chronic Obstructive Pulmonary Disease. J Am Heart Assoc. 2019;8(8). doi:10.1161/JAHA.118.011671 69. Fetterman JL, Keith RJ, Palmisano JN, et al. Alterations in Vascular Function Associated With the Use of Combustible and Electronic Cigarettes. J Am Heart Assoc. 2020;9(9). doi:10.1161/JAHA.119.014570 70. Fetterman JL, Weisbrod RM, Feng B, et al. Flavorings in Tobacco Products Induce Endothelial Cell Dysfunction. Arterioscler Thromb Vasc Biol. 2018;38(7):1607-1615. doi:10.1161/ATVBAHA.118.311156 71. Whelton PK, Carey RM, Aronow WS, et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Hypertension. 2018;71(6):1269-1324. doi:10.1161/HYP.0000000000000066
Информация
Список сокращений
АА – аневризма аорты
АВА – аневризма восходящей аорты
АГА – аневризма грудной аорты
АД – артериальное давление
АК – аортальный клапан
АН – аортальная недостаточность
ВА – восходящая аорта
ВТЛЖ – выходной тракт левого желудочка
ГКА – гигантоклеточный артериит
ГМК – гладкомышечные клетки
ДАК – двустворчатый аортальный клапан
ИБС – ишемическая болезнь сердца
ИМГ – интрамуральная гематома
ИЭ – инфекционный эндокардит
КТ – компьютерная томография
ЛЖ – левый желудочек
МРА – магнитно-резонансная томографическая ангиография
НГА – нисходящая грудная аорта
Недигидропиридиновые кальциевые блокаторы – селективные блокаторы кальциевых каналов с прямым действием на сердце (C08D)
НЗГА – наследственное заболевание грудной аорты
ОАС – острый аортальный синдром
ПАЯ – пенетрирующая аортальная язва
ПКлА – подключичная артерия
Протезирование аорты – резекция аорты с протезированием
РКИ – рандомизированное клиническое исследование
Контрастные препараты – Контрастные средства (V08)
КТА – компьютерно-томографическая ангиография
СРБ – С-реактивный белок
СТС – синотубулярное соединение
ТААА – торакоабдоминальная аневризма аорты
ТТ-ЭхоКГ – трансторакальная эхокардиография
ФВ – фракция выброса
ФК – фиброзное кольцо
Хирургическое лечение – резекция аорты с протезированием
ЧП-ЭхоКГ – чреспищеводная эхокардиография
ЭКГ – электрокардиография
ACC – American College of Cardiology (Американский колледж кардиологии)
AHA – American Heart Association (Американская ассоциация сердца)
ESC – European Society of Cardiology (Европейское общество кардиологов)
EACTS – European Association for Cardio-Thoracic Surgery (Европейская ассоциация кардио-торакальной хирургии)
NIRS – near‐infrared cerebral spectroscopy (церебральная спектроскопия в ближней инфракрасной области)
NYHA – New York Heart Association (Нью-Йоркская ассоциация сердца)
TAVI – транскатетерное протезирование аортального клапана
** – препарат включен в перечень жизненно необходимых и важнейших лекарственных препаратов
*** – медицинское изделие, имплантируемое при оказании медицинской помощи в рамках программы государственных гарантий бесплатного оказания гражданам медицинской помощи
# – назначение лекарственного препарата по показаниям, не утверждённым государственными регулирующими органами, не упомянутым в инструкции по применению.
Термины и определения
Американская ассоциация сердца (ААC) – в тексте настоящих клинических рекомендаций дополнительно указаны показания в соответствии с рекомендациями
Американской ассоциации сердца (American Heart Association – AHA). В соответствии с международным документом выделяются классы рекомендаций и уровни доказательности (обоснованности).
Американской ассоциации сердца (American Heart Association – AHA). В соответствии с международным документом выделяются классы рекомендаций и уровни доказательности (обоснованности).
Американский колледж кардиологии (АКК) – в тексте настоящих клинических рекомендаций дополнительно указаны показания в соответствии с рекомендациями Американского колледжа кардиологии (American College of Cardiology – ACC). В соответствии с международным документом, выделяются классы рекомендаций и уровни доказательности (обоснованности).
Аневризма аорты («истинная») – стойкое локальное расширение аорты, превышающее ее нормальный диаметр в данном отделе как минимум на 50%.
Аортальный клапан – клапан сердца, располагающийся в устье аорты между начальным отделом последней и выходным трактом левого желудочка.
Аортальная недостаточность – обратный ток крови из аорты в левый желудочек в фазу диастолы.
Аортальный стеноз – обструкция на уровне аортального клапана на пути потока крови в результате врожденной или приобретенной структурной деформации и/или аномалии клапана, а также вследствие дисфункции любого протеза аортального клапана.
Европейская ассоциация кардиоторакальной хирургии – в тексте настоящих клинических рекомендаций дополнительно указаны показания в соответствии с рекомендациями Европейской ассоциации кардиоторакальной хирургии (European Association for Cardio-Thoracic Surgery – EACTS). В соответствии с международным документом выделяются классы рекомендаций и уровни доказательности (обоснованности).
Европейское общество кардиологов (ЕОК) – в тексте настоящих клинических рекомендаций дополнительно указаны показания в соответствии с рекомендациями Европейского общества кардиологов (European Society of Cardiology – ESC). В соответствии с международным документом выделяются классы рекомендаций и уровни доказательности (обоснованности).
Корень аорты – наиболее проксимальная зона восходящей аорты, располагающаяся от уровня выходного тракта левого желудочка до синотубулярной зоны, являющейся границей между корнем и тубулярной частью восходящей аорты.
Исход — любой возможный результат, возникающий от воздействия причинного фактора, профилактического или терапевтического вмешательства, все установленные изменения состояния здоровья, возникающие как следствие вмешательства.
Клапанные пороки сердца – нарушения работы сердца, обусловленные морфологическими и/или функциональными изменениями одного или нескольких его клапанов. Изменения клапанов могут быть в виде стеноза, недостаточности или их сочетания.
Клиническое исследование — любое исследование, проводимое с участием человека в качестве субъекта для выявления или подтверждения клинических и/или фармакологических эффектов исследуемых продуктов, и/или выявления нежелательных реакций на исследуемые продукты, и/или изучения их всасывания, распределения, метаболизма и выведения с целью оценить их безопасность и/или эффективность. Термины «клиническое испытание» и «клиническое исследование» являются синонимами.
Компьютерная томография (КТ) – неинвазивный метод лучевой диагностики, позволяющий получить серию послойных субмиллиметровых аксиальных изображений органов и структур тела человека, основанный на измерении и сложной компьютерной обработке разности ослабления рентгеновского излучения различными по плотности тканями; для улучшения дифференцировки органов друг от друга, а также нормальных и патологических структур. Применяются различные методики контрастного усиления/контрастирования, с использованием рентгенконтрастных средств, содержащих йод. Для визуализации структур сердечно-сосудистой системы применяют рентгеновскую компьютерно-томографическую ангиографию КТ-ангиографию (КТА) – методику внутривенного болюсного введения рентгенконтрастного средства, содержащего йод в кровоток с помощью системы внутрисосудистого введения, с установленной скоростью и временем введения препарата. На основе полученных данных посредством компьютерной постобработки с 3D-реконструкцией строится трехмерная модель сердца и сосудов.
Конфликт интересов — ситуация, при которой у медицинского или фармацевтического работника при осуществлении ими профессиональной деятельности возникает личная заинтересованность в получении лично либо через представителя компании материальной выгоды или иного преимущества, которое влияет или может повлиять на надлежащее исполнение ими профессиональных обязанностей вследствие противоречия между личной заинтересованностью медицинского работника или фармацевтического работника и интересами пациента.
Лабораторная диагностика — совокупность методов, направленных на анализ исследуемого материала с помощью различного специализированного оборудования.
Лекарственные препараты — лекарственные средства в виде лекарственных форм, применяемые для профилактики, диагностики, лечения заболевания, реабилитации, для сохранения, предотвращения или прерывания беременности.
Магнитно-резонансная томография (МРТ) — способ получения томографических медицинских изображений для исследования внутренних органов и тканей с использованием явления ядерного магнитного резонанса.
Магнитно-резонансная ангиография (МР-ангиография, МРА) — метод получения изображения кровеносных сосудов при помощи магнитно-резонансного томографа.
Медицинское вмешательство — выполняемые медицинским работником и иным работником, имеющим право на осуществление медицинской деятельности, по отношению к пациенту, затрагивающие физическое или психическое состояние человека и имеющие профилактическую, диагностическую, лечебную, реабилитационную или исследовательскую направленность виды медицинских обследований и (или) медицинских манипуляций, а также искусственное прерывание беременности.
Медицинский работник — физическое лицо, которое имеет медицинское или иное образование, работает в медицинской организации и в трудовые (должностные) обязанности которого входит осуществление медицинской деятельности, либо физическое лицо, которое является индивидуальным предпринимателем, непосредственно осуществляющим медицинскую деятельность.
Пациент — физическое лицо, которому оказывается медицинская помощь или которое обратилось за оказанием медицинской помощи, независимо от наличия у него заболевания и от его состояния.
Протезирование клапана сердца – замена нативного клапана сердца протезом аортального клапана механический двустворчатый/протез аорты из биологического полимера, выполняющим его функцию.
Рабочая группа по разработке/актуализации клинических рекомендаций — коллектив специалистов, работающих совместно и согласованно в целях разработки/актуализации клинических рекомендаций, и несущих общую ответственность за результаты данной работы.
Расслоение аорты – разрушение среднего слоя ее стенки, спровоцированное внутристеночным попаданием крови, в результате которого происходит разделение слоев стенки аорты с последующим формированием «истинного» и «ложного» каналов аорты.
Реконструкция (пластика) клапана сердца – восстановление функции клапана сердца без его замены
Симптом (от греч. symptomos - признак, совпадение) – это признак какого-либо заболевания, статистически значимое отклонение того или иного показателя от границ его нормальных величин или возникновение качественно нового, не свойственного здоровому организму явления.
Синдром — устойчивая совокупность ряда симптомов с единым патогенезом.
Тезис-рекомендация — положение, отражающее порядок и правильность выполнения того или иного медицинского вмешательства, имеющего доказанную эффективность и безопасность.
Уровень достоверности доказательств (УДД) – степень уверенности в том, что найденный эффект от применения медицинского вмешательства является истинным
Уровень убедительности рекомендаций (УУР) – степень уверенности в достоверности эффекта вмешательства и в том, что следование рекомендациям принесет больше пользы, чем вреда в конкретной ситуации
Хирургическое лечение — метод лечения заболеваний путем разъединения и соединения тканей в ходе хирургической операции.
Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
1. Стандартизация диаметров корня аорты и восходящего отдела грудной аорты в зависимости от размеров тела
В соответствии с пороговыми значениями диаметра аорты, представленными в настоящих рекомендациях в отношении планирования хирургических вмешательств, пороговые значения диаметра 4,0–4,5 см предусмотрены для пациентов, чьи рост, площадь поверхности тела (ППТ) или оба этих показателя находятся в пределах 1–2 стандартных отклонений от средних значений. Для мужчин и женщин, рост которых значительно меньше или больше средних значений, эти диаметры должны быть скорректированы в меньшую или бóльшую сторону соответственно. Некоторые методики стандартизации диаметра аорты в настоящее время используются в клинической практике и клинических исследованиях [67].
Z-оценка. Z-оценка довольно часто применяется при анализе расширения аорты у детей, поскольку возрастные изменения размеров тела ребенка делают определение нормальных размеров аорты особенно проблематичным, как и отличие нормального роста аорты от патологического. Для расчета z-индекса подготовлены нормограммы, где показатели ППТ сопоставлены с диаметром корня аорты. Одним из недостатков ППТ является наличие нескольких формул для ее расчета, согласно которым для одного пациента можно получить разные результаты. Также существует несколько калькуляторов Z-оценки, и все они также работают по-разному. Наконец, большинство литературных источников, касающихся естественного течения ОАС, базируются на диаметрах аорты, в то время как сообщения об исходах на основе Z-оценок не представлены широко, в связи с чем Z-оценка обычно не применяется для регистрации степени расширения аорты у взрослых.
Размерный индекс аорты и ростовой индекс аорты. Чаще всего в рамках клинической работы со взрослыми пациентами проводят стандартизацию диаметров аорты, используя отношения диаметра аорты к ППТ или росту пациента. В 2006 году Davies и соавт. [268] показали, что размерный индекс аорты (РазмИА), который определяют по формуле «диаметр аорты (см)/ППТ (м2)», является лучшим предиктором нежелательных аортальных явлений по сравнению исключительно с диаметром, а для стратификации пациентов с аневризмами аорты по группам низкого, среднего и высокого рисков достаточно воспользоваться простой номограммой. Однако неясно, влияет ли значимым образом масса тела взрослого на ожидаемый нормальный диаметр аорты, при этом выраженные колебания массы тела не должны влиять на увеличение или уменьшение размеров аорты. В связи с этим Zafar и соавторы [41] проанализировали возможное превосходство ростового индекса аорты (РостИА, который определяют по формуле «диаметр аорты (см)/рост пациента (м)») над РазмИА; установлено, что РостИА по меньшей мере не уступает РазмИА [41], при этом обладает преимуществом более простых расчетов.
Отношение площади поперечного сечения к росту. Еще один подход к стандартизации диаметра аорты по росту был предложен Svensson и соавторами в 2002 г. [69] – они проводили расчет отношения площади поперечного сечения аорты (см) к росту пациента (м). В первичных исследованиях в качестве порога для проведения вмешательств применялось отношение площади поперечного сечения к росту >10 см2/м из-за значительного увеличения риска нежелательных явлений; при этом в более актуальных сообщениях данная группа пользовалась более простым отношением площади поперечного сечения к росту ≥10 см2/м (а не >10 см2/2) в качестве прогностического порога повышенного риска [70,103].
2. Стратификация риска хирургического лечения
-
Рекомендуется для пациентов с аневризмой грудной аорты и ТААА проводить стратификацию риска при планировании хирургического лечения [269,270].
ЕОК\РКО I C (УДД 4, УУР С)
Комментарии. Для выбора хирургической тактики и оптимизации лечения важнейшей задачей является выявление факторов риска и прогнозирование исхода операции. С этой целью рекомендуется использовать формулы для оценки риска летального исхода, представленные на сайтах Society of Thoracic Surgeons (www.riskcalc.sts.org) и European System for Cardiac Operative Risk Evaluation (www.euroscore.org). К категории высокого риска относятся пациенты, имеющие уровни логистического EuroSCORE ≥10%, EuroSCORE II ≥4 [269,270]. Выбор дополнительных методов обследования для верификации сопутствующих заболеваний определяется клинической ситуацией. При планировании лечения пациента важно учитывать ряд факторов, не включенных в шкалы EuroSCORE II и STS, но влияющих на риск осложнений вмешательства на грудной аорте. С высоким риском осложнений и плохим прогнозом после хирургических или транскатетерных вмешательств на восходящем отделе аорты и/или АК ассоциированы состояние недостаточного питания, кахексия, когнитивные нарушения, ряд индивидуальных анатомических особенностей, влияющих на технику хирургической коррекции ("фарфоровая" аорта, тяжелый кальциноз фиброзного кольца АК и прилегающих структур выходного отдела ЛЖ). Патология других органов и систем включает заболевания почек, печени, легких. Печеночная недостаточность до операции ассоциирована с повышенным риском осложнений. Имеющаяся у пациента хроническая болезнь почек 4 и 5 стадии (скорость клубочковой фильтрации <30 мл/мин) обусловливает высокий риск развития в ближайшем послеоперационном периоде острой почечной недостаточности, необходимости диализа, тяжелых осложнений и неблагоприятного исхода. Патология легких в сочетании с болевым синдромом в раннем послеоперационном периоде после вмешательства на АК с использованием полной срединной стернотомии в случае продленной искусственной вентиляции легких является фактором риска осложнений со стороны дыхательной системы. Так как с возрастом пациента растет встречаемость и тяжесть сопутствующих заболеваний, верная оценка соотношения риска и пользы того или иного метода лечения усложняется. При планировании лечения пациента с заболеванием аорты большую роль играет мультидисциплинарная команда специалистов («аортальная» команда), всесторонне оценивающая исходные данные и вырабатывающая оптимальную тактику ведения. Главной целью деятельности специализированных центров (клиник) является обеспечение высокого качества диагностики и лечения заболеваний аорты. Это достигается непрерывным медицинским образованием персонала, сочетанием клинической и научной деятельности, а также путем увеличения объемов оказываемой помощи. В условиях большого объема выполняемых операций и хороших результатов последних возможно эффективное внедрение в практику технических приемов и методик, характеризующихся крутой кривой обучения [271].
3. Нерешенные проблемы
Большая часть рекомендаций в настоящем документе основана на ограниченных сериях хирургических вмешательств, ретроспективном характере анализа данных, одноцентровых исследованиях пациентов с заболеваниями грудной аорты. Вследствие недостаточной доказательной базы рекомендаций рабочая группа подчеркивает необходимость продолжения исследовательской работы с целью ликвидации пробелов при ведении пациентов с заболеваниями грудной аорты. Так, на сегодняшний день:
- недостаточно эпидемиологических данных о распространенности ОАС;
- необходимы современные данные о рисках аортальных осложнений.
- требуется подтверждение наиболее точного, воспроизводимого и предиктивного способа измерения аорты с использованием различных диагностических методов;
- не выявлены предикторы аортальных осложнений (помимо размера) у пациентов с дилатацией грудной аорты.
- требуется изучение эффекта воздействия на факторы риска в отношении предотвращения или снижения скорости прогрессирования заболеваний грудной аорты.
- необходим поиск генетических, эпигенетических, анатомических детерминант развития и прогрессирования различных форм заболеваний грудной аорты и предикторов острого аортального синдрома.
- отсутствуют доказательства об эффективности существующей медикаментозной терапии при хронических заболеваниях грудной аорты, а также данные о новых группах препаратов;
- в отношении аневризм грудной аорты необходимо проведение РКИ для определения оптимального срока профилактических вмешательств в зависимости от распространенности поражения и других характеристик, а также индивидуальных особенностей пациента;
- отсутствуют высоко доказательные работы по оценке гендерных различий по течению заболевания и результатах хирургического лечения как у пациентов с аневризмами аорты, так и с ее расслоением.
- требуется увеличение доказательной базы при выборе наилучшего варианта лечения у пациентов с острыми и хроническими заболеваниями дуги аорты.
- необходима стандартизация терминологии.
Критерии оценки качества медицинской помощи
|
№
|
Критерии качества
|
Класс и уровень в зарубежных рекомнедациях
|
УУР
|
УУД
|
Оценка выполнения
|
|---|---|---|---|---|---|
|
1.
|
Проведен сбор жалоб и анамнеза у всех пациентов с подозрением на АГА и ТААА и осмотр генетика при наличии данных за НЗГА или семейную аортопатию
|
ЕОК/РКО I C
|
С
|
4
|
да/нет
|
|
2.
|
Выполнено физикальное обследование всех пациентов с подозрением на АГА и ТААА для установления диагноза.
|
ЕОК/РКО I C
|
С
|
4
|
да/нет
|
|
3.
|
Выдано направление в экспертный аортальный центр с большим операционным объемом (определение «экспертный центр» представлено в главе 3) имеющий в штате опытных хирургов в составе многопрофильной бригады по вмешательствам на аорте при рассмотрении оперативного вмешательства в целях оптимизации результатов лечения и диспансерного наблюдения пациентов с бессимптомным течением обширного поражения аорты, для тех, кому может помочь комплексное открытое и эндоваскулярное лечение аорты, или тех, кто имеет множественные сопутствующие заболевания.
|
ЕОК/РКО IIa C, АКК и ААC IIa C
|
C
|
4
|
да/нет
|
|
4.
|
Выполнена прицельная рентгенография органов грудной клетки всем пациентам с подозрением на АГА и ТААА в рамках первичного обследования, при поступлении в стационар, а также в случае оперативного лечения при необходимости в пери- и/или послеоперационном периоде для подтверждения диагноза.
|
ЕОК\РКО I С
|
С
|
5
|
да/нет
|
|
5.
|
Во время постановки диагноза и для последующего наблюдения для оценки анатомии и диаметра грудной аорты пациентам с расширенной грудной аортой выполнено КТА грудной аорты или МРА грудной аорты.
|
ЕОК/РКО I B, АКК и ААC 1 В
|
С
|
4
|
да/нет
|
|
6.
|
Выполнена ТТ-ЭхоКГ пациентам с расширенной грудной аортой во время постановки диагноза и для последующего наблюдения, в том числе для оценки анатомии аортального клапана, функции аортального клапана и диаметров грудной аорты.
|
ЕОК/РКО I B
|
А
|
2
|
да/нет
|
|
7.
|
Выполнены всем пациентам с АГА и ТААА, поступающим в стационар для оперативного лечения анализ кислотно-щелочного состояния крови (рН, ВЕ, рСО2, РО2, Lac - анализ капиллярной/артериальной/венозной проб) с целью оценки тяжести гипоксемии и степени выраженности метаболических нарушений, выполнение коагулограммы (ориентировачного исследования системы гемостаза) (активированное частичное тромбопластиновое время (АЧТВ), определение протромбинового (тромбопластинового) времени в крови (ПТИ), определение концетрации Д-димера в крови, исследование уровня фибриногена в крови, определение активности антитромбина III в крови), определение международного нормализованного отношения (МНО) для прогноза риска периоперационных кровотечений. Определение основных групп по системе AB0, определение антигена D системы резус (резус-фактор), определение фенотипа по антигенам C, c, E, e, Cw, K, k и определение антиэритроцитарных антител, определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови, определение антител к бледной трепонеме (Treponema pallidum) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови для исключения ассоциации с ВИЧ-инфекцией, гепатитом, а также в случае оперативного лечения при необходимости в пери- и/или послеоперационном периоде.
|
ЕОК/РКО I С
|
C
|
5
|
да/нет
|
|
8.
|
Выполнена ЧП-ЭхоКГ во время всех открытых операций на восходящей и дуге аорты.
|
ЕОК\РКО IIa B, ЕАКТХ IIa, B
|
С
|
4
|
да/нет
|
|
9.
|
Выполнено МРА аорты и её ветвей плановым пациентам с подозрением на АГА и ТААА при отсутствии противопоказаний в рамках первичного обследования при невозможности выполнения КТА аорты, при поступлении в стационар, а также в случае оперативного лечения при необходимости в пери- и/или послеоперационном периоде для установления и подтверждения диагноза, а также диагностики осложнений и сопутствующей патологии.
|
ЕОК\РКО I C, АКК и ААC I С
|
С
|
4
|
да/нет
|
|
10.
|
Выполнена коронарография всем пациентам с АГА и ТААА для выявления гемодинамически значимых стенозов коронарных артерий перед "открытым" хирургическим, транскатетерным или гибридным вмешательством на аорте мужчинам в возрасте старше 40 лет, женщинам в постменопаузе, факторами риска или подтвержденной ИБС, операциями на корне аорты.
|
ЕОК\РКО I C
|
С
|
5
|
да/нет
|
|
11.
|
При отсутствии противопоказаний и независимо от причины назначено применение бета-адреноблокаторов у пациентов с АГА и ТААА для достижения целевых показателей АД.
|
ЕОК\РКО IIa C, АКК и ААC IIа С
|
С
|
5
|
да/нет
|
|
12.
|
У пациентов с АГА, независимо от этиологии и при отсутствии противопоказаний, назначена терапия антагонистами рецепторов ангиотензина II в дополнение к терапии бета-адреноблокаторами для достижения целевых показателей АД.
|
ЕОК\РКО IIa C, АКК и ААC IIа С
|
А
|
1
|
да/нет
|
|
13.
|
Назначена терапия ингибиторами ГМГ-КоА-редуктазы умеренной или высокой интенсивности пациентам с АГА и ТААА и наличием атеросклероза по данным визуализации или при наличии клинических признаков атеросклероза.
|
ЕОК\РКО IIa C, АКК и ААC IIа С
|
С
|
5
|
да/нет
|
|
14.
|
Пациентам с атеросклеротическим генезом АГА или ТААА и наличием атероматоза аорты или пенетрирующих атеросклеротических язв назначены низкие дозы ацетилсалициловой кислоты** при отсутствии противопоказаний.
|
ЕОК\РКО IIа C, АКК и ААC IIa С
|
С
|
4
|
да/нет
|
|
15.
|
Выполнено открытое или эндоваскулярное вмешательство (см. текст рекомендаций) на грудной и торакоабдоминальной аорте у пациента с симптомной АГА и/или ТААА, а также при превышении диаметров аорты показаний указанных для конкретной категории пациентов в случае отсутствия противопоказаний.
|
ЕОК\РКО I C, АКК и ААC I С
|
С
|
4
|
да/нет
|
|
16.
|
Выполнена ТТ-ЭхоКГ в течение 2-4 недель после вмешательства на грудной аорте, затем через 6 и 12 месяцев, затем ежегодно.
|
ЕОК\РКО I С
|
С
|
4
|
да/нет
|
|
17.
|
Выполнено определение скорости расширения аорты у пациентов с расширенной грудной аортой выполнять визуализацию каждые 6–12 месяцев в динамике (в зависимости от индивидуальной анатомии с помощью ТТ-ЭхоКГ, КТА грудной аорты или МРА грудной аорты); если размер аорты стабилен выполнение контрольной визуализации рекомендуется каждые 6–24 месяца (в зависимости от диаметра аорты).
|
ЕОК\РКО IIa C, АКК и ААС IIa C
|
C
|
4
|
да/нет
|
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
Председатели рабочей группы:
Чарчян Эдуард Рафаэлович, Член-корреспондент РАН, профессор, д.м.н., зав. отделения кардиохирургии I, ФГБНУ «РНЦХ им. акад. Б. В. Петровского», Ассоциация сердечно-сосудистых хирургов России (АССХ), Российское общество ангиологов и сосудистых хирургов (РОАиСХ), European Association for Cardio-Thoracic Surgery (EACTS), The Society of Thoracoc Surgeons (STS)
Брешенков Денис Геннадьевич к.м.н., ст. научный сотрудник отделения кардиохирургии I, ФГБНУ «РНЦХ им. акад. Б. В. Петровского», Ассоциация сердечно-сосудистых хирургов России (АССХ)
Иртюга Ольга Борисовна, д.м.н., заведующая НИЛ врожденных и приобретенных пороков сердца, профессор кафедры кардиологии, заместитель директора по клинической работе ИМО, ФГБУ «НМИЦ им. В.А. Алмазова» МЗ РФ, Российское кардиологическое общество
Другие члены рабочей группы:
Абугов Сергей Александрович, д.м.н., член-корреспондент РАН, заведующий отделением рентгенохирургических (рентгенэндоваскулярных) методов диагностики и лечения ФГБНУ «РНЦХ им. акад. Б. В. Петровского», Российское общество ангиологов и сосудистых хирургов (РОАиСХ), Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению
Акчурин Ренат Сулейманович, академик РАН, д.м.н., профессор, заместитель генерального директора по хирургии, руководитель отдела сердечно-сосудистой хирургии ФГБУ «НМИЦК им. ак. Е. И. Чазова» МЗ РФ, Российское общество ангиологов и сосудистых хирургов (РОАиСХ), European Society for Vascular Surgery (ESVS)
Алекян Баграт Гегамович, академик РАН, д.м.н., профессор, руководитель Центра рентгенэндоваскулярной хирургии Института хирургии им. А.В. Вишневского, главный специалист Минздрава России по рентгенэндоваскулярной диагностике и лечению, Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению, Российское общество ангиологов и сосудистых хирургов (РОАиСХ)
Аракелян Валерий Сергеевич, д.м.н. профессор, заведующий отделом хирургии артериальной патологии ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» МЗ РФ, Российское общество ангиологов и сосудистых хирургов (РОАиСХ), European Society for Vascular Surgery (ESVS)
Бабакехян Мэри Вартановна, врач-кардиолог, младший научный сотрудник НИЛ врожденных и приобретенных пороков сердца, ассистент кафедры кардиологии ИМО, ФГБУ «НМИЦ им. В.А. Алмазова» МЗ РФ, Российское кардиологическое общество
Базылев Владлен Владленович, д.м.н., профессор, главный врач ФГБУ «Федеральный центр сердечно-сосудистой хирургии» (г. Пенза) МЗ РФ, Российское общество ангиологов и сосудистых хирургов (РОАиСХ), European Society for Vascular Surgery (ESVS)
Барбухатти Кирилл Олегович, д.м.н., профессор, главный кардиохирург Южного федерального округа и Краснодарского края, заведующий кафедрой кардиохирургии и кардиологии Кубанского государственного медицинского университета, Ассоциация сердечно-сосудистых хирургов России (АССХ), European Association for Cardio-Thoracic Surgery (EACTS)
Белов Юрий Владимирович, академик РАН, д.м.н., профессор, заслуженный деятель науки РФ, директор Институра кардио-аортальной хирургии ФГБНУ «РНЦХ им. акад. Б. В. Петровского», Российское общество ангиологов и сосудистых хирургов (РОАиСХ), European Society for Vascular Surgery (ESVS), European Association for Cardio-Thoracic Surgery (EACTS), The Society of Thoracoc Surgeons (STS)
Богачев-Прокофьев Александр Владимирович, д.м.н., директор института патологии кровообращения ФГБУ «НМИЦ им. акад. Е. Н. Мешалкина» МЗ РФ, Ассоциация сердечно-сосудистых хирургов России (АССХ), European Association for Cardio-Thoracic Surgery (EACTS)
Бокерия Лео Антонович, профессор хирургии, академик РАН, заслуженный деятель науки РФ, Президент ФГБУ "НМИЦ ССХ им. А.Н. Бакулева" МЗ РФ, Главный внештатный специалист сердечно-сосудистый хирург МЗ РФ, Руководитель отделения хирургического лечения интерактивной патологии, European Association for Cardio-Thoracic Surgery (EACTS), The Society of Thoracoc Surgeons (STS), European Society for Vascular Surgery (ESVS) и Международного кардиоторакального центра Монако, член Сербской Академии наук, президент Ассоциации сердечно-сосудистых хирургов России
Ванюркин Алмаз Гафурович, врач-сердечно-сосудистый хирург отделения сердечно-сосудистой хирургии №2, научный сотрудник НИО сосудистой и интервенционной хирургии, ФГБУ «НМИЦ им. В.А. Алмазова» МЗ РФ, Российское кардиологическое общество
Гапонов Дмитрий Прохорович, к.м.н. врач по РЭДЛ ФЦССХ г. Астрахань, доцент кафедры ССХ Астраханский ГМУ, Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению
Гордеев Михаил Леонидович, д.м.н., профессор, главный научный сотрудник НИО Кардиоторакальной хирургии ФГБУ «НМИЦ им. В.А.Алмазова» МЗ РФ, Ассоциация сердечно-сосудистых хирургов России (АССХ), European Association for Cardio-Thoracic Surgery (EACTS)
Имаев Тимур Имвярович, д.м.н., руководитель лаборатории гибридных методов лечения сердечно-сосудистых заболеваний отдела сердечно-сосудистой хирургии ИКК им. А.Л. Мясникова ФГБУ НМИЦ кардиологии МЗ РФ, Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению
Кавтеладзе Заза Александрович, д.м.н., профессор, заведующий отделением экстренной сосудистой и рентгенэндоваскулярной хирургии ФГБНУ «РНЦХ им. акад. Б. В. Петровского», Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению
Калинин Роман Евгеньевич, д.м.н., профессор, заведующий кафедрой сердечно-сосудистой, рентгенэндоваскулярной хиругии и лучевой диагностики ФГБОУ ВО РязГМУ Минздрава России, член Правления Российского общества ангиологов и сосудистых хирургов (РОАиСХ), член Исполнительного совета Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ), Ассоциации сердечно-сосудистых хирургов России (АССХ)
Когай Сергей Валериевич, врач-кардиолог отделения сердечно-сосудистой хирургии №2, ассистент кафедры факультетской терапии с клиникой ЛФ ИМО, ФГБУ «НМИЦ им. В.А. Алмазова» МЗ РФ, Российское кардиологическое общество
Козлов Борис Николаевич, д.м.н., зав. кардиохирургического отделения № 1 НИИ Кардиологии Томского НИМЦ, Ассоциация сердечно-сосудистых хирургов России (АССХ), Российское общество ангиологов и сосудистых хирургов (РОАиСХ), European Association for Cardio-Thoracic Surgery (EACTS)
Комаров Роман Николаевич д.м.н., профессор, зав. кафедрой сердечно-сосудистой хирургии ИПО ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России (Сеченовский университет), директор клиники сердечно-сосудистой хирургии Сеченовского университета, Ассоциация сердечно-сосудистых хирургов России (АССХ), Российское общество ангиологов и сосудистых хирургов (РОАиСХ)
Конради Александра Олеговна, академик РАН, д.м.н., профессор, заместитель генерального директора по научной работе, заведующая НИО артериальной гипертензии, заведующая кафедрой организации управления и экономики здравоохранения ИМО ФГБУ «НМИЦ им. В. А. Алмазова» МЗ РФ, Российское кардиологическое общество
Лепилин Петр Михайлович, к.м.н. старший научный сотрудник лаборатории гибридных методов лечения сердечно-сосудистых заболеваний Института клинической кардиологии им А.Л. Мясникова ФГБУ «РКНПК» МЗ РФ, Российское общество ангиологов и сосудистых хирургов (РОАиСХ)
Малев Эдуард Геннадиевич, д.м.н., ведущий научный сотрудник НИО некоронарогенных заболеваний сердца, ФГБУ «НМИЦ им. В.А. Алмазова» МЗ РФ, Российское кардиологическое общество
Мироненко Владимир Александрович, д.м.н., заведующий отделением реконструктивной хирургии и корня аорты ФГБУ «НМИЦ ССХ им. А.Н. Бакулева» МЗ РФ, Ассоциация сердечно-сосудистых хирургов России (АССХ), European Association for Cardio-Thoracic Surgery (EACTS)
Панфилов Дмитрий Сергеевич, д.м.н., старший научный сотрудник кардиохирургического отделения № 1 НИИ Кардиологии Томского НИМЦ, Ассоциация сердечно-сосудистых хирургов России (АССХ), Российское общество ангиологов и сосудистых хирургов (РОАиСХ)
Поляков Роман Сергеевич, д.м.н., главный научный сотрудник отделения рентгенохирургических (рентгенэндоваскулярных) методов диагностики и лечения ФГБНУ «РНЦХ им. акад. Б. В. Петровского», Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению
Россейкин Евгений Владимирович, д.м.н., главный врач ФГБУ "Федеральный центр сердечно-сосудистой хирургии" МЗ РФ (г. Хабаровск), Ассоциация сердечно-сосудистых хирургов России (АССХ), European Association for Cardio-Thoracic Surgery (EACTS)
Светликов Алексей Владимирович, д.м.н., зав. отделением сосудистой хирургии ФГБУ СЗОНКЦ им. Л.Г. Соколова ФМБА РФ, доцент кафедры факультетской хирургии Санкт-Петербургского государственного университета (Санкт-Петербург), Российское общество ангиологов и сосудистых хирургов (РОАиСХ), European Society for Vascular Surgery (ESVS), Society for vascular surgery, European Atherosclerosis Society
Сирота Дмитрий Андреевич, к.м.н., заведующий научно-исследовательского отдела хирургии аорты, коронарных и периферических артерий ФГБУ «НМИЦ им. акад. Е. Н. Мешалкина» МЗ РФ, Ассоциация сердечно-сосудистых хирургов России (АССХ), European Association for Cardio-Thoracic Surgery (EACTS)
Сухоручкин Владислав Александрович к.м.н., сердечно-сосудистый хирург отделения сосудистой хирургии ФГБУ СЗОНКЦ им. Л.Г. Соколова ФМБА РФ, Российское общество ангиологов и сосудистых хирургов (РОАиСХ)
Сучков Игорь Александрович, д.м.н., профессор, профессор кафедры сердечно-сосудистой, рентгенэндоваскулярной хиругии и лучевой диагностики ФГБОУ ВО РязГМУ Минздрава России, вице-президент Российского общества ангиологов и сосудистых хирургов (РОАиСХ), президент Ассоциации флебологов России (АФР), член Российского общества хирургов (РОХ), Ассоциации сердечно-сосудистых хирургов России (АССХ), International Union of Angiology (IUA)
Успенский Владимир Евгеньевич, д.м.н., заведующий НИЛ заболеваний аорты и аортального клапана, доцент кафедры факультетской хирургии, ФГБУ «НМИЦ им. В.А. Алмазова» МЗ РФ, Российское кардиологическое общество
Хафизов Тимур Назирович к.м.н. заведующий отделением рентгенхирургических методов диагностики и лечения ГБУЗ Республиканский кардиологический центр (г. Уфа), Российское научное общество специалистов по рентгенэндоваскулярной диагностике и лечению
Хубулава Геннадий Григорьевич, академик РАН, д.м.н., профессор, заслуженный врач РФ, руководитель Научно-клинического центра сердечно-сосудистой хирургии Первого СПбГМУ им. акад. И.П. Павлова, главный кардиохирург Санкт-Петербурга и Северо-Западного округа РФ, Ассоциация сердечно-сосудистых хирургов России (АССХ), Российское общество ангиологов и сосудистых хирургов (РОАиСХ), European Society for Vascular Surgery (ESVS), European Association for Cardio-Thoracic Surgery (EACTS)
Чернявский Александр Михайлович, д.м.н., профессор, член-корреспондент РАН, заслуженный деятель науки РФ, генеральный директор ФГБУ «НМИЦ им. акад. Е. Н. Мешалкина» МЗ РФ, Российское общество ангиологов и сосудистых хирургов (РОАиСХ), European Society for Vascular Surgery (ESVS)
Чернявский Михаил Александрович, д.м.н., главный научный сотрудник, зав. НИО сосудистой и интервенционной хирургии, ФГБУ «НМИЦ им. В.А. Алмазова» МЗ РФ, Российское кардиологическое общество
Члены Рабочей группы подтвердили отсутствие финансовой поддержки/конфликта интересов. В случае сообщения о наличии конфликта интересов член(ы) рабочей группы был(и) исключен(ы) из обсуждения разделов, связанных с областью конфликта интересов.
Приложение А2. Методология разработки клинических рекомендаций
Вследствие того, что Российское кардиологическое общество (РКО) входит в состав Европейского общества кардиологов (ЕОК), и члены РКО также являются членами ЕОК, все европейские рекомендации формируются с участием российских экспертов, которые являются соавторами рекомендаций. Таким образом, существующие рекомендации ЕОК отражают общее мнение ведущих российских и европейских кардиологов.
В связи с этим, формирование национальных рекомендаций проводилось на основе рекомендаций ЕОК с учетом национальной специфики, особенностей обследования, лечения, доступности той или иной медицинской помощи. По этой причине в ходе разработки российских клинических рекомендаций РКО использованы международные классы показаний рекомендаций, позволяющие оценить необходимость выполнения тезиса рекомендаций и уровни достоверности доказательств данных классов (Таблицы П1 и П2).
В тех случаях, когда в европейских рекомендациях отсутствовали классы и уровни доказательности, но по мнению экспертов РКО данные тезисы являлись крайне необходимыми для выполнения или, наоборот, абсолютно не рекомендованы к применению, эксперты РКО, основываясь на правилах формирования классов показаний согласно рекомендациям Европейского общества кардиологов, сами проставляли классы и уровни. В данной ситуации обозначение ЕОК заменено на РКО-классы и уровни, проставленные экспертами РКО.
Кроме того, добавлена новая система шкал УДД и УУР для лечебных, реабилитационных, профилактических вмешательств и диагностических вмешательств (Таблицы П3, П4 и П5), введенная в 2018 г. ФГБУ ЦЭККМП Минздрава РФ. Таким образом, в тексте клинических рекомендаций, разрабатываемых экспертами РКО, одновременно использованы две шкалы (Таблицы П1-П5).
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию — не реже чем один раз в три года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает МЗ РФ на основе предложений, представленных медицинскими некоммерческими профессиональными организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации новых методов лечения.
Целевая аудитория разработанных клинических рекомендаций:
-
Врач сердечно-сосудистый хирург
-
Врач-кардиолог
-
Врач по рентгенэндоваскулярной диагностике и лечению
-
Врач ультразвуковой диагностики
-
Врач-рентгенолог
-
Врач-терапевт
-
Врач-генетик
-
Врач-хирург
-
Врач общей практики (семейный врач)
Методы сбора/селекции доказательств: поиск в электронных базах данных
Описание методов, использованных для оценки качества и силы доказательств: доказательной базой рекомендаций, являются публикации, включенные в базы данных PubMed, Scopus, Google Scholar. Глубина поиска составила 40 лет.
Методы оценки качества и силы доказательств
-
консенсус экспертов;
-
оценка качества рекомендаций в соответствии с рейтинговой схемой (таблица П1).
-
оценка силы доказательств в соответствии с рейтинговой схемой (таблица П2).
В ходе разработки КР использованы международные шкалы уровня убедительности рекомендаций и уровня достоверности доказательств (Таблицы П1 и П2), а также новая система шкал УДД и УУР для лечебных, реабилитационных, профилактических вмешательств и диагностических вмешательств (Таблицы П3, П4 и П5), введенная в 2018 г. ФГБУ ЦЭККМП Минздрава РФ. Формирование Национальных рекомендаций проводилось на основе рекомендаций ЕОК, с учетом национальной специфики, особенностей обследования, лечения, учитывающих доступность медицинской помощи. По этой причине в тексте настоящих клинических рекомендаций, одновременно использованы две шкалы оценки достоверности доказательств тезисов рекомендаций: уровни достоверности доказательств ЕОК с УУР и УДД. Добавлены классы рекомендаций ЕОК, позволяющие оценить необходимость выполнения тезиса рекомендаций.
Таблица П1.
Классы показаний согласно рекомендациям других зарубежных обществ (ЕОК, АКК и ААС, ЕАКТХ).
|
Класс рекомендаций (ЕОК)
|
Определение
|
Предлагаемая формулировка
|
|---|---|---|
|
I
|
Доказано или общепризнанно, что диагностическая процедура, вмешательство/ лечение являются эффективными и полезными
|
Рекомендовано/
показано
|
|
II
IIa
IIb
|
Противоречивые данные и/или мнения об эффективности/пользе диагностической процедуры, вмешательства, лечения
Большинство данных/мнений в пользу эффективности/пользы диагностической процедуры, вмешательства, лечения
Эффективность/польза диагностической процедуры, вмешательства, лечения установлены менее убедительно
|
Целесообразно
применять
Можно
применять
|
|
III
|
Данные или единое мнение, что диагностическая процедура, вмешательство, лечение бесполезны/не эффективны, а в ряде случаев могут приносить вред
|
Не рекомендуется применять
|
Таблица П2.
Уровни достоверности доказательств согласно рекомендациям Европейского Общества Кардиологов (ЕОК, АКК и ААС, ЕАКТХ)
|
Уровни достоверности доказательств (ЕОК, АКК и ААС, ЕАКТХ)
|
|
|---|---|
|
A
|
Данные многочисленных рандомизированных клинических исследований или метаанализов
|
|
B
|
Данные получены по результатам одного рандомизированного клинического исследования или крупных нерандомизированных исследований
|
|
C
|
Согласованное мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров
|
Таблица П3.
Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, лечебных, реабилитационных вмешательств)
|
Уровни достоверности доказательств (УДД)
Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности, включаемой в клинические рекомендации информации» (зарегистрирован 08.05.2019 № 54588)
|
|
|---|---|
|
1
|
Систематический обзор рандомизированных клинических исследований с применением метаанализа
|
|
2
|
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
|
|
3
|
Нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследование «случай-контроль»
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Таблица П4.
Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД
|
Расшифровка
|
|---|---|
|
1
|
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
|
|
2
|
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
|
|
3
|
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода, или нерандомизированные сравнительные исследования, в том числе когортные исследования
|
|
4
|
Несравнительные исследования, описания клинических случаев
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Таблица П5.
Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения, медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
Уровень убедительности рекомендации (УРР)
Приказ Министерства здравоохранения Российской Федерации от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» (зарегистрирован 08.05.2019 № 54588)
|
|
|---|---|
|
А
|
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
В
|
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
С
|
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
Приложение А3. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов, инструкции по применению лекарственного препарата
-
Об основах охраны здоровья граждан в Российской Федерации (ФЗ №323 от 21.11.2011)
-
О внесении изменений в отдельные законодательные акты Российской Федерации по вопросам применения информационных технологий в сфере охраны здоровья (ФЗ №242 от 29.07.2017)
-
Порядок оказания медицинской помощи больным с сердечно-сосудистыми заболеваниями (Приказ Минздрава России №918н от 15.11.2012 с изменениями и дополнениями от 21.02.2020)
-
О классификации и критериях, используемых при осуществлении медико-социальной экспертизы граждан федеральными государственными учреждениями медико-социальной экспертизы (Приказ Минздрава России №585нн от 27.08.2019)
-
О Порядке организации медицинской реабилитации взрослых (Приказ Министерства здравоохранения РФ №778н от 31.07.2020)
-
Об утверждении порядка проведения диспансерного наблюдения за взрослыми (Приказ Министерства здравоохранения РФ №168н от 15 марта 2022)
-
Методические рекомендации по проведению оценки научной обоснованности включаемой в клинические рекомендации информации ФГБУ «ЦЭККМП» Минздрава России, 2019
ПА3-1. Опросник SF-36 «Оценка качества жизни»



ПА3-2. Шкала EuroSCORE
|
Возраст
|
||
|---|---|---|
|
|
<60 (0 балла(ов))
60-64 (1 балл)
65-69 (2 балла(ов))
70-74 (3 балла(ов))
75-79 (4 балла(ов))
80-84 (5 балла(ов))
85-89 (6 балла(ов))
90-94 (7 балла(ов))
95-100 (8 балла(ов))
|
|
|
Пол
|
||
|
|
|
Женщины (1 балл)
|
|
|
|
Мужчины (0 балла(ов))
|
|
Фракция выброса
|
||
|
|
|
30–50 % (1 балл)
|
|
|
|
< 30 % (3 балла(ов))
|
|
|
|
Нарушение функции почек (2 балла(ов))
|
|
|
|
Заболевания периферических сосудов (2 балла(ов))
|
|
|
|
Респираторное заболевание (1 балл)
|
|
|
|
Сосудистое заболевание головного мозга (2 балла(ов))
|
|
|
|
Кардиохирургическая операция в анамнезе (3 балла(ов))
|
|
|
|
Активный эндокардит (3 балла(ов))
|
|
|
|
Критическое предоперационное состояние (3 балла(ов))
|
|
|
|
Нестабильная стенокардия (2 балла(ов))
|
|
|
|
Недавний инфаркт миокарда (2 балла(ов))
|
|
|
|
Легочная гипертензия (2 балла(ов))
|
|
|
|
Экстренная хирургическая операция (2 балла(ов))
|
|
|
|
Операция помимо изолированного аортокоронарного шунтирования (АКШ) (2 балла(ов))
|
|
|
|
Разрыв межжелудочковой перегородки (4 балла(ов))
|
|
|
|
Операция на грудной аорте (3 балла(ов))
|
Общий результат
|
0 - 2 баллы:
|
Низкий риск
|
|---|---|
|
3 - 5 баллы:
|
Умеренный риск
|
|
6 - 45 баллы:
|
Высокий риск
|
ПА3-3. Шкала EuroSCORE II
Приложение Б. Алгоритмы действий врача
Диагностика пациентов с заболеваниями грудной аорты и протоколы генетических анализов
Алгоритм ведения пациента с аневризмой нисходящего грудного отдела аорты
Приложение В. Информация для пациента
Что такое аневризма аорты?
Аорта – самый крупный кровеносный сосуд в организме. Он доставляет насыщенную кислородом кровь от сердца к остальным частям тела. Аневризма аорты представляет собой выбухающий, ослабленный участок стенки аорты. Со временем аорта увеличивается и возникает риск разрыва или расслоения. Это может вызвать опасное для жизни кровотечение и потенциально смерть.
После формирования аневризма постепенно увеличивается в размерах, и стенка становится все слабее. Лечение аневризмы грудной аорты может включать хирургическое вмешательство с удалением аневризмы или установку стент-графта для поддержки стенки аорты и предотвращения разрыва.
Что вызывает формирование аневризмы грудной аорты?
Различные болезненные процессы могут вызвать аневризму грудной аорты, в том числе:
-
Дегенеративное заболевание, вызывающее разрушение ткани стенки аорты.
-
Генетические нарушения
-
Семейные аортопатии
-
Атеросклероз
-
Инфекция (редко)
-
Воспаление артерий (васкулит)
Что может произойти без лечения?
Естественное течение этого заболевания связано с высоким риском возникновения грозных осложнений:
Развитие аневризмы аорты, стенки которой очень тонкие и может внезапно произойти ее разрыв, следствием чего является острое, почти всегда смертельное кровотечение;
Хирургическое лечение позволяет избежать этих опасностей.
Каковы симптомы аневризмы грудного отдела аорты?
Аневризмы грудной аорты могут не вызывать симптомов. Когда симптомы действительно возникают, они могут быть связаны с местоположением, размером и скоростью роста аневризмы. Внезапная сильная боль, связанная с аневризмой грудной клетки, может быть признаком опасной для жизни неотложной медицинской помощи. Симптомы грудной аневризмы могут включать:
-
Боль в челюсти, шее или верхней части спины
-
Боль в груди или спине
-
Свистящее дыхание, кашель или одышка в результате давления на трахею
-
Охриплость голоса в результате давления на нервы иннервирующие связки.
-
Проблемы с глотанием из-за давления на пищевод.
Симптомы аневризмы грудной аорты могут быть похожи на другие состояния.
Как проводится операция?
Хирургическая операция проводится под наркозом. Риск анестезии вам детально объяснит врач-анестезиолог. Целью операции является устранение аневризмы аорты с замещением ее протезом или стент-графтом. Для этого через разрез (по средней линии живота, боковым разрезом через живот, рассечение грудины) обнажается аорта, пережимается аорта, пришивается синтетический протез для устранения последствий расслоения аорты. Протезы аорты и артерий не отторгаются и верно служат в течение всей жизни больного. При малоинвазивном вмешательстве, через разрез на бедре в просвет аорты устанавливается специальный протез (стент-граф).
Для отсасывания раневого секрета в ране оставляются временные дренажи (трубки). После завершения операции иногда проводится рентгенологическое исследование с рентгенконтрастным средством, содержащим йод.
Может понадобиться увеличение объема операции
Врач обсуждает с вами этапы оперативного вмешательства, однако во время операции может возникнуть необходимость в проведении дополнительных незапланированных этапов. На это также должно быть получено ваше согласие; в противном случае, операция будет остановлена. Повторная операция будет проводиться после дополнительного обсуждения с вами, что увеличит сроки лечения и повысит вероятность опасных осложнений и неблагоприятного исхода.
Какие могут быть осложнения?
В отдельных случаях при тяжелых операциях могут возникать осложнения.
Общие осложнения:
Послеоперационные кровотечения, крупные гематомы;
Инфекционные осложнения. Возникает нагноение раны, которое требует дальнейших лечебных мероприятий. При этом раны заживают долго, с образованием келоидных рубцов;
Образование тромбов в венах с возможной эмболией легочных артерий. При повышенном риске вы будете получать медикаментозные препараты с профилактической целью, которые понижают свертываемость крови (Антитромботические средства (B01A)). При применении этих препаратов может повыситься склонность к кровотечениям. При инъекции этих препаратов, так же, как и при инъекции любых других, в единичных случаях могут возникать абсцессы;
Сдавление нервов и мягких тканей из-за необходимого при операции длительного неподвижного положения тела. Эти осложнения встречаются очень редко и, как правило, проходят в течение недели. В отдельных случаях могут оставаться жалобы (например, чувство онемения) и рубцы. Также может встречаться поражение кожи дезинфектантами;
Гемотрансфузия, которая может потребоваться при определенных обстоятельствах. Крайне редко может возникнуть заражение (например, вирусами гепатита, ВИЧ/СПИД);
Реакции гиперчувствительности (аллергии) на медикаменты, средства для наркоза и рентгенологического исследования, которые могут проявляться, например, зудом. Крайне редко встречаются сильно выраженные реакции, такие как коллапс, судороги и нарушение дыхания, которые требуют стационарного лечения и могут приводить к необратимым последствиям;
Избыточное рубцевание. При соответствующей предрасположенности могут, как и при другой операции, возникать толстые бугристые и/или болезненные рубцы (келоиды);
Специфические осложнения
Повреждения соседних органов таких, как кишечник, мочеточник, мочевой пузырь и т.д., которое потребует соответствующего расширения операции;
Редко может возникнуть ишемия спинного мозга, временная или постоянная, причиной которой является ухудшение кровоснабжения спинного мозга при пережатии аорты;
Почечная недостаточность. Из-за пережатия аорты выше отхождения почечных артерий ограничивается кровоснабжение почек, следствием чего является почечная недостаточность. Может возникнуть необходимость в применении методов очистки крови (диализ);
Ухудшение кровоснабжения кишечника и печени из-за пережатия аорты во время операции. Иногда может потребоваться удаление участка кишки. В чрезвычайных ситуациях может потребоваться создание искусственного ануса (выведение кишки на переднюю брюшную стенку);
Закупорка (тромбоз), эмболия протеза, ниже и вышележащих участков сосуда. Следствием является уменьшение кровоснабжения органов и рецидив заболевания. В этом случае будет обсуждаться необходимость оперативного или консервативного лечения.
Инфицирование протеза, что может привести к кровотечению из швов протеза; при прогрессировании инфекции может потребоваться удаление протеза, следствием чего станет значительное ухудшение кровоснабжения органов.
Послеоперационное расширение аорты в месте прикрепления протеза к аорте; большое расширение должно быть удалено повторным оперативным вмешательством.
Все вышеназванные осложнения могут возникнуть после операции. Но серьезные осложнения встречаются редко: при повторных операциях (если возникает рецидив), при прогрессировании болезни, при избыточной массе тела или при наличии сопутствующих заболеваний, курении.
Каковы перспективы?
В большинстве случаев операция приводит к улучшению состояния и исчезновению жалоб.
Для сохранения положительного результата операции необходимо ваше активное участие. Требуется лечение и профилактика прогрессирования основного заболевания. Для этого вы должны полностью отказаться от курения, обсудить с вашим лечащим врачом специальную диету и возможность устранения факторов риска.
На что следует обратить внимание?
Особенно важными являются контрольные обследования после операции для своевременного выявления оценки состояния оперированного сосуда и выявлении возможных осложнений.
Приложение Г1-ГN. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Нет.
Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.