Агрессивные В-клеточные лимфомы
 Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Версия: Клинические протоколы МЗ РК - 2023 (Казахстан)
Диффузная неходжкинская лимфома неуточненная (C83.9), Другие типы диффузных неходжкинских лимфом (C83.8), Злокачественные иммунопролиферативные болезни неуточненные (C88.9), Неходжкинская лимфома: иммунобластная (диффузная) (C83.4), Неходжкинская лимфома: крупноклеточная (диффузная) (C83.3), Неходжкинская лимфома: лимфобластная (диффузная) (C83.5), Неходжкинская лимфома: недифференцированная (диффузная) (C83.6), Опухоль Беркитта (C83.7)
Онкогематология
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «18» августа 2023 года
Протокол №187
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
АГРЕССИВНЫЕ В-КЛЕТОЧНЫЕ ЛИМФОМЫ
ВВОДНАЯ ЧАСТЬ
Код(ы) МКБ:
| МКБ-10 | МКБ-9 | ||
|
Код
|
Название | Код | Название |
| С83.3 | Диффузная неходжкинская лимфома крупноклеточная | 40.11 | Биопсия лимфатической структуры |
| С83.4 | Диффузная неходжкинская лимфома иммунобластная | 40.21 | Иссечение глубокого шейного лимфатического узла |
| С83.5 | Диффузная неходжкинская лимфома лимфобластная | 40.23 | Иссечение подмышечного лимфатического узла |
| С83.6 | Диффузная неходжкинская лимфома недифференцированная | 40.24 | Иссечение пахового лимфатического узла |
| С83.7 | Лимфома Беркитта | 40.29 | Простое иссечение другой лимфатической структуры |
| С83.8 | Другие типы неходжкинских лимфом | 40.30 | Локальное иссечение лимфоузла |
| С83.9 | Диффузная неходжкинская лимфома неуточненная | 40.11 | Биопсия лимфатической структуры |
| С88.9 | Злокачественные иммунопролиферативные болезни, неуточненные | 41.50 | Полная спленэктомия |
| 86.11 | Биопсия кожи и подкожных тканей | ||
| 41.98 | Другие манипуляции на костном мозге | ||
| 99.791 | Заготовка стволовых гемопоэтических клеток крови для аутотрансплантации | ||
| МКБ-11 | |
| 2А81 | Диффузные крупноклеточные В-клеточные лимфомы |
| 2А81.0 | Первичная медиастинальная В-крупноклеточная лимфома |
| 2А81.1 | Внутрисосудистая В-крупноклеточная лимфома |
| 2А81.2 | Плазмобластная лимфома |
| 2А81.3 | Лимфоматоидный гранулематоз |
| 2А81.4 | Крупно-В-клеточная лимфома, богатая Т-клетками/гистиоцитами |
| 2А81.5 | Первичная диффузная В-крупноклеточная лимфома центральной нервной системы |
| 2А81.6 | Вирус Эпштейна-Барр-положительная диффузная В-крупноклеточная лимфома пожилых людей |
| 2А81.7 | Диффузная В-крупноклеточная лимфома, ассоциированная с хроническим воспалением |
| 2А81.8 | ALK-положительная В-крупноклеточная лимфома |
| 2А81.9 | Первичная выпотная лимфома |
| 2А81.А | Первичная кожная диффузная В-крупноклеточная лимфома, тип «нижних конечностей» |
| 2A81.Y | Другие уточненные диффузные В-крупноклеточные лимфомы |
| 2A81.Z | Диффузная В-крупноклеточная лимфома, не уточненная |
NB! *Использование после разрешения к применению в РК.
Дата разработки/пересмотра протокола: 2016 год (пересмотр 2022 г).
Пользователи протокола: врачи общей практики, терапевты, онкологи, гематологи, акушер-гинекологи.
Категория пациентов: взрослые, беременные.
Шкала уровня доказательности:
| Уровень доказательности | Характеристика исследований, которые легли в основу рекомендаций |
| А | Высококачественный мета-анализ, систематический обзор рандомизированных клинических исследований (РКИ) или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых, могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых, могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки(+), результаты которых, могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование, или мнение экспертов |
Определение:
Агрессивные В-клеточные лимфомы
По течению заболевания неходжскинские лимфомы делятся на индолентные и агрессивные.
Агрессивные неходжкинские лимфомы - это наиболее распространенный подтип НХЛ, который характеризуется быстрым темпом роста опухоли в лимфатических узлах, селезенки, печени, с поражением костного мозга и других органов.
Диффузные B-крупноклеточные лимфомы - В-клеточная опухоль, образованная диффузным пролифератом из среднего и крупного размера лимфоидных клеток. Среди диффузных крупноклеточных В-клеточных лимфом выделяют отдельные клинико- морфологические категории, исходя из морфологических, иммунофенотипических, молекулярных, биологических и клинических характеристик. Лимфомы, которые не соответствуют специфическим критериям определенной клинико-морфологической категории диффузной крупноклеточной В-клеточной лимфомы, называют диффузной крупноклеточной В-клеточной лимфомой, неуточненной [1].
ДВККЛ являются наиболее распространенными лимфоидными новообразованиями у взрослых, составляя примерно 30% всех неходжкинских лимфом (НХЛ), диагностируемых ежегодно [2]. В возрасте до 18 лет частота заболеваемости ДВККЛ не превышает 8-10%. Риск развития опухоли увеличивается с возрастом и значительно выше у людей с серопозитивностью на вирус гепатита С, при наличии вируса иммунодефицита человека. [3]. Медиана возраста составляет 64 года. Несколько чаще болеют мужчины[1].
Первичная медиастинальная В-крупноклеточная лимфома - представляет собой отдельный подтип НХЛ, который гистологически неотличим от ДВККЛ, с первичным очагом заболевания в переднем средостении. Средний возраст 35 лет. Заболеваемость преобладает у женщин[4,5].
ПМ-ДВККЛ возникает из B-клеток тимуса с начальным местно-региональным распространением на надключичные, шейные, прикорневые узлы, в средостение и легкие. Клинические симптомы могут быть связаны с быстрым ростом новообразования средостения, включая синдром верхней полой вены, выпот в перикард и плевральный выпот[4].
В-клеточная лимфома неклассифицируемая, с признаками, промежуточными между ДВККЛ и классической лимфомой Ходжкина (Лимфома серой зоны) - В классификации ВОЗ эта В-клеточная лимфома с признаками, характерными как для классической лимфомы Ходжкина, так и для диффузной крупноклеточной В-клеточной лимфомы, особенно первичной медиастинальной В-клеточной лимфомы, отнесена к пограничной категории, названной В-клеточной лимфомой неклассифицируемой с признаками, промежуточными между диффузной крупноклеточной В-клеточной лимфомой и классической лимфомой Ходжкина[1]. Чаще всего эти лимфомы возникают в средостении. Обычно они наблюдаются у мужчин, средний возраст 20-40 лет. Имеет более плохой клиническим прогноз, чем кЛХ или ПМ-ДВККЛ[2].
В-клеточная лимфома высокой степени злокачественности с двойной или тройной поломкой (транслокацией) “double-hit” или “triple-hit”- агрессивные В-клеточная лимфомы, характеризующиеся транслокациями генов МҮС и ВCL2 и/или ВСL6. Категория объединяет все В-клеточные лимфомы (кроме фолликулярной лимфомы и В-лимфобластного лейкоза/лимфомы) с перестройками генов МҮС и ВCL2 и/или ВСL6. Эти перестройки генов можно обнаружить с помощью стандартного кариотипирования, FISH или других методов молекулярной диагностики[1]. Эти лимфомы развиваются преимущественно у пациентов пожилого возраста. Медиана возраста составляет 60-70 лет. Несколько чащe болеют мужчины[1].
ДВККЛ, которые иммуногистохимически экспрессируют белки MYC и BCL2, но цитогенетически отрицательны на поломки, не относятся к данной группе агрессивных В-клеточных лимфом, так называемые лимфомы с двойной экспрессией (Dual Expression Lymphomas). Эти лимфомы так же имеют плохой прогноз по сравнению с классической ДВККЛ, но в настоящее время лечение не отличается от терапии типичных случаев ДВККЛ[6].
Лимфома Беркитта – это опухоль, субстратом которой являются атипичные мономорфные В-лимфоциты среднего размера с базофильной цитоплазмой несущие перестройку гена c-MYC, экспрессирующие маркеры центра фолликула и обладающие высокой пролиферативной активностью[7]. В текущей классификации ВОЗ указано три клинических варианта ЛБ[8]:
1 Эндемический - наиболее распространенная форма злокачественных новообразований у детей, встречающаяся в экваториальной Африке, и большинство случаев связано с Эпштейн-Барр вирусом.
2. Спорадический - составляют от 1% до 2% всех лимфом взрослых, могут быть связаны с ЭБВ-инфекцией примерно в 30% случаев.
3. ЛБ, ассоциированная с иммунодефицитом - встречается в основном у пациентов, инфицированных вирусом иммунодефицита человека, у людей с врожденным иммунодефицитом и у некоторых пациентов после трансплантации гемопоэтических клеток .
ДВККЛ, трансформированная - данный вид лимфомы возникает как следствие трансформации зрелоклеточных индолентных НХЛ (в частности, лимфомы из малых лимфоцитов/хронического лимфолейкоза, фолликулярной лимфомы, лимфомы из клеток зоны мантии и некоторых других.
Лимфобластная лимфома – категория лимфобластных лимфом включает два заболевания: T-лимфобластная лимфома/лейкоз (90%) и В-лимфобластная лимфома/лейкоз (10%), с экстрамедуллярными очагами поражения[2]. Термин «В-лимфобластная лимфома» используют в случаях отсутствия или минимального вовлечения крови и костного мозга (менее 25% лимфобластов в костном мозге). Патологический процесс главным образом развивается в лимфатических узлах и экстранодально[1]
ВИЧ-ассоциированные лимфомы – наиболее распространенными подтипами НХЛ у пациентов, живущих с ВИЧ являются ДВККЛ, ЛБ и первичная лимфома центральной нервной системы. Заболеваемость лимфомой Ходжкина и индолентной лимфомой также выше у людей, живущих с ВИЧ, но они встречаются гораздо реже, чем ЛБ или ДВККЛ. Плазмобластная лимфома является менее распространенной формой системных лимфом, составляя менее 5% лимфом у людей, живущих с ВИЧ [9]
Классификация
Классификация:
Совместно с определением патоморфологического варианта ДВККЛ, у каждого пациента с ДВККЛ должна быть определена стадия заболевания согласно классификации Ann Arbor [10], а также группа риска согласно одной из прогностических моделей для ДВККЛ [11-13]
Система стадирования Ann-Arbor в модификации Cotswold [10]:



1 К лимфатическим структурам относят лимфатические узлы, селезенку, вилочковую железу, кольцо Вальдейера, червеобразный отросток, пейеровы бляшки.
2 При лимфоме Ходжкина для второй стадии необходимо дополнительно арабской цифрой указывать количество пораженных лимфатических зон (например, стадия II4).
3 Рекомендуется различать стадию III, с поражением верхних абдоминальных лимфатических узлов (ворота печени, селезенки, чревные л/у), и стадию III2, с поражением забрюшинных лимфоузлов.
4 Кожный зуд исключен из симптомов интоксикации.
5 Медиастинально-торакальный индекс – отношение ширины срединной тени в самом широком месте к диаметру грудной клетки в самом широком ее месте – на уровне Th5-6на стандартных прямых рентгенограмм
Стратификация группы риска:
Международный прогностический индекс (IPI) для всех пациентов[11].


Международный прогностический индекс, скорректированный по возрасту (aaIPI) для пациентов ≤60 лет[11]:

Международный прогностический индекс (NCCN-IPI) [12]:
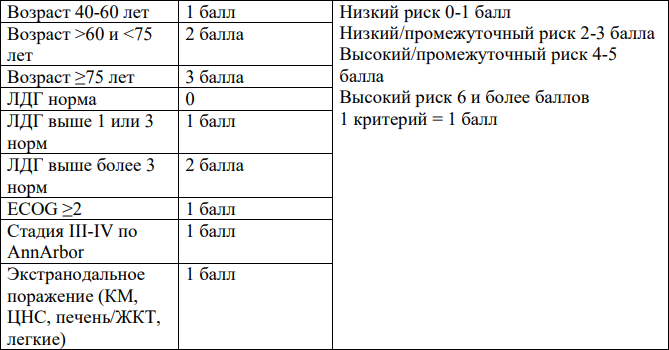
Прогностическая модель для оценки риска поражения ЦНС (CNS-IPI) [13]:

Дополнительные показания к профилактике со стороны ЦНС независимо от оценки риска ЦНС[13]:
- ВИЧ-ассоциированная лимфома;
- Лимфома яичка;
- В-клеточные лимфомы высокой степени злокачественности с транслокациями MYC и BCL2, и/или BCL6, HGBL NOS;
- Первичная кожная ДВККЛ (“leg type”);
- Стадия IE ДВККЛ груди.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ.
Диагностические критерии:
- Решающее значение для верификации диагноза лимфомы являются гистологическое и иммуногистохимическое исследования. Дополнительные методы необходимы для определения распространенности опухолевого процесса и стратификации пациентов по группам риска. [3]
- Диагноз должен быть установлен на основании исследования хирургически удаленного (резекция) лимфоузла или участка экстранодального поражения, при этом количество материала должно быть достаточным для фиксации в формалине и приготовления парафиновых блоков. Обязательно выполнение адекватного иммуногистохимического исследования.
- Панель ИГХ для В-клеточных лимфом должна включать[2]: CD20, CD3, CD5, CD10, CD45, BCL2, BCL6, Ki-67, IRF4/MUM1, MYC с или без анализа маркеров клеточной поверхности методом проточной цитометрии: kappa/ lambda, CD45, CD3, CD5, CD19, CD10, CD20.
- Дополнительные иммуногистохимические исследования для установления подтипа лимфомы: cyclinD1, kappa/lambda, CD30, CD138, Epstein-Barr virus in situ hybridization, ALK, HHV8, SOX11.
- Жалобы, анамнез, данные физического исследования играют важную роль в диагностике и дифференциальной диагностике лимфопролиферативных заболеваний, но неспецифичны в связи с чем не относятся к диагностическим критериям [3].
- Диагноз устанавливается на основе морфологического и иммуногистохимического исследования биопсийного материала и формулируется в соответствии с пересмотренной классификацией опухолей гемопоэтической и лимфоидной тканей ВОЗ 2017 [3].
Жалобы и анамнез:
- увеличение лимфоузлов (чаще безболезненное);
- кашель без выделения мокроты – возникает за счет сдавления дыхательных путей увеличенными лимфоузлами средостения;
- отеки лица, шеи, рук – возникают за счет сдавления верхней полой вены; тяжесть в левом подреберье – за счет увеличения селезенки;
- общая слабость, повышенная утомляемость;
- В-симптомы: повышение температуры тела, преимущественно в вечернее и ночное время; снижение массы тела (более 10-15 кг в течение 2-3 месяцев).
Физикальное обследование:
- идентификация пальпируемых лимфоузлов и органомегалии представлена одним или несколькими узлами;
- увеличение лимфоузлов различной локализации;
- увеличение размеров печени и селезенки.
Лабораторные исследования:
- Общий анализ крови – подсчет лейкоформулы, тромбоцитов в мазке: ОАК может быть в пределах нормы, однако может быть умеренный лейкоцитоз. Часто отмечается ускорение СОЭ до значительных цифр. Анемия наблюдается редко и является независимым неблагоприятным прогностическим признаком;
- Биохимический анализ крови – лактатдегидрогеназа, общий белок, альбумин, креатинин, мочевина, электролиты, мочевая кислота, для выявления синдрома лизиса опухоли, а также сопутствующего поражения органов;
- Гистологическое исследование – с целью верификации морфологической формы ЛПЗ;
- Иммуногистохимическое исследование – с целью верификации морфологической формы ЛПЗ.
- Гистологическое исследование гребня подвздошной кости - обязательным компонентом определения распространенности опухолевого процесса (стадии) является гистологическое исследование трепанобиоптата костного мозга. В процессе первичного обследования рекомендуется выполнять биопсию билатерально. В случае первичного поражения костного мозга, трепанобиопсия должна выполняться в рестадировании и при завершении терапии. Морфологическое исследование пунктата костного мозга не заменяет гистологическое исследование трепанобиоптата [3].
Инструментальные исследования:
- ПЭТ/КТ – для более точного стадирования процесса в дебюте заболевания, а также адекватной оценки ответа на лечение, в том числе при подозрении на рецидив заболевания является необходимым проведение позитронно эмиссионной томографии, совмещенную с компьютерной томографией с туморотропными радиофармпрепаратами [3, 14-16].
- КТ с контрастированием (органов брюшной полости, малого таза, шеи) – при невозможности проведения ПЭТ/КТ рекомендуется выполнить КТ шеи, грудной клетки, органов брюшной полости и малого таза (с контрастированием) для стадирования заболевания и уточнения наличия, размеров и распространенности опухолевых очагов [3].
- УЗИ периферических и внутрибрюшных лимфоузлов – увеличение размеров и изменение структуры лимфоузлов.
- МРТ-головного мозга – при подозрении на поражение головного мозга
Для планирования терапевтической тактики и определения необходимости ее модификации, а также для определения потребности в сопутствующей и сопроводительной терапии рекомендовано выполнить следующие диагностические исследования:
- ОАК с лейкоформулой, подсчетом количества тромбоцитов;
- Биохимический анализ крови (натрий, калий, кальций, глюкоза, мочевина, креатинин, мочевая кислота, общий белок, альбумин, общий билирубин, прямой, билирубин, ЛДГ, АСТ, АЛТ, СРБ, щелочная фосфатаза);
- Определение группы крови по системам АВО;
- Определение резус-фактора;
- Общий анализ мочи;
- Коагулограмма (АЧТВ, ПВ, МНО, ПТИ, фибриноген, АТ-3, Д-димер);
- Определение СКФ;
- Определение маркеров вирусного гепатита В и С методом ИФА или ИХЛ;
- ВИЧ-инфекции (HIVAg/anti-HIV) методом ИФА;
- ПЦР на вирусные гепатиты В и С (качественно);
- ПЦР на вирусные гепатиты В, С (количественно) ;
- Вирус Эбштейна-Барр, герпес 1-2 типа, цитомегаловирус, токсоплазмоз методом ПЦР;
- Комплекс серологических реакций на сифилис;
- ПЦР на СOVID-19;
- Исследование спинномозговой жидкости: общий анализ ликвора+/- вирусологическое, бактериологическое исследование;
- Определение ферритина, фолаты, сывороточное железо, Витамин В12;
- ProBNP; Прокальцитонин;
- Для женщин фертильного возраста- тест на беременность, определение ХГЧ;
- ЭКГ;
- ЭхоКГ;
- УЗИ ОБП+почек.
- Рентгенография придаточных пазух носа;
- Ортопантомограмма;
- Компьютерная томография грудного сегмента;
- ФГДС;
- Бронхоскопия;
- Колоноскопия;
- УЗДГ сосудов (вен и/или артерий);
- Спирография;
- УЗИ плевральной полости, периферических лимфоузлов, ОМТ, мочевого пузыря;
- Холтеровское – мониторирование ЭКГ;
NB! Объем исследований определяется лечащим врачом
Показания для консультации специалистов
- Консультация гинеколога – беременность, метроррагии, меноррагии, консультация при назначении комбинированных оральных контрацептивов; для диагностики и лечения заболеваний репродуктивной системы;
- Консультация кардиолога – для коррекции/подбора базисной терапии при АГ, хронической сердечной недостаточности, нарушения ритма сердечной деятельности; для диагностики и лечения заболеваний ССС;
- Консультация нефролога (эфферентолог) – для диагностики и лечения заболеваний почек;
- Консультация оториноларинголога – для диагностики и лечения воспалительных заболеваний придаточных пазух носа и среднего уха;
- Консультация офтальмолога – нарушения зрения, воспалительные заболевания глаз и придатков;
- Консультация хирурга – для решение вопроса о биопсии лимфатического узла/ образования, при развитии хирургических осложнений на курсах химиотерапии, определение показаний для хирургических вмешательств;
- Консультация торакального хирурга – для определения показаний к биопсии легкого/образования средостения;
- Консультация реаниматолога – нарушение витальных функций;
- Консультация фтизиатра – диагностика туберкулеза;
- Консультация челюстно-лицевого хирурга - инфекционно-воспалительные заболевания зубо-челюстной системы.
NB! Консультации узких специалистов – по показаниям.
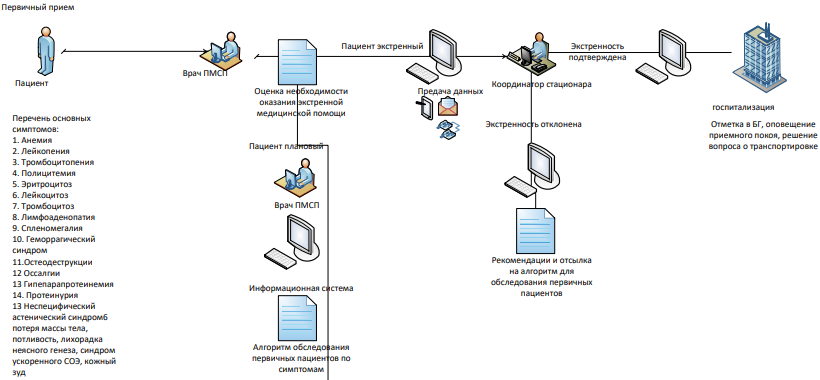
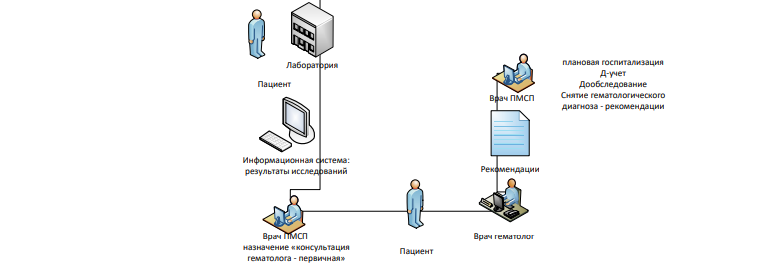
Диагностический алгоритм:
Диагностический алгоритм включает в себя выявление образования или увеличенных лимфоузлов с помощью методов лучевой диагностики, проведение биопсии и/или удаление выявленного образования с последующим гистологическим и иммуногистохимическим исследованиями. В зависимости от клинической ситуации перечень диагностических мероприятий может быть расширен.
Схема 1. Алгоритм диагностики лимфопролиферативных заболеваний

Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований.
Таблица 1. Основные В-клеточные крупноклеточные лимфомы в соответствии с текущей классификацией лимфом ВОЗ, с кратким описанием их основных характеристик (гистологические характеристики, иммунофенотип и генетические изменения) [1,2].
|
В-клеточные новообразования
|
Гистологические характеристики | Иммуногистохимические характеристики | Генетические особенности |
| ДВККЛ |
В пораженных лимфатических узлах или других органах обнаруживается диффузный пролиферат из лимфоидных клеток средних или крупных размеров, который полностью или частично замещает предсуществующую нормальную ткань.
Выделяют три наиболее распространенных цитологических варианта диффузной крупноклеточной В-клеточной лимфомы:
центробластный
иммунобластный
анапластический.
При центробластном варианте преобладают клетки с овальными или округлыми пузырьковидными ядрами с несколькими ядрышками возле ядерной мембраны и скудной умеренно базофильной цитоплазмой.
Иммунобластный вариант характеризуется преобладанием крупных лимфоидных клеток.
Анапластический вариант характеризуется наличием крупных плеоморфных клеток с ядрами причудливой неправильной формы и различным количеством цитоплазмы. Нередко встречаются многоядерные клетки. |
Опухолевые клетки экспрессируют CD20, CD79а, РАX5, CD10 (30- 50%), ВCL6 (60-90 %), MUM1 (35-65%), BCL2 (47-84 %) и CD5 (5-10%).
В некоторых случаях, особенно в анапластическом варианте, возможна экспрессия СD30.
Пролиферативная активность (Ki-67) обычно> 40%, иногда может быть> 90 %.
На основании экспрессии 3-х иммуногистохимических маркеров (CD10, BCL6 и MUM1), используя алгоритм Ханса, ДВККЛ, можно разделить на два подтипа - с фенотипом клеток герминативного центра (GCВ) и активированные В-клетки (non-GCB или АВС тип). Опухоли с экспрессией CD10, a также CD10-, но ВCL6+ и MUM1-, относятся к лимфомам c GCB фенотипом. Все другие относятся к non-GCB подтипу.
|
В 30% случаях обнаруживается перестройка ВCL6 (3q27).
В 20-30% возможна транслокация t(14;18), затрагивающая ген ВСL2. В 8-14 % случаях имеется перестройка гена МYC (8q24).
При ДВККЛ, GCB фенотипа экспрессированы гены В-лимфоцитов герминативном центре. Обычно обнаруживают транслокацию ВCL2 и мутации генов ЕZH2 и GNA13.
При ДВККЛ, non-GCB фенотипа активирован NF-
кB каскад, каскад В-клеточных рецепторов и находят мутации в генах МYD88, CARD11 и CD79B.
|
| ПМ-ДВККЛ | В очагах поражения обнаруживают диффузный пролиферат из клеток среднего и большого размера с круглыми или овальными ядрами и объемной бледной цитоплазмой. Опухолевые клетки расположены на фоне выраженного фиброза. Тонкие пучки коллагеновых волокон окружают отдельные клетки лимфомы или их группы. Иногда встречаются крупные плеоморфные клетки и/или клетки типа Штернберга-Рид. | Клетки лимфомы экспрессируют CD20, CD79а, РАX5, CD23, CD10 (25 %), ВCL6 (45-100 %), ВCL2 (55-80 %), ОСТ-2, ВОВ.1, слабо CD30 (80 %), MUM1 (75%). | Цитогенетические аномалии, характерные для ПМ-ДВККЛ, включают увеличение хромосомы 9p24 (с участием JAK2 у 50–75% пациентов) и хромосомы 2p15 (с участием c-REL, кодирующей члена семейства факторов транскрипции NF-κB) и потерю хромосомы 1p, 3p, 13q, 15q и 17p. |
| ЛБ | образована диффузным пролифератом из клеток средних размеров с многочисленными митозами и высокой скоростью пролиферации. Классическое описание включает картину «звездного неба» из-за присутствия многочисленных реактивных макрофагов. Опухолевые клетки содержат круглые ядра с мелкозернистым хроматином и многочисленными базофильными ядрышками, базофильную вакуолизированную цитоплазму |
Клетки экспрессируют CD20, CD79а, РАХ5, CD10, BCL6. Отсутствует экспрессия ВCL2, CD5, MUM1, TdT, CD34.
Ki-67 почти 100 %
|
характеризуется транслокацией гена МYС с 8q24 к региону гена тяжелой цепи иммуноглобулинов (14q32) или, реже, к локусам легких цепей каппа- (2р12) или лямбда- (22q11)
Примерно в 10% случаев с помощью FISH не удается выявить транслокацию МҮС. В этом случае может выявляться абберация 11q
|
| В-клеточная лимфома высокой степени злокачественности с двойной или тройной поломкой (транслокацией) “double-hit” или “triple-hit” | Эти лимфомы характеризуются вариабельными морфологическими признаками. Чаще всего опухоль имеет вид диффузной крупноклеточной В-клеточной лимфомы с пролифератом из крупных лимфоидных клеток типа центробластов или иммунобластов. Встречаются варианты, морфологически похожие на лимфому Беркитта или с признаками, промежуточными между диффузной крупноклеточной В-клеточной лимфомой и лимфомой Беркитта. В последнем случае обнаруживается диффузный пролиферат из довольно однообразных клеток средних размеров с картиной «звездного неба» из-за присутствия реактивных макрофагов, многочисленных фигур митозов и высокой скорости пролиферации. Также могут проявляться бластоидные черты строения опухолевых клеток, как в лимфобластной лимфоме или бластоидном варианте лимфомы из клеток мантии |
Клетки экспрессируют CD20, CD79a, PAX5, СD10 (75- 90 %), ВCL6 (75-90%) и ВСL2, отсутствует экспрессия TdT и cyclinD1.
Примерно в 20% случаев экспрессирован MUM1, главным образом в опухолях с морфологией диффузной крупноклеточной В-клеточной лимфомы, иммунофенотипом активированных В-клеток и перестройками генов МҮС и ВCL6. Лимфомы с двойной транслокацией МYС и ВCL2 обычно имеют фенотип В-лимфоцитов герминативных центрах (фенотип GCВ). Индекс Ki-67 > 90%
|
Во всех есть транслокация 8q24/MYC. Ген МYС чаще переносится к одному из генов иммуноглобулинов (обычно к IGH, реже к IGK или IGL), однако почти в 40 % случаев происходят транслокации MҮC к другим партнерам, такие как t(8;9)(q24;p13) и t(3;8)(q27;q24).
Во всех случаях перестроен ВCL2 (18q21) и/или ВCL6 (3q27). В большинстве случаев находят комплексный кариотип и мутации ТР53.
|
| В-клеточная лимфома неклассифицируемая, с признаками, промежуточными между ДВККЛ и классической лимфомой Ходжкина (Лимфомы серой зоны) | Возможны разнообразные морфологические проявления с различными цитологическими характеристиками. В одних случаях видны скопления крупных центробластоподобных клеток на диффузно-фиброзном фоне, что похоже на первичную медиастинальную В-клеточную лимфому или диффузную крупноклеточную В-клеточную лимфому. В других - находят плеоморфные опухолевые клетки, похожие на лакунарные клетки или клетки Ходжкина на фоне фиброзных дуг, как в классической лимфоме Ходжкина. Можно встретить разрозненные эозинофильные гранулоциты, лимфоциты и гистиоциты, а также очаговый некроз. |
В случаях с морфологическими признаками классической лимфомы Ходжкина опухолевые клетки обычно экспрессируют CD45, CD20, CD79a, CD30, иногда CD15.
В других случаях — с морфологическими признаками первичной медиастинальной В-клеточной лимфомы — опухолевые клетки обычно экспрессируют CD30, CD15 и не экспрессируют CD20 и CD79a.
В опухолевых клетках выражена экспрессия РАХ5, ОСТ2 и ВОВ1.
Гибридизация in situ c РHК ВЭБ дает отрицательный результат
|
Более чем в половине случаев выявляют добавочные фрагменты и амплификацию генов JАК2 и PDCD1LG2. |
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯ НА АМБУЛАТОРНОМ УРОВНЕ:
Тактика ведения на амбулаторном уровне сводиться к выявлению, своевременному направлению к гематологу/онкологу пациентов с подозрением на ЛПЗ, а также пациентов находящихся на диспансерном учете с установленным диагнозом. Обезболивающая и другая симптоматическая терапия по показаниям. Пациентам с верифицированным диагнозом возможно применение поддерживающей терапии Леналидомидом по заключению гематолога/онколога (смотрите Стационарный уровень).
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ.
Первая линия терапии:
- Пациентам до 60 лет ДВККЛ I-II стадии (без объемного поражения «bulky disease») рекомендовано проведение от 3 до 6 курсов полихимиотерапии по схеме R-CHOP с выполнением рестадирования [18]. При отсутствии ответа и/или при наличии признаков прогрессирования ДВККЛ пациент переводится на 2 линию терапии для рефрактерных/рецидивирующих форм.
- При достижении ПО или ЧО ответа на терапию R-CHOP рекомендовано выполнение консолидирующей лучевой терапии на зоны исходно поражённых лимфатических узлов и/или экстранодального поражения или завершение терапии.
- В исследовании SWOG-0014, в котором оценивали 3 курса R-CHOP с последующей лучевой терапией вовлеченного поля у пациентов с по крайней мере одним неблагоприятным фактором по IPI (n = 60), 4-летняя БПВ составила 88% после среднего периода наблюдения 5 лет; соответствующая 4-летняя ОВ составила 92%[19,20].
- При лимфоме яичка после завершения лечения следует провести лучевую терапию мошонки[2].
- Пациентам, которые не являются кандидатами на химиоиммунотерапию, рекомендуется ЛТ на вовлеченные зоны[2].
Схема 2-3. Алгоритм инициальной терапии ДВККЛ пациентов до 60 лет в зависимости от стадии заболевания по Ann-Arbor
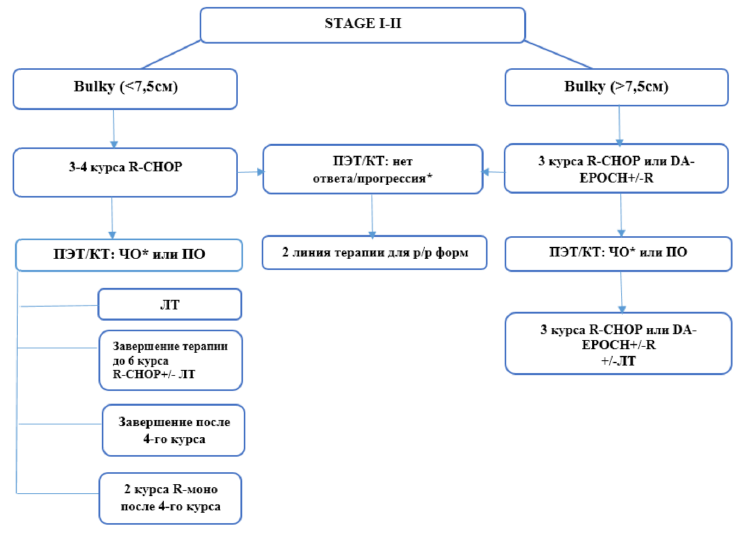
*NB! При ПЭТ/КТ+ (позитивных) результатах рекомендована повторная биопсия перед изменением курса лечения.
Пациентам до 60 лет с III-IV стадии ДВККЛ рекомендовано проведение 3-4 курсов R-CHOP или DA-EPOCH+/-R с последующим рестадирования. При достижении ответа, рекомендовано продолжить терапию до 6-го курса с планированием консолидирующей лучевой терапии на зоны с исходно массивными опухолевыми образованиями («bulky disease») и/или изолированными очагами поражения костей.
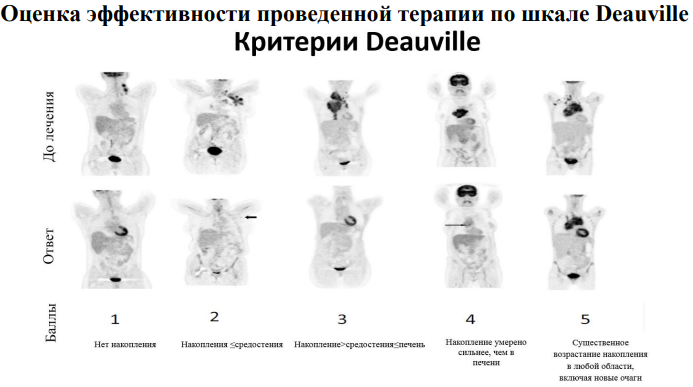
Если результаты ПЭТ-сканирования положительны (4-5б Deauville) после 6 курсов, пациент должен рассматриваться как кандидат на высокодозную химиотерапию с поддержкой аутологичными гемопоэтическими стволовыми клетками (ВДХТ+Ауто-ТГСК)[2].
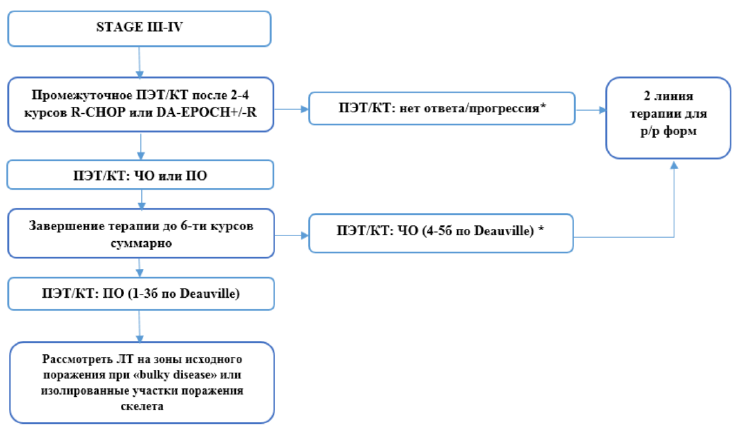
*NB! При ПЭТ/КТ+ (позитивных) результатах рекомендована повторная биопсия перед изменением курса лечения.
- Контрольное ПЭТ/КТ после ЛТ рекомендуется проводить не менее чем через 8 недель после ЛТ. Ложноположительные результаты могут быть вызваны изменениями после лечения[2].
- R-CHOP в общей сложности 6 курсов, является предпочтительным режимом для пациентов с III-IV стадией ввиду меньшей токсичности по сравнению с другими режимами. DA-EPOCH-R также включен в качестве альтернативной схемы для отдельных пациентов [19, 21].
- Пациенты без ответа на лечение или с прогрессирующим заболеванием должны получать терапию, по схемам для рецидивирующего или рефрактерного заболевания.
- Пациентам с высоким риском вовлечения ЦНС (4-6 баллов по CNS-IPI), а также пациентам с ВИЧ-ассоциированной лимфомой, лимфомой яичка, лимфомой высокой степени злокачественности с транслокацией MYC, BCL-2 и/или BCL-6, лимфомой высокой степени злокачественности, неклассифицируемой, или ДВККЛ с вовлечением почек или надпочечников, рекомендовано проведение профилактики рецидива ЦНС, включающая 4 интратекальных введения метотрексата (12-15 мг), цитарабина(30 мг), и дексаметазона (4мг) и/или 2 системных введения высоких доз метотрексата (1,5-3 г/м2) во время 2-4 курсов химиотерапии [13,22].
- Одновременное применение высоких доз метотрексата с DA-EPOCH может привести к неприемлемой токсичности.
Лечение рецидивов/рефрактерное течения:
- Пациентам с рецидивирующим/рефрактерным течением ДВККЛ рекомендуется проведение ХТ по любой из схем терапии 2-й линии c перспективой аутологичной трансплантацией гемопоэтических стволовых клеток. Аутологичная ТГСК по-прежнему считается стандартом терапии пациентов с рефрактерным/рецидивирующим течением ДВККЛ, достигшим ЧО или ПО на 2-ю линию химиотерапии [23].
- Эффективные схемы второй линии для пациентов, которые являются кандидатами на ВДХТ+АутоТГСК: R-DHAP (ритуксимаб, дексаметазон, цитарабин и цисплатин), R-ICE (ритуксимаб, ифосфамид, карбоплатин и этопозид), R-DHAX (ритуксимаб, дексаметазон, цитарабин и оксалиплатин) или R-GDP (гемцитабин, дексаметазон, цисплатин или карбоплатин)[2]
- Ритуксимаб следует включить в терапию второй линии, если рецидив наступил более чем через 6 месяцев от завершения лечения и наличия сохраняющейся СD20+ позитивности по данным ИГХ. Ритуксимаб часто не следует назначать пациентам с первичной рефрактерной болезнью.
- Нет данных и рекомендаций по консолидирующей терапии после ауто-ТГСК для ДВККЛ.
- Ауто-ТГСК пациентам с рефрактерным заболеванием, не отвечающим на терапию спасения не показана.
- Пациенты, рецидивирующие после ауто-ТГСК, обычно имеют плохой прогноз. Терапевтические возможности ограничены.
- Алло-ТГСК считается вариантом лечения пациентов с ДВККЛ, у которых наблюдается рецидив или прогрессирование после ауто-ТГСК. Алло-ТГСК следует рассматривать у молодых пациентов без сопутствующих заболеваний.
Рекомендуемые схемы 2-й линии терапии для кандидатов на ТКМ.
Предпочтительные режимы:
• DHAP ± ритуксимаб [24].
• DHAX ± ритуксимаб [25,26].
• GDP ± ритуксимаб [27].
• ICE ±ритуксимаб [28].
Другие рекомендуемые режимы
• ESHAP ± ритуксимаб [29].
• GemOx ± ритуксимаб [30].
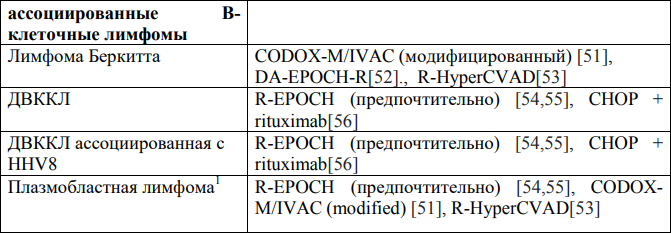
Лечение отдельных подтипов ДВККЛ:
Первичная медиастинальная В-крупноклеточная лимфома (ПМ-ДВККЛ):
- Предпочтительным является проведение химиотерапия DA-EPOCH+/-R. Пациентам до 60 лет рекомендовано проведение 6-ти курсов по схеме DA-EPOCH+/-R с рестадированием после 3 или 4-го курса. При достижении частичного или полного ответа завершение терапии до 6-го курса [31]
Другими рекомендованными схемами являются:
- R-CHOP x 6 циклов ± ЛТ на зоны исходного поражения;
- R-CHOP x 4 цикла с последующим ICE (ифосфамид, карбоплатин, этопозид) ± ритуксимаб x 3 цикла ± ЛТ[32];
- ПЭТ/КТ после завершения терапии является необходимым, так как остаточная опухоль средостения встречаются часто. Для пациентов, первоначально получавших R-CHOP, следует рассмотреть возможность проведения консолидирующей ЛТ, особенно если повышенная активность фтордезоксиглюкозы сохраняется в первичной опухоли.
- Если результаты ПЭТ/КТ отрицательны в конце лечения после более интенсивной терапией (например, DA-EPOCH-R) и исходно отсутствовало объемное заболевание (“bulky disease”), рекомендовано завершить терапию с последующим наблюдением.
- Если результаты ПЭТ/КТ положительны (PET “+” positive), рекомендуется провести биопсию, прежде чем планировать дополнительное лечение[2].
- Пациентам с рецидивирующей/рефрактерной ПМ-ДВККЛ рекомендовано лечение по схемам терапии 2-й линии для ДВККЛ.
- При неэффективности стандартной химиотерапии возможно рассмотрение терапии ингибиторами контрольных точек Пембролизумаб в монорежиме[33] или Ниволумаб в монорежиме или в комбинации с Брентуксимаб-ведотином (при CD30+ случаях) [34].
В-клеточная лимфома высокой степени злокачественности с двойной или тройной поломкой (транслокацией) (“double-hit” или “triple-hit”)
NB! Стандарта лечения для “double-hit” или “triple-hit” лимфом не разработано. R-CHOP ассоциируется с плохими результатами.
Рекомендованы следующие курсы химиотерапии:
- DA-EPOCH-R)[35].
- R-HyperCVAD (чередование с высокими дозами метотрексата и цитарабина)
- R-CODOX-M/R-IVAC[36].
Рекомендовано проведение 4-6 курсов с последующей консолидацией с ВДХТ с аутоТГСК при достижении ответа [2,36]. Рецидивирующее/рефрактерное заболевание следует лечить, как описано для ДВККЛ.
Лимфома серой зоны:
- Не существует стандарта для лечения пациентов с лимфомами серой зоны, предпочтительны агрессивные схемы для лечения крупноклеточной В-клеточной лимфомы с последующей консолидацией с ВДХТ с аутоТГСК при достижении ответа[2].
Лимфома Беркитта:
- CHOP или CHOP с этопозидом считаются не адекватной терапией для лечения ЛБ [35,36].
- Рекомендовано использование интенсивных режимов химиотерапии, включающие профилактику поражения ЦНС.
- В настоящее время рекомендовано использование блоковых режимов химиотерапии эффективность которых доказана. CODOX-M/IVAC с или без включения ритуксимаба, R-hyper-CVAD (или DA-EPOCH-R для пациентов которым высокодозные курсы противопоказаны) [37-46]. Рекомендовано проведение от 4 до 6-ти курсов с промежуточным рестадированием.
- После завершение химиотерапии при достижении ПО рекомендовано дальнейшее наблюдении. При достижении ответа меньше чем ПО, рекомендована ЛТ.
- Рецидив заболевания через 2 года после полной ремиссии на индукционную терапию случается редко.
- DA-EPOCH-R, IVAC в сочетании с ритуксимабом (R-IVAC), R-GDP (гемцитабин, дексаметазон, цисплатин в сочетании с ритуксимабом), R-ICE (ифосфамид, карбоплатин, этопозид в сочетании с ритуксимабом) и высокие дозы цитарабина включены в качестве вариантов терапии второй линии для рецидивирующих форм заболевания [2,47]. Рекомендовано проведение от 4 до 6 курсов с промежуточным рестадированием и оценкой ответа в конце лечения.
- Консолидация с высокодозной химиотерапией с поддержкой аутологичными стволовыми клетками (ВДХТ+аутоТГСК) или аллогенной ГСК (при наличии донора) может быть рассмотрена для отдельных пациентов, достигших полного или частичного ответа на терапию второй линии[48].
- Пациентам с резистентным течением заболевания рекомендуются лечение в рамках клинического исследования или поддерживающая терапия, включая паллиативную ЛТ.
- В случае наступления рецидива менее чем через 6 месяцев рекомендовано лечение в рамках клинического исследования или паллиативная терапия.
ВИЧ-ассоциированные лимфомы:
- Антиретровирусная терапия может безопасно назначаться вместе с химиотерапией. Рекомендуется избегать приема зидовудина, кобицистата и ритонавира. Одновременная АРТ связана с более высокой частотой полного ответа[49,50].
- Всем пациентам (без учета гистологии) необходимо выполнить люмбальную пункцию, для исключения поражение ЦНС. Также, необходимо определить исходные значения количества CD4 и вирусной нагрузки ВИЧ.
- Пациенты, получающие АРТ со стабильно низким уровнем CD4 + от менее 50 до 100/мкл, как правило, имеют худший прогноз и более высокий риск инфекционных осложнений. В связи с увеличением риска инфекционных осложнений и высоким риском смерти от них, ритуксимаб не рекомендуется вводить ВИЧ-инфицированным пациентам при количестве CD4клеток менее 100/мкл[2].

- 1Пациентам из группы высокого риска рекомендовано проведение консолидации с ВДХТ с последующей аутоТГСК.
- К критериям высокого риска относятся: ааIPI выше 2, наличие реаранжировки гена MYC или делеции гена TP53.
- Бортезомиб в сочетании с ICE (ифосфамид, карбоплатин и этопозид) +/- ритуксимаб – на сегодняшний день является эффективной схемой терапии 2-ой линии для пациентов с рецидивирующими/резистентными лимфомами, ассоциированными с ВИЧ[57].
- ВДХТ+АутоТКМ ассоциируется с благоприятным исходом выживаемости у пациентов с химиочувствительным рецидивирующим/рефрактерным заболеванием, аналогично с ВИЧ-серонегативными пациентами[58,59].
Лечение лимфом во время беременности:
- При диагностике лимфомы в 1-й триместр беременности до начала химиотерапии рекомендуется обсудить вопрос о прерывании беременности. Химиотерапия в 1-м триместре беременности имеет 10-20% риск развития тяжелых аномалий развития. Необходимо обсудить с пациентом все аргументы за и против искусственного прерывания беременности [3].
- В самом большом многоцентровом ретроспективном исследовании 90 пациентов с лимфомой (40 ЛХ и 50 НХЛ) отметили, что стандартная полихимиотерапия, не связанная с антиметаболитами, назначенная во 2-м и 3-м триместрах, привели к ожидаемым исходам для матери без увеличения тяжелых неблагоприятных внутриутробных или перинатальных событий. 3-летняя БПВ и ОВ 53% и 82% соответственно. Уровень выкидышей был низким - 1,1%[60]
- Для лечения НХЛ во время беременности в настоящее время предпочтительнее использование схемы СНОР[3].
Лечение пациентов старше 60 лет, а также с наличием сердечной недостаточности:
- В качестве первой линии терапии для пациентов старше 60-ти лет с тяжелыми сопутствующими заболеваниями, для очень ослабленных пациентов рекомендовано проведение курсов химиотерапии по схеме R-mini-CHOP [61,62].
- Согласно рекомендациям, NCCN 2021 для пациентов со сниженной функцией левого желудочка используются режимы химиотерапии по схемам DA+/-R-EPOCH1, R-CEPP, R-CEOP, R-GCVP [2].
- Консолидация леналидомидом в течении 2-х лет, в первой ремиссии рекомендована для пациентов, не являющихся кандидатами на ТКМ [63].
- Оптимальное ведение пациентов, с рецидивирующим/рефрактерным заболеванием не являющимися кандидатами на трансплантацию, не установлено. Стандартные варианты лечения включают схемы на основе гемцитабина с ритуксимабом или без него[64] бендамустина с ритуксимабом или без него[65] и полатузумаб ведотин (монотерапия или в комбинации с бендамустином ± ритуксимабом) [66,67].
- Другие варианты лечения включают леналидомид (с ритуксимабом или без него) [68] и ибрутиниб [69] (особенно для пациентов с non-GCB ДБККЛ).
1
в случае коррекции дозы в сторону увеличения, дозу доксорубицина следует поддерживать на исходном уровне.
Рекомендуемые схемы 2-й линии терапии для НЕ кандидатов на ТКМ.
Предпочтительные режимы:
• GemOx ± ритуксимаб [30,64];
• Полатузумаб ведотин ± бендамустин ± ритуксимаб [66,67];
Другие рекомендуемые режимы (в алфавитном порядке) [2]:
• GemOx ± ритуксимаб [30,64];
• Полатузумаб ведотин ± бендамустин ± ритуксимаб [66,67];
Другие рекомендуемые режимы (в алфавитном порядке) [2]:
• CEPP ± ритуксимаб;
• CEOP ± ритуксимаб;
• DA-EPOCH ± ритуксимаб;
• GDP ± ритуксимаб;
• Брентуксимаб ведотин для CD30+ случаев;
• Бендамустин ± ритуксимаб;
• Ибрутиниб (non-GCB);
• Леналидомид ± ритуксимаб (non-GCB).
Карта наблюдения пациента, маршрутизация пациента:
Немедикаментозное лечение.
Режим: общеохранительный
Медикаментозное лечение.
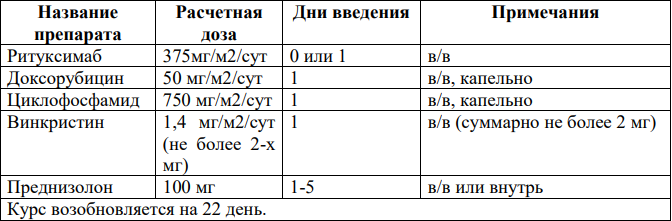
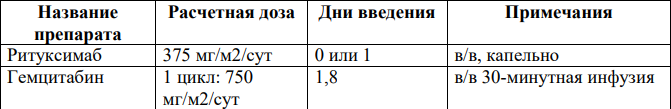
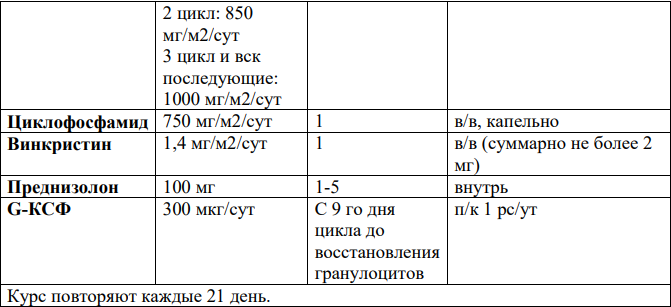
Основные схемы химиотерапии R-CHOP [18,56]:
DA-R-EPOCH1 [19,21,31,35]:


Немедикаментозное лечение.
Режим: общеохранительный
Диета: стол №15
Медикаментозное лечение.
Основные схемы химиотерапии R-CHOP [18,56]:

DA-R-EPOCH1 [19,21,31,35]:
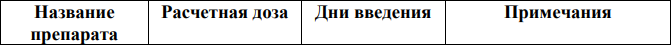
1В случае применения курса у пациентов с ВИЧ-ассоциированными лимфомами доза циклофосфамида регулируется в зависимости от уровня CD4:
- Если исходное количество CD4> 200 клеток/мм3, доза циклофосфамида 750 мг/м2.
- Если исходное количество CD4 составляет 50–200 клеток/мм3, доза циклофосфамида с 375 мг/м2.
- Для исходного уровня CD4 <50 клеток/мм3 доза циклофосфамида не выше 187,5 мг/м2.
2Если уровень нейтрофилов 1тыс/мкл, уровень тромбоцитов выше 100тыс/мкл.
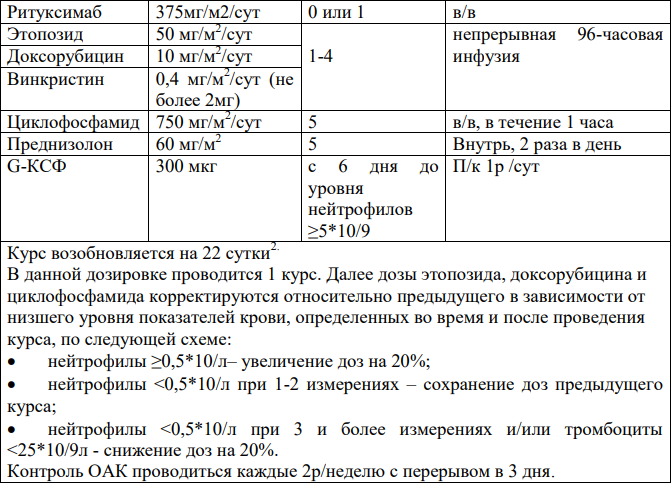
Бендамустин+ритуксимаб (BR) [65].
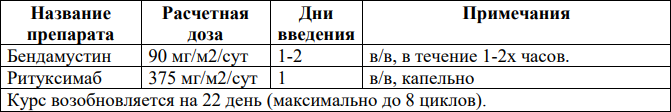
Монотерапия Ритуксимабом (поддерживающая терапия) [2].
R-mini-CHOP [61,62]:
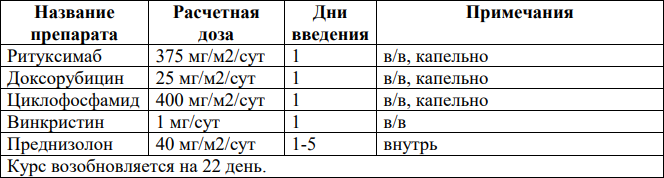
ICE [28,57]:
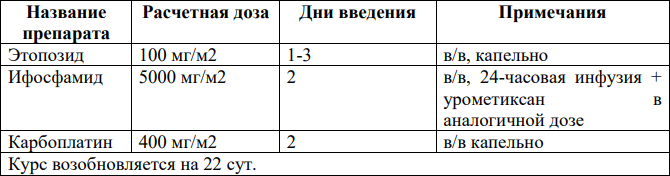
DHAP [24]
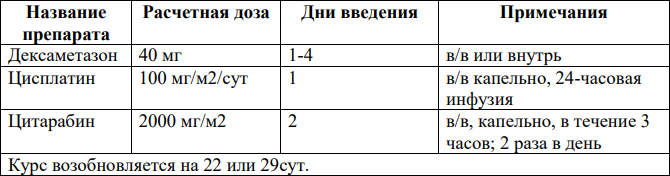
DHAX [25,26]:
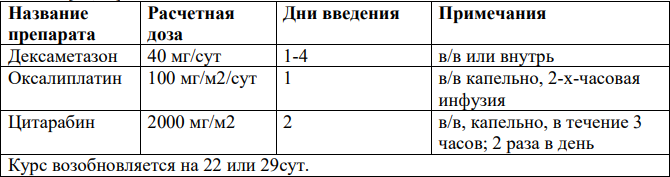
ESHAP[29]:
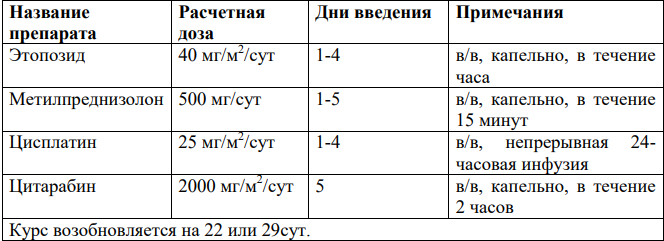
GDP[46]:

GemOх[30,64]:

Монотерапия Бендамустин [65]
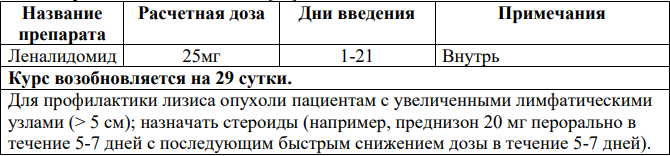
Монотерапия леналидомидом [68]
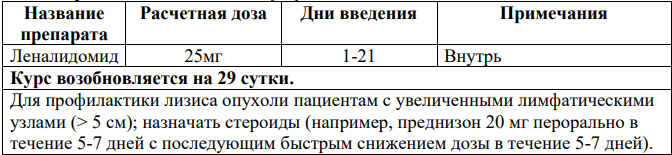
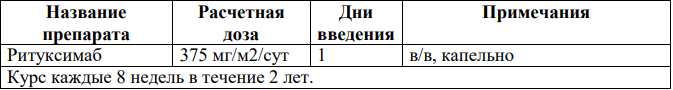
Поддерживающая терапия леналидомидом:

Леналидомид+Ритуксимаб[68]:

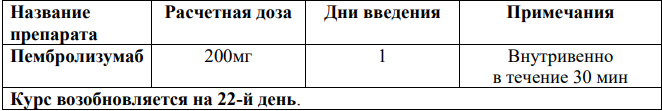
Монотерапия Пембролизумабом [33]
Монотерапия Ниволумабом [34]
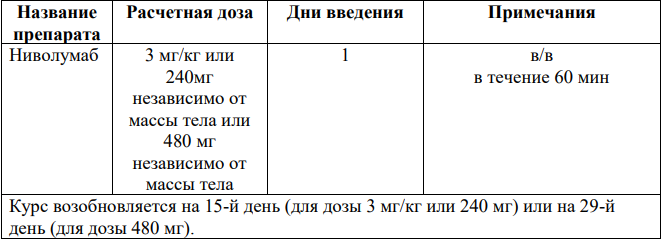


Полатузумаб-ведотин+Бендамустин+Ритуксимаб (POLO-BR) [66,67].
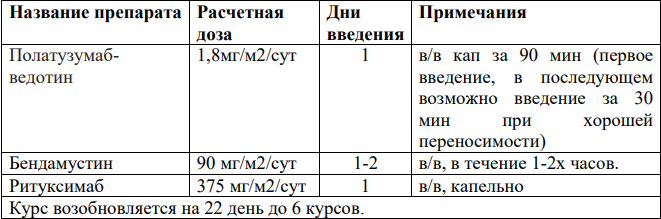
R-CODOX-M/R-IVAC[36,40,41,51].
CODOX-M (циклы 1, 3):
CODOX-M (циклы 1, 3):
- циклофосфамид 800 мг/м2 в/в, день 1;
- винкристин 1,5 мг/м2 (не более 2 мг) в/в, дни 1, 8;
- доксорубицин 40 мг/м2 в/в, день 1;
- циклофосфамид 200 мг/м2/сут. в/в, дни 2-5;
- цитарабин 70 мг интратекально, дни 1, 3;
- метотрексат 300 мг/м2 в/в в течение 1 часа, далее – 2700 мг/м2 в/в в течение последующих 23 часов (у больных старше 65 лет – 100 мг/м2 в/в в течение 1 часа, далее – 900 мг/м2 в/в в течение последующих 23 часов), день 10;
- метотрексат 12 мг интратекально, день 15;
- лейковорин 15 мг внутрь через 24 часа после интратекального введения метотрексата;
- Г-КСФ 5 мкг/кг подкожно до повышения уровня гранулоцитов > 1× 109/л;
- IVAC (циклы 2, 4):
- этопозид 60 мг/м2 (на 500 мл физ. раствора или изотонического раствора глюкозы) в/в, дни 1-5;
- ифосфамид 1,5 г/м2 (у больных старше 65 лет – 1 г/м2) в/в, дни 1-5;
- цитарабин 2 г/м2 (у больных старше 65 лет – 1 г/м2) в/в каждые 12 часов, дни 1-2 (всего 4 введения);
- метотрексат 12 мг интратекально, день 5;
- Г-КСФ подкожно до повышения уровня гранулоцитов > 1× 109/л;
- Начало следующего блока – после стабилизации уровня гранулоцитов > 1× 109/л и уровня тромбоцитов > 75× 109/л без поддержки Г-КСФ.
R-HyperCVAD/R-HMA[42,43,53].
Циклы 1, 3, 5, 7 (HyperCVAD):
- циклофосфамид 300 мг/м2, в/в, каждые 12 часов, дни 1-3 (всего 6 введений);
- дексаметазон 40 мг, в/в или внутрь, дни 1-4, 11-14;
- доксорубицин 50 мг/м2, в/в непрерывной 24-часовой инфузией в центральный катетер, день 4;
- винкристин 2 мг в/в, дни 4, 11.
- Циклы 2, 4, 6, 8 (HMA):
− цитарабин 3 г/м2 (у больных старше 60 лет – 1 г/м2) в/в каждые 12 часов, дни 2-3 (всего 4 введения);
− метилпреднизолон 50 мг в/в каждые 12 часов, дни 1-3 (всего 6 введений);
− ритуксимаб 375 мг/м2 в/в или ритуксимаб 1400 мг п/к (кроме первого введения), дни 1,11 (циклы 1, 3) и дни 2, 8 (циклы 2, 4) – всего 8 введений;
- профилактика поражения ЦНС проводится на каждом курсе, суммарно 16 интратекальных введений:
- − метотрексат 12 мг интратекально, день 2;
- − цитарабин 100 мг интратекально, день 7.
R+/-CЕOP:
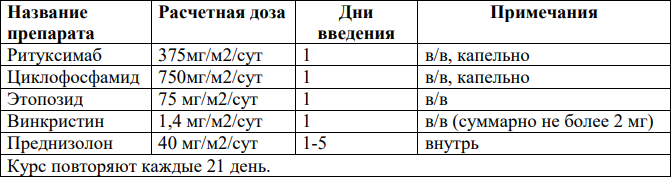
R+/-CЕРP:
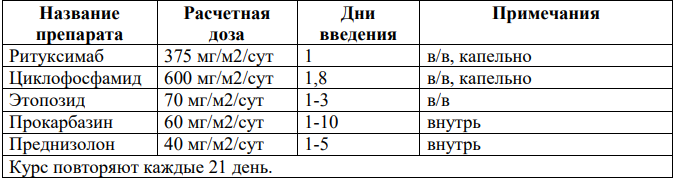
R-GCVP:
Трансфузионная поддержка:
- Показания к проведению трансфузионной терапии определяются в первую очередь клиническими проявлениями индивидуально для каждого пациента с учетом возраста, сопутствующих заболеваний, переносимости химиотерапии и развития осложнений на предыдущих этапах лечения.
- Лабораторные показатели для определения показаний имеют вспомогательное значение, в основном для оценки необходимости профилактических трансфузий концентрата тромбоцитов.
- Показания к трансфузиям также зависят от времени, после проведения курса химиотерапии – принимаются во внимание, прогнозируемое снижение показателей в ближайшие несколько дней.
Эритроцитарная масса/взвесь:
- Уровень гемоглобина не нужно повышать, пока обычные резервы и компенсационные механизмы достаточны для удовлетворения потребностей тканей в кислороде.
- Существует только одно показание для трансфузий эритроцитсодержащих сред при хронических анемиях – симптомная анемия (проявляющаяся тахикардией, одышкой, стенокардией, синкопе, de novo депрессией или элевацией ST).
- Уровень гемоглобина менее 30 г/л является абсолютным показанием для трансфузии эритроцитов.
При отсутствии декомпенсированных заболеваний сердечно-сосудистой системы и легких показаниями для профилактической трансфузии эритроцитов при хронических анемиях могут быть уровни гемоглобина:

Концентрат тромбоцитов:
- При снижении уровня тромбоцитов менее 10 х109/л или появлении геморрагических высыпаний на коже (петехии, синячки) проводится профилактическая трансфузия аферезных тромбоцитов;
- Профилактическая трансфузия аферезных тромбоцитов у пациентов с лихорадкой, пациентам, которым планируется инвазивное вмешательство может проводится при более высоком уровне – 20 х109/л;
- При наличии геморрагического синдрома петехиально-пятнистого типа (носовые, десневые кровотечения, мено-, метроррагии, кровотечения других локализаций) трансфузия концентрата тромбоцитов проводится с лечебной целью.
Свежезамороженная плазма:
- Трансфузии СЗП проводятся у пациентов с кровотечением или перед проведением инвазивных вмешательств.
- Пациенты с МНО ≥2.0 (при нейрохирургических вмешательствах ≥1.5) рассматриваются как кандидаты для трансфузии СЗП при планировании инвазивных процедур. При плановых вмешательствах возможно назначение не менее, чем за 3 дня до вмешательства фитоменадиона не менее 30 мг/сут внутривенно или внутрь.
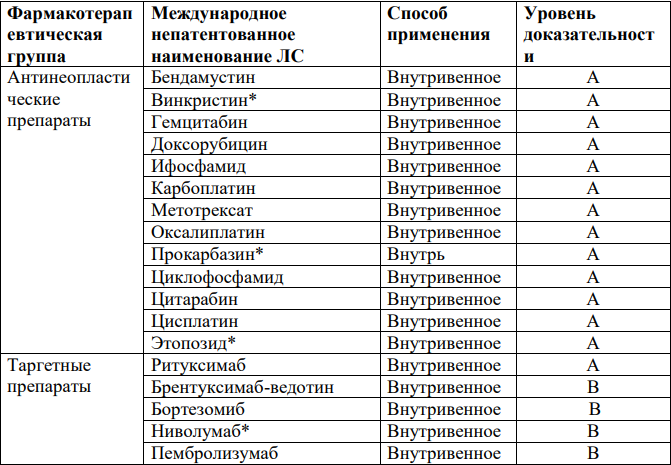
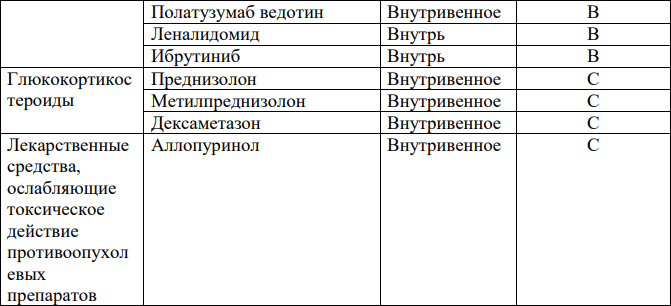
• Перечень основных лекарственных средств (имеющих 100% вероятность применения)
*В соответствии с правилами применения незарегистрированных ЛС.
NB! Дополнительное медикаментозное лечение проводится соответственно протоколам лечения развившихся осложнений.
Хирургическое вмешательство:
• Резекционная биопсия лимфоузла или образования - для гистологического и иммуногистохимического исследования с целью верификации диагноза (и/или подтверждения рецидива заболевания).
• Полная спленэктомия - для гистологического и иммуногистохимического исследования с целью верификации диагноза (и/или подтверждения рецидива заболевания) при отсутствии других локализаций лимфомного поражения.
• Иссечение анальной трещины (острой/хронической) - по показаниям в рамках профилактики / лечения септических состояний у пациентов с гемобластозами.
• Удаление геморроидальных узлов (геморроидэктомия) - по показаниям в рамках профилактики / лечения септических состояний у пациентов с гемобластозами.
• Вскрытие парапроктита/инфильтрата - по показаниям в рамках профилактики/лечения септических состояний у пациентов с гемобластозами.
• Выведение стомы кишечника - по показаниям (при острой и хронической анальной трещины) в рамках профилактики/лечения септических состояний у пациентов с гемобластозами.
• Плевральная пункция - по показаниям при гидротораксе плеврите.
• Лапароцентез - по показаниям при асците.
Основным противопоказанием к хирургическим вмешательствам является не купируемый геморрагический синдром
NB! Хирургическое лечение прочих сопутствующих хирургических патологии в рамках лечения соответствующего протокола.
Дальнейшее ведение:
- Полный ответ должен быть подтвержден по ПЭТКТ через 3 месяца от завершения инициальной терапии.
- Пациентам, завершившим лечение по поводу ДВККЛ с достижением ПО или ЧО, рекомендуется динамическое наблюдение у врача-онколога или врача-гематолога в течение 1-го года после завершения терапии каждые 3 месяца, 2-го года – каждые 6 месяцев, в дальнейшем – ежегодно [17]. Динамическое наблюдение должно включать тщательный сбор жалоб, клинический осмотр пациента, ОАК, Биохимический анализ крови необходимо проводить каждые 3 месяца в течение 1-го года жизни, затем каждые 6 месяцев в течении 2-го года и в дальнейшем – один раз в год. Для пациентов, получавших антрациклины в сочетании с облучением средостения – исследование функции сердца (ЭКГ и ЭхоКГ) и легких (спирография).
- В случае применения лучевой терапии на область шеи, рекомендован контроль ТТГ как минимум ежегодно.
- КТ шеи, ОГК, ОБП, таза с контрастированием каждые 6-месяцев в первые 2 года от завершения терапии, либо по клиническим показаниям.
- ПЭТКТ проводиться в случае если последний ПЭТКТ соответствовал 4-5б Deauville для подтверждения полного ответа/в случае подозрения на прогрессию/рецидив заболевания [17].
Индикаторы эффективности лечения:
- Всем пациентам с ДВККЛ, после 3-4 курсов химиотерапии и после завершения всей программы лечения, необходима оценка ответа на терапию в соответствии со стандартными критериями ответа на лечение лимфом [17].
- Оценку эффективности проведенной терапии необходимо проводить согласно критериям Lugano (см. приложение 3).
- Для группы пациентов, которым в дебюте заболевания и для рестадирования проводится ПЭТ/КТ, эффективность лечения оценивается по шкале Deauville (см. приложение 4).
- При проведении АллоТКМ наблюдение проводиться согласно протоколу аллогенной родственной/неродственной трансплантации костного мозга в течении 5-ти лет с мониторингом минимальной остаточной болезни (методом ПЦР, FISH, NGS) и донорского химеризма.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ.
Показания для плановой госпитализации:
- Проведение курсов химиотерапии, таргетной терапии.
- Проведение биопсии лимфатического узла/экстранодального образования или трепанобиопсии;
- Проведения мобилизации аутологичных гемопоэтических стволовых клеток;
- Проведение аутологичной/аллогенной трансплантации гемопоэтических стволовых клеток
- Контрольное обследование перед/после Ауто/Алло-ТКМ.
Показания для экстренной госпитализации:
- Соматически тяжелый пациент (ECOG≥3 баллов):
− опухолевая интоксикация, синдром сдавление;
− тяжелой анемический/геморрагический синдром, требующий заместительной терапии;
− полиорганная недостаточность в следствии основного заболевания.
- Фебрильная нейтропения.
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023
- Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2023 - 1) M.R Nasr., Anamarija M.Perry., P.Skrabek. Патология лимфатических узлов для клиницистов.; перевод с английского под редакцией Ю.А Криволапова – Практическая медицина, 2020, стр 129-155. 2) Andrew D. Zelenetz, Leo I. Gordon et al., B-Cell Lymphomas, NCCN Guidelines Version 5.2021 . 3) Демина Е.А et.al Общие принципы диагностики лимфом. Российские клинические рекомендации по диагностике и лечению злокачественных лимфопролиферативных заболеваний и др. Под ред. И.В. Поддубной, В.Г. Савченко. 2018. 4) Cazals-Hatem D, Lepage E, Brice P, et al. Primary mediastinal large B-cell lymphoma. A clinicopathologic study of 141 cases compared with 916 non-mediastinal large B-cell lymphomas, a GELA study. Am J Surg Pathol 1996;20:877-888. 5) Faris JE, LaCasce AS. Primary mediastinal large B-cell lymphoma. Clin Adv Hematol Oncol 2009;7:125-133. 6) Riedell, P.A. and Smith, S.M. (2018), Double hit and double expressors in lymphoma: Definition and treatment. Cancer, 124: 4622-4632. 7) Алгоритмы диагностики и протоколы лечения заболеваний системы крови. Под редакцией В.Г Савченко. Том 2. Изд. дом Практика, 2018. 8) Swerdlow SH, Harris NL, Jaffe ES, et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Revised 4th ed. Lyon, France: IARC; 2017. 9) Gopal S, Patel MR, Yanik EL, et al. Temporal trends in presentation and survival for HIV-associated lymphoma in the antiretroviral therapy era. J Natl Cancer Inst 2013;105:1221-1229. 10) Cheson B.D, Fisher RI, Barrington SF et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: the Lugano classification. J Clinical Oncology 2014. 11) The International Non-Hodgkin’s Lymphoma Prognostic Factors Project. A predictive model for aggressive non-hodgkin’s lymphoma. N Engl J Med1993;329:987-994. 12) Zhou Z, Sehn LH, Rademaker AW, et al. An enhanced International Prognostic Index (NCCN-IPI) for patients with diffuse large B-cell lymphoma treated in the rituximab era. Blood 2014;123:837-842. 13) Schmitz N, Zeynalova S, Nickelsen M, et al. CNS International Prognostic Index: A risk model for CNS relapse in patients with diffuse large B-cell lymphoma treated with R-CHOP. J Clin Oncol 2016;34:3150-3156. 14) Al-Sabbagh A, Ibrahim F., et al The Role of Integrated Positron Emission Tomography/Computed Tomography (PET/CT) and Bone Marrow Examination in Staging Large B-Cell Lymphoma. Clin Med Ins: Onc Vol 2020; 14: 1–6. 15) Al Tabaa, Y.; Bailly, C.; Kanoun, S., et al FDG-PET/CT in Lymphoma: Where Do We Go Now? Cancers 2021, 13, 5222. 16) Craig H. Moskowitz, Heiko Schöder, Current Status of the Role of PET Imaging in Diffuse Large B-Cell Lymphoma, Semin Hematol. 2015 Apr;52(2):138-42. 17) Тумян Г.С et.al Федеральные клинические рекомендации по диагностики и лечению Агрессивные нефолликулярные лимфомы – диффузная крупноклеточная В-клеточная лимфома, первичная медиастинальная В-клеточная лимфома, лимфома Беркитта, НОДГО, 2020. 18) Persky DO, Li H, Stephens DM, et al. Positron emission tomography-directed therapy for patients with limited-stage diffuse large B-cell lymphoma: Results of Intergroup National Clinical Trials Network Study S1001. J Clin Oncol 2020;38:3003-3011. 19) Poeschel V, Held G, Ziepert M, et al. Four versus six cycles of CHOP chemotherapy in combination with six applications of rituximab in patients with aggressive B-cell lymphoma with favourable prognosis (FLYER): a randomised, phase 3, non-inferiority trial. Lancet 2019;394:2271-2281. 20) Persky DO, Unger JM, Spier CM, et al. Phase II study of rituximab plus three cycles of CHOP and involved-field radiotherapy for patients with limited-stage aggressive B-cell lymphoma: Southwest Oncology Group study 0014. J Clin Oncol 2008;26: 2258-2263. 21) Purroy N, Bergua J, Gallur L, et al. Long-term follow-up of dose-adjusted EPOCH plus rituximab (DA- EPOCH-R) in untreated patients with poor prognosis large B-cell lymphoma. A phase II study conducted by the Spanish PETHEMA Group. Br J Haematol 2015;169:188-198. 22) Olmos-Jiménez R. et al. Practical aspects of the use of intrathecal chemotherapy Aspectos prácticos de la utilización de quimioterapia intrathecal // Farm Hosp. 2017. Vol. 41, № 1. P. 105–129. 23) Rodriguez J, Caballero MD, Gutierrez A, et al. Autologous stem-cell transplantation in diffuse large B-cell non-Hodgkin's lymphoma not achieving complete response after induction chemotherapy: the GELTAMO experience. Annals of Oncology 2004;15:1504-1509. 24) Mey UJ, Orlopp KS, Flieger D, et al. Dexamethasone, high-dose cytarabine, and cisplatin in combination with rituximab as salvage treatment for patients with relapsed or refractory aggressive non- Hodgkin's lymphoma. Cancer Invest 2006;24:593-600. 25) Lignon J, Sibon D, Madelaine I, et al. Rituximab, dexamethasone, cytarabine, and oxaliplatin (R-DHAX) is an effective and safe salvage regimen in relapsed/refractory B-cell non-Hodgkin lymphoma. Clin Lymphoma Myeloma Leuk 2010;10:262-269. 26) Rigacci L, Fabbri A, Puccini B, et al. Oxaliplatin-based chemotherapy (dexamethasone, high-dose cytarabine, and oxaliplatin) +/-rituximab is an effective salvage regimen in patients with relapsed or refractory lymphoma. Cancer 2010;116:4573-4579. 27) Crump M, Kuruvilla J, Couban S, et al. Randomized comparison of gemcitabine, dexamethasone, and cisplatin versus dexamethasone, cytarabine, and cisplatin chemotherapy before autologous stem-cell transplantation for relapsed and refractory aggressive lymphomas: NCIC-CTG LY.12. J Clin Oncol 2014;32:3490-3496. 28) Kewalramani T, Zelenetz AD, Nimer SD, et al. Rituximab and ICE (RICE) as second-line therapy prior to autologous stem cell transplantation for relapsed or primary refractory diffuse large B-cell lymphoma. Blood 2004;103:3684-8. 29) Martin A, Conde E, Arnan M, et al. R-ESHAP as salvage therapy for patients with relapsed or refractory diffuse large B-cell lymphoma: the influence of prior exposure to rituximab on outcome. A GEL/TAMO study. Haematologica 2008;93:1829-1836. 30) Mounier N, El Gnaoui T, Tilly H, et al. Rituximab plus gemcitabine and oxaliplatin in patients with refractory/relapsed diffuse large B-cell lymphoma who are not candidates for high-dose therapy. A phase II Lymphoma Study Association trial. Haematologica 2013;98:1726-1731. 31) Dunleavy K, Pittaluga S, Maeda LS, et al. Dose-adjusted EPOCH-rituximab therapy in primary mediastinal B-cell lymphoma. N Engl J Med 2013; 368:1408-1416. 32) Moskowitz C, Hamlin PA, Jr., Maragulia J, et al. Sequential dose-dense RCHOP followed by ICE consolidation (MSKCC protocol 01-142) without radiotherapy for patients with primary mediastinal large B-cell lymphoma [abstract]. Blood 2010;116. 33) Armand P, Rodig S, Melnichenko V, et al. Pembrolizumab in relapsed or refractory primary mediastinal large B-cell lymphoma. J Clin Oncol 2019;37:3291-3299. 34) Zinzani P, Santoro A, Gritti G, et al. Nivolumab combined with brentuximab vedotin for relapsed/refractory primary mediastinal large b-cell lymphoma: efficacy and safety from the phase II Checkmate 436 study. J Clin Oncol 2019;37:3081-3089. 35) Dunleavy K, Fanale MA, Abramson JS, et al. Dose-adjusted EPOCH-R (etoposide, prednisone, vincristine, cyclophosphamide, doxorubicin, and rituximab) in untreated aggressive diffuse large B-cell lymphoma with MYC rearrangement: a prospective, multicentre, single-arm phase 2 study. Lancet Haematol 2018;5:e609-e617. 36) Sun H, Savage KJ, Karsan A, et al. Outcome of Patients With Non-Hodgkin Lymphomas With Concurrent MYC and BCL2 Rearrangements Treated With CODOX-M/IVAC With Rituximab Followed by Hematopoietic Stem Cell Transplantation. Clin Lymphoma Myeloma Leuk 2015;15:341-348. 37) Wasterlid T, Brown PN, Hagberg O, et al. Impact of chemotherapy regimen and rituximab in adult Burkitt lymphoma: a retrospective population-based study from the Nordic Lymphoma Group. Ann Oncol 2013;24:1879-1886. 38) Oosten LEM, Chamuleau MED, Thielen FW, et al. Treatment of sporadic Burkitt lymphoma in adults, a retrospective comparison of four treatment regimens. Ann Hematol 2018;97:255-266. 39) Mead GM, Barrans SL, Qian W, et al. A prospective clinicopathologic study of dose-modified CODOX-M/IVAC in patients with sporadic Burkitt lymphoma defined using cytogenetic and immunophenotypic criteria (MRC/NCRI LY10 trial). Blood 2008;112:2248-2260. 40) Maruyama D, Watanabe T, Maeshima AM, et al. Modified cyclophosphamide, vincristine, doxorubicin, and methotrexate(CODOX-M)/ifosfamide, etoposide, and cytarabine (IVAC) therapy with or without rituximab in Japanese adult patients with Burkitt lymphoma (BL) and B cell lymphoma, unclassifiable, with features intermediate between diffuse large B cell lymphoma and BL. Int J Hematol 2010;92:732-743. 41) Barnes JA, Lacasce AS, Feng Y, et al. Evaluation of the addition of rituximab to CODOX-M/IVAC for Burkitt's lymphoma: a retrospective analysis. Ann Oncol 2011;22:1859-1864. 42) Thomas DA, Faderl S, O'Brien S, et al. Chemoimmunotherapy with hyper-CVAD plus rituximab for the treatment of adult Burkitt and Burkitt-type lymphoma or acute lymphoblastic leukemia. Cancer 2006;106:1569-1580. 43) Thomas DA, Kantarjian HM, Faderl S, et al. Hyper-CVAD and Rituximab for De Novo Burkitt Lymphoma/Leukemia [abstract]. Blood 2011;118:Abstract 2698. 44) Dunleavy K, Pittaluga S, Shovlin M, et al. Low-intensity therapy in adults with Burkitt's lymphoma. N Engl J Med 2013;369:1915-1925. 45) Roschewski M, Dunleavy K, Abramson JS, et al. Risk-Adapted Therapy in Adults with Burkitt Lymphoma: Results of NCI 9177, a Multicenter Prospective Phase II Study of DA-EPOCH-R. Blood 2017;130: Abstract 188. 46) Hoelzer D, Walewski J, Dohner H, et al. Improved outcome of adult Burkitt lymphoma/leukemia with rituximab and chemotherapy: report of a large prospective multicenter trial. Blood 2014;124:3870-3879. 47) Griffin TC, Weitzman S, Weinstein H, et al. A study of rituximab and ifosfamide, carboplatin, and etoposide chemotherapy in children with recurrent/refractory B-cell (CD20+) non-Hodgkin lymphoma and mature B-cell acute lymphoblastic leukemia: a report from the Children's Oncology Group. Pediatr Blood Cancer 2009;52:177-181. 48) Maramattom LV, Hari PN, Burns LJ, et al. Autologous and allogeneic transplantation for burkitt lymphoma outcomes and changes in utilization: a report from the center for international blood and marrow transplant research. Biol Blood Marrow Transplant 2013. 49) Tan CRC, Barta SK, Lee J, et al. Combination antiretroviral therapy accelerates immune recovery in patients with HIV-related lymphoma treated with EPOCH: a comparison within one prospective trial AMC034. Leuk Lymphoma 2018;59:1851-1860. 50) Barta SK, Xue X, Wang D, et al. Treatment factors affecting outcomes in HIV-associated non-Hodgkin lymphomas: a pooled analysis of 1546 patients., Blood, 2013, vol. 12219(pg. 3251-3262). 51) Alwan F, He A, Montoto S, et al. Adding rituximab to CODOX-M/IVAC chemotherapy in the treatment of HIV-associated Burkitt lymphoma is safe when used with concurrent combination antiretroviral therapy. AIDS 2015;29:903-910. 52) Roschewski M, Dunleavy K, Abramson JS, et al. Multicenter study of Risk-adapted therapy with dose-adjusted EPOCH-R in adults with untreated Burkitt lymphoma. J Clin Oncol 2020;38:2519-2529. 53) Thomas DA, Kantarjian HM, Faderl S, et al. Hyper-CVAD and rituximab for de novo Burkitt lymphoma/leukemia [abstract]. Blood 2011;118:Abstract 2698. 54) Barta SK, Lee JY, Kaplan LD, et al. Pooled analysis of AIDS malignancy consortium trials evaluating rituximab plus CHOP or infusional EPOCH chemotherapy in HIV- associated non-Hodgkin lymphoma. Cancer 2012;118:3977-3983. 55) Bayraktar UD, Ramos JC, Petrich A, et al. Outcome of patients with relapsed/ refractory acquired immune deficiency syndrome-related lymphoma diagnosed 1999-2008 and treated with curative intent in the AIDS Malignancy Consortium. Leuk Lymphoma 2012;53:2383-2389. 56) Ribera JM, Oriol A, Morgades M, et al. Safety and efficacy of cyclophosphamide, adriamycin, vincristine, prednisone and rituximab in patients with human immunodeficiency virus-associated diffuse large B-cell lymphoma: results of a phase II trial. Br J Haematol 2008;140:411-419. 57) Reid EG, Looney D, Maldarelli F, et al. Safety and efficacy of an oncolytic viral strategy using bortezomib with ICE/R in relapsed/refractory HIV-positive lymphomas. Blood Adv 2018;2:3618-3626. 58) Ayala E, Chavez JC, Gomez A, et al. Feasibility and Efficacy of High-Dose Chemotherapy and Autologous Hematopoietic Cell Transplantation for HIV-Associated Lymphoma: A Single-Institution Experience. Clin Lymphoma Myeloma Leuk 2018;18:548-551. 59) Hubel K, Re A, Boumendil A, et al. Autologous stem cell transplantation for HIV-associated lymphoma in the antiretroviral and rituximab era: a retrospective study by the EBMT Lymphoma Working Party. Bone Marrow Transplant 2019. 60) Evens AM, Advani R, et al Lymphoma occurring during pregnancy: antenatal therapy, complications, and maternal survival in a multicenter analysis. J Clin Oncol. 2013 Nov 10; 31(32):4132-9. 61) Peyrade F, Jardin F, Thieblemont C, et al. Attenuated immunochemotherapy regimen (R-miniCHOP) in elderly patients older than 80 years with diffuse large B-cell lymphoma: a multicentre, single-arm, phase 2 trial. Lancet Oncol 2011;12:460-468. 62) Peyrade F, Fain O, Fabiani B, et al. Long-term follow-up of the GELA LNH 03-7B study: A prospective phase II study of 150 patients over 80 years with diffuse large B-cell lymphoma (DLBCL) treated with RminiCHOP [abstract]. J Clin Oncol 2013;31(15_suppl):Abstract 8536. 63) Thieblemont C, Tilly H, Gomes da Silva M, et al. Lenalidomide maintenance compared with placebo in responding elderly patients with diffuse large B-cell lymphoma treated with first-line rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisone. J Clin Oncol 2017;35:2473-2481. 64) Mounier N, El Gnaoui T, Tilly H, et al. Rituximab plus gemcitabine and oxaliplatin in patients with refractory/relapsed diffuse large B-cell lymphoma who are not candidates for high-dose therapy. A phase II Lymphoma Study Association trial. Haematologica 2013;98:1726-1731. 65) Vacirca JL, Acs PI, Tabbara IA, et al. Bendamustine combined with rituximab for patients with relapsed or refractory diffuse large B cell lymphoma. Ann Hematol 2014;93:403-409. 66) Morschhauser F, Flinn IW, Advani R, et al. Polatuzumab vedotin or pinatuzumab vedotin plus rituximab in patients with relapsed or refractory non-Hodgkin lymphoma: final results from a phase 2 randomised study (ROMULUS). Lancet Haematol 2019;6:e254-e265. 67) Sehn LH, Herrera AF, Flowers CR, et al. Polatuzumab Vedotin in Relapsed or Refractory Diffuse Large B-Cell Lymphoma. J Clin Oncol 2020;38:155-165. 68) Czuczman MS, Trneny M, Davies A, et al. A Phase 2/3 Multicenter, Randomized, Open-Label Study to Compare the Efficacy and Safety of Lenalidomide Versus Investigator's Choice in Patients with Relapsed or Refractory Diffuse Large B-Cell Lymphoma. Clin Cancer Res 2017;23:4127-4137. 69) Wilson WH, Young RM, Schmitz R, et al. Targeting B cell receptor signaling with ibrutinib in diffuse large B cell lymphoma. Nat Med 2015;21:922-926.
Информация
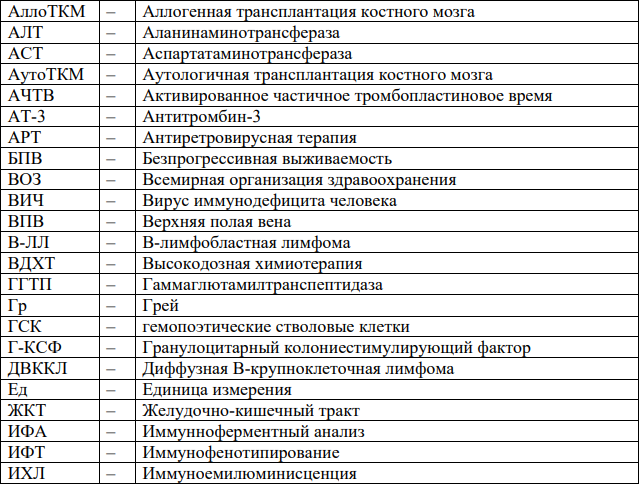
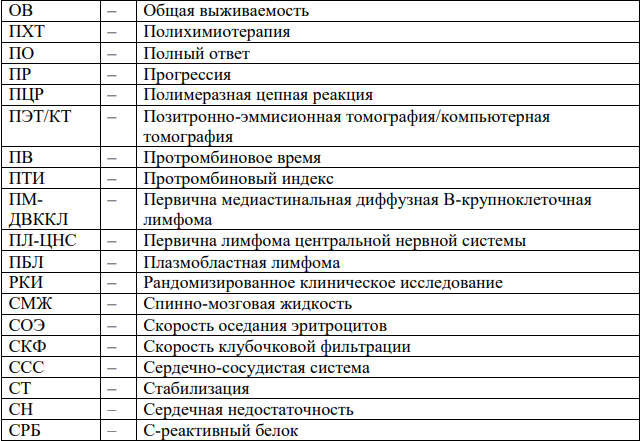
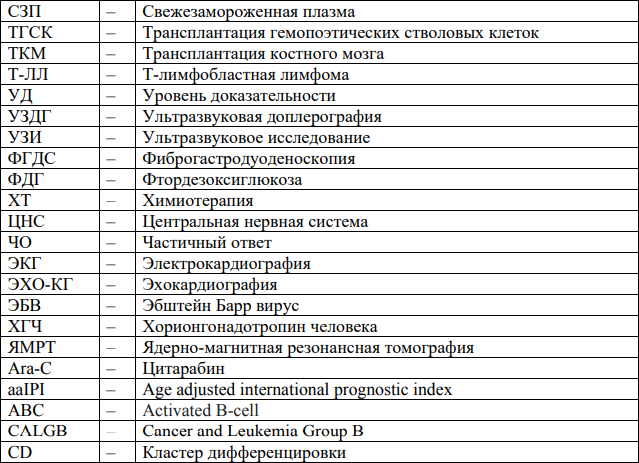
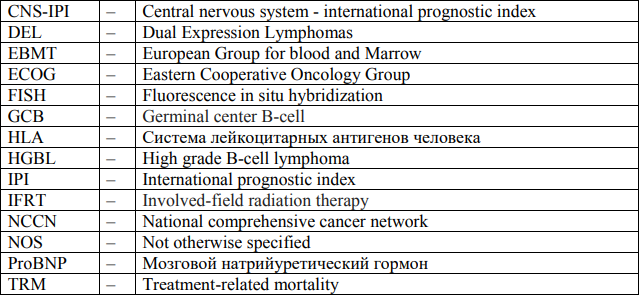
Сокращения, используемые в протоколе:

ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА:
Список разработчиков протокола с указание квалификационных данных:
1) Кемайкин Вадим Матвеевич - кандидат медицинских наук, врач-гематолог высшей квалификационной категории, руководитель центра онкогематологии и ТКМ, ТОО «Национальный научный онкологический центр».
2) Жүніс Гүлжанат Қуанышқызы - врач-гематолог центра онкогематологии и ТКМ, ТОО «Национальный научный онкологический центр».
3) Сарина Сабила Тұрғанбайқызы - врач-гематолог центра онкогематологии и ТКМ, ТОО «Национальный научный онкологический центр».
4) Габбасова Сауле Телембаевна - врач гематолог высшей категории, магистр общественного здравоохранения, член общества онкогематологов РК, член Ассоциации онкологов РК, руководитель центра гематологии с трансплантацией костного мозга КазНИИиОР.
5) Рапильбекова Гульмира Курбановна - доктор медицинских наук, профессор КФ UMC «Национальный научный центр материнства и детства», старший ординатор акушерского отделения №1, врач акушер-гинеколог.
6) Клодзинский Антон Анатольевич – кандидат медицинских наук, врач гематолог, ТОО «Центр гематологии».
7) Рамазанова Райгуль Мухамбетовна – доктор медицинских наук, врач-гематолог высшей квалификационной категории, профессор кафедры внутренних болезней НАО «Казахский Национальный Медицинский университет имени С.Д Асфендиярова».
8) Худайбергенова Махира Сейдуалиевна - клинический фармаколог, ТОО «Национальный научный онкологический центр».
6) Клодзинский Антон Анатольевич – кандидат медицинских наук, врач гематолог, ТОО «Центр гематологии».
7) Рамазанова Райгуль Мухамбетовна – доктор медицинских наук, врач-гематолог высшей квалификационной категории, профессор кафедры внутренних болезней НАО «Казахский Национальный Медицинский университет имени С.Д Асфендиярова».
8) Худайбергенова Махира Сейдуалиевна - клинический фармаколог, ТОО «Национальный научный онкологический центр».
Указание на отсутствие конфликта интересов: нет.
Рецензенты: Тургунова Людмила Геннадьевна – доктор медицинских наук, врач-гематолог высшей квалификационной категории, профессор кафедры внутренних болезней НАО «Медицинский Университете г.Караганда».
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Приложение 1
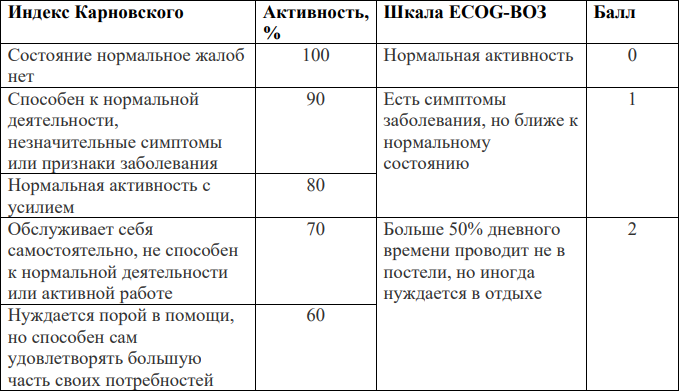
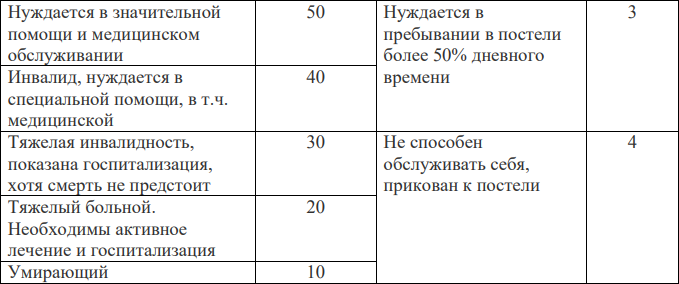
Индекс Карновского/Шкала ECOG-ВОЗ
Общее состояние онкологического больного рекомендовано оценивать по индексу Карновского (0-100%) или Шкале ECOG-ВОЗ (0-4 балла).
Приложение 2
Приложение 3


Приложение 2
Классификация лимфом. ВОЗ 2016 год.
В- клеточные опухоли:
- Хронический лимфолейкоз/ лимфома из малых лимфоцитов;
- Моноклональный В-клеточный лимфоцитоз;
- В-пролимфоцитарный лейкоз;
- Лимфома селезенки из клеток маргинальной зоны;
- Волосатоклеточный лейкоз;
- Лимфома/ лейкоз селезенки, неклассифицируемый:
- Диффузная мелкоклеточная В- клеточная лимфома красной пульпы селезенки;
- Волосатоклеточный лейкоз- подобный вариан.
- Лимфоплазмоцитарная лимфома
- Макроглобулинемия Вальденстрема
- Моноклональные гаммапатии неясного генеза (MGUS), IgM:
- Болезнь α- тяжелых цепей;
- Болезнь γ- тяжелых цепей;
- Болезнь μ- тяжелых цепей.
- Моноклональные гаммапатии неясного генеза (MGUS), IgG/A:
- Плазмоклеточная миелома;
- Солитарная плазмоцитома кости;
- Экстрамедуллярная миелома;
- Болезнь накопления моноклональных иммуноглобулинов.
- Экстранодальная лимфома из клеток маргинальной зоны лимфоидной ткани, ассоциированной со слизистой оболочкой (MALT- лимфом);
- Нодальная лимфома из клеток маргинальной зоны;
- Нодальная лимфома из клеток маргинальной зоны, педиатрический вариант;
- Фолликулярная лимфома:
- In situ фолликулярная неоплазия;
- Фолликулярная лимфома дуоденального типа.
- Фолликулярная лимфома, педиатрический вариант;
- Крупноклеточная В- клеточная лимфома с IRF4;
- Первичная кожная центрофолликулярная лимфома;
- Лимфома из клеток мантии:
- In situ неоплазия из клеток мантии;
- Диффузная крупноклеточная В- клеточная лимфома, NOS:
- GCB-тип(анг. germinal center B-cell-like);
- ABC-тип (англ. activated B-cell-like).
- В-клеточная лимфома, богатая T-клетками/гистиоцитами;
- Первичная ДВККЛ центральной нервной сиситемы (ЦНС);
- Первичная кожная диффузная крупноклеточная В- клеточная лимфома с поражением нижних конечностей;
- EBV1+ DLBCL, NOS;
- EBV1+, кожно-слизистая язва;
- ДВККЛ, связанная с хроническим воспаленнием;
- Лимфоматоидный гранулематоз;
- Первичная медиастинальная (тимическая) крупноклеточная В- клеточная лимфома;
- Внутрисосудистая крупноклеточная В- клеточная лимфома;
- ALK + крупноклеточная В- клеточная лимфома;
- Плазмобластная лимфома;
- Первичная экссудативная лимфома;
- HHV81 DLBCL, NOS*;
- Лимфома Беркитта;
- Беркитоподобная лимфома с абберацией 11q;
- В-клеточная лимфома высокой степени злокачественности, с мутациями MYC и BCL2 и /или BCL6;
- В-клеточная лимфома высокой степени злокачественности, NOS;
- В- клеточная лимфома, неклассифицируемая, с признаками, промежуточными между диффузной крупноклеточной В- клеточной лимфомой и лимфомой Ходжкина;
Т/ NK- клеточные опухоли:
- Т- клеточный пролимфоцитарный лейкоз;
- Т- клеточный гранулярный лимфоцитарный лейкоз;
- Хроническое лимфопролиферативное NK- клеточное заболевание;
- Агрессивный NK- клеточный лейкоз;
- Системная EBV Т-клеточная лимфома у детей;
- Гидроаоспенновидно- подобнаялимфома;
- Т- клеточная лимфома/ лейкоз взрослых;
- Экстранодальная NK/ T- клеточная лимфома, назальный тип;
- Ассоциированная с энтеропатией Т- клеточная лимфома;
- Мономорфная эпителиотропная кишечная Т-лимфома;
- Индолетние Т-клеточные лимфопролиферативные заболевания ЖКТ;
- Гепатоспленическая Т- клеточная лимфома;
- Подкожная панникулит- подобная Т- клеточная лимфома;
- Грибовидный микоз;
- Синдром Сезари;
- Первичные кожные CD30- позитивные Т- клеточные лимфомы;
- Лимфоматоидный папуллез;
- Первичная кожная анапластическая крупноклеточная лимфома;
- Первичная кожная γδ Т- клеточная лимфома;
- Первичная кожная CD8+ агрессивная эпидермотропная цитотоксическая Т- клеточная лимфома;
- Первичная кожная CD8+ Т- клеточная лимфома
- Первичная кожная периферическая CD8+ Т- клеточная лимфома
- Первичная кожная CD4+ мелко/ среднеклеточная Т- клеточная лимфома;
- Периферическая Т- клеточная лимфома, неуточненная;
- Ангиоиммунобластная Т- клеточная лимфома;
- Фолликулярная Т-клеточная лимфома;
- Нодальная периферическая Т-клеточная лимфома с фенотипом TFH;
- Анапластическая крупноклеточная лимфома, ALK- позитивная;
- Анапластическая крупноклеточная лимфома, ALK- негативная;
- Грудной имплантат-ассоциированной анапластическая крупно-клеточная лимфома;
Лимфома Ходжкина:
- Нодулярная с лимфоидным преобладанием лимфома Ходжкина;
- Классическая лимфома Ходжкина;
- Лимфома Ходжкина, вариант нодулярный склероз;
- Лимфома Ходжкина, вариант, богатый лимфоцитами;
- Лимфома Ходжкина, смешанноклеточный вариант;
- Лимфома Ходжкина, вариант с лимфоидным истощением.
Пострансплантационные лимфопролиферативные заболевания (PTLD):
- Плазматическая гиперплазия (PTLD);
- Инфекционный мононуклеоз (PTLD);
- Багровая фолликулярная гиперплазия;
- Полиморфная PTLD;
- Мономорфная PTLD (B- и T-/NK-клеточные типы)
- Классическая лимфома Ходжкина (PTLD).
Новообразования гистиоцитарных и дендритных клеток:
- Гистиоцитарная саркома;
- Гистиоцитоз из клеток Лангергаса;
- Саркома из клеток Лангергаса;
- Неопределенный опухоль дендритных клеток;
- Саркома из дендритных клеток;
- Саркома фолликулярных дендритных клеток;
- Опухоль из ретикулярных фибробластических клеток;
- Рассеянная юношеская ксантогранулома
- Болезнь Эрдгейма-Честера
Приложение 3
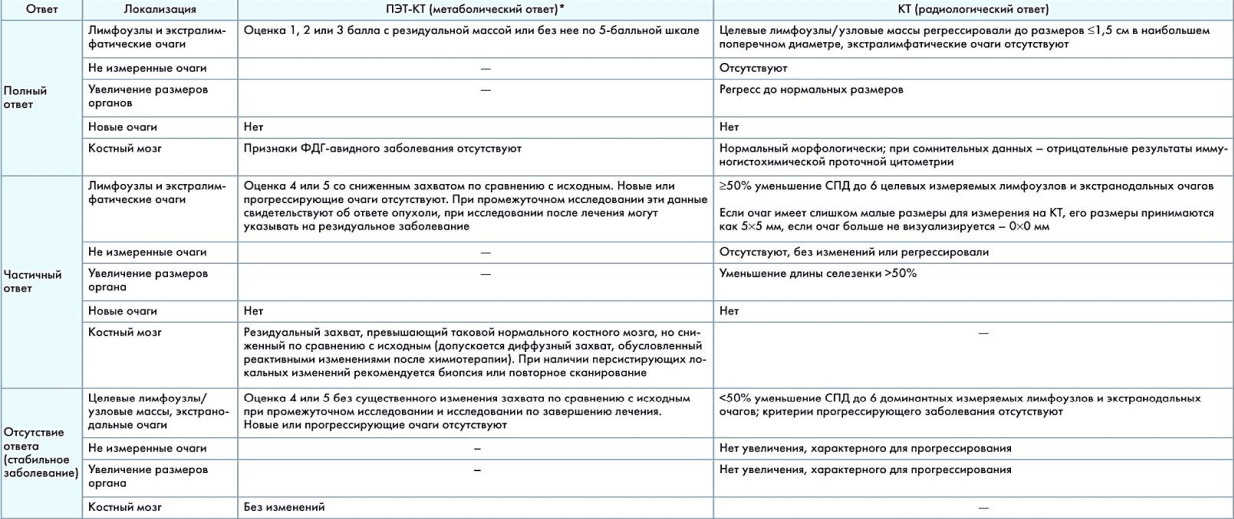
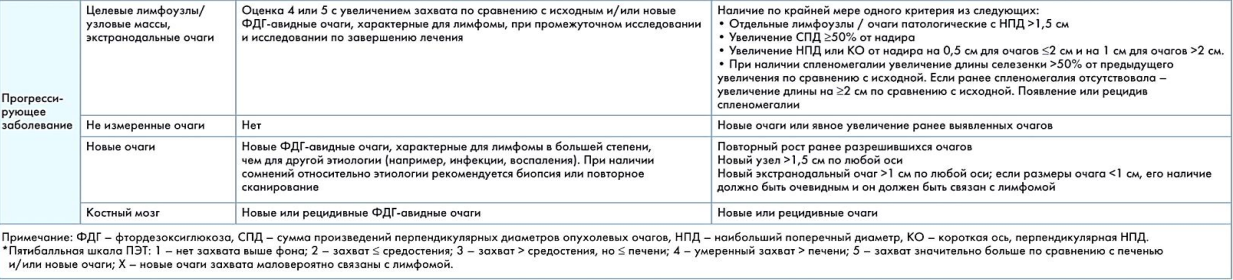
Критерии LUGANO для оценки ответа при НХЛ
Приложение 4
Клинические требования:
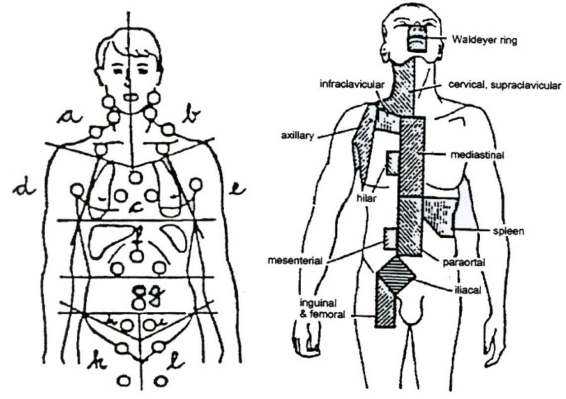
Для выбора адекватного объёма облучения необходимо помнить об определении областей и зон поражения. На V международном симпозиуме по лимфоме Ходжкина в 2001г. было уточнено, что термином «зона» обозначаются анатомические зоны, по которым устанавливается стадия заболевания в соответствии с классификацией Ann Arbor. Термин «область» – более широкое понятие, область может включать в себя одну или более зон. Так в одну область были включены шейные, над- и подключичные лимфатические узлы с одной стороны. Также в одну область объединены медиастинальные лимфатические узлы и лимфатические узлы корней легких, одной областью считаются лимфатические узлы «верхнего этажа» брюшной полости (ворота печени, ворота селезенки и корень брыжейки) и одной областью – лимфатические узлы “нижнего этажа” брюшной полости - парааортальные и мезентериальные (рисунок 1).
Рисунок 1. Области и зоны поражения при лимфомах
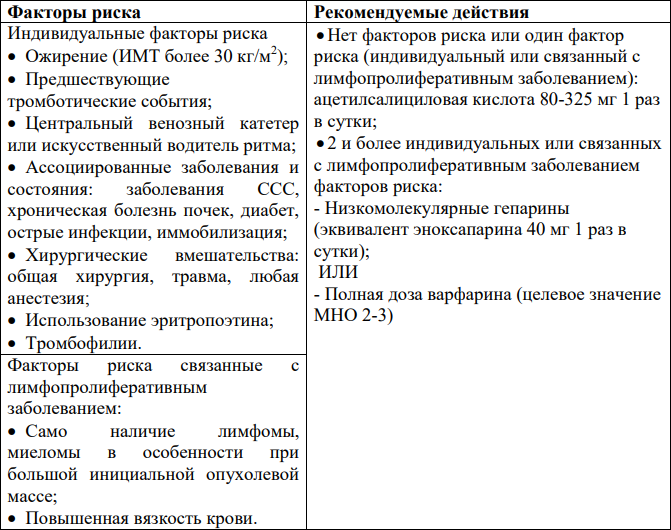
Факторы риска и профилактика тромботических и тромбоэмболических осложнений
Факторы риска и профилактика тромботических и тромбоэмболических осложнений у пациентов, которые получают талидомид или леналидомид



3 балла по шкале Deauville у многих пациентов указывает на хороший прогноз при стандартной терапии, особенно при промежуточном рестадировании. Однако, в испытаниях с участием ПЭТ, где исследовались деэскалация доз химиопрепаратов, ответ 3 балла по шкале Deauville расценивался как неадекватный ответ (чтобы избежать недостаточного лечения).
Приложение 4

Приложение 5
Клинические и технические требования к лучевой терапии.
Клинические требования:
- Оптимальный интервал между окончанием ХТ и началом лучевой терапии – 2-4 недели (но не более 6 недель).
- Очень важным для планирования лучевой терапии является качество стадирования заболевания до начала химиотерапии. Описание очагов поражения по данным клинического осмотра, КТ, МРТ должно включать анатомически точную их локализацию, количество, максимальные размеры в сантиметрах, особенно зон массивного поражения, указание 3-х размеров зоны поражения, включая протяжённость. При описании поражения средостения обязательно определение медиастинально-торакального индекса по прямому рентгеновскому снимку. Для атипично расположенных пораженных лимфатических узлов, помимо описания их, необходимо указывать их координаты (расстояние в см по горизонтали и вертикали от легко определяемых анатомических ориентиров). Всю указанную выше информацию рекомендуется изображать графически на анатомической схеме человеческого тела во фронтальной проекции.
- До начала ХТ при наличии полной информации об объеме исходного поражения рекомендуется совместная консультация гематологов-онкологов и радиологов. Особо должны быть выделены зоны сомнительного или вероятного поражения, лечебная тактика в отношении которых должна быть предварительно согласована и повторно обсуждена после окончания ХТ.
- При всех поддиафрагмальных поражениях в случае планирования облучения селезёнки рекомендуется радиоизотопное исследование функции почек. При наличии единственной левой почки либо при значительном нарушении функции правой почки следует обсудить целесообразность спленэктомии, как альтернативы ее облучению.
- Для проведения лучевой терапии можно использовать гамма-излучение Со60, фотонное излучение энергией 6 МЭВ и 18 МЭВ (18 МЭВ используется в случае глубокого расположения мишени, при больших значениях передне-задних размеров). Электронное излучение различных энергий может использоваться для лечения поверхностно расположенных лимфатических узлов.
- Расчёт дозы ЛТ должен проводиться в соответствии с МКРЕ-50-62, где указаны относительные точки и суммарные дозы. Разовая очаговая доза не должна превышать 1,8-2,0 Гр, лечение проводится ежедневно 5 раз в неделю. Следует избегать начала ЛТ в пятницу и окончания курса ЛТ в понедельник.
- В зависимости от технической оснащенности радиологического отделения могут использоваться различные методики лучевой терапии: от лечения несколькими фигурными полями (требующего четкой стыковки смежных полей облучения во избежание пере- или недооблучения) до новейших методик конформной лучевой терапии, сводящих к минимуму лучевое воздействие на нормальные ткани.
- Для точного воспроизведения положения пациента во время лечения необходимо использовать фиксирующие приспособления – подголовники, индивидуальные пластиковые маски, подставки для нижних конечностей. При облучении всех пораженных зон, кроме паховых и бедренных лимфатических узлов, используются встречные передне-задние фигурные поля (они формируются с помощью защитных блоков или многолепестковых коллиматоров диафрагмы ускорителя).
- При дополнительном облучении отдельных групп лимфатических узлов возможно любое расположение полей, минимизирующее лучевое повреждение здоровых тканей. При ЛТ остаточных объёмных опухолей рекомендуется объёмное планирование облучения, применение методики облучения тангенциальными полями, использование компенсаторных клиньев, методик конформной лучевой терапии (3D CRT).
- При поражении лимфоидной ткани кольца Вальдейера облучение проводится с двух боковых встречных полей (необходима предварительная санация полости рта, использование защитных кап).
- Каждое лечебное поле должно подтверждаться рентгеновскими снимками с помощью симулятора или системой контроля изображения на ускорителе.
Для выбора адекватного объёма облучения необходимо помнить об определении областей и зон поражения. На V международном симпозиуме по лимфоме Ходжкина в 2001г. было уточнено, что термином «зона» обозначаются анатомические зоны, по которым устанавливается стадия заболевания в соответствии с классификацией Ann Arbor. Термин «область» – более широкое понятие, область может включать в себя одну или более зон. Так в одну область были включены шейные, над- и подключичные лимфатические узлы с одной стороны. Также в одну область объединены медиастинальные лимфатические узлы и лимфатические узлы корней легких, одной областью считаются лимфатические узлы «верхнего этажа» брюшной полости (ворота печени, ворота селезенки и корень брыжейки) и одной областью – лимфатические узлы “нижнего этажа” брюшной полости - парааортальные и мезентериальные (рисунок 1).
Рисунок 1. Области и зоны поражения при лимфомах

Приложение 6
Факторы риска и профилактика тромботических и тромбоэмболических осложнений
Факторы риска и профилактика тромботических и тромбоэмболических осложнений у пациентов, которые получают талидомид или леналидомид


Приложение 7
Прогностическая модель ассоциированных с химиотерапией тромбоэмболических осложнений KhoranaА.А. и соавт.
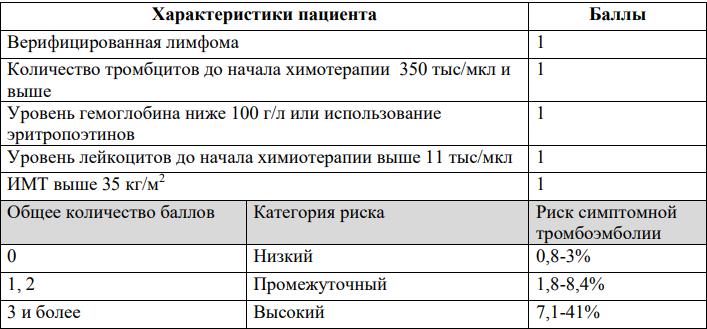
Рекомендации American Society of Clinical Oncology по профилактике и лечению тромбозов вен и тромбоэмболий у онкологических больных*
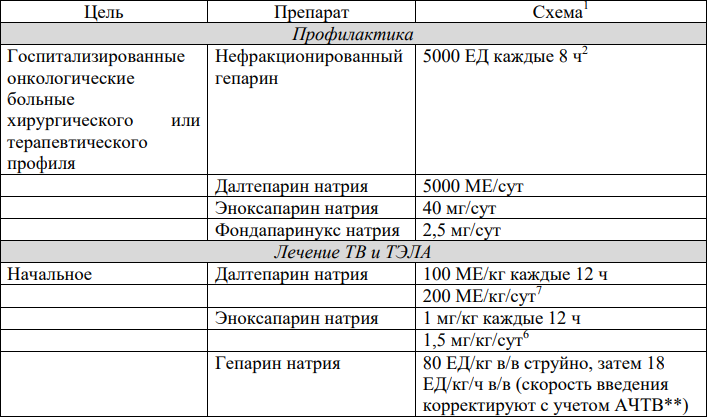
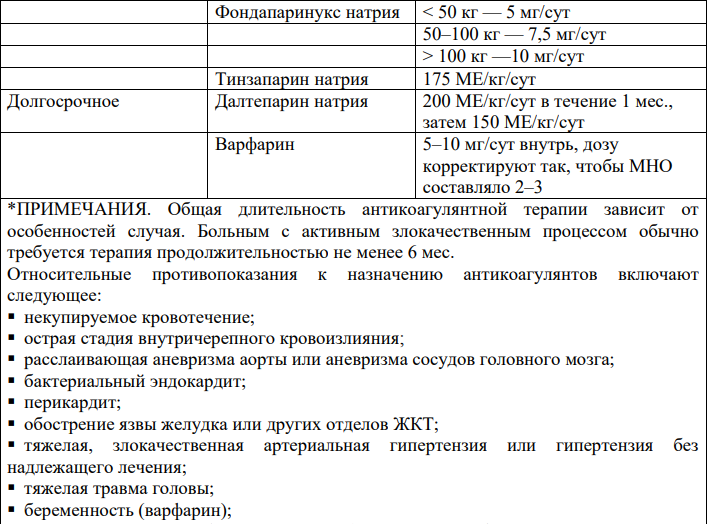

При разрушении опухолевых клеток образуется пять основных субстанций, которые выводятся исключительно почками: продукты распада пурина ксантин, гипоксантин и мочевая кислота; калий; фосфат.
Аллопуринол тормозит распад ксантина и гипоксантина до мочевой кислоты путем ингибирования ксантиноксидазы, снижая образование уратов в сыворотке крови.
Если перед началом циторедуктивной терапии наблюдается повышение уровня мочевой кислоты и/или калия, и/или фосфатов и/или креатинина, то мероприятия по нормализации этих показателей должны быть проведены до начала циторедуктивной терапии. Однако начало этой терапии не должно
откладываться более чем на 24 часа.
Главным мероприятием является инициирование и поддержание высокого диуреза - 100-250 мл/м2/ час. Если этого удается добиться, то метаболические нарушения бывают редко.
Если адекватного диуреза несмотря на достаточный объём инфузии, применение различных мочегонных средств добиться не удается, должны быть своевременно сделаны все необходимые приготовления к гемодиализу. Причиной олиго/анурии в этом случае является распространённое опухолевое поражение почек и/или обструкция опухолью (лимфомой) нисходящих мочевых путей, либо развитие тяжёлой уратной или кальциево-фосфатной нефропатии, либо комбинация этих патологических состояний.
Гиперкалиемия является наиболее опасным осложнением синдрома острого лизиса опухоли. Если после проведения профилактических/терапевтических мероприятий уровень калия повышается или при предшествующей гиперкалиемии не происходит его быстрого снижения, то угрожающее состояние может развиться в течение нескольких ближайших часов.
Тяжелый синдром острого лизиса опухоли часто осложняется развитием гипокоагуляционной фазы синдрома диссеминированного внутрисосудистого свертывания, требующего массивной заместительной терапии свежезамороженной плазмой (не мене 1000 мл 2 раза в день), концентратами тромбоцитов и нередко – проведения плазмафереза.
Профилактика синдрома лизиса опухоли
Лабораторный контроль каждые 12-24 часа: биохимический анализ крови - Na+, K+, Cl, Ca++, фосфаты, мочевая кислота, креатинин, мочевина, белок, альбумин.
Приложение 9
Коррекция водно-электролитных нарушений




Приложение 10

Рекомендации American Society of Clinical Oncology по профилактике и лечению тромбозов вен и тромбоэмболий у онкологических больных*



Приложение 8
Синдром лизиса опухоли
При разрушении опухолевых клеток образуется пять основных субстанций, которые выводятся исключительно почками: продукты распада пурина ксантин, гипоксантин и мочевая кислота; калий; фосфат.
Аллопуринол тормозит распад ксантина и гипоксантина до мочевой кислоты путем ингибирования ксантиноксидазы, снижая образование уратов в сыворотке крови.
При превышении порога растворимости ксантин, гипоксантин и мочевая кислота могут кристаллизоваться в почечных канальцах и собирательных трубочках. Фосфат, соединяясь с кальцием, образует фосфат кальция и выпадает как в почечных канальцах, так и в концевых капиллярах тканей, следствием чего являются гипокальциемия, олиго/анурия и тканевые некрозы. Растворимость ксантина и мочевой кислоты в щелочной среде намного выше, чем в кислой, но щелочная среда напротив благоприятствует выпадению в осадок фосфата кальция. Кроме того при рh>7,5 может кристаллизоваться гипоксантин. Следовательно перезащелачивание мочи тоже может благоприятствовать выпадению продуктов клеточного распада.
Если перед началом циторедуктивной терапии наблюдается повышение уровня мочевой кислоты и/или калия, и/или фосфатов и/или креатинина, то мероприятия по нормализации этих показателей должны быть проведены до начала циторедуктивной терапии. Однако начало этой терапии не должно
откладываться более чем на 24 часа.
Главным мероприятием является инициирование и поддержание высокого диуреза - 100-250 мл/м2/ час. Если этого удается добиться, то метаболические нарушения бывают редко.
Если адекватного диуреза несмотря на достаточный объём инфузии, применение различных мочегонных средств добиться не удается, должны быть своевременно сделаны все необходимые приготовления к гемодиализу. Причиной олиго/анурии в этом случае является распространённое опухолевое поражение почек и/или обструкция опухолью (лимфомой) нисходящих мочевых путей, либо развитие тяжёлой уратной или кальциево-фосфатной нефропатии, либо комбинация этих патологических состояний.
Гиперкалиемия является наиболее опасным осложнением синдрома острого лизиса опухоли. Если после проведения профилактических/терапевтических мероприятий уровень калия повышается или при предшествующей гиперкалиемии не происходит его быстрого снижения, то угрожающее состояние может развиться в течение нескольких ближайших часов.
Тяжелый синдром острого лизиса опухоли часто осложняется развитием гипокоагуляционной фазы синдрома диссеминированного внутрисосудистого свертывания, требующего массивной заместительной терапии свежезамороженной плазмой (не мене 1000 мл 2 раза в день), концентратами тромбоцитов и нередко – проведения плазмафереза.
Профилактика синдрома лизиса опухоли
1. Аллопуринол - 10 мг/кг в сутки в 2-3 приема (max – 600 мг/сутки) в течение 3 - 8 дней.
2. Инфузионная терапия:
- Объем = 3000-5000 мл/м2/сутки.
- 5% раствор декстроза 0,9% раствор NaCl = 1 : 1.
- Удельная плотность мочи < 1010.
- Контроль баланса жидкостей. Баланс: количество выделенной мочи = количество введенной жидкости - потери жидкости с дыханием.
- Контрольное взвешивание 1-2 раза в сутки.
- Интенсивность контроля за диурезом должна соответствовать ситуации и возрасту пациента.
- при недостаточном мочевыведении – фуросемид 1-10 мг/кг в сутки внутривенно или инфузией, при сопутствующей гипопротеинемии даже умеренной - альбумин, при необходимости - допамин 3-5 мкг/кг/мин.
- Инициальная инфузия - без калия. Умеренная гипокалиемия - желательна.
- Защелачивание мочи: - NaHCO340 - 80 ммоль/л добавить к постоянной инфузии (или 100-200 ммоль/м2/сутки параллельной инфузией).
- Регулирование необходимого объёма NaHCO3 соответственно pH мочи.
- значение pH мочи=7,0 является идеальным! - сохраняется достаточная растворимость для мочевой кислоты и ксантина и отсутствует опасность образования фосфорнокальциевых конкрементов.
Лабораторный контроль каждые 12-24 часа: биохимический анализ крови - Na+, K+, Cl, Ca++, фосфаты, мочевая кислота, креатинин, мочевина, белок, альбумин.
Приложение 9
Коррекция водно-электролитных нарушений




Приложение 10
Критерии вовлеченности (по D.Cheson соавторы в модификации)
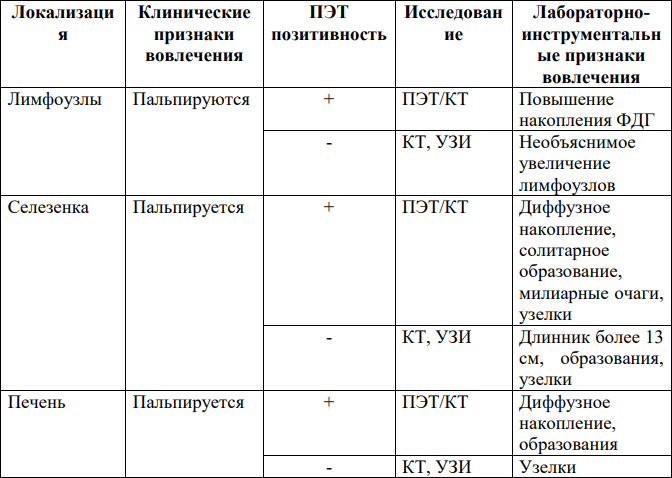
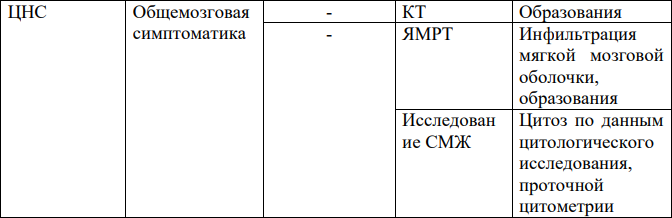

Прикреплённые файлы
Внимание!
- Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
- Информация, размещенная на сайте MedElement и в мобильных приложениях "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта", не может и не должна заменять очную консультацию врача. Обязательно обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
- Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может назначить нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
- Сайт MedElement и мобильные приложения "MedElement (МедЭлемент)", "Lekar Pro", "Dariger Pro", "Заболевания: справочник терапевта" являются исключительно информационно-справочными ресурсами. Информация, размещенная на данном сайте, не должна использоваться для самовольного изменения предписаний врача.
- Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший в результате использования данного сайта.